Область техники настоящего изобретения
Настоящее изобретение относится к области молекулярной иммунологии, биотехнологии и медицины.
Предшествующий уровень техники
Белок S100A4, также известный как mts1, p9Ka, CAPL, calvasculin, pEL98, metastasin, 18A2, 4А2, был идентифицирован в конце 1980-х - начале 1990-х годов в различных клеточных системах. Он принадлежит семейству, состоящему из примерно 21 различных белков небольшого размера (10-12 кДа), связывающих Ca2+ и обычно существующих в клетке в виде гомо- или гетеродимеров. Предполагают также существование этих белков в виде мультимерных форм, что может быть важно для их некоторых внеклеточных функций. S100-белки не обладают энзиматической активностью, и их функции обусловлены взаимодействиями с другими белками, ведущими к модулированию активности этих белков. Выраженные измененные экспрессионные уровни S100-белков были выявлены в случае ряда заболеваний человека, таких как различные типы рака, воспалительные нарушения, кардиомиопатии, нейродегенеративные нарушения. Белок S100A4 привлекает в последние годы особое внимание, в первую очередь, в связи с его свойством способствовать процессу метастазирования [Boye and Maelandsmo. S100A4 and metastasis (review). Am. J. Pathol. (2010) 178: 528-535]. Этот белок локализуется в ядре, цитоплазме и внеклеточном пространстве во многих типах клеток и участвует в большом разнообразии биологических процессов, таких как регуляция ангиогенеза (за счет превращения плазминогена в плазмин), процессах заживления и выживания, а также мобильности и инвазивности клеток, путем индукции ЕМТ-тирозин киназы и в регуляции апоптоза.
Одним из возможных механизмов стимулирования развития опухоли и ее метастазирования белком S100A4 может быть его взаимодействие с лигандами рецепторов эпидермальных факторов роста, такими как амфирегулин. Было продемонстрировано, что S100A4 специфически связывается с амфирегулином и образовавшийся гетеродимер связывается с EGFR/ErbB2-рецепторами, что приводит к активизации соответствующего опосредованного этими рецепторами сигнального каскада и усиливает амфирегулин-зависимую пролиферацию мышиных эмбриональных фибробластов [Klingelhofer et al. Epidermal growth factor receptor ligands as new extracellular targets for the metastasis-promoting S100A4 protein. FEBS J. (2009) 276: 5936-5948]. Уже имеются многочисленные экспериментальные данные, с участием S100A4. Очевидно, что S100A4 является одним из важнейших факторов, стимулирующих метастазирование опухолей, что является следствием его суммарного стимулирующего действия на процессы повышения мобильности и инвазивности клеток, а также на процесс ангиогенеза. Многочисленные исследования последних лет убедительно продемонстрировали, что белок S100A4 является важным диагностическим маркером и важной мишенью для разработки новых терапевтических препаратов.
В последние годы все большее внимание при создании новых диагностических и терапевтических препаратов для выявления и лечения многих болезней уделяется препаратам на основе антител, как правило, моноклональных классических антител. Антитело способно специфически связывать определенный антиген/белок, как свободный или находящийся в комплексе с другими молекулами, так и белок, оверэкспрессированный и локализующийся на поверхности клетки определенного типа. Такое связывание может блокировать важный биологический процесс, каскад, а также стимулировать иммунную систему пациента атаковать клетки, с которыми связалось антитело. Антитело может быть также средством специфической доставки других терапевтических молекул, субстанций или радиоизотопов. Наконец, возможно использование ди- и полифункциональных и многокомпонентных конструкций на основе получаемых антител или их производных. Ранее неоднократно уже предпринимались попытки получить антитела, связывающиеся с белком S100A4. В качестве ближайших аналогов технического решения, составляющих основу настоящего изобретения, можно привести следующие два примера.
Патент WO 2000064475 («Treatment of metastatic cancer through mts-1 gene», 23.04.1999 г.). В данном патенте заявлено получение моноклональных и поликлональных антител, связывающих белок mts-1 (он же - S100A4), с целью как диагностики злокачественных опухолей, так и воздействия на опухоль через связывание с mts-1 антитела, конъюгированного с токсином.
Патент WO 2011157724 («S100A4 Antibodies and therapeutic uses thereof», 14.06.2011 г.). В данном патенте заявлено получение моноклональных антител к двум определенным пептидным участкам белка S100A4, а также использование этих антител, их фрагментов и конъюгатов с различными веществами как для диагностики, так и для лечения болезней, ассоциированных с метастазированием, нежелательным ангиогенезом и болезней, ассоциированных с воспалением.
Данное техническое решение как наиболее близкое к заявляемому по составу действующего вещества и способу его использования выбрано авторами настоящего изобретения за прототип.
Недостатками прототипа являются:
- Относительно дорогостоящее производство антител, сложность поддержания и хранения продуцента, очень высокие требования к качеству используемых реактивов и условий культивирования.
- Относительно большой размер получаемых антител, что влечет за собой пониженную проницаемость тканей.
- Структурные особенности накладывают ограничение на узнавание некоторых «скрытых» эпитопов, находящихся, например, в углублениях, щелях малого размера в структуре белков.
- Ограниченность и относительная трудоемкость генно-инженерных манипуляций, адаптации для конкретных задач, сложность создания многовалентных и многофункциональных производных заявленных антител.
Таким образом, в уровне техники существует потребность в разработке новых антител (антиген-узнающих молекул), лишенных указанных выше недостатков и специфически узнающих белок S100A4.
Задачей настоящего изобретения является создание новых антител, способных эффективно связывать белок S100A4, получение этих антител, производство и хранение которых должно быть экономичным. Новые антитела должны быть эффективны и относительно просты; их размер должен быть в несколько раз меньше, чем у классических антител.
Техническая задача решается за счет того, что получено однодоменное антитело, специфически связывающее белки S100A4/Mts1 человека и мыши и имеющее аминокислотную последовательность SEQ ID NO:2.
Заявленное однодоменное антитело применяют для детекции белка S100A4/Mts1 в биологических жидкостях человека и мыши.
В основе настоящего изобретения находятся не классические бивалентные антитела, которые рассматриваются в качестве прототипа, а малые однодоменные наноантитела, которые имеют ряд преимуществ по сравнению с классическими моноклональными антителами для практического применения в области терапии заболеваний. Поскольку наноантитела (молекулярная масса около 12-15 кДа) на порядок меньше по размеру традиционных классических антител, они приобретают ряд новых положительных качеств, имеющих практическую значимость. Наноантитела могут обладать новыми структурными особенностями, в принципе позволяющими им узнавать некоторые «скрытые» для обычных антител эпитопы. Существуют эффективные способы получения (и селекции) таких антител в отношении различных (в том числе низкоиммуногенных) антигенов.
Полным эквивалентом термина "однодоменные наноантитела" для целей настоящего изобретения является вошедшее в широкое употребление обозначение «нанотело», введенное фирмой ABLYNX, а также «однодоменное мини-антитело».
Рекомбинантные однодоменные наноантитела получают на основе особых неканонических одноцепочечных антител, существующих в норме наряду с классическими антителами у животных семейства Верблюдовых (и у некоторых видов хрящевых рыб). Эти особые антитела состоят из димера только одной укороченной (без первого константного района СН1) тяжелой цепи иммуноглобулина и полнофункциональны в отсутствие легкой цепи иммуноглобулина. Для собственно специфического узнавания и связывания антигена при этом необходим и достаточен лишь один вариабельный домен (VHH, «наноантитело», «nanobody» или однодоменное наноантитело) этого антитела. Организация вариабельных доменов (VHH) неканонических антител в значительной степени подобна той, что у вариабельных доменов (VH) классических антител (у человека VH-домены иммуноглобулинов подкласса lgG3 имеют особо выраженную гомологию с VH и VHH верблюдовых). В обоих случаях V-домены состоят из четырех консервативных каркасных участков (FR, «framework regions»), окружающих три гипервариабельных участка (определяющие комплементарность, CDR, от «complementarity determining regions»). В обоих случаях домены формируют типичную для V-домена иммуноглобулина пространственную структуру из двух бета-слоев (-листов), один - из четырех аминокислотных цепочек и второй - из пяти [Padlan Е.А. X-Ray crystallography of antibodies. Adv. Protein Chem. 1996; 49: 57-133. Muyldermans S., Cambillau C., Wyns L. Recognition of antigens by single-domain antibody fragments: the superfluous luxury of paired domains/ «Узнавание антигенов фрагментами однодоменных антител: избыточная роскошь спаренных доменов». TIBS 2001; 26: 230-235]. В этой структуре все три гипервариабельных участка кластеризуются с одной стороны V-домена (где они участвуют в узнавании антигена) и располагаются в петлях, соединяющих бета-структуры. Однако имеются и важные отличия, связанные с функционированием VHH в формате одного домена. Так, гипервариабельные участки CDR1 и CDR3 заметно увеличены в случае VHH. Часто в гипервариабельных участках VHH обнаруживаются цистеиновые остатки, причем присутствующие сразу в двух участках (чаще всего в CDR1 и CDR3, реже - в CDR2 и CDR3). При исследовании кристаллических структур VHH было показано, что эти цистеиновые остатки формируют дисульфидные связи, что приводит к дополнительной стабилизации структуры петель данного антигена. Наиболее явным и воспроизводимым отличительным признаком VHH являются четыре замены гидрофобных аминокислотных остатков на гидрофильные во втором каркасном участке (Val37Phe, Gly44Glu, Leu45Arg, Trp47Gly, согласно нумерации Кабат). Этот каркасный участок в случае VH домена является высоко консервативным, обогащен гидрофобными аминокислотными остатками и особо важен для образования связи с вариабельным доменом VL легкой цепи. VHH-домен в этом плане сильно отличается: указанные замены гидрофобных аминокислот на гидрофильные делают невозможной ассоциацию VHH и VL. Эти замены также объясняют высокую растворимость VHH, наноантитела, когда его получают в виде рекомбинантного белка [Тиллиб С.В. «Верблюжьи наноантитела» - эффективный инструмент для исследований, диагностики и терапии. Молекулярная биология 2011; 45(1): 77-85.].
По сравнению с традиционными и чисто рекомбинантными антителами верблюжьи наноантитела обладают рядом преимуществ, что позволяет предполагать большой потенциал их будущего использования в различных исследованиях и при создании новых биотехнологических устройств, а также в клинических целях для диагностики и лечения заболеваний.
Характерными особенностями однодоменных наноантител, определяющими большой потенциал их использования для самых разнообразных практических приложений в иммунобиотехнологии, являются следующие [см. обзор; Тиллиб С.В. «Верблюжьи наноантитела» - эффективный инструмент для исследований, диагностики и терапии. Молекулярная биология 2011; 45(1): 77-85.].
- Наличие высокоэффективного способа генерирования и селекции наноантител.
- Малый размер, ~2×4 нм, 13-15 кДа (улучшенная проницаемость клеток).
- Структурные особенности (способность образовывать необычные для классических антител паратопы, позволяющие связываться с углублениями и активными центрами белков); могут использоваться для выявления «скрытых» эпитопов или эпитопов, которые не могут быть узнаны существенно более крупными обычными антителами.
- Высокий экспрессионный выход, экономичность наработки в больших количествах. Обычно наноантитела нарабатывают в периплазме бактерий E.coli (в количестве 1-10 мг из 1 литра культуры). Продемонстрирована возможность их эффективной наработки в дрожжах, растениях и клетках млекопитающих.
- Простота всевозможных генно-инженерных манипуляций, адаптации для конкретных задач, возможность создания многовалентных и многофункциональных производных.
- Низкая иммуногенность; возможность экономично «гуманизировать» антитела без заметной потери их специфической активности.
Возможность получения рекомбинантных однодоменных наноантител с заданной специфичностью определяется существованием у представителей семейства Camelidae функциональных и обладающих достаточно широким спектром узнавания неканонических антител. Неканонические антитела состоят из димера только одной укороченной тяжелой цепи иммуноглобулина (без легких цепей), специфичность узнавания которых определяется лишь одним вариабельным доменом [Hamers-Casterman С, Atarhouch Т, Muyldermans S, et al. Naturally occurring antibodies devoid of light chains./ «Существующие в природе антитела без легких цепей». Nature 1993; 363:446-448]. Техническая реализация отбора однодоменных наноантител, являющихся генно-инженерными производными антиген-распознающих доменов одноцепочечных антител верблюда, основана на высокоэффективной процедуре селекции антиген-узнающих полипептидов, экспонированных на поверхности частицы нитчатого фага («фаговый дисплей»).
Метод фагового дисплея является весьма эффективной и широко используемой технологией для функционального отбора из больших рекомбинантных библиотек последовательностей ДНК, кодирующих пептиды и белки, обладающие заданными свойствами и экспрессирующиеся в составе поверхностного белка нитчатых фагов [Brissette R & Goldstein Nl. The use of phage display peptide libraries for basic and translational research. / «Использование пептидных фагово-дисплейных библиотек для фундаметальных исследований и исследований трансляции». Methods Mol Biol. 2007; 383:203-13; Sidhu SS & Koide S. Phage display for engineering and analyzing protein interaction interfaces./ «Фаговый дисплей для конструирования и анализа взаимодействий белковых доменов». Curr Opin Struct Biol. 2007; 17:481-7]. Одно из особо важных приложений этой технологии - генерирование специфических рекомбинантных антител для самых различных антигенов [Hoogenboom HR. Selecting and screening recombinant antibody libraries./ «Селекция и анализ библиотек рекомбинантных антител». Nat Biotechnol. 2005; 23:1105-16]. Обычно, вместо больших целых молекул классических антител для экспонирования на поверхности фага используют гибридные рекомбинантные одноцепочечные белки, представляющие собой случайные комбинации клонированных последовательностей вариабельных районов тяжелой и легкой цепей иммуноглобулинов, соединенные короткой серин/глицин-богатой линкерной последовательностью. Такая химерная молекула, в случае правильного сочетания доменов, способна сохранять специфичность исходного иммуноглобулина, несмотря на введенные по сравнению с нативной молекулой антител изменениями. Одной из проблем традиционных рекомбинантных технологий является необходимость работы с очень большими библиотеками рекомбинантных антител, в которых должны быть представлены всевозможные комбинации двух случайных вариабельных районов (тяжелой и легкой цепей иммуноглобулинов), соединенных линкерной последовательностью. Помимо проблемы представленности здесь также очевидна и проблема формирования правильной относительной конформации этих двух доменов, а также проблема растворимости индивидуальных вариабельных доменов, которые часто имеют тенденцию к аггрегации. Упомянутые проблемы возможно избежать при использовании однодоменных наноантител, так как практически каждый клонированный вариабельный домен одноцепочечных антител будет в этом случае обладать определенной антиген-узнающей специфичностью, соответствующей одному из антител иммунизированного животного, и можно эффективно проводить селекцию из относительно небольших библиотек таких доменов.
Однодоменные наноантитела с заданной специфичностью или их производные могут использоваться, как и классические антитела, в различных приложениях, включающих в себя, но не ограниченных, детекцией антигенов (как в исследовательских, так и в диагностических целях), блокированием активности белка-антигена, специфической доставкой за счет связывания с антигеном желаемых молекул, конъюгированных с антителом. Также, однодоменные наноантитела могут быть исходными модулями (блоками) более сложных многомодульных препаратов. Возможно объединение в одном мультивалентном производном двух, трех и более моновалентных первичных однодоменных наноантител. Эти объединяемые в одну конструкцию однодоменные наноантитела могут связываться как с одним и тем же эпитопом антигена-мишени, так и с его разными эпитопами, или даже с различными антигенами-мишенями. Возможно также: комбинированное объединение в одну конструкцию однодоменных наноантител и других молекул или лекарств с получением многофункциональных препаратов [Conrath КЕ, Lauwereys M, Wyns L, Muyldermans S. Camel single-domain antibodies as modular building units in bispecific and bivalent antibody constructs./ «Верблюжьи однодоменные антитела в качестве модулярных строительных единиц в биспецифичных и бивалентных конструкциях антител». J Biol Chem. 2001 Mar 9; 276 (10): 7346-50; Zhang J, Tanha J, Hirama T, Khieu NH, To R, Tong-Sevinc H, Stone E, Brisson JR, MacKenzie CR. Pentamerization of single-domain antibodies from phage libraries: a novel strategy for the rapid generation of high-avidity antibody reagents. / «Пентамеризация однодоменных антител из фаговых библиотек: новая стратегия быстрого получения реагентов антител с высокой авидностью». J Mol Biol. 2004 Jan 2; 335 (1): 49-56; Cortez-Retamozo V, Backmann N, Senter PD, Wernery U, De Baetselier P, Muyldermans S, Revets H. Efficient cancer therapy with a nanobody-based conjugate. / «Эффективная раковая терапия конъюгатами на основе нанотел». Cancer Res. 2004 Apr 15; 64 (8): 2853-7; Baral TN, Magez S, Stijlemans B, Conrath K, Vanhollebeke B, Pays E, Muyldermans S, De Baetselier P. Experimental therapy of African trypanosomiasis with a nanobody-conjugated human trypanolytic factor./ «Экспериментальная терапия африканской трипаносомии с помощью человеческого трипанолитического фактора, конъюгированного с нанотелом». Nat. Med. 2006 May; 12 (5): 580-4; Coppieters К, Dreier Т, Silence К, Haard HD, Lauwereys M, Casteels P, Beirnaert E, Jonckheere H, Wiele CV, Staelens L, Hostens J, Revets H, Remaut E, Elewaut D, Rottiers P. Formatted anti-tumor necrosis factor alpha VHH proteins derived from camelids show superior potency and targeting to inflamed joints in a murine model of collagen-induced arthritis. / «Форматированные анти-TNFalpha VHH-белков, выделенные из верблюдовых, демонстрируют высокое сродство к воспаленным суставам в мышиной модели коллаген-индуцированного артрита». Arthritis Rheum. 2006 Jun; 54 (6): 1856-66]; мультимеризация с помощью введения дополнительных аминокислотных последовательностей взаимодействующих белковых доменов, таких как лейциновые зипперы [Harbury P.В., Zhang T., Kim P.S., et al. A switch between two-, three- and four-stranded coiled coils in GCN4 leucine zipper mutants. / «Переключение между двух-, трех- и четырех-цепочечными спиральными структурами в мутантах GCN4-«лейциновой молнии»». Science, 1993, 262:1401-1407; Shirashi Т., Suzuyama K., Okamoto H. et al. Increased cytotoxicity of soluble Fas ligand by fusing isoleucine zipper motif. / «Усиленная цитотоксичность растворимого Fas-лиганда вследствие его соединения с мотивом «изолейциновой молнии». Biochem. Biophys. Res. Communic. 2004, 322: 197-202; Chenchik A., Gudkov A., Komarov A., Natarajan V. Reagents and methods for producing bioactive secreted peptides. / «Реагенты и методы для получения биоактивных секретируемых пептидов». 2010. US Patent Application 20100305002], или последовательностей небольших белков, образующих стабильные комплексы [Deyev SM, Waibel R, Lebedenko EN, Schubiger AP, Plückthun A. Design of multivalent complexes using the barnase*barstar module./ «Дизайн мультивалентных комплексов используя модуль барназа-барстар». Nat Biotechnol. 2003, 21(12):1486-92.].
Также было показано [Vincke С., Loris R., Saerens D., et al. // J.Biol. Chem. 2009. V.284. №5. P.3273-3284], что можно «гуманизировать» такие верблюжьи наноантитела без заметной потери их специфической активности, проведя небольшое число точечных замен аминокислот. Это открывает потенциальную возможность широкого использования наноантител в качестве средств пассивной иммунизации для предотвращения развития различных опасных инфекционных заболеваний [Wesolowski J., Alzogaray V., Reyelt J. et al. Single domain antibodies: promising experimental and therapeutic tools in infection and immunity. / «Однодоменные антитела; многообещающие экспериментльные и терапевтические инструменты в области инфекции и иммунитета». Med. Microbiol. Immunol. 2009; 198, 157-174.].
Раскрытие настоящего изобретения
Способ получения наноантител, связывающих антигенные эпитопы белка S100A4, включает следующие принципиальные этапы:
1) индукция образования специфических антител в результате иммунизации представителя семейства Верблюдовых (в частности, двугорбого верблюда) рекомбинантными белками, полностью соответствующими по аминокислотной последовательности белкам S100A4 человека и мыши;
2) клонирование последовательностей антиген-узнающих доменов (наноантител) особых одноцепочечных антител, синтезирующихся в лимфоцитах иммунизированного животного, в фагмидном векторе (использующемся в последующей процедуре фагового дисплея), получение специфически обогащенной библиотеки последовательностей, кодирующих наноантитела;
3) селекция методом фагового дисплея (функционального отбора фаговых частиц, несущих на поверхности экспрессируемое наноантитело, а внутри - ДНК, кодурующую это наноантитело) клонов наноантител, связывающихся с заданным антигеном, белком S100A4, из полученной библиотеки наноантител;
4) проведение переклонирования и генно-инженерных модификаций кодирующих последовательностей отобранных наноантител с целью их эффективной наработки в бактериальной системе экспрессии и последующей эффективной очистки (в качестве продуцента действующего вещества используются бактерии E.coli).
В качестве антигена для иммунизации и селекции использовали рекомбинантные белки, наработанные в бактериях Е.coli. Для этого нуклеотидные последовательности, идентичные тем, что кодируют белки S100A4/Mts1 человека и мыши, были получены с помощью ПЦР-амплификации соответствующих препаратов кДНК и встроены в пламидную ДНК - экспрессионный вектор. Полученные рекомбинантные плазмидные ДНК были просеквенированы в области встроенной последовательности, что подтвердило правильность клонирования. Дополнительно был проведен масс-спектрометрический анализ наработанных рекомбинантных белков, подтвердивший то, что полученные белки полностью соответствовали по аминокислотной последовательности белкам S100A4/Mts1 человека и мыши (Описанные рекомбинантные белки были любезно предоставлены Луканидиным Е.М., Institute of Cancer Biology, Copenhagen, Denmark).
Способ получения однодоменных наноантител описан в примерах 1 и 2.
Наноантитела (молекулярная масса около 12-15 кДа) на порядок меньше по размеру традиционных антител и являются полнофункциональными антиген-узнающими единицами, обладающими рядом новых положительных качеств практической значимости. Наноантитело представляет собой однодоменный белок, который хорошо растворим и обладает повышенной стабильностью (в широком диапазоне температур и рН). Это позволяет избегать проблем с растворимостью и правильным сворачиванием молекул антител при продукции прокариотическими клетками и ведет к существенному снижению затрат на их производство по сравнению с традиционными способами получения терапевтических моноклональных антител в эукариотических системах экспрессии. Существенно облегчается также процедура сохранения и транспортировки антител по сравнению с заметно менее стабильными традиционными антителами. В силу меньшего размера наноантитела характеризуются лучшей способностью проникать в ткани. Наконец, наноантитела позволяют легко проводить генно-инженерные манипуляции с целью последующей продукции биспецифических наноантител или химер, в состав которых помимо наноантитела входит другой белок с желаемыми свойствами.
Несмотря на то, что, главным образом, в иллюстративных целях авторами настоящего изобретения делается акцент на продукции антител с использованием бактерии E.coli, среднему специалисту в данной области техники будет очевидно, что под объем настоящего изобретения подпадают и другие варианты систем реализации настоящего изобретения, прямо не заявленные в настоящем документе. Например, в качестве эукариотического продуцента могут быть использованы дрожжевые культуры или любые другие системы, очевидные в данной области техники.
Выбор путей реализации с целью получения наноантител с заявляемыми свойствами из прокариотической системы экспрессии в соответствии с одним из предпочтительных вариантов осуществления настоящего изобретения обусловлен следующими факторами:
1) Высокий экспрессионный выход, экономичность наработки в больших количествах, обеспечивающийся экспрессией наноантител в периплазму бактерий E.coli (в количестве 1-10 мг из 1 литра культуры).
2) Простота всевозможных генно-инженерных манипуляций, адаптации для конкретных задач, возможность создания многовалентных и многофункциональных производных.
3) Высокая экономическая рентабельность производства. Автор настоящего изобретения исходит из того, что, как известно среднему специалисту в данной области техники, первичные, исходно получаемые последовательности однодоменных наноантител могут быть затем адаптированы или «форматированы» различным образом для последующего практического использования.
Так, однодоменные наноантитела могут быть исходными модулями (блоками) более сложных многомодульных препаратов. Возможно объединение в одном мультивалентном производном двух, трех и более моновалентных первичных однодоменных наноантител. Эти объединяемые в одну конструкцию однодоменные наноантитела могут связываться как с одним и тем же эпитопом антигена-мишени, так и с его разными эпитопами, или даже с различными антигенами-мишенями. Возможно также комбинированное объединение в одну конструкцию однодоменных наноантител и других молекул или лекарств с получением многофункциональных препаратов; мультимеризация с помощью введения дополнительных аминокислотных последовательностей, взаимодействующих белковых доменов, таких как лейциновые зипперы, или последовательностей небольших белков, образующих стабильные комплексы. Для модулирования свойств препарата однодоменного наноантитела, например увеличения времени жизни или совершенствования способа очистки, в состав конечного соединения могут быть введены дополнительные аминокислотные последовательности. Среднему специалисту в данной области техники будет очевидно, что такие модификации и прочие варианты антител, лежащих в основе настоящего изобретения, подпадают под объем настоящего изобретения, поскольку являются структурными и функциональными вариантами однодоменных наноантител. Таким образом, авторы настоящего изобретения понимают под термином "однодоменные наноантитела" как первичные, исходно получаемые, "минимальные" аминокислотные последовательности однодоменных наноантител, так и их модификации, полученные в результате упомянутых адаптаций или «форматирования» и их варианты. Термин «вариант антитела» для целей настоящего изобретения означает полипептид, который содержит изменения в аминокислотной последовательности, а именно делеции, вставки, добавления или замены аминокислот, при условии, что при этом сохраняется необходимый уровень активности белка, например, как минимум 10% от активности исходного однодоменного наноантитела. Ряд изменений в варианте белка зависит от положения или от типа аминокислотного остатка в трехмерной структуре белка. Количество изменений может составлять, например, от 1 до 30, более предпочтительно, от 1 до 15, и наиболее предпочтительно, от 1 до 5 изменений в последовательности исходного однодоменного наноантитела. Эти изменения могут иметь место в областях полипептида, которые не являются критичными для его функции. Это становится возможным благодаря тому, что некоторые аминокислоты обладают высокой гомологией друг с другом, и поэтому третичная структура или активность белка не нарушаются при таком изменении. Поэтому в качестве варианта белка может выступать белок, который характеризуется гомологией не менее 70%, предпочтительно, не менее 80%, более предпочтительно, не менее 90%, и наиболее предпочтительно, не менее 95% по отношению к аминокислотной последовательности исходного однодоменного наноантитела при условии сохранения активности полипептида. Гомология между аминокислотными последовательностями может быть установлена с использованием хорошо известных методов, например с помощью выравнивания последовательностей в компьютерной программе BLAST 2.0, которая вычисляет три параметра: счет, идентичность и сходство.
Замена, делеция, вставка, добавление или замена одного или нескольких аминокислотных остатков будут представлять собой консервативную мутацию или консервативные мутации при условии, что активность белка при этом сохраняется. Примером консервативной мутации(ий) является консервативная замена(ы). "Консервативная аминокислотная замена" представляет собой замену, при которой аминокислотный остаток заменяется аминокислотным остатком, имеющим сходную боковую цепь. В данной области техники определены семейства аминокислот, имеющих сходные боковые цепи. Эти семейства включают в себя аминокислоты с основными боковыми цепями (например, лизин, аргинин, гистидин), кислыми боковыми цепями (например, аспарагиновая кислота, глутаминовая кислота), незаряженными полярными боковыми цепями (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин), неполярными боковыми цепями (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан), бета-разветвленными боковыми цепями (например, треонин, валин, изолейцин) и ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан, гистидин). Поскольку гипервариабельные районы наноантител определяют их специфическое взаимодействие с антигеном, то именно гомологичные замены аминокислот в этих участках могут приводить к получению несколько различающихся по последовательности наноантител, которые обладают идентичными или близкими свойствами. Таким образом, среднему специалисту в данной области техники будет очевидно, что под объем настоящего изобретения подпадают не только указанные в приложении последовательности наноантител, но и те, которые могут быть получены путем замен аминокислот в гипервариабельных участках (указанных в перечне последовательностей как CDR) на другие, но очень близкие по свойствам, аминокислоты (консервативных замен).
Фрагменты ДНК, которые кодируют по существу тот же функциональный полипептид, могут быть получены, например, путем модификации нуклеотидной последовательности фрагмента ДНК, кодирующего исходное однодоменное наноантитело, например, посредством метода сайт-направленного мутагенеза, так, что один или несколько аминокислотных остатков в определенном сайте будут делегированы, заменены, вставлены или добавлены. Фрагменты ДНК, модифицированные, как описано выше, могут быть получены с помощью традиционных методов обработки с целью получения мутации.
Фрагменты ДНК, которые кодируют по существу тот же функциональный полипептид исходного однодоменного наноантитела, могут быть получены путем экспрессирования фрагментов ДНК, имеющих мутацию, описанную выше, и установления активности экспрессируемого продукта.
Замена, делеция, вставка или добавление нуклеотидов, описанных выше, также включают мутации, которые имеют место в природе и, например, обусловлены изменчивостью.
Полипептиды однодоменных наноантител согласно настоящему изобретению могут кодироваться большим множеством молекул нуклеиновых кислот, что является результатом хорошо известного в данной области техники явления вырожденности генетического кода. Суть феномена состоит в том, что любая аминокислота (за исключением триптофана и метионина), входящая в состав природных пептидов, может кодироваться более чем одним триплетным нуклеотидным кодоном. Любая из этих вырожденных кодирующих молекул нуклеиновых кислот может входить в состав кассет, экспрессирующих антитела, заявленные в соответствии с настоящим изобретением, и подпадающих под объем настоящего изобретения.
Получение функционально-активных наноантител, распознающих антигены S100A4 показано в примерах 3, 4.
Возможность использования полученных наноантител и их комбинаций в диагностических исследованиях продемонстрировано в примерах 4 и 5.
Краткое описание фигур
На фиг.1 представлена нуклеотидная последовательность кДНК, кодирующая полученное однодоменное наноантитело aMTS1 (SEQ ID NO:1). Из нее была выведена соответствующая аминокислотная последовательность наноантитела (SEQ ID NO:2). В указанной последовательности подчеркнуты соответственно (слева направо, от N- к С-концу) гипервариабельные участки CDR1, CDR2 и CDR3, которые являются определяющими для специфического узнавания наноантителом aMTS1 белка S100A4/Mts1. Стрелками указаны позиции аминокислотных остатков, являющихся характеристическими для вариабельных доменов особых одноцепочечных антител (отличающихся от остатков в вариабельных доменах тяжелых цепей классических антител). В CDR1 и CDR3 участках aMTS1 выявляются остатки цистеина, часто встречающиеся именно в наноантителах и, повидимому, стабилизирующие наноантитело, образуя дополнительную С-С сявязь между первым и третьим гипервариабельными участками.
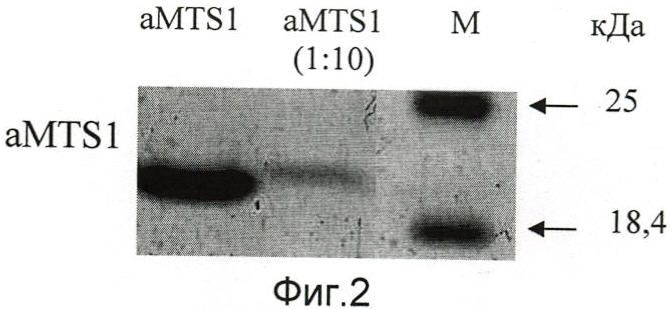
На фиг.2 представлена электорофореграмма полиакриламидного геля с наработанным (с помощью отобранной клонированной кодирующей последовательности) и затем очищенным наноантителом aMTS1.
На фиг.3 представлены результаты иммуноферментного анализа узнавания отобранным однодоменным наноантителом aMTS1 иммобилизованных в лунках иммунологической плашки рекомбинантных белков, соответствующих по аминокислотной последовательности белкам S100A4/Mts1 человека и мыши.
На фиг.4 представлены результаты Вестерн-блот детекции белка S100A4/Mts1 в лизатах клеток HeLa (человека) и NIH3T3 (мыши) с помощью наноантитела aMTS1.
Примеры осуществления настоящего изобретения
Пример 1
Получение библиотеки вариабельных доменов одноцепочечных антител
Иммунизация
Двугорбого верблюда Camelus bactrianus последовательно иммунизировали 5 раз путем подкожного введения антигенного материала, смешанного с равным объемом полного (в при первой инъекции) или неполного (при остальных инъекциях) адъюванта Фрейнда. В качестве антигена использовали смесь рекомбинантных белков (по 2 мг каждого из двух белков на 1 инъекцию), полностью соответствовавших по аминокислотной последовательности белкам S100A4/Mts1 человека и мыши, наработанных в бактериях Е.coli (Эти рекомбинантные белки были любезно предоставлены Луканидиным Е.М., Institute of Cancer Biology, Copenhagen, Denmark). Вторую инъекцию (стадию иммунизации) проводили через 3 недели после первой, затем с интервалом в две недели проводили еще три иммунизации. Взятие крови (150 мл) проводили через 5 дней после последней инъекции. Для предотвращения свертывания взятой крови добавляли 50 мл стандартного фосфатно-солевого раствора (PBS), содержащего гепарин (100 ед./мл) и ЭДТА (3 мМ).
Кровь разводили в 2 раза раствором PBS, содержащим 1 мМ ЭДТА. 35 мл разбавленного раствора крови наслаивали на ступеньку специальной среды (Histopaque-1077, Sigma) с плотностью 1,077 г/мл объемом 15 мл и проводили центрифугирование в течение 20 мин при 800×g. Мононуклеарные клетки (лимфоциты и моноциты) отбирали из интерфазной зоны плазма/Histopaque, после чего промывали раствором PBS, содержащим 1 мМ ЭДТА.
Суммарную РНК из В-лимфоцитов выделяли с помощью реагента TRIzol (Invitrogen). Затем, на колонке с олиго(dT)-целлюлозой из тотальной РНК очищали поли(А)-содержащую РНК. Концентрацию РНК определяли с помощью биофотометра (Eppendorf) и проверяли качество выделенной РНК с помощью электрофореза в 1,5%-ном агарозном геле с формальдегидом.
Реакцию обратной транскрипции проводили по стандартному протоколу [Sambrook et al., 1989] с использованием обратной транскриптазы H-M-MuLV и праймера олиго(dT)15 в качестве затравки.
Продукты обратной транскрипции использовали в качестве матрицы в двухступенчатой полимеразной цепной реакции и полученные продукты амплификации клонировали по сайтам Ncol(Pstl) и NotI в фагмидный вектор, как описано ранее [Hamers-Casterman et al., 1993; Nguyen et al., 2001; Saerens et al., 2004; Rothbauer et al., 2006]. Процедедуру селекции проводили также аналогично тем, что в указанных работах. Она базировалась на методе фагового дисплея, в которой в качестве фага-помощника использовали бактериофаг М13КО7 (New England Biolabs, США).
Пример 2
Селекция однодоменных наноантител, специфически узнающих S100A4/Mts1
Селекцию однодоменных наноантител проводили методом фагового дисплея с использованием тех же, что и для иммунизации, препаратов рекомбинантных белков S100A4/Mts1 человека и мыши (параллельно), которые иммобилизовали на дне лунок 96-луночного ИФА-планшета. Использовали полистироловые иммунологические плашки с высокой сорбцией MICROLON 600 (Greiner Bio-One). Для блокировки использовали 1% БСА (Sigma-Aldrich, США) и/или 1% обезжиренное молоко (Bio-Rad, США) в PBS. Процедуру селекции и последующей амплификации отбираемых фаговых частиц (содержащих ген однодоменного наноантитела внутри, а экспрессирующееся однодоменное наноантитело - в составе поверхностного фагового белка pIII) повторяли, как правило, последовательно три раза. Все манипуляции проводили, как описано в публикациях [Тиллиб С.В., Иванова Т.И., Васильев Л.А. 2010. Фингерпринтный анализ селекции «наноантител» методом фагового дисплея с использованием двух вариантов фагов-помощников. Acta Naturae 2010; 2 (3): 100-108; Hamers-Casterman C., Atarhouch Т., Muyldermans S. et al. Nature 1993; 363: 446-448.; Nguyen V.K., Desmyter A., Muyldermans S. Adv. Immunol. 2001; 79: 261-296; Saerens D., Kinne J., Bosmans E., Wernery U., Muyldermans S., Conrath K. J Biol Chem. 2004; 279: 51965-51972; Rothbauer U., Zolghadr K., Tillib S., et al. Nature Methods 2006; 3: 887-889].
Последовательности клонов отобранных наноантител группировали согласно схожести их фингерпринтов, получаемых при электрофоретическом разделении продуктов гидролиза амплифицированных последовательностей однодоменных наноантител параллельно тремя частощепящими рестрикционными эндонуклеазами (Hinfl, Mspl, Rsal). Последовательность кДНК однодоменного наноантитела aMTS1 (SEQ ID NO:1) была определена (см. фиг.1). Из нее была выведена соответствующая аминокислотная последовательность наноантитела (SEQ ID NO:2). В указанной последовательности подчеркнуты соответственно (слева направо, от N- к С-концу) гипервариабельные участки CDR1, CDR2 и CDR3, которые являются определяющими для специфического узнавания наноантителом aMTS1 белка S100A4/Mts1. Стрелками указаны позиции аминокислотных остатков, являющихся характеристическими для вариабельных доменов особых одноцепочечных антител (отличающихся от остатков в вариабельных доменах тяжелых цепей классических антител). В CDR1 и CDR3 участках aMTS1 выявляются остатки цистеина, часто встречающиеся именно в наноантителах и, по-видимому, стабилизирующие наноантитело, образуя дополнительную С-С связь между первым и третьим гипервариабельными участками.
Продукция наноантител
Последовательности кДНК отобранных наноантител переклонировали в экспрессионный плазмидный вектор - модифицированный вектор pHEN6 [Conrath KE, Lauwereys M, Galleni M, Matagne A, Frère JM, Kinne J, Wyns L, Muyldermans S. Beta-lactamase inhibitors derived from single-domain antibody fragments elicited in the Camelidae. / «Бэта-лактомазные ингибиторы, происходящие из фрагментов однодоменных антител, индуцированных у Верблюдовых». Antimicrob Agents Chemother. 2001; 45:2807-12], позволяющий присоединение к С-концу однодоменного нано-антитела (His)6-эпитопа (сразу вслед за НА-эпитопом). Благодаря наличию на N-конце экспрессируемой последовательности сигнального пептида (peIB) нарабатываемый рекомбинантный белок (однодоменное нано-антитело) накапливается в периплазме бактерий, что позволяет эффективно его выделять методом осмотического шока, не разрушая собственно бактериальные клетки. Продукцию однодоменных наноантител проводили в Е. coli (штамм BL21). Экспрессию индуцировали добавлением 1 мМ индолил-бета-D-галактопиранозида и клетки инкубировали при интенсивном перемешивании в течение 7 часов при 37°С или в течение ночи при 29°С. Однодоменное наноантитело выделяли из периплазматического экстракта с использованием аффинной хроматографии на Ni-NTA-агарозе с использованием системы для очистки QIAExpressionist (QIAGEN, США).
На фиг.2 представлена электорофореграмма полиакриламидного геля с наработанным (с помощью отобранной клонированной кодирующей последовательности) и затем очищенным наноантителом aMTS1.
Пример 3
Детекция рекомбинантных белков S100A4/Mts1 человека и мыши с помощью отобранного наноантитела aMTS1.
Способность наноантитела aMTS1 связываться с иммобилизованными в лунках иммунологической плашки рекомбинантными белками S100A4/Mts1 человека и мыши проверяли с использованием стандартного протокола метода иммуноферментного анализа. В качестве контроля использовали лунки с иммобилизованным белком овальбумином кур или бычим сывороточным альбумином (неспецифические белки).
В качестве вторичных антител к НА-тагу (присутствующему на С-конце проверяемого наноантитела aMTS1) использовали конъюгированные с пероксидазой хрена анти-НА-моноклональные антитела (CHGT-45P-Z, ICL, Inc., США). Активность пероксидазы хрена определяли, используя в качестве хромогенного субстрата ABTS (2,2'-азино-бис(3-этилбензотиазолин-6-сульфонат). Оптическую плотность измеряли при длине волны 405 нм с помощью планшетного флуориметра. Контрольные лунки (с иммобилизованным неспецифическим белком, белком овальбумином кур или бычим сывороточным альбумином) не содержали антиген и далее были блокированы и процессированы параллельно с экспериментальными ячейками (с антигеном).
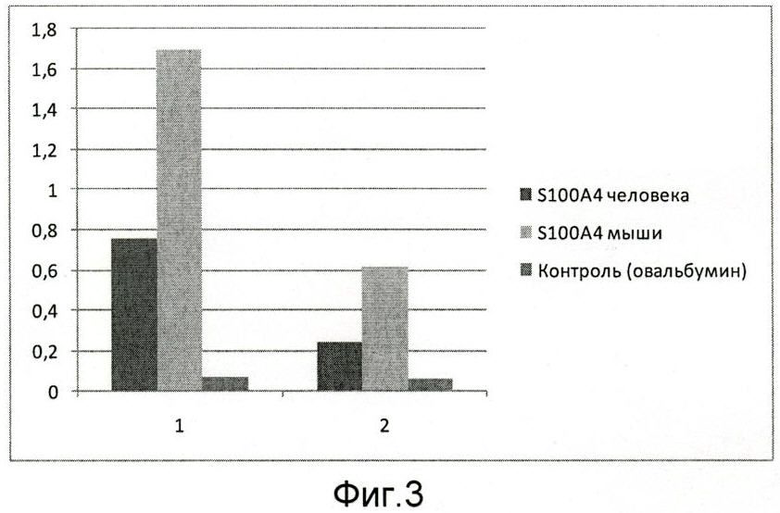
На фиг.3 представлен результат иммуноферментного анализа, из которого следует, что наноантитело aMTS1 специфически связывается с иммобилизованными (из раствора с концентрацией 2 мкг/мл) рекомбинантными белками S100A4/Mts1 как человека, так и мыши. Более эффективное связывание наблюдается в случае мышиного белка. Наноантитело брали в концентрации 1- 1 мкг/мл и 2- 0,1 мкг/мл, соответственно. Величина столбцов на рисунке соответствует относительным величинам поглощения при длине волны 405 нм, количественно отражающим эффективность связывания наноантитела aMTS1.
Пример 4
Детекция белка S100A4/Mts1 («Вестерн-блот»-детекция) в лизатах клеток линии HeLa (человека) и NIH3T3 (мыши) с помощью наноантитела aMTS1.
Способность наноантитела aMTS1 связывать белок S100A4/Mts1 в лизатах клеток человека и мыши после фракционирования белков с помощью диск-электрофореза (по Лэммли) в полиакриламидном геле и переноса разделенных белков на PVDF-мембрану проверяли с помощью стандартного протокола Вестерн-блот анализа. В качестве негативного контроля использовали экстракт клеток НЕК293 (происходящей из клеток эмбриональной почки человека), в которых, согласно литературным данным, белок S100A4/Mts1 не детектируется. Другие две взятые для анализа линии клеток - это широко распространенные линия клеток человека HeLa (происходящей из клеток аденокарциномы шейки матки) и линия клеток мыши NIH3T3 (происходящей из клеток аденокарциномы эмбриональных фибробластов). Все линии клеток культивировали на среде DMEM (Dulbecco's modified Eagle's medium), содержащей 10% эмбриональной телячьей сыворотки. Клетки пересаживали раз в неделю. Для получения клеточных лизатов клетки сперва промывали в стандартном фосфатно-солевом растворе (PBS), а затем лизировали при температуре 4°С в лизирующем буфере, содержащем 50 мМ Трис-HCl, рН 7, 5, 150 мМ NaCl, 1% SDS, 5 мМ ЭДТА, коктейль протеазных ингибиторов фирмы Roche). Лизаты центрифугировали 10 мин при 12000×g, отбрасывали осадок. Для более достоверной детекции белка (для усиления детектирующего сигнала) мы использовали процедуру предварительного специфического обогащения белка S100A4 из полученных лизатов (с помощью иммобилизованных на BrCN-сефарозе наноантител aMTS1) перед проведением электрофореза. Для этого лизаты диализовали в растворе для связывания, содержащем 10 мМ Трис-HCl, рН 7, 5, 200 мМ NaCl, 5 мМ ЭДТА, 1 мМ PMSF и затем пропускали через колонку с иммобилизованным на сефарозе наноантителом aMTS1, промывали тем же раствором, а затем элюировали в свежеприготовленном 1,4% растворе триэтиламина в воде (рН~11). Элюаты сразу же нейтрализовали, добавляя 1М Трис-HCl, рН 7,0 (пол-объема на один объем элюата). Одинаковые аликвоты элюатов, полученные из лизатов клеток трех разных клеточных линий брали для нанесения на полиакриламидный гель (использовали 12% разделяющий гель). Разделенные электрофорезом по Лэммли белки переносили из геля на PVDF-мембрану (Hybond-P, GE Healthcare) и затем проводили согласно протоколу производителя иммунохимическую реакцию, завершающуюся хемиллюминисцентной детекцией (с помощью набора ECL, GE Healcare) целевого белка. Наноантитела для детекции использовали в концентрации 10 мкг/мл. В качестве вторичных антител к НА-тагу (присутствующему на С-конце проверяемых наноантител aMTS1) использовали конъюгированные с пероксидазой хрена анти-НА-моноклональные антитела (CHGT-45P-Z, ICL, Inc., США).
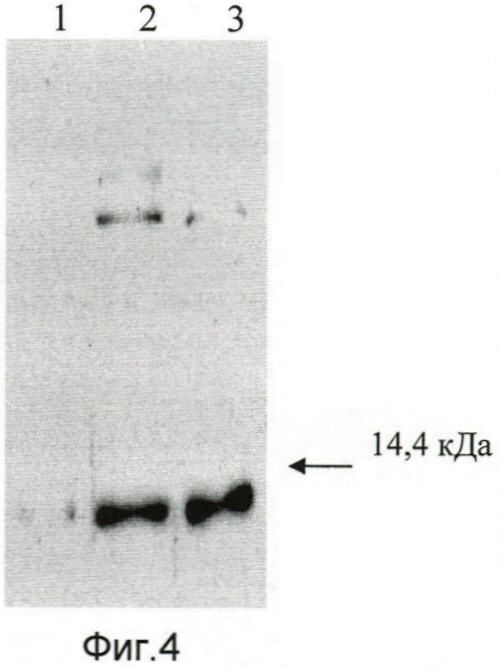
На фиг.4 представлены результаты проведенного анализа. Полученные результаты демонстрируют то, что полученное наноантитело aMTS1 способно детектировать методом Вестерн-блот-анализа эндогенные белки S100A4/Mts1 в экстрактах клеток человека и мыши. На фиг.4 стрелкой указано положение маркерного белка лизоцима. Белок S100A4/Mts1 детектируется в виде мажорной полосы в зоне белков размером примерно 12 кДа.
Приведенные примеры с фигурами подтверждают выполнение поставленной технической задачи, а именно создание новых антител, способных эффективно связывать белок S100A4. Представлено получение этих антител, производство и хранение которых будет экономичным. Заявленные наноантитела являются эффективными и относительно простыми; а их размер в несколько раз меньше, чем у классических антител. Особенности их компактной структуры позволяют относительно просто проводить всевозможные генно-инженерные манипуляции, адаптированные для конкретных задач, обеспечивают возможность создания на их основе различных многовалентных и многофункциональных производных. На базе создаваемых наноантител появляются новые возможности для более эффективного таргетирования белка S100A4 и влияния на связанные с ним биологические процессы и заболевания.
Таким образом, задача, поставленная в данном изобретении, решена.
| название | год | авторы | номер документа |
|---|---|---|---|
| НАНОАНТИТЕЛО, СПЕЦИФИЧЕСКИ СВЯЗЫВАЮЩЕЕ БЕЛОК СЕА, СПОСОБ ЕГО ИСПОЛЬЗОВАНИЯ ДЛЯ ДЕТЕКЦИИ ЭТОГО БЕЛКА | 2012 |
|
RU2493166C1 |
| НАНОАНТИТЕЛО, СПЕЦИФИЧЕСКИ СВЯЗЫВАЮЩЕЕ БЕЛОК MUC1, СПОСОБ ДЕТЕКЦИИ БЕЛКА MUC1 С ПОМОЩЬЮ НАНОАНТИТЕЛ | 2012 |
|
RU2493165C1 |
| ОДНОДОМЕННОЕ МИНИ-АНТИТЕЛО aHER2/aSKBR3-1, СПЕЦИФИЧЕСКИ СВЯЗЫВАЮЩЕЕ РЕЦЕПТОР ЭПИДЕРМАЛЬНОГО ФАКТОРА РОСТА HER2/ERBB2/neu И СПОСОБНОЕ ЧЕРЕЗ ЭТО ВЗАИМОДЕЙСТВИЕ ПРОНИКАТЬ ВНУТРЬ КЛЕТКИ-МИШЕНИ (ИНТЕРНАЛИЗОВАТЬСЯ), СПОСОБ ПОЛУЧЕНИЯ ДАННОГО АНТИТЕЛА И СПОСОБ ДЕТЕКЦИИ БЕЛКА HER2/ERBB2/neu И КЛЕТОК, ЭКСПРЕССИРУЮЩИХ ЭТОТ БЕЛОК В ПОВЫШЕННОМ КОЛИЧЕСТВЕ, С ПОМОЩЬЮ МИНИ-АНТИТЕЛА aHER2/aSKBR3-1 | 2012 |
|
RU2522929C2 |
| РЕКОМБИНАНТНЫЕ ОДНОДОМЕННЫЕ АНТИТЕЛА, СПЕЦИФИЧЕСКИ СВЯЗЫВАЮЩИЕ БЕЛОК F4/80, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИСПОЛЬЗОВАНИЯ ДЛЯ ДЕТЕКЦИИ ЭТОГО БЕЛКА | 2015 |
|
RU2599423C1 |
| НАНОАНТИТЕЛА aMh1, aMh2, СВЯЗЫВАЮЩИЕ АНТИГЕН MYCOPLASMA HOMINIS, СПОСОБ ИХ ПОЛУЧЕНИЯ, СПОСОБ ЛЕЧЕНИЯ ИНФЕКЦИИ, ВЫЗВАННОЙ MYCOPLASMA HOMINIS | 2011 |
|
RU2484095C1 |
| НАНОАНТИТЕЛА, СВЯЗЫВАЮЩИЕ АНТИГЕН Chlamydia trachomatis, СПОСОБ ПОДАВЛЕНИЯ ИНФЕКЦИИ, ВЫЗВАННОЙ Chlamydia trachomatis | 2012 |
|
RU2487724C1 |
| РЕКОМБИНАНТНЫЕ ОДНОДОМЕННЫЕ АНТИТЕЛА, СПЕЦИФИЧЕСКИ СВЯЗЫВАЮЩИЕ ИНТЕРЛЕЙКИН-6 ЧЕЛОВЕКА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИСПОЛЬЗОВАНИЯ ДЛЯ ДЕТЕКЦИИ ЭТОГО БЕЛКА | 2015 |
|
RU2603269C1 |
| ТРИМЕРИЗОВАННОЕ ОДНОДОМЕННОЕ АНТИТЕЛО, СПЕЦИФИЧЕСКИ СВЯЗЫВАЮЩЕЕСЯ С ГЛИКОПРОТЕИНОМ G ВИРУСА БЕШЕНСТВА, НЕЙТРАЛИЗУЮЩЕЕ ВИРУС БЕШЕНСТВА | 2013 |
|
RU2533802C1 |
| ПОЛИПЕПТИДНЫЙ МОДУЛЬ ДЛЯ СВЯЗЫВАНИЯ КОНСЕРВАТИВНОГО ЭПИТОПА РЕЦЕПТОР-СВЯЗЫВАЮЩЕГО ДОМЕНА БЕЛКА SPIKE КОРОНАВИРУСА SARS-COV-2 | 2022 |
|
RU2809183C1 |
| ПРОТИВОВИРУСНОЕ ОДНОДОМЕННОЕ МИНИ-АНТИТЕЛО, НУКЛЕОТИДНАЯ ПОСЛЕДОВАТЕЛЬНОСТЬ, ЭКСПРЕССИРУЮЩИЙ РЕКОМБИНАНТНЫЙ ВИРУСНЫЙ ВЕКТОР, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ПРОФИЛАКТИКИ ИЛИ ТЕРАПИИ ГРИППА ТИПА А | 2013 |
|
RU2536956C1 |
Настоящее изобретение относится к области молекулярной иммунологии, биотехнологии и медицины. Предложено однодоменное наноантитело aMTS1, специфически связывающее белки S100A4/Mts1 человека и мыши с охарактеризованной аминокислотной и нуклеотидной последовательностями, а также его применение для детекции белка S100A4/Mts1 в биологических жидкостях человека и мыши. Настоящее изобретение может найти дальнейшее применение в терапии S100-опосредованных заболеваний. 2 н.п. ф-лы, 4 ил., 4 пр.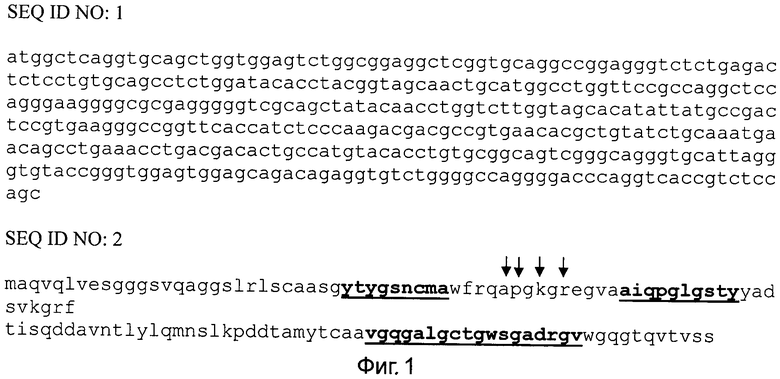
1. Однодоменное антитело, специфически связывающее белки S100A4/Mts1 человека и мыши и имеющее аминокислотную последовательность SEQ ID NO:2.
2. Применение антитела по п.1 для детекции белка S100A4/Mts1 в биологических жидкостях человека и мыши.
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| ТИЛЛИБ С.В | |||
| "Верблюжьи Наноантитела" - Эффективный инструмент для исследований, диагностики и терапии"// Молекулярная Биология | |||
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| Топка с качающимися колосниковыми элементами | 1921 |
|
SU1995A1 |
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| ЩИТОВОЙ ДЛЯ ВОДОЕМОВ ЗАТВОР | 1922 |
|
SU2000A1 |
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| KRIAJEVSKA M.V | |||
| et al | |||
| Non-muscle | |||
Авторы
Даты
2013-06-10—Публикация
2012-02-08—Подача