ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА «РОДСТВЕННЫЕ» ЗАЯВКИ.
Эта заявка имеет приоритет в соответствии с 35 Сводом Законов США §119(е) по Предварительной заявке на патент США №60/601526, поданной 13 августа 2004.
Область применения изобретения.
Область техники, к которой относится изобретение.
Предпочтительные варианты осуществления настоящего изобретения относятся к саморассасывающимся рентгеноконтрастным по своей природе полимерам для использования при изготовлении медицинских устройств, таких как стенты. В частности, полимерные композиции включают в состав галогенсодержащие фенольные фрагменты.
Описание уровня техники.
Медицинские устройства, содержащие металл или полимер, каждый день используются для многочисленных клинических применений. Металлические медицинские устройства являются в основном рентгеноконтрастными вследствие природы материала, а полимерные медицинские устройства по своей природе в основном не являются рентгеноконтрастными. Следовательно, существует необходимость в дополнительных рентгеноконтрастных саморассасывающихся полимерных формах для применения в устройствах, которые обеспечивают преимущество рентгеноконтрастности для различных медицинских процедур. Иллюстрацией таких устройств являются сосудистые стенты, которые описаны ниже.
Сосудистые стенты широко применяются для различных целей, главным образом, при лечении заболеваний сердца. В 1998 сообщалось, что около 61 миллиона американцев имеют некоторые формы заболеваний сердца, которые с 1990 являлись единственной лидирующей причиной смертности в США. Один из видов заболеваний сердца, ишемическая болезнь сердца, характеризуется, по крайней мере, частично, ингибированием потока крови через артерии, которые поставляют кровь к сердечной мышце, вследствие образования бляшек (артериосклероза) в артериях. На ишемическую болезнь сердца приходится 1 из каждых 5 смертей, которые происходят в США. В 2001 году около 1,1 миллиона человек перенесли новый или рецидив инфаркта миокарда (сердечный приступ из-за заболевания коронарной артерии). Смотреть, например, Отчет Американской Ассоциации Сердца, «Heart and Stroke Statistical Update», 2001, American Heart Association, Даллас, Техас. В настоящее время более чем 500000 американцев ежегодно проходят лечение заблокированных коронарных артерий. Ожидается, что это число удвоится за следующие 10 лет для взрослого населения.
Сосудистые стенты обычно содержат ячеистую трубочку, которую вводят в артерию для сохранения артерии открытой, после того как ее растягивают баллоном во время курса процедур ангиопластической операции на сосудах. Обычно сосудистый стент помещают в баллонный катетер, который вводится через бедренную артерию, и проталкивают к желаемому участку коронарной артерии. Там баллон надувают, таким образом, расширение стента и его давление на стенки сосуда закрепляет его на месте.
Большинство стентов сконструированы из металлов, например нержавеющей стали или нитинола. Несмотря на то что такие металлические стенты обладают некоторыми желательными характеристиками, такими как достаточное расширение в радиальном направлении для удержания открытой целевой артерии и рентгеноконтрастностью (позволяя различать и наблюдать за имплантированным стентом с помощью рентгенографии/флуороскопии), металлические стенты также имеют ряд существенных недостатков. Например, ввод и расширение металлического стента в артерии имеет тенденцию к дальнейшему повреждению заболевшего сосуда, что потенциально приводит к развитию интимальной гиперплазии и дальнейшей закупорке сосуда, проявляющейся в росте клеток гладкомышечной ткани сосудов и матричных протеинов через элементы стента. Другим недостатком, связанным с использованием металлического стента, является то, что, однажды развернувшись, они превращаются в постоянных жителей на стенках сосуда - затем их полезность проходит. В самом деле, срок службы стента оценивается в диапазоне от 6 до 9 месяцев. По истечению этого времени длительное давление и растяжение, оказываемое на архитектуру сосуда постоянным металлическим имплантантом, являются причиной ускорения рестеноза в стенте. Другим отрицательным моментом, связанным с использованием металлического стента, является то, что замена многочисленных постоянных металлических стентов в сосуде может быть препятствием к дальнейшему хирургическому вмешательству. Также развертывание первого металлического стента может стать физическим препятствием для последующей доставки второго стента в периферический участок того же сосуда. В противоположность металлическому стенту, саморассасывающийся стент может не потерять своей полезности в сосуде. Более того, саморассасывающийся стент может быть использован для доставки большей дозы лекарственного средства, лекарство и/или биологический агент могут быть в составе оболочки стента и также введены в само устройство. Также такой стент может доставлять различные лекарственные средства и/или биологические агенты одновременно или в различное время их жизненного цикла для лечения специфических аспектов или явлений сосудистого заболевания. Дополнительно, саморассасывающийся стент может также позволить повторение лечения того же самого участка кровеносного сосуда.
Патент США №6475477 («'477 патент») раскрывает медицинские устройства, образованные из рентгеноконтрастных саморассасывающихся полимеров с гидролитически нестабильными основными цепями полимера и подвешенными свободными карбоксильными группами, которые улучшают разрушение и рассасывание полимера; патент приведен здесь для ссылки во всей его целостности. Многие из раскрытых полимеров являются далеко не идеальными для использования в стентах, полимеры со свободными карбоксильными группами получают из мономеров с бензил-защищенными свободными кислотными фрагментами, которые селективно удаляют из полимера путем гидрогенолиза в присутствии палладиевого катализатора и водорода. В то время как такой метод является эффективным для удаления бензил-защищенных групп с небольшим расщеплением или вообще без расщепления полимерной основной цепи, палладиевый катализатор, используемый здесь, относительно дорог, и следы палладия трудно удалить из полимерного продукта.
Некоторые из упомянутых недостатков патента '477 исследованы в Патентной заявке №11/176638, поданной 7 июля 2005, и 10/952274, поданной 27 сентября 2004, обе из которых приведены здесь для ссылки во всей их целостности. Однако там остается необходимость в дополнительных рентгеноконтрастных саморассасывающихся полимерных формах, которые обеспечивают преимущественные физико-химические свойства, приспособленные для использования при получении различных имплантируемых медицинских устройств. Ссылка: Hutmacher DW, Sittinger M, Risbud MV. Scaffold-based tissue engineering: rationale for computer-aided design and solid free-form fabrication systems (Каркасный инжиниринг ткани: основная причина для автоматизированного проектирования и твердого технологического оборудования произвольной формы). Trends Biotechnol. 2004 июль; 22(7):354-62.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ.
С целью подведения итогов изобретения некоторые аспекты, положительные эффекты и новые признаки изобретения были описаны здесь выше. Конечно, понятно, что не обязательно все такие признаки могут быть улучшены в соответствии с любым конкретным вариантом осуществления изобретения. Причем изобретение может быть реализовано или осуществлено способом, который улучшает или оптимизирует одно преимущество или группу преимуществ, как раскрывается или предлагается здесь, без необходимого улучшения других положительных факторов, как может быть раскрыто или предложено здесь. Изобретение раскрывает рентгеноконтрастный по своей природе биосовместимый, саморассасывающийся полимер, где этот полимер содержит одно или более повторяющихся звеньев формулы (I):
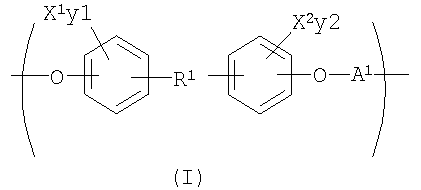
где X1 и X2 каждый независимо выбран из группы, состоящей из Br и I;
у1 и у2 каждый независимо представляет собой ноль или целое число в диапазоне от 1 до 4, при условии, что сумма у1 и у2 равна, по крайней мере, одному;
R1 представляет собой
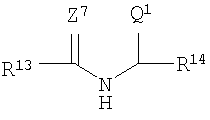
R13 и R14 каждый независимо выбирают из группы, состоящей из -СН=СН-, -(СН2)с-, -(CHJ1)-, -CHJ2-CHJ3-, -CH=CH-(CHJ1)- и -(CH2)c-(CHJ1)-;
с представляет собой ноль или целое число в диапазоне от 1 до 8;
J1, J2 и J3 каждый независимо выбирают из группы, состоящей из Н, Br, I, - NH-Q2 и -C(=Z8)-OQ3;
Q1, Q2 и Q3 каждый независимо представляет собой Н или некристаллизующуюся группу, содержащую от 1 до приблизительно 30 атомов углерода;
Z7 и Z8 каждый независимо представляет собой О или S;
А1 выбирают из группы, состоящей из
 ,
,  и
и 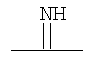 ;
;
R5 выбирают из группы, состоящей из Н, С1-С30 алкила и C1-С30 гетероалкила.
В предпочтительном варианте осуществления изобретения X1, Х2, у1 и у2 выбирают так, чтобы X1 и X2 присутствовали в количестве, которое является эффективным для обнаружения рентгеноконтрастности полимера.
В одном варианте осуществления изобретения полимер содержит повторяющиеся звенья формулы (I), R1 в формуле (I) представляет собой:
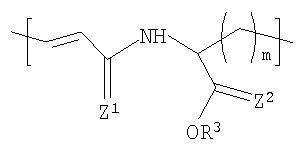
где R3 представляет Н или некристаллизующийся C1-C29 углеводород;
Z1 и Z2 каждый независимо представляют собой О или S и
m представляет собой целое число в диапазоне от 1 до 8.
В другом варианте осуществления изобретения полимер содержит повторяющееся звено формулы (I), R1 в формуле (I) представляет собой:
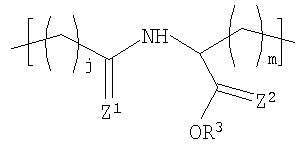
где R3 представляет Н или некристаллизующийся C1-C29 углеводород;
Z1 и Z2 каждый независимо представляют собой О или S и
j и m каждый независимо представляет собой целое число в диапазоне от 1 до 8.
В другом варианте осуществления изобретения полимер содержит повторяющееся звено формулы (I), R1 в формуле (I) представляет собой:
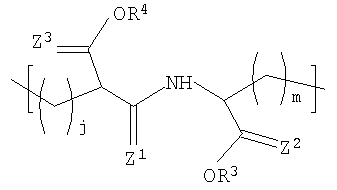
где R3 и R4 каждый независимо представляет собой Н или некристаллизующийся C1-C29 углеводород;
Z1, Z2 и Z3 каждый независимо представляют собой О или S и
j и m каждый независимо представляет собой целое число в диапазоне от 1 до 8.
Другой вариант осуществления изобретения обеспечивает медицинское устройство, которое содержит рентгеноконтрастный по своей природе, биосовместимый, саморассасывающийся полимер, где полимер содержит, в свою очередь, одно или более повторяющихся звеньев формулы (I), как описано выше. В предпочтительном варианте осуществления изобретения медицинское устройство содержит стент. Другой вариант осуществления изобретения раскрывает систему для лечения участка сосуда, содержащую такой стент и катетер, имеющий средства для развертывания, где указанный катетер приспособлен для доставки стента к указанному участку, и указанные средства развертки приспособлены для развертывания стента. Другой вариант осуществления изобретения раскрывает способ для повторного лечения полости тела, включающий развертывание такого стента вдоль участка в кровеносном сосуде, где такой стент находится в течение некоторого периода времени; и спустя какое-то время развертывание второго стента вдоль приблизительно того же участка в кровеносном сосуде, так что кровеносный сосуд повторно подвергается лечению.
Другой вариант осуществления изобретения раскрывает рентгеноконтрастный по своей природе, биосовместимый, саморассасывающийся полимер, где этот полимер содержит одно или более повторяющихся звеньев формулы (I), как определено выше, и также содержит одно или более повторяющихся звеньев формулы (II):
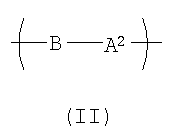
где В представляет собой -O-(CHR6)p-O)q-;
R6 представляет собой Н или C1-С3 алкил;
р и q являются каждый индивидуально целым числом из диапазона от 1 до 100;
А выбирают из группы, состоящей из
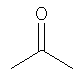 ,
, 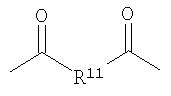 ,
, 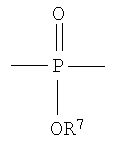 ,
,  и
и  ;
;
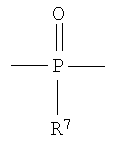
где R7 представляет собой Н или C1-С30 углеводород и R11 выбирают из группы, состоящей из C1-С30 алкила, С1-С30 гетероалкила, C5-С30 арила, С6-С30 алкиларила и С2-С30 гетероарила. Другой вариант осуществления изобретения раскрывает медицинское устройство, которое содержит такой полимер. В одном варианте осуществления изобретения, В представляет собой звенья алифатического линейного или разветвленного диола или поли(алкиленгликоля). Другой вариант осуществления изобретения раскрывает рентгеноконтрастный по своей природе, биосовместимый, саморассасывающийся полимер, где этот полимер содержит одно или более повторяющихся звеньев формулы (I) и одно или более повторяющихся звеньев формулы (II), каждый, как определено выше, и также содержит одно или более повторяющихся звеньев формулы (Ia):
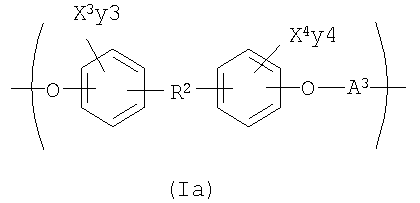
где X3 и X4 каждый независимо выбран из группы, состоящей из Br и I;
у3 и у4 каждый независимо представляет собой ноль или целое число в диапазоне от 1 до 4;
R2 выбирают из группы, состоящей из:
 ,
,
 и
и
 ;
;
R8 и R9 каждый независимо представляет собой Н или некристаллизующийся С1-С30 углеводород;
Z4, Z5 и Z6 каждый независимо представляют собой О или S и
а и b каждый независимо представляет собой целое число в диапазоне от 1 до 8;
А выбирают из группы, состоящей из:
 ,
,
 ,
,
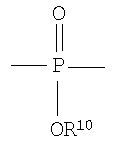 ,
,
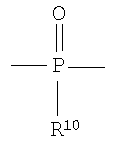 и
и
 ;
;
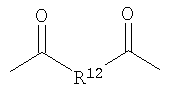
где R10 выбирают из группы, состоящей из Н или C1-С30 алкила, C1-С30 гетероалкила, и где R12 выбирают из группы, состоящей из C1-С30 алкила, C1-С30 гетероалкила, C5-С30 арила, С6-С30 алкиларила и C2-С30 гетероарила. Другой вариант осуществления изобретения раскрывает медицинское устройство, которое содержит такой полимер.
В некоторых вариантах осуществления изобретения полимер может содержать одно или более повторяющихся звеньев формулы (I), (Ia) и/или (II). Например, другой вариант осуществления раскрывает рентгеноконтрастный по своей природе, биосовместимый, саморассасывающийся полимер, где этот полимер содержит одно или более повторяющихся звеньев формулы (III):
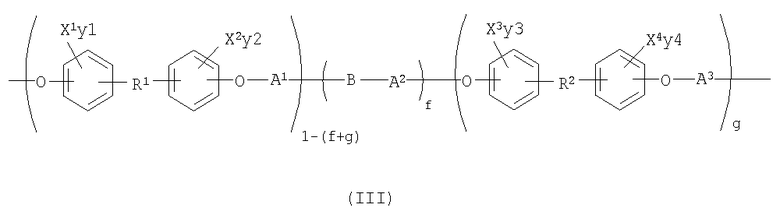
где X1, X2, X3, X4, у1, у2, у3, у4, R1, R2, А1, А2, А3 и В являются такими, как определены выше, и где f и g могут каждый независимо изменяться от 0 до 1, например, в виде составляемых/осуществляемых требований, при условии, что сумма f и g меньше 1. Другой вариант осуществления изобретения раскрывает медицинское устройство, которое содержит такой полимер.
В предпочтительных вариантах осуществления медицинских устройств, описанных выше, устройство представляет собой стент. В вариантах стент также включает конфигурации, выбранные из группы, состоящей из листового стента, плетеного стента, саморасширяющегося стента, проволочного стента, деформируемого стента и шарнирного стента. В другом варианте стент включает, по крайней мере, два в основном недеформируемых элемента, расположенных с образованием трубчатого элемента, эти недеформируемые элементы являются подвижными и/или свободно вращающимися и взаимосвязанными для допущения возможности трубчатому элементу расширяться от сжатого до расширенного состояния.
В другом варианте стент также содержит трубчатый элемент, содержащий ряд подвижно соединенных радиальных элементов и блокирующий механизм, предназначенный для одностороннего движения радиальных элементов, так что указанный трубчатый элемент приспособлен расширяться от первого сжатого диаметра до второго расширенного диаметра с минимальной отдачей.
В предпочтительных вариантах осуществления медицинского устройства группы X1 и X2 в полимере являются иодом.
В предпочтительных вариантах осуществления медицинское устройство также содержит эффективное количество терапевтического агента. Предпочтительно количество является достаточным для ингибирования рестеноза, тромбоза, образования бляшек, разрыва бляшек и воспаления, снижения холестерина и/или ускорения заживления.
В другом варианте осуществления медицинского устройства полимер образует оболочку, по крайней мере, на части медицинского устройства.
Другой вариант осуществления раскрывает систему для лечения участка внутри сосуда. Система включает в себя катетер, имеющий средства развертывания, и стент, как описано выше, содержащий рентгеноконтрастный, биосовместимый, саморассасывающийся полимер, где катетер приспособлен для доставки стента к участку и средства развертывания предназначены для развертывания стента. В некоторых предпочтительных вариантах осуществления изобретения катетер выбирают из группы, состоящей из проволочного катетера, коаксиального быстро обменивающегося катетера и многообменного катетера доставки.
Другой вариант осуществления изобретения раскрывает способ для повторного лечения полости тела. Способ включает стадии: развертывания первого стента вдоль участка в кровеносном сосуде, где первый стент содержит вышеописанный рентгеноконтрастный, биосовместимый, саморассасывающийся полимер и где первый стент находится в сосуде в течение некоторого периода времени; и спустя какое-то время происходит развертывание второго стента, саморассасывающего, или металлического, или другого вдоль приблизительно того же участка в кровеносном сосуде, так что кровеносный сосуд повторно подвергается лечению.
В других аспектах изобретения полимер содержит основную цепь, которая не является природной. Альтернативно и/или дополнительно полимер может содержать основную цепь, содержащую, по крайней мере, одно аминокислотное производное.
В предпочтительных вариантах осуществления изобретения медицинское устройство предназначено для размещения в участке сосудистой, костно-мышечной/ортопедической, нервной, респираторной, репродуктивной, мочевой, пищеварительной, эндокринной, кроветворной и/или покровной системы. В одном варианте осуществления изобретения медицинское устройство приспособлено для размещения в репродуктивной системе для применения, отличного от лечения фибромы матки.
В другом варианте осуществления медицинское устройство имеет не галогенированную оболочку.
Вышеупомянутые и другие объекты, признаки и преимущества настоящего изобретения легко очевидны из детального описания предпочтительных вариантов, представленных ниже.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ.
Чертеж представляет собой детальный вид шарнирной стентовой конфигурации в соответствии с одним предпочтительным вариантом осуществления настоящего изобретения, содержащего меняющиеся зубчики, которые отклоняются вниз для обеспечения стента, расширяющегося в одном направлении.
ДЕТАЛЬНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ.
Для соответствия важным потребностям в отношении развития саморассасывающихся, рентгеноконтрастных стентов изобретатели разработали некоторые полимерные материалы, которые содержат повторяющееся звено формулы (I). Предпочтительные полимеры содержат повторяющееся звено формулы (I), включающее комбинации производных структурных элементов, выбранных из дикарбоновых кислот, галогенированных (например, иодированных или бромированных) производных дезаминотирозил-тирозина и поли(алкилен гликолей), которые обладают желательными физико-механическими и физико-химическими свойствами, которые являются устойчивыми при их использовании в создании медицинских устройств, таких как стенты. Например, стенты, описанные в соответствии с предпочтительными вариантами осуществления настоящего изобретения: (а) являются достаточно рентгеноконтрастными для того, чтобы быть видимыми при обычной рентгеновской флуороскопии; (b) являются достаточно прочными для поддержания на соответствующем с медицинской точки зрения уровне радиального сжатия в артерии или окружающей ткани; и/или (с) имеют желательную степень рассасывания, которая может быть приспособлена для вычисления необходимого диапазона применений, требующих присутствия стентов в течение различных отрезков времени или для элюирования лекарственных средств.
Хотя изобретатели не хотят быть привязанными к какой-либо конкретной теории воздействия, они считают, что полезная комбинация свойств, связанных с медицинскими устройствами по настоящему изобретению, может быть отнесена, по крайне мере, частично к некоторым характеристикам полимеров формулы (I), из которых эти устройства выполнены. Понятно, что полимеры, описанные здесь, могут быть использованы в соответствии с предпочтительными аспектами изобретения в качестве однородных полимеров, в виде сополимеров и/или смеси полимеров. Соответствующим образом применяемая здесь отсылка к полимеру формулы (I) является отсылкой к полимеру, который содержит повторяющееся звено формулы (I), которое может быть гомополимером, сополимером или смесью.
Саморассасывающиеся, рентгеноконтрастные по своей природе стенты, раскрываемые в соответствии с предпочтительными вариантами осуществления изобретения, могут быть использованы, например, для временной обработки кровеносных сосудов, как при традиционном применении, которое обычно включает доставку через катетер.
Заявитель раскрывает, что биосовместимый, саморассасывающийся рентгеноконтрастный по своей природе полимерный класс может быть получен из широкого класса арилсодержащих биосовместимых, саморассасывающихся полимеров. Например, для всех из биосовместимых, саморассасывающихся полимеров, представленных в таблице ниже, рентгеноконтрастные атомы могут быть введены в ароматическое кольцо путем галогенирования, в частности бромирования и иодирования, с помощью хорошо известных техник, которые могут быть легко осуществлены специалистами в области техники без длительного экспериментирования, в свете данных, приведенных здесь. Патент США №6475477 раскрывает широкий класс рентгеноконтрастных по своей природе, биосовместимых, саморассасывающихся полимеров, выполненных этим способом. Рентгеноконтрастность возможно придать другим полимерам из Таблицы 1 подобным образом, например галогенированием мономеров, из которых получают полимеры, и/или галогенированием самих полимеров. Полное описание каждого патента из списка в Таблице 1 приведено здесь для ссылки и, в частности, с целью описания способа, с помощью которого различные полимеры могут быть получены.
Например, предпочтительный вариант осуществления изобретения раскрывает рентгеноконтрастный по своей природе биосовместимый, саморассасывающийся полимер, где этот полимер содержит одно или более повторяющихся звеньев формулы (I):
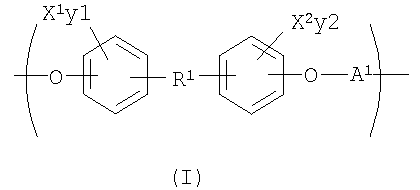
где Х1 и Х2 каждый независимо выбран из группы, состоящей из Br и I;
у1 и у2 каждый независимо представляет собой ноль или целое число в диапазоне от 1 до 4 при условии, что сумма у1 и у2 равна, по крайней мере, одному;
R1 представляет собой

R13 и R14 каждый независимо выбирают из группы, состоящей из -СН=СН-, -(СН2)с-, -(CHJ1)-, -CHJ2-CHJ3-, -CH=CH-(CHJ1)- и -(CH2)с-(CHJ1)-;
с представляет собой ноль или целое число в диапазоне от 1 до 8;
J1, J2 и J3 каждый независимо выбирают из группы, состоящей из Н, Br, I, - NH-Q2 и -C(=Z8)-OQ3;
Q1, Q2 и Q3 каждый независимо представляет собой Н или некристаллизующуюся группу, содержащую от 1 до приблизительно 30 атомов углерода;
Z7 и Z8 каждый независимо представляет собой О или S;
А1 выбирают из группы, состоящей из
 ,
,  и
и  ;
;
R5 выбирают из группы, состоящей из Н, C1-С30 алкила и C1-С30 гетероалкила. В предпочтительном варианте осуществления изобретения X1, X2, у1 и у2 выбирают так, чтобы X1 и X2 присутствовали в количестве, которое является эффективным для обнаружения рентгеноконтрастности полимера.
В различных вариантах осуществления изобретения R1 выбирают из группы, состоящей из:
 ,
,
 и
и

где R3 и R4 каждый независимо представляет собой Н или некристаллизующийся C1-С30 углеводород;
Z1, Z2 и Z3 каждый независимо представляют собой О или S и
j и m каждый независимо представляет собой целое число в диапазоне от 1 до 8.
Другой вариант осуществления изобретения раскрывает рентгеноконтрастный по своей природе, биосовместимый, саморассасывающийся полимер, где этот полимер содержит одно или более повторяющихся звеньев формулы (I), как определено выше, и также содержит одно или более повторяющихся звеньев формулы (II):
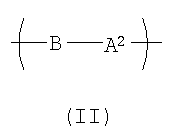
где В представляет собой -O-(CHR6)p-O)q-;
R6 представляет собой Н или C1-С3 алкил;
р и q являются каждый индивидуально целым числом из диапазона от 1 до 100;
А2 выбирают из группы, состоящей из
 ,
,  ,
,  ,
,  и
и  ;
;
где R7 представляет собой Н или C1-С30 углеводород и R11 выбирают из группы, состоящей из C1-С30 алкила, C1-С30 гетероалкила, C5-С30 арила, С6-С30 алкиларила и С2-С30 гетероарила. Другой вариант осуществления изобретения раскрывает медицинское устройство, которое содержит такой полимер. В одном варианте осуществления изобретения В представляет собой звенья алифатического линейного или разветвленного диола или поли(алкиленгликоля).
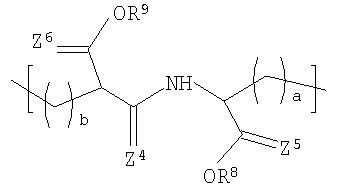
Другой вариант осуществления изобретения раскрывает рентгеноконтрастный по своей природе, биосовместимый, саморассасывающийся полимер, где этот полимер содержит одно или более повторяющихся звеньев формулы (I) и одно или более повторяющихся звеньев формулы (II), каждый как определено выше, и также содержит одно или более повторяющихся звеньев формулы (Ia):
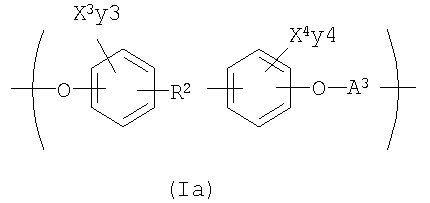
где X3 и X4 каждый независимо выбран из группы, состоящей из Br и I;
у3 и у4 каждый независимо представляет собой ноль или целое число в диапазоне от 1 до 4;
R2 выбирают из группы, состоящей из:
 ,
,
 и
и
 ;
;
R8 и R9 каждый независимо представляет собой Н или некристаллизующийся C1-С30 углеводород;
Z4, Z3 и Z6 каждый независимо представляют собой О или S и
а и b каждый независимо представляет собой целое число в диапазоне от 1 до 8;
А3 выбирают из группы, состоящей из:
 ,
,
 ,
,
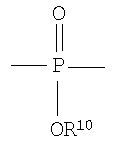 ,
,
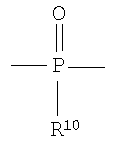 и
и
 ;
;
где R10 выбирают из группы, состоящей из Н или C1-С30 алкила, C1-С30 гетероалкила, и
где R12 выбирают из группы, состоящей из C1-С30 алкила, C1-С30 гетероалкила, C5-С30 арила, С6-С30 алкиларила и С2-С30 гетероарила. Другой вариант осуществления изобретения раскрывает медицинское устройство, которое содержит такой полимер.
Некоторые галогенированные композиционные варианты вышеописанных полимеров из Таблицы 1 могут быть представлены формулой (I), также другими формулами, представленными здесь. Необходимо отметить, что композиционный диапазон, описанный здесь для полимеров, содержащих повторяющиеся звенья формулы (I), выходит за пределы полимеров, описанных в Таблице 1. Соответствующим образом некоторые предпочтительные примеры рентгеноконтрастных по своей природе, биосовместимых, саморассасывающихся полимеров включают полимеры, содержащие повторяющиеся звенья, представленные формулой (I), включая полимеры, которые также содержат повторяющиеся звенья формулы (Ia) и/или формулы (II).
Например, в соответствии с одним предпочтительным вариантом осуществления настоящего изобретения описывается медицинское устройство, содержащее рентгеноконтрастный по своей природе, биосовместимый, саморассасывающийся полимер, включая их гомогенные полимеры, сополимеры и смеси, где полимер содержит одно или более повторяющихся звеньев формулы (III):
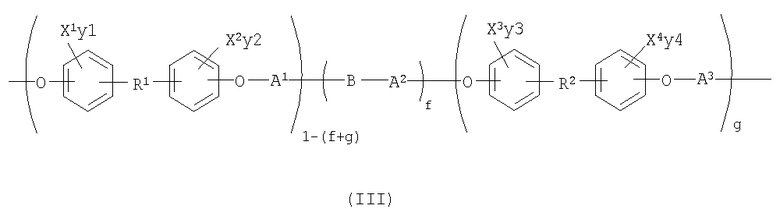
где Х1, Х2, Х3 и Х4 каждый независимо представляет собой Br и I;
у1, у2, у3 и у4 каждый независимо представляет собой 0,1, 2, 3 или 4;
где f и g могут изменяться от 0 до 1 при условии, что сумма f и g меньше 1;
R1 и R2 независимо представляют:
 или
или
 или
или

где R3 и R4 каждый независимо представляет собой Н или некристаллизующийся C1-С30 углеводород;
где j и m каждый независимо представляет собой целое число в диапазоне от 1 до 8;
Z1, Z2 и Z3 каждый независимо представляют собой О или S
и где А1 выбирают из группы, состоящей из
 ,
,  и
и  ;
;
где R5 представляет собой H, C1-С30 углеводород;
где А2 и А3 каждый независимо выбирают из группы, состоящей из
 ,
,  ,
, 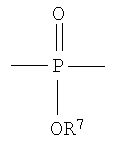 ,
,  и
и  ;
;
где R7 представляет собой H или C1-С30 углеводород и R11 выбирают из группы, состоящей из C1-С30 алкила, C1-С30 гетероалкила, С5-С30 арила, С6-С30 алкиларила и С2-С30 гетероарила;
где В представляет собой -O-(CHR6)p-O)q-;
где R6 представляет собой Н или C1-С3 алкил;
где р и q являются каждый индивидуально целым числом из диапазона от 1 до 100;
Предпочтительно X1, X2, X3, X4, у1, у2, у3, у4 выбирают так, что X1, X2, X3, X4 присутствуют в количестве, которое является эффективным для обнаружения рентгеноконтрастности полимера. Например, в одном варианте осуществления изобретения сумма у1, у2, у3, у4 равна, по крайней мере, одному. В другом варианте осуществления изобретения В представляет собой звено алифатического линейного или разветвленного диола или поли(алкиленгликоля). Считают, что повторяющее звено формулы (III) содержит повторяющиеся звенья формулы (I), (II) и (Ia), как описано выше. Причем полимер, который содержит повторяющее звено формулы (III), является примером полимера, который содержит повторяющее звено формулы (I).
Галогенирование ароматических колец может быть осуществлено, как описано в примерах ниже, и с помощью обычных методов, детально описанных в патенте США №6475477; приведенного здесь для ссылки во всей своей целостности и, в частности, с целью описания способов галогенирования мономеров. Предпочтительные полимеры являются достаточно галогенированными для обнаружения рентгеноконтрастности полимеров, например у1 и у2 в формуле (I) может независимо быть равен =0, 1, 2, 3 или 4. Галогенирование ароматических колец является предпочтительным. В одном варианте осуществления изобретения сумма у1 и у2 равна, по крайней мере, 1. Различные другие группы в полимере также могут быть галогенированы.
В широком классе галогенированных полимеров, содержащих повторяющиеся звенья, представленные формулой (I), полимеры, имеющие R1 и А1 группы, указанные в Таблице 2, являются предпочтительными:


















В соответствии с одним аспектом настоящего изобретения описывается галогензамещенный полимер, содержащий одно или более повторяющихся звеньев, описываемых формулой (I). Смесь галогенированных мономеров, раскрываемых здесь, также включают в соответствии с предпочтительными вариантами настоящего изобретения. В некоторых вариантах осуществления изобретения полимеры, содержащее повторяющееся звено формулы (I), не содержат кристаллизующихся групп, например не содержат кристаллизующихся боковых цепей. Например, в некоторых вариантах осуществления изобретения, описанных выше, Q1, Q2 и Q3 в формуле для R1 является каждый независимо H или не кристаллизующейся группой, содержащей от 1 до 30 атомов углерода. В других вариантах осуществления изобретения, описанных выше, R3, R4, R8 и/или R9 каждый независимо является Н или не кристаллизующейся C1-С30 углеводородной цепью. Кристаллизация боковых цепей может быть минимизирована или предотвращена регулированием длины боковой цепи, типа боковой цепи и пространства между боковыми цепями. Когда пространство между боковыми цепями увеличивается, тенденция для боковых цепей кристаллизоваться снижается. Подобным образом, когда гибкость боковых цепей возрастает, тенденция для боковых цепей кристаллизоваться снижается. Подобным образом, когда длина боковых цепей уменьшается, тенденция для боковых цепей кристаллизоваться также снижается. Таким образом, некоторые варианты полимеров, содержащих повторяющиеся звенья формулы (I), не включает полимеры с кристаллизующимися боковыми цепями, описанными в заявке на патент США №11/176638, поданной 7 июля, 2005, которая приведена здесь для ссылки во всей ее целостности.
СИНТЕЗ МОНОМЕРОВ И ПОЛИМЕРОВ.
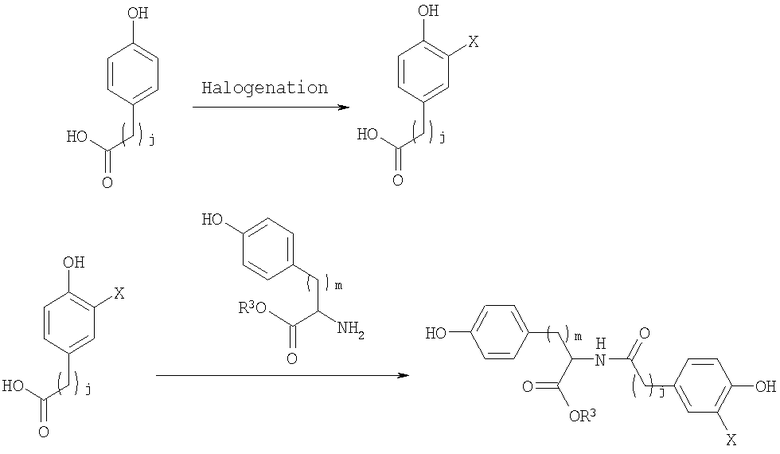
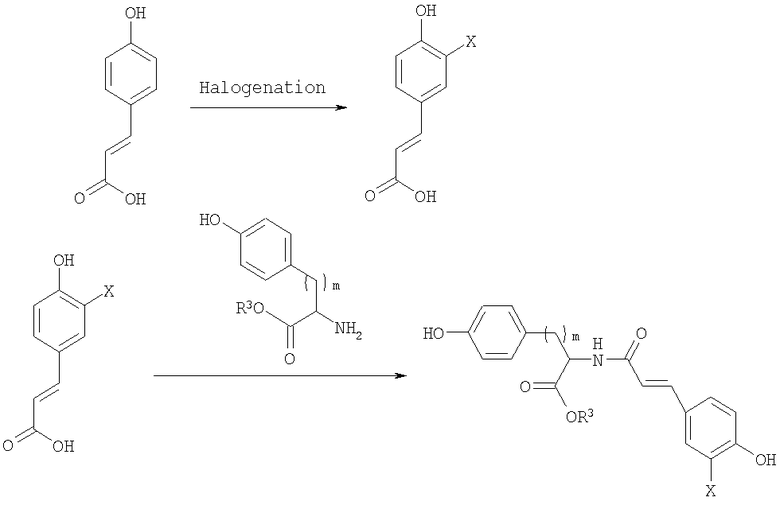
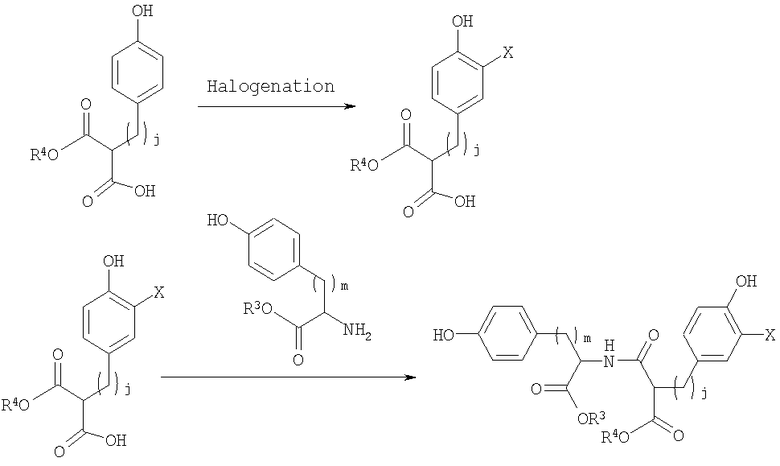
Полимеры, описанные здесь (включая, например, полимеры, содержащие повторяющее звено формулы (I)), могут быть синтезированы различными обычными способами, известными в уровне техники. Например, Синтетические Схемы 1-3 иллюстрируют получение галогенированных фенольных мономеров, полезных для получения полимеров формулы (I).
Синтетическая схема 1
Halogenetion = Галогенирование
Синтетическая схема 2
Halogenetion = Галогенирование
Синтетическая схема 3
Halogenetion = Галогенирование
В синтетических Схемах 1-3, представленных выше, Х может быть галогеном, таким как иод, бром, хлор или фтор. Предпочтительно галоген представляет собой иод или бром. Галогенирование может быть осуществлено обычными реакциями, известными в уровне техники. Например, иодирование арильных колец может быть осуществлено обработкой KI, ICl, IF, бензилтриметиламмониум дихлороиодат или I2 в присутствии солей меди. Подобным образом бромирование арильных колец может быть осуществлено обработкой бромом в присутствии катализатора, такого как железо. Другие реагенты для бромирования включают HOBr или бромамиды. Реакция соединения кислоты и амина, проиллюстрированная на Схемах 1-3, может также быть осуществлена обычными методами, известными в уровне техники. Стандартные реагенты для соединения, включая EDCl (гидрохлорид 1-этил-3(3'-диметиламинопропил)карбодиимид), HBTU (2-(1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурониум гексафторфосфат, HOBt (1-гидроксибензотриазол) и тому подобное, могут быть использованы для активирования реагирующих веществ.
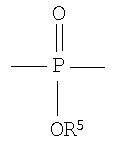
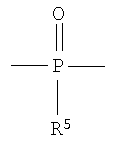
Полученные галогенированные фенольные мономеры могут быть полимеризованы с образованием различных связей, например полимеры с фосфатными связями, такие как поли(фосфаты) и поли(фосфонаты). Соответствующие структуры этого класса полимеров, каждый имеющий различную боковую цепь, соединенную с атомом фосфора, являются следующими:
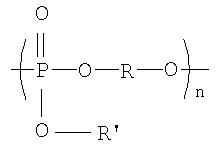
Полифосфат
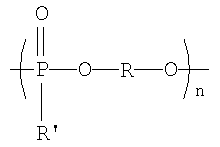
Полифосфонат
Разносторонность этих полимеров может объясняться разносторонностью атома фосфора, который известен множественностью реакций. Его связывание может захватывать 3р-орбитали или различные 3s-3p-гибриды; spd-гибрида также возможны из-за доступности d-орбиталей. Таким образом, физико-химические свойства поли(фосфоэфиров) могут быть легко изменены изменением группы R или R'. Способность к биологическому разложению полимера объясняется в основном физиологически лабильной фосфороэфирной связью в основной цепи полимера. Изменением основной цепи или боковой цепи широкий диапазон степеней биодеградации достижим.
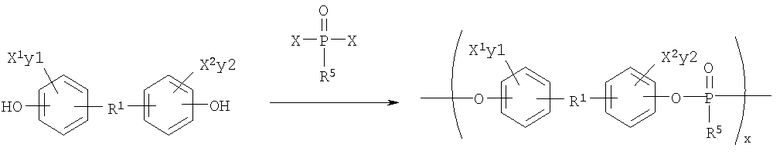
Синтетические схемы 4-5, представленные ниже, иллюстрируют синтез поли(фосфонатов) и поли(фосфатов) соответственно:
Синтетическая Схема 4
Синтетическая Схема 5
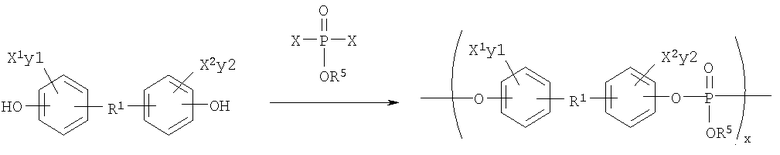
Поли(фосфаты) могут быть получены дегидрохлоринированием между фосфодихлоридатом и диолом в соответствии со следующей схемой:
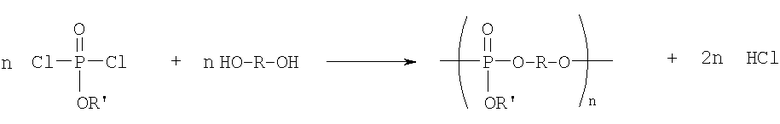
Поли(фосфонаты) могут быть получены подобной конденсацией между соответственно замещенными дихлоридами и диодами.
Поли(фосфиты) могут быть получены из гликолей двухстадийной реакцией конденсации. 20% молярный избыток диметилфосфита является предпочтительным для использования при взаимодействии с гликолем, за которым следует удаление метоксифосфонильной концевой группы у олигомеров при высокой температуре. Преимущество поликонденсации в расплаве заключается в том, что удается избежать использования растворителей и большого количества других добавок, что облегчает очистку. Это может также обеспечить умеренно высокий молекулярный вес. Полимеризация может также быть осуществлена в растворе. Хлорсодержащий органический растворитель может быть использован, такой как хлороформ, дихлорметан или дихлорэтан. Для улучшения высокого молекулярного веса полимеризацию в растворе предпочтительно осуществляют в присутствии эквимолярного количества взаимодействующих веществ, наиболее предпочтительно стехиометрического количества кислоты акцептора или катализатора типа кислоты Льюиса. Полезные кислотные акцепторы включают третичные амины, такие как пиридин или триэтиламин. Примерами полезных катализаторов типа кислоты Льюиса является хлорид магния или кальция. Продукт может быть выделен из раствора осаждением из не растворяющего данный продукт растворителя и очищен выделением в виде соли гидрохлорида обычными техниками, известными специалисту в данной области техники, такими как промывание водным подкисленным раствором, например разбавленной HCl.
Галогенированные фенольные мономеры могут также быть полимеризованы с образованием полиминокарбонатов, как проиллюстрировано на Синтетической Схеме 6. Полиминокарбонаты по структуре подобны поликарбонатам. Полиминокарбонаты имеют иминогруппы на местах, обычно занятых карбонильным кислородом у поликарбонатов. Таким образом, полииминокарбонаты имеют связи в соответствии с формулой:
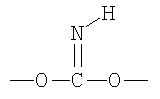
Введение связей иминокарбонатов могут придавать значительную степень гидролитической нестабильности полимеру. Полиминокарбонаты имеют желательные механические свойства, подобные свойствам, присущим соответствующим поликарбонатам.
Синтетическая Схема 6
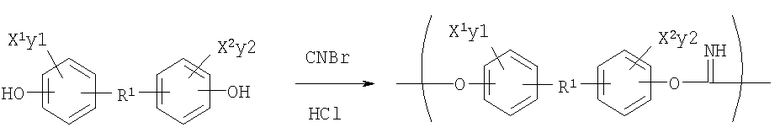
Процесс полимеризации в растворе может быть использован для получения полиминокарбонатов. Например, процесс полимеризации в растворе может включать стадии взаимодействия дифенола с дицианатом в растворе в основном чистого растворителя в присутствии катализатора, выбранного из группы, состоящей из гидрооксидов металлов, гидридов металлов и алкоксидов металлов, и восстановления полученного полиминокарбоната. Растворитель предпочтительно выбирают из группы, состоящей из ацетона и тетрагидрофурана («ТГФ»). Наиболее предпочтительным растворителем является свежеперегнанный ТГФ. Катализатором предпочтительно является гидроксид или алкоксид щелочных металлов, такой как гидроксид натрия или третбутоксид калия.
Чистота растворителя, выбор катализатора и выбор растворителя могут значительно повлиять на результаты, полученные при реакции полимеризации в растворе. Таким образом, даже номинально чистые реагенты или аналитические чистые растворители, и в частности ТГФ, могут содержать остаточную воду, стабилизаторы, такие как бутилированный гидрокситолуол и пероксиды. Эти загрязняющие вещества, даже в минимальных количествах, могут служить препятствием реакции полимеризации в растворе. Среди широкого класса катализаторов, предложенных для полимеризации в растворе полиминокарбонатов, гидроксиды металлов, алкоксиды металлов, гидриды металлов, и в частности гидроксиды и алкоксиды щелочных металлов, обеспечивают явно высокие результаты. ТГФ и ацетон являются предпочтительными растворителями.
Межфазный процесс полимеризации может быть также использован для получения полиминокарбонатов. Например, межфазный процесс полимеризации может включать стадии смешения водного раствора галогенированного фенольного мономера и основного катализатора с раствором цианогенбромида в органическом растворителе, не смешивающемся с водой, путем постепенного добавления водного раствора к раствору цианогенбромида в органическом растворителе в процессе смешивания и восстановления полученного полиминокарбоната. Порядок добавления может быть очень существенным, и скорость добавления может быть также существенным фактором.
Реакции по вышеприведенным синтетическим схемам могут быть осуществлены через негалогенированные версии. Затем галогенирование полимера может быть осуществлено. Галогенирование может быть осуществлено обычными реакциями, известными в уровне техники. Например, иодирование арильных колец может быть осуществлено обработкой KI, ICl, IF, бензилтриметиламмониум дихлороиодат или I2 в присутствие солей меди. Например, бромирование арильных колец может быть осуществлено обработкой бромом в присутствие катализатора, такого как железо. Другие реагенты для бромирования включают HOBr или бромамиды. Галогенирование полимера может быть неселективным, что включено в объем предпочтительных вариантов осуществления.
Исходные материалы, описанные здесь, являются коммерчески доступными, известными или могут быть получены способами, известными в уровне техники. Дополнительно исходные материалы, не описанные здесь, являются коммерчески доступными, известными или могут быть получены способами, известными в уровне техники.
Исходные материалы могут иметь соответствующие заместители для получения желаемых продуктов с соответствующими заместителями. Альтернативно заместители могут быть добавлены на любой стадии синтеза для получения желаемых продуктов с соответствующими заместителями.
Синтетические схемы демонстрируют способы, которые могут быть использованы для получения соединений по предпочтительным вариантам осуществления изобретения. Специалист в данной области оценит, что число различных синтетических реакционных схем может быть использовано для синтеза соединений по предпочтительным вариантам осуществления. Более того, специалист определит, что число различных растворителей, соединяющих агентов и условий реакции может быть использовано в реакционных схемах для получения сопоставимых результатов.
Специалист в данной области техники оценит изменения в последовательности и, более того, осознает изменения в соответствующих условиях реакции от аналогичных реакций, продемонстрированных или иным образом известных, которые могут быть соответственно использованы в процессах, приведенных выше, для получения соединений по предпочтительным вариантам осуществления.
В процессах, описанных здесь, для получения соединений по предпочтительным вариантам осуществления изобретения требования к защитным группам хорошо известны специалисту в области органической химии, и соответствующим образом использование соответствующих защитных групп необходимо подразумевать для процессов по схемам, приведенным здесь, хотя такие группы могут быть не проиллюстрированы. Введение и удаление таких подходящих защитных групп хорошо известно в области органической химии; смотреть например, Т.W.Greene, «Protective Groups in Organic Synthesis» («Защитные группы в Органическом Синтезе»), Wiley (New York), 1999.
Продукты реакций, описанные здесь, выделяют обычными способами, такими как экстракция, дистилляция, хроматография и тому подобное.
Соли соединений по синтетическим схемам, описанных выше, получают взаимодействием соответствующих оснований или кислот со стехиометрическим эквивалентом соединений по синтетическим схемам, представленным выше.
Полимеры, описанные здесь, например, полимеры, содержащие повторяющееся звено формулы (I), могут быть использованы для различных целей, например в медицинских устройствах. Например, различные предпочтительные варианты изобретения раскрывают медицинские устройства, которые содержат полимер формулы (I). Медицинские устройства могут содержать полимер различными способами. Например, медицинское устройство может быть сконструировано полностью или частично из полимера, быть покрытым полимером, герметизировано полимером и/или устройство может содержать полимер. Не ограничивающие примеры медицинских устройств, которые могут содержать полимер формулы (I), включают: стенты, стентовый имплантат, кольцо для аннулопластики, сосудистый имплантат, шовный материал, сосудистый манжет, устройство для лечения дефекта перегородки сердца, сердечный клапан, компонент сердечного клапана, устройство для лечения сердечного клапана, запирающее устройство, индуктор пролиферации сосудистой системы и соединительной ткани, имплантат, сконструированный из ткани. В некоторых вариантах осуществления изобретения это медицинское устройство не включает в себя любое из медицинских устройств (например, эмболотерапевтические продукты), описанное в заявке на Патент США №10/952274, поданной 27 сентября 2004, опубликованной 19 мая 2005 как Публикация патента США №2005/0106119 А1, которая приведена здесь для ссылки во всей ее целостности. В некоторых вариантах осуществления изобретения это медицинское устройство не включает в себя любое из медицинских устройств (например, эмболотерапевтические продукты), содержащих полимер с кристаллизующимися боковыми цепями, описанных в заявке на Патент США №11/176638, поданной 7 июля 2005, которая приведена здесь для ссылки во всей ее целостности.
В предпочтительном варианте осуществления изобретения медицинское устройство содержит стент. Стент может иметь различные конфигурации, например конфигурации, выбранные из группы, состоящей из листового стента, плетеного стента, саморасширяющегося стента, проволочного стента, деформируемого стента и шарнирного стента.
В предпочтительном варианте осуществления изобретения стент имеет, по крайней мере, два в основном недеформируемых элемента, расположенных с образованием трубчатого элемента, эти недеформируемые элементы являются подвижными и/или свободно вращающимися, взаимосвязанные для допущения возможности трубчатому элементу расширяться от сжатого до расширенного состояния. В другом варианте стент также содержит трубчатый элемент, содержащий ряд подвижно соединенных радиальных элементов и блокирующий механизм, предназначенный для одностороннего движения радиальных элементов, так что указанный трубчатый элемент приспособлен расширяться от первого сжатого диаметра до второго расширенного диаметра с минимальной отдачей.
Стент на катетере обычно именуют как стентовая система. Катетер включает, но не ограничивается, проволочный катетер, коаксиальный быстро обменивающийся катетер и катетер Медтроник Зиппер Текнолоджи (Medtronic Zipper Technology), который является относительно новой многообменной платформой доставки. Такие катетеры могут включать, например, описанные в патентах США №4762129; 5232445; 4748982; 5496346; 5626600; 5040548; 5061273; 5350395; 5451233 и 5749888. Дополнительные примеры подходящих конструкций катетеров включают описанные в патентах США №4762129; 5092877; 5108416; 5197978; 5232445; 5300085; 5445646; 5496275; 5545135; 5545138; 5549556; 5755708; 5769868; 5800393; 5836965; 5989280; 6019785; 6036715; 5242399; 5158548; и 6007545. Описание цитированных выше патентов приведено здесь для ссылки во всей их целостности.
Катетеры могут быть предназначены для различных целей, таких как создание ультразвукового эффекта, электрического поля, магнитного поля, светового и/или температурного эффекта. Нагревающие катетеры могут включать описанные в патентах США №5151100, 5230349; 6447508; и 6562021, также WO 90/14046 A1. Катетеры, излучающие в ИК-диапазоне, могут включать, например, описанные в патентах США №5910816 и 5423321. Описание цитированных выше патентов приведено здесь для ссылки во всей их целостности.
В другом предпочтительном варианте осуществления изобретения стент также содержит какое-то количество терапевтического агента (например, фармацевтического агента и/или биологического агента), достаточного для проявления выбранного терапевтического эффекта. Термин «фармацевтический агент», как используется здесь, включает вещество, предназначенное для облегчения, лечения или предотвращения заболевания, которое стимулирует специфический физиологический (метаболический) отклик. Термин «биологический агент», как используется здесь, охватывает любую субстанцию, которая обладает структурной и/или функциональной активностью в биологической системе, включая, без ограничения, орган, тканевые или клеточные производные, клетки, вирусы, нуклеиновые кислоты (животные, растительные, микробные и вирусные), которые являются природными, рекомбинантными и синтетическими по происхождению, любой последовательности и размера, антитела, полинуклеотиды, олигонуклеотиды, кДНК, онкогены, протеины, пептиды, аминокислоты, липопротеины, гликопротеины, липиды, углеводы, полисахариды, липиды, липосомы или другие клеточные компоненты или органеллы, например рецепторы и лиганды. Также термин «биологический агент», как используется здесь, включает вирус, сыворотку, токсин, антитоксин, вакцину, кровь, компоненты крови или производные, аллергенный продукт, или аналогичный продукт, или арсфенамин, или его производные (или любое трехвалентное органическое соединение мышьяка), применимые для предотвращения, обработки, лечения заболевания или ран человека (в соответствии с Разделом 351(а) Акта Министерства Здравоохранения, Образования и Социального обеспечения (Public Health Service Act (42 Свод Законов США 262(а)). Также термин «биологический агент» может включать 1) «биомолекулу», как используется, охватывающую биологически активный пептид, протеин, углевод, витамин, липид или нуклеиновую кислоту, получаемую или выделяемую из организмов природного происхождения или рекомбинантных организмов, антител, тканей или клеточных линий или синтетических аналогов таких молекул; 2) «генетический материал», как используется здесь, охватывающий нуклеиновую кислоту (или дезоксирибонуклеиновую кислоту (ДНК), или рибонуклеиновую кислоту (РНК)), генетический элемент, ген, фактор, аллель, оперон, структурный ген, регуляторный ген, ген-оператор, ген-комплемент, геном, генетический код, кодон, антикодон, матричная РНК (мРНК), транспортная РНК (тРНК), рибосомный экстрахромосомный генетический элемент, плазмоген, плазмид, транспозон, генная мутация, генная последовательность, экзон, интрон и 3) «обработанные биопрепараты», как используется здесь, такие как клетки, ткани или органы, которые претерпели воздействие. Терапевтический агент может также включать витамин, или минеральные вещества, или другие натуральные элементы.
Для устройств, помещенных в сосудистую систему, количество терапевтического агента является предпочтительно достаточным для ингибирования рестеноза или тромбоза или для влияния на некоторые другие состояния ткани около стента, например исцеление уязвимой ткани, поврежденной атеросклерозом, и/или предотвращения разрыва или стимулирования эндотелизации. Агент(ы) могут быть выбраны из группы, состоящей из антипролиферативных агентов, противовоспалительных агентов, агентов против матричных металлопротеиназ, агентов для снижения липидов, для изменения уровня холестерина, антитромботических и антитромбоцитарных агентов в соответствии с предпочтительными вариантами осуществления настоящего изобретения. В некоторых предпочтительных вариантах осуществления изобретения для стента терапевтический агент содержится в стенте, поскольку агент сочетается с полимером или смешивается другими средствами, известными специалистам в уровне техники. В других предпочтительных вариантах осуществления для стента терапевтический агент доставляется из полимерной оболочки на поверхности стента. В другом предпочтительном варианте терапевтический агент доставляется посредством не полимерной оболочки. В других предпочтительных вариантах осуществления для стента терапевтический агент доставляется, по крайней мере, из одного участка или с одной поверхности стента. Терапевтический агент может быть химически связан с полимером или носителем, используемым для доставки терапевтического агента, по крайней мере, из одной части стента и/или терапевтический агент может быть химически связан с полимером, который содержит, по крайней мере, одну часть стента. В одном предпочтительном варианте более чем один терапевтический агент может быть доставлен.
Оптимизированный полимер для использования при конструировании стента должен выполнять, по крайней мере, некоторые из следующих критериев:
- Рентгеноконтрастность является предпочтительно достаточной для гарантирования видимости структуры стента на фоне человеческой грудной клетки с помощью рентгеновской флуороскопии - стандартный метод, используемый в клиниках.
- В соответствии с аспектами по настоящему изобретению стенты предпочтительно формируют со стенками, обеспечивающими небольшое поперечное сечение и допускающими прекрасную продольную упругость. В предпочтительных вариантах осуществления изобретения толщина стенки составляет приблизительно от 0,0001 дюйма (0,00025 см) до 0,0250 дюймов (0,064 см) и более предпочтительно приблизительно от 0,0010 (0,0025 см) до 0,0100 дюймов (0,025 см). Однако толщина стенки зависит, по крайней мере, частично, от выбранного материала. Например, толщина может быть меньше чем приблизительно 0,0060 дюймов (0,015 см) для пластмассовых и разлагаемых материалов и может быть меньше чем приблизительно 0.0020 дюймов (0,0051 см) для металлических материалов. В частности, при применении 3,00 мм стента, когда используется пластмассовый материал, толщина находится в диапазоне приблизительно от 0,0040 (0,010) до 0,0045 дюймов (0,011 см). Однако стент, имеющий различные диаметры, может использовать различную толщину для применения в желчных и других периферических сосудах. Указанный выше диапазон толщины представлен для обеспечения предпочтительных характеристик по всем аспектам устройства, включая сборку и развертывание. Однако понятно, что этот диапазон не должен ограничиваться в отношении объема изобретения и что идеи настоящего изобретения могут быть применимы к устройствам, имеющим размеры, не обсуждаемые здесь.
- Стенты предпочтительно являются гемосовместимыми для предотвращения острых тромбозов. Соответствующим образом поверхности устройства являются предпочтительно устойчивыми к адсорбции протеина и тромбоцит/моноцит присоединению. Также поверхности устройств идеально благоприятствуют эндотелиальному избыточному разрастанию, но препятствуют соединению и росту клеток гладкомышечной ткани сосудов (которые являются ответственными за распространение рестеноза).
- Стенты предпочтительно сохраняют их механическую прочность (например, кольцевую прочность) в течение периода от 1-24 месяцев, более предпочтительно около 3-18 месяцев, еще более предпочтительно от 3-6 месяцев.
- Стенты предпочтительно имеют желательную степень биохимического разложения и саморассасывания такую, что стенты пребывают в течение периода времени в полости тела так, что некоторое время спустя любой стент, саморассасывающийся, или металлический, или другой, может быть использован для повторной обработки приблизительно того же участка кровеносного сосуда, или допускают другие формы повторного вмешательства в сосуд, такие как шунтирование сосуда.
Термин «саморассасывающийся» используется здесь для обозначения полимера, который подвергается биоразложению (через действие воды и/или энзимов для химического разложения) и, по крайней мере, продукты разложения удаляются и/или абсорбируются телом.
Термин «рентгеноконтрастный» используется здесь для обозначения объекта или материала, содержащего объект, видимый с помощью методов анализа изображения in vivo, такие как, но, не ограничиваясь, способы рентгеновской радиографии, флуороскопии, другие формы излучения, отображение магнитного резонанса, электромагнитная энергия, структурное изображение (такое как рассчитанная или компьютеризированная томография) и функциональное изображение (такое как ультразвуковая эхография). Термин «рентгеноконтрастный по своей природе» используется здесь для обозначения полимера, который является по существу рентгеноконтрастным вследствие ковалентного связывания изотопов галогена с полимером. Соответствующим образом термин не охватывает негалогенированный полимер, в котором рентгеноконтрастность вызвана исключительно смешением с изотопами галогена или другими рентгеноконтрастными агентами, такими как металлы и их комплексы.
Высоковыгодная комбинация свойств, связанных с предпочтительными галогенированными полимерами в соответствии с вариантами осуществления настоящего изобретения, хорошо подходит для создания различных медицинских устройств, кроме стентов, особенно для медицинского применения, где устройства и/или применение для обработки, заживления, восстановления, косметического эффекта и лечения являются предпочтительно рентгеноконтрастными, биосовместимыми и имеют различное время саморассасывания. Изобретение может быть введено in vivo на, в или вокруг ткани или органа. Подобным образом оно может быть введено ех vivo в надсеченную ткань или поверхность органа и/или использоваться с другим устройством или компонентом устройства, и затем помещено в тело. Изобретение может быть введено с другими синтетическими субстратами и/или биологическими или разработанными на высоком уровне субстратами и/или терапевтическими средствами.
Например, заявители считают, что в некоторых вариантах осуществления изобретения, дополнительно к стентам, полимеры, описанные здесь, являются подходящими для создания имплантируемых устройств с или без терапевтических агентов, компонентов устройства и/или оболочек с или без терапевтических агентов для других сердечно-сосудистых и периферических сосудистых устройств (например, сердце, клапаны, артериальные и венозные кровеносные сосуды, микроциркуляторная часть и сердечная мышца). В некоторых предпочтительных вариантах осуществления изобретения галогенированные полимеры по настоящему изобретению могут преимущественно использоваться для создания различных продуктов, которые включают терапевтические системы доставки колец для аннулопластики, стентовых имплантатов, запирающих устройств, сосудистых имплантатов, шовного материала, сосудистых манжетов (вне сосуда, используемые для различного вида восстановлений, заживлений или обработок), устройство для лечения дефекта перегородки сердца, компонент сердечного клапана, клапаны, компоненты клапана и/или сердечное блокирующее устройство (например, открытое овальное окно (разновидность дефекта межпредсердной перегородки)). Другой вариант осуществления изобретения раскрывает медицинское устройство, предназначенное для доставки, по крайней мере, одного терапевтического агента, такого как стволовые клетки, генетический материал и ткани, где медицинское устройство содержит полимер, который состоит из повторяющихся звеньев формулы (I).
Также полимер, описанный здесь, может быть использован в имплантируемых медицинских устройствах с и без терапевтических агентов, компонентах устройства и/или оболочках с и без терапевтических агентов для использования в других медицинских системах, например костно-мышечная система или ортопедическая система (например, сухожилия, связки, кости, хрящи, скелетные, гладкие мышцы); нервная система (например, спинной мозг, мозг, глаза, внутреннее ухо); респираторная система (например, носовая полость и пазухи, трахея, гортань, легкие); репродуктивная система (например, мужская или женская репродуктивная система); мочевая система (например, почки, пузырь, уретра, мочеточник); пищеварительная система (например, ротовая полость, зубы, слюнные железы, глотка, пищевод, желудок, тонкая кишка, толстая кишка); поджелудочная железа (экзокринные железы, желчные протоки, желчный пузырь, печень, аппендикс, ректо-анальный); эндокринная система (например, поджелудочная железа/островки, гипофиз, околощитовидная железа, щитовидная железа, надпочечник, шишковидное тело); система кроветворения (например, кровь и костный мозг, лимфоузлы, селезенка, вилочковая железа, лимфатические сосуды); и покровная система (например, кожа, волосы, ногти, потовые железы, сальные железы).
Не ограничивающие примеры медицинских устройств, которые могут содержать полимер формулы (I), включают биосовместимые ортопедические устройства, примеры которых описаны в патентах США №6689153 В1 и 6280473 В1, оба из которых приводятся здесь для ссылки. Варианты полимеров могут быть использованы для биосовместимых штифтов, винтов, шовного материала, гвоздиков, скобок и фиксаторов; бедренных протезов и заживляющих компонентов, пористых мембран, пластин и брусочков для восстановления скелета (например, челюстно-лицевой перелом, переломы костей и остеотомии). Пластинки могут быть Н-, O-, Т-, L-, Х- и/или Y-образной формы или другой геометрической формы, такой как треугольная или прямоугольная, все из которых могут быть различного профиля и размеров; дизайн, профили и размеры таких вариантов осуществления описаны Сарвером и другими в патенте СШа №5868747, который приведен здесь для ссылки. Пластины могут быть предварительно сформированы с крепежными отверстиями или сконструированы для сверления и закрепления при использовании. Подобным образом биосовместимый полимер может быть использован в качестве мембраны, материала, сети и волокнистых форм различных размеров, геометрий и дизайна для любого не эмболического применения в теле. Не ограничивающие примеры медицинских устройств, которые могут содержать полимер формулы (I), включают устройство для восстановления сухожилия, связок, суставов, ушной раковины, носа и других хрящевых тканей, сосудистые и гемостатические блокирующие устройства, устройства восстановления кожи, наращивания и лечения ран, рубцов и тому подобное. Более того, варианты осуществления изобретения могут включать полимер формулы (I) для использования в косметических целях (например, наполнитель ткани для разглаживания морщин) и в качестве герметика, например, при применении на сосудах и зубах.
Медицинские устройства, которые содержат полимер формулы (I), могут включать один или более дополнительных компонентов. Не ограничивающие примеры таких дополнительных компонентов включают, например, дополнительное количество рентгеноконтрастных агентов, например, выбранных из группы, состоящей из иода, брома, бария, висмута, золота, платины, тантала, вольфрама и их смесей; агенты, улучшающие магнитный резонанс; и/или эффективное количество, по крайней мере, одного терапевтического агента (например, фармацевтический агент и/или биологический агент), достаточное для вызывания выбранного терапевтического эффекта (например, по крайней мере, одного агента для обработки инфекции (антибиотик, антимикробный и антивирусный), обеспечения местной анестезии, улучшения заживления раны и тому подобное) в зависимости от целевого применения. В предпочтительных вариантах, по крайней мере, часть терапевтического агента содержится в полимерном материале. В другом варианте осуществления изобретения, по крайней мере, часть терапевтического агента содержится в оболочке поверхности медицинского устройства.
Более того, полимеры, описанные здесь, могут также быть использованы для обработки опухолей любого органа и тканевой системы организма. Также имплантируемые, рентгеноконтрастные диски, пробки и другие устройства могут быть использованы в качестве «маркеров» для отслеживания обрабатываемых участков (например, в случае удаления опухоли). Рентгеноконтрастный по своей природе характер полимера вместе с биосовместимостью допускает его использование в качестве добавки к другим полимерным продуктам для наблюдения за их положением и возможно длительности посредством рентгеноконтрастности. Например, рентгеноконтрастный полимер мог бы быть использован в качестве маркерной ленты на катетере, оболочки на ведущем проводе, провода сердечного ритмоводителя или любого другого устройства, требующего рентгеноконтрастности. Рентгеноконтрастный полимер может быть смешан с не рентгеноконтрастным полимером, средствами, известными специалисту в уровне техники, для создания композитного полимерного имплантата с рентгеноконтрастностью.
Полимеры, описанные здесь, могут быть также использованы для наполнения телесного пространства или структуры, такой как поврежденная ткань или орган, центральная части ткани или органа, иссеченного при биопсии, которая может быть по размеру от маленькой до большой, участок, иссекаемый при опухоли ткани и для увеличения ткани и органов, такого как в косметических процедурах увеличения груди или мужского полового члена. Наполнение может быть выполнено, используя полимеры во многих вариантах, например, галогенированными гелями, пенами, частицами, волокнами, твердыми или полутвердыми (например, различной консистенции или, по крайней мере, частично или полностью пористые устройства, слоистые материалы и/или композиты). Рентгеноконтрастный по своей природе характер полимера вместе с биосовместимостью может быть, в частности, подходящим для обработки поврежденных, разрушенных или удаленных структур, которые могут быть созданы вводимым через инъекцию полимером или имплантируемым устройством; такой продукт может быть использован для восстановления соска груди или внешней ушной раковины как у пациентов с опухолью, так и в других случаях.
Рентгеноконтрастный по своей природе характер полимера вместе с биосовместимостью может быть в частности подходящим для ортопедических целей и для применения на позвоночнике. Эти варианты могут иметь различную форму, например твердую, полутвердую и/или нетвердую, без ограничений. Это позволяет твердым формам приобрести достаточную механическую силу для выдерживания давления от соседней мускулатуры и не сжиматься, тогда как более эластичные вариации могут быть идеальными для участков восстановления или движения мягкой ткани. Примеры галогенированных фасонных или предварительно сформованных устройств, гелей, суспензионных замазок и глины включают внутренние и внешние устройства фиксации костей, штифтов и винтов для костей, интерференционных винтов и фиксаторов, фиксирующие скобы для ран, гвоздики, шовный материал, мембраны и тому подобное; системы фиксации концов отломков кости пластинкой, устройства артродеза позвонков, замена кости, восстановление и замена протетической связки/сухожилия, и даже для усовершенствованного лечения, используя автоматизированный компьютерный дизайн для создания индивидуальных специфических устройств для восстановления, увеличения или иных действий, такие как черепно-лицевые пластины, имплантат подбородка, костный ограничитель и так далее. Другие примеры вариантов осуществления изобретения включают применение полимера в качестве вводимого через инъекцию вяжущего вещества, как для позвоночной пластики, где вводимое вещество просачивается через пустоты в кости и становится вкрапленным между порами трабекул, затвердевает, увеличивая таким образом костную плотность. Также полимер может быть использован в виде замазки или пасты, где полимер смешивают с деминерализованной костной мукой, желатином, другим биоматериалом или субстратом с или без терапевтического средства (например, по крайней мере, одного из следующих: фактор роста, костный морфогенетический протеин, гормон роста, костеобразующий пептид и тому подобное), который может являться полезным для замены кости, ее реконструкции и восстановления.
Как в деталях определено здесь, различные способы и техники могут быть использованы для создания или производства медицинских устройств в соответствии с вариантами осуществления настоящего изобретения. Они включают литьевое формование, лазерную обработку, лазерную резку, лазерную абляцию, высекание штампом, химическое травление, плазменное травление или другие методы, известные в уровне техники, с помощью которых возможно создавать компоненты, и если необходимо, осуществлять сборку полученных вырезанных частей в устройство. Описанные варианты могут быть собраны в устройства, используя различные техники быстрого макетирования (БМ), описанные в патентах США №5490962 и 6530958 В1 Хатмачером (Hutmacher) и другими (2004), которые приводятся здесь для ссылки во всей их целостности. Техники быстрого макетирования применительно к созданию полимерных устройств могут улучшить простую и сложную геометрию. Методы быстрого макетирования могут быть компьютеризированы и интегрированы с техниками отображения для получения устройств, которые являются индивидуальными по размеру и форме и выполняются на заказ по специфическим заявкам для отдельных пациентов. Такие устройства могут направлять клетки и ткани во время лечения. Они могут также улучшить одновременное добавление клеток во время каркасного конструирования с роботизированной сборкой и автоматизированные техники трехмерного клеточного инкапсулирования для развития конструктивно сложной ткани с полимерами, описанными здесь. Примеры техник быстрого макетирования, которые могут быть использованы, включают: 1) конструирование твердой произвольной формы (SFF) (на основе растворителя, без растворителя и на водной основе), которая строит части селективным добавлением материала, слой за слоем, как уточняет компьютерная программа. Каждый слой представляет форму поперечного сечения модели на специфичном уровне. Техники твердой произвольной формы предлагают уникальные способы для точного контроля матричной архитектуры (размер, форма, взаимосвязанность, разветвление, геометрия и ориентация) с получением биомиметической структуры, изменяющейся по дизайну и составу материала, таким образом, улучшая контроль над механическими свойствами, биологическими эффектами и деградационной динамикой каркаса. SFF также допускает включение терапевтических агентов. 2) Стереолитография (SLA) является селективной техникой лазерного спекания, которая использует СО2 лазерный луч для спекания тонких слоев порошков полимерных материалов с образованием твердых трехмерных объектов. 3) Технология трехмерного печатания (3DP) создает устройства слой за слоем, используя «струйную» печатающую головку и связующий раствор, наносимый на порошковый слой. 4) Изготовление осаждением формы (SDM) охватывает конструирование слоеного каркаса индивидуальной геометрии обработкой клинических данных отображения и их преобразование на желаемый слой каркаса отсекателем с компьютерным числовым программным управлением. 5) Системы на основе экструзионных технологий, такие как моделирование наплавкой (FDM), трехмерное вычерчивание струйного отвердевания (MJS) и получение точной экструзии (РЕМ), применяют экструзию материала в слоеной форме для построения каркаса. 6) Отверждение основы (SGC) для проектирования устройств с использованием технологии фотохимически проводимого гелеобразования биомакромолекул, которые являются химически модифицированными фотодимеризующимися группами. В этом последнем случае медицинское устройство может быть частично, а не полностью, саморассасывающимся, например, если содержит полимеры, описанные здесь, и один или более из следующих фотореакционных агентов: макромеры на основе полиэтиленгликоля, акриловые производные полиэтиленгликоля, включая полиэтиленгликоль-со-полигидроксикислоты диакрилат и полиэтиленгликоль-полилизин диакрилат, оба из которых содержат концевые акрилоильные группы.
Как в деталях описано здесь, различные способы и техники устройства доставки могут быть использованы для вариантов осуществления изобретения. В некоторых вариантах медицинские устройства, описанные здесь, являются не эмболическими устройствами, которые не включают эмболические устройства, описываемые в заявке на Патент США №10/952274, поданной 27 сентября 2004, опубликованной 19 мая 2005 как публикация патента США №2005/0106119 А1, которые приводятся здесь для ссылки во всей их целостности. Устройства могут иметь конфигурацию для доставки физическим хирургическим образом, катетером, инъекцией, вливанием, распылением и/или продавливанием, экструзией через один или множество каналов в полость тела млекопитающего. Также устройства могут изменять температуру (например, холодным компрессом, водяной баней, микроволнами, нагревательной пластиной, горячим обертыванием и использованием устройств, таких как описаны в патенте США №5263991, который приведен здесь для ссылки), они создаются и имеют определенный размер путем отливки на форму или оправку и обрабатываются для использования на участке тела. Подобным образом полимеры могут быть выполнены текучими для доставки в полость тела в случае неэмболических назначений. Устройства могут быть размещены прямо в или на ткани тела или органа, например, на подкожной или внутримышечной основе.
Ускорение или предотвращение клеточного врастания или селективной интеграции клеток и матриц в участки каркаса может быть осуществлено с помощью каркасного дизайна. Например, размер пор может регулировать, какие типы клеток будут расти в пористом каркасе. Имплантируемые устройства или каркасы могут иметь размер пор от нуля микрон (без пор) до микропор (например, 1 -200 микрон) и макропор (например, 200-1000 микрон), как мы определяем здесь для клеточного и тканевого врастания. Устройства также могут быть сконструированы с каналами пор 1-1000 микрон и каналами, которые являются бесконечно большими (поры макропористых каналов составляют 1000 микрон или больше) для клеточного и тканевого взаимодействия и восстановления. Также устройства могут иметь участки, которые являются полностью пористыми, частично пористыми или и то, и другое. Ванг (Whang) предлагает размер пор для врастания фибропласта между 20 и 125 микронами для регенерации взрослой ткани млекопитающих и 100-250 микрон - для регенерации кости (Whang и другие, 1995). Гладкие поверхности по сравнению с шероховатыми поверхностями известны как осуществляющие клеточный метаболизм (Salthouse и Matlaga). Также клеточное прилипание, выравнивание, топографическое управление, миграция, присоединение и пролиферация, получение матриц может быть изменено с помощью пористой структуры, шероховатости поверхности и структуры (например, гребни, спирали, геодезические модели, сферы, желобки, выпуклости и впадины (von Recum и другие, 1996; Curtis and Clark, 1990). Дополнительно высвобождение терапевтического средства, такого как протеин, может контролироваться уникальной микроархитектурой (Whang et al., 1996). В основном, чем больше размер пор, например от 30 и более микрон в диаметре, тем больше вероятность того, что иммунные клетки могут пропускать инородные структуры и капилляры могут образовываться.
Такие устройства полимеров, описанные здесь, могут иметь поры, каналы или отверстия, достаточные по размеру и распределению для допущения и оптимизации пролиферации сосудистой и соединительной клеточной ткани, производных от соседних твердых и мягких тканей, для проникновения через и в основном к месту повреждения для того, чтобы залечить этот участок. Такие устройства могут быть образованы химическим образом и адаптированы для саморассасывания в теле в течение периода приблизительно 2 или более месяцев с момента первоначального имплантирования.
Дополнительно полимеры, описанные здесь, могут быть использованы in vitro для развития тканевых конструктивно сложных имплантатов или для применения при прямой имплантации участка тела в качестве носителя или канала для доставки клеток (например, инкапсулированные островковые клетки и/или суспензионные клетки), другие материалы (например, терапевтические средства, биологические средства) и/или ткани.
Более того, полимеры, описанные здесь, могут быть также использованы для мягких тканей. Некоторые примеры включают антиадгезионные барьеры для эпикардиальной, абдоминальной и тазовой адгезии. В других вариантах осуществления изобретения полимеры, описанные здесь, могут быть использованы в качестве имплантируемой сетки или субстрата для восстановления мягких органов (например, кишечник, печень, кожа) и для актуальных уплотнителей, применяемых к любому устройству, используемому для имплантата и вводимому в любой надрез, или каутеризации.
Более того, полимеры, описанные здесь, могут быть также использованы in vitro, например, для получения и инженерии клеток и тканей для трансплантации, in vitro исследований клеточных культур для криоконсервирования, иммуномодуляции, иммуноизоляции, исследования клеток (зрелые, дифференцированные, эмбриональные, плюрипотентные стволовые клетки), генной терапии, морфогенеза, для использования в биореакторах, исследованиях кинетики, транспорта и механики клеток, ткани, органов и высококонструктивных устройств, исследований клеточных взаимодействий с полимерами и каркасами и исследования саморассасывания полимеров. Дополнительно полимеры, описанные здесь, могут быть использованы in vitro для диагностического тестирования. В качестве не ограничивающего примера, полимер может быть использован в качестве несущей поверхности для активных тестовых агентов (например, терапевтических агентов, клеток и других биологических средств).
В свете описания, приведенного здесь, специалист в данной области будет способен легко создать множество различных медицинских устройств, которые содержат один или более полимеров, описанных здесь (например, полимер, содержащий повторяющееся звено формулы (I)). После полимеризации соответствующая обработка полимеров в соответствии с предпочтительными вариантами осуществления изобретения может быть достигнута одним из множества известных методов для получения различных стентов или других медицинских устройств, подходящих для различных целей. Например, в некоторых предпочтительных вариантах осуществления изобретения представленным полимерам придают форму стентов через способы, включающие экструзию, компрессионное формование, литьевое формование, литье с растворителем, центробежное литье, комбинации двух или более способов и тому подобное. Также стенты могут содержать, по крайней мере, один волоконный материал, отверждающий материал, пластинчатый материал и/или сотканный материал. Такие процессы могут также включать двухмерные способы изготовления, такие как резка экструдированных листов полимера, возможна лазерная, механическая резка или другие методы и сборка полученных отрезанных частей в стенты или подобные способы трехмерного изготовления устройств из твердых форм. В некоторых других вариантах осуществления полимеры вводятся в оболочки на поверхность имплантируемых стентов, в частности стента, выполненного или из полимера по настоящему изобретению или другого материала, такого как металл. Такие оболочки могут быть созданы на стентах через способы, такие как окунание, распыление, их комбинации и тому подобное.
Стент, изготовленный в соответствии с предпочтительными аспектами по настоящему изобретению, может быть любой конструкции (например, шарнирные стенты, листовые стенты (иногда именуемые как стенты «рулет с желе»), деформируемые стенты, саморасширяющиеся стенты), подходящей для данного применения. Предпочтительно стенты по настоящему изобретению предназначены для несложной имплантации в артерию или ткань животного, такого как человек, и являются расширяющими и/или поддерживающими артерию открытой, после указанная артерия открывается через медицинскую процедуру, такую как ангиопластика. Примерами подходящих стентов для использования в настоящем изобретении являются «шарнирные» стенты, включая описанные в патентах США №6033436; 6224626 и 6623521, и находящейся в процессе рассмотрения заявке на патент США №11/016269, поданной 17 декабря 2004, все из которых приведены здесь для ссылки во всей их целостности. Другие подходящие конструкции для использования здесь включают используемые традиционно металлические и полимерные стенты, включая различные сетки, свертки, листы, зигзаги и катушки, например деформируемые стенты Palmaz, такие как в патенте США №4733665 и его преемников, которые имеют регулируемое расширение и часть протеза, которая деформируется с силой при избытке предела упругости. Другие конструкции стента включают следующие устройства и их преемники: патент США №5344426, автор Lau, патент США №5549662 и 5733328, автор Fordenbacher, патент США №5735872 и 5876419, автор Carpenter, патент США №5741293, автор Wijay, патент США №5984963, автор Ryan, патент США №5441515 и 5618299, автор Khosravi, патент США №5059211; 5306286 и 5527337, автор Stack, патент США №5443500, автор Sigwart, патент США №5449382, автор Dayton, патент США №6409752, автор Boatman и подобные.
Полимеры, описанные здесь, также являются полезными при изготовлении широкого спектра терапевтических устройств доставки. Такие устройства могут быть приспособлены для использования множества терапевтических средств, например фармацевтических средств (то есть лекарств) и/или биологических агентов, предварительно определенных и включающих биомолекулы, генетический материал, обработанный биологический материал и тому подобное. Любое число транспортных систем, способных доставить терапевтические средства к телу, могут быть выполнены, включая устройства для терапевтической доставки при лечении рака, внутрисосудистых проблем, дентальных проблем, ожирения, инфекции, контроля репродукции и тому подобное. В некоторых вариантах осуществления изобретения любое из вышеописанных устройств может быть приспособлено для использования в качестве устройства для терапевтической доставки (дополнительно к любому другому функциональному назначению). Регулируемые терапевтические системы доставки могут быть изготовлены, где биологически или фармацевтически активные и/или пассивные агенты вкраплены или распределены физически в полимерной матрице или физически смешаны с поликарбонатом или полиакрилатом по настоящему изобретению. Регулируемые терапевтические системы доставки могут быть также изготовлены прямым применением терапевтических средств на поверхности саморассасывающихся стентовых устройств (состоящих, по крайней мере, из одного из представленных полимеров) без использования этих полимеров в качестве оболочки, или использованием других полимеров или веществ для оболочки.
Одним главным преимуществом использования рентгеноконтрастных, саморассасывающихся полимеров, описанных здесь, при применении устройств терапевтической доставки является избавление от наблюдения за высвобождением терапевтического средства и наличие имплантируемой терапевтической системы доставки. Поскольку рентгеноконтрастность полимерной матрицы объясняется ковалентно присоединенными галогеновыми заместителями, уровень рентгеноконтрастности напрямую связан с остаточным количеством разрушающейся терапевтической матрицы доставки, все еще присутствующей на участке имплантата в любое данное время после имплантации. В предпочтительных вариантах осуществления изобретения скорость высвобождения терапевтического средства из разрушающейся системы доставки будет коррелировать со скоростью всасывания полимера. В таких предпочтительных вариантах осуществления изобретения прямое измерение оставшейся степени рентгеноконтрастности обеспечит наблюдающего специалиста способом наблюдения за уровнем терапевтического высвобождения из имплантируемой системы доставки.
Поверхность стента покрывают, используя полимеры, имеющие функциональные свойства, которые поддерживают биологический ответ. Дополнительно к стентам, которые могут доставлять терапевтический агент, например, при доставке биологического полимера на стенте, такого как репеллантный фосфорилхолин, стент может быть покрыт другим саморассасывающимся полимером, предопределенным для улучшения биологического ответа в просвете сосуда, желательным для некоторой клинической эффективности. Оболочка может быть выбрана из широкого класса любого биосовместимого саморассасывающегося полимера, который может включать один любой или комбинацию галогенированных или негалогенированных тирозин-производных поликарбонатов, тирозин-производных полиакрилатов, поли(эфирамидов), поли(амидокарбонатов), триметиленкарбонатов, поликапролактонов, полидиоксанов, полигидроксибутиратов, полигидроксивалератов, полигликолидов, полилактидов, их стереоизомеров и сополимеров, таких как гликолид/лактид сополимеры. В предпочтительных вариантах осуществления изобретения стент покрывают полимером, несущим отрицательный заряд, который отталкивает отрицательно заряженные внешние мембраны эритроцитов и таким образом снижает риск образования сгустков. В другом предпочтительном варианте осуществления изобретения стент покрывают полимером, который проявляет сродство для клеток (например, эндотелиальные клетки) для улучшения заживления. В еще другом предпочтительном варианте осуществления изобретения стент покрывают полимером, препятствующим присоединению и/или пролиферации специфических клеток, например артериальных фибропластов и/или гладких мышечных клеток, для того, чтобы снизить рестеноз и/или воспаление клеток, таких как макрофаги.
Описанные выше стенты являются рентгеноконтрастными саморассасывающимися полимерными стентами по настоящему изобретению, которые могут быть модифицированы с помощью покрытия для достижения функциональных свойств, которые поддерживают биологический ответ. Подобным образом, другие вышеупомянутые медицинские устройства и/или компоненты устройств рентгеноконтрастных по своей природе саморассасывающихся полимеров могут быть также модифицированы с помощью покрытия, как указано выше, для достижения функциональных свойств, которые поддерживают биологический ответ.
Конструкция стента.
Предпочтительные варианты осуществления изобретения, описанного здесь, относят в основном к расширяющимся медицинским имплантатам для поддержания просвета полости тела. За последние годы большое число различных стентов было предложено. Хотя структура стентов может значительно меняться, фактически все стенты приспособлены для расширения из сжатого состояния, имеющего маленький диаметр, до расширенного состояния, имеющего большой диаметр. Находясь в сжатом состоянии, стент обычно доставляют через катетер по кровеносному сосуду или другой полости тела до залечиваемого участка. После того как стент достигнет участка, стент радиально расширяется до имплантируемого размера для поддержания стенок сосуда. Расширение стента из сжатого состояния до расширенного состояния может быть достигнуто множеством различных способов. Различные типы стентов описаны ниже, исходя из их конфигурации и средств расширения. Для дополнительной информации различные типы стентов описаны у Balcon и других, «Recommendations on Stent Manufacture, Implantation and Utilization» («Рекомендации по Производству Стентов, Имплантация и Использование»), European Heart Journal (1997), том 18, страницы 1536-1547 и Phillips и другие, «The Stenter's Notebook» («Записная Книжка Стентера»), Physician's Press (1998), Birmingham, Michigan; описание которых приводится здесь для ссылки во всей их целостности.
Баллонные расширяемые стенты изготавливаются в сжатом состоянии и расширяются до желаемого диаметра с помощью баллона. При доставке баллонный расширяемый стент обычно устанавливается по внешней стороне раздуваемого баллона, расположенного вдоль отдаленного конца катетера. После достижения излечиваемого участка стент расширяется от сжатого до расширенного состояния путем раздувания баллона. Стент обычно расширяется до диаметра, который больше или равен внутреннему диаметру полости тела. Стент может быть удерживаться в расширенном состоянии путем механической деформации стента, как раскрывается, например, в патенте США №4733665, автор Palmaz. Альтернативно, баллонные расширяемые стенты могут поддерживаться в расширенном состоянии путем удерживания стенок стента в соответствии с одним из изобретений, описанных, например, в патентах США №4740207, автор Kreamer, 4877030, автор Beck и другие, и 5007926, автор Derbyshire. Также еще стент может быть поддержан в расширенном состоянии с помощью одностороннего удерживания стенок стента вместе с эндотелиальным ростом, как показано в патенте США №5059211, автор Stack и другие.
Термин «радиальная сила», как используется здесь, описывает внешнее давление, которому стент способен противостоять без нанесения клинически значительных повреждений. Вследствие их высокой радиальной силы баллонные расширяемые стенты в основном используются в коронарных артериях для гарантирования раскрытого состояния сосуда. Во время развертывания в полости тела раздувание баллона может быть отрегулировано для расширения стента до конкретного желательного диаметра. Соответствующим образом, стенты могут быть использованы там, где точное местоположение и размеры очень важны. Баллонные расширяемые стенты могут также использоваться для прямого стентирования, где предварительное расширение сосуда перед развертыванием стента отсутствует. Предпочтительнее, во время прямого стентирования, расширение раздуваемого баллона расширяет сосуд и одновременно расширяет стент.
Одним из первым саморасширяющихся стентов, используемых клинически, является плетеный «WallStent», как описано в патенте США №4954126, автор Wallsten. В основном WallStent содержит металлическую сетку в форме Китайского манжета для пальца. Манжет обеспечивает плетеный стент, который не является суперэластичным, но технически все еще относится к группе саморасширяющихся стентов. Другим примером саморасширяющихся стентов является стент, описанный в патенте США №5192307, автор Wall, где протез, подобный стенту, образуется из полимерного или листового металла, который является расширяемым или сжимающимся при замене. Стент может быть свободным в открытом положении и запираемым в закрытом положении или, альтернативно, может быть свободным в закрытом положении и запираемым в открытом положении. В рассмотренном случае для удержания стента в сжатом состоянии может быть использован стержень. Стержень удаляют, и стент переходит в расширенную форму. Для запирания стента на его стенке предусматривают один или более крючков. Крючки цепляются за дополнительные выемки, создаваемые на противоположной стенке, для механического соединения свернутого листа, образующего стент.
Стенты, расширяющиеся при нагревании, подобны по своей природе саморасширяющимся стентам. Однако в этом типе стентов для расширения конструкции стента необходимо воздействие тепла. Стенты этого типа могут быть образованы из сплава с памятью формы, такого как Нитинол. Другие типы расширяющихся при нагревании стентов могут быть образованы из проволоки, покрытой оловом, расширяющейся при нагревании. Расширяющиеся при нагревании стенты могут быть доставлены к пораженному участку на катетере, способном принимать горячую текучую среду. Горячий солевой раствор или другая жидкость может проходить через часть катетера, на котором стент размещают, таким образом передавая тепло стенту и вызывая его расширение.
Желательно, чтобы стент был баллонным расширяемым для обеспечения точного размещения и размеров на обрабатываемом участке. Также желательно, чтобы такой стент имел достаточную радиальную силу для поддержания полости в раскрытом состоянии, одновременно подвергаясь воздействию значительной внешней силы. Также желательно, чтобы стент имел конфигурацию, демонстрирующую небольшое или не продольное сокращение при радиальном расширении. Также желательно, чтобы такой стент был достаточно гибким по продольной оси для соответствия искривленной форме полости тела. Также желательно, чтобы такой стент был способен соответствовать внутренней форме полости тела.
Несмотря на то, что различные конфигурации стента, включая без ограничений листовые стенты, плетеные стенты, саморасширяющиеся стенты, проволочные стенты, деформируемые стенты и шарнирные стенты, известны в уровне техники, понятно, что данное описание является только иллюстративным и не должно быть построено каким-либо образом ограничивающим данное изобретение. На самом деле, саморассасывающиеся, рентгеноконтрастные по своей природе полимеры, описанные здесь, могут быть применимы для множества других конструкций стентов, которые известны в уровне техники. Более того, различные применения настоящего изобретения и его модификаций, которые встретятся специалистам в данной области, также охватываются общими концепциями, описанными здесь.
Некоторые предпочтительные варианты осуществления настоящего изобретения относятся к расширяющимся шарнирным стентам, имеющим множество модулей. Модули имеют множество скользящих и запирающих элементов, допускающих скольжение радиальных элементов из сжатого состояния до расширенного/развернутого состояния, но предотвращающих радиальную отдачу от расширенного состояния. Один из положительных эффектов заключается в том, что для изготовления по специальным требованиям элементы конструкции стента из модулей и фиксаторов (замков) могут менять функциональные характеристики силы, упругости, радиуса кривизны в развернутом состоянии и степени растяжения. В некоторых предпочтительных вариантах осуществления изобретения стент содержит полимер, описанный в формуле I, такой, что стент содержит рентгеноконтрастный, саморассасывающийся материал, который способен исчезать через некоторое время. В некоторых вариантах осуществления изобретения стент служит в качестве терапевтической платформы доставки.
Некоторые варианты осуществления изобретения относятся к радиально расширяющимся стентам, используемым для того, чтобы открывать или расширять целевой участок в полости тела. В некоторых вариантах осуществления собранный стент содержит трубчатый элемент, имеющий длину по продольной оси и диаметр по радиальной оси соответствующего размера для введения в полость тела. Длина и диаметр трубчатого элемента могут значительно изменяться при развертывании в различных выбранных целевых полостях в зависимости от числа и конфигурации структурных компонентов, описанных ниже. Трубчатый элемент регулируют, по крайней мере, от первого сжатого состояния до второго расширенного состояния. Один или более ограничителей и зацепляющихся элементов или петлей являются встроенными в структурные компоненты трубчатого элемента, благодаря чему отдача (то есть сжатие из расширенного состояния до более сжатого диаметра) минимизируется до менее чем 5%.
Трубчатый элемент в соответствии с некоторыми вариантами осуществления изобретения имеет «четкий сквозной просвет», который определяется отсутствием структурных элементов, выступающих в полость или в сжатом или развернутом состоянии. Также трубчатый элемент имеет гладкие краевые кромки для минимизации травм от краевых эффектов. Трубчатый элемент является предпочтительно тонкостенным (толщина стенки зависит от выбранного материала, изменяющегося приблизительно от менее чем 635 до менее чем 100 микрометров) и гибким (например, приблизительно менее чем 0,01 силы Ньютона/миллиметр упругой деформации) для облегчения доставки к маленьким сосудам и через извилистую сосудистую сеть. Тонкостенная конструкция также минимизирует турбулентность крови и таким образом риск тромбоза. Тонкая стенка развернутого трубчатого элемента в соответствии с некоторыми вариантами осуществления изобретения также облегчает более быструю эндотелиализацию стента.
Стенка трубчатого элемента может содержать, по крайней мере, один модуль, который содержит ряд скользящих и запирающихся радиальных элементов.
Предпочтительно множество модулей связаны по продольной оси через соединительные элементы, которые соединяют, по крайней мере, некоторые из радиальных элементов между соседними модулями. Радиальные элементы предпочтительно имеют конфигурацию, в которой каждый модуль является таким, как это определяет окружность трубчатого элемента. Каждый радиальный элемент в модуле является предпочтительно структурно дискретным, унитарной единицей, которая физически отделена от других радиальных элементов в модуле и содержит одно или более круговых ребер, согнутых по радиальной оси с образованием части общей окружности трубчатого элемента. По крайней мере, одно из этих ребер в каждом радиальном элементе имеет один или более ограничителей по длине ребра. По крайней мере, некоторые из радиальных элементов также имеют, по крайней мере, один шарнирно-сочлененный механизм для подвижно соединенного ребра (ребер) от соседних, радиальных элементов, смещенных по окружности. В одном аспекте настоящего изобретения шарнирно-сочлененный механизм содержит петли для зацепления ограничителей, расположенных вдоль соединенных скользящим образом соседних ребер. Шарнирно-сочлененный механизм между петлей одного радиального элемента и ограничителем соседнего радиального элемента является таким, что запирающийся, или храповой, механизм образуется, благодаря чему соседние радиальные элементы могут скользить по окружности отдельно один от другого, но в основном предотвращают скольжение по окружности навстречу один к другому. Соответствующим образом, трубчатый элемент может быть радиально расширенным от более маленького диаметра до более большого диаметра, но отдача от маленького диаметра предпочтительно сводится к минимуму с помощью запирающего механизма.
Другие предпочтительные варианты осуществления шарнирных стентов включают, но не ограничиваются, неподвижными шарнирными стентами с радиальными элементами, следующими по определенному геометрическому пути, имеющему как радиальное, так и осевое перемещение; шарнирные стенты с продольными модулями, содержащими как активные (шарнирные), так и пассивные радиальные элементы, где радиальные элементы имеют различные характеристики, включая, но не ограничиваясь, пружинные элементы, механизм управления слабого развертывания и устройство фиксаторов безопасности сверхразвертывания; шарнирный стент с несимметричной геометрией механизма блокировки для улучшения разрешения при задании размеров; движущийся шарнирный стент с положительной отдачей механизма блокировки; подвижный шарнирный стент с активной системой блокировки; деформируемый шарнирный стент, который обеспечивает дополнительное устройство радиального расширения и/или увеличивает безопасность устройства; шарнирный стент с двумя боковыми блокировочными характеристиками; обжимной шарнирный стент для улучшения способности удерживаться в баллоне доставки и шарнирный стент с оптимизированной конструкцией сжатого элемента или стенки для снижения турбулентности и создания в основном ламинарного течения потока крови. Также варианты осуществления включают шарнирный стент с участком с большой площадью поверхности для поддержки; шарнирный стент с участком с входным каналом бокового ответвления сосуда и шарнирный стент с трансплантируемым покрытием. Также варианты осуществления содержат шарнирные стенты, выполненные из слоистого материала и/или пространственно-локализованного материала.
Ссылаясь на чертеж, часть предпочтительного варианта осуществления стента 320 проиллюстрирована, где радиальные элементы 320(1), 320(2) являются подвижно соединенными. Каждый радиальный элемент снабжен рельсом 328, имеющим множество отклоняющихся зубчиков 326. Каждый из зубчиков является угловым направленным вверх и имеет конфигурацию для отклонения вниз (то есть в радиальном направлении). Поскольку запирающие петли 322, 324 скользят вдоль отклоняющихся зубчиков 326, это вызывает отклонение зубчиков вниз для того, чтобы петли 322, 324 проходили через зубчики 326 при развертывании. Однако вследствие наличия угла у зубчиков запирающиеся петли могут двигаться только в одном направлении. В частности, если сила сжатия толкает радиальные элементы 320(1), 320(2) назад к сжатому состоянию, запирающиеся петли 322, 324 будут упираться в зубчики 326, таким образом предотвращая дальнейшее относительное движение.
Некоторые аспекты дополнительных вариантов осуществления стентов описаны в патентах США №6033436, 6224626 и 6623521 и одновременно находящихся на рассмотрении заявок на патент США №10/897235, поданной 21 июля 2004 и 11/016269, поданной 17 декабря 2004; все из которых приведены здесь для ссылки во всей их целостности.
Хотя стент, создаваемый из единого целого элемента, описывается выше как имеющий конкретные механические характеристики для удержания стента в расширенном состоянии, множество других «шарнирных» механизмов может быть использовано. Например, другие подходящие запирающие механизмы могут быть обнаружены в патенте США №5344426, автор Lau, патентах США №5735872 и 5876419, автор Carpenter, патенте США №5741293, автор Wijay, патенте США №5984963, автор Ryan, патентах США №5441515 и 5618299, автор Khosravi, патенте США №5306286, автор Stack, патенте США №5443500, автор Sigwart, патенте США №5449382, автор Dayton, патенте США №6409752, автор Boatman, и тому подобное. Каждая из этих ссылок приведена здесь для ссылки во всей ее целостности.
Дополнительно многие из шарнирных механизмов, описанных в вышеупомянутых патентах, могут быть подходящими для использования в стентах по изобретению, содержащих подвижно соединенные элементы этого типа, описанного выше.
Стенты, которые доставляют терапевтические агенты.
Терапевтические агенты могут быть введены в саморассасывающиеся стенты и/или покрывать, по крайней мере, один участок на поверхности стента, таким образом обеспечивая локальное высвобождение таких агентов. В предпочтительных вариантах осуществления терапевтический агент содержится в стенте, поскольку агент сочетается с полимером или примешивается с помощью других средств, известных в уровне техники. В других предпочтительных вариантах осуществления стента терапевтический агент доставляется из полимерного покрытия на поверхности стента. В еще другом предпочтительном варианте терапевтический агент доставляется с помощью не полимерного покрытия. В других предпочтительных вариантах осуществления стента терапевтический агент доставляется, по крайней мере, от одного участка или одной поверхности стента.
Предпочтительный терапевтический агент (агенты) контролирует рестеноз (включая неоинтимальное утолщение, интимальную гиперплазию, внутристентовый рестеноз или ограничивает разрастание клеток гладкомышечной ткани сосудов) в просвете стентированного сосуда. Сосудистое применение стентов и применение в других полостях тела может требовать использования различных терапевтических средств или более одного терапевтического средства.
Множество соединений рассматриваются для использования при управлении сосудистым рестенозом и внутристентовым рестенозом. Некоторые из предпочтительных агентов, которые улучшают открытый просвет сосуда, включают, без ограничений, паклитаксель, Рапамицин, АВТ-578, эверолимус, дексаметазон, модулирующие оксид азота молекулы для эндотелиальной функции, такролимус, эстрадиол, микофенольную кислоту, С6-керамид, актиномицин-D и эпотилоны и их производные и аналоги.
Предпочтительные терапевтические агенты могут также ограничивать или ингибировать тромбоз или затрагивать некоторые другие состояния стентированной ткани, например лечение уязвимых бляшек, ингибирование разрыва бляшек, стимулирование эндотелиализации или ограничение других типов клеток от пролиферации и от производства и отложения внеклеточных матричных молекул. Агент (агенты) могут быть выбраны из группы, состоящей из, без ограничения: антипролиферативные агенты, противовоспалительные агенты, ингибиторы матричных металлопротеиназ, агенты, снижающие содержание липидов, антитромботические и антитромбоцитарные агенты в соответствии с предпочтительными вариантами осуществления настоящего изобретения.
В предпочтительном варианте осуществления стента устройство доставляет терапевтический агент (агенты) для лечения уязвимых атеросклеротических повреждений ткани, такие как противовоспалительные, терапевтические средства, снижающие содержание липидов/изменение матрикса, и/или антипролиферативные средства. Противовоспалительные средства могут включать аспирин, эффективный нейтрализатор воспаления, лозартан, блокатор ангиотензинового рецептора или правастатин, ингибитор 3-Гидрокси-3-Метил-Глутарил Коэнзима А (ГМГ-КоА) редуктазы. Также доставка статинов, таких как правастатин и флювастатин, которые являются ингибиторами 3-ГМГ-КоА-редуктазы, могут вызывать интерстициальную коллагеновую экспрессию генов и снижение экспрессии матричных металлопротеиназ (ММР-1, ММР-3 и ММР-9) для эффективной стабилизации уязвимых атеросклеротических повреждений ткани. Локальная доставка агентов, снижающих содержание липидов, например Правастатина, может также улучшать стабильность бляшек.
В предпочтительных вариантах осуществления стента устройство доставляет антитромбоцитарный агент, который действует с помощью ингибирования гликопротеинового IIb/IIIa рецептора или другими средствами, таким как, но без ограничений, аспирин, Плавикс (клопидогреля бисульфат), тиклопидин, интегрелин и дипиридамол. В другом предпочтительном варианте осуществления стента устройство доставляет антитромбиновый агент, который действует с помощью ингибирования тромбина или других средств, такие как гепарин, низкомолекулярный по весу гепарин (НМВГ), полиамин, к которому сульфат декстрана и гепарин ковалентно присоединяются, гепаринсодержащее полимерное покрытие для вживленных имплантатов (MEDI-COAT от STS Biopolymers), полиуретан мочевина/гепарин, R-Гирудин, Гирулог, гирудин/простациклин и аналоги, аргатробан, эфегатран и клещевой противосвертывающий пептид. Дополнительные анти-тромбообразующие вещества и формы могут включать, без ограничения, эндотелийпроизводный расслабляющий фактор, простагландин I.sub.2, ингибитор активатора плазминогена, активатор плазминогена тканевого типа (tPA), РЕОПРО: антитромбоцитарный гликопротеин IIb/IIIa интегринового рецептора, фибрин и фибриновый пептид А, лекарственный средства, снижающие уровень липидов, например Омега-3 жирные кислоты, и Chrysalin (также известный как TRAP-508) от Chrysalis Vascular Technologies (Крисалис Васкулар Текнолоджи).
Различные соединения реагируют на другие патологические события и/или сосудистые заболевания. Некоторые из этих терапевтических целевых соединений являются агентами для лечения эндотелиального повреждения (например, сосудистые эндотелиальные факторы роста VEGF; фактор роста фибробластов FGF), агентами для регулирования клеточной активации и фенотипа (например, MEF-2 & Gax модуляторы; NFBCB антагонисты; ингибиторы клеточного цикла), агентами для дисрегулирования клеточного роста (например, E2F ловушки; RB мутанты; ингибиторы клеточного цикла), агентами для дирегулированного апоптоза (например, Вах или СРР32 индукторы; Вс1-2 ингибиторы; интегриновые антагонисты) и агентами для аномальной клеточной миграции (например, интегриновые антагонисты; блокаторы PDGF (тромбоцитпроизводный фактор роста); ингибиторы активатора плазминогена).
Терапевтические агенты для покрытия или введения в стентовый полимер в соответствии с вариантами осуществления изобретения могут быть классифицированы, исходя из участков их воздействия на реципиента. Считают, что следующие агенты оказывают воздействие внеклеточным образом или на участках специфических мембранных рецепторов. Они включают кортикоиды и другие ионно-обменные блокаторы каналов, факторы роста, антитела, блокаторы рецепторов, токсины слияния, внеклеточные матричные протеины, пептиды или другие биомолекулы (например, гормоны, липиды, матричные металлопротеиназы и тому подобное), излучение, противовоспалительные агенты, включающие цитокины, такие как интерлейкин-1 (ИЛ-1), и альфа фактор некроза опухоли (ФНО-α), гамма интерферон (интерферон-γ), и Траниласт, который модулирует противовоспалительный ответ.
Другая группа агентов оказывает свое воздействие на плазматическую мембрану. Они включают агенты, охватываемые в каскаде сигнальной трансдукции, такие как соединительные протеины, связанные с мембраной, и цитоплазматические протеин киназы и эффекторы, тирозин киназы, рецепторы фактора роста и адгезионные молекулы (селектины и интегрины).
Некоторые соединения являются активными в цитоплазме, включая, например, гепарин, рибозимы, цитоксины, антисмысловые олигонуклеотиды и векторы экспрессии. Другие терапевтические подходы направлены на ядро. Они включают генную интеграцию, прото-онкогенез, в частности важные агенты для клеточного деления, протеины ядра, гены клеточного цикла и факторы транскрипции.
Другие терапевтические соединения, которые могут быть полезными в качестве покрытия стентов, и/или составы, введенные в саморассасывающиеся стенты, включают:
антитела, например, антитела ICAM-1 для ингибирования моноцитного хемотаксического рекрутмента и адгезии, адгезии макрофагов и связанных событий (Yasukawa и другие, 1996, Circulation); терапии, на основе токсинов, таких как химерные токсины или индивидуальные токсины для управления пролиферацией гладкомышечных клеток (Epstein и другие, 1991, Circulation); bFGF-сапорин для селективной блокировки пролиферации гладкомышечных клеток среди этих клеток с большим числом FGF-2 рецепторов (Chen и другие, 1995, Circulation), сурамин ингибирует миграцию и пролиферацию блокированием PDGF-индуцированной и/или митоген активированной протеин киназы (МАРК-АР-1) индуцированной передачи сигнала (Hu и другие. Circulation, 1999); Берапрост Натрия, химически стабильный постациклиновый аналог (PGI2), подавляет интимальное утолщение и сужение просвета коронарных артерий (Kurisu и другие, Hiroshima J. Med Sci, 1997); Верапамил ингибирует неоинтимальную пролиферацию клеток гладкомышечной ткани сосудов (Brauner и другие, J. Thorac Cardiovasc Surg 1997), агенты, которые блокируют CD 154 или CD40 рецептор, могут ограничивать развитие атеросклероза (Е.Lutgens и другие, Nature Medicine, 1999), агенты, которые контролируют отклик от элементов отдачи касательного напряжения или механического стресса или деформируемых элементов или генов белка температурного шока; и антихемоаттрактанты для гладкомышечных и противовоспалительных клеток.
В дополнение или в качестве альтернативы, клетки могут быть инкапсулированы в саморассасывающиеся микросферы или смешаны напрямую с полимером или гидрогелем. Живые клетки могут быть использованы для непрерывной доставки молекул, например цитокинов и факторов роста. Клетки любого происхождения могут быть использованы в соответствии с этим аспектом настоящего изобретения. Также неживые клетки могут быть использованы и законсервированы, или дегидратированные клетки, которые сохраняют свое назначение при их повторной гидратации, могут быть использованы. Природные, химически модифицированные (обработанные) и/или клетки генной инженерии могут быть использованы.
Терапевтические агенты могут быть полярными или обладать чистым отрицательным или положительным или нейтральным зарядом; они могут быть гидрофобными, гидрофильными или цвиттер-ионными или иметь большое сродство к воде. Высвобождение может происходить с помощью управляемых механизмов высвобождения, диффузии, взаимодействия с другим агентом (агентами), доставляемыми внутривенной инъекцией, аэрозолизацией или перорально. Высвобождение также может происходить под воздействием магнитного поля, электрического поля или при использовании ультразвука.
В другом аспекте изобретения стент может также содержать в себе или доставлять гидрогель или другой материал, такой как фосфорилхолин (PC), который предотвращает адгезию клеток крови, протеинов крови или молекул крови, внеклеточного матрикса или других типов клеток. Гидрогель может доставлять терапевтический агент.
При использовании синтетических, натуральных (растительного, микробного, вирусного или животного происхождения) и рекомбинантных агентов, имеющих выбранные функции или химические свойства, они могут быть смешаны с дополнительными веществами (например, антитромботические и антирестенозные вещества; нуклеиновые кислоты и липидные комплексы). Фармакологические агенты могут также содержать витамины и минералы. Например, агенты, функция которых напрямую или не напрямую через взаимодействия или механизмы охватывает аминокислоты, нуклеиновые кислоты (ДНК, РНК), протеины или пептиды (например, RGD пептиды (пептиды, содержащие аргинин-глицин-аспартамовую кислоту)), фрагменты углеводов, полисахариды, липосомы или другие клеточные компоненты или органеллы, например рецепторы и лиганды.
Генетические подходы для управления рестенозом включают без ограничения: использование антисмысловых олигонуклеотидов для PDGFR-ββ мРНК для управления экспрессией PDGF; использование антисмысловых олигонуклеотидов для нуклеиновых антигенов c-myb или с-myc онкогенов (Bauters и другие, 1997, Trends CV Med); применение антисмысловых фосфоротиоат олигодеоксинуклеотидов против cdk 2 киназы (циклин зависимой киназы) для управления клеточным циклом клеток гладкомышечной ткани сосудов (Morishita и другие, 1993, Hypertension); применение гена VEGF (или самого VEGF) для стимуляции восстановительного лечения ран, такого как эндотелиализация и снижение роста неоинтимы (Asahara и другие, 1995); доставка гена синтетазы оксида азота (eNOS) для снижения пролиферации клеток гладкомышечной ткани сосудов (Von Der Leyen и другие, 1995, Proc Nati Acad Sci); применение аденовируса, экспрессирующего ингибитор-1 активатора плазминогена (PAI-I) для снижения миграции клеток гладкомышечной ткани сосудов и таким образом снижения рестеноза (Carmeliet и другие, 1997, Circulation); стимуляция повышенной экспрессии аполипопротеина A-I (ApoAl) для установления равновесия уровня липопротеинов низкой плотности и высокой плотности в сыворотке; использование апоптоза генных продуктов для ускорения некроза клеток (например, клеток гладкомышечной ткани) и цитотактических генных продуктов для регуляции деления клеток (протеин, подавляющий новообразование р53 и Gax гомеобокс генный продукт для подавления ras; р21 избыточной экспрессии); и ингибирование NF-κВ активации (например, р65) для управления пролиферацией клеток гладкомышечной ткани (Autieri и другие, 1994, Biochem Biophys Res Commun).
Выше описаны ретгеноконтрастные по своей природе саморассасывающиеся полимерные стенты по настоящему изобретению, которые доставляют терапевтический агент. Подобным образом, другие вышеупомянутые медицинские устройства и/или компоненты устройства из рентгеноконтрастных по своей природе саморассасывающихся полимеров могут также доставлять терапевтический агент, как предварительно отмечено.
Дополнительно к их применению в медицинских устройствах полимеры, описанные здесь, могут также быть полезными для тестирования in vitro, диагностики и производства клеток, ткани и/или органов и биоинженерного материала.
ПРИМЕР 1
СИНТЕЗ (3-(3-ИОДО-4-ГИДРОКСИФЕНИЛ)ПРОПАНОВОЙ КИСЛОТЫ-ТИРОЗИН ЭТИЛОВОГО ЭФИРА)
Мономер (3-(3-иодо-4-гидроксифенил)пропановой кислоты-тирозин этилового эфира) представляет собой бифенол, несущий один атом иода в положении 3 одного из двух фенольных колец. Эта бифункциональная молекула может быть полимеризована, как проиллюстрировано в последующих Примерах. Этот пример описывает способ, используемый для введения атома иода в ароматическое кольцо (4-гидроксифенил)пропановой кислоты и соединение этого иодированного производного с тирозин этиловым эфиром для получения 3-(3-иодо-4-гидроксифенил)пропановой кислоты-тирозин этилового эфира).
Иодирование 3-(4-гидроксифенил)пропановой кислоты.
Приготовление раствора (а): в коническую 250 мл колбу Эрленмейера добавляют 100 мл дистиллированной воды, 24 г иодида калия и 25 г иода. Смесь перемешивается всю ночь, до тех пор, пока все твердые вещества не растворятся.
Приготовление раствора (b): 16.6 г (0.1 моль) (4-гидроксифенил)пропановой кислоты помещают в 3-гордую круглодонную колбу Мортона, снабженную верхней мешалкой и 125 мл капельной воронкой. 140 мл 40% раствора триметиламина в воде было добавлено, и смесь перемешивалась до получения чистого раствора.
Раствор (а) помещают в капельную воронку и по каплям добавляют к раствору (b) при интенсивном перемешивании. Добавление каждой капли раствора (а) придает коричневый цвет реакционной смеси. Скорость прибавления такова, что все цвета исчезают перед добавлением следующей капли. Перемешивание продолжается в течение часа после добавления последней капли, затем 50 мл тиосульфата натрия 0.1 М добавляют к реакционной смеси. Тот же раствор также используется для промывания воронки.
37% HCl добавляют по каплям при интенсивном перемешивании, до тех пор, пока раствор не будет демонстрировать слабую кислую реакцию с помощью лакмусовой бумажки, и образуется осадок. Смесь концентрируют до половины объема на роторном испарителе и затем экстрагируют эфиром. Органическую фазу высушивают над сульфатом магния и обесцвечивают, используя животный уголь. Суспензию затем отфильтровывают через небольшой слой силикагеля и выпаривают досуха. Белый осадок дважды перекристаллизовывают из толуола, восстанавливают фильтрацией, высушивают в атмосфере азота и затем под высоким вакуумом.
Характеристика: Анализ на DSC (дифференциальный сканирующий калориметр) демонстрирует диапазон температуры плавления 109-111°С. 1Н-ЯМР (ДМСО) продукта демонстрирует следующие пики (мд): 2.5 (т, 2Н), 2.7 (т, 2Н), 6.8 (д, 2Н), 7.06 (д, 2Н), 10.08 (с, 1Н), 12.05 (с, 1Н). Обратно-фазная жидкостная хроматография высокого давления (ЖХВД) демонстрирует 3.8% исходного материала и 1.4% дииодированного продукта.
Стадия 2: Получение (3-(3-иодо-4-гидроксифенил)пропановой кислоты-тирозин этилового эфира)
К 250 мл 3-горлой круглодонной колбе, снабженной верхней мешалкой, добавляют 17 г (0.0582 моль) 3-(3-иодо-4-гидроксифенил)пропановой кислоты, 12.25 г (0.0585 моль) тирозин этилового эфира, и 25 мл N-метил-2-пирролидона (NMP). Смесь перемешивается до тех пор, пока раствор не станет прозрачным. Колбу охлаждают на ледяной бане, затем 11.84 г (0.0619 моль) 1-(3-диметиламинопропил)-3-этилкарбодимид гидрохлорид (EDCI HCl) добавляют одной порцией, за которым следует добавление 15 мл NMP. Охлаждающую баню убирают спустя 2,5 часа, и реакцию оставляют перемешивать на всю ночь при комнатной температуре. 71 мл этилацетата добавляют и перемешивание сохраняют еще в течение 15 минут. Неочищенный продукт затем переносят в 500 мл разделительную воронку и экстрагируют один раз 75 мл солевого раствора, затем двумя аликвотами (75 и 35 мл) 3% NaHCO3/14% NaCl, за которым следует добавление аликвоты 35 мл 0.4М HCl/14% NaCl и, в конце концов, солевого раствора. Органическую фазу высушивают над сульфатом магния и обрабатывают активированным углем, отфильтровывают и концентрируют до густого сиропа, который кристаллизуют в твердую массу после нескольких часов. Продукт растирают в порошок в метиленхлориде, используя механическое перемешивание, затем восстанавливают фильтрацией, высушивают в атмосфере азота, затем под глубоким вакуумом.
Характеристика: DSC анализ демонстрирует диапазон температуры плавления 110-113°С. 1Н-ЯМР (ДМСО) демонстрирует следующие пики (мд): 1.1 (т, 3Н), 2.35 (т, 2Н), 2.65 (м, 2Н). 2.85 (м, 2Н), 4.05 (к, 2Н), 4.35 (м, 1Н), 6.65/6.75/6.95 (м, 6Н), 7.5 (с, 1Н), 8.25 (д, 1Н), 9.25 (с, 1Н), 10.05 (с, 1Н). Обратно-фазная ЖХВД демонстрирует 2.2% неиодированного мономера и отсутствие дииодированного продукта.
ПРИМЕР 2
СИНТЕЗ (3-(3-ИОДО-4-ГИДРОКСИФЕНИЛ)-2-ПРОПЕНОВОЙ КИСЛОТЫ-ТИРОЗИН ЭТИЛОВОГО ЭФИРА)
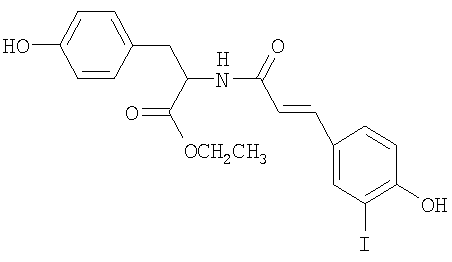
Мономер (3-(3-иодо-4-гидроксифенил)пропеновой кислоты-тирозин этилового эфира) представляет собой бифенол, несущий один атом иода в положении 3 одного из двух фенольных колец. Эта бифункциональная молекула может быть полимеризована, как проиллюстрировано в последующих Примерах. Этот пример описывает способ, используемый для введения атома иода в ароматическое кольцо (3-(4-гидроксифенил)-2-пропеновой кислоты и соединение этого иодированного производного с тирозин этиловым эфиром для получения 3-(3-иодо-4-гидроксифенил)-2-пропеновой кислоты-тирозин этилового эфира).
Иодирование 3-(4-гидроксифенил)-2-пропеновой кислоты.
Приготовление раствора (а): в коническую 250 мл колбу Эрленмейера добавляют 100 мл дистиллированной воды, 24 г иодида калия и 25 г иода. Смесь перемешивается всю ночь, до тех пор, пока все твердые вещества не растворятся.
Приготовление раствора (b): 16.6 г (0.1 моль) (3-(4-гидроксифенил)-2-пропеновой кислоты помещают в 3-горлую круглодонную колбу Мортона, снабженную верхней мешалкой и 125 мл капельной воронкой. 140 мл 40% раствора триметиламина в воде было добавлено, и смесь перемешивалась до получения чистого раствора.
Раствор (а) помещают в капельную воронку и по каплям добавляют к раствору (b) при интенсивном перемешивании. Добавление каждой капли раствора (а) придает коричневый цвет реакционной смеси. Скорость прибавления такова, что все цвета исчезают перед добавлением следующей капли. Перемешивание продолжается в течение часа после добавления последней капли, затем 50 мл тиосульфата натрия 0.1 М добавляют к реакционной смеси. Тот же раствор также используется для промывания воронки.
37% HCl добавляют по каплям при интенсивном перемешивании, до тех пор, пока раствор не будет демонстрировать слабую кислую реакцию с помощью лакмусовой бумажки, и образуется осадок. Смесь концентрируют до половины объема на роторном испарителе и затем экстрагируют эфиром. Органическую фазу высушивают над сульфатом магния и обесцвечивают, используя животный уголь. Суспензию затем отфильтровывают через небольшой слой силикагеля и выпаривают досуха. Белый осадок дважды перекристаллизовывают из толуола, восстанавливают фильтрацией, высушивают в атмосфере азота и затем под высоким вакуумом.
Стадия 2: Получение (3-(3-иодо-4-гидроксифенил)-2-пропеновой кислоты-тирозин этилового эфира)
К 250 мл 3-горлой круглодонной колбе, снабженной верхней мешалкой, добавляют 17 г (0.0582 моль) 3-(3-иодо-4-гидроксифенил)-2-пропеновой кислоты, 12.25 г (0.0585 моль) тирозин этилового эфира, и 25 мл N-метил-2-пирролидона (NMP). Смесь перемешивается до тех пор, пока раствор не станет прозрачным. Колбу охлаждают на ледяной бане, затем 11.84 г (0.0619 моль) 1-(3-диметиламинопропил)-3-этилкарбодимид гидрохлорид (EDCI HCl) добавляют одной порцией, за которым следует добавление 15 мл NMP. Охлаждающую баню убирают спустя 2,5 часа, и реакцию оставляют перемешивать на всю ночь при комнатной температуре. 71 мл этилацетата добавляют и перемешивание сохраняют еще в течение 15 минут. Неочищенный продукт затем переносят в 500 мл разделительную воронку и экстрагируют один раз 75 мл солевого раствора, затем двумя аликвотами (75 и 35 мл) 3% NaHCO3/14% NaCl, за которым следует добавление аликвоты 35 мл 0.4М HCl/14% NaCl и, в конце концов, солевого раствора. Органическую фазу высушивают над сульфатом магния и обрабатывают активированным углем, отфильтровывают и концентрируют до густого сиропа, который кристаллизуют в твердую массу после нескольких часов. Продукт растирают в порошок в метиленхлориде, используя механическое перемешивание, затем восстанавливают фильтрацией, высушивают в атмосфере азота, затем под глубоким вакуумом.
ПРИМЕР 3
СИНТЕЗ (2-(3-ИОДО-4-ГИДРОКСИБЕНЗИЛ)МЕТИЛМАЛОНАТА-ТИРОЗИН ЭТИЛОВОГО ЭФИРА)
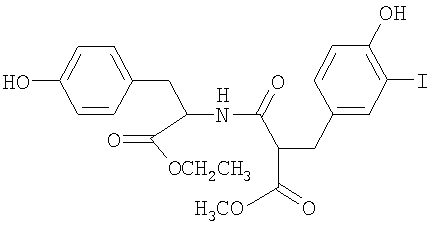
Мономер (2-(3-иодо-4-гидроксибензил)метилмалоната-тирозин этилового эфира) представляет собой бифенол, несущий один атом иода в положении 3 одного из двух фенольных колец. Эта бифункциональная молекула может быть полимеризована, как проиллюстрировано в последующих Примерах. Этот пример описывает способ, используемый для введения атома иода в ароматическое кольцо (2-(4-гидроксибензил)-метилмалоната и соединение этого иодированного производного с тирозин этиловым эфиром для получения (2-(3-иодо-4-гидроксибензил)-метилмалонат-тирозин этилового эфира).
Иодирование 2-(4-гидроксибензил)-метилмалоната.
Приготовление раствора (а): в коническую 250 мл колбу Эрленмейера добавляют 100 мл дистиллированной воды, 24 г иодида калия и 25 г иода. Смесь перемешивается всю ночь, до тех пор, пока все твердые вещества не растворятся.
Приготовление раствора (b): 22 г 2-(4-гидроксибензил)метилмалоната помещают в 3-горлую круглодонную колбу Мортона, снабженную верхней мешалкой и 125 мл капельной воронкой. 140 мл 40% раствора триметиламина в воде было добавлено, и смесь перемешивалась до получения чистого раствора.
Раствор (а) помещают в капельную воронку и по каплям добавляют к раствору (b) при интенсивном перемешивании. Добавление каждой капли раствора (а) придает коричневый цвет реакционной смеси. Скорость прибавления такова, что все цвета исчезают перед добавлением следующей капли. Перемешивание продолжается в течение часа после добавления последней капли, затем 50 мл тиосульфата натрия 0.1 М добавляют к реакционной смеси. Тот же раствор также используется для промывания воронки.
37% HCl добавляют по каплям при интенсивном перемешивании, до тех пор, пока раствор не будет демонстрировать слабую кислую реакцию с помощью лакмусовой бумажки, и образуется осадок. Смесь концентрируют до половины объема на роторном испарителе и затем экстрагируют эфиром. Органическую фазу высушивают над сульфатом магния и обесцвечивают, используя животный уголь. Суспензию затем отфильтровывают через небольшой слой силикагеля и выпаривают досуха. Белый осадок дважды перекристаллизовывают из толуола, восстанавливают фильтрацией, высушивают в атмосфере азота и затем под высоким вакуумом.
Стадия 2: Получение (2-(3-иодо-4-гидроксибензил)-метилмалоната-тирозин этилового эфира)
К 250 мл 3-горлой круглодонной колбе, снабженной верхней мешалкой, добавляют 23 г 2-(3-иодо-4-гидроксибензил)метилмалоната, 12.25 г (0.0585 моль) тирозин этилового эфира и 25 мл N-метил-2-пирролидона (NMP). Смесь перемешивается до тех пор, пока раствор не станет прозрачным. Колбу охлаждают на ледяной бане, затем 11.84 г (0.0619 моль) 1-(3-диметиламинопропил)-3-этилкарбодимид гидрохлорид (EDCI HCl) добавляют одной порцией, за которьм следует добавление 15 мл NMP. Охлаждающую баню убирают спустя 2,5 часа и реакцию оставляют перемешивать на всю ночь при комнатной температуре. 71 мл этилацетата добавляют, и перемешивание сохраняют еще в течение 15 минут. Неочищенный продукт затем переносят в 500 мл разделительную воронку и экстрагируют один раз 75 мл солевого раствора, затем двумя аликвотами (75 и 35 мл) 3% NaHCO3/14% NaCl, за которым следует добавление аликвоты 35 мл 0.4М HCl/14% NaCl и, в конце концов, солевого раствора. Органическую фазу высушивают над сульфатом магния и обрабатывают активированным углем, отфильтровывают и концентрируют до густого сиропа, который кристаллизуют в твердую массу после нескольких часов. Продукт растирают в порошок в метиленхлориде, используя механическое перемешивание, затем восстанавливают фильтрацией, высушивают в атмосфере азота, затем под глубоким вакуумом.
ПРИМЕР 4
ПОЛИ(3-(3-ИОДО-4-ГИДРОКСИФЕНИЛ)ПРОПАНОВОЙ КИСЛОТЫ-ТИРОЗИН ЭТИЛОВЫЙ ЭФИР), ПОЛУЧЕННЫЙ ПОЛИМЕРИЗАЦИЕЙ В РАСТВОРЕ С ЭТИЛФОСФОДИХЛОРИДАТОМ
В атмосфере аргона 5.5 г (3-(3-иодо-4-гидроксифенил)пропановой кислоты-тирозин этилового эфира), 5.07 г 4-диметиламинопиридина (DMAP) и 50 мл метиленхлорида могут быть перенесены в 250 мл колбу, снабженную воронкой. Раствор 3.07 г этилфосфодихлоридата (ЕОР) в 30 мл метиленхлорида может быть добавлен в воронку. Раствор в колбе может быть охлажден до -40°С при перемешивании, и раствор ЕОР может быть добавлен по каплям через воронку. Когда добавление завершится, смесь может быть постепенно доведена до температуры 45°С и может быть поддерживаема при температуре кипения всю ночь.
Затем растворитель может быть выпарен, и вакуум (0.1 мм Hg) может быть применен в течение одного часа, в то время как температура осадка поддерживается при 120°С. Остаток может быть повторно растворен в 100 мл хлороформа, промыт 0.1М раствором HCl в дистиллированной воде, высушен над безводным Na2SO4 и охлажден 500 мл эфира. Полученный остаток может быть собран и высушен над вакуумом.
ПРИМЕР 5
ПОЛИ(3-(3-ИОДО-4-ГИДРОКСИФЕНИЛ)-2-ПРОПЕНОВОЙ КИСЛОТЫ-ТИРОЗИН ЭТИЛОВЫЙ ЭФИР), ПОЛУЧЕННЫЙ ПОЛИМЕРИЗАЦИЕЙ С ЭТИЛФОСФОДИХЛОРИДАТОМ
В атмосфере аргона 5.5 г (3-(3-иодо-4-гидроксифенил)-2-пропеновой кислоты -тирозин этилового эфира), 5.07 г 4-диметиламинопиридина (DMAP) и 50 мл метиленхлорида могут быть перенесены в 250 мл колбу, снабженную воронкой. Раствор 3.07 г этилфосфодихлоридата (ЕОР) в 30 мл метиленхлорида может быть добавлен в воронку. Раствор в колбе может быть охлажден до -40°С при перемешивании, и раствор ЕОР может быть добавлен по каплям через воронку. Когда добавление завершится, смесь может быть постепенно доведена до температуры 45°С и может быть поддерживаема при температуре кипения всю ночь.
Затем растворитель может быть выпарен, и вакуум (0.1 мм Hg) может быть применен в течение одного часа, в то время как температура осадка поддерживается при 120°С. Остаток может быть повторно растворен в 100 мл хлороформа, промыт 0.1М раствором HCl в дистиллированной воде, высушен над безводным Na2SO4 и охлажден 500 мл эфира. Полученный остаток может быть собран и высушен над вакуумом.
ПРИМЕР 6
ПОЛИ(2-(3-ИОДО-4-ГИДРОКСИБЕНЗИЛ)МЕТИЛМАЛОНАТА-ТИРОЗИН ЭТИЛОВЫЙ ЭФИР), ПОЛУЧЕННЫЙ ПОЛИМЕРИЗАЦИЕЙ С ЭТИЛФОСФОДИХЛОРИДАТОМ
В атмосфере аргона 7.8 г (2-(3-иодо-4-гидроксибензил)метилмалоната-тирозин этилового эфира), 5.07 г 4-диметиламинопиридина (DMAP) и 50 мл метиленхлорида могут быть перенесены в 250 мл колбу, снабженную воронкой. Раствор 3.07 г этилфосфодихлоридата (ЕОР) в 30 мл метиленхлорида может быть добавлен в воронку. Раствор в колбе может быть охлажден до -40°С при перемешивании, и раствор ЕОР может быть добавлен по каплям через воронку. Когда добавление завершится, смесь может быть постепенно доведена до температуры 45°С и может быть поддерживаема при температуре кипения всю ночь.
Затем растворитель может быть выпарен, и вакуум (0.1 мм Hg) может быть применен в течение одного часа, в то время как температура осадка поддерживается при 120°С. Остаток может быть повторно растворен в 100 мл хлороформа, промыт 0.1М раствором HCl в дистиллированной воде, высушен над безводным Na2SO4 и охлажден 500 мл эфира. Полученный остаток может быть собран и высушен над вакуумом.
ПРИМЕР 7
ПОЛИ(3-(3-ИОДО-4-ГИДРОКСИФЕНИЛ)ПРОПАНОВОЙ КИСЛОТЫ-ТИРОЗИН ЭТИЛОВЫЙ ЭФИР), ПОЛУЧЕННЫЙ ПОЛИМЕРИЗАЦИЕЙ В РАСТВОРЕ С ЦИАНОГЕНБРОМИДОМ
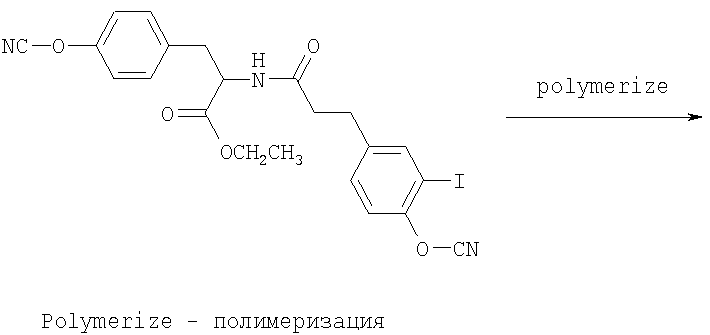
В трехгорлую 500 мл круглодонную колбу, снабженную термометром, верхней мешалкой и капельной воронкой, может быть загружен раствор 21.4 г цианоген бромида (CNBR), растворенного в 100 мл ацетона. Система может быть защищена от попадания влаги осушительной трубочкой с CaCl2 и охлаждена до -10°С с помощью внешней охлаждающей смеси ацетон - сухой лед. 71 г (3-(3-иодо-4-гидроксифенил)пропановой кислоты-тирозин этиловый эфир) и 20.2 г триэтиламина может быть растворено в 150 мл ацетона и помещено в капельную воронку. При интенсивном перемешивании (3-(3-иодо-4-гидроксифенил)пропановой кислоты-тирозин этиловый эфир)/раствор триэтиламина могут быть добавлены к раствору цианоген бромида за период 20 минут. Температура может быть сохранена ниже -5°С. Перемешивание может быть продолжено в течение дополнительных 40 минут; затем реакционная смесь может быть оставлена нагреваться до +10°С. После завершения реакции плотный осадок гидробромида триэтиламина может быть удален фильтрацией на Бюхнеровской воронке. К светлому, бесцветному фильтрату 500 мл ледяной воды может быть добавлено медленно и при перемешивании за 5 минут. Плотный кристаллический осадок (3-(3-иодо-4-гидроксифенил)пропановой кислоты-тирозин этилового эфира) дицианата может образовываться, который может быть собран на Бюхнеровской воронке, его промывают ледяной водой, быстро высушивают над пентаоксидом фосфора под вакуумом. Неочищенный материал перекристаллизовывают из гексана.
Полимеризация (3-(3-иодо-4-гидроксифенил)пропановой кислоты-тирозин этилового эфира) дицианата.
44% (вес/объем) раствор в ТГФ точно стехиометрической смеси (3-(3-иодо-4-гидроксифенил)пропановой кислоты-тирозин этилового эфира) и (3-(3-иодо-4-гидроксифенил)пропановой кислоты-тирозин этилового эфира)-дицианата может быть получен, за которым следует добавление 1М трет-бутоксида калия, достаточного для получения раствора с концентрацией 1.0 молярный процент. Смесь может быть перемешана при 23°С, и превращение дицианата наблюдается спектрофотометрически. Неочищенный продукт может быть получен испарением растворителя. Продукт может быть осторожно промыт избытком ацетона и высушен под вакуумом.
Предшествующее описание предпочтительных вариантов осуществления следует считать иллюстративным, а не ограничивающим настоящее изобретение, в том виде, как оно определено формулой изобретения. Как легко оценить, многочисленные вариации и комбинации признаков, изложенных выше, могут быть использованы без отступления от объема притязаний по настоящему изобретению, в том виде, как оно изложено в формуле изобретения. Такие вариации не рассматриваются как отступление от сущности и объема изобретения, и все такие вариации предназначены для включения в объем притязаний по следующей формуле изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПОЛИМЕРЫ С КРИСТАЛЛИЗУЮЩИМИСЯ БОКОВЫМИ ЦЕПЯМИ ДЛЯ МЕДИЦИНСКОГО ПРИМЕНЕНИЯ | 2005 |
|
RU2383558C2 |
| КРИСТАЛЛИЗУЮЩИЕСЯ ПОЛИМЕРЫ С БОКОВОЙ ЦЕПЬЮ ДЛЯ МЕДИЦИНСКИХ ЦЕЛЕЙ | 2007 |
|
RU2445979C2 |
| N-ЗАМЕЩЕННЫЕ МОНОМЕРЫ И ПОЛИМЕРЫ | 2007 |
|
RU2470040C2 |
| СТЕНТ ИЗ СКОЛЬЗЯЩИХ И БЛОКИРУЮЩИХ ЭЛЕМЕНТОВ | 2006 |
|
RU2446775C2 |
| N-ЗАМЕЩЕННЫЕ МОНОМЕРЫ И ПОЛИМЕРЫ | 2007 |
|
RU2461582C2 |
| ПОЛИМЕРНЫЕ ПО СУЩЕСТВУ РЕНТГЕНОКОНТРАСТНЫЕ ПРОДУКТЫ ДЛЯ ЭМБОЛОТЕРАПИИ | 2004 |
|
RU2373958C2 |
| СТЕНТ, ВЫДЕЛЯЮЩИЙ РАПАМИЦИН | 2010 |
|
RU2563429C2 |
| СТЕНТ ИЗ ОГОЛЕННОГО МЕТАЛЛА С РЕЗЕРВУАРАМИ, ВЫДЕЛЯЮЩИМИ ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ | 2011 |
|
RU2573107C2 |
| СТЕНТ, ВЫДЕЛЯЮЩИЙ ДВА ЛЕКАРСТВЕННЫХ ВЕЩЕСТВА | 2010 |
|
RU2552086C2 |
| СТИМУЛИРУЮЩАЯ АДГЕЗИЮ ВРЕМЕННАЯ МАСКА ДЛЯ ПОКРЫТЫХ ПОВЕРХНОСТЕЙ | 2009 |
|
RU2526885C2 |
Изобретение относится к рентгеноконтрастному по своей природе биосовместимому, саморассасывающемуся полимеру, пригодному при изготовлении медицинских устройств (например, стентов), предназначенных для размещения в участке, выбранном из сосудистой, костно-мышечной/ортопедической, нервной, респираторной, репродуктивной, мочевой, пищеварительной, эндокринной, кроветворной или покрывной системы. Полимер содержит одно или более повторяющихся звеньев формулы (I)
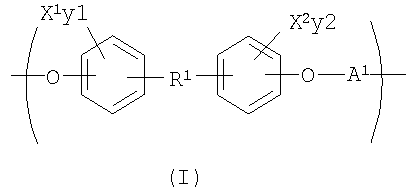
Настоящее изобретение также относится к системе для лечения участка внутри сосуда, содержащей стент и катетер, имеющий средства развертывания, а также к способу повторного лечения полости тела. Стенты, выполненные из заявленного полимера или покрытые таким полимером, являются гемосовместимыми для предотвращения острых тромбозов, препятствуют соединению и росту клеток гладкомышечной ткани сосудов, отвечающих за распространение рестеноза, а также сохраняют механическую прочность в течение длительного периода времени и могут использоваться для повторной обработки того же участка кровеносного сосуда. 9 н. и 20 з.п.ф-лы, 2 табл., 1 ил.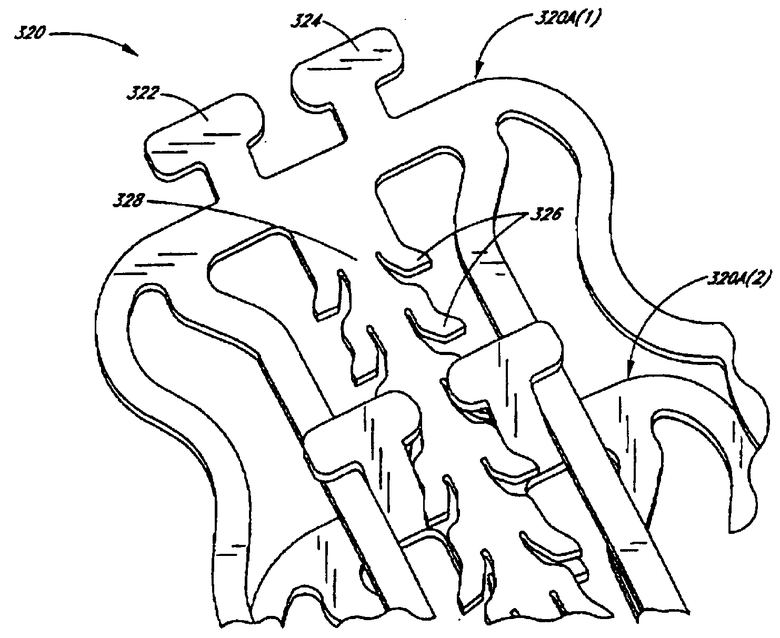
1. Рентгеноконтрастный по своей природе биосовместимый, саморассасывающийся полимер, где указанный полимер содержит одно или более повторяющихся звеньев формулы (I):
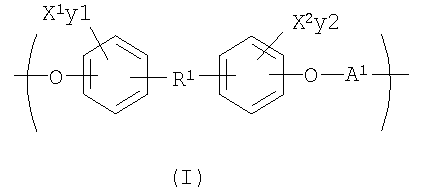
где X1 и X2 каждый независимо выбран из группы, состоящей из Вr и I;
у1 и у2 каждый независимо представляет собой ноль или целое число в диапазоне от 1 до 4, при условии, что сумма у1 и у2 равна, по крайней мере,1;
R1 представляет собой
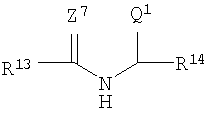 ;
;
R13 и R14 каждый независимо выбирают из группы, состоящей из -СН=СН-, -(СН2)с-, -(CHJ1)-, -CHJ2-CHJ3-, -СН=СН-(CHJ1)-, и -(СН2)с-(CHJ1)-;
с представляет собой ноль или целое число в диапазоне от 1 до 8;
J1, J2 и J3 каждый независимо выбирают из группы, состоящей из Н, Br, I, - NH-Q2 и -C(=Z8)-OQ3;
Q1, Q2 и Q3 каждый независимо представляет собой Н или некристаллизующуюся группу, содержащую от 1 до приблизительно 30 атомов углерода;
Z7 и Z8 каждый независимо представляет собой О или S;
А1 выбирают из группы, состоящей из
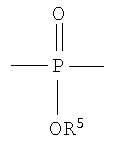 и
и 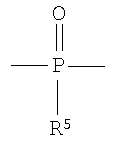
R5 выбирают из группы, состоящей из Н, C1-С30 алкила, и С1-С30 гетероалкила.
2. Имплантируемое медицинское устройство, предназначенное для размещения в участке, выбранном из сосудистой, костно-мышечной/ортопедической, нервной, респираторной, репродуктивной, мочевой, пищеварительной, эндокринной, кроветворной или покровной системы, где указанное медицинское устройство содержит полимер по п.1.
3. Медицинское устройство по п.2, где указанное медицинское устройство предназначено для использования in vivo.
4. Медицинское устройство по п.2, где указанное медицинское устройство предназначено для использования ех vivo.
5. Медицинское устройство по п.4, где указанное медицинское устройство предназначено для использования in vitro.
6. Медицинское устройство по п.2, где указанное медицинское устройство содержит стент.
7. Медицинское устройство по п.6, где указанный стент также имеет конфигурацию, выбранную из группы, состоящей из листового стента, плетеного стента, саморасширяющегося стента, проволочного стента, деформируемого стента и шарнирного стента.
8. Медицинское устройство по п.6, где указанный стент также содержит, по крайней мере, два в основном недеформируемых элемента, расположенных с образованием трубчатого элемента, эти недеформируемые элементы являются подвижно соединенными для допущения возможности трубчатому элементу расширяться от сжатого до расширенного состояния.
9. Медицинское устройство по п.6, где указанный стент также содержит трубчатый элемент, содержащий ряд подвижно-соединенных радиальных элементов и блокирующий механизм, предназначенный для одностороннего движения радиальных элементов, так что указанный трубчатый элемент приспособлен расширяться от первого сжатого диаметра до второго расширенного диаметра с минимальной отдачей.
10. Медицинское устройство по п.2, также содержащее эффективное количество терапевтического агента.
11. Медицинское устройство по п.10, где указанный терапевтический агент выбирают из группы, состоящей из антипролиферативных агентов, противовоспалительных агентов, агентов против матричных металлопротеиназ, агентов для снижения уровня липидов, для изменения уровня холестерина, антитромботических и антитромбоцитарных агентов.
12. Медицинское устройство по п.10, где указанное эффективное количество является достаточным для обеспечения эффекта, выбранного из группы, состоящей из: ингибирование рестеноза, тромбоза, образования бляшек, разрыва бляшек и воспаления, снижение уровня холестерина и/или ускорение заживления.
13. Медицинское устройство по п.2, где Х1 и Х2 представляет собой иод.
14. Медицинское устройство по п.2, также имеющее негалогенированное покрытие.
15. Медицинское устройство по п.2, где указанный полимер образует покрытие, по крайней мере, на части указанного медицинского устройства.
16. Система для лечения участка внутри сосуда, содержащая стент по п.6 и катетер, имеющий средства развертывания, где указанный катетер приспособлен для доставки стента к участку, и средства развертывания предназначены для развертывания стента.
17. Способ для повторного лечения полости тела, включающий:
развертывание первого стента вдоль участка в кровеносном сосуде, где указанный первый стент представляет собой стент по п.6; и
развертывание второго стента, вдоль приблизительно того же участка в кровеносном сосуде, так что кровеносный сосуд повторно подвергается лечению этим вторым стентом.
18. Полимер по п.1, также содержащий одно или более повторяющихся звеньев формулы (II):
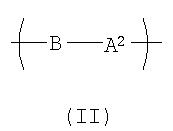
где В представляет собой -O-(CHR6)p-O)q-;
R6 представляет собой Н или C1-С3алкил;
р и q являются каждый индивидуально целым числом из диапазона от 1 до 100;
А2 выбирают из группы, состоящей из
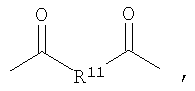
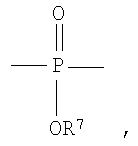
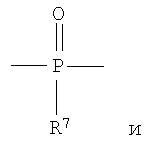
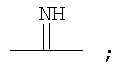
где R7 представляет собой Н или С1-С30 углеводород; и
R11 выбирают из группы, состоящей из C1-С30 алкила, C1-С30 гетероалкила, С5-С30 арила, С6-С30 алкиларила, и С2-С30 гетероарила.
19. Имплантируемое медицинское устройство, предназначенное для размещения в участке, выбранном из сосудистой, костно-мышечной/ортопедической, нервной, респираторной, репродуктивной, мочевой, пищеварительной, эндокринной, кроветворной или покровной системы, где указанное медицинское устройство содержит полимер по п.18.
20. Полимер по п.18, также содержащий одно или более повторяющихся звеньев формулы (Ia):
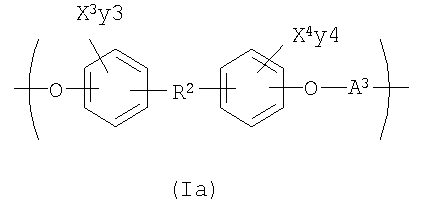
где X3 и X4 каждый независимо выбран из группы, состоящей из Вr и I;
у3 и у4 каждый независимо представляет собой ноль или целое число в диапазоне от 1 до 4;
R2 выбирают из группы, состоящей из:
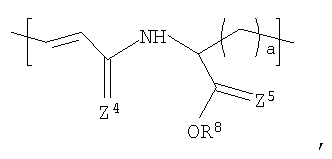
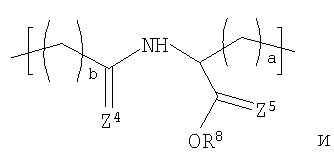
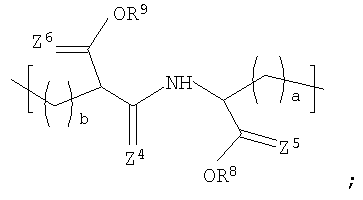
R8 и R9 каждый независимо представляет собой Н или некристаллизующийся C1-С30 углеводород;
Z4, Z5 и Z6 каждый независимо представляют собой О или S; и
а и b каждый независимо представляет собой целое число в диапазоне от 1 до 8;
А3 выбирают из группы, состоящей из:
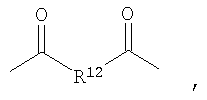
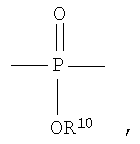
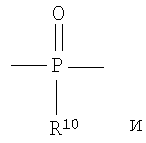
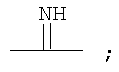
R10 выбирают из группы, состоящей из Н или C1-С30 алкила, C1-С30 гетероалкила; и
R12 выбирают из группы, состоящей из C1-С30 алкила, C1-С30 гетероалкила, С5-С30 арила, С6-С30 алкиларила, и С2-С30 гетероарила.
21. Имплантируемое медицинское устройство, предназначенное для размещения в участке, выбранном из сосудистой, костно-мышечной/ортопедической, нервной, респираторной, репродуктивной, мочевой, пищеварительной, эндокринной, кроветворной или покровной системы, где указанное медицинское устройство содержит полимер по п.20.
22. Полимер по п.1, где R1 представляет:
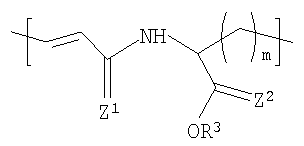
где R3 представляет Н или некристаллизующийся C1-C29 углеводород;
Z1 и Z2 каждый независимо представляют собой О или S; и
m представляет собой целое число в диапазоне от 1 до 8.
23. Имплантируемое медицинское устройство, предназначенное для размещения в участке, выбранном из сосудистой, костно-мышечной/ортопедической, нервной, респираторной, репродуктивной, мочевой, пищеварительной, эндокринной, кроветворной или покровной системы, где указанное медицинское устройство содержит полимер по пункту 22.
24. Полимер по п.1, где R1 представляет:
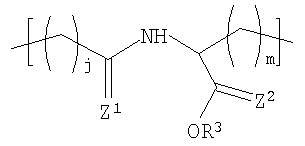
где R3 представляет Н или некристаллизующийся C1-C29 углеводород;
Z1 и Z2 каждый независимо представляют собой О или S; и j и
m каждый независимо представляет собой целое число в диапазоне от 1 до 8.
25. Имплантируемое медицинское устройство, предназначенное для размещения в участке, выбранном из сосудистой, костно-мышечной/ортопедической, нервной, респираторной, репродуктивной, мочевой, пищеварительной, эндокринной, кроветворной или покровной системы, где указанное медицинское устройство содержит полимер по п.24.
26. Полимер по п.1, где R1 представляет:
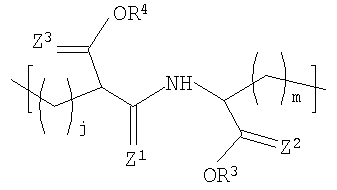 ,
,
где R3 и R4 каждый независимо представляет собой Н или
некристаллизующийся C1-C29 углеводород;
Z1, Z2 и Z3 каждый независимо представляют собой О или S; и
j и m каждый независимо представляет собой целое число в диапазоне от 1 до 8.
27. Имплантируемое медицинское устройство, предназначенное для размещения в участке, выбранном из сосудистой, костно-мышечной/ортопедической, нервной, респираторной, репродуктивной, мочевой, пищеварительной, эндокринной, кроветворной или покровной системы, где указанное медицинское устройство содержит полимер по п.26.
28. Медицинское устройство по п.2, также содержащее эффективное количество рентгеноконтрастного агента.
29. Медицинское устройство по п.2, также содержащее эффективное количество агента, улучшающего магнитный резонанс.
| US 4980449 А, 25.12.1990 | |||
| Прибор, замыкающий сигнальную цепь при повышении температуры | 1918 |
|
SU99A1 |
| US 6238687 B1, 29.05.2001 | |||
| US 5954744 A, 21.09.1999 | |||
| US 6475477 B2, 05.11.2002 | |||
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| ТРАНСПЛАНТИРУЕМЫЕ СТЕНТЫ С БИОАКТИВНЫМИ ПОКРЫТИЯМИ | 1999 |
|
RU2242251C2 |
Авторы
Даты
2010-08-10—Публикация
2005-08-09—Подача