ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка является частично продолжающей заявку на патент США под серийным номером 11/176638, поданную 7 июля 2005 г., с заявленным приоритетом по заявке на временный патент США №60/586796, поданной 8 июля 2004 г., обе они настоящим включены целиком и полностью посредством ссылки.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Область техники, к которой относится изобретение
Настоящее изобретение относится к кристаллизующимся полимерам с боковой цепью, более конкретно к кристаллизующимся полимерам с боковой цепью, пригодным для медицинских целей.
Описание уровня техники, имеющего отношение к изобретению
Полимерные материалы широко используются в многочисленных областях. Например, терапевтическая эмболизация представляет собой селективное блокирование кровеносных сосудов или пораженных сосудистых структур. Примеры полимерных устройств и реагентов для эмболотерапии включают эмболизирующие спирали, гелевые вспененные материалы, клеи и частичные полимерные эмболизирующие агенты, используемые, например, для контроля кровотечения, предотвращения кровопотери до хирургической операции или во время нее, ограничения или блокирования поступления крови к опухолям и сосудистым мальформациям, например, при фибромах матки, опухолях (то есть химио-эмболизация), геморрагия (например, во время травмы с кровотечением) и артериовенозных мальформациях, фистулах (например, AVF) и аневризмах.
Эмболизирующие агенты из жидких полимеров включают преципитатные и реактивные системы. Например, в преципитатной системе, полимер может быть растворен в биологически приемлемом растворителе, который рассеивается после подачи к сосуду, оставляя полимер внутри, для преципитации. Реактивные системы включают цианоакрилатные системы, в которых, например, жидкая мономерная и/или олигомерная цианоакрилатная смесь вводится в участок сосуда через катетер и полимеризуется внутри. В этой системе полимеризация инициируется водой, содержащейся в крови.
Ряд технологических областей применения включает использование полимера, который претерпевает переход из одного состояния в другое при изменении температуры. Например, в области медицины один из способов введения твердого полимера в конкретный участок органа заключается в нагреве полимера до состояния текучести, после чего полимер инжектируют в данный участок и дают возможность ему остыть и отвердеть. В патенте США №5469867 описаны кристаллизующиеся полимеры с боковой цепью, которые считаются пригодными для перекрытия каналов в теле живого организма млекопитающего. Такие полимеры считаются спроектированными с учетом возможности их расплавления таким образом, чтобы они обладали текучестью при температуре чуть выше температуры тела, но отвердевали при остывании до температуры тела.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Изобретение представляет полимер, включающий основную цепь, множество кристаллизующихся боковых цепей и множество тяжелых атомов, присоединенных к полимеру. Тяжелые атомы могут присутствовать в количестве, которое является эффективным для придания полимеру свойства рентгеноконтрастности. В варианте осуществления полимер содержит повторяющееся звено формулы (VI), как изложено далее. Еще один вариант осуществления представляет медицинское устройство, содержащее такой полимер.
Еще один вариант осуществления представляет медицинское устройство, которое включает полимерный материал, при этом полимерный материал содержит биосовместимый, по существу, рентгеноконтрастный кристаллизующийся полимер с боковой цепью. В одном варианте осуществления медицинское устройство содержит, по меньшей мере, стент.
Еще один вариант осуществления представляет способ лечения, включающий введение медицинского устройства в полость органа млекопитающего в количестве, эффективном, по меньшей мере, для частичной окклюзии полости органа, при этом медицинское устройство содержит полимерный материал, который содержит кристаллизующийся полимер с боковой цепью. В другом варианте осуществления способ дополнительно включает формирование канала, проходящего сквозь медицинское устройство.
Еще один вариант осуществления представляет способ получения, по существу, рентгеноконтрастного кристаллизующегося полимера с боковой цепью, содержащего первый мономер и второй мономер, причем первый мономер содержит тяжелый атом, а второй мономер содержит кристаллизующуюся группу.
Еще один вариант осуществления представляет способ получения, по существу, рентгеноконтрастного кристаллизующегося полимера с боковой цепью, включающий проведение реакции кристаллизующегося полимера с боковой цепью с реагентом в виде тяжелого металла при условиях, выбранных для обеспечения присоединения множества тяжелых атомов к кристаллизующемуся полимеру с боковой цепью.
Еще один вариант осуществления представляет стент, который содержит кристаллизующийся полимер с боковой цепью.
Эти и другие варианты осуществления далее описаны более подробно.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖА
На фиг.1 представлен подробный вид на конфигурацию скользящего и фиксируемого стента в соответствии с одним предпочтительным вариантом осуществления настоящего изобретения, содержащего отводимые зубья, которые отводятся вниз, чтобы обеспечить однонаправленное расширение стента.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Вариант осуществления представляет кристаллизующийся полимер с боковой цепью, содержащий тяжелый атом (HACSCCP). Многие полимеры содержат атомы с относительно низким атомным числом, такие как атомы водорода, углерода, азота, кислорода, кремния и серы. Однако было обнаружено, что присоединение к полимеру атомов с относительно более высоким атомным числом может повлиять на различные физические и механические свойства полимера. Например, присоединение тяжелых атомов к полимеру в достаточных количествах может, преимущественно, придать полимеру свойство упрощения его обнаружения при использовании различной медицинской техники отображения. Термин «тяжелый атом» используется в настоящем документе для обозначения атомов с атомным числом 17 и более. Предпочтительные тяжелые атомы имеют атомное число 35 и более и включают бром, йод, висмут, золото, платину, тантал, вольфрам и барий. В определенных конфигурациях HACSCCP могут быть, по существу, рентгеноконтрастными. Термин «по существу, рентгеноконтрастный» используется в настоящем документе, чтобы обозначить полимер, к которому присоединено достаточное количество тяжелых атомов с использованием ковалентных или ионных связей, чтобы придать полимеру свойство упрощения его обнаружения при использовании различной медицинской техники отображения (например, с помощью рентгеновского излучения и/или во время флуороскопии). HACSCCP могут использоваться в разнообразных областях применения, в том числе для медицинских целей, в которых они выполнены с возможностью обеспечения, по существу, рентгеноконтрастности, что может создавать значительные преимущества. Понятно, что степень придания полимеру присоединенными к нему тяжелыми атомами способности быть обнаруженным с помощью медицинской техники отображения, в основном, зависит от количества тяжелых атомов, внедренных в полимер, и от конфигурации (например, толщины) полимера.
Помимо тяжелых атомов, HACSCCP содержат также кристаллизующиеся боковые цепи. Кристаллизующиеся полимеры с боковой цепью (SCC), иногда называемые «гребневидные» полимеры, хорошо известны, смотри N.A.Plate и V.P.Shibaev, J. Polymer Sci.: Macromol. Rev. 8: 117-253 (1974), описание которого настоящим включено посредством ссылки. Понятно, что HACSCCP представляют собой полимер типа SCC и что ссылка в настоящем документе на полимеры SCC включает HACSCCP, если только не указано иначе. В одном варианте осуществления полимер SCC, по существу, не содержит тяжелых атомов. HACSCCP могут представлять собой полимеры SCC, которые модифицированы для включения тяжелых атомов, например, путем присоединения тяжелых атомов к полимеру SCC и/или получением HACSCCP путем полимеризации мономеров, которые содержат тяжелые атомы. Полимеры SCC могут иметь различные конфигурации, например гомополимер, сополимер (например, нерегулярный сополимер, чередующийся сополимер, блоксополимеры, привитые сополимеры), различные тактичности (например, хаотичный, изотактический, атактический, синдиотактический) и т.д. Полимер SCC может представлять собой смесь или купаж двух или более полимеров SCC, причем каждый из отдельных полимеров SCC в смеси может иметь различные конфигурации, различные уровни содержания тяжелых атомов, молекулярные веса, точки плавления и т.д. «Скелет» полимера или главная цепь полимера SCC, к которой присоединяются кристаллизующиеся боковые цепи, может иметь различную конфигурацию, например линейную, разветвленную, поперечно сшитую, дендритную, с одиночной нитью, с двойной нитью и т.д. Предпочтительными полимерами SCC для медицинских целей являются, по существу, рентгеноконтрастные, биосовместимые и/или биорассасывающиеся. Тяжелые атомы могут присоединяться к главной цепи и/или боковым цепям HACSCCP.
Кристаллизующиеся боковые цепи полимеров SCC (включая, например, HACSCCP), предпочтительно, подбирают из условия кристаллизации друг с другом для образования кристаллических участков. Они могут содержать, например, -(СН2)n- и/или -((CH2)m-O-)n группы. Боковые цепи являются, предпочтительно, линейными, для облегчения кристаллизации. Для полимеров SCC, которые содержат группы -(СН2)n- в кристаллизующейся боковой цепи, «n», предпочтительно, соответствует диапазону примерно от 6 до 30, более предпочтительно диапазону от 20 до 30. Для полимеров SCC, которые содержат группы -((CH2)m-O-)n в кристаллизующейся боковой цепи, «n», предпочтительно, соответствует диапазону примерно от 6 до 30, а «m», предпочтительно, соответствует диапазону от 1 до 8. Более предпочтительно «m» и «n» подбирают таким образом, чтобы в группах -((CH2)m-O-)n содержалось примерно от 6 до 30 атомов углерода, даже более предпочтительно примерно от 20 до 30 атомов углерода. Промежуток между боковыми цепями, длину и тип боковой цепи, предпочтительно, подбирают из условия получения итогового полимера SCC с желательной точкой плавления. Например, для медицинских целей (например, эмболотерапии) промежуток между боковыми цепями, длину и тип боковых цепей, предпочтительно, подбирают, чтобы получить полимер SCC (и/или материал, в который он внедрен) с точкой плавления в диапазоне примерно от 30°С до примерно 80°С. По мере увеличения промежутка между боковыми цепями тенденция боковых цепей к кристаллизации снижается. Подобным образом, по мере увеличения гибкости боковых цепей, тенденция боковых цепей к кристаллизации снижается. С другой стороны, по мере увеличения длины боковых цепей тенденция боковых цепей к кристаллизации увеличивается. Во многих случаях длина кристаллизующейся боковой цепи может находиться в диапазоне от примерно двукратного до примерно десятикратного расстояния между кристаллизующимися боковыми цепями полимера SCC.
Примеры полимеров SCC включают варианты следующих полимеров, которые выбраны таким образом, что алкильная группа является достаточно протяженной (например, в ней более 6 атомов углерода), чтобы обеспечить желаемую точку плавления, и, для HACSCCP, модифицирована с включением тяжелых атомов, например, достаточно тяжелых атомов, чтобы обеспечить рентгеноконтрастность: поли(1-алкен)ы, поли(алкил акрилат)ы, поли(алкилметакрилат)ы, поли(алкил винил эфир)ы и поли(алкил стирол)ы. Примеры полимеров SCC дополнительно включают варианты полимеров, описанные в следующих ссылочных материалах, и включают (или модифицированы для обеспечения включения) кристаллизующиеся боковые цепи, и, для HACSCCP, тяжелые атомы, например достаточно тяжелые атомы, чтобы обеспечить ренгеноконтрастность: патенты США №№4638045; 4863735; 5198507; 5469867; 5912225; и 6238687, а также - заявка на временный патент США №60/601526, поданная 13 августа 2004 г.; все они включены целиком и полностью, посредством ссылки, и, в частности, с целью описания полимеров SCC и способов их получения.
В одном варианте осуществления боковые цепи подбирают, чтобы получить полимер SCC (или материал, в который внедрен полимер SCC) с контролируемой температурой плавления. В предпочтительном варианте осуществления полимерные изделия для эмболотерапии включают HACSCCP, выполненные с обеспечением возможности обнаружения изделия для эмболотерапии с помощью такой техники, как рентгеновское излучение. Боковые цепи HACSCCP могут быть подобраны так, чтобы полимерное изделие для эмболотерапии имело более высокую точку плавления, чем температура тела млекопитающего, для которого предназначено данное изделие. Такой полимерный продукт для эмболотерапии может, например, нагреваться выше температуры плавления, чтобы стать более текучим и тем самым облегчить свою подачу к целевой сосудистой системе, где он может остыть и затвердеть, чтобы обеспечить окклюзию сосудистой системы. Использование, по существу, рентгеноконтрастного HACSCCP для обеспечения рентгеноконтрастности и контролируемой температуры плавления может быть особенно полезным в медицинских целях, но для специалистов в данной области техники понятны и другие дополнительные возможности применения. Таким образом, в то время как в настоящем документе различные описания применения полимеров SCC могут указывать на предпочтение для медицинских целей, понятно, что за пределами области медицины использование полимеров SCC и, в частности, HACSCCP может быть полезным для различных технологий.
Более того, в некоторых вариантах осуществления существующие полимеры SCC могут использоваться для разработок различных медицинских устройств. Например, предварительно изготовленные и готовые к поставке устройства, быстро смоделированные устройства, устройства-прототипы в реальном времени, использующие компьютерную технологию. Дополнительно, существующие в настоящее время полимеры могут быть доставлены непосредственно к органу, не имеющему просвета, или не имеющему полости. Различные медицинские устройства могут включать, помимо прочего, стенты и стентовые трансплантаты для сосудистых применений и просветов органов, спицы, винты, нити для наложения швов, средства закрепления и пластины для реконструкции скелетных или мягких тканей, например, в подкожных и внутримышечных тканях.
Вариантом осуществления HACSCCP является полимер, содержащий главную цепь, множество кристаллизующихся боковых цепей и множество тяжелых атомов, присоединенных к полимеру, при этом тяжелые атомы присутствуют в количестве, эффективном для придания полимеру свойства рентгеноконтрастности. Полимер, содержащий повторяющееся структурное звено с формулой (I), является примером такого HACSCCP:
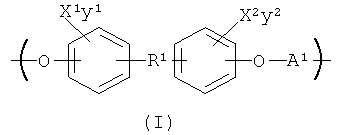
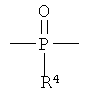
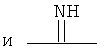
В формуле (I) X1 и X2 каждый независимо выбраны из группы, состоящей из Вr и I; у1 и у2 каждый независимо равны нулю или целому числу в диапазоне от 1 до 4; А выбирают из группы, состоящей из
 ,
, 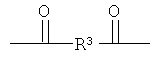 ,
,  ,
, 
 ;
;
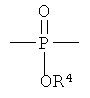
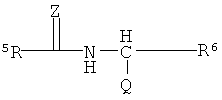
R3 выбирают из группы, состоящей из C1-С30 алкила, C1-С30 гетероалкила, C5-С30 арила, С6-С30 алкиларила и С2-С30 гетероарила; R4 выбирают из группы, состоящей из Н, C1-С30 алкила и C1-С30 гетероалкила; R1 - это
 или
или 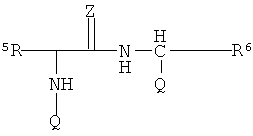
R5 и R6 каждый независимо выбирают из группы, состоящей из -СН=СН-, -CHJ1-CHJ2- и -(СН2)а-; где «а» - нуль или целое число в диапазоне от 1 до 8; J1 и J2 - каждый независимо выбраны из группы, состоящей из Вr и I, a Z - это О или S, а Q - кристаллизующаяся группа, содержащая примерно от 6 до 30 атомов углерода, предпочтительно, примерно от 20 до 30 атомов углерода. В одном варианте осуществления Q представляет собой:
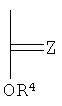
Полимеры с формулой (I) могут быть получены модификацией общих способов, описанных в заявке на временный патент США №60/601526, поданной 13 августа 2004 г., для выбора соответствующей длины боковой цепи, промежутка между боковыми цепями и содержания галогенов.
Понятно, что Q и/или R4 могут содержать кристаллизующиеся боковые цепи, в которых каждый из X, J1 и J2 представляет собой тяжелый атом, а «у» можно отрегулировать так, чтобы количество тяжелых атомов в полимере было достаточным для обеспечения рентгеноконтрастности полимера. Q и R4 могут каждый независимо содержать звенья, выбранные из группы, состоящей из -(СH2)n1- и -((CH2)m1-O-)n1, где ml и n1 каждое независимо выбраны таким образом, что Q и/или R4 каждый независимо содержат примерно от 1 до 30 атомов углерода, предпочтительно от примерно 6 до примерно 30 атомов углерода и, более предпочтительно, от примерно 20 до 30 атомов углерода. Более того, Q и R4 могут включать другие функциональные группы, такие как эфир и амид, и/или тяжелые атомы, такие как йод и бром. Таким образом, не ограничивающие примеры Q и R включают -Cn1H2n1+1, -CO2-Cn1H2n1+1, -CONH-Cn1H2n1+1, -(СН2)n1-Вr, - (CH2)n1-I, - CO2-(CH2)n1-Br, - CO2-(CH2)n1-I, - CONH-CO2-(CH2)n1-Br и -CONH-CO2-(CH2)n1-I. В одном варианте осуществления R5 представляет собой -СН=СН- или -(CH2)a-; R6 представляет собой -(СН2)n- и Q - эфирная группа, содержащая примерно от 10 до 30 атомов углерода.
Понятно, что полимер, который содержит повторяющееся звено формулы (1), может быть сополимером, например полимером с формулой (1), который дополнительно содержит повторяющиеся звенья -R2-A2-, где R2 выбран из группы, состоящей из -(СН2)n2- и -((CH2)m2-O-)n2, где m2 и n2 каждый выбран независимо таким образом, что R2 содержит от 1 до примерно 30 атомов углерода; и где А2 определено таким же самым образом, как и А1 выше. Таким образом, этот вариант осуществления представляет полимер, содержащий повторяющиеся звенья формулы (Iа):
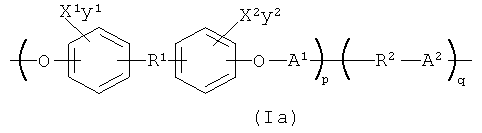
В формуле (1а) X1, Х2, у1, у2, R1 и А1 определены, как описано выше для формулы (I); р и q могут каждое независимо варьироваться в широком диапазоне, чтобы получить полимер с желаемыми свойствами, например температурой плавления, рентгеноконтрастностью и вязкостью, используя обычное экспериментирование. В одном варианте осуществления р и q каждое независимо представляют собой целое число в диапазоне от 1 до примерно 10000. Понятно, что звенья формулы (I) и звенья -R2-A2- в полимере, содержащем повторяющиеся звенья формулы (Iа), могут быть расположены различным образом, например, в форме блоксополимера, нерегулярного сополимера, чередующегося сополимера и т.д.
Еще один вариант HACSCCP (например, полимер, содержащий главную цепь, множество кристаллизующихся боковых цепей и множество тяжелых атомов, присоединенных к полимеру, при этом тяжелые атомы присутствуют в количестве, которое является эффективным для придания полимеру свойства рентгеноконтрастности), содержит повторяющееся звено с формулой (II):
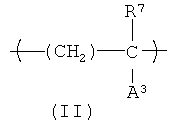
В формуле (II) R2 представляет собой Н или СН3; А3 представляет собой химическую группу с молекулярным весом около 500 или меньше, при этом на А3 приходится, по меньшей мере, один из тяжелых атомов, присоединенный к полимеру. Не ограничивающие примеры А3 включают карбоксилат металла (например, -CO2Cs), сульфонат металла (например, -SO4Ba), галогенированный алкилэфир (например, -СO2-(CH2)b-Br), галогенированный алкиламид (например, -CONH-(CH2)b-Br) и галегенированный ароматический углеводород (например, -С6H4-I), где b - целое число в диапазоне примерно от 1 до 4. В одном варианте осуществления А3 содержит ароматическую группу, содержащую, по меньшей мере, один атом галогена, выбранный из группы, состоящей из брома и йода. В другом варианте осуществления, А3 содержит химическую группу с формулой -L1-(CH2)n3-L2-Ar1, в которой L1 и L2 каждый независимо представляют ничтожное количество (т.е. не присутствие) сложного эфира, простого эфира или амидной группы; n3 представляет собой нуль или целое число в диапазоне примерно от 2 до примерно 20 атомов углерода. HACSCCP, которые содержат повторяющееся звено с формулой (II), могут быть получены полимеризацией соответствующих мономеров или дополнительной реакцией с соответствующими полимерными прекурсорами. HACSCCP, которые содержат повторяющееся звено с формулой (II), могут представлять собой сополимеры, включающие дополнительные повторяющиеся звенья.
Группы А3 в боковой цепи в HACSCCP, содержащем повторяющееся звено с формулой (II), могут быть кристаллизующимися, и/или HACSCCP, содержащий повторяющееся звено с формулой (II), может дополнительно содержать второе повторяющееся звено, которое содержит кристаллизующуюся боковую цепь. Примерами подходящих вторых повторяющихся звеньев могут быть следующие: поли(1-алкен)ы, поли(алкилметакрилат)ы, поли(алкилвинил эфир)ы и поли(алкил стирол)ы. Алкильные группы вышеуказанных примеров вторых повторяющихся звеньев, предпочтительно, содержат более 6 атомов углерода и, более предпочтительно, содержат примерно от 6 до примерно 30 атомов углерода. Например, в одном варианте осуществления второе повторяющееся звено может быть описано формулой (III):
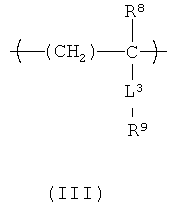
В формуле (III) R8 представляет собой Н или СН3; L3 представляет собой эфирную или амидную связь, а R9 - содержит углеводородную группу от С6 до С30. HACSCCP, содержащие повторяющееся звено с формулой (II) и второе повторяющееся звено (такое как повторяющееся звено с формулой (III)), могут быть получены сополимеризацией соответствующих мономеров и/или дополнительной реакцией с соответствующими полимерными прекурсорами.
Еще один вариант HACSCCP (например, полимера, содержащего главную цепь, множество кристаллизующихся боковых цепей и множество тяжелых атомов, присоединенных к полимеру, при этом тяжелые атомы присутствуют в количестве, эффективном для придания полимеру свойства рентгеноконтрастности) содержит повторяющееся звено с формулой (IV), в которой А3 соответствует приведенному выше определению:
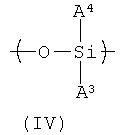
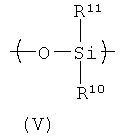
В формуле (IV) А4 представляет собой Н или группу, содержащую примерно от 1 до примерно 30 атомов углерода, например углеводород C1-С30. Группы боковой цепи А3 и/или А4 в HACSCCP, содержащем повторяющееся звено с формулой (IV), могут быть кристаллизующимися, и/или HACSCCP, содержащий повторяющееся звено с формулой (IV), может дополнительно содержать второе повторяющееся звено, которое содержит кристаллизующуюся боковую цепочку. Например, в одном варианте осуществления второе повторяющееся звено может быть описано формулой (V), где R10 содержит углеводородную группу от С6 до С30, а R11 представляет собой Н или группу, содержащую примерно от 1 до примерно 30 атомов углерода, например углеводород C1-С30:
Еще один вариант HACSCCP содержит повторяющееся звено с формулой (VI):
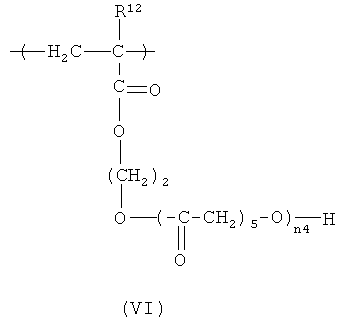
в которой R12 представляет собой Н или СН3, a n4 - целое число в диапазоне примерно от 1 до примерно 1000. В предпочтительных вариантах HACSCCP, содержащий повторяющееся звено с формулой (VI), является биосовместимым. Еще в одном варианте медицинское устройство (например, стент, катетер или другое медицинское устройство, описанное в настоящем документе) содержит полимер, содержащий повторяющееся звено с формулой (VI). Повторяющиеся звенья с формулой (VI) могут быть получены различными способами. Например, может быть представлен исходный полимер, содержащий повторяющиеся звенья гидроксиэтилметакрилата (НЕМА), и, по меньшей мере, часть этих повторяющихся звеньев гидроксиэтилметакрилата (НЕМА) может участвовать в реакции с капролактоном, чтобы получить повторяющиеся звенья с формулой (VIa), где в боковой цепи содержатся кристаллизующиеся поли(капролактоновые) (PCL) группы, как показано ниже на схеме А.
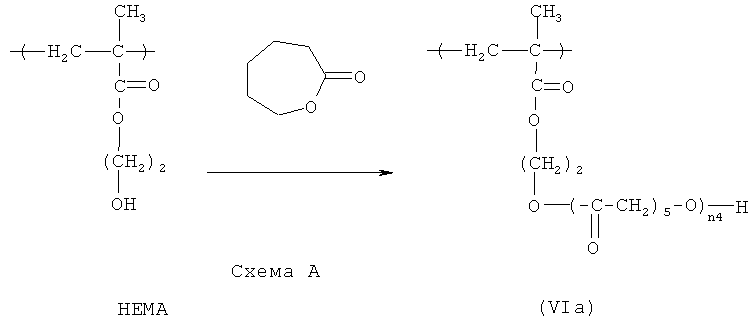
Полимеризация капролактона для получения кристаллизующихся групп PCL может быть проведена с использованием соответствующего катализатора, например, октоата олова. Температуру плавления боковой цепи (и HACSCCP) можно регулировать путем манипулирования степенью полимеризации (n4) групп PCL, например путем регулирования относительных количеств повторяющихся звеньев НЕМА и капролактонового мономера во время полимеризации способом, в общем случае, известным специалистам в данной области техники. Температуру плавления можно также регулировать, изменяя расстояние между группами PCL вдоль полимерного скелета, например путем соответствующего подбора количества повторяющихся звеньев НЕМА в исходном полимере. В одном варианте осуществления, n4 представляет собой целое число в диапазоне примерно от 2 до примерно 10. Тяжелые атомы могут быть включены в HACSCCP, который содержит повторяющееся звено с формулой (VI), разными способами, например HACSCCP может дополнительно содержать повторяющееся звено с формулой (II), в соответствии с приведенным выше описанием.
Полимеры SCC не ограничены описанными выше примерами (например, не ограничены HACSCCP, содержащими повторяющиеся звенья с формулами от (I) до (VI)), и дополнительно включают варианты известных полимеров, которые были модифицированы для того, чтобы включать кристаллизующиеся группы в боковых цепях и/или достаточное количество тяжелых атомов, чтобы придать результирующую рентгеноконтрастность полимеру. Специалистам в данной области техники понятно, что HACSCCP могут быть получены различными способами, например путем обычного экспериментирования для модифицирования известных способов получения полимеров SCC, для внедрения при этом тяжелых атомов в получающиеся полимеры. Например, рентгеноконтрастные, в своей основе, варианты кристаллизующихся полимеров с боковой цепью, описанные в патенте США №5469867, могут быть получены путем сополимеризации соответствующих мономеров с мономерами, содержащими тяжелые атомы. Патент США №5469867 включен посредством ссылки и, в частности, с целью описания мономеров, полимеров и способов полимеризации. Примеры подходящих мономеров, содержащих тяжелые атомы, описаны в Kruft et al. «Изучение рентгеноконтрастных полимерных биоматериалов с потенциальными возможностями применения в качестве эндососудистых протезов», Biomaterials 17 (1996 г.) 1803-1812; и Jayakrishnan et al., «Синтез и полимеризация некоторых йодсодержащих мономеров для биомедицинских применений», J. Appl. Polm. Sci., 44 (1992 г.), 743-748. HACSCCP могут также быть получены при дополнительной реакции, например, путем присоединения тяжелых атомов к полимерам, описанным в патенте США №5469867. Особые примеры полимеров SCC, которые могут быть модифицированы тяжелыми атомами для получения HACSCCP, включают полимеры акрилата, фтороакрилата, метакрилата и винилового эфира, описанные в J. Poly. Sci, 10.3347 (1972); J. Poly. Sci, 10: 1657 (1972); J. Poly. Sci, 9: 3367 (1971); J. Poly. Sci, 9: 3349 (1971); J. Poly. Sci, 9: 1835 (1971); J.A.C.S. 76: 6280 (1954); J. Poly. Sci, 7: 3053 (1969); Polymer J. 17: 991 (1985), соответствующие акриламиды, замещенные акриламидные и малеимидные полимеры (J. Poly. Sci.: Poly. Physics Ed. 11: 2197 (1980); полиолефиновые полимеры, такие как описанные в J. Poly. Sci.: Macromol. Rev. 8: 117-253 (1974) и Macromolecules 13: 12 (1980), полиалкилвинилэфиры, полиалкилэтилен оксиды, такие как описанные в Macromolecules 13: 15 (1980), алкилфосфазеновые полимеры, полиаминокислоты, такие как описанные в Poly. Sci. СССР 21: 241, Macromolecules 18: 2141, полиизоцианиты, такие как описанные в Macromolecules 12: 94 (1979), полиуретаны, полученные при реакции амино- или спиртосодержащих мономеров с длинными цепочками алкиловых изоцианатов, сложных и простых полиэфиров, полисилоксанов и полисиланов, таких как описанные в Macromolecules 19: 611 (1986), и р-алкилстирольных полимеров, таких как описанные в J.A.C.S. 75: 3326 (1953) и J. Ply. Sci. 60: 19 (1962). Вышеперечисленные полимеры SCC могут быть модифицированы тяжелыми атомами, чтобы получить HACSCCP, различными способами. Например, мономеры, содержащие тяжелые атомы, могут быть подготовлены путем йодирования и/или бромирования мономеров, используемых для получения вышеуказанных полимеров. Эти содержащие тяжелые атомы мономеры могут затем подвергаться сополимеризации с немодифицированными мономерами для получения HACSCCP. Специалисты в данной области техники могут идентифицировать условия для получения мономеров, содержащих тяжелые атомы, и соответствующих HACSCCP, путем обычного экспериментирования.
В еще одном варианте осуществления HACSCCP получают путем реакции кристаллизующегося полимера с боковой цепью с реагентом тяжелого металла при условиях, выбранных для присоединения множества тяжелых атомов к кристаллизующемуся полимеру с боковой цепью. Например, кристаллизующийся полимер с боковой цепью может быть подвергнут воздействию реагента тяжелого металла, который содержит бром и/или йод. Примеры реагентов тяжелых металлов включают пары брома, пары йода, раствор брома и раствор йода. Кристаллизующийся полимер с боковой цепью может быть подвергнут воздействию реагента тяжелого металла, например, путем смешивания твердого полимера с реагентом тяжелого металла и/или растворением или диспергированием кристаллизующегося полимера с боковой цепью в растворителе и смешиванием с реагентом тяжелого металла. Можно также использовать и другие способы.
Полимеры SCC могут содержать различные количества тяжелых атомов и/или кристаллизующихся боковых цепей, в зависимости от свойств, которыми, желательно, должен обладать полимер SSC. Предпочтительно содержимого кристаллизующихся боковых цепей достаточно для существенного уменьшения или предотвращения кристаллизации главной цепи. Во многих случаях объем кристаллизующейся боковой цепи в полимере SCC соответствует диапазону от примерно 20% до примерно 80% по весу, исходя из общего веса полимера, а в некоторых случаях он может соответствовать диапазону примерно от 35% до примерно 65%, на той же основе. Длина кристаллизующейся боковой цепи полимера SCC предпочтительно превышает среднее расстояние между кристаллизующимися боковыми цепями, примерно в два - десять раз. Полимеры SCC могут содержать кристаллический участок (например, образованный при кристаллизации боковых цепей при температуре ниже точки плавления полимера) и некристаллический участок (например, стекловидный или эластомерный участок, образованный некристаллизующимися участками полимера SCC). В одном варианте осуществления, некристаллический участок характеризуется более высокой температурой стеклования, чем температура тела млекопитающего, например выше примерно 37°С; в другом варианте осуществления, некристаллический участок характеризуется более низкой температурой стеклования, чем температура тела млекопитающего, например ниже примерно 37°С. Количество тяжелых атомов в конкретном полимере SCC можно подобрать, исходя из желаемой степени рентгеноконтрастности и/или желаемых (механических) свойств материала. Например, для медицинских целей HACSCCP предпочтительно содержит примерно от 1% до примерно 90% тяжелых атомов, более предпочтительно примерно от 20% до примерно 50% тяжелых атомов, по весу, исходя из общего веса HACSCCP. В некоторых случаях полимер SCC внедряют в полимерный материал и/или формируют из него медицинское устройство, как описано ниже. Когда полимер SCC представляет собой HACSCCP, количество тяжелых атомов может быть отрегулировано, для обеспечения желаемой степени ренгеноконтрастности результирующего полимерного материала и/или медицинского устройства.
Беспорядочное внедрение тяжелых атомов в боковую цепь кристаллизующихся полимеров часто мешает или иным образом препятствует кристаллизации кристаллизующихся боковых цепей, особенно, при высоких уровнях внедрения тяжелых атомов, при относительно коротких боковых цепях, и/или при относительно большом расстоянии между боковыми цепями. Предпочтительно тяжелые атомы присоединяют к HACSCCP способом, который сводит к минимуму или исключает помехи для кристаллизации боковой цепи. Например, в одном варианте осуществления, по меньшей мере, около 50%, предпочтительно, по меньшей мере, около 80% тяжелых атомов присоединяют к главной цепи HACSCCP. В еще одном варианте осуществления, по меньшей мере, около 50%, предпочтительно, по меньшей мере, около 80% тяжелых атомов присоединяют к концам боковых цепей HACSCCP, например, к концам кристаллизующихся боковых цепей и/или к некристаллизующимся боковым цепям. В еще одном варианте осуществления, по меньшей мере, около 50%, предпочтительно, по меньшей мере, около 80% тяжелых атомов присоединяют либо к главной цепи, либо к боковым цепям (кристаллизующимся и/или некристаллизующимся) HACSCCP. В еще одном варианте осуществления HACSCCP представляет собой блоксополимер, который содержит кристаллический блок и аморфный блок, и, по меньшей мере, около 50%, предпочтительно, по меньшей мере, около 80% тяжелых атомов присоединены к аморфному блоку.
Молекулярный вес полимеров SCC может быть выбран с учетом предполагаемого применения полимера. Например, в некоторых медицинских применениях, например, для определенных применений в эмболотерапии, желательно, чтобы полимер SCC обладал текучестью при температурах, превышающих точку плавления полимера, и находился в твердом состоянии при температурах ниже точки плавления полимера. Вязкость расплавленного полимера SCC, в основном, увеличивается с увеличением молекулярного веса полимера, таким образом, молекулярный вес конкретного полимера SCC, предпочтительно, подбирают из условия обеспечения желаемой вязкости расплавленного полимера. Например, диапазон подходящих молекулярных весов полимеров SCC, используемых в эмболотерапии, может соответствовать примерно от 2000 до примерно 250000, предпочтительно примерно от 5000 до примерно 150000. Молекулярные веса представляют собой средневзвешенную величину, в соответствии с определением эксклюзионной хроматографии размеров при высоком давлении с использованием обнаружения путем светового рассеяния.
В некоторых случаях может быть желательным смешать или приготовить купаж полимера SCC со вторым материалом (например, вторым полимером), для получения полимерного материала, который можно затем использовать с предполагаемой целью. Например, в одном варианте осуществления представлен полимерный материал, который содержит полимер SCC (например, HACSCCP) и второй полимер. Предпочтительно второй полимер является биосовместимым и/или биорассасывающимся. Примеры второго полимера, пригодного для смешивания с полимерами SCC, для получения полимерных материалов, включают, по существу, не рентгеноконтрастные полимеры, описанные в патенте США №5469867, и рентгеноконтрастные полимеры, описанные в заявке на временный патент США №60/601526, поданной 13 августа 2004 г., оба они включены посредством ссылки. В зависимости от предполагаемого применения относительные количества полимера SCC и второго полимера в полимерном материале могут варьироваться в широком диапазоне. Например, в одном варианте осуществления полимерный материал содержит примерно от 1% до примерно 100% полимера SCC и вплоть до примерно 99% второго полимера по весу, исходя из общего веса. Поскольку полимерный материал может состоять только из полимера SCC, понятно, что термин «полимерный материал», в соответствии с использованием в настоящем документе, включает полимеры SCC (такие как HACSCCP). Как отмечено выше, понятно, что полимер SCC сам по себе может представлять собой смесь или купаж двух или более отдельных полимеров SCC, характеризующихся, например, различными молекулярными весами, конфигурациями или температурами плавления.
Полимерный материал, который содержит полимер SCC, может быть отформован в виде различных конфигураций или заранее заданных форм, например в виде стержня, гранулы или листа. Стержень может быть линейным, спиральным, полым, в значительной степени удлиненным (например, в виде струны или нити) и может иметь различные формы поперечного сечения, например, по существу, круглое, по существу, эллиптическое, по существу, треугольное, по существу, прямоугольное, нерегулярное и т.д. Гранула может быть сферической гранулой, геометрически неоднородной гранулой (например, в форме хлопьев или ломтиков), пористой гранулой, полой гранулой, твердой гранулой и т.д. Гранула, предпочтительно, характеризуется исключаемым диаметром от примерно 10 микрон до примерно 5000 микрон.
Конфигурация полимерного материала может зависеть от различных факторов, таких как предполагаемое применение, ограничения при транспортировке, ограничения при обработке и т.д. Например, в одном варианте осуществления представлено медицинское устройство, содержащее полимерный материал. Полимерный материал может содержать полимер SCC. Неограничивающие примеры медицинских устройств, которые могут содержать полимер SCC, включают, например, стент (например, расширяющийся стент), стентовый имплантат, кольцо для аннулопластики, сосудистый имплантат, лигатуру, сосудистую манжетку, устройство для восстановления дефекта перегородки, сердечный клапан, компонент сердечного клапана, устройство восстановления сердечного клапана, запорное устройство, индуктор сосудистой системы и пролиферации соединительной ткани, катетер (например, баллонный катетер, предназначенный для доставки стента) и/или имплантат, разработанный для тканей. Различные варианты выполнения медицинских устройств далее описаны более подробно. Понятно, что медицинское устройство может состоять только из полимерного материала, который состоит только из полимера SCC. Например, в одном варианте осуществления медицинское устройство выполнено с возможностью его подачи (например, путем инъекции, с помощью катетера, физической вставки, заливки, с помощью нагретого стержня, распылением и/или выдавливанием) в полость органа млекопитающего. Таким устройством может быть, например, препарат для эмболотерапии, изготовленный, главным образом, из полимерного материала, который содержит HACSCCP. Таким образом, хотя определенное описание, приведенное далее, может касаться медицинских устройств, понятно, что такое описание применимо также к полимерным материалам и полимерам SCC (в том числе HACSCCP), если только из контекста не следует иное. Подобным образом, приведенное в настоящем документе описание полимерных материалов и полимеров SCC, также применимо к медицинским устройствам, если только из контекста не следует иное.
Медицинское устройство, которое содержит полимер SCC, может представлять собой медицинское устройство, в котором, по меньшей мере, часть полимера SCC находится на поверхности медицинского устройства. Обнаружено, что такое расположение полимера SCC на поверхности медицинского устройства позволяет манипулировать поверхностными свойствами медицинского прибора, в зависимости от температуры, например, полимер SCC на поверхности может обеспечивать повышенную биосовместимость и/или действовать как зависящее от температуры смазочное вещество и/или обеспечивающий сцепление состав, например, на поверхности сопряжения с одним или более медицинскими устройствами и/или компонентами медицинских устройств. Полимер SCC может быть помещен на поверхность медицинских устройств различными способами. Например, некоторые количества полимера SCC могут быть нанесены на выбранные места поверхности медицинского устройства; полимер SCC может быть нанесен на поверхность медицинского устройства в виде покрытия; пленка из полимера SCC может быть нанесена на медицинское устройство; и/или медицинское устройство может быть выполнено таким образом, что полимер SCC отформован на его поверхности. Например, в одном варианте осуществления рентгеноконтрастные и/или кристаллизующиеся группы могут быть привиты на поверхность полимерного медицинского устройства, например, путем проведения реакции рентгеноконтрастных и/или кристаллизующихся групп с функциональными группами на поверхности и/или путем полимеризации рентгеноконтрастных и/или кристаллизующихся мономеров на участке инициации на поверхности с образованием при этом полимерных рентгеноконтрастных и/или кристаллизующихся групп. Функциональные группы и участки инициации могут быть созданы на поверхности полимерного медицинского устройства различными способами. Например, обработка поверхности полимера ионизирующим излучением (например, пучком электронов и/или гамма-излучением) и/или плазмой в присутствии кислорода может привести к образованию групп -ОН на поверхности полимера. Такие группы -ОН могут затем вступать в реакцию с обработанной изоцианатом рентгеноконтрастной и/или кристаллизующейся группой, для присоединения этих групп к поверхности с образованием уретановых связей. Полимеризация соответствующего мономера, такого как капролактон, может быть инициирована от групп -ОН в присутствии подходящего катализатора (такого как октоат олова), для образования кристаллизующихся групп PCL, которые прикрепляются к поверхности полимера. В качестве еще одного примера обработка поверхности полимера ионизирующим излучением и/или плазмой может обеспечить создание активных участков поверхности, способных инициировать полимеризацию фото- и/или радиационно-чувствительных кристаллизующихся мономеров (1-алкенов, содержащих примерно от 6 до примерно 30 атомов углерода), прививая при этом кристаллизующийся полимер с боковой цепью на поверхность полимерного медицинского устройства. Группа, присоединенная к поверхности, может быть рентгеноконтрастной и/или кристаллизующейся. В одном варианте осуществления полимерное медицинское устройство содержит полимер SCC, присоединенный к его поверхности.
Зависящие от температуры свойства (например, сцепление, смазка и т.д.) конкретного полимера SCC, помещенного на поверхность медицинского устройства, типично зависят от характера поверхности, характера полимера SCC и характера взаимодействий между ними. Например, в некоторых случаях полимеры SCC с относительно небольшим молекулярным весом обладают тенденцией к проявлению лучшего сцепления при температурах выше температуры плавления полимера SCC, по сравнению со свойствами сцепления этих полимеров SCC при температурах ниже температуры плавления. С другой стороны, в некоторых случаях полимеры SCC с относительно большим молекулярным весом обладают тенденцией к проявлению лучшего сцепления при температурах ниже температуры плавления, чем при температурах выше температуры плавления. Относительно неполярные полимеры SCC, способные образовать относительно слабые межмолекулярные взаимодействия, такие как полимеры SCC с высоким содержанием фосфора, проявляют себя как лучшие смазочные вещества, чем относительно полярные полимеры SCC, способные к образованию относительно сильных межмолекулярных взаимодействий, в зависимости от характера поверхности медицинского устройства. Использование конкретного полимера SCC для обеспечения зависимой от температуры функциональности поверхности медицинского устройства, предпочтительно, определяется обычным экспериментированием, с учетом основных принципов адгезии, известных специалистам в данной области техники, в соответствии с руководством, представленным в настоящем документе.
Медицинское устройство, которое содержит полимерный материал, может включать один или более дополнительных компонентов, например пластификатор, наполнитель, агент, образующий ядро кристаллизации, консервант, стабилизатор, агент фотоактивации и т.д., в зависимости от предполагаемого применения. Например, в одном варианте осуществления медицинское устройство содержит эффективное количество, по меньшей мере, одного терапевтического агента и/или агента, усиливающего магнитный резонанс. Неограничивающие примеры предпочтительных терапевтических агентов включают химиотерапевтический агент, нестероидный противовоспалительный, стероидный противовоспалительный и заживляющий раны агент. Терапевтические агенты могут вводиться с полимерным материалом. В предпочтительном варианте осуществления, по меньшей мере, часть терапевтического агента содержится в полимерном материале. В еще одном варианте осуществления, по меньшей мере, часть терапевтического агента содержится в покрытии на поверхности медицинского устройства.
Не ограничивающие примеры предпочтительных химиотерапевтических агентов включают таксаны, таксинины, таксолы, паклитаксел, диоксорубицин, цис-платин, адриамицин и блеомицин. Неограничивающие примеры предпочтительных нестероидных противовоспалительных соединений включают аспирин, дексаметазон, ибупрофен, напроксен и ингибиторы Сох-2 (например, Рофекскоксиб, Целекоксиб и Валдекоксиб). Неограничивающие примеры предпочтительных стероидных противовоспалительных соединений включают дексаметазон, беклометазон, гидрокортизон и преднизон. Могут использоваться смеси, содержащие один или более терапевтических агентов. Не ограничивающие примеры предпочтительных агентов, усиливающих магнитный резонанс, включают соли гадолиния, такие как карбонат гадолиния, оксид гадолиния, хлорид гадолиния и их смеси.
Нуклеирующие агенты представляют собой материалы, которые, в присутствии полимера, обеспечивают более термодинамически благоприятные условия кристаллизации полимера. Например, нуклеирующий агент может ускорять кристаллизацию полимера при заданной температуре и/или вызывать кристаллизацию (например, переохлажденного полимера) при более высокой температуре, чем при отсутствии нуклеирующего агента. Неограничивающие примеры предпочтительных нуклеирующих агентов включают аналоги полимеров SCC с малым молекулярным весом с более высокими пиковыми температурами кристаллизации, чем у кристаллизующегося массива полимера, карбоксилатные соли (такие как бензоат натрия), неорганические соли (такие как сульфат бария) и различные зернистые материалы с относительно высокими отношениями площади поверхности к объему.
Количества дополнительных компонентов, присутствующих в медицинском устройстве, предпочтительно выбирают из условия обеспечения эффективности для предполагаемого применения. Например, терапевтический агент предпочтительно присутствует в медицинском устройстве в количестве, которое является эффективным для обеспечения желаемого терапевтического воздействия на пациента, которому это терапевтическое устройство вводится или имплантируется. Такие количества могут быть определены путем обычного экспериментирования. В определенных вариантах осуществления желательное терапевтическое воздействие заключается в биологической реакции. В одном варианте осуществления терапевтический агент в медицинском устройстве выбирают из условия обеспечения содействия, по меньшей мере, одной биологической реакции, предпочтительно биологической реакции, выбранной из группы, состоящей из тромбоза, присоединения клеток, пролиферации клеток, притяжения клеток зоны воспаления, осаждения протеинов матрицы, ингибирования тромбоза, ингибирования присоединения клеток, ингибирования пролиферации клеток, ингибирования клеток зоны воспаления и ингибирования осаждения протеинов матрицы. Количество агента, усиливающего магнитный резонанс в медицинских устройствах, предпочтительно представляет собой количество, эффективное для облегчения рентгеновской визуализации, и может быть определено путем обычного экспериментирования.
Вязкость и/или точка плавления медицинского устройства, которое содержит полимер SCC, обычно зависит от относительных количеств полимера SCC и прочих компонентов, если таковые имеются, в медицинском устройстве. Вязкость и/или точку плавления медицинского устройства (или полимерного материала в медицинском устройстве) можно контролировать изменением количества полимера SCC в медицинском устройстве и подбором полимера SCC, который обеспечивает получение медицинского устройства с желаемой вязкостью и/или точкой плавления. Так, например, чтобы создать полимерный материал с точкой плавления 40°С, может быть желательным выбрать полимер SCC, у которого точка плавления несколько выше, например, около 45°С, для внедрения в полимерный материал, с целью компенсации присутствия второго полимера или другого компонента, обладающего тенденцией к понижению точки плавления полимера SCC при смешивании с ним. В одном варианте осуществления медицинское устройство содержит полимерный материал с точкой плавления в диапазоне от примерно 30°С до примерно 80°С.
Полимерный материал медицинского устройства, предпочтительно, рассчитан на текучесть при температуре выше точки плавления. Вязкость полимерного материала при температуре выше точки плавления может изменяться в широком диапазоне, в зависимости от таких факторов, как предполагаемое применение. Например, для препаратов, предназначенных для эмболотерапии, полимерный материал, предпочтительно, обладает вязкостью при температуре выше точки плавления, которая позволяет подать медицинское устройство к целевой сосудистой системе с помощью удобных технических приемов, таких как инъекция через шприц и/или протекание через катетер. В таких случаях желаемая вязкость часто зависит от диаметра иглы шприца или катетера, например меньшие вязкости являются обычно предпочтительными при диаметрах меньшей величины. С другой стороны, если вязкость слишком мала, полимерный материал может смещаться от целевой сосудистой системы до остывания и отверждения. В одном варианте осуществления полимерный материал медицинского устройства характеризуется вязкостью в диапазоне от примерно 50 сП до примерно 500 сП при температуре выше точки плавления. Еще в одном варианте осуществления вязкость полимерного материала соответствует диапазону примерно от 500 сП до примерно 5000 сП при температуре выше точки плавления. Еще в одном варианте осуществления, вязкость полимерного материала соответствует диапазону примерно от 5000 сП до примерно 250000 сП при температуре выше точки плавления. Еще в одном варианте осуществления вязкость полимерного материала соответствует диапазону примерно от 250000 сП до примерно 1000000 сП при температуре выше точки плавления.
В одном варианте осуществления полимерный материал выполнен с возможностью образования твердой массы при попадании в полость органа. Твердая масса может полностью или частично соответствовать внутреннему размеру полости органа. Например, полимерный материал может быть выполнен с содержанием количества полимера SCC, которое обеспечивает получение полимерного материала с точкой плавления около 40°С. Полимерный материал может дополнительно быть выполнен с обеспечением возможности его подачи в полость органа, например, полимерный материал может быть в форме стержня, который можно нагреть до расплавленного состояния, чтобы облегчить протекание. Расплавленный полимерный материал можно затем подать в полость органа путем его протекания через устройство подачи в расплавленном состоянии. После поступления в полость органа расплавленный полимерный материал может, по меньшей мере, частично соответствовать внутреннему размеру полости органа, а затем остыть, чтобы образовать твердую массу. В качестве еще одного примера, полимерный материал может быть в форме небольших частиц, взвешенных в биосовместимой жидкости-носителе с относительно малой вязкостью, такой как вода или физиологический раствор. В этом случае может быть обусловлено течение полимерного материала через устройство подачи к целевой полости органа. Небольшие частички полимерного материала могут нагреваться перед подачей, во время подачи и/или внутри целевой полости, что обусловливает протекание полимерного материала и его соответствие внутреннему размеру полости органа. После остывания полимерный материал может образовать твердую массу, которая продолжает соответствовать внутреннему размеру полости органа. Понятно, что полимерные материалы с различными конфигурациями и химическими составами перед нагревом могут отличаться своей способностью соответствовать полости органа, будучи нагретыми, и поэтому могут подбираться, в силу этой причины, чтобы подходить к требованиям лечения. Далее, понятно, что полимерный материал не нужно расплавлять полностью, чтобы обеспечить его подачу. Например, полимерному материалу можно придать конкретную форму, такую как спираль, затем имплантировать в намеченную полость органа, при сохранении предварительно приданной формы. Полимерный материал (например, спираль) можно нагреть перед имплантацией и/или во время нее по различным соображениям, например, чтобы придать спирали большую упругость и, таким образом, облегчить ее подачу, и/или обеспечить возможность спирали лучшим образом соответствовать полости органа, в которую ее имплантируют. Можно также обусловить перетекание полимерного материала снаружи органа и его подачу в полость органа в текучем состоянии.
В варианте осуществления представлен полимерный материал с «памятью формы», содержащий полимер SCC. Например, полимеру SCC может быть придана первая форма, такая как спиральная, в ходе стандартного процесса термопластического формообразования, со сшиванием для фиксирования памяти этой первой формы. Эту спираль из полимера SCC можно затем нагреть, чтобы расплавить полимер SCC, обеспечивая возможность его повторного формообразования с принятием второй формы, такой как стержень. Сшивание ограничивает или предотвращает термопластичную текучесть в расплавленном состоянии полимера SCC. Находясь во второй форме, полимер SCC остывает до температуры, при которой происходит его рекристаллизация. Рекристаллизация полимера SCC ограничивает или предотвращает возврат второй формы (например, стержневой формы) к первой форме (например, спиральной форме). После повторного нагрева до температуры выше точки плавления полимера SCC вторая форма возвращается к первой форме, например, стержень возвращается к своему прежнему, сохраненному в памяти, состоянию в виде спирали. Сшивание полимера SCC может выполняться различными способами, известными специалистам в данной области техники.
Вариант осуществления представляет способ лечения, содержащий введение медицинского устройства, в соответствии с описанием в настоящем документе (например, медицинского устройства, содержащего полимер SCC), в полость органа млекопитающего в количестве, эффективном, по меньшей мере, для частичной окклюзии полости органа. В общем случае такой способ может использоваться для окклюзии любого типа полости органа, в том числе, например, полостей различных органов, которые обычно называют трубками, трубочками, каналами, отверстиями, сосудами, пустотами и протоками. В предпочтительном варианте осуществления медицинское устройство представляет собой препарат для эмболотерапии. Предпочтительно полимер SCC представляет собой HACSCCP. Еще в одном предпочтительном варианте осуществления, полость органа содержит сосудистую систему, например, артериовенозную мальформацию или кровеносный сосуд, такой как варикозная вена. Медицинское устройство можно ввести в полость органа многообразными способами, в том числе инжекцией, катетером или хирургической имплантацией. Для конкретной полости органа медицинское устройство, предпочтительно, подбирают таким образом, чтобы точка плавления полимерного материала была достаточно высокой, и полимер находился в твердом состоянии при нормальной температуре в полости органа, и достаточно низкой для того, чтобы этот размягченный или расплавленный полимерный материал мог соответствовать размеру полости органа при небольшом тепловом повреждении для млекопитающего, в которое он вводится, или при отсутствии такого повреждения. Введение такого полимерного материала в полость органа, таким образом, может включать нагрев полимерного материала до температуры выше точки плавления и/или охлаждение его до температуры ниже точки плавления.
Различные типы устройств подачи могут использоваться для введения медицинского устройства в полость органа, например пластиковые трубки, катетеры, миниатюрные канюли, конические канюли и различные типы шприцев и гиподермических игл, которые, в общем случае, известны и доступны лицам, являющимся профессиональными медиками. Вариант осуществления представляет медицинское оборудование, содержащее полимерный материал и устройство подачи, при этом полимерный материал представляет собой полимер SCC, причем полимерный материал и устройство подачи обладают совместной конфигурацией, облегчающей подачу полимерного материала в полость органа с помощью устройства подачи. Полимерный материал, предпочтительно, содержится внутри устройства подачи в количестве, которое может в некоторой степени варьироваться в зависимости от конкретной окклюдируемой полости органа и от желаемой степени и типа окклюзии. Специалисты в данной области техники осведомлены о размере окклюдируемой полости, на основании размеров пациента, общих знаний анатомии и использования способов диагностики, таких как рентгеновское излучение и магнитно-резонансная томография. Специалисты в данной области техники способны определить, какое количество полимерного материала следует разместить внутри устройства подачи. В общем случае, в устройстве подачи следует поместить избыточное количество полимерного материала, чтобы предусмотреть определенную допустимую погрешность. В варианте осуществления медицинское оборудование содержит препарат для эмболотерапии и трубку, при этом препарат для эмболотерапии содержит полимер SCC, в соответствии с описанием в настоящем документе, а форма трубки облегчает перетекание препарата для эмболотерапии к полости органа. Например, трубка может содержать иглу, канюлю, шприц и/или катетер и может быть оборудована нагревателем, рассчитанным на нагрев препарата для эмболотерапии до температуры выше его точки плавления, например до температуры в диапазоне примерно от 30°С до примерно 80°С. Полимерный материал может быть помещен внутрь устройства подачи в твердом состоянии или может быть отдельно нагрет и помещен в устройство подачи в текучем состоянии. В одном варианте осуществления медицинское устройство может быть предварительно заправлено полимерным материалом, находящимся внутри него, а затем может быть нагрето, чтобы обеспечить текучесть полимерного материала. Нагрев может быть осуществлен от внешнего источника, такого как воздушная, водяная или масляная ванна или электрический нагреватель, причем в каждом случае могут нагреваться и устройство подачи, и полимерный материал. Нагрев может быть осуществлен также и от внутреннего источника, например, при использовании небольшого электрического резистивного элемента на конце катетера, через который пропущен тонкий стержень из твердого полимерного материала, или при использовании небольшого лазера, направленного на кончик стержня из полимерного материала, выступающего из конца катетера.
Устройство подачи может включать экструзионное сопло, предпочтительно, небольшого диаметра, чтобы не нанести серьезных повреждений тканям вокруг окклюдируемой полости органа, но вместе с тем достаточно большого для того, чтобы полимерный материал можно было экструдировать с помощью сопла. Например, в случае применения, связанном с окклюзией протока органа, размер сопла обычно относят к внутреннему диаметру протока, в который оно помещено. Например, игла указателя 24 обычно соответствует отверстию прокола, ведущего к канальцу. 2-миллиметровый катетер обычно подходит для введения полимерного материала в фаллопиевы трубы. 1/4-дюймовая канюля является предпочтительной для введения полимерного материала во внутреннюю полость плечевой кости взрослого человека. При подаче в расплавленном состоянии полимерный материал, предпочтительно, подбирают с вязкостью, которая облегчает его прохождение через экструзионное сопло. В общем случае относительно меньшие вязкости являются предпочтительными для сопел относительно меньшего диаметра.
Понятно, что устройство подачи может включать экструзионное сопло с одним или более подающими отверстиями. Полимерный материал может дозироваться через множество отверстий последовательно или одновременно. Эта методика может обеспечить лучшее тампонирование и/или стабилизацию полимерного материала, который остывает, и может обеспечить возможность подачи большего количества полимерного материала через большую площадь поверхности. Материалы с разнообразными пространственными расположениями и составами могут быть поданы одновременно благодаря использованию различных подающих отверстий.
Например, в варианте осуществления два или более полимерных материалов (каждый из которых содержит полимер SCC) могут быть поданы один за другим в полость органа. В варианте для эмболотерапии первый полимерный материал подают к сосудистой системе. Первый полимерный материал может характеризоваться первой конфигурацией, например, в виде спирали. Спираль может быть с первоначально заданной формой, например спираль с памятью формы, как описано выше, и подаваться в форме стержня (с образованием спирали после подачи), или может представлять собой спираль, формируемую во время подачи путем экструзии полимерного материала через подающее отверстие устройства подачи с головкой соответствующей формы. Первый полимерный материал, предпочтительно, подают при температуре выше его точки плавления, например выше точки плавления первого полимера SCC в первом полимерном материале.
Спираль может иметь относительно открытую структуру, которая частично окклюдирует сосудистую систему, уменьшая кровоток, но не прекращая его полностью. Хотя такая частичная окклюзия может быть соответствующей в некоторых случаях, в других случаях может оказаться желательной дальнейшая окклюзия. Такую дальнейшую окклюзию можно осуществить путем подачи второго полимера в сосудистую систему, в непосредственной близости к первому полимерному материала. Второй полимерный материал, предпочтительно, подают при температуре выше точки плавления, например выше точки плавления второго полимера SCC во втором полимерном материале. Второй полимерный материал, предпочтительно, обладает меньшей вязкостью, чем первый полимерный материал, что позволяет ему, по меньшей мере, частично заполнить пустоты или зазоры в первом полимерном материале и/или между первым полимерным материалом и внутренней поверхностью сосудистой системы. Так, например, второй полимерный материал может иметь консистенцию пасты при температуре выше его точки плавления во время подачи, что позволяет ему заполнить пространства между витками спирали первого полимерного материала.
В это же место, в непосредственной близости к первому и второму полимерным материалам, могут быть поданы один или более дополнительных полимерных материалов. Например, первый и второй полимерные материалы могут только частично окклюдировать сосудистую систему, хотя обычно в большей степени, чем один только первый полимер. В таком случае может оказаться желательным подать третий полимерный материал, чтобы обеспечить дальнейшую окклюзию. Третий полимерный материал, предпочтительно, подают при температуре выше его точки плавления, например выше точки плавления третьего полимера SCC в третьем полимерном материале. Третий полимерный материал, предпочтительно, обладает меньшей вязкостью, чем первый полимерный материал, что позволяет ему, по меньшей мере, частично заполнить пустоты или зазоры в полимерной массе, образованной первым и вторым полимерными материалами и/или между этой массой и внутренней поверхностью сосудистой системы.
Специалистам в данной области техники понятно, что на практике могут использоваться множественные вариации описанных выше вариантов осуществления. Например, единственный полимерный материал может подаваться многочисленными дозами или в различных формах, например в виде спирали при первой подаче и в виде пасты при второй подаче, или в виде пасты при обеих подачах - первой и второй. Два или более полимерных материалов могут подаваться одновременно, например, первый полимерный материал в форме спирали может быть покрыт или смешан со вторым полимерным материалом в виде пасты или жидкости, чтобы образовать композитный материал, содержащий оба полимера, и полученный композитный материал может затем подаваться в полость органа. Конечной целью подачи могут быть полости разнообразных органов, может также варьироваться очередность, в которой подаются различные полимерные материалы и формы. Подача полимерного материала, который содержит полимер SCC, может комбинироваться, последовательно или одновременно, с подачей другого материала, например металлической эмболизирующей спирали. Так, например, полимерный материал можно подавать в полость органа, а металлическую эмболизирующую спираль можно подавать в полость органа в контакте с полимерным материалом. Между подачами могут проходить различные промежутки времени, например полимерный материал в форме спирали можно подать для обеспечения частичной окклюзии полости органа, а второй полимерный материал в виде пасты можно подать в зону, находящуюся в непосредственной близости к спирали, через несколько минут, часов, дней, недель, месяцев или лет.
Для вариантов осуществления, в которых полимерный материал подают в расплавленном состоянии, после того как полимерный материал помещен в устройство подачи и нагрет до состояния текучести, сопло устройства подачи (например, такое как кончик иглы, катетер и/или распыляющее сопло) можно вставить в отверстие канала (или через стенку полости), который должен быть окклюдирован, и полимер можно дозировать из сопла в полость органа. Инжекция, предпочтительно, продолжается, пока не будет достигнута желаемая степень окклюзии (например, блокирование сосудистой системы). В некоторых случаях может оказаться желательным обеспечить окклюзию только части полости. После этого сопло устройства подачи можно извлечь.
После подачи полимерного материала процесс может продолжаться без вмешательства оператора. Например, в случае эмболотерапии кровеносная система млекопитающего обычно оказывает охлаждающее воздействие на окружающие ткани, что приводит к охлаждению инжектированного полимерного материала. Полимерный материал, предпочтительно, подбирают таким образом, что он остывает и отвердевает, потеряв всего лишь незначительное количество энергии, то есть затвердевает после понижения температуры всего лишь на несколько градусов по шкале Цельсия. Обычно на остывание уходит всего лишь несколько секунд или минут, хотя бывают случаи, когда может быть желательным, чтобы остывание происходило медленнее, например, в случае, когда после подачи происходит восстановление кости. После остывания, полимер, предпочтительно, затвердевает внутри полости таким образом, что он соответствует форме полости, при этом происходит, по меньшей мере, частичное или полное перекрытие канала. Полимерный материал может оставаться на месте в полости в течение длительного времени. Для предпочтительных медицинских устройств, содержащих биосовместимые не иммуногенные материалы, свойственна незначительная побочная реакция, или ее может совсем не быть. В определенном варианте осуществления полимер является биорассасывающимся, таким образом, он может уменьшиться с течением времени, в этом случае окружающие ткани могут заполнить окклюдированный ранее участок.
Эффективная окклюзия полости может также быть достигнута путем использования полимерного материала SCC и различных наполнителей. Например, полимерный материал SCC можно подать с (1) светополимеризующимся материалом, в котором происходит сшивание при использовании света; (2) с веществом, вступающим в реакцию с кровью, которое стимулирует коагуляцию, таким как коллаген или тромбин, и/или (3) нуклеирующим агентом.
В варианте осуществления полимерный материал можно легко удалить, чтобы опять обеспечить наличие полости, которая функционирует обычным образом. Например, может быть желательным удалить полимерный материал из семявыносящих протоков или фаллопиевой трубы, чтобы восстановить способность к оплодотворению. Полимерный материал можно удалить различными путями. Например, полимерный материал можно удалить простой механической экстракцией. В определенных случаях такие устройства, как щипцы и/или катетеры с различными присоединенными к ним крючками, можно вставить в канал и использовать для наложения на полимерный материал и вытягивания полимерного материала из полости или проталкивания его вперед, во вторую полость, таким образом, чтобы первая полость больше не была окклюдирована, и полимерный материал не причинял никаких повреждений. Альтернативно такое устройство, как нагретая проволока, может быть приведено в контакт с затвердевшим полимерным материалом. При нагревании полимерного материала нагретой проволокой температура полимерного материала поднимается выше точки его плавления, таким образом, он снова становится текучим. В случае канала (такого как капилляр или вена) нагрев может продолжаться до тех пор, пока текучий полимерный материал не начнет вытекать из канала, и канал снова откроется для выполнения своей обычной функции. При определенных обстоятельствах жидкую пробку можно вытянуть, отсосать или вытолкнуть из канала, например, всасыванием при помощи слабого разрежения или с использованием легкого давления, создаваемого воздухом или физиологическим раствором, и/или путем механического разрушения вместе с захватом и всасыванием.
Предпочтительный способ удаления затвердевшего полимерного материала из канала или другой полости заключается в инжекции липофильного материала, такого как природное масло или эфир жирной кислоты, в канал на участке, окружающем затвердевший полимерный материал. Предпочтительно выбирают липофильный материал, обладающий тенденцией к диффузии в полимерном материале, снижая при этом его температуру плавления. Липофильный материал, предпочтительно, добавляют в количестве, которое является эффективным для снижения температуры плавления полимерного материала до величины, меньшей температуры тела, в такой степени, чтобы полимер стал текучим. Как только полимер становится текучим, естественное механическое движение, происходящее внутри каналов живых существ, стремится переместить полимер из канала, восстанавливая при этом нормальную функцию канала.
В предпочтительном варианте осуществления медицинское устройство содержит стент. Стент может включать различные компоновки, например компоновку, выбранную из группы, состоящей из пластинчатого стента, плетеного стента, саморасширяющегося стента, проволочного стента, деформируемого стента и скользящего и фиксируемого стента.
В предпочтительном варианте осуществления стент содержит, по меньшей мере, два, по существу, не деформируемых элемента, расположенных с образованием трубчатого элемента, при этом не деформируемые элементы взаимно сцеплены с возможностью скольжения, чтобы обеспечить возможность расширения трубчатого элемента от сжатого диаметра до расширенного диаметра. В другом варианте трубчатый элемент содержит серию взаимодействующих с возможностью скольжения радиальных элементов и, по меньшей мере, один фиксирующий механизм, который обеспечивает одностороннее скольжение радиальных элементов от первого сжатого диаметра до второго расширенного диаметра.
Стент на катетере обычно в совокупности называют системой стента. Катетеры включают, помимо прочего, проводниковые катетеры, коаксиальные быстро заменяемые катетеры и Medtronic Zipper Technology, которые представляют собой относительно новую платформу подачи, предусматривающую множественные замены. Такие катетеры могут включать, например, модели, описанные в патентах США №№4, 762, 129; 5, 232, 445; 4, 748, 982; 5, 496, 346; 5, 626, 600; 5, 040, 548; 5, 061, 273; 5, 451, 233 и 5, 749, 888. Дополнительные примеры подходящих конструкций катетеров включают те, которые описаны в патентах США №№4, 762, 129; 5, 092, 877; 5, 108, 416; 5, 197, 987; 5, 232, 445; 5, 300, 085; 5, 445, 646; 5, 496, 275; 5, 545, 135; 5, 545, 138; 5, 549, 556; 5, 755, 708; 5, 769, 868; 5, 800, 393; 5, 836, 965; 5, 989, 280; 6, 019, 785; 6, 036, 715; 5, 242, 399; 5, 158, 548 и 6,007,545. Описания этих вышеперечисленных патентов включены целиком и полностью в настоящий документ посредством ссылки.
Катетеры могут быть специализированными для различных целей, например, чтобы осуществить ультразвуковое воздействие, создать электрическое поле, магнитное поле, световое и/или температурное воздействие. Нагревающие катетеры могут включать, например, такие, которые описаны в патентах США №№5, 151, 100; 5, 230, 349; 6, 447, 508 и 6, 562, 021, а также WO 90/14046 А1. Катетеры с инфракрасным излучением могут включать, например, такие, как описанные в патентах США №№5, 910, 896 и 5, 423, 321. Описания вышеперечисленных патентов и патентных публикаций целиком и полностью включены в настоящий документ посредством ссылки на них.
В еще одном предпочтительном варианте стент дополнительно содержит некоторое количество терапевтического агента (например, фармацевтического агента и/или биологического агента), достаточное для оказания желательного терапевтического воздействия. Термин «фармацевтический агент», в соответствии с использованием в настоящем документе, означает вещество, предназначенное для ослабления, лечения или предотвращения заболевания, которое стимулирует специфическую физиологическую (метаболическую) реакцию. Термин «биологический агент», в соответствии с использованием в настоящем документе, означает вещество, которое обладает структурной и/или функциональной активностью в биологической системе, включая, помимо прочего, орган, ткань или производные на базе клеток, клетки, вирусы, векторы, нуклеиновые кислоты (животные, растительные, микробные и вирусные), которые являются природными и рекомбинантными и синтетическими по происхождению и любой последовательности и размера, антитела, полинуклеотиды, олигонуклеотиды, комплиментарные ДНК, онкогены, протеины, пептиды, аминокислоты, липопротеины, гликопротеины, липиды, карбогидраты, полисахариды, липосомы или прочие клеточные компоненты или органоиды, например рецепторы и лиганды. Дополнительно термин «биологический агент», в соответствии с использованием в настоящем документе, включает вирус, сыворотку, токсин, антитоксин, вакцину, кровь, компонент или производное крови, аллергенный продукт или аналоговый продукт, или сальварсан, или его производные (или любое трехвалентное органическое соединение мышьяка), применимые для предотвращения, лечения или терапии болезней или увечий человека (в соответствии с Разделом 351 (а) Закона о службе общественного здравоохранения (42 U.S.С. 262(а)). Дополнительно термин «биологический агент» может включать 1) «биомолекулу», в соответствии с использованием в настоящем документе, охватывающую биологически активный пептид, протеин, карбогидрат, витамин, липид или нуклеиновую кислоту, полученные и очищенные от естественных или рекомбинантных организмов, антител, тканей или клеточных линий или синтетических аналогов таких молекул; 2) «генетический материал», в соответствии с использованием в настоящем документе, охватывающий нуклеиновую кислоту (либо дезоксирибонуклеиновую кислоту (ДНК), либо рибонуклеиновую кислоту (РНК), генетический элемент, ген, фактор, аллель, оперон, структурный ген, регуляторный ген, ген-оператор, набор генов, геном, генетический код, триплет, антикодон, матричную РНК (мРНК), транспортную РНК (тРНК), рибосомный экстрахромосомный генетический элемент, плазмоген, плазмиду, транспозон, генную мутацию, генную последовательность, экзон, интрон и 3) «обработанные биопрепараты», в соответствии с использованием в настоящем документе, такие как клетки, ткани или органы, которые подвергнуты воздействию. Терапевтический агент может также включать витамины или минеральные вещества или иные природные элементы.
Для устройств, помещенных в сосудистую систему, например стента, количество терапевтического агента, предпочтительно, является достаточным для ингибирования рестеноза или тромбоза или для влияния на некоторое другое состояние стентированной ткани, например, заживления нестабильной бляшки и/или предотвращения разрыва или стимулирования эндотелизации. Агент(ы) может быть выбран из группы, состоящей из антипрофилеративных агентов, противовоспалительных, ингибиторов матричной металлопротеиназы, понижающих уровень липидов, модификаторов холестерола, антитромботических и антиагрегантных агентов, в соответствии с предпочтительными вариантами осуществления настоящего изобретения. В некоторых предпочтительных вариантах выполнения стента терапевтический агент находится внутри стента, поскольку данный агент смешивают с полимером или примешивают другими способами, известными специалистам в данной области техники. В других предпочтительных вариантах выполнения стента терапевтический агент подается из полимерного покрытия на поверхности стента. В другом предпочтительном варианте терапевтический агент подается с помощью средств, не имеющих полимерного покрытия. В других предпочтительных вариантах выполнения стента терапевтический агент подается, по меньшей мере, из одного участка или с одной поверхности стента. Терапевтический агент может быть химически связан с полимером или носителем, используемым для подачи терапевтического агента, по меньшей мере, с одного участка стента, и/или терапевтический агент может быть химически связан с полимером, который содержит, по меньшей мере, одну часть корпуса стента. В одном предпочтительном варианте осуществления может подаваться более одного терапевтического агента.
Предпочтительный полимер SCC, используемый при изготовлении стента, должен удовлетворять, по меньшей мере, некоторым их следующих критериев.
- Рентгеноконтрастность является, предпочтительно, достаточной для обеспечения видимости структуры стента на фоне грудной клетки человека при рентгеновской флуороскопии, стандартной методике, используемой в клинике.
- Стенты, в соответствии с аспектами настоящего изобретения, предпочтительно, выполнены со стенками, для обеспечения небольшого профиля поперечного сечения и отличной продольной гибкости. В предпочтительных вариантах осуществления толщина стенки составляет примерно от 0,0001 дюймов до примерно 0,0250 дюймов и, более предпочтительно, примерно от 0,0010 дюймов до примерно 0,0100 дюймов. Однако толщина стенки зависит, по меньшей мере, частично, от выбранного материала. Например, толщина может быть меньше, чем примерно 0,0060 дюймов для пластмассовых и разрушаемых материалов и может быть меньше, чем примерно 0,0020 дюймов для металлических материалов. Более конкретно, для стентов 3 мм, при использовании пластикового материала, толщина, предпочтительно, соответствует диапазону примерно от 0,0040 дюймов до примерно 0,0045 дюймов. Однако для стентов с различными диаметрами могут использоваться различные толщины для билиарных и прочих периферийных сосудистых применений. Обнаружено, что вышеуказанные диапазоны толщин обеспечивают предпочтительные характеристики в отношении всех аспектов устройства, включая сборку и равертывание. Однако понятно, что вышеупомянутые диапазоны толщин не должны быть ограничивающими по отношению к объему данного изобретения, и что идеи настоящего изобретения могут быть применены к устройствам с размерами, не описанными в настоящем документе.
- Стенты, предпочтительно, являются гемосовместимыми, чтобы предотвратить острые тромбозы. Соответственно, поверхности устройства, предпочтительно, являются устойчивыми к адсорбции протеинов и присоединению тромбоцитов/моноцитов. Более того, поверхности устройства идеально благоприятствуют избыточному росту эндотелия, но препятствуют присоединению и росту клеток гладкой мускулатуры (которые отвечают за образование рестеноза).
- Стенты, предпочтительно, сохраняют свою механическую прочность (например, прочность при сохранении формы дуги) в течение примерно 1-24 месяцев, более предпочтительно, около 3-18 месяцев, более предпочтительно, около 3-12 месяцев и наиболее предпочтительно, около 3-6 месяцев.
Стенты, предпочтительно, характеризуются желательным биологическим разложением и биологическим рассасыванием, таким образом, стенты остаются в полости органа в течение некоторого периода времени, при этом позднее любой стент, биорассасывающийся, или металлический, или иной может, использоваться для повторного лечения примерно того же самого участка кровеносного сосуда или обеспечить возможность осуществления других форм повторного сосудистого вмешательства, такого как шунтирование сосуда.
В одном варианте осуществления содержащее полимер SCC медицинское устройство включает стент и/или катетер, и, таким образом, содержащее полимер SCC медицинское устройство может представлять собой стент или систему стента, содержащую стент и катетер подачи. Полимер SCC может быть внедрен в такое медицинское устройство различными путями. Например, в различных вариантах осуществления корпус стента и/или катетера может содержать или состоять, в основном, из полимера SCC; стент и/или катетер могут быть покрыты полимером SCC;
полимер SCC может находиться на поверхностях сопряжения между частями медицинского устройства, например между стентом и катетером; полимер SCC может представлять собой HACSCCP; и/или полимер SCC может быть помещен на поверхность стента и/или катетера. В вариантах осуществления медицинского устройства полимер SCC является, предпочтительно, биосовместимым, и, предпочтительно, имеет температуру плавления в диапазоне примерно от 30°С до примерно 80°С.
Стент, содержащий полимер SCC, может быть любой конструкции (например, скользящие и фиксируемые стенты, пластинчатые стенты (иногда называемые стентами в виде «рулета с джемом»), деформируемые стенты и саморасширяющиеся стенты), подходящей для заданного применения. Предпочтительно, стент, содержащий полимер SCC, предназначен для простой имплантации в артерию или ткань животного организма, такого как человеческий организм, и обеспечения возможности расширения и/или быть подходящим для удерживания в открытом состоянии артерии, например, после того, как упомянутая артерия была открыта во время медицинской процедуры, такой как ангиопластика. Примеры подходящих конструкций стентов для использования в настоящем изобретении включают «скользящие и фиксируемые» стенты, в том числе те, которые описаны в патентах США №№6, 033, 436; 6, 224, 626 и 6, 623, 521, находящейся на рассмотрении заявке на патент США №11/016, 269, поданной 17 декабря 2004 г., и находящейся на рассмотрении заявке на патент США №11/200, 656, поданной 10 августа 2005 г., все они включены в настоящий документ путем ссылки.
Обращаясь теперь к фиг.1, изображена часть предпочтительного варианта выполнения стента 320, в котором радиальные элементы 320(1), 320(2) взаимно соединены с возможностью скольжения. Каждый радиальный элемент снабжен перемычкой 328 с множеством отводимых зубьев 326. Каждый из зубьев наклонен вверх и выполнен с возможностью отведения вниз (т.е. в радиальном направлении). Поскольку фиксирующие выступы 322, 324 скользят вдоль отводимых зубьев 326, это обусловливает отведение зубьев вниз, чтобы обеспечить возможность выступам 322, 324 проходить над зубьями 326 во время развертывания. Более конкретно, если сжимающее усилие выталкивает радиальные элементы 320(1), 320(2) назад, в сжатое положение, то фиксирующие выступы 322, 324 будут упираться в зубья 326, предотвращая тем самым, дальнейшее относительное перемещение. Все или некоторые из различных элементов (например, элементы 320(1), 320(2), 322, 324, 326, 328) варианта выполнения стента 320 могут содержать или состоять, в основном, из полимера SCC.
Другие подходящие конструкции стента, адаптируемые для использования в соответствии с настоящим документом, включают те, которые традиционно используются в металлических и полимерных стентах, включая различные сетчатые, типа «рулета с джемом», пластинчатые, зигзагообразные и в виде спиральной пружины конструкции, например деформируемые стенты Palmaz, такие как по патенту США №4, 733, 665, и преемственные конструкции, характеризующиеся контролируемым расширением и частью протеза, который деформируется с усилием, превышающим предел упругости. Другие конструкции стентов включают следующие модели и их преемников: патент США №5, 344, 426 на имя Lau, патенты США №№5, 549, 662 и 5, 733, 328 на имя Fordenbacher, патенты США №№5, 735, 872 и 5, 876, 419 на имя Carpenter, патент США №5, 741, 293 на имя Wijay, патент США №5, 984, 963 на имя Ryan, патенты США №№5, 441, 515 и 5, 618, 299 на имя Khosravi, патенты США №№5, 059, 211; 5, 306, 286 и 5, 527,337 на имя Stack, патент США №5, 443, 500 на имя Sigwart, патент США №5, 449, 382 на имя Dayton, патент США №6,409,752 на имя Boatman и тому подобные.
Различными зависящими от температуры свойствами полимера SCC (например, прочность, гибкость, кристалличность, сцепление и т.д.) можно манипулировать, чтобы повысить эксплуатационные характеристики медицинского устройства. Например стент может представлять собой расширяемый стент, например, стент, который спроектирован или выполнен с обеспечением изменяемого размера поперечного сечения, например, размер поперечного сечения может быть увеличен после установки стента внутри кровеносного сосуда, когда расширение является желательным. Стент может быть механически расширяемым термически расширяемым или может представлять собой гибрид стента, расширяемого как механически, так и термически. В варианте осуществления корпус расширяемого стента содержит полимер SCC в количестве, эффективном для обеспечения расширения стента при температуре выше точки плавления полимера SCC. Например, расширяемый стент может быть помещен внутри кровеносного сосуда, расширен при температуре выше точки плавления биосовместимого, по существу, рентгеноконтрастного кристаллизующегося полимера с боковой цепью, затем охлажден (активно или пассивно) до температуры ниже точки плавления. В одном варианте осуществления, по меньшей мере, часть расширяемого стента является расширяемой под действием тепла. Предпочтительно часть, расширяемая под действием тепла, расширяется при температуре выше точки плавления кристаллизующегося полимера с боковой цепью. В варианте осуществления расширяемый стент или его часть содержит полимер SCC в количестве, эффективном для обеспечения возможности стента расширяться при температуре, превышающей температуру тела (около 38°С). Например, стент может состоять, главным образом, из полимера SCC с температурой плавления в диапазоне примерно от 40°С до примерно 80°С. Нагрев такого стента до температуры выше точки плавления повышает гибкость стента, позволяя ему принимать размер и форму, желательную для выполнения соответствующей функции, например обеспечивать опору для кровеносного сосуда. В варианте осуществления до, во время и/или после соответствующего размещения внутри кровеносного сосуда расширяемый стент можно нагреть до температуры выше точки плавления и расширить, например, с помощью баллонного катетера, расположенного внутри стента, способом, в общем случае, известным специалистам в данной области техники. В виде варианта через баллонный катетер может циркулировать нагретая жидкость, чтобы обеспечить нагрев расширяемого стента. После расширения стент можно охладить, например обеспечить его остывание до температуры окружающей крови и/или тканей, и/или за счет циркуляции охлаждающей жидкости через баллонный катетер. После охлаждения ниже температуры рекристаллизации полимера SCC (которая может отличаться от температуры плавления или совпадать с ней), стент становится гораздо более жестким и, таким образом, способным обеспечить желаемую функцию, например поддержку кровеносного сосуда. Количество и тип полимера SCC в стенте можно выбрать, исходя из свойств гибкости в зависимости от температуры, желательных для стента, в соответствии с определением путем обычного экспериментирования.
В варианте осуществления медицинское устройство (содержащее полимер SCC) представляет собой катетер, например устройство с любым из описанных выше конструкций катетеров. Полимер SCC может быть внедрен в такой катетер различными путями, как описано выше. В варианте осуществления, по меньшей мере, часть полимера SCC находится на поверхности катетера. Обнаружено, что такое расположение полимера SCC на поверхности катетера обеспечивает возможность манипулирования поверхностными свойствами катетера, в зависимости от температуры, например полимер SCC может функционировать как зависимое от температуры смазочное вещество и/или состав, обеспечивающий сцепление, как описано выше.
В варианте осуществления медицинское устройство (содержащее полимер SCC) представляет собой систему стента, содержащую стент и катетер. Полимер SCC может быть внедрен в такую систему стента различными путями, например, в корпус стента или на его поверхность, в корпус или на поверхность катетера и/или на поверхность сопряжения между стентом и катетером. Полимер SCC может быть размещен на поверхности сопряжения между двумя медицинскими устройствами различными способами. Например, некоторые количества полимера SCC могут быть нанесены на выбранные места поверхности одного из - стента или катетера - или их обоих; полимер SCC может покрывать одну или обе поверхности стента и катетера; пленка из полимера SCC может быть нанесена на одну или обе поверхности стента и катетера; и/или одна или обе поверхности стента и катетера могут быть изготовлены таким образом, что полимер SCC отформован на поверхности (ях). Способы размещения полимера SCC на поверхности и/или поверхностях сопряжения описаны выше.
В варианте осуществления полимер SCC выполнен с возможностью обеспечения зависимого от температуры сцепления между стентом и катетером. Например, как описано выше, полимер SCC можно выбрать из условия обеспечения большего сцепления при температурах выше точки плавления полимера SCC. Такой полимер SCC может быть обеспечен на поверхностях сопряжения стента и катетера и нагрет до температуры выше точки плавления, что приводит к усилению сцепления между стентом и катетером. Затем стент может быть установлен в желаемое место внутри сосудистой системы. Во время такого размещения свойства сцепления полимера SCC, желательно, уменьшают или предотвращают проскальзывание между стентом и катетером. После расширения стента полимеру SCC можно дать возможность остыть (и/или активно охладить его при циркуляции жидкости через катетер) до температуры ниже точки плавления полимера SCC. После такого охлаждения характер сцепления, обеспечиваемого полимером SCC, ослабевает, что обеспечивает возможность точного извлечения катетера из его местоположения в непосредственного близости к стенту, без нежелательного смещения стента. В других вариантах осуществления полимер SCC подбирают таким образом, чтобы обеспечить большее сцепление при температурах ниже точки плавления полимера SCC. В таких вариантах осуществления стент, предпочтительно, устанавливают при температуре ниже точки плавления полимера SCC, когда сцепление сильнее (для полимера SCC по этому варианту осуществления), расширяют до желаемого диаметра внутри сосудистой системы, затем нагревают, чтобы уменьшить сцепление между стентом и катетером, тем самым облегчая отсоединение и извлечение катетера, при сведении к минимуму нежелательного смещения стента. Таким образом, в некоторых вариантах осуществления полимер SCC нагревают, чтобы усилить сцепление, и/или охлаждают, чтобы уменьшить сцепление; в других вариантах осуществления полимер SCC охлаждают, чтобы усилить сцепление, и/или нагревают чтобы уменьшить сцепление. Предпочтительно, полимер SCC представляет собой HACSCCP.
В еще одном варианте осуществления медицинское устройство сформировано в живом организме путем введения полимерного материала в полость органа с последующим формированием канала в полимерном материале. Например, стент может быть сформирован путем введения полимерного материала (содержащего полимер SCC) в кровеносный сосуд таким способом, который схож с описанным выше, для эмболизации, после чего в полимерном материале формируют канал. Предпочтительно, полимер SCC представляет собой HACSCCP. Канал, предпочтительно, выполняют коаксиально кровеносному сосуду, таким образом, кровь может протекать через канал. Канал может быть сформирован различными способами. Например, в одном варианте осуществления полимерный материал формуют вокруг цилиндрической формы. Полимер SCC в полимерном материале подбирают таким образом, чтобы сцепление между формой и полимерным материалом было больше при температурах ниже точки плавления полимера SCC. Форму и полимерный материал затем вставляют в сосудистую систему и размещают так, чтобы, по меньшей мере, частично окклюдировать кровеносный сосуд. Затем форму нагревают до температуры немного выше точки плавления полимерного материала, тем самым уменьшая сцепление между полимерным материалом и формой. После этого форму извлекают, оставляя после нее цилиндрическое отверстие в полимерном материале. Извлечение формы без нежелательного сдвига полимерного материала облегчается зависимыми от температуры свойствами сцепления полимера SCC. Можно также использовать и другие способы для образования каналов в полимерном материале, например использовать формы другой конфигурации и/или нагревать часть полимерного материала до температуры выше точки плавления полимера SCC или полимерного материала. Размер, форму, количество и конфигурацию каналов можно контролировать различными способами. Например, тепловая энергия может быть приложена на различных уровнях и в различных формах, например, с помощью лазера и/или при вставке в полимерный материал нагретых приспособлений (таких как нагретая проволока).
ПРИМЕР 1
В каучуковую колбу, оснащенную термометром, мешалкой и обратным конденсатором, добавляют 500 граммов (г) октаметилциклотетрасилоксана, 250 г октафенилциклотетрасилоксана и 250 г окта(йодофенил)циклотетрасилоксана, мономера, несущего тяжелый атом. Колбу с содержимым нагревают до 150°С и добавляют 0,11 г смеси калия гидроксида-изопропанола (нейтральный эквивалент =193,5) (отношение Si:K примерно 4470:1). Раствор перемешивают примерно в течение 30 минут. После того, как раствор становится слишком вязким для его эффективного перемешивания (из-за образования полимера), полимер нагревают приблизительно до 165°С в течение 3-4 часов, затем охлаждают до комнатной температуры. Получившийся при этом полимер представляет собой HACSCCP, содержащий повторяющиеся звенья с формулой (IV), в которой А3 и А4 представляют собой йодированные фенильные группы, повторяющиеся звенья с формулой (V) в которых R10 и R11 представляют собой фенильные группы, и диметилсилоксановые повторяющиеся звенья.
ПРИМЕР 2
В каучуковую колбу, оснащенную термометром, мешалкой и обратным конденсатором, в которой содержится 250 г ксилена, перемешанного при температуре около 135°С, добавляют раствор из 20 г 4-йодостирола, 60 г докосанила акрилата и 11 г ди-терт-бутила пероксида в течение приблизительно 3 часов. После завершения добавления смесь продолжают перемешивать примерно еще 3 часа, чтобы достичь более полной конверсии, затем охлаждают до комнатной температуры. Полученный в результате полимер представляет собой HACSCCP, содержащий повторяющиеся звенья с формулой (II), в которой R7 и R8 представляют собой Н, А3 - это С6Н4-I, и повторяющиеся звенья с формулой (III), в которой L3 представляет собой эфирную связь, а R9 содержит углеводородную группу С22.
ПРИМЕР 3
В колбу с закругленным дном и 2-горлышками емкостью 500 мл, оснащенную механической мешалкой и резиновой перегородкой, добавляют 30 г мономера с формулой (VII) (12DТ-докосанил) и 240 мл метилена хлорида. Твердые вещества растворяют путем перемешивания. Около 4,34 г трифосгена, растворенного в 30 мл метилена хлорида, набирают в герметичный шприц и добавляют к реактивной емкости с помощью шприцевого насоса с постоянной скоростью в течение примерно 2-3 часов. Полученный вязкий раствор полимера разбавляют, добавляя примерно 150 мл тетрагидрофурана и 10 мл воды. Полимер изолируют преципитацией раствора полимера в изопропаноле, фильтрацией полученного твердого вещества и сушкой в вакууме. Полимер представляет собой HACSCCP, содержащий повторяющееся звено с формулой (I), в которой X1 - это I, у1 - 2, у2 - 0, А' это -(С=О)-,
R5 - это -СН2СН2-, R6 - это -СН2-, a Q - кристаллизующаяся эфирная группа, содержащая 23 атома углерода.
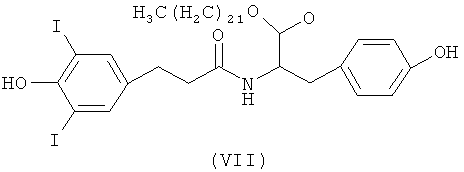
ПРИМЕР 4
Эмболизация проводится следующим образом: HACSCCP, приготовленный, как описано в примере 3, формируют в виде эмболизирующего медицинского устройства в виде стержня и загружают в нагретый катетер. Врач подает катетер в артериовенозную фистулу (AVF), которая должна быть эмболизирована. С помощью флуороскопии выполняют базовую ангиограмму, чтобы лучше определить участок эмболизации. Стержень из эмболизирующего агента HACSCCP проталкивают через катетер к намеченному участку. Локализованный нагрев в катетере приводит к расплавлению HACSCCP, что обеспечивает его протекание через катетер и к намеченному участку в виде жидкости, что соответствует AVF и эмболизирует ткань. HACSCCP остывает и рекристаллизуется на намеченном участке. Подача HACSCCP продолжается до тех пор, пока на намеченном участке не прекратится кровоток. Прекращение кровотока подтверждается инжекцией контрастного агента и просмотром с помощью флуороскопии. HACSCCP при флуороскопии является видимым. Катетер охлаждают, чтобы остановить истечение не нужного более HACSCCP. Катетер далее извлекают.
ПРИМЕР 5
Эмболизацию выполняют в соответствии с описанием в Примере 4, за исключением того, что используется HACSCCP с более высокой вязкостью, и HACSCCP поставляют к артерии для лечения аневризмы. При этом обеспечивается эмболизация.
ПРИМЕР 6
Эмболизация артерии с травматическим кровотечением выполняется, в основном, как описано в Примере 4, за исключением того, что перед подачей HACSCCP формируют в виде спирали и сшивают с помощью инфракрасного излучения, тем самым получая спираль с памятью формы. Во время нагрева спираль с памятью формы размягчается и образует гибкий стержень, который подают к артерии через катетер. После подачи, гибкий стержень охлаждается и восстанавливает спиральную форму внутри артерии, тем самым, уменьшая кровоток.
ПРИМЕР 7
В реактор емкостью один литр загружают 90 граммов йодстирола и 10 граммов гидрокси этилметакрилата (НЕМА). Добавляют примерно 200 мл толуола (растворитель) и осторожно продувают реактор аргоном. Затем добавляют 0,5 молярных процента азобисизобутиронитрила (AIBN, инициатор полимеризации) и проводят реакцию при 70°С в течение примерно 24 часов. Состав полученного сополимера йодстирола и НЕМА подтверждается ядерной магнитно-резонансной спектроскопией (ЯМР-спектроскопией). Затем добавляют 30 граммов капролактона. Для азеотропического дегидратирования реакционной системы примерно 10% толуола удаляют дистилляцией, а затем добавляют 100 частей на миллион катализатора - октоата олова. Температура повышается до 100°С, и капролактон полимеризуется путем прививания подвешенных гидроксильных групп сополимера йодостирола/НЕМА. Полученный HACSCCP коагулируют в спирте и высушивают. HACSCCP содержит около 23% (NMR) поликристаллического поликапролактона (PCL)
в форме кристаллизующихся боковых цепей PCL. Собственная вязкость HACSCCP составляет более 1,0 в толуоле при 30°С, указывая на относительно большой молекулярный вес.
ПРИМЕР 8
Ряд материалов HACSCCP приготавливают способом, сходным с описанным в примере 7, за исключением того, что относительные количества НЕМА и йодостирола варьируют, вместе с молекулярными весами «скелета» и боковых цепей PCL. Ряд полимеров HACSCCP характеризуется диапазоном точек плавления, в зависимости от протяженности и расстояния между кристаллизующимися боковыми цепями PCL (более протяженные цепи и/или более близкие расстояния между ними приводят к получению более высоких точек плавления, например, вплоть до примерно 60°С). Ряд полимеров HACSCCP также характеризуется диапазоном радиоконтрастности, в зависимости от количества повторяющихся звеньев йодостирола, внедренных в HACSCCP.
Специалистам в данной области техники понятно, что в материалах и способах, описанных выше, могут быть предусмотрены различные исключения и модификации, не выходя за рамки объема данного изобретения, и все такие модификации и изменения подразумеваются соответствующими объему данного изобретения, в соответствии с его определением прилагаемой формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПОЛИМЕРЫ С КРИСТАЛЛИЗУЮЩИМИСЯ БОКОВЫМИ ЦЕПЯМИ ДЛЯ МЕДИЦИНСКОГО ПРИМЕНЕНИЯ | 2005 |
|
RU2383558C2 |
| САМОРАССАСЫВАЮЩИЕСЯ РЕНТГЕНОКОНТРАСТНЫЕ ПО СВОЕЙ ПРИРОДЕ ПОЛИМЕРЫ ДЛЯ МНОГОЦЕЛЕВОГО ИСПОЛЬЗОВАНИЯ | 2005 |
|
RU2396289C2 |
| ПОЛИМЕРНЫЕ ПО СУЩЕСТВУ РЕНТГЕНОКОНТРАСТНЫЕ ПРОДУКТЫ ДЛЯ ЭМБОЛОТЕРАПИИ | 2004 |
|
RU2373958C2 |
| СТЕНТ | 2007 |
|
RU2432183C9 |
| N-ЗАМЕЩЕННЫЕ МОНОМЕРЫ И ПОЛИМЕРЫ | 2007 |
|
RU2470040C2 |
| Катетерный баллон | 2011 |
|
RU2633723C2 |
| ЛОКАЛЬНАЯ СОСУДИСТАЯ ДОСТАВКА ИНГИБИТОРОВ mTOR В СОЧЕТАНИИ СО СТИМУЛЯТОРАМИ РЕЦЕПТОРА, АКТИВИРУЕМОГО ПРОЛИФЕРАТОРАМИ ПЕРОКСИСОМ | 2008 |
|
RU2510654C2 |
| СМЕСИ БУТИЛЬНЫХ ИОНОМЕРОВ | 2015 |
|
RU2700611C2 |
| БИОРАЗЛАГАЮЩИЕСЯ ПОЛИМЕРЫ, СПОСОБНЫЕ К ВОССТАНОВЛЕНИЮ ФОРМЫ | 1999 |
|
RU2215542C2 |
| ЛОКАЛЬНАЯ СОСУДИСТАЯ ДОСТАВКА ПРОБУКОЛА, ОДНОГО ИЛИ В КОМБИНАЦИИ С СИРОЛИМУСОМ, ДЛЯ ЛЕЧЕНИЯ РЕСТЕНОЗА, УЯЗВИМЫХ БЛЯШЕК, ААА (АНЕВРИЗМЫ БРЮШНОЙ АОРТЫ) И ИНСУЛЬТА | 2008 |
|
RU2481084C2 |
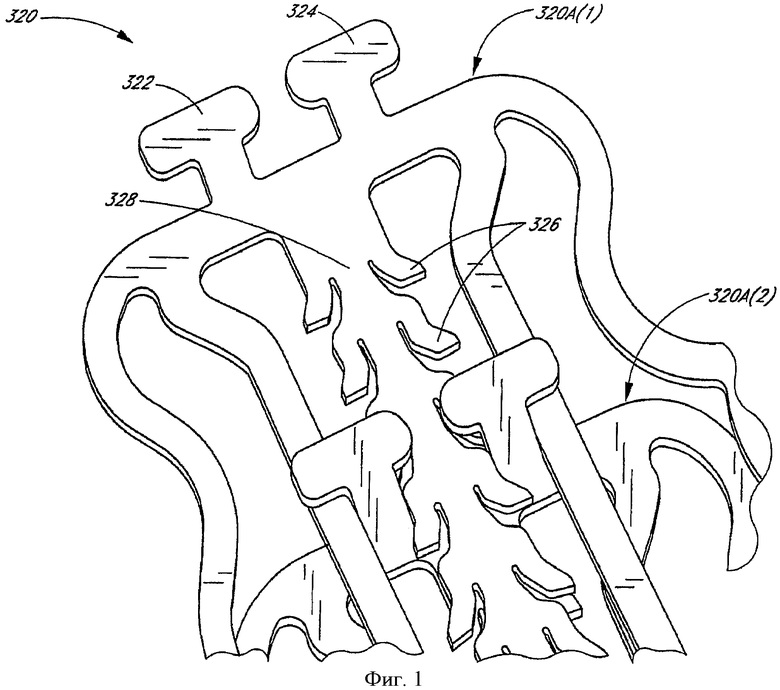
Изобретение относится к медицине. Описаны кристаллизующиеся полимеры с боковой цепью (SSC), которые пригодны для разнообразных медицинских целей. В определенных случаях применения кристаллизующиеся полимеры с боковой цепью, содержащие тяжелые атомы (HACSCCP), являются особенно пригодными. Примером HACSCCP является полимер, который содержит основную цепь, множество кристаллизующихся боковых цепей и множество тяжелых атомов, присоединенных к полимеру. В определенных конфигурациях тяжелые атомы присутствуют в количестве, которое является эффективным для придания полимеру свойства рентгеноконтрастности. Полимерный материал, включающий HACSCCP, может использоваться для изготовления медицинского устройства, пригодного, по меньшей мере, для частичного смыкания полости органа. Медицинским устройством может быть изделие для эмболотерапии. Полимерный материал, включающий полимер SCC, может также использоваться для изготовления других медицинских устройств, таких как стенты. 5 н. и 20 з.п. ф-лы, 1 ил., 8 пр.
1. Полимер, содержащий:
главную цепь;
множество кристаллизующихся боковых цепей; и множество тяжелых атомов, присоединенных к полимеру, при этом тяжелые атомы присутствуют в количестве, эффективном для придания полимеру рентгеноконтрастности;
при этом полимер содержит повторяющееся звено с формулой (VI)
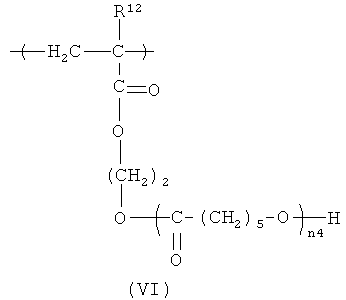
где R12 представляет собой Н или СН3, а n4 - целое число в диапазоне примерно от 1 до примерно 1000.
2. Полимер по п.1, в котором n4 - целое число в диапазоне примерно от 2 до примерно 10.
3. Полимер по п.1, дополнительно содержащий повторяющееся звено с формулой (II)
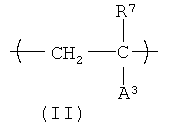
в котором R7 представляет собой Н или СН3; А3 - химическая группа с молекулярным весом около 500 или менее; при этом А3 включает, по меньшей мере, один из тяжелых атомов, присоединенных к полимеру.
4. Полимер по п.1, который является биосовместимым.
5. Медицинское устройство, содержащее полимер по пп.1-4.
6. Медицинское устройство по п.5, содержащее стент.
7. Стент, содержащий полимер по п.1, при этом стент выбран из группы, состоящей из пластинчатого стента, плетеного стента, саморасширяющегося стента, проволочного стента, деформируемого стента и скользящего и фиксируемого стента.
8. Стент по п.7, в котором кристаллизующийся полимер с боковой цепью является рентгеноконтрастным.
9. Стент по п.7, в котором кристаллизующийся полимер с боковой цепью содержит тяжелые атомы.
10. Стент по п.7, в котором кристаллизующийся полимер с боковой цепью является биосовместимым.
11. Стент по п.7, при этом стент представляет собой расширяющийся стент.
12. Стент по п.11, в котором, по меньшей мере, часть расширяющегося стента является расширяющейся в зависимости от температуры или расширяющейся под действием тепла.
13. Стент по п.12, в котором расширяющаяся под действием тепла часть является расширяющейся при температуре выше точки плавления кристаллизующегося полимера с боковой цепью.
14. Стент по п.13, в котором точка плавления соответствует диапазону примерно от 30°С до примерно 80°С.
15. Стент по п.11, в котором, по меньшей мере, часть кристаллизующегося полимера с боковой цепью находится на поверхности расширяющегося стента.
16. Стент по п.11, в котором кристаллизующийся полимер с боковой цепью обеспечивает адгезионное сцепление между расширяющимся стентом и катетером.
17. Стент по п.11, в котором адгезионное сцепление является разъемным при нагреве или охлаждении.
18. Стент по п.11, в котором кристаллизующийся полимер с боковой цепью обеспечивает смазку между расширяющимся стентом и катетером.
19. Способ лечения млекоптающего, включающий:
введение медицинского устройства по п.5 в полость органа млекопитающего в количестве, эффективном, по меньшей мере, для частичной окклюзии полости органа, и формирование канала, проходящего сквозь медицинское устройство;
при этом медицинское устройство содержит полимерный материал.
20. Способ по п.19, в котором полимерный материал вводят в полость органа при наличии формы.
21. Способ по п.20, в котором формирование канала включает удаление формы из полости органа.
22. Способ по п.19, в котором полимерный материал является рентгеноконтрастным.
23. Способ по п.19, в котором полимерный материал является биосовместимым.
24. Способ по п.19, в котором медицинское устройство содержит стент.
25. Способ изготовления полимера по пп.1-4, включающий:
предоставление полимера, который содержит повторяющиеся звенья гидроксиэтилметакрилата; и
проведение реакции, по меньшей мере, части звеньев гидроксиэтилметакрилата с капролактоном.
| Дорожная спиртовая кухня | 1918 |
|
SU98A1 |
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| ИОДСОДЕРЖАЩИЕ ДЕНДРИМЕРНЫЕ ПОЛИМЕРЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ДИАГНОСТИЧЕСКОЕ СРЕДСТВО ДЛЯ РЕНТГЕНОДИАГНОСТИКИ | 1994 |
|
RU2147592C1 |
Авторы
Даты
2012-03-27—Публикация
2007-01-16—Подача