УРОВЕНЬ ТЕХНИКИ
1. Область техники, к которой относится изобретение
Настоящее изобретение относится к поддерживающим ткани медицинским устройствам и более конкретно к расширяемым неизвлекаемым устройствам, которые имплантируют внутрь просветов трубчатых органов тела живого животного или человека для поддерживания органа и сохранения его в раскрытом состоянии и которые имеют отверстия для доставки многообразных благотворно действующих средств к месту медицинского вмешательства, а также поверхностное покрытие из антитромботического препарата. Настоящее изобретение также относится к способу маскирования и демаскирования для стимулирования адгезии матриц из терапевтического препарата и полимера к стенкам, формирующим отверстия в медицинском устройстве.
2. Обсуждение прототипа
В прошлом для поддерживания проходного отверстия в раскрытом состоянии были разработаны постоянные или биоразлагаемые устройства для имплантации внутри проходного отверстия в организме. Эти устройства обычно вводят подкожно и транслюминально продвигают до размещения в желательном местоположении. Эти устройства затем либо расширяют механически, например расширением оправки или баллона, размещенного внутри устройства, или же они расширяются сами за счет высвобождения запасенной энергии при приведении в действие внутри организма. Будучи расширенными внутри просвета, эти устройства, называемые стентами, оказываются заключенными внутри ткани организма и становятся постоянным имплантатом.
Известные конструкции стентов включают спиральные стенты из монофиламентной проволоки (патент США № 4969458); сварные металлические сетчатые трубки (патенты США №№ 4733665 и 4776337); и, наиболее известные, тонкостенные металлические цилиндры с протяженными в осевом направлении щелями, сформированными вдоль окружности (патенты США №№ 4733665, 4739762 и 4776337). Известные конструкционные материалы для использования в стентах включают полимеры, органические тканые материалы и биосовместимые металлы, такие как нержавеющая сталь, золото, серебро, тантал, титан, и сплавы с эффектом памяти формы, такие как никелид титана.
Патент Соединенных Штатов № 6241762, который приведен здесь для сведения, представляет конструкцию непризматического стента, которая устраняет несколько эксплуатационных недостатков предшествующих стентов. В дополнение, предпочтительные варианты исполнения, раскрытые в этом патенте, представляют стент с крупными, недеформируемыми продольными и соединительными элементами, которые могут содержать отверстия без ущерба механическим характеристикам продольных или соединительных элементов или всего устройства в целом. Далее, эти отверстия могут служить в качестве крупных, защищенных резервуаров для доставки разнообразных благотворно действующих средств к месту имплантации устройства без необходимости поверхностного покрытия на стенте.
Из многих проблем, которые могут быть разрешены с помощью основанной на стентах адресной доставки благотворно действующих препаратов, одной из важнейших является рестеноз. Рестеноз представляет собой наиболее существенное осложнение, которое может возникать вследствие васкулярных интервенций, таких ангиопластика и имплантация стентов. Проще говоря, рестеноз представляет собой процесс заживления раны, который сокращает диаметр просвета сосуда в результате отложения внеклеточного матрикса и пролиферации клеток гладкой мышечной ткани сосудов и который в конечном итоге приводит к повторному сужению или даже повторной окклюзии просвета. Несмотря на внедрение усовершенствованных хирургических методов, устройств и фармацевтических препаратов общий уровень частоты рестеноза для стентов из обнаженного металла по-прежнему регистрируют в интервале от приблизительно двадцати пяти процентов до приблизительно пятидесяти процентов в течение периода времени от шести до двадцати месяцев после проведения ангиопластики. Для лечения этого состояния зачастую требуются дополнительные процедуры повторной васкуляризации, тем самым усиливая травмирование и риски пациента.
Многообещающие результаты в подавлении рестеноза показали традиционные стенты с поверхностными покрытиями из разнообразных благотворно действующих средств. Например, патент Соединенных Штатов № 5716981 раскрывает стент, который имеет поверхностное покрытие из композиции, включающей полимерный носитель и паклитаксель. Патент представляет подробные описания способов нанесения покрытий на поверхности стента, такие как набрызгивание и погружение, а также желательный характер самого покрытия: следует «покрывать стент гладко и равномерно» и «обеспечивать равномерное, прогнозируемое, продолжительное высвобождение антиангиогенного фактора». Однако поверхностные покрытия в реальности могут слабо регулировать кинетические характеристики выделения благотворно действующих средств. Эти покрытия непременно должны быть очень тонкими, типично с толщиной от пяти до восьми микрон (5-8 мкм). По сравнению с этим площадь поверхности стента очень велика, так что весь объем благотворно действующего средства в целом имеет очень короткий диффузионный пробег для перехода в окружающую ткань. Полученный суммарный профиль высвобождения лекарственного средства скорее характеризуется резким начальным выбросом, с последующим быстрым достижением асимптотического уровня, нежели «равномерным, продолжительным выделением», или линейным характером высвобождения.
Увеличение толщины поверхностного покрытия оказывает благоприятное действие, которое проявляется в улучшении кинетических параметров высвобождения лекарственного препарата, в том числе в способности лучше контролировать выделение лекарственного средства и в возможности повышения дозировки лекарственного средства. Однако увеличенная толщина покрытия приводит к возрастанию общей толщины стенки стента. Это нежелательно по многим соображениям, в том числе ввиду повышенного риска травмирования просвета сосуда во время имплантации, сокращения поперечного сечения потока в просвете трубчатого органа после имплантации и повышенной уязвимости покрытия к механическому нарушению или повреждению во время расширения и имплантации. Толщина покрытия является одним из нескольких факторов, которые оказывают влияние на кинетические характеристики высвобождения благотворно действующего средства, и тем самым ограничения по толщине сужают диапазон скоростей высвобождения, продолжительности такового и тому подобных, каковые могут быть достигнуты.
Поверхностные покрытия могут также ограничивать доставку комбинаций из нескольких лекарственных средств из стента. Например, если из поверхностного покрытия должны были выделяться комбинации нескольких лекарственных препаратов, то скорости высвобождения, периоды продолжительности выделения и прочие характеристики выделения нельзя простым путем контролировать по отдельности. Однако рестеноз включает множественные биологические процессы и может излечиваться более эффективно с использованием комбинации лекарственных препаратов, выбранных для воздействия на эти различные биологические процессы.
Статья авторов Chao-Wei Hwang et al., озаглавленная «Движущие силы физиологического транспорта, обусловливающие распределение лекарственных средств при доставке с использованием стентов», раскрывает важную взаимосвязь между пространственными и временными параметрами распределения лекарственных препаратов с выделяющих лекарственное средство стентов и механизмы внутриклеточного транспорта лекарственных препаратов. В поиске путей улучшения механической работоспособности и структурных характеристик конструкции стентов развивались до более сложных геометрических форм с присущей таковым неоднородностью распределения в окружном и продольном направлениях аксиальных элементов (продолин) стента. Примерами этой тенденции являются типичные имеющиеся в продаже на рынке стенты, которые расширяются с образованием примерно ромбической или многоугольной конфигурации, будучи используемыми в просвете трубчатых органов тела. Оба типа были использованы для доставки благотворно действующего средства в форме поверхностного покрытия. Исследования показали, что трубчатые части тканей, непосредственно соседствующие с продольными и поперечными элементами, получают лекарственные препараты с гораздо более высокими концентрациями, чем более отдаленные части ткани, такие как расположенные в средней части продольно протяженных ячеек с «ромбовидной» формой. Существенно то, что этот градиент концентрации лекарственного средства внутри стенки просвета трубчатого органа остается более высоким с течением времени для гидрофобных благотворно действующих средств, таких как паклитаксель или рапамицин, которые до настоящего времени зарекомендовали себя как наиболее эффективные препараты против рестеноза. Поскольку локальные концентрации и градиенты лекарственных препаратов неразрывно связаны с биологическими эффектами, первоначальное пространственное расположение источников благотворно действующих средств (продольных и поперечных элементов стента) является ключевым фактором эффективности.
В дополнение к субоптимальному пространственному распределению благотворно действующих средств существуют прочие потенциальные недостатки, присущие стентам с поверхностным покрытием. Определенные фиксированные носители на основе полимерных матриц, часто используемые в покрытиях на устройствах, типично оставляют значительную процентную долю благотворно действующего средства в покрытии в неопределенном состоянии. Поскольку такие благотворно действующие средства могут быть цитотоксичными, например паклитаксель, то могут возникать подострые и хронические проблемы, такие как хроническое воспаление, поздний тромбоз, и задержанное или неполное заживление стенки сосуда. Кроме того, сами полимерные носители часто вызывают воспаление ткани стенки сосуда. С другой стороны, употребление биоразлагаемых полимерных носителей на поверхностях стентов может иметь результатом «неправильное расположение» или полости между стентом и тканью стенки сосуда после разложения полимерного носителя. Полости создают возможность эпициклического перемещения стента относительно соседней ткани. Возникающие проблемы включают микроабразию и воспаление, дрейф стента и неудачную реэндотелиализацию стенки сосуда.
Ранние клинические испытания на людях привели к выводу, что могут иметь место определенные недостатки, связанные с первым поколением устройств для доставки лекарственных средств. Последующее врачебное наблюдение участвующих в клинических испытаниях пациентов в течение от шести до восемнадцати месяцев после имплантации покрытых лекарственными средствами стентов показывает, что у значительного числа пациентов могут возникать неправильное расположение продольных и поперечных элементов стентов относительно артериальных стенок и краевой рестеноз. Краевой рестеноз возникает сразу же за пределами ближайшей и отдаленной кромок стента и прогрессирует вокруг кромок стента и во внутреннем (люминальном) пространстве, зачастую приводя к необходимости повторной реваскуляризации пациента.
Еще один потенциальный недостаток состоит в том, что расширение стента может вызывать деформацию вышележащего полимерного покрытия, обусловливая отслаивание, растрескивание или разрушение покрытия, каковые могут влиять на кинетические характеристики высвобождения лекарственного препарата или оказывать прочие неблагоприятные воздействия. Эти эффекты наблюдались в покрытых лекарственным средством стентах первого поколения, когда эти стенты расширялись до увеличенных диаметров, тем самым препятствуя их использованию в артериях с более крупным диаметром. Далее, расширение такого покрытого стента в кровеносном сосуде, пораженном атеросклерозом, будет прилагать сдвиговые усилия в окружном направлении к полимерному покрытию, что может вызывать отслоение покрытия от нижележащей поверхности стента. Такое отделение опять же может оказывать неблагоприятное воздействие, включая эмболизацию фрагментами покрытия вплоть до закупоривания сосуда.
Еще одна проблема, которая может быть разрешена с помощью локальной доставки благотворно действующих средств на основе стентов, представляет собой тромбоз. В дополнение к одному или более терапевтическим препаратам для лечения рестеноза стент может быть покрыт антитромботическим средством. Однако, в зависимости от характера покрытий на поверхности стента, например покрытия из антитромботического средства, для усиления адгезии прочих терапевтических средств к покрытым поверхностям стента может(-гут) быть предпочтительным(-ыми) дополнительный(-ные) слой (слои) или грунтовочный(-ные) слой (слои). Альтернативно, вместо грунтовочного(-ных) слоя(-ев) может быть использован способ маскирования и демаскирования.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Стимулирующая адгезию временная маска для поверхностей с гепариновым покрытием согласно настоящему изобретению преодолевает затруднения, кратко описанные выше.
В соответствии с первым аспектом настоящее изобретение предлагает способ нанесения покрытия на интралюминальную трехмерную структуру (скаффолд), имеющую множество отверстий. Способ включает нанесение маски на внутренние поверхности множества отверстий в интралюминальном скаффолде, нанесение покрытия на поверхности интралюминального скаффолда, причем покрытие включает антитромботический материал, удаление маски и любого второго покрытия, прилипшего к маске, с внутренних поверхностей множества отверстий в интралюминальном скаффолде, и заполнение множества отверстий одним или более терапевтическими препаратами.
В соответствии с еще одним аспектом настоящее изобретение представляет имплантируемое медицинское устройство. Имплантируемое медицинское устройство включает по существу цилиндрический интралюминальный скаффолд, имеющий люминальную поверхность и аблюминальную поверхность, причем расстояние между люминальной поверхностью и аблюминальной поверхностью определяет поверхности стенок интралюминального скаффолда, интралюминальный скаффолд, также включающий множество отверстий, определяющих внутренние поверхности, антитромботическое покрытие, закрепленное на люминальной, аблюминальной поверхностях и поверхностях стенок интралюминального скаффолда, и по меньшей мере одно терапевтическое средство, осажденное по меньшей мере в одном из множества отверстий и находящееся в непосредственном контакте с внутренними поверхностями таковых.
Принимая во внимание недостатки прототипа, было бы преимущественным создание стента, способного доставлять относительно большой объем благотворно действующего средства в травмированное место просвета сосуда, в то же время избегая многочисленных потенциальных проблем, связанных с поверхностными покрытиями, содержащими благотворно действующие средства, без увеличения эффективной толщины стенок стента и без вредного воздействия на характеристики механического расширения стента.
Далее, было бы преимущественным создание поддерживающего ткань устройства с различными благотворно действующими средствами, помещенными в различные отверстия, для достижения желательного пространственного распределения двух или более благотворно действующих средств.
Далее, было бы преимущественным создание поддерживающего ткань устройства с различными благотворно действующими средствами, помещенными в различные отверстия, для достижения желательных различных кинетических параметров высвобождения для двух или более благотворно действующих средств из одного и того же устройства.
Далее, было бы преимущественным создание поддерживающего ткань устройства, имеющего все поверхности, покрытые антитромботическим средством, и затем использование грунтовочного материала в проемах или отверстиях в таковом для усиления адгезии одного или более благотворно действующих средств, которыми заполнены отверстия.
Настоящее изобретение направлено на способ маскирования и демаскирования для создания покрытого гепарином стента, имеющего резервуары или отверстия в таковом, в котором гепариновое покрытие покрывает все поверхности стента, за исключением внутренних стенок резервуаров или отверстий в стенте. Применением описываемого здесь способа маскирования и демаскирования стент, который может быть изготовлен из любого пригодного биосовместимого материала, включающего металлы, сплавы и полимеры, может быть снабжен гепариновым покрытием, которое покрывает определенные поверхности, такие как люминальная, аблюминальная или муральная (стеночная), и боковые поверхности продольных и соединительных элементов, но не покрывает внутренние стенки резервуаров или отверстий. Этим путем резервуары или отверстия могут быть заполнены в соответствии с описываемыми здесь способами с применением дополнительного грунтовочного материала или без такового.
Общая концепция настоящего изобретения состоит в нанесении полимерной маски на поверхности резервуаров или отверстий в элементах стента до нанесения на стент покрытия из антитромботического средства, например гепарина, и затем в удалении полимерной маски и части, или предпочтительно всего целиком, любого гепаринового покрытия, прилипшего поверх маски, тем самым получая стент, имеющий резервуары или отверстия по существу с обнаженными металлическими поверхностями, в то же время оставляя прочие детали покрытыми гепарином.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Вышеприведенные и прочие признаки и преимущества изобретения будут очевидными из нижеследующего более подробного описания предпочтительных вариантов осуществления изобретения, иллюстрированных сопроводительными чертежами.
Фиг.1 представляет трехмерное изображение расширяемого медицинского устройства с благотворно действующим средством на концах в соответствии с настоящим изобретением.
Фиг.2 представляет трехмерное изображение расширяемого медицинского устройства с благотворно действующим средством в центральной части и без благотворно действующего средства на концах в соответствии с настоящим изобретением.
Фиг.3 представляет трехмерное изображение расширяемого медицинского устройства с различными благотворно действующими средствами в различных отверстиях в соответствии с настоящим изобретением.
Фиг.4 представляет трехмерное изображение расширяемого медицинского устройства с различными благотворно действующими средствами в попеременных отверстиях в соответствии с настоящим изобретением.
Фиг.5 представляет увеличенный вид сбоку части расширяемого медицинского устройства с содержащими благотворно действующее средство отверстиями в мостиковых элементах в соответствии с настоящим изобретением.
Фиг.6 представляет увеличенный вид сбоку части расширяемого медицинского устройства с разветвительным отверстием в соответствии с настоящим изобретением.
Фиг.7 представляет вид поперечного сечения расширяемого медицинского устройства, имеющего комбинацию из первого средства, такого как противовоспалительный препарат, в первом множестве отверстий, и второго средства, такого как антипролиферативный препарат, во втором множестве отверстий, в соответствии с настоящим изобретением.
Фиг.8 представляет график скоростей высвобождения для одного примера противовоспалительного и антипролиферативного средств, доставляемых расширяемым медицинским устройством из фиг.7, в соответствии с настоящим изобретением.
Фиг.9A-9C представляют фрагментарные схематические изображения альтернативного примерного варианта осуществления расширяемого медицинского устройства в соответствии с настоящим изобретением.
Фиг.10 иллюстрирует реакцию сочетания между PLGA (сополимера молочной и гликолевой кислот) с концевой кислотной карбоксильной группой и PEI (полиэтиленимином) с низкой молекулярной массой в соответствии с настоящим изобретением.
Фиг.11 иллюстрирует реакцию сочетания между PLGA (сополимера молочной и гликолевой кислот) с концевой кислотной карбоксильной группой и PEI (полиэтиленимином) с высокой молекулярной массой или разветвленным таковым в соответствии с настоящим изобретением.
Фиг.12A, 12B и 12C представляют виды поперечных сечений секции стента в условиях исполнения способа соответственно настоящему изобретению.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Фиг.1 иллюстрирует расширяемое медицинское устройство, имеющее множество отверстий, включающих благотворно действующее средство, для доставки в ткани с помощью расширяемого медицинского устройства. Расширяемое медицинское устройство 10, иллюстрированное на фиг.1, представляет собой отрезок трубчатого материала для формирования цилиндрического расширяемого устройства. Расширяемое медицинское устройство 10 включает множество цилиндрических секций 12, соединенных между собой множеством мостиковых элементов 14. Мостиковые элементы 14 позволяют поддерживающему ткань устройству изгибаться в осевом направлении при прохождении причиняющим боль извилистым путем в сосудистой системе до места развертывания и обеспечивают устройству возможность изгибаться в продольном направлении, когда необходимо согласование с кривизной просвета поддерживаемого трубчатого органа. Каждая из цилиндрических трубчатых частей 12 сформирована в виде сети из удлиненных продольных элементов 18, которые соединены друг с другом упругими подвесками 20 и окружными поперечными элементами 22. Во время расширения медицинского устройства 10 упругие подвески 20 деформируются, тогда как продольные элементы 18 не деформируются. Дополнительные подробности одного примера расширяемого медицинского устройства описаны в патенте США № 6241762, который приведен здесь для сведения.
Как иллюстрировано на фиг.1, удлиненные продольные элементы 18 и окружные поперечные элементы 22 включают отверстия 30, некоторые из каковых включают благотворно действующее средство для доставки в просвет трубчатого органа, в который имплантировано расширяемое медицинское устройство. В дополнение, другие части устройства 10, такие как мостиковые элементы 14, могут включать отверстия, как обсуждается ниже в отношении фиг.5. Предпочтительно, отверстия 30 сформированы в недеформируемых частях устройства 10, таких как продольные элементы 18, так, чтобы отверстия не деформировались и благотворно действующее средство доставлялось без опасности разрушения, вытеснения или иным образом повреждения во время расширения устройства. Дополнительное описание одного примера способа, каковым благотворно действующее средство может быть помещено внутри отверстий 30, приведено в патентной заявке США с серийным № 09/948987, поданной 7 сентября 2001 года, которая приведена здесь для сведения.
Примерные варианты осуществления настоящего изобретения могут быть дополнительно усовершенствованы с использованием анализа методом конечных элементов и других способов, для оптимизации размещения благотворно действующих средств внутри отверстий 30. По существу, форма и местоположение отверстий 30 могут быть модифицированы для максимизации объема полостей, в то же время с сохранением относительно высокой прочности и жесткости продольных и поперечных элементов в отношении упругих подвесок 20. Согласно одному предпочтительному примерному варианту осуществления настоящего изобретения отверстия имеют площадь по меньшей мере 5×10-6 квадратных дюймов (3,22×10-3 мм2) и предпочтительно по меньшей мере 7×10-6 квадратных дюймов (4,5×10-3 мм2). Обычно объем заполнения отверстий благотворно действующим средством варьирует от приблизительно пятидесяти процентов до приблизительно девяносто пяти процентов объема отверстия.
Определения
Предполагается, что термины «средство», «терапевтический препарат» или «благотворно действующее средство» интерпретируются максимально широко и используются так, что включают любое терапевтическое средство или лекарственный препарат, а также неактивные агенты, такие как барьерные слои, слои носителя, слои терапевтического препарата или защитные слои.
Термины «лекарственный препарат» и «терапевтическое средство» употребляются взаимозаменяемо для обозначения любой терапевтически активной субстанции, которая доставляется в просвет трубчатого органа в теле живого организма, для оказания желательного, обычно благотворного, действия. Благотворно действующие средства могут включать один или более лекарственных препаратов или терапевтических средств.
Настоящее изобретение используется для доставки антинеопластических препаратов, антиангиогенных препаратов, ангиогенных факторов, противовоспалительных средств, иммуносупрессантов, таких как рапамицин, противорестенозных препаратов, антитромбоцитарных средств, вазодилататоров, антитромботических препаратов, антипролиферативных средств, например таких, как паклитаксель, и антитромбинов, например таких, как гепарин.
Термин «эрозия» означает процесс, в ходе которого компоненты среды или матрицы претерпевают саморассасывание, и/или деградацию, и/или разложение в результате химических, или физических, или ферментативных процессов. Например, в случае биоразлагаемых полимерных матриц эрозия может происходить за счет расщепления или гидролиза полимерных цепей, тем самым повышая растворимость матрицы и суспендированных благотворно действующих средств.
Термин «скорость эрозии» представляет собой время, затрачиваемое на протекание процесса эрозии, обычно выражаемую в единицах площади на единицу времени.
Термины «матрица» или «саморассасывающаяся матрица» используются взаимозаменяемо для обозначения среды или материала, которые при имплантации субъекту не вызывают нежелательного отклика, достаточного для отторжения матрицы. Сама матрица обычно не обусловливает никакого терапевтического отклика, хотя матрица может содержать или заключать в себе благотворно действующее средство, как определено здесь. Матрица также представляет собой среду, которая может просто обеспечивать поддержку, структурную целостность или структурные барьеры. Матрица может быть полимерной, неполимерной, гидрофобной, гидрофильной, липофильной, амфифильной и тому подобной. В дополнение, понятие «саморассасывающаяся матрица» также следует понимать как означающее полное поглощение матрицы организмом с течением времени.
Термин «отверстия» включает как сквозные отверстия, так и углубления.
Термин «фармацевтически приемлемый» имеет отношение к такой характеристике, как нетоксичность для реципиента или пациента, и пригодности для поддержания устойчивости благотворно действующего средства, и обеспечению возможности доставки благотворно действующего средства к целевым клеткам или ткани.
Термин «полимер» имеет отношение к молекулам, образованным путем химического объединения двух или более повторяющихся структурных единиц, называемых мономерами. Соответственно этому в пределы термина «полимер» могут входить, например, димеры, тримеры и олигомеры. Полимер может быть синтетическим, природного происхождения или полусинтетическим. В предпочтительной форме термин «полимер» имеет отношение к молекулам, которые обычно имеют молекулярную массу (Mw) больше приблизительно 3000, и предпочтительно больше приблизительно 10000, и молекулярную массу (Mw) меньше приблизительно 10 миллионов, предпочтительно меньше приблизительно миллиона и более предпочтительно меньше приблизительно 200000. Примеры полимеров включают, но не ограничиваются таковыми, сложные эфиры поли-альфа-гидроксикислот, такие как полимолочная кислота (PLLA или DLPLA), полигликолевая кислота, сополимер молочной и гликолевой кислот (PLGA), сополимер молочной кислоты и капролактона; трехблочные блок-сополимеры этиленоксида, лактида и гликолида (PEO-block-PLGA и PEO-block-PLGA-block-PEO); полиэтиленгликоль и полиэтиленоксид, поли(блок-этиленоксид-блок-пропиленоксид-блок-этиленоксид); поливинилпирролидон; полиортоэфиры; полисахариды и производные полисахаридов, такие как полигиалуроновая кислота, полиглюкоза, альгиновые кислоты, хитин, хитозан, производные хитозана, целлюлоза, метилцеллюлоза, гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза, карбоксиметилцеллюлоза, циклодекстрины и замещенные циклодекстрины, такие как сульфобутиловые простые эфиры бета-циклодекстрина; полипептиды и белки, такие как полилизин, полиглутаминовая кислота, альбумин; полиангидриды; полигидроксиалканоаты, такие как полигидроксивалерат, полигидроксибутират и тому подобные.
Термин «первоначально» в отношении целенаправленной доставки обозначает количество, больше приблизительно пятидесяти процентов от общего количества терапевтического средства, при условии, что кровеносный сосуд является основным направлением доставки.
Разнообразные примерные варианты осуществления настоящего изобретения, описанные здесь, предусматривают размещение различных благотворно действующих средств в различных отверстиях в расширяемом устройстве или благотворно действующего средства в некоторых отверстиях, но не в других таковых. Конкретная структура расширяемого медицинского устройства может варьировать без выхода за пределы смысла изобретения. Поскольку каждое отверстие заполняют независимо, благотворно действующее средство в каждом отверстии может иметь индивидуальный химический состав и фармакокинетическую характеристику.
Один пример применения различных благотворно действующих средств в различных отверстиях в расширяемом медицинском устройстве или размещения благотворно действующих средств в некоторых отверстиях и отсутствия таковых в других отверстиях состоит в разрешении проблемы краевого рестеноза. Как обсуждалось выше, современное поколение покрытых стентов может быть сопряжено с трудностями в отношении краевого рестеноза или рестеноза, возникающего непосредственно за кромками стента и прогрессирующего вокруг стента и внутрь самого люминального пространства.
Причины краевого рестеноза в стентах первого поколения для доставки лекарственных средств до сих пор остаются не вполне понятными. Может быть так, что область повреждения ткани вследствие ангиопластики и/или имплантации стента распространяется за пределы диффузионного диапазона современного поколения благотворно действующих средств, таких как паклитаксель, который склонен к интенсивному распределению в ткани. Подобное явление наблюдалось в случаях радиационной терапии, в которых малые дозы радиации на кромках стента проявляли стимулирующее действие при наличии повреждения. В этом случае проблема разрешалась облучением по большей длине, чтобы облучению подвергалась неповрежденная ткань. В случае стентов для доставки лекарственных средств размещение увеличенных доз или более высоких концентраций благотворно действующих средств вдоль кромок стента, помещение различных препаратов на кромках стента, которые более легко диффундируют через ткань, или размещение различных благотворно действующих средств или комбинаций благотворно действующих средств на кромках устройства может способствовать устранению проблемы краевого рестеноза.
Фиг.1 иллюстрирует расширяемое медицинское устройство 10 с «горячими концами» или благотворно действующим средством, размещенным в отверстиях 30а на концах устройства, чтобы оказывать воздействие и сокращать краевой рестеноз. Остальные отверстия 30b в центральной части устройства могут быть пустыми (как показано) или могут содержать благотворно действующее средство с более низкой концентрацией.
Другие механизмы краевого рестеноза могут включать цитотоксичность конкретных лекарственных препаратов или комбинаций лекарственных средств. Такие механизмы могли бы включать физическое или механическое сокращение ткани подобно таковому, наблюдаемому при образовании рубцов эпидермальной ткани, и стент мог бы предотвращать сократительный отклик внутри его собственных границ, но не за пределами его кромок. Далее, механизм этой последней формы рестеноза может иметь отношение к остаточным явлениям продолжительной или локальной доставки лекарственного средства к артериальной стенке, которое сказывается даже после того, как само лекарственное средство уже перестает находиться на стенке. То есть рестеноз может представлять собой отклик на форму токсического повреждения, обусловленного лекарственным препаратом и/или носителем лекарственного средства. В этой ситуации могло бы быть полезным исключение определенных средств с кромок устройства.
Фиг.2 иллюстрирует альтернативный примерный вариант осуществления расширяемого медицинского устройства 200, имеющего множество отверстий 230, в котором отверстия 230b в центральной части устройства заполнены благотворно действующим средством и отверстия 230а на кромках устройства оставлены пустыми. Устройство на фиг.2 называется как имеющее «холодные концы».
В дополнение к применению для сокращения краевого рестеноза, расширяемое медицинское устройство 200 на фиг.2 может быть использовано в сочетании с расширяемым медицинским устройством 10 на фиг.1 или другим стентом для доставки лекарственных средств, когда первоначальная процедура стентирования должна быть дополнена введением дополнительного стента. Например, в некоторых случаях устройство 10 из фиг.1 с «горячими концами» или устройство с равномерным распределением лекарственного средства может быть имплантировано неправильно. Если лечащий врач определяет, что устройство не покрывает достаточной части просвета трубчатого органа, с одного конца существующего устройства может быть введено дополнительное устройство с небольшим перекрыванием существующего устройства. Когда дополнительное устройство имплантируют, устройство 200 из фиг.2 используют так, чтобы «холодные концы» медицинского устройства 200 предотвращали двойное дозирование благотворно действующего средства на участке перекрывания устройств 10, 200.
Фиг.3 иллюстрирует дополнительный альтернативный примерный вариант осуществления изобретения, в котором в различных отверстиях расширяемого медицинского устройства 300 размещены различные благотворно действующие средства. Первое благотворно действующее средство помещено в отверстия 330а на концах устройства, и второе благотворно действующее средство расположено в отверстиях 330b в центральной части устройства. Благотворно действующее средство может содержать различные лекарственные препараты, одни и те же лекарственные препараты в различных концентрациях, или различные вариации одного и того же лекарственного препарата. Примерный вариант осуществления согласно фиг.3 может быть использован для оснащения расширяемого медицинского устройства 300 либо «горячими концами», либо «холодными концами».
Предпочтительно, каждая концевая часть устройства 300, которая включает отверстия 330а, содержащие первое благотворно действующее средство, охватывает по меньшей мере одно отверстие и вплоть до приблизительно пятнадцати отверстий от кромки. Это расстояние соответствует длине примерно от приблизительно 0,005 до приблизительно 0,1 дюйма (0,127-2,54 мм) от кромки нерасширенного устройства. Расстояние от кромки устройства 300, которое включает первое благотворно действующее средство, предпочтительно составляет примерно одну секцию, где секция определяется дистанцией между мостиковыми элементами.
Различные благотворно действующие средства, включающие различные лекарственные препараты, могут быть размещены в различных отверстиях в стенте. Это обеспечивает возможность доставки двух или более благотворно действующих средств с одиночного стента с любым желательным профилем доставки. Альтернативно, различные благотворно действующие средства, включающие один и тот же лекарственный препарат с различными концентрациями, могут быть размещены в различных отверстиях. Этим обеспечивается возможность более равномерного распределения лекарственного препарата в ткани при неоднородной структуре устройства.
Два или более различных благотворно действующих средств, размещенных в описываемых здесь устройствах, могут включать (1) различные лекарственные препараты; (2) различные концентрации одного и того же лекарственного препарата; (3) один и тот же лекарственный препарат с различными кинетическими характеристиками высвобождения, то есть различными скоростями эрозии матрицы; или (4) различные формы одного и того же лекарственного препарата. В примерах различных благотворно действующих средств, включающих один и тот же лекарственный препарат с различными кинетическими характеристиками высвобождения, могут быть использованы различные носители для достижения профилей вымывания с различной формой. Некоторые примеры различных форм одного и того же лекарственного препарата включают формы лекарственного средства, имеющие переменную гидрофильность или липофильность.
В одном примере устройства 300 на фиг.3 отверстия 330а на концах устройства заполнены первым благотворно действующим средством, включающим лекарственный препарат с высокой липофильностью, тогда как отверстия 330b в центральной части устройства заполнены вторым благотворно действующим средством, включающим лекарственный препарат с более низкой липофильностью. Первое благотворно действующее средство с высокой липофильностью на «горячих концах» будет диффундировать более легко в окружающую ткань, сокращая краевой рестеноз.
Устройство 300 может иметь линию скачкообразного перехода, на которой благотворно действующее средство изменяется с первого средства на второе средство. Например, все отверстия в пределах расстояния 0,05 дюйма (1,27 мм) от конца устройства могут включать первое средство, тогда как остальные отверстия включают второе средство. Альтернативно, устройство может иметь постепенный переход от первого средства ко второму средству. Например, концентрация лекарственного препарата в отверстиях может постепенно нарастать (или снижаться) в сторону концов устройства. В еще одном примере количество первого лекарственного препарата в отверстиях увеличивается, в то время как количество второго лекарственного препарата в отверстиях сокращается при переходе в сторону концов устройства.
Фиг.4 иллюстрирует дополнительный альтернативный примерный вариант осуществления расширяемого медицинского устройства 400, в котором различные благотворно действующие средства позиционированы в различных отверстиях 430а, 430b в устройстве попеременным или хаотичным образом. Этим путем многообразные благотворно действующие средства могут быть доставлены в ткань по всей площади или части поверхности, поддерживаемой устройством. Этот примерный вариант осуществления будет полезным для доставки многочисленных благотворно действующих средств, где комбинирование множественных средств в единой композиции для помещения в устройство невозможно вследствие взаимодействия или проблем стабильности благотворно действующих средств.
В дополнение к применению различных благотворно действующих средств в различных отверстиях для создания различных концентраций лекарственных препаратов на различных определенных участках ткани, размещение различных благотворно действующих средств в различных отверстиях может быть использовано для обеспечения более однородного пространственного распределения благотворно действующего средства, доставляемого в примерных ситуациях, где расширяемое медицинское устройство имеет неравномерное распределение отверстий в расширенной конфигурации.
Употребление различных лекарственных препаратов в различных отверстиях хаотичным или попеременным образом позволяет доставлять два различных лекарственных препарата, которые не могут быть доставлены, будучи комбинированными внутри одной и той же композиции матрицы «полимер/лекарственный препарат». Например, сами лекарственные препараты могут взаимодействовать друг с другом нежелательным образом. Альтернативно, два лекарственных препарата могут быть несовместимыми с одинаковыми полимерами для формирования матрицы, или с одинаковыми растворителями для помещения матрицы «полимер/лекарственный препарат» в отверстия.
Далее, примерный вариант исполнения на фиг.4, имеющий различные лекарственные препараты в различных отверстиях с хаотичным распределением, создает возможность доставки различных лекарственных препаратов с весьма различающимися желательными кинетическими характеристиками высвобождения из одного и того же медицинского устройства или стента и оптимизации кинетики выделения в зависимости от механизма действия и свойств индивидуальных средств. Например, растворимость средства в воде очень сильно влияет на высвобождение средства из полимера или иной матрицы. Соединение с высокой растворимостью в воде в общем будет доставляться из полимерной матрицы очень быстро, тогда как липофильное средство будет доставляться в течение более длительного периода времени из той же матрицы. Таким образом, если гидрофильное средство и липофильное средство должны доставляться в качестве двойной комбинации лекарственных препаратов из медицинского устройства, то затруднительно обеспечить желательный профиль выделения для этих двух средств, доставляемых из одной и той же полимерной матрицы.
Система из фиг.4 обеспечивает возможность легкой доставки гидрофильного и липофильного лекарственного препарата из одного и того же стента. Далее, система из фиг.4 позволяет доставлять два средства с двумя различными кинетическими характеристиками высвобождения и/или периодами введения. Можно независимо контролировать каждый параметр из начального высвобождения в течение первых двадцати четырех часов, скорости выделения после первых двадцати четырех часов, общего периода введения и любых прочих характеристик высвобождения двух лекарственных препаратов. Например, доставка первого благотворно действующего средства может быть организована с такой скоростью выделения, чтобы по меньшей мере сорок процентов (предпочтительно по меньшей мере пятьдесят процентов) лекарственного препарата доставлялись в течение первых двадцати четырех часов, и доставка второго благотворно действующего средства может быть организована так, чтобы менее двадцати процентов (предпочтительно менее десяти процентов) лекарственного препарата доставлялись в течение первых двадцати четырех часов. Период введения первого благотворно действующего средства может составлять приблизительно около трех недель или менее (предпочтительно двух недель или менее), и период введения второго благотворно действующего средства может быть приблизительно около четырех недель или более.
Рестеноз, или рецидив закупоривания сосуда после вмешательства, включает комбинацию, или серию, биологических процессов. Эти процессы включают активацию тромбоцитов и макрофагов. Цитокины и факторы роста стимулируют пролиферацию клеток гладкой мышечной ткани, и повышение функциональной активности генов и металлопротеиназ ведет к росту клеток, трансформации внеклеточного матрикса и миграции клеток гладкой мышечной ткани. Наиболее успешную терапию рестеноза может представлять собой лекарственная терапия, которая ориентирована на множество этих процессов с использованием комбинации лекарственных препаратов. Настоящее изобретение представляет средство для создания такой успешной комбинации для лекарственной терапии.
Обсуждаемые ниже примеры иллюстрируют некоторые комбинированные лекарственные системы, которые полезны своей способностью высвобождать различные лекарственные препараты из различных проемов или отверстий. Один пример благотворно действующей системы для доставки двух лекарственных препаратов из хаотично расположенных или перемежающихся отверстий представляет доставку противовоспалительного средства или иммуносупрессантного препарата в комбинации с антипролиферативным средством или антимиграторным препаратом. Другие комбинации этих средств могут быть также использованы для целевых множественных биологических процессов, участвующих в рестенозе. Противовоспалительный препарат смягчает первоначальную воспалительную реакцию сосуда на ангиопластику и стентирование и доставляется с высокой начальной дозировкой, после чего следует более медленное выделение в течение периода времени приблизительно двух недель для согласования с максимумом развития макрофагов, которые стимулируют воспалительный процесс. Антипролиферативное средство доставляется с относительно равномерной скоростью в течение более длительного периода времени для снижения миграции и пролиферации клеток гладкой мышечной ткани.
В дополнение к примерам, которые приведены ниже, последующая диаграмма в таблице 1 иллюстрирует некоторые из полезных терапевтических комбинаций двух лекарственных препаратов, которые могут быть созданы помещением лекарственных средств в различные отверстия в медицинском устройстве.
Размещение лекарственных препаратов в различных отверстиях позволяет точно отрегулировать кинетические характеристики высвобождения для конкретного средства независимо от гидрофобности или липофобности лекарственного препарата. Примеры некоторых компоновок для доставки липофильного лекарственного препарата по существу при постоянной или линейной скорости высвобождения описаны в публикации WO 04/110302, опубликованной 23 декабря 2004 года, которая приведена здесь для сведения. Примеры некоторых компоновок для доставки гидрофильного лекарственного препарата описаны в публикации WO 04/043510, опубликованной 27 мая 2004 года, которая приведена здесь для сведения. Перечисленные выше гидрофильные лекарственные препараты включают CdA (2-хлордезоксиаденозин), гливек, VIP (вазоактивный интестинальный пептид), инсулин и ApoA-1 milano (миланский аполипопротеин А-1). Вышеперечисленные липофильные лекарственные препараты включают паклитаксель, эпотилон D, рапамицин, пимекролимус, РКС-412 (N-бензоил-стауроспорин) и дексаметазон. Фарглитазар является частично липофильным и отчасти гидрофильным.
В дополнение к доставке многочисленных лекарственных препаратов для воздействия на различные биологические процессы, происходящие при рестенозе, настоящее изобретение может обеспечивать доставку двух различных лекарственных средств для лечения различных заболеваний с использованием того же стента. Например, стент может доставлять антипролиферативный препарат, такой как паклитаксель, или лекарственный препарат из группы лимусов, из одного набора отверстий для лечения рестеноза, в то же время с доставкой миокардиального предохраняющего средства, такого как инсулин, из других отверстий для лечения острого инфаркта миокарда.
Во многих из известных расширяемых устройств и для устройства, иллюстрированного на фиг.5, площадь покрытия устройством 500 является большей в цилиндрических трубчатых частях 512 устройства, нежели в области мостиковых элементов 514. Площадь покрытия определяется как отношение площади поверхности устройства к площади просвета трубчатого органа, в котором размещено устройство. Когда устройство с переменной площадью покрытия используют для доставки благотворно действующего средства, содержащегося в отверстиях устройства, концентрация благотворно действующего средства, доставляемого в ткань, соседствующую с цилиндрическими трубчатыми частями 512, является большей, чем концентрация благотворно действующего средства, доставляемого в ткань, примыкающую к мостиковым элементам 514. Чтобы устранить эту вариацию в продольном направлении структуры устройства и прочие вариации площади покрытия устройством, которые ведут к неравномерному распределению концентраций доставляемого благотворно действующего средства, концентрации благотворно действующего средства могут варьировать в отверстиях в отдельных частях устройства для обеспечения более однородного распределения благотворно действующего средства по всей ткани. В случае примерного варианта осуществления, иллюстрированного на фиг.5, отверстия 530а в трубчатых частях 512 включают благотворно действующее средство с более низкой концентрацией лекарственного препарата, чем в отверстиях 530b в мостиковых элементах 514. Равномерность доставки средства может быть достигнута разнообразными путями, включающими вариацию концентрации лекарственного препарата, диаметра или формы отверстий, количества средства в отверстии (то есть степени заполнения отверстия в процентах), материала матрицы или формы лекарственного препарата.
Еще один пример нанесения для использования различных благотворно действующих средств в различных отверстиях представлен в расширяемом медицинском устройстве 600, как иллюстрировано на фиг.6, скомпонованном для применения в месте разветвления сосуда. Разветвительные устройства включают боковое отверстие 610, которое позиционировано так, чтобы обеспечивать возможность протекания крови через боковой отросток сосуда. Один пример разветвительного устройства описан в Патенте США №6293967, который приведен здесь для сведения. Разветвительное устройство 600 включает в качестве признака боковое отверстие 610, прерывающее регулярный рисунок продольных элементов, которые формируют остальное устройство. Поскольку область вокруг разветвления является в особенности проблематичной областью в отношении рестеноза, концентрация антипролиферативного препарата может быть повышена в отверстиях 630a в области, окружающей боковое отверстие 610 устройства 600, для доставки повышенных концентраций лекарственного препарата туда, где это требуется. Остальные отверстия 630b в области, отдаленной от бокового отверстия, содержат благотворно действующее средство с меньшей концентрацией антипролиферативного препарата. Повышенное количество антипролиферативного средства, доставляемого в область, которая окружает полость при разветвлении, может быть обеспечено другим благотворно действующим средством, содержащим иной лекарственный препарат, или другим благотворно действующим средством, содержащим более высокую концентрацию того же лекарственного препарата.
В дополнение к размещению различных благотворно действующих средств в пристеночной или аблюминальной стороне расширяемого медицинского устройства для лечения стенки сосуда, благотворно действующие средства могут быть помещены на люминальной стороне расширяемого медицинского устройства для предотвращения или сокращения тромбоза. Лекарственные препараты, которые доставляются в кровоток с люминальной стороны устройства, могут быть размещены на ближайшем конце устройства или отдаленном конце устройства.
Способы размещения различных благотворно действующих средств в различных отверстиях в расширяемом медицинском устройстве могут включать известные способы, такие как погружение и нанесение покрытия, а также известные способы микрораспыления с помощью пьезоэлектрической головки. Микрораспылительные устройства могут действовать под управлением компьютера для размещения точно отмеренных количеств двух или более жидких благотворно действующих средств в точно заданные места на расширяемом медицинском устройстве известным путем. Например, сдвоенное устройство для распыления средства может подавать два средства в отверстия одновременно или последовательно. Когда благотворно действующие средства помещены в сквозные отверстия в расширяемом медицинском устройстве, люминальная сторона сквозных отверстий может быть блокирована на время загрузки с помощью упругой оправки, обеспечивающей возможность размещения благотворно действующих средств в жидкой форме, например с растворителем. Благотворно действующие средства могут быть также размещены с использованием устройств для впрыскивания вручную.
ПРИМЕР 1
Фиг.7 иллюстрирует стент 700 с двумя лекарственными препаратами, имеющий противовоспалительное средство и антипролиферативное средство, доставляемые из различных отверстий в стенте, для обеспечения независимых кинетических характеристик высвобождения двух лекарственных препаратов, которые конкретно запрограммированы для соответствия биологическим процессам при рестенозе. Согласно этому примеру стент с двумя лекарственными средствами включает противовоспалительный препарат, пимекролимус, в первом наборе отверстий 710, в сочетании с антипролиферативным препаратом, паклитакселем, во втором наборе отверстий 720. Каждое средство помещено в матричном материале внутри отверстий стента в конкретной мозаичной компоновке, рассчитанной на достижение кинетических характеристик, иллюстрированных на фиг.8 кривыми 810 и 820. Каждый из лекарственных препаратов доставляется главным образом пристеночно для лечения рестеноза.
Как иллюстрировано на фиг.7, пимекролимус размещают в стенте для направленной доставки к муральной стороне стента с использованием барьера 712 на люминальной стороне отверстия. Барьер 712 сформирован из биоразлагаемого полимера. Пимекролимус размещают внутри отверстий таким образом, чтобы создать кинетические характеристики высвобождения, имеющие двойные фазы. Первая фаза выделения пимекролимуса обеспечивается расположенной на муральной стороне областью 716 матрицы, которая имеет быстро выделяющий состав, включающий пимекролимус и биоразлагаемый полимер (PLGA) с высоким процентным содержанием лекарственного препарата, таким как примерно девяносто процентов лекарственного препарата примерно на десять процентов полимера. Вторая фаза высвобождения обеспечивается центральной областью 714 матрицы с пимекролимусом и биоразлагаемым полимером (PLGA) в отношении приблизительно пятидесяти процентов лекарственного препарата к пятидесяти процентам полимера. Как можно видеть на графике на фиг.8, первая фаза выделения пимекролимуса доставляет приблизительно пятидесяти процентов загруженного лекарственного препарата в течение первых примерно двадцати четырех часов. Вторая фаза выделения доставляет остальные пятьдесят процентов в течение приблизительно двух недель. Это высвобождение специально рассчитано на согласование с развитием воспалительного процесса после ангиопластики и стентирования. В дополнение или в качестве альтернативы к изменению концентрации лекарственного препарата между двумя областями, предусмотренному для создания двухфазного выделения, для достижения двух различных скоростей высвобождения в двух различных областях расположения лекарственного препарата могут быть использованы различные полимеры или различные соотношения сомономеров в одном и том же полимере.
Паклитаксель помещают внутри отверстий 720 таким образом, чтобы создать кинетические параметры высвобождения, имеющие по существу линейный характер выделения после первых приблизительно двадцати четырех часов, как иллюстрировано на фиг.8. Отверстия 720 с паклитакселем загружены с тремя областями, включающими базовую область 722 главным образом из полимера с минимальным количеством лекарственного препарата на люминальной стороне отверстия, центральную область 724 с паклитакселем и полимером (PLGA), имеющую концентрационный градиент, и покровную область 726 в основном из полимера, который контролирует выделение паклитакселя. Паклитаксель выделяется с начальной скоростью высвобождения в первый день примерно от пяти до приблизительно пятнадцати процентов от общего количества лекарственного препарата, с последующим по существу линейным характером высвобождения в течение времени от приблизительно двадцати до девяноста дней. Дополнительные примеры компоновок паклитакселя в отверстиях с концентрационным градиентом описаны в публикации WO 04/110302, упомянутой выше.
Фиг.7 иллюстрирует области лекарственного препарата, барьера и защитной прокладки как четко разделенные области внутри отверстий для упрощения иллюстрации. Следует понимать, что эти области не являются столь же различающимися и образуются смешением различных зон. Таким образом, хотя барьерные слои представляют собой главным образом полимер без лекарственного препарата, в зависимости от использованного способа приготовления некоторое небольшое количество лекарственного средства из последующей области может быть вовлечено в барьерную область.
Количество выделяемых лекарственных препаратов варьирует в зависимости от размера стента. Для стента величиной три мм на шесть мм количество пимекролимуса составляет от приблизительно пятидесяти до приблизительно трехсот микрограммов, предпочтительно от приблизительно ста до приблизительно двухсот пятидесяти микрограммов. Количество паклитакселя, выделяемого из этого стента, составляет от приблизительно пяти до приблизительно пятидесяти микрограммов, предпочтительно от приблизительно десяти до приблизительно тридцати микрограммов. В одном примере выделяются приблизительно двести микрограммов пимекролимуса и приблизительно двадцать микрограммов паклитакселя. Лекарственные препараты могут быть сосредоточены в попеременных отверстиях в стенте. Однако, ввиду большой разницы в выделяемых дозах двух лекарственных средств, может быть желательным размещение паклитакселя в каждом третьем отверстии из четырех в стенте. Альтернативно, отверстия для доставки малой дозы лекарственного препарата (паклитакселя) могут быть сделаны меньшими, чем отверстия для увеличенной дозы.
Компоновки «полимер/лекарственный препарат» формируют способом впрыскивания с помощью пьезоэлектрической головки под компьютерным управлением, как описано в публикации WO 04/026182, опубликованной 1 апреля 2004 года, которая приведена здесь для сведения. Сначала могут быть сформированы компоновки первого средства, с последующим размещением по отверстиям второго средства с помощью пьезоэлектрического инжектора. Альтернативно, система согласно публикации WO 04/02182 может быть оснащена сдвоенными пьезоэлектрическими диспенсерами для распределения двух средств в одно и то же время.
ПРИМЕР 2
Согласно этому примеру стент с двумя лекарственными препаратами включает гливек в первом наборе отверстий 710 в комбинации с антипролиферативным средством, паклитакселем, во втором наборе отверстий 720. Каждое средство помещено в матричном материале внутри отверстий стента в конкретной мозаичной компоновке, рассчитанной на достижение кинетических характеристик, иллюстрированных на фиг.8.
Гливек выделяется путем двухфазного высвобождения, включающего интенсивное начальное выделение в первый день и затем медленное выделение в течение времени от одной до двух недель. В первой фазе высвобождения гливек доставляется в количестве примерно пятидесяти процентов от загруженного лекарственного средства в течение первых примерно двадцати четырех часов. Во второй фазе выделение высвобождает остальные пятьдесят процентов в течение приблизительно одной-двух недель. Паклитаксель помещают внутри отверстий 720 таким образом, чтобы создать кинетические характеристики выделения, имеющие по существу линейный профиль высвобождения после первых приблизительно двадцати четырех часов, как иллюстрировано на фиг.8 и как описано выше в примере 1.
Количество выделяемых лекарственных препаратов варьирует в зависимости от размера стента. Для стента величиной три мм на шесть мм количество гливека составляет от приблизительно двухсот до приблизительно пятисот микрограммов, предпочтительно от приблизительно трехсот до приблизительно четырехсот микрограммов. Количество паклитакселя, выделяемого из этого стента, составляет от приблизительно пяти до приблизительно пятидесяти микрограммов, предпочтительно от приблизительно десяти до приблизительно тридцати микрограммов. Как в примере 1, лекарственные препараты могут быть сосредоточены в попеременных отверстиях в стенте или размещены хаотическим образом. Компоновки размещения «полимер/лекарственный препарат» формируют путем, описанным в примере 1.
ПРИМЕР 3
Согласно этому примеру стент с двумя лекарственными препаратами включает РКС-412 (регулятор клеточного роста) в первом наборе отверстий в комбинации с антипролиферативным средством, паклитакселем, во втором наборе отверстий. Каждое средство помещено в матричном материале внутри отверстий стента в конкретной мозаичной компоновке, рассчитанной на достижение кинетических характеристик, обсуждаемых ниже.
РКС-412 выделяется по существу с постоянной скоростью высвобождения после первых приблизительно двадцати четырех часов, с выделением в течение периода времени от приблизительно четырех до шестнадцати недель, предпочтительно от приблизительно шести до двенадцати недель. Паклитаксель помещают внутри отверстий таким образом, чтобы создать кинетические характеристики выделения, имеющие по существу линейный профиль высвобождения после первых приблизительно двадцати четырех часов, с выделением в течение периода времени от приблизительно четырех до шестнадцати недель, предпочтительно от приблизительно шести до двенадцати недель.
Количество выделяемых лекарственных препаратов варьирует в зависимости от размера стента. Для стента величиной три мм на шесть мм количество РКС-412 составляет от приблизительно ста до приблизительно четырехсот микрограммов, предпочтительно от приблизительно ста пятидесяти до приблизительно двухсот пятидесяти микрограммов. Количество паклитакселя, выделяемого из этого стента, составляет от приблизительно пяти до приблизительно пятидесяти микрограммов, предпочтительно от приблизительно десяти до приблизительно тридцати микрограммов. Как в примере 1, лекарственные препараты могут быть сосредоточены в попеременных отверстиях в стенте или размещены хаотическим образом. Компоновки размещения «полимер/лекарственный препарат» формируют путем, описанным в примере 1.
Терапевтические средства
Настоящее изобретение относится к доставке средств против рестеноза, включающих паклитаксель, рапамицин, кладрибин (CdA) и их производные, а также прочие цитотоксические или цитостатические препараты и средства стабилизации микротубулярной сети. Хотя здесь были главным образом описаны средства против рестеноза, настоящее изобретение может быть также использовано для доставки других средств по отдельности или в комбинации со средствами против рестеноза. Некоторые из терапевтических препаратов для применения согласно настоящему изобретению, которые могут быть переданы главным образом люминально, главным образом мурально, или обоими путями, и могут быть доставлены по отдельности или в комбинации, включают, но не ограничиваются таковыми, антипролиферативные препараты, антитромбины, иммуносупрессанты, включая сиролимус, антилипидные препараты, противовоспалительные препараты, антинеопластики, антитромбоцитарные препараты, ангиогенные факторы, антиангиогенные факторы, витамины, антимитотики, ингибиторы металлопротеиназы, доноры NO (оксида азота), эстрадиолы, антисклеротические препараты, вазоактивные препараты, факторы роста эндотелия, эстроген, бета-блокаторы, AZ-блокаторы (азельнидипин), гормоны, статины, инсулиновые факторы роста, антиоксиданты, средства стабилизации мембран, кальциевые антагонисты, ретиноид, бивалирудин, феноксодиол, этопозид, тиклопидин, дипиридамол и трапидил, по отдельности или в комбинации с любым терапевтическим средством, упомянутым здесь. Терапевтические препараты также включают пептиды, липопротеины, полипептиды, кодирующие полипептиды полинуклеотиды, липиды, белковые лекарственные препараты, конъюгаты лекарственных препаратов с белками, ферменты, олигонуклеотиды и их производные, рибозимы, другой генетический материал, клетки, антисмысловые олигонуклеотиды, моноклональные антитела, тромбоциты, прионы, вирусы, бактерии и эукариотические клетки, такие как эндотелиальные клетки, стволовые клетки, ACE-ингибиторы (ангиотензинпревращающего фермента), моноциты/макрофаги или клетки васкулярной гладкой мышечной ткани по наименованию, но в нескольких примерах. Терапевтическое средство также может представлять собой пролекарство, которое метаболизируется в желательный лекарственный препарат, будучи введенным реципиенту. В дополнение, терапевтические средства могут быть предварительно составленными в виде микрокапсул, микросфер, микропузырьков, липосом, ниосом, эмульсий, дисперсий или тому подобных, перед тем, как они будут введены в слой терапевтического средства. Терапевтические препараты также могут представлять собой радиоактивные изотопы или агенты, активируемые какой-нибудь иной формой энергии, такой как световая энергия или ультразвук, или другими циркулирующими молекулами, которые могут быть введены системно. Терапевтические средства могут исполнять многообразные функции, включающие модуляцию ангиогенеза, подавление рестеноза, пролиферации клеток, тромбоза, агрегации тромбоцитов, свертывания крови и вазодилатации.
Противовоспалительные препараты включают, но не ограничиваются таковыми, нестероидные противовоспалительные средства (NSAID, НПВС), такие как производные арилуксусных кислот, например диклофенак; производные арилпропионовых кислот, например напроксен; и производные салициловой кислоты, например дифлунизал. Противовоспалительные средства также включают глюкокортикоиды (стероиды), такие как дексаметазон, аспирин, преднизолон и триамцинолон, пирфенидон, меклофенамовая кислота, траниласт, и нестероидные противовоспалительные средства. Противовоспалительные препараты могут быть использованы в комбинации с антипролиферативными средствами для смягчения реакции ткани на антипролиферативный препарат.
Средства также могут включать антилимфоцитарные препараты; антимакрофаговые субстанции; иммуномодуляторные препараты; ингибиторы циклооксигеназы; антиоксиданты; лекарственные препараты для снижения уровня холестерина; статины и ангиотензинпревращающий фермент (АСЕ); фибринолитики; ингибиторы врожденного коагуляционного каскада; средства против гиперлипопротеинемии; и антитромбоцитарные средства; антиметаболиты, такие как 2-хлордезоксиаденозин (2-CdA, или кладрибин); иммуносупрессанты, включающие сиролимус, эверолимус, такролимус, этопозид и митоксантрон; антилейкоцитарные препараты, такие как 2-CdA, ингибиторы IL-1 (цитокины ИЛ-1), моноклональные антитела anti-CD116/CD118, моноклональные антитела к VCAM (васкулярная молекула клеточной адгезии) или ICAM (межклеточная молекула клеточной адгезии), протопорфирин цинка; антимакрофаговые субстанции, такие как лекарственные препараты, которые повышают уровень оксида азота (NO); сенсибилизаторы клеточных структур к инсулину, в том числе глитазоны; липопротеины высокой плотности (HDL) и производные; и синтетические копии HDL, такие как липатор, ловастатин, правастатин, аторвастатин, симвастатин и производные статинов; вазодилататоры, такие как аденозин и дипиридамол; доноры оксида азота; простагландины и их производные; соединения anti-TNF (анти-ФНО, моноклональные антитела к фактору некроза опухолей); антигипертонические лекарственные препараты, включающие бета-блокаторы, ингибиторы ангиотензинпревращающего фермента (АСЕ) и блокаторы кальциевых каналов; вазоактивные субстанции, включающие вазоактивные интестинальные полипептиды (VIP); инсулин; сенсибилизаторы клеточных структур к инсулину, в том числе глитазоны; агонисты рецепторов PPAR, и метформин; протеинкиназы; антисмысловые олигонуклеотиды, включая Resten-NG; антитромбоцитарные препараты, в том числе тирофибан, эптифибатид и абсиксимаб; кардиопротекторы, в том числе VIP, гипофизарный пептид, активирующий аденилат-циклазу (РАСАР), apoA-1 milano (Миланский аполипопротеин А-1), амлодипин, никорандил, цилостаксон и тиенопиридин; ингибиторы циклооксигеназы, включающие ингибиторы COX-1 и COX-2 (ЦОГ-1 и ЦОГ-2); и ингибиторы пептидазы, включая омапатрилат. Другие лекарственные препараты, которые могут быть использованы для лечения воспаления, включают средства снижения уровня липидов, эстроген и прогестин, агонисты эндотелиновых рецепторов и антагонисты интерлейкина-6, и адипонектин. Терапевтические препараты также могут включать ингибиторы фосфодиэстеразы (PDEi), такие как циластазол, и агонисты аденозиновых рецепторов, предпочтительно А2А-рецепторов, агонисты, такие как регаденозон.
Средства могут быть также доставлены с использованием подхода, основанного на генной терапии, в комбинации с расширяемым медицинским устройством. Генная терапия имеет отношение к доставке экзогенных генов в клетку или ткань, тем самым побуждая целевые клетки экспрессировать продукт экзогенного гена. Гены типично доставляются либо механическим способом, либо переносятся с помощью векторной системы.
Некоторые из описанных здесь средств могут быть скомбинированы с добавками, которые способствуют сохранению их активности. Например, добавки, включающие поверхностно-активные вещества, антациды, антиоксиданты и детергенты, могут быть использованы для сведения к минимуму денатурирования и агрегации белкового лекарственного препарата. Могут быть применены анионные, катионные или неионные поверхностно-активные вещества. Примеры неионных формообразующих компонентов включают, но не ограничиваются таковыми, сахара, в том числе сорбит, сахарозу, трегалозу; декстраны, включающие декстран, карбоксиметилдекстран (СМ), диэтиламиноэтилдекстран (DEAE); производные сахаров, включающие D- глюкозаминовую кислоту и диэтилмеркапталь D-глюкозы; синтетические простые полиэфиры, включающие полиэтиленгликоль (РЕО) и поливинилпирролидон (PVP); карбоновые кислоты, включающие D-молочную кислоту, гликолевую кислоту и пропионовую кислоту; поверхностно-активные вещества со сродством к гидрофобным поверхностям раздела фаз, включающие н-додецил-бета-D-мальтозид, н-октил-бета-D-глюкозид, сложные эфиры полиэтиленгликоля (РЕО) и алифатических кислот (например, стеарат (торговая марка “Myrj 59”) или олеат), сложные эфиры полиоксиэтилен-сорбитана (РЕО) и алифатических кислот (например, твин-80, полиоксиэтилен-20-сорбитан моноолеат), сложные эфиры сорбита и алифатических кислот (например, SPAN-60, моностеарат сорбита), сложные эфиры полиоксиэтилен-глицерина и алифатических кислот; сложные эфиры глицерина и алифатических кислот (например, моностеарат глицерина), углеводородные простые эфиры полиэтиленоксида (например, РЕО-10-олеиловый простой эфир; тритон Х-100; и Lubrol (полиоксиэтилен-9-лауриловый простой эфир)). Примеры ионных детергентов включают, но не ограничиваются таковыми, соли алифатических кислот, в том числе стеарат кальция, стеарат магния и стеарат цинка; фосфолипиды, включающие лецитин и фосфатидилхолин (РС); карбоксиметиловый эфир полиэтиленгликоля (CM-PEG); холевую кислоту; додецилсульфат натрия (SDS); докузат (АОТ; бис(2-этилгексил)сульфосукцинат натрия, размягчающее слабительное); и таурохолевую кислоту.
В соответствии с еще одним примерным вариантом осуществления стент или интралюминальный скаффолд, как описанный выше, может быть покрыт антитромботическим средством, в дополнение к одному или более терапевтическим препаратам, осажденным в выемках или отверстиях. В одном примерном варианте осуществления стент может быть изготовлен с отверстиями в таковом, и перед добавлением или осаждением других терапевтических средств в отверстия на стенте или части такового может быть зафиксирован антитромботический препарат, с материалом носителя или без такового (полимера или полимерной матрицы). В этом примерном варианте осуществления люминальная и аблюминальная поверхности стента, а также поверхности стенок отверстий, могут быть покрыты антитромботическим средством или покрытием. В альтернативном примерном варианте осуществления стент может быть сначала покрыт антитромботическим препаратом или покрытием, и затем могут быть сформированы отверстия. В этом примерном варианте осуществления антитромботическое средство или покрытие должны были бы иметь только люминальная и аблюминальная поверхности, но не стенки отверстий. В каждом из этих вариантов осуществления на всем стенте или на частях такового может быть зафиксировано любое количество антитромботических средств. В дополнение, для фиксации антитромботического средства на стенте может быть использовано любое число известных способов, таких, какие употребляются на коронарном стенте с торговым наименованием Bx Velocity® HEPACOATTM фирмы Cordis Corporation. Альтернативно, стенты могут быть изготовлены с шероховатой поверхностной текстурой или могут иметь микротекстуру для усиления закрепления клеток и эндотелизации, независимо от антитромботического покрытия или в дополнение к таковому. Кроме того, в отверстиях может быть осаждено любое число терапевтических препаратов, и различные препараты могут быть использованы в различных областях стента.
Как описано выше, важно отметить, что в соответствии с настоящим изобретением может быть использовано любое число лекарственных препаратов и или средств, в том числе: антипролиферативные/антимитотические средства, включающие природные продукты, такие как алкалоиды винка (то есть винбластин, винкристин и винорельбин), паклитаксель, эпиподофиллотоксины (то есть этопозид, тенипозид), антибиотики (дактиномицин (актиномицин Д), даунорубицин, доксорубицин и идарубицин), антрациклины, митоксантрон, блеомицины, пликамицин (митрамицин) и митомицин, ферменты (L-аспарагиназа, которая системно метаболизирует L-аспарагин и лишает такового клетки, которые неспособны синтезировать свой собственный аспарагин); антитромбоцитарные средства, такие как ингибиторы гликопротеиновых (GP) рецепторов IIbIIIa, и антагонисты витронектиновых рецепторов; антипролиферативные/антимитотические алкилирующие средства, такие как азотистые иприты (мехлоретамин, циклофосфамид и аналоги, мелфалан, хлорамбуцил), этиленимины и метилмеламины (гексаметилмеламин и тиотепа), алкилсульфонаты - бисульфан, нитрозомочевины (кармустин, BCNU (БиКНУ, 1,3-бис-(2-хлорэтил)-1-нитрозомочевина)) и аналоги, стрептозоцин), триазены - дакарбазин (DTIC) (ДТИК, 5-(3,3-диметил-1-триазено)имидазол-4-карбоксамид); антипролиферативные/антимитотические антиметаболиты, такие как аналоги фолиевой кислоты (метотрексат), аналоги пиримидина (фторурацил, флоксуридин и цитарабин), пуриновые аналоги и родственные ингибиторы (меркаптопурин, тиогуанин, пентостатин и 2-хлордезоксиаденозин (кладрибин)); координационные комплексы платины (цисплатин, карбоплатин), прокарбазин, гидроксимочевина, митотан, аминоглутетимид; гормоны (то есть эстроген); антикоагулянты (гепарин, синтетические соли гепарина и прочие ингибиторы тромбина); фибринолитические препараты (такие как тканевый активатор плазминогена, стрептокиназа и урокиназа), аспирин, дипиридамол, тиклопидин, клопидогрел, абсиксимаб; противомиграционные средства; антисекреторные средства (брефелдин); противовоспалительные препараты: такие как адренокортикоидные стероиды (кортизол, кортизон, флудрокортизон, преднизон, преднизолон, 6α-метилпреднизолон, триамцинолон, бетаметазон и дексаметазон), нестероидные препараты (производные салициловой кислоты, то есть аспирин; производные пара-аминофенола, то есть ацетаминофен; индол- и инденуксусные кислоты (индометацин, сулиндак и этодалак), гетероарилуксусные кислоты (толметин, диклофенак и кеторолак), арилпропионовые кислоты (ибупрофен и производные), антраниловые кислоты (мефенамовая кислота и меклофенамовая кислота), енольные производные с кислотными свойствами (пироксикам, теноксикам, фенилбутазон и оксифентатразон), набуметон, соединения золота (ауранофин, ауротиоглюкоза, золота-натрия тиомалат); иммуносупрессанты: (циклоспорин, такролимус (FK-506), сиролимус (рапамицин), азатиоприн, микофенолата мофетил); ангиогенные препараты: фактор роста эндотелия сосудов (VEGF), фактор роста фибробластов (FGF), фактор роста тромбоцитарный (PDGF), эритропоэтин; блокатор ангиотензиновых рецепторов; доноры оксида азота; антисмысловые олигонуклеотиды и комбинации таковых; ингибиторы клеточного цикла, ингибиторы mTOR-киназ (мишень для рапамицина у млекопитающих) и ингибиторы трансдукции сигналов киназ фактора роста.
С привлечением теперь фиг.9A, 9B и 9C иллюстрировано схематическое представление части стента.
Как иллюстрировано на фиг.9A, стент 900 включает множество по существу круглых отверстий 902. В этом примерном варианте осуществления множество по существу круглых отверстий 902 проходит сквозь стенку стента 900. Другими словами, множество по существу круглых отверстий 902 простирается от аблюминальной поверхности стента 900 до люминальной поверхности стента 900, в котором толщина стенки определяется расстоянием между люминальной и аблюминальной поверхностями. Однако в других вариантах осуществления не требуется, чтобы отверстия проходили сквозь стенку стента 900. Например, отверстия, или резервуары, могут простираться частично либо от люминальной, либо от аблюминальной поверхностей, или от обеих таковых. Стент 900 на фиг.9A имеет необработанные аблюминальную и люминальную поверхности и пустые отверстия 902.
На фиг.9B по меньшей мере одна поверхность была покрыта терапевтическим препаратом 908. Терапевтический препарат предпочтительно включает антитромботическое средство, такое как гепарин; однако может быть использовано любое антитромботическое средство. Антитромботическое средство может быть зафиксировано с использованием любого способа, как вкратце описано выше. В этом примерном варианте осуществления как аблюминальная, так и люминальная поверхности имеют антитромботическое средство, зафиксированное на таковых. В дополнение, поскольку в этом стыке нет никакого множества по существу круглых отверстий 902, стенки отверстий 902 могут также иметь некоторое количество закрепленного на таковых антитромботического средства. Количество антитромботического средства, зафиксированного на стенках отверстий 910, зависит от того, каким образом закреплено средство. Например, если средство закреплено при нанесении покрытия путем погружения, стенки отверстий будут иметь больше средства, зафиксированного на таковых, чем если бы средство фиксировалось с использованием способа нанесения покрытия набрызгиванием. Как здесь описано, в этом примерном варианте осуществления все открытые поверхности имеют существенное покрытие из закрепленного на таковых антитромботического средства; однако в альтернативном примерном варианте осуществления только специальные поверхности могут иметь зафиксированное на таковых антитромботическое средство. Например, в одном примерном варианте осуществления антитромботическим средством может быть обработана только поверхность, контактирующая с кровью. В еще одном дополнительном альтернативном примерном варианте осуществления одна или обе поверхности могут быть покрыты антитромботическим средством, тогда как стенки отверстий не покрыты. Это может быть выполнено многообразными путями, включающими закупоривание отверстий перед нанесением покрытия или созданием отверстий после фиксирования антитромботического средства.
Фиг.9С иллюстрирует законченный стент в соответствии с этим примерным вариантом осуществления. Как иллюстрировано в этой фигуре, множество по существу круглых отверстий 902 были заполнены одним или более терапевтическими препаратами для лечения сосудистых заболеваний, таких как рестеноз и воспаление, или любых других заболеваний, как здесь описано. Каждое отверстие 902 может быть заполнено одним и тем же терапевтическим препаратом или различными препаратами, как подробно описано выше. Как иллюстрировано на фигуре, эти различные препараты 912, 914 и 916 использованы в конкретной компоновке; однако, как конкретизировано выше, возможна любая комбинация, а также употребление одиночного препарата с различающимися концентрациями. Лекарственные средства, такие как рапамицин, могут быть осаждены в отверстия 902 любым пригодным образом. Способы осаждения средства включают микропипетирование и/или методы струйного заполнения. В одном примерном варианте осуществления заполнение лекарственным препаратом может быть выполнено так, чтобы лекарственный препарат и/или композиция из лекарственного препарата и полимерной матрицы в отверстии содержались ниже уровня поверхностей стента во избежание контакта с окружающей тканью. Альтернативно, отверстия могут быть заполнены так, чтобы лекарственный препарат и/или композиция из лекарственного препарата и полимерной матрицы могли контактировать с окружающей тканью. В дополнение, общая доза каждого из лекарственных препаратов, если употребляют множественные лекарственные средства, может быть рассчитана с максимальной гибкостью. Кроме того, скорость высвобождения каждого из лекарственных препаратов может быть отрегулирована индивидуально. Например, отверстия вблизи концов могут содержать бóльшие количества лекарственных препаратов для лечения краевого рестеноза.
В соответствии с примерным вариантом осуществления полость или отверстия могут быть конфигурированы не только для наибольшей эффективности лекарственной терапии, но и для обеспечения физического разделения различных лекарственных средств друг от друга. Это физическое разделение может способствовать предотвращению взаимодействия между средствами.
Как употребляемый здесь, рапамицин включает рапамицин и все аналоги, производные и конъюгаты, которые связаны с цитозольным белком FKBP12 и прочими иммунофилинами, и обладают такими же фармакологическими свойствами, как рапамицин, включая ингибирование киназы TOR (мишени для рапамицина). В дополнение, все лекарственные препараты и средства, описанные здесь, включают аналоги, производные и конъюгаты таковых.
Как здесь описано, стент, имеющий сквозные отверстия, полости, резервуары или отверстия в таковом, может быть покрыт антитромботическим средством и/или лекарственным препаратом, или комбинацией одного или более терапевтических препаратов, по отдельности или в сочетании с одним или более полимерами. По существу, стент может быть изготовлен с отверстиями в таковом, и перед добавлением или осаждением терапевтических препаратов, по отдельности или в комбинации с одним или более полимерами в отверстия, на стенте или на части такового может быть зафиксировано антитромботическое средство, с материалом носителя или без такового. В примерном варианте осуществления, как здесь описано, люминальная и аблюминальная поверхности стента, а также поверхности стенок отверстий могут быть покрыты антитромботическим средством. В этом примерном варианте осуществления антитромботическое средство включает гепарин или его разнообразные производные, такие как гепарин с низкой молекулярной массой (LMWH), хотя может быть использовано любое число пригодных антитромботических средств. Гепарин и/или низкомолекулярный гепарин (LMWH) имеют очень высокие отрицательные заряды.
На всей поверхности описываемого здесь стента в целом, включая внутренние поверхности сквозных проемов или отверстий, которые становятся резервуарами для терапевтического препарата и/или комбинации полимеров и терапевтического препарата, сначала формируют ковалентно связанное покрытие из гепарина. Само гепариновое покрытие связывается с металлической поверхностью стента с помощью своего собственного грунтовочного материала, включающего перемежающиеся слои из полиэтиленимина, катионного полимера с высокой адсорбцией, известного под сокращенным наименованием PEI, и сульфата декстрана, полимерного аниона. Применение такого рода грунтовочного материала известно в технологии и изложено в ряде патентов, в том числе в патентах США №№ 5213898, 5049403, 6461665 и 6767405. Более конкретно, гепарин ковалентно связывается с грунтовочным материалом, включающим слои из полиэтиленимина (PEI) и сульфата декстрана, который, в свою очередь, связывается с металлической поверхностью. Когда все поверхности покрыты гепариновой смесью, каждое из отверстий, или резервуаров, заполняют с использованием одного из описываемых здесь способов.
В соответствии с еще одним примерным вариантом осуществления настоящее изобретение направлено на грунтовочные композиции и конфигурации для улучшения адгезии доставляющей лекарственное средство матрицы, например комбинации терапевтического препарата и полимера, к покрытой гепарином поверхности медицинского устройства, например стента. Настоящее изобретение является в особенности преимущественным там, где гепариновое покрытие ковалентно связано с металлической или полимерной поверхностью медицинского устройства. В настоящем изобретении грунтовочный материал предпочтительно включает компонент с высокой молекулярной массой или компонент с низкой молекулярной массой, и доставляющая лекарственный препарат матрица включает лекарственный препарат и/или другое благотворно действующее средство и формообразующий материал, предпочтительно полимерный формообразующий материал. В дополнение, грунтовочный материал предпочтительно также может включать материал, имеющий противоположный электрический заряд и сходную плотность заряда относительно таковых для нижележащего слоя, например гепарина.
Концепция грунтовочного материала поверх гепаринового слоя или покрытия для усиления сцепления покрытой гепарином поверхности с любой другой матрицей или покрытием является уникальной, если принимать во внимание, что типично гепариновую поверхность используют для придания антитромботических свойств и поэтому не покрывают при практическом применении. В настоящем изобретении только поверхности внутренних стенок проемов или отверстий в стенте, которые представляют собой резервуары для комбинаций «лекарственный препарат/полимер», будут покрыты грунтовочным материалом согласно настоящему изобретению, тем самым усиливая адгезию между двумя слоями и ограничивая потенциальную потерю матрицы «лекарственный препарат/полимер», без существенного негативного влияния на поверхность гепарина за пределами резервуаров. Важно отметить, что грунтовочные материалы, блокирующие гепарин в соответствии с настоящим изобретением, являются биосовместимыми в плане их первоначального предполагаемого употребления.
Грунтовочный материал согласно настоящему изобретению может быть использован в любом типе стента. В описываемом здесь примерном варианте осуществления грунтовочный материал применяют со стентом или стентами, иллюстрированными на фиг.1, 2, 3 и 4.
В соответствии с одним примерным вариантом осуществления грунтовочный материал включает полимерно-полиэтилениминные конъюгаты, например сополимер молочной и гликолевой кислот (PLGA) и полиэтиленимин (PEI), и/или PLGA-протамин. Полиэтиленимин представляет собой высококатионный полимер, который связывается с определенными отрицательно заряженными белками или полисахаридами. В дополнение к полиэтиленимину (PEI), другим материалом, пригодным для этого конъюгата, является протамин. Протамин представляет собой разрешенное лекарственное средство на основе белка с низкой молекулярной массой, которое употребляют в качестве антидота гепарина. Он слабо растворяется в воде. Этим путем грунтовочный материал может одновременно и интенсивно взаимодействовать как с гепариновым покрытием, так и содержащей лекарственный препарат матрицей, тем самым улучшая адгезию между двумя субстанциями. Поскольку гепарин представляет собой полианионное вещество, предполагается, что такое поликатионное вещество, как протамин, прочно связывалось бы с гепарином, но было бы достаточно гидрофобным в других фрагментах своей структуры, чтобы обеспечивать прочное связывание PLGA-компонента матрицы «лекарственное средство/полимер» в резервуаре.
Реакции связывания между сополимером молочной и гликолевой кислот (PLGA) и полиэтиленимином (PEI) и полиэтиленимином (PEI) и гепарином могут представлять собой реакции ионного связывания или ковалентного связывания. Фиг.10 иллюстрирует пример ковалентного связывания между PLGA и PEI. Более конкретно, фиг.10 иллюстрирует реакцию сочетания между сополимером молочной и гликолевой кислот (PLGA), имеющим концевую кислотную карбоксильную группу, и полиэтиленимином (PEI) с низкой молекулярной массой. Альтернативно, грунтовочный материал может включать полиэтиленимин (PEI) с высокой молекулярной массой или разветвленный полиэтиленимин (PEI). С привлечением фиг.11, иллюстрирована реакция сочетания между сополимером молочной и гликолевой кислот (PLGA), имеющим концевую кислотную карбоксильную группу, и полиэтиленимином (PEI) с высокой молекулярной массой или разветвленным PEI. Как иллюстрировано, реакция может быть организована для соотношения «один-к-одному» или с образованием конъюгата “PLGA-PEI-PLGA” при отношении 2:1 между PLGA и PEI.
Нижеприведенная таблица 2 иллюстрирует степень эффективности полиэтиленимина (PEI) в качестве грунтовочного материала для повышения адгезии комплекса «лекарственный препарат/полимер» к покрытым гепарином поверхностям. Испытуемые стенты погружают в тестируемую среду, включающую фосфатно-солевой буфер и бычий сывороточный альбумин, которая имитирует условия физиологической текучей среды. Комплекс «лекарственный препарат/полимер» включает рапамицин и сополимер молочной и гликолевой кислот (PLGA).
В альтернативном примерном варианте осуществления грунтовочный материал может включать катионы с низкой молекулярной массой, образующие комплексы с гепарином, в том числе бензалкония хлорид и/или олигомерные аргининовые пептиды, или катионные комплексообразователи с высокой молекулярной массой, в том числе полилизин, полиаргинин, протамин, поли(диметиламиноэтил)метакрилат или поли(диметиламиноэтил)акрилат.
В соответствии с настоящим изобретением способ повышения адгезии лекарственного комплекса к гепарину может включать нанесение стимулирующего адгезию грунтовочного материала с последующим заполнением раствором полимера и лекарственного препарата или нанесение стимулирующего адгезию грунтовочного материала с последующим заполнением раствором сополимера молочной и гликолевой кислот (PLGA), имеющего концевую кислотную карбоксильную группу, или смеси имеющего концевую кислотную карбоксильную группу и регулярного PLGA и системы «PLGA/лекарственный препарат».
Грунтовочный материал согласно настоящему изобретению наносят на внутренние, покрытые гепарином стенки проемов или отверстий в стенте перед тем, как отверстия заполняют матрицей для локальной доставки лекарственного препарата. Другими словами, в готовом стенте, выделяющем лекарственный препарат, грунтовочный материал будет занимать пространство между поверхностью гепаринового покрытия и массивом выделяющей лекарственный препарат матрицы и будет повышать адгезию между гепариновым покрытием и выделяющей лекарственный препарат матрицей. Усиление адгезии достигается благодаря многочисленным факторам, включающим снижение осмотической концентрации раствора и инфильтрации воды в гепариновое покрытие при употреблении после нейтрализации зарядов с помощью катионного грунтовочного материала, снижение растворимости в воде комплекса «гепарин/катионный грунтовочный материал» сравнительно с самой поверхностью гепарина, ионное связывание, ковалентное связывание и улучшенную физическую адгезию между грунтовочным материалом и матрицей «полимер/лекарственный препарат» благодаря поверхностному натяжению и тому подобные.
В еще одном примерном варианте осуществления настоящего изобретения грунтовочный материал согласно настоящему изобретению предпочтительно будет иметь часть своей молекулярной структуры, которая заряжена положительно для связывания с отрицательно заряженным гепариновым покрытием, и часть, которая является гидрофобной, гидрофильной или сбалансированной в этом отношении, для связывания с полимерным компонентом доставляющей лекарственный препарат матрицы. Эта часть грунтовочного материала будет варьировать в зависимости от природы доставляющей лекарственный препарат матрицы. Более конкретно, грунтовочный материал предназначен для улучшения адгезии доставляющей лекарственный препарат матрицы к покрытым гепарином отверстиям в стенте так, чтобы ни одно(один) или по существу ни одно(один) из отверстий или резервуаров не теряли своего содержимого, когда стент приходит в контакт с текучими средами на водной основе, такими как физиологический раствор, кровь и/или межклеточная жидкость.
Хотя грунтовочный материал согласно настоящему изобретению был описан как предназначенный конкретно для повышения адгезии между покрытыми гепарином внутренними стенками резервуара в стенте и заполняющей резервуар смесью лекарственного препарата и полимера, он может быть полезным для прикрепления или связывания любого субстрата с частью покрытой гепарином поверхности. Например, контактирующие с кровью полимерные медицинские устройства часто покрывают гепарином для сведения к минимуму тромбоза на устройстве, но это может быть желательным для последующего связывания с такой поверхностью. Смесь грунтовочных материалов согласно настоящему изобретению в растворителе можно нанести на выбранный участок устройства, испарить растворитель для создания покрытой грунтовочным материалом области на поверхности гепарина, и затем новая подсистема может быть последовательно связана с покрытой грунтовочным материалом областью.
Грунтовочный материал преимущественно наносят в виде раствора полимерного грунтовочного материала в растворителе, таком как диметилсульфоксид (DMSO, ДМСО), N-метилпирролидон или водные смеси таковых, и он может быть введен в резервуары с использованием любого из способов заполнения, описанных в настоящей заявке. Такой раствор грунтовочного материала может быть затем высушен для создания покрытия из слоя грунтовочного материала поверх покрытой гепарином поверхности. Предпочтительно нанесение слоя грунтовочного материала потребует проведения только одиночной стадии осаждения в процессе заполнения стента. Выбор пригодного растворителя для осаждения катионного грунтовочного материала определяется главным образом его способностью растворять грунтовочный материал и его совместимостью с приспособлением для заполнения и описываемым здесь способом.
Настоящее изобретение может быть просто охарактеризовано как имплантируемое медицинское устройство. Медицинское устройство включает интралюминальный скаффолд, имеющий множество отверстий в таковом, первое покрытие, включающее материал, имеющий первый электрический заряд, закрепленный по меньшей мере на части поверхности интралюминального скаффолда и поверхности множества отверстий, второе покрытие, включающее материал, имеющий второй электрический заряд, зафиксированный по меньшей мере на части первого покрытия, причем второй электрический заряд противоположен первому электрическому заряду, и по меньшей мере один терапевтический препарат, осажденный по меньшей мере в одном из множества отверстий, в котором второе покрытие скомпоновано как промежуточный слой между первым покрытием и по меньшей мере одним терапевтическим препаратом.
Первое покрытие может включать любое антитромботическое средство, как здесь описанное. Например, может быть использован полисахарид, такой как гепарин. Второе покрытие может включать полимерный катион или полимерный конъюгат, имеющий катионные сегменты, как здесь описано. Примеры полимерных катионов включают олигомерные аргининовые пептиды, полилизин, полиаргинин, протамин, поли(диметиламиноэтил)полиэтиленимин. Примеры полимерных катионных конъюгатов включают первый компонент, такой как сополимер молочной и гликолевой кислот, и второй компонент, включающий любой из вышеизложенных катионов. Терапевтический препарат может включать средство против рестеноза, противовоспалительный препарат, антитромботическое средство, антипролиферативное средство, средство для сведения к минимуму повреждения инфарктной ткани или любые комбинации таковых.
В более общем смысле, концепция настоящего изобретения может быть распространена так, чтобы включать грунтовочные материалы, которые усиливают прочность сцепления между гидрофильными и гидрофобными поверхностями. Например, прочие представляющие интерес гидрофильные поверхности относятся к так называемым покрытиям «с хорошей смазываемостью», таким как таковые, употребляемые с сочетании с катетерами. Эти гидрофильные поверхности часто являются ковалентно связанными, но могут быть просто конформными покрытиями. Примеры химических структур, которые имеют место в покрытиях с хорошей смазываемостью, представляют собой основанные на поливинилпирролидоне, гидроксиэтилметакрилате, полиэтиленоксиде или полиэтиленгликоле и тому подобные.
Как здесь описано, стент, имеющий сквозные проемы, полости, резервуары или отверстия любого типа в таковом, может быть покрыт антитромботическим средством или комбинацией средств и иметь отверстия, заполненные одним или более терапевтическими препаратами по отдельности или в комбинации с полимерным материалом. В изложенных здесь примерных вариантах осуществления один или более терапевтических препаратов может заполнять отверстия в стенте непосредственно в контакте с антитромботическим средством или, более предпочтительно, через слой или покрытие из грунтовочного материала. Однако в соответствии с еще одним примерным вариантом осуществления один или более терапевтических препаратов, по отдельности или в комбинации с полимерным материалом, может находиться в непосредственном контакте со стенками резервуаров или отверстий, тогда как остальные поверхности стента являются покрытыми антитромботическим покрытием в результате применения способа маскирования, подробнее описанного ниже. Наличие одного или более терапевтических препаратов, по отдельности или в комбинации с полимером, при обеспечении непосредственного контакта с внутренними стенками резервуаров или отверстий, имеет результатом повышенную адгезию без необходимости в слое грунтовочного материала, как описанного выше.
В соответствии с этим новым примерным вариантом осуществления настоящее изобретение направлено на способ маскирования и демаскирования для создания покрытого гепарином стента, имеющего резервуары или отверстия в таковом, в котором гепариновое покрытие покрывает все поверхности стента, за исключением внутренних стенок резервуаров или отверстий в стенте. Хотя на всем протяжении настоящего описания употребляется гепарин, важно отметить, что может быть использовано любое антитромботическое средство. При применении описываемого здесь способа маскирования и демаскирования стент, который может быть сконструирован из любого биосовместимого материала, включающего металлы, сплавы и полимеры, может быть снабжен гепариновым покрытием, которое покрывает определенные поверхности, такие как люминальные, аблюминальные или пристеночные, и боковые поверхности продольных и соединительных элементов, но не покрывает внутренние стенки резервуаров или отверстий. Этим путем резервуары или отверстия могут быть заполнены в соответствии с описанными здесь способами, с дополнительным грунтовочным материалом или без такового.
Общая концепция настоящего изобретения состоит в нанесении полимерной маски на поверхности резервуаров или отверстий в элементах стента до покрытия стента антитромботическим средством, например гепарином, и затем в удалении полимерной маски и части, или предпочтительно всего целиком, любого гепаринового покрытия, прилипшего поверх маски, тем самым создавая стент, имеющий резервуары или отверстия по существу с обнаженными металлическими поверхностями, тогда как прочие части остаются покрытыми гепарином.
Способ маскирования и демаскирования стента и конечная конфигурация стента могут быть разъяснены с привлечением фиг.12А, 12В и 12С. Фиг.12А, 12В и 12С представляют изображения поперечного сечения элемента стента с отверстием или резервуаром в таковом. Стент может иметь любую пригодную конфигурацию, такую, как у стентов, иллюстрированных на фиг.1, 2, 3 и 4. Первая стадия способа включает нанесение полимерной маски на внутренние стенки резервуаров или отверстий в стенте. Фиг.12А иллюстрирует полимерную маску 1202 на внутренней поверхности 1204 отверстия в стенте 1206. Стадия маскирования включает частичное или полное заполнение резервуаров или отверстий полимерным материалом с использованием любого из описываемых здесь способов заполнения. Следующая стадия способа включает нанесение на все поверхности стента покрытия из антитромботического средства, такого как гепарин. Гепариновое покрытие может быть нанесено с использованием любого из описываемых здесь способов и материала. Фиг.12В иллюстрирует гепариновое покрытие 1208 на всей поверхности стента 1206, в том числе на полимерной маске 1202 в резервуарах или отверстиях. Конечная стадия этого способа включает демаскирование, или удаление, полимерной маски 1202 и части, или предпочтительно всего целиком, любого гепаринового покрытия, присоединенного к полимерной маске. Эта стадия может быть выполнена любым подходящим путем. В предпочтительном примерном варианте осуществления маска 1202 может быть удалена растворением полимерной маски в подходящем растворителе, таком как ацетон, в как таковом или в сочетании с перемешиванием растворителя с использованием ультразвукового облучения. Ключевой момент настоящего изобретения состоит в том, что гепариновое покрытие не удаляется с любых поверхностей, иных, нежели таковые в резервуарах или отверстиях, и в сохранении существенной части биоактивных компонентов антитромботических средств. Как только маска была удалена, терапевтический препарат, сам по себе или в комбинации с полимерным материалом, может быть осажден в отверстиях, как здесь описано. Фиг.12С иллюстрирует конечную конфигурацию стента с резервуарами или отверстиями, заполненными терапевтическим препаратом и/или матрицей 1210 из терапевтического препарата и полимерного материала, как здесь описано.
Полимерная маска может включать любой пригодный полимер или комбинацию полимеров, включая биоустойчивые и саморассасывающиеся полимеры. Полимер или комбинация полимеров может включать компоненты с различными молекулярными массами и составными частями. В предпочтительном примерном варианте осуществления полимерная маска включает сополимер молочной и гликолевой кислот (PLGA). Полимерная маска может быть осаждена в соответствии с любым из описываемых здесь способов. По существу, сополимер молочной и гликолевой кислот (PLGA) смешивают с диметилсульфоксидом (DMSO, ДМСО) для образования раствора, который затем наносят на стенки, как описано выше. После того как поверхность резервуаров или отверстий была покрыта и избыток раствора удален, растворитель удаляют с помощью процесса испарения, оставляя полимерную маску в виде поверхностного покрытия в резервуарах или отверстиях. Типично для получения оптимальной толщины маски достаточно осаждение от двух до пяти слоев раствора. Как описано выше, все поверхности стента, в том числе полимерную маску, затем покрывают гепарином. Соответственно этому покрытые полимером резервуары или отверстия будут иметь гепариновое покрытие, которое не является предпочтительным. Стенты затем подвергают воздействию растворителя, такого как ацетон, который может растворять маску, и обрабатывают ультразвуком в течение заранее заданных периодов времени, продолжительность которых варьирует от приблизительно пяти минут до приблизительно одного часа, для удаления полимерной маски и связанного с нею гепаринового покрытия в резервуарах или отверстиях, в то же время сохраняя покрытие из активного гепарина на остальных поверхностях стента. Сохранение биоактивности гепарина после удаления полимерной маски продемонстрировано в нижеследующей таблице.
Таблица 3 представляет сравнение активности и плотности гепарина до и после удаления полимерной маски в ацетоне с обработкой ультразвуком.
Результаты явственно демонстрируют, что как активность гепарина, что определено испытанием связывания антитромбина, так и поверхностная плотность гепарина сохраняются после облучения ультразвуком в ацетоне в процессе демаскирования.
Внутренние поверхности резервуаров или отверстий теперь возвращаются в состояние с обнаженной металлической поверхностью и могут быть заполнены композицией из терапевтического препарата и полимера с использованием вышеописанного способа. Стенты, приготовленные с использованием этой методологии, были протестированы, и результаты приведены ниже в таблице 4.
Как иллюстрировано в вышеприведенной таблице, результаты этого способа четко показывают, что удаление части, или предпочтительно всего целиком, любого покрытия из резервуаров или отверстий повышает адгезию матрицы из терапевтического препарата и полимера.
В предпочтительном примерном варианте осуществления резервуары или отверстия заполняют комбинацией рапамицина, такого как сиролимус, и полимерного формообразующего материала. В этом предпочтительном примерном варианте осуществления полимерный формообразующий материал включает PLGA. Однако, как здесь описано, резервуары или отверстия могут быть заполнены многообразными средствами и полимерами, а также в разнообразных конфигурациях.
Следует отметить, что в дополнение к употреблению энергии ультразвука в процессе удаления маски может быть использована любая пригодная форма энергии. Например, может быть применена тепловая энергия. По существу, во время процесса демаскирования растворитель может быть нагрет.
Следует также отметить, что терапевтические препараты могут быть смешаны с любым числом описываемых здесь пригодных полимеров. Полимер может представлять собой биоустойчивый полимер, в том числе полиметакрилат, полиакрилат и полистирол, или полимер может быть саморассасывающимся полимером, включающим полилактид, сополимер молочной и гликолевой кислот и сополимер гликолида и капролактона.
Хотя то, что показано и описано, представляется наиболее практичными и предпочтительными вариантами осуществления, очевидно, что отклонения от конкретных описанных и показанных компоновок и способов будут предложены квалифицированными специалистами в этой области технологии и могут быть использованы без выхода за пределы смысла и области изобретения. Настоящее изобретение не ограничивается конкретными описанными и иллюстрированными конструкциями, но должно трактоваться как охватывающее все модификации, которые могут входить в пределы области прилагаемых пунктов формулы изобретения.
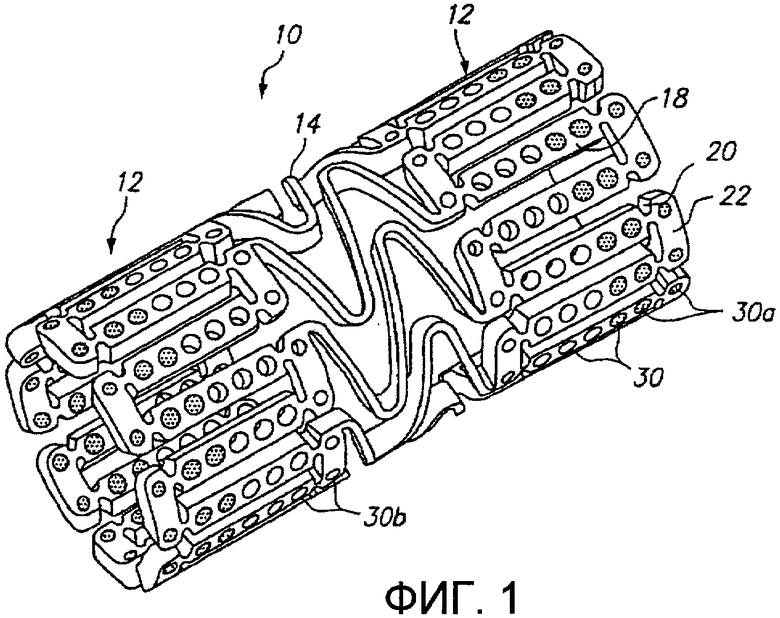
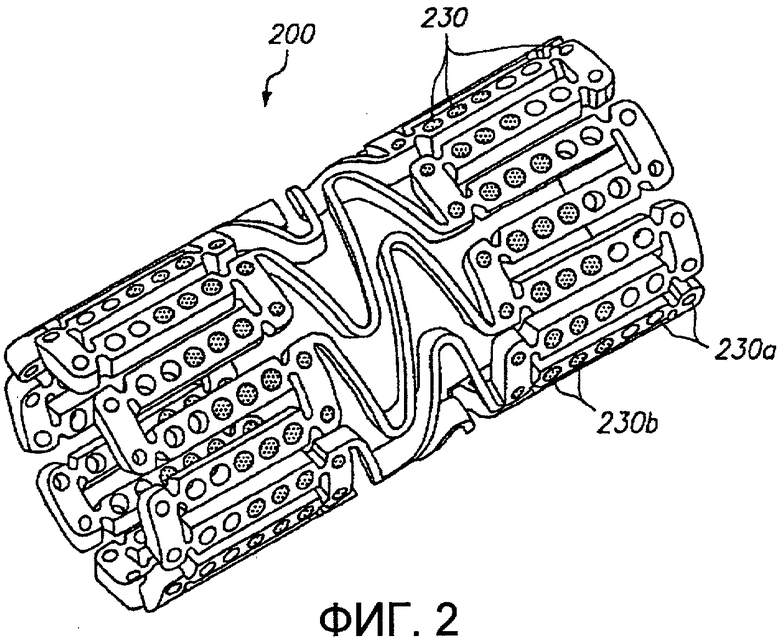
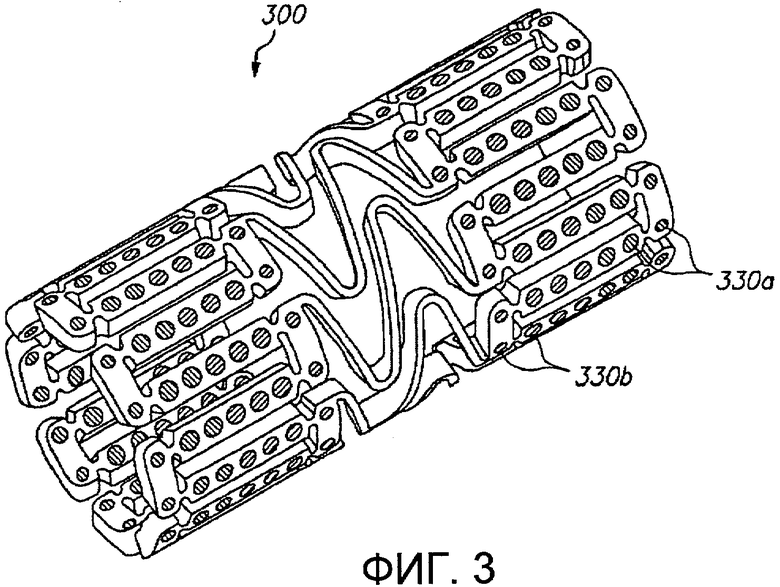
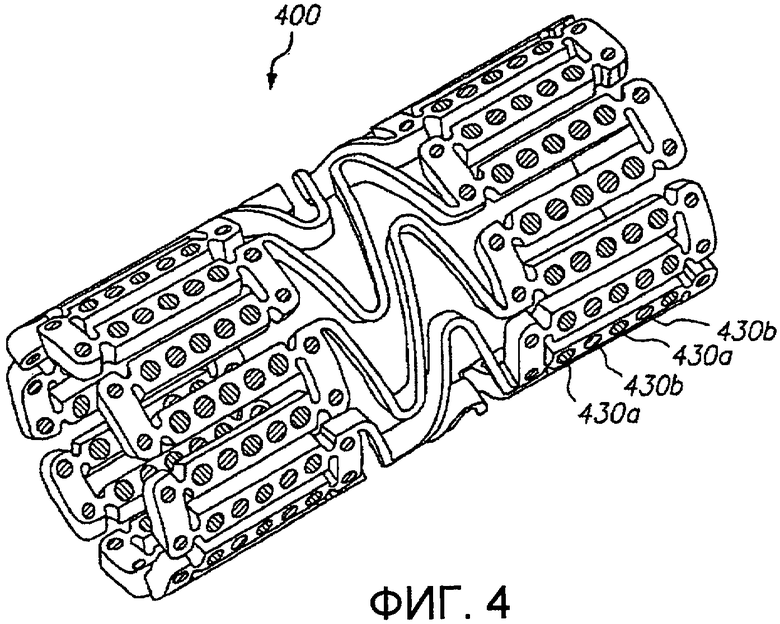




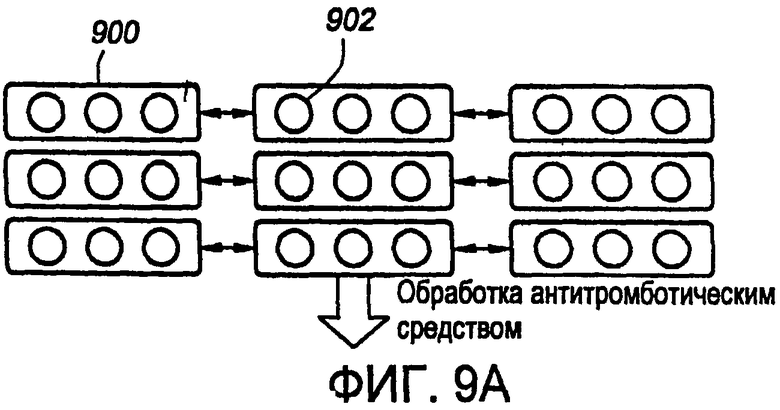



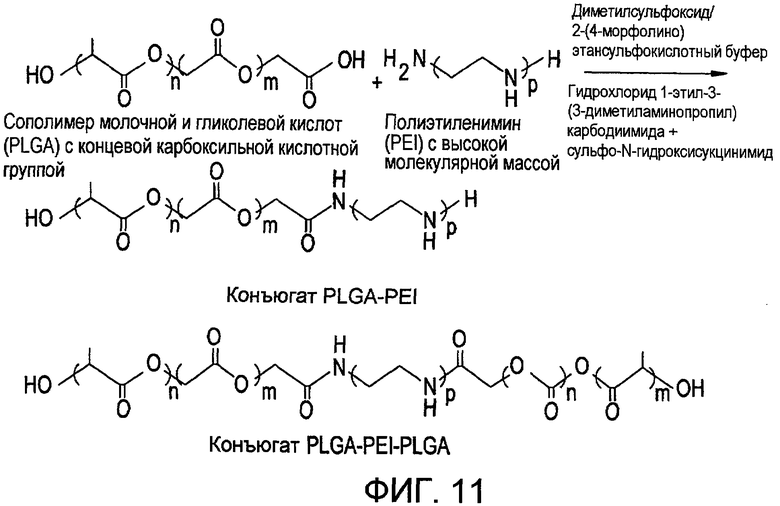

Группа изобретений относится к медицине, а именно к сосудистой хирургии и кардиологии, и может быть использована при проведении стентирования. Предложено имплантируемое медицинское устройство, представляющее собой цилиндрический интралюминальный скаффолд, выполненный из множества секций и мостиковых элементов, имеющий люминальную поверхность и аблюминальную поверхность, множество сквозных отверстий, расположенных на секциях и мостиковых элементах. Антитромботическое покрытие, закрепленное только на люминальной и аблюминальной поверхностях и поверхностях стенок интралюминального скаффолда, а не на поверхности сквозных отверстий. Терапевтический препарат, размещенный по меньшей мере в одном из множества сквозных отверстий, при этом терапевтический агент не является антитромботическим покрытием и не покрывается антитромботическим покрытием. Также предложен способ покрытия интралюминального скаффолда путем нанесения маски на внутренние поверхности отверстий и удаления ее после нанесения на скаффолд антитромботического материала. Изобретения обеспечивают эффективную профилактику и лечение рестеноза за счет локальной одновременной доставки различных лекарственных препаратов на стенте, закрепленных посредством усиленной адгезии и приемов маскирования и демаскирования. 2 н. и 12 з.п. ф-лы, 4 табл., 12 ил., 3 пр.
1. Способ покрытия интралюминального скаффолда, имеющего множество отверстий в таковом, включающий:
нанесение маски на внутренние поверхности множества отверстий в интралюминальном скаффолде;
нанесение покрытия на поверхности интралюминального скаффолда, покрытия, включающего антитромботический материал;
удаление маски и любого покрытия, прилипшего к маске, с внутренних поверхностей множества отверстий в интралюминальном скаффолде; и
заполнение множества отверстий одним или более терапевтическими препаратами.
2. Способ покрытия интралюминального скаффолда по п.1, в котором стадия нанесения маски включает контактирование внутренних поверхностей множества отверстий с раствором полимера и первого растворителя по меньшей мере один раз.
3. Способ покрытия интралюминального скаффолда по п.1, в котором стадия нанесения покрытия включает контактирование поверхностей интралюминального стента по меньшей мере со слоем грунтовочного материала для антитромботического материала, с последующим контактированием слоя грунтовочного материала с антитромботическим покрытием.
4. Способ покрытия интралюминального скаффолда по п.1, в котором стадия удаления маски включает контактирование маски со вторым растворителем и подведение ультразвуковой энергии ко второму растворителю, находящемуся во множестве отверстий.
5. Способ покрытия интралюминального скаффолда по п.1, в котором стадия удаления маски включает контактирование маски со вторым растворителем и подведение тепловой энергии ко второму растворителю, находящемуся во множестве отверстий.
6. Имплантируемое медицинское устройство, включающее:
по существу цилиндрический интралюминальный скаффолд, выполненный из множества секций и мостиковых элементов, имеющий люминальную поверхность и аблюминальную поверхность, где интралюминальный скаффолд также включает множество сквозных отверстий, простирающихся между люминальной и аблюминальной поверхностями и определяемых внутренней поверхностью, и где множество сквозных отверстий расположено на по меньшей мере одном из множеств секций и мостиковых элементов;
антитромботическое покрытие, закрепленное только на люминальной и аблюминальной поверхностях и поверхностях стенок интралюминального скаффолда, а не на поверхности сквозных отверстий; и
по меньшей мере один терапевтический препарат, размещенный по меньшей мере в одном из множества сквозных отверстий и находящийся в непосредственном контакте с внутренними поверхностями такового, где по меньшей мере терапевтический агент не является антитромботическим покрытием, закрепленным на люминальной и аблюминальной поверхностях интралюминального скаффолда, и где по меньшей мере терапевтический агент не покрывается антитромботическим покрытием.
7. Имплантируемое медицинское устройство по п.6, в котором антитромботическое средство включает полисахарид.
8. Имплантируемое медицинское устройство по п.7, в котором полисахарид включает сульфированный полисахарид.
9. Имплантируемое медицинское устройство по п.7, в котором полисахарид включает гепарин.
10. Имплантируемое медицинское устройство по п.6, в котором по меньшей мере один терапевтический препарат включает комбинацию полимера и по меньшей мере одного средства, выбранного из группы, состоящей из средства против рестеноза, противовоспалительного препарата, антитромботического средства, антипролиферативного средства и кардиопротектора.
11. Имплантируемое медицинское устройство по п.10, в котором полимер включает биоустойчивый полимер.
12. Имплантируемое медицинское устройство по п.11, в котором биоустойчивый полимер выбирают из группы, состоящей из полиметакрилата, полиакрилата и полистирола.
13. Имплантируемое медицинское устройство по п.10, в котором полимер включает саморассасывающийся полимер.
14. Имплантируемое медицинское устройство по п.13, в котором саморассасывающийся полимер выбирают из группы, состоящей из полилактида, сополимера молочной и гликолевой кислот и сополимера гликолида и капролактона.
| US 7195640 B2, 27.03.2007 | |||
| US 20050070996 A1, 31.03.2005 | |||
| US 20050033417 A1, 10.02.2005 | |||
| US 6663662 B2, 16.12.2003 | |||
| US 20060184237 A1, 17.08.2006 | |||
| WO 2006116989 A2, 09.11.2006 |
Авторы
Даты
2014-08-27—Публикация
2009-12-22—Подача