Изобретение относится к медицине и может быть использовано в кардиологии или терапии.
Известны способы разделения на фракции липопротеинов крови методом аналитического ультрацентрифугирования (Климов А.Н., Никульчева Н.Г. Липиды, липопротеины и атеросклероз. - Питер, пресс, с.98-102). Известен способ разделения на фракции ЛП в полиакриламидном геле (Шацкая Н.Н. Биохимические исследования в оценке состояния сердечнососудистой системы. В кн. "Методы исследований в профпатологии", Москва, 1988, с.95-97).
Известны также способы разделения на фракции ЛП путем электрофореза в геле агарозы (Лаб. Методы исследования / Под редакцией В.В.Меньшикова. М.: Медицина, 1987, с.248-249), SU 1720015 А, 15.03.1992, RU 2063040 C1, 27.06.1996, RU 2115121 C1, 10.07.1998, RU 2097038 C1, 27.11.1997, RU 2060034 C1, 20.05.1996, EP 0074610 A, 23.03.1983.
Недостатком данных способов является то, что они не позволяют выявить все фракции ЛП крови, включая хиломикроны (ХМ), липопротеины высокой плотности (ЛПВП), липопротеины низкой плотности (ЛПНП), липопротеины очень низкой плотности (ЛПОНП) и ЛП(а), а служат для разделения на фракции ХМ, ЛПВП, ЛПНП, ЛПОНП от комплекса альбумина с неэтерифицированными жирными кислотами, а также не позволяют выявить минорные фракции модифицированных липопротеинов крови, а именно модифицированных Lipoprotein abnormal (Lp(a) или ЛП(а)).
Известен способ оценки эффективности лечения ишемической болезни сердца (ИБС) RU фракций липопротеинов крови авторов Канской Н.В., Федоровой Н.А., Перовой Н.В., Гарганеевой Н.П., Кожановой А.А., Байкова А.Н., Канского А.В., Похряева Е.Н., RU 2210077 С2, опубликованный 10.08.2003.
Способ оценки эффективности лечения ИБС включает определение до и после начала лечения уровня модифицированных ЛП(а) путем инкубации 7% ПЭГ-6000 преципитата сыворотки крови больного с раствором Судана Б в течение 1 ч в темном термостате при 40°С и затем внесения пробы в лунку в геле агарозы с площадью основания 4×20 мм для электрофореза и последующей денситометрии. Данный способ является наиболее близким к предлагаемому по технической сущности и достигаемому результату и выбран в качестве прототипа. Недостатком данного способа является то, что он не позволяет достаточно точно оценить эффективность лечения ИБС, т.к. не позволяет достаточно точно выявить минорные фракции модифицированных ЛП(а). Это связано с тем, что минорная фракция ЛП(а) является наиболее атерогенной.
Целью предлагаемого изобретения является повышение точности способа. Указанная цель достигается тем, что исследуется сыворотка крови больного ИБС до и после лечения. Модифицированные ЛП(а) определяют путем обработки 0,6 мл сыворотки крови 0,2 мл 0,1% раствором Тритона X-100, инкубацией 15 минут при 20°С, с последующим добавлением 7% раствора полиэтиленгликоля 6000, инкубацией с красителем Суданом Б при 40°С в течение 1 ч с последующим электрофоретическим разделением ЛП в геле агарозы в лунке 4×20 мм и при снижении уровня модифицированных ЛП(а) на 40% и более по сравнению с исходным уровнем оценивают лечение ишемической болезни сердца как эффективное. Новым в данном способе является то, что дополнительно перед инкубацией 7% ПЭГ-6000 сыворотку крови обрабатывают 0,1% раствором Тритона Х-100 и эффективность лечения оценивают по снижению уровня модифицированных ЛП(а) на 40% и более по сравнению с исходным уровнем. Следовательно, только комплексная модернизация способа-прототипа позволяет получить желаемый результат. Для получения ПЭГ-6000 преципитата сыворотки крови использовался 7%-ный раствор ПЭГ-6000. 7%-ный ПЭГ-6000 является предельной концентрацией для получения преципитатов сыворотки крови, содержащих иммунные комплексы и не содержащих грубодисперсных белков сыворотки крови. Применение 6%-ного раствора ПЭГ-6000 не позволяет полностью осадить иммунные комплексы сыворотки крови. Поэтому для повышения точности способа экспериментальным путем была выбрана 7%-ная концентрация ПЭГ-6000, позволяющая, с одной стороны, полностью осадить иммунные комплексы из сыворотки крови с гарантией отсутствия грубодисперсных (высокомолекулярных) белков сыворотки крови, а с другой стороны, позволяющая полностью осадить циркулирующие иммунные комплексы (ЦИК), присутствующие в сыворотке крови. Так, в случае концентрации ЦИК в сыворотке крови, равной 2,5 г/л, эта же концентрация ЦИК выявлена в 7%-ных преципитатах сыворотки крови (с результатом +3%), что связано с увеличением числа манипуляций, а не изменением концентрации ЦИК в преципитатах сыворотки крови.
Инкубация 7% ПЭГ-6000 преципитата исследуемой сыворотки крови с красителем Судана Б повышает сродство красителя к ЛП преципитатов крови, а большой объем взятого для исследований образца крови позволяет выявить модифицированные ЛП(а), содержащиеся в крови больных ишемической болезнью сердца (ИБС) в очень низких концентрациях. Дополнительная обработка сыворотки крови тритоном Х-100 позволяет повысить точность способа и получить желаемый результат. Предлагаемый способ позволяет выявлять следующие минорные фракции модифицированных ЛП: ЛПВП, ЛПНП, ЛПОНП и ЛП(а).
Каждый вновь введенный в формулу изобретения признак выполняет функцию повышения точности и эффективности способа: обработка 0,6 мл пробы сыворотки крови пациента 0,2 мл 0,1% раствора тритон Х-100, инкубация пробы при 20°С в течение 15 мин и дополнительное выявление минорных фракций модифицированных липопротеинов.
Исследование ЛП разных классов при диагностике ишемической болезни сердца (ИБС) рекомендовано Всероссийским научным обществом кардиологов согласно положению рекомендаций Европейского общества по изучению атеросклероза - Диагностика и коррекция нарушений липидного обмена с целью профилактики и лечения атеросклероза (г.Москва, 2005 г.; Клиническая лабораторная диагностика, №10, 2008 г., с.21-32).
В настоящее время перспективными являются методы исследования липидов с детергентами /Тритон Х-100 и др./ В лабораторной практике все больше используются прямые или гомогенные методы определения липопротеинов (ЛП) и их липидов. Такие методы основаны на использовании различных детергентов, способных блокировать или солюбилизировать классы ЛП для специфического выделения ЛПВП, ЛПНП и других фракций ЛП.
При использовании таких методов изоляция других классов ЛП не требует дополнительных операций и концентрацию холестерина (ХС) в классах ЛП можно определить напрямую в сыворотке крови общепринятыми ферментными методами в той же кювете (Клиническая лабораторная диагностика, №10, 2008 г., с.21-32).
Увеличение концентрации ЛП abnormal, или ЛП(а), в крови считают независимым фактором риска атеросклероза. При содержании в крови ЛП(а) более 300 мкг/мл при норме 0-300 мкг/мл риск возникновения коронарного атеросклероза увеличивается вдвое, а при одновременном повышении уровня ЛП(а) ХС и ХС ЛПНП - в 5 раз (J.A. M.A. - 2001. - Vol.285. - p.2486-2497, Eur. Heart.J. - 2003. - Vol.24, - p.1601-1610).
В настоящее время особое внимание уделяется исследованию минорных фракций модифицированных ЛП(а), в связи с чем разрабатываются способы лабораторной диагностики, позволяющие исследовать этот липопротеин крови. Он относится к апо-В-содержащим липопротеинам, богатым холестеролом (ХС). ЛП(а) идентичен "тонущим" пре-β-ЛП (sinking pre-β-Lp), имеющим при электрофорезе подвижность пре-β-ЛП. ЛП(а) содержат 27% белка, 8% углеводов и 65% липидов, из которых ЭХС составляют 59%, НЭХС 14%, ФЛ 14%.
Белковым компонентом ЛП(а) является высокогликозилированный полипептид-апо(а), имеющий близкое структурное сродство к плазминогену - одному из факторов системы свертывания - противосвертывания крови. При росте концентрации как ЛП(а), так и его модифицированных форм в крови нарушаются процессы микроциркуляции в кровеносных артериях с возможным образованием микротромбов.
Благодаря наличию в структуре апо(а) сиаловых кислот ЛП(а) более отрицательно заряжен по сравнению с β-ЛП в электрическом поле, лучше растворим в воде, может взаимодействовать с ионами металлов (кальция). Этот липопротеин и его модифицированные формы гетерогенны. Все это свидетельствует об особой роли ЛП(а) и модифицированных ЛП(а) в атерогенезе.
ЛП(а) может взаимодействовать с ЛПНП-рецепторами, оказывая слабое влияние на активность ГМК-КоА редуктазы, на этерификацию ХС. Период полураспада ЛП(а) длиннее, чем у ЛПНП и составляет 3,3 суток. Содержание ЛП(а) в крови в норме не превышает 30 мг/л. При высокой концентрации в крови ЛП(а) выявляется в местах поражения сосудов в области скопления фибриногена. Повышенная концентрация ЛП(а) часто сочетается с IIа, IIб типами гиперлипопротеинемий, при которых часто выявляются модифицированные ЛП. Поэтому в клинической практике крайне важно определение ЛП(а) одновременно с определением белков острой фазы воспаления. Установлено, что большинство гиполипидемических препаратов не влияет на повышенный уровень ЛП(а).
Фракция ЛП(а) гетерогенна. Установлено, что при электрофорезе ЛП(а) находятся в области β-глобулинов, но до 5% ЛП(а) при этом могут выявляться в области α-глобулинов. По причине такой выраженной гетерогенности достаточно сложно оценить при электрофорезе всю фракцию ЛП(а), а тем более ее минорные фракции, которые могут оставаться на линии старта, если размер их частиц достаточно велик. Поэтому использование общепринятого в исследованиях последнего пятидесятилетия детергента Тритон Х-100 для обработки сыворотки крови, а именно липопротеинов крови, ведущее к частичной делипидизации ЛП и увеличению их подвижности при электрофорезе, позволяет выявлять минорные фракции ЛП(а). В химической промышленности используются различные детергенты (при изготовлении стирального порошка, моющих средств и т.д.), но при работе с биологическим материалом используется преимущественно Тритон Х-100. Режим обработки пробы Тритоном Х-100 подбирался на основе экспериментальных исследований эмпирическим путем. Для этого использовали различные разведения Тритона Х-100, различную температуру и различную экспозицию в минутах. При использовании различных концентраций раствора Тритон Х-100 малые концентрации (ниже 0,1%) не увеличивали выделения минорных фракций ЛП, в том числе ЛП(а), а высокие концентрации (больше 0,1%) вели к полной делипидизации и разрушению структуры ЛП. Результат проведенного исследования представлен в таблице №1.
Обработка 0,3 мл сыворотки крови для исследования липопротеинов разными концентрациями раствора Тритон Х-100 в течение различного времени инкубации пробы при разной температуре.
Следовательно, оптимальными условиями обработки сыворотки крови раствором Тритон Х-100 является концентрация 0,1% в объеме 0,1 мл, при температуре 20 градусов Цельсия в течение 15 минут.
Поскольку ЛП(а) наиболее атерогенен, очень важно на ранних стадиях заболевания выявлять максимальное содержание ЛП(а) в крови каждого пациента. Это позволяет диагностировать ишемическую болезнь сердца еще до стадии значительных изменений других клинико-лабораторных показателей, повышает точность диагностики заболевания. В свою очередь таким пациентам рано назначается патогенетически обоснованная терапия. Не менее важно выявление минорных фракций ЛП(а) для оценки эффективности терапии заболевания и прогнозирования течения ишемической болезни сердца.
Все сказанное свидетельствует о крайней важности разработки способов лабораторной диагностики, позволяющих наиболее полно выявлять ЛП(а), его модифицированные формы и их минорные фракции.
В настоящее время в широкой клинической лабораторной практике недостаточно используют способы определения ЛП(а). В то же время популярность способа электрофоретического разделения на фракции ЛП крови в геле агарозы обусловлена его высокой чувствительностью, простотой осуществления и достаточной адекватностью получаемых результатов (Клиническая лабораторная диагностика, №10, 2008, С.21-32).
Существенные признаки, характеризующие изобретение, проявили в заявляемой совокупности новые свойства, явным образом не вытекающие из уровня техники в данной области, и не являются очевидными для специалиста.
Идентичной совокупности признаков не обнаружено при изучении патентной и научно-медицинской литературы.
Данное изобретение может быть использовано в медицинской практике для повышения точности диагностики степени и оценки эффективности лечения ишемической болезни сердца.
Таким образом, следует считать предлагаемое изобретение соответствующим условиям патентоспособности: «новизна», «изобретательский уровень», «промышленная применимость».
Метод основан на электрофоретической подвижности модифицированных липопротеинов крови.
Изобретение будет понятно из следующего описания приложенных чертежей.
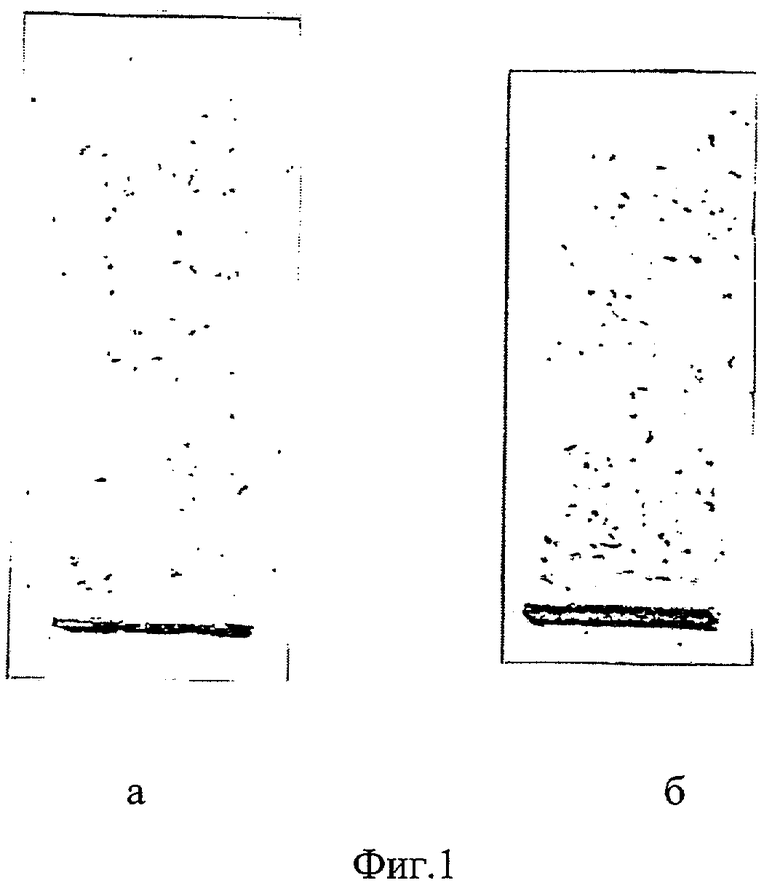
На фиг.1 представлены результаты электрофоретического разделения на фракции ЛП сыворотки крови: а - в группе контроля способом-прототипом; б - в группе контроля предлагаемым способом;
На фиг.2а, б представлены результаты электрофоретического разделения на фракции ЛП сыворотки крови в группе больных ИБС способом-прототипом;
На фиг.3 представлены результаты электрофоретического разделения на фракции ЛП сыворотки крови больного Б: а - способом-прототипом; б - предлагаемым способом.
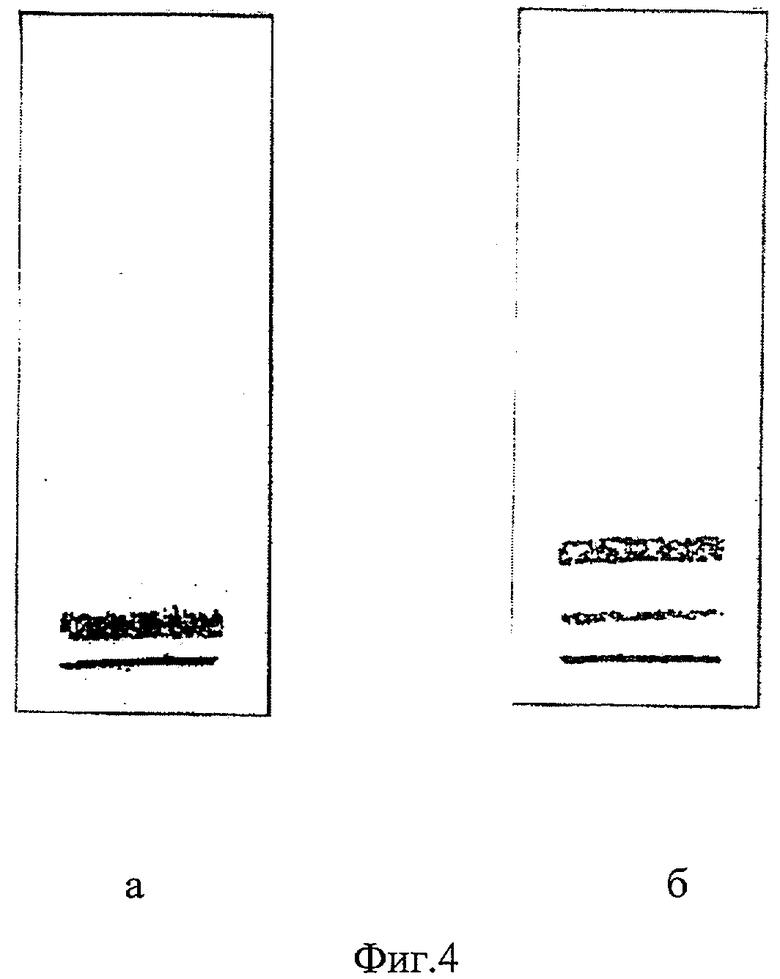
На фиг.4а и б представлены результаты электрофоретического разделения на фракции ЛП сыворотки крови больных после лечения.
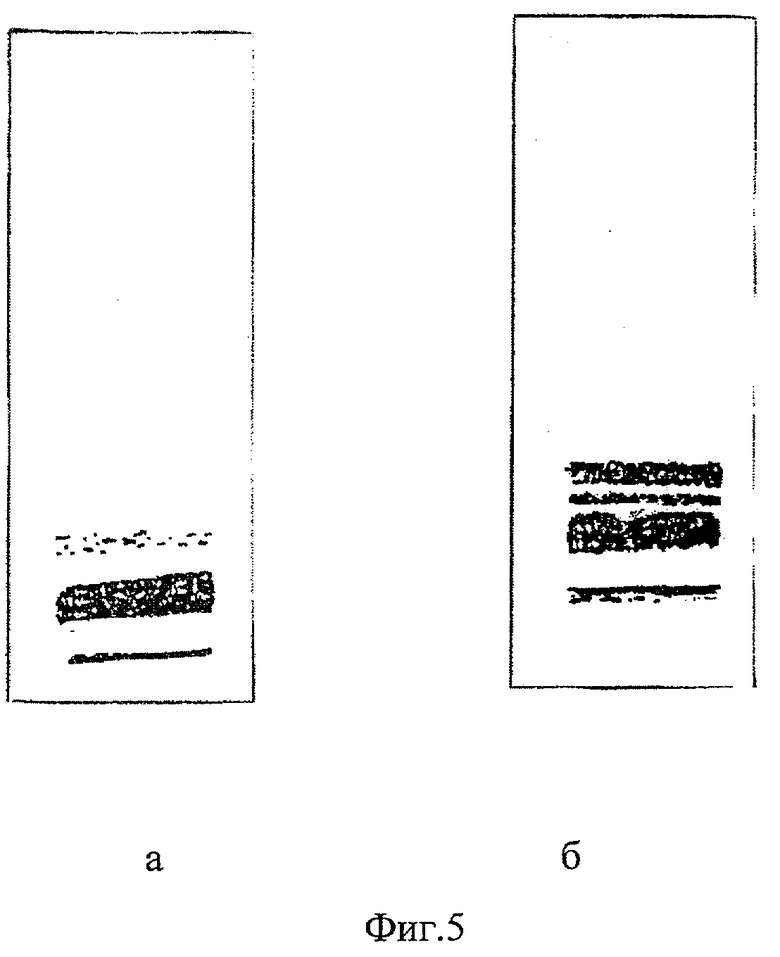
На фиг.5а и б представлены результаты электрофоретического разделения на фракции ЛП сыворотки крови больного ишемической болезнью сердца по способу-прототипу и по предлагаемому способу.
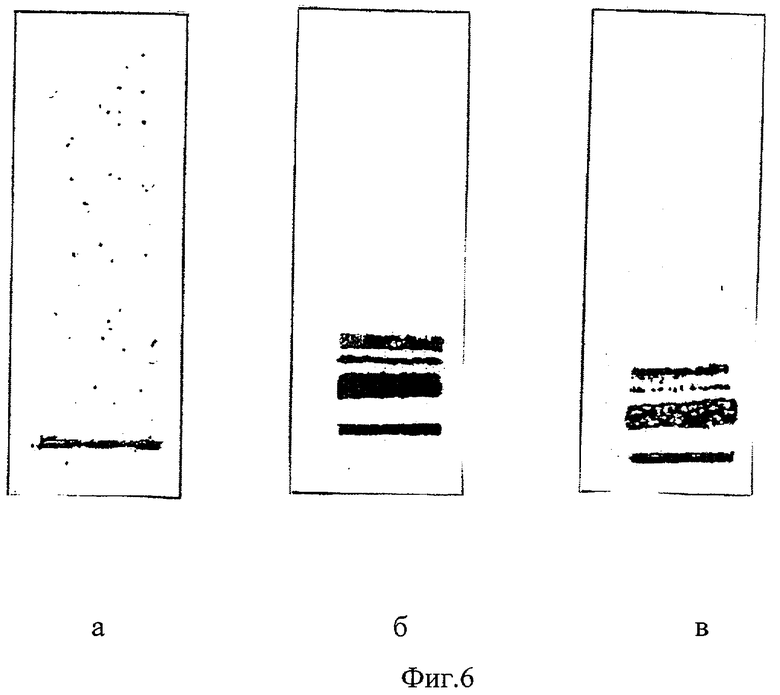
На фиг.6а и б представлены результаты электрофоретического разделения на фракции ЛП сыворотки крови больных ишемической болезнью сердца по предлагаемому способу до и после лечения.
Способ осуществляется следующим образом поэтапно:
1) приготовление раствора Судана Б: 400 мг Судана Б растворяют в 20 мг этиленгликоля на кипящей водяной бане в течение 50 минут, фильтруют, хранят в стеклянной посуде;
2) приготовление геля агарозы: 320 мг агарозы А фирмы "Sigma" растворяют в 20 мл воды при кипячении, затем помещают в термостат при 55°С;
добавляют 20 мл раствора альбумина (1 г альбумина в 200 мл веронал-мединалового буфера, рН 8,6). 3 мл геля агарозы наносят на обезжиренное горизонтально установленное предметное стекло, помещают металлический стальной стержень-брусок 20×4 мм (высотой 10 мм), который после застывания геля убирают магнитом;
3) к 0,6 мл пробы сыворотки крови пациента добавляют 0,2 мл 0,1% раствора Тритон Х-100, инкубируют 15 мин при 20°С, затем добавляют 40 мл 7% полиэтиленгликоля ПЭГ-6000 и инкубируют 1 ч при 20°С, центрифугируют 40 мин при 25000 g. Осадок дважды промывают.
4) 0,25 мл раствора преципитата используют для электрофоретического исследования. К 0,25 мл преципитата сыворотки крови добавляют 0,15 мл раствора Судана Б, помещают на 1 ч в темный термостат при 40°С, затем добавляют 0,2 мл горячего раствора геля агарозы, смешивают, подогревают при 55°С и подогретым вносят в желобок геля агарозы;
5) предметное стекло помещают в камеру для электрофореза слоем агарозы вниз, электрофорез проводят в течение часа в холодильной камере при температуре 4°С при напряжении 100 В и силе тока 40-45 мА;
6) электрофореграмму фиксируют в 5% растворе уксусной кислоты в течение одного часа, затем высушивают между листами фильтровальной бумаги, непрерывно смачивая 96% этиловым спиртом;
7) денситометрию проводят на микрофотометре МФ-4.
При проведении повторного исследования до и после лечения величина фракции минорных ЛП(а) до лечения принимается за 100% и рассчитывается процентное значение величины снижения фракции минорных ЛП(а) после проведенной терапии ишемической болезни сердца.
Для подтверждения работоспособности предлагаемого способа и достижения технического результата были обследованы группа контроля (n=12) и группа больных ИБС (n=22). Обе группы обследованы с помощью предлагаемого способа и способа-прототипа.
В группе контроля в 7% ПЭГ-6000 преципитатах сыворотки крови в случае использования способа-прототипа и предлагаемого способа ЛП не выявлены (фиг.1а, б).
В группе больных ИБС в 7% ПЭГ-6000 преципитатах сыворотки крови с помощью способа-прототипа выявлены ЛПНП и ЛПОНП и следы ЛП(а) (фиг.2а, б).
В группе больных ИБС в 7% ПЭГ-6000 преципитатах сыворотки крови, предлагаемым в качестве изобретения способом, кроме фракций ЛПНП, ЛПОНП в зоне между ЛПНП и ЛПОНП выявлены минорные фракции модифицированных ЛП(а) у 16 пациентов, а у 6 пациентов этой группы фракция ЛП(а) выявлена в виде низких (следовых) концентраций. После лечения фракции модифицированных ЛП были менее интенсивными (фиг.4а, б). Фракция ЛП(а) либо полностью отсутствовала, либо снижалась на 40% и более.
Пример 1
Пациент Б., 45 лет. История болезни №531. Поступил в отделение ИБС и атеросклероза НИИ кардиологии ТНЦ СО РАМН с жалобами на боли за грудиной и в области сердца, возникающие при физической нагрузке; боли купируются нитроглицеролом. Больного беспокоит одышка при физической нагрузке. АД 160/90 мм рт.ст., пульс в покое 66 ударов в минуту. Диагноз: ишемическая болезнь сердца, стенокардия напряжения ФК II. Результаты лабораторных исследований: ХС общий 8,7 ммоль/л; триацилглицерол 1,8 ммоль/л; ХС ЛПВП 0,9 ммоль/л.
Результаты электрофоретического исследования ЛП крови данного больного по способу-прототипу представлены на (фиг.3а), а по предлагаемому способу на (фиг.3б). Выявлены модифицированные ЛПНП, ЛПВП, ЛПОНП, ЛП(а) в низкой концентрации.
Пример 2
Больной Б., 42 года, история болезни №117, поступил в отделение ИБС и атеросклероза НИИ кардиологии г.Томска. Жалобы при поступлении на боли в области сердца колющего характера, иррадиирущие под лопатку. На ЭКГ выявлены рубцовые изменения в миокарде. Велоэргометрия была прекращена при нагрузке 50 Вт по причине усиления загрудинных болей. АД 160/100 мм рт.ст., пульс в покое 68 уд. в мин. Боли купируются нитроглицерином.
Результаты лабораторного исследования: ХС общий 7,0 ммоль/л, триацилглицериды 1,8 ммоль/л, ХС ЛПВП 1,1 ммоль/л.
Результаты электрофоретического исследования ЛП 7% ПЭГ-6000 преципитата сыворотки крови по способу-прототипу представлены на фиг.5а по предлагаемому способу на фиг.5б. Выявлены фракции мЛПНП, мЛПОНП и мЛП(а).
Диагноз при поступлении: ишемическая болезнь сердца, стенокардия напряжения, ФК III.
После проведенного лечения результаты лабораторного исследования: ХС общий 6,3 ммоль/л, триацилглицериды 1,4 ммоль/л, ХС ЛПВП 1,4 ммоль/л.
При электрофоретическом исследовании ЛП 7% ПЭГ-6000 преципитата сыворотки крови фракции ЛП не выявлены. Фиг.6а содержит только линию старта.
Диагноз при выписке: ишемическая болезнь сердца, стенокардия напряжения, ФКП. Заключение: лечение эффективное.
Пример 3
Больной Ж., 54 года, история болезни №104, поступил в отделение ИБС и атеросклероза НИИ кардиологии г.Томска с жалобами на боли в области сердца, иррадиирущие под лопатку. На ЭКГ явления ишемии миокарда. Велоэргометрия прекращена при нагрузке 60 Вт по причине загрудинной боли и одышки. АД 160/110 мм рт.ст., пульс в покое 67 уд. в мин. Боли купируются нитроглицерином.
Результаты лабораторного исследования: ХС общий 8,8 ммоль/л, триацилглицериды 1,8 ммоль/л, ХС ЛПВП 0,9 ммоль/л.
Результаты электрофоретического исследования ЛП 7% ПЭГ-6000 преципитата сыворотки крови выявили наличие мЛПНП, мЛПОНП и мЛП(а) (фиг.6б). Результаты денситометрии мЛП: мЛПНП - 74%, мЛПОНП - 20 и мЛП(а) - 6%.
Диагноз при поступлении: ишемическая болезнь сердца, стенокардия напряжения, ФК III-IV.
После проведенного лечения результаты лабораторного исследования: ХС общий 6,5 ммоль/л, триацилглицериды 1,0 ммоль/л, ХС ЛПВП 1,3 ммоль/л.
Результаты электрофоретического исследования мЛП крови по предлагаемому способу после лечения представлены на фиг.6в.
Результаты денситометрии мЛП: мЛПНП - 78%, мЛПОНП - 20 и мЛП(а) - 2%.
Диагноз при выписке: ишемическая болезнь сердца, стенокардия напряжения, ФК II. Снижение уровня ЛП(а) на 66% по сравнению с исходным свидетельствовало об эффективности лечения ишемической болезни сердца.
Итак, при применении способа-прототипа оценка эффективности лечения ишемической болезни сердца проводилась по клинической картине заболевания и уровню липидов крови без выявления мЛП, что свидетельствовало о недостаточной точности способа. Оценка эффективности терапии по способу-прототипу не превышала 39%.
У других 29 больных ИБС точность определения эффективности лечения ишемической болезни сердца составила 100%, т.к. после лечения фракция мЛП(а) либо е выявлялась, либо снижалась на 40% и более. Способ применен у 51 пациента.
Применение предлагаемого способа определения эффективности лечения ишемической болезни сердца в отличие от способа-прототипа позволило выявить дополнительную фракцию модифицированных ЛП(а) в максимально возможном количестве, оценить ее снижение после проведенной курсовой терапии ИБС и повысить точность способа. С помощью способа-прототипа такие результаты получить не удалось, т.к. полностью фракцию мЛП(а) выявить было невозможно ни до, ни после лечения. Ложноположительных случаев оценки эффективности лечения ИБС не наблюдалось. При этом предлагаемый способ прост в использовании и интерпретации полученных результатов и может быть внедрен в клиническую практику.
Приложение
Таблица 1. Исследование влияния детергента Тритон Х-100 на выявление фракций липопротеидов при разном времени инкубации и разной температуре, то есть определение оптимальных условий
Фиг.1. Представлены результаты электрофоретического разделения на фракции ЛП сыворотки крови: а - в группе контроля способом-прототипом; б - в группе контроля предлагаемым способом;
Фиг.2 (а, б). Представлены результаты электрофоретического разделения на фракции ЛП сыворотки крови в группе больных ИБС способом-прототипом;
Фиг.3. Представлены результаты электрофоретического разделения на фракции ЛП сыворотки крови больного Б.: а - способом-прототипом; б - предлагаемым способом.
Фиг.4 (а и б). Представлены результаты электрофоретического разделения на фракции ЛП сыворотки крови больных после лечения.
Фиг.5 (а и б). Представлены результаты электрофоретического разделения на фракции ЛП сыворотки крови больного ишемической болезнью сердца по способу-прототипу и по предлагаемому способу.
Фиг.6 (а и б). Представлены результаты электрофоретического разделения на фракции ЛП сыворотки крови больных ишемической болезнью сердца по предлагаемому способу до и после лечения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОЦЕНКИ ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ ИШЕМИЧЕСКОЙ БОЛЕЗНИ СЕРДЦА | 2010 |
|
RU2439581C1 |
| СПОСОБ ОЦЕНКИ ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ ИШЕМИЧЕСКОЙ БОЛЕЗНИ СЕРДЦА | 2011 |
|
RU2462722C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ТЕЧЕНИЯ ИШЕМИЧЕСКОЙ БОЛЕЗНИ СЕРДЦА | 2009 |
|
RU2398239C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ТЕЧЕНИЯ ИШЕМИЧЕСКОЙ БОЛЕЗНИ СЕРДЦА | 2012 |
|
RU2507518C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ТЕЧЕНИЯ ИШЕМИЧЕСКОЙ БОЛЕЗНИ СЕРДЦА | 2010 |
|
RU2439582C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ТЕЧЕНИЯ ИШЕМИЧЕСКОЙ БОЛЕЗНИ СЕРДЦА | 2011 |
|
RU2470294C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ФРАКЦИЙ МОДИФИЦИРОВАННЫХ ЛИПОПРОТЕИНОВ КРОВИ | 2009 |
|
RU2413952C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ФРАКЦИЙ МОДИФИЦИРОВАННЫХ ЛИПОПРОТЕИНОВ КРОВИ | 2010 |
|
RU2428698C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ФРАКЦИЙ МОДИФИЦИРОВАННЫХ ЛИПОПРОТЕИНОВ КРОВИ | 2007 |
|
RU2364873C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ТЕЧЕНИЯ ИШЕМИЧЕСКОЙ БОЛЕЗНИ СЕРДЦА | 2012 |
|
RU2520755C1 |


Изобретение относится к медицине, а именно к кардиологии и терапии. До и после лечения ишемической болезни сердца определяют модифицированные ЛП(а) следующим образом. Обрабатывают 0,6 мл сыворотки крови 0,2 мл 0,1% раствором Тритона Х-100, инкубируют 15 минут при 20°С. Затем добавляют 7% раствор полиэтиленгликоля 6000, инкубируют с красителем Суданом Б при 40°С в течение 1 ч с последующим электрофоретическим разделением ЛП в геле агарозы в лунке 4×20 мм. При снижении уровня модифицированных ЛП(а) на 40% и более по сравнению с исходным уровнем оценивают лечение ишемической болезни сердца как эффективное. Использование предлагаемого способа позволяет повысить точность оценки эффективности лечения ишемической болезни сердца. 1 табл., 6 ил.
Способ оценки эффективности лечения ишемической болезни сердца, включающий определение до и после начала лечения уровня модифицированных Lipoprotein abnormal (ЛП(а)) путем инкубации 7% ПЭГ-6000 преципитата сыворотки крови больного с раствором Судана Б в течение 1 ч в темном термостате при 40°С и затем внесения пробы в лунку в геле агарозы с площадью основания 4×20 мм для электрофореза и последующей денситометрии, отличающийся тем, что дополнительно перед инкубацией сыворотки крови с 7% ПЭГ-6000, сыворотки крови обрабатывают 0,1% раствором Тритона Х-100 и эффективность лечения оценивают по снижению уровня модифицированных ЛП(а) на 40% и более по сравнению с исходным уровнем.
| СПОСОБ ОЦЕНКИ ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ ИШЕМИЧЕСКОЙ БОЛЕЗНИ СЕРДЦА | 2000 |
|
RU2210077C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ФРАКЦИЙ ЛИПОПРОТЕИДОВ КРОВИ У БОЛЬНЫХ ИШЕМИЧЕСКОЙ БОЛЕЗНЬЮ СЕРДЦА | 2000 |
|
RU2200950C2 |
| СПОСОБ ОЦЕНКИ ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ ИШЕМИЧЕСКОЙ БОЛЕЗНИ СЕРДЦА | 2000 |
|
RU2210075C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ФРАКЦИЙ МОДИФИЦИРОВАННЫХ ЛИПОПРОТЕИНОВ КРОВИ | 2000 |
|
RU2210079C2 |
| АЛАНИЧЕВ А.Е | |||
| Критерии эффективности диагностики и лечения больных ишемической болезнью сердца с пароксизмальной формой фибрилляции предсердий | |||
| Автореф | |||
| дис | |||
| канд | |||
| мед | |||
| наук, 2008, с.5-17. | |||
Авторы
Даты
2010-08-10—Публикация
2009-02-02—Подача