Настоящее изобретение относится к особому соединению перовскитного типа общей формулы (1). Изобретение относится также к катализатору, содержащему такое соединение перовскитного типа. Изобретение относится далее к способу разложения монооксида азота (N2O), устройству для получения азотной кислоты и способу получения азотной кислоты. Изобретение относится также к применению указанного соединения перовскитного типа для разложения N2О.
Монооксид азота представляет собой оказывающий существенное влияние на климат так называемый веселящий газ (закись азота), который наряду с диоксидом углерода и метаном непосредственно способствует обусловленному антропогенными факторами парниковому эффекту. В результате фотохимических процессов разложение N2O происходит преимущественно в стратосфере, при этом следует отметить, что по своей стойкости N2O превосходит диоксид углерода в 310 раз и вносит соответственно больший «вклад» в глобальное потепление атмосферы. Благодаря образованию оксида азота (NO) в стратосфере N2O дополнительно способствует в значительной степени разложению озонового слоя.
Промышленность по производству азотной кислоты является одним из основных промышленных источников непосредственного поступления N2O в атмосферу. При осуществлении так называемого способа Оствальда аммиак на катализаторах на основе благородного металла, в частности на основе платиновых сплавов, нанесенных на уложенные одна на другую в несколько слоев сетки, подвергают каталитическому окислению кислородом воздуха, при этом в качестве первичного продукта образуется NO. Под действием кислорода воздуха NO окисляется до диоксида азота (NO2). При повышенном давлении этот NO2 абсорбируют в воде с получением главным образом 50-68%-ной азотной кислоты.
При проведении каталитического процесса наряду с NO в качестве нежелательного вторичного продукта образуется N2O. В отличие от других образующихся оксидов азота N2О в ходе последующей операции по абсорбированию не абсорбируется водой. Без проведения последующих последовательных стадий по удалению N2O этот монооксид азота согласно данным анализа Европейской Ассоциации производителей удобрений (EFMA, от англ. European Fertilizer Manufactures Association) за 1995 г. выбрасывается в атмосферу с отходящим газом в концентрации от 300 до 3500 част./млн, что в количественном пересчете составляет от 1,2 до 13,8 кг на тонну продукта (НNО3).
Согласно решениям Киотского протокола, предписывающим к обязательному исполнению снизить выбросы шести газов, способствующих парниковому эффекту, а именно: СО2, СН4, N2O, частично фторированных фторуглеводородов (Н-ФУВ), перфторированных фторуглеводородов (ФУВ) и SF6, страны-участницы общей конвенции об охране климата также обязаны принять меры по снижению выбросов N2O при производстве азотной кислоты.
Решения Киотского протокола инициировали проведение исследований и разработку различных технологий по снижению выбросов N2O при производстве азотной кислоты, которые отличаются друг от друга прежде всего своей ролью и своим местом в технологической цепочке, включающей различные стадии процесса. В первую очередь это относится к мерам по интеграции в процесс каталитического окисления аммиака, к каталитическому окислению непосредственно под катализатором на основе благородного металла, используемым при окислении аммиака, и к разложению N2O в отходящем газе после стадии абсорбции.
После стадии абсорбции отходящий газ для регенерации тепла нагревают до температур 250-500°С, используя с целью получения энергии расширитель отходящего газа. Расширенный отходящий газ при температуре свыше 100°С выводится в атмосферу. Способы разложения N2O в отходящем газе отличаются друг от друга местом проведения этой операции, т.е. до поступления в расширитель или после выхода из него, и тем самым рабочей температурой используемого катализатора разложения.
Такое оснащение блоком разложения в отходящем газе связано прежде всего для существующих установок со значительными затратами, к тому же лишь в некоторых из этих установок удается достичь требуемую температуру отходящего газа, а в случае его предварительного нагрева производственные затраты возросли бы еще заметнее.
Одним из подходов для решения указанной проблемы, который позволил бы существенно снизить производственные затраты и тем самым повысить экономичность способа, могли бы стать альтернативный катализатор окисления аммиака, включение в процесс каталитического окисления аммиака катализатора селективного разложения N2O или предусмотренное непосредственно за катализатором на основе благородного металла селективное разложение N2O в содержащем продукт газе.
Альтернативные, не содержащие благородных металлов катализаторы описаны, например, в US-A-4812300 и US-B-6489264.
В US-A-4812300 описан катализатор общей формулы АВО3 со структурой перовскитного типа. При этом А обозначает щелочной металл, щелочноземельный металл, редкоземельный элемент, лантаноид или актиноид. В обозначает элемент либо комбинацию элементов группы IB, IVB, VB, VIB, VIIB или VIII Периодической системы. В качестве А предпочтительно использовать La, Sr и их смеси, а в качестве В - Cr, Mn, Co, Ni, Сu и их смеси. В зависимости от температуры этот катализатор предназначен обеспечить селективное окисление аммиака до NO, минимизируя при этом образование N2O.
В US-B-6489264 описан катализатор окисления аммиака общей формулы (AxByO3z)k(MemOn)f. При этом k и f обозначают мас. проценты при соотношении между k и f от 0,01 до 1. А обозначает Са, Sr, Ba, Mg, Be, La либо их смесь, а В обозначает Mn, Fe, Ni, Со, Сr, Сu, V либо их смесь. х обозначает 0-2, у обозначает 1-2 и z обозначает 0,8-1,7. МеmOn представляет собой оксид соответствующего металла.
Помимо неудовлетворительной селективности в отношении продукта недостатки подобной технологии заключаются прежде всего в том, что она не обеспечивает в достаточной мере генерирование необходимого для процесса тепла, а специальная операция по предварительному нагреву содержащей эдукт газовой смеси потребовала бы соответствующих дополнительных расходов и ее осуществление в этой форме в существующих установках по производству азотной кислоты оказалось бы невозможным.
В качестве примера попыток найти приемлемый подход к решению указанной проблемы можно назвать техническое решение, предложенное в заявках WO 99/64352 и WO 01/87771. В первой из них предлагается частичная замена катализатора на основе благородного металла на катализатор, содержащий оксид кобальта. Во второй предусматривается использовать комбинацию модифицированного сплава палладия и родия. В обеих заявках указывается, что подобные технические решения позволяют снизить эмиссию N2O. Однако этим решениям присущи существенные недостатки, заключающиеся прежде всего в высокой восприимчивости катализаторов к отравлению или быстрому старению.
Чисто каталитическое разложение N2O с использованием таких катализаторов, как диоксид кремния, диоксид титана, диоксид алюминия, диоксид тория, платиновая пленка и древесный уголь известно уже давно. Примеры катализаторов, пригодных для разложения N2O и применяемых непосредственно под катализатором на основе благородного металла для окисления аммиака, можно найти в DE-A-19841740, US-A-2004/0179986, US-A-2005/0202966, US-B-6723295 и WO 2004/052512.
В DE 19700490 A1 описывается используемый для разложения N2O до N2 и O2 катализатор, который содержит лантансодержащий перовскит. Этот катализатор состоит из смеси перовскита с анионным дефектом состава La1-xCuxCo3-δ′, где х=0-0,5, и шпинели состава Со3O4 в массовом соотношении 1:1.
Один из вариантов осуществления изобретения, описанного в US-A-5562888, относится к способу каталитического разложения N2O, который проводят в присутствии кислорода с использованием твердого раствора оксида формулы Lа0,8S0,2МО3±δ. М обозначает переходный металл, предпочтительно Cr, Mn, Fe, Co или Y, и δ обозначает отклонение от рассчитанного стехиометрического количества.
Однако оба описанных выше типа катализаторов оказываются неэффективными при высоких температурах в диапазоне 800-1200°С, при которых приходится работать прежде всего с целью снизить содержание N2О в технологических газах при производстве азотной кислоты.
Из уровня техники известен целый ряд катализаторов, используемых для разложения NOx, содержащегося в автомобильных отработавших газах.
В US-A-3884837 предложен катализатор общей формулы RE1-xMxMnO3, где RE представляет собой один или несколько элементов из группы, включающей La, Pr и Nd, М обозначает одновалентный ион, например Na, К или Rb, a x обозначает число от 0,05 до 0,5. Указанное соединение предназначено для катализа разложения содержащих NOx вредных веществ с образованием в результате безвредных продуктов. В качестве безвредных продуктов указаны N2O и азот. Что касается разложения N2O, то в названном документе US-A-3884837 оно не описано.
В US-A-4126580 описывается катализатор формулы АВО3 с кристаллической структурой перовскитного типа, предназначенный, в частности, для восстановления оксидов азота до соединений с более низкой степенью окисления.
В US-B-6569803 предлагается катализатор, который предназначен для очистки отработавших газов и в котором по меньшей мере один определенный компонент из благородного металла нанесен на комплексный оксид перовскитного типа, включающий по меньшей мере два разных металлических компонента. При этом согласно одному из предпочтительных вариантов указанный комплексный оксид имеет формулу La1-xKxBO3, где В обозначает по меньшей мере один металл из группы, включающей Mn, Co, Fe и Ni, и где 0<х<1. Этот катализатор должен обеспечивать высокую эффективность очистки от NOx при высоких температурах.
В ЕР-А-0089199 описан катализатор, состоящий в основном из перовскита общей формулы La(1-x)/2Sr(1+x)/2Co1-xMexO3. Me представляет собой элемент, выбранный из группы, включающей Fe, Mn, Сr, V и Ti, a x обозначает число от 0,15 до 0,90. Этот катализатор предназначен для одновременной обработки окислительных и восстановительных газов.
Каталитическое окисление содержащегося в автомобильных отработавших газах NO до NO2 и/или NO3 также описано в уровне техники.
В US-A-5990038 предлагается определенный катализатор для очистки отработавших газов. Каталитически активный слой этого катализатора состоит из двух гранулятов. Один из данных гранулятов включает двойной оксид формулы (La1-xAx)1-αBOδ, на который нанесен благородный металл, выбранный из Pt и Pd. А обозначает по меньшей мере один элемент, выбранный из группы, включающей Ва, К и Cs. В обозначает по меньшей мере один переходный металл, выбранный из группы, включающей Fe, Со, Ni и Mn. x обозначает число от 0 до 1, α обозначает число от 0 до 0,2 и δ обозначает число, выбранное с таким расчетом, чтобы заряд первого двойного оксида равнялся в целом 0. Предлагаемый катализатор должен обеспечивать беспроблемное окисление NO до NO2 и/или NО3 благодаря взаимодействию между двойным оксидом и благородным металлом.
В US-B-6395675 описывается устройство для очистки отработавших газов, включающее катализатор, предназначенный для очистки отработавших газов. В состав катализатора входит, в частности, порошок из двойного оксида общей формулы (Ln1-αAα)1-βBOδ. α и β обозначают числа от 0 до 1, δ обозначает число больше 0. Ln обозначает по меньшей мере один элемент, выбранный из группы, включающей La, Се, Nd и Sm. А обозначает по меньшей мере еще один, второй, элемент, выбранный из группы, включающей Mg, Ca, Sr, Ba, Na, К и Cs. В обозначает по меньшей мере еще один, третий, элемент, выбранный из группы, включающей Fe, Co, Ni и Мn. При этом третий элемент должен окислять NOx до NO2.
Перовскиты применяют также в других областях техники. Так, например, в US-A-5447705 описано применение ряда катализаторов состава LnxA1-yByO3 при получении синтез-газа. В приведенной формуле х обозначает число от 0 до 10, а у обозначает число от 0 до 1. Ln обозначает по меньшей мере один элемент, выбранный из группы редкоземельных элементов с порядковыми номерами от 57 до 71. А и В обозначают отличные друг от друга металлы, выбранные из групп IVb, Vb, VIb, VIIb и VIII.
Существенный недостаток вышеописанных катализаторов и прежде всего катализаторов, содержащих кобальт, состоит в их крайне высокой восприимчивости к отравлению серой. Другим недостатком этих катализаторов является исключительно быстрое старение.
Еще одной проблемой, с которой сталкиваются при применении многих предложенных до настоящего времени катализаторов для разложения N2O, является ингибирование, обусловленное наличием в технологическом газе, соответственно в отработавшем газе кислорода. Функциональность этих катализаторов может быть обеспечена лишь в том случае, когда в потоке газа присутствует восстановитель, предназначенный для удаления физически или химически адсорбированных оксидов.
Исходя из вышеизложенного, в основу настоящего изобретения была положена задача предложить катализатор для разложения N2O. При создании изобретения прежде всего предусматривалось, что катализатор должен применяться для разложения N2O в содержащем продукт газе, образующемся при окислении аммиака в процессе получения азотной кислоты.
В соответствии с этим изобретение относится к катализатору, в состав которого входят носитель с сотовой структурой и соединение перовскитного типа общей формулы (1)

где х обозначает число от 0,05 до 0,9, М1 выбран из группы, включающей La, Се, Nd, Pr, Sm и их комбинации, М2 выбран из группы, включающей Fe, Ni и их комбинации, и М3 выбран из группы, включающей Сu, Со, Мn и их комбинации.
Настоящее изобретение относится далее к способу разложения N2О, заключающемуся в том, что N2O вводят в контакт с соединением перовскитного типа общей формулы (1)

где х обозначает число от 0,0 до 0,9, М1 выбран из группы, включающей La, Се, Nd, Pr, Sm и их комбинации, М2 выбран из группы, включающей Fe, Ni и их комбинации, и М3 выбран из группы, включающей Сu, Со, Мn и их комбинации.
Согласно еще одному варианту изобретение относится к устройству для получения азотной кислоты, включающему соединение перовскитного типа общей формулы (1)

где х обозначает число от 0,0 до 0,9, М1 выбран из группы, включающей La, Се, Nd, Pr, Sm и их комбинации, М2 выбран из группы, включающей Fe, Ni и их комбинации, и М3 выбран из группы, включающей Сu, Со, Мn и их комбинации, и катализатор окисления аммиака.
Применение соединения перовскитного типа общей формулы (1)

где х обозначает число от 0,0 до 0,9, М1 выбран из группы, включающей La, Се, Nd, Pr, Sm и их комбинации, М2 выбран из группы, включающей Fe, Ni и их комбинации, и М3 выбран из группы, включающей Сu, Со, Мn и их комбинации, для разложения N2O также описано ниже.
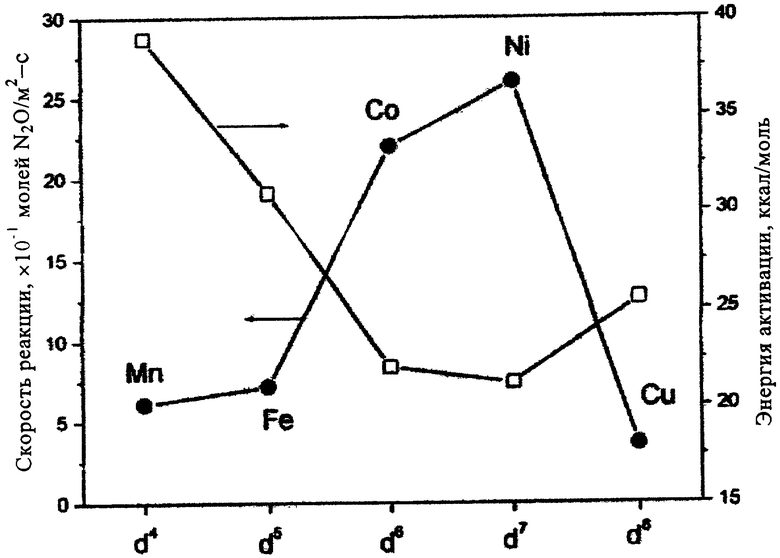
На прилагаемом к описанию чертеже показаны степень разложения N2O и энергия активации процесса при использовании перовскитов LaMO3.
Соединения перовскитного типа
Соединение перовскитного типа имеет следующую общую формулу (1)

В этой формуле х обозначает число от 0,05, более предпочтительно по меньшей мере 0,1, особенно предпочтительно по меньшей мере 0,15. Максимально х обозначает 0,9, предпочтительно максимально 0,6, более предпочтительно максимально 0,4, особенно предпочтительно максимально 0,25.
М1 выбран из группы, включающей La, Се, Nd, Pr, Sm и их комбинации. В одном из вариантов осуществления изобретения М1 предпочтительно представляет собой La. В другом варианте М1 предпочтительно представляет собой комбинацию указанных лантанидов, например комбинацию, состоящую из 50-55 мас.% Се, 25-30 мас.% La, 10-15 мас.% Nd, 5-10 мас.% Pr и 0-1 мас.% Sm, в каждом случае в пересчете на оксид. Ниже комбинация лантанидов кратко обозначена как Ln.
М2 выбран из группы, включающей Fe, Ni и их комбинации.
М3 выбран из группы, включающей Сu, Со, Мn и их комбинации. Предпочтительны из них Сu и Со, более предпочтителен Со.
Если М2 представляет собой Ni, то в этом случае М3 предпочтительно представляет собой Сu или Со, более предпочтительно Со, а х предпочтительно обозначает 0-0,4 или 0,15-0,4.
Если М2 представляет собой Fe или комбинацию Fe и Ni, то в этом случае М3 предпочтительно представляет собой Сu, а х предпочтительно обозначает 0-0,4 или 0,15-0,4.
К предпочтительным относятся следующие соединения:
М1FеО3,
М1Fe0,3-0,9Ni0,7-0,1O3, предпочтительно М1Fe0,4-0,8Ni0,6-0,2O3, более предпочтительно М1Fe0,4Ni0,6O3 и М1Fe0,8Ni0,2O3,
М1Fe0,8-1,0Cu0,2-0,0O3,
М1Ni0,9-0,7Со0,1-0,3О3, предпочтительно М1Ni0,8Со0,2O3.
В приведенных выше формулах М1 предпочтительно представляет собой La или Ln.
Не основываясь на какой-либо теории, можно предположить, что внедрение элемента М3 в кристаллическую структуру перовскитного типа приводит к изменению природы 3d-катиона касательно распределения его заряда или к образованию вакансий кристаллической решетки кислорода/катиона, т.е. к дефекту решетки. Благодаря этому образуется новая разновидность поверхности, вовлеченная в каталитическую реакцию и обусловливающая различную энергию активации каталитического разложения N2O, на чем основывается особая пригодность соединений перовскитного типа общей формулы (1) для их применения в указанных целях.
Согласно изобретению соединение перовскитного типа может применяться в различных формах в качестве катализатора. Так, например, соединение перовскитного типа может применяться как таковое в виде частиц правильной или неправильной формы (в порошках, гранулах, пеллетах). В другом варианте соединение перовскитного типа применяется в комбинации с соответствующим носителем. Такой носитель может иметь любую известную форму. Так, в частности, носителями могут служить пеллеты, шарики и элементы с сотовой структурой. В одном из предпочтительных вариантов осуществления изобретения используют носители с сотовой структурой. В большинстве случаев подобные носители имеют примерно цилиндрическую наружную форму и множество пронизывающих их параллельных каналов. Применение таких носителей сотового типа в области катализа известно. Сами носители в свою очередь выполняются преимущественно из оксидного материала (например, кордиерита) или металла. Согласно изобретению возможно использование обеих форм.
Соединение перовскитного типа может быть внедрено в материал носителя, носитель может быть пропитан соединением перовскитного типа или же носитель может иметь покрытие (из γ-оксида алюминия), содержащее соединение перовскитного типа.
Согласно варианту, в котором носитель имеет покрытие, содержащее соединение перовскитного типа, оно может быть нанесено на материал-носитель, который содержится в указанном покрытии.
В качестве материла-носителя пригодны все обычно используемые в этой области материалы. Предпочтительно использовать в этих целях материалы с развитой поверхностью. Под такими материалами согласно изобретению подразумеваются материалы, удельная БЭТ-поверхность которых (поверхность, определяемая по адсорбции азота методом Брунауэра-Эммета-Теллера) превышает 5 м2/г. В качестве материалов-носителей приемлемы, например, оксид титана, оксид алюминия, оксид кремния, оксид церия, оксид циркония, цеолиты и их смеси или смешанные оксиды указанных элементов. Предпочтителен среди указанных материалов оксид алюминия, поскольку он способен дополнительно препятствовать старению катализатора.
Носитель с покрытием можно изготавливать различными методами. Один из таких возможных методов заключается в том, что сначала приготавливают сам носитель, после чего на него наносят покрытие из материала-носителя и соединения перовскитного типа. Другой возможный метод заключается в том, что сначала изготавливают сам носитель, затем на него наносят покрытие из материала-носителя и в завершение на него наносят соединение перовскитного типа. Технологии проведения этих операций известны из уровня техники.
При осуществлении первого метода можно, например, приготавливать дисперсию соединения перовскитного типа и других компонентов покрытия, включая материал-носитель или его предшественники. При этом соединение перовскитного типа может уже присутствовать на материале-носителе либо присутствовать в дисперсии. Сам носитель можно один или несколько раз окунать в эту дисперсию. Затем возможное избыточное количество дисперсии можно удалять из каналов носителя и после этого завершать получение катализатора, например, путем сушки и кальцинирования.
При осуществлении второго метода приготавливают дисперсию из вышеназванных компонентов покрытия, за исключением соединения перовскитного типа, и на носитель описанным выше образом наносят покрытие. Затем носитель с нанесенным на него покрытием пропитывают соединением-предшественником соединения перовскитного типа. В завершение это соединение-предшественник соответствующим образом превращают в соединение перовскитного типа.
При создании изобретения было установлено, что в зависимости от типа носителя могут использоваться различные соединения перовскитного типа, относящиеся соответственно к предпочтительным. Так, согласно варианту, в котором применяют носитель с покрытием, содержащим соединение перовскитного типа, в качестве него предпочтительно используют соединения формул М1Fe0,8-1,0Cu0,2-0,0O3 и М1Fe0,3-0,9Ni0,7-0,1O3 (предпочтительно М1Fe0,4-0,8Ni0,6-0,2O3, более предпочтительно М1Fe0,4Ni0,6O3), особенно предпочтительно при этом соединение перовскитного типа формулы М1La. Эти соединения неожиданно отличаются высокой устойчивостью к таким модификациям с компонентами материала-носителя, где, например, наблюдается образование менее активных шпинелей. На активность прежде всего соединения перовскитного типа формулы LaFe0,8-1,0Cu0,2-0,0O3 изменения в содержании кислорода и воды в потоке газа практически не оказывают сколько-нибудь заметного влияния. Влияние на селективность при наличии NO/NO2 в потоке газа настолько незначительно, что находится ниже предела обнаружения.
В другом варианте осуществления изобретения соединение перовскитного типа внедрено в материал носителя. В составе носителя соединение перовскитного типа предпочтительно содержится в количестве от 50 до 90 мас.%, более предпочтительно от 55 до 70 мас.%, в пересчете на общую массу носителя. Наряду с соединением перовскитного типа носитель может дополнительно содержать другие обычные компоненты. К ним относятся среди прочих оксидные материалы, которые, например, не утрачивают стойкости вплоть до температуры порядка 1200°С. В качестве примера соединений подобного типа можно назвать кордиерит, глинозем, графит, муллит, оксид алюминия, оксид циркония, муллит циркония, титанат бария, оксид титана, карбид кремния и нитрит кремния. В одном из особенно предпочтительных вариантов осуществления изобретения носитель наряду с соединениями перовскитного типа содержит кордиерит, предпочтительно в количестве от 0 до 50 мас.%, более предпочтительно от 0 до 15 мас.%, глинозем в количестве от 0 до 50 мас.%, особенно предпочтительно от 0 до 30 мас.%, и Аl2О3 в количестве от 0 до 50 мас.%, особенно предпочтительно от 10 до 30 мас.%. Предпочтительно экструдаты содержат 25-30 мас.% Аl2О3, 8-10 мас.% кордиерита и примерно 5 мас.% графита.
В одном из других вариантов осуществления изобретения носитель представляет собой соединение перовскитного типа. Согласно одному из предпочтительных вариантов соединение перовскитного типа имеет формулу М1Ni0,9-0,7Со0,1-0,3О3, предпочтительно М1Ni0,8Со0,2O3, где М1 предпочтительно представляет собой La. Эти соединения неожиданно проявляют незначительную для рассматриваемого разложения N2О энергию активации порядка 30 ккал/моль, что позволяет без проблем применять их в широком диапазоне температур. Сказанное относится прежде всего к диапазону температур 850-900°С, используемых обычно для разложения N2O при производстве азотной кислоты, поскольку, как было установлено, в этих случаях удается достичь удвоения показателей разложения N2О. Одновременно в ходе исследований была выявлена линейная зависимость между эффективностью разложения и количеством применяемого катализатора в указанном диапазоне температур. Влияние на селективность при наличии NO/NO2 в исследовавшемся газе не было установлено, поскольку соответствующие показатели находились ниже пределов обнаружения.
W обозначает скорость реакции, X обозначает степень разложения N2O, ЕA обозначает энергию активации при разложении N2O с использованием катализаторов LаМО3 (при 900°С). Х представляет собой отношение не превращенного количества N2O к исходно поступившему количеству N2О.
В случае экструдатов предпочтительными соединениями перовскитного типа являются М1Fе0,8-1,0Сu0,2-0,0О3 и М1Fe0,3-0,9Ni0,7-0,1O3 (предпочтительно М1Fe0,4-0,8Ni0,6-0,2O3, более предпочтительно М1Fe0,8Ni0,2O3). В приведенных формулах М1 предпочтительно представляет собой Ln. Носители, содержащие соответствующие экструдаты, неожиданно обладают значительной пористостью. Кроме того, образующиеся при использовании этих соединений NiFе2O4- или СuFе2О4-шпинели предположительно заметно повышают каталитическую активность процесса разложения N2O. Помимо этого наблюдается лишь незначительная зависимость активности разложения N2O от варьирующегося содержания воды и кислорода в реакционном газе, а также наличия в нем NO/N2O.
В случае экструдатов особенно эффективным зарекомендовало себя, кроме того, соединение LaFeO3. Это соединение перовскитного типа отличается высокой активностью при разложении N2O.
Способ разложения N2O
Настоящее изобретение относится далее к способу разложения N2O, заключающемуся в том, что N2O вводят в контакт с соединением перовскитного типа. При разложении N2O образуются в основном N2 и О2.
Для условий, в которых соединение перовскитного типа вводят в контакт с N2O, не предусмотрены какие-либо особые ограничения. Так, например, реакцию можно проводить при температурах в интервале от 800 до 1200°С. Количество используемого соединения перовскитного типа определяется особенностями практического применения и может устанавливаться соответствующим образом самим специалистом. Продолжительность контакта между катализатором и N2O также зависит от специфики применения и составляет предпочтительно более 0,02 с.
Поскольку катализатор по изобретению может применяться также при наличии в содержащем N2O потоке газа воды, кислорода, NO или NOx, его можно использовать во многих случаях, где требуется разложить N2O. Прежде всего предлагаемый в изобретении способ пригоден для разложения N2O в содержащем продукт газе, образующемся при окислении аммиака в процессе получения азотной кислоты.
Устройство для получения азотной кислоты
Настоящее изобретение относится также к устройству для получения азотной кислоты, включающему соединение перовскитного типа и катализатор окисления аммиака. Устройства для получения азотной кислоты известны в данной области техники и описаны, например, у Kirk-Othmer в "Encyclopedia of Chemical Technology", т.17, 4-е изд., 1996, cc.84-96. Предлагаемое в изобретении устройство отличается от устройств из уровня техники тем, что в нем дополнительно предусмотрено применение соединения перовскитного типа для разложения N2O. Благодаря этому удается снизить выделения вредного N2O.
В одном из вариантов осуществления изобретения соединение перовскитного типа находится за катализатором окисления аммиака по ходу потока. В устройстве по изобретению абсорбция оксидов азота в воде происходит предпочтительно лишь после разложения N2O.
Соединение перовскитного типа может быть представлено в одной из описанных выше форм катализатора. Предпочтительно, однако, применять это соединение в комбинации с носителем, имеющим сотовую структуру.
Такой сотовый носитель с соединением перовскитного типа общей формулы (1) помещают, например, в реакторе для каталитического окисления аммиака на соответствующую основу в виде решетки или в корзину. Если предусмотрено применение сотовых носителей, то можно использовать один или несколько подобных носителей. В таком устройстве сотовый носитель может служить опорой для расположенного над ним катализатора на основе благородного металла и расположенной непосредственно под катализатором системы регенерации благородного металла при ее наличии. В предлагаемом в изобретении устройстве катализатор на основе благородного металла и система регенерации благородного металла могут быть отделены от носителя одной либо несколькими разделительными сетками, например из неблагородного металла. Благодаря устройству по изобретению обеспечивается равномерное прохождение потока через катализатор и носитель с сотовой структурой.
Преимущество предлагаемого в изобретении устройства состоит в том, что сотовый носитель обеспечивает равномерное прохождение потока при минимальной потере давления. Сотовый носитель можно простым путем приспосабливать к конкретным рабочим условиям, преобладающим в том или ином случае в реакторе для получения азотной кислоты, и к различному содержанию N2O в технологическом газе, соответствующим образом изменяя проходное сечение каналов, их количество и толщину ограничивающих их стенок.
Получение соединений перовскитного типа
На методику получения соединений перовскитного типа не накладывается никаких особых ограничений, и для получения этих соединений может использоваться любой из известных в данной области способов. К таким способам относятся среди прочих соосаждение, пропитка, золь-гелевый метод и механическое смешение оксидов или предшественников оксидов с последующим кальцинированием.
Ниже для более подробного пояснения изобретения описаны несколько способов, с помощью которых получали соединения, представленные в примерах.
1) Способ Печини
Соединения перовскитного типа получают по способу Печини (М.Р.Pechini, US-A-3330697). Этот способ заключается в том, что насыщенный при комнатной температуре раствор взятых в соответствующих пропорциях нитратных солей смешивают с лимонной кислотой и этиленгликолем. Затем раствор упаривают при 80-100°С. После выдержки при постоянной температуре 200-250°С образуется аморфное соединение-предшественник перовскита. Для образования перовскитов образец в течение 4 ч кальцинируют при температуре в интервале от 700 до 900°С.
2) Механохимический способ
Для получения соединений перовскитного типа коммерчески доступные оксиды переходных металлов, такие как α-Fе2О3, СоО, СuО, МnО или NiO, смешивают с соответствующими карбонатами лантаноидов. Смешанные оксиды редкоземельных элементов и переходных металлов получают смешением, например, Ln2(СО3)3/Fe2O3 в массовом соотношении 4,5:1,0. Fе2О3 можно также заменять на один либо несколько других оксидов переходных металлов. Затем смесь несколько раз пропускают через дезинтегратор. После 4-часовой выдержки при постоянной температуре в интервале от 700 до 900°С полученную смесь повторно измельчают в дезинтеграторе.
Получение пропитанных носителей
1) Способ Печини
Насыщенный при комнатной температуре раствор взятых в соответствующих пропорциях нитратных солей смешивают с лимонной кислотой и этиленгликолем. В этот раствор на 5-10 мин погружают коммерчески доступный сотовый носитель на основе кордиерита, продувают его воздухом и сушат при комнатной температуре на воздухе. В завершение в течение 4 ч проводят кальцинирование при температуре в интервале от 700 до 900°С.
2) Способ пастирования
Для получения сотового носителя соответствующее соединение перовскитного типа добавляют к пасте из кордиерита или Аl2О3. Согласно другому варианту к такой пасте можно добавлять раствор из взятых в соответствующих пропорциях нитратных солей соединения перовскитного типа. Наряду с кордиеритом или Аl2О3 паста может содержать водный раствор метилцеллюлозы. В качестве дополнительных компонентов могут добавлять в требуемых соотношениях глинозем, тальк и 3d-оксиды. Затем пасту перемешивают в течение 40 мин в соответствующем смесителе. Влажность полученной таким путем пасты составляет 20-30%. Затем пасту экструдируют, продавливая ее под давлением через матрицу, с получением формованного изделия. Полученные таким путем монолиты отверждают при комнатной температуре и сушат при 300-400°С в течение 4 ч. После этого в течение 4-5 ч проводят кальцинирование при температуре в интервале от 1000 до 1250°С.
Получение носителей, содержащих перовскит
Насыщенный при комнатной температуре раствор взятых в соответствующих пропорциях нитратных солей смешивают с лимонной кислотой и этиленгликолем и упаривают при 80-100°С. На этой стадии образуются полимеризованные комплексы состава металл-простой эфир. В результате выдержки при постоянной температуре 200-250°С органический остаток сгорает и образуется аморфный предшественник перовскита. Для получения соединения перовскитного типа этот предшественник выдерживают в течение 4 ч при постоянной температуре в интервале от 700 до 900°С.
В качестве исходного материала для получения соединений формулы Ln(Fe,Ni)1-xCuxO3 используют коммерчески доступные оксиды переходных металлов α-Fе2О3, NiO и CuO, a также карбонаты смешанных лантаноидов (Ln). В состав этих смешанных лантаноидов входят 50-55 мас.% Се, 25-30 мас.% La, 10-15 мас.% Nd, 5-10 мас.% Pr и 0-1 мас.% Sm, при этом имеются в виду их оксиды СеO2, Lа2О3, Nd2O3, Рr6O11 и Sm2О3.
Смесь редкоземельных элементов и переходных металлов получают смешением 3,5 кг Ln2(СО3)3 с 1,3 кг Fе2О3, соответственно СuО или NiO. После смешения указанных компонентов эту смесь для получения соединения перовскитного типа выдерживают в течение 4 ч при постоянной температуре в интервале от 700 до 900°С.
Для получения пластичной пасты соединение перовскитного типа пластифицируют с использованием соответствующего связующего на основе Аl2О3(Аl2О3·nН2О) или глинозема (Аl2О3 20-25 мас.%, SiO2 55-60 мас.%, Н2O 10-15 мас.%, остальное примеси) (а также пептизатора, например, водного раствора различных кислот, таких как азотная, щавелевая и уксусная кислота). Для улучшения реологических свойств пасты добавляют этиленгликоль. Кроме того, можно добавлять частицы кордиерита (2MgO·2Al2O2·5SiO2) крупностью менее 0,5 мм и графит. Такие компоненты повышают термоударную стойкость, соответственно увеличивают пористость материала катализатора. Полученную смесь в течение 10 мин подвергают механической обработке в планетарной шаровой мельнице и затем экструдируют с получением таким путем сотового носителя. После сушки при комнатной температуре сотовый носитель в течение 4 ч кальцинируют при температуре в интервале от 900 до 1150°С.
Описанные соединения перовскитного типа являются безусловным достижением в решении проблемы разложения N2О, поскольку они обладают помимо прочего высокой ударной термостойкостью. Этот фактор особенно важен при использовании способа Оствальда, поскольку при его осуществлении имеют место большие перепады температуры, прежде всего при пуске и остановке реактора. Кроме того, соединения перовскитного типа отличаются высокой стойкостью к старению даже при высоких температурах, преобладающих, например, в потоке содержащего продукт газа, образующегося при получении азотной кислоты.
Помимо этого, соединения перовскитного типа могут применяться в тех случаях, когда в потоке газа наряду с N2O присутствуют сера и серусодержащие соединения, кислород, вода, NO или NOx.
Примеры
Ниже изобретение более подробно поясняется на примерах, которые, однако, относятся только к предпочтительным вариантам осуществления изобретения и не ограничивают его объем.
Экспериментальная конструкция опытного реактора
Каталитическое разложение N2O осуществляют в П-образном, выполненном из кварцевого стекла проточном реакторе с внутренним диаметром 11,4 мм при давлении окружающей среды. Для равномерного термостатирования реактор помещают в песчаную баню с электрообогревом.
Температуру в реакторе измеряют и регулируют по температуре наружной стенки реактора. Температуру катализатора дополнительно измеряют путем ее определения в одном из сотовых каналов. Расход газовых смесей регулируют с помощью регуляторов массового расхода в пределах от 0,5 до 3,2 л/мин. Водяной пар примешивают с помощью сатуратора при заданной температуре. Во избежание образования возможных конденсатов все элементы и системы отбора образцов, через которые проходит газовый поток, снабжены теплоизоляцией и имеют обогрев.
Пример 1
В опытный реактор загружают слой сыпучего материала в виде инертных шариков из кварцевого стекла (диаметр 1-2 мм, общая масса 1 г). Затем добавляют 5-20 мг катализатора, представляющего собой соединение перовскитного типа в виде частиц крупностью 0,25-0,50 мм и покрывающего загруженный сыпучий материал равномерным слоем. БЭТ-поверхность соединения перовскитного типа варьируется в пределах от 1 до 10 м2/г. Все измерения проводят при постоянной температуре в стационарном состоянии. Для отслеживания процесса гомогенного разложения N2O и с целью его возможной последующей корректировки проводят контрольное измерение без катализатора. Для возможности сопоставления полученные результаты, наряду с абсолютной (100%-ной) степенью превращения N2O, указаны в пересчете на скорость реакции W в молях N2O/м2·с.
Наиболее высокую активность при разложении N2O проявили, как было установлено, перовскиты, в состав которых входят Со и Ni, прежде всего перовскиты, содержащие оба этих элемента.
Каталитические свойства исследовавшихся перовскитов в значительной степени зависят от природы 3d-катиона, его заряда и координации. С помощью дополнительных элементов М3 эти свойства можно целенаправленно изменять, т.е. имеет место эффект, который предположительно обусловлен точечными дефектами или дефектами кристаллической решетки, при этом в результате введения элемента М3 с несколькими валентностями происходит изменение заряда катиона или образование соответствующих валентностей кислородных катионов.
Пример 2
В этом примере испытывали носитель с сотовой структурой, пропитанный соединением перовскитного типа.
Для испытаний использовали содержащий кордиерит носитель с удельной поверхностью 35 м2/г и объемом пор 0,4 см3/г. Носитель имел пористую структуру с шестиугольным основанием и каналы с поперечным сечением в форме равностороннего треугольника с длиной стороны 2,5 мм и толщиной ограничивающих их стенок 0,4 мм. В испытаниях использовали такой носитель диаметром 9-10 мм. Полученные результаты представлены в таблицах 5-7.
Пример 3
В этом примере испытывали носители с сотовой структурой, изготовленные экструзией (экструдаты) содержащих перовскит материалов. Для испытаний выбирали два типа носителей, различающихся между собой геометрическими параметрами. Носители первого типа имели форму шестигранных призм с длиной стороны 6,0 см, а каждый из каналов имел в поперечном сечении форму равностороннего треугольника с длиной стороны 2,5 мм и толщину ограничивающих его стенок 0,4 мм. Носители второго типа также имели форму шестигранных призм, но с длиной стороны 2,8 см, а каждый из их каналов имел в поперечном сечении форму равностороннего треугольника с длиной стороны 1,6 мм и толщину ограничивающих его стенок 0,6 мм. Образцы для испытаний вырезали из соответствующих предварительно изготовленных сотовых носителей. При этом форму образцов выбирали с таким расчетом, чтобы их можно было поместить в опытный реактор.
Активность катализатора определяли в интервале температур от 800 до 900°С. Стандартный состав газовой смеси включал 0,15% N2O, 3% O2 и 3% Н2O, остальное приходилось на гелий. Для исследования влияния кислорода на возможное ингибирование активности катализатора использовали газовую смесь, в состав которой входили 0,13% N2O, 7% O2 и 3% Н2O, остальное приходилось на гелий. Для исследования влияния H2O на разложение N2O долю водяного пара повышали до 10-12%. Все приведенные значения указаны с поправкой на гомогенное саморазложение N2O при высоких температурах.
Объем пор измеряли ртутным порометром высокого давления. Удельную поверхность определяли обычным БЭТ-методом с использованием термической десорбции Аr.
Пример 4
Для исследования влияния концентрации воды в газовой смеси на степень разложения N2O использовали водяной сатуратор при различных температурах.
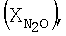 образец: 57% LnFеО3+28,6% Аl2О3+9,5% кордиерита + 4,9% графита, высота монолитов 12,0 мм, температура 900°С
образец: 57% LnFеО3+28,6% Аl2О3+9,5% кордиерита + 4,9% графита, высота монолитов 12,0 мм, температура 900°С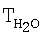 [°С]
[°С]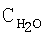 [об.%]
[об.%]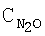 [об.%]
[об.%]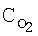 [об.%]
[об.%]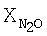 [%]
[%]
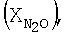 образец: 57% LnFe0,8Cu0,2О3+30% Аl2О3+10% кордиерита + 5% алюмосиликатных волокон, высота монолитов 6,60 мм, температура 900°С
образец: 57% LnFe0,8Cu0,2О3+30% Аl2О3+10% кордиерита + 5% алюмосиликатных волокон, высота монолитов 6,60 мм, температура 900°С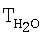 [°С]
[°С]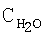 [об.%]
[об.%]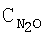 [об.%]
[об.%]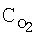 [об.%]
[об.%]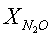 [%]
[%]
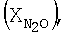 образец: 57% LnFe0,8Ni0,2O3+28,6% Аl2О3+9,5% кордиерита+4,9% графита, высота монолитов 6,60 мм, температура 900°С
образец: 57% LnFe0,8Ni0,2O3+28,6% Аl2О3+9,5% кордиерита+4,9% графита, высота монолитов 6,60 мм, температура 900°С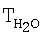 [°С]
[°С]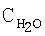
[об.%]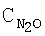 [об.%]
[об.%]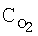 [об.%]
[об.%]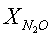 [%]
[%]
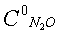 0,13%, температура 900°С
0,13%, температура 900°С
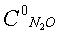 0,118%, температура 900°С
0,118%, температура 900°С
Пример 5
В промышленном реакторе для производства азотной кислоты на решетчатое дно расположенной там корзины помещали изготовленный экструзией сотовый носитель, содержащий соединение перовскитного типа LаFеО3. Для удержания катализатора на основе благородного металла и системы регенерации платины на определенном расстоянии от носителя использовали две разделительные сетки из неблагородного металла марки Megapyr.
В результате количество N2O в отработавшем газе удалось снизить на 65,8%, т.е. с 491 част./млн до 168 част./млн.
| название | год | авторы | номер документа |
|---|---|---|---|
| КАТАЛИЗАТОР ДЛЯ РАЗЛОЖЕНИЯ NO ЕГО ПРИМЕНЕНИЕ, А ТАКЖЕ СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2001 |
|
RU2258030C2 |
| ЦЕОЛИТЫ, СОДЕРЖАЩИЕ ФОСФОР/СЕРУ-ПЕРЕХОДНЫЙ МЕТАЛЛ, ДЛЯ РАЗЛОЖЕНИЯ NO | 2011 |
|
RU2598902C2 |
| РАЗРАБОТКА УЛУЧШЕННОЙ ЗАГРУЗКИ КАТАЛИЗАТОРА | 2004 |
|
RU2358901C2 |
| КАТАЛИЗАТОР, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЕ ДЛЯ РАЗЛОЖЕНИЯ NO | 2008 |
|
RU2456074C2 |
| КАТАЛИЗАТОР, СПОСОБ ЕГО ПРИГОТОВЛЕНИЯ И СПОСОБ ОКИСЛЕНИЯ АММИАКА | 2010 |
|
RU2430782C1 |
| КАТАЛИЗАТОР СКВ, ДОПУСКАЮЩИЙ ПЕРЕДОЗИРОВКУ NH | 2016 |
|
RU2715539C2 |
| УДАЛЕНИЕ ВЕСЕЛЯЩЕГО ГАЗА ПРИ ПРОИЗВОДСТВЕ АЗОТНОЙ КИСЛОТЫ | 2001 |
|
RU2237010C2 |
| КЕРАМИЧЕСКИЙ КАТАЛИЗАТОР ДЛЯ СЕЛЕКТИВНОГО РАЗЛОЖЕНИЯ NO И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1999 |
|
RU2221642C2 |
| КАТАЛИЗАТОР ОКИСЛЕНИЯ АММИАКА ДЛЯ ПРОИЗВОДСТВА АЗОТНОЙ КИСЛОТЫ НА ОСНОВЕ ОРТОКОБАЛЬТАТОВ ИТТРИЯ-ГАДОЛИНИЯ | 2014 |
|
RU2637939C2 |
| ОДНОСЛОЙНЫЙ ИЛИ ДВУХСЛОЙНЫЙ КАТАЛИЗАТОР УСТРАНЕНИЯ ПРОСКОКА АММИАКА | 2016 |
|
RU2743125C2 |
Изобретение относится к особому соединению перовскитного типа, катализатору, содержащему такое соединение перовскитного типа, способу разложения монооксида диазота (N2O), устройству для получения азотной кислоты и способу получения азотной кислоты. Изобретение относится также к применению указанного соединения перовскитного типа для разложения N2O. Описано устройство в способе получения азотной кислоты на стадии окисления аммиака, включающее соединение перовскитного типа, предназначенное для разложения монооксида диазота, общей формулы (1), при этом по ходу потока, содержащего продукт газа, расположены катализатор окисления аммиака, одна или несколько разделительных сеток и соединение перовскитного типа. Описан способ получения азотной кислоты с использованием данного устройства. Описан катализатор, для использования в данном устройстве, в состав которого входят носитель с сотовой структурой и соединение перовскитного типа общей формулы (1). Также описаны способ разложения монооксида диазота, для использования в вышеописанном устройстве, заключающийся в том, что монооксид диазота вводят в контакт с соединением перовскитного типа общей формулы (1), и применение соединения перовскитного типа общей формулы (1) для разложения монооксида диазота, для использования в вышеописанном устройстве. Технический результат - разложение N2O в содержащем продукт газе, образующемся при окислении аммиака в процессе получения азотной кислоты. 5 н. и 9 з.п. ф-лы, 16 табл., 1 ил.
1. Устройство в способе получения азотной кислоты на стадии окисления аммиака, включающее соединение перовскитного типа, предназначенное для разложения монооксида диазота, общей формулы (1)
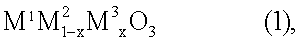
где х обозначает число от 0,05 до 0,9, М1 выбран из группы, включающей La, Се, Nd, Pr, Sm и их комбинации, М2 выбран из группы, включающей Fe, Ni и их комбинации, и М3 выбран из группы, включающей Сu, Со, Мn и их комбинации, при этом по ходу потока, содержащего продукт газа, расположены катализатор окисления аммиака, одна или несколько разделительных сеток и соединение перовскитного типа.
2. Способ получения азотной кислоты с использованием устройства по п.1.
3. Катализатор для использования в устройстве по п.1, в состав которого входят носитель с сотовой структурой и соединение перовскитного типа общей формулы (1)
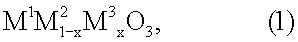
где х обозначает число от 0,05 до 0,9, М1 выбран из группы, включающей La, Се, Nd, Pr, Sm и их комбинации, М2 выбран из группы, включающей Fe, Ni и их комбинации, и М3 выбран из группы, включающей Сu, Со, Мn и их комбинации.
4. Катализатор по п.3, где М1 представляет собой La.
5. Катализатор по п.3 или 4, где х обозначает число от 0,05 до 0,8.
6. Катализатор по одному из пп.3-5, где носитель представляет собой экструдат, содержащий соединение перовскитного типа.
7. Катализатор по одному из пп.3-5, где носитель пропитан соединением перовскитного типа.
8. Катализатор по одному из пп.3-5, где соединение перовскитного типа нанесено на соответствующий носитель, который имеет покрытие из материала-носителя.
9. Способ разложения монооксида диазота для использования в устройстве по п.1, заключающийся в том, что монооксид диазота вводят в контакт с соединением перовскитного типа общей формулы (1)
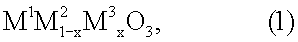
где х обозначает число от 0,05 до 0,9, М1 выбран из группы, включающей La, Се, Nd, Pr, Sm и их комбинации, М2 выбран из группы, включающей Fe, Ni и их комбинации, и М3 выбран из группы, включающей Сu, Со, Мn и их комбинации.
10. Способ по п.9, при этом способ проводят в присутствии кислорода.
11. Способ по п.9 или 10, при этом монооксид диазота присутствует в содержащем продукт газе, образующемся при окислении аммиака.
12. Способ по п.11, при этом содержащий продукт газ вводят в контакт с соединением перовскитного типа при температуре в интервале от 800 до 1200°С.
13. Применение соединения перовскитного типа общей формулы (1)
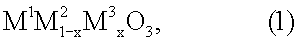
где х обозначает число от 0,05 до 0,9, М1 выбран из группы, включающей La, Се, Nd, Pr, Sm и их комбинации, М2 выбран из группы, включающей Fe, Ni и их комбинации, и М3 выбран из группы, включающей Сu, Со, Мn и их комбинации, для разложения монооксида диазота, для использования в устройстве по п.1.
14. Применение по п.13, при этом монооксид диазота присутствует в содержащем продукт газе, образующемся при окислении аммиака в процессе получения азотной кислоты.
| КЕРАМИЧЕСКИЙ КАТАЛИЗАТОР ДЛЯ СЕЛЕКТИВНОГО РАЗЛОЖЕНИЯ NO И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1999 |
|
RU2221642C2 |
| RU 2005100520 А, 10.08.2005 | |||
| RU 2005119994 А, 10.02.2006 | |||
| КАТАЛИЗАТОР ОКИСЛЕНИЯ НА ОСНОВЕ ОКСИДОВ СО СТРУКТУРОЙ ПЕРОВСКИТА | 1994 |
|
RU2063267C1 |
| US 5447705 А, 05.09.1995 | |||
| US 6395675 B1, 28.05.2002 | |||
| Волнолом | 1981 |
|
SU1147813A1 |
| DE 19700490 A1, 16.07.1998. | |||
Авторы
Даты
2010-08-27—Публикация
2006-03-10—Подача