Область техники
Настоящее изобретение относится к композиции, содержащей молочную кислоту и лактоферрин, для лечения и/или профилактики состояний мочеполовых путей.
Одно относится также к применению указанной композиции для изготовления лекарственного средства для лечения и/или профилактики состояний мочеполовых путей, а также к способу лечения и/или профилактики состояний мочеполовых путей.
Уровень техники
Кислотность, как полагают, является одним из защитных механизмов влагалища. Указанная кислотность связана с пониженным риском инфекций, таких как хламидии, генитальная микоплазма, трихомоноз, инфекция мочевыводящих путей, и пониженным носительством бактерий на входе во влагалище (Hanna, N. et al., 1985, 1975, Stamey, T.A. and Kaufman M.F., 1975., Stamey, T.A. and Timothy, M.M., 1975).
Напротив, дисбаланс микробиоты влагалища, бактериальный вагиноз (BV), ассоциирован с преждевременными родами, повышенным риском заболеваний, передающихся половым путем, повышенным риском ВИЧ-инфекции и воспаления тазовых органов (Schwebke, J.R., 2003, Obstet. Gynecol. Clin. North. Am. 30:685-94; Eschenbach, D.A., 1993, Am. J. Obstet. Gynecol., Vol. 169:441-5; Taha et al., Aids, 1998, Vol. 12:1699-706; Hillier, S.L. et al., 1996, Am. J. Obstet. Gynecol., Vol. 175: 435-41).
В течение перинатального периода и от менархе до менопаузы влагалище является наиболее кислотным. Влагалище, как полагают, подкисляется в результате анаэробного метаболизма влагалищного гликогена до кислых продуктов, преимущественно уксусной и молочной кислот. Вопрос о том, кто именно осуществляет указанный механизм - влагалищные бактерии и/или эпителиальные клетки - до сих пор остается спорным (см. обзор Pybus and Onderdonk, 1999).
Благоприятная окружающая среда для продуцирующих лактат микроорганизмов обычно имеется, что обеспечивает значение рН слизистого секрета около 4. Однако окружающая среда может разрушаться такими факторами, как изменения концентрации эстрогенов во время определенных периодов менструального цикла и во время менопаузы, а также возрастающая частота различных типов секреции, например, в результате затянувшихся менструальных кровотечений, предменструальных кровянистых выделений, кровотечений в середине цикла и эякулята. Инородные тела во влагалище, например спирали, пессарии, и инородные тела, внесенные в связи с антибиотикотерапией и при мытье, также могут приводить к таким нарушениям состава нормальной микробиоты, которые приводят к повышению рН. Когда рН повышается более чем до 4,5, наблюдается усиление тенденции роста анаэробных бактерий.
Нарушения состава нормальной микробиоты во влагалище без воспалительных реакций со стороны слизистой оболочки относятся к BV и приводят к появлению неприятных выделений и рН свыше 4,5, но они обычно не рассматриваются как фактическое нарушение. Однако BV является показателем того, что защита против инфекции, которая частично обеспечивается низким рН, ослаблена, и при неблагоприятных обстоятельствах это действительно приводит к инфекции.
Изменения микробиоты связаны со сдвигами значения рН во влагалище (Caillouette, J.C. et al., 1997). При наличии BV рН во влагалище повышается, и наблюдается сдвиг от доминирования молочнокислых бактерий до микробиологического состава, в котором доминируют Gardnerella vaginalis и анаэробные бактерии. Наличие анаэробных бактерий вызывает появление неприятных выделений и выделение летучих аминов при повышении рН (свыше 4,5).
Запах, появляющийся при повышении рН вагинальной жидкости, образуется в результате присутствия аминов. Выделения при BV содержат повышенную концентрацию нескольких аминов, которые продуцируются посредством анаэробного бактериального декарбоксилирования. Амины становятся летучими и, таким образом, улавливаются обонянием, когда они существуют в непротонированной форме (свободного основания). Однако после добавления сильной кислоты амины конвертируются в протонированную форму (соль) и утрачивают летучесть. Молочная кислота является сильной кислотой и, таким образом, является пригодной для уменьшения выделений с неприятным запахом.
При уменьшении рН во влагалище с использованием молочной кислоты молочным бактериям различных видов облегчается реколонизация влагалища, и, таким образом, восстанавливается природная резистентность в отношении избыточного роста бактерий, связанного с BV. Лактат (т.е. соль молочной кислоты), вводимый в геле, содержащем субстрат для роста (гликоген) молочнокислых бактерий, как было показано, является эффективным при повышенных значениях рН и неприятном запахе при BV (см. ЕР 0 257 007).
Лактат-гель обеспечивает кислый крем с молочной кислотой, содержащий гликоген, без консервантов. Гликоген в изобилии обнаруживают в эпителиальных клетках влагалища женщин фертильного возраста, и он является важным питательным субстратом для молочнокислых бактерий.
По сравнению с кремами, которые содержат только молочную кислоту, или с кислыми кремами с консервантами, лактат-гель, как было показано, in vitro является вдвое более благоприятным по своему влиянию на выживание молочнокислых бактерий. Таким образом, его можно применять для восстановления нормальной окружающей среды в случаях BV.
Было показано также, что лактат-гель обладает некоторым антибактериальным действием в отношении некоторых связанных с BV видов бактерий благодаря своему низкому значению рН (см. Andersch, B. et al; “Treatment of Bacterial Vaginosis with an Acid Cream: A Comparison between the Effect of Lactate-Gel and Metronidazole”, Gynecol. Obstet. Invest., 21: 19-25 (1986)). Однако в отношении дрожжей, таких как C. albicans и C. krusei, эффекта не наблюдалось.
Обычные способы лечения грибковых инфекций влагалища обычно включают в себя введение антибиотиков, например производных имидазола. Существует, разумеется, множество стимулов для сокращения использования антибиотиков, например, из-за развития резистентности.
Кроме того, существуют трудности дифференциального диагноза между BV и грибковой инфекцией. Это приводит к назначению антибиотиков в качестве меры предосторожности, в результате чего антибиотики вводятся чрезмерно, без необходимости.
Было бы, разумеется, очень полезным появление неантибиотического лекарственного средства, которое, помимо упомянутых выше свойств понижать рН влагалища и уменьшать запах, было бы эффективным для лечения или профилактики BV и/или грибковых инфекций, в частности дрожжевых инфекций. В идеале лекарственное средство должно быть эффективным вне зависимости от того, от какого заболевания страдает пациент или имеет риск развития заболевания - от BV или от грибковой инфекции. До настоящего времени указанной возможности не было.
Сущность изобретения
Целью настоящего изобретения является разработка более эффективной композиции для лечения урогенитальных состояний, которая понижает рН и является эффективной в отношении неприятного запаха, и которая также является эффективной для лечения бактериального вагиноза и грибковых инфекций, в частности грибковых инфекций, вызванных различными видами дрожжей.
Указанная цель достигается композицией, содержащей молочную кислоту, которая отличается тем, что содержит лактоферрин (LF) и/или его пептидный фрагмент.
Включение в композицию LF и/или его пептидного фрагмента усиливает противомикробную активность композиции, и ее можно, таким образом, использовать для ингибирования роста и/или уничтожения нежелательных бактерий и грибов в мочеполовых путях, в частности во влагалище.
Концентрация LF и/или его пептидного фрагмента может составлять от 0,0001 до 100 мг/мл, в частности от 0,001 до 10 мг/мл или от 0,01 до 5 мг/мл, и указанный LF может представлять собой рекомбинантный человеческий LF. Указанный пептидный фрагмент лактоферрина может быть синтетическим или рекомбинантным.
Концентрация молочной кислоты может составлять от 0,1 до 10% (т.е. от 1 до 100 мг/мл).
Композиция может дополнительно содержать нейтрализующее вещество, а содержание молочной кислоты и нейтрализующего вещества предпочтительно является таким, чтобы значение рН составляло от 3,5 до 4,5.
Композиция может дополнительно содержать ростовой субстрат для молочнокислых бактерий, а весовое соотношение молочной кислоты и ростового субстрата предпочтительно составляет от 20:1 до 500:1, более предпочтительно приблизительно 50:1.
Композиция может дополнительно содержать инертный носитель и/или агент, отвечающий за консистенцию.
Композиция может, например, быть в форме крема, геля, вагинального суппозитория, таблетки или спрея.
Кроме того, изобретение относится к применению композиции, описанной выше, для изготовления лекарственного средства для профилактики и/или лечения состояний мочеполовых путей. Лекарственное средство обладает противомикробной активностью.
Состояния, которые следует лечить или предотвращать, включают в себя повышенные значения рН и/или нарушение микробиоты в мочеполовых путях. Нарушения микробиоты влагалища характеризуются аномально высокими уровнями бактерий (анаэробных грамотрицательных бактерий, анаэробных грамположительных кокков, стафилококков, стрептококков, E. сoli) и/или Candida, связанных с BV, в комбинации с аномально низкими уровнями молочнокислых бактерий.
Изобретение относится также к способу профилактики и/или лечения указанных выше состояний.
Композиция согласно изобретению имеет ряд преимуществ:
- Композиция является мягкой по отношению к молочнокислым бактериям.
- Комбинация молочной кислоты и LF в одной композиции обеспечивает неожиданные синергические эффекты, поскольку она понижает рН, уменьшает запах и ингибирует рост бактерий и дрожжей, связанных с BV.
- Композиция является эффективной вне зависимости от того, от какого заболевания страдает пациент - от BV или от грибковой инфекции, что, разумеется, является преимуществом, если невозможно поставить надежный диагноз, в частности, в случае самолечения.
- Применение антибиотиков может быть уменьшено.
Краткое описание фигур
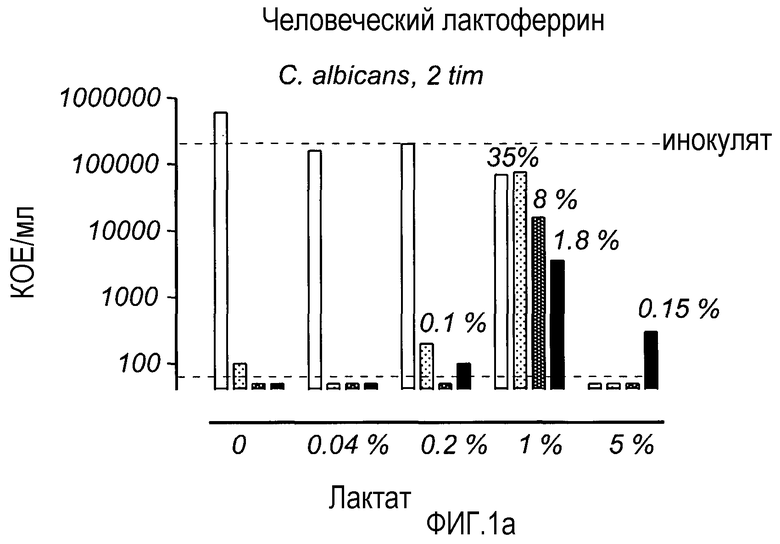
На Фиг. 1 показана противогрибковая активность LF в отношении C. albicans в присутствии лактата (а) и хлорида водорода (b). LF инкубировали с различными концентрациями лактата, разведенного в 0,2% бактопептоне, и c C. albicans в течение 2 ч. После этого каждый раствор анализировали на предмет содержания жизнеспособных микроорганизмов.
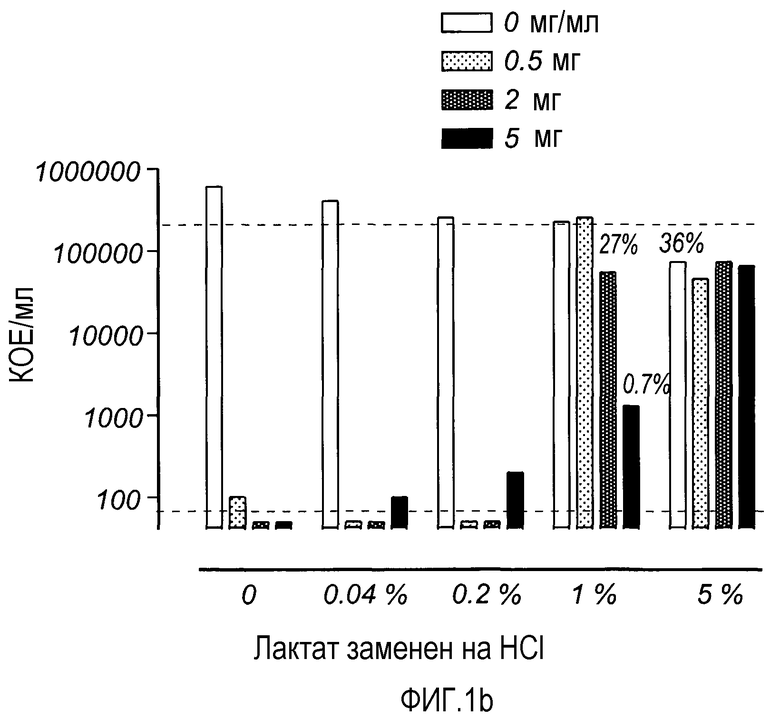
На Фиг. 2 показано влияние LF (2 мг/мл) на два штамма Lactobacillus, часто обнаруживаемых в микробиоте влагалища. Бактерии инкубировали в течение 3 ч. с различными концентрациями лактата, разведенного в 0,34% BHI, и в атмосфере СО2.
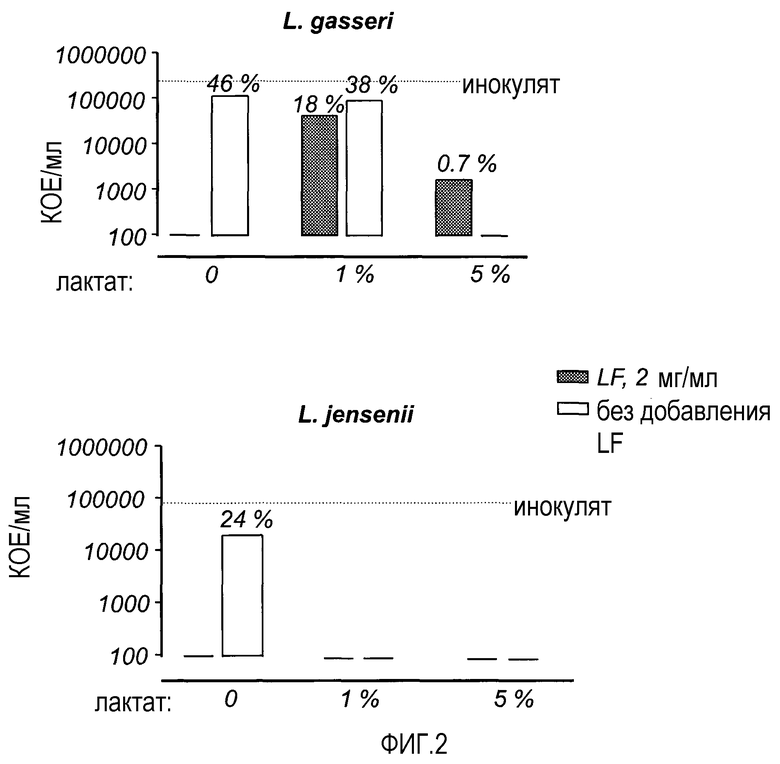
На Фиг. 3 показана антибактериальная активность LF и лактата в отношении L. gasseri и E. coli при тех же условиях (0,34% BHI, СО2, 2 ч инкубации).
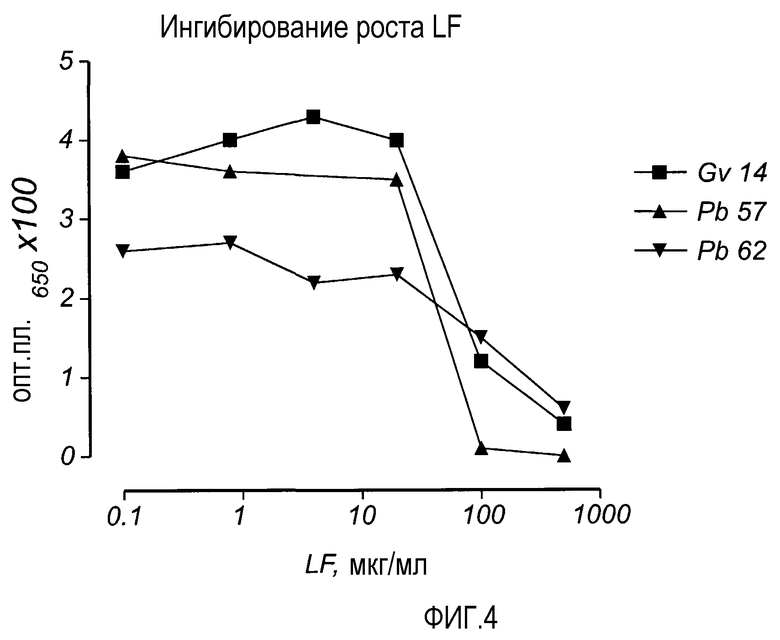
На Фиг. 4 показано ингибирование роста G. vaginalis (Gv 14) и двух штаммов P. bivia (Pb 57, Pb 62) в присутствии различных концентраций LF. Бактерии инкубировали в 0,34% BHI в анаэробных условиях в течение 20 часов. Ингибирование роста изучали спектрометрически.
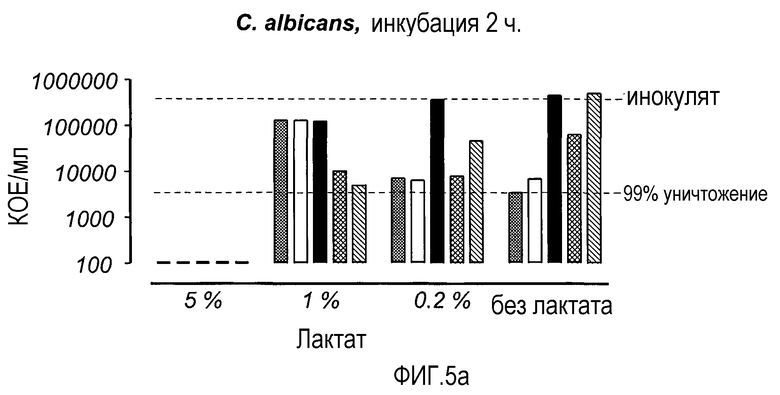
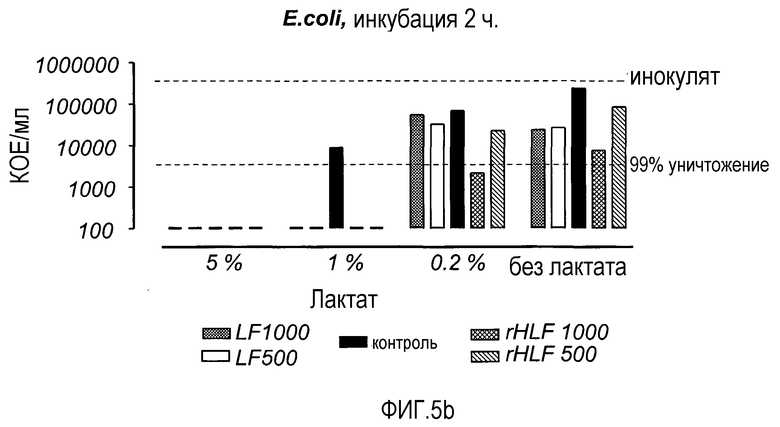
На Фиг. 5 показана микробицидная активность LF и rHLF в отношении C. albicans и E. coli в присутствии лактата (концентрации 5 и 1%, разведение 0,2% бактопептоном). Растворы инкубировали в течение 2 ч, а затем анализировали на предмет содержания жизнеспособных микроорганизмов.
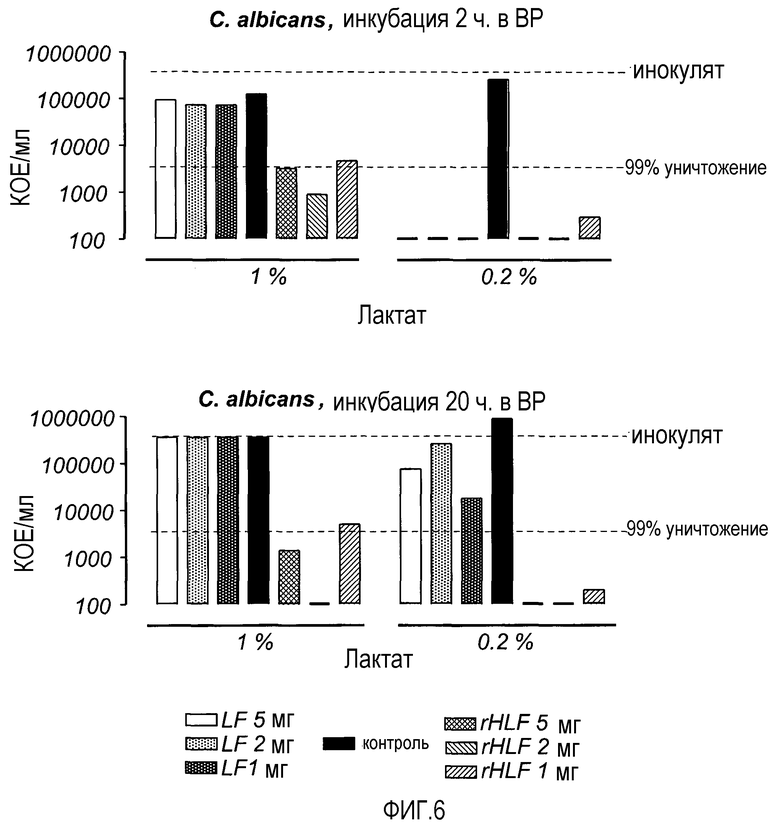
На Фиг. 6 показана фунгицидная активность LF и rHLF в отношении C. albicans в присутствии лактата (концентрации 1 и 0,2% в 0,2% бактопептоне). Растворы инкубировали в течение 2 и 20 ч и анализировали на предмет содержания жизнеспособных микроорганизмов.
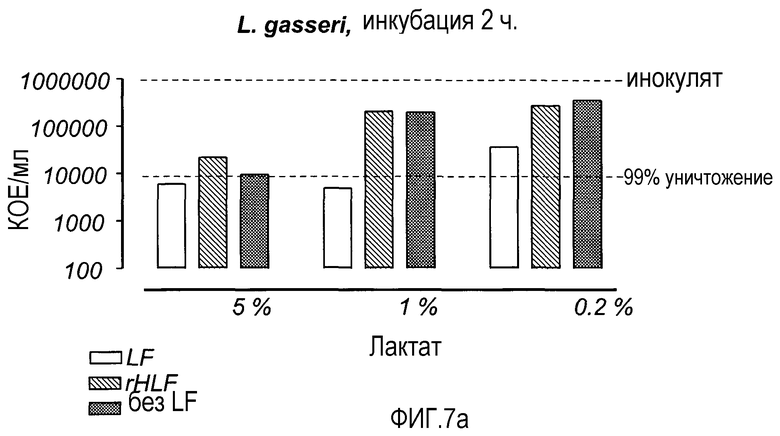
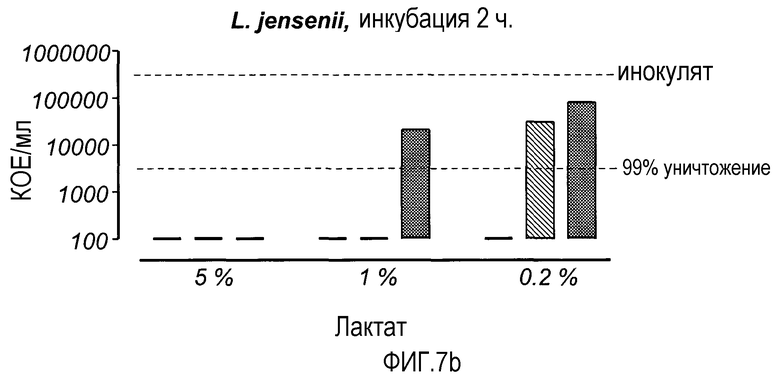
На Фиг. 7 показана бактерицидная активность LF (2 мг/мл) и rHLF (2 мг/мл) в присутствии лактата (5, 1 и 0,2%, разведенные 0,2% бактопептоном). Растворы инкубировали в течение 2 ч и анализировали на предмет содержания жизнеспособных микроорганизмов.
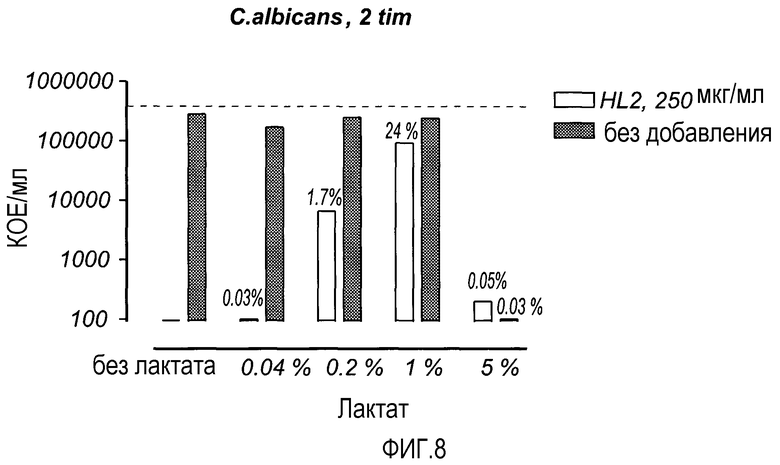
На Фиг. 8 показана фунгицидная активность LF пептида HL2 (250 мкг/мл) в присутствии различных концентраций лактата (5, 1, 0,2 и 0,04%, разведенные 0,2% бактопептоном). Растворы инкубировали в течение 2 ч. и анализировали на предмет содержания жизнеспособных микроорганизмов. Приведенные выше столбиков процентные доли соответствуют выживаемости микроорганизмов в инокуляте.
Подробное описание изобретения
Лактоферрин (LF), который описан как антибактериальный агент, модулятор воспалительного ответа и иммунорегулирующий белок, представляет собой железосвязывающий гликопротеин, имеющий структуру одиночной цепи. LF обнаруживают в молозиве и зрелом молоке в количестве 2-7 г/л. В молозиве LF составляет до 43% общего содержания белков. В других экзокринных секретах, таких как слюна, слезы, бронхиальная слизь и цервиковагинальная жидкость, также содержится LF (таблица 1).
Он является исключительно устойчивым к протеолитическому расщеплению трипсином и трипсиноподобными ферментами. Расщепление пепсином, однако, дает пептидный фрагмент, лактоферрицин, который облает сильным бактерицидным действием в отношении обширного спектра бактерий in vitro. Как LF, так и лактоферрицин являются бактерицидными и фунгицидными in vitro.
Уровни LF в некоторых секретах мг/мл
Очень важно поддерживать баланс между микроорганизмами во влагалище. При лечении BV (неприятные выделения, вызванные дисбалансом между микроорганизмами во влагалище, без воспаления) важно восстановить такой состав микроорганизмов, при котором доминируют молочнокислые бактерии.
В ходе исследовательской работы, которая привела к настоящему изобретению, было установлено, что можно получить неожиданно хорошие синергические эффекты путем объединения известного лактата, описанного выше, с LF и/или его пептидными фрагментами.
Таким образом, настоящее изобретение относится к кислой композиции молочной кислоты, содержащей LF и/или его пептидные фрагменты. Композиция согласно изобретению укрепляет натуральные защитные механизмы слизистой оболочки влагалища, помогая восстановлению продуктивной окружающей среды для молочнокислых бактерий, понижая рН, а также проявляя противомикробную активность в отношении ряда микробов, например, C. albicans, E. coli, S. aureus, G. vaginalis и различных видов Prevotella.
LF для применения согласно изобретению может представлять собой человеческий LF, рекомбинантный человеческий LF (rHLF) или LF крупного рогатого скота.
Под человеческим LF подразумевается LF, выделенный от людей, например, из человеческого молока.
Под рекомбинантным человеческим LF подразумевается LF, выработанный в про- или эукариотических клетках (в бактериях, в грибковых клетках, выработанный растениями или животными), с использованием технологии гибридной ДНК.
Пептидные фрагменты LF также можно использовать в настоящем изобретении как в отдельности, так и в комбинации с LF. Возможно использование одного вида пептидного фрагмента или двух или более видов пептидных фрагментов.
Под «пептидными фрагментами LF» подразумеваются пептиды различных размеров, в основе которых лежит противомикробная область молекулы LF из N-концевого участка. Последовательность пептидного фрагмента основана на последовательности, состоящей из аминокислот (а.к.) 1-40, в частности из аминокислот 12-40, человеческого LF, считая с N-конца. Можно использовать как синтетические, так и рекомбинантные пептиды. Примером LF пептида является лактоферрицин. Другой пептид может быть пептидом длиной в 25 или 23 аминокислоты, начиная с а.к. остатка в положении 16 или 18, соответственно, начиная с N-конца. LF-пептиды, подходящие для использования в настоящем изобретении, описаны в международной заявке WO 00/01730.
Концентрация LF и/или его пептидного фрагмента может, например, составлять от 0,0001 до 100 мг/мл, от 0,0001 до 1 мг/мл, от 0,001 до 10 мг/мл, от 0,01 до 5 мг/мл, или от 1 до 50 мг/мл. В частности, концентрация LF и/или его пептидного фрагмента составляет от 0,001 до 10 мг/мл или от 0,01 до 5 мг/мл.
Концентрация молочной кислоты может, например, составлять от 1 до 100 мг/мл или от 10 до 100 мг/мл.
Помимо этого, в настоящем изобретении можно использовать лактат, т.е. соль молочной кислоты.
Композиция может содержать нейтрализующее вещество для забуферивания рН молочной кислоты. Примерами нейтрализующих веществ являются гидроксид натрия и аммиак.
Содержание молочной кислоты и нейтрализующего вещества может быть таким, что рН составляет от 3,5 до 4,5, предпочтительно около 3,8. Значение рН преимущественно является не настолько низким, чтобы кислота раздражала ткани или ухудшала окружающую среду для молочных бактерий, которые требуют умеренно кислого окружения. Значение рН 3,7-3,9, как было установлено, является особенно благоприятным.
Композиция может дополнительно содержать ростовой субстрат для молочнокислых бактерий. Ростовой субстрат предпочтительно представляет собой α(1-4) глюканы, содержащие ветви α(1-6).
Примером подходящего ростового субстрата является гликоген, который в большом количестве находят в эпителиальных клетках влагалища женщин фертильного возраста, и он является важным питательным субстратом для молочнокислых бактерий. Гликоген используют в качестве ростового субстрата для молочнокислых бактерий, таким образом, чтобы лечение приводило не только к изменению уровня рН до более низких значений в результате снабжения молочной кислотой, но также и к восстановлению благоприятного окружения для роста молочнокислых бактерий с целью регенерации природных условий. Другими примерами ростовых субстратов являются лактоза, декстроза, глюкоза и амилопектин.
Молочную кислоту включают в композицию в значительно большей весовой доле, чем ростовой субстрат, например в весовых соотношениях от 20:1 до 500:1, в частности 50:1.
Композиция согласно изобретению может быть в форме крема, геля, спрея, таблетки или вагинального суппозитория. Композиция согласно изобретению, следовательно, имеет консистенцию крема или геля, консистенцию таблетки, консистенцию, подходящую для введения путем распыления, или ее вводят в виде вагинального суппозитория или таблетки.
Композицию согласно изобретению можно вводить вагинально, перорально или трансдермально.
Носитель для активных составляющих композиции можно добавлять для формирования пригодного к употреблению фармацевтического продукта. Композиция согласно изобретению может содержать носители, которые является такого типа носителями, которые являются инертными для конкретного случая и которые обеспечивают кремо- или гелеобразную консистенцию или консистенцию, подходящую для введения путем распыления. Альтернативно, инертный носитель представляет собой вещество, которое плавится при температуре тела и в биологической жидкости.
Если необходимо изготовить вагинальный суппозиторий, требуется носитель, который дает возможность изготовления изделия, которое является относительно твердым при комнатной температуре и в сухой среде, но которое плавится при температуре тела и при контакте с биологической жидкостью. В этой связи можно использовать полиэтиленгликоль, PEG, который постепенно плавится в среде влагалища.
Одним подходящим носителем для крема является пропиленгликоль, но известно, что и другие вещества инертной природы также являются пригодными в качестве носителей, например триглицериды.
Композиция согласно изобретению может дополнительно включать в себя агент, отвечающий за консистенцию, такой как, в случае кремов и гелей, метилгидроксипропиловый эфир целлюлозы. Примером коммерческого продукта, который можно упомянуть, является Hypromellosum® HG 4000. Другим примером агента, отвечающего за консистенцию, является кукурузный крахмал.
Под «состоянием мочеполовых путей» подразумевается любое нарушение или расстройство мочевыводящих путей или половых органов у особи женского и/или мужского пола. В частности, изобретение является пригодным для лечения состояний влагалища.
Состояние, которое следует лечить согласно изобретению, может включать в себя повышение значения рН и/или нарушение микробиоты мочеполовых путей. Под «повышенным значением рН» подразумевается рН выше 4,5.
Под «нарушением микробиоты» подразумевается биота, имеющая аномально высокие уровни связанных с BV бактерий, таких как G. vaginalis, анаэробные грамотрицательные бактерии (виды Prevotella, Bacteroides и Fusobacterium), анаэробные грамположительные кокки, виды Mobiluncus и/или аномально высокие уровни E. сoli, стафилококков (S. aureus) и стрептококков, в комбинации с аномально низкими уровнями молочнокислых бактерий. Также высокие уровни Candida, которые могут приводить к вагинитам, рассматривают как нарушение микробиоты влагалища.
Под «аномально высоким уровнем» подразумевается уровень, который в 100-1000 раз превышает уровень у здоровых лиц.
Под «аномально низким уровнем» подразумевается не преобладающий, т.е. не присутствующий, или же присутствующий в количестве менее одного морфотипа молочнокислой бактерии в микроскопическом иммерсионном поле или в количестве, меньшем или равном другим морфотипам в иммерсионном поле (Оценка согласно “Nugent scoring system”, используемой в мире для описания бактериального дисбаланса в вагинальном секрете. См. Nugent, R.P. et al., 1991, J. Clin. Microbiol. 29:297-301).
Под «противомикробной активностью» подразумевается бактериостатическая, фунгистатическая, бактерицидная и/или фунгицидная активность, т.е. способность замедлять рост и убивать некоторые бактерии и грибы, соответственно.
Под «профилактикой и/или лечением состояния» подразумевается любое лечение с целью излечения или облегчения состояния из указанных выше, или с целью предотвращения развития указанного состояния.
Примерами состояний, которые следует лечить композицией согласно изобретению, являются бактериальный вагиноз, промежуточная вагинальная микробиота и дрожжевые инфекции, например инфекции, вызванные Candida (кандидозный вагинит, кандидозный баланит).
Помимо этого, композицию согласно изобретению можно использовать для лечения хламидиозных инфекций, генитальной микоплазмы, трихомоноза, инфекции мочевыводящих путей, воспаления тазовых органов и инфекций, вызванных вирусом папилломы человека (HPV). Кроме того, композицией согласно изобретению можно лечить любые комбинации упомянутых выше состояний.
Композицию согласно изобретению можно также использовать, например, для лечения грибковой экземы, изъязвления сосков, а также в качестве профилактического средства против заболеваний, передающихся половым путем, или в качестве агента, обеспечивающего скольжение.
Композицию согласно изобретению можно также использовать для лечения бактериальных и/или вирусных инфекций ротовой полости, горла и/или носа. Помимо этого, ее можно использовать для лечения кожных инфекций, вызванных бактериями и/или вирусами.
Под «фармацевтически эффективным количеством» подразумевается количество композиции согласно изобретению, которое будет обеспечивать желательный фармакологический и/или терапевтический эффект. Желательным фармакологическим и/или терапевтическим эффектом является, как описано выше, излечение или облегчение и/или профилактика развития состояний мочеполовых путей.
Под «пациентом» подразумевается любое млекопитающее, которое является или не является человеком, особью женского или мужского пола, и нуждается в лечении с использованием композиции и/или способа согласно изобретению.
Композиция согласно изобретению может дополнительно содержать другие вещества, такие как адъюванты, носители, консерванты, витамины, минералы, эстроген и т.п., которые хорошо известны специалистам.
Помимо этого, возможно комбинировать композицию согласно изобретению с другими обычными фармакологическим средствами для лечения состояний мочеполовых путей, например, с лечением антибиотиками и/или противогрибковыми агентами, такими как препараты имидазольной группы.
Композиция может быть в форме концентрата, предназначенного для разбавления потребителем перед использованием. Указанный концентрат удобно разбавлять, например, чистой водой, водными растворами или физиологическим раствором.
Конкретные примеры композиции согласно изобретению возникают из следующих иллюстративных композиций.
Крем
Крем
Примеры
Материалы и методы
Бактериальные и грибковые штаммы
Бактериальные штаммы S. aureus 1800 (CCUG 1800), E. coli O6 и дрожжи C. albicans (ATCC 64549) использовали в микропланшетном исследовании. Все микроорганизмы культивировали в мозговой сердечной инфузионной среде (BHI) на шейкере в течение ночи при 37°С. Объем культуры переносили в новую пробирку с BHI и инкубировали в течение еще двух часов на шейкере. Бактерии собирали в log-фазе, промывали один раз, а затем суспендировали в бульоне, используемом на микропланшетного исследования. Суспензию регулировали спектрометрически и разводили до концентрации приблизительно 4×106 клеток в мл на 650 нм.
L. gasseri и L. jensenii культивировали на чашках с шоколадно-агаровой средой в течение 24 ч. в атмосфере 5% СО2/95% воздуха. Затем их собирали и добавляли в BHI (0,34%). После промывания бактериальные растворы регулировали спектрометрически и разводили приблизительно до 8×106 бактерий/мл.
G. vaginalis и P. bivia культивировали на чашках с шоколадно-GL средой в течение 48 ч. в анаэробных условиях. Бактерии собирали и суспендировали в BHI для дальнейшей инкубации (4 часа при 37°С). Бактерии дважды промывали в бактопептоне (ВР, 0,2%). Концентрацию регулировали спектрометрически и разводили приблизительно до 1×107 бактерий на мл.
LF и пептид
LF из человеческого молока приобретали у компании Sigma (Saint Louis, США). Рекомбинантный человеческий LF приобретали у компании Agenix. Пептидный фрагмент, состоявший из 23 аминокислот на основе противомикробной области человеческого LF, синтезировали с использованием стратегии fmoc.
Минимальные микробицидные и ингибирующие концентрации, ММС.
Промытые клетки суспендировали в 0,2% ВР (рН 7,0) или в среде BHI, разведенной 1/10 (0,34%, рН 6,7-6,9) (Difco, США). Концентрацию бактериальных или грибковых клеток регулировали спектрометрически. LF или пептид разводили серийно в BHIdil или ВР двойными этапами (если не указано иное), добавляли в трех повторностях в лунки микротитрационного планшета (200 мкл на лунку). Растворы бактериальных или дрожжевых клеток добавляли в 10 мкл объемы, с получением конечной концентрации приблизительно 2×105 клеток на мл. Концентрацию маточного раствора всегда проверяли с использованием определения содержания жизнеспособных микроорганизмов. Микропланшет инкубировали при 37°С в увлажненной камере в течение 2 ч, если не указано иное. Из каждой лунки отбирали по 5 мкл и добавляли в виде капли на чашку с кровяным агаром и инкубировали в течение ночи при 37°С. В некоторых экспериментах осуществляли более тщательное определения содержания жизнеспособных микроорганизмов, и гибель выражали как оставшиеся колониеобразующие единицы по отношению к инокуляту. Нижний лимит выявления микроорганизмов составлял 200 КОЕ/мл.
Процедуру микробицидного исследования в отношении G. vaginalis и P. bivia осуществляли как описано выше, за исключением того, что микропланшет инкубировали в анаэробных условиях (2 ч). Затем капли растворов анализировали на содержание жизнеспособных бактерий на чашках с кровяным агаром после 48 ч. анаэробной инкубации при 37°С.
Пример 1
Противомикробная активность лактата и LF
Противомикробную активность человеческого LF изучали с использованием микробицидного исследования, описанного выше. Различные микробы, такие как C. albicans, E. coli и S. aureus изучали на предмет их выживания в лактате (не содержавшем инертной гелевой основы, которая делает гель непригодным для микробицидного исследования), содержавшем LF.
Фиг. 1 показывает противогрибковую активность LF в отношении C. albicans в присутствии лактата (а) и хлорида водорода (b). LF инкубировали с различными концентрациями лактата, разведенного в 0,2% бактопептоне, и c C. albicans в течение 2 ч. После этого каждый раствор анализировали на предмет содержания жизнеспособных микроорганизмов.
Результаты заявителей показали, что LF усиливает противомикробный эффект лактата в отношении C. albicans, когда лактат разбавляли в пять раз или более (≤1%), для всех концентраций LF, кроме 0,5 мг при разведении лактата 1% (фиг. 1а). LF уменьшал количество дрожжевых клеток на 99,9% при концентрациях лактата 0,2%, 0,04% и 0%. В неразведенном лактате наблюдалась противогрибковая активность. 1% лактат уменьшал количество C. albicans на 65%. Однако, в присутствии LF 92% и 98,2% инокулята погибало при использовании 2 и 5 мг/мл, соответственно. Замена лактата на HCl, дававший то же значение рН, что и лактат, давала уменьшение кандидацидной активности без разведения (фиг. 1b). Данные эксперименты также показали, что не только низкие значения рН, но и сам лактат был важным фактором противогрибковой активности (в неразведенном растворе лактата).
Антибактериальная активность лактата в отношении E. coli и S. aureus была хорошей как в отсутствии, так и в присутствии LF (таблица 2 и 3).
Эффекты LF и лактата изучали также в отношении двух штаммов молочнокислых бактерий (L. gasseri и L. jensenii), которые часто находят во влагалище (фиг. 2).
Фиг. 2 показывает влияние LF (2 мг/мл) на L. gasseri и L. jensenii. Бактерии инкубировали в течение 3 ч с различными концентрациями лактата, разведенного в 0,34% BHI, и в атмосфере СО2. L. gasseri лучше выживала в аналитической системе, чем L. jensenii. Неразведенный лактат (5%) влиял на выживание Lactobacillus. В 1% лактате L. jensenii не выживала, в то время как 18% L. gasseri, обработанной LF, выживало.
В следующем эксперименте осуществляли сравнение E. coli и L. gasseri с целью, не влияют ли различные условия инкубации (0,34% BHI, инкубатор СО2) на эффект LF. Таким образом, на E. coli воздействовали так же, как и не L. gasseri.
Как было установлено ранее, E. coli является чувствительной к лактату, а L. gasseri является более резистентной, чем E. coli, в лактате, как с LF, так и без него (фиг. 3).
Микробицидная активность LF при различных концентрациях лактата по анализу с использованием микропланшетного-капельного исследования. Цифры соответствуют процентной доле оставшихся от инокулюма бактерий. +++ означает, что совокупность колониеобразующих единиц (CFU), содержавшихся в 5 мкл капле, образовывала ровный слой бактерий, ++ означает, что наблюдалась «сморщенная» поверхность, и, наконец 0 означает, что в трех повторах образцов по 5 мкл CFU обнаружено не было (>99,95 инокулюма убито).
Микробицидная активность LF при различных концентрациях лактата по анализу с использованием микропланшетного-капельного исследования. Цифры соответствуют процентной доле оставшихся от инокулюма бактерий. +++ = количеству колониеобразующих единиц в 5 мкл капле, которое образовывало ровный слой бактерий (в скобках = тенденция к складчатой поверхности по сравнению с контролем). 0 = в трех повторах образцов по 5 мкл бактерий не обнаружено (>99,95 инокулюма убито).
Эксперимент показал, что L. gasseri была более резистентной, чем E. coli к эффектам лактата и LF в комбинации, несмотря на малое выживание L. gasseri в LF без лактата.
Изучалась также антибактериальная активность LF в отношении G. vaginalis и P. bivia. В данном эксперименте бактериальные штаммы не выживали в тест-системе заявителей, несмотря на создание анаэробных условий. (См. пример 2, ниже, на предмет дальнейших экспериментов).
В качестве резюме, LF усиливал противомикробную активность лактата в отношении C. albicans и E. coli (хотя в случае C. albicans степень активность в некоторой степени зависела от концентраций LF и лактата).
При концентрации неразведенного лактата противомикробная активность была полной без LF в отношении C. albicans, S. aureus и E. coli. Также можно сделать вывод о том, что не только значение рН важно для противомикробной активности, но также и тип молекулы, обеспечивающей низкие значения рН, так, α-гидроксипропионовая кислота, лактат более активна в присутствии LF, нежели HCl (фиг. 1).
Как представляется, LF в комбинации с лактатом является благоприятным для хозяина против неприятных запахов и микробиологического дисбаланса.
Пример 2
Противомикробная активность LF в отношении G. vaginalis и P. bivia.
Микробицидное исследование было модифицировано, чтобы создать условия для выживания G. vaginalis и P. bivia. Вместо 0,2% ВР использовали 0,34% BHI. Бактериальные штаммы изучали при добавлении в лунки только LF в различных концентрациях (без лактата). Планшет инкубировали в течение 20 часов.
Ингибирование роста, обеспечиваемое LF, наблюдалось для всех изучавшихся штаммов (фиг. 4).
Во второй серии экспериментов определяли минимальную бактерицидную концентрацию (MBC) при 99% уничтожении для нескольких штаммов G. vaginalis (таблица 4). Из указанных штаммов только в случае одного штамма наблюдался некоторый рост, когда инкубацию осуществляли с 2,5 мг LF. Таким образом, противомикробная активность LF в отношении P. bivia и G. vaginalis была подтверждена.
Бактерицидная активность LF. LF разбавляли пятикратно путем серийных разведений. Концентрацию, при которой 99% микроорганизмов было убито, определяли как МВС99.
Использовали концентрации 2500, 500, 100, 20, 4 мкг/мл
Пример 3
Противомикробная активность лактата и rHLF
Целью исследования было установить, усиливает ли rHLF противомикробные эффекты лактата в такой же степени, что и LF, выделенный из человеческого молока (Sigma).
Противомикробную активность лактата (без гелевой основы), содержавшего rHLF, изучали с использованием микропланшетного исследования. Изучали микроорганизмы C. albicans, E. coli и S. aureus.
В первом эксперименте авторы изобретения сравнивали rHLF и LF в условиях без лактата (не показано). Анализ с использованием микропланшетного исследования показал, что оба препарата LF имели сходную микробицидную активность в отношении E. coli, в то время как LF был в некоторой степени более активен в отношении S. aureus и C. albicans в концентрациях 0,25 и 0,125 мг/мл (2 ч инкубации).
В присутствии лактата самая сильная активность против C. albicans была получена с неразведенным лактатом (5%), поскольку дрожжевые клетки не выжили (фиг. 5а). Однако при концентрации лактата 1%, rHLF (0,5-1,0 мг/мл) почти достиг 99% уничтожения инокулята. При концентрации лактата 0,2%, оба препарата LF в концентрации 1 мг/мл достигали 99% уничтожения. Что касается уничтожения E. coli, в неразведенном (5%) лактате бактерии не выживали, в то время как оба препарата LF усиливали бактерицидное действие при концентрации лактата 1% (фиг. 5b). rHLF в концентрации 1 мг/мл был наиболее эффективным из двух LF при концентрации лактата 0,2% и в растворе без лактата.
В следующем эксперименте изучали более высокие концентрации LF и rhLF на предмет фунгицидного действия на C. albicans (фиг. 6). И в этом случае также более выраженный эффект получали при использовании rHLF, чем при использовании LF, при концентрации лактата 1%. При концентрации лактата 0,2% более сильный эффект rHLF наблюдался только после более продолжительного времени инкубации (20 ч, фиг. 6).
На основе результатов, полученных с 2 мг rHLF (см. фиг. 6), препараты LF изучали на предмет их воздействия на два вида Lactobacillus из микробиоты влагалища, L. gasseri и L. jensenii (фиг. 7). После 2 ч. инкубации rHLF не оказывал дополнительного действия на выживание L. gasseri, по сравнению с тем, которое наблюдалось в присутствии лактата (фиг. 7а), тогда как оба препарата LF усиливали уничтожение L. jensenii в 1% лактате. При концентрации лактата 0,2% L. jensenii была более резистентной к антибактериальному эффекту rhLF. Таким образом, L. jensenii была более чувствительной к эффектам препаратов LF, чем L. gasseri, особенно в 1% лактате (фиг. 7b), и оба вида молочнокислых бактерий были более резистентны к rhLF.
Таким образом, были получены синергические эффекты в результате добавления rHLF к лактату. rHLF оказался до некоторой степени слабее по своей противомикробной активности по сравнению с LF, при испытании в разведенной среде BHI (0,34%). Напротив, rHLF был до некоторой степени сильнее, чем LF, в присутствии лактата (1 или 0,2%), за исключением случаев с использованием молочнокислых бактерий. Данный противоположный эффект в отношении молочнокислых бактерий является благоприятным для хозяина, поскольку молочнокислые бактерии входят в состав нормальной микробиоты здорового организма. Результаты показывают, что 2 мг/мл rHLF могли бы быть подходящей концентрацией в лактате.
Пример 4
Противомикробная активность лактата и пептида LF, HL2.
Изучали пептидный фрагмент на основе противомикробной области молекулы LF, содержавший 23 a.к., на предмет его фунгицидной активности в присутствии лактата. Как можно видеть из фиг. 8, добавление HL2 уменьшало жизнеспособность дрожжевых клеток при всех концентрациях лактата, а также тогда, когда лактат не добавляли. При концентрации неразведенного лактата (5%), однако, эффект лактата был полным даже в отсутствие HL2.
Таким образом, короткий пептидный фрагмент LF придавал растворам лактата противогрибковую активность.
Резюме
Подводя итоги приведенных примеров, можно сказать, что добавление LF к лактату усиливало его противомикробный эффект.
Синергический эффект в отношении бактерий, таких как E. coli (фиг. 5b), был получен при объединении лактата с LF/rHLF. Что касается противогрибковой активности лактата в отношении Candida, при добавлении, в частности, rHLF к лактату также были выявлены синергические эффекты (фиг. 5а и фиг. 6).
Указанный синергический эффект являлся неожиданным, поскольку при добавлении отрицательно заряженных молекул (лактат) следовало бы ожидать конкуренции с отрицательно заряженными группами на поверхности бактерий за взаимодействие с катионогенным LF. Обычно считается, что электростатическое взаимодействие с отрицательно заряженными поверхностями микроорганизмов является первым этапом микробицидной активности LF. Например, было показано, что возрастающие концентрации фосфата и бикарбоната могут уменьшать фунгицидную активность человеческого LF (Soukka et al., 1992, FEMS Micrоbiology letters 90:223-228).
Следует подчеркнуть также, что молочнокислые бактерии, такие как L. gasseri, неожиданно одинаково хорошо выживали в лактате, независимо от добавления rHLF (фиг. 7а).
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОБИОТИЧЕСКИЕ ШТАММЫ Lactobacillus (ВАРИАНТЫ) И ИХ ПРИМЕНЕНИЕ | 2003 |
|
RU2316586C2 |
| ПРИМЕНЕНИЕ ТИОСУЛЬФАТА ДЛЯ УСИЛЕНИЯ АНТИПАТОГЕННОГО ДЕЙСТВИЯ ЛАКТОБАЦИЛЛ | 2013 |
|
RU2667122C2 |
| ШИПУЧАЯ КОМПОЗИЦИЯ В ТВЕРДОЙ ФОРМЕ ДЛЯ ПРИМЕНЕНИЯ В ВАГИНАЛЬНЫХ ПРИЛОЖЕНИЯХ ДЛЯ ЛЕЧЕНИЯ ВАГИНАЛЬНЫХ ИНФЕКЦИЙ | 2012 |
|
RU2587717C2 |
| БАКТЕРИЯ LACTOBACILLUS RHAMNOSUS ДЛЯ ЛЕЧЕНИЯ, НАПРИМЕР, БАКТЕРИАЛЬНОГО ВАГИНОЗА | 2016 |
|
RU2758109C2 |
| Питательная среда для выделения и культивирования Lactobacillus iners и других представителей вагинальной микробиоты | 2022 |
|
RU2794804C1 |
| ПЕПТИДЫ, ВЫДЕЛЕННЫЕ ИЗ ЧЕЛОВЕЧЕСКОГО ЛАКТОФЕРРИНА, И ИХ ПРИМЕНЕНИЕ | 2012 |
|
RU2593757C2 |
| ПРИМЕНЕНИЕ ТОТАРОЛА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ТОТАРОЛ | 2018 |
|
RU2812223C2 |
| ШТАММ LACTOBACILLUS CRISPATUS ДЛЯ ЛЕЧЕНИЯ ИЛИ ПРОФИЛАКТИКИ ПОЛОВЫХ И УРОГЕНИТАЛЬНЫХ ИНФЕКЦИЙ, ТАКИХ КАК ВАГИНОЗ И КАНДИДОЗ, И ЕГО ПРИМЕНЕНИЕ | 2013 |
|
RU2661102C2 |
| НОВЫЕ СИНТЕТИЧЕСКИЕ ПЕПТИДЫ И ИХ ПРИМЕНЕНИЕ | 2012 |
|
RU2596393C2 |
| Пробиотический штамм Lactobacillus gasseri и его композиция с лактоферрином для профилактики диареи, некротизирующего энтероколита и сепсиса, вызываемых штаммами Escherichia coli у преждевременно рожденных детей | 2016 |
|
RU2641258C1 |
Изобретение относится к области медицины. Изобретение характеризуется композицией, содержащей молочную кислоту и лактоферрин или его пептидный фрагмент, для лечения и/или профилактики состояний мочеполовых путей и применением указанной композиции для изготовления лекарственного средства для лечения и/или профилактики состояний мочеполовых путей, а также способом их лечения. Способ профилактики и/или лечения состояния мочеполовых путей, вызванных бактериальной или грибковой инфекцией, включает введение пациенту фармацевтически эффективного количества композиции, содержащей молочную кислоту или ее соль и лактоферрин или его пептидный фрагмент, где указанный пептидный фрагмент основан на противомикробной области молекулы лактоферрина с N-конца. Изобретение обеспечивает противомикробный эффект при применении, в способе профилактики и/или лечения указанной композицией. 3 н. и 22 з.п. ф-лы, 4 табл., 10 ил.
1. Композиция для лечения и/или профилактики состояний мочеполовых путей, вызванных бактериальной или грибковой инфекцией, содержащая 0,1-10% молочной кислоты или ее соли, отличающаяся тем, что композиция дополнительно содержит лактоферрин или его пептидный фрагмент, где указанный пептидный фрагмент основан на противомикробной области молекулы лактоферрина с N-конца, где концентрация лактоферрина или его пептидного фрагмента составляет от 0,001 до 10 мг/мл.
2. Композиция по п.1, где концентрация лактоферрина или его пептидного фрагмента составляет от 0,01 до 5 мг/мл.
3. Композиция по любому из предыдущих пунктов, где указанный лактоферрин представляет собой рекомбинантный человеческий лактоферрин.
4. Композиция по п.1, где указанный пептидный фрагмент лактоферрина является синтетическим или рекомбинантным.
5. Композиция по п.1, дополнительно содержащая нейтрализующее вещество.
6. Композиция по п.5, где содержание молочной кислоты или ее соли и нейтрализующего вещества таково, что значение pH составляет от 3,5 до 4,5.
7. Композиция по п.5 или 6, где указанное нейтрализующее вещество представляет собой гидроксид натрия.
8. Композиция по п.1, дополнительно содержащая ростовой субстрат для видов молочнокислых бактерий.
9. Композиция по п.8, где весовое отношение молочной кислоты или ее соли к ростовому субстрату составляет от 20:1 до 500:1.
10. Композиция по п.9, где весовое отношение молочной кислоты или ее соли к ростовому субстрату составляет 50:1.
11. Композиция по п.8, где указанный ростовой субстрат представляет собой α(1-4) глюканы, содержащие ветви α(1-6).
12. Композиция по п.11, где указанный ростовой субстрат выбран из группы, состоящей из гликогена, амилопектина, глюкозы, декстрозы и лактозы.
13. Композиция по п.1, дополнительно содержащая инертный носитель.
14. Композиция по п.13, где указанный инертный носитель представляет собой пропиленгликоль или полиэтиленгликоль.
15. Композиция по п.1, дополнительно содержащая агент, обеспечивающий скольжение.
16. Композиция по п.15, где указанный агент, обеспечивающий скольжение, представляет собой метилгидроксипропиловый эфир целлюлозы.
17. Композиция по п.1, в виде крема, геля, вагинального суппозитория, таблетки или спрея.
18. Применение композиции, содержащей молочную кислоту или ее соль и лактоферрин или его пептидный фрагмент, где указанный пептидный фрагмент основан на противомикробной области молекулы лактоферрина с N-конца, для изготовления лекарственного средства, обладающего противомикробной активностью, для профилактики и/или лечения состояний мочеполовых путей, вызванных бактериальными или грибковыми инфекциями.
19. Применение по п.18, где указанное состояние включает повышенное значение pH и/или нарушение микробиоты мочеполовых путей.
20. Применение по п.19, где указанное нарушение микробиоты характеризуется аномально высокими уровнями BV-ассоциированных бактерий (анаэробных грамотрицательных бактерий, анаэробных грамположительных кокков, стафилококков, стрептококков, E. coli) и/или Candida в сочетании с аномально низкими уровнями молочнокислых бактерий.
21. Применение по п.19, где указанное состояние выбрано из группы, состоящей из бактериального вагиноза, промежуточной вагинальной микробиоты и дрожжевых инфекций.
22. Способ профилактики и/или лечения состояния мочеполовых путей, вызванных бактериальной или грибковой инфекцией, включающий введение пациенту, в случае необходимости, фармацевтически эффективного количества композиции, содержащей молочную кислоту или ее соль и лактоферрин или его пептидный фрагмент, где указанный пептидный фрагмент основан на противомикробной области молекулы лактоферрина с N-конца.
23. Способ по п.22, где указанное состояние включает повышенное значение pH и/или нарушение микробиоты мочеполовых путей.
24. Способ по п.23, где указанное нарушение микробиоты характеризуется аномально высокими уровнями BV-ассоциированных бактерий (анаэробных грамотрицательных бактерий, анаэробных грамположительных кокков, стафилококков, стрептококков, E. coli) и/или Candida в сочетании с аномально низкими уровнями молочнокислых бактерий.
25. Способ по любому из пп.22-24, где указанное состояние выбрано из группы, состоящей из бактериального вагиноза, промежуточной вагинальной микробиоты и дрожжевых инфекций.
| EP 0257007 A, 24.02.1988 | |||
| EP 1040766, 04.10.2000 | |||
| Wyatt TL et al | |||
| Antigen-releasing polymer rings and microspheres stimulate mucosal immunity in the vagina | |||
| J Control Release | |||
| Способ и аппарат для получения гидразобензола или его гомологов | 1922 |
|
SU1998A1 |
| PMID: 9685876 [найдено 05.02.2009] | |||
| Найдено из базы данных Entrez PubMed | |||
| ПОРОГОВОЕ УСТРОЙСТВО НА ТРАНЗИСТОРАХ | 0 |
|
SU240013A1 |
| WO 9806425 A1, 19.02.1998 | |||
| Крепь горных выработок | 1977 |
|
SU629347A1 |
Авторы
Даты
2010-09-10—Публикация
2005-06-23—Подача