Область техники, к которой относится изобретение
Данное изобретение относится к новым пептидам и их применению, в частности для лечения и/или предотвращения инфекций, воспаления, боли, ран, рубца и/или опухолей.
Уровень техники, предшествующий изобретению
Лактоферрин представляет собой одноцепочечный связывающий металл гликопротеин с молекулярной массой 77 кДа. Было обнаружено, что структурный домен лактоферрина, ответственный за бактерицидные свойства, представляет собой расщепляемый пепсином фрагмент, называемый лактоферрицин (см. например, 

Лактоферриновые рецепторы обнаружены на поверхности многих типов клеток, включая моноциты и макрофаги, лектин-стимулируемые человеческие лимфоциты периферической крови, клетки щеточной каймы и опухолевые клеточные линии.
Несколько патентных публикаций описывают возможное применение лактоферрина для лечения инфекций или воспалений. В WO 98/06425, например, раскрыто, что лактоферрин и лактоферрицин могут быть использованы для лечения и предотвращения инфекций, воспалений и опухолей.
EP 629347 описывает противомикробный агент, содержащий (A) гидролизат лактоферрина и/или один или более из противомикробных пептидов, полученных из лактоферринов, и (B) одно или более соединений, выбранных из группы, состоящей из металлохелатирующего белка, токоферола, циклодекстрина, сложного эфира глицерина и жирной кислоты, спирта, ЭДТА или ее соли, аскорбиновой кислоты или ее соли, лимонной кислоты или ее соли, полифосфорной кислоты или ее соли, хитозана, цистеина и холевой кислоты в качестве его эффективных компонентов. Этот противомикробный агент предназначен для обработки продуктов и особенно для безопасной обработки, например, еды и лекарственных средств. Агент в соответствии с данной публикацией, таким образом, является новым консервантом. В публикации приведены несколько пептидных последовательностей и некоторые из них имеют сходство с пептидами в соответствии с изобретением, хотя имеют место некоторые важные отличия, дополнительно описанные ниже.
US 5304633 раскрывает противомикробные пептиды, выделенные из гидролизатов человеческого и бычьего лактоферрина. В особенности описано выделение пептидов, соответствующих аминокислотам с 12 по 47 и с 17 по 41 человеческого лактоферрина.
JP 7145196 описывает приготовление антибиотических пептидов гидролизом лактоферрина. В особенности раскрыто приготовление пептида, соответствующего аминокислотам с 17 по 41 человеческого лактоферрина.
JP 8040925 раскрывает фармацевтические композиции, содержащие полученные из лактоферрина пептиды, и их использование в лечении поражений роговицы, особенно кератита. В особенности раскрыты пептиды, соответствующие аминокислотам с 17 по 41, с 12 по 58 и с 19 по 38 человеческого лактоферрина.
JP 7274970 описывает рекомбинантную выработку антибактериальных полученных из лактоферрицина пептидов, в особенности раскрыты пептиды, соответствующие аминокислотам с 18 по 42 человеческого лактоферрина.
JP 8143468 описывает полученные из лактоферрина пептиды и их использование в качестве противоязвенных лекарственных веществ, в особенности раскрыт пептид, соответствующий аминокислотам с 19 по 33 человеческого лактоферрина.
WO 00/01730 описывает пептиды, полученные из человеческого лактоферрина, и их использование для лечения инфекций и воспалений.
EP 1228097 описывает пептиды, полученные из непосредственного N-терминального конца человеческого лактоферрина, и их использование в качестве микробного агента.
EP 1151009 описывает пептиды, содержащие последовательность, соответствующую аминокислотам с 35 по 50 человеческого лактоферрина, обладающие противомикробной и/или нейтрализирующей эндотоксины активностью.
WO 2006/047744 описывает иммунномодуляторные пептиды, полученные из N-терминальной части человеческого лактоферрина, содержащие по меньшей мере 33 аминокислоты и при этом замещенные как на N-, так и на C-конце четырьмя положительно заряженными аминокислотами.
WO 2009/050279 описывает мутированные лактоферриновые пептиды и их противомикробную активность.
WO 2009/062898 описывает аргинин-замещенные лактоферриновые пептиды и их противомикробную и противовоспалительную активность.
Сущность изобретения
Данное изобретение относится к новым пептидам с улучшенной противомикробной и/или противовоспалительной активностью. Пептиды в соответствии с данным изобретением сконструированы на основании аминокислотной последовательности SEQ ID NO:1, соответствующей аминокислотам с 13 по 30 зрелого человеческого лактоферрина.
Q-P-E-Α-T-K-C-F-Q-W-Q-R-N-M-R-K-V-R (SEQ ID NO:1)
Первый вариант осуществления изобретения относится к пептидам, содержащим по меньшей мере аминокислотную последовательность
X1-X2-W-X4-X5-X6-M-X8-K-V-X11-X12-X13-X14-X15-X16-X17 (SEQ ID NO:2),
где
X1 представляет собой F, K или R,
X2 представляет собой Q, W или R,
X4 представляет собой K или R,
X5 представляет собой R или K,
X6 представляет собой N, A, V, W или R,
X8 представляет собой R или K,
X11 представляет собой R, F или K,
X12 представляет собой G, S, N, V, L или H,
X13 представляет собой S, G, T или V,
X14 представляет собой R, L, Y, W или K,
X15 представляет собой R, K или W,
X16 представляет собой R, K или W и
X17 представляет собой R, G, Q, V, M, F, W или K,
и функционально эквивалентные варианты этих пептидов.
Пептиды могут предпочтительно дополнительно содержать аминокислоты F, W или C в N-терминальном конце.
Пептиды могут предпочтительно дополнительно содержать аминокислоты G, R или L в C-терминальном конце.
Предпочтительно, пептиды в соответствии с первым вариантом осуществления изобретения содержат по меньшей мере аминокислотную последовательность
X1-X2-W-K-X5-X6-M-X8-K-V-X11-X12-X13-X14-X15-X16-X17 (SEQ ID NO:3),
где
X1 представляет собой F, K или R,
X2 представляет собой Q или W,
X5 представляет собой R или K,
X6 представляет собой N, A, V или W,
X8 представляет собой R или K,
X11 представляет собой R, F или K,
X12 представляет собой V, L или N,
X13 представляет собой S, G, T или V,
X14 представляет собой R, L, Y, W или K,
X15 представляет собой R, K или W,
X16 представляет собой R, K или W и
X17 представляет собой R, F, W или K;
и функционально эквивалентные варианты этих пептидов.
Пептиды могут предпочтительно дополнительно содержать аминокислоты F, W или C в N-терминальном конце.
Пептиды могут предпочтительно дополнительно содержать аминокислоты G, R или L в C-терминальном конце.
Более предпочтительно пептиды в соответствии с первым вариантом осуществления изобретения выбраны из пептидов, содержащих аминокислотную последовательность, выбранную из аминокислотных последовательностей

и функционально эквивалентных вариантов этих пептидов.
Наиболее предпочтительно пептиды в соответствии с первым вариантом осуществления изобретения выбраны из пептидов

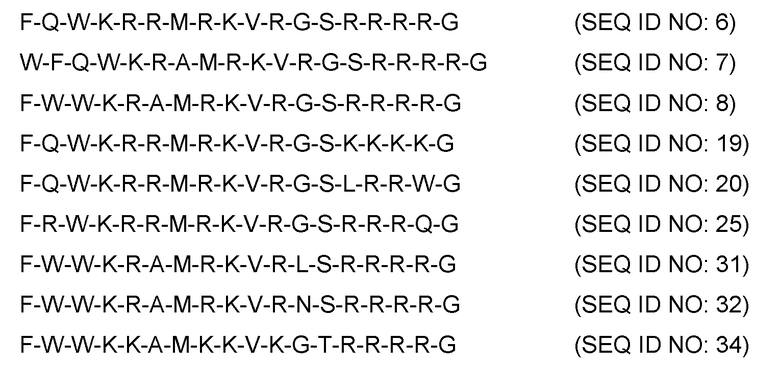
и функционально эквивалентных вариантов этих пептидов.
Пептиды в соответствии с изобретением предпочтительно имеют длину от 12 до 100 аминокислотных остатков, такую как, предпочтительно, длина от 12 до 50 аминокислотных остатков или длина от 12 до 30 аминокислотных остатков, такую как, более предпочтительно, длина от 12 до около 25 аминокислотных остатков, такую как, наиболее предпочтительно, длина от 12 до 20 аминокислотных остатков, такую как 12, 13, 14, 15, 16, 17, 18, 19 или 20 аминокислотных остатков.
Пептиды в соответствии с изобретением содержат стандартные двадцать генетически кодируемых аминокислот. Они также могут содержать одну или более из аминокислот в соответствующих стереоизомерах в 'D' форме, по сравнению с природной 'L' формой.
В описании для обозначения аминокислот использованы однобуквенные или трехбуквенные символы.
Эти символы, которые хорошо известны специалисту в данной области, имеют следующее значение: A=Ala=аланин, C=Cys=цистеин, D=Asp=аспарагиновая кислота, E=Glu=глутаминовая кислота, F=Phe=фенилаланин, G=Gly=глицин, I=Ile=изолейцин, K=Lys=лизин, M=Met=метионин, N=Asn=аспарагин, P=Pro=пролин, Q=Gln=глутамин, R=Arg=аргинин, S=Ser=серин, T=Thr=треонин, V=Val=валин, W=Trp=триптофан.
Строчные буквы используются для обозначения соответствующих D-аминокислот.
Функционально эквивалентные варианты пептидов в соответствии с изобретением могут содержать вставки или делеции одной или более аминокислот, такие как 1-5 вставок или делеций, 1, 2, 3, 4 или 5 вставок или делеций.
Функционально эквивалентные варианты пептидов в соответствии с изобретением могут также содержать замены. Замены могут быть как консервативными, так и неконсервативными. Консервативные замены представляет собой замещение аминокислоты в пределах одного общего класса (например, кислая аминокислота, основная аминокислота и т.д.) другой аминокислотой в пределах того же класса. Например, гидрофобная аминокислота может быть замещена другой гидрофобной аминокислотой, например, Trp может быть замещен на Leu. Положительно заряженная аминокислота может быть замещена другой положительно заряженной аминокислотой, например, Arg может быть замещен на Lys, например 1-5 замен, 1, 2 ,3 ,4 или 5 замен.
Фигура 1 иллюстрирует различные классы аминокислот.
Функционально эквивалентные варианты пептидов в соответствии с изобретением могут также содержать другие неприродные аминокислоты, при условии, что полипептидом сохраняется требуемое функциональное свойство. Такие неприродные аминокислоты могут содержать α,α-двузамещенные аминокислоты, N-алкил-аминокислоты или другие варианты, имитирующие конкретные природные аминокислоты.
Например, в функционально эквивалентных вариантах пептидов в соответствии с изобретением лизин (K/Lys) может предпочтительно быть замещен на Dap (диаминопропионовая кислота), Dab (2,4-диаминобутановая кислота), Orn (орнитин) или Hyl (5-гидроксилизин), аргинин (R/Arg) может быть предпочтительно замещен на Har (гомоаргинин), аланин (A/Ala) может быть предпочтительно замещен на Aib (α-аминоизомасляная кислота) или Abu (2-аминомасляная кислота), валин (V/Val) может быть предпочтительно замещен на Nva (норвалин) или Iva (изовалин), лейцин(L/Leu) может быть предпочтительно замещен на Nle (норлейцин) или Cha (3-циклогексилаланин), серин (S/Ser) может быть предпочтительно замещен на Hse (гомосерин), цистеин (C/Cys) может быть предпочтительно замещен на Hey (Гомоцистеин), гистидин (H/His) может быть предпочтительно замещен на Hhs (гомогистидин) или 3-MH (3-метилгистидин), фенилаланин (F/Phe) может быть предпочтительно замещен на Phg (2-фенилглицин), пролин (P/Pro) может быть предпочтительно замещен на Hyp (4-гидроксипролин).
Соответственно, функционально эквивалентными вариантами пептидов являются пептиды, которые имеют более 70% идентичности последовательности, такую как более 75% идентичности последовательности, предпочтительно более 80% идентичности последовательности, такую как более 85% идентичности последовательности, наиболее предпочтительно более 90% идентичности последовательности, такую как более 93, 94, 95, 96, 97, 98 или 99% идентичности последовательности, по сравнению с пептидом, выбранным из пептидов


Процент идентичности между двумя аминокислотными последовательностями определяется следующим образом. Во-первых, аминокислотная последовательность сравнивается, например, с SEQ ID NO:1 с использованием программы BLAST 2 Sequences (BI2seq) из отдельной версии BLASTZ, содержащей BLASTN версия 2.0.14 и BLASTP версия 2.0.14. Эта отдельная версия BLASTZ может быть получена на веб-сайте Национального центра биотехнологической информации правительства США ncbi.nlm.nih.gov. Инструкции, объясняющие, как использовать программу BI2seq, можно найти в файле readme, сопровождающем BLASTZ. BI2seq выполняет сравнение между двумя аминокислотными последовательностями с использованием алгоритма BLASTP. Для сравнения двух аминокислотных последовательностей, опции BI2seq установлены следующим образом: -i установлена для файла, содержащего первую аминокислотную последовательность, которая должна быть сравнена (например, C:\seq1.txt); -j установлена для файла, содержащего вторую аминокислотную последовательность, которая должна быть сравнена (например, C:\seq2.txt); -p установлена для blastp; -o установлена для любого целевого имени файла (например, C:\output.txt); и все другие опции оставлены в их стандартных настройках. Например, следующая команда может быть использована для генерирования выходного файла, содержащего сравнение между двумя аминокислотными последовательностями: C:\BI2seq -i c:\seq1.txt -j c:\seq2.txt -p blastp -o c:\output.txt. Если две сравниваемые последовательности имеют гомологию, тогда обозначенный выходной файл будет представлять эти области гомологии в виде выровненных последовательностей. Если две сравниваемые последовательности не имеют гомологии, обозначенный выходной файл не будет представлять выровненные последовательности. После выравнивания, количество совпадений определяется подсчетом количества положений, где в обоих последовательностях представлен идентичный нуклеотид или аминокислота.
Процент идентичности определяется делением количества совпадений на длину последовательности, установленной в идентифицируемой последовательности, с последующим умножением полученного значения на 100, Например, если последовательность сравнивается с последовательностью, приведенной в SEQ ID NO:1 (длина последовательности, приведенной в SEQ ID NO:1, составляет 18) и количество совпадений составляет 16, то последовательность имеет процент идентичности 89% (т.е., 16÷18·100=89) с последовательностью, приведенной в SEQ ID NO:1.
Кроме того, слияния пептидов в соответствии с изобретением с другими полипептидами, например, с глутатион-S-трансферазой, белком A, олигогистидиновой меткой для облегчения очистки или с эпитопом, распознаваемым антителом, таким как метка Myc эпитопом, также включены в данное изобретение.
Слияния, которые содержат другие целевые свойства которые, например, пригодны в детектировании или выделении пептида, или стимуляции клеточного поглощения пептида также включены в изобретение. Примерами таких сливающихся партнеров являются биотиновая группа, стрептавидиновая группа, радиоактивная группа, флуоресцентная группа, подобная небольшому флуорофору или флуорофору зеленому флуоресцентному белку GFP, иммуногенная метка, липофильная молекула или полипептидный домен, который может стимулировать клеточное поглощение пептида.
Функционально эквивалентные варианты пептидов в соответствии с изобретением могут также содержать химически модифицированные или дериватизированные аминокислоты, например посредством пегилирования, амидирования, этерификации, ацетилирования и/или алкилирования.
Существуют и должны быть включены различные стратегии присоединения для PEG. Например, PEG может быть связан с N-терминальными аминогруппами или с аминокислотными остатками с реакционноспособными амино- или гидроксильными группами (Lys, His, Ser, Thr и Tyr) напрямую или посредством использования γ-аминомасляной кислоты в качестве линкеров. PEG может также быть связан с карбоксильными (Asp, Glu, C-концевые) или сульфгидрильными (Cys) группами.
Функционально эквивалентные варианты пептидов в соответствии с изобретением могут также содержать химические производные аминокислот, полученные реакцией с функциональной стороной. Такие дериватизированные молекулы содержат молекулы, в которых свободные аминогруппы были дериватизированы с образованием амингидрохлоридов, п-толуол сульфонильных групп, карбоксибензокси групп, т-бутилоксикарбонильных групп, хлорацетильных групп или формильных групп. Свободные карбоксильные группы могут быть дериватизированы с образованием солей, метиловых и этиловых сложных эфиров или других типов сложных эфиров и гидразидов. Свободные гидроксильные группы могут быть дериватизированы с образованием O-ацильных или O-алкильных производных.
Функционально эквивалентные варианты пептидов в соответствии с изобретением могут также содержать пептидомиметические варианты пептидов. Пептидомиметик представляет собой соединение, которое имитирует конформацию и конкретные свойства пептида. Например, пептидомиметики содержат пептиды с сохраненными (-CO-NH-) связями. Кроме того, пептидомиметики содержат варианты, где аминокислотные остатки соединены γ(CH2NH)-связью, которая замещает обычную амидную связь. Кроме того, пептидомиметики также содержат омега-аминокислоты, где амино- и карбоксильные группы разделены полиметиленовыми звеньями вариабильной длины.
Пептиды в соответствии с изобретением могут содержать модификации, такие как амидирование, аминоконцевое ацилирование (например, ацетилирование или амидирование тиогликолевой кислотой), концевое карбоксильное амидирование (например, с аммиаком или метиламином), и другие концевые модификации, где N-или C-концевые области пептида заблокированы для снижения подверженности экзопротеолитическому расщеплению. Дополнительно, посредством ацетилирования N-конца и амидирования C-конца пептиды будут лишены заряда на концах. Предполагая, что рецепторы связывают соответствующие последовательности LF (где нет N- и C-концевых зарядов), кэппированные пептиды должны связываться лучше, так как они в этом отношении похожи на нативный белок больше, чем некэппированные пептиды.
Пептиды в соответствии с изобретением могут быть мечены по C-концу триптофаном для повышения активности, как описано Pasupuleti et al. Biochim Biophys Acta 2009, 1790:800-8.
Дополнительно, если он присутствует, цистеиновый остаток в пептидах может быть замещен ацетамидометилцистеином. Дополнительно, пептиды в соответствии с изобретением могут быть в циклической форме, полученной посредством создания дисульфидного мостика между двумя цистеинами в последовательности. Дополнительно, пептиды в соответствии с изобретением могут содержать образованные лактамы.
Пептиды в соответствии с изобретением пригодны для лечения и/или предотвращения инфекций, воспалений, опухолей, боли, ран и рубцов. Термин "лечение", используемый в данном документе, относится к излечиванию, реверсированию, ослаблению, облегчению, минимизированию, подавлению или остановке повреждающего эффекта болезненного состояния, развития болезни или другого аномального состояния, и термин "предотвращение", используемый в данном документе, относится к минимизированию, снижению, уменьшению или подавлению риска развития болезненного состояния или прогрессирования или других аномальных или болезнетворных состояний.
Инфекции, излечиваемые пептидами или лекарственными средствами/медицинскими устройствами в соответствии с изобретением, содержат инфекции, вызванные всеми классами патогенов, такими как бактерии, вирусы, грибы и т.д. Пептиды в соответствии с изобретением могут быть использованы для покрытия/обработки различных лекарственных средств/продуктов медицинского назначения для уменьшения/предотвращения связанных с устройством инфекций.
Также возможно обрабатывать различные типы воспалений. Воспаление представляет собой комплексное явление, характеризуемое в числе прочего аномальным "покраснением" и опуханием тканей и органов, болью и нагреванием в поврежденных участках, капиллярной дилатацией, инфильтрацией лейкоцитов и т.д. Воспаление первоначально вызвано воздействием бактериальных и других ядовитых агентов и физической травмы. Аллергическое воспаление является важной патофизиологической особенностью некоторых нарушений или медицинских состояний, включая аллергическую астму, атонический дерматит, аллергический ринит и некоторые офтальмологические аллергические заболевания.
Соответственно, один аспект данного изобретения относится к способам лечения и/или предотвращения инфекций, воспалений, опухолей, боли, ран и рубцов, где эффективное количество пептида по изобретению и его функционально эквивалентные варианты вводятся пациенту. Указанный пептид может быть приготовлен для того, чтобы быть введенным орально, системно, парентерально, локально или местно. Дополнительно, указанный пептид может быть включен в пищевой продукт или включен в детскую пищевую смесь.
Дополнительно, другой аспект данного изобретения относится к пептидам по изобретению для использования в лечении и/или предотвращении инфекций, воспалений, опухолей, боли, ран и рубцов. Указанный пептид может быть приготовлен для орального введения, системного введения, парентерального введения, локального введения или местного введения. Дополнительно, указанный пептид для применения может быть включен в пищевой продукт или включен в состав детского питания.
Дополнительно другой аспект данного изобретения относится к использованию пептидов по изобретению для производства лекарственного средства/продуктов медицинского назначения для лечения и/или предотвращения инфекций, воспалений, опухолей, боли, ран и рубцов. Указанное лекарственное средство может быть приготовлено для орального введения, системного введения, парентерального введения, локального введения или местного введения. Дополнительно, лекарственное средство/продукт медицинского назначения может быть включено в пищевой продукт или включено в состав детского питания.
Воспаление имеет много форм и опосредовано множеством различных цитокинов и другими химическими сигналами. Эти медиаторы воспаления содержат фактор некроза опухоли-α (TNF-α), интерлейкин-1 (IL-1), интерлейкин-4 (IL-4), интерлейкин-5 (IL-5), интерлейкин-6 (IL-6), интерлейкин-8 (IL-8), интерферон гамма (IFN-γ) и различные колониестимулирующие факторы (CSFs).
Несмотря на ингибирование инфекций и модуляцию воспалительного ответа, пептиды пригодны для лечения/предотвращения образования ран и рубцов. Как указано выше, пептиды в соответствии с изобретением также пригодны для лечения опухолей.
Пептиды в соответствии с изобретением могут быть использованы или если они включены в медицинское устройство, лекарственное средство, или как фармацевтическая композиция. Лекарственное средство или фармацевтическая композиция в соответствии с изобретением могут также содержать вещества, используемые для облегчения приготовления фармацевтического препарата или введения препарата. Такие вещества хорошо известны специалистам в данной области и могут, например, являться фармацевтически допустимыми адъювантами, носителями и консервантами.
Соответственно, один аспект данного изобретения относится к фармацевтическим композициям, содержащим пептид в соответствии с изобретением.
Другой аспект изобретения относится к фармацевтическим композициям, содержащим пептид в соответствии с изобретением для использования в лечении и/или предотвращении инфекций, воспалений, опухолей, боли, ран и рубцов.
Пептиды в соответствии с изобретением могут быть приготовлены или для орального введения, системного введения, парентерального введения, локального введения, или для местного введения.
Пептиды, лекарственные средства, медицинское устройство и фармацевтическая композиция в соответствии с изобретением могут быть введены пациенту или орально, системно, парентерально, локально или местно.
Термин "пациент", используемый в данном документе, относится к любому индивидууму с риском развития или страдающему от болезненного состояния, развития болезни или другого аномального или болезнетворного состояния.
Системное ведение пригодно, например, для лечения инфекции мочевыводящих путей, колита и опухолей. Системное ведение может быть осуществлено оральным, назальным, пульмональным, орофарингеальным, внутривенным, внутриартериальным, внутриполостным, внутримышечным, подкожным, трансдермальным, суппозиториями (включая ректальные) или другими путями, известными специалисту в данной области.
Локальное введение пригодно например, для лечения инфекций и воспалений кожи и кожных структур, респираторных инфекций, всех инфекций и воспалений в мембранах слизистых и т.д. Локальное введение может быть осуществлено местным, накожным, оральным, назальным, вагинальным, офтальмическим, ушным, пульмональным или орофарингеальным путем. Для лечения местных инфекций или воспалений пептиды или лекарственные средства или медицинское устройство в соответствии с изобретением могут, например, быть включены в гель, крем, мазь, раствор или пасту, ингаляционный порошок/раствор, ушной или офтальмический раствор/суспензию/мазь.
В способе в соответствии с изобретением эффективное количество пептида в соответствии с изобретением вводится пациенту. Термин "эффективное количество", используемый в данном документе, относится к количеству, достаточному для лечения или предотвращения болезненного состояния, развития болезни или других аномальных или болезнетворных состояний.
Пептиды, или лекарственные средства, или медицинское устройство и способы в соответствии с изобретением особенно хорошо подходят для лечения и/или предотвращения инфекций мочевыводящих путей и колита, инфекций и воспаления кожи и кожных структур, инфекций и воспаления в наружном ухе, слуховом канале, внутреннем ухе, и глазе, и респираторной системе, хронических и острых ран, но некоторые другие воспалительные и инфекционные заболевания также являются излечимыми в соответствии с данным изобретением, такие как воспалительные заболевания кишечника, ревматоидный артрит, артроз, состояния, вызванные вирусом HIV-1, состояния, вызванные вирусом CMV и состояния, вызванные грибками, например, видами Candida, такими как Candida albicans и Candida krusei, Aspergillus и Cryptococcus neoformans. Этот список никоим образом не ограничивает объем изобретения.
Пептиды, лекарственные средства, медицинское устройство и способы в соответствии с изобретением также хорошо подходят для профилактического медицинского обслуживания посредством уменьшения риска развития воспалительных или инфекционных заболеваний у пациентов с повышенным риском возникновения такого осложнения.
Пептиды по данному изобретению подходят для противовоспалительных и иммунномодуляторных методов терапии, иллюстрируемых, но не ограниченных ими:
1) В целом лечение и/или предотвращение воспаления и/или медицинского состояния, возникшего в результате воспаления, и в частности:
2a) Кишечник: болезнь Крона, колит, язвенный колит.
2b) Суставы: ревматоидный артрит, артрит, артроз, локализированные нарушения мышц, включая мышечный спазм, мышечный разрыв, мышечную травму, мышечное напряжение, мышечное растяжение.
2c) Дерматология: псориаз, экзема (excema), дерматит, угри.
2d) Сердце: перикардит, эндокардит, сердечная недостаточность.
2e) Боль: (дополнительно описана под 2f ниже).
2f) Нервная система: Альцгеймер, множественный склероз, синдром запястного канала, грыжа межпозвонкового диска, цервикальная ризопатия, паралич Белла, острое повреждение спинного мозга, сдавление спинного мозга, спинальный стеноз, постгерпетическая невралгия, вирусный энцефалит, вирусный менингит, болезнь Меньера, полиомиелит и осложнения после полиомиелита, хроническая воспалительная демиелинизирующая полинейропатия, полиневропатия, тригеминальная невралгия, хронические эпилептические расстройства.
2g) Органы чувств: глаукома.
2h) Поверхности слизистой (воспаление в результате химио/радиационной терапии).
2i) Аллергия.
2j) Аутоиммунные заболевания.
Пептиды по изобретению дополнительно подходят для предотвращения и/или лечения ран и/или рубцов применительно к состояниям и процедурам, иллюстрируемым, но не ограниченным ими:
3a) хирургические процедуры на различные ткани, такие как кожа, мышцы, сухожилия, нервная ткань, кровеносные сосуды и в различных частях тела, таких как глаза, уши, голосовая складка, кисть руки, спинной мозг, интраабдоминальная полость, внутригрудная полость, полость черепа, ротовая полость, гинекологические процедуры, эндометриоз, фимоз,
3b) угри.
3c) келоидные и гипертрофические рубцы.
3d) плеврит.
3e) перитонеальный диализ.
3f) острые и хронические раны.
Предполагается, что пептиды по изобретению дополнительно обладают анти- ангиогенетическими эффектами и следовательно подходят для лечения и/или предотвращения:
4a) рака.
4b) ревматоидного артрита.
Пептиды по изобретению обладают противоинфекционными эффектами и подходят для предотвращения и/или лечения:
5a) Антибактериальные эффекты:
Верхние и нижние дыхательные пути (тонзиллит, синусит, пневмония, хроническое обструктивное заболевание легких, кистозный фиброз, и т.д.).
Инфекции глаза (например, конъюнктивит).
Инфекции мочевыводящих путей.
Заболевания, передающиеся половым путем (включая противомикробное покрытие презервативов).
Половой тракт (включая вагиноз, вагинит, цервицит, эндометрит, PID).
Инфекции желудочно-кишечного тракта (системные инфекции, инициируемые GI)
Инфекции центральной нервной системы.
Инфекции кожи и структур кожи, такие как вторично-инфицированные травматические повреждения, включая инфекции послеоперационной раны, целлюлит или абсцессы, вторично-инфицированные дерматозы, импетиго и карбункулы или фурункулез (включая как грамположительные и грамотрицательные бактерии, стафилококки, к примеру, MRSA, стрептококки, нозокомиальные, раны, ожоги), мышцы, суставов (например, септический артрит), кости и гемопоэтической системы.
Инфекции, относящиеся ко рту, глазу, внутреннему и наружному уху и слуховому каналу, включая пародонтит, гингивит.
5b) Противовирусные эффекты:
Верхних и нижних дыхательных путей.
Заболевания, передающиеся половым путем.
Инфекции желудочно-кишечного тракта (системные инфекции, инициируемые в GI).
Инфекции центральной нервной системы.
5c) Противогрибковые эффекты:
Верхних и нижних дыхательных путей (такие как афты, кожно-слизистый кандидоз).
Мочеполовые пути (такие как вульвовагинальный кандидоз, баланит).
Инфекции желудочно-кишечного тракта (системные инфекции, инициируемые в Gl).
Инфекции центральной нервной системы.
Инфекции кожи и кожных структур (такие как кожно-слизистый кандидоз), дерматоз и экзема.
Наиболее предпочтительно пептиды по данному изобретению используются для лечения, профилактики и/или предотвращения импетиго, ожоговых ран, инфицированных абразий, инфицированных повреждений, экскориации, рожистого воспаления, целлюлита, абсцессов, фурункула, карбункул, зашитых ран, инфекций послеоперационной раны, вторично-инфицированных дерматозов: атонического дерматита, псориаза и аллергического контактного дерматита, укусов животного, инфекции вследствие катетеризации.
Пептиды, лекарственные средства и способы в соответствии с изобретением могут быть использованы или отдельно, в комбинации с любыми другими, или в комбинации с традиционной терапией.
В соответствии с данным изобретением также возможно включать пептиды, в эффективном количестве, в любой тип еды или напитков, предназначенный для снижения инфекций и/или воспалений у пациентов, имеющих повышенный риск таких состояний из-за лежащего в основе заболевания, низкой массы при рождении или медицинского лечения. Например, возможно включать пептиды в эффективном количестве в состав детской смеси для ингибирования вредоносных эффектов бактерий, таких как потеря в весе, вызванная воспалением, индуцированным бактериями, вирусами или грибами у младенцев. Когда пептиды в соответствии с изобретением должны быть использованы в продуктах питания, например, в питательных целях, особенно предпочтительно использовать пептиды природного происхождения.
Так как пептиды в соответствии с изобретением обладают противомикробными эффектами, они также могут быть использованы в качестве консервантов в различных продуктах питания и лекарственных средствах, таких как гели, кремы, мази, пасты, растворы, эмульсии и т.д.
Далее изобретение будет дополнительно объяснено в последующих примерах. Эти примеры предназначены только для иллюстрирования и не должны рассматриваться как ограничивающие объем изобретения.
ОПИСАНИЕ ФИГУР
Фигура 1. Изображение различных классов аминокислот, демонстрирующее сходство с точки зрения гидрофобности, размера и заряда.
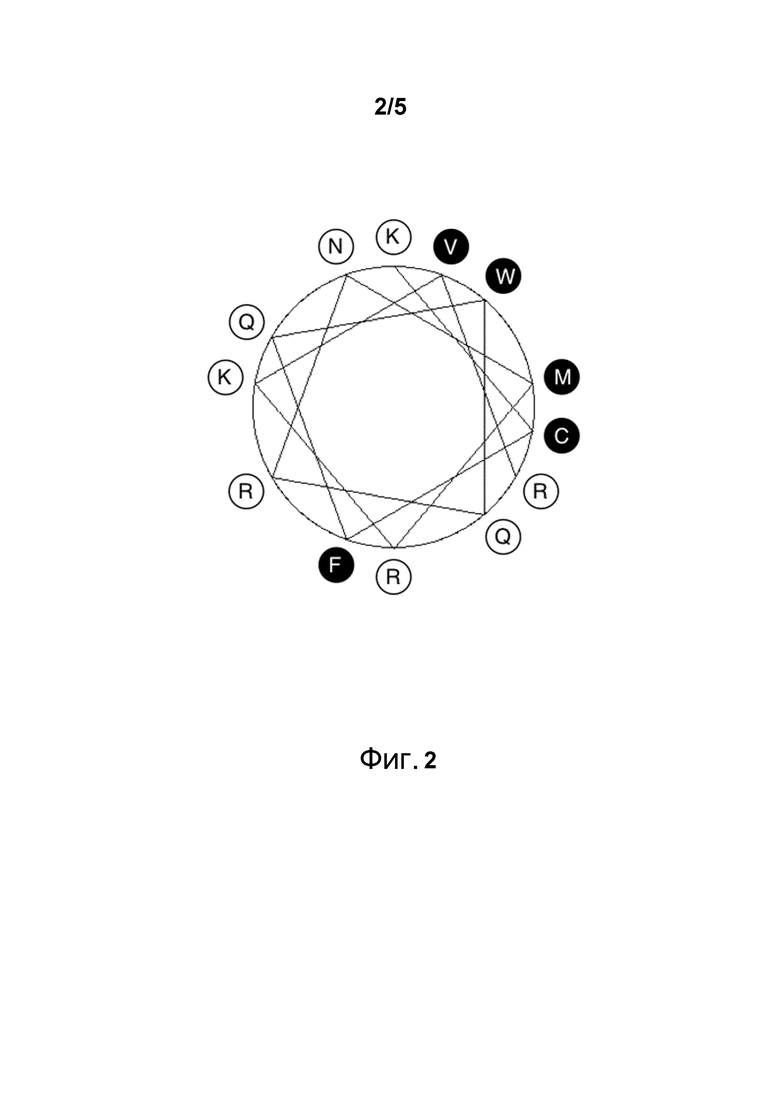
Фигура 2. Вид сверху спирали, соответствующей части пептида SEQ ID NO:1, а именно KCFQWQRNMRKVR.
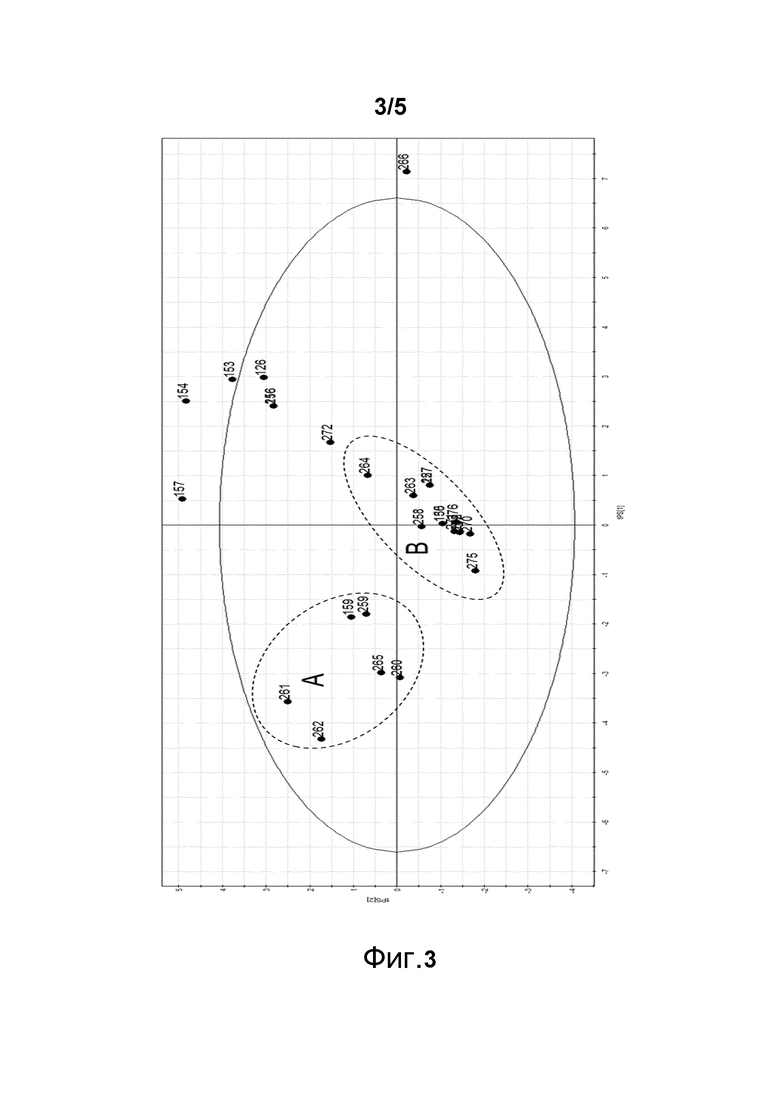
Фигура 3. Диаграмма разброса, изображающая кластеризующиеся пептиды. Пептиды нанесены в соответствии с их физико-химическими свойствами. Пептиды с TNF-α ингибирующей активностью (с концентрацией пептида 40 мкМ) могут быть обнаружены в двух кластерах: кластерах A и B.
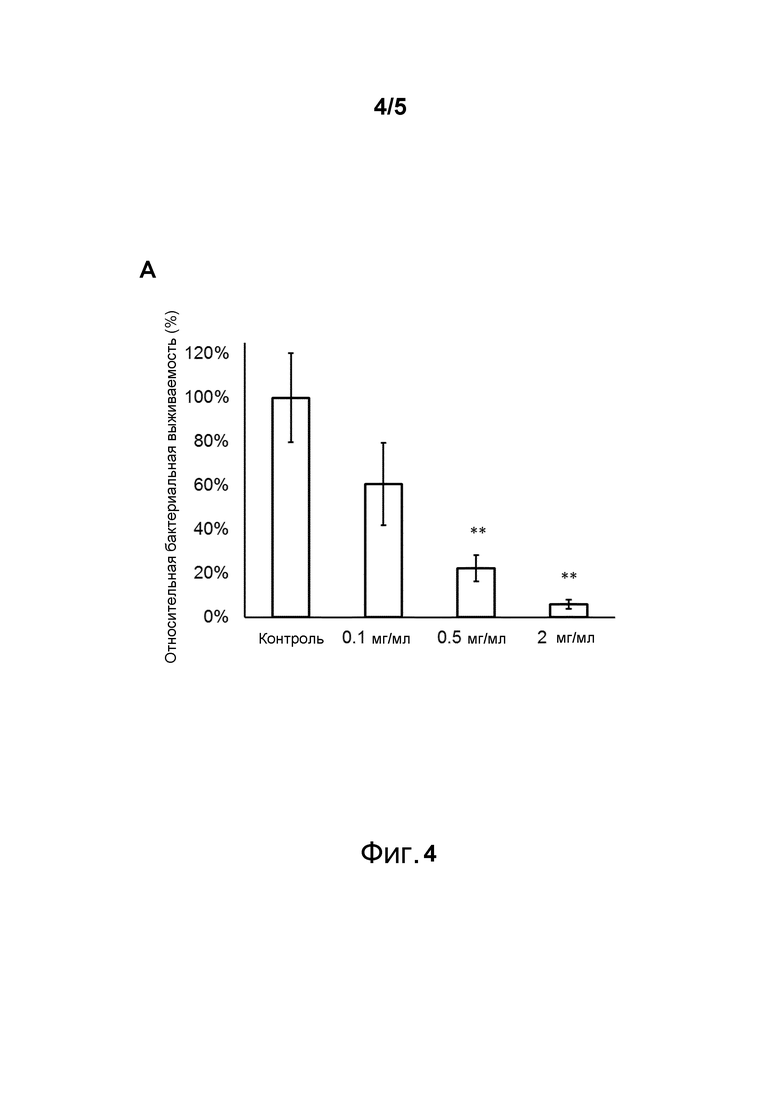
Фигура 4. Дозозависимый эффект пептида 265 (A) на бактериальную колонизацию инфицированных иссечененных ран у крыс. Раны, инфицированные MRSA (CCUG 41879) и обработанные соответствующим пептидом в H2O в концентрациях 0,1, 0,5 и 2 мг/мл, демонстрируют значительное снижение в количестве бактерий дозозависимым образом. Результаты представлены в виде относительной бактериальной выживаемости (%) по сравнению с контрольной группой ± SEM (n=15 ран). Статистическую значимость оценивали по критерию Стьюдента: *=p<0,05, **=p<0,01, ***=p<0,001.
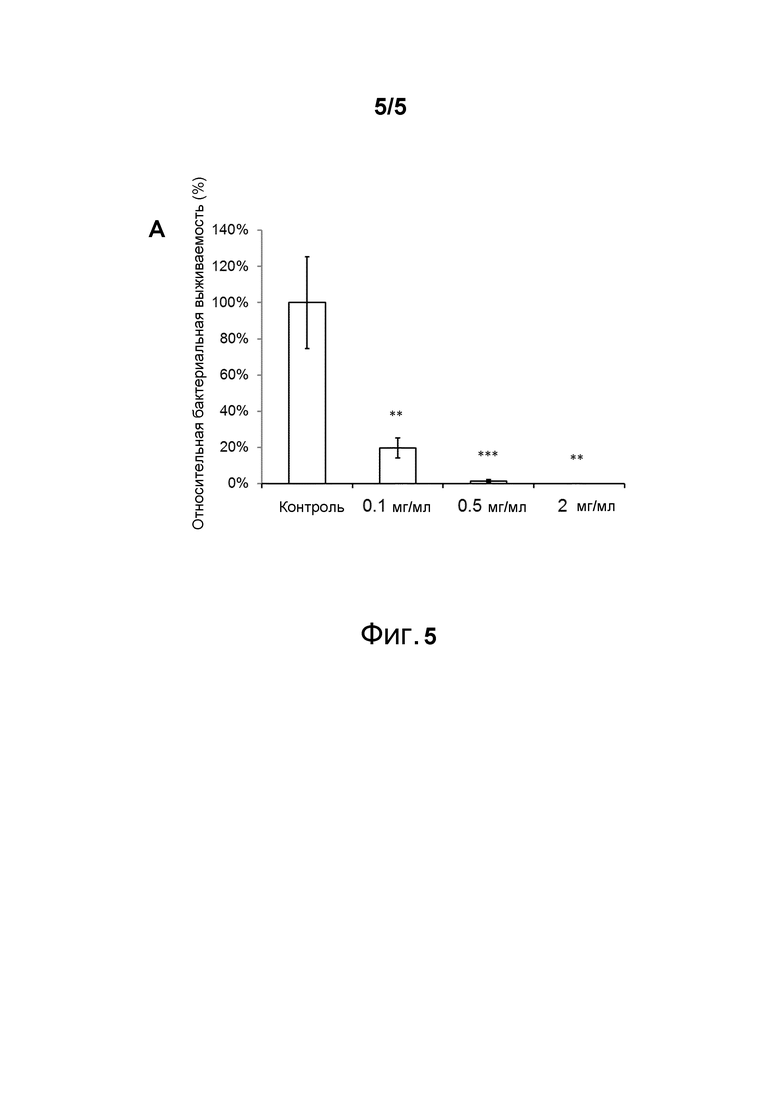
Фигура 5. Дозозависимый эффект пептида 265 (A) на бактериальную колонизацию инфицированных ран свиной кожи. Раны, инфицированные S. aureus в PBS/сыворотка (50/50) и обработанные соответствующим пептидом в H2O в концентрациях 0,1, 0,5 и 2 мг/мл, демонстрируют значительное снижение в количестве бактерий дозозависимым образом. Результаты представлены в виде относительной бактериальной выживаемости (%) по сравнению с контрольной группой ± SEM (n=10 раны). Статистическая значимость оценивалась по критерию Стьюдента: *=p<0,05, **=p<0,01, ***=p<0,001.
ПРИМЕРЫ
Пример 1. Пептидный скрининг 1
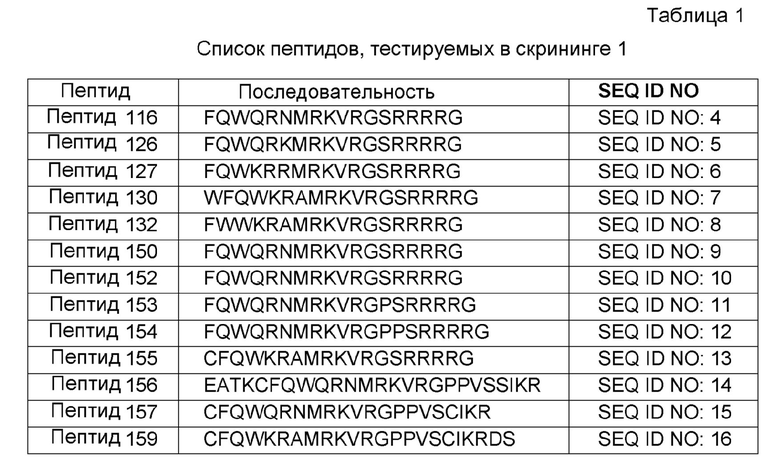
Полученные из лактоферрина пептиды, показанные в таблице 1, конструировали и тестировали. Идентифицировали активные пептиды.
Новые пептидные варианты были разработаны на основании измеренной противовоспалительной и противомикробной активности пептидов, имеющих последовательности сходные с SEQ ID NO:1. Кроме того, учитывали структурные аспекты соответствующих последовательностей для этих пептидов. На практике, это означает, спиральность пептидов поддерживали и увеличивали. Новые варианты пептидов конструировали посредством увеличения положительного заряда и гидрофобных областей пептидов. Таким образом, амфипатический характер пептидов был повышен (Фигура 2). На основании новых конструкций новые пептиды были упорядочены как PEPscreen library (Sigma) и тестировались как на противовоспалительную, так и на противомикробную активность.
Противовоспалительную активность измеряли как ингибирование выработки TNF-α в LPS-стимулируемых THP-1 клетках.
Клеточная линия THP-1 (TIB-202; ATCC, Manassas, VA, USA), соответствующая человеческим моноцитам, поддерживалась в RPMI 1640 (PAA Laboratories GmbH, Pasching, Austria), дополненной 10% фетальной бычей сывороткой (FBS; PAA Laboratories GmbH, Pasching, Austria), 1 мМ пируватом натрия (Sigma -Aldrich, St. Louis, MO, USA) и 20 мМ HEPES (PAA, Laboratories GmbH, Pasching, Austria).
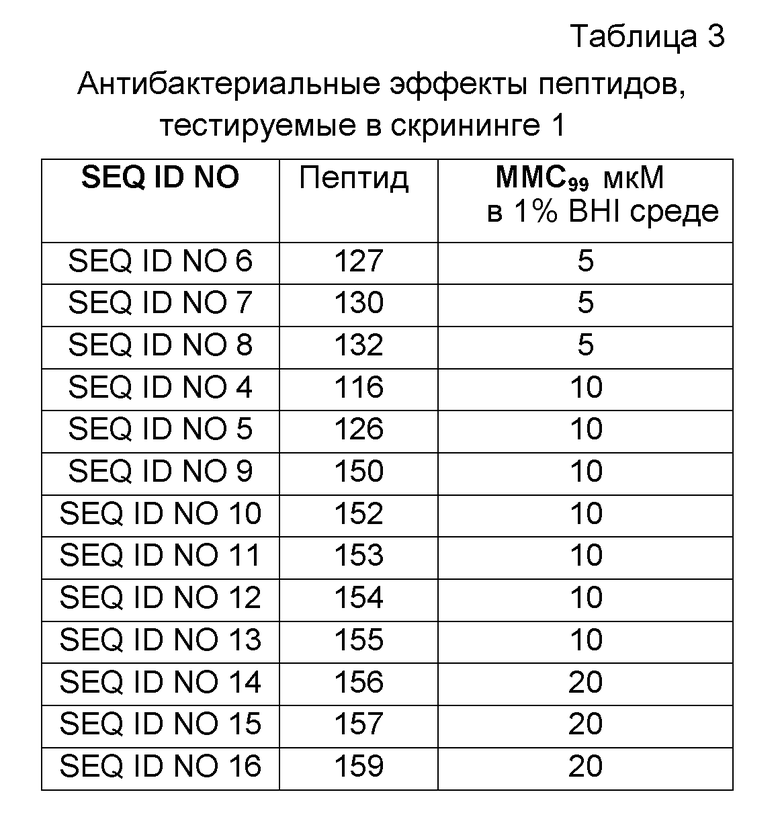
Клеточную плотность доводили до 106 клеток/мл и добавляли 100 мкл суспензии в расчете на лунку в 96-луночные клеточные культуральные планшеты (Sarstedt, Nümbrecht, Germany). Клетки обрабатывали 10 нг/мл PMA (форбол 12-миристат 13-ацетата; Sigma-Aldrich, St. Louis, MO, USA) в течение 48 часов для того, чтобы дифференцировать моноциты в макрофагоподобные клетки. Затем клетки стимулировали добавлением 0,1 нг/мл липополисахарида (LPS; E. coli серотип O55:B5; Sigma-Aldrich, St. Louis, MO, USA) в среду, описанную выше за исключением того, что она содержала 5% термоинактивированной FBS. Через 30 минут после добавления LPS пептиды (40 мкМ) добавляли в трипликатах. После 6 часов инкубации при +37°C, 5% CO2 и во влажной атмосфере, клеточные супернатанты собирали, центрифугировали и держали в замороженном виде при -20°C до анализа содержания TNF-α с помощью ELISA (R&D Systems, Minneapolis, MN, USA). Результаты представлены как среднее относительной секреции (%), со стимулируемым уровнем TNF-α без добавленного пептида, принятым за 100%, и базальной секрецией, принятой за 0% (Таблица 2).

Противомикробную активность измеряли как бактерицидный эффект на S. aureus с использованием минимальной бактерицидной концентрации, MMC99.
S. aureus (#1800; CCUG, Gothenburg, Sweden), культивируемые на планшетах с кровяным агаром [Columbia agar (Oxoid, Basingstoke, UK), дополненным 5% дефибринированной лошадиной крови (National Veterinary Institute (SVA), Uppsala, Sweden)], переносили в бульон с сердечно-мозговым экстрактом (3.7% BHI; Difco, BD Diagnostics, Franklin Lakes, NJ, USA) и инкубировали во встряхивателе при 250 об/мин +37°C в течение ночи. Культуру затем разбавляли 1:10 в свежем BHI бульоне и инкубировали в течение дополнительных двух часов для достижения фазы логарифмического роста. Бактерии осаждали и суспендировали в 1% BHI среды (BHI бульон, разбавленный в 100 раз в воде с высоким уровнем очистки) до концентрации 107 бактерий/мл, как установлено по измерению оптической плотности при 600 нм.
Пептиды последовательно двукратно разбавляли от 160 мкМ до 1,25 мкМ в 1% BHI среде. Пептиды (100 мкл) затем инкубировали с бактериями (5 мкл 107 бакт./мл) в течение 2 часов при +37°C. Капли (5 мкл) суспензии помещали на планшеты с кровяным агаром. Планшеты с кровяным агаром инкубировали в течение ночи при +37°C. Записывали значения MMC99, т.е. наименьшую пептидную концентрацию, необходимую для достижения 99% снижения жизнеспособных бактерий (Таблица 3). Концентрацию бактериальной суспензии, используемой в анализе, подтверждали количеством жизнеспособных организмов на планшетах с кровяным агаром.
Пример 2. Пептидный скрининг 2
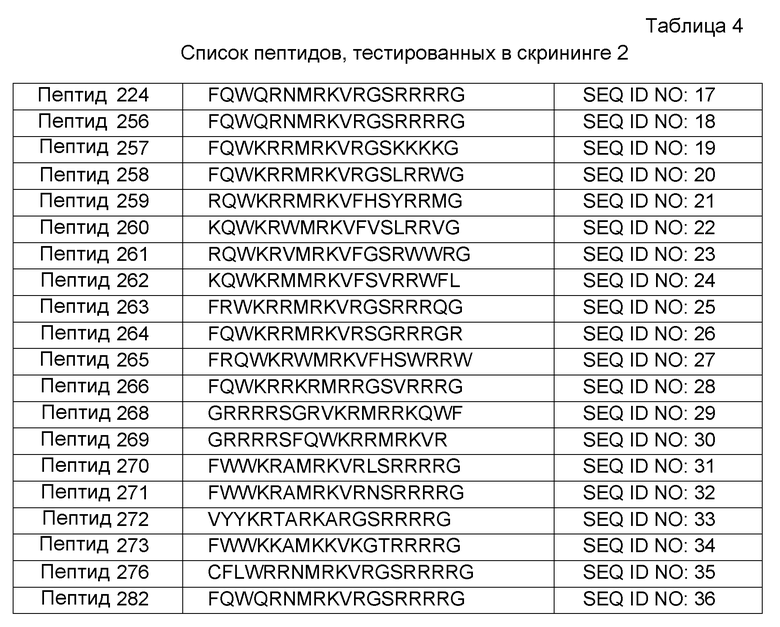
TNF-α активности для пептидов из этого раунда скринирования многомерных корреляций подвергались множественному анализу с использованием программного обеспечения ProPHECY™ (Saromics, Lund, Sweden). Большое количество идентификаторов рассчитывали для каждого пептида. Затем TNF-α активности соотносили с этими идентификаторами. Создавали отдельные регрессионные модели для пептидного класса. Кроме того, также создавали общие модели, которые рассматривали пептидный класс. В результате анализа регрессионной модели предположили несколько вариабельных областей, которые способствовали улучшенной TNF-α активности. Новые пептиды во втором этапе скринирования предполагали для пептидного класса, первоначально на основании модуляции заряда, амфипатичности и гидрофобности. На основании новых конструкций около 80 пептидов упорядочили как PEPscreen library (Sigma) и тестировали как на противовоспалительную, так и на противомикробную активность.
Противовоспалительную активность измеряли как ингибирование выработки TNF-α в LPS-стимулируемых THP-1 клетках.
Клеточная линия THP-1 (TIB-202; ATCC, Manassas, VA, USA), соответствующая человеческим моноцитам, поддерживалась в RPMI 1640 (PAA Laboratories GmbH, Pasching, Austria), дополненной 10% фетальной бычей сывороткой (FBS; PAA Laboratories GmbH, Pasching, Austria), 1 мМ пирувата натрия (Sigma-Aldrich, St. Louis, MO, USA) и 20 мМ HEPES (PAA, Laboratories GmbH, Pasching, Austria).
Клеточную плотность доводили до 106 клеток/мл и добавляли 100 мкл суспензии в расчете на лунку к 96-луночным клеточным культуральным планшетам (Sarstedt, Nümbrecht, Germany). Клетки обрабатывали 10 нг/мл PMA (форбол 12-миристат 13-ацетата; Sigma-Aldrich, St. Louis, MO, USA) в течение 48 часов для того, чтобы дифференцировать моноциты в макрофагоподобные клетки. Затем клетки стимулировали добавлением 0,1 нг/мл липополисахарида (LPS; E. coli серотип 055:B5; Sigma-Aldrich, St. Louis, MO, USA) в среду, описанную выше, за исключением того, что она содержала 5% термоинактивированной FBS. Через 30 минут после добавления LPS пептиды (40 мкМ, 10 мкМ и 4 мкМ) добавляли в трипликатах. После 6 часов инкубации клеточные супернатанты собирали, центрифугировали и хранили в замороженном виде при -20°C до анализа содержания TNF-α с помощью ELISA (R&D Systems, Minneapolis, MN, USA). Результаты представлены как средняя относительная секреция (%), со стимулируемым TNF-α уровнем без добавленного пептида, принятым за 100%, и базальной секрецией, принятой за 0% (Таблица 5).
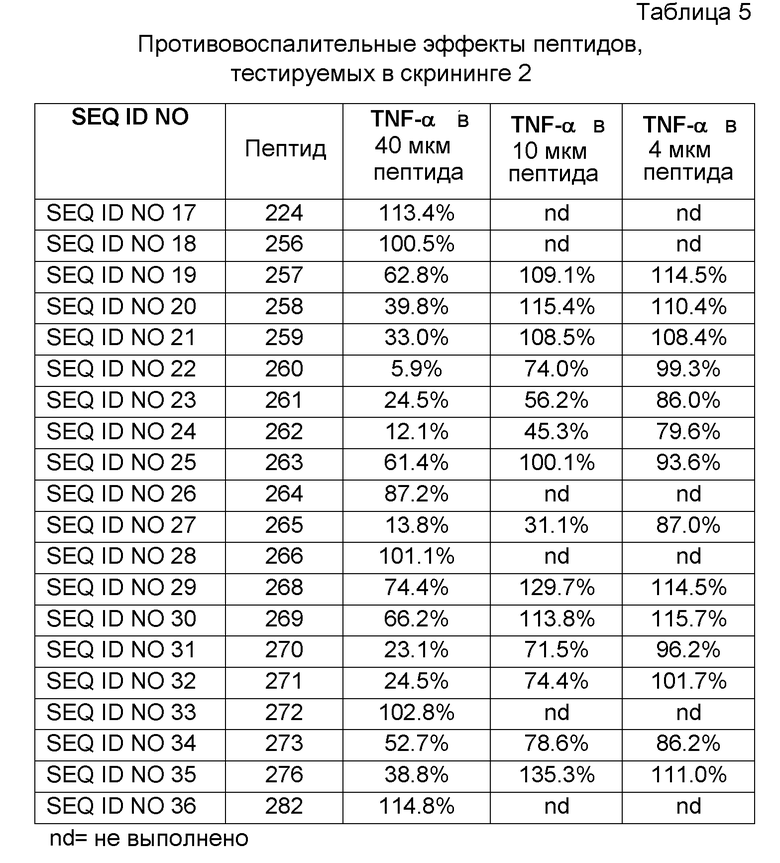
Противомикробную активность измеряли как бактерицидный эффект на S. aureus с использованием минимальной бактерицидной концентрации, MMC99.
S. aureus (#1800; CCUG, Gothenburg, Sweden), культивированные на планшетах с кровяным агаром [Columbia agar (Oxoid, Basingstoke, UK), дополненных 5% дефибринированной лошадиной кровью (National Veterinary Institute (SVA), Uppsala, Sweden)], переносили в бульон с сердечно-мозговым экстрактом (3.7% BHI; Difco, BD Diagnostics, Franklin Lakes, NJ, USA) и инкубировали во встряхивателе при 250 об/мин при +37°C в течение ночи. Культуру затем разбавляли 1:10 в свежем BHI бульоне и инкубировали в течение дополнительных двух часов до достижения фазы логарифмического роста. Бактерии осаждали и суспендировали в 1% BHI среды (BHI бульон, разбавленный в 100 раз в воде с высоким уровнем очистки) до конечной концентрации 107 бактерий/мл, как установлено измерением оптической плотности при 600 нм.
Пептиды последовательно разводили в два раза от 400 мкМ до 0,78 мкМ или в 1% BHI среды, или в 50% термоинактивированной стимулированной раневой жидкости [SWF, содержащей 1 часть 0,1% пептона (Oxoid, Basingstoke, UK) в физиологическом растворе и 1 часть фетальной бычей сыворотки, разбавленной в 2 раза в воде с высоким уровнем очистки].
Затем пептиды (100 мкл) инкубировали с бактериями (5 мкл 107 бакт./мл) в течение 2 часов при +37°C. Капли (5 мкл) суспензии помещали на планшеты с кровяным агаром. Планшеты с кровяным агаром инкубировали в течение ночи при +37°C. Регистрировали величины MMC99, т.е. наименьшую пептидную концентрацию, необходимую для достижения 99% снижения жизнеспособных бактерий (Таблица 6). Концентрацию бактериальной суспензии, используемой в анализе, подтверждали количеством жизнеспособных микроорганизмов на планшетах с кровяным агаром.
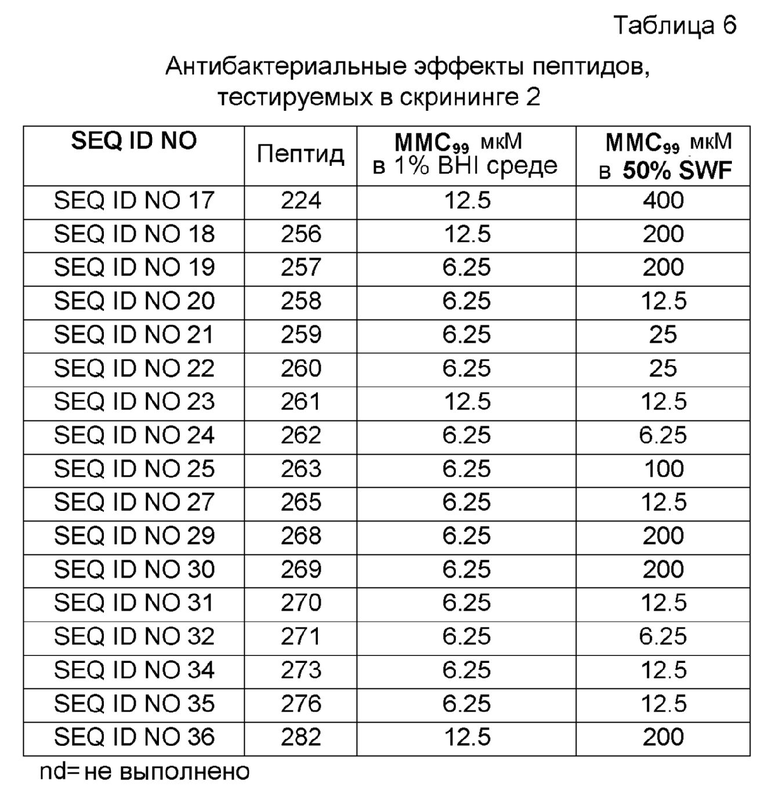
Пептиды
Матрицей для пептидов является аргинин-замещенный пептид. Пептиды, рассматриваемые ниже, имеют сходную длину, и диаграмма разброса на фигуре 3 показывает два кластера с пептидами с выраженными TNF-α активностями при 40 мкМ. Матричный пептид был почти неактивен при той же концентрации, но активен при более высоких концентрациях.

Таблица 7 демонстрирует большое количество мутаций в обоих кластерах A и B. Хорошо видно, что две группы пептидов как перекрываются, так и дополняют друг друга по отношению к позиционным мутациям. Активные пептиды из кластера A все имеют заряженные аминокислоты R или K в положении 1 и 4 и гидрофобную аминокислоту F в положении 11. Как гидрофобные аминокислоты V, M и W, так и заряженная аминокислота R могут быть в положении 6. Все положения 14, 16 и 17 имеют гидрофобные незаряженные аминокислоты F, M, V или W, которые отличаются от матрицы, в которой в тех же положениях имеется R. Кластер B показывает, что Q в положении 2 может быть замещен или гидрофобными остатками W, L или заряженной аминокислотой R.
Модификации, осуществленные в кластере A и кластере B, являются комплементарными по отношению друг к другу в некоторых из положений. Таким образом, положение -1 может иметь добавленную гидрофобную C, F или W или полярную S аминокислоту. Аминокислота в положении 12, которая представляет собой G для матричного пептида, может быть замещена рядом различных остатков, как полярных, так и гидрофобных, иллюстрируемых H, V, S, N, L. Ситуация является сходной в положении 13, где S матрицы может быть замещен на V, G и T. Активные пептиды могут иметь как гидрофобные, так и заряженные аминокислоты в положениях 14, 15, 16, 17 и 18. В положении 17 также можно обнаружить активные пептиды с G и Q.
В заключение, в принципе все из активных пептидов, принадлежащих кластеру A и B, проявляют высокие противомикробные эффекты даже в близких к физиологической соли концентрациях.
Пример 3. In vitro противомикробный эффект
Противомикробные эффекты пептида 265 (SEQ ID NO:27) анализировали посредством анализа MMC99 (минимальная бактерицидная концентрация) по отношению к S. aureus (CCUG 1800), MRSA (CCUG 41879), P. aeruginosa (ATCC 15442), E. coli (CCUG 31246), S. pyogenes (CCUG 4207), P. acnes (CCUG 1794T), S. epidermidis (ATCC12228), K. pneumoniae (ATCC 13883), A. baumannii (ATCC 19606) и C. albicans (ATCC 64549). Пептиды приобретали у Biopeptide Company (San Diego, CA, USA) и Bachem AG (Bubendorf, Switzerland) и результаты представлены в таблице 8A и 8B соответственно.
Пептид последовательно разбавляли в двух различных средах для анализа, 1% BHI среде (среда с сердечно-мозговой вытяжкой) или 50% термоинактивированной стимулированной раневой жидкости (SWF), и затем инкубировали с микроорганизмами в течение 2 часов. Капли суспензии помещали на планшеты с кровяным агаром. Регистрировали величины MMC99, т.е. наименьшую концентрацию пептида, требуемую для достижения 99% снижения жизнеспособных микроорганизмов. Как представлено в таблице 8, пептид обладает способностью убивать микроорганизмы, часто появляющиеся в инфекциях.
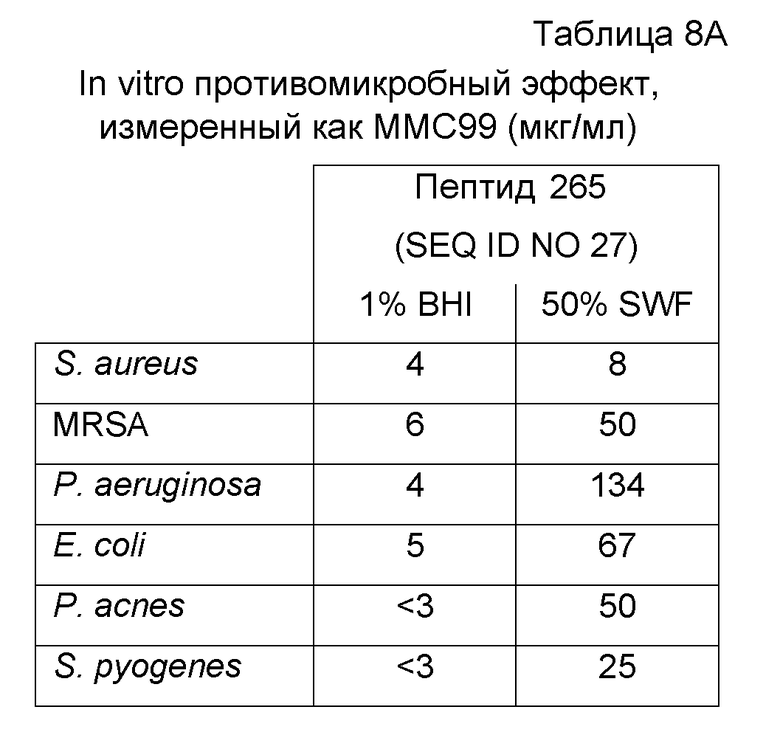
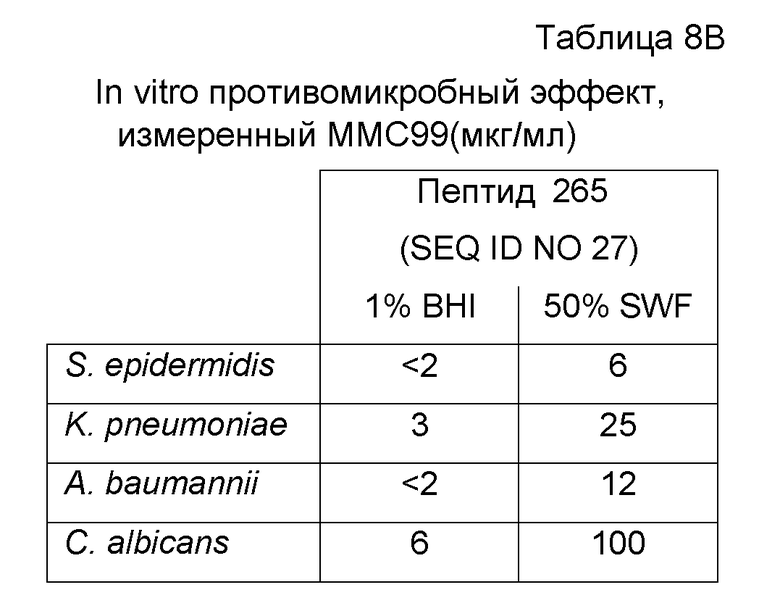
Пример 4. In vivo противомикробный эффект в модели эксцизионной раны у крыс
Противомикробные эффекты пептида 265 (SEQ ID NO:27) in vivo исследовали на модели эксцизионной раны у крысы. Раны инокулировали устойчивым к метициллину S. aureus (MRSA) в течение двух часов с последующим единичным введением пептида или контроля (H2O) за два часа перед окончанием и сбором бактерий. Пептид продемонстрировал выраженный противомикробный эффект (Фигура 4).
Пример 5. In vivo противомикробный эффект в инфицированных ранах свиньи
Противомикробные эффекты пептида 265 (SEQ ID NO:27) исследовали в ex vivo модели на свиной коже. Раны инокулировали S. aureus в присутствии PBS/сыворотка 50/50. Через два часа после инокуляции раны обрабатывали отдельным введением пептида или плацебо (H2O). Через четыре часа после обработки бактерии собирали и определяли количество жизнеспособных микроорганизмов на каждой ране. Результаты подтверждают обнаружения на крысах, указывая на то, что пептид является чрезвычайно эффективными противоинфекционным агентом при применении локально (Фигура 5).
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЕ СИНТЕТИЧЕСКИЕ ПЕПТИДЫ И ИХ ПРИМЕНЕНИЕ | 2012 |
|
RU2596393C2 |
| КОРОТКИЕ АНТИМИКРОБНЫЕ ЛИПОПЕПТИДЫ | 2013 |
|
RU2627648C2 |
| НОВЫЕ ПЕПТИДЫ ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ИММУНОПАТОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ, ВКЛЮЧАЯ ЛЕЧЕНИЕ И ПРОФИЛАКТИКУ ИНФЕКЦИИ ПОСРЕДСТВОМ МОДУЛИРОВАНИЯ ВРОЖДЕННОГО ИММУНИТЕТА | 2006 |
|
RU2507213C2 |
| ПЕПТИДЫ С АНТАГОНИСТИЧЕСКОЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ ПРИРОДНОГО CXCR4 | 2014 |
|
RU2671708C2 |
| МУТАНТНЫЕ ЛЕНТИВИРУСНЫЕ БЕЛКИ ENV И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2012 |
|
RU2654673C2 |
| КОРОТКИЕ БИОАКТИВНЫЕ ПЕПТИДЫ ДЛЯ УСКОРЕНИЯ ЗАЖИВЛЕНИЯ РАН | 2014 |
|
RU2606753C1 |
| СКОНСТРУИРОВАННЫЕ АНТИ-TGF-БЕТА АНТИТЕЛА И АНТИГЕН-СВЯЗЫВАЮЩИЕ ФРАГМЕНТЫ | 2014 |
|
RU2681502C2 |
| МОДУЛЯЦИЯ АКТИВНОСТИ КОМПЛЕМЕНТА | 2015 |
|
RU2670988C2 |
| ИДЕНТИФИКАЦИЯ ЛИЗИНОВ И ИХ ПРОИЗВОДНЫХ, ОБЛАДАЮЩИХ АНТИБАКТЕРИАЛЬНОЙ АКТИВНОСТЬЮ ПРОТИВ PSEUDOMONAS AERUGINOSA | 2018 |
|
RU2807688C2 |
| ЛЕЧЕНИЕ ВОСПАЛИТЕЛЬНЫХ, АУТОИММУННЫХ И НЕЙРОДЕГЕНЕРАТИВНЫХ НАРУШЕНИЙ ИММУННОДЕПРЕССИВНЫМИ ПОЛИПЕТИДАМИ, ЯВЛЯЮЩИМИСЯ ПРОИЗВОДНЫМИ ТАТ | 2013 |
|
RU2653754C2 |














Изобретение относится к новым пептидам, сконструированным на основании аминокислотной последовательности, соответствующей последовательности зрелого человеческого лактоферрина с 13 по 30 аминокислотный остаток, обладающим улучшенной противомикробной и/или противовоспалительной активностью, и их применению, в частности для лечения и/или предотвращения инфекций, воспалений, ран или рубцов. 6 н. и 3 з.п. ф-лы, 5 ил., 8 табл., 5 пр.
1. Пептид, выбранный из любого из пептидов
R-Q-W-K-R-R-M-R-K-V-F-H-S-Y-R-R-M-G (SEQ ID NO: 21)
K-Q-W-K-R-W-M-R-K-V-F-V-S-L-R-R-V-G (SEQ ID NO: 22)
R-Q-W-K-R-V-M-R-K-V-F-G-S-R-W-W-R-G (SEQ ID NO: 23)
K-Q-W-K-R-M-M-R-K-V-F-S-V-R-R-W-F-L (SEQ ID NO: 24)
F-R-Q-W-K-R-W-M-R-K-V-F-H-S-W-R-R-W (SEQ ID NO: 27)
F-Q-W-K-R-R-M-R-K-V-R-G-S-R-R-R-R-G (SEQ ID NO: 6)
W-F-Q-W-K-R-A-M-R-K-V-R-G-S-R-R-R-R-G (SEQ ID NO: 7)
F-W-W-K-R-A-M-R-K-V-R-G-S-R-R-R-R-G (SEQ ID NO: 8)
F-Q-W-K-R-R-M-R-K-V-R-G-S-K-K-K-K-G (SEQ ID NO: 19)
F-Q-W-K-R-R-M-R-K-V-R-G-S-L-R-R-W-G (SEQ ID NO: 20)
F-R-W-K-R-R-M-R-K-V-R-G-S-R-R-R-Q-G (SEQ ID NO: 25)
F-W-W-K-R-A-M-R-K-V-R-L-S-R-R-R-R-G (SEQ ID NO: 31)
F-W-W-K-R-A-M-R-K-V-R-N-S-R-R-R-R-G (SEQ ID NO: 32) и
F-W-W-K-K-A-M-K-K-V-K-G-T-R-R-R-R-G (SEQ ID NO: 34);
или
пептида, как указано выше, где свободная СООН на карбоксильном конце преобразована в CONH2;
или
пептида, как указано выше, где свободная NH2 группа на амино-конце преобразована в CH3CONH.
2. Пептид по п. 1, где пептид представляет собой F-R-Q-W-K-R-W-M-R-K-V-F-H-S-W-R-R-W (SEQ ID NO: 27).
3. Пептид по п. 1, где свободная СООН на карбоксильном конце преобразована в CONH2.
4. Пептид по п. 1, где свободная NH2 группа на амино-конце преобразована в CH3CONH.
5. Применение пептида по любому из пп. 1-4 в лечении и/или предотвращении инфекций, воспалений, ран или рубцов.
6. Применение пептида по любому из пп. 1-4 в лечении, профилактике и/или предотвращении импетиго, ожоговых ран, инфицированных царапин, инфицированных разрывов, экскориаций, рожистых воспалений, целлюлита, абсцессов, фурункулов, карбункулов, зашитых ран, инфекций послеоперационной раны, вторично-инфицированных дерматозов: атопического дерматита, псориаза и аллергического контактного дерматита, укусов животного или связанной с катетером инфекции.
7. Применение пептида по любому из пп. 1-4 для получения лекарственного средства для лечения и/или предотвращения инфекций, воспалений, ран или рубцов.
8. Способ лечения инфекций, воспалений, ран или рубцов, где способ включает введение эффективного количества пептида по любому из пп. 1-4 субъекту, нуждающемуся в таком лечении.
9. Фармацевтическая композиция для лечения и/или профилактики инфекций, воспалений, ран или рубцов, содержащая эффективное количество пептида по любому из пп. 1-4.
| АНТИБАКТЕРИАЛЬНЫЕ ПЕПТИДЫ | 2007 |
|
RU2468033C2 |
| ПРЕОБРАЗОВАТЕЛЬ НАПРЯЖЕНИЯ В ИНТЕРВАЛ ВРЕМЕНИ | 1990 |
|
RU2060586C1 |
| WO 2010081800 A2, 22.07.2010 | |||
| ODELL E W; ET AL "ANTIBACTERIAL ACTIVITY OF PEPTIDES HOMOLOGOUS TO A LOOP REGION IN HUMAN LACTOFERRIN", FEBS LETTERS, 1996, Vol:382, Page(s):175 - 178. | |||
Авторы
Даты
2016-08-10—Публикация
2012-01-25—Подача