Область изобретения
Изобретение относится к ПЭГ-илированным (покрытым полиэтиленгликолем) наночастицам на основе биологически разлагаемого полимера и полиэтиленгликоля, к способу их изготовления, препаративным формам, содержащим их, и к их применению в качестве систем для введения лекарственных средств.
Описание предшествующего уровня техники
В последние годы были предложены биологически разлагаемые наночастицы в качестве новых систем для введения лекарственных средств. Один из самых важных признаков, который они обеспечивают, представляет собой контролируемое высвобождение включенного лекарственного средства. Это ведет к большей терапевтической эффективности, обеспечивает более удобное для пациента введение и позволяет предотвратить передозировку. Кроме того, могут быть включены лекарственные средства с различными физико-химическими признаками, позволяя улучшить их устойчивость в биологических жидкостях. Это обстоятельство очень важно в случае антигенов, белков и макромолекул в целом. Кроме того, наночастицы ввиду их маленького размера подходят для введения лекарственных средств различными путями, например орально, парентерально и в виде глазных лекарственных форм (Kreuter, Adv. Drug Del. Rev., 7 (1991) 71-86; Gref et al., Science, 263 (1994) 1600-1603; Zimmer and Kreuter, Adv. Drug Del. Rev., 16 (1995) 61-73).
Оральное введение представляет собой самый удобный и популярный путь введения лекарственных средств. Однако биологическая доступность определенной активной молекулы зависит от (i) характеристик молекулы лекарственного средства и от фармацевтической формы и (ii) от физиологических условий, имеющихся в желудочно-кишечном тракте, таких как присутствие протеолитических ферментов, перистальтические движения и пресистемный метаболизм. Были предложены коллоидные системы, такие как наночастицы, для преодоления некоторых из этих препятствий. Эти носители по существу имеют большую удельную площадь поверхности, посредством чего облегчается их взаимодействие с биологической подложкой (слизистой оболочкой желудочно-кишечного тракта). Регулирование высвобождения лекарственного средства также позволяет продлить время эффекта молекул с низким биологическим периодом полувыведения. С другой стороны, наночастицы могут захватываться клетками пейеровых бляшек и фолликулами лимфоидной ткани (Hodges et al., J. Drug Target., 3 (1995) 57-60; Florence, Pharm. Res., 14 (1997) 259-266). Этот феномен позволяет направить лекарственное средство в лимфатические пути и в случае вакцин содействовать представлению их антигена. Однако обычные наночастицы имеют несколько значительных недостатков в отношении их применения путем орального введения: (i) определенная неустойчивость в жидкостях желудочно-кишечного тракта, (ii) низкая степень кишечного всасывания и (iii) неспецифический тропизм или адгезия в слизистой оболочке желудочно-кишечного тракта.
Парентеральное введение наночастиц обеспечивает регулируемое системное высвобождение, которое подходит для лекарственных средств с (i) низкой оральной биологической доступностью, (ii) коротким биологическим периодом полувыведения из плазмы и (iii) ограниченной устойчивостью. Другим существенным преимуществом парентерально введенных наночастиц является возможность концентрации лекарственного средства в определенном органе. Однако наночастицы быстро распознаются, захватываются и выводятся из циркуляции крови макрофагами мононуклеарной фагоцитарной системы (MPS) после их внутривенного введения. Этот феномен ограничивает их функцию в регулируемом высвобождении, а также возможность концентрации лекарственного средства в тканях, отличных от MPS.
Введение систем контролируемого высвобождения в виде глазных лекарственных форм имеет значительные преимущества для лечения глазных заболеваний, хотя можно также получить системный эффект. Однако введение в виде глазных лекарственных форм связано с быстрым выведением препаративной формы из прероговичной области ввиду дренирования в носослезный проток и разбавления слезной жидкости. Эти процессы приводят к тому, что очень низкая процентная доля введенного лекарственного средства (менее чем 5%) может проникнуть через роговицу и достичь внутриглазных тканей. Это дренирование ответственно за возникновение системных эффектов после введения препаративной формы этим путем. Ряд исследований продемонстрировал, что применение наночастиц позволяет увеличить количество лекарственных средств в конъюнктиве и увеличить их биологическую доступность по сравнению с обычными офтальмологическими формами, такими как растворы и мази (Gurny et al., J. Controlled Rel., 6 (1987) 367-373; Deshpande et al., Crit. Rev. Ther. Drug Carrier Syst., 15 (1998) 381-420). Коллоидные системы можно вводить в виде простых капель, избегая проблем, связанных со зрением, ввиду их низкой вязкости. Частоту применения можно снизить ввиду пролонгированного высвобождения лекарственного средства из матрицы наночастиц. Однако наночастицы также проявляют быстрое выведение из участка всасывания.
Поэтому, даже хотя наночастицы потенциально можно использовать для различных ранее указанных способов введения, еще существуют проблемы, которые затрудняют их применение. Модификация характеристик полимерной матрицы, а также их поверхности может обеспечить решение некоторых из описанных выше проблем.
С этой точки зрения, ассоциация или покрытие наночастиц подходящими полимерами может модифицировать их физико-химические характеристики, и это может косвенно модифицировать их распределение и взаимодействие с биологической средой. Возможная стратегия представляет собой связывание полиэтиленгликоля (ПЭГ) с наночастицами, известное как пэгиляция или получение скрытых наночастиц.
В отношении применения оральным введением ассоциация полиэтиленгликолей с обычными наночастицами позволяет защитить их против ферментной атаки в жидкостях пищеварительного тракта. Это связано с возможностью отторжения белков пропиленгликолями (Gref et al., Science, 263 (1994) 1600-1603). Эта стратегия также позволила бы минимизировать их взаимодействие с муцином и другими белками, присутствующими в просвете. Аналогичная стратегия применялась при разработке наночастиц для глазного применения. Fresta et al. наблюдали значительное увеличение глазного всасывания ацикловира после его введения в наносферах поли(алкилцианоакрилата), покрытых полиэтиленгликолем (Fresta et al., J. Pharm. Sci., 90 (2001) 288-297). Этот феномен объясняется большим взаимодействием покрытых наночастиц с роговичным эпителием.
Различные наночастицы, покрытые полиэтиленгликолем, после внутривенного введения демонстрировали длительное присутствие в циркуляции (Gref et al., Science, 263 (1994) 1600-1603; Stolnik et al., Pharm. Res., 11 (1994) 1800-1808; Bazile et al., J. Pharm. Sci., 84 (1995) 493-498). Наночастицы поли(молочной) кислоты (PLA), покрытые полиэтиленгликолем, имеют гораздо более длительный период полувыведения из плазмы (t1/2=6 ч), чем когда они покрыты альбумином или полоксамером (t1/2=2-3 мин) (Verrecchia et al., J. Controlled Rel., 36 (1995) 49-61). Присутствие гидрофильных полиэтиленгликолевых цепей на поверхности наночастиц значительно снижает их взаимодействие с белками крови (известными как опсонины). Эти белки содействуют фагоцитозу, формируя «мостик» между частицами и фагоцитами (Frank & Fries, Immunol. Today, 12 (1991) 322-326). Однако гидрофильные свойства полиэтиленгликолей являются не единственным важным фактором, обеспечивающим эффективное сопротивление опсонизации. Другие гидрофильные полимеры, такие как поливиниловый спирт, продемонстрировали низкую защитную способность против опсонизации наночастиц (Leroux et al., Life Sci., 57 (1995) 695-703). Поэтому стерическая стабилизация, обеспечиваемая ПЭГ-илированием, была бы также вызвана другими физико-химическими свойствами, такими как высокая гибкость цепей ПЭГ и специфическая структурная формация (Mosquiera et al., Biomaterials, 22 (2001) 2967-2979).
Основным недостатком, связанным с этой новой стратегией, является устойчивость ассоциации полиэтиленгликолей с поверхностью наночастиц (Peracchia et al., Life Sci., 61 (1997) 749-761). Известно, что способность полиэтиленгликоля отторгать белки зависит от конфигурации, заряда, длины и гибкости цепей (Torchillin, J. Microencaps., 15 (1998) 1-19). Способ модификации поверхности наночастиц главным образом осуществляется физической адсорбцией (Stolnik et al., Adv. Drug Del. Rev., 16 (1995) 195-214) или ковалентным связыванием (De Jaeghere et al., J. Drug Target., 8 (2000) 143-153). Однако недостатком простой адсорбции является быстрая потеря покрытия вследствие неустойчивости взаимодействия. Учитывая то, что ковалентное связывание предпочтительно, большинство ПЭГ-илированных наночастиц были получены с использованием сополимеров полиэтиленгликоля с молочной или гликолевой кислотой. Однако процесс сополимеризации требует использования нескольких катализаторов и определенных химических условий (Beletsi et al., Int. J. Pharm., 182 (1999) 187-197). Кроме того, могут быть проблематичными остатки токсичных органических растворителей, используемых при органическом синтезе (метиленхлорид, толуол и т.д.).
Поэтому еще необходимо получить наночастицы, которые устойчивы при оральном введении, которые сохраняют гидрофильное покрытие и которые имеют хорошие биоадгезивные характеристики и специфичность в желудочно-кишечном тракте. Для того чтобы быть эффективными, они должны быть нетоксичными, биологически разлагаемыми и легко получаемыми.
Краткое изложение сущности изобретения
Целью настоящего изобретения является предоставление наночастиц, которые устраняют указанные выше недостатки, т.е. обладают устойчивостью и специфичностью при оральном введении, имеют хорошие биоадгезивные характеристики для взаимодействия со слизистыми оболочками, способны нести широкий диапазон активных молекул, высвобождают активные молекулы регулируемым образом и предотвращают их выведение из системы крови, особенно когда они вводятся парентерально.
Наблюдалось, что наночастицы, сформированные биологически разлагаемым полимером и полиэтиленгликолем, разрешают эти проблемы. В частности, было обнаружено, что наночастицы, сформированные простым поливинилметиловым эфиром и сополимером малеинового ангидирида и полиэтиленгликоля, легко получить, и они обеспечивают превосходные характеристики биоадгезии, размера и зета потенциала, делая их подходящими для введения активных молекул. Кроме того, было обнаружено, что выбор типа полиэтиленгликоля, используемого для их получения, позволяет подходящим образом модулировать признаки этих наночастиц, которые можно преимущественно использовать в соответствии с типом препарата, который предстоит использовать, и/или способом введения фармацевтической препаративной формы.
Поэтому в первом аспекте изобретение относится к ПЭГ-илированным наночастицам для переноса биологически активных молекул, включающих биологически разлагаемый полимер и полиэтиленгликоль или его производные. В одном варианте биологически разлагаемый полимер представляет собой сополимер простого винилметилового эфира и малеинового ангидрида (PVM/MA).
Полиэтиленгликоль предпочтительно имеет молекулярную массу в диапазоне от 400 до 35000 Да. Полиалкиленгликоль обеспечивает хорошие результаты, когда он выбран из группы полиэтиленгликолей, полипропиленгликолей, блок- или статистических сополимеров, включая 2 типа блоков, их смеси или их производные. По меньшей мере, одна концевая гидроксильная группа полиэтиленгликоля необязательно замещена, предпочтительно, алкокси, акрилатной, метакрилатной, алкильной, амино, фосфатной, изотиоцианатной, сульфгидрильной, меркапто- или сульфатной группой.
В одном варианте изобретения отношение массы полиэтиленгликоля к биологически разлагаемому полимеру составляет 1:2-6, предпочтительно 1:2-4, предпочтительнее примерно 1:4.
ПЭГ-илированные наночастицы по изобретению могут включать активную молекулу, такую как белки, пептиды, ДНК, РНК, нуклеозиды, нуклеотиды, олигонуклеотиды или полинуклеотиды. С точки зрения ее активности, она может представлять собой, среди других, противоопухолевое средство или антиген для опухолей, или защитное средство центральной нервной системы или глюкокортикоид, или антиген для вакцинации или аллерген для иммунотерапии.
В другом аспекте изобретение относится к фармацевтической композиции, включающей ПЭГ-илированные наночастицы, как описано выше. В одном варианте препаративная форма предназначена для орального введения. В другом варианте она предназначена для парентерального введения или для введения через слизистую оболочку (например, глазную слизистую оболочку).
Поэтому ПЭГ-илированные наночастицы по изобретению можно использовать при изготовлении лекарственного средства. Оно может необязательно быть в лиофилизированной форме.
В другом аспекте изобретение относится к способу получения описанных ПЭГ-илированных наночастиц, включающему стадию одновременной инкубации полимера и полиэтиленгликоля в органическом растворителе перед десольватацией полимера водно-спиртовым раствором. В одном варианте концентрация биологически разлагаемого полимера составляет от 0,001 до 10% мас./об., а концентрация полиэтиленгликоля - от 0,001 до 5% мас./об. Отношение органической фазы к фазе водно-спиртового раствора составляет от 1/1 до 1/10.
Способ может, кроме того, включать дополнительные стадии для удаления органических растворителей и/или очистки, а также стадии стабилизации ПЭГ-илированных наночастиц посредством использования поперечно-сшивающих веществ. Биологически активная молекула может быть включена на стадии одновременной инкубации полимера и полиэтиленгликоля в органическом растворителе, или она может быть в последующем включена в водную суспензию уже сформированных наночастиц, с тем чтобы могла произойти их ассоциация.
Описание чертежей
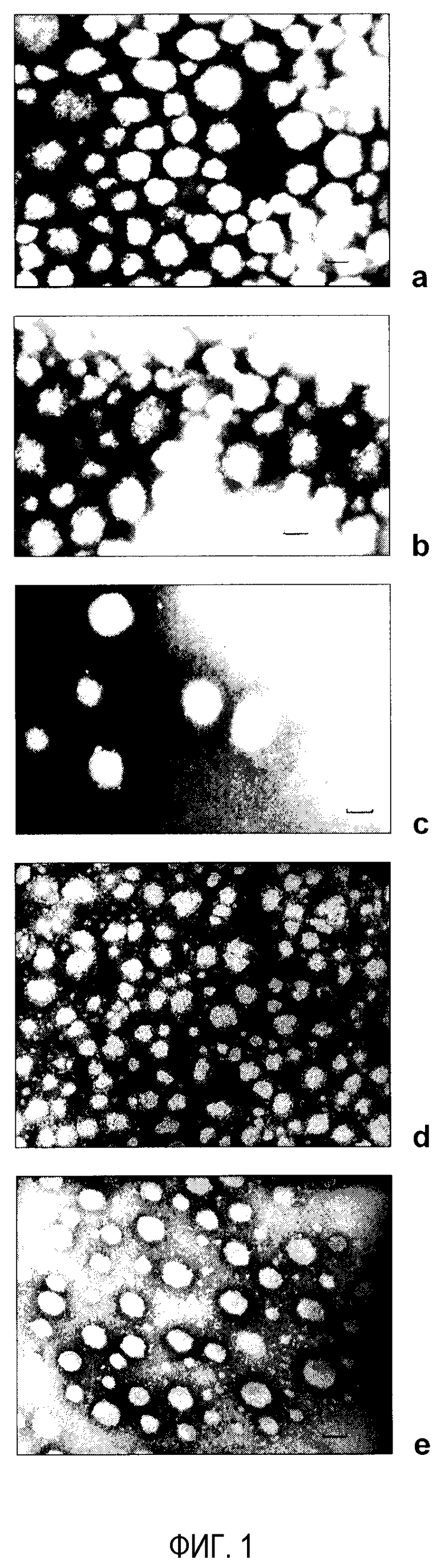
На фиг. 1 показаны фотографии трансмиссионной электронной микроскопии (ТЕМ) различных типов наночастиц (NP) - (а) NP; (b) PEG NP; (c) mPEG NP; (d) DAE-PEG NP; (e) DAP-PEG NP. Шкала представляет 150 нм.
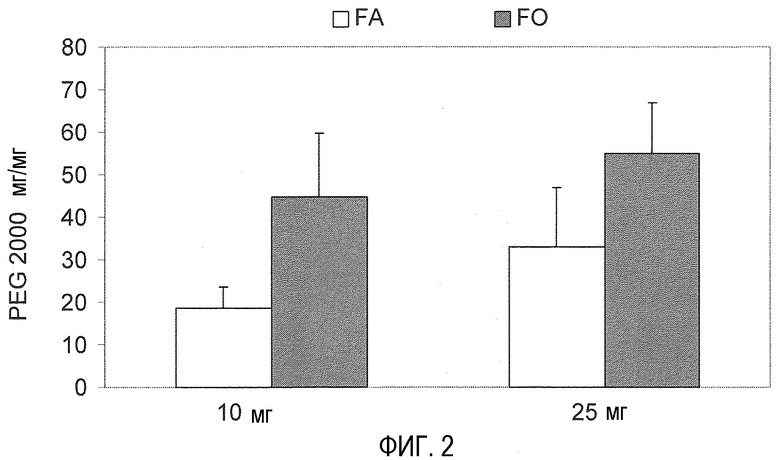
На фиг. 2 показана ассоциация PEG 2000 (мг/мг) в соответствии с используемым способом: одновременной инкубацией PEG и PVM/MA в органической фазе (ОР) или инкубацией наночастиц с водным раствором (АР) PEG.
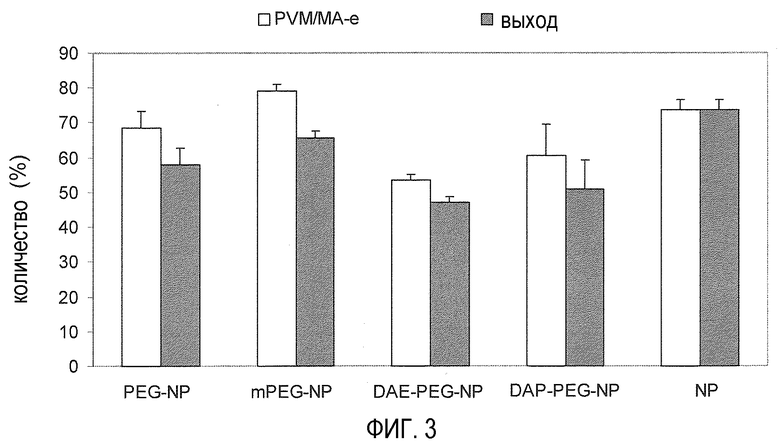
На фиг. 3 показано воздействие полиэтиленгликоля на процентную долю PVM/MA, превращенного в наночастицы (PVM/MA-e), и на производительность способа.
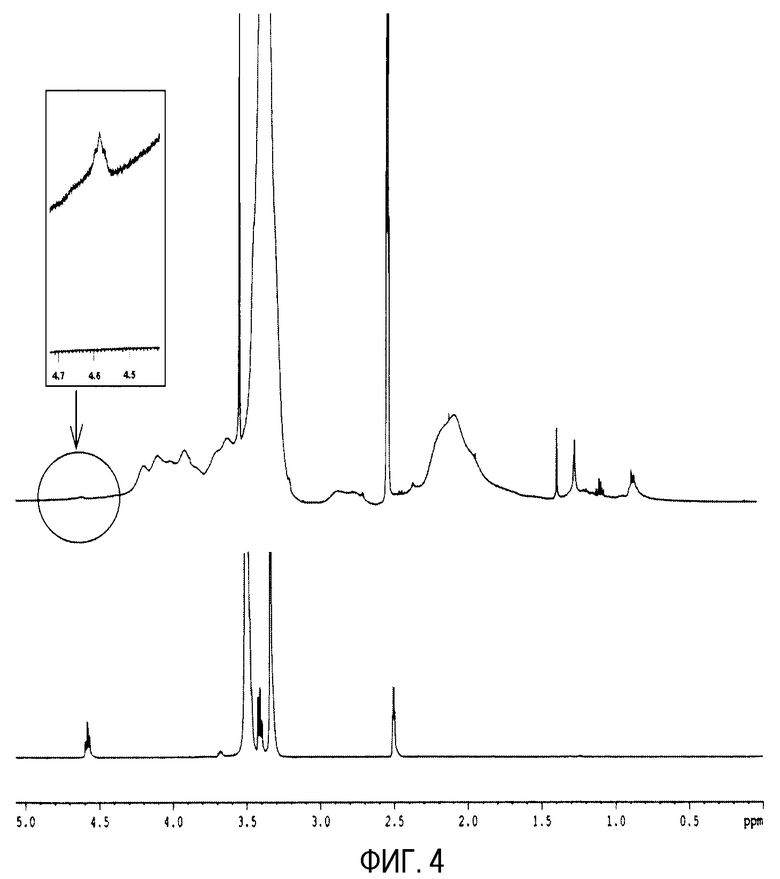
Фиг. 4 показывает спектры ядерного магнитного резонанса ПЭГ-илированных наночастиц с PEG 2000 (верхние) и свободного PEG 2000 (нижние). Увеличенное изображение пика при 4,58 м.д. (протоны гидроксильной группы) показано в прямоугольнике.
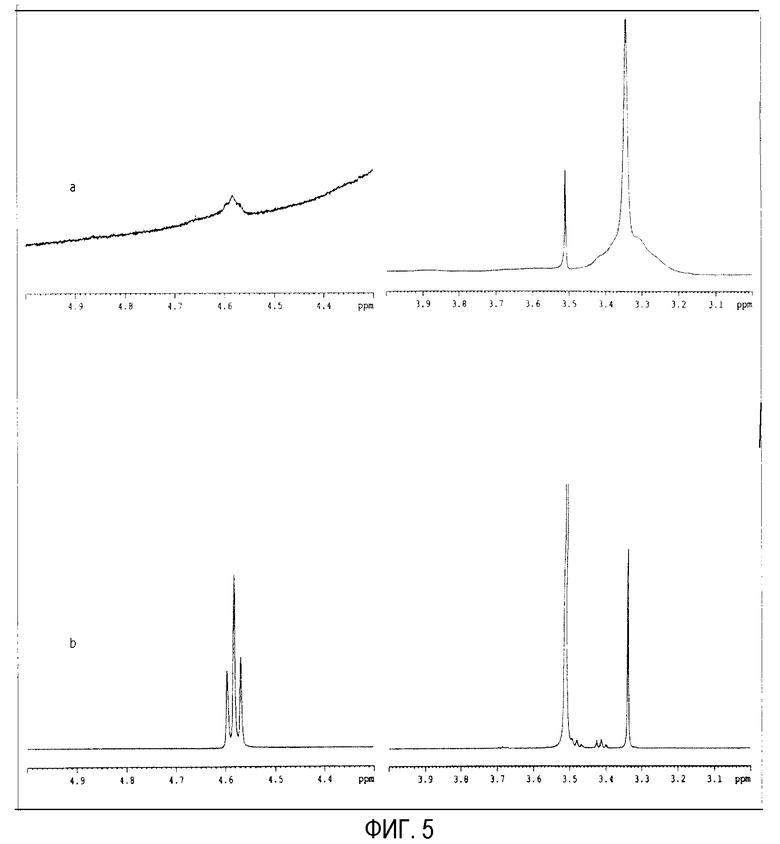
На фиг. 5 показаны детали спектров ядерного магнитного резонанса (а) ПЭГ-илированных наночастиц с PEG 2000 и (b) свободного PEG 2000, растворенных в DMSO (диметилсульфоксиде) (5 мг в 0,5 мл).
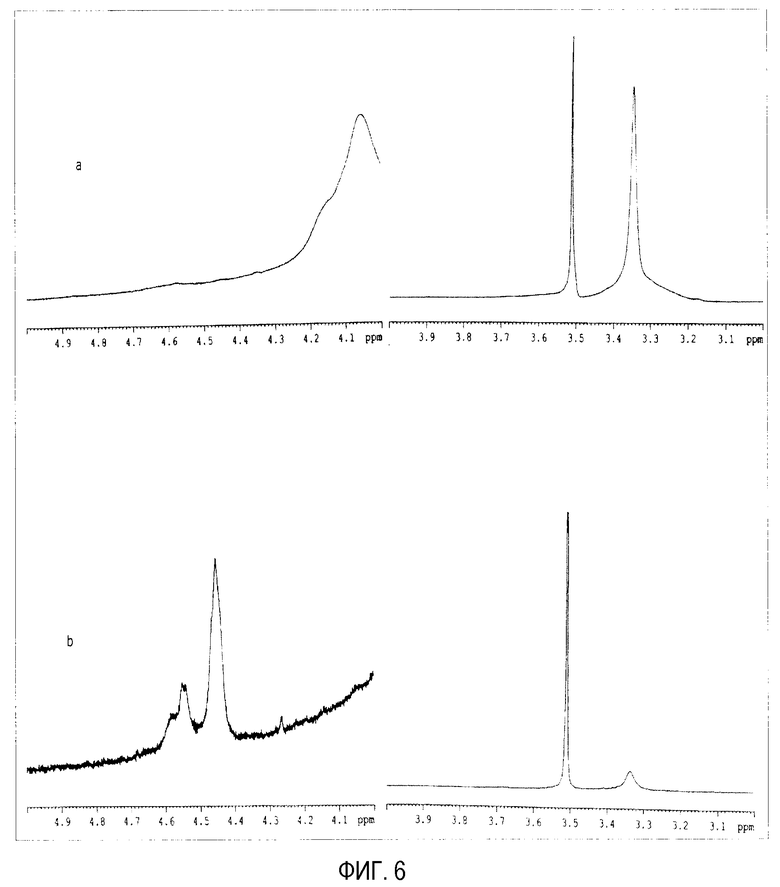
На фиг. 6 показаны детали спектров ядерного магнитного резонанса (а) ПЭГ-илированных наночастиц с DAP-PEG 2000 и (b) свободного DAP-PEG 2000, растворенных в DMSO (5 мг в 0,5 мл).
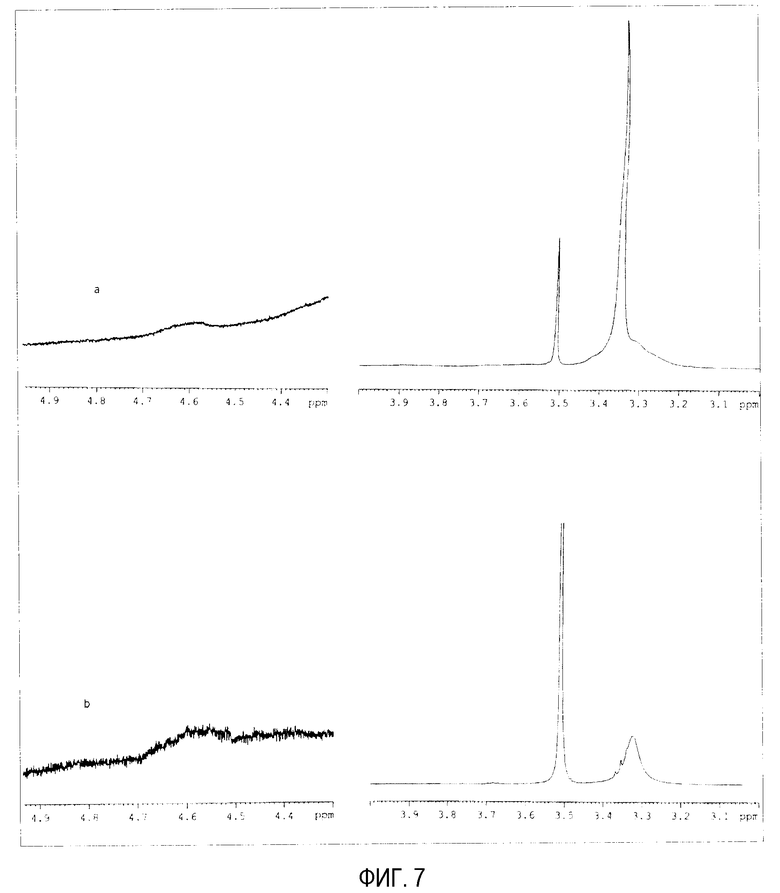
На фиг. 7 показаны детали спектров ядерного магнитного резонанса (а) ПЭГ-илированных наночастиц с DAE-PEG 2000 и (b) свободного DAE-PEG 2000, растворенных в DMSO (5 мг в 0,5 мл).
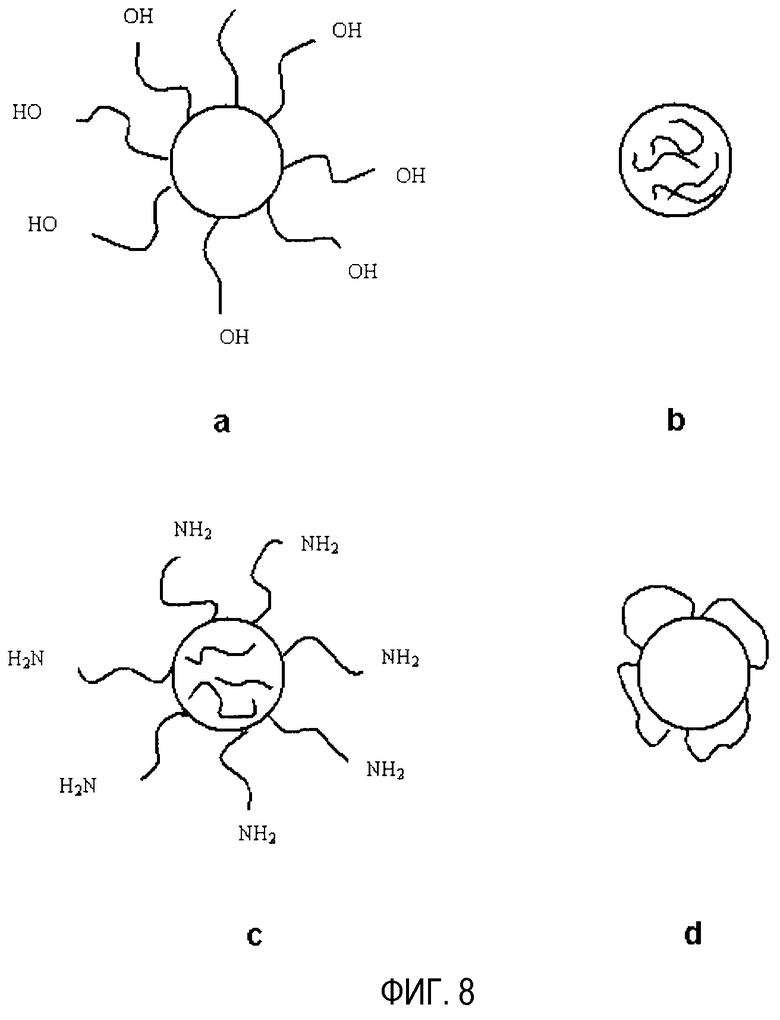
На фиг. 8 показаны структуры, предложенные для различных ПЭГ-илированных наночастиц, по данным ядерного магнитного резонанса и величинам зета потенциала - а) PEG-NP; b) mPEG-NP; c) DAE-PEG-NP; d) DAP-PEG-NP.
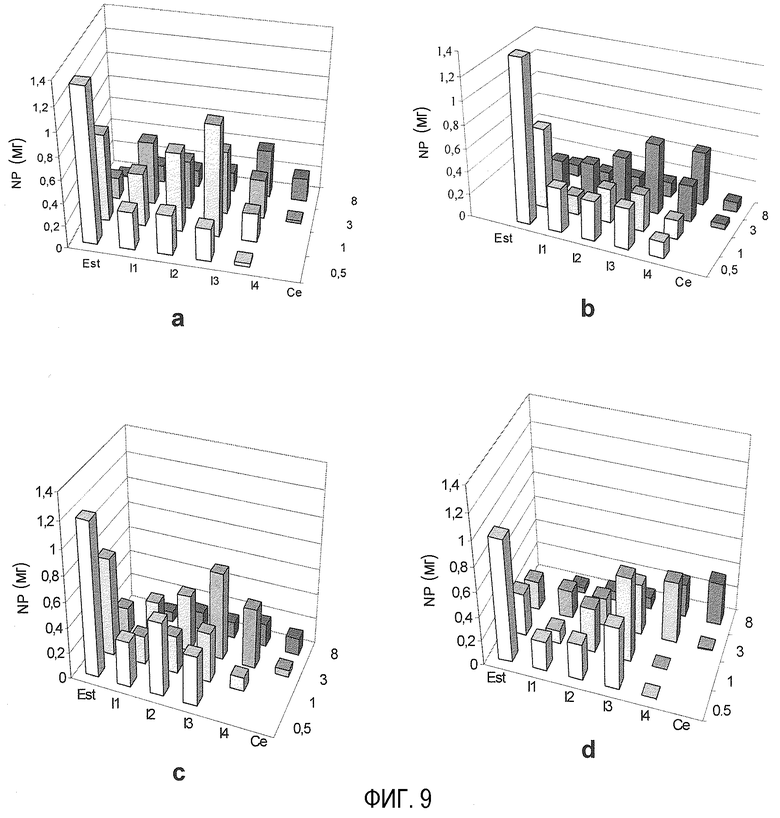
На фиг. 9 показано распределение ПЭГ-илированных наночастиц в желудочно-кишечном тракте после их орального введения у крыс: а) PEG-NP; b) mPEG-NP; c) DAE-PEG-NP; d) DAP-PEG-NP. Ось x представляет количество сцепленных наночастиц (NP) (мг); ось у показывает различные части тракта (St: желудок; I1, I2, I3, I4: части кишечника; Ce: слепая кишка; ось z представляет время после введения (ч).
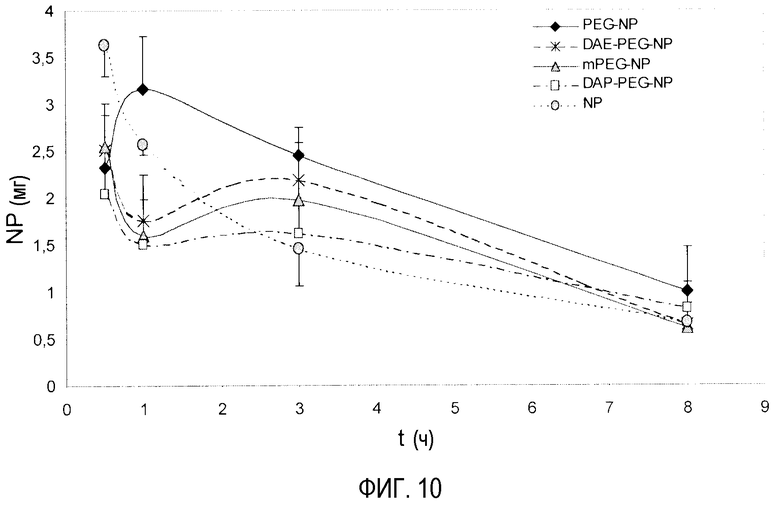
На фиг. 10 показаны кривые биоадгезии (NP, мг) различных ПЭГ-илированных наночастиц во всем желудочно-кишечном тракте после орального введения одной дозы 10 мг. T: время в ч.
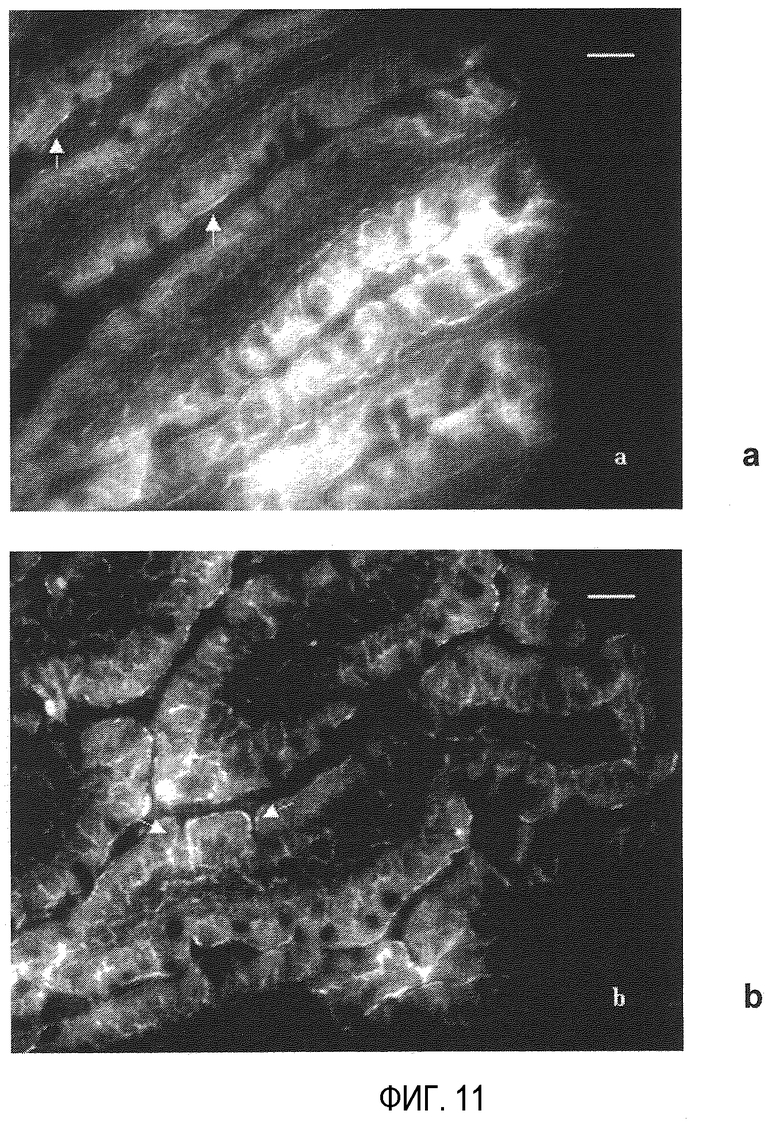
На фиг. 11 показаны полученные флуоресцентной микроскопией изображения части подвздошной кишки через 2 ч после орального введения 10 мг ПЭГ-илированных наночастиц с PEG 2000 (PEG-NP): а) ворсинки подвздошной кишки: стрелками показан верхушечный компартмент эпителия; b) эпителиальные клетки: клетками показана флуоресценция между энтероцитами. Шкала представляет 20 мкм.
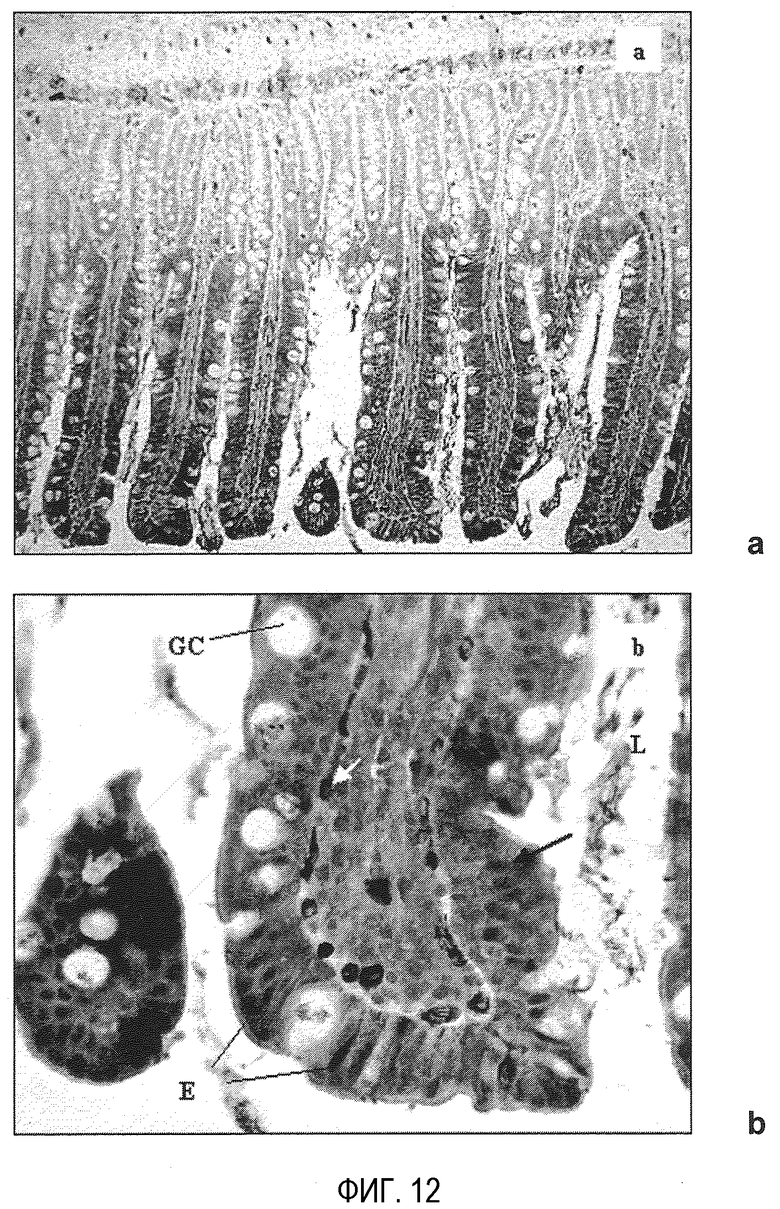
На фиг. 12 показаны микроскопические изображения сегмента подвздошной кишки через 2 ч после орального введения 10 мг ПЭГ-илированных наночастиц с PEG 2000 (PEG-NP): а) общий вид (увеличение в 135 раз) и b) увеличенная деталь (увеличение в 530 раз). L: просвет; Е: энтероциты; GC: клетки, генерирующие слизь; темные стрелки: ядра энтероцитов; белые стрелки: кровяные капилляры в подслизистой.
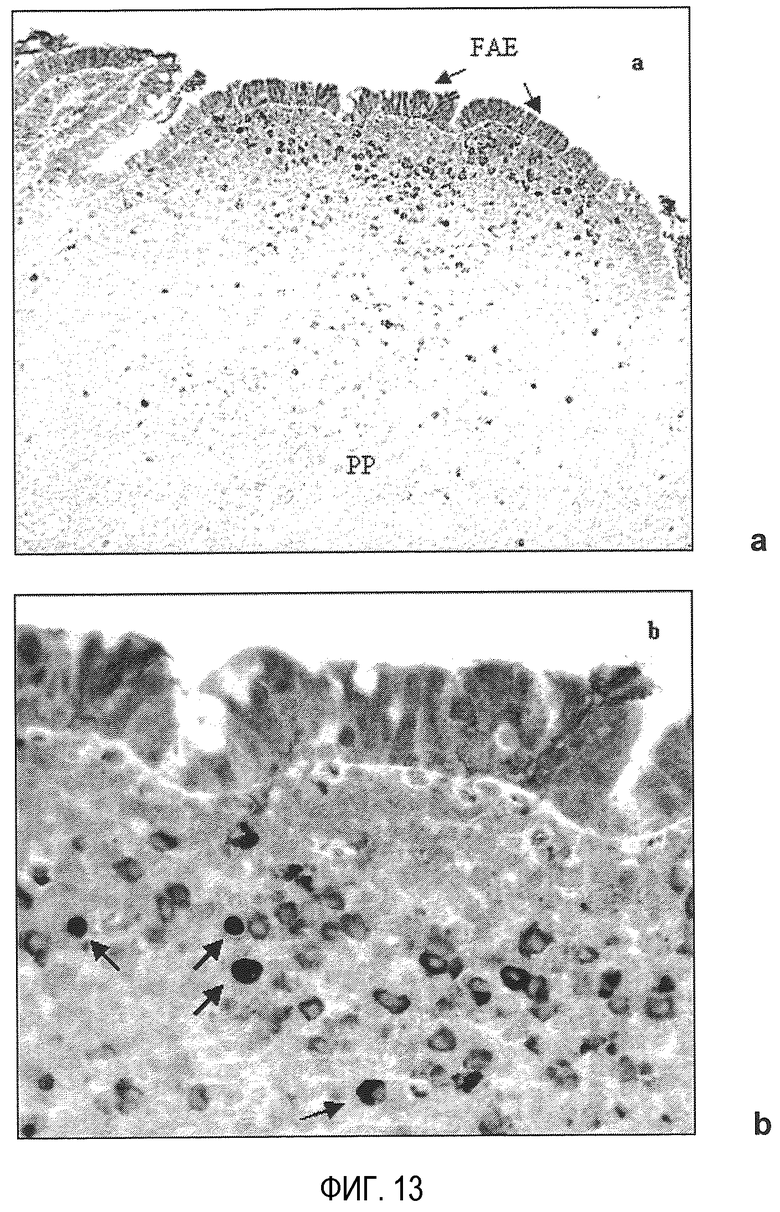
На фиг. 13 показано положение PEG-NP в пейеровых бляшках подвздошной кишки после орального введения 10 мг наночастиц: а) общий вид пейеровой бляшки (увеличение в 135 раз); b) увеличенная деталь (увеличение в 530 раз); РР - пейерова бляшка; FAE - связанный с фолликулом эпителий; темные стрелки: куполовидные клетки пейеровой бляшки, в которые должны быть включены наночастицы.
Подробное описание изобретения
К удивлению, было обнаружено, что модификация и покрытие наночастиц биологически разлагаемого полимера, такого как сополимер простого винилметилового эфира и малеинового ангидрида (PVM/MA) с различными полиэтиленгликолями, позволяет получить наночастицы с характеристиками физико-химических свойств, биоадгезии и специфичности при оральном введении, превращающими их в очень интересные системы в качестве особых носителей лекарственных средств. Признаки этих наночастиц можно преимущественно модифицировать в соответствии с типом используемого полиэтиленгликоля и способом получения. ПЭГ-илированные наночастицы по изобретению могут пролонгировать время нахождения в слизистых оболочках после их орального или глазного введения. Эти наночастицы представляют интерес для введения лекарственных средств с узкими окнами всасывания и, таким образом, улучшают их биологическую доступность. Эти наночастицы также представляют собой подходящие носители для лекарственных средств с повышенной токсичностью (например, цитотоксических препаратов), поскольку они позволяют увеличить время циркуляции системы в плазме, в течение которого препарат постепенно высвобождается регулируемым образом. С другой стороны, ПЭГ-илированные наночастицы могут предотвратить распознавание и выведение посредством клеток системы мононуклеарных фагоцитов (MPS), обеспечивая длительную циркуляцию лекарственных средств после их внутривенного введения.
Термин «наночастицы» используется для обозначения сфер или аналогичных форм с размером менее чем 1,0 мкм, предпочтительно, в диапазоне от 10 до 900 нм.
Как указано выше, в одном аспекте изобретение относится к ПЭГ-илированным наночастицам, образованным из биологически разлагаемого полимера. Можно использовать известные в данной области биологически разлагаемые полимеры, которые вызывают образование наночастиц. Эти полимеры включают, среди других, полигидроксикислоты, такие как полимолочная и полигликолевая кислота, и их сополимеры (например, PLGA), полиангидриды, сложные полиэфиры и полисахариды, например хитозан. Термин «биологически разлагаемые» в настоящем описании относится к полимерам, которые растворяются или разрушаются через период времени, который приемлем для желательного применения, в данном случае терапии in vivo, после их контакта с физиологическим раствором с рН 6-9 и при температуре в диапазоне от 25°С до 40°С.
В одном варианте изобретения сополимер простого винилметилового эфира и малеинового ангидрида в форме ангидирда (PVM/MA или Gantrez AN) используется в качестве биологически разлагаемого полимера. Он предпочтительно имеет молекулярную массу в диапазоне от 100 до 2400 кДа, предпочтительнее от 200 до 2000 кДа. В одном варианте изобретения предпочтителен сополимер PVM/MA с молекулярной массой от 180 до 250 кДа.
Этот сополимер предпочтителен, потому что он широко используется в фармацевтической технологии ввиду его низкой токсичности (LD 50=8-9 г/кг при оральном введении) и превосходной биологической совместимости. Его также легко получить с точки зрения количества и его стоимости. Этот полимер ввиду его ангидридных групп может взаимодействовать с различными гидрофильными веществами без необходимости применения обычных органических реагентов (глютаральдегид и производные карбодиимида), имеющих значительную токсичность (Arbos et al., J. Controlled Rel., 83 (2002) 321-330). Полимер нерастворим в водной среде, но ангидридная группа Gantrez AN гидролизуется, давая начало получению карбоксильных групп. Растворение происходит медленно и зависит от условий, в которых оно происходит. Ввиду биологической доступности функциональных групп в PVM/MA ковалентное связывание молекул с нуклеофильными группами, такими как гидроксилы (-ОН) или амины (NH2), происходит простой инкубацией в водной среде.
Не ПЭГ-илированные наночастицы этого сополимера и их получение описаны в WO 02/069938, принадлежащей тому же заявителю, и содержание этой заявки полностью включено сюда в качестве ссылки. Наночастицы сополимера простого винилметилового эфира и малеинового ангидрида легко получить десольватированием полимера посредством добавления к его органическому раствору первого полярного растворителя (смешиваемого с раствором полимера) и последующего добавления второй жидкости, не являющейся растворителем, в данном случае, водно-спиртового раствора. Необязательно можно добавить поперечно-сшивающее вещество. Получение ПЭГ-илированных наночастиц этого полимера описано ниже, и было обнаружено, что их можно очень легко получить.
В настоящем описании под термином «полиэтиленгликоль» подразумевается любой гидрофильный полимер, растворимый в воде, содержащей группы простого эфира, связанные 2 или 3 атомами углерода, необязательно, разветвленные алкиленовые группы. Поэтому это определение включает разветвленные или неразветвленные полиэтиленгликоли, полипропиленгликоли, а также блок- или статистические сополимеры, включающие эти 2 типа блоков. Этот термин также включает производные концевых гидроксильных групп, которые могут быть модифицированы (1 или оба конца) с тем, чтобы ввести алкокси-, акрилатную, метакрилатную, алкильную, амино-, фосфатную, изотиоционатную, сульфгидрильную, меркапто- и сульфатную группы. Полиэтиленгликоль или полипропиленгликоль может иметь заместители в алкиленовых группах. Если заместители присутствуют, то они предпочтительно представляют собой алкильные группы.
Полиэтиленгликоли представляют собой растворимые в воде полимеры, которые были утверждены для орального, парентерального и местного применения лекарственных средств (FDA, Администрация пищевых продуктов и лекарственных средств США). Полиэтиленгликоли получают посредством полимеризации этиленоксида (ЕО) или пропиленоксида (РО) в присутствии воды, моноэтиленгликоля или диэтиленгликоля как инициаторов взаимодействия в щелочной среде (1,2-Epoxide Polymers: Ethylene Oxide Polymers and Copolymers" in Encyclopedia of Polymer Science and Engineering; Mark, H.F. (Ed.), John Wiley and Sons Inc., 1986, pp. 225-273). Когда достигается желательная молекулярная масса (в целом регулируемая посредством измерений вязкости в ходе осуществления способа), реакция полимеризации заканчивается нейтрализацией катализатора кислотой (молочной кислотой, уксусной кислотой или им подобными). В результате получается линейный полимер, имеющий очень простую структуру:
HO-(CH2-CH2-O)n-H,
где (n) представляет собой количество мономеров или единиц ЕО. Единицы альтернативно содержат пропиленовые группы.
Хотя технически все эти продукты следует называть поли(оксиалкиленами), продукты со средними величинами молекулярного веса (или молекулярной массой) от 200 до 35000 известны как полиэтиленгликоли (ПЭГ, PEG). Этот термин «полиэтиленгликоль» обычно используется для указания на существенное влияние гидроксильных концевых групп на физико-химические свойства этих молекул. Термин PEG обычно используется в комбинации с цифровой величиной. В фармацевтической промышленности цифра указывает на среднюю молекулярную массу, тогда как в химической промышленности цифра, сопровождающая буквы PEG, относится к полимеризованным единицам ЕО, образующим молекулу (Hand book of Pharmaceutical Excipients, Rowev R.C., Sheskey P. J., 5 Weller P.J. (Eds.), 4th Edition, Pharmaceutical Press and American Pharmaceutical Association, London, UK, 2003). PEG включены в различные фармакопеи, хотя номенклатура отличается (International Harmonisation: Polyethylene glycol (PEG): Pharmeuropa 1999, 11, 612-614). В соответствии с руководством Handbook of Pharmaceutical Excipients (Fourth Edition), 2003 Edited by R.C. Rowe, P.J. Sheskey и P.J. Weller Published by the Pharmaceutical Press (London, UK) и American Pharmaceutical Association (Washington, USA) полиоксиэтиленгликоли также именуются полиэтиленгликолями, макроголами, макроголом или PEG. В Британской Фармакопее используются полиэтиленгликоли и макроголы, в Европейской Фармакопее полиэтиленгликоли и макрогол, тогда как в Фармакопее США (USP) используется полиэтиленгликоль(и).
PEG с молекулярной массой менее чем 400 представляют собой нелетучие жидкости при комнатной температуре. PEG 600 проявляет точку плавления в диапазоне от 17 до 22°С, тогда как PEG со средними молекулярными массами в диапазоне от 800 до 2000 представляют собой пастообразные материалы с низкими точками плавления. PEG с молекулярной массой, превышающей 3000, представляют собой твердое вещество, и PEG с молекулярной массой до 35000 имеется в продаже. С другой стороны, хотя точка плавления PEG увеличивается с увеличением молекулярной массы, точка кипения увеличивается до максимальной величины 60°С. Аналогичным образом, когда молекулярная масса увеличивается, уменьшается его растворимость в воде. В любом случае, для PEG 35000 количество, близкое к 50% мас./мас., может раствориться в воде.
С токсикологической точки зрения, PEG считаются скорее нетоксичными и не иммуногенными (Hermansky S.J et al., Food Chem. Toxic., 1995, 33, 139-140; Final Report on the Safety Assessment of PEGs: J.A. С.Т., 1993, 12, 429-457; Polyethylene glycol, 21 CFR 172.820, FDA). Допустимое суточное потребление, определенное ВОЗ, составляет 10 мг/кг массы (Polyethylene glycols; Twenty-third report of the Joint FАО/WHO Expert Committee on Food Additives; World Health Organisation, Geneva; Technical Report Series 1980, 648, 17-18).
Производные полиэтиленгликоля имеют преимущества, аналогичные традиционным PEG, такие как их растворимость в воде, отсутствие физиологической активности, низкая токсичность и устойчивость в очень разных условиях. Эти производные включают очень разные продукты и характеризуются функциональной группой, замещающей гидроксил, такой как -NH2 (среди самых реактивных групп), фенол, альдегид, изотиоцианат, -SH группы и т.д. Среди производных полиэтиленгликоля можно указать следующие соединения, которые можно использовать в изобретении:
- сложные эфиры полиоксиэтилена: сложный эфир моносукцинимидилсукцинат простого монометилового эфира PEG; простой монокарбоксиметиловый эфир монометилового эфира PEG; адипинат PEG; дистеарат PEG, моностеарат PEG; гидроксистеарат PEG; дилаурат PEG; диолеат PEG, моноолеат PEG, монорицинолеат PEG; сложные эфиры кокосового масла PEG;
- простые алкиловые эфиры полиоксиэтилена: простой монометиловый эфир PEG или метокси PEG (mPEG); простой диметиловый эфир PEG;
- другие: поли(этиленгликольтерефталат); производные полиоксиэтилена и сложные эфиры сорбитана и жирные кислоты; сополимеры этиленоксида и пропиленоксида; сополимеры этиленоксида с акриламидом;
- производные PEG: O,O'-бис-(2-аминоэтил)полиэтиленгликоль (DAE-PEG 2000); O,O'-бис-(2-аминопропил)полипропиленгликоль-полиэтиленгликоль-полипропиленгликоль.
В одном варианте изобретения полиэтиленгликоль является неразветвленным и не имеет замещенных гидроксильных групп. В этом варианте используемые полиэтиленгликоли имеют молекулярную массу от 400 до 35000 Да. Когда молекулярная масса менее чем 400 Да, то было обнаружено, что эффективное ПЭГ-илирование не происходит. Поэтому в одном предпочтительном варианте изобретения полиэтиленгликоль, используемый при изготовлении ПЭГ-илированных наночастиц, имеет молекулярную массу, равную или больше чем 400, предпочтительнее, равную или больше чем 1000, особенно предпочтительны величины от 1500 до 10000, предпочтительно, от 2000 до 5000 кДа.
Поэтому в одном варианте используется полиэтиленгликоль 2000 (PEG 2000). Количество PEG 2000 в отношении полимера составляет предпочтительно от 1:2 до 1:6; величины, близкие к отношению 1:4, обеспечивают хорошие результаты. Например, примерно 0,25 мг PEG 2000/мг полимера обеспечивает эффективное ПЭГ-илирование. В этом случае количество, ассоциированное с наночастицами, составляет примерно 55,0 мкм/мг наночастиц. Эти наночастицы характеризуются наличием сферической формы и размера, близкого к 300 нм.
В другом варианте изобретения полиэтиленгликоль, используемый при изготовлении ПЭГ-илированных наночастиц, имеет блокированную концевую гидроксильную группу, например, посредством производного простого метилового эфира. Это снижает его гидрофильность и может даже изменить структуру наночастицы. В этом случае большая процентная доля цепей полиэтиленгликоля была бы включена внутрь них, и только небольшая их часть располагалась бы на поверхности наночастиц. Эта особенность позволяет заявителям модулировать признаки наночастиц посредством блокирования гидроксильных групп или путем введения других функциональных групп, как описано ниже. В случае m-PEG, который находится внутри наночастиц, его функцией была бы модификация высвобождения лекарственного средства путем модификации пористости полимерной матрицы.
Простой метиловый эфир полиэтиленгликоля 2000 (m-PEG 2000) используется в предпочтительном варианте. Количество m-PEG 2000 в отношении полимера составляет предпочтительно 1:2-6; величины, близкие к отношению 1:4, обеспечивают хорошие результаты, например, примерно 0,25 мг m-PEG 2000/мг полимера. В этом случае количество, ассоциированное с наночастицами, составляет 35,5 мкг/мг наночастиц. Эти наночастицы характеризуются наличием сферической формы и размера, близкого к 300 нм.
В другом варианте изобретения используемый полиэтиленгликоль имеет концевые функциональные группы, отличные от гидроксильной группы, такие как аминогруппы. Эти аминогруппы, в свою очередь, могут быть замещены и иметь функциональные группы. В предпочтительном варианте аминогруппы представляют собой -NH2. Наблюдалось, что с этими группами наночастицы после орального введения накапливаются в определенных сегментах кишечного тракта, что обеспечивает возможность определенного введения.
Поэтому в одном варианте полиэтиленгликоль, используемый при изготовлении ПЭГ-илированных наночастиц, представляет собой О,О-бис-(2-аминоэтил)полиэтиленгликоль 2000 (DAE-PEG 2000). В этом случае считается, что структура ПЭГ-илированных наночастиц не представляет собой структуру «щеточного» типа, потому что цепи соединялись бы на двух концах, вызывая образование формы «петельного» типа. Количество DAE-PEG в отношении полимера составляет предпочтительно менее чем 1:4. В предпочтительном варианте оно равно или меньше чем 0,25 мг DAE-PEG 2000/мг полимера. В этом случае количество, ассоциированное с наночастицами, составляет примерно 90,6 мкг/мг наночастиц. Эти наночастицы характеризуются наличием сферической формы и размера, близкого к 500 нм.
В другом варианте полиэтиленгликоль, используемый при получении ПЭГ-илированных наночастиц, имеет аминогруппы и ответвления в алкильной группе. Было обнаружено, что с этими заместителями имеется тенденция к формированию структуры щеточного типа при одном из концов внутри наночастицы и другом конце снаружи.
Поэтому, если используемый полиэтиленгликоль представляет собой O,O'-бис-(2-аминопропил)полипропиленгликоль-полиэтиленгликоль-полипропиленгликоль 2000 (DAP-PEG 2000), наночастицы характеризуются наличием сферической формы и размера, близкого к 360 нм. В этом случае количество DAP-PEG в отношении полимера предпочтительно равно или меньше чем 0,25 мг DAP-PEG 2000/мг полимера, а количество, ассоциированное с наночастицами, составляет 67,6 мкг/мг наночастиц.
Химические структуры некоторых полиалкиленгликолей, соответствующих ранее указанным группам с различными типами функциональных групп, иллюстративно представлены ниже:
а) H(OCH2CH2)nOH
b) H3C(OCH2CH2)nOH
c) H2N(CH2CH2O)nCH2CH2NH2
d) H2NCHCH3CH2(OCHCH3CH2) (OCH2CH2)n(OCH2CHCH3)NH2
Определенными примерами были бы:
а) полиэтиленгликоль 400, 1000 или 2000 (PEG 400, PEG 1000 или PEG 2000);
b) простой метиловый эфир полиэтиленгликоля 2000 (mPEG 2000);
c) O,O'-бис-(2-аминоэтил)полиэтиленгликоль (DAE-PEG 2000);
d) O,O'-бис-(2-аминопропил)полипропиленгликоль-полиэтиленгликоль-полипропиленгликоль (DAP-PEG 2000).
Как видно из описанного выше, что подтверждено примерами, выбор типа полиэтиленгликоля позволяет модулировать по желанию признаки системы, которая генерирована. Использование смесей различных типов полиэтиленгликолей добавляет дополнительный фактор вариабельности. С практической точки зрения, это важно для адаптации и выбора самой подходящей системы для каждой активной молекулы и для каждого способа введения.
Способ получения биологически разлагаемого полимера и наночастиц полиэтиленгликоля, предпочтительно сополимера простого винилметилового эфира и малеинового ангидрида (PVM/MA) и полиэтиленгиколя, основан на способе смещения растворителя, описанном, например, в WO 02/069 938.
В одном варианте изобретения ПЭГ-илированные наночастицы получают двумя различными способами: (i) одновременной инкубацией двух полимеров (например, PVM/MA и PEG) в органической фазе и (ii) инкубацией наночастиц биологически разлагаемого полимера с водным раствором полиэтиленгликоля. Эти способы обоснованы для получения наночастиц PVM/MA с ассоциацией PEG на их поверхности. Первый вариант (одновременная инкубация полимеров) предпочтителен, потому что он обеспечивает хорошую степень ассоциации PEG.
Первый способ включает одновременное растворение биологически разлагаемого полимера и полиэтиленгликоля в органическом растворителе, таком как, например, ацетон. Инкубация смеси проводится при перемешивании при комнатной температуре в течение определенного периода времени. Концентрация биологически разлагаемого полимера составляет от 0,001 до 10% мас./об., а концентрация полиэтиленгликоля или его производного - от 0,001 до 5% мас./об.
К этому раствору необязательно добавляется определенный объем полярного растворителя, смешиваемого с раствором полимеров, такого как, например, этанол.
Можно также необязательно использовать поперечно сшивающий агент для улучшения устойчивости наночастиц, как описано в WO 02/069938. Среди поперечно сшивающих агентов, которые можно использовать, находятся диаминированные молекулы (например, 1,3 диаминопропан), полисахариды или одиночные сахариды, белки и, в целом, любая молекула, имеющая функциональные группы, которые способны взаимодействовать с группами ангидрида Gantrez. В способе по изобретению поперечная сшивка не обязательна, когда добавляются PEG, потому что это происходит одновременно. Должно добавляться очень небольшое количество указанных продуктов, если желательна их поперечная сшивка.
Наконец, добавляется аналогичный объем второй жидкости, не являющейся растворителем, предпочтительно, водно-спиртовой раствор. В одном варианте используется вода фармацевтического сорта (очищенная вода WFI в соответствии с заявкой). Отношение органической фазы к водно-спиртовому раствору находится предпочтительно в диапазоне от 1/1 до 1/10. Наночастицы формируются сразу в среде, имея вид молочной суспензии.
Органические растворители удаляются любым подходящим способом, таким как выпаривание под пониженным давлением, причем наночастицы остаются в устойчивой водной суспензии.
Наночастицы очищаются обычными средствами, такими как центрифугирование, ультрацентрифугирование, тангенциальная фильтрация или выпаривание, включая использование вакуума.
Наконец, их, при желании, можно лиофилизировать для их длительного хранения и консервации. Можно использовать обычные криопротективные агенты, такие как сахароза или маннит, для содействия лиофилизации, предпочтительно в концентрации в диапазоне от 0,1 до 10 мас.%.
Второй способ включает растворение биологически разлагаемого полимера в органическом растворителе, таком как ацетон. В последующем к этому раствору добавляются определенный объем водно-спиртового раствора, такого как этанол, и, наконец, аналогичный объем воды. Наночастицы сразу формируются в среде, и они имеют вид молочной суспензии. Органические растворители удаляются, как описано в предыдущем способе, например, выпариванием под пониженным давлением, причем наночастицы остаются в устойчивой водной суспензии. Затем наночастицы инкубируются в водном растворе полиэтиленгликоля. Инкубация проводится при перемешивании в течение определенного периода времени. Наночастицы в последующем очищаются центрифугированием, и они, в конечном счете, лиофилизируются с использованием описанных выше способов.
Изобретение также нацелено на фармацевтические композиции, включающие описанные ПЭГ-илированные наночастицы и, необязательно, активную молекулу. Подходящие фармацевтические композиции представляют собой фармацевтические композиции, известные специалисту в области энтеральных препаративных форм, предпочтительно оральных и парентеральных препаративных форм, таких как инфузионные растворы, и местных препаративных форм, таких как глазные препаративные формы. Препаративные формы должны включать подходящие эксципиенты для каждой препаративной формы. Например, в случае оральных препаративных форм в виде таблетки или капсулы, при необходимости, могут быть включены связывающие вещества, разрыхляющие вещества, смазывающие вещества, наполнители, энтеросолюбильное покрытие и т.д. Оральные препаративные формы получают обычно смешиванием, сухим или влажным гранулированием и включением ПЭГ-илированных наночастиц по изобретению.
В одном аспекте изобретения ПЭГ-илированные наночастицы вводятся путем обеспечения доступа к слизистой оболочке организма (включая оральное, ректальное, интраназальное, вагинальное и глазное введение).
Когда ПЭГ-илированные наночастицы вводятся парентерально, они используются для модификации распределения ассоциированной биологически активной молекулы и/или обычных наночастиц. В случае парентеральных препаративных форм используются стерильные суспензии или лиофилизат наночастиц и носитель для растворения перед использованием, такой как физиологический солевой раствор. При необходимости, могут быть включены такие эксципиенты, как криоконсервирующие вещества, растворы, регулирующие рН, и поверхностно-активные вещества.
Описанные ПЭГ-илированные наночастицы и их препаративные формы могут использоваться в качестве основы для введения биологически активных молекул. Под активной молекулой подразумевается любое химическое соединение, введенное субъекту, предпочтительно человеку, в профилактических или терапевтических целях. Конечно, этот термин также включает макромолекулярные соединения, такие как белки, пептиды, нуклеиновые кислоты и т.д. ПЭГ-илированные наночастицы используются для модификации распределения ассоциированной биологически активной молекулы.
В одном варианте активная молекула относится к группе, образованной ДНК, РНК, нуклеозидами, нуклеотидами, олигонуклеотидами или полинуклеотидами. В другом варианте активная молекула относится к группам белков или пептидов.
Могут быть включены активные молекулы из групп, образованных противоопухолевыми средствами или антигенными средствами для опухолей, из групп, образованных защитными средствами центральной нервной системы или глюкокортикоидами, и т.д. Альтернативно, активная молекула представляет собой антиген для вакцинации или аллерген для иммунотерапии.
В одном варианте изобретения ПЭГ-илированные наночастицы можно также использовать в качестве адъювантов вакцин.
Включение лекарственного средства в наночастицы можно осуществить, как описано в WO 02/069938, включением в раствор полимера перед образованием наночастиц, или последующим добавлением его к водной суспензии уже образованных наночастиц. Например, и в зависимости от природы лекарственного средства можно использовать следующие способы:
а) гидрофобные препараты: добавление к органической фазе (ацетону) и совместная инкубация/солюбилизация с PVMMA и PEG в течение вариабельного периода времени (до 1 ч) при перемешивании (механическом, магнитном или ультразвуковом перемешивании);
b) гидрофильные препараты: добавление к органической фазе (ацетону) и совместная инкубация с PVMMA и PEG в течение вариабельного периода времени (до 1 ч) при перемешивании (механическом, магнитном или ультразвуковом перемешивании) до получения тонкой суспензии в ацетоне. Этот способ успешно использовался для инкапсуляции белковой модели (яичного альбумина, белка примерно 44 кДа). Включение было эффективным, обеспечивая увеличенную инкапсуляцию белковой модели;
с) гидрофильные препараты: добавление в водной фазе для инкубации с предварительно образованными наночастицами (это способ, используемый для инкапсуляции двух флуоресцентных маркеров, используемых в примерах: FITC и RBITC).
Ниже изобретение описано посредством нескольких не ограничивающих и иллюстративных примеров изобретения.
ПРИМЕРЫ
Несколько методик использовали для физико-химической характеристики новых наночастиц. Размер и зета потенциал наночастиц определяют в приборе Zetamaster (Malvern, United Kingdom). Форму наночастиц можно наблюдать электронной трансмиссионной микроскопией (Zeiss, Germany) после маркировки образцов фосфорно-вольфрамовой кислотой.
Пример 1:
Получение ПЭГ-илированных наночастиц с полиэтиленгликолем 2000 (PEG-NP)
Испытывали 2 способа:
- смешивание двух полимеров в органической фазе;
- покрытие предварительно образованных наночастиц PEG.
Величины продуктивности способов изготовления ПЭГ-илированных наночастиц получают посредством определения их массы в конце способа и после их лиофилизации. Величины продуктивности изготовления выражаются в процентных долях, рассчитанных в отношении исходной массы сополимера PVM/MA и полиэтиленгликоля. Количество полиэтиленгликоля, ассоциированного с наночастицами, определяют методом колориметрии (Labsystems iEMS Reader MF) и рассчитывают как разность между используемым исходным количеством и количеством, обнаруженным в надосадочных жидкостях, полученных во время продукции наночастиц.
1.1. Ассоциация полиэтиленгликоля с сополимером простого винилметилового эфира и малеинового ангидрида в органической фазе
Этот способ осуществляется одновременной инкубацией PVM/MA и PEG 2000 в органической фазе.
Для этого 100 мг PVM/MA растворяют в 5 мл органического растворителя (ацетона). Затем к этому раствору (10-50 мг) добавляют PEG 2000. Смесь оставляют для взаимодействия при перемешивании на магнитной мешалке в течение 1 ч. Затем к этой фазе добавляют 10 мл этанола и 10 мл дистиллированной воды. Полученную смесь оставляют на 5 мин для гомогенизации. Органические растворители удаляют выпариванием под пониженным давлением (Buchi R-144, Switzerland), концентрируя суспензию образовавшихся наночастиц. Суспензию подвергают очистке центрифугированием (20 мин. при 17000 об/мин, дважды) (Sigma 3K30, Germany). Надосадочные жидкости собирают для аналитических оценок, тогда как остаток ресуспендируют в водном растворе сахарозы (5% мас./об.). Суспензию наночастиц окончательно замораживают и лиофилизируют в аппарате Genesis 12EL (Virtis, USA).
Полученные наночастицы имеют сферическую форму, аналогичную обычным наночастицам (фиг. 1b). Свойства этих ПЭГ-илированных наночастиц представлены в табл. 1. Ассоциация PEG 2000 с наночастицами вызывает увеличение полидисперсии популяции. Наблюдается, что с увеличением количества полиэтиленгликоля (отношение 1:2) размер и особенно полидисперсия становятся очень высокими. Наблюдения поверхностного потенциала наночастиц проявляют более низкие отрицательные величины для ПЭГ-илированных наночастиц. Эти результаты свидетельствуют о присутствии цепей полиэтиленгликоля на поверхности наночастиц. Наконец, необходимо указать, что при отношениях PEG 2000:PVM/MA менее чем 1:4 мас./мас. количество PEG, ассоциированного с наночастицами, поддерживается постоянным и близким к 50 мкг/мг.
Влияние количества PEG 2000 на физико-химические характеристики наночастиц. Данные выражают средние величины ± стандартное отклонение (n=3).
(мг)
(нм)
(мВ)
(мкг/мг)*
1.2. Ассоциация полиэтиленгликоля с предварительно образованными наночастицами
100 мг PVM/MA растворяют в 5 мл органического растворителя (ацетона). Затем к этому раствору добавляют 10 мл этанола и 10 мл дистиллированной воды при перемешивании. Полученную смесь оставляют на 5 мин для гомогенизации. Затем суспензию наночастиц выпаривают под пониженным давлением до тех пор, пока не удаляться оба растворителя. Объем водной наносуспензии доводят водой до 5 мл и добавляют 5 мл водного раствора, содержащего от 10 до 25 мг PEG 2000. Инкубацию наночастиц в фазе полиэтиленгликоля проводят при перемешивании на магнитной мешалке в течение 1 ч. Суспензию подвергают очистке центрифугированием (20 мин при 17000 об/мин, дважды) (Sigma 3K30, Germany). Надосадочные жидкости удаляют и остаток ресуспендируют в водном растворе сахарозы (5% мас./об.). Суспензию наночастиц окончательно замораживают и лиофилизируют в аппарате Genesis 12EL (Virtis, USA).
Количество полиэтиленгликоля, ассоциированное с наночастицами, определяют ранее указанным колориметрическим способом. Результаты показывают, что при этом способе количество PEG, ассоциированное с наночастицами, значительно ниже, чем при способе, описанном в примере 1.1 (инкубация в органической фазе) (фиг. 2). Причиной этого результата является высокий аффинитет полиэтиленгликоля к воде, поэтому не получается эффективной ассоциации с карбоксильными группами, происходящими в результате гидролиза сополимера в предварительно образованных частицах. Можно сделать вывод, что способ получения ПЭГ-илированных наночастиц одновременной инкубацией сополимера и полиэтиленгликоля в органической фазе более эффективен, чем простое покрытие предварительно образованных наночастиц PEG.
1.3. Влияние молекулярной массы PEG на физико-химические характеристики ПЭГ-илированных наночастиц
Способ осуществляется одновременной инкубацией PVM/MA и желательного полиэтиленгликоля (PEG 400, PEG 1000 или PEG 2000), как описано в примере 1.1.
Для этого 100 мг PVM/MA растворяют в 5 мл органического растворителя (ацетона). Затем добавляют 25 мг PEG (400, 1000 или 2000). Смесь оставляют для взаимодействия при перемешивании на магнитной мешалке в течение 1 ч. Затем к этой фазе добавляют 10 мл этанола и 10 мл дистиллированной воды. Полученную смесь оставляют на 5 мин для гомогенизации. Органические растворители удаляют выпариванием под пониженным давлением (Buchi R-144, Switzerland), концентрируя суспензию наночастиц. Суспензию подвергают очистке центрифугированием (20 мин при 17000 об/мин, дважды) (Sigma 3K30, Germany). Надосадочные жидкости удаляют и остаток ресуспендируют в водном растворе сахарозы (5% мас./об.). Суспензию наночастиц окончательно замораживают и лиофилизируют в аппарате Genesis 12EL (Virtis, USA).
Количество PEG (400, 1000 или 2000) и mPEG 2000 (пример 2) определяют колориметрической оценкой. Для этого 15 мкл йодного раствора (10 мг/мл йода; 20 мг/мл йодида калия) добавляют к 1 мл надосадочных жидкостей, полученных в течение стадии очистки наночастиц. Спектральную поглощательную способность комплекса, полученного между PEG (или mPEG) и йодом, наблюдают колориметрией при λ 540 нм (Sims & Snape, Anal. Biochem., 107 (1980) 60-63).
В табл. 2 показано влияние молекулярной массы PEG на физико-химические характеристики полученных наночастиц. Ввиду этих результатов можно сделать вывод, что полиэтиленгликоли с низкой молекулярной массой не подходят для ПЭГ-илирования этих наночастиц. В случае PEG 400, который представляет собой жидкость, нельзя получить ассоциацию, а в случае PEG 1000 ассоциация очень низкая. Эти результаты также подтверждаются данными исследования поверхностного заряда частиц. Зета потенциал наночастиц, модифицированных PEG 400 или PEG 1000, всегда более отрицательный, чем зета потенциал частиц, ПЭГ-илированных PEG 2000, и аналогичен таковому непокрытых частиц. Можно сделать вывод, что ПЭГ-илирование PEG 2000 гораздо эффективнее.
Влияние молекулярной массы PEG на физико-химические характеристики ПЭГ-илированных наночастиц (отношение PEG/PVM-MA=0,25). Данные выражают средние величины ± стандартное отклонение (n=3)
**ND - не выявляемо
1Определение количества PEG, ассоциированного с наночастицами, ядерным магнитным резонансом (способом, описанным в примере 5)
Пример 2:
Получение ПЭГ-илированных наночастиц с простым метиловым эфиром полиэтиленгликоля 2000 (mPEG-NP)
Этот способ осуществляется одновременной инкубацией PVM/MA и mPEG в органической фазе.
Для этого 100 мг сополимера PVM/MA растворяют в 5 мл органического растворителя (ацетона). Затем к этому раствору добавляют некоторое количество mPEG 2000 (10-50 мг). Смесь оставляют для взаимодействия при перемешивании на магнитной мешалке в течение 1 ч. Затем к этой фазе добавляют 10 мл этанола и 10 мл дистиллированной воды. Полученную смесь оставляют на 5 мин для гомогенизации. Органические растворители удаляют выпариванием под пониженным давлением (Buchi R-144, Switzerland), концентрируя суспензию образовавшихся наночастиц. Суспензию подвергают очистке центрифугированием (20 мин. при 17000 об/мин, дважды) (Sigma 3K30, Germany). Надосадочные жидкости удаляют и остаток ресуспендируют в водном растворе сахарозы (5% мас./об.). Суспензию наночастиц окончательно замораживают и лиофилизируют в аппарате Genesis 12EL (Virtis, USA).
На фиг. 1(с) показано, что наночастицы, покрытые mPEG 2000, имеют сферическую форму, и поверхность представляется гладкой. В табл. 3 показан уровень ассоциации mPEG 2000 с наночастицами и его влияние на размер, полидисперсию и поверхностный заряд наночастиц. Результаты показывают, что с увеличением исходного количества mPEG 2000 слегка увеличивается процентная доля, ассоциированная с наночастицами.
Присутствие mPEG увеличивает полидисперсию популяции наночастиц, особенно при высокой концентрации (отношение mPEG/PVM-MA более чем 0,25). С другой стороны, отрицательный заряд наночастиц уменьшается, когда увеличивается количество используемого mPEG. Однако значительные отклонения, наблюдаемые при использовании больших количеств mPEG, свидетельствуют о том, что цепи mPEG 2000 неравномерно распределяются по поверхности.
Влияние количества mPEG 2000 на физико-химические характеристики наночастиц. Данные выражают средние величины ± стандартное отклонение (n=3)
(мг)
Пример 3:
Получение ПЭГ-илированных наночастиц с O,O'-бис-(2-аминоэтил)полиэтиленгликоля 2000 (DAE-PEG-NP)
Этот способ осуществляется одновременной инкубацией PVM/MA и DAE-PEG 2000 в органической фазе.
Для этого определенное количество DAE-PEG (5, 10, 25 или 35 мг) растворяют в 5 мл органического растворителя (ацетона). Затем к этому раствору добавляют 100 мг PVM/MA при перемешивании на магнитной мешалке. Полученную смесь оставляют для взаимодействия при перемешивании на магнитной мешалке в течение 1 ч. К этой органической фазе добавляют 10 мл этанола и 10 мл дистиллированной воды при перемешивании. Полученную смесь оставляют на 5 мин для гомогенизации. Органические растворители удаляют выпариванием под пониженным давлением (Buchi R-144, Switzerland), концентрируя суспензию наночастиц. Суспензию подвергают очистке центрифугированием (20 мин при 17000 об/мин, дважды) (Sigma 3K30, Germany). Надосадочные жидкости удаляют и остаток ресуспендируют в водном растворе сахарозы (5% мас./об.). Суспензию наночастиц окончательно замораживают и лиофилизируют в аппарате Genesis 12EL (Virtis, USA).
Количество DAE-PEG и DAP-PEG (пример 4) определяют после добавления реагента из набора для анализа белков Micro BCATM Protein Assay Reagent Kit (Pierce, U.S.A.) к надосадочным жидкостям, полученным для стадии очистки наночастиц. Этот реагент способен взаимодействовать с аминогруппами этих полиэтиленгликолей, давая окрашенный комплекс. Для этого 150 мкл реагента добавляют к такому же объему надосадочной жидкости. Спектральную поглощательную способность определяют колориметрией при λ 570 нм после инкубации в течение 2 ч при 37°С.
Фиг. 1(d) показывает, что наночастицы, покрытые DAE-PEG 2000, имеют сферическую форму. В табл. 4 показан уровень ассоциации DAE-PEG 2000 и его влияние на размер, полидисперсию и поверхностный заряд наночастиц. Эти результаты показывают, что увеличение количества DAE-PEG 2000 (с 5 до 35 мг) увеличивает количество эксципиента, сцепленного с наночастицами. Однако когда количество используемого DAE-PEG 2000 больше 25 мг, наночастицы не образуются.
При анализе размера наблюдается, как увеличение степени ассоциации продуцирует наночастицы с более крупным размером и большей полидисперсией. Поэтому, когда наночастицы DAE-PEG продуцируются с 25 мг, полученные частицы имеют размер больше чем 500 нм и очень высокую полидисперсию. С другой стороны, наблюдается снижение отрицательного поверхностного заряда покрытых наночастиц в сравнении с непокрытыми наночастицами. Эти данные свидетельствуют о том, что цепи DAE-PEG 2000 присутствуют на поверхности наночастиц.
Влияние количества DAE-PEG 2000 на физико-химические характеристики наночастиц. Данные выражают средние величины ± стандартное отклонение (n=3)
(мг)
Пример 4:
Получение ПЭГ-илированных наночастиц с O,O'-бис-(2-аминопропил)полипропиленгликоль-полэтиленгликоль-полипропиленгликоля 2000 (DAP-PEG-NP)
Этот способ осуществляется одновременной инкубацией PVM/MA и DAE-PEG 2000 в органической фазе.
Для этого определенное количество DAE-PEG (10-50 мг) растворяют в 5 мл органического растворителя (ацетона). Затем к этому раствору добавляют 100 мг сополимера простого винилметилового эфира и малеинового ангидрида при перемешивании на магнитной мешалке. Полученную смесь оставляют для взаимодействия при перемешивании на магнитной мешалке в течение 1 ч. Затем к этой фазе добавляют 10 мл этанола и 10 мл дистиллированной воды при перемешивании. Полученную смесь оставляют на 5 мин для гомогенизации. Органические растворители удаляют выпариванием под пониженным давлением (Buchi R-144, Switzerland), концентрируя суспензию наночастиц. Суспензию подвергают очистке центрифугированием (20 мин при 17000 об/мин, дважды) (Sigma 3K30, Germany). Надосадочные жидкости удаляют и остаток ресуспендируют в водном растворе сахарозы (5% мас./об.). Суспензию наночастиц окончательно замораживают и лиофилизируют в аппарате Genesis 12EL (Virtis, USA).
Фиг. 1(e) показывает, что наночастицы, покрытые DAP-PEG 2000, имеют сферическую форму и гладкую поверхность. В табл.5 показаны общие характеристики этих наночастиц. Результаты показывают, что увеличение количества DAP-PEG 2000 увеличивает его количество, сцепленное с наночастицами. Однако когда количество используемого DAP-PEG 2000 больше 35 мг, наночастицы не образуются.
Наблюдается, что увеличение степени ассоциации продуцирует наночастицы с более крупным размером, а также большей полидисперсией. Наблюдения зета потенциала показывают значительное снижение отрицательных величин, полученных для покрытых наночастиц (величины, близкие к нулю). Эти результаты свидетельствуют о том, что цепи DAP-PEG 2000 преимущественно расположены на поверхности наночастиц.
Влияние количества DAP-PEG 2000 на физико-химические характеристики наночастиц. Данные выражают средние величины ± стандартное отклонение (n=3)
(мг)
** ND - не выявляемо
Пример 5:
Исследование продуктивности способа и структуры ПЭГ-илированных наночастиц
На фиг. 3 показано влияние типа полиэтиленгликоля на процентную долю PVM/MA, трансформированного в наночастицы, и на общую продуктивность способа. В целом процентная доля сополимера, трансформированного в наночастицы, близка к 73%. Наблюдается, что когда наночастицы модифицируются PEG или mPEG, процентная доля PVM/MA, трансформированного в частицы, значительно не модифицируется. Однако ПЭГ-илирование наночастиц DAE-PEG или DAP-PEG уменьшает продуктивность способа.
Ассоциация полиэтиленгликолей с наночастицами подтверждается способом элементного анализа (Leco CHN-900, USA). В соответствии с этой методикой они могут проявлять изменения их кислородного, водородного или азотного состава при ассоциации с другими компонентами (например: PEG).
Табл. 6 включает состав элементов C, H, O и N различных типов ПЭГ-илированных наночастиц. По сравнению с обычными наночастицами (NP) все ПЭГ-илированные наночастицы проявляют увеличение процентной доли водорода (Н) и относительное снижение содержания кислорода в них. С другой стороны, DAE-PEG NP и DAP-PEG NP проявляют присутствие азота, которое не наблюдается в немодифицированных наночастицах.
Сравнение процентных долей элементов в ПЭГ-илированных наночастицах и немодифицированных наночастицах (NP)
Локализацию полиэтиленгликолей (внутри или на поверхности наночастиц) анализируют ядерным магнитным резонансом (1H-ЯМР) (Bruker 400 UltrashieldTM, Germany) после растворения 5 мг ПЭГ-илированных наночастиц в 0,5 мл дейтерированного диметилсульфоксида. Спектр ПЭГ-илированных наночастиц с PEG и mPEG получают после применения 6400 разверток, тогда как спектры DAE-PEG-NP и DAP-PEG-NP - после 12800 разверток. Спектры демонстрируют типичный пик водорода полиэтиленовых единиц (при 3,51 м.д. - OCH2CH2-) и пики водорода гидроксильных групп (в случае PEG и mPEG) или пики водорода аминогрупп DAE-PEG и DAP-PEG (при 4,58 м.д.) (фиг. 4). Рассчитывают отношение величин площадей этих двух пиков, находящееся в спектрах ПЭГ-илированных частиц и в спектрах свободных полиэтиленгликолей. Величины этих отношений могут предоставить информацию для определения локализации цепей полиэтиленгликоля в ПЭГ-илированных наночастицах.
Наблюдается, что пик водорода гидроксильной группы (4,58 м.д.) оказывается в спектре ПЭГ-илированных наночастиц с PEG 2000 (фиг. 5а). В табл. 7 показана площадь двух ранее указанных пиков (при 3,51 м.д. и при 4,58 м.д.) и отношения их для PEG-NP и свободного PEG. Рассчитано, что отношение между этими двумя пиками для наночастиц примерно в 2 раза больше, чем для свободного PEG 2000. В случае этих наночастиц эти данные означают, что пропорция гидроксильных групп в 2 раза меньше, поэтому можно сделать вывод, что значительное количество этих функциональных групп (которые не оказываются в спектре) сцеплены с ангидридными группами сополимера. В соответствии с этими наблюдениями небольшая часть цепей PEG 2000 будет включена внутрь наночастиц, тогда как большая часть цепей PEG расположится на их поверхности. Этот факт подтверждают данные зета потенциала, показанные в табл. 1.
В табл. 7 показаны данные, относящиеся к площадям двух пиков для m-PEG-NP и свободного mPEG 2000. Наблюдается, что отношение двух пиков для ПЭГ-илированных наночастиц и mPEG 2000 одинаково (177 к 217). Эти результаты показывают, что пропорция гидроксильных групп mPEG в этих двух случаях (наночастицах и свободном mPEG) одинакова и что небольшая процентная доля взаимодействует с ангидридными группами сополимера. Можно сделать вывод, что структура этих частиц отличается от структуры PEG-NP. В этом случае большая процентная доля цепей mPEG будет включена внутрь, и только небольшая ее часть будет располагаться на поверхности наночастиц. Поэтому распределение цепей mPEG по поверхности неравномерно, что согласуется с большими отклонениями, наблюдавшимися при анализе зета потенциала этих частиц (табл. 3).
Анализ спектров PEG 2000 и ПЭГ-илированных наночастиц с PEG 2000 посредством способа ядерного магнитного резонанса (Н-ЯМР)
В табл. 8 показаны данные, относящиеся к площадям пиков для DAP-PEG-NP и свободного DAP-PEG 2000. В спектре DAP-PEG 2000 имеется 2 сигнала, соответствующих водородам двух различных аминогрупп, расположенных на концах его цепи: дуплет у δ=4,55 м.д. и другая у δ=4,45 м.д. (фиг. 6b). Наблюдается, что в спектре ПЭГ-илированных наночастиц с DAP-PEG 2000 нет водорода этих аминогрупп (фиг. 6а), что указывает на то, что все аминогруппы этого типа полиэтиленгликоля взаимодействуют с ангидридными группами полимера, образующего наночастицы. Кроме того, цепи DAP-PEG будут сцеплены с поверхностью наночастиц у двух концевых аминогрупп, и покрытие поверхности будет полным. Это подтверждается величинами зета потенциала (близкими к нулю) этих частиц (табл. 5).
Анализ спектров DAP-PEG 2000 и ПЭГ-илированных наночастиц (DAP-PEG-NP) посредством способа ядерного магнитного резонанса (Н-ЯМР)
3,51 м.д. (водород полиэтиленовых единиц)
4,55 м.д. (водород аминогрупп)
4,45 м.д. (водород аминогрупп)
В случае DAP-PEG 2000 невозможно рассчитать такое же отношение этих двух пиков, потому что пик при 4,58 м.д. имеет очень низкую интенсивность и низкое разрешение (не зависимое от концентрации и количества проведенных разверток) (фиг. 7b). В любом случае можно наблюдать, что этот пик появляется в спектре наночастиц, а также в спектре DAP-PEG 2000. Поэтому можно сделать вывод, что часть цепей DAE-PEG будет включена внутрь частиц. Однако большая часть их будет локализоваться на поверхности, сцепленная только на конце цепи этого полиэтиленгликоля.
В отношении этих данных можно сделать вывод, что ПЭГ-илированные наночастицы имеют другую структуру. Структура, предложенная для различных препаративных форм, показана на фиг. 8. Определенные полиэтиленгликоли, такие как PEG 20000, DAE-PEG и DAP-PEG, модифицируют поверхность созданных наночастиц. В случае PEG-NP и DAE-PEG-NP покрытие вызовет появление структуры «щеточного» типа (фиг. 8а и с), тогда как в случае DAP-PEG цепи будут сцеплены на этих двух концах, вызывая появление формации «петельного» типа (фиг. 8d). Единственный случай, в котором модификация поверхности наночастиц не наблюдается, - это, когда используется mPEG 2000. mPEG будет главным образом обнаружена внутри наночастиц (фиг. 8b).
Пример 6:
Исследование биоадгезивных характеристик ПЭГ-илированных наночастиц в желудочно-кишечном тракте крыс
Это исследование проводилось в соответствии с предписаниями Комитета по этике университета Наварры, в соответствии с Европейским законодательством по проведению экспериментов на животных (86/609/EU).
ПЭГ-илированные наночастицы, использованные в этом анализе, являются флуоресцентно меченными изотиоцианатом родамина В. Для этого наночастицы образуются посредством одновременной инкубации PVM/MA и различных типов полиэтиленгликолей (в соответствии со способом в примерах 1.1, 2, 3 и 4). Затем к этой фазе добавляют 10 мл этанола и 10 мл дистиллированной воды при перемешивании. Полученную смесь оставляют на 5 мин для гомогенизации. Органические растворители удаляют выпариванием под пониженным давлением (Buchi R-144, Swittzerland), концентрируя суспензию наночастиц. Объем водной наносуспензии доводят водой до 9 мл и добавляют 1 мл водного раствора изотиоцианата родамина В (1,25 мг/мл). Инкубацию наночастиц с флуоресцентным маркером проводят при перемешивании в течение 5 мин. Затем суспензию флуоресцентно модифицированных наночастиц подвергают очистке центрифугированием (20 мин при 17000 об/мин, дважды) (Sigma 3K230, Germany). Надосадочные жидкости удаляют и остаток ресуспендируют в водном растворе сахарозы (5% мас./об.). Суспензию наночастиц окончательно замораживают и лиофилизируют в аппарате Genesis 12EL (Virtis, USA).
Табл. 9 включает характеристики препаративных форм, использованных в этом анализе, и флуоресцентно маркированных изотиоцианатом родамина В.
Физико-химические характеристики наночастиц, учитываемые в исследовании биоадгезии. Средняя величина ± стандартное отклонение (n=3)
**Количество изотиоцианата родамина В, сцепленного с наночастицами (выраженное в мкг/мг наночастиц), определяется колориметрией при 540 нм.
Полученные наночастицы (10 мг) орально вводят самцам крыс (линия Wistar, масса 220,0 г) после их дисперсии в 1 мл воды. После орального введения животных умерщвляют смещением шейных позвонков в различные точки времени: 0,5, 1, 3 и 8 ч. Брюшную полость вскрывают и экстрагируют желудочно-кишечный тракт. Его делят на следующие анатомические части: желудок, тонкая кишка и слепая кишка. Каждый сегмент вскрывают в продольном направлении через брыжейку и промывают солевым фосфатным буфером (рН 7,4; 0,15 М) для удаления фракции не сцепившихся наночастиц. Кроме того, каждый сегмент разрезают на части длиной 2 см, переваривают в течение 24 ч 1 мл 3М гидроксида натрия (Arbos et al., Int. J. Pharm., 242 (2002) 129-136). Затем родамин удаляют 2 мл метанола, и образцы центрифугируют в течение 10 мин при 4000 об/мин. Надосадочные жидкости (1 мл) разбавляют 3 мл воды, и количество родамина определяют посредством флуоресцентной спектроскопии при λex=540 нм и λem=580 нм (GENios, Austria). Фракцию наночастиц, сцепленных со слизистой оболочкой, можно оценить в соответствии с этим способом.
Удельное распределение ПЭГ-илированных наночастиц в различных частях желудочно-кишечного тракта показано на фиг. 9. Все препаративные формы проявили значительную исходную адгезию к слизистой оболочке желудка. Процентная доля дозы, сцепленной с этим органом, через 30 мин после ее введения находилась в диапазоне от 13% для PEG-NP и 9% для DAP-PEG-NP. Все препаративные формы ПЭГ-илированных наночастиц также проявили определенный аффинитет к части I3 тонкой кишки; однако было показано, что PEG-NP и DAP-PEG-NP - самые эффективные препаративные формы через 3 ч после введения для поддержания количеств, сцепленных с тонкой кишкой, около 20% дозы. Наконец, пик сцепленных наночастиц через 8 ч после введения был обнаружен в последней части тонкой кишки (для PEG-NP) или в слепой кишке (для mPEG-NP и DAP-PEG-NP). Относительно значительную фракцию (близкую к 10%) наночастиц, сцепленных со слизистой оболочкой, можно было еще количественно определить в случае PEG-NP и DAP-PEG-NP. В заключение можно утверждать, что наночастицы, покрытые PEG 2000 и mPEG 2000, проявляют очень однородное распределение и диссеминированы по всем частям тракта в течение 8 ч (фиг. 9а и b). ПЭГ-илированные наночастицы с DAE-PEG предпочтительно сцепляются со слизистой оболочкой в промежуточных частях тонкой кишки (фиг. 9с), тогда как наночастицы, модифицированные DAP-PEG 2000, накапливаются главным образом в дистальных областях кишечного тракта (фиг. 9d). Эти результаты означают, что наночастицы, созданные в настоящем изобретении, могут обеспечить специфическое высвобождение препарата.
Параметры биоадгезии (Arbos et al., Int. J. Pharm., 242 (2002) 129-136): кривую адгезии каждой препаративной формы получали представлением сцепленной фракции ПЭГ-илированных наночастиц в слизистой оболочке желудочно-кишечного тракта крыс в течение времени. По этой кривой рассчитывали следующие параметры: AUCadh, kadh и MRTadh. kadh представляет скорость выведения сцепленной фракции и рассчитывается с помощью программы WinNonlin версии 1.5 (Scientific Consulting, Inc.). AUCadh или площадь под кривой, представляющей сцепленную фракцию в течение времени (выраженную в форме динамики количества сцепленного маркера во времени), оценивали трапециевидным способом относительно tz (последней точки взятия пробы), который позволяет количественно определить интенсивность биоадгезивного феномена. Наконец, MRTadh представляет собой среднее время нахождения сцепленной фракции наночастиц, и оно позволяет оценить относительную длительность адгезивных взаимодействий, используя последнюю точку взятия пробы в качестве предела.
На фиг. 10 показаны биоадгезивные профили ПЭГ-илированных наночастиц во всем желудочно-кишечном тракте в течение 8 ч. Все ПЭГ-илированные наночастицы проявляют биоадгезивные профили, которые отличаются от профиля немодифицированных наночастиц (NP). Максимальная биоадгезия NP происходит через 30 мин после их орального введения и затем быстро уменьшается. Напротив, ПЭГ-илированные наночастицы в целом имеют меньшую исходную способность к развитию биоадгезивных взаимодействий. Однако адгезивная способность поддерживается, по меньшей мере, в течение 3 ч. Поэтому через 3 ч после введения количество наночастиц, сцепленных со слизистой желудочно-кишечного тракта, находится в диапазоне от 25% введенной дозы для PEG-NP до 16% для DAP-PEG-NP, во всех случаях больше, чем контрольных (NP). С другой стороны, профиль, полученный для PEG-NP, представляет особый интерес. Эти наночастицы проявляют максимальную адгезию через 1 ч после введения (примерно 32% дозы), а через 3 ч после их введения уровни частиц, сцепленных со слизистой оболочкой, аналогичны исходным уровням. В случае остающихся ПЭГ-илированных наночастиц их исходная адгезия сохраняется в течение, по меньшей мере, 3 ч.
Биоадгезивные параметры могут предоставить больше деталей в отношении адгезивных свойств наночастиц (табл. 10). Как указывалось ранее, исходная способность ПЭГ-илированных наночастиц взаимодействовать со слизистой оболочкой (Qmax) ниже, чем таковая для непокрытых частиц (NP). Однако площадь биоадгезии под кривой (AUCadh) ПЭГ-илированных наночастиц выше; это означает, что адгезивная интенсивность больше. Этот феномен, в частности, наблюдается в случае PEG-NP, где AUCadh в 1,6 раза больше, чем для NP. Кроме того, все препаративные формы ПЭГ-илированных наночастиц имеют более низкую степень выведения сцепленной фракции (kadh) и более длительное время пребывания (MRTadh) в сравнении с непокрытыми частицами. Поэтому DAP-PEG-NP проявляют более медленное выведение сцепленной фракции, чем для обычных частиц, свидетельствуя о длительно продолжающемся биоадгезивном потенциале этих наночастиц. Наблюдается, что все ПЭГ-илированные наночастицы проявляют длительное время пребывания (MRTadh) в желудочно-кишечном тракте. В отношении среднего времени пребывания сцепленной фракции (MRTadh) особый интерес представляет то, что все ПЭГ-илированные наночастицы проявляют значительно большее среднее время пребывания, чем NP. Поэтому эти наночастицы проявляют величины времени пребывания, на 17-48 мин большие, чем обычные частицы.
Параметры биоадгезии ПЭГ-илированных наночастиц, рассчитанные в соответствии с их распределением во всем желудочно-кишечном тракте в течение времени
Пример 7:
Визуализация ПЭГ-илированных наночастиц в слизистой оболочке желудочно-кишечного тракта
ПЭГ-илированные наночастицы визуализируют в слизистой оболочке желудочно-кишечного тракта посредством флуоресценции и оптической микроскопии. Для этого ПЭГ-илированные наночастицы маркируют флуоресцентными молекулами, такими как изоцианат родамина В (RBITC), и изотиоцианатом флуоресцеина (FITC). После орального введения крысам берут различные части кишечника и промывают солевым фосфатным буфером (рН 7,4; 0,15 М), как описано выше.
В первом случае сегменты кишечника (содержащие наночастицы, маркированные RBITC) фиксируют в среде Tissue-Tek® O.C.T. (Sakura, Holland) и замораживают посредством сухого льда и 2-метилбутана. Затем сегменты разрезают на отрезки по 5 мкм в криостате (Leica, Germany) при низкой температуре (-22°С). Полученные отрезки помещают на предметное стекло, покрытое поли-L-лизином (Sigma, Spain), и осматривают под флуоресцеиновым микроскопом (Olympus CH-40, Japan).
С другой стороны, отрезки кишечника (содержащие наночастицы, маркированные FITC) фиксируют в растворе формалина (4%) в течение 24 ч. После фиксации ткани заливают в парафин и затем разрезают на срезы 3 мкм. Эти срезы помещают на предметное стекло, покрытое Vectabond (Vector Labs, U.S.A.). Затем полученные срезы освобождают от парафина, регидратируют, и эндогенная пероксидаза блокируется посредством добавления раствора гидропероксида (3%) в течение 10 мин. Затем подложки промывают дистиллированной водой (5 мин), помещают в цитратный буфер (рН 6,0; 0,01 М), нагревают в микроволновой печи (15 мин при максимальной мощности и 15 мин при минимальной мощности), промывают водой и, наконец, Tris солевым буфером (TBS) (pН 7,36; NaCl 0,5М; 0,05 М). Для предотвращения неспецифической маркировки срезы инкубируют с нормальной козьей сывороткой (1:20, DAKO, USA) при комнатной температуре в течение 30 мин и затем со специфической антисывороткой (1:100 моноклональная сыворотка против FITC, M0878, DAKO, USA) при 4°С в течение 24 ч. После промывания Tris солевым буфером (TSB) образцы инкубируют с козьим анти-мышиным Ig вторичным антителом, соединенным с декстраном, маркированным пероксидазой (комнатная температура, 30 мин). Образцы промывают буфером TBS и активность пероксидазы проявляют раствором диаминобензидина. Срезы слабо контрастируются гематоксилином, их дегидрируют и устанавливают в DPX. Образцы, в конечном счете, осматривают под оптическим микроскопом (Nicon Eclipse E 800M, Japan).
На фиг. 11 показано присутствие PEG-NP в эпителиальных клетках тонкой кишки. Частицы в целом локализуются в верхушечном компартменте клеток (фиг. 11а), хотя можно наблюдать определенные фракции, которые проникли между клетками кишечного эпителия (фиг. 11b).
Интенсивное проникновение наночастиц в энтероциты можно наблюдать с помощью оптической микроскопии (фиг. 12). Как и при флуоресцентной микроскопии, наблюдается распределение в верхушечном компартменте клеток. С другой стороны, фиг. 12b также показывает распределение в базолатеральном компартменте. Наблюдается, что некоторые из ядер клеток включают маркер или маркированные наночастицы, что позволяет предположить, что применение этих наночастиц может представлять интерес для содействия доставки различных биологически активных молекул в ядро.
Наконец, на фиг. 13 показано распределение этих систем в клетках пейеровых бляшек. Особый интерес представляет наблюдение, что эти наночастицы, как представляется, концентрируются в области, известной как «купол» пейеровой бляшки. Купол характеризуется тем, что он представляет собой область, где накапливаются клетки моноцитарно-макрофагальной системы. Это позволяет утверждать об интересе этих ПЭГ-илированных наночастиц для разработки оральных вакцин и при иммунотерапии.
| название | год | авторы | номер документа |
|---|---|---|---|
| НАНОЧАСТИЦЫ ДЛЯ ИНКАПСУЛИРОВАНИЯ СОЕДИНЕНИЙ, ИХ ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ | 2015 |
|
RU2718922C2 |
| НАНОЧАСТИЦЫ, ВКЛЮЧАЮЩИЕ ЦИКЛОДЕКСТРИН И БИОЛОГИЧЕСКИ АКТИВНУЮ МОЛЕКУЛУ, И ИХ ПРИМЕНЕНИЕ | 2008 |
|
RU2460518C2 |
| КОМПОЗИЦИЯ, СТИМУЛИРУЮЩАЯ ИММУННЫЙ ОТВЕТ, СОДЕРЖАЩАЯ НАНОЧАСТИЦЫ НА ОСНОВЕ СОПОЛИМЕРА МЕТИЛВИНИЛОВОГО ЭФИРА МАЛЕИНОВОГО АНГИДРИДА | 2005 |
|
RU2379028C2 |
| ВОДОДИСПЕРГИРУЕМЫЕ ПЕРОРАЛЬНЫЕ, ПАРЕНТЕРАЛЬНЫЕ И МЕСТНЫЕ КОМПОЗИЦИИ ДЛЯ ПЛОХО РАСТВОРИМЫХ В ВОДЕ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ, ВКЛЮЧАЮЩИЕ УЛУЧШАЮЩИЕ ИХ СВОЙСТВА ПОЛИМЕРНЫЕ НАНОЧАСТИЦЫ | 2007 |
|
RU2492872C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ДОСТАВКИ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2009 |
|
RU2496482C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ УСТОЙЧИВОЙ ИММУНОТЕРАПИИ | 2014 |
|
RU2696876C2 |
| НАНОСОЕДИНЕНИЯ ПЛАТИНЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2010 |
|
RU2538199C2 |
| Коньюгат на основе магнитных наночастиц для терапии солидных опухолей и способ его получения | 2023 |
|
RU2830006C1 |
| МОДУЛЬНЫЕ ЧАСТИЦЫ ДЛЯ ИММУНОТЕРАПИИ | 2014 |
|
RU2672055C2 |
| КОМПОЗИЦИИ НА ОСНОВЕ НАНОЧАСТИЦ С УЛУЧШЕННЫМ ПРОНИКНОВЕНИЕМ ЧЕРЕЗ СЛИЗИСТЫЕ ОБОЛОЧКИ | 2013 |
|
RU2598627C2 |
Изобретение относится к медицине и касается наночастиц, включающих сополимер простого винилметилового эфира и малеинового ангидрида (PVM/MA) или его производные. Настоящее изобретение обеспечивает увеличенную биоадгезию и, как следствие, пролонгированное время удерживания при тесном контакте со слизистыми. 5 н. и 21 з.п. ф-лы, 13 ил., 10 табл.
1. ПЭГ-илированные наночастицы для переноса биологически активных молекул, включающие биологически разлагаемый полимер и полиэтиленгликоль или его производные, отличающиеся тем, что биологически разлагаемый полимер представляет собой сополимер простого винилметилового эфира и малеинового ангидрида (PVM/MA), а полиэтиленгликоль покрывает поверхность частиц биологически разлагаемого полимера PVM/MA.
2. Наночастицы по п.1, где сополимер имеет молекулярную массу в диапазоне от 100 до 2400 кДа, предпочтительнее, от 200 до 2000 кДа, особенно предпочтительно, от 180 до 250 кДа.
3. Наночастицы по п.1, где полиэтиленгликоль или его производные имеют молекулярную массу от 400 до 35000 Да.
4. Наночастицы по п.3, где полиэтиленгликоль выбран из группы полиэтиленгликолей, полипропиленгликолей, блок- или статистических сополимеров, включая 2 типа блоков, их смеси или их производные.
5. Наночастицы по п.4, где полиэтиленгликоль имеет, по меньшей мере, одну модифицированную концевую гидроксильную группу, предпочтительно, с алкокси-, акрилатной, метакрилатной, алкильной, амино-, фосфатной, изотиоцианатной, сульфгидрильной, меркапто- или сульфатной группой.
6. Наночастицы по любому из пп.1-5, где полиэтиленгликоль выбран из группы, образованной полиэтиленгликолем 2000, простым метиловым эфиром полиэтиленгликоля 2000, O,O'-бис-(2-аминоэтил)полиэтиленгликоля 2000, O,O'-бис-(2-аминопропил)полипропиленгликоль-полиэтиленгликоль-полипропиленгликоля 2000 или их смесей.
7. Наночастицы по п.1, где отношение массы полиэтиленгликоля к биологически разлагаемому полимеру составляет 1:2-6, предпочтительно, 1:2-4, предпочтительнее, примерно 1:4.
8. Наночастицы по п.1, включающие белок или пептид в качестве активной молекулы.
9. Наночастицы по п.1, включающие соединение, выбранное из группы, образованной ДНК, РНК, нуклеозидами, нуклеотидами, олигонуклеотидами или полинуклеотидами в качестве активной молекулы.
10. Наночастицы по п.1, включающие противоопухолевое средство или антиген для опухолей в качестве активной молекулы.
11. Наночастицы по п.1, включающие защитное средство центральной нервной системы или глюкокортикоид в качестве активной молекулы.
12. Наночастицы по п.1, включающие антиген для вакцинации или аллерген для иммунотерапии в качестве активной молекулы.
13. Фармацевтическая композиция, включающая ПЭГ-илированные наночастицы по любому из пп.1-12, вместе с эксципиентом, носителем или адъювантом.
14. Фармацевтическая композиция по п.13 для введения путем обеспечения доступа к слизистой оболочке организма, предпочтительно, орально, ректально, интраназально, вагинально или интраокулярно.
15. Фармацевтическая композиция по п.14 для орального введения.
16. Фармацевтическая композиция по п.14 для глазного введения.
17. Применение наночастиц по любому из пп.1-12 при изготовлении лекарственного средства.
18. Лиофилизат, включающий ПЭГ-илированные наночастицы по любому из пп.1-12.
19. Способ получения описанных ПЭГ-илированных наночастиц по любому из пп.1-12, включающий стадию одновременной инкубации полимера и полиэтиленгликоля в органическом растворителе перед десольватацией полимера водно-спиртовым раствором.
20. Способ по п.19, отличающийся тем, что концентрация биологически разлагаемого полимера составляет от 0,001 до 10% мас./об., а концентрация полиэтиленгликоля - от 0,001 до 5% мас./об.
21. Способ по п.19, отличающийся тем, что отношение органической фазы к фазе водно-спиртового раствора составляет от 1/1 до 1/10.
22. Способ по п.19, отличающийся тем, что он включает дополнительные стадии для удаления органических растворителей и/или очистки.
23. Способ по п.19, отличающийся тем, что активная молекула добавляется на стадии одновременной инкубации полимера и полиэтиленгликоля в органическом растворителе.
24. Способ по п.19, отличающийся тем, что активная молекула добавляется к водной суспензии уже сформированных наночастиц.
25. Способ по п.19, отличающийся тем, что включает дополнительную стадию лиофилизиации, необязательно, в присутствии криопротективного средства, предпочтительно, сахарозы или маннита.
26. Способ по п.20, где PVM/MA имеет молекулярную массу в диапазоне от 100 до 2400 кДа.
| ПРОТИВООПУХОЛЕВЫЕ НАНОЧАСТИЦЫ С МОДИФИЦИРОВАННОЙ ПОВЕРХНОСТЬЮ И СОДЕРЖАЩАЯ ИХ КОМПОЗИЦИЯ | 1993 |
|
RU2130781C1 |
| Arbos P | |||
| et al., "Influence of the surface characteristics of PVM/MA nanoparticles on their bioadhesive properties." J Control Release | |||
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| US 2002068090 A1, 06.06.2002 | |||
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
Авторы
Даты
2010-09-27—Публикация
2005-04-28—Подача