В последнее время все большее внимание ветеринарных врачей и эпидемиологов привлекают проблемы птичьего гриппа, африканской чумы свиней, листериоза.
Listeria monocytogenes - бактериальный патоген - возбудитель листериоза, тяжелого заболевания людей и животных, характеризующийся высокой смертностью. Причиной листериоза могут стать зараженные мясные, рыбные и молочные продукты, а также больные животные и люди. L. monocytogenes способна сохранять жизнеспособность и размножаться вне живого организма в пресной и морской воде, в почве, силосе, зараженном сточными водами или навозом.
Она способна сохранять жизнеспособность и размножаться в широком диапазоне температур (-18°С ÷ +75°С) и значений рН среды (4,4÷11,0), выдерживать замораживание, высушивание, присутствие соли (10-20%) и фенольных соединений коптильного дыма. У чувствительных людей листериоз могут вызвать всего 100 клеток L. monocytogenes, поэтому даже непродолжительный период хранения пищевого продукта с листериями при температуре бытового холодильника в течение 1,5-3 дней может сделать продукт опасным для здоровья.
Согласно СанПиН 2.3.2.1078-01 большинство отечественных рыбных продуктов должны соответствовать нормативу: «отсутствие L. monocytogenes в 25 г продукта», то есть содержать менее 1 клетки на 25 г продукта. Столь жесткие требования указывают на необходимость на предприятиях, даже с высоким санитарно-гигиеническим уровнем, ужесточения существующих в отрасли схем мойки и дезинфекции и поиска новых высокоэффективных дезинфицирующих средств [Л.Б.Мухина, Е.Ю.Дмитриева, Рыбное хозяйство, 2, 2005 г. «Заражение возбудителем листериоза рыбы, рыбной продукции и рыбоперерабатыващих производств»].
Африканская чума свиней, она же африканская лихорадка, восточноафриканская чума, болезнь Монтгомери. Впервые зарегистрирована в 1903 г. на юге Африки. На территорию России вирус занесен из Грузии.
Вирус африканской чумы свиней (АЧС) иммунобиологически отличается от вируса классической чумы свиней. Это ДНК-содержащий вирус семейства Iridoviridae, размер вириона 175-215 нм. Установлено несколько типов вируса АЧС [Я.Р.Коваленко, М.А.Сидоров, Л.Г.Бурба, «Африканская чума свиней» М., 1972].
Вирус очень устойчив во внешней среде - при комнатной температуре сохраняется до 3 месяцев. Прямые солнечные лучи разрушают вирус через 5-9 дней. В замороженном мясе сохраняется 5-6 месяцев, в солонине 80 дней.
К заболеванию восприимчивы домашние и дикие свиньи. Заражение происходит при контакте здоровых животных с больными. Инфекция распространяется через корм, пастбища, транспортные средства, загрязненные выделениями пораженных особей. Переносчиками вируса могут быть насекомые, хищные птицы и звери, собаки, но сами они не заражаются.
Инкубационный период длится 2-5 дней. Заболевание протекает молниеносно или остро и хронически. В первом случае животные гибнут внезапно, без характерных признаков. Во втором - повышается температура до 41,5-42°С, развивается одышка, кашель, пропадает аппетит, наступает рвота, возникает паралич. На коже живота, ушей, внутренней поверхности бедра возникают кровоизлияния, которые сливаются и образуют темно-багровые пятна, на 7-10 день животные погибают. Африканская чума не лечится, вакцина не разработана. Поэтому при заболевании свиней уничтожаются не только больные животные, но и те, которые были с ними в контакте.
Неблагополучные хозяйства или район немедленно закрываются на карантин. Всех свиней в эпизоотическом очаге в радиусе 5-20 км уничтожают бескровным способом. Трупы, навоз, остатки кормов и малоценный инвентарь сжигают, золу зарывают на глубину не менее 2 метров, смешивая ее с известью.
Помещения и территорию ферм дезинфицируют горячим 3% раствором едкого натрия, 2% раствором формальдегида. Разведение свиней в неблагополучном пункте разрешается не ранее чем через год после снятия карантина.
Вирусы гриппа (ВГ) типа А подтип H5N1 инфицируют различные виды птиц и млекопитающих, включая людей, лошадей, свиней, китов, тюленей и т.д. Они характеризуются высокой антигенной гетерогенностью поверхностных белков гемагглютинина (НА) и нейраминидазы (NA) и представлены согласно номенклатуре 15 подтипами НА и 9 NA. Средства специфической профилактики для ВГ тип A/H5N1 отсутствуют, то есть приготовление вакцины традиционным способом на куриных эмбрионах невозможно в связи с патогенностью вируса A/H5N1 для кур. В настоящее время проводят уничтожение зараженных птиц с последующим сжиганием.
Применяемые в нашей стране дезинфицирующие средства - хлор, хлорамины, гипохлорит, нейтральный аналит АНК, теряют свою эффективность в процессе хранения (хлор 20-30% ежемесячно), являются сильными аллергенами, требуют использования защитной спецодежды и респираторов для персонала.
Исследования, проведенные в лабораториях различных стран, доказали, что на сегодняшний день препарат vibrex (стабилизированный диоксид хлора, разработанный компанией Agranco Corp., USA) является лучшим по своей эффективности. Он в 260 раз эффективнее хлора и в 10 раз более стабилен, не рассеивается, менее токсичен, чем хлор.
В качестве дезинфицирующих средств изучены и четвертичные аммониевые основания [J.Shiral, T.Karmo, T.Ivone, J. vet. Med. Sci., 1997, 59, 5, р.318-232. J. Vet. Med. Sci., 2000, 62, р.85-92]. Было установлено, что спектр их активности ограничен и распространяется на вирусы группы А и преимущественно - на оболочечные вирусы. Кроме того, они не обладают бактерицидной активностью [D.J.Jefferey. Rev. Sci. Tech. Off. Int. Epiz., 1995, 14, p.57-74].
Учитывая изложенное, поиск новых отечественных высокоэффективных дезинфицирующих средств, обладающих низкой токсичностью, пониженными аллергическими свойствами, не теряющих свою активность длительное время, остается весьма актуальной задачей, что послужило целью данного исследования.
Авторами настоящего изобретения была установлена вирулицидная, бактерицидная и дезинфицирующая активность хлорида 1-гексадецил-R-(-)-3-окси-1-азониабицикло[2.2.2]октана (далее просто вещество). Вещество относится к кватернатам оптически активных бициклических аминоспиртов. Представляет собой хиральное органическое вещество, структурная формула (см. фиг.1).
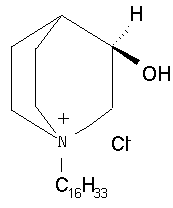
Фиг.1 Структурная схема хирального органического вещества.
Вещество характеризуется низкой токсичностью, не оказывает токсического воздействия на системы жизнеобеспечения лабораторных животных, не вызывает гипертермических реакций у животных, не оказывает аллергизирующего действия и не обладает кумулятивным эффектом.
Хорошо растворяется в воде, образуя растворы нейтрального характера. Вещество высокостабильно в водных растворах, не требует особых условий транспортирования и хранения, сохраняет свою биологическую активность более трех лет. Способ получения хлорида 1-гексадецил-R-(-)-3-окси-1-азониабицикло[2.2.2]октана описан [патент на изобретение RU №2321589, 2005 г.]. Наиболее близким по спектру биологической активности для него является препарат vibrex, который может рассматриваться в качестве его прототипа.
Исследования in vitro.
Испытания проводили в соответствии с «Методами испытаний дезинфекционных средств для оценки их безопасности и эффективности», М., 1998, утвержденными Главным Государственным санитарным врачом РФ и «Методическими указаниями по отбору, оценке и испытаниям антивирусного и антибактериального действия химических соединений», М., 2004 г., с использованием микроорганизмов различных таксономических групп.
Оцениваемые показатели.
- Минимальная вирулицидная концентрация в отношении вируса гриппа А подтип H5N1 (семейство Ортомиксовирусы), вируса энтеровирусного энцефаломиелита свиней - болезни Тешена (семейство Пикорновирусы) - РНК-содержащие вирусы, вируса миксомы кроликов (семейство Поксвирусы) и африканской чумы свиней - ДНК-вирусы;
- Минимальная бактерицидная концентрация в отношении возбудителей листериоза, сибирской язвы (грамположительные бактерии) и колибактериоза (грамотрицательная микрофлора);
- Минимальная спороцидная концентрация в отношении Bacillus anthraces в споровой форме;
- дезинфицирующее действие на тест-объектах в отношении грамотрицательной (Escherichia coli) и грамположительной (Listeria monocytogenes) микрофлоры.
Изучение вирулицидной активности вещества.
Вирулицидное (инактивирующее) действие изучали в отношении вируса гриппа А птиц подтипа H5N1/05 (ВГП) на 10-дневных развивающихся куриных эмбрионах (КЭ).
Готовили растворы вещества разведения 2000 мкг/мл и 1000 мкг/мл. К одному мл раствора добавляли 1 мл ВГП с титром 9,0 lgЭЛД50 (50%-ная эмбриональная летальная доза).
Инкубировали в течение 18 ч при t=18°C, одновременно с контролем вируса, к которому вместо вещества добавили физиологический раствор. По окончании инкубации смеси титровали на КЭ по общепринятой методике. Активность инактивирующего действия вещества определяли по разнице титров вирусов в опыте и контроле и выражали в lgЭЛД50.
Вирулицидное (инактивирующее действие) в отношении вируса миксомы кроликов (МК) изучали на перевиваемой культуре клеток почки крольчонка RK-13 (КК RK-13). Готовили растворы вещества разведения 2000 мкг/мл и 1000 мкг/мл. К 1 мл раствора добавляли 1 мл вируса МК с титром 7,25 lgTЦД50 (50%-ная тканевая цитотоксическая доза). Перемешивали и инкубировали 18 часов при t=37°С. Одновременно инкубировали контроль вируса, к которому вместо вещества добавляли культуральную поддерживающую среду.
Вирулицидное (инактивирующее) действие изучали в отношении вируса болезни Тешена (ВБТ) на перевиваемой культуре клеток почки сибирского горного козерога (ПСГК). Для определения вирулицидной активности вещества готовили разведение 500, 250 и 125 мкг/мл. К 1 мл раствора вещества добавляли 1 мл вируса ВБТ с титром 8,0 lgTЦД50 (50% тканевая цитопатическая доза), получая исходную концентрацию вещества 250, 125 и 62,5 мкг/мл. Тщательно перемешивали и инкубировали при температуре 37°С в течение 15, 30 и 60 мин одновременно с контролем вируса, к которому вместо вещества добавляли культуральную поддерживающую среду. По окончании инкубации смеси титровали на ПСГК по общепринятой методике с 10x шагом параллельно с контролем. Активность инактивирующего действия определяли по разнице титров вирусов в опыте и контроле и выражали в lgTЦД50.
Вирулицидное (инактивирующее) действие изучали в отношении вируса африканской чумы свиней (АЧС) на первичной культуре клеток костного мозга свиней (ККМС). Для определения вирулицидной активности вещества готовили разведение 500, 250 и 125 мкг/мл. К 1 мл раствора вещества добавляли 1 мл вируса АЧС с титром 7,0 lgГAE50 (50% гемадсорбирующая единица), получая исходную концентрацию вещества 250, 125 и 62,5 мкг/мл. Тщательно перемешивали и инкубировали при комнатной температуре в течение 15, 30 и 60 мин одновременно с контролем вируса, к которому вместо вещества добавляли культуральную поддерживающую среду. По окончании инкубации смеси титровали на ККМС по общепринятой методике с 10х шагом параллельно с контролем. Активность инактивирующего действия определяли по разнице титров вирусов в опыте и контроле и выражали в lgГAE50.
Активность инактивирующего действия определяли по разнице титров вирусов в опыте и контроле и выражали в lgТЦД50.
Изучение антимикробной активности вещества.
В ходе экспериментов по испытанию антибактериального действия вещества определяли минимальную бактериостатическую (ингибирующую) концентрацию (МИК) и минимальную бактерицидную концентрацию (МБК), которые выражали в мкг/мл.
Посевная концентрация возбудителей колибактериоза, листериоза составляла 106 КОЕ/мл, а сибирской язвы - 106 спор/мл.
Для определения антимикробной активности вещества в отношении вегетативной формы B. anthraces микробную взвесь готовили следующим образом: концентрацию клеток в смыве суточной агаровой культуры доводили до 10 ед. оптической плотности (ОСО), затем ее разводили в 100 раз. В одном мл каждого разведения вещества засевали 0,3 мл суспензии.
Изучение дезинфицирующей активности вещества.
В ходе испытаний дезинфицирующей активности вещества на поверхность тест-объектов (металл, стекло и транспортная лента) площадью 25 см2 наносили по 0,1 мл взвеси культур Escherichia coli 0157:Н7 и Listeria monocytogenes 766 (1010 КОЕ/мл) и оставляли до полного высыхания.
На стерильной водопроводной воде готовили разведения вещества с концентрацией 2,0÷0,0156%, дезинфекцию зараженных модельных поверхностей веществом осуществляли методом орошения, путем нанесения 0,75 мл (0,3 да3/м2) каждого из разведений испытуемого вещества.
Отбор смывов с тест-поверхностей проводили через 15 мин, 30 мин, 1 и 3 часа.
На контрольные тест-объекты наносили по 0,75 стерильной водопроводной воды. Посевы смывов проводили на чашки Петри с дрожжевым тритон-соевым агаром (ДТСА). Посевы инкубировали при 37°С в течение 48 часов.
Учет результатов проводили по наличию (отсутствию) характерного роста микроорганизма на ДТСА.
Результаты исследований приведены в таблицах №1, 2 и 3.
Из табл.1 следует, что вещество полностью инактивирует вирус гриппа А подтип H5N1/05 при концентрации 1000 мкг/мл (0,1%-ный раствор), а вирус МК при концентрации 500 мкг/мл (0,05%-ный раствор).
Из данных, представленных в табл.2 следует, что вещество в концентрации 62,5 мкг/мл (0,006% раствор) и экспозиции 15 мин полностью инактивирует вирусы африканской чумы свиней и болезни Тешена.
Из табл.3 следует, что бактериостатическая активность для представителей грамотрицательной микрофлоры (Escherichia coli) составляла 0,004 мг/мл, а для грамположительной флоры - 0,002 и менее мг/мл.
Бактерицидная активность в отношении энтеропатогенного штамма Escherichia coli серотипа 0157:H7 составила 0,0195 мг/мл, и для Listeria monocytogenes 766 - 0,009 мг/мл, что более чем в пять раз превосходит по эффективности лучший препарат на сегодняшний день - vibrex, производимый в США.
Из данных табл.4 видно, что вещество обладает выраженной дезинфицирующей активностью в отношении Escherichia coli серотипа 0157:Н7 и Listeria monocytogenes штамм 766 на тест-поверхностях из нержавеющей стали, стекла и резины. В концентрации 0,125% и экспозиции 15 мин происходит полное обеззараживание исследуемых тест-объектов, зараженных в дозе 109 мс.т/25см2 культурами Escherichia coli серотипа 0157:Н7 и Listeria monocytogenes штамм 766.
В результате проведенных исследований установлено:
1. Хлорид 1-гексадецил-R-(-)-3-окси-1-азониабицикло[2.2.2]октана в концентрации 0,1% полностью инактивирует вирус гриппа А птиц подтипа H5N1 (РНК-содержащий вирус), а в концентрации 0,006% полностью инактивирует вирусы африканской чумы свиней (ДНК-содержащий вирус) и вирусы энтеровирусного энцефалита свиней - болезни Тешена (РНК-содержащий вирус).
В концентрации 0,05% - инактивирует вирус миксомы кролика (ДНК-содержащий вирус).
2. Бактериостатическая активность вещества находилась в пределах 0,009÷0,078 мг/мл в зависимости от используемой тест-культуры.
3. Концентрация 0,125% по действующему веществу и экспозиции 15 мин обеспечивает полное обеззараживание исследованных тест-объектов.
Полученные результаты свидетельствуют о перспективности применения вещества в качестве эффективного дезинфицирующего противоинфекционного средства.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРЕПАРАТ "ТЕОТРОПИН" ДЛЯ ДЕЗИНФЕКЦИИ ОБЪЕКТОВ САНИТАРНОГО НАДЗОРА | 1997 |
|
RU2123337C1 |
| СРЕДСТВО ДЛЯ ДЕЗИНФЕКЦИИ ОБЪЕКТОВ ВЕТЕРИНАРНОГО НАДЗОРА | 2011 |
|
RU2455980C1 |
| КОМПОЗИЦИЯ ДЛЯ ДЕГАЗАЦИИ ОТРАВЛЯЮЩИХ ВЕЩЕСТВ И ДЕЗИНФЕКЦИИ ОБЪЕКТОВ САНИТАРНОГО НАДЗОРА | 2006 |
|
RU2322265C1 |
| ШТАММ КЛЕТОК E.coli BL21(DE3)pLysS, КЛОН pTT9/ASFVp30, СОДЕРЖАЩИЙ РЕКОМБИНАНТНУЮ ПЛАЗМИДУ СО ВСТРОЙКОЙ УЧАСТКА ГЕНА СР204L ВИРУСА АФРИКАНСКОЙ ЧУМЫ СВИНЕЙ, КОДИРУЮЩЕГО КОНФОРМАЦИОННЫЙ ЭПИТОП БЕЛКА p30, ДЛЯ ИЗГОТОВЛЕНИЯ ДИАГНОСТИЧЕСКИХ ПРЕПАРАТОВ | 2011 |
|
RU2463343C1 |
| КОМПОЗИЦИЯ ДЛЯ ДЕГАЗАЦИИ ОТРАВЛЯЮЩИХ ВЕЩЕСТВ И ДЕЗИНФЕКЦИИ ОБЪЕКТОВ САНИТАРНОГО НАДЗОРА | 2009 |
|
RU2402351C1 |
| СПОСОБ ПОЛУЧЕНИЯ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ К БЕЛКУ Р30 ВИРУСА АФРИКАНСКОЙ ЧУМЫ СВИНЕЙ С ИСПОЛЬЗОВАНИЕМ РЕКОМБИНАНТНЫХ КОНСТРУКЦИЙ | 2013 |
|
RU2534343C1 |
| ДЕЗИНФИЦИРУЮЩЕЕ СРЕДСТВО-"ДЕЗАНТ" | 2004 |
|
RU2273495C1 |
| АДАМАНТИЛАМИДЫ СЕРОСОДЕРЖАЩИХ КИСЛОТ И ИХ ПРОТИВОГРИППОЗНАЯ АКТИВНОСТЬ | 2015 |
|
RU2617850C1 |
| ДЕЗИНФИЦИРУЮЩЕЕ СРЕДСТВО "МИКСАМИН" | 2010 |
|
RU2423998C1 |
| СПОСОБ ФОТОИНАКТИВАЦИИ ВИРУСА ГРИППА А ПТИЦ ПОДТИПА H5N1 | 2007 |
|
RU2357770C1 |
Изобретение относится к области медицины и ветеринарии, а именно к дезинфицирующим средствам против вирусных и бактериальных инфекций. Средство, обладающее вирулицидным, бактерицидным и дезинфицирующим действием, проявляющее активность в отношении вируса гриппа А подтип H5N1, вируса болезни Тешена, вируса миксомы кролика, вируса африканской чумы свиней, бактерии Listeria monocytogenes представляет собой хлорид-1-гексадецил-R-(-)-3-окси-1-1-азониабицикло[2.2.2]октана. Изобретение обеспечивает повышение эффективности дезинфекции. 4 табл.
Средство, обладающее вирулицидным, бактерицидным и дезинфицирующим действием, проявляющее активность в отношении вируса гриппа А подтип H5N1, вируса болезни Тешена (РНК-содержащие вирусы), вируса миксомы кролика, вируса африканской чумы свиней (ДНК-содержащие вирусы), бактерии Listeria monocytogenes, характеризующееся тем, что оно представляет собой хлорид-1-гексадецил-R-(-)-3-окси-1-1-азониабицикло[2.2.2]октана.
| J.SHIRAL et al | |||
| J | |||
| vet | |||
| Med | |||
| Sci | |||
| Электрическое сопротивление для нагревательных приборов и нагревательный элемент для этих приборов | 1922 |
|
SU1997A1 |
| RU 229661 C2, 10.11.2006 | |||
| СПОСОБ ПОЛУЧЕНИЯ БРОМИДА 1-ГЕКСАДЕЦИЛ-R(-)-3-ОКСИ-1-АЗОНИАБИЦИКЛО[2.2.2]ОКТАНА-ИММУНОМОДУЛЯТОРА С ПРОТИВООПУХОЛЕВЫМИ, БАКТЕРИОСТАТИЧЕСКИМИ И АНТИАГРЕГАНТНЫМИ СВОЙСТВАМИ | 2005 |
|
RU2321589C2 |
| СПОСОБ СПЕКТРАЛЬНОЙ СЕНСИБИЛИЗАЦИИ ОСОБОМЕЛКОЗЕРНИСТЫХ БРОМИОДСЕРЕБРЯНЫХ ФОТОГРАФИЧЕСКИХ ЭМУЛЬСИЙ ДЛЯ АМПЛИТУДНО-ФАЗОВЫХ ГОЛОГРАММ | 1987 |
|
RU2035761C1 |
Авторы
Даты
2010-11-10—Публикация
2009-07-07—Подача