СВЯЗАННЫЕ ЗАЯВКИ
Эта заявка представляет собой не являющуюся предварительной заявку, поданную в соответствии с правилом 1.53(b)(1) статьи 37 CFR, по которой, в соответствии с правилом 119(е) статьи 35 USC, испрашивается приоритет по предварительной заявке номер 60/591339, поданной 26 июля 2004, содержание которой включено в данный документ в качестве ссылки.
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение в основном относится к областям молекулярной биологии и регуляции ростовых факторов. Более конкретно, изобретение относится к модуляторам пути передачи сигнала HGF/c-met и применениям указанных модуляторов.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ
Гепсин (также известный как TMRPRSS1) представляет собой экспрессируемую на клеточной поверхности сериновую протеазу, подобную химотрипсину, и является представителем семейства трансмембранных сериновых протеаз типа II (TTSP), которое также включает в себя матриптазу (также известную как MT-SP1) и энтеропептидазу [1]. Человеческий ген гепсина, расположенный на хромосоме 19 в q11-13,2 [2], кодирует полипептид из 417 аминокислот [3], содержащий короткий N-концевой цитоплазматический конец, трансмембранную область и внеклеточный домен (Arg45 - Leu417), состоящий из богатого цистеином домена фагоцитарного рецептора (домен SRCR) и протеазного домена. Профермент гепсина аутокаталитически активируется посредством расщепления по Arg162 - Ile163 [4], формируя гетеродимерный фермент с протеазным доменом, дисульфидной связью (Cys153-Cys277) связанным с доменом SRCR. Кроме ковалентной связи Cys-Cys, в недавно определенной кристаллической структуре гепсина выявили, что домен SRCR и протеазный домен обладают общей обширной областью контакта, приблизительно по 1200Å2 каждого домена [5]. Так как эта область контакта расположена вблизи проксимальных относительно мембраны остатков домена SRCR, протеазный домен и активный центр гепсина могут располагаться вблизи клеточной поверхности (5). Это в корне отличается от других расположенных на клеточной поверхности сериновых протеаз, таких как факторы свертывания VIIa (FVIIa)1, IXa и Xa, активные центры которых расположены намного выше (60-80 Å) мембранной поверхности [6-8].
Физиологическая функция гепсина неясна. За исключением фактора свертывания VII, макромолекулярные субстраты не известны и физиологически значимые ингибиторы не идентифицированы. Роль гепсина в свертывании крови была предложена Kazama et al. (1995) [9], которые показали, что трансфицированные гепсином клетки могут активировать фактор свертывания VII. Однако мыши с дефицитом гепсина были жизнеспособными и у них не выявляли нарушений свертывания крови [10, 11], что вызывает сомнения относительно роли гепсина в нормальном гемостазе. Однако возможно, что гепсин может вносить вклад в формирование фибрина в патологических ситуациях, таких как почечно-клеточная карцинома [12], где первичный инициатор свертывания крови, тканевой фактор [13, 14], отсутствует. Кроме того, в других исследованиях предполагается функциональная связь между гепсином и клеточным ростом. Сообщалось, что в зависимости от линии опухолевых клеток и используемых экспериментальных условий, гепсин обладал стимулирующим рост [15] или супрессирующим рост [16] действием. Дополнительную информацию относительно гепсина можно найти, в частности, в публикации PCT № WO2004/009803; патенте США № 6482630; патенте США № 6423543; патенте США № 5981830; публикации патентной заявки США № 2004/0009911 A1; публикации патентной заявки США № 2004/0001801 A1; публикации патентной заявки США № 2003/0223973 A1; публикации патентной заявки США № 2003/0175736 A1; публикации патентной заявки США № 2003/0013097 A1 (также WO02/059373); публикации патентной заявки США № 2003/0049645 (также WO02/064839) и публикации патентной заявки США № 2004/0132156.
Недавние эксперименты по генной экспрессии идентифицировали гепсин как один из наиболее высоко активированных генов при раке предстательной железы [17-22]. Окрашивание in situ выявило экспрессию гепсина на эпителиальных клетках предстательных желез [19]. Экспрессия гепсина коррелирует с неопластической трансформацией [19], являясь наивысшей в опухолях пациентов с тяжелой формой заболевания и наименьшей при доброкачественной гиперплазии [18, 22]. В отличие от этого, в одном из исследований обнаружили, что низкая экспрессия белка гепсина коррелирует с высокими показателями по Глисону и большими опухолями [20]. Связано ли это очевидное противоречие с применяемыми методами, т.е. иммуногистохимия [20], в отличие от подсчета РНК [18, 22], неясно. Кроме того, гепсин также сильно активирован при раке яичника [23] и при почечно-клеточной карциноме, где он в основном ассоциирован с клетками эпителиального типа [12].
На поверхности эпителиальных клеток гепсин идеально расположен для взаимодействия с компонентами внеклеточного матрикса и другими ассоциированными с мембраной белками. Известно, что подобные химотрипсину сериновые протеазы, включая матриптазу TTSP (синоним MT-SP1) [24, 25], которая структурно родственна гепсину, активируют фибринолитические ферменты, матриксные металлопротеиназы и латентные формы факторов роста, таких как фактор роста гепатоцитов (HGF). HGF стимулирует клеточную пролиферацию, миграцию, ангиогенез, выживаемость и морфогенез посредством активации рецепторной тирозинкиназы Met (рассмотрено в [26, 27]). Кроме его важного значения в нормальной физиологии, путь HGF/Met вовлечен в инвазивный рост опухоли и опухолевое метастазирование [26]. HGF обладает высоким сходством с сериновой протеазой плазминогеном и состоит из α-цепи, содержащей N-концевой домен и четыре домена "kringle" и β-цепи с гомологией с подобными химотрипсину протеазами. Он секретируется во внеклеточный матрикс в виде неактивного одноцепочечного предшественника (про-HGF) и требует активирующего расщепления по Arg494-Val495 для формирования биологически компетентного, связанного дисульфидной связью гетеродимера α/β [28-31]. Эта стадия опосредована конвертирующими про-HGF сериновыми протеазами, такими как активатор фактора роста гепатоцитов (HGFA) [32], матриптаза [33, 34], активатор плазминогена урокиназного типа (u-PA) [35], фактор XIIa [36], фактор XIa и плазматический калликреин [34]. HGFA и матриптаза ингибируются экспрессируемыми на клеточной поверхности ингибиторами типа Кунитца, такими как два варианта сплайсинга ингибитора активатора фактора роста гепатоцитов HAI-1 [37, 38] и HAI-1B [34], и посредством HAI-2 [39]. HAI-2 (также известный как плацентарный бикунин) [40] также сильно ингибирует фактор XIa и плазматический калликреин [41], тогда как HAI-1B обладает слабой ингибирующей активностью или вовсе ею не обладает [34]. Таким образом, биологическая доступность пула про-HGF во внеклеточном матриксе регулируется активностью конвертаз про-HGF и их ингибиторов.
Профиль экспрессии гепсина в тканях злокачественных опухолей, как описано выше, связанный с его возможной ролью в действии в качестве регулятора других факторов роста, нарушение регуляции которых может лежать в основе канцерогенеза, позволяет предположить, что модуляция взаимодействия гепсина с его субстратом может оказаться эффективным терапевтическим подходом. В этом отношении существует очевидная необходимость идентифицировать физиологический субстрат гепсина и/или его физиологический модулятор(ы). Изобретение соответствует этой необходимости и предоставляет другие преимущества.
Все цитируемые в данном документе ссылки, включающие в себя патентные заявки и публикации, включены в данный документ в качестве ссылки в полном объеме.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Как описано в данном документе, физиологическим субстратом для гепсина, белка клеточной поверхности, сильно сверхэкспрессированного при множестве злокачественных опухолей, является фактор роста гепатоцитов, в отношении которого известно, что он играет важную роль во многих аспектах развития злокачественной опухоли. В данном документе показано, что гепсин расщепляет про-HGF с активностью, сравнимой с мощной физиологической конвертазой про-HGF, HGFA (активатор фактора роста гепатоцитов). Двухцепочечный (активированный) HGF, образуемый гепсином, проявляет нормальную биологическую активность, включающую в себя индукцию фосфорилирования тирозина Met, стимуляцию клеточной пролиферации и стимуляцию клеточной миграции. Кроме того, в данном документе, в качестве физиологических регуляторов ферментативной активности гепсина, идентифицированы два содержащих домены Кунитца ингибитора, HAI-1B и HAI-2. Изобретение относится к способам и композициям, основанным, по меньшей мере частично, на этих открытиях, которые ниже описаны более подробно. Показано, что гепсин и его взаимодействие с HGF и/или его физиологическими ингибиторами может являться уникальной и эффективной мишенью для более точной регулировки в разработке профилактических и/или терапевтических подходов для противодействия патологическим состояниям, ассоциированным с аномальной или нежелательной передачей сигнала по пути HGF/Met (также обозначаемому как "c-met"). Таким образом, изобретение относится к способам, композициям, наборам и готовым изделиям для идентификации и для использования веществ, способных к модуляции пути HGF/c-met посредством модуляции физиологических взаимодействующих молекул, вовлеченных в регуляцию активации HGF.
Таким образом, в одном из аспектов изобретение относится к способу скрининга (или идентификации) возможного ингибирующего вещества (т.е. антагониста), ингибирующего активацию HGF гепсином, где указанный способ включает в себя: (a) приведение вещества-кандидата в контакт с первым образцом, содержащим гепсин и субстрат про-HGF, и (b) сравнение степени активации субстрата про-HGF в образце со степенью активации субстрата про-HGF в эталонном образце, содержащем равные с первым образцом количества гепсина и субстрата про-HGF, но не контактировавшим с указанным веществом-кандидатом, в соответствии с чем уменьшение степени активации субстрата про-HGF в первом образце по сравнению с эталонным образцом означает, что вещество-кандидат способно ингибировать активацию гепсином одноцепочечного HGF (про-HGF). В одном варианте осуществления гепсин в образце находится в количестве эффективном для активации указанного про-HGF. Субстрат про-HGF, пригодный для использования в этих способах, может находиться в ряде форм, при условии, что он воспроизводит свойство участка расщепления гепсином на про-HGF. Примеры субстрата про-HGF включают в себя в качестве неограничивающих примеров полноразмерный одноцепочечный HGF, содержащий форму пептидной связи R494-V495 дикого типа, и любой фрагмент HGF, содержащий эту пептидную связь. Такой фрагмент может быть любой длины, например, длиной по меньшей мере (приблизительно) 5, 7, 10, 15, 20, 25 аминокислот или длиной (приблизительно) от 4 до 25, от 5 до 20, от 7 до 15 аминокислоты. Как правило и предпочтительно, субстрат про-HGF содержит пептидную связь R494-V495, способную к расщеплению под действием гепсина дикого типа. В одном варианте осуществления субстрат про-HGF содержит участок расщепления человеческого HGF, соответствующий консенсусному участку расщепления протеаз (т.е. основный остаток в положении P1 и два гидрофобных аминокислотных остатка в положениях P1' и P2': P1 - R494, P1' - V495, P2' - V496).
В другом аспекте изобретение относится к способу скрининга субстрата, блокирующего активацию про-HGF гепсином, где указанный способ включает в себя скрининг субстрата, связывающего (предпочтительно, но не обязательно, специфически) гепсин или про-HGF и блокирующего специфическое взаимодействие (например, связывание) гепсина и про-HGF. В некоторых вариантах осуществления вещество конкурирует с гепсином за связывание с HGF. В некоторых вариантах осуществления вещество конкурирует с про-HGF за связывание с гепсином. В одном варианте осуществления вещество содержит, состоит или по существу состоит из аминокислотной последовательности, по меньшей мере приблизительно с 60%, 70%, 80%, 90%, 95%, 99% сходства или идентичности последовательности по отношению к про-HGF (например, человеческому), например, фрагмент человеческого HGF, содержащий аминокислотные остатки 494 (Arg), связанные пептидной связью с 495 (Val). В некоторых вариантах осуществления, где вещество содержит, состоит или по существу состоит из такой аминокислотной последовательности, фрагмент мутирован или лишен по меньшей мере части бета-цепи HGF, так что указанный фрагмент обладает уменьшенным активирующим c-met действием по сравнению с HGF дикого типа.
Как очевидно специалисту в данной области, анализы скрининга, соответствующие описанным выше анализам, также могут включать в себя первую стадию скрининга на основе показателей формирования комплекса гепсин-HGF для получения первой группы возможных модулирующих веществ, с последующей второй стадией скрининга на основе способности первой группы возможных модулирующих веществ модулировать активацию HGF и/или конверсию HGF в форму, способную активировать путь HGF/c-met. Подходящие показатели могут быть любыми, которые очевидны специалисту в данной области на основе знания о формировании фермент-субстратного комплекса и/или биологической активности, связанной с путем передачи сигнала HGF/c-met. Формирование фермент-субстратного комплекса можно измерять, например, с применением обычных биохимических анализов (например, гель-электрофорез, хроматография, ЯМР и т.д.). Виды биологической активности HGF/c-met включают в себя в качестве неограничивающих примеров фосфорилирование C-met, фосфорилирование клеточных молекул, являющихся субстратами киназы C-met, рост клеток (пролиферация, выживаемость и т.д.), ангиогенез, клеточная миграция, морфогенез клеток и т.д.
В одном из аспектов изобретение относится к антагонистам HGF/c-met, нарушающим путь передачи сигнала HGF/c-met. Например, изобретение относится к молекуле, ингибирующей расщепление про-HGF гепсином (например, расщепление в положении R494-V495). Молекула может осуществлять свое ингибирующее действие целым рядом способов, включая, в качестве неограничивающих примеров, связывание или с гепсином или с про-HGF, так, что ингибируется расщепление про-HGF гепсином, связывание с комплексом гепсин-про-HGF, так, что ингибируется расщепление про-HGF, и/или связывание с про-HGF или гепсином (по одному или в комплексе), так, что ингибируются эффекты расщепления HGF гепсином (например, ингибирование высвобождения HGF после расщепления гепсином). В одном варианте осуществления молекула-антагонист согласно изобретению не ингибирует связывание HGF с c-met. Например, в одном из вариантов осуществления молекула-антагонист согласно изобретению не является антителом или его фрагментом, обладая сходной ингибирующей и/или связывающей способностью как антитело, продуцируемое гибридомной клеточной линией, депонированной под инвентарным номером American Type Culture Collection ATCC HB-11894 (гибридома 1A3.3.13) или HB-11895 (гибридома 5D5.11.6). В одном из вариантов осуществления молекула-антагонист согласно изобретению ингибирует биологическую активность, связанную с активацией HGF/c-met.
В одном из аспектов антагонист согласно изобретению получают на основании описанного в данном документе открытия, что ингибиторы активатора фактора роста гепатоцитов (HAI-1, HAI-1B, HAI-2) являются мощными ингибиторами активации про-HGF гепсином. В одном из вариантов осуществления изобретение относится к антагонисту активации про-HGF гепсином, где указанный антагонист содержит по меньшей мере часть человеческого HAI-1, HAI-1B или HAI-2 (включая и полноразмерные). В одном из вариантов осуществления указанная часть содержит последовательность домена Кунитца (KD), способную к ингибированию активации про-HGF под действием гепсина. В одном из вариантов осуществления указанная последовательность домена Кунитца представляет собой домен Кунитца 1 (KD1) HAI-1 или HAI-1B. В одном из вариантов осуществления антагонист согласно изобретению содержит вариант последовательности KD1, по меньшей мере приблизительно с 70%, 75%, 80%, 85%, 90%, 95%, 97%, 98%, 99% идентичности последовательности с KD1 дикого типа человеческого HAI-1, где указанный вариант последовательности обладает по меньшей мере сопоставимую с KD1 дикого типа способность ингибировать расщепление человеческого про-HGF под действием гепсина. В одном из вариантов осуществления антагонист согласно изобретению содержит вариант последовательности KD1 с идентичностью последовательности с KD1 дикого типа человеческого HAI-1 приблизительно от 70% до 99%, приблизительно от 75% до 98%, приблизительно от 80% до 97%, от 85% до 95%, где указанная последовательность обладает по меньшей мере сопоставимую с KD1 дикого типа способность ингибировать расщепление гепсином человеческого про-HGF. В одном из вариантов осуществления указанная последовательность домена Кунитца представляет собой один или оба домена Кунитца HAI-2. В одном из вариантов осуществления антагонист согласно изобретению содержит вариант последовательности домена Кунитца HAI-2, по меньшей мере приблизительно с 70%, 75%, 80%, 85%, 90%, 95%, 97%, 98%, 99% идентичности последовательности с соответствующим доменом(ами) Кунитца дикого типа человеческого HAI-2, где указанный вариант последовательности обладает по меньшей мере сопоставимую с HAI-2 дикого типа способностью ингибировать расщепление гепсином человеческого про-HGF. В одном из вариантов осуществления антагонист согласно изобретению содержит вариант последовательности домена Кунитца HAI-2 с идентичностью последовательности соответствующему домену(ам) Кунитца дикого типа человеческого HAI-2 приблизительно от 70% до 99%, приблизительно от 75% до 98%, приблизительно от 80% до 97%, от 85% до 95%, где указанная последовательность обладает по меньшей мере сопоставимую с HAI-2 дикого типа способность ингибировать расщепление гепсином человеческого про-HGF.
В некоторых вариантах осуществления антагонист согласно изобретению представляет собой или содержит низкомолекулярное соединение, пептид, антитело, фрагмент антитела, аптамер или их сочетание. Как описано в данном документе антагонисты можно получать обычным способом с применением известных в данной области способов (включая описанные более подробно ниже) на основе открытия взаимодействия гепсина, ингибиторов активатора фактора роста гепатоцитов и про-HGF, как описано в данном документе. Например, в некоторых вариантах осуществления антагонист согласно изобретению конкурирует с гепсином за связывание с HGF, но не обладает способностью расщеплять про-HGF в участке расщепления гепсина. В некоторых вариантах осуществления антагонист согласно изобретению конкурирует с про-HGF за связывание с гепсином. Например, в одном из вариантов осуществления указанный антагонист содержит, состоит или по существу состоит из аминокислотной последовательности, по меньшей мере приблизительно с 60%, 70%, 80%, 90%, 95%, 98%, 99% сходства или идентичности последовательности относительно про-HGF (например, человеческого) и способен в значительной степени связывать гепсин, но у него отсутствует участок расщепления гепсина (например, участок P1, содержащий пептидную связь человеческого HGF дикого типа R494-V495) и/или он лишен способности активировать c-met (например, там, где мутирована β-цепь HGF, отсутствует β-цепь HGF или ее часть и т.д.). В одном из вариантов осуществления антагонист согласно изобретению содержит, состоит или по существу состоит из фрагмента HGF, способного связывать гепсин, где указанный фрагмент лишен по меньшей мере части β-цепи HGF, так, что указанный фрагмент обладает уменьшенным активирующим c-met действием по сравнению с HGF дикого типа.
Таким образом, изобретение относится к мутантному HGF, способному в значительной степени связывать гепсин, но обладающему уменьшенной по сравнению с HGF дикого типа модулирующей активностью в отношении HGF/c-met, например, антагонисту активности HGF/c-met или варианту HGF, со снижением, но не с отсутствием, биологической активности HGF (например, стимулирующее клеточный рост действие). В одном из вариантов осуществления антагонист согласно изобретению способен ингибировать биологическую активность (in vivo) HGF дикого типа (такая биологическая активность включает в себя в качестве неограничивающих примеров стимуляцию клеточной пролиферации, увеличение выживаемости клеток, стимуляцию ангиогенеза, индукцию/стимуляцию клеточной миграции). В одном из вариантов осуществления антагонист согласно изобретению обеспечивает сниженную стимулирующую рост клеток активность (включая в качестве неограничивающих примеров стимулирующую клеточную пролиферацию активность, стимулирующую выживаемость клеток активность, ангиогеннную стимулирующую активность, стимулирующую клеточную миграцию активность).
В некоторых вариантах осуществления антагонист согласно изобретению получают способом скрининга или идентификации согласно изобретению, как описано в данном документе.
В одном из аспектов молекула-антагонист согласно изобретению связана с токсином, таким как цитотоксическое средство. Эти молекулы/вещества можно составлять или вводить в сочетании с дополнительным/усиливающим средством, таким как радиация и/или химиотерапевтическое средство.
В одном из аспектов изобретение относится к молекуле, способной к усилению расщепления гепсином про-HGF, где указанная молекула способна препятствовать взаимодействию HAI-1, HAI-1B и/или HAI-2 с гепсином. В некоторых вариантах осуществления усиливающая молекула согласно изобретению представляет собой или содержит низкомолекулярное соединение, пептид, антитело, фрагмент антитела, аптамер или их сочетание. Например, усиливающая молекула согласно изобретению может содержать, состоять или по существу состоять из фрагмента или его вариантов из HAI-1, HAI-1B и/или HAI-2, где указанный фрагмент способен связывать гепсин, но существенно не ингибирует расщепление про-HGF гепсином. В одном из вариантов осуществления указанная молекула способна к конкурентному ингибированию связывания HAI-1, HAI-1B и/или HAI-2 дикого типа с гепсином. В одном из вариантов осуществления усиливающая молекула согласно изобретению представляет собой антитело, препятствующее формированию комплекса, содержащего гепсин и HAI-1, HAI-1B и/или HAI-2. В одном из вариантов осуществления усиливающая молекула согласно изобретению представляет собой гепсин или его вариант (включая любой из них, определяемый ниже), где гепсин или его вариант способен осуществлять расщепление про-HGF по участку R494-V495.
Изобретение также относится к способам и композициям, пригодным для модуляции состояний заболевания, ассоциированных с нарушением регуляции пути передачи сигнала HGF/c-met. Таким образом, в одном из аспектов изобретение относится к способу модуляции активации c-met у субъекта, где указанный способ включает в себя введение субъекту модулирующей HGF/c-met молекулы согласно изобретению (например, молекула-антагонист, как описано в данном документе, ингибирующая расщепление про-HGF гепсином), посредством чего модулируется активация c-met. В одном из вариантов осуществления указанная молекула представляет собой антагонист HGF/c-met, ингибирующий активность HGF/c-met. В одном из вариантов осуществления указанная молекула представляет собой усиливающую молекулу, увеличивающую активность HGF/c-met. В одном из аспектов изобретение относится к способу лечения патологического состояния, ассоциированного с активацией c-met у субъекта, где указанный способ включает в себя введение субъекту антагониста c-met согласно изобретению (например, любого из антагонистов расщепления про-HGF гепсином, как описано в данном документе), посредством чего ингибируется активация c-met.
Путь передачи сигнала HGF/c-met вовлечен во множество биологических и физиологических функций, включая, например, стимуляцию клеточного роста (например, клеточной пролиферации, выживаемости клеток, клеточной миграции, морфогенеза клеток) и ангиогенеза. Таким образом, в другом аспекте изобретение относится к способу ингибирования активированного c-met роста клеток (например, пролиферации и/или выживания), где указанный способ включает в себя приведение клетки или ткани в контакт с антагонистом согласно изобретению, посредством чего ингибируется клеточная пролиферация, ассоциированная с активацией c-met. В еще одном аспекте изобретение относится к способу ингибирования ангиогенеза, где указанный способ включает в себя введение в клетку, ткань и/или организм субъекта в состоянии, ассоциированном с аномальным ангиогенезом, антагониста согласно изобретению, посредством чего ангиогенез ингибируется. В еще одном аспекте изобретение относится к способу усиления ангиогенеза, где указанный способ включает в себя введение в клетку, ткань и/или организм субъекта в состоянии, которое могло бы улучшиться при усиленном ангиогенезе и/или которое ассоциировано с субоптимальной степенью ангиогенеза, усиливающей молекулы согласно изобретению, посредством чего ангиогенез усиливается.
В одном из аспектов изобретение относится к применению антагониста согласно изобретению для получения лекарственного средства для терапевтического и/или профилактического лечения заболевания, такого как опухоль, злокачественная опухоль, нарушение пролиферации клеток, иммунное (такое как аутоиммунное) нарушение и/или связанное с ангиогенезом нарушение. Антагонист может находиться в любой описанной в настоящем документе форме, включая антитело, фрагмент антитела, низкомолекулярное соединение (например, органическая молекула), полипептид (например, олигопептид), нуклеиновую кислоту (например, олигонуклеотид, такой как антисмысловой олигонуклеотид или интерферирующая РНК), аптамер или их сочетание.
В одном из аспектов изобретение относится к применению усиливающей молекулы согласно изобретению для получения лекарственного средства для терапевтического и/или профилактического лечения заболевания, такого как заживление ран (например, ран, ассоциированных с диабетом, травмой и т.д.). Усиливающая молекула может находиться в любой описанной в настоящем документе форме, включая антитело, фрагмент антитела, низкомолекулярное соединение (например, органическую молекулу), полипептид (например, олигопептид), нуклеиновую кислоту (например, олигонуклеотид, такой как антисмысловой олигонуклеотид или интерферирующая РНК), аптамер или их сочетание.
В одном из аспектов изобретение относится к применению нуклеиновой кислоты согласно изобретению для получения лекарственного средства для терапевтического и/или профилактического лечения заболевания, такого как опухоль, злокачественная опухоль, нарушение пролиферации клеток, иммунное (такое как аутоиммунное) нарушение и/или связанное с ангиогенезом нарушение (например, заживление ран).
В одном из аспектов изобретение относится к применению экспрессирующего вектора согласно изобретению для получения лекарственного средства для терапевтического и/или профилактического лечения заболевания, такого как опухоль, злокачественная опухоль, нарушение пролиферации клеток, иммунное (такое как аутоиммунное) нарушение и/или связанное с ангиогенезом нарушение (например, заживление ран).
В одном из аспектов изобретение относится к применению клетки-хозяина согласно изобретению для получения лекарственного средства для терапевтического и/или профилактического лечения заболевания, такого как опухоль, злокачественная опухоль, нарушение пролиферации клеток, иммунное (такое как аутоиммунное) нарушение и/или связанное с ангиогенезом нарушение (например, заживление ран).
В одном из аспектов изобретение относится к применению готового изделия согласно изобретению для получения лекарственного средства для терапевтического и/или профилактического лечения заболевания, такого как опухоль, злокачественная опухоль, нарушение пролиферации клеток, иммунное (такое как аутоиммунное) нарушение и/или связанное с ангиогенезом нарушение (например, заживление ран).
В одном из аспектов изобретение относится к применению набора согласно изобретению для получения лекарственного средства для терапевтического и/или профилактического лечения заболевания, такого как опухоль, злокачественная опухоль, нарушение пролиферации клеток, иммунное (такое как аутоиммунное) нарушение и/или связанное с ангиогенезом нарушение (например, заживление ран).
В одном из аспектов изобретение относится к способу ингибирования активированной c-met клеточной пролиферации, где указанный способ включает в себя приведение клетки или ткани в контакт с эффективным количеством антагониста согласно изобретению, посредством чего ингибируется клеточная пролиферация, ассоциированная с активацией c-met.
В одном из аспектов изобретение относится к способу лечения патологического состояния, ассоциированного с нарушением регуляции активации c-met у субъекта, где указанный способ включает в себя введение субъекту эффективного количества антагониста согласно изобретению, посредством чего указанное состояние подвергается лечению.
В одном из аспектов изобретение относится к способу ингибирования роста клеток, экспрессирующих c-met или фактор роста гепатоцитов, или же оба этих фактора, где указанный способ включает в себя приведение указанной клетки в контакт с антагонистом согласно изобретению, таким образом вызывая ингибирование роста указанных клеток. В одном из вариантов осуществления клетка контактирует с HGF, экспрессируемым другой клеткой (например, посредством паракринного эффекта).
В одном из аспектов изобретение относится к способу терапевтического лечения млекопитающего со злокачественной опухолью, содержащей клетки, экспрессирующие c-met или фактор роста гепатоцитов, или же оба этих фактора, где указанный способ включает в себя введение указанному млекопитающему эффективного количества антагониста согласно изобретению, таким образом эффективно проводя лечение указанного млекопитающего. В одном из вариантов осуществления клетка контактирует с HGF, экспрессированным другой клеткой (например, посредством паракринного эффекта).
В одном из аспектов изобретение относится к способу лечения или профилактики нарушения пролиферации клеток, ассоциированного с увеличенной экспрессией или активностью гепсина, c-met и/или фактора роста гепатоцитов, где указанный способ включает в себя введение нуждающемуся в таком лечении субъекту эффективного количества антагониста согласно изобретению, таким образом подвергая указанное нарушение пролиферации клеток эффективному лечению или профилактике. В одном из вариантов осуществления указанное нарушение пролиферации представляет собой злокачественную опухоль.
В одном из аспектов изобретение относится к способу ингибирования роста клетки, где рост указанной клетки, по меньшей мере частично, зависит от потенцирующего рост действия гепсина, c-met и/или фактора роста гепатоцитов, где указанный способ включает в себя приведение указанной клетки в контакт с эффективным количеством антагониста согласно изобретению, таким образом ингибируя рост указанной клетки. В одном из вариантов осуществления клетка контактирует с HGF, экспрессируемым другой клеткой (например, посредством паракринного эффекта).
В одном из аспектов изобретение относится к способу терапевтического лечения опухоли у млекопитающего, где рост указанной опухоли, по меньшей мере частично, зависит от потенцирующего рост эффекта гепсина, c-met и/или фактора роста гепатоцитов, где указанный способ включает в себя приведение указанной клетки в контакт с эффективным количеством антагониста согласно изобретению, таким образом, подвергая указанную опухоль эффективному лечению. В одном из вариантов осуществления клетка контактирует с HGF, экспрессируемым другой клеткой (например, посредством паракринного эффекта).
Способы согласно изобретению можно применять для воздействия на любое подходящее патологическое состояние, например, клетки и/или ткани, ассоциированные с нарушением регуляции гепсина и/или пути передачи сигнала HGF/c-met. В одном из вариантов осуществления клетка, являющаяся мишенью в способе согласно изобретению, представляет собой клетку злокачественной опухоли. Например, клетка злокачественной опухоли может представлять собой клетку, выбранную из группы, состоящей из клетки рака молочной железы, клетки колоректального рака, клетки рака легких, клетки папиллярной карциномы (например, щитовидной железы), клетки рака толстой кишки, клетки рака поджелудочной железы, клетки рака яичников, клетки рака шейки матки, клетки злокачественной опухоли центральной нервной системы, клетки рака предстательной железы, клетки остеогенной саркомы, клетки почечноклеточной карциномы, клетки печеночно-клеточной карциномы, клетки злокачественной опухоли мочевого пузыря, клетки карциномы желудка, клетки сквамозной карциномы головы и шеи, клетки меланомы и клетки лейкоза. В одном из вариантов осуществления клетка, являющаяся мишенью в способе согласно изобретению, представляет собой гиперпролиферативную и/или гиперпластическую клетку. В одном из вариантов осуществления клетка, являющаяся мишенью в способе согласно изобретению, представляет собой диспластическую клетку. В еще одном варианте осуществления клетка, являющаяся мишенью в способе согласно изобретению, представляет собой метастатическую клетку.
Способы согласно изобретению могут дополнительно включать в себя стадии дополнительной обработки. Например, в одном из вариантов осуществления способ дополнительно включает в себя стадию, на которой клетка или ткань, являющиеся мишенями (например, злокачественная клетка) подвергают радиационному воздействию или воздействию химиотерапевтическим средством.
Как описано в данном документе, активация c-met является важным биологическим процессом, нарушение регуляции которого ведет к многочисленным патологическим состояниям. Таким образом, в одном из вариантов осуществления способов согласно изобретению, клетка-мишень (например, злокачественная клетка) представляет собой клетку, в которой по сравнению с нормальной клеткой того же тканевого происхождения увеличена активация c-met. В одном из вариантов осуществления способ согласно изобретению вызывает гибель клеток-мишеней. Например, контакт с антагонистом согласно изобретению может приводить к неспособности клетки передавать сигнал путем c-met, что приводит к гибели клетки.
Нарушение регуляции активации c-met (и таким образом передачи сигнала) может происходить вследствие ряда клеточных изменений, включающих в себя, например, сверхэкспрессию HGF (узнаваемый c-met лиганд) и/или самого c-met. Таким образом, в некоторых вариантах осуществления способ согласно изобретению включает в себя поражение клетки, где c-met или фактор роста гепатоцитов, или же оба этих фактора, указанной клеткой (например, злокачественной клеткой) экспрессируются более сильно по сравнению с нормальной клеткой того же тканевого происхождения. Экспрессирующая c-met клетка может регулироваться HGF из множества источников, т.е. аутокринным или паракринным способом. Например, в одном из вариантов осуществления способов согласно изобретению, клетка-мишень контактирует/связывается с фактором роста гепатоцитов, экспрессируемым в другой клетке (например, посредством паракринного эффекта). Указанная другая клетка может быть того же или другого тканевого происхождения. В одном из вариантов осуществления клетка-мишень контактирует/связывается с HGF, экспрессируемым самой клеткой-мишенью (например, вследствие аутокринного эффекта/петли).
В одном из аспектов изобретение относится к способу, включающему в себя введение субъекту усиливающей молекулы согласно изобретению. Подходящие состояния для лечения этим способом включают в себя любые патологические состояния, которые ассоциированы с аномально/нежелательно низким физиологическим уровнем ангиогенеза, связанного с активностью HGF/c-met у субъекта. Примеры таких состояний включают в себя в качестве неограничивающих примеров заживление ран, гипертрофия сердца, инфаркт миокарда, ишемию конечностей, заболевание периферических артерий и т.д.
В одном из аспектов изобретение относится к композициям, содержащим один или несколько антагонистов или усилителей согласно изобретению и носитель. В одном из вариантов осуществления носитель является фармацевтически приемлемым.
В одном из аспектов изобретение относится к нуклеиновым кислотам, кодирующим антагонист или усиливающую молекулу согласно изобретению. В одном из вариантов осуществления нуклеиновая кислота согласно изобретению кодирует антагонист или усиливающую молекулу, представляющую собой или содержащую полипептид (например, олигопептид). В одном из вариантов осуществления нуклеиновая кислота согласно изобретению кодирует антагонист или усиливающую молекулу, представляющую собой или содержащую антитело или его фрагмент.
В одном из аспектов изобретение относится к векторам, содержащим нуклеиновую кислоту согласно изобретению.
В одном из аспектов изобретение относится к клеткам-хозяевам, содержащим нуклеиновую кислоту или вектор согласно изобретению. Вектор может представлять собой вектор любого типа, например рекомбинантный вектор, такой как экспрессирующий вектор. Можно применять любую из множества клеток-хозяев. В одном из вариантов осуществления клетка-хозяин представляет собой прокариотическую клетку, например, E. coli. В одном из вариантов осуществления клетка-хозяин представляет собой эукариотическую клетку, например клетку млекопитающего, такую как клетку китайского хомяка (CHO).
В одном из аспектов изобретение относится к способам получения антагониста или усиливающей молекулы согласно изобретению. Например, изобретение относится к способу получения антагониста, представляющего собой или содержащего антитело (или его фрагмент), где указанный способ включает в себя экспрессию в подходящей клетке-хозяине рекомбинантного вектора согласно изобретению, кодирующего указанное антитело (или его фрагмент), и выделение указанного антитела. В другом примере изобретение относится к способу получения антагониста или усиливающей молекулы, представляющих собой или содержащих полипептид (такой как олигопептид), где указанный способ включает в себя экспрессию в подходящей клетке-хозяине рекомбинантного вектора согласно изобретению, кодирующего указанный полипептид (такой как олигопептид), и выделение указанного полипептида (такого как олигопептид).
В одном из аспектов изобретение относится к готовому изделию, содержащему контейнер и композицию, находящуюся в контейнере, где композиция содержит один или несколько антагонистов или усиливающих молекул согласно изобретению. В одном из вариантов осуществления композиция содержит нуклеиновую кислоту согласно изобретению. В одном из вариантов осуществления композиция, содержащая антагонист или усиливающую молекулу, дополнительно содержит носитель, который в некоторых вариантах осуществления является фармацевтически приемлемым. В одном из вариантов осуществления готовое изделие согласно изобретению дополнительно содержит инструкции для введения композиции (например, антагониста или усиливающей молекулы) субъекту.
В одном из аспектов изобретение относится к набору, содержащему первый контейнер, содержащий композицию, содержащую один или несколько антагонистов или усиливающих молекул согласно изобретению, и второй контейнер, содержащий буфер. В одном из вариантов осуществления буфер является фармацевтически приемлемым. В одном из вариантов осуществления композиция, содержащая антагонист или усиливающую молекулу дополнительно, содержит носитель, который в некоторых вариантах осуществления является фармацевтически приемлемым. В одном из вариантов осуществления набор дополнительно содержит инструкции для введения композиции (например, антагониста или усиливающей молекулы) субъекту.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Фиг.1. Степень чистоты гепсина и его активность в отношении фактора VII. (A) Экспрессируемый клетками CHO растворимый гепсин содержал целый внеклеточный домен (Arg45-Leu417) и C-концевую метку His8. На окрашенных гелях (восстановительные условия) очищенного гепсина видно, что гепсин спонтанно преобразовывался в его двухцепочечную форму посредством расщепления по Arg163-Ile163 (подтверждено N-концевым секвенированием). (B) Активация профермента фактора VII гепсином (40 нМ) в присутствие везикул PCPS и CaCl2 при 37°C в течение периода 2 часа. Положения профермента FVII, а также легкой цепи (л.ц.) и протеазного домена (т.ц.) FVIIa обозначены. Маркеры молекулярной массы приведены как Mr × 10-3.
Фиг.2. Специфическая активация про-HGF гепсином. Меченый 125I про-HGF (0,05 мг/мл) инкубировали в 20 мМ Hepes, pH 7,5, 150 мМ NaCl (буфер Hepes) с уменьшающимися концентрациями гепсина и HGFA: стадии 3-кратного разбавления ферментов, от 40 нМ на дорожке 2 до 0,16 нМ на дорожке 7. (A) Гепсин и (B) HGFA. После 4 часов при 37°C образцы анализировали посредством SDS-PAGE в восстановительных условиях с последующей экспозицией на рентгеновские пленки. Положения про-HGF, α-цепи HGF и β-цепи HGF (дублет) обозначены. Дорожка 1 представляет собой аликвоту, непосредственно отобранную в начале реакции. (C) Активация плазминогена посредством t-PA (тканевый активатор плазминогена) и гепсина. Плазминоген (0,12 мг/мл) инкубировали с t-PA (40 нМ), гепсином (40 нМ) или буфером (контроль) в буфере Hepes. В различные моменты времени отбирали аликвоты и анализировали на SDS-PAGE (восстановительные условия) с последующим окрашиванием красителем Simply Blue Safe Stain. Дорожка 1, буфер после 0,5 часа; дорожка 2, t-PA после 0,5 часа; дорожка 3, гепсин после 0,5 часа; дорожка 4, буфер после 5 часов; дорожка 5, t-PA после 5 часов; дорожка 6, гепсин после 5 часов. Положения плазминогена (Plg) и тяжелой цепи плазмина (т.ц.) обозначены.
Фиг.3. Фосфорилирование Met посредством про-HGF, активированного гепсином и HGFA. (A) Немеченый про-HGF (0,3 мг/мл) расщепляли 40 нМ гепсина или 40 нМ HGFA, получая >95% конверсии. Образуемый вследствие расщепления гепсином (HGFгепсин) и вследствие расщепления HGFA (HGFHGFA) HGF анализировали на SDS-PAGE (восстановительные условия) и окрашивали красителем Simply Blue Safe Stain. (B) Фосфорилирование рецептора Met измеряли в анализе KIRA посредством воздействия на клетки A549 увеличивающимися концентрациями HGFгепсин (окружности), HGFHGFA (квадраты) или scHGF (ромбы), нерасщепленной одноцепочечной формы HGF. Активность выражали как процент от максимального сигнала, полученного с контрольным препаратом HGF. Значения представляют собой среднее арифметическое ± SD трех экспериментов.
Фиг.4. Клеточная пролиферация и миграция с про-HGF, активированным гепсином (HGFгепсин) и HGFA (HGFHGFA). (A) Клеточная пролиферация клеток BxPC3 в присутствие увеличивающихся концентраций HGFгепсин (закрашенные столбцы) и HGFHGFA (незакрашенные столбцы). Значения представляют собой среднее арифметическое двух экспериментов. (B) Количественный анализ клеточной миграции, стимулированной увеличивающимися концентрациями HGFгепсин (закрашенные столбцы) и HGFHGFA (незакрашенные столбцы), добавленных в нижнюю камеру системы клеточной миграции transwell. Значения представляют собой среднее арифметическое ± SD трех экспериментов. Активность в анализах пролиферации и миграции выражали как процент контрольных клеток, подвергнутых воздействию 100 нг/мл контрольного препарата HGF, который включали в каждый эксперимент.
Фиг.5. Ингибирование ферментативной активности гепсина в амидолитическом анализе. Гепсин (0,4 нМ) инкубировали с ингибиторами в течение 30 мин при комнатной температуре и на кинетическом микропланшет-ридере определяли ферментативную активность по отношению к S2366 (0,2 мМ ≈ Km). (■), sHAI-1B, (▼), sHAI-1B (R260A), (●), sHAI-1B (K401A), (●), sHAI-2.
Фиг.6. Ингибирование активации про-HGF мутантными формами sHAI-1B и посредством sHAI-2. Меченый 125I про-HGF (0,05 мг/мл) инкубировали с гепсином (15 нМ) и ингибиторами в течение 4 часов при 37°C. Аликвоты реакционной смеси анализировали, как описано на фигуре 1. Гепсин при 15 нМ присутствовал в каждом образце. Уровень ингибиторов составлял 1 мкМ. Дорожка 1, аликвота при t = 0; 2, без ингибитора; 3, sHAI-1B; 4, sHAI-1B (R260A); 5, sHAI-1B (K401A); 6, sHAI-2. Положения про-HGF, α-цепь HGF и β-цепь HGF (дублет) обозначены.
Фиг.7. Один из вариантов осуществления аминокислотной последовательности природного человеческого гепсина.
Фиг.8. Другой вариант осуществления аминокислотной последовательности природного человеческого гепсина.
СПОСОБЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Изобретение относится к способам, композициям, наборам и готовым изделиям, содержащим модуляторы пути передачи сигнала HGF/c-met, включая способы использования таких модуляторов.
В данном документе предоставлено подробное описание этих способов, композиций, наборов и готовых изделий.
Основные способы
Если не указано иначе, в практическом осуществлении настоящего изобретения применяют общепринятые способы молекулярной биологии (включая рекомбинантные способы), микробиологии, клеточной биологии, биохимии и иммунологии, известные специалистам в данной области. Такие способы полностью описаны в литературе, такой как, "Molecular Cloning: A Laboratory Manual", второе издание (Sambrook et al., 1989); "Oligonucleotide Synthesis" (M. J. Gait, ed., 1984); "Animal Cell Culture" (R. I. Freshney, ed., 1987); "Methods in Enzymology" (Academic Press, Inc.); "Current Protocols in Molecular Biology" (F. M. Ausubel et al., eds., 1987, и периодические обновления); "PCR: The Polymerase Chain Reaction", (Mullis et al., ed., 1994); "A Practical Guide to Molecular Cloning" (Perbal Bernard V., 1988); "Phage Display: A Laboratory Manual" (Barbas et al., 2001).
Определения
В настоящем документе термин "гепсин" относится к полипептидам с природной последовательностью, полипептидным вариантам и фрагментам полипептида с природной последовательностью и полипептидным вариантам (которые определены в данном документе дополнительно), способным к расщеплению про-HGF способом, сходным с гепсином дикого типа. Описанный в данном документе полипептид гепсина может представлять собой полипептид гепсина, который выделен из множества источников, таким как из образцов человеческой ткани или из другого источника, или получен рекомбинантными или синтетическими способами. Термины "гепсин", "полипептид гепсина", "фермент гепсина" и "белок гепсина" также включают в себя варианты полипептида гепсина, как описано в настоящем документе.
"Полипептид гепсина с природной последовательностью" содержит полипептид с той же аминокислотной последовательностью, что и соответствующий полипептид гепсина, полученный из природных условий. В одном из вариантов осуществления полипептид гепсина с природной последовательностью содержит аминокислотную последовательность SEQ ID № 1 (см. фиг.7). В одном из вариантов осуществления полипептид гепсина с природной последовательностью содержит аминокислотную последовательность SEQ ID № 2 (см. фиг.8). Такой полипептид гепсина с природной последовательностью можно выделить из природных источников или получить рекомбинантными или синтетическими способами. Термин "полипептид гепсина с природной последовательностью" конкретно относится к встречающимся в природе укороченным или секретируемым формам конкретного полипептида гепсина (например, последовательность внеклеточного домена), встречающимся в природе формам вариантов (например, формам альтернативного сплайсинга) и встречающимся в природе аллельным вариантам полипептида.
В настоящем документе "вариант полипептида гепсина" или его варианты означает полипептид гепсина, как правило, активный полипептид гепсина, по меньшей мере, приблизительно с 80% идентичности аминокислотной последовательности с любой из последовательностей полипептидов гепсина с природной последовательностью, как описано в настоящем документе. Такие варианты полипептида гепсина включают в себя, например, полипептиды гепсина, где с N- или C-конца природной аминокислотной последовательности добавлены или удалены один или несколько аминокислотных остатков. Как правило, вариант полипептида гепсина обладает, по меньшей мере приблизительно 80% идентичности аминокислотной последовательности, альтернативно, по меньшей мере приблизительно 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности аминокислотной последовательности с последовательностью полипептида гепсина с природной последовательностью, как описано в настоящем документе. Как правило, длина полипептидов вариантов гепсина составляет по меньшей мере приблизительно 10 аминокислот, альтернативно, длина составляет, по меньшей мере, приблизительно 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200, 210, 220, 230, 240, 250, 260, 270, 280, 290, 300, 310, 320, 330, 340, 350, 360, 370, 380, 390, 400, 410, 420, 430, 440, 450, 460, 470, 480, 490, 500, 510, 520, 530, 540, 550, 560, 570, 580, 590, 600 аминокислот или более. Необязательно в полипептидах вариантов гепсина находится не более одной консервативной аминокислотной замены по сравнению с последовательностью природного полипептида гепсина, альтернативно, не более чем 2, 3, 4, 5, 6, 7, 8, 9 или 10 консервативных аминокислотных замен по сравнению с последовательностью природного полипептида гепсина.
"Процент (%) идентичности аминокислотной последовательности" в отношении пептидной или полипептидной последовательности определяют как процент аминокислотных остатков в последовательности-кандидате, которые идентичны аминокислотным остаткам в конкретной пептидной или полипептидной последовательности после выравнивания последовательностей и введения, если необходимо разрывов для достижения максимума процента идентичности последовательностей и без рассматривания любых консервативных замен как части идентичности последовательности. Выравнивание с целями определения процента идентичности аминокислотных последовательностей можно осуществлять различными способами, известными специалистам в данной области, например, с применением общедоступного компьютерного программного обеспечения, такого как программное обеспечение BLAST, BLAST-2, ALIGN или Megalign (DNASTAR). Специалисты в данной области могут определить подходящие параметры для измерения выравнивания, включая любые алгоритмы, необходимые для достижения максимального выравнивания на всем протяжении сравниваемых последовательностей. Однако для целей настоящего описания значения % идентичности аминокислотных последовательностей получали с применением компьютерной программы сравнения последовательностей ALIGN-2, как описано в патенте США № 6828146.
В настоящем документе термин "вектор" предназначен для обозначения молекулы нуклеиновой кислоты, способной к транспортировке другой нуклеиновой кислоты с которой она сцеплена. Один из типов векторов представляет собой "плазмиду", которая обозначает замкнутую кольцевую двухцепочечную ДНК, в которую можно лигировать дополнительные сегменты ДНК. Другим типом вектора является фаговый вектор. Другим типом вектора является вирусный вектор, где в вирусный геном можно лигировать дополнительные сегменты ДНК. Некоторые векторы способны к автономной репликации в клетке-хозяине в которую их ввели (например, бактериальные векторы, имеющие бактериальную точку начала репликации и эписомные векторы млекопитающих). Другие векторы (например, неэписомные векторы млекопитающих) при введении в клетку-хозяина могут интегрироваться в геном клетки-хозяина и, таким образом, реплицироваться вместе с геномом хозяина. Кроме того, некоторые векторы способны направлять экспрессию генов, с которыми они функционально связаны. Такие векторы обозначают в настоящем документе как "рекомбинантные экспрессирующие векторы" (или просто, "рекомбинантные векторы"). В основном, экспрессирующие векторы, пригодные в способах рекомбинантной ДНК, часто находятся в форме плазмид. В настоящем описании, "плазмида" и "вектор" могут быть использованы взаимозаменяемо, так как плазмида представляет собой наиболее широко применяемую форму вектора.
"Полинуклеотид" или "нуклеиновая кислота", как взаимозаменяемо используют в настоящем документе, относятся к полимерам нуклеотидов любой длины и включают в себя ДНК и РНК. Нуклеотиды могут представлять собой дезоксирибонуклеотиды, рибонуклеотиды, модифицированные нуклеотиды или основания и/или их аналоги или любой субстрат, который можно инкорпорировать в полимер посредством ДНК- или РНК-полимеразы или посредством реакции синтеза. Полинуклеотид может содержать модифицированные нуклеотиды, такие как метилированные нуклеотиды и их аналоги. Если присутствует, модификацию структуры нуклеотида можно проводить до или после сборки полимера. Последовательность нуклеотидов может прерываться ненуклеотидными компонентами. Полинуклеотид можно дополнительно модифицировать после синтеза, например, посредством конъюгации с меткой. Другие типы модификаций включают в себя, например, "кэпирование", замену одного или нескольких встречающихся в природе нуклеотидов аналогом, межнуклеотидные модификации, такие как, например, межнуклеотидные модификации с незаряженными связями (например, метилфосфонаты, фосфотриэфиры, фосфоамидаты, карбаматы и т.д.) и с заряженными связями (например, фосфоротиоаты, фосфородитиоаты и т.д.), межнуклеотидные модификации, содержащие боковые группы, такие как, например, белки (например, нуклеазы, токсины, антитела, сигнальные пептиды, ply-L-лизин и т.д.), межнуклеотидные модификации с интеркаляторами (например, акридин, псорален и т.д.), межнуклеотидные модификации, содержащие хелаторы (например, металлы, радиоактивные металлы, бор, окислительные металлы и т.д.), межнуклеотидные модификации, содержащие алкилирующие средства, межнуклеотидные модификации с модифицированными связями (например, альфа-аномерные нуклеиновые кислоты и т.д.), а также немодифицированные формы полинуклеотида(ов). Кроме того, любую из гидроксильных групп, как правило, присутствующих на сахарах, можно замещать, например, фосфонатными группами, фосфатными группами, защищенными стандартными защитными группами или активированных для образования дополнительных связей с дополнительными нуклеотидами, или можно конъюгировать с твердыми или полутвердыми подложками. 5'- и 3'-концевой OH можно фосфорилировать или замещать аминами или молекулами органических кэпирующих групп с количеством атомов углерода от 1 до 20. Другие гидроксилы также можно дериватизировать стандартными защитными группами. Полинуклеотиды также могут содержать формы аналогов сахаров рибозы или дезоксирибозы, которые, как правило, известны в данной области, включая, например, 2'-O-метил-, 2'-O-аллил-, 2'-фтор- или 2'-азидорибозу, карбоциклические аналоги сахаров, альфа-аномерные сахара, эпимерные сахара, такие как арабинозу, ксилозы или ликсозы, пиранозные сахара, фуранозные сахара, седогептулозы, ациклические аналоги и нуклеозидные аналоги без оснований, такие как метилрибозид. Одну или несколько фосфодиэфирных связей можно заменить альтернативными связывающими группами. Такие альтернативные связывающие группы включают в себя в качестве неограничивающих примеров, варианты осуществления, где фосфат замещен P(O)S ("тиоат"), P(S)S ("дитиоат"), "(O)NR2 ("амидат"), P(O)R, P(O)OR', CO или CH2 ("формацеталь"), в которых каждый R или R' независимо представляет собой H или замещенный или незамещенный алкил (1-20 C), необязательно содержащий простую эфирную (-O-) связь, арил, алкенил, циклоалкил, циклоалкенил или аралкил. Не все связи в полинуклеотид должны быть идентичными. Приведенное выше описание применимо ко всем приводимым в настоящем документе полинуклеотидам, включая РНК и ДНК.
В настоящем документе, "олигонуклеотид", как правило, относится к коротким, как правило, одноцепочечным, как правило, синтетическим полинуклеотидам, которые, как правило, но необязательно, составляют менее чем приблизительно 200 нуклеотидов в длину. Термины "олигонуклеотид" и "полинуклеотид" не являются взаимоисключающими. Приведенное выше для полинуклеотидов описание в равной степени и полностью применимо к олигонуклеотидам.
В настоящем документе, термин "фактор роста гепатоцитов" или "HGF", если конкретно не указано или из контекста не ясно иначе, относится к любому природному полипептиду HGF или его варианту (или встречающемуся в природе или синтетическому), способному активировать путь передачи сигнала HGF/c-met в условиях, обеспечивающих прохождение процесса. Как правило, термин "HGF дикого типа" относится к полипептиду, содержащему аминокислотную последовательность встречающегося в природе белка HGF. Как правило, термин "последовательность HGF дикого типа" относится к аминокислотной последовательности, находящейся во встречающемся в природе HGF.
Термины "антитело" и "иммуноглобулин" используют взаимозаменяемо в самом широком смысле и они включают в себя моноклональные антитела (например, полноразмерные или целые моноклональные антитела), поликлональные антитела, поливалентные антитела, полиспецифические антитела (например, биспецифические антитела при условии, что они проявляют желательную биологическую активность) и также могут включать в себя определенные фрагменты антител (как более подробно описано в настоящем документе). Антитело может быть человеческим, гуманизированным и/или аффинно зрелым.
"Фрагменты антител" содержат только часть целого антитела, где данная часть предпочтительно сохраняет, по меньшей мере, одну, предпочтительно большинство или все функции, обычно ассоциированные с этой частью, когда она находится в целом антителе. В одном из вариантов осуществления фрагмент антитела содержит антигенсвязывающий участок целого антитела и, таким образом, сохраняет способность связывать антиген. В другом варианте осуществления фрагмент антитела, например, фрагмент антитела, содержащий Fc-область, сохраняет, по меньшей мере, одну из биологических функций, обычно связанных с Fc-областью, когда она находится в целом антителе, такую как связывание FcRn, изменение времени полужизни антитела, функция, ADCC и связывание комплемента. В одном из вариантов осуществления фрагмент антитела представляет собой моновалентное антитело, которое обладает временем полужизни in vivo по существу таким же, как и целое антитело. Например, такой фрагмент антитела может содержать антигенсвязывающее плечо, связанное с последовательностью Fc, способной придавать фрагменту стабильность in vivo.
В настоящем документе термин "моноклональное антитело" относится к антителу, полученному из группы по существу гомогенных антител, т.е. отдельные находящиеся в группе антитела являются идентичными, за исключением возможных встречающихся в природе мутаций, которые могут присутствовать в незначительных количествах. Моноклональные антитела являются высокоспецифичными, являясь направленными к одному антителу. Кроме того, в отличие от препаратов поликлональных антител, которые, как правило, включают в себя различные антитела, направленные к различным детерминантам (эпитопам), каждое моноклональное антитело направлено к одной детерминанте на антигене.
Моноклональные антитела в настоящем документе, в частности, включают в себя "химерные" антитела, у которых часть тяжелой и/или легкой цепи идентичны или гомологичны соответствующим последовательностям у антител, полученных от конкретных видов или принадлежащих конкретному классу или подклассу антител, тогда как остаток цепи(ей) идентичен или гомологичен соответствующим последовательностям у антител, полученных от других видов или принадлежащих другому классу или подклассу антител, а также фрагменты таких антител, при условии, что они проявляют желательную биологическую активность (патент США № 4816567 и Morrison et al., Proc. Natl. Acad. Sci. USA 81:6851-6855 (1984)).
"Гуманизированные" формы не принадлежащих человеку (например, мышиных) антител представляют собой химерные антитела, содержащие минимальную последовательность, происходящую от не принадлежащего человеку иммуноглобулина. Преимущественно, гуманизированные антитела представляют собой человеческие иммуноглобулины (реципиентное антитело), в которых остатки из гипервариабельной области реципиента замещены остатками из гипервариабельной области не являющихся человеком видов (донорное антитело), таких как мышь, крыса, кролик или не являющийся человеком примат, обладающими желательной специфичностью, аффинностью и емкостью. В некоторых случаях остатки каркасной области (FR) человеческого иммуноглобулина замещены соответствующими не принадлежащими человеку остатками. Кроме того, гуманизированные антитела могут содержать остатки, которых нет ни в реципиентном антителе, ни в донорном антителе. Эти модификации проводят для дальнейшего улучшения характеристик антител. В основном гуманизированное антитело содержит по существу все, по меньшей мере, из одного, а обычно двух, вариабельных доменов, где все или по существу все из гипервариабельных петель соответствуют гипервариабельным петлям не являющегося человеческим иммуноглобулина, а все или по существу все из FR являются FR последовательности человеческого иммуноглобулина. Гуманизированное антитело необязательно также содержит по меньшей мере часть константной области иммуноглобулина (Fc), как правило, константную область человеческого иммуноглобулина. Более подробно, см. Jones et al., Nature 321:522-525 (1986); Riechmann et al., Nature 332:323-329 (1988) и Presta, Curr. Op. Struct. Biol. 2:593-596 (1992). См. также следующие обзорные статьи и цитируемые там ссылки: Vaswani and Hamilton, Ann. Allergy, Asthma & Immunol. 1:105-115 (1998); Harris, Biochem. Soc. Transactions 23:1035-1038 (1995); Hurle and Gross, Curr. Op. Biotech. 5:428-433 (1994).
"Человеческое антитело" представляет собой антитело с аминокислотной последовательностью, соответствующей аминокислотной последовательности антитело, продуцируемого человеком и/или сделанной с применением любого из способов для получения человеческих антител, как описано в настоящем документе. Это определение человеческого антитела, в частности, исключает гуманизированное антитело, содержащее не являющиеся человеческими антигенсвязывающие остатки.
"Аффинно зрелое" антитело представляет собой антитело с одним или несколькими изменениями в одной или нескольких его CDR, что приводит к усилению аффинности антитела в отношении антигена по сравнению с исходным антителом без этого изменения(ий). Предпочтительные аффинно зрелые антитела обладают наномолярными или даже пикомолярными аффинностями в отношении антигена-мишени. Аффинно зрелые антитела получают известными в данной области способами. У Marks et al. Bio/Technology 10:779-783 (1992) описано созревание аффинности посредством перестановки доменов VH и VL. Случайный мутагенез CDR и/или остатков каркасной области описан у: Barbas et al. Proc Nat. Acad. Sci, USA 91:3809-3813 (1994); Schier et al. Gene 169:147-155 (1995); Yelton et al. J. Immunol. 155:1994-2004 (1995); Jackson et al., J. Immunol. 154(7):3310-9 (1995) и Hawkins et al., J. Mol. Biol. 226:889-896 (1992).
"Блокирующее" антитело или "антагонистическое" антитело представляет собой антитело, ингибирующее или снижающее биологическую активность антигена, с которым оно связывается. Предпочтительные блокирующие антитела или антагонистические антитела в значительной степени или полностью ингибируют биологическую активность антигена.
В настоящем документе "антитело-агонист" представляет собой антитело, имитирующее по меньшей мере один из видов функциональной активности представляющего интерес полипептида.
"Нарушение" представляет собой любой состояние, которому можно помочь посредством лечения веществом/молекулами или способом согласно изобретению. Оно включает в себя хронические и острые нарушения или заболевания, включая такие патологические состояния, которые создают предрасположенность млекопитающего к указанному нарушению. Неограничивающие примеры нарушений для лечения по настоящему документу включают в себя злокачественные и доброкачественные опухоли; нелейкозные и лимфоидные злокачественные образования; нейрональные, глиальные, астроцитарные, гипоталамические нарушения и нарушения других железе, макрофагальные, эпителиальные, стромальные и бластоцельные нарушения и воспалительные, иммунологические и другие связанные с ангиогенезом нарушения.
Термины "нарушение пролиферации клеток" и "нарушение пролиферации" относятся к нарушениям, ассоциированным с некоторой степенью аномальной клеточной пролиферации. В одном из вариантов осуществления нарушение пролиферации клеток представляет собой злокачественную опухоль.
В настоящем документе "опухоль" относится в целом к росту и пролиферации неопластических клеток, злокачественным или доброкачественным, и всем предзлокачественным и злокачественным клеткам и тканям. В настоящем документе термины "злокачественная опухоль", "злокачественный", "нарушение пролиферации клеток", "нарушение пролиферации" и "опухоль" не являются взаимоисключающими.
Термины "злокачественная опухоль" и "злокачественный" означают или описывают физиологическое состояние у млекопитающих, как правило, характеризующееся нерегулируемым клеточным ростом/пролиферацией. Примеры злокачественных опухолей включают в себя, в качестве неограничивающих примеров, карциному, лимфому, бластому, саркому и лейкоз. Более конкретные примеры таких злокачественных опухолей включают в себя плоскоклеточный рак, мелкоклеточный рак легких, немелкоклеточный рак легких, аденокарциному легких, сквамозную карциному легких, злокачественную опухоль брюшной полости, печеночно-клеточный рак, злокачественную опухоль желудочно-кишечного тракта, злокачественную опухоль поджелудочной железы, глиобластому, рак шейки матки, рак яичника, рак печени, злокачественную опухоль мочевого пузыря, гепатому, рак молочной железы, злокачественную опухоль толстого кишечника, колоректальный рак, рак эндометрия или матки, карциному слюнных желез, злокачественную опухоль почки, злокачественную опухоль печени, злокачественную опухоль предстательной железы, злокачественную опухоль наружных женских половых органов, злокачественную опухоль щитовидной железы, печеночную карциному и различные типы злокачественной опухоли головы и шеи.
В настоящем документе "лечение" относится к клиническому вмешательству с целью изменения естественного течения болезни подвергаемого лечению индивидуума или клетки, и его можно проводить или для профилактики, или в течение клинической патологии. Желательные эффекты лечения включают в себя предотвращение возникновения или рецидива заболевания, облегчение симптомов, сокращение любых прямых или непрямых патологических последствий заболевания, предотвращение метастазирования, снижение скорости прогрессирования заболевания, облегчение или ослабление болезненного состояния и ремиссию или улучшенный прогноз. В некоторых вариантах осуществления антитела согласно изобретению применяют для задержки развития заболевания или нарушения.
"Эффективное количество" относится к количеству, эффективному при дозах и в течение периодов времени, необходимых для достижения желательного терапевтического или профилактического результата.
"Терапевтически эффективное количество" вещества/молекулы согласно изобретению, агониста или антагониста могут варьировать, в зависимости от таких факторов как стадия заболевания, возраст, пол и масса индивидуума и способности вещества/молекулы, агониста или антагониста вызывать у индивидуума желательный ответ. Терапевтически эффективное количество также представляет собой количество, при котором любые токсические или вредные эффекты вещества/молекулы, агониста или антагониста перевешиваются терапевтически благоприятными эффектами. "Профилактически эффективное количество" относится к количеству, эффективному при дозах и в течение периодов времени, необходимых для достижения профилактического результата. Как правило, но не обязательно, так как профилактическую дозу применяют у субъектов до или на ранних стадиях заболевания, профилактически эффективное количество бывает меньшим, чем терапевтически эффективное количество.
В настоящем документе термин "цитотоксическое средство" относится к веществу, ингибирующему или предотвращающему функционирование клеток и/или вызывающему разрушение клеток. Термин предназначен для включения в него радиоактивных изотопов (например, At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32 и радиоактивные изотопы Lu), химиотерапевтических средств, например, метотрексата, адриамицина, алкалоидов барвинка (винкристина, винбластина, этопозида), доксорубицина, мелфалана, митомицина C, хлорамбуцила, даунорубицина или других интеркалирующих средств, ферментов и их фрагментов, таких как нуклеолитических ферментов, антител и токсинов, таких как низкомолекулярные токсины или ферментативно активные токсины бактериального, грибкового, растительного или животного происхождения, включая их фрагменты и/или варианты, и различных противоопухолевых или противораковых средств, описанных ниже. Ниже описаны другие цитотоксические средства. Уничтожающие опухоль средства вызывают разрушение опухолевых клеток.
"Химиотерапевтическое средство" представляет собой химическое соединение, пригодное для лечения злокачественной опухоли. Примеры химиотерапевтических средств включают в себя алкилирующие средства, такие как тиотепа и ЦИТОКСАН® (CYTOXAN®) циклофосфамид; алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины, включающие в себя алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилоломеламин; ацетогенины (особенно буллатацин и буллатацинон); дельта-9-тетрагидроканнабинол (дронабинол, МАРИНОЛ® (MARINOL®)); бета-лапахон; лапахол; колхицины; бетулиновая кислота; камптотецин (включая синтетический аналог топотекан (ГИКАМТИН® (HYCAMTIN®)), CPT-11 (иринотекан, КАМПТОЗАР® (CAMPTOSAR®)), ацетилкамптотецин, скополектин и 9-аминокамптотецин); бриостатин; каллистатин; CC-1065 (включая его адозелезиновые, карзелезиновые и бизелезиновые синтетические аналоги); подофиллотоксин; подофиллиновую кислоту; тенипозид; криптофицины (особенно криптофицин 1 и криптофицин 8); доластатин; дуокармицин (включая синтетические аналоги KW-2189 и CB1-TM1); элеутеробин; панкратистатин; саркодиктин; спонгистатин; азотистые иприты, такие как хлорамбуцил, хлорнафазин, холофосфамид, эстрамустин, ифосфамид, мехлоретамин, гидрохлорид оксида мехлоретамина, мелфалан, новембихин, фенестерин, преднимустин, трофосфамид, урамустин; нитрозомочевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин и ранимнустин; антибиотики, такие как ендииновые антибиотики (например, калихимицин, особенно калихимицин гаммаII и калихимицин омегаII (см., например, Agnew, Chem Intl. Ed. Engl., 33: 183-186 (1994)); динемицин, включая динемицин A; эсперамицин; а также хромофор неокарциностатин и родственные хромопротеиновые энедииновые антибиотические хромофоры), аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, карабицин, карминомицин, карцинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин (включая АДРИАМИЦИН® (ADRIAMYCIN®), морфолинодоксорубицин, цианоморфолинодоксорубицин, 2-пирролинодоксорубицин, липосомный инъекционный препарат доксорубицина HCl (ДОКСИЛ® (DOXIL®)) и дезоксидоксорубицин), эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, такие как митомицин C, микофеноловая кислота, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат, гемцитабин (ГЕМЗАР® (GEMZAR®)), тегафур (УФТОРАЛ® (UFTORAL®)), капецитабин (КСЕЛОДА® (XELODA®)), эпотилон и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; аналоги пурина, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидина, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин; андрогены, такие как калустерон, дромостанолона пропионат, эпитиостанол, мепитиостан, тестолактон; антиадренергические препараты, такие как аминоглутетимид, митотан, трилостан; компенсаторы фолиевой кислоты, такие как фролиновая кислота; ацеглатон; альдофосфамида гликозид; аминолевулиновую кислоту; энилурацил; амсакрин; бестрабуцил; бизантрен; эдатраксат; дефофамин; демеколин; диазиквон; эльфорнитин; эллиптиния ацетат; этоглюцид; нитрат галлия; гидроксимочевину; лентинан; лонидаинин; майтанзиноиды, такие как майтанзин и анзамитоцины; митогуазон; митоксантрон; мопиданмол; нитраэрин; пентостатин; фенамет; пирарубицин; лозоксантрон; 2-этилгидразид; прокарбазин; PSK® полисахаридный комплекс (JHS Natural Products, Eugene, OR); разоксан; ризоксин; сизофиран; спирогерманий; тенуазониевая кислота; триазиквон; 2,2',2"-трихлортриэтиламин; трихотецены (особенно токсин T-2, верракурин A, роридин A и ангуидин); уретан; виндезин (ЭЛДИЗИН® (ELDISINE®), ФИЛДЕЗИН® (FILDESIN®)); дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид ("Ara-C"); тиотепа; таксоиды, например, паклитаксел (ТАКСОЛ® (TAXOL®)), сконструированный на основе альбумина состав наночастиц паклитаксела (АБРАКСАН® (ABRAXANE™)) и доцетаксел (ТАКСОТЕР® (TAXOTERE®)); хлоранбуцил; 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин (ВЕЛБАН® (VELBAN®)); платина; этопозид (VP-16); ифосфамид; митоксантрон; винкристин (ОНКОВИН® (ONCOVIN®)); оксалиплатин; лейковорин; винорельбин (НАВЕЛБИН® (NAVELBINE®)); новантрон; эдатрексат; дауномицин; аминоптерин; ибандронат; ингибитор топоизомеразы RFS 2000; фифторметилорнитин (DMFO); ретиноиды, такие как ретиноевая кислота; фармацевтически приемлемые соли, кислоты или производные любого из указанного выше; а также сочетания двух или более из указанного выше, такие как CHOP, аббревиатура для комбинированной терапии циклофосфамидом, доксорубицином, винкристином и преднизолоном, и FOLFOX, аббревиатура для схемы лечения оксалиплатином (ЭЛОКСАТИН™ (ELOXATIN™)), комбинированного с 5-FU и лейковорином.
Также в это определение включены противогормональные средства, действующие для регуляции, уменьшения, блокирования или ингибирования воздействий гормонов, которые могут стимулировать рост злокачественной опухоли и часто применяемые в форме системного или общего лечения. Они могут представлять собой сами гормоны. Примеры включают в себя антиэстрогены и селективные модуляторы эстрогеновых рецепторов (SERM), включающие в себя, например, тамоксифен (включая тамоксифен НОЛВАДЕКС® (NOLVADEX®)), ралоксифен (ЭВИСТА® (EVISTA®)), дролоксифен, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и торемифен (ФАРЕСТОН® (FARESTON®)); антипрогестероновые средства; негативные регуляторы эстрогеновых рецепторов (ERD); антагонисты эстрогеновых рецепторов, такие как фулвестрант (ФАСЛОДЕКС® (FASLODEX®)); средства, функционирующие для супрессии или выключения яичников, например, агонисты релизинг-фактора лютеинизирующего гормона (LHRH), такие как лейпролида ацетат (ЛЮПРОН® (LUPRON®) и ЭЛИГАРД® (ELIGARD®)), гозерелина ацетат, бусерелина ацетат и триптерелин; другие антиандрогены, такие как флутамид, нилутамид и бикалутамид и ингибиторы ароматазы, ингибирующие фермент ароматазу, регулирующего продукцию эстрогенов в надпочечниках, такие как, например, 4(5)-имидазолы, аминоглутетимид, мегестрола ацетат (МЕГАЗА® (MEGASE®)), экземестан (АРОМАЗИН® (AROMASIN®)), форместан, фадрозол, ворозол (РИВИЗОР® (RIVISOR®)), летрозол (ФЕМАРА® (FEMARA®)) и анастрозол (АРИМИДЕКС® (ARIMIDEX®)). Кроме того, такое определение химиотерапевтических средств включает в себя бифосфонаты, такие как клодронат (например, БОНЕФОС® (BONEFOS®) или ОСТАК (OSTAC®)), этидронат (ДИДРОКАЛ® (DIDROCAL®)), NE-58095, золедроновая кислота/золедронат (ЗОМЕТА® (ZOMETA®)), алендронат (ФОСАМАКС® (FOSAMAX®)), памидронат (АРЕДИА® (AREDIA®)), тилудронат (СКЕЛИД® (SKELID®)) или ризедронат (АКТОНЕЛ® (ACTONEL®)); а также троксацитабин (1,3-диоксолановый аналог нуклеозида цитозина); антисмысловые олигонуклеотиды, особенно те, которые ингибируют экспрессию генов в путях передачи сигнала, участвующих в нарушенной клеточной пролиферации, такие как, например, PKC-альфа, Raf, H-Ras и рецептор эпидермального фактора роста (EGF-R); вакцины, такие как вакцина ТЕРАТОП® (THERATOPE®) и вакцины для генной терапии, например, вакцина АЛЛОВЕКТИН® (ALLOVECTIN®), вакцина ЛЕУВЕКТИН (LEUVECTIN®) и вакцина ВАКСИД® (VAXID®); ингибитор топоизомеразы 1 (например, ЛУРТОТЕКАН® (LURTOTECAN®)); rmRH (например, АБАРЕЛИКС® (ABARELIX®)); лапатиниба дитозилат (низкомолекулярный ингибитор двойной тирозинкиназы ErbB-2 и EGFR, также известный как GW572016); ингибиторы COX-2, такие как целекоксиб (ЦЕЛЕБРЕКС® (CELEBREX®); 4-(5-(4-метилфенил)-3-(трифторметил)-1H-пиразол-1-ил)бензолсульфонамид и фармацевтически приемлемые соли, кислоты или производные любого из указанного выше.
В настоящем документе "ингибирующее рост средство" относится к соединению или композиции, которые ингибируют рост клетки, рост которой зависит от активации HGF/c-met in vitro или in vivo. Таким образом, ингибирующее рост средство может представлять собой средство, которое в значительной степени уменьшает процентное содержащие зависимых от HGF/c-met клеток в S-фазе. Примеры ингибирующих рост средств включают в себя средства, которые блокируют прохождение клеточного цикла (в точке, отличной от S-фазы), такие как средства, которые индуцируют арест в фазе G1 и арест в M-фазе. Классические блокаторы M-фазы включают в себя препараты барвинка (винкристин и винбластин), таксаны и ингибиторы топоизомеразы II, такие как доксорубицин, эпирубицин, даунорубицин, этопозид, и блеомицин. Те средства, которые осуществляют арест в фазе G1, также осуществляют арест в S-фазе, например, алкилирующие ДНК средства, такие как тамоксифен, преднизон, дакарбазин, мехлоретамин, цисплатин, метотрексат, 5-фторурацил и ara-C. Дополнительную информацию можно найти в The Molecular Basis of Cancer, Mendelsohn and Israel, eds., глава 1, озаглавленная "Cell cycle regulation, oncogenes, and antineoplastic drugs" by Murakami et al. (WB Saunders: Philadelphia, 1995), особенно стр. 13. Таксаны (паклитаксел и доцетаксел) представляют собой противоопухолевые лекарственные средства, оба полученные из тисового дерева. Доцетаксел (ТАКСОТЕР® (TAXOTERE®), Rhone-Poulenc Rorer), полученный из европейского тиса, представляет собой полусинтетический аналог паклитаксела (ТАКСОЛ® (TAXOL®), Bristol-Myers Squibb). Паклитаксел и доцетаксел стимулируют сборку микротрубочек из димеров тубулина и стабилизируют микротрубочки, предотвращая деполимеризацию, что приводит к ингибированию митоза в клетках.
"Доксорубицин" представляет собой антрациклиновый антибиотик. Полное химическое название доксорубицина соответствует (8S-цис)-10-[(3-амино-2,3,6-тридезокси-α-L-ликсогексапиранозил)окси]-7,8,9,10-тетрагидро-6,8,11-тригидрокси-8-(гидроксиацетил)-1-метокси-5,12-нафтацендиону.
Композиции и способы согласно изобретению
A. Антитела
В одном из вариантов осуществления настоящее изобретение относится к антителам, которые могут найти применение, согласно настоящему описанию, в качестве терапевтических и/или диагностических средств. Иллюстративные антитела включают в себя поликлональные, моноклональные, гуманизированные, биспецифические и гетероконъюгированные антитела.
1. Поликлональные антитела
Поликлональные антитела предпочтительно индуцируют у животных посредством нескольких подкожных (sc) или интраперитонеальных (ip) инъекций соответствующего антигена и адъюванта. Может быть эффективным конъюгировать соответствующий антиген (особенно когда используют синтетические пептиды) с белком, являющимся иммуногенным у видов, которые подвергают иммунизации. Например, антиген можно конъюгировать с гемоцианином морского блюдца (KLH), сывороточным альбумином, бычьим тиреоглобулином или ингибитором соевого трипсина, с применением бифункционального или дериватизирующего средства, например малеимидобензоилсульфосукцинимидный сложный эфир (конъюгация через остатки цистеина), N-гидроксисукцинимид (через остатки лизина), глутаральдегид, янтарный ангидрид, SOCl2 или R1N=C=NR, где R и R1 представляют собой различные алкильные группы.
Животных иммунизируют против антигена, иммуногенных конъюгатов или дериватов посредством объединения, например, 100 мкг или 5 мкг белка или конъюгата (для кроликов или мышей, соответственно) с 3 объемами полного адъюванта Фрейнда, и внутрикожного введения раствора в нескольких местах. Через месяц животных подвергают поддерживающей иммунизации от 1/5 до 1/10 исходного количества пептида или конъюгата в полном адъюванте Фрейнда посредством подкожной инъекции в нескольких местах. После прохождения от 7 до 14 суток у животных забирают кровь и сыворотку анализируют на титр антител. Животных подвергают поддерживающей иммунизации до выхода титра на плато. Конъюгаты также можно получать в культуре рекомбинантных клеток в виде слитых белков. Также для усиления иммунного ответа удобно использовать вызывающие агрегацию средства, такие как квасцы.
2. Моноклональные антитела
Моноклональные антитела можно получать с применением гибридомного способа, впервые описанного Kohler et al., Nature, 256:495 (1975), или можно получать с применением способов рекомбинантной ДНК (патент США № 4816567).
В гибридомном способе мышь или другое подходящее животное-хозяина, такое как хомяк, иммунизируют, как описано выше, для получения лимфоцитов, продуцирующих или способных продуцировать антитела, специфически связывающихся с белком, используемым для иммунизации. Альтернативно, лимфоциты можно иммунизировать in vitro. После иммунизации лимфоциты выделяют, а затем сливают с линией миеломных клеток с применением подходящего средства, вызывающего слияние клеток, такого как полиэтиленгликоль с формированием гибридомной клетки (Goding, Monoclonal antibodies: Principles and Practice, p.59-103 (Academic Press, 1986)).
Полученные таким образом гибридомные клетки высевают и растят в подходящей среде для культивирования, которая предпочтительно содержит одно или несколько веществ, ингибирующих рост или выживание неиспользованных, исходных миеломных клеток (также обозначаемых как партнер по слиянию). Например, если в исходных миеломных клетках отсутствует фермент гипоксантингуанинфосфорибозилтрансфераза (HGPRT или HPRT), селективная среда для культивирования для гибридом, как правило, будет содержать гипоксантин, аминоптерин и тимидин (среда HAT), которые предотвращают рост клеток с дефицитом HGPRT.
Предпочтительными миеломными клетками-партнерами по слиянию являются клетки, которые эффективно сливаются, поддерживают стабильную высокую продукцию антитела у отобранных клеток, продуцирующих антитела, и являются чувствительными к селективной среде, осуществляющей селекцию от неслившихся исходных клеток. Предпочтительными линиями миеломных клеток являются мышиные миеломные линии, такие как линии, полученные из мышиных опухолей MOPC-21 и MPC-11, доступные из Salk Institute Cell Distribution Center, San Diego, California USA, и SP-2 и производные, например, клетки X63-Ag8-653, доступные из American Type Culture Collection, Manassas, Virginia, USA. Также для получения человеческих моноклональных антител описаны клеточные линии человеческой миеломы и гипермиеломы человека-мыши (Kozbor, J. Immunol., 133:3001 (1984); и Brodeur et al., Monoclonal antibody Production Techniques and Applications, pp. 51-63 (Marcel Dekker, Inc., New York, 1987)).
Среду для культивирования, в которой растут гибридомные клетки, оценивают на продукцию моноклональных антител, направленных к антигену. Предпочтительно специфичность связывания моноклональных антител, полученных из гибридомных клеток, определяют посредством иммунопреципитации или посредством анализа связывания in vitro, такого как радиоиммунологический анализ (RIA) или твердофазный иммуноферментный анализ (ELISA).
Аффинность связывания моноклонального антитела, например, можно определять посредством анализа Скэтчарда, описанного у Munson et al., Anal. Biochem., 107:220 (1980).
После того, как идентифицированы гибридомные клетки, продуцирующие антитела желательной специфичности, аффинности и/или активности, клоны можно субклонировать посредством серийных разведений и выращивать стандартными способами (Goding, Monoclonal antibodies: Principles and Practice, p.59-103 (Academic Press, 1986)). Подходящие для этих целей среды для культивирования включают в себя, например, среду D-MEM или RPMI-1640. Кроме того, гибридомные клетки можно выращивать in vivo в виде асцитных опухолей у животных, например, с помощью i.p. инъекции клеток мышам.
Моноклональные антитела, секретируемые субклонами, подходящим способом выделяют среды для культивирования, асцитной жидкости или сыворотки общепринятыми способами очистки антител, такими как, например, аффинная хроматография (например, с применением сефарозы с белком A или белком G) или ионообменная хроматография, хроматография на гидроксиапатите, электрофорез в геле, диализ и т.д.
ДНК, кодирующую моноклональные антитела, легко выделять и секвенировать с применением общепринятых способов (например, с применением олигонуклеотидных зондов, способных специфически связываться с генами, кодирующими тяжелые и легкие цепи мышиных антител). Гибридомные клетки служат предпочтительным источником такой ДНК. После выделения ДНК можно поместить в экспрессирующие векторы, которые затем трансфицируют в клетки-хозяева, такие как клетки E. coli, клетки COS обезьяны, клетки китайского хомяка (CHO) или миеломные клетки, которые в ином случае не продуцируют белок антитела, для обеспечения синтеза моноклональных антител в рекомбинантных клетках-хозяевах. Обзорные статьи о рекомбинантной экспрессии в бактериях ДНК, кодирующей антитело, включают в себя Skerra et al., Curr. Opinion in Immunol., 5:256-262 (1993) и Pluckthun, Immunol. Revs. 130:151-188 (1992).
В дополнительных вариантах осуществления моноклональные антитела или фрагменты антител можно выделять из фаговых библиотек антител, полученных с применением способов, описанных у McCafferty et al., Nature, 348:552-554 (1990). В Clackson et al., Nature, 352:624-628 (1991) и Marks et al., J. Mol. Biol., 222:581-597 (1991) описано выделение мышиных и человеческих антител, соответственно, с применением фаговых библиотек. В последующих публикациях описано получение человеческих антител с высокой аффинностью (нМ диапазон) посредством перестановки цепей (Marks et al., Bio/Technology, 10:779-783 (1992)), а также сочетанной инфекции и рекомбинации in vivo в качестве стратегии для конструирования очень больших фаговых библиотек (Waterhouse et al., Nuc. Acids. Res. 21:2265-2266 (1993)). Таким образом, эти способы представляют собой конкурентные альтернативы традиционным способам продукции моноклональных антител посредством гибридом для выделения моноклональных антител.
ДНК, кодирующую антитело, можно модифицировать для получения химерных или слитых полипептидов антител, например, посредством замены на человеческие последовательности константных доменов тяжелых и легких цепей (CH и CL) гомологичных мышиных последовательностей (патент США № 4816567; и Morrison, et al., Proc. Natl Acad. Sci. USA, 81:6851 (1984)), или посредством слияния кодирующей последовательности иммуноглобулина со всей или частью кодирующей последовательности для не являющегося иммуноглобулином полипептида (гетерологичный полипептид). Последовательности не являющихся иммуноглобулинами полипептидов могут замещать константные домены антитела или ими замещают вариабельные домены одного антигенсвязывающего участка антитела для получения химерного бивалентного антитела, содержащего один антигенсвязывающий участок со специфичностью к одному антигену и другой антигенсвязывающий участок со специфичностью к другому антителу.
3. Человеческие и гуманизированные антитела
Антитела согласно изобретению могут дополнительно включать в себя гуманизированные антитела или человеческие антитела. Гуманизированные формы не являющихся человеческими (например, мышиных) антител представляют собой химерные иммуноглобулины, цепи иммуноглобулинов или их фрагменты (такие как Fv, Fab, Fab', F(ab')2 или другие антигенсвязывающие подпоследовательности антител), которые содержат минимальную последовательность, полученную из не являющегося человеческим иммуноглобулина. Гуманизированные антитела включают в себя человеческие иммуноглобулины (реципиентное антитело), в которых остатки из определяющей комплементарность области (CDR) реципиента замещены остатками из CDR не являющихся человеком видов (донорное антитело), таких как мышь, крыса или кролик с желательной специфичностью, аффинностью и емкостью. В некоторых случаях каркасные остатки Fv человеческого иммуноглобулина замещены соответствующими не принадлежащими человеку остатками. Гуманизированные антитела также могут содержать остатки, которых нет ни в реципиентном антителе, ни в импортированных CDR или каркасных последовательностях. В основном гуманизированное антитело содержит по существу все по меньшей мере один, а, как правило, два, вариабельных домена, в которых все, или по существу все, из областей CDR соответствуют областям из не являющегося человеческим иммуноглобулина, а все, или по существу все, из областей FR представляют собой области консенсусной последовательности человеческого иммуноглобулина. Оптимально гуманизированное антитело также будет содержать по меньшей мере часть константной области иммуноглобулина (Fc), как правило, константной области человеческого иммуноглобулина [Jones et al., Nature, 321:522-525 (1986); Riechmann et al., Nature, 332:323-329 (1988) и Presta, Curr. Op. Struct. Biol., 2:593-596 (1992)].
Способы гуманизирования не являющихся человеческими антител хорошо известны в данной области. Как правило, гуманизированное антитело несет один или несколько аминокислотных остатков, введенных в него из источника, который не является человеком. Эти не являющиеся человеческими аминокислотные остатки часто обозначают как "импортированные" остатки, которые, как правило, берут из "импортируемого" вариабельного домена. Гуманизирование по существу можно проводить по способу Winter и коллег [Jones et al., Nature, 321:522-525 (1986); Riechmann et al., Nature. 332:323-327 (1988); Verhoeyen et al., Science, 239:1534-1536 (1988)], замещая CDR или последовательностями CDR грызунов соответствующие последовательности человеческого антитела. Таким образом, такие "гуманизированные" антитела представляют собой химерные антитела (патент США № 4816567), где соответствующей последовательностью из не являющихся человеком видов замещено значительно меньше, чем интактный человеческий вариабельный домен. На практике гуманизированные антитела, как правило, представляют собой человеческие антитела, в которых некоторые остатки CDR и, возможно, некоторые остатки FR замещены остатками из аналогичных участков антител грызунов.
Выбор человеческих вариабельных доменов, легкого и тяжелого, для использования в получении гуманизированных антител очень важен для уменьшения антигенности и ответа HAMA (антитело человека к антителу мыши), когда антитело предназначено для терапевтического применения у людей. В соответствии с так называемым способом "наилучшего соответствия" последовательность вариабельного домена антитела грызуна скринируют по отношению полной библиотеки известных последовательностей человеческих вариабельных доменов. Идентифицируют последовательность человеческого домена V, которая наиболее близка домену V грызуна, и для гуманизированного антитела берут человеческую каркасную область (FR) из него (Sims et al., J. Immunol. 151:2296 (1993); Chothia et al., J. Mol. Biol., 196:901 (1987)). В другом способе используют конкретную каркасную область, полученную из консенсусной последовательности всех человеческих антител конкретной подгруппы легких или тяжелых цепей. Одну и ту же каркасную область можно использовать для нескольких различных гуманизированных антител (Carter et al., Proc. Natl. Acad. Sci. USA. 89:4285 (1992); Presta et al., J. Immunol. 151:2623 (1993)).
Кроме того, важно, чтобы антитела подвергались гуманизированию с сохранением высокой аффинности связывания в отношении антигена и других благоприятных биологических свойств. Для достижения этой цели, в соответствии с предпочтительным способом, гуманизированные антитела получают с применением способа анализа исходных последовательностей и различных умозрительных гуманизированных продуктов с применением трехмерных моделей исходной и гуманизированной последовательностей. Трехмерные модели иммуноглобулинов являются общедоступными и хорошо известны специалистам в данной области. Доступны компьютерные программы, которые иллюстрируют и отображают возможные трехмерные конформационные структуры выбранных последовательностей иммуноглобулинов-кандидатов. Изучение этих изображений позволяет провести анализ вероятной роли остатков в функционировании последовательности иммуноглобулина-кандидата, т.е. анализ остатков, которые влияют на способность иммуноглобулина-кандидата связывать антиген. Таким образом, можно выбрать и комбинировать остатки FR из реципиента и импортируемых последовательностей так, чтобы достичь желательных характеристик антитела, таких как увеличенная аффинность для антигена(ов)-мишени(ей). В основном в воздействие на связывание антигена прямо и наиболее значительно вовлечены остатки гипервариабельной области.
Рассматривают различные формы гуманизированного антитела. Например, гуманизированное антитело может быть фрагментом антитела, таким как Fab, который необязательно конъюгирован с одним или несколькими цитотоксическими средствами с целью получения иммуноконъюгата. Альтернативно, гуманизированное антитело может представлять собой интактное антитело, такое как интактное антитело IgG1.
В качестве альтернативы гуманизированию, можно получать человеческие антитела. Например, в настоящее время возможно получать трансгенных животных (например, мышей), которые после иммунизации способны продуцировать полный репертуар человеческих антител в отсутствие продукции эндогенных иммуноглобулинов. Например, описано, что гомозиготная делеция гена соединительной области тяжелой цепи (JH) антитела у химерных и зародышевых мутантов мышей приводит к полному ингибированию продукции эндогенных антител. Перенос набора человеческих зародышевых генов иммуноглобулинов таким зародышевым мутантам приводит к продукции после стимуляции антигеном человеческих антител. См., например, Jakobovits et al., Proc. Natl. Acad. Sci. USA. 90:2551 (1993); Jakobovits et al., Nature, 362:255-258 (1993); Bruggemann et al., Year in Immuno. 7:33 (1993); патенты США № 5545806, 5569825, 5591669 (все GenPharm); 5545807 и WO 97/17852.
Альтернативно, для получения человеческих антител и фрагментов антител in vitro из репертуара генов вариабельных (V) доменов иммуноглобулинов от неиммунизированных доноров можно применять технологию фагового дисплея (McCafferty et al., Nature 348:552-553 [1990]). В соответствии с этим способом гены V-доменов антител клонируют в рамку считывания в ген основного или минорного белка оболочки нитевидного бактериофага, такого как M13 или fd, и представляют в виде функциональных фрагментов антител на поверхности фаговой частицы. Так как нитевидная частица содержит копию одноцепочечной ДНК фагового генома, выбор на основе функциональных свойств антитела также приводит к выбору гена, кодирующего антитело, проявляющего эти свойства. Таким образом, фаги имитируют некоторые свойства B-клетки. Фаговый дисплей можно проводить в различных форматах, рассмотренных, например, у Johnson, Kevin S. and Chiswell, David J., Current Opinion in Structural Biology 3:564-571 (1993). Для фагового дисплея можно использовать различные источники сегментов V-генов. Clackson et al., Nature, 352:624-628 (1991) выделили набор разнообразных антител к оксазолону из малой случайной комбинаторной библиотеки V-генов, полученных из селезенки иммунизированных мышей. Можно сконструировать репертуар V-генов от неиммунизированных человеческих доноров и антитела для набора различных антигенов (включая собственные антигены) можно выделять, по существу следуя способам, описанным Marks et al., J. Mol. Biol. 222:581-597 (1991) или Griffith et al., EMBO J. 12:725-734 (1993). См., также, патенты США № 5565332 и 5573905.
Как указано выше, человеческие антитела также можно получать посредством активированных in vitro B-клеток (см. патенты США 5567610 и 5229275).
4. Фрагменты антител
В определенных обстоятельствах выгодно применять фрагменты антител, а не целые антитела. Меньший размер фрагментов обеспечивает быстрое выведение и может приводить к улучшенному доступу к солидным опухолям.
Для получения фрагментов антител разработаны различные способы. Как правило, эти фрагменты получают посредством протеолитического расщепления интактных антител (см., например, Morimoto et al., Journal of Biochemical and Biophysical Methods 24:107-117 (1992) и Brennan et al., Science, 229:81 (1985)). Однако эти фрагменты в настоящее время можно получать непосредственно с применением рекомбинантных клеток-хозяев. Все фрагменты антител, Fab, Fv и ScFv, можно экспрессировать в E. coli и секретировать из нее, таким образом, обеспечивая легкое получение больших количеств этих фрагментов. Фрагменты антител можно выделять из фаговых библиотек антител, обсуждаемых выше. Альтернативно, фрагменты Fab'-SH можно непосредственно восстанавливать из E. coli и химически связывать с образованием фрагментов F(ab')2 (Carter et al., Bio/Technology 10:163-167 (1992)). В соответствии с другим подходом фрагменты F(ab')2 можно выделять непосредственно из культуры рекомбинантных клеток-хозяев. В патенте США № 5869046 описаны фрагменты Fab и F(ab')2 с увеличенным временем полувыведения in vivo, содержащие остатки эпитопа связывания рецептора спасения. Практикующим специалистам в данной области очевидны другие способы получения фрагментов антител. В других вариантах осуществления антителом выбора является одноцепочечный фрагмент Fv (scFv). См. WO 93/16185; патент США № 5571894 и патент США № 5587458. Только Fv и sFv являются молекулами с интактным участком связывания, у которых отсутствуют константные области; таким образом, они подходят для уменьшенного неспецифического связывания в течение применения in vivo. Можно сконструировать слитые белки sFv с образованием соединения эффекторного белка с N- или C-концом sFv. См. Antibody Engineering, ed. Borrebaeck, выше. Фрагмент антитела также может представлять собой "линейное антитело", например, как описано в патенте США 5641870. Такие линейные фрагменты антител могут быть моноспецифическими или биспецифическими.
5. Биспецифические антитела
Биспецифические антитела представляют собой антитела, обладающие специфичностью связывания, по меньшей мере, с двумя различными эпитопами. Типичные биспецифические антитела могут связываться с двумя различными эпитопами гепсина, HGF и/или комплекса гепсин:HGF, как описано в данном документе. Другие такие антитела могут сочетать участок связывания этих структур с участком связывания для другого полипептида. Альтернативно плечо антитела можно комбинировать с плечом, которое связывает тригерную молекулу на лейкоците, такую как молекулу T-клеточного рецептора (например CD3), или Fc-рецепторы для IgG (FcγR), такие как FcγRI (CD64), FcγRII (CD32) и FcγRIII (CD16), так чтобы сфокусировать и локализовать клеточные защитные механизмы на экспрессирующей и/или связывающей гепсин и/или HGF клетке. Биспецифические антитела также можно применять для локализации цитотоксических средств на клетках, экспрессирующих и/или связывающих гепсин, HGF и/или комплекс гепсин:HGF. Эти антитела несут связывающее полипептид плечо и плечо, связывающее цитотоксическое средство (например, сапорин, антитело к интерферону α, алкалоид барвинка, цепь рицина A, метотрексат или гаптен с радиоактивным изотопом). Биспецифические антитела можно получать в виде полноразмерных антител или фрагментов антител (например, биспецифические антитела F(ab')2).
В WO 96/16673 описано биспецифическое антитело к ErbB2/FcγRIII, а в патенте США № 5837234 описано биспецифическое антитело к ErbB2/FcγRI. Биспецифическое антитело к ErbB2/Fcα показано в WO98/02463. В патенте США № 5821337 указано биспецифическое антитело к ErbB2/CD3.
Способы получения биспецифических антител известны в данной области. Общепринятое получение полноразмерных биспецифических антител основано на коэкспрессии двух пар тяжелой цепи-легкой цепи иммуноглобулинов, где две цепи обладают различными специфичностями (Millstein et al., Nature 305:537-539 (1983)). Вследствие случайной сортировки тяжелых и легких цепей иммуноглобулинов эти гибридомы (квадромы) продуцируют потенциальную смесь из 10 различных молекул антител, из которых только одна обладает правильной биспецифической структурой. Очистка правильной молекулы, которую обычно проводят посредством стадий аффинной хроматографии, является достаточно трудоемкой, а выход продукта является низким. Подобные способы описаны в WO 93/08829 и у Traunecker et al., EMBO J. 10:3655-3659 (1991).
Согласно другому подходу вариабельные домены антител с желательной специфичностью связывания (участок связывания антигена с антителом) объединяют с последовательностями константных доменов иммуноглобулинов. Предпочтительно объединение проводят с константным доменом тяжелой цепи Ig, содержащей, по меньшей мере, часть шарнирной области, области CH2 и CH3. Предпочтительно иметь расположенную по меньшей мере на одной из слитых структур первую константную область тяжелой цепи (CH1), содержащую участок, необходимой для связывания легкой цепи. ДНК, кодирующие слитые тяжелые цепи иммуноглобулинов и, если желательно, легкие цепи иммуноглобулинов, вставляют в отдельные экспрессирующие векторы и котрансфицируют в подходящую клетку-хозяина. Это обеспечивает большую гибкость в регулировке общих пропорций трех полипептидных фрагментов в вариантах осуществления, когда оптимальный выход желательного биспецифического антитела обеспечивают неравные соотношения применяемых в конструкции трех полипептидных цепей. Однако в один экспрессирующий вектор можно вставлять кодирующие последовательности двух или всех трех полипептидных цепей, когда экспрессия по меньшей мере двух полипептидных цепей в равном соотношении приводит к высоким выходам или когда соотношение не имеет значительного влияния на выход желательного сочетания цепей.
В предпочтительном варианте осуществления этого подхода биспецифические антитела состоят из тяжелой цепи гибридного иммуноглобулина с первой специфичностью связывания на одном плече и пары тяжелая цепь-легкая цепь гибридного иммуноглобулина (обеспечивающей вторую специфичность связывания) на другом плече. Обнаружено, что такая ассиметричная структура облегчает разделение желательного биспецифичного соединения от нежелательных сочетаний цепей иммуноглобулинов, так как присутствие легкой цепи иммуноглобулина только в одной половине биспецифической молекулы обеспечивает простой путь разделения. Этот подход описан в WO 94/04690. Более подробно о получении биспецифических антител см., например, Suresh et al., Methods in Enzymology 121:210 (1986).
Согласно другому подходу, описанному в патенте США № 5731168, поверхность контакта между парой молекул антител можно сконструировать так, чтобы максимизировать долю гетеродимеров, восстанавливаемых из культуры рекомбинантных клеток. Предпочтительная поверхность раздела содержит, по меньшей мере, часть домена CH3. В данном способе одну или несколько аминокислот с маленькими боковыми цепями на поверхности раздела молекулы первого антитела заменяют на аминокислоты с большими боковыми цепями (например, тирозин или триптофан). На поверхности раздела второй молекулы антитела создают компенсирующие "полости" идентичного или сходного с большими боковыми цепями размера посредством замены аминокислот с большими боковыми цепями на аминокислоты с меньшими боковыми цепями (например, аланин или треонин). Это обеспечивает механизм для увеличения выхода гетеродимера по отношению к другим нежелательным конечным продуктам, таким как гомодимеры.
Биспецифические антитела включают в себя сшитые или "гетероконъюгированные" антитела. Например, одно из антител в гетероконъюгате может быть связанным с авидином, а другое - с биотином. Такие антитела были предложены, например, для направления клеток иммунной системы к нежелательным клеткам (патент США № 4676980) и для лечения ВИЧ-инфекции (WO 91/00360, WO 92/200373 и EP 03089). Гетероконъюгированные антитела можно получать с применением любых удобных способов сшивки. Подходящие сшивающие средства хорошо известны в данной области и описаны в патенте США № 4676980, вместе с рядом способов сшивания.
Способы получения биспецифических антител из фрагментов антител также описаны в литературе. Например, биспецифические антитела можно получать с использованием химического связывания. У Brennan et al., Science 229:81 (1985) описан способ, где интактные антитела протеолитически расщепляли с получением фрагментов F(ab')2. Эти фрагменты восстанавливали в присутствие образующего комплексы с дитиолом реагента, арсенита натрия, для стабилизации присутствующих дитиолов и предотвращения образования межмолекулярных дисульфидных связей. Затем получаемые фрагменты Fab' преобразуют в производные тионитробензоата (TNB). Одно из производных Fab'-TNB затем снова преобразуют в Fab'-тиол восстановлением меркаптоэтиламином и смешивают с эквимолярным количеством другого производного Fab'-TNB с получением биспецифического антитела. Получаемые биспецифические антитела можно использовать в качестве средств для селективной иммобилизации ферментов.
Недавний прогресс облегчил прямое восстановление из E. coli фрагментов Fab'-SH, которые можно химически связать с формированием биспецифических антител. У Shalaby et al., J. Exp. Med. 175: 217-225 (1992) описано получение молекулы полностью гуманизированного биспецифического антитела F(ab')2. Каждый фрагмент Fab' раздельно секретируют из E. coli и подвергают прямому химическому связыванию in vitro с формированием биспецифического антитела. Сформированное таким образом биспецифическое антитело способно связываться с клетками, сверхэкспрессирующими рецептор ErbB2 и нормальными человеческими T-клетками, а также инициировать литическую активность человеческих цитотоксических лимфоцитов против мишеней рака молочной железы человека. Также описаны различные способы получения и выделения фрагментов биспецифических антител непосредственно из культуры рекомбинантных клеток. Например, биспецифические антитела получали с применением лейциновых молний. Kostelny et al., J. Immunol. 148(5): 1547-1553 (1992). Пептиды с лейциновыми молниями из белков Fos и Jun связывали с частями Fab' двух различных антител посредством слияния генов. Гомодимеры антител восстанавливали по шарнирной области с формированием мономеров, а затем снова окисляли с формированием гетеродимеров антител. Этот способ также можно применять для получения гомодимеров антител. Технология "диател", описанная у Hollinger et al., Proc. Natl. Acad. Sci. USA 90:6444-6448 (1993), предоставляет альтернативный механизм получения фрагментов биспецифических антител. Фрагменты содержат VH, соединенный с VL посредством линкера, который является слишком коротким, чтобы позволить спаривание двух доменов одной и той же цепи. Таким образом, домены VH и VL одного фрагмента принуждают образовывать пару с комплементарными доменами VL и VH другого фрагмента, тем самым формируя два антигенсвязывающих участка. Также описана другая стратегия получения фрагментов биспецифических антител посредством использования димеров одноцепочечных антител Fv (sFv). См. Gruber et al., J. Immunol., 152:5368 (1994).
Рассматривают антитела более чем с двумя валентностями. Например, можно получать триспецифические антитела. Tutt et al., J. Immunol. 147:60 (1991).
6. Гетероконъюгированные антитела
Гетероконъюгированные антитела также входят в объем настоящего изобретения. Гетероконъюгированные антитела состоят из двух ковалентно связанных антител. Например, такие антитела предлагали для направления клеток иммунной системы к нежелательным клеткам [патент США № 4676980] и для лечения ВИЧ-инфекции [WO 91/00360; WO 92/200373; EP 03089]. Полагают, что антитела можно получать in vitro с применением известных в химии синтетических белков способов, включая способы с применением сшивающих реагентов. Например, с применением реакции замещения дисульфидов или посредством формирования тиоэфирной связи можно сконструировать иммунотоксины. Примеры подходящих для данной цели реагентов включают в себя иминотиолат и метил-4-меркаптобутиримидат и реагенты, описанные, например, в патенте США № 4676980.
7. Поливалентные антитела
Поливалентное антитело клеткой, экспрессирующей антиген, с которым связывается антитела, может интернализироваться (и/или катаболизироваться) быстрее, чем бивалентное антитело. Антитела согласно настоящему изобретению могут представлять собой поливалентные антитела (которые часто принадлежат отличному от класса IgM классу) с тремя или более антигенсвязывающими участками (например, тетравалентные антитела), которые можно легко получать посредством рекомбинантной экспрессии нуклеиновой кислоты, кодирующей полипептидные цепи антитела. Поливалентное антитело может содержать домен димеризации и три или более антигенсвязывающих участка. Предпочтительный домен димеризации содержит Fc-область или шарнирную область (или состоит из них). При этих условиях антитело будет содержать Fc-область и три или более антигенсвязывающих участка с N-конца от Fc-области. Предпочтительное поливалентное антитело по данному документу содержит от трех до приблизительно восьми, но предпочтительно четыре, антигенсвязывающих участка (или состоит из них). Поливалентное антитело содержит, по меньшей мере, одну полипептидную цепь (а предпочтительно две полипептидные цепи), где полипептидная цепь(и) содержит два или более вариабельных домена. Например, полипептидная цепь(и) может содержать VD1-(X1)n-VD2-(X2)n-Fc, где VD1 представляет собой первый вариабельный домен, VD2 представляет собой второй вариабельный домен, Fc представляет собой одну полипептидную цепь Fc-области, X1 и X2 представляют собой аминокислоту или полипептид, а n представляет собой 0 или 1. Например, полипептидная цепь(и) могут содержать: цепь VH-CH1-гибкий линкер-VH-CH1-Fc-область или цепь VH-CH1-VH-CH1-Fc-область. Поливалентное антитело по данному документу предпочтительно дополнительно содержит по меньшей мере две (а предпочтительно четыре) полипептида вариабельных доменов легких цепей. Поливалентное антитело по данному документу может, например, содержать приблизительно от двух до приблизительно восьми полипептидов вариабельных доменов легких цепей. Рассматриваемые в данном документе полипептиды вариабельных доменов легких цепей содержат вариабельный домен легкой цепи и, необязательно, дополнительно содержат домен CL.
8. Организация эффекторной функции
Может быть желательным модифицировать антитело согласно изобретению в отношении эффекторной функции, например, так, чтобы усилить обусловленную антигеном опосредованную клетками цитотоксичность (ADCC) и/или обусловленную комплементом цитотоксичность (CDC) антитела. Этого можно достигнуть введением одной или нескольких замен аминокислот в Fc-область антитела. Альтернативно или дополнительно, в Fc-область можно ввести цистеиновый остаток(ки), тем самым, обеспечивая возможность формирования в этой области дисульфидной связи между цепями. Полученное таким образом гомодимерное антитело может обладать улучшенной способностью к интернализации и/или увеличенным обусловленным комплементом уничтожением клеток и обусловленной антителами клеточной цитотоксичностью (ADCC). См. Caron et al., J. Exp Med. 176:1191-1195 (1992) и Shopes. B. J. Immunol. 148:2918-2922 (1992). Гомодимерные антитела с увеличенной противоопухолевой активностью также можно получать с применением гетеробифункциональных сшивающих средств, как описано в Wolff et al., Cancer Research 53:2560-2565 (1993). Альтернативно, можно сконструировать антитело, которое обладает двумя Fc-областями и, таким образом, обладает увеличенными способностями в отношении лизиса комплементом и ADCC. См. Stevenson et al., Anti-Cancer Drugs Design 3:219-230 (1989). Для увеличения времени полужизни антитела в сыворотке, в антитело можно ввести эпитоп связывания рецептора спасения (особенно фрагмент антитела), например, как описано в патенте США 5739277. Как применяют в настоящем документе, термин "эпитоп связывания рецептора спасения" относится к эпитопу Fc-области молекулы IgG (например, IgG1, IgG2, IgG3 или IgG4), ответственному за увеличение времени полужизни молекулы IgG в сыворотке in vivo.
9. Иммуноконъюгаты
Изобретение также относится к иммуноконъюгатам или конъюгатам антитело-лекарственное средство (ADC), содержащим антитело, конъюгированное с цитотоксическим средством, таким как химиотерапевтическое средство, лекарственное средство, ингибирующее рост средство, токсин (например, ферментативно активный токсин бактериального, грибкового, растительного или животного происхождения или его фрагменты) или радиоактивный изотоп (т.е. радиоконъгат).
Применение конъюгатов антитело-лекарственное средство для локальной доставки цитотоксических или цитостатических средств, т.е. лекарственных средств уничтожения или ингибирования опухолевых клеток при лечении злокачественной опухоли (Syrigos and Epenetos (1999) Anticancer Research 19:605-614; Niculescu-Duvaz and Springer (1997) Adv. Drg Del. Rev. 26:151-172; патент США 4975278) теоретически обеспечивает направленную доставку молекул лекарственного средства в опухоли и внутриклеточное накопление в них там, где системное введение этих неконъюгированных лекарственных средств кроме опухолевых клеток, которые стремятся удалить, может приводить к неприемлемым уровням токсичности для нормальных клеток (Baldwin et al., (1986) Lancet pp. (Mar. 15, 1986):603-05; Thorpe, (1985) "Antibody Carriers Of Cytotoxic Agents In Cancer Therapy: A Review," в Monoclonal Antibodies '84: Biological And Clinical Applications, A. Pinchera et al. (ed.s), p. 475-506). Таким образом, добиваются максимальной эффективности при минимальной токсичности. Сообщалось, что для этих способов пригодны и поликлональные антитела, и моноклональные антитела (Rowland et al., (1986) Cancer Immunol. Immunother., 21:183-87). Используемые в этих способах лекарственные средства включают в себя дауномицин, доксорубицин, метотрексат и виндезин (Rowland et al., (1986), выше). Используемые для конъюгатов антитело-токсин токсины включают в себя бактериальные токсины, такие как дифтерийный токсин, растительные токсины, такие как рицин, низкомолекулярные токсины, такие как гелданамицин (Mandler et al. (2000) Jour. of the Nat. Cancer Inst. 92(19):1573-1581; Mandler et al. (2000) Bioorganic & Med. Chem. Letters 10:1025-1028; Mandler et al (2002) Bioconjugate Chem. 13:786-791), майтанзиноиды (EP 1391213; Liu et al., (1996) Proc. Natl. Acad. Sci. USA 93:8618-8623) и калихимицин (Lode et al (1998) Cancer Res. 58:2928; Hinman et al (1993) Cancer Res. 53:3336-3342). Токсины могут осуществлять их цитотоксическое и цитостатическое действие посредством механизмов, включающих в себя связывание тубулина, связывание ДНК или ингибирование топоизомераз. Некоторые цитотоксические лекарственные средства при конъюгации с большими антителами или белковыми лигандами рецепторов имеют тенденцию становиться неактивными или менее активными.
ЗЕВАЛИН® (ZEVALIN®) (ибритумомаб тиуксетан, Biogen/Idec) представляет собой конъюгат антитело-радиоактивный изотоп, состоящий из мышиного моноклонального антитела IgG1 каппа, направленного к антигену CD20, находящемуся на поверхности нормальных и злокачественных B-лимфоцитов, и радиоактивного изотопа 111In или 90Y, связанных посредством тиокарбамидного линкера-хелатора (Wiseman et al (2000) Eur. Jour. Nucl. Med. 27(7):766-77; Wiseman et al (2002) Blood 99(12):4336-42; Witzig et al (2002) J. Clin. Oncol. 20(10):2453-63; Witzig et al (2002) J. Clin. Oncol. 20(15):3262-69). Хотя ЗЕВАЛИН обладает активностью против B-клеточной неходжкинской лимфомы (NHL), введение приводит к тяжелым и продолжительным цитопениям у большинства пациентов. МИЛОТАРГ (MYLOTARG™) (гемтузумаб озогамицин, Wyeth Pharmaceuticals), конъюгат антитело-лекарственное средство, состоящий из гуманизированного антитела к CD33, связанного с калихимицином в 2000 году одобрен для лечения острого миелоидного лейкоза посредством инъекции (Drugs of the Future (2000) 25(7):686; патенты США № 4970198; 5079233; 5585089; 5606040; 5693762; 5739116; 5767285; 5773001). Кантузумаб мертанзин (Immunogen, Inc.), конъюгат антитело-лекарственное средство, состоящий из антитела huC242, посредством дисульфидного линкера SPP, связанного с молекулой майтанзиноидного лекарственного вещества, DM1, проходит II фазу испытаний для лечения злокачественных опухолей, экспрессирующих CanAg, таких как рак толстой кишки, рак поджелудочной железы, рак желудка и другие. В процессе разработки для потенциального лечения опухолей предстательной железы находится MLN-2704 (Millennium Pharm., BZL Biologiсs, Immunogen Inc.), конъюгат антитело-лекарственное средство, состоящий из моноклонального антитела к специфичному для предстательной железы мембранному антигену (PSMA), связанного с молекулой майтанзиноидного лекарственного вещества, DM1. Пептиды ауристатина, ауристатин E (AE) и монометилауристатин (MMAE), синтетические аналоги доластатина, конъюгировали с химерными моноклональными антителами cBR96 (специфичными в отношении Lewis Y на карциномах) и cAC10 (специфичному в отношении CD30 на злокачественных новообразованиях гематологического происхождения) (Doronina et al (2003) Nature Biotechnology 21(7):778-784), и они находятся в терапевтической разработке.
Химиотерапевтические средства, пригодные для получения таких иммуноконъюгатов, описаны выше. Ферментативно активные токсины и их фрагменты, которые можно использовать, включают в себя A-цепь дифтерийного токсина, не связывающиеся активные фрагменты дифтерийного токсина, A-цепь экзотоксина (из Pseudomonas aeruginosa), A-цепь рицина, A-цепь абрина, A-цепь модецина, альфа-сарцин, белки Aleurites fordii, диантиновые белки, белки Phytolaca americana (PAPI, PAPII и PAP-S), ингибитор Momordica charantia, курцин, кротин, ингибитор Sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трикотецены. Для получения радиоконъюгированных антител доступно множество радионуклидов. Примеры включают в себя 212Bi, 131I, 131In, 90Y и 186Re. Конъюгаты антитела и цитотоксического средства получают с применением множества бифункциональных связывающих белки средств, таких как N-сукцинимидил-3-(2-пиридилдитиол)пропионат (SPDP), иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметиладипимидат HCl), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаральдегид), бис-азидо-соединения (такие как бис-(п-азидобензоил)гександиамин), производные бис-диазония (такие как бис-(п-диазонийбензоил)этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат) и соединения с двумя атомами активного фтора (такие как 1,5-дифтор-2,4-динитробензол). Например, рициновый иммунотоксин можно получать, как описано у Vitetta et al., Science, 238: 1098 (1987). Иллюстративным хелатирующим средством для конъюгации радионуклеотида с антителом является меченная углеродом 14 1-изотиоцианатбензил-3-метилдиэтилентриаминопентауксусная кислота (MX-DTPA). См. WO94/11026.
В данном документе предоставлены конъюгаты антитела и одного или нескольких низкомолекулярных токсинов, таких как калихимицин, майтанзиноиды, трихотецен и CC1065 и производных этих токсинов, обладающих токсической активностью.
Майтанзин и майтанзиноиды
В одном из вариантов осуществления антитело (полноразмерное или фрагменты) согласно изобретению конъюгировано с одной или несколькими майтанзиноидными молекулами.
Майтанзиноиды представляют собой ингибиторы митоза, действующие посредством ингибирования полимеризации тубулина. Майтанзин впервые выделили из восточно-африканского кустарника Maytenus serrata (патент США № 3896111). Впоследствии обнаружилось, что некоторые микроорганизмы также продуцируют майтанзиноиды, такие как майтанзинол и сложные эфиры с C-3 майтанзинола (патент США № 4151042). Синтетический майтанзинол и его производные и аналоги описаны, например, в патентах США № 4137230; 4248870; 4256746; 4260608; 4265814; 4294757; 4307016; 4308268; 4308269; 4309428; 4313946; 4315929; 4317821; 4322348; 4331598; 4361650; 4364866; 4424219; 4450254; 4362663 и 4371533, описания которых явно включены в настоящий документ в качестве ссылки.
Конъюгаты майтанзиноид-антитело
С целью увеличить их терапевтический индекс майтанзин и майтанзиноиды конъюгировали с антителами, специфически связывающимися с антигенами опухолевых клеток. Иммуноконъюгаты, содержащие майтанзиноиды и их терапевтическое применение, описаны, например, в патентах США № 5208020, 5416064 и европейском патенте EP 0 425 235 B1, описания которых явно включены в настоящий документ в качестве ссылки. У Liu et al., Proc. Natl. Acad. Sci. USA 93:8618-8623 (1996) описаны иммуноконъюгаты, содержащие майтанзиноид, обозначенный DM1, связанный с моноклональным антителом C242, направленным к человеческому колоректальному раку. Обнаружено, что конъюгат является высокоцитотоксичным в отношении культивируемых клеток злокачественной опухоли толстого кишечника и демонстрирует противоопухолевую активность в анализе опухолевого роста in vivo. У Chari et al., Cancer Research 52:127-131 (1992) описаны иммуноконъюгаты, в которых майтанзиноид посредством дисульфидного линкера конъюгирован с мышиным антителом A7, связывающимся с антигеном на клеточных линиях злокачественной опухоли толстого кишечника человека, или с другим мышиным моноклональным антителом, TA.1, которое связывается с онкогеном HER-2/neu. Цитотоксичность конъюгата TA.1-майтанзиноид тестировали in vitro на клеточной линии рака молочной железы человека, SK-BR-3, которая экспрессирует 3 × 105 молекул поверхностного антигена HER-2 на клетку. Конъюгаты с лекарственным средством достигали степени цитотоксичности, сходной со свободным майтанзиноидным лекарственным средством, которую можно увеличить посредством увеличения количества майтанзиноидных молекул на молекулу антитела. Конъюгат A7-майтанзиноид у мышей проявлял низкую системную цитотоксичность.
Конъюгаты антитело-майтанзиноид (иммуноконъюгаты)
Конъюгаты антитело-майтанзиноид получают посредством химического связывания антитела с молекулой майтанзиноида без значительного снижения биологической активности антитела или молекулы майтанзиноида. В среднем эффективность в увеличении цитотоксичности для клеток-мишеней без отрицательного воздействия на функцию или растворимость антитела продемонстрировали 3-4 майтанзиноидные молекулы, конъюгированные на молекулу антитела, хотя можно было бы ожидать, что даже одна молекула токсина/антитела будет увеличивать цитотоксичность по сравнению с применением неконъюгированного антитела. Майтанзиноиды хорошо известны в данной области и их можно синтезировать известными способами или выделить из природных источников. Подходящие майтанзиноиды описаны, например, в патенте США № 5208020 и других патентах и непатентных публикациях, на которые приводились ссылки выше в данном документе. Предпочтительные майтанзиноиды представляют собой майтанзинол и аналоги майтанзинола, модифицированные по ароматическому кольцу или другим положениям в молекуле майтанзинола, такие как различные сложные эфиры майтанзинола.
В данной области известно множество линкерных групп для получения конъюгатов антитело-майтанзиноид, например, включающих в себя группы, описанные в патенте США № 5208020 или европейском патенте EP 0 425 235 B1 и Chari et al., Cancer Research 52:127-131 (1992). Линкерные группы включают в себя дисульфидные группы, тиоэфирные группы, неустойчивые к кислотам группы, фотолабильные группы, неустойчивые к пептидазам группы или неустойчивые к эстеразам группы, как описано в указанных выше патентах, где предпочтительными являются дисульфидные и тиоэфирные группы.
Конъюгаты антитела и майтанзиноида можно получать с применением множества бифункциональных связывающих белки средств, таких как N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат, иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметиладипимидат HCl), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаральдегид), бис-азидо-соединения (такие как бис-(п-азидобензоил)гександиамин), производные бис-диазония (такие как бис-(п-диазонийбензоил)этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат), и соединения с двумя атомами активного фтора (такие как 1,5-дифтор-2,4-динитробензол). Особенно предпочтительные связывающие средства включают в себя N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP) (Carlsson et al., Biochem. J. 173:723-737 [1978]) и N-сукцинимидил-4-(2-пиридилтио)пентаноат (SPP) для образования дисульфидной связи.
Линкер может быть присоединен к молекуле майтанзиноида в различных положениях, зависящих от типа связи. Например, сложноэфирную связь можно образовывать реакцией с гидроксильной группой с применением общепринятых способов связывания. Реакция может происходить по положению C-3 с гидроксильной группой, положению C-14, модифицированному гидроксиметилом, положению C-15, модифицированному гидроксильной группой, и положению C-20 с гидроксильной группой. В предпочтительном варианте осуществления связь формируют в положении C-3 майтанзинола или аналога майтанзинола.
Калихимицин
Другой представляющий интерес иммуноконъюгат содержит антитело, конъюгированное с одной или несколькими молекулами калихимицина. Семейство антибиотиков калихимицина способно образовывать двухцепочечные разрывы ДНК в субпикомолярных концентрациях. Для получения конъюгатов с семейством калихимицина, см. патенты США 5712374, 5714586, 5739116, 5767285, 5770701, 5770710, 5773001, 5877296 (все выданные American Cyanamid Company). Структурные аналоги калихимицина, которые можно использовать, включают в себя в качестве неограничивающих примеров, γ1 I, α2 I, α3 I, N-ацетил-γ1 I, PSAG и θI 1 (Hinman et al., Cancer Research 53:3336-3342 (1993), Lode et al, Cancer Research 58:2925-2928 (1998) и указанные выше патенты США, выданные American Cyanamid). Другим противоопухолевым лекарственным средством, с которым можно конъюгировать антитело, является QFA, которое представляет собой антифолат. Места приложения действия у калихимицина и QFA находятся внутри клеток, но им нелегко пересекать плазматическую мембрану. Поэтому захват клетками этих средств в результате опосредованной антителом интернализации значительно усиливает их цитотоксическое действие.
Другие цитотоксические средства
Другие противоопухолевые средства, которые можно конъюгировать с антителами согласно изобретению, включают в себя BCNU, стрептозоицин, винкристин и 5-фторурацил, семейство средств, вместе известных как комплекс LL-E33288, описанный в патентах США 5053394, 5770710, а также эсперамицины (патент США 5877296).
Ферментативно активные токсины и их фрагменты, которые можно использовать, включают в себя A-цепь дифтерийного токсина, несвязывающиеся активные фрагменты дифтерийного токсина, A-цепь экзотоксина (из Pseudomonas aeruginosa), A-цепь рицина, A-цепь абрина, A-цепь модецина, альфа-сарцин, белки Aleurites fordii, диантиновые белки, белки Phytolaca americana (PAPI, PAPII и PAP-S), ингибитор Momordica charantia, курцин, кротин, ингибитор Sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трикотецены. См., например, WO 93/21232 опубликованную 28 октября 1993 года.
Настоящее изобретение дополнительно относится к иммуноконъюгату, формируемому между антителом и соединением с нуклеолитической активностью (например, рибонуклеазой или ДНК-эндонуклеазой, такой как дезоксирибонуклеаза; ДНКаза).
Для селективного разрушения опухоли антитело может содержать высокорадиоактивный атом. Для получения радиоконъюгированных антител доступно множество радиоактивных изотопов. Примеры включают в себя At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 и радиоактивные изотопы Lu. Когда конъюгат применяют для детекции, он может содержать радиоактивный атом для сцинтиграфических исследований, например, tc99m или I123, или спиновую метку для способа получения изображений ядерно-магнитного резонанса (ЯМР) (также известного как способ получения изображений с помощью магнитного резонанса, mri), такую как снова йод-123, йод-131, индий-111, фтор-19, углерод-13, азот-15, кислород-17, гадолиний, марганец или железо.
Радиоактивные или другие метки можно вводить в конъюгат посредством известных способов. Например, пептид можно биосинтезировать или синтезировать посредством химического аминокислотного синтеза с применением подходящих предшественников аминокислот, включающих в себя, например, фтор-19 вместо водорода. Метки, такие как tc99m или I123, Re186, Re188 и In111, можно присоединять посредством цистеинового остатка в пептиде. Иттрий-90 можно присоединять посредством лизинового остатка. Для введения йода-123 можно применять способ IODOGEN (Fraker et al (1978) Biochem. Biophys. Res. Commun. 80: 49-57. В "Monoclonal antibodies in Immunoscintigraphy" (Chatal, CRC Press 1989) подробно описаны другие способы.
Конъюгаты антитела и цитотоксического средства можно получать с применением множества бифункциональных связывающих белки средств, таких как N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат, иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметиладипимидат HCl), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаральдегид), бис-азидо-соединения (такие как бис-(п-азидобензоил)гександиамин), производные бис-диазония (такие как бис-(п-диазонийбензоил)этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат) и соединения с двумя атомами активного фтора (такие как 1,5-дифтор-2,4-динитробензол). Например, рициновый иммунотоксин можно получать, как описано в Vitetta et al., Science, 238: 1098 (1987). Иллюстративным хелатирующим средством для конъюгации радионуклеотида с антителом является меченная углеродом 14 1-изотиоцианатбензил-3-метилдиэтилентриаминопентауксусная кислота (MX-DTPA). См. WO94/11026. Линкер может являться "расщепляемым линкером", облегчающим высвобождение цитотоксического лекарственного средства в клетке. Например, можно применять неустойчивый к кислоте линкер, чувствительный к пептидазам линкер, фотолабильный линкер, диметильный линкер или содержащий дисульфид линкер (Chari et al., Cancer Research 52:127-131 (1992); патент США № 5208020).
Соединения согласно изобретению явно включают в себя в качестве неограничивающих примеров ADC, полученные с применением сшивающих реагентов: BMPS, EMCS, GMBS, HBVS, LC-SMCC, MBS, MPBH, SBAP, SIA, SIAB, SMCC, SMPB, SMPH, сульфо-EMCS, сульфо-GMBS, сульфо-KMUS, сульфо-MBS, сульфо-SIAB, сульфо-SMCC и сульфо-SMPB и SVSB (сукцинимидил-(4-винилсульфон)бензоат), которые являются коммерчески доступными (например, в Pierce Biotechnology, Inc., Rockford, IL., U.S.A). См. стр. 467-498, 2003-2004 Applications Handbook and Catalog.
ПОЛУЧЕНИЕ КОНЪЮГАТОВ АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО
В конъюгатах антитело-лекарственное средство (ADC) согласно изобретению, антитело (Ab) посредством линкера (L) конъюгировано с одной или несколькими молекулами лекарственного средства (D), например, приблизительно от 1 до приблизительно 20 молекул лекарственного средства на антитело. ADC формулы I можно получать различными способами, применяя реакции, условия и реагенты из органической химии, известные специалистам в данной области, включающие в себя: (1) реакцию нуклеофильной группы антитела с бивалентным линкерным реагентом с формированием посредством образования ковалентной связи Ab-L с последующей реакцией с молекулой лекарственного средства D; и (2) реакцию нуклеофильной группы молекулы лекарственного средства с бивалентным линкерным реагентом с формированием посредством образования ковалентной связи D-L с последующей реакцией с нуклеофильной группой антитела.
Нуклеофильные группы на антителах включают в себя в качестве неограничивающих примеров: (i) N-концевые аминогруппы, (ii) аминные группы боковых цепей, например, лизина, (iii) тиоловые группы боковых цепей, например, цистеина, и (iv) гидроксил сахаров или аминные группы, когда антитело гликозилировано. Аминовые, тиоловые и гидроксильные группы являются нуклеофильными и способны вступать в реакцию с формированием ковалентных связей с электрофильными группами на линкерных молекулах и линкерных реагентах, включающих в себя: (i) активные сложные эфиры, такие как сложные эфиры NHS, сложные эфиры HOBt, галогенформиаты и галогенангидриды; (ii) алкил- и бензилгалогениды, такие как галогенацетамиды; (iii) альдегидные, кетоновые, карбоксильные и малеимидные группы. У некоторых антител существуют восстановимые межцепочечные дисульфиды, т.е. цистеиновые мостики. Антитела можно сделать реакционно-способными для конъюгации с линкерными реагентами посредством обработки восстанавливающим средством, таким как DTT (дитиотреитол). Таким образом, каждый цистеиновый мостик теоретически будет формировать два реакционно-способных тиоловых нуклеофила. Дополнительные нуклеофильные группы можно ввести в антитела посредством реакции остатков лизинов с 2-иминотиоланом (реагент Траута), что приводит к преобразованию амина в тиол.
Конъюгаты антитело-лекарственное средство также можно получать посредством модификации антитела с введением электрофильных групп, которые могут реагировать с нуклеофильными заместителями на линкерном реагенте или лекарственном средстве. Можно окислять сахара на гликозилированных антителах, например, с применением окисляющих реагентов периодатов, с формированием альдегидных или кетоновых групп, которые могут реагировать с аминогруппой линкерных реагентов или молекул лекарственного средства. Полученные иминовые группы оснований Шиффа могут формировать стабильную связь или их можно восстанавливать, например, посредством борогидридных реагентов с формированием стабильных аминных связей. В одном из вариантов осуществления реакция углеводной части гликозилированного антитела с галактозоксидазой или метапериодатом натрия может приводить к образованию в белке карбонильных (альдегидной или кетоновой) групп, которые могут реагировать с подходящими группами на лекарственном средстве (Hermanson, Bioconjugate Techniques). В другом варианте осуществления белки, содержащие N-концевые остатки серина или треонина, могут реагировать с метапериодатом натрия, что приводит к образованию альдегида вместо первой аминокислоты (Geoghegan & Stroh, (1992) Bioconjugate Chem. 3:138-146; патент США 5362852). Такой альдегид может реагировать с молекулой лекарственного средства или линкерным нуклеофилом.
Подобным образом нуклеофильные группы на молекуле лекарственного средства включают в себя в качестве неограничивающих примеров: амино-, тиольную, гидроксильную, гидразидную, оксимную, гидразиновую, тиосемикарбазоновую, гидразинкарбоксилатную и арилгидразидную группы, способные к реакции с формированием ковалентных связей с электрофильными группами на линкерных молекулах и линкерных реагентах, включающими в себя: (i) активные сложные эфиры, такие как сложные эфиры NHS, сложные эфиры HOBt, галогенформиаты и галогенангидриды; (ii) алкил- и бензилгалогениды, такие как галогенацетамиды; (iii) альдегидные, кетоновые, карбоксильные и малеимидные группы.
Альтернативно, слитый белок, содержащий антитело и цитотоксическое средство можно получать, например, рекомбинантными способами или пептидным синтезом. Цепь ДНК может содержать соответствующие области, кодирующие две части конъюгата, расположенные рядом друг с другом или разделенные областью, кодирующей линкерный пептид, который не нарушает желательных свойств конъюгата.
В еще одном варианте осуществления, антитело можно конъюгировать с "рецептором" (таким как стрептавидин) для использования в предварительной обработке опухолей, где пациенту вводят конъюгат антитело-рецептор с последующим удалением из кровотока несвязавшегося конъюгата с применением очищающего средства, а затем вводят "лиганд" (например, авидин), который конъюгирован с цитотоксическим средством (например, радионуклеотидом).
10. Иммунолипосомы
Описанные в настоящем документе антитела также можно составлять в виде иммунолипосом. "Липосома" представляет собой небольшой носитель, состоящий из различного типа липидов, фосфолипидов и/или поверхностно-активного средства, который пригоден для доставки лекарственного средства млекопитающему. Компоненты липосомы, как правило, расположены в двуслойной структуре, сходно с расположением липидов в биологических мембранах. Содержащие антитело липосомы получают известными в данной области способами так, как в Epstein et al., Proc. Natl. Acad. Sci. USA 82:3688 (1985); Hwang et al., Proc. Natl Acad. Sci. USA 77:4030 (1980); патенты США № 4485045 и 4544545 и WO97/38731, опубликованная 23 октября 1997 года. В патенте США № 5013556 описаны липосомы с увеличенным временем нахождения в кровотоке.
Особенно пригодные липосомы можно получать способом выпаривания с обращенной фазой с липидной композицией, содержащей фосфатидилхолин, холестерин и дериватизированный PEG фосфатидилэтаноламин (PEG-PE). Липосомы экструдируют через фильтры с определенным размером пор с выходом липосом желательного диаметра. Фрагменты Fab' антитела согласно настоящему изобретению можно конъюгировать с липосомами, как описано в Martin et al., J. Biol. Chem. 257:286-288 (1982), реакцией обмена дисульфидов. В липосоме необязательно содержится химиотерапевтическое средство. См. Gabizon et al., J. National Cancer Inst. 81 (19): 1484 (1989).
B. Связывающиеся олигопептиды
Связывающиеся олигопептиды согласно изобретению представляют собой олигопептиды, которые связываются, предпочтительно специфически с гепсином, HGF и/или комплексом гепсин:HGF, как описано в данном документе. Связывающиеся олигопептиды можно синтезировать химически с применением известной технологии синтеза олигопептидов или можно получать и очищать с применением рекомбинантной технологии. Длина связывающихся олигопептидов, как правило, составляет, по меньшей мере, приблизительно 5 аминокислот, альтернативно, по меньшей мере, приблизительно 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100 аминокислоты или более, где такие олигопептиды способны связываться, предпочтительно специфически, с полипептидом, как описано в данном документе. Связывающиеся олигопептиды можно идентифицировать без излишнего экспериментирования с применением хорошо известных способов. При этом следует отметить, что способы скрининга библиотек олигопептидов на олигопептиды, способные специфически связываться с полипептидной мишенью, хорошо известны в данной области (см., например, патенты США № 5556762, 5750373, 4708871, 4833092, 5223409, 5403484, 5571689, 5663143; публикации PCT № WO 84/03506 и WO84/03564; Geysen et al., Proc. Natl. Acad. Sci. U.S.A., 81:3998-4002 (1984); Geysen et al., Proc. Natl. Acad. Sci. USA, 82:178-182 (1985); Geysen et al., в Synthetic Peptides as Antigens, 130-149 (1986); Geysen et al., J. Immunol. Meth., 102:259-274 (1987); Schoofs et al., J. Immunol., 140:611-616 (1988), Cwirla, S. E. et al. (1990) Proc. Natl. Acad. Sci. USA. 87:6378; Lowman, H.B. et al. (1991) Biochemistry, 30:10832; Clackson, T. et al. (1991) Nature, 352: 624; Marks, J. D. et al. (1991), J. Mol. Biol., 222:581; Kang, A.S. et al. (1991) Proc. Natl. Acad. Sci. USA. 88:8363 и Smith, G. P. (1991) Current Opin. Biotechnol., 2:668).
В этом отношении хорошо известным способом, обеспечивающим скрининг больших библиотек олигопептидов для идентификации представителя(ей) этих библиотек, способного специфически связываться с полипептидной мишенью, является бактериофаговый (фаговый) дисплей. Фаговый дисплей представляет собой способ, посредством которого варианты полипептидов в виде слитых с белком оболочки белков представляются на поверхности бактериофаговых частиц (Scott, J.K. and Smith, G. P. (1990) Science, 249: 386). Полезность фагового дисплея заключается в том факте, что большие библиотеки выборочно рандомизированных вариантов белков (или случайно клонированных кДНК) можно быстро и эффективно проверять на те молекулы, которые связываются с молекулой-мишенью с высокой аффинностью. Представление пептидной (Cwirla, S. E. et al. (1990) Proc. Natl. Acad. Sci. USA. 87:6378) или белковой (Lowman, H.B. et al. (1991) Biochemistry. 30:10832; Clackson, T. et al. (1991) Nature, 352: 624; Marks, J. D. et al. (1991), J. Mol. Biol., 222:581; Kang, A.S. et al. (1991) Proc. Natl. Acad. Sci. USA, 88:8363) библиотек на фаге использовали для скрининга миллионов полипептидов или олигопептидов на полипептиды или олигопептиды со свойствами специфического связывания (Smith, G. P. (1991) Current Opin. Biotechnol., 2:668). Проверка фаговых библиотек случайных мутантов требует стратегии для конструирования и размножения большого количества вариантов, процедуры для аффинной очистки с применением направленного рецептора и средств для оценки результатов усиления связывания. Патенты США № 5223409, 5403484, 5571689 и 5663143.
Хотя в большинстве способов фагового дисплея используют нитевидный фаг, также известны системы фагового дисплея на основе фага лямбда (WO 95/34683; патент США 5627024), системы фагового дисплея на основе фага T4 (Ren et al., Gene, 215: 439 (1998); Zhu et al., Cancer Research, 58(15): 3209-3214 (1998); Jiang et al., Infection & Immunity, 65(11): 4770-4777 (1997); Ren et al., Gene, 195(2):303-311 (1997); Ren, Protein Sci., 5:1833 (1996); Efimov et al., Virus Genes, 10: 173 (1995)) и системы фагового дисплея на основе фага T7 (Smith and Scott, Methods in Enzymology, 217: 228-257 (1993); патент США 5766905).
В настоящее время разработано множество других усовершенствований и вариаций основной концепции фагового дисплея. Эти усовершенствования улучшают способность систем дисплея скринировать пептидные библиотеки на связывание с выбранными молекулами-мишенями и представлять функциональные белки с возможностью скрининга этих белков на желательные свойства. Для реакций фагового дисплея разработаны устройства для комбинаторных реакций (WO 98/14277), а библиотеки фагового дисплея применяли для анализа и контроля бимолекулярных взаимодействий (WO 98/20169; WO 98/20159) и свойств напряженных спиральных пептидов (WO 98/20036). В WO 97/35196 описан способ выделения аффинного лиганда, в котором библиотека фагового дисплея контактирует с одним раствором, в котором лиганд связывается с молекулой-мишенью, и вторым раствором, в котором аффинный лиганд не связывается с молекулой-мишенью, для селективного выделения связывающихся лигандов. В WO 97/46251 описан способ биопэннинга библиотеки случайного фагового дисплея с аффинно очищенным антителом, а затем выделения связавшихся фагов с последующим процессом микропэннинга с применением лунок микропланшета для выделения фага, связывающегося с высокой аффинностью. Также сообщалось о применении белка A Staphylococcus aureus в качестве аффинной метки (Li et al. (1998) Mol Biotech., 9:187). В WO 97/47314 описано применение субстрактных вычитательных библиотек для различения ферментной специфичности с применением комбинаторной библиотеки, которая может представлять собой библиотеку фагового дисплея. В WO 97/09446 описан способ отбора ферментов, пригодных для применения в детергентах с применением фагового дисплея. Дополнительные способы отбора специфически связывающихся белков описаны в патентах США № 5498538, 5432018 и WO 98/15833.
Способы получения пептидных библиотек и скрининга этих библиотек описаны также в патентах США № 5723286, 5432018, 5580717, 5427908, 5498530, 5770434, 5734018, 5698426, 5763192 и 5723323.
C. Связывающиеся низкомолекулярные соединения
Связывающиеся низкомолекулярные соединения предпочтительно представляют собой органические молекулы, отличные от олигопептидов или антител, как определено в настоящем документе, которые связываются, предпочтительно специфически, с гепсином, HGF и/или комплексом гепсин:HGF, как описано в данном документе. Связывающиеся органические низкомолекулярные соединения можно идентифицировать и химически синтезировать с применением известной методологии (см., например, публикация PCT № WO 00/00823 и WO 00/39585). Размер связывающихся органических низкомолекулярных соединений, как правило, составляет менее чем приблизительно 2000 дальтон, альтернативно, менее чем приблизительно 1500, 750, 500, 250 или 200 дальтон, где такие органические низкомолекулярные соединения, которые способны к связыванию, предпочтительно специфическому, с полипептидом, как описано в данном документе, можно без излишнего экспериментирования идентифицировать с применением известных способов. При этом следует отметить, что способы скрининга библиотек органических низкомолекулярных соединений на молекулы, способные связываться с полипептидной мишенью, хорошо известны в данной области (см., например, публикации PCT № WO 00/00823 и WO 00/39585). Связывающиеся органические низкомолекулярные соединения могут представлять собой, например, альдегиды, кетоны, оксимы, гидразоны, семикарбазоны, карбазиды, первичные амины, вторичные амины, третичные амины, N-замещенные гидразины, гидразиды, спирты, простые эфиры, тиолы, тиоэфиры, дисульфиды, карбоновые кислоты, сложные эфиры, амиды, карбамиды, карбаматы, карбонаты, кетали, тиокетали, ацетали, тиоацетали, арилгалогениды, арилсульфонаты, алкилгалогениды, алкилсульфонаты, ароматические соединения, гетероциклические соединения, анилины, алкены, алкины, диолы, аминоспирты, оксазолидины, оксазолины, тиазолидины, тиазолины, енамины, сульфонамиды, эпоксиды, азиридины, изоцианаты, сульфонилхлориды, диазо-соединения, хлорангидриды и т.п.
D. Скрининг на антитела, связывающиеся олигопептиды и связывающиеся низкомолекулярные соединения с желательными свойствами.
Выше описаны способы получения антител, олигопептидов и низкомолекулярных соединений согласно изобретению. По желанию, можно дополнительно отбирать антитела, олигопептиды или другие низкомолекулярные соединения с определенными биологическими характеристиками.
Ингибирующие рост эффекты антитела, олигопептида или другого низкомолекулярного соединения согласно изобретению можно оценивать известными в данной области способами, например, с применением клеток, экспрессирующих гепсин и/или про-HGF эндогенно или после трансфекции соответствующего гена(ов). Например, подходящие линии опухолевых клеток и трансфицированные гепсином и/или полипептидом HGF клетки можно обрабатывать моноклональным антителом, олигопептидом или другим низкомолекулярным соединением согласно изобретению в различных концентрациях в течение нескольких суток (например, 2-7) и окрашивать кристаллическим фиолетовым или MTT или анализировать с применением какого-либо другого колориметрического анализа. Другой способ измерения пролиферации представляет собой сравнение захвата 3H-тимидина клетками, обработанными в присутствие или отсутствие антитела, связывающегося олигопептида или связывающегося низкомолекулярного соединения согласно изобретению. После обработки клетки собирают и на сцинцилляционном счетчике количественно определяют уровень включившейся в ДНК радиоактивности. Подходящие положительные контроли включают в себя обработку выбранной клеточной линии ингибирующим рост антителом, для которого известно, что оно ингибирует рост этой клеточной линии. Ингибирование роста опухолевых клеток in vivo можно определять различными известными в данной области способами. Опухолевая клетка может представлять собой опухолевую клетку, сверхэкспрессирующую гепсин и/или полипептид про-HGF. Антитело, связывающийся олигопептид или связывающееся органическое низкомолекулярное соединение будут ингибировать клеточную пролиферацию экспрессирующих гепсин и/или HGF опухолевых клеток in vitro или in vivo по сравнению с необработанной опухолевой клеткой приблизительно на 25-100%, более предпочтительно - приблизительно на 30-100%, и даже более предпочтительно - приблизительно на 50-100% или 70-100%, в одном из вариантов осуществления при концентрации антитела приблизительно от 0,5 до 30 мкг/мл. Ингибирование роста можно измерять при концентрации антитела приблизительно от 0,5 до 30 мкг/мл или приблизительно от 0,5 нМ до 200 нМ в клеточной культуре, где ингибирование роста определяют через 1-10 суток после воздействия антитела на опухолевые клетки. Антитело ингибирует рост in vivo, если введение антитела при концентрации приблизительно от 1 мкг/кг массы тела до приблизительно 100 мг/кг массы тела приводит к уменьшению размера опухоли или уменьшению пролиферации опухолевых клеток в пределах приблизительно от 5 суток до 3 месяцев, начиная от первого введения антитела, предпочтительно в пределах приблизительно от 5 до 30 суток.
Для отбора антитела, связывающегося олигопептида или связывающегося органического низкомолекулярного соединения, индуцирующих гибель клеток, можно анализировать потерю целостности мембран относительно контроля, на что указывает, например, захват йодида пропидия (PI), трипанового синего или 7AAD. Анализ захвата PI можно проводить в отсутствие комплемента и иммунных эффекторных клеток. Экспрессирующие гепсин и/или полипептид про-HGF опухолевые клетки инкубируют с одной средой или средой, содержащей подходящее антитело (например, приблизительно при 10 мкг/мл), связывающийся олигопептид или связывающееся органическое низкомолекулярное соединение. Клетки инкубируют в течение периода времени в размере 3 суток. После каждой обработки клетки отмывают и аликвоты добавляют в покрытые 35-мм ситом пробирки 12 × 75 (1 мл на пробирку, 3 пробирки на обрабатываемую группу) для удаления агрегатов клеток. Затем в пробирки добавляют PI (10 мкг/мл). Затем образцы можно анализировать с применением проточного цитометра FACSCAN® и программного обеспечения FACSCONVERT® CellQuest (Becton Dickinson). Те антитела, связывающиеся олигопептиды или связывающиеся органические низкомолекулярные соединения, которые индуцируют статистически значимые уровни клеточной гибели, как определено посредством захвата PI, можно выбирать как индуцирующие клеточную гибель антитела, связывающиеся олигопептиды или связывающиеся органические низкомолекулярные соединения.
Для скрининга на антитела, олигопептиды или другие органические низкомолекулярные соединения, связывающиеся на эпитопе на полипептиде, связываемом представляющем интерес антителом, можно проводить стандартный анализ перекрестного блокирования, такой как описан в Antibodies, A Laboratory Manual, Cold Spring Harbor Laboratory, Ed Harlow and David Lane (1988). Этот анализ можно применять для определения, если тестируемые антитело, олигопептид или другое органическое низкомолекулярное соединение связывают тот же участок или эпитоп, как и известное антитело. Альтернативно или дополнительно можно проводить эпитопное картирование известными в данной области способами. Например, для идентификации контактирующих остатков последовательность антитела можно подвергать мутагенезу, такому как сканирование аланином. Мутантное антитело исходно тестируют на связывание с поликлональным антителом для гарантии правильной укладки. В другом способе пептиды, соответствующие другим областям полипептида, можно использовать в конкурентных анализах с тестируемыми антителами или с тестируемым антителом и антителом с охарактеризованным или известным эпитопом.
E. Зависимая от антитела опосредованная ферментом пролекарственная терапия (ADEPT)
Антитела по настоящему изобретению также можно применять в ADEPT посредством конъюгации антитела с активирующим пролекарство ферментом, конвертирующим пролекарство (например, пептидильное химиотерапевтическое средство, см. WO 81/01145) в активное противоопухолевое лекарственное средство. См., например, WO 88/07378 и патент США № 4975278.
Ферментативный компонент иммуноконъюгата, пригодный для ADEPT, включает в себя любой фермент, способный действовать на пролекарство таким способом, чтобы конвертировать его в его более активную цитотоксическую форму.
Ферменты, пригодные в способе по данному изобретению, включают в себя в качестве неограничивающих примеров щелочную фосфатазу, пригодную для конверсии в свободные лекарственные средства содержащих фосфаты пролекарств; арилсульфатазу, пригодную для конверсии в свободные лекарственные средства содержащих сульфаты пролекарств; цитозиндезаминазу, пригодную для конверсии в противоопухолевое лекарственное средство, 5-фторурацил, нетоксического 5-фторцитозина; протеазы, такие как протеаза Serratia, термолизин, субтилизин, карбоксипептидазы и катгепсины (такие как катгепсины B и L), пригодные для конверсии в свободные лекарственные средства содержащих пептиды пролекарств; D-аланилкарбоксипептидазы, пригодные для конверсии пролекарств, содержащих D-аминокислотные заместители; расщепляющие углеводы ферменты, такие как β-галактозидаза и нейраминидаза, пригодные для конверсии в свободные лекарственные средства гликозилированных пролекарств; β-лактамазу, пригодную для конверсии в свободные лекарственные средства дериватизированных β-лактамами лекарственных средств; и пенициллинамидазы, такие как амидаза пенициллина V или амидаза пенициллина G, пригодные для конверсии в свободные лекарственные средства лекарственных средств, дериватизированные по их азоту в аминах феноксиацетильными или фенилацетильными группами, соответственно. Альтернативно, для конверсии пролекарств согласно изобретению в свободные активные лекарственные средства можно использовать антитела с ферментативной активностью, также известные в данной области как "абзимы" (см., например, Massey, Nature 328:457-458 (1987)). Для доставки абзима в скопление опухолевых клеток можно получать конъюгаты антитело-абзим, как описано в данном документе.
Ферменты согласно данному изобретению можно ковалентно связывать с антителами хорошо известными в данной области способами, такими как применение обсуждаемых выше гетеробифункциональных сшивающих реагентов. Альтернативно с применением хорошо известных в данной области способов рекомбинантной ДНК можно конструировать слитые белки, содержащие, по меньшей мере, антигенсвязывающую область антитела согласно изобретению, связанную, по меньшей мере, с функционально активной частью фермента согласно изобретению (см., например, Neuberger et al., Nature 312:604-608 (1984).
F. Варианты антител
Кроме описанных в данном документе антител, предполагается, что можно получать варианты антител. Варианты антител можно получать введением подходящих нуклеотидных замен в кодирующую ДНК и/или посредством синтеза желательного антитела. Специалистам в данной области понятно, что замены аминокислот могут изменять посттрансляционное процессирование антитела, такое как изменение количества или положение участков гликозилирования или изменение характеристик прикрепления к мембране.
Изменения в антителах, описанных в данном документе, можно проводить, например, с применением любых способов и руководств по консервативным и неконсервативным мутациям, приведенных, например, в патенте США № 5364934. Изменения могут представлять собой замену, делецию или вставку одного или нескольких кодонов, кодирующих антитело, что приводит к изменению в аминокислотной последовательности по сравнению с природной последовательностью антитела или полипептида. Необязательно изменение проводят посредством замены по меньшей мере одной аминокислоты на любую другую аминокислоту в одном или нескольких доменах антитела. Руководство по определению того, какой аминокислотный остаток можно вставлять, замещать или удалять без отрицательного воздействия на желательную активность можно найти при сравнении последовательности антитела с последовательностью известных гомологичных молекул белков и минимизации количества изменений аминокислотной последовательности, сделанных в областях высокой гомологии. Замены аминокислот могут представлять собой результат замены одной аминокислоты другой аминокислотой со сходными структурными и/или химическими свойствами, такой как замена лейцина на серин, т.е. замены консервативных аминокислот. Вставки или удаления необязательно можно проводить в диапазоне приблизительно от 1 до 5 аминокислот. Допустимое изменение можно определять посредством системного создания вставок, делеций или замен аминокислот в последовательности и тестирования полученных вариантов на активность, проявляемую исходной последовательностью.
По данному документу предоставлены фрагменты антител и полипептидов. Такие фрагменты могут быть укороченными на N-конце или C-конце или у них могут отсутствовать внутренние остатки, например, при сравнении с полноразмерным природным антителом или белком. У некоторых фрагментов отсутствуют аминокислотные остатки, которые не существенны для желательной биологической активности антитела или полипептида.
Фрагменты антител и полипептидов можно получать любым из ряда общепринятых способов. Желательные пептидные фрагменты можно синтезировать химическим способом. Альтернативный подход включает в себя получение фрагментов антител или полипептидов посредством ферментативного расщепления, например, посредством обработки белка ферментом, для которого известно, что он расщепляет белки в участках, определенных конкретными аминокислотными остатками, или посредством расщепления ДНК подходящими рестрикционными ферментами и выделения желательного фрагмента. Еще один подходящий способ включает в себя выделение и амплификацию фрагмента ДНК, кодирующего желательный фрагмент антитела или полипептида, посредством полимеразной цепной реакции (ПЦР). В ПЦР для 5' и 3' праймеров применяют олигонуклеотиды, определяющие желательные концы фрагмента ДНК. Предпочтительно, фрагменты антител и полипептидов обладают, по меньшей мере, одним биологическим и/или иммунологическим видом активности, общим с описанным здесь нативным антителом или полипептидом.
В конкретных вариантах осуществления представляющие интерес консервативные замены представлены в таблице ниже под заголовком предпочтительных замен. Если такие замены приводят к изменению биологической активности, тогда проводят более значительные изменения, обозначенные в данной таблице как иллюстративные замены или как дополнительно описано ниже по отношению к классам аминокислот, а продукты подвергают скринингу.
Значительные модификации в функции или иммунологической идентичности антитела или полипептида проводят посредством выбора замен, которые значительно отличаются по их воздействию на поддержание (a) структуры полипептидного каркаса в области замены, например, такого как конформация листа или спирали, (b) заряда или гидрофобности молекулы в участке-мишени или (c) размера боковой цепи. Аминокислоты можно группировать по сходству свойств их боковых цепей (в A. L. Lehninger, в Biochemistry, второе издание, p. 73-75, Worth Publishers, New York (1975)):
(1) неполярные: Ala (A), Val (V), Leu (L), Ile (I), Pro (P), Phe (F), Trp (W), Met (M)
(2) незаряженные полярные: Gly (G), Ser (S), Thr (T), Cys (C), Tyr (Y), Asn (N), Gln (Q)
(3) кислые: Asp (D), Glu (E)
(4) основные: Lys (K), Arg (R), His (H)
Альтернативно, встречающиеся в природе остатки можно разделить на группы на основе общих свойств боковых цепей:
(1) гидрофобные: норлейцин, Met, Ala, Val, Leu, Ile;
(2) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gln;
(3) кислые: Asp, Glu;
(4) основные: His, Lys, Arg;
(5) остатки, влияющие на ориентацию цепи: Gly, Pro;
(6) ароматические: Trp, Tyr, Phe.
Неконсервативные замены влекут за собой замену представителя одного из этих классов на другой класс. Такие замененные остатки также можно вводить в участки консервативных замен или, более предпочтительно, в оставшиеся (неконсервативные) участки.
Изменения можно проводить с применением известных в данной области способов, таких как опосредованный олигонуклеотидами (сайт-специфический) мутагенез, сканирование аланином и мутагенез на основе ПЦР. Для получения варианта ДНК антитела или полипептида на клонированной ДНК можно проводить сайт-специфический мутагенез [Carter et al., Nucl. Acids Res., 13:4331 (1986); Zoller et al., Nucl. Acids Res., 10:6487 (1987)], кассетный мутагенез [Wells et al., Gene, 34:315 (1985)], мутагенез на основе рестрикционного отбора [Wells et al., Philos. Trans. R. Soc. London SerA, 317:415 (1986)] или другие известные способы.
Для идентификации одной или нескольких аминокислот на непрерывной последовательности также можно применять анализ сканирования аминокислотой. В числе предпочтительных сканирующих аминокислот находятся относительно небольшие, нейтральные аминокислоты. Такие аминокислоты включают в себя аланин, глицин, серин и цистеин. Аланин представляет собой, как правило, предпочитаемую сканирующую аминокислоту из этой группы, так как у него отсутствует боковая цепь после бета-углеродного атома и менее вероятно, что он изменит конформацию основной цепи варианта [Cunningham and Wells, Science, 244:1081-1085 (1989)]. Аланин, как правило, также предпочитают, так как он является наиболее частой аминокислотой. Кроме того, его часто находят и в углубленных, и в находящихся на поверхности положениях [Creighton, The Proteins, (W.H. Freeman & Co., N.Y.); Chothia, J. Mol. Biol., 150:1 (1976)]. Если замена на аланин не дает удовлетворительных количеств варианта, можно использовать изостерическую аминокислоту.
Также можно замещать любой цистеиновый остаток, не вовлеченный в поддержание правильной конформации антитела или полипептида, как правило, серином, для увеличения устойчивости молекулы к окислению и предотвращения неправильного сшивания. Напротив, в антитело или полипептид для увеличения ее стабильности цистеиновую связь(и) можно добавлять (особенно, когда антитело представляет собой фрагмент антитела, такой как фрагмент Fv).
Особенно предпочтительный тип варианта замещения включает в себя замену одного или нескольких остатков гипервариабельной области исходного антитела (например, гуманизированное или человеческое антитело). Как правило, полученный вариант(ы), выбираемый для дальнейшего усовершенствования, будет обладать улучшенными биологическими свойствами относительно исходного антитела, из которого он получен. Удобный способ получения таких замещенных вариантов включает в себя созревание аффинности с применением фагового дисплея. В кратком изложении, некоторые участки гипервариабельной области (например, 6-7 участков) подвергают мутированию с получением всех возможных аминокислотных замен по каждому участку. Полученные таким образом варианты антител в моновалентном виде экспонируют на частицах нитевидных фагов в виде слитых белков с продуктом гена III M13, упакованных в каждой частице. Экспонированные на фагах варианты затем скринируют на их биологическую активность (например, аффинность связывания), как описано в данном документе. Для идентификации участков-кандидатов гипервариабельной области для модификации можно проводить мутагенез сканирования аланином для идентификации остатков гипервариабельной области, вносящих значительный вклад в связывание антигена. Альтернативно или дополнительно может быть полезным проводить анализ кристаллической структуры комплекса антиген-антитело для идентификации точек контакта между антителом и полипептидом антигена. Такие контактные участки и участки, расположенные рядом, являются кандидатами на замену в соответствии с разработанными по данному документу способами. После получения таких вариантов панель вариантов подвергают скринингу, как описано в данном документе, и антитела с лучшими в одном или нескольких подходящих анализах свойствами можно выбирать для дальнейшего усовершенствования.
Молекулы нуклеиновой кислоты, кодирующие варианты аминокислотной последовательности антитела, получают множеством известных в данной области способов. Эти способы включают в себя в качестве неограничивающих примеров, выделение из природного источника (в случае вариантов встречающейся в природе аминокислотной последовательности) или получение посредством опосредованного олигонуклеотидами (или сайт-специфического) мутагенеза, мутагенеза на основе ПЦР и кассетного мутагенеза ранее полученного варианта или безвариантной версии антитела.
G. Модификации антител и полипептидов
В объем данного изобретения включены ковалентные модификации антител и полипептидов. Один из типов ковалентных модификаций включает в себя реакцию намеченных аминокислотных остатков антитела или полипептида с органическим дериватизирующим средством, способным к реакции с выбранными боковыми цепями или с N- или C-коневыми остатками антитела или полипептида. Получение производных с применением бифункциональных средств пригодно, например, для сшивания антитела или полипептида с нерастворимым в воде матриксом или поверхностью подложки для применения в способах очистки антител и наоборот. Обычно применяемые сшивающие средства включают в себя, например, 1,1-бис(диазоацетил)-2-фенилэтан, глутаральдегид, сложные эфиры N-гидроксисукцинимида, например сложные эфиры с 4-азидосалициловой кислотой, гомобифункциональные имидоэфиры, включающие в себя сложные эфиры дисукцинимидила, такие как 3,3'-дитиобис(сукцинимидилпропионат), бифункциональные малеимиды, такие как бис-N-малеимидо-1,8-октан и такие средства как метил-3-[(п-азидофенил)дитио]пропиоимидат.
Другие модификации включают в себя дезамидирование глутаминиловых и аспарагиниловых остатков до соответствующих глутамиловых и аспартиловых остатков, соответственно, гидроксилирование пролина и лизина, фосфорилирование гидроксильных групп сериновых или треониновых остатков, метилирование α-аминогрупп боковых цепей лизина, аргинина и гистидина [T.E. Creighton, Proteins: Structure and Molecular Properties. W.H. Freeman & Co., San Francisco, p. 79-86 (1983)], ацетилирование N-концевого амина и амидирование любой C-концевой карбоксильной группы.
Другой тип ковалентной модификации антитела или полипептида, включенный в объем настоящего изобретения, включает в себя изменение исходного профиля гликозилирования антитела или полипептида. "Изменение исходного профиля гликозилирования" применяют в данном документе с целью обозначения делеции одной или нескольких углеводных молекул, находящихся на исходной последовательности антитела или полипептида (или посредством удаления подлежащего участка гликозилирования или посредством удаления гликозилирования химическими и/или ферментативными способами), и/или добавления одного или нескольких участков гликозилирования, которые не присутствуют на исходной последовательности антитела или полипептида. Кроме того, фраза включает в себя количественные изменения гликозилирования исходных белков, включающие в себя изменение природы и соотношений различных присутствующих углеводных молекул.
Гликозилирование антител и других полипептидов, как правило, является или N-связанным или O-связанным. N-связанное относится к присоединению молекулы углевода к боковой цепи остатка аспарагина. Распознаваемыми последовательностями для ферментативного присоединения молекулы углевода к боковой цепи аспарагина являются трипептидные последовательности аспарагин-X-серин и аспарагин-X-треонин, где X представляет собой любую аминокислоту за исключением пролина. Таким образом, присутствие или любой из этих трипептидных последовательностей в полипептиде создает потенциальный участок гликозилирования. O-связанное гликозилирование относится к присоединению одного из сахаров N-ацетилгалактозамина, галактозы или ксилозы к гидроксиаминокислоте, чаще всего серину или треонину, хотя также можно использовать 5-гидроксипролин или 5-гидроксилизин.
Добавление к антителу или антителу участков гликозилирования удобно проводить, изменяя аминокислотную последовательность так, чтобы она содержала одну или несколько из указанных выше трипептидных последовательностей (для N-связанных участков гликозилирования). Изменение также можно проводить посредством добавления к последовательности исходного антитела или полипептида одного или несколько остатков серина или треонина или замещения на них (для O-связанных участков гликозилирования). Аминокислотную последовательность антитела или полипептида необязательно можно изменять посредством изменений на уровне ДНК, особенно посредством мутации ДНК, кодирующей антитело или полипептид по предварительно выбранным основаниям так, что образуются кодоны, которые транслируются в желательные аминокислоты.
Другие способы увеличения количества молекул углеводов на антителе или полипептиде представляют собой химическое или ферментативное присоединение гликозидов к полипептиду. Такие способы описаны в данной области, например в WO 87/05330, опубликованной 11 сентября 1987 года, и в Aplin и Wriston, CRC Crit. Rev. Biochem., p. 259-306 (1981).
Удаление молекул углеводов, находящихся на антителе или полипептиде можно проводить химическим или ферментативным способом или посредством мутационной замены кодонов, кодирующих аминокислотные остатки, служащие мишенями для гликозилирования. Способы химического дегликозилирования известны в данной области и описаны, например, у Hakimuddin, et al., Arch. Biochem. Biophys., 259:52 (1987) и у Edge et al., Anal. Biochem., 118:131 (1981). Ферментативное отщепление молекул углеводов от полипептидов можно осуществлять применением множества эндо- и экзогликозидаз, как описано у Thotakura et al., Meth. Enzymol., 138:350 (1987).
Другой тип ковалентной модификации антитела или полипептида включает в себя связывание антитела или полипептида с одним из множества небелковых полимеров, например, с полиэтиленгликолем (PEG), полипропиленгликолем или полиоксиалкиленами, способом, указанным в патентах США № 4640835; 4496689; 4301144; 4670417; 4791192 или 4179337. Антитело или полипептид также можно заключить в микрокапсулы, полученные, например, посредством способами коацервации или межфазной полимеризации (например, гидроксиметилцеллюлозные или желатиновые микрокапсулы и поли(метилметацилатные) микрокапсулы, соответственно), в коллоидные системы доставки лекарственных средств (например, липосомы, микросферы альбумина, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие способы описаны в Remington's Pharmaceutical Sciences. 16th edition, Oslo, A., Ed., (1980).
Антитело или полипептид по настоящему изобретению также можно модифицировать способом формирования химерных молекул, содержащих антитело или полипептид, слитые с другими гетерологичным полипептидом или аминокислотной последовательностью.
В одном из вариантов осуществления такая химерная молекула содержит слитый белок антитела или полипептида с полипептидной меткой, предоставляющей эпитоп, с которым может селективно связываться антитело к метке. Эпитоп-метку, как правило, помещают на N- или C-конце антитела или полипептида. Присутствие таких меченных эпитопом форм антитела или полипептида можно выявлять с применением антитела к полипептидной метке. Также обеспечение эпитопом-меткой позволяет легко выделять антитело или полипептид посредством аффинной хроматографии с применением антитела к метке или другого типа аффинного матрикса, который связывается с эпитопом-меткой. В данной области известны различные полипептидные метки и соответствующие им антитела. Примеры включают в себя метки полигистидин (поли-his) или полигистидинглицин (поли-his-gly); полипептидная метка flu HA и ее антитело 12CA5 [Field et al., Mol. Cell. Biol., 8:2159-2165 (1988)]; метка c-myc и антитела 8F9, 3C7, 6E10, G4, B7 и 9E10 к ней [Evan et al., Molecular и Cellular Biology. 5:3610-3616 (1985)]; и метка на основе гликопротеина D (gD) вируса простого герпеса и ее антитело [Paborsky et al., Protein Engineering, 3(6):547-553 (1990)]. Другие полипептидные метки включают в себя пептид Flag [Hopp et al., BioTechnology, 6:1204-1210 (1988)]; пептид эпитопа KT3 [Martin et al., Science, 255:192-194 (1992)]; пептид эпитопа α-тубулина [Skinner et al., J. Biol. Chem., 266:15163-15166 (1991)] и метка из пептида белка гена 10 T7 [Lutz-Freyermuth et al., Proc. Natl. Acad. Sci. USA, 87:6393-6397 (1990)].
В альтернативном варианте осуществления химерная молекула может содержать слитый белок антитела или полипептида с иммуноглобулином или конкретной областью иммуноглобулина. Для бивалентной формы химерной молекулы (также обозначаемой как "иммуноадгезин"), такой слитый белок можно образовывать с Fc-областью молекулы IgG. Гибриды с Ig предпочтительно включают в себя подстановку растворимой (трансмембранный домен удален или активирован) формы антитела или полипептида вместо, по меньшей мере, одной вариабельной области в молекуле Ig. В особенно предпочтительном варианте осуществления гибрид с иммуноглобулинами включает в себя области шарнира, CH2 и CH3 или шарнира, CH1, CH2 и CH3 молекулы IgG1. Для получения гибридов с иммуноглобулинами см. также патент США № 5428130, опубликованный 27 июня 1995 года.
H. Получение антител и полипептидов
Дальнейшее описание в основном относится к получению антител и полипептидов посредством культивирования клеток, трансформированных или трансфицированных вектором, содержащим кодирующую антитело или полипептид нуклеиновую кислоту. Конечно полагают, что для получения антител и полипептидов можно использовать альтернативные способы, которые хорошо известны в данной области. Например, подходящую аминокислотную последовательность или ее части можно получать прямым пептидным синтезом с применением твердофазных способов синтеза [см., например, Stewart et al., Solid-Phase Peptide Synthesis, W.H. Freeman Co., San Francisco, CA (1969); Merrifield, J. Am. Chem. Soc. 85:2149-2154 (1963)]. Синтез белков in vitro можно проводить с применением ручных способов или автоматически. Автоматический синтез можно проводить, например, с применением синтезатора Applied Biosystems Peptide Synthesizer (Foster City, CA) по инструкциям производителя. Различные части антитела или полипептида можно синтезировать раздельно химическим способом и объединять с применением химических или ферментативных способов с получением желательного антитела или полипептида.
1. Выделение кодирующей антитело или полипептид ДНК
Кодирующую антитело или полипептид ДНК можно получать из библиотеки кДНК, полученной из ткани, для которой есть уверенность, что она содержит мРНК антитела или полипептида и экспрессирует ее на детектируемом уровне. Таким образом, ДНК человеческого антитела или полипептида можно удобно получать из библиотеки кДНК, полученной из ткани человека. Кодирующий антитело или полипептид ген также можно получать из геномной библиотеки или посредством известных способов синтеза (например, автоматизированный синтез нуклеиновой кислоты).
Библиотеки можно скринировать с применением зондов (таких как олигонуклеотиды, по меньшей мере, приблизительно из 20-80 оснований) сконструированных для идентификации представляющего интерес гена или кодируемого им белка. Скрининг библиотеки кДНК или геномной библиотеки с применением выбранного зонда можно проводить с применением стандартных способов, так как описано в Sambrook et al., Molecular Cloning: A Laboratory Manual (New York: Cold Spring Harbor Laboratory Press, 1989). Альтернативный способ выделения гена, кодирующего антитело или полипептид, представляет собой применение способа ПЦР [Sambrook et al., выше; Dieffenbach et al., PCR Primer: A Laboratory Manual (Cold Spring Harbor Laboratory Press, 1995)].
Способы для скрининга библиотеки кДНК хорошо известны в данной области. Выбранные в качестве зондов олигонуклеотидные последовательности должны быть достаточной длины и достаточно однозначными, чтобы минимизировать ложно положительные реакции. Олигонуклеотид предпочтительно является меченным так, что его можно детектировать при гибридизации с ДНК в скринируемой библиотеке. Способы мечения хорошо известны в данной области и включают в себя применение радиоактивных меток, подобных меченной 32P АТФ, биотинилирование или ферментное мечение. Условия гибридизации, включающие в себя умеренно строгие и высоко строгие, приведены в Sambrook et al., выше.
Идентифицированные в таких способах скрининга библиотек последовательности можно сравнивать и выравнивать с другими известными последовательностями, депонированными и доступными в открытых базах данных, таких как GenBank или других, закрытых, базах данных последовательностей. Идентичность последовательностей (или на уровне аминокислот, или на уровне нуклеотидов) в пределах определенных областей молекулы или по всей длине последовательности можно определять с применением известных в данной области способов и как описано в данном документе.
Нуклеиновую кислоту с кодирующей белок последовательностью можно получать посредством скрининга выбранных библиотек кДНК или геномных библиотек с применением в первый раз описанной в данном документе выведенной аминокислотной последовательности и, если необходимо, с применением обычных способов наращивания праймера, как описано в Sambrook et al., выше, для детекции предшественников и процессирования промежуточных продуктов мРНК, которые могут не подвергаться обратной транскрипции в кДНК.
2. Отбор и трансформация клеток-хозяев
Клетки-хозяева трансфицируют или трансформируют описанными в данном документе экспрессирующими или клонирующими векторами для получения антитела или полипептида и культивируют в обычных питательных средах, соответствующим образом модифицированных для индукции промоторов, отбора трансформантов или амплификации генов, кодирующих желательные последовательности. Условия культивирования, такие как среды, температура, pH и т.п., специалисты в данной области могут выбрать без излишнего экспериментирования. В основном, принципы, протоколы и практические указания для максимизации продуктивности клеточных культур можно найти в Mammalian Cell Biotechnology: a Practical Approach, M. Butler, ed. (IRL Press, 1991) и Sambrook et al., выше.
Способы трансфекции эукариотических клеток и трансформации прокариотических клеток, как правило, известны специалистам в данной области, например, CaCl2, CaPO4, посредством липосом и электропорацией. В зависимости от используемой клетки-хозяина, трансформацию проводят с применением стандартных способов, подходящих для таких клеток. Для прокариот, как правило, используют обработку кальцием, с применением хлорида кальция, как описано в Sambrook et al., выше, или электропорацию. Для трансформации некоторых растительных клеток используют инфекцию с применением Agrobacterium tumefaciens, как описано у Shaw et al., Gene, 23:315 (1983) и WO 89/05859, опубликованной 29 июня 1989 года. Для клеток млекопитающих без таких клеточных стенок можно применять способ преципитации с фосфатом кальция по Graham and van der Eb, Virology, 52:456-457 (1978). Основные аспекты трансфекций системы клеток-хозяев млекопитающих описаны в патенте США № 4399216. Трансформацию дрожжей, как правило, проводят способом Van Solingen et al., J. Bact., 130:946 (1977) и Hsiao et al., Proc. Natl. Acad. Sci. (USA). 76:3829 (1979). Однако для введения ДНК в клетки также можно использовать другие способы, такие как посредством микроинъекции в ядро, электропорации, слияния бактериальных протопластов с интактными клетками или посредством поликатионов, например, полибрен, полиорнитин. О различных способах для трансформации клеток млекопитающих см. Keown et al., Methods in Enzymology, 185:527-537 (1990) и Mansour et al., Nature, 336:348-352 (1988).
Подходящие клетки-хозяева для клонирования и экспрессии ДНК в векторах по настоящему документу включают в себя прокариоты, дрожжи и клетки высших эукариот. Подходящие прокариоты включают в себя в качестве неограничивающих примеров эубактерии, такие как грамотрицательные или грамположительные организмы, например, Enterobacteriaceae, такие как E. coli. Общедоступными являются различные штаммы E. coli, такие как штамм E. coli K12 MM294 (ATCC 31446); E. coli X1776 (ATCC 31537); штамм E. coli W3110 (ATCC 27325) и K5 772 (ATCC 53635). Другие подходящие прокариотические клетки-хозяева включают в себя Enterobacteriaceae, такие как Escherichia, например, E. coli, Enterobacter, Erwinia, Klebsiella, Proteus, Salmonella, например, Salmonella typhimurium, Serratia, например, Serratia marcescans и Shigella, а также Bacilli, такие как B. subtilis и B. licheniformis (например, B. licheniformis 41P, описанные в DD 266710, опубликованном 12 апреля 1989 года), Pseudomonas, такие как P. aeruginosa и Streptomyces. Эти примеры являются иллюстрирующими, а не ограничивающими. Штамм W3110 является особенно предпочтительным хозяином или исходным хозяином, так как он является общим штаммом-хозяином для ферментации продуктов рекомбинантной ДНК. Предпочтительно, клетка-хозяин секретирует минимальные количества протеолитических ферментов. Например, штамм W3110 можно модифицировать с введением генетической мутации в гены, кодирующие эндогенные для хозяина белки, с примерами таких хозяев, включающих в себя штамм E. coli W3110 1A2, который обладает полным генотипом tonA; штамм E. coli W3110 9E4, который обладает полным генотипом tonA ptr3; штамм E. coli W3110 27C7 (ATCC 55244), который обладает полным генотипом tonA ptr3 phoA E15 (argF-lac)169 degP ompT kan r; штамм E. coli W3110 37D6, который обладает полным генотипом tonA ptr3 phoA E15 (argF-lac)169 degP ompT rbs7 ilvG kan r; штамм E. coli W3110 40B4, который представляет собой штамм 37D6 с мутацией делеции degP, неустойчивой к канамицину, и штамм E. coli с мутантной периплазматической протеазой, описанный в патенте США № 4946783, опубликованном 7 августа 1990 года. Альтернативно, подходят способы клонирования in vitro, например, ПЦР или другие полимеразные реакции нуклеиновой кислоты.
Полноразмерные антитела, фрагменты антител и слитые с антителом белки можно продуцировать в бактериях, конкретно, когда гликозилирование и эффекторная функция Fc не нужны, например, когда терапевтическое антитело конъюгируют с цитотоксическим средством (например, токсином) и иммуноконъюгат самостоятельно является эффективным при разрушении опухолевых клеток. Полноразмерные антитела обладают более длительным временем полужизни в кровотоке. Получение в E. coli является более быстрым и более экономичным. Об экспрессии фрагментов антител и полипептидов в бактериях см., например, патент США № 5648237 (Carter et. al.), патент США № 5789199 (Joly et al.) и патент США № 5840523 (Simmons et al.), в котором описаны область инициации трансляции (TIR) и сигнальные последовательности для оптимизации экспрессии и секреции, эти патенты включены в настоящий документ в качестве ссылки. После экспрессии антитело выделяют из клеточной массы E. coli в растворимую фракцию и его можно очищать, например, посредством колонки с белком A или G, в зависимости от изотипа. Конечную очистку можно проводить подобно способу очистки антитела, экспрессируемого, например, в клетках CHO.
Кроме прокариот, подходящими хозяевами для клонирования и экспрессии кодирующих антитела или полипептиды векторов являются эукариотические микроорганизмы, такие как нитевидные грибы или дрожжи. Обычно используемым низшим эукариотическим микроорганизмом-хозяином является Saccharomyces cerevisiae. Другие включают в себя Schizosaccharomyces pombe (Beach and Nurse, Nature, 290: 140 [1981]; EP 139383, опубликованный 2 мая 1985 года); хозяева Kluyveromyces (патент США № 4943529; Fleer et al., Bio/Technology. 9:968-975 (1991)), такие как, например, K. lactis (MW98-8C, CBS683, CBS4574; Louvencourt et al., J. Bacteriol., 154(2):737-742 [1983]), K. fragilis (ATCC 12424), K. bulgaricus (ATCC 16045), K. wickeramii (ATCC 24178), K. waltii (ATCC 56500), K. drosophilarum (ATCC 36906; Van den Berg et al., Bio/Technology, 8:135 (1990)), K. thermotolerans и K. marxianus; yarrowia (EP 402226); Pichia pastoris (EP 183070; Sreekrishna et al., J. Basic Microbiol., 28:265-278 [1988]); Candida; Trichoderma reesia (EP 244234); Neurospora crassa (Case et al., Proc. Natl. Acad. Sci. USA, 76:5259-5263 [1979]); Schwanniomyces, такие как Schwanniomyces occidentalis (EP 394538, опубликованный 31 октября 1990 года) и нитевидные грибы, такие как, например, Neurospora, Penicillium, Tolypocladium (WO 91/00357, опубликованный 10 января 1991 года) и хозяева Aspergillus, такие как A. nidulans (Ballance et al., Biochem. Biophys. Res. Commun., 112:284-289 [1983]; Tilburn et al., Gene, 26:205-221 [1983]; Yelton et al., Proc. Natl. Acad. Sci. USA, 81: 1470-1474 [1984]) и A. niger (Kelly и Hynes, EMBO J., 4:475-479 [1985]). В настоящем документе подходящими являются метилотрофные дрожжи и они включают в себя в качестве неограничивающих примеров дрожжи, способные расти на метаноле, выбранные из родов, включающих в себя Hansenula, Candida, Kloeckera, Pichia, Saccharomyces, Torulopsis и Rhodotorula. Список конкретных видов, представляющих собой примеры этого класса дрожжей можно найти в C. Anthony, The Biochemistry of Methylotrophs, 269 (1982).
Подходящие клетки-хозяева для экспрессии гликозилированного антитела или полипептида происходят из многоклеточных организмов. Примеры клеток беспозвоночных включают в себя клетки насекомых, таких как Drosophila S2 и Spodoptera Sf9, а также клетки растений, такие как клеточные культуры хлопка, кукурузы, картофеля, сои, петунии, томата и табака. Идентифицировано множество бакуловирусных штаммов и вариантов и соответствующие пермиссивные клетки-хозяева насекомых, таких хозяев, как Spodoptera frugiperda (гусеница), Aedes aegypti (комар), Aedes albopictus (комар), Drosophila melanogaster (плодовая мушка) и Bombyx mori. Общедоступными является множество вирусных штаммов для трансфекции, например вариант L-1 NPV Autographa californica и штамм Bm-5 NPV Bombyx mori и такие вирусы можно использовать по настоящему документу в качестве вирусов согласно настоящему изобретению, особенно для трансфекции клеток Spodoptera frugiperda.
Однако наибольший интерес представляли клетки позвоночных и размножение клеток позвоночных в культуре (тканевая культура) стало стандартной процедурой. Примеры пригодных линий клеток-хозяев млекопитающих представляют собой линия почки обезьяны CV1, трансформированная SV40 (COS-7, ATCC CRL 1651); линия эмбриональной почки человека (клетки 293 или клетки 293, субклонированные для роста в суспензионной культуре, Graham et al., J. Gen Virol. 36:59 (1977)); клетки почки детеныша хомяка (BHK, ATCC CCL 10); клетки яичника китайского хомяка/-DHFR (CHO, Urlaub et al., Proc. Natl. Acad. Sci. USA 77:4216 (1980)); клетки Сертоли мыши (TM4, Mather, Biol. Reprod. 23:243-251 (1980)); клетки почки обезьяны (CV1 ATCC CCL 70); клетки почки африканской зеленой мартышки (VERO-76, ATCC CRL-1587); клетки карциномы шейки матки человека (HELA, ATCC CCL 2); клетки почки собаки (MDCK, ATCC CCL 34); клетки печени буйволовой крысы (BRL 3A, ATCC CRL 1442); клетки легкого человека (W138, ATCC CCL 75); клетки печени человека (Hep G2, HB 8065); опухоль молочной железы мыши (MMT 060562, ATCC CCL51); клетки TRI (Mather et al., Annals N.Y. Acad. Sci. 383:44-68 (1982)); клетки MRC 5; клетки FS4 и линия гепатомы человека (Hep G2).
Клетки-хозяева трансформируют описанными выше экспрессирующими или клонирующими векторами для продукции антитела или полипептида и культивируют в обычных питательных средах, соответствующим образом модифицированных для индукции промоторов, отбора трансформантов или амплификации генов, кодирующих желательные последовательности.
3. Отбор и использование реплицирующегося вектора
Нуклеиновую кислоту (например, кДНК или геномную ДНК), кодирующую антитело или полипептид, можно вставлять в реплицирующийся вектор для клонирования (амплификации ДНК) или для экспрессии. Общедоступными являются множество векторов. Например, вектор может быть в форме плазмиды, космиды, вирусной частицы или фага. Подходящую последовательность нуклеиновой кислоты можно вставлять в вектор множеством способов. В основном ДНК вставляют в подходящий участок(ки) узнавания рестрикционной эндонуклеазы с применением известных в данной области способов. Компоненты векторов, как правило, включают в себя в качестве неограничивающих примеров один или несколько сигнальных последовательностей, участок начала репликации, один или несколько маркерных генов, энхансерный элемент, промотор и последовательность терминации транскрипции. Для конструирования подходящих векторов, содержащих один или несколько из этих компонентов, используют стандартные способы лигирования, известные специалистам в данной области.
Полипептид можно получать рекомбинантным способом, а не только прямым способом, но также и в качестве слитого пептида с гетерологичным пептидом, который может представлять собой сигнальную последовательность или другой полипептид со специфическим участком расщепления на N-конце зрелого белка или полипептида. В основном сигнальная последовательность может представлять собой компонент вектора или она может быть частью кодирующей антитело или полипептид ДНК, которую вставляют в вектор. Сигнальная последовательность может представлять собой прокариотическую сигнальную последовательность, например, выбранную из группы лидерных пептидов щелочной фосфатазы, пенициллиназы, lpp или термостабильного энтеротоксина II. Для дрожжей секреторная сигнальная последовательность может представлять собой, например, лидерный пептид дрожжевой инвертазы, лидерный пептид альфа-фактора (включая лидерные пептиды α-фактора Saccharomyces и Kluyveromyces, где последний описан в патенте США № 5010182) или лидерный пептид кислой фосфатазы, лидерный пептид глюкоамилазы C. albicans (EP 362179, опубликованный 4 апреля 1990 года) или сигнальный пептид, описанный в WO 90/13646, опубликованной 15 ноября 1990 года. При экспрессии в клетках млекопитающих для непосредственной секреции белка можно использовать сигнальные последовательности млекопитающих, такие как сигнальные последовательности из секретируемых полипептидов того же или родственного вида, а также вирусные секреторные лидерные пептиды.
И экспрессирующие, и клонирующие векторы содержат последовательность нуклеиновой кислоты, позволяющую вектору реплицироваться в одной или нескольких выбранных клетках-хозяевах. Такие последовательности хорошо известны для множества бактерий, дрожжей и вирусов. Участок начала репликации из плазмиды pBR322 подходит для большинства грамотрицательных бактерий, участок начала репликации плазмиды 2μ подходит для дрожжей, а различные вирусные участки начала репликации (SV40, полиома, аденовирус, VSV или BPV) подходят для клонирующих векторов в клетках млекопитающих.
Экспрессирующие и клонирующие векторы, как правило, содержат селективный ген, также называемый селективный маркер. Типичные селективные гены кодируют белки, которые (a) обуславливают устойчивость к антибиотикам или другим токсинам, например, ампициллину, неомицину, метотрексату или тетрациклину, (b) дополняют ауксотрофный дефицит или (c) обеспечивают критичные питательные вещества, недоступные из комплексных сред, например, ген, кодирующий D-аланинрацемазу для Bacilli.
Примерами подходящих селективных маркеров для клеток млекопитающих являются маркеры, позволяющие идентификацию клеток, способных захватывать кодирующую антитело или полипептид нуклеиновую кислоту, такие как DHFR или тимидинкиназа. Подходящей клеткой-хозяином при применении DHFR дикого типа является линия клеток CHO с дефицитом активности DHFR, полученная и выращиваемая, как описано у Urlaub et al., Proc. Natl. Acad. Sci. USA, 77:4216 (1980). Подходящий селективный ген для применения в дрожжах представляет собой ген trp1, присутствующий в дрожжевой плазмиде YRp7 [Stinchcomb et al., Nature, 282:39 (1979); Kingsman et al., Gene, 7:141 (1979); Tschemper et al., Gene, 10:157 (1980)]. Ген trp1 предоставляет маркер селекции для мутантного штамма дрожжей с отсутствием способности расти на триптофане, например, ATCC № 44076 или PEP4-1 [Jones, Genetics, 85:12 (1977)].
Экспрессирующие и клонирующие векторы, как правило, содержат промотор, функционально связанный с кодирующей антитело или полипептид последовательностью нуклеиновой кислоты, для направления синтеза мРНК. Промоторы, распознаваемые множеством потенциальных клеток-хозяев, хорошо известны. Промоторы, пригодные для использования в прокариотических хозяевах, включают в себя промоторные системы β-лактамазы и лактозы [Chang et al., Nature, 275:615 (1978); Goeddel et al., Nature. 281:544 (1979)], промоторную систему щелочной фосфатазы, триптофана (trp) [Goeddel, Nucleic Acids Res., 8:4057 (1980); EP 36776], и гибридные промоторы, такие как промотор tac [deBoer et al., Proc. Natl. Acad. Sci. USA, 80:21-25 (1983)]. Промоторы для применения в бактериальных системах также содержат последовательность Шайна-Дальгарно (S.D.) функционально связанную с ДНК, кодирующей антитело или полипептид.
Примеры подходящих промоторных последовательностей для применения в дрожжевых хозяевах включают в себя промоторы для 3-фосфоглицераткиназы [Hitzeman et al., J. Biol. Chem., 255:2073 (1980)] или других ферментов гликолиза [Hess et al., J. Adv. Enzyme Reg., 7:149 (1968); Holland, Biochemistry, 17:4900 (1978)], таких как енолаза, глицеральдегид-3-фосфатдегидрогеназа, гексокиназа, пируватдекарбоксилаза, фосфофруктокиназа, глюкоза-6-фосфатизомераза, 3-фосфоглицератмутаза, пируваткиназа, триозофосфатизомераза, фосфоглюкозоизомераза и глюкокиназа.
Другие дрожжевые промоторы, которые являются индуцибельными промоторами, обладающие дополнительным преимуществом контролируемой условиями роста транскрипции, представляют собой промоторные области для алкогольдегидрогеназы 2, изоцитохрома C, кислой фосфатазы, катаболическими ферментами, связанными с метаболизмом азота, металлотионеина, глицеральдегид-3-фосфатдегидрогеназы и ферментов, отвечающих за утилизацию мальтозы и галактозы. Подходящие для применения для экспрессии в дрожжах векторы и промоторы дополнительно описаны в EP 73657.
Транскрипция антитела или полипептида с векторов в клетках-хозяевах млекопитающих контролируется, например, промоторами, полученными из геномов вирусов, таких как вирус полиомы, вирус птичьей оспы (UK 2211504, опубликованный 5 июля 1989 года), аденовирус (такой как аденовирус 2), вирус папилломы крупного рогатого скота, вирус саркомы птиц, цитомегаловирус, ретровирус, вирус гепатита B и вирус обезьяны 40 (SV40), гетерологичными промоторами млекопитающих, например, промотором актина или промотором иммуноглобулина, и промоторами белков теплового шока, при условии, что такие промоторы совместимы с системами клетки-хозяина.
Транскрипцию ДНК, кодирующей антитело или полипептид, у высших эукариот можно увеличить посредством вставки в вектор энхансерной последовательности. Энхансеры представляют собой действующие в цис-положении элементы ДНК, как правило, длиной приблизительно от 10 до 300 п.н., которые действуют на промотор, увеличивая транскрипцию с него. Известно множество энхансерных последовательностей из генов млекопитающих (глобин, эластаза, альбумин, α-фетопротеин и инсулин). Однако, как правило, применяют энхансер из вируса эукариотических клеток. Примеры включают в себя энхансер SV40 на поздней части участка начала репликации (п.н. 100-270), энхансер раннего промотора цитомегаловируса, энхансер вируса полиомы на поздней части участка начала репликации и аденовирусные энхансеры. Энхансер можно вставлять в вектор в положении 5' или 3' к кодирующей антитело или полипептид последовательности, но предпочтительно он расположен со стороны 5' от промотора.
Экспрессирующие векторы, применяемые в эукариотических клетках-хозяевах (дрожжи, грибы, насекомые, растения, животные, человек или ядросодержащие клетки из других многоклеточных организмов), также содержат последовательности, необходимые для терминации транскрипции и для стабилизации мРНК. Такие последовательности обычно находятся на 5' и, иногда на 3', нетранслируемых областях эукариотических или вирусных ДНК или кДНК. Эти области содержат нуклеотидные сегменты, транскрибируемые в виде фрагментов полиаденилирования в нетранслируемой части мРНК, кодирующей антитело или полипептид.
Другие дополнительные способы, векторы и клетки-хозяева, пригодные для адаптации к синтезу антител или полипептидов в рекомбинантных культурах клеток позвоночных, описаны в Gething et al., Nature, 293:620-625 (1981); Mantei et al., Nature, 281:40-46 (1979); EP 117060 и EP 117058.
4. Культивирование клеток-хозяев
Клетки-хозяева, используемые для получения антитела или полипептида по данному изобретению можно культивировать во множестве сред. Для культивирования клеток-хозяев подходят коммерчески доступные среды, такие как среда Хама F10 (Sigma), минимальная поддерживающая среда ((MEM), (Sigma), RPMI-1640 (Sigma) и модифицированная Дульбекко среда Игла ((DMEM), Sigma). Кроме того, для культивирования клеток-хозяев в качестве сред для культивирования можно использовать любую из сред, описанных в Ham et al., Meth. Enz. 58:44 (1979), Barnes et al., Anal. Biochem. 102:255 (1980), патентах США №№ 4767704; 4657866; 4927762; 4560655 или 5122469; WO 90/03430; WO 87/00195 или ссылке на патент США 30985. Любую из этих сред по мере необходимости можно дополнять гормонами и/или другими факторами роста (такими как инсулин, трансферрин или эпидермальный фактор роста), солями (такими как хлорид натрия, солями кальция, магния и фосфатами), буферами (такими как HEPES), нуклеотидами (такими как аденозин и тимидин), антибиотиками (такими как лекарственное средство ГЕНТАМИЦИН™ (GENTAMYCIN™)), микроэлементами (определенными как неорганические соединения, как правило, присутствующие в конечных концентрациях в микромолярном диапазоне) и глюкозой или эквивалентным источником энергии. Также можно добавлять любые другие необходимые добавки в подходящих концентрациях, которые известны специалистам в данной области. Условия культивирования, такие как температура, pH и т.п., представляют собой условия, ранее применяемые для клетки-хозяина, выбранной для экспрессии и они, как правило, очевидны специалистам в данной области.
5. Детекция амплификации/экспрессии генов
Амплификацию и/или экспрессию генов можно измерять в образце прямым способом, например, общепринятыми саузерн-блоттингом, нозерн-блоттингом, для количественного определения транскрипции мРНК [Thomas, Proc. Natl. Acad. Sci. USA, 77:5201-5205 (1980)], дот-блоттингом (анализ ДНК) или гибридизацией in situ, с применением соответствующим образом меченого зонда, на основе предоставленных в данном документе последовательностей. Альтернативно, можно применять антитела, которые распознают специфические дуплексы, включая дуплексы ДНК, дуплексы РНК и гибридные дуплексы ДНК-РНК или дуплексы ДНК-белок. В свою очередь, антитела можно метить, а анализ можно проводить так, что дуплекс связывается с поверхностью так, что при формировании на поверхности дуплекса можно детектировать присутствие антитела, связанного с дуплексом.
Альтернативно, для прямого количественного определения экспрессии продукта гена экспрессию генов можно измерять иммунологическими способами, такими как иммуногистохимическое окрашивание клеток или тканевые срезы и анализ культуры клеток или жидкостей организма. Антитела, пригодные для иммуногистохимического окрашивания и/или анализа образцов жидкостей, могут быть или моноклональными или поликлональными и их можно получать от любого млекопитающего. Антитела можно удобно получать к нативной последовательности полипептида или к синтетическому пептиду на основе предоставленной в данном документе последовательности ДНК или к экзогенной последовательности, слитой с ДНК полипептида и кодирующей специфический эпитоп антитела.
6. Очистка антитела и полипептида
Формы антитела и полипептида можно выделять из среды для культивирования или из лизатов клеток-хозяев. Если они являются мембраносвязанными, их можно отделять от мембран с применением подходящих растворов детергентов (например, Triton-X 100) или посредством ферментативного расщепления. Применяемые для экспрессии антитела или полипептида клетки можно разрушать различными физическими или химическими способами, такими как циклическое замораживание-оттаивание, ультразвуковое облучение, механическое разрушение или лизирующие клетку средства.
Может являться желательным очистить антитело и полипептид от белков или полипептидов рекомбинантных клеток. Примерами подходящих способов очистки являются следующие способы: посредством разделения на ионообменной колонке; осаждение этанолом; ВЭЖХ с обратной фазой; хроматография на оксиде кремния или катионообменной смоле, такой как DEAE; хроматофокусирование; SDS-PAGE; осаждение сульфатом аммония; гель-фильтрация с применением, например, Sephadex G-75; содержащие белок A сефарозные колонки для удаления загрязнений, таких как IgG; и металлхелатные колонки для связывания меченых эпитопами форм антитела и полипептида. Можно применять различные способы очистки белков и такие способы известны в данной области и описаны, например, в Deutscher, Methods in Enzymology, 182 (1990); Scopes, Protein Purification: Principles and Practice, Springer-Verlag, New York (1982). Выбранная стадия(и) очистки будет зависеть, например, от природы использования способа получения и конкретного получаемого антитела или полипептида.
При использовании рекомбинантных способов антитело можно получать внутриклеточно в периплазматическом пространстве и прямо секретировать в среду. Если антитело получают внутриклеточно, в качестве первой стадии удаляют дебрис из макрочастиц или клеток-хозяев, или фрагментов лизиса, например, посредством центрифугирования или ультрацентрифугирования. У Carter et al., Bio/Technology 10:163-167 (1992) описан способ выделения антител, которые секретируются в периплазматическое пространство E. coli. В кратком изложении клеточную массу оттаивают в присутствии ацетат натрия (pH 3,5), ЭДТА и фенилметилсульфонилфторида (PMSF) в течение приблизительно 30 минут. Клеточный дебрис можно удалять центрифугированием. Когда антитело секретируется в среду, супернатанты из каждой экспрессионной системы, как правило, вначале концентрируют с применением коммерчески доступного концентрирующего белок фильтра, например устройство для ультрафильтрации Amicon или Millipore Pellicon. На любой из указанных выше стадий для ингибирования протеолиза можно добавлять ингибитор протеаз, такой как PMSF, а для предотвращения роста дополнительных загрязнителей можно добавлять антибиотики.
Состав антител, полученный из клеток, можно очищать, например, с применением хроматографии на гидроксиапатите, электрофореза в геле, диализа и аффинной хроматографии, где аффинная хроматография является предпочтительным способом очистки. Необходимость в белке A как аффинном лиганде зависит от вида и изотипа любого из иммуноглобулиновых доменов Fc, который присутствует в антителе. Белок A можно применять для очистки антител, которые основаны на тяжелых цепях γ1, γ2 или γ4 человека (Lindmark et al., J. Immunol. Meth. 62:1-13 (1983)). Белок G рекомендован для всех изотипов мышей и для γ3 человека (Guss et al., EMBO J. 5:15671575 (1986)). Матрикс, к которому прикрепляют аффинный лиганд, наиболее часто представляет собой агарозу, но также доступны другие матриксы. Механически стабильные матриксы, такие как стекло с контролируемым размером пор или поли(стиролдивинил)бензол, позволяют достичь более быстрых скоростей потока и более короткого времени обработки, чем можно достичь при применении агарозы. Когда антитело содержит домен CH3, для очистки подходит смола Bakerbond ABX™ (J. T. Baker, Phillipsburg, NJ). В зависимости от антитела для выделения также доступны другие способы для очистки белка, такие как разделение на ионообменной колонке, осаждение этанолом, ВЭЖХ с обратной фазой; хроматография на оксиде кремния; хроматография на гепаринсефарозе (heparin SEPHAROSE™), хроматография на анионо- или катионообменной смоле (такой как колонка с полиаспарагиновой кислотой), хроматофокусирование, SDS-PAGE и осаждение сульфатом аммония.
После любой подготовительной стадии(й) очистки содержащую представляющее интерес антитело и загрязнители смесь можно подвергать хроматографии гидрофобного взаимодействия с низким pH с применением элюирующего буфера при pH в пределах приблизительно 2,5-4,5, предпочтительно проводимую при низких концентрациях солей (например, приблизительно от 0-0,25M соли).
I. Фармацевтические составы
Терапевтические составы антител, связывающихся олигопептидов, связывающихся органических или неорганических низкомолекулярных соединений и/или полипептидов, применяемые согласно настоящему изобретению, получают для хранения посредством смешивания антитела, полипептида, олигопептида или органического/неорганического низкомолекулярного соединения с желательной степенью чистоты с необязательными фармацевтически приемлемыми носителями, эксципиентами или стабилизаторами (Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980)), в форме лиофилизированных составов или водных растворов. Приемлемые носители, эксципиенты или стабилизаторы являются нетоксичными для реципиентов при применяемых дозах и концентрациях и включают в себя буферы, такие как ацетатный, Tris, фосфатный, цитратный и буферы на основе других органических кислот; антиоксиданты, включающие в себя аскорбиновую кислоту и метионин; консерванты (такие как хлорид октадецилдиметилбензиламмония; хлорид гексаметония; хлорид бензалкония; хлорид бензэтония; фенол, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехин; резорцин; циклогексанол; 3-пентанол и м-крезол); полипептиды с низкой молекулярной массой (менее чем приблизительно 10 остатков); белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелаторы, такие как ЭДТА; средства создания тоничности, такие как трегалоза и хлорид натрия; сахара, такие как сахароза, маннит, трегалоза или сорбит; поверхностно-активное вещество, такое как полисорбат; формирующие соли противоионы, такие как натрий; комплексные соединения с металлами (например, комплексы Zn-белок) и/или неионные поверхностно-активные средства, такие как TWEEN®, PLURONICS® или полиэтиленгликоль (PEG). Состав может содержать антитело в концентрации от 5 до 200 мг/мл, предпочтительно - от 10 до 100 мг/мл.
Составы согласно настоящему документу также могут содержать более одного активного соединения в соответствии с необходимостью для конкретного показания, подвергаемого лечению, предпочтительно такие активные соединения с дополнительным действием, которые не влияют друг на друга неблагоприятным образом. Например, кроме антитела, связывающегося олигопептида или связывающегося органического или неорганического низкомолекулярного соединения, может быть желательным включать в один состав дополнительное антитело, например, второе антитело, которое связывается с другим эпитопом на том же полипептиде или антитело к какой-либо другой мишени, такой как фактор роста, который влияет на развитие конкретной злокачественной опухоли. Альтернативно или дополнительно состав может дополнительно содержать химиотерапевтическое средство, цитотоксическое средство, цитокин, ингибирующее рост средство, противогормональное средство и/или кардиопротектор. Соответственно, такие молекулы присутствуют в сочетании в количествах, которые эффективны для намеченной цели.
Активные ингредиенты также можно заключать в микрокапсулы, полученные, например, способами коацервации или межфазной полимеризации, например, гидроксиметилцеллюлозные или желатиновые микрокапсулы и поли(метилметакрилатные) микрокапсулы, соответственно, в коллоидные системы доставки лекарственных средств (например, липосомы, микросферы альбумина, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие способы описаны в Remington's Pharmaceutical Sciences. 16th edition, Oslo, A., Ed., (1980).
Можно получать препараты с замедленным высвобождением. Подходящие примеры препаратов с замедленным высвобождением включают в себя полупроницаемые матриксы твердых гидрофобных полимеров, содержащих антитело, где матриксы находятся в виде имеющих форму изделий, например, пленок или микрокапсул. Примеры матриксов с замедленным высвобождением включают в себя сложные полиэфиры, гидрогели (например, поли(2-гидроксиэтилметакрилат), или поли(виниловый спирт)), полилактиды (патент США № 3773919), сополимеры L-глутаминовой кислоты и γ-этил-L-глутамата, недеградируемый этиленвинилацетат, деградируемые сополимеры молочной кислоты-гликолевой кислоты, такие как ЛЮПРОН-ДЕПОТ (LUPRON DEPOT®) (инъецируемые микросферы, состоящие из сополимера молочной кислоты-гликолевой кислоты и лейпролида ацетата) и поли-D-(-)-3-гидроксимасляную кислоту.
Составы для применения для введения in vivo должны быть стерильными. Этого легко добиться посредством фильтрации через стерильные фильтрующие мембраны.
J. Лечение антителами, связывающимися олигопептидами и связывающимися органическими/неорганическими низкомолекулярными соединениями
Для определения экспрессии полипептида (гепсина и/или HGF) при злокачественной опухоли доступно множество детекционных способов анализа. В одном из вариантов осуществления сверхэкспрессию полипептида можно анализировать иммуногистохимически (IHC). Погруженные в парафин тканевые срезы из опухолевой биопсии можно подвергать IHC анализу и согласовывать с критериями интенсивности окраски полипептида, указанными ниже:
Показатель 0 - окрашивания не наблюдается или наблюдается окрашивание мембран менее чем у 10% опухолевых клеток.
Показатель 1+ - слабое/едва заметное окрашивание мембран выявляют более чем у 10% опухолевых клеток. У клеток окрашена только часть их мембраны.
Показатель 2+ - от слабого до умеренного полного окрашивания мембран наблюдают более чем у 10% опухолевых клеток.
Показатель 3+ - от среднего до сильного полного окрашивания мембран наблюдают более чем у 10% опухолевых клеток.
Опухоли с показателями 0 или 1+ для экспрессии полипептида можно охарактеризовать как несверхэкспрессирующие полипептид, тогда как опухоли с показателями 2+ или 3+ можно охарактеризовать как сверхэкспрессирующие полипептид.
Альтернативно или дополнительно, на фиксированной в формалине, погруженной в парафин опухолевой ткани, для определения степени (если есть) сверхэкспрессии полипептида в опухоли, можно проводить анализы FISH, такие как INFORM® (продаваемый Ventana, Arizona) или PATHVISION® (Vysis, Illinois).
Сверхэкспрессию или увеличение количества полипептида можно оценить с применением детекционного анализа in vivo, например, посредством введения молекулы (такой как антитело, олигопептид или органическое низкомолекулярное соединение), которая связывается с молекулой для детекции и метит ее детектируемой меткой (например, радиоактивным изотопом или флуоресцентной меткой), и наружного сканирования пациента на локализацию метки.
Как описано выше, антитела, олигопептиды и органические низкомолекулярные соединения согласно изобретению имеют различные нетерапевтические применения. Антитела, олигопептиды и органические/неорганические низкомолекулярные соединения согласно настоящему изобретению могут быть пригодны для определения стадии экспрессирующих полипептид злокачественных опухолей (например, при радиодиагностике). Антитела, олигопептиды и органические низкомолекулярные соединения также пригодны для очистки или иммунопреципитации полипептида из клеток, для детекции и количественного определения полипептида in vitro, например, при ELISA или вестерн-блоттинге, для уничтожения и удаления экспрессирующих полипептид клеток из популяции смешанных клеток в качестве стадии очистки других клеток.
В настоящее время, в зависимости от стадии злокачественной опухоли, лечение злокачественной опухоли включает в себя одно или сочетание следующих видов лечения: хирургическое вмешательство для удаления злокачественной ткани, радиационная терапия и химиотерапия. Терапия антителом, олигопептидом или органическим низкомолекулярным соединением может быть особенно предпочтительной для пожилых пациентов, кто плохо переносит токсические и побочные эффекты химиотерапии, и при метастазирующем заболевании, когда радиационная терапия обладает ограниченной пригодностью. Направленные к опухоли антитела, олигопептиды и органические/неорганические низкомолекулярные соединения согласно изобретению пригодны для облегчения экспрессирующих полипептид злокачественных опухолей при первичном диагнозе заболевания или при обострении. Для терапевтических применений антитело, олигопептид или органическое/неорганическое низкомолекулярное соединение можно применять отдельно или в комбинированном лечении, например, с гормонами, средствами против ангиогенеза или радиоактивно-мечеными соединениями или совместно с хирургическим вмешательством, криотерапией и/или радиотерапией. Лечение антителом, олигопептидом или органическим/неорганическим низкомолекулярным соединением можно проводить в сочетании с другими формами традиционного лечения последовательно с предшествующим или последующим традиционным лечением. При лечении злокачественной опухоли, особенно у пациентов с особенно высокой степенью риска, применяют химиотерапевтические лекарственные средства, такие как ТАКСОТЕР® (TAXOTERE®) (доцетаксел), ТАКСОЛ® (TAXOL®) (паклитаксел), эстрамустин и митоксантрон. В настоящем способе согласно изобретению для лечения или облегчения злокачественной опухоли пациентам со злокачественной опухолью можно вводить антитело, олигопептид или органическое/неорганическое низкомолекулярное соединение в сочетании с лечением одним или несколькими из указанных ранее химиотерапевтических средств. В частности предложено комбинированное лечение паклитакселом и модифицированными дериватами (см., например, EP0600517). Антитело, олигопептид или органическое/неорганическое низкомолекулярное соединение следует вводить с терапевтически эффективной дозой химиотерапевтического средства. В другом варианте осуществления антитело, олигопептид или органическое/неорганическое низкомолекулярное соединение вводят в сочетании с химиотерапией для усиления активности или эффективности химиотерапевтического средства, например, паклитаксела. В Physicians' Desk Reference (PDR) приведены дозы этих средств, которые использовали при лечении различных злокачественных опухолей. Режим дозирования и дозировки этих указанных выше химиотерапевтических лекарственных средств, которые являются терапевтически эффективными, будут зависеть от конкретной подвергаемой лечению злокачественной опухоли, степени заболевания и других факторов, хорошо известных практикующим специалистам в данной области, и могут быть определены врачом.
В одном конкретном варианте осуществления пациенту вводят конъюгированный с цитотоксическим средством конъюгат, содержащий антитело, олигопептид или органическое/неорганическое низкомолекулярное соединение. Предпочтительно иммуноконъюгат, связанный с белком, интернализуется клеткой, что приводит к увеличенной эффективности иммуноконъюгата в уничтожении клеток злокачественной опухоли, с которыми он связывается. В предпочтительном варианте осуществления цитотоксическое средство поражает нуклеиновую кислоту в клетках злокачественной опухоли или противодействует ей. Примеры таких цитотоксических средств описаны выше и включают в себя майтанзиноиды, калихимицины, рибонуклеазы и эндонуклеазы ДНК.
Антитела, олигопептиды, органические/неорганические низкомолекулярные соединения или их конъюгаты с токсинами вводят человеку известными способами, такими как внутривенное введение, например, в виде болюсной или непрерывной инфузии в течение периода времени, посредством внутримышечного, интраперитонеального, интрацереброспинального, подкожного, внутрисуставного, внутрисиновиального, интратекального, перорального, топического или ингаляционного способов. Внутривенное или подкожное введение антитела, олигопептида или органического низкомолекулярного соединения является предпочтительным.
С введением антитела, олигопептида или органического/неорганического низкомолекулярного соединения можно сочетать другие терапевтические режимы. Комбинированное введение включает в себя совместное введение с применением отдельных составов или одного фармацевтического состава и последовательное введение в любом порядке, где, предпочтительно, существует период времени, когда оба (или все) активные средства одновременно проявляют свою биологическую активность. Предпочтительно такое комбинированное лечение приводит к синергическому терапевтическому эффекту.
Также может быть желательным сочетать введение антитела или антител, олигопептидов или органических/неорганических низкомолекулярных соединений с введением антитела, направленного к другому опухолевому антигену, ассоциированному с конкретной злокачественной опухолью.
В другом варианте осуществления, способы терапевтического лечения по настоящему изобретению включают в себя совместное введение антитела (или антител), олигопептидов или органических/неорганических низкомолекулярных соединений и одного или нескольких химиотерапевтических средств или ингибирующих рост средств, включая в себя совместное введение смесей различных химиотерапевтических средств. Химиотерапевтические средства включают в себя эстрамустина фосфат, преднимустин, цисплатин, 5-фторурацил, мелфалан, циклофосфамид, гидроксикарбамид и гидроксикарбамидтаксаны (такие как паклитаксел и доцетаксел) и/или антрациклиновые антибиотики. Получать такие химиотерапевтические средства и использовать протоколы их дозирования можно по инструкциям производителя или как определено практикующими специалистами эмпирически. Получение и протоколы дозирования для такой химиотерапии также описаны в Chemotherapy Service Ed., M.C. Perry, Williams & Wilkins, Baltimore, MD (1992).
Антитело, олигопептид или органическое/неорганическое низкомолекулярное соединение можно сочетать с противогормональным соединением, например антиэстрогеновым соединением, таким как тамоксифен; антипрогестероновым соединением, таким как онапристон (см. ЕР 616812): или антиандрогеновым соединением, таким как флутамид, в дозировках, известных для таких молекул. Когда злокачественная опухоль для лечения является андрогеннезависимой злокачественной опухолью, пациента ранее могли подвергать антиандрогенному лечению, и после того, как злокачественная опухоль станет андрогеннезависимой пациенту можно вводить антитело, олигопептид или органическое/неорганическое низкомолекулярное соединение (и необязательно другие средства, как описано в данном документе).
Иногда пациенту также может быть полезным совместно вводить кардиопротектор (для предотвращения или уменьшения дисфункции миокарда, связанной с лечением) или один или несколько цитокинов. Кроме указанных выше терапевтических режимов лечения пациента до лечения антителом, олигопептидом или органическим/неорганическим низкомолекулярным соединением одновременно с ним или после него можно подвергнуть хирургическому удалению злокачественных клеток и/или радиационной терапии. Подходящие дозировки для любого из указанных выше терапевтических средств представляют собой используемые в настоящее время дозировки и их можно уменьшать вследствие комбинированного действия (синергии) средства и антитела, олигопептида или органического/неорганического низкомолекулярного соединения.
Для профилактики или лечения заболевания дозировку и способ введения выбирает лечащий врач исходя из известных критериев. Подходящая доза антитела, олигопептида или органического/неорганического низкомолекулярного соединения будет зависеть от типа заболевания для лечения, как определено выше, тяжести и течения заболевания, от того вводят ли антитело, олигопептид или органическое/неорганическое низкомолекулярное соединение с профилактическими или лечебными целями, предыдущего лечения, истории болезни пациента и ответа на антитело, олигопептид или органическое/неорганическое низкомолекулярное соединение и выбора лечащего врача. Соответственно, антитело, олигопептид или органическое/неорганическое низкомолекулярное соединение вводят пациенту один раз или в виде ряда введений. Предпочтительно, антитело, олигопептид или органическое/неорганическое низкомолекулярное соединение вводят посредством внутривенной инфузии или посредством подкожных инъекций. В зависимости от типа и тяжести заболевания исходной дозой-кандидатом для введения пациенту посредством одного или нескольких отдельных введений или посредством непрерывной инфузии может являться приблизительно от 1 мкг/кг массы тела до приблизительно 50 мг/кг массы тела (например, приблизительно 0,1-15 мг/кг/дозу) антитела. Режим дозирования может включать в себя введение исходной ударной дозы в размере приблизительно 4 мг/кг, с последующей еженедельной поддерживающей дозой в размере приблизительно 2 мг/кг антитела. Однако пригодными могут являться и другие режимы дозирования. Обычная суточная доза может находиться в диапазоне приблизительно от 1 мкг/кг до 100 мг/кг или более, в зависимости от указанных выше факторов. Для повторных введений в течение нескольких суток или более, в зависимости от состояния, лечение продолжают до тех пор, пока не произойдет желательного подавления симптомов заболевания. Прогресс этого лечения можно легко контролировать традиционными способами и анализами и на основе известных врачам и другим специалистам в данной области критериев.
Кроме введения пациенту белка антитела, настоящая заявка относится к введению антитела посредством генной терапии. Такое введение кодирующей антитело нуклеиновой кислоты заключается в выражении "введение терапевтически эффективного количества антитела". См., например, WO96/07321, опубликованную 14 марта 1996 года, относительно применения генной терапии для получения внутриклеточных антител.
Существует два основных подхода введения нуклеиновой кислоты (необязательно содержащейся в векторе) в клетки пациента: in vivo и ex vivo. Для доставки in vivo нуклеиновую кислоту инъецируют непосредственно пациенту, как правило, в тот участок, где антитело необходимо. Для лечения ex vivo у пациента берут клетки, в эти выделенные клетки вводят нуклеиновую кислоту и модифицированные клетки вводят пациенту или непосредственно, или, например, инкапсулированными в пористые мембраны, которые имплантируют пациенту (см., например, патенты США № 4892538 и 5283187). Существует множество доступных способов для введения нуклеиновых кислот в живые клетки. Способы отличаются в зависимости от того, переносят ли нуклеиновую кислоту в культивируемые клетки in vitro, или in vivo в клетки намеченного хозяина. Способы, подходящие для переноса нуклеиновой кислоты в клетки млекопитающих in vitro, включают в себя применение липосом, электропорации, микроинъекции, слияния клеток, DEAE-декстран, способ осаждения фосфатом кальция и т.д. Традиционно используемым вектором для доставки гена ex vivo является ретровирусный вектор.
Предпочитаемые в настоящее время способы переноса нуклеиновой кислоты in vivo включают в себя трансфекцию вирусными векторами (такими как аденовирус, вирус простого герпеса I или аденоассоциированный вирус) и основанные на липидах системы (подходящие липиды для опосредованного липидами переноса генов представляют собой, например, DOTMA, DOPE и DC-Chol). Для обзора известных в настоящее время протоколов мечения генов и генной терапии см. Anderson et al., Science 256:808-813 (1992). Также см. WO 93/25673 и цитируемые в ней ссылки.
Антитела согласно изобретению могут находится в различных формах, охватываемым определением "антитело" по данному документу. Таким образом, антитела включают в себя полноразмерное или интактное антитело, фрагменты антител, природную последовательность антитела или аминокислотных вариантов, гуманизированные, химерные или слитые антитела, иммуноконъюгаты и их функциональные фрагменты. В слитых антителах последовательность антитела слита с гетерологической полипептидной последовательностью. Антитела можно модифицировать по Fc-области для обеспечения желательных эффекторных функций. Как обсуждалось более подробно в одном из разделов настоящего документа, с подходящими Fc-областями, простое антитело, связанное с клеточной поверхностью, может индуцировать цитотоксичность, например, вследствие обусловленной антителами клеточной цитотоксичности (ADCC) или посредством привлечения комплемента при обусловленной комплементом цитотоксичности или посредством какого-либо другого механизма. Альтернативно, там где желательно ликвидировать или уменьшить эффекторную функцию, для того, чтобы минимизировать побочные эффекты или терапевтические осложнения, можно использовать некоторые другие Fc-области.
В одном из вариантов осуществления антитело конкурирует за связывание или прочно связывается с тем же эпитопом, что и антитела согласно изобретению. Также рассматриваются антитела с биологическими характеристиками предоставляемых антител согласно изобретению, в особенности, включая направленность к опухоли in vivo и любое ингибирование клеточной пролиферации или цитотоксические характеристики.
В данном документе подробно описаны способы получения указанных выше антител.
Предоставляемые антитела, олигопептиды и органические/неорганические низкомолекулярные соединения пригодны для лечения экспрессирующей гепсин и/или HGF злокачественной опухоли или для облегчения одного или нескольких симптомов злокачественной опухоли у млекопитающих. Способы согласно изобретению включают в себя использование в лечении и/или облегчении симптомов метастатических опухолей, ассоциированных с этими злокачественными опухолями, антагонистов. Антитело, олигопептид или органическое/неорганическое низкомолекулярное соединение антагонист способны связываться по меньшей мере с частью злокачественных клеток, экспрессирующих полипептид(ы) (гепсин и/или HGF) у млекопитающих. В одном из вариантов осуществления антитело, олигопептид или органическое/неорганическое низкомолекулярное соединение эффективны в разрушении и уничтожении экспрессирующих полипептид и/или отвечающих опухолевых клеток или ингибируют рост таких клеток in vitro или in vivo при связывании с полипептидом. Такое антитело включает в себя простое антитело (не конъюгированное с каким-либо средством). Простые антитела, которые обладают цитотоксическими или ингибирующими рост клеток свойствами, можно дополнительно соединять с цитотоксическим средством для придания им еще большей эффективности в разрушении опухолевых клеток. Цитотоксические свойства можно придать антителу, например, посредством конъюгации антитела с цитотоксическим средством, с формированием иммуноконъюгата, как описано в данном документе. В некоторых вариантах осуществления цитотоксическое средство или ингибирующее рост средство представляет собой низкомолекулярное соединение. В некоторых вариантах осуществления применяют токсины, такие как калихимицин или майтанзиноид и их аналоги или производные.
Изобретение относится к композиции, содержащей антитело, олигопептид или органическое/неорганическое низкомолекулярное соединение согласно изобретению и носитель. С целью лечения злокачественной опухоли нуждающемуся в таком лечении пациенту можно вводить композиции, где композиция может содержать один или несколько антител, предоставленных в виде иммуноконъюгата или в виде простого антитело. В дополнительных вариантах осуществления композиции могут содержать эти антитела, олигопептиды или органические/неорганические низкомолекулярные соединения в сочетании с другими терапевтическими средствами, такими как цитотоксические или ингибирующие рост средства, включая химиотерапевтические средства. Изобретение также относится к составам, содержащим антитело, олигопептид или органическое/неорганическое низкомолекулярное соединение согласно изобретению и носитель. В одном из вариантов осуществления состав представляет собой терапевтический состав, содержащий фармацевтически приемлемый носитель.
Другой аспект изобретения представляет собой нуклеиновые кислоты, кодирующие антитела. В объем входят нуклеиновые кислоты, кодирующие цепи H и L, а особенно остатки гипервариабельных областей, цепи, кодирующие природную последовательность антитела, а также варианты, модификации и гуманизированные версии антитела.
Изобретение также относится к способам, пригодным для лечения злокачественной опухоли или облегчения одного или нескольких симптомов злокачественной опухоли у млекопитающего, включающим в себя введение млекопитающему терапевтически эффективного количества антитела, олигопептида или органического/неорганического низкомолекулярного соединения. Терапевтические композиции антитела, олигопептида или органического/неорганического низкомолекулярного соединения можно вводить кратковременно (резко) или длительно или с перерывами, в соответствии с решением лечащего врача. Также предоставлены способы ингибирования роста и уничтожения полипептид (гепсин и/или HGF)- экспрессирующих и/или -отвечающих клеток.
Изобретение также относится к наборам и готовым изделиям, содержащим, по меньшей мере, одно антитело, олигопептид или органическое/неорганическое низкомолекулярное соединение. Содержащие антитела, олигопептиды или органические/неорганические низкомолекулярные соединения наборы находят применение, например, для анализа уничтожения клеток, для очистки или иммунопреципитации полипептида из клеток. Например, для выделения и очистки полипептида, набор может содержать антитело, олигопептид или органическое/неорганическое низкомолекулярное соединение, связанные с гранулами (например, гранулами сефарозы). Можно предоставлять наборы, которые содержат антитела, олигопептиды или органические/неорганические низкомолекулярные соединения для детекции и количественного определения полипептида in vitro, например, при ELISA или вестерн-блоттинге. Такие антитело, олигопептид или органическое/неорганическое низкомолекулярное соединение, пригодные для детекции, можно предоставлять с меткой, такой как флуоресцентная или радиоактивная метка.
K. Готовые изделия и наборы
Другой вариант осуществления изобретения представляет собой готовое изделие, содержащее вещества, пригодные для лечения экспрессирующей полипептид (гепсин и/или HGF) злокачественной опухоли, такой рак предстательной железы и яичника. Готовое изделие содержит контейнер и ярлык или вкладыш в упаковку на контейнере или приложенный к контейнеру. Подходящие контейнеры включают в себя, например, бутылки, флаконы, шприцы и т.д. Контейнеры можно формировать из множества материалов, таких как стекло или пластик. Контейнер содержит композицию, эффективную для лечения злокачественной опухоли, и может иметь стерильное входное отверстие (например, контейнер может представлять собой пакет с внутривенным раствором или флакон с пробкой, поддающейся прокалыванию иглой для подкожной инъекции). По меньшей мере, одно активное средство в композиции представляет собой антитело, олигопептид или органическое/неорганическое низкомолекулярное соединение согласно изобретению. Ярлык или вкладыш в упаковку указывают на то, что композицию применяют для лечения злокачественной опухоли. Ярлык или вкладыш в упаковку дополнительно содержат инструкции для введения композиции антитела, олигопептида или органического/неорганического низкомолекулярного соединения пациенту со злокачественной опухолью. Кроме того, готовое изделие может дополнительно содержать второй контейнер, содержащий фармацевтически приемлемый буфер, такой как бактериостатическая вода для инъекций, фосфатно-солевой буфер, раствор Рингера и раствор декстрозы. Дополнительно можно включать другие материалы, желательные с коммерческой точки зрения или точки зрения пользователя, включая другие буферы, разбавители, фильтры, иглы и шприцы.
Также предоставлены наборы, которые пригодны для различных целей, например, для анализов экспрессии полипептида или уничтожения клеток, для очистки или иммунопреципитации полипептида из клеток. Для выделения и очистки полипептида набор может содержать антитело, олигопептид или органическое/неорганическое низкомолекулярное соединение, связанные с гранулами (например, сефарозными гранулами). Можно предоставлять наборы, которые содержат антитела, олигопептиды или органические/неорганические низкомолекулярные соединения для детекции или количественного определения полипептида in vitro, например, при ELISA или вестерн-блоттинге. Как и для готового изделия, набор содержит ярлык или вкладыш в упаковку на контейнере или приложенный к контейнеру. Контейнер содержит композицию, содержащую по меньшей мере одно антитело, олигопептид или органическое/неорганическое низкомолекулярное соединение согласно изобретению. Дополнительно сюда можно включать контейнеры, например, содержащие, разбавители и буферы, контрольные антитела. Ярлык или вкладыш в упаковку могут предоставлять описание композиции, а также инструкции для планируемого применения in vitro или детекции.
L. Полипептиды и кодирующие полипептиды нуклеиновые кислоты - конкретные формы и применения
Нуклеотидные последовательности (или комплементарные к ним), кодирующие полипептиды согласно изобретению, имеют много применений в области молекулярной биологии, а также применений в терапии и т.д. Кодирующая полипептиды нуклеиновая кислота также пригодна для получения полипептидов описанными в данном документе рекомбинантными способами, где такие полипептиды могут найти применение, например, для получения антител, как описано в данном документе.
Полноразмерную природную последовательность гена полипептида или ее части можно применять в качестве гибридизационных зондов для библиотеки кДНК для выделения других кДНК (например, кДНК, кодирующих встречающиеся в природе варианты полипептида или полипептид из другого вида), обладающих желательной идентичностью последовательности и природной последовательностью полипептида, описанной в настоящем документе. Необязательно длина зондов составляет приблизительно от 20 до приблизительно 50 оснований. Гибридизационные зонды можно получать, по меньшей мере, из частично новых областей полноразмерной природной нуклеотидной последовательности, где такие области можно определить без излишнего экспериментирования, или из геномной последовательности, включая промоторы, энхансерные элементы и интроны природной последовательности полипептида. В качестве примера способ скрининга включает в себя выделение кодирующей области гена полипептида с применением известной последовательности ДНК для синтеза выбранного зонда приблизительно из 40 оснований. Гибридизационные зонды можно метить различными метками, включая радионуклеотиды, такие как 32P или 35S или ферментативные метки, такие как щелочная фосфатаза, связанная с зондом связывающими системами авидина/биотина. Меченые зонды с последовательностью, комплементарной к последовательности гена полипептида по настоящему изобретению, можно использовать для скрининга библиотек человеческой кДНК, геномной ДНК или мРНК для определения того, какие представители таких библиотек гибридизуются с данным зондом. Способы гибридизации дополнительно детализованы в примерах ниже. Любые последовательности EST, описанные в настоящей заявке, аналогичным образом можно применять в качестве зондов с применением описанных в данном документе способов.
Другие пригодные фрагменты кодирующих полипептиды нуклеиновых кислот включают в себя антисмысловые или смысловые олигонуклеотиды, содержащие одноцепочечную последовательность нуклеиновой кислоты (или РНК, или ДНК), способную связываться с последовательностью-мишенью мРНК полипептида (смысловая) или ДНК полипептида (антисмысловая). Антисмысловые или смысловые олигонуклеотиды согласно настоящему изобретению содержат фрагмент кодирующей области ДНК, кодирующей гепсин, про-HGF или связывающиеся фрагменты, как описано в данном документе. Такой фрагмент, как правило, содержит, по меньшей мере, приблизительно 14 нуклеотидов, предпочтительно приблизительно от 14 до 30 нуклеотидов. Возможность получать антисмысловой или смысловой олигонуклеотид, на основе последовательности кДНК, кодирующей данный белок, например, описана в Stein and Cohen (Cancer Res. 48:2659, 1988) и van der Krol et al. (BioTechniques 6:958, 1988).
Связывание антисмысловых или смысловых олигонуклеотидов с последовательностями-мишенями нуклеиновых кислот приводит к формированию дуплексов, которые блокируют транскрипцию или трансляцию последовательности-мишени одним из нескольких способов, включающих в себя увеличенную деградацию дуплексов, преждевременную терминацию транскрипции или трансляции или другими способами. Такие способы входят в объем настоящего изобретения. Таким образом, антисмысловые олигонуклеотиды можно использовать для блокирования экспрессии белка, там где белок может играть роль в индукции злокачественной опухоли у млекопитающих. Антисмысловые или смысловые олигонуклеотиды дополнительно содержат олигонуклеотиды с модифицированным сахарно-фосфодиэфирным каркасом (или другими связями сахаров, такими как описаны в WO 91/06629), где такие связи сахаров устойчивы к эндогенным нуклеазам. Такие олигонуклеотиды с устойчивыми связями сахаров стабильны in vivo (т.е. способны противостоять ферментативному разрушению), но сохраняют специфичность последовательности, чтобы быть способными связываться с нуклеотидными последовательностями-мишенями.
Предпочтительные межгенные участки для связывания антисмысловых последовательностей включают в себя область, содержащую кодон инициации/старта трансляции (5'-AUG/5'-ATG) или кодон терминации/стоп-кодон (5'-UAA, 5'-UAG и 5-UGA/5'-TAA, 5'-TAG и 5'-TGA) открытой рамки считывания (ORF) гена. Эти области относятся к части мРНК или гена, содержащей приблизительно от 25 до приблизительно 50 смежных нуклеотидов в прямом направлении (т.е. 5' или 3') от кодона инициации или терминации трансляции. Другие предпочтительные области для связывания антисмысловых последовательностей включают в себя: интроны; экзоны; места соединения интронов и экзонов; открытую рамку считывания (ORF) или "кодирующую область", которая представляет собой область между кодоном инициации трансляции и кодоном терминации трансляции; 5'-кэп мРНК, содержащий метилированный по N7 остаток гуанозина, связанный с 5'-концевым остатком мРНК посредством 5'-5' трифосфатной связи и включающий в себя саму структуру 5'-кэпа, а также первые 50 нуклеотидов, прилегающие к кэпу; 5'- нетранслируемую область (5'UTR), часть мРНК в направлении 5'- от кодона инициации трансляции и, таким образом, содержащая нуклеотиды между участком 5'-кэпа и кодоном инициации трансляции мРНК или соответствующие нуклеотиды на гене, и 3'- нетранслируемая область (3'UTR), часть мРНК в направлении 3'- от кодона терминации трансляции и, таким образом, содержащая нуклеотиды между кодоном терминации трансляции и 3'-концом мРНК или соответствующие нуклеотиды на гене.
Конкретные примеры предпочтительных антисмысловых соединений, пригодных для ингибирования экспрессии полипептида, включают в себя олигонуклеотиды, содержащие модифицированные каркасы или неприродные межнуклеозидные связи. Олигонуклеотиды с модифицированными каркасами включают в себя олигонуклеотиды, содержащие атом фосфора в каркасе, и олигонуклеотиды, не содержащие атома фосфора в каркасе. Для целей данного описания и, как иногда считают в данной области, модифицированные нуклеотиды без атома фосфора в их межнуклеозидном каркасе также можно рассматривать как олигонуклеозиды. Предпочтительные модифицированные каркасы олигонуклеотидов включают в себя, например, фосфоротиоаты, хиральные фосфоротиоаты, фосфородитиоаты, фосфотриэфиры, аминоалкилфосфотриэфиры, метилированные и другие алкилированные фосфонаты, включая 3'-алкиленфосфонаты, 5'-алкиленфосфонаты и хиральные фосфонаты, фосфинаты, фосфорамидаты, включающие в себя 3'-амино, фосфорамидат и аминоалкилфосфорамидаты, тионофосфорамидаты, тионоалкилфосфонаты, тионоалкилфосфотриэфиры, селенофосфаты и борофосфаты с нормальными 3'-5' связями, их 2'-5' связанные аналоги и олигонуклеотиды с инвертированной полярностью, где одна или несколько межнуклеотидных связей представляет собой связь 3' с 3', 5' с 5' или 2' с 2'. Предпочтительные олигонуклеотиды с инвертированной полярностью содержат одиночную связь 3' с 3' по 3'-концевой межнуклеотидной связи, т.е. один инвертированный нуклеозидный остаток, в котором может отсутствовать основание (нуклеиновое основание отсутствует или вместо нее находится гидроксильная группа). Также включены различные соли, смешанные соли и формы свободных кислот. Репрезентативные патенты Соединенных Штатов, в которых описано получение содержащих фосфор связей, включают в себя в качестве неограничивающих примеров, патенты США №: 3687808; 4469863; 4476301; 5023243; 5177196; 5188897; 5264423; 5276019; 5278302; 5286717; 5321131; 5399676; 5405939; 5453496; 5455233; 5466677; 5476925; 5519126; 5536821; 5541306; 5550111; 5563253; 5571799; 5587361; 5194599; 5565555; 5527899; 5721218; 5672697 и 5625050, каждый из которых включен в настоящий документ в качестве ссылки.
Предпочтительные модифицированные каркасы олигонуклеотидов, которые не содержат атома фосфора, имеют каркасы, образуемые короткоцепочечными алкильными или циклоалкильными межнуклеозидными связями, смешанными межнуклеозидными связями с гетероатомом и алкилом или циклоалкилом или одной или несколькими короткоцепочечными межнуклеозидными связями с гетероатомом или гетероциклом. Они включают в себя олигонуклеотиды с морфолиновыми связями (частично формируемыми из сахарной части нуклеозиды); силоксановые каркасы; сульфидные, сульфоксидные и сульфоновые каркасы; формацетильные и тиоформацетильные каркасы; метиленформацетильные и -тиоформацетильные каркасы; рибоацетильные каркасы; содержащие алкены каркасы; сульфаматные каркасы; метиленимино и метиленгидразиновые каркасы; сульфонатные и сульфонамидные каркасы; амидные каркасы и другие, содержащие части смешанных компонентов N, О, S и CH2. Репрезентативные патенты Соединенных Штатов, в которых описано получение таких олигонуклеозидов, включают в себя в качестве неограничивающих примеров патенты США №: 5034506; 5166315; 5185444; 5214134; 5216141; 5235033; 5264562; 5264564; 5405938; 5434257; 5466677; 5470967; 5489677; 5541307; 5561225; 5596086; 5602240; 5610289; 5602240; 5608046; 5610289; 5618704; 5623070; 5663312; 5633360; 5677437; 5792608; 5646269 и 5677439, каждый из которых включен в настоящий документ в качестве ссылки.
В других предпочтительных антисмысловых олигонуклеотидах и сахарная, и межнуклеозидная связь, т.е. каркас нуклеотидных единиц, замещены новыми группами. Основания сохраняют для гибридизации с соответствующим соединением нуклеиновой кислоты-мишени. Одно из таких олигомерных соединений, олигонуклеотидный миметик, для которого показано, что он обладает превосходными гибридизационными свойствами, обозначают здесь как пептидная нуклеиновая кислота (PNA). В соединениях PNA, сахарный остов олигонуклеотида заменен на содержащий амидные связи каркас, конкретно на аминоэтилглициновый каркас. Нуклеиновые основания сохраняются и связываются прямо или опосредовано с аза-атомами азота амидной части каркаса. Репрезентативные патенты Соединенных Штатов, в которых описано получение соединений PNA, включают в себя в качестве неограничивающих примеров, патенты США №: 5539082; 5714331 и 5719262, каждый из которых включен в настоящий документ в качестве ссылки. Дополнительные указания относительно соединений PNA можно найти в Nielsen et al., Science, 1991, 254, 1497-1500.
Предпочтительные антисмысловые олигонуклеотиды включают в себя фосфоротиоатные каркасы и/или каркасы с гетероатомами, а конкретно -CH2-NH-O-CH2-, -CH2-N(CH3)-O-CH2- [известный как метилен(метилиминовый) или MMI каркас], -CH2-O-N(CH3)-CH2-, -CH2-N(CH3)-N(CH3)-CH2- и -O-N(CH3)-CH2-CH2- [где природный фосфодиэфирный каркас представлен как -O-P-O-CH2-], описанные в указанном выше патенте США № 5489677, а амидные каркасы в указанном выше патенте США № 5602240. Также предпочтительны антисмысловые олигонуклеотиды с морфолиновыми каркасными структурами по указанному выше патенту США № 5034506.
Модифицированные олигонуклеотиды также могут содержать одну или несколько замещенных молекул сахара. Предпочтительные олигонуклеотиды содержат в положении 2'- одно из следующего: OH; F; O-алкил, S-алкил или N-алкил; O-алкенил, S-алкенил или N-алкенил; O-алкинил, S-алкинил или N-алкинил или O-алкил-O-алкил, где алкил, алкенил и алкинил могут представлять собой замещенные или незамещенные алкил от C1 до C10 или алкенил и алкинил от C2 до C10. Особенно предпочтительными являются O[(CH2)nO]mCH3, O(CH2)nOCH3, O(CH2)nNH2, O(CH2)nCH3, O(CH2)nONH2, и O(CH2)nON[(CH2)nCH3)]2, где n и m представляют собой от 1 до приблизительно 10. Другие предпочтительные антисмысловые олигонуклеотиды содержат в положении 2'- одно из следующего: низший алкил от C1 до C10, замещенный низший алкил, алкенил, алкинил, алкарил, аралкил, O-алкарил или O-аралкил, SH, SCH3, OCN, Cl, Br, CN, CF3, OCF3, SOCH3, SO2 CH3, ONO2, NO2, N3, NH2, гетероциклоалкил, гетероциклоалкарил, аминоалкиламино, полиалкиламино, замещенный силил, расщепляющую РНК группу, репортерную группу, интеркалятор, группу для улучшения фармакокинетических свойств олигонуклеотида, группу для улучшения фармакодинамических свойств олигонуклеотида и другие заместители с подобными свойствами. Предпочтительная модификация включает в себя 2'-метоксиэтокси (2'-O-CH2CH2OCH3, также известный как 2'-O-(2-метоксиэтил) или 2'-MOE) (Martin et al., Helv. Chim. Acta, 1995, 78, 486-504), т.е. группу алкоксиалкокси. Дополнительная предпочтительная модификация включает в себя 2'-диметиламинооксиэтокси, т.е. группу O(CH2)2ON(CH3)2, также известную как 2'-DMAOE, как описано в примерах ниже в данном документе, и 2'-диметиламиноэтоксиэтокси (также известный в данной области как 2'-O-диметиламиноэтоксиэтил или 2'-DMAEOE), т.е. 2'-O-CH2-O-CH2-N(CH2).
Дополнительная предпочтительная модификация включает в себя замкнутые нуклеиновые кислоты (LNA) в которых 2'-гидроксильная группа сахарного кольца связана с 3' или 4' атомом углерода, тем самым формируя бициклическую молекулу сахара. Связь предпочтительно представляет собой связывающую 2' атом кислорода и 4' атом углерода метиленовую (-CH2-)n группу, где n представляет собой 1 или 2. LNA и их получение описано в WO 98/39352 и WO 99/14226.
Другие предпочтительные модификации включают в себя 2'-метокси (2'-O-CH3), 2'-аминопропокси (2'-OCH2CH2CH2NH2), 2'-аллил (2'-CH2-CH=CH2), 2'-O-аллил (2'-О-CH2-CH=CH2) и 2'-фтор (2'-F). Модификация 2' может находиться в арабино-положении (сверху) или рибо-положении (снизу). Предпочтительная модификация 2'-арабино представляет собой 2'-F. Подобные модификации также можно производить в других положениях олигонуклеотида, конкретно - в 3'-положении сахара у 3'-концевого нуклеотида или в 2'-5'-связанных олигонуклеотидах и в 5'-положении 5'-терминального нуклеотида. Олигонуклеотиды вместо пентафуранозильного сахара также могут содержать имитаторы сахара, такие как циклобутиловые группы. Репрезентативные патенты Соединенных Штатов, в которых описано получение таких модифицированных групп сахаров включают в себя в качестве неограничивающих примеров, патенты США №: 4981957; 5118800; 5319080; 5359044; 5393878; 5446137; 5466786; 5514785; 5519134; 5567811; 5576427; 5591722; 5597909; 5610300; 5627053; 5639873; 5646265; 5658873; 5670633; 5792747 и 5700920, каждый из которых включен в настоящий документ в качестве ссылки в полном объеме.
Олигонуклеотиды также могут включать в себя модификации или замены нуклеиновых оснований (часто обозначаемых в данной области просто как "основание"). Как применяют в настоящем документе, "немодифицированные" или "природные" нуклеиновые основания включают в себя пуриновые основания аденин (A) и гуанин (G) и пиримидиновые основания тимин (T), цитозин (C) и урацил (U). Модифицированные нуклеиновые основания включают в себя другие синтетические и природные нуклеиновые основания, такие как 5-метилцитозин (5-me-C), 5-гидроксиметилцитозин, ксантин, гипоксантин, 2-аминоаденин, 6-метильные и другие алкильные производные аденина и гуанина, 2-пропильные и другие алкильные производные аденина и гуанина, 2-тиоурацил, 2-тиотимин и 2-тиоцитозин, 5-галогенурацил и цитозин, 5-пропинил (-C≡C-CH3 или -CH2-C≡CH) -урацил и -цитозин и другие алкинильные производные пиримидиновых оснований, 6-азоурацил, -цитозин и -тимин, 5-урацил (псевдоурацил), 4-тиоурацил, 8-галоген, 8-амино, 8-тиол, 8-тиоалкил, 8-гидроксил и другие 8-замещенные аденины и гуанины, 5-галоген, особенно 5-бром, 5-трифторметил и другие 5-замещенные урацилы и цитозины, 7-метилгуанин и 7-метиладенин, 2-F-аденин, 2-аминоаденин, 8-азагуанин и 8-азааденин, 7-деазагуанин и 7-деазааденин и 3-деазагуанин и 3-деазааденин. Дополнительные модифицированные нуклеиновые основания включают в себя трициклические пиримидины, такие как феноксазинцитидин(1H-пиримидо[5,4-b][1,4]бензоксазин-2(3H)-он), фенотиазинцитидин (1H-пиримидо[5,4-b][1,4]бензотиазин-2(3H)-он), G-зажимы такие как замещенный феноксазинцитидин (например 9-(2-аминоэтокси)-H-пиримидо[5,4-b][1,4]бензоксазин-2(3H)-он), карбазолцитидин (2H-пиримидо[4,5-b]индол-2-он), пиридоиндолцитидин (H-пиридо[3',2':4,5]пирроло[2,3-d]пиримидин-2-он). Модифицированные нуклеиновые основания также могут включать в себя нуклеиновые основания, в которых пуриновое или пиримидиновое основание замещено другим гетероциклом, например, 7-деаза-аденин, 7-деазагуанозин, 2-аминопиридин и 2-пиридон. Дополнительные нуклеиновые основания включают в себя нуклеиновые основания, описанные в патенте США № 3687808, нуклеиновые основания, описанные в The Concise Encyclopedia Of Polymer Science And Engineering, стр. 858-859, Kroschwitz, J. I., ed. John Wiley & Sons, 1990, и нуклеиновые основания, описанные в Englisch et al., Angewandte Chemie, International Edition, 1991, 30, 613. Некоторые из этих нуклеиновых оснований являются особенно пригодными для увеличения аффинности связывания олигомерных соединений согласно изобретению. Они включают в себя 5-замещенные пиримидины, 6-азапиримидины и N-2, N-6 и O-6 замещенные пурины, включая 2-аминопропиладенин, 5-пропинилурацил и 5-пропинилцитозин. Показано, что замены на 5-метилцитозин увеличивают стабильность дуплекса нуклеиновой кислоты на 0,6-1,2°C. (Sanghvi et al, Antisense Research and Applications, CRC Press, Boca Raton, 1993, pp. 276-278) и являются предпочтительными заменами оснований, даже более конкретно, когда сочетаются с 2'-O-метоксиэтиловыми модификациями сахаров. Репрезентативные патенты Соединенных Штатов, в которых описано получение модифицированных нуклеиновых оснований, включают в себя в качестве неограничивающих примеров: патент США № 3687808, а также патенты США №: 4845205; 5130302; 5134066; 5175273; 5367066; 5432272; 5457187; 5459255; 5484908; 5502177; 5525711; 5552540; 5587469; 5594121, 5596091; 5614617; 5645985; 5830653; 5763588; 6005096; 5681941 и 5750692, каждый из которых включен в настоящий документ в качестве ссылки.
Другая модификация антисмысловых олигонуклеотидов представляет собой химическое связывание с олигонуклеотидом одной или нескольких молекул или конъюгатов, которые улучшают активность олигонуклеотида, его распределение в клетках или его захват клетками. Соединения согласно изобретению могут включать в себя группы для конъюгирования, ковалентно связанные с функциональными группами, такими как первичные или вторичные гидроксильные группы. Группы для конъюгирования согласно изобретению включают в себя интеркаляторы, репортерные молекулы, полиамины, полиамиды, полиэтиленгликоли, простые полиэфиры, группы, улучшающие фармакодинамические свойства олигомеров и группы that, улучшающие фармакокинетические свойства олигомеров. Типичные группы для конъюгирования включают в себя холестерины, липиды, катионные липиды, фосфолипиды, катионные фосфолипиды, биотин, феназин, фолат, фенантридин, антрахинон, акридин, флуоресцеины, родамины, кумарины и красители. В контексте данного изобретения группы, улучшающие фармакодинамические свойства, включают в себя группы, улучшающие захват олигомера, увеличивающие устойчивость к деградации и/или усиливающие специфичную для последовательности гибридизацию с РНК. В контексте данного изобретения группы, улучшающие фармакокинетические свойства, включают в себя группы, улучшающие захват, распределение, метаболизм или выведение олигомера. Группы для конъюгирования включают в себя в качестве неограничивающих примеров липидные группы, такие как холестериновая группа (Letsinger et al., Proc. Natl. Acad. Sci. USA, 1989, 86, 6553-6556), холевая кислота (Manoharan et al., Bioorg. Med. Chem. Let., 1994, 4, 1053-1060), тиоэфир, например, гексил-S-тритилтиол (Manoharan et al., Ann. N.Y. Acad. Sci., 1992, 660, 306-309; Manoharan et al., Bioorg. Med. Chem. Let., 1993, 3, 2765-2770), тиохолестерин (Oberhauser et al., Nucl. Acids Res., 1992, 20, 533-538), алифатическую цепь, например, додекандиоловые или унцдециловые остатки (Saison-Behmoaras et al., EMBO J., 1991, 10, 1111-1118; Kabanov et al., FEBS Lett., 1990, 259, 327-330; Svinarchuk et al., Biochimie, 1993, 75, 49-54), фосфолипид, например, дигексадецил-рац-глицерин или 1,2-ди-O-гексадецил-рац-глицеро-3-H-фосфонат триэтиламмония (Manoharan et al., Tetrahedron Lett., 1995, 36, 3651-3654; Shea et al., Nucl. Acids Res., 1990, 18, 3777-3783), полиаминовую или полиэтиленгликолевую цепь (Manoharan et al., Nucleosides & Nucleotides, 1995, 14, 969-973) или адамантануксусную кислоту (Manoharan et al., Tetrahedron Lett., 1995, 36, 3651-3654), пальмитиловую группу (Mishra et al., Biochim. Biophys. Acta, 1995, 1264, 229-237) или октадециламиновую или гексиламинокарбонилоксихолестериновую группу. Олигонуклеотиды согласно изобретению также можно конъюгировать с активными лекарственными средствами, например, аспирином, варфарином, фенилбутазоном, ибупрофеном, супрофеном, фенбуфеном, кетопрофеном, (S)-(+)-пранопрофеном, карпрофеном, дансилсаркозином, 2,3,5-трийодобензойной кислотой, флуфенамовой кислотой, фолиновой кислотой, бензотиадиазидом, хлортиазидом, диазепином, индометацином, барбитуратом, цефалоспорином, сульфатным лекарственным средством, антидиабетическим средством, антибактериальным средством или антибиотиком. Конъюгаты олигонуклеотид-лекарственное средство и их получение описаны в патентных заявках США с серийным номером 09/334130 (поданная 15 июня 1999 года) и патентах США № 4828979; 4948882; 5218105; 5525465; 5541313; 5545730; 5552538; 5578717, 5580731; 5580731; 5591584; 5109124; 5118802; 5138045; 5414077; 5486603; 5512439; 5578718; 5608046; 4587044; 4605735; 4667025; 4762779; 4789737; 4824941; 4835263; 4876335; 4904582; 4958013; 5082830; 5112963; 5214136; 5082830; 5112963; 5214136; 5245022; 5254469; 5258506; 5262536; 5272250; 5292873; 5317098; 5371241, 5391723; 5416203, 5451463; 5510475; 5512667; 5514785; 5565552; 5567810; 5574142; 5585481: 5587371; 5595726; 5597696; 5599923; 5599928 и 5688941, каждый из которых включен в настоящий документ в качестве ссылки.
Не является необходимым для всех положений в данном соединении быть модифицированными одинаковым способом, и, фактически, в одном соединении и даже в одном нуклеозиде в олигонуклеотиде можно проводить более одной из указанных выше модификаций. Настоящее изобретение также относится к антисмысловым соединениям, которые представляют собой химерные соединения. В контексте данного изобретения "химерные антисмысловые соединения" или "химеры" представляют собой антисмысловые соединения, конкретно олигонуклеотиды, которые содержат две или более химически отличные области, каждая состоящая, по меньшей мере, из одной мономерной единицы, т.е. нуклеотида в случае олигонуклеотидного соединения. Эти олигонуклеотиды, как правило, содержат, по меньшей мере, одну область, где олигонуклеотид модифицирован так, чтобы придавать олигонуклеотиду увеличенную устойчивость к деградации нуклеазами, способность к усиленному захвату клетками и/или увеличенную аффинность связывания с нуклеиновой кислотой-мишенью. Дополнительная область олигонуклеотида может служить в качестве субстрата для ферментов, способных расщеплять гибриды РНК:ДНК или РНК:РНК. В качестве примера, РНКаза H представляет собой клеточную эндонуклеазу, которая расщепляет цепь РНК дуплекса РНК:ДНК. Таким образом, активация РНКазы приводит к расщеплению РНК-мишени, тем самым значительно увеличивая эффективность ингибирования олигонуклеотидом экспрессии гена. Таким образом, при использовании химерных олигонуклеотидов можно получать сопоставимые результаты по сравнению с фосфоротиоатными дезоксиолигонуклеотидами, гибридизующимися с той же областью-мишенью. Химерные антисмысловые соединения согласно изобретению можно составлять в виде комбинированных конструкций двух или более олигонуклеотидов, модифицированных олигонуклеотидов, олигонуклеозидов и/или миметиков олигонуклеотидов, как описано выше. Предпочтительные химерные антисмысловые олигонуклеотиды включают в себя, по меньшей мере, один модифицированный по 2' остаток сахара (предпочтительно 2'-O-(CH2)2-O-CH3) на 3'-конце для придания устойчивости к нуклеазам и область, по меньшей мере, с 4 последовательными остатками сахаров с 2'-H для придания активности РНКазы H. Такие соединения также обозначают в данной области как гибриды или гапмеры. Предпочтительные гапмеры несут области модифицированных по 2' остатков сахаров (предпочтительно 2'-O-(CH2)2-O-CH3) на 3'-конце и на 5'-конце, разделенные, по меньшей мере, одной областью, по меньшей мере, с 4 последовательными остатками сахаров с 2'-H, и предпочтительно включают в себя фосфоротиоатные связи в каркасе. Репрезентативные патенты Соединенных Штатов, в которых описано получение таких гибридных структур, включают в себя в качестве неограничивающих примеров, патенты США № 5013830; 5149797; 5220007; 5256775; 5366878; 5403711; 5491133; 5565350; 5623065; 5652355; 5652356 и 5700922, каждый из которых включен в настоящий документ в качестве ссылки в полном объеме.
Антисмысловые соединения, используемые в соответствии с данным изобретением, можно удобно и просто получать посредством хорошо известного способа твердофазного синтеза. Оборудование для такого синтеза продается несколькими поставщиками, включая, например, Applied Biosystems (Foster City, Calif.). Дополнительно или альтернативно можно применять любые другие способы для такого синтеза, известные в данной области. Хорошо известно применение подобных способов для получения олигонуклеотидов, таких как фосфоротиоатные и алкилированные производные. Соединения согласно изобретению также можно смешивать, инкапсулировать, конъюгировать или иным образом объединять с другими молекулами, молекулярными структурами или смесями соединений, например, таких, как липосомы, связываемые рецепторами молекулы, пероральные, ректальные, топические или другие составы, для содействия захвату, распределению и/или всасыванию. Репрезентативные патенты Соединенных Штатов, в которых описано получение таких способствующих захвату, распределению и/или всасыванию составов, включают в себя в качестве неограничивающих примеров, патенты США № 5108921; 5354844; 5416016; 5459127; 5521291; 5543158; 5547932; 5583020; 5591721; 4426330; 4534899; 5013556; 5108921; 5213804; 5227170; 5264221; 5356633; 5395619; 5416016; 5417978; 5462854; 5469854; 5512295; 5527528; 5534259; 5543152; 5556948; 5580575 и 5595756, каждый из которых включен в настоящий документ в качестве ссылки.
Другие примеры смысловых или антисмысловых олигонуклеотидов включают в себя такие олигонуклеотиды, которые ковалентно связаны с органическими группами, такими как органические группы, описанные в WO 90/10048, и другими группами, такими как поли-(L-лизин), которые увеличивают аффинность олигонуклеотида в отношении последовательности-мишени нуклеиновой кислоты. Кроме того, для модификации специфичности связывания антисмыслового или смыслового олигонуклеотида в отношении нуклеотидной последовательности-мишени к смысловым или антисмысловым олигонуклеотидам можно присоединять интеркалирующие средства, такие как эллиптицин и алкилирующие средства или комплексы с металлами.
Антисмысловые или смысловые олигонуклеотиды можно вводить в клетку, содержащую последовательность-мишень нуклеиновой кислоты, любым способом генного переноса, включая, например, опосредованную CaPO4 трансфекцию ДНК, электропорацию или с применением переносящих гены векторов, таких как вирус Эпштейна-Барр. В предпочтительном способе антисмысловой или смысловой олигонуклеотид вводят в подходящий ретровирусный вектор. Клетки, содержащие последовательность-мишень нуклеиновой кислоты, приводят в контакт с рекомбинантным ретровирусным вектором in vivo или ex vivo. Подходящие ретровирусные векторы включают в себя в качестве неограничивающих примеров ретровирусные векторы, полученные из мышиного ретровируса M-MuLV, N2 (ретровирус, полученный из M-MuLV), или двухкопийные векторы, обозначенные DCT5A, DCT5B и DCT5C (см. WO 90/13641).
Также смысловые или антисмысловые олигонуклеотиды можно вводить в клетку, содержащую нуклеотидную последовательность-мишень, посредством формирования конъюгата со связывающей лиганд молекулой, как описано в WO 91/04753. Подходящие связывающие лиганд молекулы включают в себя в качестве неограничивающих примеров рецепторы клеточной поверхности, факторы роста, другие цитокины или другие лиганды, которые связываются с рецепторами на клеточной поверхности. Предпочтительно, конъюгация связывающей лиганд молекулы существенным образом не препятствует способности связывающей лиганд молекулы связываться с соответствующей ей молекулой или рецептором или не блокирует проникновение смыслового или антисмыслового олигонуклеотида или его конъюгированной версии в клетку.
Альтернативно, смысловой или антисмысловой олигонуклеотид можно вводить в клетку, содержащую последовательность-мишень нуклеиновой кислоты, посредством формирования комплекса олигонуклеотид-липид, как описано в WO 90/10448. Комплекс смыслового или антисмыслового олигонуклеотида-липида предпочтительно диссоциирует внутри клетки под действием эндогенной липазы.
Длина молекул антисмысловых или смысловых РНК или ДНК, как правило, составляет, по меньшей мере, приблизительно 5 нуклеотидов, альтернативно, по меньшей мере, приблизительно 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 105, 110, 115, 120, 125, 130, 135, 140, 145, 150, 155, 160, 165, 170, 175, 180, 185, 190, 195, 200, 210, 220, 230, 240, 250, 260, 270, 280, 290, 300, 310, 320, 330, 340, 350, 360, 370, 380, 390, 400, 410, 420, 430, 440, 450, 460, 470, 480, 490, 500, 510, 520, 530, 540, 550, 560, 570, 580, 590, 600, 610, 620, 630, 640, 650, 660, 670, 680, 690, 700, 710, 720, 730, 740, 750, 760, 770, 780, 790, 800, 810, 820, 830, 840, 850, 860, 870, 880, 890, 900, 910, 920, 930, 940, 950, 960, 970, 980, 990 или 1000 нуклеотидов, где термин "приблизительно" в данном контексте означает длину референсной нуклеотидной последовательности плюс-минус 10% от указанной длины.
Зонды также можно применять в способах ПЦР для получения пула последовательностей для идентификации близкородственных кодирующих полипептид последовательностей.
Нуклеотидные последовательности, кодирующие полипептиды, также можно применять для конструирования гибридизационных зондов для картирования гена, кодирующего полипептид, и для генетического анализа индивидуумов с генетическими заболеваниями. Предоставленные в данном документе нуклеотидные последовательности можно картировать на хромосоме и конкретных областях хромосомы с применением известных способов, таких как гибридизация in situ, анализ сцепления по отношению к известным хромосомным маркерам и гибридизационный скрининг библиотек.
Полипептид можно использовать в анализах для идентификации других белков или молекул, вовлеченных во взаимодействие с полипептидом посредством связывания. Посредством таких способов можно идентифицировать ингибиторы взаимодействия с рецептором/лигандом посредством связывания. Для скрининга пептидных или низкомолекулярных ингибиторов взаимодействия посредством связывания также можно использовать белки, вовлеченные в такие взаимодействия посредством связывания. Можно разрабатывать скринирующие анализы для поиска лучших соединений, имитирующих биологическую активность природного полипептида или рецептора полипептида. Такие скринирующие анализы включают в себя анализы, пригодные для высокопроизводительного скрининга химических библиотек, что делает их особенно подходящими для идентификации низкомолекулярных кандидатов в лекарственное средство. Рассматриваемые низкомолекулярные соединения включают в себя синтетические органические или неорганические соединения. Анализы можно проводить во множестве форматов, включая анализы связывания белок-белок, анализы биохимического скрининга, иммунологические анализы и основанные на клетках анализы, которые хорошо охарактеризованы в данной области.
Кодирующие полипептиды нуклеиновые кислоты или их модифицированные формы также можно применять для получения трансгенных животных или животных с "нокаутом", которые в свою очередь пригодны для разработки и скрининга терапевтически пригодных реагентов. Трансгенное животное (например, мышь или крыса) представляет собой животное с клетками, которые содержат трансген, где трансген введен животному или предку животного на пренатальной, например, эмбриональной стадии. Трансген представляет собой ДНК, которая интегрирована в геном клетки, из которой развивается трансгенное животное. В одном из вариантов осуществления кодирующую полипептид кДНК можно применять для клонирования кодирующей полипептид геномной ДНК в соответствии с хорошо известными способами и геномных последовательностей, используемых для получения трансгенных животных, содержащих клетки, которые экспрессируют кодирующую полипептид ДНК. Способы получения трансгенных животных, конкретно, таких животных как мыши или крысы, стали обычными в данной области и описаны, например, в патентах США № 4736866 и 4870009. Как правило, в конкретные клетки трансген полипептида вводят с применением тканеспецифических энхансеров. Трансгенные животные, содержащие копию кодирующего трансген полипептида, введенную в зародышевую линию животного на эмбриональной стадии, можно использовать для проверки действия увеличенной экспрессии кодирующей полипептид ДНК. Таких животных можно использовать в качестве тестовых животных для реагентов, которые, как полагают, обеспечивают защиту, например, от патологических состояний, ассоциированных с ее сверхэкспрессией. В соответствии с этим аспектом изобретения животных обрабатывают реагентом и уменьшенная по сравнению с необработанными животными, несущими трансген, частота патологического состояния будет означать потенциальное терапевтическое воздействие на патологическое состояние.
Альтернативно, для конструирования животного с "нокаутом" гена, которое несет дефектный или измененный кодирующий полипептид ген как результат гомологичной рекомбинации между эндогенным кодирующим полипептид геном и введенной в эмбриональную стволовую клетку животного кодирующей полипептид измененной геномной ДНК, можно использовать не являющиеся человеческими гомологи полипептидов. Например, кодирующую полипептид кДНК можно использовать для клонирования кодирующей полипептид геномной ДНК в соответствии с известными способами. Часть кодирующей полипептид геномной ДНК можно удалить или заменить другим геном, таким как ген, кодирующий селективный маркер, который можно использовать для контроля интеграции. Как правило, в вектор включают несколько тысяч пар оснований неизмененной фланкирующей ДНК (и 5'-, и 3'-конца) [например, см. Thomas and Capecchi, Cell, 51:503 (1987) для описания векторов для гомологичной рекомбинации]. Вектор вводят в линию эмбриональных стволовых клеток (например, посредством электропорации) и отбирают клетки, в которые введенная ДНК гомологично рекомбинировала с эндогенной ДНК [например, см. Li et al., Cell, 69:915 (1992)]. Затем отобранные клетки инъецируют в бластоцисту животного (например, мыши или крысы) с формированием агрегационных химер [например, см. Bradley, in Teratocarcinomas and Embryonic Stem Cells: A Practical Approach, E. J. Robertson, ed. (IRL, Oxford, 1987), p. 113-152]. Затем химерный эмбрион можно имплантировать подходящей псевдобеременной самке животного-няньки и эмбрион выращивать до срока с получением животного с "нокаутом". Потомство, несущее в своих гаметах гомологично рекомбинированную ДНК, можно идентифицировать стандартными способами и использовать выведения животных, у которых все клетки животного содержат гомологично рекомбинированную ДНК. Животных с нокаутом можно охарактеризовать по их способности противостоять определенным патологическим состояниям и в отношении развития у них вследствие отсутствия полипептида патологических состояний.
Кодирующую полипептиды нуклеиновую кислоту также можно использовать в генной терапии. В применениях генной терапии гены вводят в клетку для достижения синтеза терапевтически эффективного генного продукта in vivo, например, для замены дефектного гена. "Генная терапия" включает в себя традиционную генную терапию, где длительного эффекта достигают посредством однократной обработки, и введение генотерапевтических средств, что включает в себя однократное или повторное введение терапевтически эффективных ДНК или мРНК. В качестве терапевтических средств для блокирования экспрессии определенных генов in vivo можно использовать антисмысловые РНК и ДНК. Уже показано, что короткие антисмысловые олигонуклеотиды можно вводить в клетку, где они действуют в качестве ингибиторов, несмотря на их низкие внутриклеточные концентрации, вызванные их ограниченным захватом клеточной мембраной (Zamecnik et al., Proc. Natl. Acad. Sci. USA 83:4143-4146 [1986]). Олигонуклеотиды для увеличения их захвата можно модифицировать, например, посредством замены их отрицательно заряженных фосфодиэфирных групп незаряженными группами.
Существует множество доступных способов для введения нуклеиновых кислот в живые клетки. Способы варьируют в зависимости от того, переносят ли нуклеиновую кислоту в культивируемые клетки in vitro или в клетки планируемого хозяина in vivo. Подходящие для переноса нуклеиновой кислоты в клетки млекопитающих in vitro способы включают в себя применение липосом, электропорации, микроинъекции, слияния клеток, DEAE-декстран, способ осаждения фосфатом кальция и т.д. Предпочитаемые в настоящее время способы переноса генов in vivo включают в себя трансфекцию вирусными (как правило, ретровирусными) векторами и опосредованную липосомами с вирусными белками оболочки трансфекцию (Dzau et al., Trends in Biotechnology 11, 205-210 [1993]). В некоторых ситуациях желательно снабдить источник нуклеиновой кислоты средством, направленным к клеткам-мишеням, таким как антитело, специфичное для мембранного белка клеточной поверхности или для клетки-мишени, лиганд для рецептора на клетке-мишени и т.д. Когда применяют липосомы для направления и/или для облегчения захвата можно использовать белки, которые связываются с мембранным белком клеточной поверхности, связанным с эндоцитозом, например белки капсида или их фрагменты, тропные к конкретному типу клеток, антитела к белкам, которые претерпевают интернализацию в цикле, белки, имеющие целью внутриклеточную локализацию и увеличивающие время полужизни внутри клетки. Способ опосредованного рецепторами эндоцитоза описан, например, в Wu et al., J. Biol. Chem. 262, 4429-4432 (1987) и Wagner et al., Proc. Natl. Acad. Sci. USA 87, 3410-3414 (1990). Для обзора протоколов маркирования генов и генной терапии см. Anderson et al., Science 256, 808-813 (1992).
Молекулы кодирующих полипептиды нуклеиновых кислот или их фрагментов, описанные в данном документе, пригодны для идентификации хромосом. В отношении этого существует постоянная необходимость идентификации новых хромосомных маркеров, так как в настоящее время доступно относительно немного маркирующих хромосомы реагентов на основе фактических данных о последовательностях. Каждую молекулу нуклеиновой кислоты согласно настоящему изобретению можно использовать в качестве хромосомного маркера.
Полипептиды и молекулы нуклеиновой кислоты согласно изобретению можно использовать с целью диагностики для тканевого типирования, где полипептиды могут быть иным образом экспрессированы в одной ткани по сравнению с другой, предпочтительно в больной ткани по сравнению с нормальной тканью того же тканевого типа. Молекулы нуклеиновой кислоты найдут применение для получения зондов для ПЦР, нозерн-блоттинга, анализа по Саузерну и анализа вестерн-блоттингом.
Данное изобретение относится к способам скрининга соединений для идентификации соединений, предотвращающих действие полипептида (антагонистов). Разработаны скринирующие анализы на антагонистические лекарственные средства-кандидаты для идентификации соединений, связывающихся или образующих комплекс с полипептидами, кодируемыми генами, определенными по данному документу, или иным образом препятствующих взаимодействию кодируемых полипептидов с другими клеточными белками, включая, например, ингибирование экспрессии полипептида клетками. Такие скринирующие анализы включают в себя анализы, пригодные для высокопроизводительного скрининга химических библиотек, что делает их особенно подходящими для идентификации низкомолекулярных лекарственных средств-кандидатов.
Анализы можно проводить во множестве форматов, включая анализы связывания белок-белок, анализы биохимического скрининга, иммунологические анализы и основанные на клетках анализы, которые хорошо охарактеризованы в данной области.
Все анализы на антагонисты являются общими в том, что в них применяют контакт лекарственного средства-кандидата с полипептидом, кодируемым идентифицированной по данному документу нуклеиновой кислотой в условиях и в течение времени, подходящих для того, чтобы позволить взаимодействовать этим двум компонентам.
В анализах связывания можно разделить или определить взаимодействие связывания и образование комплекса. В конкретном варианте осуществления полипептид или лекарственное средство-кандидат иммобилизуют на твердой фазе, например, на планшете для микротитрования посредством ковалентного или нековалентного присоединения. Нековалентное присоединение, как правило, проводят посредством покрытия твердой поверхности раствором полипептида и высушивания. Альтернативно для прикрепления полипептида к твердой поверхности можно использовать иммобилизованное антитело, например, моноклональное тело, специфичное к полипептиду для иммобилизации. Анализ проводят посредством связывания неиммобилизованного компонента, который может быть помечен детектируемой меткой с иммобилизованным компонентом, например, покрытая поверхность, содержащая прикрепленный компонент. После завершения реакции непрореагировавшие компоненты удаляют, например, посредством отмывки и детектируют прикрепленные к твердой поверхности комплексы. Когда исходно неиммобилизованный компонент несет детектируемую метку, детекция иммобилизованной метки на поверхности означает образование комплекса. Когда изначально неиммобилизованный компонент не несет метки, образование комплекса можно детектировать, например, посредством применения меченого антитела, специфически связывающегося с иммобилизованным комплексом.
Если соединение-кандидат взаимодействует, но не связывается, с полипептидом, его взаимодействие с этим полипептидом можно анализировать хорошо известными способами для детекции белок-белковых взаимодействий. Такие анализы включают в себя традиционные подходы, такие как, например, перекрестное связывание, коиммунопреципитация и совместная очистка на градиентах или хроматографических колонках. Кроме того, белок-белковые взаимодействия можно контролировать, применяя основанную на дрожжах генетическую систему, описанную Fields с соавторами (Fields and Song, Nature (London), 340:245-246 (1989); Chien et al., Proc. Natl. Acad. Sci. USA, 88:9578-9582 (1991)), как описано у Chevray and Nathans, Proc. Natl. Acad. Sci. USA, 89: 5789-5793 (1991). Многие активаторы транскрипции, такие как дрожжевой GAL4, состоят из двух физически раздельных узловых доменов, где один действует как ДНК-связывающий домен, а другой функционирует в качестве домена активации транскрипции. В дрожжевой экспрессионной системе, описанной в указанных выше публикациях (как правило, обозначаемой как "двухгибридная система"), пользуются преимуществом этого свойства и применяют два гибридных белка, один, в котором белок-мишень слит с ДНК-связывающим доменом GAL4, а другой, в котором активирующие белки-кандидаты слиты с активирующим доменом. Экспрессия репортерного гена GAL1-lacZ под контролем активированного GAL4 промотора зависит от восстановления активности GAL4 вследствие белок-белкового взаимодействия. Колонии, содержащие взаимодействующие полипептиды, детектируют с применением хромогенного субстрата для β-галактозидазы. Полный набор (MATCHMAKER™) для идентификации белок-белковых взаимодействий между двумя конкретными белками с применением двухгибридного способа коммерчески доступен из Clontech. Эту систему также можно расширить для картирования белковых доменов, вовлеченных в специфические белковые взаимодействия, а также для обнаружения аминокислотных остатков, которые принципиально важны для этих взаимодействий.
Соединения, препятствующие взаимодействию гена, кодирующего идентифицированный по данному документу полипептид, и других внутри- и внеклеточных компонентов, можно тестировать следующим образом: как правило, получают реакционную смесь, содержащую продукт гена и внутри- или внеклеточный компонент в условиях и в течение времени, обеспечивающих взаимодействие и связывание двух продуктов. Для тестирования способности соединения-кандидата ингибировать связывание реакцию проводят в отсутствии и в присутствие тестируемого соединения. Кроме того, в третью реакционную смесь можно добавлять плацебо, что служит положительным контролем. Связывание (формирование комплекса) между тестируемым соединением и внутри- или внеклеточным компонентом, присутствующем в смеси, контролируют, как описано выше в данном документе. Формирование комплекса в контрольной реакции(ях), но не в реакционной смеси, содержащей тестируемое соединение, означает, что тестируемое соединение препятствует взаимодействию тестируемого соединения и его партнера по реакции.
Для анализа на антагонисты полипептид можно добавлять к клетками вместе с соединением для скрининга на конкретный вид активности и способность соединения ингибировать представляющую интерес активность в присутствие полипептида означает, что соединение представляет собой антагонист полипептида. Альтернативно, антагонисты можно детектировать посредством комбинирования полипептида и потенциального антагониста с мембраносвязанными рецепторами или кодируемыми рецепторами полипептида в условиях, подходящих для анализа конкурентного ингибирования. Полипептид может быть меченым, например, радиоактивно, так, что количество молекул полипептида, связанных с рецептором, можно использовать для определения эффективности потенциального антагониста. Кодирующий рецептор ген можно идентифицировать множеством способов, известных специалистам в данной области, например, пэннинг лигандов и сортировка FACS. Coligan et al., Current Protocols in Immun., 1(2): Chapter 5 (1991). Предпочтительно, применяют клонирование по экспрессии, где полиаденилированную РНК получают из клеток, отвечающих на полипептид, и библиотеку кДНК, созданную из этой РНК, разделяют на группы и используют для трансфекции клеток COS или других клеток, не отвечающих на полипептид. Трансфицированные клетки, растущие на предметных стеклах, подвергают воздействию меченого полипептида. Полипептид можно метить множеством способов, включая иодирование или введение участка распознавания сайт-специфической протеинкиназы. После фиксации и инкубации стекла подвергают ауторадиографическому анализу. Идентифицируют положительные группы и получают подгруппы и снова трансфицируют с применением согласованного процесса разделения на подгруппы и повторного скрининга, что в конечном итоге приведет к получению одного клона, кодирующего предполагаемый рецептор.
В качестве альтернативного подхода для идентификации рецептора меченый полипептид можно фотоаффинно связывать с клеточной мембраной или препаратами экстрактов, экспрессирующими молекулу рецептора. Перекрестно-связанное вещество разделяют посредством PAGE и экспонируют на рентгеновскую пленку. Меченый комплекс, содержащий рецептор, можно вырезать, разделять на пептидные фрагменты и подвергать белковому микросеквенированию. Полученную после микросеквенирования аминокислотную последовательность можно применять для проектирования набора вырожденных олигонуклеотидных зондов для скрининга библиотеки кДНК для идентификации гена, кодирующего предполагаемый рецептор.
В другом анализе на антагонисты, клетки млекопитающих или мембранный препарат, экспрессирующие рецептор, можно инкубировать с меченым полипептидом в присутствие соединения-кандидата. Затем можно измерять способность соединения усиливать или блокировать это взаимодействие.
Более конкретные примеры потенциальных антагонистов включают в себя олигонуклеотид, который связывается с гибридами иммуноглобулина с полипептидом, и, конкретно, антитела, включая в качестве неограничивающих примеров, поли- и моноклональные антитела и фрагменты антител, одноцепочечные антитела, антиидиотипические антитела и химерные или гуманизированные версии таких антител или фрагментов, а также антитела и фрагменты антител человека. Альтернативно потенциальный антагонист может представлять собой близкородственный белок, например мутантную форму полипептида, который распознает рецептор, но не оказывает эффекта, тем самым конкурентно ингибируя действие полипептида.
Другой потенциальный антагонист представляет собой конструкцию антисмысловой РНК или ДНК, полученную с применением способа антисмысловых нуклеиновых кислот, когда, например, молекула антисмысловой РНК или ДНК действует, непосредственно блокируя трансляцию мРНК посредством гибридизации с мРНК-мишенью и предотвращая трансляцию белка. Способ антисмысловых нуклеиновых кислот можно применять для контроля экспрессии гена посредством формирования тройной спирали или посредством антисмысловой ДНК или РНК, где оба способа основаны на связывании полинуклеотида с ДНК или РНК. Например, кодирующую 5'-часть полинуклеотидной последовательности, которая кодирует зрелые полипептиды по данному документу, можно использовать для проектирования антисмыслового олигонуклеотида РНК длиной приблизительно от 10 до 40 пар оснований. Олигонуклеотид ДНК проектируют так, чтобы он был комплементарен области гена, участвующей в транскрипции (тройная спираль - см. Lee et al., Nucl. Acids Res., 6:3073 (1979); Cooney et al., Science, 241: 456 (1988); Dervan et al., Science, 251:1360 (1991)), тем самым предотвращая транскрипцию и продукцию полипептида. Антисмысловой олигонуклеотид РНК гибридизуется с мРНК in vivo и блокирует трансляцию молекулы мРНК в полипептид (антисмысловая нуклеиновая кислота - Okano, Neurochem., 56:560 (1991); Oligodeoxynucleotides as Antisense Inhibitors of Gene Expression (CRC Press: Boca Raton, FL, 1988). Описанные выше олигонуклеотиды также можно доставлять в клетки так, что in vivo может экспрессироваться антисмысловая РНК или ДНК, ингибируя образование полипептида. Когда используют антисмысловую ДНК, предпочтительны олигодезоксирибонуклеотиды, полученные из участка инициации трансляции, например, приблизительно между положениями -10 и +10 на нуклеотидной последовательности гена-мишени.
Потенциальные антагонисты включают в себя низкомолекулярные соединения, которые связываются с активным центром, участком связывания рецептора или фактором роста или другим значимым участком связывания полипептида, тем самым блокируя нормальную биологическую активность полипептида. Примеры низкомолекулярных соединений включают в себя в качестве неограничивающих примеров небольшие пептиды или подобные пептидам молекулы, предпочтительно растворимые пептиды и синтетические непептидные органические или неорганические соединения.
Рибозимы представляют собой ферментативные молекулы РНК, способные катализировать специфическое расщепление РНК. Рибозимы действуют на основании сиквенс-специфической гибридизации с комплементарной РНК-мишенью, с последующим эндонуклеолитическим расщеплением. Конкретные участки расщепления рибозимов в потенциальной РНК-мишени можно идентифицировать известными способами. Более подробно см., например, Rossi, Current Biology, 4:469-471 (1994) и публикацию PCT № WO 97/33551 (опубликованную 18 сентября 1997 года).
Молекулы нуклеиновой кислоты при формировании тройной спирали, применяемые для ингибирования транскрипции, должны быть одноцепочечными и состоять из дезоксинуклеотидов. Состав оснований этих олигонуклеотидов проектируют так, чтобы он обеспечивал формирование тройной спирали по правилам спаривания оснований Хугстина, которые, как правило, требуют достаточно больших участков пуринов или пиримидинов на одной из цепей дуплекса. Более подробно см., например, публикацию PCT № WO 97/33551, выше.
Эти низкомолекулярные соединения можно идентифицировать одним или несколькими из скринирующих анализов, обсуждаемых в данном документе выше, и/или любыми другими способами скрининга, хорошо известными специалистам в данной области.
Выделенную кодирующую полипептид нуклеиновую кислоту можно использовать для рекомбинантного получения полипептида с применением хорошо известных в данной области способов и как описано в данном документе. В свою очередь полученные полипептиды можно применять для получения антител с применением хорошо известных в данной области способов и как описано в данном документе.
Антитела, специфически связывающие полипептид, идентифицированный согласно настоящему документу, а также другие молекулы, идентифицированные посредством скринирующих анализов, описанных в данном документе выше, можно в качестве фармацевтических композиций вводить для лечения различных нарушений, включающих в себя злокачественную опухоль
Если полипептид является внутриклеточным и в качестве ингибиторов используют целые антитела, предпочтительна интернализация антител. Однако для доставки антитела или фрагмента антитела в клетки также можно использовать липофекцию или липосомы. Когда используют фрагменты антител, предпочтителен наименьший ингибирующий фрагмент, который специфически связывается со связывающимся доменом белка-мишени. Например, на основе последовательностей вариабельных областей антитела можно сконструировать пептидные молекулы, которые сохранят способность связываться с последовательностью белка-мишени. Такие пептиды можно синтезировать химически и/или получать посредством технологии рекомбинантных ДНК. См., например, Marasco et al., Proc. Natl. Acad. Sci. USA, 90: 7889-7893 (1993).
Состав по настоящему документу также может содержать более одного активного соединения в соответствии с необходимостью для конкретного показания, подвергаемого лечению, предпочтительно такие составы с дополнительным действием, которые не влияют друг на друга неблагоприятным образом. Альтернативно или дополнительно состав может содержать средство, усиливающее его функцию, такое как цитотоксическое средство, цитокин, химиотерапевтическое средство или ингибирующее рост средство. Соответственно, такие молекулы присутствуют в сочетании в количествах, которые эффективны для намеченной цели.
Следующие ниже примеры предложены только в целях иллюстрации и не предназначены для ограничения объема настоящего изобретения каким либо образом.
ПРИМЕРЫ
Реагенты
Хромогенное вещество S2366 получали из DiaPharma Group, Inc. (West Chester, OH), Lys-плазминоген из Haematologic Technologies Inc. (Essex Junction, VT), а активатор тканевого плазминогена (t-PA) из Genentech, Inc. (South San Francisco, CA). Про-HGF, экспрессированный в клетках яичников китайского хомяка (CHO) в отсутствие сыворотки и очищенный посредством хроматографии на HiTrap Sepharose SP, предоставлен David Kahn (Genentech). HGFA, содержащий остатки Val373-Arg407 экспрессировали в бакуловирусной экспрессирующей системе и очищали как описано (34). Очищенный человеческий рекомбинантный FVII, экспрессированный в человеческих клетках 293, был получен в дар от Mark O'Connell (Genentech) и описан ранее (42). Для получения везикул PCPS использовали диолеоил-1,2-диацил-sn-глицеро-3-(фосфо-L-серин) (PS) и олеоил-1,2-диацил-sn-глицеро-3-фосфохолин (PC) (Avanti Polar Lipids Inc., Alabaster, AL) (молярное соотношение 7:3), по существу, как описано (43). Маркеры молекулярной массы представляли собой стандарты SeeBlue Plus2 и MultiMark (Invitrogen, Carlsbad, CA).
Экспрессия и очистка гепсина
кДНК полноразмерного гепсина, полученную из ассоциации I.M.A.G.E. (ATCC, Manassas, VA), расщепляли рестрикционными эндонуклеазами EcoRI и Not I (New England Biolabs Inc. Beverly, MA) и вставляли в эукариотический экспрессирующий вектор pRK5E. Секретируемый меченую His кДНК гепсина конструировали посредством слияния кДНК, кодирующей сигнальную последовательность человеческого HGF (аминокислоты Met1-Gly31) с кДНК, кодирующей внеклеточный домен человеческого гепсина (Arg45-Leu417: система нумерации в соответствии с Somoza et al., 2003 (5)). Кроме того, к C-концу после Leu417 добавляли метку His8 и конечную конструкцию кДНК вставляли в эукариотический экспрессирующий вектор pCMV.PD5. Гепсин экспрессировали в системе транзиторной экспрессии в клетках яичника китайского хомяка (CHO) и очищали посредством аффинной хроматографии с никель-нитрилотриуксусной кислотой (Ni-NTA), по существу, как описано для получения sHAI-1B дикого типа (34).
Экспрессия и очистка sHAI-1B, мутантных sHAI-1B и sHAI-2
Растворимую форму HAI-1B (sHAI-1B), содержащую целый внеклеточный домен, получали в системе транзиторной экспрессии в клетках CHO и очищали, как описано ранее (34). С применением сайт-специфического мутагенеза, остатки P1 KD1 (Arg260) и KD2 (Lys401) по отдельности заменяли на Ala и полученные белки, sHAI-1B(R260A) и sHAI-1B(K401A), экспрессировали и очищали, как описано (34).
Полноразмерный HAI-2 получали из библиотеки кДНК, полученной из РНК эмбрионального легкого человека (BD Biosciences Clontech, Palto Alto, CA) с применением участка олиго-dT/Not I в качестве праймера и адаптора с участком для Sal I в качестве второй цепи. кДНК расщепляли с применением Sal I и Not I; кДНК, более чем 2,8 т.п.н. лигировали в pRK5D. Одноцепочечную ДНК библиотеки кДНК легкого человека/pRK5D получали с применением стандартных способов молекулярной биологии. Обратный праймер (5'-TTTCTTGAGGCACTCCTCCTTG-3') отжигали с пулом одноцепочечных кДНК и наращивали с применением ДНК-полимеразы T7 или T4. Синтезированными двухцепочечными ДНК трансформировали E.coli и колонии подвергали скринингу с применением стандартных способов гибридизации на фильтрах. Размер вставок анализировали посредством ПЦР и расщепления рестрикционной эндонуклеазой, XbaI. Идентифицировали полноразмерные клоны HAI-2 и подтверждали посредством секвенирования ДНК. Растворимую форму HAI-2 (sHAI-2) получали посредством конструирования кДНК, кодирующей внеклеточный домен (Ala28-Lys197; система нумерации в соответствии с Kawaguchi et al., 1997 (39)) HAI-2 и дополнительную C-концевую метку His8 со спейсером в виде Gly. Затем полученную кДНК вставляли в бакуловирусный экспрессирующий вектор, полученный из pVL1393 (BD Biosciences Pharmingen, San Diego, CA). sHAI-2 экспрессировали в бакуловирусной экспрессирующей системе и очищали аффинной хроматографией с Ni-NTA, по существу как описано для получения β-цепи HGF (44). Концентрации белков определяли посредством анализов количественного определения аминокислот.
Анализы активации FVII и плазминогена
FVII в концентрации 0,11 мг/мл активировали посредством 230 нМ гепсина в 30 мМ Tris-HCl, pH 8,4, 30 мМ имидазоле, 200 мМ NaCl (буфер Tris) в присутствие 0,5 мМ везикул PCPS и 5 мМ CaCl2 при 37°C. Аликвоты реакционной смеси, взятые в различные моменты времени, анализировали посредством SDS-PAGE (восстановительные условия) с применением 4-20% градиентного геля (Invitrogen, Carlsbad, CA). Гели окрашивали красителем Simply Blue Safe Stain (Invitrogen).
Плазминоген в концентрации 0,12 мг/мл инкубировали с 40 нМ гепсина или 40 нМ t-PA (положительный контроль) в 20 мМ Hepes pH 7,5, 150 мМ NaCl (буфер Hepes) при 37°C. Аликвоты реакционной смеси, взятые в различные моменты времени, анализировали посредством SDS-PAGE, как описано для анализов активации FVII.
Активация про-HGF гепсином и HGFA
Про-HGF (0,3 мг/мл) инкубировали в буфере Hepes с 40 нМ гепсина или с 40 нМ HGFA в течение 4 ч при 37°C и хранили при -20°C до дальнейшего использования. Анализы расщепленного вещества, HGFгепсин и HGFHGFA, посредством SDS-PAGE показали, что >95% про-HGF преобразуется в двухцепочечный HGF.
Анализы активации про-HGF и мечение про-HGF 125I проводили, как описано (34, 45). В кратком изложении, меченый 125I про-HGF в концентрации 0,05 мг/мл в буфере Hepes инкубировали с увеличивающимися концентрациями (0,16-40 нМ) гепсина или HGFA при 37°C. Через 4 ч отбирали аликвоты и анализировали посредством SDS-PAGE (4-20% градиентный гель) (Invitrogen Corp., Carlsbad, CA). Для исследований ингибирования гепсин (15 нМ) инкубировали в буфере Hepes с 1 мкМ sHAI-1B, sHAI-1B(K401A), sHAI-1B(R260A) или sHAI-2 при 37°C. Через 4 ч образцы анализировали посредством SDS-PAGE и окрашивали красителем Simply Blue Safe Stain (Invitrogen).
Анализы ингибирования ферментов
Условия анализа были сходными с условиями, описанными у Somoza et al. 2003 (5), с применением хромогенного субстрата S2366 (L-пироглутамил-L-пролил-L-аргинин-п-нитроанилингидрохлорид). Гепсин (конечная концентрация 0,4 нМ) инкубировали с увеличивающимися концентрациями ингибиторов в буфере Tris в течение 30 мин при комнатной температуре. Добавляли субстрат S2366 и измеряли изменение оптической плотности при 405 нм с применением кинетического сканера микропланшетов (Molecular Devices, Sunnyvale CA). Концентрации гепсина и S2366 в данной конечной реакционной смеси составляли 0,4 нМ и 0,2 мМ (определенная Km = 0,2 мМ), соответственно. Ингибирующую активность выражали в виде относительной активности (vi/v0) от активности неингибированного фермента. Концентрации ингибитора, приводящие к 50% ингибированию (IC50), рассчитывали посредством внесения данных в программу аппроксимации кривой регрессии с четырьмя параметрами (Kaleidagraph, Synergy Software, Reading, PA). Для каждого ингибитора проводили, по меньшей мере, три независимых эксперимента.
Анализы клеточной пролиферации и миграции
Анализы пролиферации проводили на клеточной линии аденокарциномы поджелудочной железы человека BxPC3, полученной из European Collection of Cell Cultures (CAMR, Centre for Applied Microbiology and Research, Salisbury, Wiltshire, UK). Клетки выращивали в среде RPMI содержащей 10% ЭБС (Sigma, St. Louis, MO), 10 мМ hepes, 2 мМ глутамин, пенициллин-стрептомицин (Invitrogen, Carlsbad, CA) и 250 мкг/мл G418 (Invitrogen). Конфлуэнтные клеточные слои промывали PBS с последующими 10 мМ EDTA/PBS и после инкубации открепляли трипсином. Клетки ресуспендировали в среде для роста и высевали (10000-15000 клеток/лунку) в 96-луночные белодонные планшеты MT (Cultur Plate™, Packard/PerkinElmer, Boston, MA). Через 24 ч среду для роста заменяли на RPMI-0,1% БСА. Через дополнительные 24 ч среду удаляли и добавляли различные концентрации HGFгепсин и HGFHGFA в RPMI-0,1% БСА и клеткам позволяли расти в течение 72 ч. Затем проводили количественный анализ клеточной пролиферации посредством применения набора CellTiter-Glo Luminescent Kit (Promega, Madison, WI) по инструкциям производителя. Люминесценцию измеряли на люминометре для микропланшетов Tropix TR717 (Berthold 75323, Bad Wildbad, Germany). После вычитания фоновых значений (пролиферация в отсутствие HGF) активность HGFгепсин и HGFHGFA выражали в виде процента от пролиферации BxPC3 при 100 нг/мл контрольного препарата HGF (полученного от Dr. Ralph Schwall, Genentech).
Анализы клеточной миграции на клеточной линии рака молочной железы MDA-MB435 (HTB-129, ATCC, Manassas, VA) проводили, как описано (44). В кратком изложении, 0,2 мл клеточной суспензии в среде без сыворотки (0,6-0,8 × 106 клеток/мл) добавляли в верхние камеры 24-луночных планшетов transwell (размер пор 8 мкм) (HTS Multiwell™ Insert System, Falcon, Franklin Lakes, NJ) предварительно покрытых 10 мкг/мл коллагена типа I из хвоста крыс (Upstate, Lake Placid, NY). В нижнюю камеру добавляли препараты HGF в среде без сыворотки. После инкубации в течение 13-14 ч клетки на апикальной стороне мембраны удаляли, а клетки, мигрировавшие к базальной стороне, фиксировали в 4% параформальдегиде с последующим окрашиванием 0,5% раствором кристаллического фиолетового. Клетки растворяли в 10% уксусной кислоте и измеряли A560 на планшетном сканере Molecular Devices. Промиграционную активность мутантов HGF выражали в виде процента от контрольного препарата HGF после вычитания базальной миграции в отсутствие HGF.
Анализ фосфорилирования рецептора Met
Анализ активации киназного рецептора (KIRA) проводили, как описано (44). В кратком изложении, клетки легочной карциномы A549 (CCL-185, ATCC, Manassas, VA) высевали в 96-луночные планшеты при плотности 50000 клеток на лунку. После инкубации в течение ночи при 37°C среду для роста удаляли и клетки содержали при недостатке сыворотки в течение от 30 до 60 мин в среде, содержащей 0,1% ЭБС. Добавляли увеличивающиеся концентрации HGFгепсин и HGFHGFA в среде, содержащей 0,1% ЭБС. В качестве контроля использовали нерасщепленную одноцепочечную форму HGF (scHGF), в которой участок расщепления мутирован (Arg494Glu) (44). После 10 мин инкубации при 37°C среду удаляли и клетки лизировали в лизирующем буфере (Cell Signaling Technologies, Beverly, MA), дополненном смесью ингибиторов протеаз. К клеточным лизатам добавляли меченое BV-TAG антитело 4G10 антитело и биотинилированное антитело к Met. После инкубации в течение от 1,5 до 2 ч добавляли магнитные бусы со стрептавидином (Dynabeads, Bio Veris) и инкубировали в течение 45 мин. Бусы со связавшимся веществом (антитело к Met/Met/антитело к фосфотирозину) улавливали внешним магнитом. После стадии отмывки полученный от источника света хемилюминесцентный сигнал измеряли в виде относительных люминесцентных единиц на устройстве Bio Veris. Для каждого эксперимента фосфорилирование Met HGFгепсин, HGFHGFA или scHGF выражали в виде процента от максимального сигнала, полученного с контрольным препаратом HGF.
Результаты
Протеолитическое процессирование про-HGF гепсином
Растворимую форму гепсина, содержащую целый внеклеточный домен (Arg45-Leu417; система нумерации в соответствии с Somoza et al., 2003 (5)) и C-концевую метку His8 экспрессировали в клетках CHO. В течение процесса очистки профермент гепсина спонтанно преобразовывался в его двухцепочечную форму (фиг. 1A), наиболее вероятно вследствие аутоактивации (4). N-концевое секвенирование протеазного домена массой ≈ 30 кДа (163IVGGRDTSLGR173) подтвердило расщепление по ожидаемой пептидной связи Arg162-Ile163, с образованием активного фермента. Гепсин активно конвертировал профермент FVII в двухцепочечный FVIIa (фиг.1B), согласуясь с экспериментами, опубликованными Kazama et al., 1995 (9) с применением экспрессируемого на клеточной поверхности гепсина для определения активации FVII. Активность гепсина в отношении про-HGF проверяли посредством измерения преобразования меченого 125I про-HGF в двухцепочечный HGF. Результаты показали, что про-HGF расщеплялся гепсином, зависимым от концентрации образом (фиг.2A). Активность гепсина была сравнима с активностью HGFA (фиг.2B), где оба фермента достигали полного преобразования про-HGF при концентрации 4-13 нМ. В той же системе анализ активаторы про-HGF фактор XIa, фактор XIIa и плазматический калликреин требовали для полного преобразования про-HGF приблизительно в 5-6 раз больших концентраций (45). N-концевое секвенирование β-цепей HGF массой ≈ 36 кДа и ~39 кДа давало идентичные последовательности (495VVNGIPTRTNIG506), демонстрируя, что гепсин преобразовывал про-HGF по ожидаемой пептидной связи Arg494-Val495. В отличие от фактора XIa и плазматического калликреина гепсин не образовывал фрагмента α2-цепи HGF (посредством расщепления между Arg424-His425) (45), даже после длительных периодов реакции. Кроме того, у гепсина (40 нМ) полностью отсутствует способность активировать плазминоген в течение 5 ч реакции (фиг. 2C). В сравнение с этим эффективный процессинг плазминогена под действием t-PA, содержащего 50% профермента, расщепляется уже через 0,5 ч (фиг. 2C).
Биологическая активность полученного при расщеплении HGF гепсином
Немеченый про-HGF (0,3 мг/мл) полностью конвертировался (>95%) в HGF 40 нМ гепсина или 40 нМ HGFA (фиг.3A) с образованием HGFгепсин и HGFHGFA, соответственно. В анализе активации киназного рецептора (KIRA) на клетках A549 легочной карциномы, оба препарата HGF индуцировали сходное зависимое от концентрации увеличение фосфорилирования Met, достигая максимальной активности при 250 нг/мл (фиг.3B). Как показано ранее (44), нерасщепляемая одноцепочечная форма HGF (scHGF) с измененным участком расщепления (R494E) не проявляет активности (фиг.3B). Контрольные эксперименты показали, что гепсин или HGFA отдельно не оказывают действия (данные не показаны). Кроме того, HGFгепсин эффективно стимулирует пролиферацию клеток рака поджелудочной железы BxPC3. Активность была сравнима с активностью HGFHGFA в исследуемом диапазоне 5-100 нг/мл (фиг.4A). Сходные результаты были получены в анализе клеточной миграции на клетках MDA-MB435 с применением покрытой коллагеном системы миграции transwell. Как выявлено в анализах клеточной пролиферации, промиграционные эффекты HGFгепсин были зависимыми от концентрации и неотличимыми от активности HGFHGFA (фиг.4B).
Ингибирование ферментативной активности гепсина посредством sHAI-1B и sHAI-2
Начальный скрининг 26 коммерчески доступных хромогенных веществ показал, что гепсин с наивысшей скоростью (данные не показаны) гидролизует S2366, субстрат, сообщенный Somoza et al., 2003 (5). С применением S2366 в качестве субстрата измеряли ингибирующую активность высокоочищенных, растворимых форм HAI-1B (sHAI-1B) и HAI-2 (sHAI-2) дикого типа. Кроме того, авторы получали два мутанта sHAI-1B: sHAI-1B(R260A) и sHAI-1B (K401A), в которых отдельные домены Кунитца были инактивированы заменой остатков P1 (Arg260 в KD1 и Lys401 в KD2) аланином (34). Результаты показали, что и sHAI-1B, и sHAI-2 эффективно ингибируют ферментативную активность гепсина со значениями IC50 в размере 21,1 ± 2,7 нМ и 1,3 ± 0,3 нМ, соответственно (фиг.5). Кроме того, мутантный sHAI-1B(K401A), содержащий нефункциональный KD2, был также эффективен, как и sHAI-1B дикого типа, тогда как sHAI-1B(R260A) обладал >47 раз уменьшенной активностью (фиг.5). Полученные значения IC50 обобщены в таблице 1.
Ингибирование гепсина ингибиторами домена Кунитца
Ингибирование опосредованной гепсином активации про-HGF
Способность sHAI-1B и sHAI-2 препятствовать процессированию макромолекулярного субстрата измеряли в анализе активации 125I-про-HGF. Полученные результаты находились в полном соответствии с их ожидаемыми ингибирующими активностями, определенными в амидолитических анализах. При концентрациях sHAI-2, sHAI-1B дикого типа и sHAI-1B(K401A) в размере 1 мкМ, происходило полное ингибирование расщепления про-HGF (фиг.6). В отличие от этого 1 мкМ sHAI-1B(R260A) продемонстрировал отсутствие ингибирования и активация про-HGF продолжалась до полного преобразования (фиг.6).
Обсуждение
Путь передачи сигнала HGF/Met играет важную роль в человеческой физиологии и патологии, включая инвазию и метастазирование опухоли. Локальная доступность активного HGF контролируется подобными химотрипсину сериновыми протеазами и родственными им ингибиторами, которые регулируют преобразование неактивного про-HGF во внеклеточной среде. Таким образом, нарушения этого "верхнего" пути конвертазы про-HGF при злокачественной опухоли может стимулировать рост опухоли посредством ускорения процессирования про-HGF. В данном документе авторы демонстрируют, что гепсин, сериновая протеаза, сильно активированная при раке предстательной железы и яичников, является эффективным активатором про-HGF.
Таким образом, вероятно, что гепсин играет важную роль в осуществлении опухолевого роста посредством активации пути передачи сигнала HGF/Met, который участвует в раке предстательной железы (46-48), а также раке яичников (49, 50).
Гепсин протеолитически расщеплял про-HGF по пептидной связи Arg494-Val495 без какого-либо дополнительного расщепления по Arg424-His425 в домене Крингла 4, участке, распознаваемом фактором XIa и плазматическим калликреином (45). Образуемый гепсином двухцепочечный HGF являлся полностью функциональным, включая фосфорилирование рецептора Met и стимуляцию клеточной пролиферации и миграции с активностью, сравнимой с HGF, образуемым HGFA. Молекулярный механизм, лежащий в основе опосредованного гепсином преобразования неактивного про-HGF в активный фактор роста, сходен с протеолитическим преобразованием профермента в фермент сходных с химотрипсином сериновых протеаз. Это подтверждается недавними исследованиями на структурных последствиях активации про-HGF, продемонстрировавших, что расщепление по Arg494-Val495 приводит к конформационным изменениям в подобной протеазе β-цепи HGF и полному созреванию участка связывания рецептора Met (44, 51). Этот участок связывания Met, который находится в "области активного центра" и "активационном домене" HGF, обладает значительным сходством с областью процессирования субстрата сериновых протеаз (44, 51). Таким образом, расщепление про-HGF гепсином приводит к структурным перестройкам в β-цепи HGF, что позволяет сформироваться действующим комплексам передачи сигнала HGF/Met. Протеолитическая активность гепсина в отношении про-HGF оказывается высокоспецифичной, так как он не расщепляет плазминоген, ближайший структурный гомолог про-HGF. Гепсин не обладает протеолитической активностью в отношении других субстратов сериновых протеаз, таких как протромбин, белок C, фактор X и фактор IX (9).
Исследования на мышах с нуль-мутацией HGF демонстрируют, что путь HGF/Met важен для нормального эмбрионального развития и жизнеспособности (52, 53). В отличие от этого, мыши с дефицитом гена гепсина развиваются нормально, что указывает на то, что маловероятно, что гепсин является основным активатором HGF в течение эмбриогенеза. Сходно с гепсином, недостатки других известных конвертаз про-HGF, матриптазы (54), фактора XI (55), прекалликреина (56) и u-PA (57) не являются летальными для эмбрионов. Вследствие его важности в эмбриогенезе и постнатальной физиологии активность HGF может регулироваться согласованным способом несколькими системами конвертаз про-HGF. Если так, то сочетанный дефицит генов конвертаз про-HGF должен приводить к дефектам развития, сходным с мышами с нуль-мутацией HGF. Альтернативно, конвертазу про-HGF, регулирующую процессинг HGF в течение эмбриогенеза, может быть еще не идентифицировали.
HAI-1B, HAI-1 и HAI-2 являются ингибиторами на поверхности эпителиальных клеток и экспрессируются во многих нормальных тканях и опухолях (34, 58-63). По существу они идеально расположены для регуляции ферментативной активности экспрессируемых эпителиальными клетками TTSP и, возможно, других ассоциированных с клеточной поверхностью сериновых протеаз. Действительно, варианты сплайсинга HAI-1, HAI-1 и HAI-1B эффективно ингибируют матриптазу TTSP (MT-SP1), а комплексы HAI-1 с матриптазой найдены в человеческом грудном молоке (38). В данном документе, авторы показали, что sHAI-1B и sHAI-2 также являются эффективными ингибиторами ферментативной активности гепсина. Кроме того, эксперименты по специфическому для остатка P1 мутагенезу показали, что ингибирование гепсина полностью опосредовано KD1 sHAI-B, так как мутантный sHAI-1B (R260A) являлся неактивным в анализах про-HGF и обладал < 1 % активности дикого типа и мутанта KD2 в амидолитическом анализе. Таким образом, гепсин, матриптаза и HGFA не только обладают сравнимыми активностями в отношении конверсии про-HGF (34), но также ингибируются посредством sHAI-1B с одинаковой эффективностью (16-30 нМ) специфичным в отношении KD1 образом (34, 64). Варианты сплайсинга HAI-1 и HAI-1B отличаются только по отсутствию или наличию 16 аминокислот, расположенных на C-конце KD1. Профиль их экспрессии в тканях, включая злокачественные опухоли предстательной железы и яичников, идентичны и до настоящего времени не выявлено значимых различий в эффективности и профили протеазы-мишени. Таким образом, авторы считают, что функции двух вариантов сплайсинга in vivo эквивалентны. Роль доменов Кунитца HAI-2 в исследовании авторов изобретения конкретно не исследовалась. Для большинства ее ферментов-мишеней HAI-2 использует и N-, и C-концевой домены Кунитца (41, 65).
Функциональная связь гепсина с HAI-1B и HAI-2 in vitro, совместно с их локализацией на поверхностях эпителиальных клеток in vivo, позволяет предположить, что они составляют физиологически значимую систему фермент-ингибитор. Например, два варианта сплайсинга HAI-1 и HAI-2 экспрессируются в линиях нормальных клеток предстательной железы и клеток рака предстательной железы (34, 59, 61), а антиген HAI-1 локализуется на слое секреторных клеток железистого эпителия предстательной железы (59). Интригует, что экспрессия гепсина в опухолях предстательной железы локализуется в том же эпителиальном компартменте (19, 20), поддерживая идею о том, что HAI-1 и, возможно, HAI-2 ассоциированы с гепсином in vivo. Хотя экспрессия гепсина сильно повышена при раке предстательной железы (17-22), HAI-1 и HAI-2 увеличиваются только немного (приблизительно в 1,5 раза) в соответствии с результатами по генной экспрессии, опубликованными Welsh et al., 2001 (17). Как следствие, ферментативная активность гепсина в опухолях может контролироваться неадекватно и может приводить к увеличенному процессингу про-HGF и прогрессированию опухоли. Сходный дисбаланс систем конвертаз/ингибиторов про-HGF описан для матриптазы/HAI-1 при раке яичников (62, 63), HGFA/HAI-1 при колоректальном раке (66, 67) и HGFA/HAI-1 при почечно-клеточной карциноме (68). Повышенная экспрессия гепсина в некоторых из этих злокачественных опухолей позволяет предположить, что определенные системы конвертаз/ингибиторов включают в себя несколько ферментов и, следовательно, увеличенные соотношения фермента/ингибитора могут увеличивать значение для озлокачествления.
В заключение, представленные результаты демонстрируют, что гепсин эффективно активирует про-HGF, таким образом раскрывая функциональную связь между гепсином на эпителиальной поверхности опухоли и внеклеточным матриксом, содержащим неактивный предшественник фактора роста. Открытие того, что HAI-1B и HAI-2 являются эффективными ингибиторами гепсина, который активирован при раке предстательной железы и яичников, предоставляет новые подходы для лечения злокачественных опухолей. Например, функциональные домены Кунитца HAI-1B или HAI-2 могут служить в качестве каркасов для получения более специфических и/или более эффективных ингибиторов ферментов при использовании технологии фагового дисплея, которую успешно применяли для других каркасов на основе домена Кунитца (69, 70).
Сноски/Сокращения
1Фактор VIIa, FVIIa; буфер Hepes, 20 мМ Hepes pH 7,5, 150 мМ NaCl; буфер Tris, 30 мМ Tris-HCl, pH 8,4, 30 мМ имидазол, 200 мМ NaCl; про-HGF, одноцепочечный фактор роста гепатоцитов, HGF, двухцепочечный фактор роста гепатоцитов; HGFA активатор фактора роста гепатоцитов; HAI-1, ингибитор активатора фактора роста гепатоцитов-1; HAI-1B, вариант сплайсинга ингибитора активатора фактора роста гепатоцитов-1; HAI-2, ингибитор активатора фактора роста гепатоцитов-2; KD1 и KD2, N- и C-концевые домены Кунитца HAI-1B; sHAI-1B, растворимая форма HAI-1B, включающая в себя внеклеточный домен; sHAI-2, растворимая форма HAI-2, включающая в себя внеклеточный домен; HGFгепсин, HGF, образуемый при активации про-HGF гепсином; HGFHGFA, HGF, образуемый при активации про-HGF HGFA; scHGF, нерасщепляющийся одноцепочечный HGF с мутантным участком расщепления (Arg494Glu); u-PA, активатор плазминогена урокиназного типа; t-PA, тканевой активатор плазминогена. Ni-NTA, никель-нитрилотриуксусная кислота.
Частичный список ссылок
1. Szabo, R., Wu, Q., Dickson, R. В., Netzel-Arnett, S., Antalis, T. M., and Bugge, T. H. (2003) Thromb. Haemost. 90, 185-193.
2. Tsuji, A., Torres-Rosado, A., Arai, Т., Le Beau, M. M., Lemons, R. S., Chou, S.-H., and Kurachi, K. (1991) J Biol Chem 266, 16948-16953.
3. Leytus, S. P., Loeb, K. R., Hagen, F. S., Kurachi, K., and Davie, E. W. (1988) Biochemistry 27, 1067-1074.
4. Vu, T.-K. H, Liu, R. W., Haaksma, C. J., Tomasek, J. J., and Howard, E. W. (1997) J Biol Chem 272, 31315-31320.
5. Somoza, J. R., Ho, J. D., Luong, C., Ghate, M., Sprengeler, P. A., Mortara, K., Shrader, W. D., Sperandio, D., Chan, H., McGrath, M, E., and Katz, B. A. (2003) Structure 11, 1123-1131.
6. McCallum, C. D., Hapak, R. C., Neuenschwander, P. F., Morrissey, J. H., and Johnson, A. E. (1996) J. Biol. Chem. 271, 28168-28175.
7. Mutucumarana, V. P., Duffy, E. J., Lollar, P., and Johnson, A. E. (1992) J. Biol. Chem. 267, 17012-17021.
8. Husten, E. J., Esmon, С. Т., and Johnson, A. E. (1987) J. Biol. Chem. 262, 12953-12961.
9. Kazama, Y., Hamamoto, Т., Foster, D. C, and Kisiel, W. (1995) J. Biol. Chem. 270, 66-72.
10. Wu, Q., Yu, D., Post, J, Halks-Miller, M., Sadler, J. E., and Morser, J. (1998) J. Clin. Invest. 101, 321-326.
11. Yu, I.-S., Chen, H.-J., Lee, Y.-S. E., Huang, P.-H., Lin, S.-R., Tsai, T.-W., and Lin, S.-W. (2000) Thromb. Haemost. 84, 865-870.
12. Zacharski, L. R., Ornstein, D. L., Memoli, V. A., Rousseau, S. M., and Kisiel, W. (1998) Thromb. Haemost. 79, 876-877.
13. Rapaport, S. I., and Rao, L. V. M. (1995) Thromb. Haemost. 74, 7-17.
14. Mann, К. G. (1999) Thromb. Haemost. 82, 165-174.
15. Torres-Rosado, A., O'Shea, К. S., Tsuji, A., Chou, S.-H., and Kurachi, K. (1993) Proc Natl Acad Sci USA 90, 7181-7185.
16. Srikantan, V., Valladares, M., Rhim, J. S., Moul, J. W., and Srivastava, S. (2002) Cancer Res. 62, 6812-6816.
17. Welsh, J. В., Sapinoso, L. M., Su, A. I., Kern, S. G., Wang-Rodriguez, J., Moskaluk, C. A., Frierson Jr., H. F., and Hampton, G. M. (2001) Cancer Res. 61, 5974-5978.
18. Stamey, Т. A., Warrington, J. A., Caldwell, M. C., Chen, Z., Fan, Z., Mahadevappa, M., McNeal, J. E., Nolley, R., and Zhang, Z. (2001) J. Urol. 166, 2171-2177.
19. Magee, J. A., Araki, Т., Patil, S., Ehrig, Т., True, L., Humphrey, P. A., Catalona, W. J., Watson, M. A., and Milbrandt, J. (2001) Cancer Res. 61, 5692-5696.
20. Dhanasekaran, S. M., Barrette, T. R., Ghosh, D., Shah, R., Varambally, S., Kurachi, K., Pienta, K. J., Rubin, M. A., and Chinnaiyan, A. M. (2001) Nature 412, 822-826.
21. Luo, J., Duggan, D. J., Chen, Y., Sauvageot, J., Ewing, C. M., Bittner, M. L., Trent, J. M., and Isaacs, W. B. (2001) Cancer Res. 61, 4683-4688.
22. Stephan, C., Yousef, G. M., Scorilas, A., Jung, K., Jung, M., Kristiansen, G., Hauptmann, S., Kishi, Т., Nakamura, Т., Loening, S. A., and Diamandis, E. P. (2004) J. Urol. 171, 187-191.
23. Tanimoto, H., Yan, Y., Clarke, J., Korourian, S., Shigemasa, K., Parmley, T. H., Parham, G. P., and O'Brien, T. J. (1997) Cancer Res. 57, 2884-2887.
24. Lin, C.-Y., Anders, J., Johnson, M., Sang, Q. A., and Dickson, R. B. (1999) J. Biol. Chem. 274, 18231-18236.
25. Takeuchi, Т., Shuman, M. A., and Craik, C. S. (1999) Proc. Natl. Acad. Sci. USA 96, 11054-11061.
26. Birchmeier, C., Birchmeier, W., Gherardi, E., and Vande Woude, G. F. (2003) Nature Rev. Mol. Cell Biol. 4, 915-925.
27. Trusolino, L., and Comoglio, P. M. (2002) Nature Rev. Cancer 2, 289-300.
28. Hartmann, G., Naldini, L., Weidner, K. M., Sachs, M., Vigna, E., Comoglio, P. M., and Birchmeier, W. (1992) Proc. Natl. Acad. Sci. USA 89, 11574-11578.
29. Lokker, N. A., Mark, M. R., Luis, E. A., Bennett, G. L., Robbins, K. A., Baker, J. В., and Godowski, P. J. (1992) EMBO J 11. 2503-2510.
30. Naka, D., Ishii, Т., Yosniyama, Y., Miyazawa, К., Наrа, H., Hishida, Т., and Kitamura, N. (1992) J. Biol. Chem. 267, 20114-20119.
31. Gak, E., Taylor, W. G., Chan, A. M.-L., and Rubin, J. S. (1992) FEBS Lett. 311, 17-21.
32. Miyazawa, K., Shimomura, Т., Kitamura, A., Kondo, J., Morimoto, Y., and Kitamura, N. (1993) J. Biol. Chem. 268, 10024-10028.
33. Lee, S.-L., Dickson, R. В., and Lin, C.-Y. (2000) J. Biol. Chem. 275, 36720-36725.
34. Kirchhofer, D., Peek, M., Li, W., Stamos, J., Eigenbrot, C., Kadkhodayan, S., Elliott, J. M., Corpuz, R. Т., Lazarus, R. A., and Moran, P. (2003) J. Biol. Chem. 278, 36341-36349.
35. Naldini, L., Tamagnone, L., Vigna, E., Sachs, M., Hartmann, G., Birchmeier, W., Daikuhara, Y., Tsubouchi, H., Blasi, P., and Comoglio, P. M. (1992) EMBO J. 11, 4825-4833.
36. Shimomura, Т., Miyazawa, К., Komiyama, Y., Hiraoka, H., Naka, D., Morimoto, Y., and Kitamura, N. (1995) Eur. J. Biochem. 229, 257-261.
37. Shimomura, Т., Denda, К., Kitamura, A., Kawaguchi, Т., Kito, M., Kondo, J., Kagaya, S., Qin, L., Takata, H., Miyazawa, K., and Kitamura, N. (1997) J. Biol. Chem. 272, 6370-6376.
38. Lin, C.-Y., Anders, J., Johnson, M., and Dickson, R. B. (1999) J. Biol. Chem. 274, 18237-18242.
39. Kawaguchi, Т., Qin, L., Shimomura, Т., Kondo, J., Matsumoto, K., Denda, K., and Kitamura, N. (1997) J. Biol. Chem. 272, 27558-27564.
40. Marlor, С. W., Delaria, K. A., Davis, G., Muller, D. K., Greve, J. M., and Tamburini, P. P. (1997) J. Biol. Chem. 272, 12202-12208.
41. Delaria, K. A., Muller, D. K., Marlor, C. W., Brown, J. E., Das, R. C., Roczniak, S. O., and Tamburini, P. P. (1997) J. Biol. Chem. 272, 12209-12214.
42. Kelley, R. F., Yang, J., Eigenbrot, C., Moran, P., Peek, M., Lipari, M. Т., and Kirchhofer, D. (2004) Biochemistry 43, 1223-1229.
43. Mimms, L. Т., Zampighi, G., Nozaki, Y., Tanford, C., and Reynolds, J. A. (1981) Biochemistry 20, 833-840.
44. Kirchhofer, D., Yao, X., Peek, M., Eigenbrot, C., Lipari, M. Т., Billeci, K. L., Maun, H. R., Moran, P., Santell, L., Wiesmann, C., and Lazarus, R. A. (2004) J. Biol. Chem. (in press).
45. Peek, M., Moran, P., Mendoza, N., Wickramasinghe, D., and Kirchhofer, D. (2002) J. Biol. Chem. 277, 47804-47809.
46. Gmyrek, G. A., Walburg, M., Webb, C. P., Yu, H.-M., You, X., Darracott Vaughan, E., Vande Woude, G. F., and Kundsen, B. S. (2001) Am. J. Pathol. 159, 579-590.
47. Knudsen, B. S., Gmyrek, G. A., Inra, J., Scherr, D. S., Vaughan, E. D., Nanus, D. M., Kattan, M. W., Gerald, W. L., and Vande Woude, G. F. (2002) Urology 60, 1113-1117.
48. Zhu, X., and Humphrey, P. A. (2000) Urology 56, 1071-1074.
49. Huntsman, D., Resau, J. H., Klineberg, E., and Auersperg, N. (1999) Am. J. Pathol. 155, 343-348.
50. Wong, A. S. Т., Pelech, S. L., Woo, M. M. M., Yim, G., Rosen, В., Ehlen, T., Leung, P. C. K., and Auersperg, N. (2001) Oncogene 20, 1318-1328.
51. Stamos, J., Lazarus, R. A., Yao, X., Kirchhofer, D., and Wiesmann, C. (2004) EMBO J. 23, 2325-2335.
52. Schmidt, C., Bladt, F., Goedecke, S., Brinkmann, V., Zschiesche, W., Sharpe, M., Gherardi, E., and Birchmeier, C. (1995) Nature (London) 373, 699-702.
53. Uehara, Y., Minowa, O., Mori, C., Shiota, K., Kuno, J., Noda, Т., and Kitamura, N. (1995) Nature (London) 373, 702-705.
54. List, K., Haudenschild, С. С., Szabo, R., Chen, W., Wahl, S. M., Swaim, W., Engelholm, L. H., Behrendt, N., and Bugge, T. H. (2002) Oncogene 21, 3765-3779.
55. Gailani, D., Lasky, N. M., and Broze Jr., G. J. (1997) Blood Coag. Fibrinol. 8, 134-144.
56. Hathaway, W. E., Wuepper, K. D., Weston, W. L., Humbert, J. R., Rivers, R. P. A., Genton, E., August, C. S., Montgomery, R. R., and Mass, M. P. (1976) Am. J. Med. 60, 654-664.
57. Carmeliet, P., Schoonjans, L., Kieckens, L., Ream, В., Degen, J., Bronson, R., De Vos, R., van den Oord, J. J., Collen, D., and Mulligan, R. C. (1994) Nature 368, 419-424.
58. Hamasuna, R., Kataoka, H., Meng, J.-Y., Itoh, H., Moriyama, Т., Wakisaka, S., and Koono, M. (2001) Int.J. Cancer 93, 339-345.
59. Kataoka, H., Suganuma, Т., Shimomura, Т., Itoh, H., Kitamura, N., Nabeshima, K., and Koono, M. (1999) J. Histochem. Cytochem. 47, 673-682.
60. Kataoka, H., Itoh, H., Uchino, H., Hamasuna, R., Kitamura, N., Nabeshima, K., and Koono, M. (2000) Cancer Lett. 148, 127-134.
61. Parr-, С., and Jiang, W. G. (2001) Int. J. Oncol. 19, 857-863.
62. Oberst, M., Anders, J., Xie, В., Singh, В., Ossandon, M., Johnson, M., Dickson, R. В., and Lin, C.-Y. (2001) Am. J. Pathol. 158, 1301-1311.
63. Oberst, M. D., Johnson, M. D., Dickson, R. В., Lin, C.-Y., Singh, В., Stewart, M., Williams, A., al-Nafussi, A., Smyth, J. F., Gabra, H., and Sellar, G. C. (2002) Clin. Cancer Res. 8, 1101-1107.
64. Denda, K., Shimomura, T., Kawaguchi, Т., Miyazawa, K., and Kitamura, N. (2002) J. Biol. Chem. 277, 14053-14059.
65. Qin, L., Denda, K., Shimomura, Т., Kawaguchi, Т., and Kitamura, N. (1998) FEBS lett. 436, 111-114.
66. Kataoka, H., Hamasuna, R., Itoh, H., Kitamura, N. and Koono, M. (2000) Cancer Res. 60, 6148-6159.
67. Kataoka, H., Uchino, H., Denda, K., Kitamura, N., Itoh, H., Tsubouchi, H., Nabeshima, K., and Koono, M. (1998) Cancer Lett. 128, 219-227.
68. Yamauchi. M., Kataoka, H., Itoh, H., Seguchi, Т., Hasui, Y., and Osada, Y. (2004) J. Urol. 171, 890-896.
69. Dennis, M. S., and Lazarus, R. A. (1994) J. Biol. Chem. 269, 22129-22136.
70. Dennis, M. S., Herzka, A., and Lazarus, R. A. (1995) J. Biol. Chem. 270, 25411-25417.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ МОДУЛЯЦИИ ГЕПСИНОМ СТИМУЛИРУЮЩЕГО МАКРОФАГИ БЕЛКА | 2010 |
|
RU2539772C2 |
| СПОСОБ ЛЕЧЕНИЯ ОПУХОЛИ У СУБЪЕКТА | 2006 |
|
RU2404193C2 |
| МОДУЛЯТОРЫ АКТИВАТОРА ФАКТОРА РОСТА ГЕПАТОЦИТОВ | 2005 |
|
RU2418004C2 |
| АНТИТЕЛА ПРОТИВ ГЕПСИНА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2010 |
|
RU2559533C2 |
| ВАРИАНТЫ БЕТА-ЦЕПИ HGF | 2006 |
|
RU2403261C2 |
| ГУМАНИЗИРОВАННЫЕ АНТАГОНИСТЫ, НАПРАВЛЕННЫЕ ПРОТИВ c-met | 2005 |
|
RU2398777C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ДИАГНОСТИКИ И ЛЕЧЕНИЯ ОПУХОЛИ | 2010 |
|
RU2563359C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ АНТАГОНИСТАМИ С-МЕТ И EGFR | 2009 |
|
RU2601892C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ДИАГНОСТИКИ И ЛЕЧЕНИЯ ОПУХОЛИ | 2011 |
|
RU2636461C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ДИАГНОСТИКИ И ЛЕЧЕНИЯ ОПУХОЛЕЙ | 2011 |
|
RU2595389C2 |




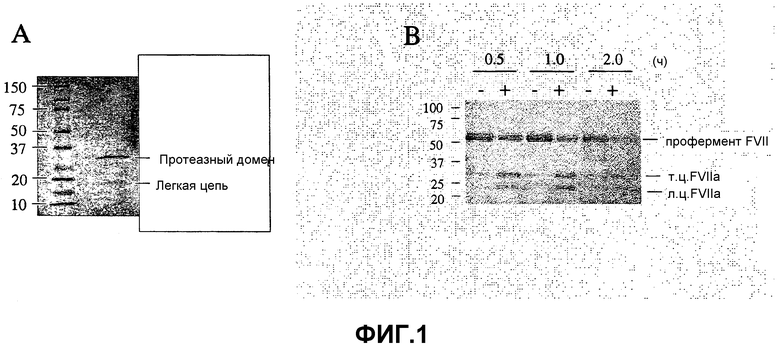
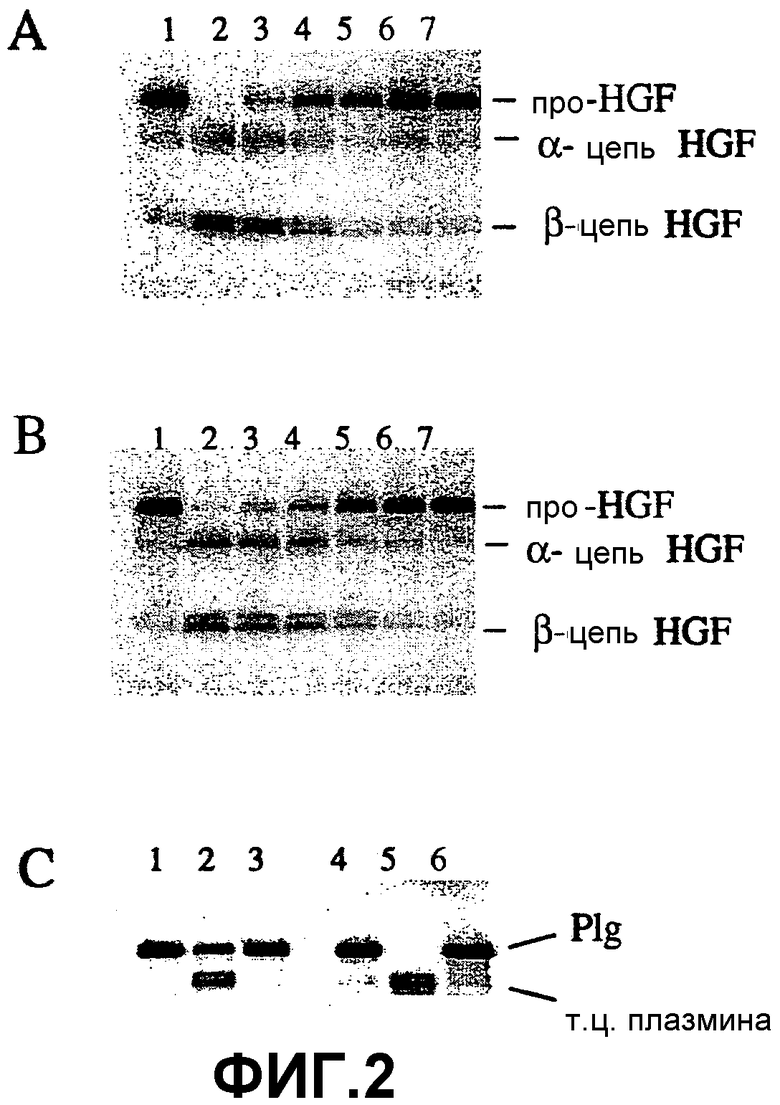
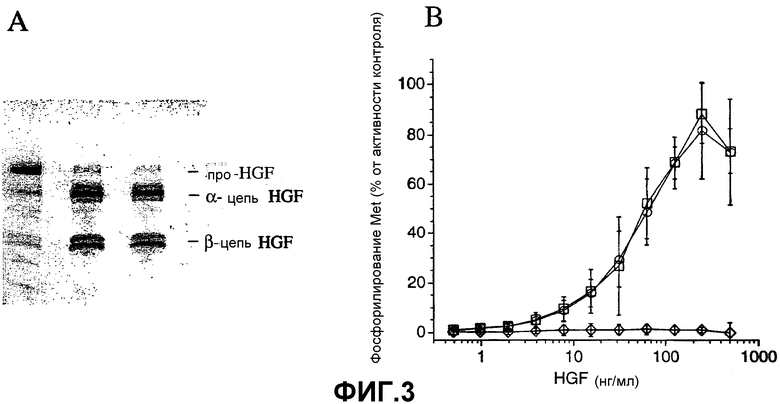
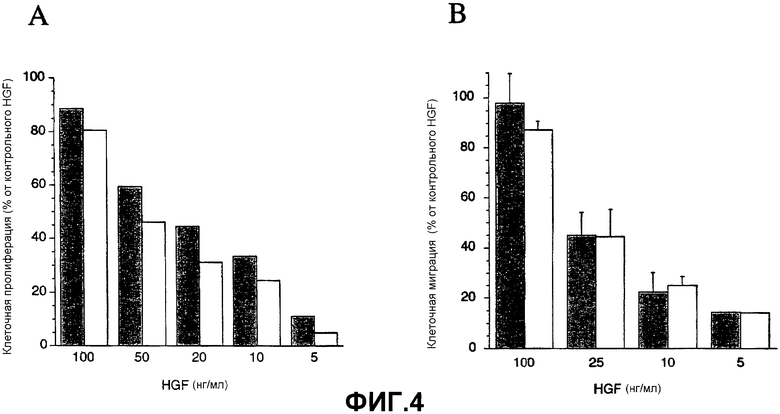
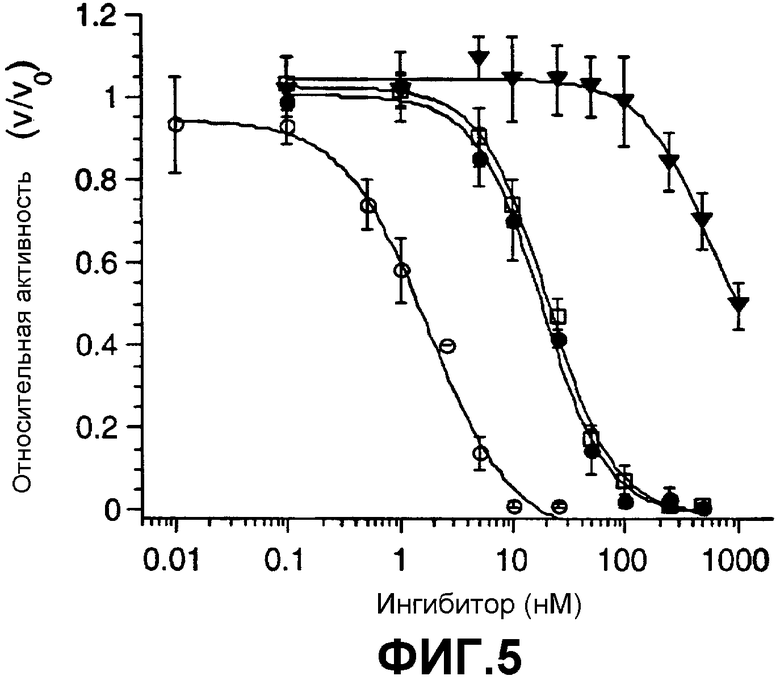
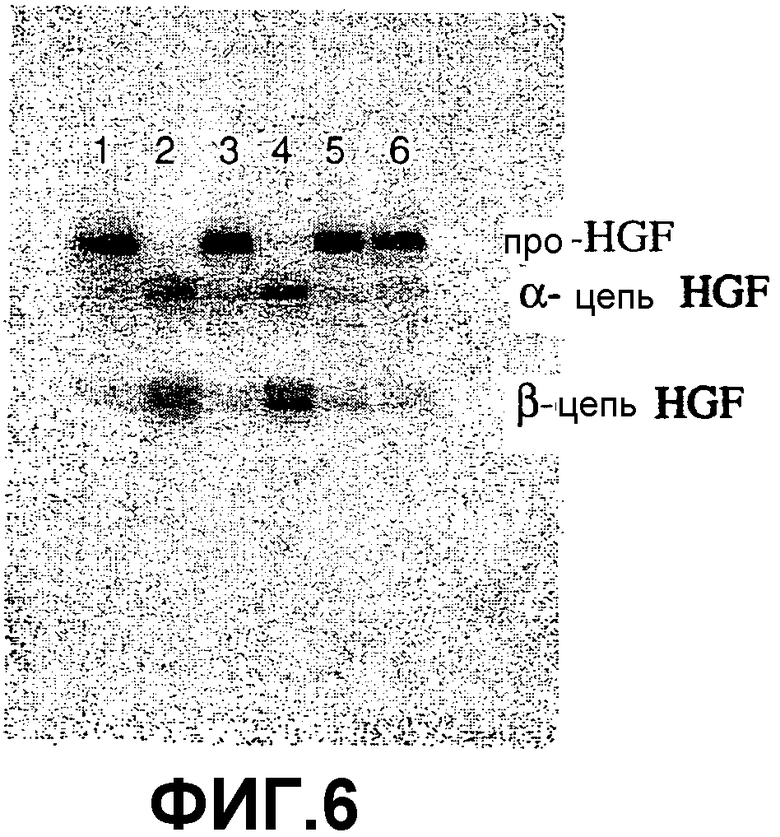



Изобретение относится к биотехнологии, а именно к модуляторам пути передачи сигнала HGF/c-met. Предложен способ идентификации ингибирующего вещества-кандидата, которое ингибирует активацию HGF гепсином. Способ основан на сравнении степени активации субстрата про-HGF в образце, содержащем гепсин, про-HGF и исследуемое вещество-кандидат, со степенью активации субстрата про-HGF в эталонном образце, не содержащем вещества-кандидата. Также предложено средство для ингибирования взаимодействия гепсина и фактора роста гепатоцитов, включающее последовательность домена Кунитца, которая представляет собой последовательность KD-1 домена Кунитца HAI-1 или HAI-1B, или один или оба домена Кунитца HAI-2. Изобретение позволяет идентифицировать физиологические модуляторы гепсина. 2 н. и 4 з.п. ф-лы, 8 ил., 2 табл.
1. Способ идентификации ингибирующего вещества-кандидата, которое ингибирует активацию HGF гепсином, где указанный способ включает в себя (а) приведение вещества-кандидата в контакт с первым образцом, содержащим гепсин и субстрат про-HGF, и (b) сравнение степени активации субстрата про-HGF в образце со степенью активации субстрата про-HGF в эталонном образце, содержащем равные с первым образцом количества гепсина и субстрата про-HGF, но не контактировавшим с указанным веществом-кандидатом, согласно которому уменьшение степени активации субстрата про-HGF в первом образце по сравнению с эталонным образцом означает, что вещество-кандидат способно ингибировать активацию одноцепочечного HGF (про-HGF) гепсином.
2. Способ по п.1, где гепсин в образце находится в эффективном для активации указанного про-HGF количестве.
3. Способ по п.1, где субстрат про-HGF представляет собой полипептид, содержащий HGF или его фрагмент, содержащий форму пептидной связи R494-V495 дикого типа.
4. Способ по п.1, где субстрат про-HGF содержит участок расщепления человеческого HGF, соответствующий консенсусному участку расщепления протеаз, где участок расщепления содержит основный остаток в положении P1 и два гидрофобных аминокислотных остатка в положениях Р1' и Р2'.
5. Способ по п.1, где вещество связывает гепсин или про-HGF.
6. Средство для ингибирования взаимодействия гепсина и фактора роста гепатоцитов, где средство включает последовательность домена Кунитца, которая способна ингибировать про-HGF активацию под действием гепсина, где последовательность домена Кунитца (KD) представляет собой:
(i) последовательность KD-1 домена Кунитца ингибитора-1 активатора фактора роста гепатоцитов человека (HAI-1), ингибитора-1 В активатора фактора роста гепатоцитов человека (HAI-1В); или (ii) один или оба домена Кунитца ингибитора-2 активатора фактора роста гепатоцитов человека (HAI-2).
| KIRCHHOFER D | |||
| et al | |||
| Tissue expression, protease specificity, and Kunitz domain functions of hepatocyte growth factor activator inhibitor-1 В (HAI-1В), a new splice variant of HAI-1// J Biol Chem | |||
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
| SZABO R | |||
| et al | |||
| Type II transmembrane serine proteases// Thromb Haemost | |||
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
| Пожарный двухцилиндровый насос | 0 |
|
SU90A1 |
| WU | |||
Авторы
Даты
2010-11-27—Публикация
2005-07-25—Подача