Изобретение относится к области экспериментальной биологии и медицины, конкретно к фармакологии и клеточным технологиям, и может быть использовано в регенеративной медицине.
Существуют способы увеличения содержания клеток-предшественников различных классов в определенных тканях с помощью линейно-рестриктированных и раннедействующих факторов роста [1].
Известна возможность увеличения резерва стволовых клеток в организме с помощью препарата нативной гиалуронидазы [2, 3].
Недостатками данного средства являются побочные эффекты и осложнения [4, 5], связанные с иммуногенностью гиалуронидазы, представляющей собой белковый препарат. В частности, системные и местные аллергические реакции различной интенсивности (вплоть до анафилактического шока) при ее парентеральном введении, представляющем собой единственно возможный путь назначения данного фермента. В связи с этим важное значение приобретает проблема создания средства, обладающего способностью увеличивать резерв стволовых клеток в организме, при использовании которого отсутствовали бы побочные эффекты, наблюдаемые при парентеральном применении нативной гиалуронидазы.
Задачей, решаемой данным изобретением, является создание средства, увеличивающего резерв стволовых клеток в организме, не имеющего иммуногенности, эффективного как при парентеральном, так и при пероральном введении.
Поставленная задача достигается иммобилизацией гиалуронидазы на носителях низкой молекулярной массы на носителях с помощью ионизирующего излучения. В качестве носителя используются биологически индифферентные вещества - водорастворимые полимеры с молекулярной массой 400-4000 Да.
Наиболее предпочтительным способом иммобилизации является воздействие на полимерный носитель и биологически активное соединение направленным потоком ускоренных электронов с энергией электронов 2,5 МэВ, поглощенная доза от 2 до 10 кГр, скорость набора дозы 1,65 кГр/час.
В качестве водорастворимого полимера используют полиэтиленгликоль, гидроксиэтилкрахмал, поливинилпирролидон и др. с молекулярной массой от 400 до 4000 Да.
Новым в предлагаемом изобретении является создание средства, представляющего собой гиалуронидазу, иммобилизированную с помощью ионизирующего излучения, увеличивающего резерв стволовых клеток в организме, не имеющего иммуногенности, и эффективного как при парентеральном, так и при пероральном введении.
Используемое нами оригинальное средство иммобилизированной с помощью ионизирующего излучения на низкомолекулярном носителе гиалуронидазы было разработано и получено НИИ фармакологии СО РАМН (г.Томск) совместно с ООО «Саентифик Фьючер Менеджмент» (г.Новосибирск).
В настоящее время весьма перспективными для лечения различных заболеваний выглядят способы клеточной терапии. При этом наиболее физиологичным и целесообразным подходом к решению задач регенеративной медицины является фармакологическая стимуляция эндогенных стволовых клеток (СК) [6]. Вместе с тем регуляторы функций СК в подавляющем большинстве представляют собой белковые соединения, применение которых в качестве препаратов для системного использования значительно ограничено вследствие их высокой иммуногенности [4, 5]. Известны способы преодоления иммуногенности белковых препаратов с помощью глюкокортикоидных гормоны, антигистаминных средств и др. Однако использование данных препаратов зачастую сопровождается развитием нежелательных побочных эффектов и осложнений, характерных для них самих [6, 7].
В то же время значительное снижение иммуногенности веществ наблюдается при энтеральном приеме лекарственных препаратов. Однако средства белкового происхождения в желудочно-кишечном тракте подвергаются расщеплению под влиянием протеолитических ферментов, что делает данный путь их введения в организм неэффективным. В то же время существуют данные о снижении иммуногенности и повышении устойчивости белков к протеазам при их иммобилизации на низкомолекулярных носителях [8]. Известен препарат - лонгидаза, представляющий собой конъюгат гиалуронидазы («Лидаза») и полиоксидония, получаемый путем химического синтеза [9]. Тем не менее, сведений о возможности уменьшения иммуногенных свойств гиалуронидазы, а также способа создания препарата с высокой гиалуронидазной активностью, эффективного, в том числе при приеме внутрь, за счет иммобилизации молекул фермента на носителях низкой молекулярной массы с использованием ионизирующего излучения, на сегодняшний день не существует. Более того, не существует данных о фармакологических преимуществах препаратов, полученных в результате иммобилизации биологически активных веществ с помощью ионизирующего излучения, перед соединениями, образующимися при конъюгировании тех же исходных субстанций, но химическим путем. То есть не известно существование качественных различий конечного продукта, связанных со способом его получения: технологии химического синтеза (с помощью которой получают лонгидазу) и электронно-лучевой технологией иммобилизации (с помощью которой осуществляется получение предлагаемого средства). В то же время известно, что процесс манипуляции разнородными субстанциями на молекулярном уровне [10, 11], в том числе с использованием физических факторов, обладающих высокой энергией, может сопровождаться существенными изменениями стереохимической структуры исходных веществ, и в конечном итоге приводить к модификации их свойств, характер которой зачастую является непредсказуемым.
Факт иммобилизации гиалуронидазы на носителе с помощью ионизирующего излучения с достижением нового технического результата: создание средства, увеличивающего резерв стволовых клеток в организме, не имеющего иммуногенности и эффективного при парентеральном и пероральном приеме, для специалиста является не очевидным.
Заявляемые существенные признаки проявили в совокупности новые свойства, не вытекающие явным образом из уровня техники в данной области. Предлагаемое изобретение может быть использовано в экспериментальной биологии и медицине с выходом в практическое здравоохранение. Идентичной совокупности признаков при исследовании уровня техники по патентной и научно-медицинской литературе не обнаружено.
Исходя из вышеизложенного, следует считать заявляемое техническое решение соответствующим критериям: «Новизна», «Изобретательский уровень», «Промышленная применимость».
Эксперименты были проведены на мышах-самцах линии CBA/CaLac в количестве 106 штук, массой 18-20 г, 27 морских свинках обоего пола массой 200-250 г. Животные получены из питомника отдела экспериментального биомедицинского моделирования НИИ фармакологии СО РАМН.
Пример 1
10% водный раствор полиэтиленгликоля с молекулярной массой 400 Да облучали потоком ускоренных электронов в дозе 1,5 Мрад. Обработку проводили тормозным излучением, генерируемым ускорителем ИЛУ-6 с энергией электронов 2,5 МэВ, поглощенная доза от 2 кГр, скорость набора дозы 1,65 кГр/час. В облученный раствор вносили гиалуронидазу («Лидаза», ФГУП «НПО Микроген» МЗ РФ) до конечной концентрации 70 ЕД гиалуронидазы в 1 мл 10% полиэтиленгликоля. Смесь перемешивали 10 минут и получали конечный иммобилизиованный препарат в виде слегка опалесцирующего раствора. Выход готового продукта составляет 96,2%.
Пример 2
5% водный раствор гидроксиэтил-крахмала с молекулярной массой 1,5 кДа облучали потоком ускоренных электронов в дозе 1,5 Мрад. Обработку проводили тормозным излучением, генерируемым ускорителем ИЛУ-10 с энергией электронов 2,5 МэВ, поглощенная доза 10 кГр, скорость набора дозы 1,65 кГр/час. В облученный раствор вносили гиалуронидазу («Лидаза», ФГУП «НПО Микроген» МЗ РФ) до конечной концентрации 70 ЕД гиалуронидазы в 1 мл 5% гидроксиэтил-крахмале. Смесь перемешивали 10 минут и получали конечный иммобилизиованный препарат в виде слегка опалесцирующего раствора. Выход готового продукта составляет 97,3%.
Пример 3
Изучали специфическую активность имГД. В качестве препарата сравнения использовали «Лонгидазу» (НПО Петровакс Фарм. Россия), представляющую собой химический конъюгат гиалуронидазы («Лидаза») с полиоксидонием.
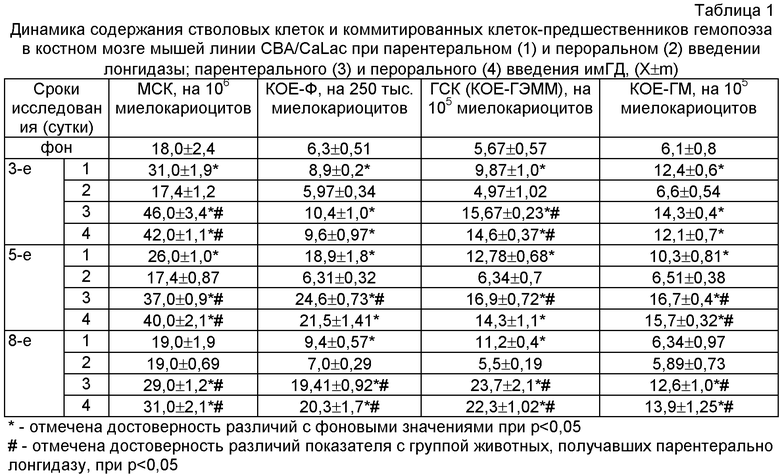
На 3, 5, 8 сут с помощью метода лимитирующих разведений определяли количество мезенхимальных (истинных) стволовых клеток (МСК) [12], а также методом клонирования в полувязкой среде изучали содержание гемопоэтических стволовых клеток (ГСК) - гранулоцитарно-эритро-макрофагально-мегакариоцитарных единиц (КОЕ-ГЭММ), коммитированных мезенхимальных (КОЕ-Ф) и грануломоноцитарных (КОЕ-ГМ) клеток-предшественников в костном мозге [13], представляющем собой по современным представлениям депо СК в организме [6].
Обработку результатов проводили методом вариационной статистики с использованием t-критерия Стьюдента и непараметрического U-критерия Вилкоксона-Манна-Уитни. Частоту встречаемости МСК в костном мозге и периферической крови определяли с помощью обобщенной линейной модели для распределения Пуассона. Соответствие данных лимитирующих разведений одномерной модели Пуассона оценивалось посредством линейной log-log регрессии. При этом теоретическая фракция отрицательных лунок µi распределялась как µi=exp(-fxi), где f - частота встречаемости MCK, xi - количество клеток, высаженных в лунку [12]. Использовалась программа Statistica 6.0.
Препарат иммобилизированной с помощью электронно-лучевого воздействия на полиэтиленкликоле гиалуронидазы (имГД) в дозе 1000 Ед/кг, вводили интактным животным однократно внутрибрюшинно и перорально. Контрольным мышам в эквивалентном объеме (0,2 мл) внутрибрюшинно и перорально вводили препарат сравнения «Лонгидазу» (НПО Петровакс Фарм. Россия) в дозе 1000 Ед/кг.
Введение животным исследуемых препаратов во всех случаях, за исключением перорального введения препарата сравнения, приводило к существенному возрастанию содержания исследуемых прогениторных элементов в костном мозге.
При внутрибрюшинном введении лонгидазы количество MCK, КОЕ-ГЭММ, КОЕ-Ф и КОЕ-ГМ было повышенным на протяжении всего эксперимента и достигало максимальных значений на 5 сутки опыта.
Использование имГД приводило к значительно более выраженным и продолжительным изменениям со стороны изучаемых пулов прогениторных элементов. Причем следует отметить, что свою максимальную эффективность заявляемое средство проявляло в отношении наиболее ранних клеток-предшественников: МСК и КОЕ-ГМ. Более того, практически не наблюдалось различий в группах животных, получающих данный препарат разными способами (парентерально и перорально) (табл.1).
Пример 4
Средство получали путем иммобилизации гиалуронидазы на молекулах гидроксиэтил-крахмала с помощью разных видов ионизирующего излучения: 1) гамма излучения (имГД-1), 2) ультрафиолетового излучения (имГД-2) и 3) лазерного излучения (имГД-3). Препараты иммобилизированной ГД (ООО «Саентифик Фьючер Менеджмент», г.Новосибирск) в дозе 50 Ед/кг вводили интактным животным перорально 1 раз в сутки в течение 5 дней.
Введение имГД во всех случаях приводило к значительному и практически одинаковому увеличению содержания ранних (МСК, КОЕ-ГЭММ) и коммитированных прогениторных клеток (КОЕ-Ф) в гемопоэтической ткани. При этом наибольших величин повышение исследуемых показателей имело место в отношении МСК и КОЕ-ГЭММ на 8 сутки опыта (табл.2).
Пример 5
Проводили сравнительное изучение аллергизирующих (иммуногенных) свойств препаратов гиалуронидазы, иммобилизированной на полиэтиленгликоле с помощью ионизирующей радиации (имГД), и «Лонгидазу» (НПО Петровакс Фарм., Россия).
Препараты исследовались в одинаковых дозах (определяемых по единицам активности гиалуронидазы), которая была определена как оптимальная в отношении стимуляции стволовых клеток, и в 10 раз ее превышающей (содержание гиалуронидазы 100 и 1000 Ед/кг соответственно). Оценка аллергизирующих свойств препарата проводилась с использованием следующих тестов: реакции общей анафилаксии, реакции специфической агломерации лейкоцитов, при внутрикожном и конъюнктивальном тестировании на морских свинках, реакции гиперчувствительности замедленного типа на мышах [14].
Для сенсибилизации морских свинок препараты вводили: сначала 1 раз подкожно, затем в той же дозе 2 раза внутримышечно, через день, в область бедра. Анафилактогенные свойства препаратов гиалуронидазы выявляли путем его внутрисердечного введения на 21-е сутки после последней сенсибилизирующей инъекции. Разрешающее тестирующее внутрисердечное введение препарата проводилось в дозе, равной суммарной сенсибилизирующей, т.е. 300 Ед/кг. Контролем служили несенсибилизированные морские свинки, которым препарат вводили внутрисердечно.
Учет интенсивности анафилактической реакции проводили с использованием формулы
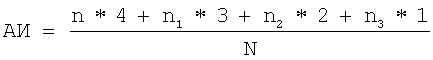 ,
,
где АИ - анафилактический индекс;
n - число животных, анафилактическая реакция которых заканчивалась смертельным исходом;
n1 - число животных со значительными проявлениями анафилактической реакции;
n2 - число животных со средними проявлениями реакции;
n3 - число животных со слабыми проявлениями реакции;
N - общее число животных в группе.
Для оценки кожно-сенсибилизирующих свойств препарата через 20 дней после окончания сенсибилизирующих инъекций на боковой поверхности тела морских свинок выстригали шерсть, и каждому животному внутрикожно вводили препарат имГД, либо лонгидазу в дозах 10 Ед/животное (50 Ед/кг) в 0,02 мл физиологического раствора (доза, не вызывающая визуальных изменений кожи у интактных морских свинок).
Реакцию кожи на введение препарата оценивали в баллах с учетом выраженности гиперемии и размеров гиперемированной области (средняя величина диаметра в миллиметрах). Были определены четыре степени гиперемии, которым соответствовали числовые индексы: сильная (+++) - 1,0; средняя (++) - 0,66; слабая (+) - 0,33; сомнительная (+/-) - 0,17. Умножение величины диаметра гиперемированной области на индекс соответствующей степени гиперемии, позволило в едином показателе (баллы) выразить обе характеристики реакции.
На 20-й день после завершения цикла сенсибилизирующих инъекций, проводилось конъюнктивальное тестирование. Тест заключался в закапывании в левый глаз каждого животного 0,02 мл физиологического раствора, содержащего 10 Ед препарата, в правый глаз - физиологического раствора в том же объеме. Оценка состояния конъюнктивы глаза проводилась через 4 и 24 часа после воздействия.
С целью подтверждения результатов, полученных вышеперечисленными тестами, использовалась реакция аллергодиагностики in vitro РСАЛ (реакция специфической агломерации лейкоцитов). Рабочая доза препаратов гиалуронидазы для этой реакции составляла 5 Ед на 0,05 мл крови животного.
На мышах сенсибилизацию проводили с использованием полного адьюванта Фрейнда (ПАФ). Препараты гиалуронидазы вводили однократно подкожно в основание хвоста в 0,06 мл ПАФ, который был взят в соотношении 1:1 к объему раствора препарата. Доза препарата составляла 1000 мкг/кг. Контрольным животным вводили ПАФ в том же объеме.
Через 5 суток после инъекции опытным и контрольным мышам в подушечку одной из задних лап вводили препараты гиалуронидазы в дозе 30 Ед/животное в 0,04 мл физиологического раствора, в другую лапу - физиологический раствор. Через 24 часа после второй инъекции с помощью инженерного микрометра типа МК измеряли толщину обеих лап. Величину реакции определяли как разницу в толщине опытной и контрольной лап, в миллиметрах.
В ходе эксперимента было установлено, что реакция морских свинок на внутрикожное введение препарата имГД по таким визуальным показателям, как покраснение или отек, не отличалась от соответствующих показателей у животных, которым вводили дистиллированную воду, в то время как при введении лонгидазы кожная реакция была достоверно более выражена. Конъюнктивальный тест и реакция аллергодиагностики in vitro не выявили признаков аллергизирующего действия у имГД, и обнаружили таковые у препарата сравнения. При тестирующем внутрисердечном введении препаратов имГД и лонгидазы имело место статистически значимое увеличение анафилактического индекса в группе животных, получавших лонгидазу, причем АИ был более единицы (табл.3).
Кроме того, изучение аллергизирующих (иммуногенных) свойств показало, что внутрикожные тестирующие инъекции имГД, в отличие от лонгидазы, не приводили к изменению величины реакции ГЗТ по сравнению с контрольным уровнем показателя через 4 и 24 часа после воздействия (табл.4).
Таким образом, препарат, иммобилизированный с помощью ионизирующего излучения гиалуронидазы, не оказывает иммуногенного эффекта, проявляющегося аллергизацией организма, в то время как обычный конъюгат фермента с носителем обладает аллергизирующими свойствами.
Таким образом, средство, представляющее собой иммобилизированную на низкомолекулярном носителе с помощью ионизирующего излучения гиалуронидазу, способно значительно увеличивать содержание стволовых клеток различных классов в организме и не обладает иммуногенностью. При этом эффективность данного средства значительно превышает таковую у известных аналогов. Более того, особенности технологии получения данного средства приводят к возможности его эффективного использования не только парентерально, но и внутрь.
Цитируемая литература:
1. Metcalf D. Hemopoietic growth factors. 1. The Lancet. - 1989. - Vol.15. - P.825-827.
2. Гольдберг Е.Д., Дыгай A.M., Зюзьков Г.Н. и др. Роль гиалуронидазы в регуляции функций мезенхимальных клеток-предшественников. Клеточные технологии в биологии и медицине. - 2007. - №2. - С.115-119.
3. Зюзьков Г.Н., Жданов В.В., Дыгай A.M., Гольдберг Е.Д. Роль гиалуронидазы в регуляции гемопоэза. Бюл. эксперим. биол. и медицины. - 2007. - №12. - С.690-695.
4. Anderson J.A. Allergic reactions to drugs and biologic agents. JAMA. - 1992. - Vol.268. - p.2845-2857.
5. De Swarte R.D., Drug allergy. In: Patterson R. e.a. Allergic Diseases Diagnosis and Management, 4th ed. Philadelphia, Ра. JB Lippincott. - 1993. - P.396-551.
6. Гольдберг Е.Д., Дыгай A.M., Жданов B.B., Зюзьков Г.Н. и др. Фармакологические аспекты регенеративной медицины. Бюл. эксперим. биол. и медицины. - 2008. - Приложение 2. - С.14-21.
7. Vial Т., Descotes J. Clinical toxicity of cytokines used as haemopoietic growth factors. Drug Saf. - 1995. - Vol.13. - №6. - P.371-406.
8. Vereschagin E.I., Khan Do-Hung, et al. Radiation Technology in the Preparation of Polyethylene Oxide Hydrophilic Gels and Immobilization of Proteases for Use in Medical Practice. Arch. Pharm. Res. - 2001. - V.24. - N 3. - P.229-233.
9. Дубницкая Л.В., Назаренко T.A. Возможности применения препарата Лонгидаза® в комплексной терапии патологических изменений эндометрия. Русский медицинский журнал. - 2008. - Т.16 - №19. - С.1248-1251.
10. Сейфулла Р.Д., Тимофеев А.Б., Орджоникидзе З.Г. и др. Проблемы использования нанотехнологии в фармакологии. Экспериментальная и клиническая фармакология. - 2008. - №1. - С.61-69.
11. Евдокимов Ю.М. Пространственно упорядоченные формы ДНК и ее комплексов - основа создания наноконструкций для медицины и биотехнологий. Российские нанотехнологии. - 2006. - №1-2. - С.256-264.
12. In't Anker P.S., Noort W.A., Scherjon S.A. e.a. Mesenchymal stem cells in human second-trimester bone marrow, liver, lung, and spleen exhibit a similar immunophenotype but a heterogenous multilineage differentiation potential. Haematologica. - 2003. - Vol.88. - P.845-852.
13. Гольдберг Е.Д., Дыгай A.M., Шахов В.П. Методы культуры ткани в гематологии. - Томск: Изд-во ТГУ, 1992. - 272 с.
14. Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. Под ред. Р.У.Хабриева. - 2 изд. - М.: ОАО «Изд-во «Медицина», 2005. - С.54-69.
| название | год | авторы | номер документа |
|---|---|---|---|
| СРЕДСТВО, УСИЛИВАЮЩЕЕ МОБИЛИЗАЦИЮ СТВОЛОВЫХ КЛЕТОК | 2009 |
|
RU2442601C2 |
| СРЕДСТВО ДЛЯ РЕГЕНЕРАТИВНОЙ МЕДИЦИНЫ | 2009 |
|
RU2406528C2 |
| ГЕМОСТИМУЛИРУЮЩЕЕ СРЕДСТВО И СПОСОБ СТИМУЛЯЦИИ ГЕМОПОЭЗА | 2009 |
|
RU2414926C1 |
| ГЕПАТОПРОТЕКТОРНОЕ СРЕДСТВО | 2010 |
|
RU2444569C1 |
| СРЕДСТВО ДЛЯ СТИМУЛЯЦИИ РОСТА ОРГАНИЗМА | 2011 |
|
RU2452509C1 |
| ГЕМОСТИМУЛИРУЮЩЕЕ СРЕДСТВО | 2010 |
|
RU2437675C1 |
| СРЕДСТВО, УСИЛИВАЮЩЕЕ ДЕЙСТВИЕ БИОЛОГИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ И ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ | 2009 |
|
RU2421239C1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ РЕГЕНЕРАТИВНОЙ АКТИВНОСТЬЮ | 2011 |
|
RU2480236C1 |
| АНАЛЬГЕТИЧЕСКОЕ СРЕДСТВО | 2011 |
|
RU2452510C1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ ГИПОГЛИКЕМИЧЕСКИМ ДЕЙСТВИЕМ ПРИ ИНСУЛИННЕЗАВИСИМОМ САХАРНОМ ДИАБЕТЕ | 2009 |
|
RU2416427C1 |
Изобретение относится к области биотехнологии и медицины, конкретно к созданию с помощью нанотехнологии радиоционного синтеза средства, увеличивающего резерв стволовых клеток в организме и обладающего низкой иммуногенностью, и может быть использовано в регенеративной медицине. Средство представляет собой гиалуронидазу, иммобилизированную на полимере, путем ее внесения в раствор низкомолекулярного водорастворимого полимера, предварительно подвергшегося воздействию ионизирующего излучения в дозе 1-5 Мрад, до конечной концентрации 70 ЕД в 1 мл. Изобретение позволяет получить иммобилизированную гиалуронидазу, которая характеризуется значительным повышением ее способности увеличивать резерв стволовых клеток в организме и эффективна как при парентеральном, так и при пероральном введении. 4 табл.
Средство, увеличивающее резерв стволовых клеток в организме, представляющее собой иммобилизированную на низкомолекулярном водорастворимом полимере гиалуронидазу, отличающееся тем, что гиалуронидаза иммобилизирована на полимере путем ее внесения в раствор низкомолекулярного водорастворимого полимера, предварительно подвергшегося воздействию ионизирующего излучения в дозе 1-5 Мрад, до конечной концентрации 70 ЕД в 1 мл.
| СПОСОБ СНИЖЕНИЯ ТОКСИЧНОСТИ АМФОТЕРИЦИНА В | 2005 |
|
RU2297246C1 |
| ЗЮЗЬКОВ Г.Н | |||
| и др | |||
| Роль гиалуронидазы в регуляции гемопоэза | |||
| Бюл | |||
| эксперим | |||
| биол | |||
| и медицины | |||
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| VERESCHAGIN E.I | |||
| et al | |||
| Radiation technology in the preparation of polyethylene oxide hydrophilic gels and immobilization of proteases for use in medical practice | |||
| Arch | |||
| Pharm | |||
| Res | |||
| Перекатываемый затвор для водоемов | 1922 |
|
SU2001A1 |
Авторы
Даты
2010-12-10—Публикация
2009-03-05—Подача