Изобретение относится к медицине, конкретно к фармакологии и клеточным технологиям, и может быть использовано в регенеративной медицине.
Существуют препараты гранулоцитарного колониестимулирующего фактора (Г-КСФ), обладающие гемостимулирующим, мобилизующим стволовые клетки [1, 2], гепатопротекторным [3] и церебропротекторным [4] эффектами.
Известен препарат пегилированного (иммобилизированного/конъюгированного химическим путем с полиэтиленгликолем) Г-КСФ - пегфилграстим [5]. Данное средство является наиболее близким по технической сущности и достигаемому результату и выбрано в качестве прототипа.
Недостатком препаратов Г-КСФ, в том числе пегфилграстма, является их иммуногенность, определяемая белковой природой соединения и единственно возможным - парентеральным путем введения данного средства [2, 5]. В частности, их применение может сопровождаться выраженными системными и местными аллергическими реакции различной интенсивности (вплоть до анафилактического шока) [6, 7]. Кроме того, терапия дегенеративных заболеваний с помощью имеющихся препаратов Г-КСФ является недостаточно эффективной.
Задачей, решаемой данным изобретением, является создание средства для регенеративной медицины, не имеющего иммуногенности, высокоэффективного как при парентеральном, так и при пероральном введении.
Поставленная задача достигается иммобилизацией гранулоцитарного колониестимулирующего фактора на носителях с помощью ионизирующего излучения. В качестве носителя используются биологически индифферентные вещества - водорастворимые полимеры с молекулярной массой 400-4000 Да.
Наиболее предпочтительным способом иммобилизации является воздействие на полимерный носитель и биологически активное соединение направленным потоком ускоренных электронов с энергией 2,5 МэВ, поглощенная доза от 2 до 10 кГр, скорость набора дозы 1,65 кГр/час.
В качестве водорастворимого полимера используют полиэтиленгликоль, гидроксиэтилкрахмал, поливинилпирролидон и др.
Новым в предлагаемом изобретении является создание средства для регенеративной медицины, представляющего собой гранулоцитарный колониестимулирующий фактор, иммобилизированный на полимерном носителе с молекулярной массой 400-4000 Да с помощью ионизирующего излучения, обладающего геммо-стимулирующим, мобилизующим стволовые клетки, гепатопротекторным и церебропротекторным эффектами. Техническим результатом предлагаемого изобретения является отсутствие иммуногенности, и высокая эффективность средства как при парентеральном, так и при пероральном введении.
Используемое нами оригинальное средство гранулоцитарного колониестимулирующего фактора, иммобилизированного с помощью ионизирующего излучения на низкомолекулярном носителе, было разработано и получено совместно ООО «Саентифик Фьючер Менеджмент» (г.Новосибирск) и НИИ фармакологии СО РАМН (г.Томск).
Известно, что снижение степени иммуногенности веществ может быть достигнуто путем их перорального приема. Однако средства белкового происхождения, каким является и Г-КСФ, в желудочно-кишечном тракте подвергаются расщеплению под влиянием протеолитических ферментов, что делает данный путь их введения в организм неэффективным. В связи с этим важное значение приобретает проблема создания средства для регенеративной медицины, обладающего широким спектром терапевтического действия, низким риском развития побочных эффектов и осложнений, в том числе за счет его использования перорально.
Существуют данные о повышении физической стабильности, растворимости, а также снижении иммуногенности и чувствительности к протеолитическим ферментам белков при их покрытии биологически индифферентными полимерами, конъюгации с определенными носителями (в том числе иммобилизации с помощью радиационных воздействий) [8, 9]. Тем не менее, сведений о возможности создания соединений белка, в том числе Г-КСФ, лишенных аллергизирующих (иммуногенных) свойств, а также способа создания препаратов на их основе, обладающих высокой специфической активностью, характерной для нативных белковых веществ, и одинаково эффективных при использовании парентерально и внутрь, на сегодняшний день не существуете. При этом известно, что процесс манипуляции разнородными субстанциями на молекулярном уровне, в том числе с использованием физических факторов, обладающих высокой энергией, может сопровождаться существенными изменениями стереохимической структуры исходных веществ, и в конечном итоге приводить к модификации их свойств, характер которой, однако, является непредсказуемым [10, 11]. Вместе с тем в настоящее время не существует данных о фармакологических преимуществах препаратов, полученных в результате иммобилизации биологически активных веществ с помощью ионизирующего излучения, перед соединениями, образующимися при конъюгировании тех же исходных субстанций, но химическим путем. То есть не известно существование качественных различий конечного продукта, связанных со способом его получения: технологии химического синтеза (с помощью которой получают пегфилграстим [2, 5]) и электроно-лучевой технологией иммобилизации (с помощью которой осуществляется получение предлагаемого средства). Кроме того, в мировой литературе, в принципе, нет сведений о возможности повышения биологической (фармакологической) активности белковых регуляторных молекул путем иммобилизации действующего вещества на носителях, не связанной с изменением исключительно их фармакокинетики (именно за счет изменения фармакокинетических параметров объясняется модификация свойств Г-КСФ при синтезе пегфилграстима).
Факт иммобилизации гранулоцитарного колониестимулирующего фактора на носителе с помощью ионизирующего излучения с достижением нового технического результата: создание средства, обладающего гемостимулирующим, мобилизующим стволовые клетки, гепатопротекторным и церебропротекторным действием, с низкой иммуногенностью, высокоэффективным при парентеральном и пероральном (энтеральном) приеме, для специалиста является не очевидным.
Заявляемые существенные признаки проявили в совокупности новые свойства, не вытекающие явным образом из уровня техники в данной области. Предлагаемое изобретение может быть использовано в экспериментальной биологии и медицине с выходом в практическое здравоохранение. Идентичной совокупности признаков при исследовании уровня техники по патентной и научно-медицинской литературе не обнаружено.
Исходя из вышеизложенного, следует считать заявляемое техническое решение соответствующим критериям: «Новизна», «Изобретательский уровень», «Промышленная применимость».
Эксперименты были проведены на 259 беспородных крысах обоего пола, массой 200-250 г, мышах-самцах линии CBA/CaLac в количестве 367 штук, массой 18-20 г, 54 морских свинках обоего пола массой 200-250 г. Животные получены из питомника отдела экспериментального биомедицинского моделирования НИИ фармакологии СО РАМН.
Настоящее изобретение иллюстрируется следующими примерами.
Пример 1
В 10% водный раствор полиэтиленгликоля с молекулярной массой 400 Да вносили Г-КСФ (ООО «Саентифик Фьючер Менеджмент», г.Новосибирск) до конечной концентрации 10 мг Г-КСФ в 1 мл 10% полиэтиленгликоля. Смесь перемешивали и облучали потоком ускоренных электронов в дозе 1,5 Мрад. Обработку проводили тормозным излучением, генерируемым ускорителем ИЛУ-6 с энергией электронов 2,5 МэВ, поглощенная доза от 2 кГр, скорость набора дозы 1,65 кГр/час. Получали конечный иммобилизиованный препарат в виде слегка опалесцирующего раствора. Выход готового продукта составляет 98,2%.
Пример 2
5% водный раствор гидроксиэтил-крахмала с молекулярной массой 1,5 кДа облучали потоком ускоренных электронов в дозе 1,5 Мрад. Обработку проводили тормозным излучением, генерируемым ускорителем ИЛУ-10 с энергией электронов 2,5 МэВ, поглощенная доза 10 кГр, скорость набора дозы 1,65 кГр/час. В облученный раствор вносили Г-КСФ (ООО «Саентифик Фьючер Менеджмент», г. Новосибирск) до конечной концентрации 10 мг Г-КСФ в 1 мл 5% гидроксиэтил-крахмале.
Смесь перемешивали 10 минут и получали конечный иммобилизиованный препарат в виде слегка опалесцирующего раствора. Выход готового продукта составляет 99,1%.
Пример 3
В 10,0% водный раствор поливинилпирролидона с молекулярной массой 4 кДа вносили Г-КСФ (ООО «Саентифик Фьючер Менеджмент», г.Новосибирск) до конечной концентрации 1 мг Г-КСФ в 1 мл. Затем смесь перемешивали 30 минут и облучали гамма-излучением в дозе 1,0 Мрад. Обработку проводили тормозным излучением, генерируемым ускорителем ИЛУ-10 с энергией электронов 2,5 МэВ, поглощенная доза 5 кГр, скорость набора дозы 1,65 кГр/час.
Препарат иммобилизованного Г-КСФ получали в виде прозрачного раствора. Выход готового продукта составляет 98%.
Пример 4
Проводили сравнительное изучение аллергизирующих (иммуногенных) свойств препаратов гранулоцитарного колониестимулирующего фактора, иммобилизированного на полиэтиленгликоле с помощью ионизирующей радиации (имГ-КСФ) (получен по примеру 1), и пегфилграстима («NEULASTIM», Щвейцария, Hoffmann-La Roche).
Препараты исследовались в одинаковых дозах (определяемых по содержанию Г-КСФ), которая была определена как оптимальная в отношении нормализации показателей крови у мышей с цитостатической миелосупрессией, и в 10 раз ее превышающей (содержание Г-КСФ 100 и 1000 мкг/кг соответственно). Оценка аллергизирующих свойств препарата проводилась с использованием следующих тестов: реакции общей анафилаксии, реакции специфической агломерации лейкоцитов, при внутрикожном и конъюнктивальном тестировании на морских свинках, реакции гиперчувствительности замедленного типа на мышах [12]. Обработку результатов проводили методом вариационной статистики с использованием t-критерия Стьюдента и непараметрического U-критерия Вилкоксона-Манна-Уитни.
Для сенсибилизации морских свинок препараты вводили: сначала 1 раз подкожно, затем в той же дозе 2 раза внутримышечно, через день, в область бедра. Анафилактогенные свойства препаратов Г-КСФ выявляли путем его внутрисердечного введения на 21-е сутки после последней сенсибилизирующей инъекции. Разрешающее тестирующее внутрисердечное введение препарата проводилось в дозе, равной суммарной сенсибилизирующей, т.е. 300 мкг/кг. Контролем служили несенсибилизированные морские свинки, которым препарат вводили внутрисердечно.
Учет интенсивности анафилактической реакции проводили с использованием формулы
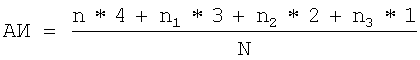 ,
,
где АИ - анафилактический индекс;
n - число животных, анафилактическая реакция которых заканчивалась смертельным исходом;
n1 - число животных со значительными проявлениями анафилактической реакции;
n2 - число животных со средними проявлениями реакции;
n3 - число животных со слабыми проявлениями реакции;
N - общее число животных в группе.
Для оценки кожно-сенсибилизирующих свойств препарата через 20 дней после окончания сенсибилизирующих инъекций на боковой поверхности тела морских свинок выстригали шерсть, и каждому животному внутрикожно вводили препарат имГ-КСФ, либо пегфилграстим в дозах 10 мкг/животное (50 мкг/кг) в 0,02 мл физиологического раствора (доза, не вызывающая визуальных изменений кожи у интактных морских свинок).
Реакцию кожи на введение препарата оценивали в баллах с учетом выраженности гиперемии и размеров гиперемированной области (средняя величина диаметра в миллиметрах). Были определены четыре степени гиперемии, которым соответствовали числовые индексы: сильная (+++) - 1,0; средняя (++) - 0,66; слабая (+) - 0,33; сомнительная (+/-) - 0,17. Умножение величины диаметра гиперемированной области на индекс соответствующей степени гиперемии позволило в едином показателе (баллы) выразить обе характеристики реакции.
На 20-й день после завершения цикла сенсибилизирующих инъекций проводилось конъюнктивальное тестирование. Тест заключался в закапывании в левый глаз каждого животного 0,02 мл физиологического раствора, содержащего 10 мкг препарата, в правый глаз - физиологического раствора в том же объеме. Оценка состояния конъюнктивы глаза проводилась через 4 и 24 часа после воздействия.
С целью подтверждения результатов, полученных вышеперечисленными тестами, использовалась реакция аллергодиагностики in vitro РСАЛ (реакция специфической агломерации лейкоцитов). Рабочая доза препаратов Г-КСФ для этой реакции составляла 2,5 мкг на 0,05 мл крови животного (50 мкг/мл).
На мышах сенсибилизацию проводили с использованием полного адьюванта Фрейнда (ПАФ). Препараты Г-КСФ вводили однократно подкожно в основание хвоста в 0,06 мл ПАФ, который был взят в соотношении 1:1 к объему раствора препарата. Доза препарата составляла 1000 мкг/кг. Контрольным животным вводили ПАФ в том же объеме.
Через 5 суток после инъекции опытным и контрольным мышам в подушечку одной из задних лап вводили препараты Г-КСФ в дозе 20 мкг/животное в 0,04 мл физиологического раствора (1000 мкг/кг), в другую лапу - физиологический раствор. Через 24 часа после второй инъекции с помощью инженерного микрометра типа МК измеряли толщину обеих лап. Величину реакции определяли как разницу в толщине опытной и контрольной лап, в миллиметрах.
В ходе эксперимента было установлено, что реакция морских свинок на внутрикожное введение препарата имГ-КСФ по таким визуальным показателям, как покраснение или отек, не отличалась от соответствующих показателей у животных, которым вводили дистиллированную воду, в то время как при введении пегфилграстима кожная реакция была достоверно более выражена. Конъюнкти-вальный тест и реакция аллергодиагностики in vitro не выявили признаков аллер-гизирующего действия ни у одного из препаратов Г-КСФ. В то же время при тестирующем внутрисердечном введении препаратов имГ-КСФ и пегфилграстима имело место статистически значимое увеличение анафилактического индекса в группе животных, получавших пегфилграстим, в то время как при введении имГ-КСФ АИ не отличался от такового в контрольной группе (табл.1).
Кроме того, изучение аллергизирующих (иммуногенных) свойств показало, что внутрикожные тестирующие инъекции имГ-КСФ и пегфилграстима не приводили к изменению величины реакции ГЗТ по сравнению с контрольным уровнем показателя через 4 и 24 часа после воздействия (табл.2).
Аналогичные результаты были получены при изучении имГ-КСФ, полученного при иммобилизации Г-КСФ на гидроксиэтил-крахмале и декстране.
Таким образом, препарат иммобилизированного с помощью ионизирующего излучения Г-КСФ не оказывает иммуногенного эффекта, проявляющегося аллергизацией организма, в то время как пегфилграстим обладает слабо выраженными аллергизирующими свойствами
Пример 5
Проведено экспериментальное изучение иммунотоксических свойств Г-КСФ, иммобилизированного на полиэтиленгликоле с помощью ионизирующего излучения (получен по примеру 2) [12]. В качестве препарата сравнения использовался пегфилграстим («NEULASTIM», Швейцария, Hoffmann-La Roche).
Препараты исследовались на мышах при подкожном введении в дозе 100 мкг/кг, которая была определена как терапевтическая (1 ТД) и в дозе на порядок ее выше - 1000 мкг/кг (10 ТД). Экспериментальная оценка иммунотоксических свойств препаратов Г-КСФ проводилась с использованием следующих тестов: предварительная оценка иммунотоксичности при однократном введении; изучение влияния препарата на массу и клеточность центральных и периферических органов иммунитета; оценка влияния препарата на фагоцитарную активность перитонеальных макрофагов; изучение влияния препарата на число антителообразующих клеток (АОК) после иммунизации эритроцитами барана (ЭБ); исследование влияния препарата на спонтанную и индуцированную митогенами пролиферацию спленоцитов.
Обработку результатов проводили методом вариационной статистики с использованием t-критерия Стьюдента и непараметрического U-критерия Вилкоксона-Манна-Уитни.
Курсовое введение имГ-КСФ в используемых дозах не оказывало влияния на массу и клеточность центральных и периферических органов иммунитета экспериментальных мышей, на уровень антителообразующих клеток после иммунизации животных эритроцитами барана, на пролиферативный ответ лимфоцитов. В то время как пегфилграстим приводил к снижению спонтанной пролиферативной активности лимфоцитов (на 5,8% от фона) при его добавлении в культуру в дозе 5 нг/мл.
Таким образом, в результате проведенных исследований установлено, что иммобилизированный с помощью ионизирующего излучения Г-КСФ не обладает иммунотоксическими свойствами.
Пример 6
Были проведены эксперименты по изучению гемопоэзстимулирующей активности имГ-КСФ (полученного по примеру 1). В качестве сравнения служил препарат пегфилграстима («NEULASTIM», Щвейцария, Hoffmann-La Roche).
Исследования гемостимулирующих свойств проводили на мышах линии СВА на модели миелосупрессии. Для этого всем животным вводили циклофосфан (ЦФ) в дозе 170 мг/кг. Затем мыши 1-й группы получали подкожно пегфилграстим, мыши 2-й группы - пегфилграстим перорально, животным 3-й группы подкожно вводили имГ-КСФ, а 4-й - имГ-КСФ перорально. Все препараты вводили в дозе 100 мкг/кг 2 раза: на 1 день после введения цитостатика и через 5 дней. Контрольным животным вводили физиологический раствор в соответствующих режимах. На 7, 10 дни опыта с помощью стандартных и культуральных гематологических методов определяли показатели периферической крови и костного мозга, а также число КОЕ-ГМ в костном мозге [13]. Обработку результатов проводили методом вариационной статистики с использованием t-критерия Стьюдента и непараметрического U-критерия Вилкоксона-Манна-Уитни.
Проведенные эксперименты позволили установить, что пероральное введение пегфилграстима не приводило к изменениям исследуемых показателей, свидетельствующее о неэффективности использования per os препарата Г-КСФ, иммобилизированного на носителе химическим способом. В остальных случаях в периферической крови возрастало содержание палочко- и сегментоядерных нейтрофилов, а также количество КОЕ-ГМ, незрелых и зрелых нейтрофильных гранулоцитов в гемопоэтической ткани. При этом наиболее выраженными были изменения в группе животных, получавших имГ-КСФ подкожно (табл.3). В то же время достаточно существенным оказался подъем данных показателей и у животных, получавших иммобилизованный Г-КСФ перорально.
Пример 7
Изучение мобилизующих стволовые клетки свойств имГ-КСФ были проведены на интактных мышах линии СВА. Для исследований использовали препарат имГ-КСФ, полученный по примеру 2. В качестве препарата сравнения служил пегфилграстим («NEULASTIM», Щвейцария, Hoffmann-La Roche). Режим введения препаратов был отобран в предварительных экспериментах как наиболее эффективный. Мыши 1-й группы получали подкожно пегфилграстим, мыши 2-й группы - пегфилграстим перорально, животным 3-й группы подкожно вводили имГ-КСФ, а 4-й - имГ-КСФ перорально. Все препараты вводили в дозе 100 мкг/кг 1 раз в день в течение 5-и дней. На 5, 7-е сут определяли количество мезенхимальных стволовых клеток (МСК) и грануломоноцито-эритро-мегакариоцитарных (КОЕ-ГЭММ) клеток-предшественников в периферической крови [1, 13, 14].
В ходе эксперимента было установлено, что парентеральное применение (но не пероральное) пегфилграстима, а также парентеральное и пероральное введение имГ-КСФ приводили к значительному увеличению содержания стволовых клеток в периферической крови. Причем максимальных значений увеличение показателей отмечалось при парентеральном введении имГ-КСФ, а изменение числа МСК и КОЕ-ГЭММ при пероральном использовании им Г-КСФ было на уровне такового при подкожном введении пегфилграстима (табл.4).
Пример 8
Были исследованы изменения морфофункционального состояния печени под действием иммГ-КСФ и пегфилграстима («NEULASTIM», Щвейцария, Hoffmann-La Roche) при моделировании хронического токсического гепатита.
Эксперименты были проведены на беспородных крысах массой 250-300 г. У крыс гепатит вызывали внутрижелудочным введением 50% раствора ССЦ (гепатотропный яд) на оливковом масле в дозе 2 мл/кг в течение 3-х недель 2 раза в неделю (6 раз).
По окончании моделирования хронического токсического поражения печени животные были поделены на 3 равные группы. Крысам 1-й группы в течение 5 дней подкожно вводили 100 мкг/кг пегфилграстима, растворенного в 0,5 мл растворителя. Первое введение осуществляли на следующий день после последнего введения тетрахлоруглерода. Животным 2-й группы подкожно вводили иммГ-КСФ в дозе 100 мкг/кг в течение 5 дней. Крысам 3-й группы внутрижелудочно вводили иммГ-КСФ в дозе 100 мкг/кг в течение 5 дней. Животным контрольной группы по той же схеме в эквивалентном объеме вводили физиологический раствор. Обработку результатов проводили методом вариационной статистики с использованием t-критерия Стьюдента и непараметрического U-критерия Вилкоксона-Манна-Уитни.
Для изучения состояния печени оценивали гибель крыс, проводили биохимические исследования содержания в сыворотке крови аспартат- и аланинаминотрансфераз (АсАТ, АлАТ) на 40-е сутки, а также морфологическое исследование печени на 40-е сутки опыта. Активность ферментов сыворотки крови определяли общепринятыми методами, используя полуавтоматический биохимический анализатор фирмы Cormay и стандартные наборы к нему. Кровь для исследования получали из бедренной артерии через катетер. На гистологических препаратах печени, окрашенных гематоксилином и эозином, определяли количество клеток инфильтрата с помощью окулярной сетки Автандилова, содержащей 25 тест-точек. В 20 полях зрения подсчитывали количество клеток, попадающих на тест-точки сетки. Относительную площадь инфильтрации высчитывали как отношение точек сетки, приходящихся на клетки инфильтрата, ко всем точкам сетки в 20 полях зрения. Площадь соединительной ткани определяли с помощью средств компьютерной обработки графических данных. Для этого на стандартной площади среза печени (последовательные микрофотографии 10 полей зрения, выполненные микровидеокамерой “Digital micro”, с программой передачи изображения на компьютер фирмы «Элекард», Томск) измеряли площадь структур, окрашенных пикрофуксином, и вычисляли процентное отношение к выбранной стандартной площади.
Проведенные эксперименты показали, что гибель крыс в группах животных, получавших препараты Г-КСФ, была значительно ниже, чем в контроле (35,6%). При этом при подкожном введении имГ-КСФ гибели крыс не отмечалось. Биохимические исследования сыворотки крови выявили повышение активности АлАТ, и АсАТ и ЩФ на 40-е сутки опыта после начала введения CCl4 в контрольной группе (табл.5). В то же время пегфилграстим практически не влиял на содержание ферментов в сыворотки крови. Вместе с тем как парентеральное, так и пероральное использование имГ-КСФ сопровождалось существенным падение их активности.
При исследовании гистологических препаратов печени в контрольной группе крыс отмечалось выраженное нарушение долькового строения органа. На препаратах были видны поля грануляционной ткани, замещающей погибшие гепатоциты, в которых происходило новообразование сосудов и печеночных протоков. В сохранившихся гепатоцитах наблюдалась выраженная крупнокапельная жировая дистрофия. В то же время имела место значительная регенерационная гипертрофия печеночных клеток. Введение пегфилграстима, либо иммГ-КСФ при моделировании CCl4-гепатита сохраняло дольковое строение печени, а жировая дистрофия гепатоцитов была преимущественно мелкокапельная. У опытных животных отмечалась менее выраженная инфильтрация портальных трактов.
В целом относительная площадь инфильтрации была достоверно ниже, чем в контрольной группе. Кроме того, препараты Г-КСФ существенно уменьшали и площадь соединительной ткани (табл.6). При этом наиболее выраженный гепа-топротекторный эффект имел место при подкожном введении заявляемого имГ-КСФ. Вместе с тем значительной терапевтической активностью данный препарат обладал и при пероральном введении, причем таковая была сопоставима с парентеральным примением пегфилграстима.
Таким образом, иммобилизированный с помощью ионизирующей радиации Г-КСФ обладает выраженными гепатопротекторными свойствами как при парентеральном, так и при пероральном введении. При этом механизмом его действия, очевидно, являются стимуляция и мобилизация стволовых клеток костного мозга с их дальнейшим детерминированным хомингом в печеночную ткань и диффе-ренцировкой в тканеспецифичные элементы [1, 3].
Пример 9
В эксперименте на мышах проводили исследование церебропротекторных эффектов имГ-КСФ на модели гипоксической энцефалопатии. Оценку состояния центральной нервной системы животных производили по регистрации показателей психоневрологического статуса: условно-рефлекторной деятельности и ориентировочно-исследовательскому поведению животных в открытом поле.
Энцефалопатия моделировалось с помощью термокамеры объемом 500 мл. Мыши помещались в термокамеру, крышка закрывалась, и мыши оставались там до атонального судорожного припадка или остановки дыхания, определяемой визуально, в течение 10-15 секунд. После извлечения из термокамеры и восстановления самостоятельного дыхания, через 5-10 минут, мыши вновь помещались в термокамеру также до наступления атонального состояния (генерализованного судорожного припадка или остановки дыхания). Мыши 1-й группы получали подкожно пегфилграстим («NEULASTIM», Щвейцария, Hoffmann-La Roche), мыши 2-й группы - перорально пегфилграстим («NEULASTIM», Щвейцария, Hoffmann-La Roche), животным 3-й группы подкожно вводили имГ-КСФ, а 4-й - имГ-КСФ перорально. Все препараты вводили в дозе 100 мкг/кг 1 раз в день в течение 5-и дней, начиная сразу после воздействия. Контрольным животным вводили физиологический раствор в соответствующих режимах. Через 1 сутки после моделирования энцефалопатии у животных вырабатывался условный рефлекс пассивного избегания, проверка сохранности рефлекса и ориентировочно-исследовательского поведения в открытом поле осуществлялась на 14, 21-е сут опыта. Обработку результатов проводили методом вариационной статистики с использованием t-критерия Стьюдента и непараметрического U-критерия Вилкоксона-Манна-Уитни.
В ходе эксперимента гипоксическое воздействие приводило к формированию энцефалопатии. Так, наблюдалось статистически значимое увеличение общей двигательной активности мышей в открытом поле, числа горизонтальных перемещений и повышение коэффициента асимметрии движений. В то же время отмечалось резкое падение уровня воспроизведения условного рефлекса пассивного избегания и спонтанная смертность животных на протяжении всего периода наблюдения, достигающая на 21-е сут 35,7%.
Терапевтический эффект пегфилграстима проявлялся только при его подкожном введении, в то время как препарат имГ-КСФ оказывал лечебное действие при парентеральном и пероральном назначении. Причем в обоих случаях (введения имГ-КСФ) церебропротекторный эффект был выше, чем у пегфилграстима при его подкожном применении. Более того, подкожное введение имГ-КСФ полностью отменяло появление признаков энцефалопатии (табл.7, 8).
Кроме того, с помощью культуральных методов на 7-е сут опыта определялось содержание нейральных предшественников в паравентрикулярной области головного мозга [4]. В ходе исследований было обнаружено значительное увеличение их числа у животных, получавших подкожно пегфилграстим, подкожно и перорально имГ-КСФ. При этом наибольших величин достигало изменение данного параметра именно в группах животных, которым вводили имГ-КСФ (табл.9).
Таким образом, препарат им Г-КСФ обладал выраженным лечебным действием в отношении постгипоксической энцефалопатии, причем его терапевтический эффект значительно превосходил эффект терапии с помощью препарата аналога - пегфилграстима. При этом действие имГ-КСФ было связано со стимуляцией механизмов регенерации «глубокого» резерва, определяемых функциональной активностью эндогенных стволовых клеток организма.
Пример 10
В двух вариантах изучали действие препаратов Г-КСФ на гранулоцитарные прекурсоры (основные клетки-мишени Г-КСФ [13]. Обработку результатов проводили методом вариационной статистики с использованием t-критерия Стьюдента и непараметрического U-критерия Вилкоксона-Манна-Уитни.
При первом варианте неприлипающие клетки костного мозга (в концентрации 105 миелокариоцитов/мл) помещали в полувязкую 1%-метилцеллюлозную культуральную среду следующего состава: 50% среды RPMI, 20% инактивированной эмбриональной телячей сыворотки, 6 г/л глюкозы, 280 мг/л L-глутамина, 50 мг/л гентамицина. Затем в одном случае добавляли 5 нг/мл пегфилграстима, а в другом 5 нг/мл имГ-КСФ, и инкубировали в CO2-инкубаторе при 37°С, 5% CO2 и 100%) влажности воздуха в течение 7 сут. В контроле добавляли соответствующий объем 10%) р-ра полиэтиленгликоля. После чего производили подсчет гранулоцитарных колоний (КОЕ-Г), отражающих содержание основных клеток-мишеней Г-КСФ[13].
При этом значительно более выраженный рост КОЕ-Г отмечался при добавлении имГ-КСФ (табл.10, А). Вместе с тем при длительном культивировании клеточного материала ответ КОЕ-Г мог быть связан с более выраженной физической устойчивостью иммобилизированного с помощью ионизирующего излучения Г-КСФ в модели биологической среды. Для изучения степени выраженности прямого действия препаратов Г-КСФ на прогениторные клетки, связанного исключительно с уровнем (степенью) активации под их влиянием специфических рецепторов, были проведены эксперименты другого дизайна.
Для этого неприлипающие клетки костного мозга (в концентрации 105 миелокариоцитов/мл) помещали в культуральную среду следующего состава: 90% среды RPMI, 10%» инактивированной эмбриональной телячей сыворотки, 6 г/л глюкозы, 280 мг/л L-глутамина, 50 мг/л гентамицина. Затем в первом случае добавляли 30 нг/мл пегфилграстима, а в другом 30 нг/мл имГ-КСФ, и инкубировали в CO2-инкубаторе при 37°С, 5% CO2 и 100%) влажности воздуха в течение 1 сут. В контроле добавляли соответствующий объем 10% р-ра полиэтиленгликоля.
При этом количество Г-КСФ и время инкубации были отобраны в предварительно проведенных исследованиях, на основании которых было сделано заключение о том, что используемая концентрация Г-КСФ и срок преинкубации клеток с препаратами позволяют оценивать именно уровень активации рецептора к Г-КСФ, т.к. дальнейшее увеличение содержания препаратов цитокина в культуральной среде уже не способно повышать степень ответа кроветворных прекурсоров (происходит полное насыщение - задействован весь рецепторный аппарат клетки), а срок максимальной биологической активности данных веществ в заданных условиях превышает 1 сут.
Затем клетки отмывали центрифугированием, помещали их в полувязкую метилцеллюлозную среду и инкубировали в CO2-инкубаторе при 37°С, 5% CO2 и 100% влажности воздуха в течение 7 сут. После чего подсчитывали количество гранулоцитарных колоний.
В ходе исследования, как и в предыдущем случае, была показана значительно более высокая стимулирующая активность имГ-КСФ в отношении прогениторных клеток (табл.10, Б).
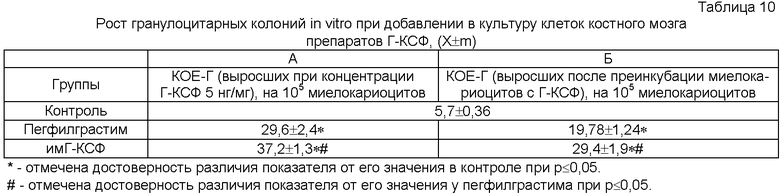
Таким образом, Г-КСФ, иммобилизированный на носителе с помощью ионизирующего излучения, обладает значительно более высокой специфической активность, чем пегфилграстим, в том числе не связанной с физической стойкостью препарата в биологической среде.
Полученные результаты позволяют сделать вывод, что более выраженная эффективность действия имГ-КСФ in vivo связана с повышением степени реализации потенциала рецептор-опосредованной активации функций прогениторных клеток.
В целом, исходя из полученных данных следует, что средство, представляющее собой гранулоцитарный колониестимулирующий фактор, иммобилизированный на водорастворимом носителе с помощью ионизирующего излучения, обладает выраженной гемостимулирующей, мобилизующей стволовые клетки, гепатопротекторной и церебропротекторной активностями - регенеративной активностью. При этом эффективность данного средства значительно превышает таковую у Г-КСФ, конъюгированного (иммобилизированного) с носителем химическим путем (пегфилграстим). Более того, технология получения данного средства позволяют эффективно его использовать в гематологии и регенеративной медицине не только парентерально, но и внутрь.
Литература
1. Гольдберг Е.Д., Дыгай A.M., Жданов В.В., Зюзьков Г.Н. и др. Фармакологические аспекты регенеративной медицины. // Бюл. эксперим. биол. и медицины. - 2008. - Приложение 2. - С.14-21.
2. Tricot G., Barlogie В., Zangari М., van Rhee F. e.a. Mobilization of peripheral blood stem cells in myeloma with either pegfilgrastim or filgrastim following chemotherapy. Haematologica. 2008 Nov; 93(11): 1739-42. Epub 2008 Aug 25.
3. Патент (RU) на изобретение №2295971 «Способ терапии экспериментального хронического токсического гепатита», 2007 г. (опубл. 27.03.2007 г., Бюл. №9). Авторы: Гольдберг Е.Д., Дыгай A.M., Жданов В.В., Зюзьков Г.Н. и др.
4. Патент (RU) на изобретение №2284060 «Способ экспериментальной терапии энцефалопатии», 2006 г.(опубл. 20.09.2006 г., Бюл. №26). Авторы: Гольдберг Е.Д., Дыгай A.M., Зюзьков Г.Н., Жданов В.В., Суслов Н.И.
5. Piedmonte D.M., Treuheit M.J. Formulation of Neulasta (pegfilgrastim). Adv Drug Deliv Rev. - 2008. Jan 3; 60(1):50-8.
6. Anderson J.A. Allergic reactions to drugs and biologic agents. JAMA. - 1992 - vol.268. - p.2845-2857.
7. De Swarte R.D., Drug allergy. In: Patterson R. e.a. Allergic Diseases Diagnosis and Management, 4th ed. Philadelphia, Pa^ J.B. Lippincott. - 1993 - p.396-551.
8. Veronese F.M., Mero A. The impact of PEGylation on biological therapies. BioDrugs. 2008; 22(5):315-29.
9. Vereschagin E.I., Khan Do-Hung, et al. Radiation Technology in the Preparation of Polyethylene Oxide Hydrophilic Gels and Immobilization of Proteases for Use in Medical Practice. // Arch. Pharm. Res. - 2001. - V.24. - N3. - P.229-233.
10. Сейфулла Р.Д., Тимофеев А.Б., Орджоникидзе З.Г. и др. Проблемы использования нанотехнологии в фармакологии. // Экспериментальная и клиническая фармакология. - 2008. - №1. - С.61-69.
11. Евдокимов Ю.М. Пространственно упорядоченные формы ДНК и ее комплексов - основа создания наноконструкций для медицины и биохетнологий. // Российские нанотехнологии. - 2006. - №1-2. - С.256-264.
12. Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. / Под ред Р.У.Хабриева. - 2 изд. - М.: ОАО «Изд-во Медицина, 2005. - С.54-69.
13. Гольдберг Е.Д., Дыгай A.M., Шахов В.П. Методы культуры ткани в гематологии. - Томск: Изд-во ТГУ, 1992. - 272 с.
14. In't Anker P.S., Noort W.A., Scherjon S.A. e.a. Mesenchymal stem cells in human second-trimester bone marrow, liver, lung, and spleen exhibit a similar immunophenotype but a heterogenous multilineage differentiation potential // Haematologica. - 2003. - Vol.88. - P.845-852.
| название | год | авторы | номер документа |
|---|---|---|---|
| СРЕДСТВО, УСИЛИВАЮЩЕЕ МОБИЛИЗАЦИЮ СТВОЛОВЫХ КЛЕТОК | 2009 |
|
RU2442601C2 |
| СРЕДСТВО, УСИЛИВАЮЩЕЕ ДЕЙСТВИЕ БИОЛОГИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ И ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ | 2009 |
|
RU2421239C1 |
| СРЕДСТВО КОРРЕКЦИИ ОТДАЛЕННЫХ ПОСЛЕДСТВИЙ НАРУШЕНИЙ СПЕРМАТОГЕНЕЗА, ВЫЗВАННЫХ ЦИТОСТАТИЧЕСКИМ ВОЗДЕЙСТВИЕМ | 2013 |
|
RU2535002C2 |
| СРЕДСТВО, УВЕЛИЧИВАЮЩЕЕ РЕЗЕРВ СТВОЛОВЫХ КЛЕТОК В ОРГАНИЗМЕ | 2009 |
|
RU2405822C1 |
| СРЕДСТВО ДЛЯ СТИМУЛЯЦИИ РОСТА ОРГАНИЗМА | 2011 |
|
RU2452509C1 |
| Средство для коррекции повреждений яичников, вызванных цитостатическим воздействием | 2021 |
|
RU2785397C1 |
| ГЕМОСТИМУЛИРУЮЩЕЕ СРЕДСТВО | 2010 |
|
RU2437675C1 |
| ГЕМОСТИМУЛИРУЮЩЕЕ СРЕДСТВО И СПОСОБ СТИМУЛЯЦИИ ГЕМОПОЭЗА | 2009 |
|
RU2414926C1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ РЕГЕНЕРАТИВНОЙ АКТИВНОСТЬЮ | 2011 |
|
RU2480236C1 |
| СПОСОБ КОРРЕКЦИИ НАРУШЕНИЙ ЭРИТРОПОЭЗА ПРИ ЭКСПЕРИМЕНТАЛЬНОЙ ЭНЦЕФАЛОПАТИИ | 2005 |
|
RU2302664C2 |
Изобретение относится к медицине, а именно к фармакологии и клеточным технологиям. Средство, обладающее регенеративной активностью, представляет собой гранулоцитарный колониестимулирующий фактор, иммобилизированный на водорастворимых полимерах с молекулярной массой 400-4000 Да. При этом гранулоцитарный колониестимулирующий фактор иммобилизирован на полимерах с помощью ионизирующего излучения - потока ускоренных электронов с энергией 2,5 МэВ, поглощенной дозой от 2 до 10 кГр и скоростью набора дозы 1,65 кГр/час. Средство заявленного изобретения не имеет иммуногенности, является высокоэффективным как при парентеральном, так и при пероральном введении. 10 табл.
Средство, обладающее регенеративной активностью и представляющее собой иммобилизированный на водорастворимых полимерах с молекулярной массой 400-4000 Да гранулоцитарный колониестимулирующий фактор, отличающееся тем, что гранулоцитарный колониестимулирующий фактор иммобилизирован на полимерах с помощью ионизирующего излучения - потока ускоренных электронов с энергией 2,5 МэВ, поглощенной дозой от 2 до 10 кГр и скоростью набора дозы 1,65 кГр/ч.
| PIEDMONTE DM et al | |||
| Formulation of Neulasta (pegfilgrastim) | |||
| Adv Drug Deliv Rev., 2008, 60(1), p.50-8, PMID: 17822802, реф., найдено в PubMed, найдено 13.05.2010 | |||
| RU 2000122310 А, 10.08.2002 | |||
| 0 |
|
SU401384A1 | |
| Стабилизированный источник питания | 1973 |
|
SU473268A1 |
| VERESCHAGIN El et al | |||
| Radiation technology in the preparation of polyethylene oxide hydrophilic gels and | |||
Авторы
Даты
2010-12-20—Публикация
2009-03-05—Подача