Область техники
Изобретение относится к новому химическому соединению, которое может быть использовано как исходное вещество для получения нового замещенного металлфталоцианина, а именно октакис-[2,3,9,10,16,17,24,25-(α/β-D-галактопиранозо-6'-ил)]фталоцианина цинка, проявляющего свойства красителя.
Уровень техники
Основными требованиями, предъявляемыми к прямым красителям, являются растворимость в воде, наличие заместителей и группировок, атомы которых способны участвовать в образовании водородных связей с оксигруппами целлюлозы. Таким требованиям отвечают растворимые в воде фталоцианиновые соединения, в частности дисульфокислота фталоцианина меди (Прямой бирюзовый светопрочный) и смесь красителей на основе фталоцианина меди, имеющих в своем составе точно неустановленное число и местоположение сульфо- и сульфоамидных заместителей (Прямой бирюзовый светопрочный К) /Степанов Б.И. Введение в химию и технологию органических красителей. М.: Химия, 1977 г., 488 с./. Эти соединения получают введением соответствующих заместителей в молекулу фталоцианина меди. Еще одним методом получения замещенных фталоцианинов является конденсация замещенных 1,3-дииминоизоиндолинов /Neil В.McKeown. The Synthesis of Symmetrical Phthalocyanines. In The Porphyrin Handbook. M.Kadish, K.M.Smith, R.Guilard, Eds. Volume 15. Phthalocyanines: Synthesis, p.61-124/.
Наиболее близким аналогом заявляемого соединения является 5,6-бис(3',5'-дитретбутилфенокси)-1,3-дииминоизоиндолин формулы
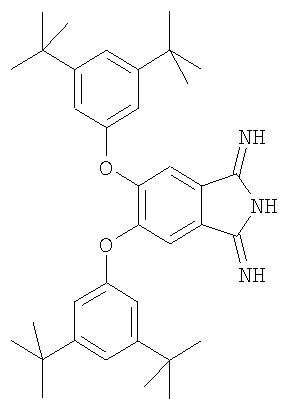
На основе этого соединения получают 2,3,9,10,16,17,23,24-октакис(3',5'-дитретбутилфенокси)фталоцианин и его комплекс с индием /М.John Plater, Adam Jeremiah and Grant Bourhill. Synthesis of soluble halogenated aryloxy substituted indium phthalocyanines. J. Chem. Soc., Perkin Trans. 1, 2002, p.91-96/.
Эти фталоцианины обладают очень хорошей растворимостью в органических растворителях, однако они не растворимы в воде.
Сущность изобретения
Изобретательская задача заключалась в поиске соединения, являющегося замещенным 1,3-дииминоизоиндолином, которое при использовании его в качестве исходного соединения дало бы возможность синтезировать октакис-[2,3,9,10,16,17,24,25-(α/β-D-галактопиранозо-6'-ил)]фталоцианин цинка, хорошо растворимый в воде, обладающий способностью окрашивать целлюлозные волокна в глубокий цвет и при этом прочно фиксироваться на них.
Поставленная задача решена 5,6-бис-(1',2':3',4'-ди-O-изопропилиден-α-D-галактопиранозо-6'-ил)-1,3-дииминоизоиндолином формулы
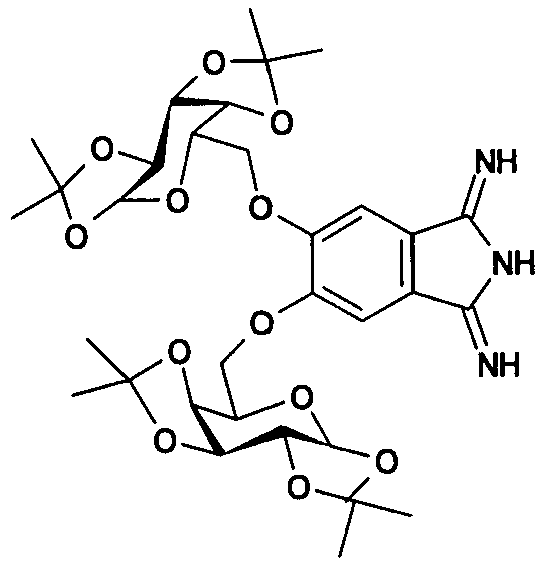
Изобретение позволяет получить следующие преимущества:
- использование 5,6-бис-(1',2':3',4'-ди-O-изопропилиден-α-D-галактопиранозо-6'-ил)-1,3-дииминоизоиндолина в качестве исходного вещества дает возможность синтезировать октакис-[2,3,9,10,16,17,24,25-(α/β-D-галактопиранозо-6'-ил)]фталоцианин цинка, хорошо растворимый в воде;
- полученный на основе заявляемого соединения октакис-[2,3,9,10,16,17,24,25-(α/β-D-галактопиранозо-6'-ил)]фталоцианин цинка окрашивает целлюлозное волокно в зеленый цвет из нейтральных красильных ванн, проявляя тем самым свойства прямых красителей;
- окраски, полученные с применением октакис-[2,3,9,10,16,17,24,25-(α/β-D-галактопиранозо-6'-ил)]фталоцианина цинка, отличаются хорошей прочностью, а интенсивность окраски сохраняется после физико-механических воздействий.
Структура заявляемого соединения подтверждена данными 1Н и 13С ЯМР спектроскопии, а также масс-спектрометрии (LC-MS эксперимент). 1H ЯМР (400 МГц, CDCl3): δ=7.49 (с, 2Н, Н-Ar), 5.51 (д, J1,2=5.0 Гц, 2Н, Н-1, Н-1'), 4.62 (дд, J2,3=2.6 Гц, J3,4=8.0 Гц, 2Н, Н-3, Н-3'), 4.43 (д, J4,5<1.0 Гц, 2Н, Н-4, Н-4'), 4.30 (дд, 2Н, Н-2, Н-2'), 4.20-4.16 (м, 6Н, Н-5, Н-5', H-6a,b, Н-6а',b'), 3.75-3.59 (м, 3Н, NH), 1.45, 1.42, 1.31, 1.30 (4с, 24Н, СН3), 1.42 (с, 6Н, СН3), 1.32 (с, 12Н, СН3) м.д. 13С ЯМР (100 МГц, ДМСО-d6) δ=152.7 (2С, CAr-О), 109.8 (2С, С(СН3)2), 109.1 (2С, С(СН3)2), 96.7 (2С, С-1, С-1'), 26.3, 25.4, 24.7, 23.4 (8С, 2С, 2С, 2С, 2С, СН3) м.д. MS (LS-MS), m/z=684 [M+Na]+.
В масс-спектре присутствует сигнал при m/z=684, соответствующий сумме молекулярного иона и катиона натрия. Положение сигналов протонов в 1Н ЯМР и сигналов атомов углерода в 13С ЯМР спектрах и их интегрирование полностью подтверждают структуру заявляемого соединения. Характерными в этом случае является мультиплет в области 3.7 м.д., соответствующий трем иминным протонам.
Сведения, подтверждающие возможность воспроизведения изобретения
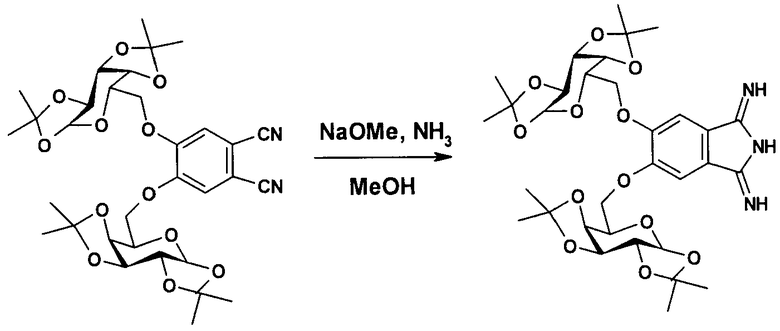
Заявляемое соединение получено из 4,5-бис-(1',2':3',4'-ди-O-изопропилиден-α-D-галактопиранозо-6'-ил)фталонитрила по схеме
Для этого были использованы следующие реагенты:
- метиловый спирт ГОСТ 2222-78, CAS 67-56-1;
- натрия метилат (Sodium methylate) - Acros Organics, CAS №124-41-4;
- аммиак жидкий технический ГОСТ 6221-90;
- 4,5-бис-(1',2':3',4'-ди-O-изопропилиден-α-D-галактопиранозо-6'-ил)фталонитрил, который является новым соединением, поэтому был получен нами из 1,2-дибром-4,5-дифторбензола в две стадии.
Стадия 1.
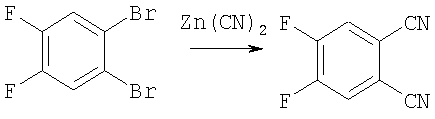
Стадия 2.
Стадия 1. Получение 4,5-дифторфталонитрила.
В двугорлой колбе растворяли 272 мг (1 ммоль) 1,2-дибром-4,5-дифторбензола и 20 мг полиметилгидросилоксана (PMHS) в 2 мл N,N-диметиацетамида при комнатной температуре. Реакционную массу нагревали до температуры 120°С и добавляли 20 мг трис-дибензилиденацетондипалладия (Pd2(dba)3) и 15 мг 1,1'-бис(дифенил-фосфино)ферроцена (DPPF). Затем в 4-5 порций добавляли 117 мг (1 ммоль) цианистого цинка (Zn(CN)2) в течение 3 ч. Окончание реакции определяют при помощи ТСХ. Затем реакционную смесь охлаждали до комнатной температуры, разбавляли этилацетатом и фильтровали. Фильтрат промывали водой, сушили над сульфатом магния и концентрировали в вакууме. Полученный остаток хроматографировали на силикагеле с использованием дихлорметана в качестве элюента. Выход 4,5-дифторфталонитрила после удаления растворителя и сушки в вакууме составил 151 мг (92%). 1Н ЯМР (400 МГц, CDCl3): δ=7.66 (с, 2Н, Н-Ar) м.д. ИК (табл. KBr): ν=3129, 3064, 2244, 1799, 1613, 1583, 1510, 1414, 1322, 1204, 1076, 908, 828, 654, 537 см-1. MS (EI), m/z=164 [М]+(100%).
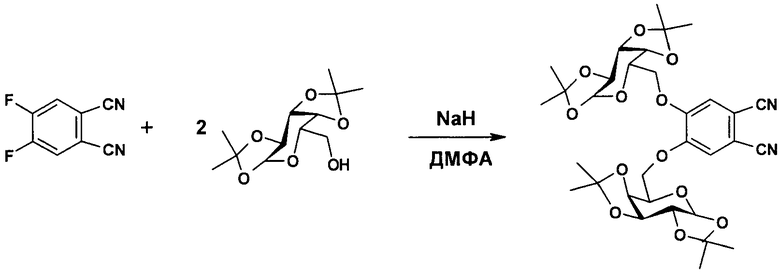
Стадия 2. Получение 4,5-бис-(1',2':3',4'-ди-O-изопропилиден-α-D-галактопиранозо-6'-ил)фталонитрила.
К смеси 5.2 г (20 ммоль) 1,2:3,4-ди-О-изопропилиден-α-D-галактопиранозы и 1.64 г (10 ммоль) 4,5-дифторфталонитрила в 50 мл ДМФА порциями прибавляли 0.8 г (20 ммоль) NaH и полученную смесь перемешивали при 35-40°С 2 дня. Затем охлажденную до комнатной температуры реакционную смесь выливали в воду, выпавший осадок отфильтровывали и сушили в вакууме. Очистку проводили колоночной хроматографией на силикагеле, используя смесь толуол-ацетон (5:1) в качестве элюента. Выход 4,5-бис-(1',2':3',4'-ди-О-изопропилиден-α-D-галактопиранозо-6'-ил)фталонитрила составил 6.2 г (96%). Т.пл.=198°С. 1Н ЯМР (400 МГц, CDCl3): δ=7.17 (с, 2Н, Н-Ar), 5.51 (д, J1,2=5.0 Гц, 2Н, Н-1, Н-1'), 4.63 (дд, J2,3=2.5 Гц, J3,4=7.9 Гц, 2Н, Н-3, Н-3'), 4.37 (д, J4,5<1.0 Гц, 2Н, Н-4, Н-4'), 4.32 (дд, 2Н, Н-2, Н-2'), 4.20-4.13 (м, 6Н, Н-5, Н-5', Н-6а,b, Н-6а',b'), 1.49 (с, 6Н, СН3), 1.42 (с, 6Н, СН3), 1.32 (с, 12Н, СН3) м.д. 13С ЯМР (100 МГц, ДМСО-d6) δ=152.0 (2С, CAr-О), 116.7 (2С, CAr-Н), 115.5 (2С, CN), 109.4 (2С, CAr-CN), 108.8 (2С, С(СН3)2), 108.6 (2С, С(СН3)2), 96.1 (2С, С-1, С-1'), 70.4, 70.3, 68.1, 66.1 (8С, 2С, 2С, 2С, 2С, СН3) м.д. ИК (табл. KBr): ν=2987, 2933, 2231, 1590, 1519, 1370, 1212, 1115, 1003, 920, 536 см-1. MS (FTICR), m/z=644 [М]+.
М=644.7 Найдено, %: С - 59.78, Н - 6.32, N-4.10
C32H40N2O12 Вычислено, %: С - 59.62, Н - 6.25, N - 4.35.
Пример 1. Получение заявляемого 5,6-бис-(1',2':3',4'-ди-O-изопропилиден-α-D-галактопиранозо-6'-ил)-1,3-дииминоизоиндолина.
К охлажденному до 0°С раствору 502 мг (9.3 ммоль) метилата натрия в 40 мл смеси метанол-тетрагидрофуран (1:1) добавляли при перемешивании 6.0 г (9.3 ммоль) 4,5-бис-(1,2:3,4-ди-О-изопропилиден-α-D-галактопиранозо-6-ил)фталонитрила. Через полученный раствор пропускали газообразный аммиак сначала 30 мин при комнатной температуре, затем 1 час при кипении реакционной смеси. Затем смесь выливали в воду, выпавший осадок отфильтровывали, промывали холодным метанолом, сушили в вакууме. Выход 5,6-бис-(1',2':3',4'-ди-O-изопропилиден-α-D-галактопиранозо-6'-ил)-1,3-дииминоизоиндолина составил 5.9 г (95%).
Пример 2. Использование заявляемого соединения как исходного для получения октакис-[2,3,9,10,16,17,24,25-(α/β-D-галактопиранозо-6'-ил)]фталоцианина цинка, проявляющего свойства красителя.
Октакис-[2,3,9,10,16,17,24,25-(α/β-D-галактопиранозо-6'-ил)]фталоцианин цинка, который может быть использован для крашения целлюлозных волокон в зеленый цвет может быть получен из 5,6-бис-(1',2':3',4'-ди-О-изопропилиден-α-D-галактопиранозо-6'-ил)-1,3-дииминоизоиндолина в две стадии.
Стадия 1. Получение октакис-[2,3,9,10,16,17,24,25-(1',2':3',4'-ди-O-изопропилиден-α-D-галактопиранозо-6'-ил)]фталоцианина цинка
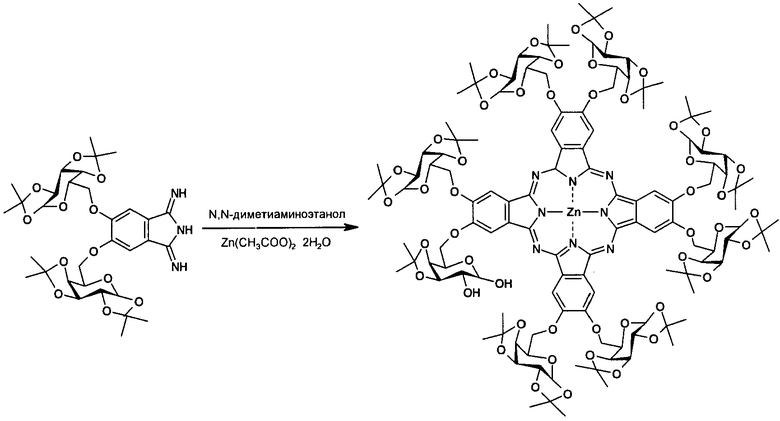
Смесь 661 мг (1 ммоль) 5,6-бис-(1',2':3',4'-ди-O-изопропилиден-α-D-галактопиранозо-6'-ил)-1,3-дииминоизоиндолина и 110 мг (0.5 ммоль) двухводного ацетата цинка в 1 мл диметиламиноэтанола кипятили в течение 24 часов. Затем охлажденную до комнатной температуры реакционную массу выливали в 20 мл 50%-ного водного метанола. Выпавший осадок отфильтровывали, промывали смесью вода-метанол (1:1) и сушили в вакууме. Продукт очищали колоночной хроматографией на силикагеле, используя в качестве элюента смесь гексан-этилацетат (1:1) для отделения примесей и затем этилацетат для элюирования готового продукта. Выход октакис-[2,3,9,10,16,17,24,25-(1',2':3',4'-ди-О-изопропилиден-α-D-галактопиранозо-6'-ил)]-фталоцианина цинка составил 198 мг (30%). 1Н ЯМР (400 МГц, ДМСО-d6): δ=7.16 (с, 8Н, Н-Ar), 5.66 (д, J1,2=4.8 Гц, 8Н, Н-1), 4.76-4.43 (м, 48Н, Н-2, Н-3, Н-4, Н-5, Н-6), 1.53-1.36 (м, 96Н, СН3) м.д. 13С ЯМР (100 МГц, ДМСО-d6) δ=109.8 (8С, С(СН3)2), 109.1 (8С, С(СН3)2), 96.9, 96,7 (8С, С-1, С-1'), 26.5, 26.3, 25.5, 25.3, 24.8, 24.7 (32С, СН3) м.д. ИК (табл. KBr): ν=2987, 2936, 1609, 1492, 1456, 1383, 1281, 1211, 1070, 1005, 891, 748, 511 см-1. ЭСП (ДМСО), λmax (log ε)=669 (4.95), 604 (4.48), 352 (4.91), 289 (4.67) нм. MS (MALDI-TOF), m/z=2643 [М]+.
М=2642.2 Найдено, %: С - 58.35, Н - 6.10, N - 4.12
C128H160N8O48Zn Вычислено, %: С - 58.14, Н - 6.10, N - 4.24.
Стадия 2. Получение октакис-[2,3,9,10,16,17,24,25-(α/β-D-галактопиранозо-6'-ил)]фталоцианина цинка.
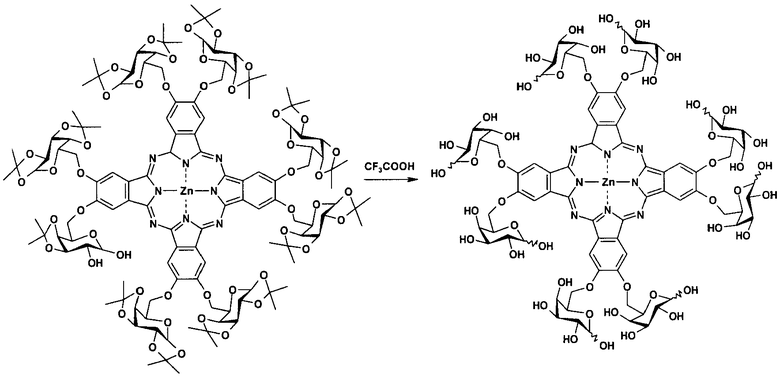
Раствор 100 мг октакис-[2,3,9,10,16,17,24,25-(1,2:3,4-ди-О-изопропилиден-α-D-галактопиранозо-6-ил)]фталоцианина цинка в 10 мл 90%-ной водной трифторуксусной кислоты перемешивали при комнатной температуре в течение 4 часов. Затем кислоту нейтрализовали медленным добавлением водного раствора карбоната натрия и полученную смесь концентрировали в вакууме. Полученный остаток очищали методом высокоэффективной жидкостной хроматографии, используя смесь ацетонитрил-вода в качестве элюента. Выход 60 мг (81%). 1Н ЯМР (400 МГц, ДМСО-d6): δ=8.99 (с, 8Н, Н-Ar), 5.66-3.71 (м, 56Н) м.д. ИК (табл. KBr): ν=3428, 2925, 1716, 1637, 1495, 1399, 1256, 1074, 744, 616, 580 см-1. ЭСП (ДМСО), λmax (log ε)=679 (4.67), 613 (3.90), 360 (4.34), 291 (4.12) нм. MS (MALDI-TOF), m/z=2001 [М]+.
Пример 3. Крашение целлюлозного волокна с применением октакис-[2,3,9,10,16,17,24,25-(α/β-D-галактопиранозо-6'-ил)]фталоцианина цинка.
Образец хлопчатобумажной ткани пропитывали в течение 30 с при температуре 40°С в красильном растворе, содержащем 2 г/л октакис-[2,3,9,10,16,17,24,25-(α/β-D-галактопиранозо-6-ил)]фталоцианина цинка и 2.5 г/л карбоната натрия. Затем образец отжимали до 100% и, не проводя операцию фиксации красителя, сушили на воздухе. Устойчивость окраски к стирке оценивали в растворе олеинового мыла (5 г/л) при температуре 40°С в течение 30 мин. Интенсивность окраски (K/S) оценивали по коэффициенту отражения, полученному на приборе «Spekol-11».
Интенсивность окраски до стирки - 3.031, а после стирки - 3.000.
| название | год | авторы | номер документа |
|---|---|---|---|
| 4,5-БИС-(1',2':3',4'-ДИ-О-ИЗОПРОПИЛИДЕН-α-D-ГАЛАКТОПИРАНОЗО-6'-ИЛ)ФТАЛОНИТРИЛ | 2009 |
|
RU2409585C1 |
| НОВЫЕ 1-β-D-РИБОФУРАНОЗИЛ-3-(5-ЗАМЕЩЕННЫЕ-1,2,4-ОКСАДИАЗОЛ-3-ИЛ)-1,2,4-ТРИАЗОЛЫ, ОБЛАДАЮЩИЕ ПРОТИВОВИРУСНЫМИ СВОЙСТВАМИ, И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2016 |
|
RU2629360C1 |
| МЕТАЛЛОКОМПЛЕКСЫ ОКТА-4,5-[4-(1-МЕТИЛ-1-ФЕНИЛЭТИЛ)ФЕНОКСИ]ФТАЛОЦИАНИНА В КАЧЕСТВЕ ЛЮМИНЕСЦЕНТНЫХ МАТЕРИАЛОВ И КРАСИТЕЛЕЙ ДЛЯ ПОЛИМЕРНЫХ МАТЕРИАЛОВ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2016 |
|
RU2641743C1 |
| МЕТАЛЛОЦЕН, ЛИГАНД, КАТАЛИТИЧЕСКАЯ СИСТЕМА, СПОСОБ ПОЛИМЕРИЗАЦИИ | 1997 |
|
RU2194708C2 |
| Способ получения лиганда 2-гидроксифталоцианина | 2015 |
|
RU2606186C1 |
| ПОЛИСУЛЬФАТИРОВАННЫЕ ГЛИКОЗИДЫ И ИХ СОЛИ | 2005 |
|
RU2413734C2 |
| Хиральные монотерпеновые сульфинамиды | 2017 |
|
RU2646959C1 |
| ПОЛИОКСИЭТИЛЕН, ИМЕЮЩИЙ САХАР НА ОДНОМ КОНЦЕ И ДРУГУЮ ФУНКЦИОНАЛЬНУЮ ГРУППУ НА ДРУГОМ КОНЦЕ, И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1996 |
|
RU2193574C2 |
| СПОСОБ ПОЛУЧЕНИЯ АЛКИЛЗАМЕЩЕННЫХ 2-ДЕЗОКСИ-2-ФТОР-D-РИБОФУРАНОЗИЛ-ПИРИМИДИНОВ И ПУРИНОВ И ИХ ПРОИЗВОДНЫХ | 2005 |
|
RU2407747C2 |
| Четвертичные аммониевые соединения на основе производных пентаэритрита и пиридоксина, обладающие антибактериальной активностью | 2023 |
|
RU2811203C1 |
Изобретение относится к 5,6-бис-(1',2':3',4'-ди-O-изопропилиден-альфа-D-галактопиранозо-6'-ил)-1,3-дииминоизоиндолину, который может быть использован в процессе синтеза октакис-[2,3,9,10,16,17,24,25-(α/β-D-галактопиранозо-6'-ил)]фталоцианина цинка, способного окрашивать целлюлозные волокна в зеленый цвет; при этом указанная окраска отличается прочностью к влажно-тепловым воздействиям.
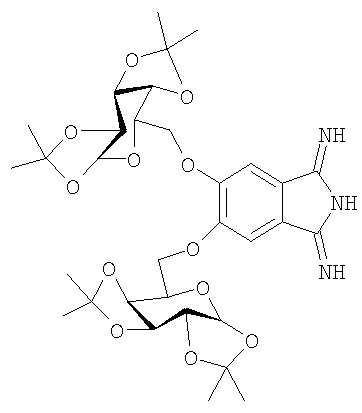
5,6-бис-(1',2':3',4'-ди-O-изопропилиден-α-D-галактопиранозо-6'-ил)-1,3-дииминоизоиндолин
| N.E.Galanin et al | |||
| Russian Journal of General Chemistry, 2008, Vol.78, No.7, pp.1436-1440 | |||
| Jurgen Sleven et al | |||
| Способ использования делительного аппарата ровничных (чесальных) машин, предназначенных для мериносовой шерсти, с целью переработки на них грубых шерстей | 1921 |
|
SU18A1 |
| A.Yu.Tolbin et al | |||
| Russian Chemical Bulletin, International Edition, 2005, Vol.54, No.9, pp.2099-2103 | |||
| RU 2005123319 A, 27.01.2006 | |||
| EP 0847749 A1, 17.06.1998. | |||
Авторы
Даты
2011-01-20—Публикация
2009-05-19—Подача