Настоящее изобретение относится к группе производных 1H-имидазола, которые являются модуляторами рецепторов каннабиноидов CB2, к способам получения указанных соединений, к новым промежуточным соединениям, полезным в синтезе указанных производных имидазола. Изобретение также относится к применению соединения, раскрытого в описании для получения лекарственного средства, оказывающего благоприятное воздействие. Благоприятное воздействие раскрыто в описании или очевидно специалисту в данной области техники из описания и общего уровня техники. Изобретение также относится к применению соединения изобретения для получения лекарственного средства для лечения или предотвращения заболевания или состояния. Более конкретно, изобретение относится к новым способам применения для лечения заболевания или состояния, раскрытым в описании или очевидным специалисту в данной области техники из описания и общего уровня техники. В вариантах исполнения изобретения определенные соединения, раскрытые в описании, используются для изготовления лекарственного средства, пригодного для лечения расстройств, в которые вовлечены CB2 рецепторы каннабиноидов, или которые можно лечить посредством манипуляции указанными рецепторами.
Производные 1H-имидазола как модуляторы CB1 рецептора известны из WO 03/027076, WO 03/063781, WO 03/040107 и WO 03/007887. Производные (морфолин-4-ил)алкил-(1H)-имидазола были заявлены в качестве модуляторов рецептора CB2 в WO 01/58869, раскрывающем три специфических имидазола (примеры 64, 65 и 66), которые включали n L-фенилаланинпроизводную карбоксамидную группу в положении 4 их (1H)-имидазольного фрагмента. Производные 1-арил-(1H)-имидазола были заявлены в US 4952698 как ЦНС-активные соединения. Недавние успехи в области селективных лигандов CB2-рецептора были рассмотрены K.H. Raitio et al. (Curr. Med. Chem. 2005, 12, 1217-1237).
Неожиданно было найдено новое производное 1H-имидазола, которое связывается с CB2-рецептором, включая соединения, имеющие приблизительно во сто раз более высокое сродство к рецептору CB2 по сравнению с соединениями в предшествующем уровне техники, которые приводились в WO 01/58869. Кроме того, многие из соединений в объеме настоящего изобретения являются высоко селективными по отношению к рецептору подтипа CB2, что означает, что они связываются с намного более высокой аффинностью с рецептором CB2, чем с рецептором CB1. Соединения в пределах настоящего изобретения являются либо агонистами рецептора CB2, частичными агонистами рецептора CB2, антагонистами рецептора CB2, либо обратными агонистами рецептора CB2.
Изобретение относится к соединениям общей формулы (I)
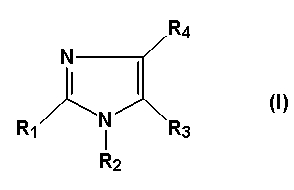
в которой
- R1 представляет собой водород, или атом галогена, или C1-3-алкильную группу, причем C1-3-алкильная группа может включать 1-3 атома фтора либо гидрокси или аминогруппу, или R1 представляет собой C2-3-алкинильную группу, C2-3-алкенильную группу, причем C2-3-алкинильная группа или C2-3-алкенильная группа может содержать 1-3 атома фтора, или R1 представляет собой ацетильную, циклопропильную, циано, метилсульфонильную, этилсульфонильную, метилсульфинильную, этилсульфинильную, трифторметилсульфанильную, метилсульфанильную, этилсульфанильную группы, формильную группу или C2-4-гетероалкильную группу,
- R2 представляет собой фенильную группу, которая может быть замещена 1, 2, 3, 4 или 5 заместителями Y, которые могут быть одинаковыми или различными, выбранными из группы, состоящей из метила, этила, пропила, метокси, этокси, гидрокси, хлора, йода, брома, фтора, трифторметила, трифторметокси, карбамоила, фенила и циано, или R2 представляет собой гетероарильную группу, причем гетероарильная группа может быть замещена 1, 2 или 3 заместителями Y, причем Y имеет значение, определенное выше, при условии, что R2 не является 6-метил-2-пиридильной группой, или
R2 представляет собой мононенасыщенную или полностью насыщенную 4-10-членную моноциклическую, конденсированную бициклическую или конденсированную трициклическую карбоциклическую кольцевую систему, или
R2 представляет собой мононенасыщенную или полностью насыщенную 4-10-членную моноциклическую, конденсированную бициклическую или конденсированную трициклическую гетероциклическую кольцевую систему, причем карбоциклическая или гетероциклическая кольцевая система может быть замещена 1-5 заместителями, выбранными из метила, этила, амино, гидрокси или фтора, или
R2 представляет собой группу общей формулы CH2-R5, в которой R5 представляет собой фенильную группу, которая замещена 1, 2, 3, 4 или 5 заместителями Y, как определено выше, или R5 представляет собой гетероарильную группу или 1,2,3,4-тетрагидронафтильную или инданильную группу, причем указанная гетероарильная группа или 1,2,3,4-тетрагидронафтильная или инданильная группы могут быть замещены 1, 2 или 3 заместителями Y, как определено выше, или R5 представляет собой мононенасыщенную или полностью насыщенную 4-10-членную моноциклическую, конденсированную бициклическую или конденсированную трициклическую карбоциклическую кольцевую систему, или
R5 представляет собой мононенасыщенную или полностью насыщенную 4-10-членную моноциклическую, конденсированную бициклическую или конденсированную трициклическую гетероциклическую кольцевую систему, причем карбоциклическая или гетероциклическая кольцевые системы необязательно могут быть замещены 1-5 заместителями, выбранными из группы, состоящей из метила, этила, амино, гидрокси или фтора, или
R2 представляет собой метилсульфониламиноалкильную группу, метилсульфонилалкильную или ацетамидоалкильную группу,
- R3 представляет собой водород, или атом галогена, или формил, C1-6-алкилсульфонильную, C1-6-алкилсульфинильную, C1-6-алкилсульфанильную, трифторметилсульфанильную, бензилсульфанильную или цианогруппу, или
R3 представляет собой C1-8-алкильную группу, причем указанная C1-8-алкильная группа может быть замещена 1-5 заместителями, выбранными из группы, состоящей из фтора, гидрокси или амино, или R3 представляет собой C2-6-алкинильную, C2-6-алкенильную, C1-6-алканоильную, C3-8-циклоалкильную, C5-8-гетероциклоалкильную или C2-6-гетероалкильную группу, причем указанные группы необязательно замещены 1-3 метильными группами, этильной, амино или гидроксигруппой или 1-3 атомами фтора, или R3 представляет собой фенильную группу, которая замещена 1-5 заместителями Y, где Y имеет значение, определенное выше, или R3 представляет собой гетероарильную группу, причем указанная гетероарильная группа может быть замещена 1, 2 или 3 заместителями Y, где Y имеет значение, определенное выше, или R3 представляет собой бензил- или гетероарилметильную группу, причем бензил- или гетероарилметильная группа может быть замещена 1, 2 или 3 заместителями Y,
- R4 представляет собой одну из подгрупп (i) или (ii)
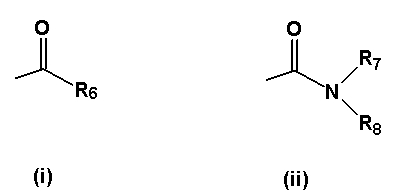
где R6 представляет собой разветвленную или линейную C4-8-алкильную группу, C3-8-циклоалкильную группу, C3-8-циклоалкил-C1-2-алкильную группу, C5-7-гетероциклоалкил-C1-2-алкильную группу, C5-10-бициклоалкильную группу, C5-10-бициклоалкил-C1-2-алкильную группу, C5-10-гетеробициклоалкил-C1-2-алкильную группу, C6-10-трициклоалкильную группу, C6-10-трициклоалкил-C1-2-алкильную группу, C6-10-гетеротрициклоалкил-C1-2-алкильную группу, причем указанные группы могут быть замещены 1-5 заместителями, выбранными из метила, гидрокси, этила, трифторметила или фтора, или R6 представляет фенил, бензил, нафтильную или фенетильную группу, которые могут быть замещены на их ароматической кольцевой системе 1-3 заместителями Y, как определено выше, при условии, что R6 не является 2-метилфенильной группой, или R6 представляет собой пиридильную или тиенильную группу,
- R7 представляет собой атом водорода или линейную C1-6-алкильную группу, причем указанная линейная C1-6-алкильная группа может быть замещена 1-3 атомами фтора, или R7 представляет собой изопропильную группу,
- R8 представляет собой C2-6-алкильную группу, причем указанная группа замещена гидрокси или аминогруппой или 1-3 атомами фтора, или R8 представляет собой разветвленную C7-10-алкильную группу, C3-8-циклоалкильную группу, C5-8-гетероциклоалкильную группу, C3-8-циклоалкил-C1-2-алкильную группу, C5-7-гетероциклоалкил-C1-2-алкильную группу, C5-10-бициклоалкильную группу, C5-10-бициклоалкил-C1-2-алкильную группу, C5-10-гетеробициклоалкил-C1-2-алкильную группу, C6-10-трициклоалкильную группу, C6-10-трициклоалкил-C1-2-алкильную группу, C6-10-гетеротрициклоалкил-C1-2-алкильную группу, причем указанные группы могут быть замещены 1-5 заместителями, выбранными из метила, гидрокси, этила, амино, гидроксиметила, трифторметила или фтора, или R8 представляет собой фенильную группу, причем указанная группа замещена 1-5 заместителями Y, как определено выше, или R8 представляет собой нафтильную, 1,2,3,4-тетрагидронафтильную или инданильную группу, причем указанная нафтильная, 1,2,3,4-тетрагидронафтильная или инданильная группа может быть замещена 1-3 заместителями Y, или R8 представляет собой фенил-C1-3-алкильную группу, дифенил-C1-3-алкильную группу, причем указанные группы могут быть замещены по фенильному кольцу 1-5 заместителями Y, где Y имеет вышеупомянутое значение, или R8 представляет собой бензильную группу, причем указанная бензильная группа замещена 1-5 заместителями Y, или R8 представляет собой гетероарильную, гетероарилметильную, нафтилметильную или гетероарилэтильную группу, причем указанная гетероарильная, гетероарилметильная, нафтилметильная или гетероарилэтильная группа может быть замещена 1-3 заместителями Y, где Y имеет вышеупомянутое значение, или R8 представляет собой пиперидинильную, азепанильную, морфолинильную, азабицикло[3.3.0]октанильную, 4-гидроксипиперидинильную или пирролидинильную группу, при условии, что R8 не является ни 6-метоксибензотиазол-2-ильной группой, ни [3-хлор-5-(трифторметил)пирид-2-ил]метильной группой,
или R7 и R8 вместе с атомом азота, с которым они связаны, образуют насыщенную или ненасыщенную, неароматическую или частично ароматическую, моноциклическую, бициклическую или трициклическую гетероциклическую группу, включающую 7-10 кольцевых атомов, причем указанная насыщенная или ненасыщенная, неароматическая или частично ароматическая, моноциклическая, бициклическая или трициклическая гетероциклическая группа может быть замещена 1-5 заместителями, выбранными из группы, состоящей из C1-3-алкила, гидрокси, метокси, циано, фенила, трифторметила или галогена, или
R7 и R8 вместе с атомом азота, с которым они связаны, образуют насыщенную моноциклическую гетероциклическую группу, необязательно включающую другой гетероатом (выбранный из N, O, S), имеющую 5-6 кольцевых атомов, причем указанная гетероциклическая группа замещена 1-5 заместителями, выбранными из группы, состоящей из C1-3-алкила, гидрокси, амино, фенила, бензила или фтора,
при условии, что R7 и R8 вместе с атомом азота, с которым они связаны, не образуют триметилзамещенную азабицикло[3.2.1]октанильную группу,
а также их таутомерам, стереоизомерам и N-оксидам, также как фармакологически приемлемым солям, гидратам и сольватам указанных соединений формулы (1) и их таутомеров, стереоизомеров и N-оксидов.
Изобретение относится к рацематам, смесям диастереомеров, а также к индивидуальным стереоизомерам соединений, имеющих формулу (I).
В описании заместителей термин «алкил» означает линейную или разветвленную алкильную группу. Например, C1-3-алкил означает метил, этил, н-пропил или изопропил. Термин «гетероарил» означает моноциклические или конденсированные бициклические гетероароматические группы, которые включают, но без ограничения, следующие группы: фурил, тиенил, пирролил, оксазолил, тиазолил, имидазолил, пиразолил, изоксазолил, изoтиазолил, пиридил, пиридазинил, пиримидинил, пиразинил, 1,3,5-триазинил, индазолил, индолил, индолизинил, изоиндолил, бензо[b]фуранил, бензо[b]тиофенил, 1,3-бензодиоксолил, 2,3-дигидро-1,4-бензодиоксинил, бензимидазолил, бензтиазолил, пуринил, хинолинил, изохинолил, 1,2,3,4-тетрагидрохинолинил, 1,2,3,4-тетрагидроизохинолинил, хинолил, фталазинил, хиназолинил, хиноксалинил, 1,8-нафтиридинил, за исключением хинолин-2-оновой группы. Термин «галоген» означает хлор, фтор, бром или йод. Термин «C3-8-циклоалкил» означает циклопропил, циклобутил, циклопентил, циклогексил, циклогептил или циклооктил. Термин «C5-8-гетероциклоалкил» относится к кольцам, содержащим (N, O, S) гетероатомы, включая, но без ограничения, следующие: пиперидинил, морфолинил, азепанил, пирролидинил, тиоморфолинил, пиперазинил, тетрагидрофурил, тетрагидропиранил. Термин «C5-10-бициклоалкильная группа» относится к карбобициклическим кольцевым системам, включая, но без ограничения, следующие группы: бицикло[2.2.1]гептанил, бицикло[3.3.0]октанил или бицикло[3.1.1]гептанил. Термин «C6-10-трициклоалкильная группа» относится к карботрициклическим кольцевым системам, таким как 1-адамантиловая, норадамантиловая или 2-адамантиловая группы. Сокращение «C2-4 гетероалкил» относится к (N, O, S) гетероатомам, содержащим линейные или разветвленные C2-4-алкильные группы, включая, но без ограничения, следующие группы: метоксиметил, диметиламинометил и этилсульфанилметил.
Пролекарства упомянутых выше соединений включены в объем настоящего изобретения. Пролекарства представляют собой терапевтические агенты, которые являются неактивными по существу, но преобразуются в один или более активных метаболитов. Пролекарства являются биореверсируемыми производными молекул лекарственного средства, используемыми, чтобы преодолеть некоторые барьеры, которые препятствуют использованию исходной молекулы лекарственного средства. Указанные барьеры включают, но без ограничения, следующее: растворимость, проходимость, стабильность, предсистемный метаболизм и ограничения в направленности (Medicinal Chemistry: Principles and Practice, 1994, ISBN 0-85186-494-5, Ed.: F.D. King, p. 215; J. Stella, "Prodrugs as therapeutics", Expert Opin. Ther. Patents, 14(3), 277-280, 2004; P. Ettmayer et al., "Lessons learned from marketed and investigational prodrugs", J. Med. Chem., 47, 2393-2404, 2004). Пролекарства, т.е. соединения, которые при введении людям любым известным путем метаболизируются в соединения, имеющие формулу (I), включены в объем изобретения. В особенности это относится к соединениям с первичными или вторичными амино или гидроксильными группами. Такие соединения могут реагировать с органическими кислотами, что приводит к соединениям, имеющим формулу (I), и у которых присутствует дополнительная группа, которая легко удаляется после введения, например, но без ограничения следующих: амидин, енамин, основание Манниха, гидроксилметиленовое производное, O-(ацилоксиметиленкарбамат)производное, карбамат, сложный эфир, амид или енаминон.
N-оксиды упомянутых выше соединений находятся в объеме настоящего изобретения. Третичные амины могут давать или могут не давать начало метаболитам в форме N-оксидов. Степень, в которой такое N-окисление имеет место, варьирует от следовых количеств до практически количественного преобразования. N-оксиды могут быть более активными, чем их соответствующие третичные амины или менее активным. Так как N-оксиды легко восстанавливаются до их соответствующих третичных аминов химическими способами, в человеческом теле это происходит с различными степенями. Некоторые N-оксиды подвергаются почти количественной восстановительной конверсии в соответствующие третичные амины, в других случаях преобразование является лишь следовой реакцией или даже полностью отсутствующей (M.H. Bickel: "The pharmacology and Biochemistry of N-oxides", Pharmacological Reviews, 21(4), 325-355, 1969).
Изобретение, в частности, относится к соединениям общей формулы (I)

в которой
- R1 представляет собой атом галогена или C1-3-алкильную группу, причем C1-3-алкильная группа может включать 1-3 атома фтора либо гидрокси или аминогруппу, или R1 представляет собой C2-3-алкинильную группу, C2-3-алкенильную группу, причем C2-3-алкинильная группа или C2-3-алкенильная группа может содержать 1-3 атома фтора, или R1 представляет собой ацетильную, циклопропильную, циано, метилсульфонильную, этилсульфонильную, метилсульфинильную, этилсульфинильную, трифторметилсульфанильную, метилсульфанильную, этилсульфанильную группы, формильную группу или C2-4-гетероалкильную группу, а R2, R3 и R4 имеют значения, приведенные выше.
В более предпочтительном варианте изобретение относится к соединениям формулы (I)

в которой
- R3 представляет собой водород, или атом галогена, или формильную, метилсульфонильную, этилсульфонильную, метилсульфинильную, этилсульфинильную, трифторметилсульфанильную, метилсульфанильную, этилсульфанильную или цианогруппу, или R3 представляет собой C1-6-алкильную группу, причем указанная C1-6-алкильная группа может содержать 1-3 атома фтора либо гидрокси или аминогруппу, или R3 представляет собой C2-6-алкинильную, C2-6-алкенильную, C1-6-алканоильную, C3-8-циклоалкильную, C5-8-гетероциклоалкильную или C2-6-гетероалкильную группу, причем указанные группы необязательно замещены 1-3 метильными группами, этильной, амино или гидроксигруппой или 1-3 атомами фтора, или R3 представляет собой фенильную группу, которая замещена 1-5 заместителями Y, где Y имеет значение, определенное выше, или R3 представляет собой гетероарильную группу, причем указанная гетероарильная группа может быть замещена 1, 2 или 3 заместителями Y, где Y имеет значение, определенное выше, или R3 представляет собой бензильную или гетероарилметильную группу, причем указанная бензильная или гетероарилметильная группа может быть замещена 1, 2 или 3 заместителями Y,
- R4 представляет собой подгруппу (ii)
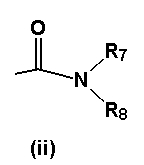
в которой
- R7 представляет собой атом водорода, или линейную C1-6-алкильную группу, или изопропильную группу,
- R8 представляет собой C2-6-алкильную группу, причем указанная группа замещена гидрокси или аминогруппой или 1-3 атомами фтора, или R8 представляет собой разветвленную C7-10-алкильную группу, C3-8-циклоалкильную группу, C5-8-гетероциклоалкильную группу, C3-8-циклоалкил-C1-2-алкильную группу, C5-7-гетероциклоалкил-C1-2-алкильную группу, C5-10-бициклоалкильную группу, C5-10-бициклоалкил-C1-2-алкильную группу, C5-10-гетеробициклоалкил-C1-2-алкильную группу, C6-10-трициклоалкильную группу, C6-10-трициклоалкил-C1-2-алкильную группу, C6-10-гетеротрициклоалкил-C1-2-алкильную группу, причем указанные группы могут быть замещены 1-5 заместителями, выбранными из метила, гидрокси, этила, амино, гидроксиметила, трифторметила или фтора, или R8 представляет собой фенильную группу, причем указанная группа замещена 1-5 заместителями Y, как определено выше, или R8 представляет собой нафтильную или 1,2,3,4-тетрагидронафтильную или инданильную группу, причем указанные группы могут быть замещены 1-3 заместителями Y, или R8 представляет собой фенил-C1-3-алкильную группу, дифенил-C1-3-алкильную группу, причем указанные группы могут быть замещены по фенильному кольцу 1-5 заместителями Y, где Y имеет значение, упомянутое выше, или R8 представляет собой бензильную группу, причем указанная бензильная группа замещена 1-5 заместителями Y, или R8 представляет собой гетероарильную, гетероарилметильную или гетероарилэтильную группу, причем указанная гетероарильная, гетероарилметильная или гетероарилэтильная группа может быть замещена 1-3 заместителями Y, как определено выше, или R8 представляет собой пиперидинильную, азепанильную, морфолинильную, азабицикло[3.3.0]октанильную, 4-гидроксипиперидинильную или пирролидинильную группу, при условии, что R8 не является ни 6-метоксибензотиазол-2-ильной группой, ни [3-хлор-5-(трифторметил)пирид-2-ил]метильной группой, или
R7 и R8 вместе с атомом азота, с которым они связаны, образуют насыщенную или ненасыщенную, неароматическую или частично ароматическую, моноциклическую, бициклическую или трициклическую гетероциклическую группу, имеющую 7-10 атомов в кольце, причем указанная гетероциклическая группа может быть замещена одной или двумя C1-3-алкильными группами, гидроксигруппами, фенильными группами, триметилфторметильными группами, бензильными группами, дифенилметильными группами или атомом галогена, или R7 и R8 вместе с атомом азота, с которым они связаны, образуют насыщенную моноциклическую гетероциклическую группу, необязательно содержащую другой гетероатом (выбранный из N, O, S), имеющую 5-6 атомов в кольце, причем указанная гетероциклическая группа замещена 1-3 C1-3-алкильными группами, гидроксигруппой или 1-2 атомами фтора,
при условии, что R7 и R8 вместе с атомом азота, с которым они связаны, не образуют триметилзамещенную азабицикло[3.2.1]октанильную группу, а R1 и R2 имеют значения, приведенные выше.
Также в более предпочтительном варианте изобретение относится к соединениям формулы (I)

в которой
- R1 представляет собой атом галогена или C1-3-алкильную группу, причем C1-3-алкильная группа может включать 1-3 атома фтора либо гидроксигруппу, или R1 представляет собой C2-3-алкинильную группу, C2-3-алкенильную группу, ацетильную, циклопропильную, циано, метилсульфонильную, метилсульфинильную, метилсульфанильную или C2-4-гетероалкильную группу,
- R2 представляет собой фенильную группу, которая может быть замещена 1, 2, 3, 4 или 5 заместителями Y, которые могут быть одинаковыми или различными, выбранными из группы, состоящей из метила, этила, пропила, метокси, этокси, гидрокси, хлора, йода, брома, фтора, трифторметила, трифторметокси, карбамоила, фенила и циано, или R2 представляет собой моноциклическую гетероарильную группу, причем указанная гетероарильная группа может быть замещена 1, 2 или 3 заместителями Y, где Y имеет значение, определенное выше, при условии, что R2 не является 6-метил-2-пиридильной группой, или
R2 представляет собой мононенасыщенную или полностью насыщенную 4-10-членную моноциклическую, конденсированную бициклическую или конденсированную трициклическую кольцевую карбоциклическую систему, или
R2 представляет собой мононенасыщенную или полностью насыщенную 4-10-членную моноциклическую, конденсированную бициклическую или конденсированную трициклическую кольцевую гетероциклическую систему, причем указанная карбоциклическая или гетероциклическая кольцевая система может быть замещена 1-5 заместителями, выбранными из метила, этила, амино, гидроксила или фтора, или
R2 представляет собой группу общей формулы CH2-R5, где R5 представляет собой фенильную группу, которая замещена 1, 2, 3, 4 или 5 заместителями Y, как определено выше, или R5 представляет собой гетероарильную группу или 1,2,3,4-тетрагидронафтильную или инданильную группу, причем указанная гетероарильная группа или 1,2,3,4-тетрагидронафтильная или инданильная группа может быть замещена 1, 2 или 3 заместителями Y, как определено выше, или R5 представляет собой мононенасыщенную или полностью насыщенную моноциклическую, конденсированную бициклическую или конденсированную трициклическую 4-10-членную карбоциклическую кольцевую систему, или
R5 представляет собой мононенасыщенную или полностью насыщенную 4-10-членную моноциклическую, конденсированную бициклическую или конденсированную трициклическую кольцевую гетероциклическую систему, причем указанная карбоциклическая или гетероциклическая кольцевая система может быть необязательно замещена 1-3 метильными группами, этильной, амино или гидроксигруппой или атомом фтора,
- R3 представляет собой водород, или атом галогена, или метилсульфанильную или цианогруппу, или R3 представляет собой C1-6-алкильную группу, причем указанная C1-6-алкильная группа может содержать 1-3 атома фтора либо гидрокси или аминогруппу, или R3 представляет собой C2-6-алкинильную или C2-6-алкенильную группу, причем указанные группы необязательно замещены 1-3 атомами фтора,
- R4 представляет собой подгруппу (ii)

в которой
- R7 представляет собой атом водорода или линейную C1-3-алкильную группу,
- R8 представляет собой C2-6-алкильную группу, причем указанную группу замещают гидрокси или аминогруппой или 1-3 атомами фтора, или R8 представляет собой разветвленную C7-10-алкильную группу, C3-8-циклоалкильную группу, C5-8-гетероциклоалкильную группу, C3-8-циклоалкил-C1-2-алкильную группу, C5-7-гетероциклоалкил-C1-2-алкильную группу, C5-10-бициклоалкильную группу, C5-10-бициклоалкил-C1-2-алкильную группу, C5-10-гетеробициклоалкил-C1-2-алкильную группу, C6-10-трициклоалкильную группу, C6-10-трициклоалкил-C1-2-алкильную группу, C6-10-гетеротрициклоалкил-C1-2-алкильную группу, причем указанные группы могут быть замещены 1-5 заместителями, выбранными из метила, гидрокси, этила, амино, гидроксиметила, трифторметила или фтора, или R8 представляет собой фенильную группу, причем указанная группа замещена 1-5 заместителями Y, как определено выше, или R8 представляет собой нафтил, или 1,2,3,4-тетрагидронафтил, или инданил, причем указанные группы могут быть замещены 1-3 заместителями Y, или R8 представляет собой фенил-C1-3-алкильную группу, дифенил-C1-3-алкильную группу, причем указанные группы могут быть замещены по фенильному кольцу 1-5 заместителями Y, где Y имеет значение, упомянутое выше, или R8 представляет собой бензильную группу, причем указанная бензильная группа замещена 1-5 заместителями Y, или R8 представляет собой гетероарильную, гетероарилметильную или гетероарилэтильную группу, причем указанные гетероарильная, гетероарилметильная или гетероарилэтильная группы могут быть замещены 1-3 заместителями Y, как определено выше, или R8 представляет собой пиперидинильную, азепанильную, морфолинильную, азабицикло[3.3.0]октанильную, 4-гидроксипиперидинильную или пирролидинильную группу при условии, что R8 не является ни 6-метоксибензотиазол-2-ильной группой, ни [3-хлор-5-(трифторметил)пирид-2-ил]метильной группой.
В еще более предпочтительном варианте изобретение относится к соединениям формулы (I)

в которой
- R1 представляет собой атом галогена или C1-3-алкильную группу, причем C1-3-алкильная группа может включать 1-3 атома фтора либо гидроксигруппу, или R1 представляет собой циано или метилсульфанильную группу,
- R2 представляет собой мононенасыщенную или полностью насыщенную 5-7-членную моноциклическую кольцевую карбоциклическую систему, которая может быть замещена 1-5 заместителями, выбранными из метила, этила, амино, гидрокси или фтора, или R2 представляет собой фенильную группу, которая может быть замещена 1, 2, 3, 4 или 5 заместителями Y, которые могут быть одинаковыми или различными, выбранными из группы, состоящей из метила, этила, пропила, метокси, этокси, гидрокси, хлора, йода, брома, фтора, трифторметила, трифторметокси, карбамоила, фенила и циано,
- R3 представляет собой водород, или атом галогена, либо метилсульфанильную или цианогруппу, или R3 представляет собой C1-6-алкильную группу, причем указанная C1-6-алкильная группа может включать 1-3 атома фтора либо гидрокси или аминогруппу,
- R4 представляет собой подгруппу (ii)

в которой
- R7 представляет собой атом водорода или метильную группу,
- R8 представляет собой C2-6-алкильную группу, причем указанная группа замещена 1-3 атомами фтора, или R8 представляет собой разветвленную C7-10-алкильную группу, C3-8-циклоалкильную группу, C5-8-гетероциклоалкильную группу, C3-8-циклоалкил-C1-2-алкильную группу, C5-7-гетероциклоалкил-C1-2-алкильную группу, C5-10-бициклоалкильную группу, C5-10-бициклоалкил-C1-2-алкильную группу, C5-10-гетеробициклоалкил-C1-2-алкильную группу, C6-10-трициклоалкильную группу, C6-10-трициклоалкил-C1-2-алкильную группу, C6-10-гетеротрициклоалкил-C1-2-алкильную группу, причем указанные группы могут быть замещены 1-5 заместителями, выбранными из метила, гидрокси, этила, амино, гидроксиметила, трифторметила или фтора, или R8 представляет собой фенильную группу, причем указанная группа замещена 1-5 заместителями Y, как определено выше, или R8 представляет собой нафтильную или 1,2,3,4-тетрагидронафтильную или инданильную группу, причем указанные группы могут быть замещены 1-3 заместителями Y, или R8 представляет собой фенил-C1-3-алкильную группу, дифенил-C1-3-алкильную группу, причем указанные группы могут быть замещены по фенильному кольцу 1-5 заместителями Y, где Y имеет вышеупомянутое значение, или R8 представляет собой замещенную бензильную группу, причем указанная бензильная группа замещена 1-5 заместителями Y, или R8 представляет собой гетероарильную, гетероарилметильную или гетероарилэтильную группу, причем указанные гетероарильная, гетероарилметильная или гетероарилэтильная группы могут быть замещены 1-3 заместителями Y, как определено выше, при условии, что R8 не является ни 6-метоксибензотиазол-2-ильной, ни [3-хлор-5-(трифторметил)пирид-2-ил]метильной группой.
В наиболее предпочтительном варианте изобретение относится к соединениям формулы (I)

в которой
- R1 представляет собой атом галогена или C1-3-алкильную группу, причем C1-3-алкильная группа может включать 1-3 атома фтора, или R1 представляет собой циано или метилсульфанильную группу,
- R2 представляет собой насыщенное шестичленное моноциклическое карбоциклическое кольцо, или R2 представляет собой фенильную группу, которая может быть замещена 1, 2 или 3 заместителями Y, которые могут быть одинаковыми или различными, выбранными из группы, состоящей из метила, этила, пропила, метокси, этокси, гидрокси, хлора, йода, брома, фтора, трифторметила, трифторметокси, карбамоила, фенила и циано,
- R3 представляет собой водород, или атом галогена, или метилсульфанильную или цианогруппу, или R3 представляет собой C1-4-алкильную группу, причем указанная C1-4-алкильная группа может включать 1-3 атома фтора,
- R4 представляет собой подгруппу (ii)

в которой
- R7 представляет собой атом водорода или метильную группу,
- R8 представляет собой C2-6-алкильную группу, причем указанная группа замещена 1-3 атомами фтора, или R8 представляет собой разветвленную C7-10-алкильную группу, C3-8-циклоалкильную группу, C5-8-гетероциклоалкильную группу, C3-8-циклоалкил-C1-2-алкильную группу, C5-7-гетероциклоалкил-C1-2-алкильную группу, C5-10-бициклоалкильную группу, C5-10-бициклоалкил-C1-2-алкильную группу, C5-10-гетеробициклоалкил-C1-2-алкильную группу, C6-10-трициклоалкильную группу, C6-10-трициклоалкил-C1-2-алкильную группу, C6-10-гетеротрициклоалкил-C1-2-алкильную группу, причем указанные группы могут быть замещены 1-5 заместителями, выбранными из метила, гидрокси, этила, амино, гидроксиметила, трифторметила или фтора, или R8 представляет собой фенильную группу, причем указанная группа замещена 1-3 заместителями Y, как определено выше, или R8 представляет собой нафтильную группу, причем указанная группа может быть замещена 1-3 заместителями Y, или R8 представляет собой фенил-C1-2-алкильную группу, причем указанная группа может быть замещена по фенильному кольцу 1-3 заместителями Y, где Y имеет вышеупомянутое значение, или R8 представляет собой замещенную бензильную группу, причем указанная бензильная группа замещена 1-5 заместителями Y.
Изобретение в предпочтительном варианте также относится к соединениям, имеющим формулу (I), в которой R2 представляет собой насыщенное шестичленное моноциклическое карбоциклическое кольцо, или R2 представляет собой фенильную группу, которая может быть замещена 1, 2, 3, 4 или 5 заместителями Y, которые могут быть одинаковыми или различными, выбранными из группы, состоящей из метила, этила, пропила, метокси, этокси, гидрокси, хлора, йода, брома, фтора, трифторметила, трифторметокси, карбамоила, фенила и циано, а все другие символы имеют значения, описанные выше.
В другом варианте исполнения изобретение относится к соединениям общей формулы (XIV)
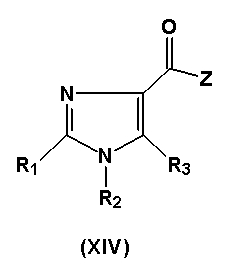
в которой
- R1 представляет собой атом галогена или C1-3-алкильную группу, причем C1-3-алкильная группа может включать 1-3 атома фтора либо гидрокси или аминогруппу, или R1 представляет собой C2-3-алкинильную группу, C2-3-алкенильную группу, причем указанные C2-3-алкинильная группа или C2-3-алкенильная группа могут включать 1-3 атома фтора, или R1 представляет собой ацетильную, циклопропильную, циано, метилсульфонильную, этилсульфонильную, метилсульфинильную, этилсульфинильную, трифторметилсульфанильную, метилсульфанильную, этилсульфанильную группу, формильную группу или C2-4-гетероалкильную группу,
- R2 представляет собой фенильную группу, которая может быть замещена 1, 2, 3, 4 или 5 заместителями Y, которые могут быть одинаковыми или различными, выбранными из группы, состоящей из метила, этила, пропила, метокси, этокси, гидрокси, хлора, йода, брома, фтора, трифторметила, трифторметокси, карбамоила, фенила и циано, или R2 представляет собой гетероарильную группу, причем указанная гетероарильная группа может быть замещена 1, 2 или 3 заместителями Y, где Y имеет значение, определенное выше, при условии, что R2 не является 6-метил-2-пиридильной группой, или
R2 представляет собой мононенасыщенную или полностью насыщенную 4-10-членную моноциклическую, конденсированную бициклическую или конденсированную трициклическую кольцевую карбоциклическую систему, или
R2 представляет собой мононенасыщенную или полностью насыщенную 4-10-членную моноциклическую, конденсированную бициклическую или конденсированную трициклическую кольцевую гетероциклическую систему, причем указанная карбоциклическая или гетероциклическая кольцевая система может быть замещена 1-5 заместителями, выбранными из метила, этила, амино, гидрокси или фтора, или
R2 представляет собой группу общей формулы CH2-R5, где R5 представляет собой фенильную группу, которая замещена 1, 2, 3, 4 или 5 заместителями Y, как определено выше, или R5 представляет собой гетероарильную группу или 1,2,3,4-тетрагидронафтильную или инданильную группу, причем указанная гетероарильная группа или 1,2,3,4-тетрагидронафтильная или инданильная группа может быть замещена 1, 2 или 3 заместителями Y, как определено выше, или R5 представляет собой мононенасыщенную или полностью насыщенную моноциклическую, конденсированную бициклическую или конденсированную трициклическую 4-10-членную карбоциклическую кольцевую систему, или
R5 представляет собой мононенасыщенную или полностью насыщенную 4-10-членную моноциклическую, конденсированную бициклическую или конденсированную трициклическую кольцевую гетероциклическую систему, причем указанная карбоциклическая или гетероциклическая кольцевая система может быть необязательно замещена 1-5 заместителями, выбранными из группы, состоящей из метила, этила, амино, гидрокси или фтора, или
R2 представляет собой метилсульфониламиноалкильную группу, метилсульфонилалкильную или ацетамидоалкильную группу
при условии, что R2 не является фенильной, 4-метилфенильной или 4-метоксифенильной группой,
- R3 представляет собой водород, или атом галогена, или формил, С1-6-алкилсульфонил, C1-6-алкилсульфинил, C1-6-алкилсульфанил, трифторметилсульфанил, бензилсульфанил или цианогруппу, или R3 представляет собой C1-8-алкильную группу, причем указанная C1-8-алкильная группа может быть замещена 1-5 заместителями, выбранными из группы, состоящей из фтора, гидрокси или амино, или R3 представляет собой C2-6-алкинил, C2-6-алкенил, C1-6-алканоил, C3-8-циклоалкил, C5-8-гетероциклоалкил или C2-6-гетероалкил, причем указанные группы необязательно замещены 1-3 метильными группами, этильными, амино или гидроксигруппами или 1-3 атомами фтора, или R3 представляет собой фенильную группу, которая замещена 1-5 заместителями Y, где Y имеет значение, определенное выше, или R3 представляет собой гетероарильную группу, причем указанная гетероарильная группа может быть замещена 1, 2 или 3 заместителями Y, где Y имеет значение, определенное выше, или R3 представляет собой бензильную или гетероарилметильную группу, причем указанные бензильная или гетероарилметильная группы могут быть замещены 1, 2 или 3 заместителями Y,
- Z представляет собой атом хлора или C1-3-алкильную группу, гидроксигруппу, или -O-Na, -O-K, -O-Li, или -O-Cs группу, или Z представляет собой N-метокси-N-метиламиногруппу,
причем указанные соединения являются полезными в синтезе соединений общей формулы (I), в которой
- R1 представляет собой атом галогена или C1-3-алкильную группу, причем C1-3-алкильная группа может включать 1-3 атома фтора либо гидрокси или аминогруппу, или R1 представляет собой C2-3-алкинильную группу, C2-3-алкенильную группу, причем указанные C2-3-алкинильная группа или C2-3-алкенильная группа могут включать 1-3 атома фтора, или R1 представляет собой ацетильную, циклопропильную, циано, метилсульфонильную, этилсульфонильную, метилсульфинильную, этилсульфинильную, трифторметилсульфанильную, метилсульфанильную, этилсульфанильную группу, формильную группу или C2-4-гетероалкильную группу,
- R2 представляет собой фенильную группу, которая может быть замещена 1, 2, 3, 4 или 5 заместителями Y, которые могут быть одинаковыми или различными, выбранными из группы, состоящей из метила, этила, пропила, метокси, этокси, гидрокси, хлора, йода, брома, фтора, трифторметила, трифторметокси, карбамоила, фенила и циано, или R2 представляет собой гетероарильную группу, причем указанная гетероарильная группа может быть замещена 1, 2 или 3 заместителями Y, где Y имеет значение, определенное выше, при условии, что R2 не является 6-метил-2-пиридильной группой, или
R2 представляет собой мононенасыщенную или полностью насыщенную 4-10-членную моноциклическую, конденсированную бициклическую или конденсированную трициклическую кольцевую карбоциклическую систему, или
R2 представляет собой мононенасыщенную или полностью насыщенную 4-10-членную моноциклическую, конденсированную бициклическую или конденсированную трициклическую кольцевую гетероциклическую систему, причем указанная карбоциклическая или гетероциклическая кольцевая система может быть замещена 1-5 заместителями, выбранными из метила, этила, амино, гидрокси или фтора, или
R2 представляет собой группу общей формулы CH2-R5, где R5 представляет собой фенильную группу, которая замещена 1, 2, 3, 4 или 5 заместителями Y, как определено выше, или R5 представляет собой гетероарильную группу или 1,2,3,4-тетрагидронафтильную или инданильную группу, причем указанная гетероарильная группа или 1,2,3,4-тетрагидронафтильная или инданильная группа может быть замещена 1, 2 или 3 заместителями Y, как определено выше, или R5 представляет собой мононенасыщенную или полностью насыщенную моноциклическую, конденсированную бициклическую или конденсированную трициклическую 4-10-членную карбоциклическую кольцевую систему, или
R5 представляет собой мононенасыщенную или полностью насыщенную 4-10-членную моноциклическую, конденсированную бициклическую или конденсированную трициклическую кольцевую гетероциклическую систему, причем указанная карбоциклическая или гетероциклическая кольцевая система может быть необязательно замещена 1-5 заместителями, выбранными из группы, состоящей из метила, этила, амино, гидрокси или фтора, или
R2 представляет собой метилсульфониламиноалкильную группу, метилсульфонилалкильную или ацетамидоалкильную группу,
- R3 представляет собой водород, или атом галогена, или формил, С1-6-алкилсульфонил, C1-6-алкилсульфинил C1-6-алкилсульфанил, трифторметилсульфанил, бензилсульфанил или цианогруппу, или R3 представляет собой C1-8-алкильную группу, причем указанная C1-8-алкильная группа может быть замещена 1-5 заместителями, выбранными из группы, состоящей из фтора, гидрокси или амино, или R3 представляет собой C2-6-алкинильную, C2-6-алкенильную, C1-6-алканоильную, C3-8-циклоалкильную, C5-8-гетероциклоалкильную или C2-6-гетероалкильную группу, причем указанные группы необязательно замещены 1-3 метильными группами, этильными, амино или гидроксигруппами или 1-3 атомами фтора, или R3 представляет собой фенильную группу, которая замещена 1-5 заместителями Y, где Y имеет значение, определенное выше, или R3 представляет собой гетероарильную группу, причем указанная гетероарильная группа может быть замещена 1, 2 или 3 заместителями Y, где Y имеет значение, определенное выше, или R3 представляет собой бензильную или гетероарилметильную группу, причем указанные бензильная или гетероарилметильная группы могут быть замещены 1, 2 или 3 заместителями Y.
ОБЩИЕ АСПЕКТЫ СИНТЕЗОВ
Соединения формулы (I) могут быть получены различными методиками. Выбор специфического метода зависит от ряда факторов, таких как совместимость функциональных групп с используемыми реактивами, возможность использовать защитные группы, катализаторы, активирующие и сшивающие реагенты и окончательные структурные свойства, присутствующие у полученного конечного продукта.
Производные имидазола могут быть получены согласно известным методам. Релевантными статьями являются следующие:
a) Gomez-Sanchez et al., J. Heterocyclic Chem. (1987), 24, 1757-1763;
b) Matsuura et al., J. Chem. Soc. Perkin Trans. I (1991), 11, 2821-2826;
c) Ueda et al., Tetrahedron Lett. (1988), 29, 4607-4610;
d) Gupta et al., Eur. J. Med. Chem. (2004), 39, 805-814;
e) Van Berkel et al., Tetrahedron Lett. (2004), 45, 7659-7662;
f) Haberhauer and Rominger, Tetrahedron Lett. (2002), 43, 6335-6338;
g) Dell'Erba et al., Tetrahedron (1997), 53, 2125-2136;
h) Lipshutz et al., Tetrahedron Lett. (1992), 33, 5865-5868.
Соединения общей формулы (I) могут быть получены согласно процедурам, приведенным в схемах 1-6.
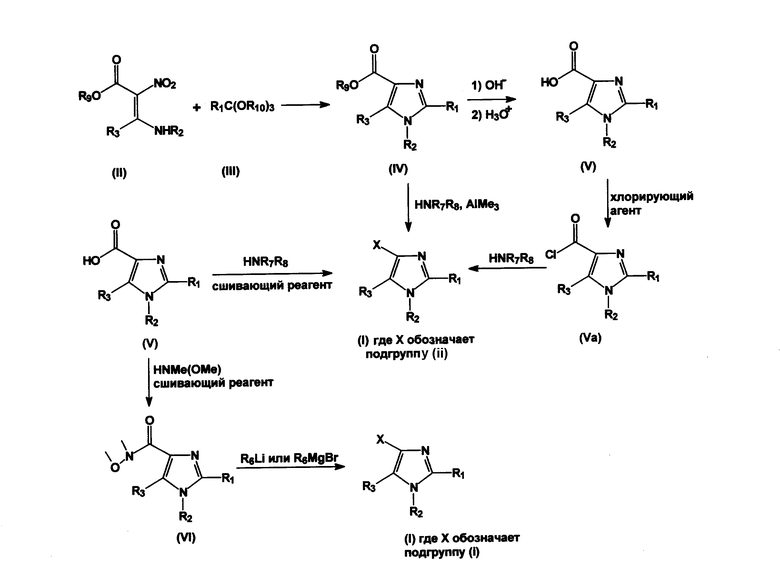
Схема 1: символы R1-R8 имеют значения, приведенные выше, R9 и R10 представляют собой алкил(С1-3)
Производные нитроенамина общей формулы (II) могут быть получены согласно процедуре, опубликованной Gomez-Sanchez et al., J. Heterocyclic Chem. (1987), 24, 1757-1763. Производные нитроенамина общей формулы (II) могут реагировать с орто-эфирами общей формулы (III), образуя производные имидазола общей формулы (IV) (схема 1). Последующий основный гидролиз сложного эфира, например, с использованием гидроксида лития (LiOH), NaOH, KOH или CsOH может дать промежуточное соединение в виде щелочных солей имидазолкарбоновых кислот, которые могут быть подкислены кислотой, такой как водный хлороводород (HCl), образуя производные имидазолкарбоновых кислот общей формулы (V). Соединения общей формулы (IV) могут быть амидированы амином общей формулы R7R8NH в соединение общей формулы (I), где X представляет собой подгруппу (ii), определенную выше. Указанные амидирования могут катализироваться триметилалюминием (CH3)3Al. (Для получения дополнительной информации по алюминийопосредованной конверсии эфиров в амиды, см.: J.I. Levin, E. Turos, S.M. Weinreb, Synth. Commun. (1982), 12, 989-993). Производные имидазолкарбоновых кислот общей формулы (V) или их соответствующие щелочные соли могут реагировать с амином общей формулы R7R8NH с образованием соединения общей формулы (I), где X представляет подгруппу (ii), определенную выше. Данная специфическая реакция предпочтительно проходит с применением способов активации и сшивания, таких как образование активного эфира, или в присутствии так называемого сшивающего реагента, например DCC, HBTU (O-бензотриазол-1-ил-N,N,N',N'-тетраметилурония гексафторфосфата), TBTU, HOAt (N-гидрокси-7-азабензотриазола), PyBOP (бензотриазол-1-илокси-трис(пирролидин)фосфония гексафторфосфата), BOP, CIP (2-хлор-1,3-диметилимидазолиния гексафторфосфата), 2-хлор-1,3-диметилимидазолиния хлорида, PyAOP (7-aзaбензотриазол-1-илокси-трис(пирролидин)фосфония гексафторфосфата) и т.п. (Для получения дополнительной информации о методах активации и сшивания см. a) M. Bodanszky, A. Bodanszky: The Practice of Peptide Synthesis, Springer-Verlag, New York, 1994; ISBN: 0-387-57505-7; b) K. Akaji et al., Tetrahedron Lett. (1994), 35, 3315-3318; c) F. Albericio et al., Tetrahedron Lett. (1997), 38, 4853-4856); d) C. Montalbetti and V. Falque, Tetrahedron (2005), 61, 10827-10852).
Альтернативно, соединение, имеющее общую формулу (V), или соответствующие щелочные соли могут реагировать с так называемым галогенирующим агентом, например тионилхлоридом (SOCl2) или оксалилхлоридом. Указанная реакция дает соответствующий карбонилхлорид (хлорангидрид) (Va), который может впоследствии реагировать с соединением, имеющим формулу R7R8NH, в которой R7 и R8 имеют значения, описанные выше, образуя соединение общей формулы (I), где X представляет собой подгруппу (ii), определенную выше. Такие реакции могут быть катализированы пиридином или 4-диметиламинопиридином (DMAP).
Соединение, имеющее общую формулу (V), может реагировать с N-метокси-N-метиламином в присутствии сшивающего реагента, что приводит к соответствующему N-метокси-N-метиламиду общей формулы (VI), впоследствии реагирующему с литиевым реагентом общей формулы R6-Li или реактивом Гриньяра с образованием соединения общей формулы (I), где X представляет собой подгруппу (i), определенную выше.
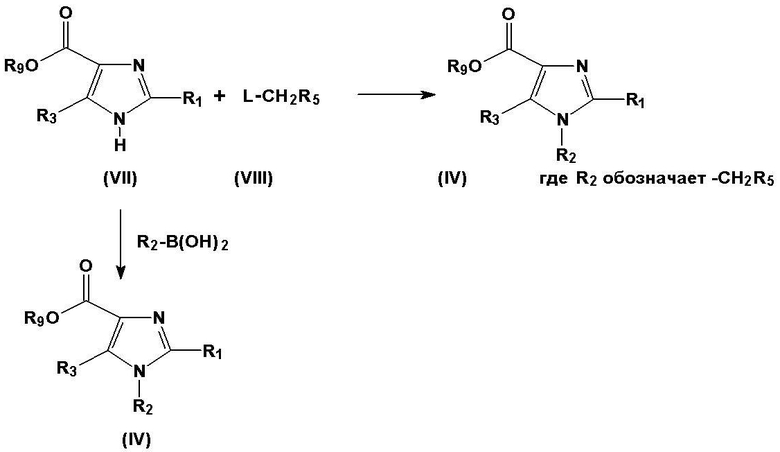
Схема 2: символы R1-R5 имеют значения, такие же, как приведено выше, R9 представляет собой алкил(С1-3). В соединениях общей формулы R2-B(ОН)2 R2 представляет собой фенил, который необязательно замещен, или гетероарильную группу, так называемый реактив Сузуки.
Альтернативно, соединение, имеющее общую формулу (VII), может реагировать с соединением общей формулы (VIII), где L представляет собой так называемую уходящую группу, например хлор, бром, йод или мезилокси (схема 2). Соединение, имеющее общую формулу (VII), может также реагировать с метилсульфониламиноалкилгалогенидом или метилсульфонилалкилгалогенидом, образуя метилсульфониламиноалкильную группу или метилсульфонилалкильную группу в положении 1 ядра имидазола. Такие реакции предпочтительно проводят в присутствии оснований, таких как гидрид натрия или карбонат калия, чтобы облегчить нуклеофильную атаку соединения (VII), для получения соединения формулы (IV), где R2 представляет собой группу -CH2R5, а R5 имеет значение, упомянутое выше.
Альтернативно, соединение, имеющее общую формулу (VII), может реагировать с соединением общей формулы R2-B(ОН)2, в котором R2 представляет собой фенил, который является необязательно замещенным, или гетероарильную группу, т.е. с так называемым реактивом Сузуки, образуя соединение общей формулы (IV). Соединения общей формулы (IV) могут быть преобразованы в соединения общей формулы (I) согласно схеме 1. Такие реакции могут катализироваться металлами.
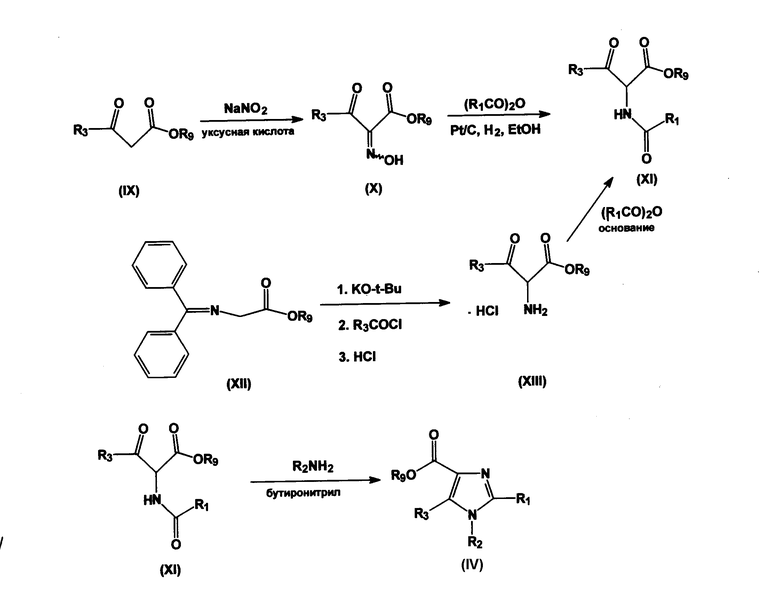
Схема 3: символы R1-R3 имеют значения, такие же, как приведено выше, R9 представляет собой алкил(С1-3).
Соединение, имеющее общую формулу (IX), может реагировать с производным нитрита, например нитрита натрия (NaNO2), образуя соединение общей формулы (X). (Схема 3). Соединение, имеющее общую формулу (X), может реагировать с ангидридом общей формулы (R1CO)2O в присутствии восстанавливающего агента, такого как водород, и катализатора, такого как Pd-на-угле (Pd/C) и т.п., в инертном органическом растворителе, например этаноле, образуя соединение общей формулы (XI). Соединение, имеющее общую формулу (XI), может реагировать с амином общей формулы R2NH2 в инертном растворителе, таком как бутиронитрил, образуя соединение общей формулы (IV). Соединения общей формулы (IV) могут быть преобразованы в соединения общей формулы (I) согласно схеме 1.
Альтернативно, соединение общей формулы (XI) может быть получено в двухстадийной реакции из соединения общей формулы (XII). Соединение общей формулы (XII) может быть депротонировано сильным основанием, таким как трет-бутоксид калия (KO-t-Bu), с последующей реакцией с ацилирующим соединением общей формулы R3COL, где L представляет собой уходящую группу, такую как хлорид, после чего проводят обработку кислотой, например соляной и т.п. Конечное соединение общей формулы (XIII) может реагировать с ангидридом общей формулы (R1CO)2O, образуя соединение формулы (XI). Альтернативно, соединение, имеющее общую формулу (X), может реагировать с восстанавливающим агентом, таким как водород, и катализатором, таким как Pd-на-угле (Pd/C) и т.п., в инертном органическом растворителе, например этаноле, в присутствии кислоты, например соляной, в результате чего образуется соединение общей формулы (XIII).
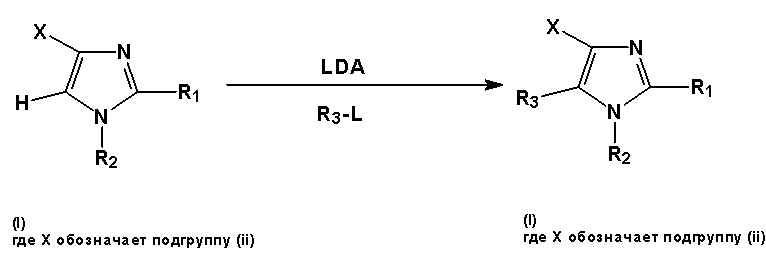
Схема 4: символы R1-R3 имеют значения, такие же, как приведено выше, X представляет собой подгруппу (ii).
Соединение, имеющее общую формулу (I), в которой X представляет собой подгруппу (ii), и в которой положение 5 молекулы имидазола содержит атом водорода, может быть депротонировано сильным ненуклеофильным основанием, таким как диизопропиламид лития (LDA), после чего проводят обработку группой R3-L, где L является уходящей группой, что ведет к образованию соединения общей формулы (I), в которой X является подгруппой (ii), и в которой положение 5 молекулы имидазола содержит заместитель R3 (схема 4).
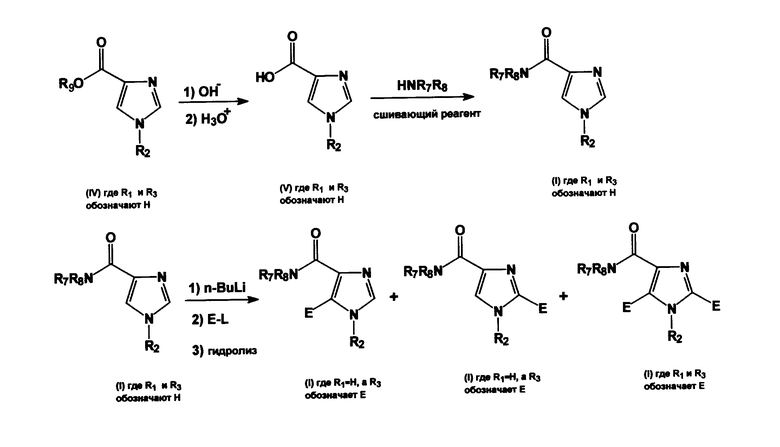
Схема 5: символы R2, R7, R8 и R9 имеют значения, такие же, как приведено выше, E является электрофильной молекулой, L представляет собой уходящую группу.
Производное имидазола общей формулы (IV), где R1 и R3 представляют собой водород, и где R9 имеет значение, упомянутое выше, может быть преобразовано через гидролиз сложного эфира, например, при использовании гидроксида лития (LiOH), NaOH, KOH или CsOH, что приводит к образованию промежуточного соединения в виде щелочных солей имидазолкарбоновых кислот, причем указанные соли могут быть подкислены, например, водным хлороводородом (HCl) для получения производных имидазолкарбоновых кислот общей формулы (V). Производные имидазолкарбоновых кислот общей формулы (V) могут быть амидированы, что приводит к образованию соединения общей формулы (I), где R1 и R3 представляют собой водород, а R2, R7 и R8 имеют значение, упомянутое выше. Указанное соединение общей формулы (I), в которой R1 и R3 представляют собой водород, а R2, R7 и R8 имеют значение, упомянутое выше, может быть депротонировано сильным ненуклеофильным основанием, таким как диизопропиламид лития (LDA), или n-BuLi, после чего проводят обработку группой E-L, в которой L представляет собой уходящую группу, такую как иодид, бромид, или S-алкил, а E является электрофильной группой, включая, но без ограничения, следующее: -S-алкил, первичный алкил, хлор, бром, йод или циано, чтобы получить соединение общей формулы (I), где X представляет собой подгруппу (ii) и где 2/5-положение молекулы имидазола содержит заместитель E и/или атом водорода в зависимости от типа группы E-L, примененной в указанной реакции (схема 5). Определение группы E является частью определения R1 и R3 и не выходит за рамки определения R1 и R3, данных выше. Смеси соединений, которые могут образоваться в последней стадии реакции в схеме 5, могут быть выделены и очищены, например, хроматографическими или кристаллизационными методами.
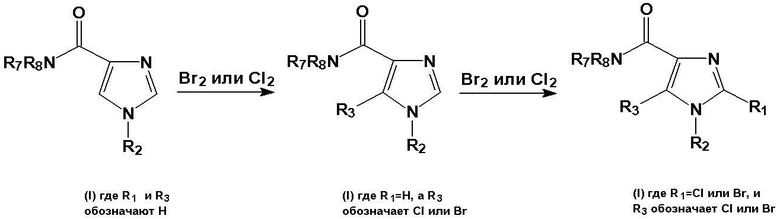
Схема 6: символы R2, R7 и R8 имеют значения, такие же, как приведено выше.
Соединение общей формулы (I), где R1 и R3 представляют собой водород, а R2, R7 и R8 имеют значение, упомянутое выше, может реагировать с галогенирующим агентом, таким как N-хлорсукцинимид (NCS) или бром (Br2), в инертном органическом растворителе, например дихлорметане, образуя соединение общей формулы (I), в которой R3 представляет собой Cl или Br, а R1 является атомом водорода. Соединение общей формулы (I), где R3 представляет собой Cl или Br, а R1 является атомом водорода, может реагировать с галогенирующим агентом, таким как N-хлорсукцинимид (NCS) или бром (Br2) в инертном органическом растворителе, например дихлорметане, образуя соединение общей формулы (I), в которой R3 представляет собой Cl или Br, и R1 представляет собой Cl или Br (схема 6).
Для получения более подробной информации относительно нуклеофилов, электрофилов и концепции уходящих групп см.: M.B. Smith and J. March: Advanced organic chemistry, p. 275, 5th ed., (2001) John Wiley & Sons, New York, ISBN: 0-471-58589-0).
Больше информации относительно введения и последующего удаления защитных групп в органическом синтезе может быть найдено в T.W. Greene and P.G.M. Wuts, "Protective Groups in Organic Synthesis", third edition, John Wiley & Sons, Inc., New York, 1999.
Фармацевтически приемлемые соли могут быть получены путем использования стандартных методик, известных в уровне техники, например, в результате смешивания соединения настоящего изобретения с подходящей кислотой, например неорганической кислотой, такой как соляная, или с органической кислотой, такой как фумаровая.
ФАРМАЦЕВТИЧЕСКИЕ ПРЕПАРАТЫ
Соединения изобретения могут быть переведены в формы, подходящие для введения посредством обычных способов, используя вспомогательные вещества, такие как жидкий или твердый материалы-носители. Фармацевтические композиции изобретения можно вводить энтерально, перорально, парентерально (внутримышечно или внутривенно), ректально или локально (местно). Их можно вводить в форме растворов, порошков, таблеток, капсул (включая микрокапсулы), мазей (крема или геля) или суппозиториев. Подходящими наполнителями для таких композиций являются стандартные фармацевтически жидкие или твердые наполнители и разбавители, растворители, эмульгаторы, смазки, ароматизаторы, красители и/или буферные вещества. Часто используемыми вспомогательными веществами, которые могут быть упомянуты, являются карбонат магния, диоксид титана, лактоза, маннит и другие сахара или сахароспирты, тальк, молочный белок, желатин, крахмал, целлюлоза и ее производные, животные и растительные масла, например жир печени рыбы, масла подсолнечника, арахиса или кунжута, полиэтиленгликоль и растворители, такие как, например, стерильная вода и моно- или многоатомные спирты, такие как глицерин.
Соединения настоящего изобретения обычно вводятся в виде фармацевтических композиций, которые являются важными и новыми вариантами исполнения изобретения из-за присутствия соединений, более предпочтительно специфических соединений, раскрытых в описании. Типы фармацевтических композиций, которые могут использоваться, включают, но без ограничения, таблетки, жевательные таблетки, капсулы, растворы, парентеральные растворы, суппозитории, суспензии и т.п., раскрытые в данном описании или очевидные специалисту в данной области техники из описания и общего знания в уровне техники. В вариантах исполнения изобретения приводится фармацевтическая упаковка или набор, включающие один или более контейнеров, наполненных одним или более компонентами фармацевтической композиции изобретения. Контейнер может включать различные письменные материалы, такие как инструкции по применению, или примечания в форме, предписанной правительственным агентством, регулирующим изготовление, использование или продажу фармацевтических продуктов, причем указанное примечание отражает одобрение агентства по поводу изготовления, использования или продажи для введения человеку или животным.
ФАРМАКОЛОГИЧЕСКИЕ МЕТОДЫ
In vivo и in vitro фармакологические испытания, связанные с нейротрансмиссией каннабиноидного CB2-рецептора, были описаны в литературе. Некоторые примеры:
• Ibrahim, M.M. et al. (2003) Proc. Natl. Acad. Sci. USA 100, 10529-10533.
• Hanus, L. et al. (1999) Proc. Natl. Acad. Sci. USA 96, 14228-14233.
• Zhang, J. et al. (2003) Eur. J. Neuroscience 17, 2750-2754.
• Klein, T.W. et al. (2003) J. Leukoc. Biol. 74, 486-496.
• Shoemaker, J.L. et al. (2005), J. Pharmacol. Exp. Ther. 315, 828-838.
• Iwamura, H. et al. (2001), J. Pharmacol. Exp. Ther. 296, 420-425.
In vitro аффинность к каннабиноидным CB 1 -рецепторам
Аффинность соединений изобретения к каннабиноидным рецепторам CB1 может быть определена с использованием препаратов мембран клеток яичника китайского хомячка (CHO), в которых человеческий каннабиноидный CB1-рецептор является стабильно трансфицированным вместе с [3H]СР-55,940 в качестве радиолиганда. После инкубации свежеприготовленного препарата мембран клеток с [3H]-лигандом с или без добавления соединений изобретения с помощью фильтрации на стекловолокнистых фильтрах проводится разделение связанного и свободного лиганда. Радиоактивность на фильтре измерена с помощью жидкостного сцинтилляционного метода.
In vitro аффинность к каннабиноидным CB 2 -рецепторам
Аффинность соединений изобретения к каннабиноидным рецепторам CB2 может быть определена с использованием препаратов мембран клеток яичника китайского хомячка (CHO), в которых человеческий каннабиноидный CB2-рецептор является стабильно трансфицированным вместе с [3H]СР-55,940 в качестве радиолиганда. После инкубации свежеприготовленного препарата мембран клеток с [3H]-лигандом с или без добавления соединений изобретения с помощью фильтрации на стекловолокнистых фильтрах проводится разделение связанного и свободного лиганда. Радиоактивность на фильтре измерена с помощью жидкостного сцинтилляционного метода.
Благодаря своей модулирующей активности в отношении каннабиноидных CB2-рецепторов соединения настоящего изобретения являются подходящими для использования в терапии расстройств иммунной системы, воспалительных расстройств, аллергий, боли, невропатической боли, рассеянного склероза, нейродегенеративных расстройств, деменции, дистонии, мышечной спастичности, тремора, эпилепсии, травматических повреждений головного мозга, инсульта, болезни Паркинсона, болезни Альцгеймера, эпилепсии, болезни Хантингтона, церебральной ишемии, кровоизлияния в мозг, черепно-мозговой травмы, раны спинного мозга, нейровоспалительных расстройств, нейродегенерации мозговой системы, атеросклероза, вирусного энцефалита, расстройств, связанных с демиелинизацией и других неврологических расстройств, а также в терапии раковых образований, диабета, желудочных заболеваний, заболеваний легких, астмы и сердечно-сосудистых заболеваний, также как и других заболеваний, в процесс которых вовлечена CB2-рецепторная нейропередача.
Соединения изобретения могут быть переведены в формы, подходящие для введения посредством обычных способов, с использованием вспомогательных веществ и/или жидких или твердых материалов-носителей.
ДОЗА
Аффинность соединений изобретения к каннабиноидным рецепторам CB2 была определена, как описано выше. По аффинности связывания, измеренной для данного соединения формулы (I), можно оценить теоретическую минимальную эффективную дозу. При концентрации соединения, равной двойному измеренному значению Ki, 100% каннабиноидных CB2-рецепторов вероятно будут заняты соединением. Преобразование указанной концентрации к мг соединения на кг веса пациента приводит к теоретической минимальной эффективной дозе, принимая биодоступность идеальной. Фармакокинетические, фармакодинамические и другие исследования могут изменить дозу, которую фактически вводят до более высокого или низкого значения. Доза, которую предпочтительно вводить, составляет 0,001-1000 мг/кг, предпочтительно 0,1-100 мг/кг веса пациента.
ТЕРАПИЯ
Используемый в описании термин "лечение" относится к лечению состояния или заболевания млекопитающего, предпочтительно человека, и включает: (1) предотвращение появления заболевания или патологического состояния у пациента, который может быть предрасположен к заболеванию, но у которого еще не было диагностировано наличие заболевания, (2) замедление заболевания или патологического состояния, т.е. остановка его развития, (3) освобождение от заболевания или патологического состояния, т.е. вызывая регресс патологического состояния, или (4) освобождение от патологических состояний, вызванных заболеванием, т.е. останавливая симптомы заболевания.
ПРИМЕРЫ
ПРИМЕР 1: МАТЕРИАЛЫ И МЕТОДЫ
Все реакции, включающие влагочувствительные соединения или условия, были выполнены в атмосфере безводного азота. Реакции были проверены с использованием тонкослойной хроматографии (ТСХ) на покрытых силикагелем пластиковых пленках (Merck precoated silica gel 60 F254) с обозначенным элюентом. Пятна визуализировались УФ светом (254 нм) или I2. Флэш-хроматография относится к очистке с использованием обозначенного элюента и силикагеля Acros (0,030-0,075 мм). Петролейный эфир означает петролейный эфир 40-60. Спектры ядерного магнитного резонанса (1H ЯМР и 13C ЯМР) были определены в обозначенном растворителе с тетраметилсиланом в качестве внутреннего стандарта. Химические сдвиги приведены в м.д. (δ масштаб) колебаний тетраметилсилана. Константы сцепления J приведены в герцах (Гц). Формы пиков в спектрах ЯМР обозначены символами «кв.» (квартет), «дкв.» (двойной квартет), «т» (триплет), «дт» (двойной триплет), «д» (дуплет), «дд» (двойной дуплет), «с» (синглет), «ушир.с» (уширенный синглет) и «м» (мультиплет). Точки плавления были зарегистрированы на аппарате для определения точек плавления Bϋchi B-545 или определены методом дифференциальной сканирующей калориметрии (ДСК). Выходы относятся к выделенным чистым продуктам.
Оборудование и процедура препаративной LC/MS
Sciex API 150 EX масс-спектрометр с электрораспылением
2 Shimadzu LC8A LC насос
Shimadzu SCL-10A VP системный контроллер
Shimadzu SPD-10A VP УФ
Gilson 215 инжектор/коллектор
(мл/мин)
ПРИМЕР 2: СИНТЕЗЫ СПЕЦИФИЧЕСКИХ СОЕДИНЕНИЙ
Специфические соединения, синтез которых описан ниже, предназначены, чтобы далее иллюстрировать изобретение более подробно, и таким образом, как считают, не ограничивают объем изобретения каким-либо способом. Другие варианты исполнения изобретения будут очевидны специалистам в данной области техники из рассмотрения описания и практического применения изобретения, раскрытого в описании. Таким образом, предусмотрено, что описание и соединения будут рассмотрены только выборочно, в соответствии с истинным объемом и сущностью изобретения, обозначаемыми в пунктах формулы изобретения.
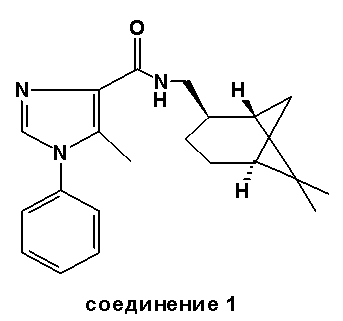
Синтез соединения 1
Часть A: Перемешиваемая магнитной мешалкой смесь этил 5-метил-1H-имидазол-4-карбоксилата (13,875 г, 0,090 моль), фенилбороновой кислоты (13,16 г, 0,108 моль) и CuI (0,85 г, 0,0045 моль) в этаноле/воде (900 мл, 1/1 (об./об.)) была разделена на 12 равных частей и реагировала параллельно при 85°C в течение 60 час. После охлаждения до комнатной температуры эти 12 частей были объединены и сконцентрированы в вакууме. Остаток был очищен флэш-хроматографией (этилацетат/петролейный эфир 40-65=1/1 (об./об.)), в результате чего был получен этил 5-метил-1-фенил-1H-имидазол-4-карбоксилат (5,88 г, выход 26%).
1H-ЯМР (400 МГц, CDCl3): δ 1,42 (т, J=7 Гц, 3H), 2,47 (с, 3H), 4,40 (кв., J=7 Гц, 2H), 7,26-7,31 (м, 2H), 7,48-7,56 (м, 3H), 7,59 (с, 1H).
Часть B: (-)-Цис-миртаниламин (CAS 38235-68-6) (0,95 мл, 5,7 ммоль) был растворен в безводном дихлорметане (15 мл), после чего был добавлен (CH3)3Al (2,9 мл 2М раствора в гептане, 5,8 ммоль). Полученную смесь перемешивали магнитной мешалкой в течение 10 мин при комнатной температуре, после чего был добавлен этил 5-метил-1-фенил-1H-имидазол-4-карбоксилат (1,1 г, 4,8 ммоль). Полученную смесь перемешивали при 35°C в течение 16 час, выливали в водный раствор NaHCO3, перемешивали в течение 30 мин и фильтровали на Hyflo. Фильтрат был дважды экстрагирован дихлорметаном. Органические слои были высушены над Na2SO4, отфильтрованы и сконцентрированы в вакууме. Последующая очистка флэш-хроматографией (этилацетат/петролейный эфир 40-65=1/2 (об./об.)) дала N-[(1R,2S,5R)-rel-6,6-диметилбицикло[3.1.1]гептан-2-метил]-5-метил-1-фенил-1H-имидазол-4-карбоксамид, соединение 1 (1,05 г, выход 65%).
Точка плавления: 85-89°C.
Аналогично были получены следующие соединения 2-7
Соединение 2: Точка плавления: 214-219°C.
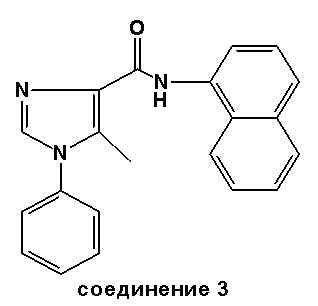
Соединение 3: Точка плавления: 167-169°C.
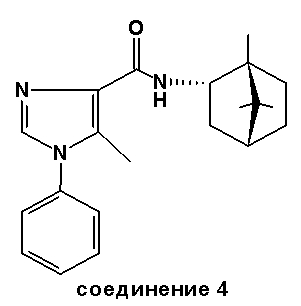
Соединение 4: из R-(+)-борниламина (CAS 32511-34-5).
Точка плавления: 209-212°C.
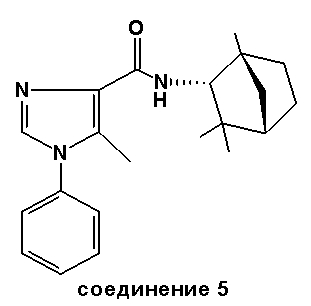
Соединение 5: из эндо-(1R)-1,3,3-триметилбицикло[2.2.1]гептан-2-амина.
Точка плавления: 149-152°C.
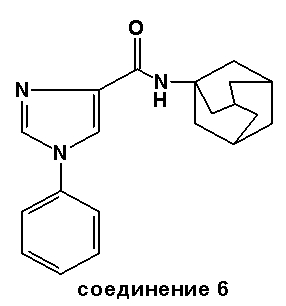
Соединение 6: Точка плавления: 198-200°C.
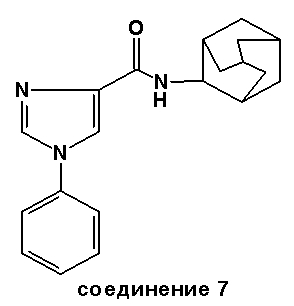
Соединение 7: Точка плавления: 232-234°C.
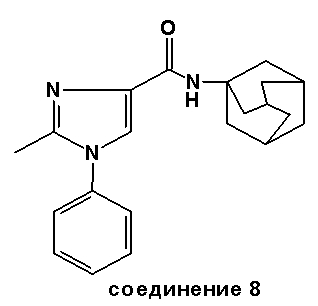
Синтез соединения 8
Часть A: Этил 2-метил-1-фенил-1H-имидазол-4-карбоксилат (4,8 г, выход 21%) был получен согласно описанной методике (в J. Heterocyclic Chem. 1987, 24, 1757-1763) из этил 3-анилино-2-нитроакрилата (23,6 г, 0,01 моль) и триэтилортоацетата (150 мл). Первоначально образованный неочищенный продукт был очищен флэш-хроматографией (элюент: диэтиловый эфир), Rf (диэтиловый эфир ~0,15), чтобы получить чистый этил 2-метил-1-фенил-1H-имидазол-4-карбоксилат в виде масла.
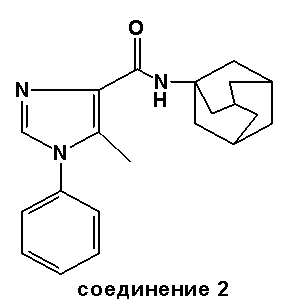
Часть B: Этил 2-метил-1-фенил-1H-имидазол-4-карбоксилат (2,25 г, 0,012 моль) подвергают взаимодействию (аналогично методике, описанной выше для соединения 1) с AlMe3 (7,2 мл 2M раствора в гексане, 0,0144 моль) и 1-адамантанамин·HCl (2,25 г, 0,012 моль). Первоначально образованный неочищенный продукт был очищен флэш-хроматографией (элюент: диэтиловый эфир), чтобы получить N-адамантил-2-метил-1-фенил-1H-имидазол-4-карбоксамид (2,2 г, выход 55%). Точка плавления: 207-210°C.
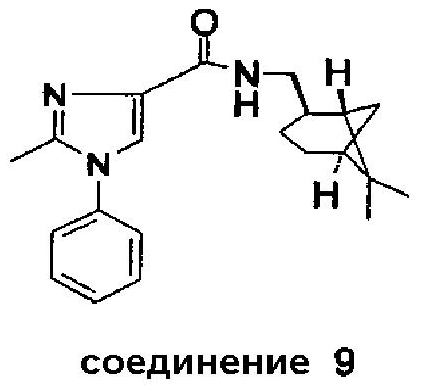
Соединение 9 было получено аналогично соединению 6 из (-)-цис-миртаниламина (CAS 38235-68-6).
Точка плавления: 124-127°C.
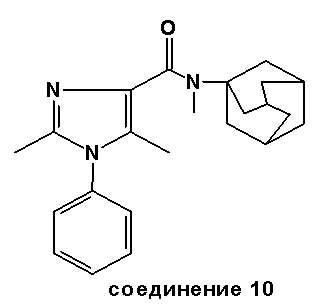
Соединение 10: N-адамантил-2-метил-1-фенил-1H-имидазол-4-карбоксамид (0,33 г, 0,001 моль) растворяли в безводном тетрагидрофуране (25 мл). Полученный раствор медленно добавляли к раствору диизопропиламида лития (1,25 мл 2М раствора в гептан/ТГФ, 0,0025 моль LDA) под N2 при -70°C. Затем добавляли раствор метилиодида (0,14 г, 0,001 моль) в безводном ТГФ, и полученный раствор перемешивали в течение 1 час при -70°C. Раствору позволили достигнуть комнатной температуры и перемешивали в течение еще 2 час, после чего нейтрализовали водной уксусной кислотой. После концентрации в вакууме полученный остаток очищали флэш-хроматографией (диэтиловый эфир/петролейный эфир (40-60)=3/1 (об./об.)), чтобы получить соединение 10 и соединение 11 соответственно.
Точка плавления соединения 10: 180-183°C.
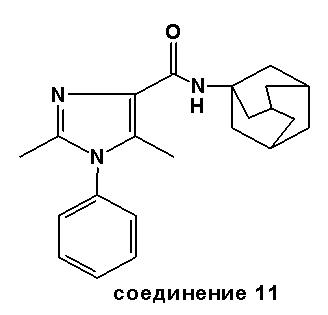
Соединение 11: Соединение 11 было получено более эффективно, реакцией этил 2,5-диметил-1-фенил-1H-имидазол-4-карбоксилата (сравнить соответствующий метиловый эфир 3j в J. Heterocyclic Chem. 1987, 24, 1757-1763) с AlMe3 и 1-адамантанамин·HCl, в соответствии с методикой амидирования Вайнреба (Weinreb), описанной выше для соединения 1, часть B.
Точка плавления: 201-204°C.
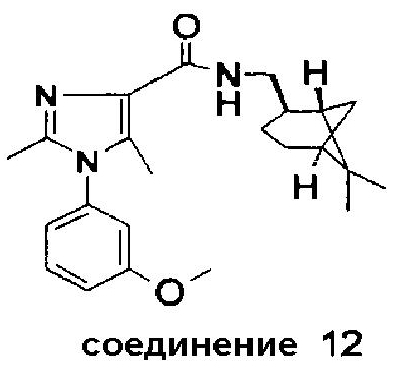
Синтез соединения 12
Часть A: Этил 2,5-диметил-1-(3-метоксифенил)-1H-имидазол-4-карбоксилат был получен аналогично процедуре, описанной в J. Heterocyclic Chem. 1987, 24, 1757-1763, из этил 3-(3-метоксифениламино)-3-метил-2-нитроакрилата и триэтилортоацетата.
Часть B: Этил 2,5-диметил-1-(3-метоксифенил)-1H-имидазол-4-карбоксилат был амидирован (аналогично процедуре, описанной выше для соединения 1) (при перемешивании при 70°C в течение 16 час) с AlMe3 и (-)-цис-миртаниламином (CAS 38235-68-6), образуя соединение 12. Точка плавления: 153-155°C.
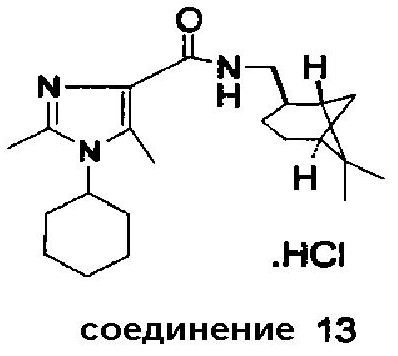
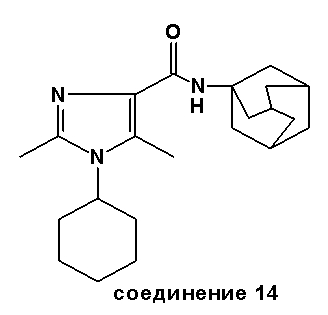
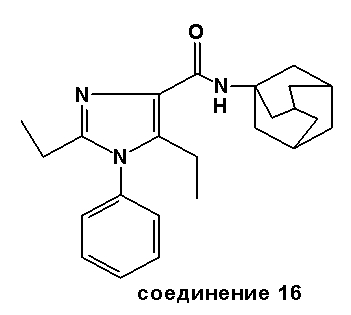
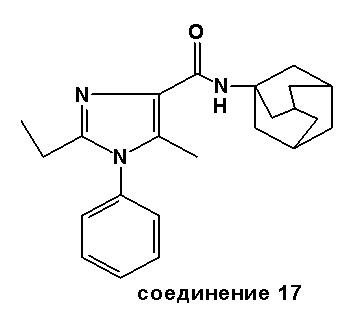
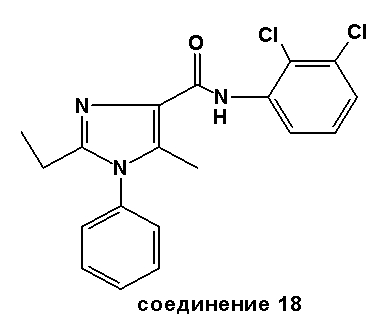
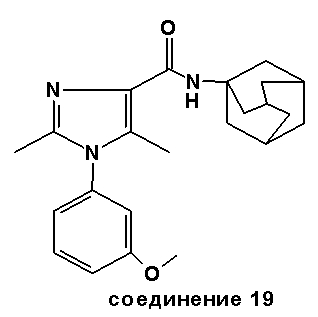
Аналогично были получены соединения 13-20.

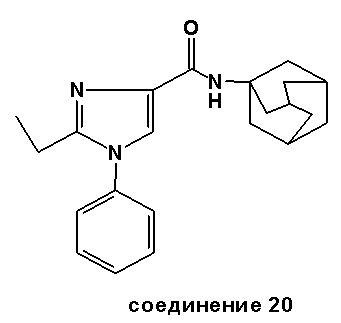
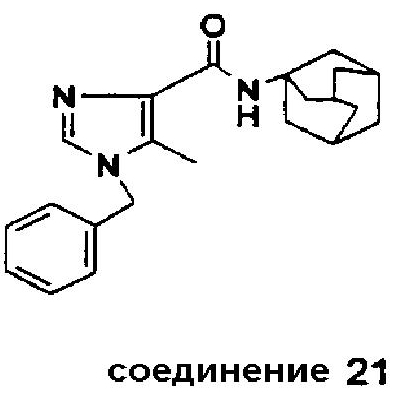
Синтез соединения 21
Часть A: К перемешиваемой магнитной мешалкой суспензии этил 4-метил-1H-имидазол-5-карбоксилата (15,42 г, 0,100 моль) в безводном ТГФ медленно добавляли гидрид натрия (NaH) (4,88 г 60%-й суспензии, 0,120 моль) и получившуюся смесь перемешивали при комнатной температуре в течение 30 мин. Бензилбромид (13,8 мл, 0,120 моль) медленно добавляли, и получившаяся смесь реагировала в течение 16 час. Затем к смеси была добавлена вода. Органический слой отделяли от водного слоя. Водный слой экстрагировали 3 раза этилацетатом. Органический слой высушивали над MgSO4, отфильтрован и полностью сконцентрирован в виде масла. Полученный остаток очищали (чтобы разделить два образованных региоизомера) флэш-хроматографией (градиент диэтилового эфира/этилацетата) с получением этил N-бензил-5-метил-1H-имидазол-4-карбоксилата (11,4 г, выход 47%).
1H-ЯМР (400 MГц, CDCl3): δ 1,40 (т, J=7 Гц, 3H), 2,45 (с, 3H), 4,37 (кв., J=7 Гц, 2H), 5,10 (с, 2H), 7,03-7,08 (м, 2H), 7,28-7,38 (м, 3H), 7,48 (с, 1H).
Часть B: Этил N-бензил-5-метил-1H-имидазол-4-карбоксилат (1,5 г, 0,0061 моль) подвергают взаимодействию с адамантил-1-амин·HCl (1,72 г, 0,0092 моль) и Al(CH3)3 (4,6 мл, 2M в гексане, 0,0092 моль) в 1,2-дихлорэтане (20 мл) при 70°C в течение 40 час согласно методике, описанной для соединения 1, часть B. Очистка флэш-хроматографией (этилацетат/петролейный эфир = 1/1 (об./об.)) дала соединение 21 (1,24 г, 58%).
Точка плавления: 182-184°C.
Аналогично были получены соединения 22, 23 и 23A:
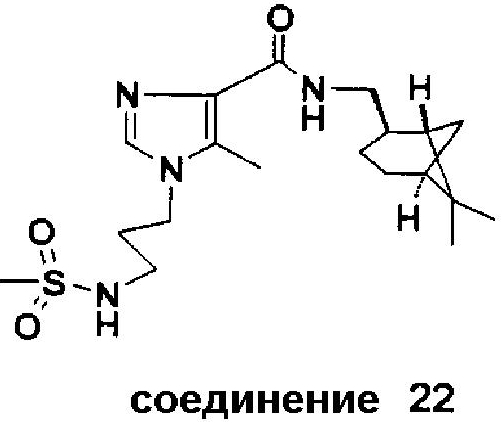
Синтез соединения 22
Соединение 22 было получено в результате реакции 3-(метилсульфониламино)пропилхлорида с этил 4-метил-1H-имидазол-5-карбоксилатом, с использованием K2CO3 как основания, в ДМФА при 90°C в течение 20 час, с последующим разделением двух образованных региоизомеров флэш-хроматографией (этилацетат/метанол = 9/1 (об./об.)), за которой последовало катализируемое Al(CH3)3 амидирование с (-)-цис-миртаниламином.
Соединение 22. Точка плавления: 84-108°C. Rf 0,35 (EtOAc/MeOH = 4/1 (об./об.)).
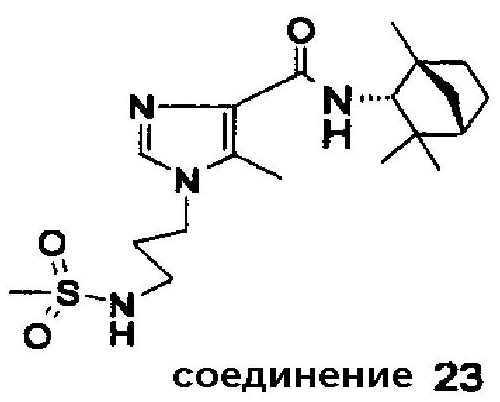
Соединение 23 (из эндо-(1R)-1,3,3-триметилбицикло[2.2.1]гептан-2-амина). Точка плавления: 149-156°C. Rf 0,4 (EtOAc/MeOH = 4/1 (об./об.)).
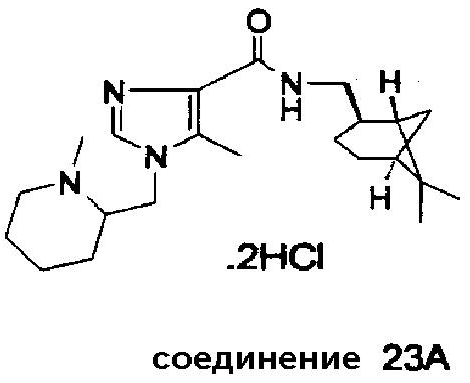
Синтез соединения 23A
Соединение 23A было получено в результате взаимодействия 1-метилпиперидин-2-илметил·HCl эфира метансульфоновой кислоты с этил 4-метил-1H-имидазол-5-карбоксилатом, с использованием KOH в качестве основания в диметилсульфоксиде при 60°C в течение 40 час, с последующим разделением образованных региоизомеров флэш-хроматографией (дихлорметан/метанол = 95/5 (об./об.)), с последующей конверсией полученного эфира до соответствующей карбоновой кислоты (гидроксид лития/ТГФ/вода; при 60°C в течение 20 час) и взаимодействием образованной карбоновой кислоты с (-)-цис-миртаниламином, используя PyBOP (бензотриазол-1-илокситрис(пирролидинo)-фосфония гексафторфосфат) в качестве сшивающего реагента в присутствии диизопропилэтиламина в дихлорметане. Неочищенное соединение 23A было далее очищено флэш-хроматографией (дихлорметан/метанол = 95/5 (об./об.)), сопровождаемой преобразованием выделенного свободного основания до дигидрохлорида. Соединение 23A. Точка плавления: 148-153°C.
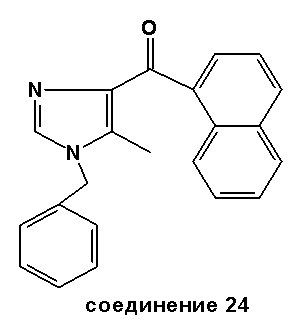
Синтез соединения 24
Часть A: К перемешиваемому магнитной мешалкой раствору этил N-бензил-5-метил-1H-имидазол-4-карбоксилата (8,4 г, 0,0345 моль) в метаноле (200 мл) медленно добавляли раствор KOH (7,3 г, чистота 85%, 0,110 моль) и полученную смесь нагревали при 80°C в течение 2 час. Раствор охлаждали до комнатной температуры и концентрировали, затем добавляли HCl (9,2 мл). Полученный осадок собирали фильтрацией с получением N-бензил-5-метил-1H-имидазол-4-карбоновой кислоты (6,77 г, выход 91%).
Точка плавления: 292°C (с разложением).
Часть B: К перемешиваемому магнитной мешалкой раствору N-бензил-5-метил-1H-имидазол-4-карбоновой кислоты (6,77 г, 0,031 моль) в безводном ацетонитриле (35 мл) последовательно добавляли диизопропилэтиламин (DIPEA) (17,2 мл, 0,0992 моль), HBTU (14,098 г, 0,0372 моль) и метоксиметиламин (3,63 г, 0,0372 моль). Полученная смесь реагировала при 20°C в течение 16 час и впоследствии была сконцентрирована в вакууме. Полученный остаток собирали этилацетатом и последовательно промывали 5%-м водным раствором NaHCO3 и водой. Органический слой высушивали над MgSO4, отфильтровывали и концентрировали в вакууме. Полученный масляный остаток (18,45 г) очищали флэш-хроматографией (этилацетат/ацетон = 7/3 (об./об.)) с получением N-метокси-N-метил-5-метил-1-бензил-1H-имидазол-4-карбоксамида (10,77 г, выход 82%).
МН+ = 260.
1H-ЯМР (400 MГц, CDCl3): δ 2,34 (с, 3H), 3,47 (с, 3H), 3,77 (с, 3H), 5,09 (с, 2H), 7,05-7,10 (м, 2H), 7,18-7,28 (м, 3H), 7,48 (с, 1H).
Часть C: К перемешиваемому магнитной мешалкой раствору 1-нафтилмагнийбромида (49 мл, 0,25 М в ТГФ, 0,00123 моль) добавляли раствор N-метокси-N-метил-5-метил-1-бензил-1H-имидазол-4-карбоксамида (2,69 г, 0,0104 моль) в безводном ТГФ (10 мл) и полученный раствор перемешивали в течение 1 час. Реакционную смесь нейтрализовали 1N HCl (21 мл) и последовательно экстрагировали этилацетатом (EtOAc). Слой EtOAc дважды промывали водой, высушивали над MgSO4, отфильтровывали и концентрировали в вакууме. Полученный неочищенный остаток очищали флэш-хроматографией (этилацетат/петролейный эфир = 1/1 (об./об.)), за которой последовала другая флэш-хроматографическая очистка (дихлорметан/метанол = 99/1 (об./об.)), в результате чего было получено чистое соединение 24 (1,35 г, выход 66%) в виде масла.
1H-ЯМР (400 MГц, CDCl3): δ 2,58 (с, 3H), 5,12 (с, 2H), 7,08-7,13 (м, 2H), 7,31-7,40 (м, 3H), 7,44-7,56 (м, 4H), 7,78-7,82 (м, 1H), 7,84-7,89 (м, 1H), 7,92-7,96 (м, 1H), 8,16-8,22 (м, 1H).
Синтез соединения 25
Аналогично было получено соединение 25 (из N-метокси-N-метил-5-метил-1-фенил-1H-имидазол-4-карбоксамида и н-гексиллития в безводном диэтиловом эфире). Флэш-хроматографическая очистка (метил-трет-бутиловый эфир/петролейный эфир = 1/3 (об./об.)) первоначально выделенного неочищенного продукта дала соединение 25 (выход 24%) в виде масла бледно-желтого цвета.
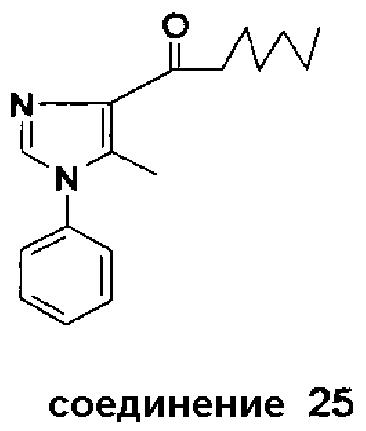
Соединение 25. 1H-ЯМР (400 MГц, CDCl3): δ 0,86-0,94 (м, 3H), 1,25-1,47 (м, 6H), 1,70-1,80 (м, 2H), 2,50 (с, 3H), 3,04-3,11 (м, 2H), 7,26-7,32 (м, 2H), 7,50-7,59 (м, 4H).
Аналогично было получено соединение 26
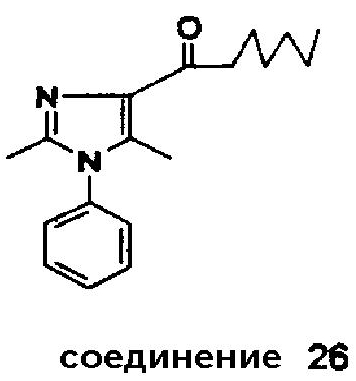
Соединение 26; Rf (метанол/дихлорметан = 3/97 (об./об.), силикагель) = 0,65.
Синтез соединения 27
К перемешиваемому магнитной мешалкой раствору N-(адамант-1-ил)-1-фенил-1H-имидазол-4-карбоксилата (1,61 г, 0,005 моль) в дихлорметане (20 мл) добавляли раствор Br2 (0,52 мл, 0,010 ммоль) в дихлорметане (5 мл). Полученная смесь реагировала при комнатной температуре в течение 4 час. Дихлорметан и 5%-й водный раствор NaHCO3 добавляли к реакционной смеси. Отделенный органический слой высушивали над MgSO4, отфильтровывали и концентрировали в вакууме. Полученный остаток очищали флэш-хроматографией (дихлорметан/ацетон = 19/1 (об./об.)). Последующая перекристаллизация из ацетонитрила дала N-(адамант-1-ил)-5-бром-1-фенил-1H-имидазол-4-карбоксамид (0,51 г, выход 26%). Точка плавления: 229-232°C.
Аналогично было получено соединение 28 с 17%-м выходом, используя N-хлорсукцинимид (NCS) как хлорирующий агент, в течение 40 час при комнатной температуре. Флэш-хроматография (дихлорметан/ацетон = 19/1 (об./об.)). Точка плавления: 209-213°C.
Синтез соединения 29
К перемешиваемому магнитной мешалкой раствору N-(адамант-1-ил)-5-бром-1-фенил-1H-имидазол-4-карбоксилата (0,60 г) в дихлорметане (20 мл) добавляли раствор Br2 (0,30 мл) в дихлорметане (5 мл) и триэтиламин (0,21 мл). Полученная смесь реагировала при комнатной температуре в течение 50 час. Дихлорметан и 5%-й водный раствор NaHCO3 добавляли к реакционной смеси. Отделенный органический слой высушивали над MgSO4, отфильтровывали и концентрировали в вакууме. Полученный остаток очищали флэш-хроматографией (дихлорметан). Последующее перемешивание в диэтиловом эфире, сопровождаемое фильтрацией, дало N-(адамант-1-ил)-2,5-дибром-1-фенил-1H-имидазол-4-карбоксамид (0,29 г). Точка плавления: 228-231°C.
Аналогично было получено соединение 30 с 32%-м выходом из N-(адамант-1-ил)-5-хлор-1-фенил-1H-имидазол-4-карбоксилата с использованием N-хлорсукцинимида (NCS) в качестве хлорирующего агента. Точка плавления: 193-195°C.
Синтез соединения 31
К перемешиваемой магнитной мешалкой суспензии N-(адамант-1-ил)-2-метил-1-фенил-1H-имидазол-4-карбоксилата (2,01 г, 0,006 моль) в безводном ТГФ (20 мл) под N2 при -70°C медленно добавляли раствор диизопропиламида лития (LDA) (9,0 мл 2М раствора в гептан/ТГФ, 0,018 моль LDA) и полученный раствор перемешивали в течение 1 час под N2 при -70°C. Затем добавляли раствор пара-толуолсульфонилцианида (1,63 г, 0,009 моль) в безводном ТГФ (10 мл) и полученный раствор перемешивали в течение 1 час при -70°C. Раствор доводили до комнатной температуры и перемешивали в течение еще 12 час, после чего реакцию останавливали водой. Смесь экстрагировали диэтиловым эфиром. Органический слой высушивали над MgSO4, отфильтровывали и концентрировали в вакууме. Полученный остаток очищали флэш-хроматографией (дихлорметан/ацетон = 19/1 (об./об.)) и впоследствии перекристаллизовывали из ацетонитрила, в результате чего получали соединение 31 (0,23 г, выход 11%). Точка плавления соединения 31: 246-248°C.
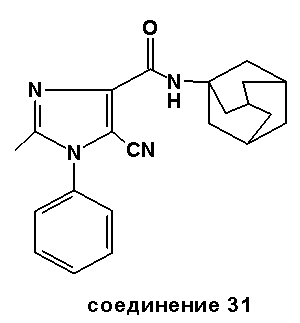
Аналогично было получено соединение 32 из N-(адамант-1-ил)-2-метил-1-фенил-1H-имидазол-4-карбоксилата с использованием диметилдисульфида (CH3SSCH3) с 31%-м выходом. Точка плавления: 172-173°C.
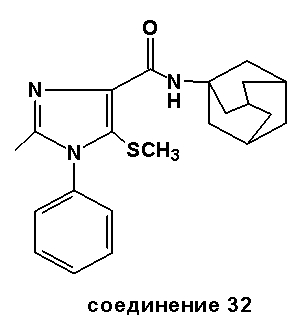
Аналогично было получено соединение 33 из N-(адамант-1-ил)-2-метил-1-фенил-1H-имидазол-4-карбоксилата с использованием пара-толилсульфонилхлорида с 28%-м выходом. Точка плавления: 216-218°C.
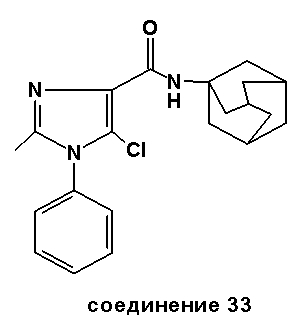
Аналогично было получено соединение 33A из N-(адамант-1-ил)-2-метил-1-фенил-1H-имидазол-4-карбоксилата с использованием пара-толилсульфонилбромида. Точка плавления: 242-244°C.
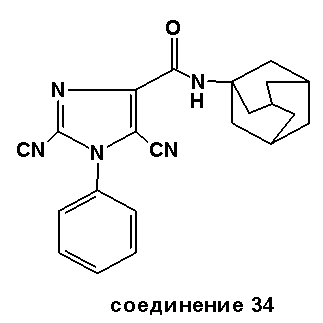
Аналогично было получено соединение 34 из N-(адамант-1-ил)-1-фенил-1H-имидазол-4-карбоксилата с использованием пара-толилсульфонилцианида с 7%-м выходом.
Точка плавления: 237-239°C.
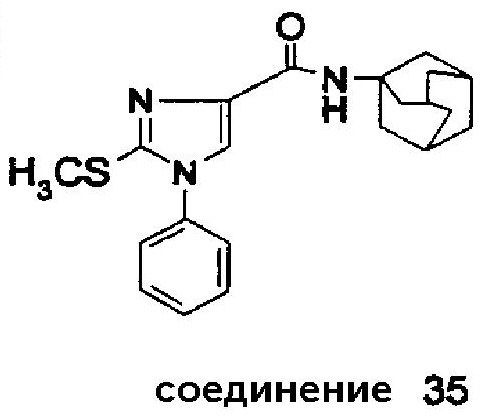
Аналогично было получено соединение 35 из N-(адамант-1-ил)-1-фенил-1H-имидазол-4-карбоксилата с использованием диметилдисульфида (CH3SSCH3) с 12% выходом.
Точка плавления: 166-168°C.
Общие сведения: Все соединения 36-114 были получены согласно общему методу, приведенному в схеме 3, выше. Полученные соединения общей формулы (IV) были преобразованы (см. схему 1, выше) через соответствующие карбоновые кислоты общей структуры (V) в соединения общей формулы (I), где X представляет собой подгруппу (ii)
Синтез соединения 36
Часть A: NaNO2 (13,8 г) растворяли в воде (48 мл) при 4°C. Полученный раствор медленно добавляли к перемешиваемому магнитной мешалкой раствору метилового эфира 3-оксомасляной кислоты (17,4 г, 0,15 моль), поддерживая температуру <5°C. После перемешивания смеси в течение 2 час добавляли воду (120 мл) и полученную смесь дважды экстрагировали диэтиловым эфиром. Объединенные органические слои последовательно промывали водой и 5%-м водным раствором NaHCO3. Органический слой высушивали над MgSO4, отфильтровывали и полностью концентрировали с получением неочищенного метилового эфира 2-гидроксиимино-3-оксомасляной кислоты (24 г) в виде бесцветного масла без последующей очистки.
1H-ЯМР (400 MГц, CDCl3): δ 2,42 (с, 3H), 3,91 (с, 3H), 9,90 (ушир.с, 1H).
Часть B: Неочищенный метиловый эфир 2-гидроксиимино-3-оксомасляной кислоты (24 г, ~0,15 моль), растворенный в перемешиваемой магнитной мешалкой смеси уксусной кислоты (293 мл), уксусного ангидрида (110 мл) и Pd/C (4 г), гидрогенизировали в течение 20 час при комнатной температуре при давлении H2 1 атм. После фильтрации на Hyflo уксусная кислота и уксусный ангидрид удаляли концентрацией в вакууме. Полученную неочищенную смесь очищали флэш-хроматографией (дихлорметан/метанол = 95/5 (об./об.)), в результате чего получали метиловый эфир 2-ацетиламино-3-оксомасляной кислоты (16,7 г, выход 60%) в виде белого твердого вещества. Rf (дихлорметан/метанол = 95/5 (об./об.)) = 0,4.
1H-ЯМР (400 MГц, CDCl3): δ 2,08 (с, 3H), 2,40 (с, 3H), 3,83 (с, 3H), 5,29 (д, J~7 Гц, 1H), 6,71 (ушир., 1H).
Часть C: К перемешиваемому магнитной мешалкой раствору метилового эфира 2-ацетиламино-3-оксомасляной кислоты (5 г, 28,9 ммоль) в бутиронитриле добавляли анилин (3,42 мл) и трифторуксусную кислоту (2,89 мл), после чего полученную смесь нагревали с обратным холодильником в течение 45 мин. Бутиронитрил удаляли в вакууме при комнатной температуре и полученные остатки собирали дихлорметаном и промывали дважды водным раствором карбоната калия. Органический слой высушивали над MgSO4, отфильтровывали и концентрировали в вакууме. Полученный остаток очищали флэш-хроматографией (диэтиловый эфир/ацетон = 4/1 (об./об.)) с получением метил 2,5-диметил-1-фенил-1H-имидазол-4-карбоксилата (3,0 г, выход 46%).
1H-ЯМР (400 MГц, CDCl3): δ 2,22 (с, 3H), 2,33 (с, 3H), 3,91 (с, 3H), 7,18-7,22 (м, 2H), 7,51-7,59 (м, 3H).
Часть D: К перемешиваемому магнитной мешалкой раствору метил 2,5-диметил-1-фенил-1H-имидазол-4-карбоксилата (8,0 г, 0,035 моль) в ТГФ (100 мл) добавляли раствор LiOH (1,68 г) в воде (100 мл). Полученную смесь нагревали при 70°C в течение 16 час, затем охлаждали до комнатной температуры и подкисляли 2 молярными эквивалентами 1 н. раствора HCl. Образованный осадок собирали с получением неочищенной 2,5-диметил-1-фенил-1H-имидазол-4-карбоновой кислоты (7,0 г, выход 93%).
1H-ЯМР (400 MГц, ДМСО-d6): δ 2,31 (с, 3H), 2,43 (с, 3H), 7,56-7,61 (м, 2H), 7,66-7,71 (м, 3H).
Часть Е: К перемешиваемому магнитной мешалкой раствору 2,5-диметил-1-фенил-1H-имидазол-4-карбоновой кислоты (0,6 г, 0,0028 моль) в ацетонитриле (35 мл) последовательно добавляли диизопропилэтиламин (DIPEA, основание Хюнига) (1,27 г), гексафторфосфат O-бензотриазол-1-ил-N,N,N',N'-тетраметилурония (HBTU) (1,27 г) и (-)-цис-миртаниламин (1,05 мл, 0,0028 моль). Полученная смесь реагировала при 20°C в течение 16 час и впоследствии была сконцентрирована в вакууме. Полученный остаток собирали дихлорметаном и промывали 5%-м водным раствором NaHCO3. Органический слой высушивали над MgSO4, отфильтровывали и концентрировали в вакууме. Полученный остаток очищали флэш-хроматографией (дихлорметан/метанол = 95/5 (об./об.)) с получением N-[(1R,2S,5R)-rel-6,6-диметилбицикло[3.1.1]гептан-2-метил]-2,5-диметил-1-фенил-1H-имидазол-4-карбоксамида (соединение 36) (0,70 г, выход 72%). Rf (силикагель/дихлорметан/метанол = 95/5 (об./об.)) ~0,6.
Аналогично были получены соединения 37-47:
Соединение 37: 1H-ЯМР (400 MГц, CDCl3): δ 1,26 (т, J=7 Гц, 3H), 2,41 (с, 3H), 2,56 (кв., J=7 Гц, 2H), 7,23-7,28 (м, 2H), 7,49-7,60 (м, 6H), 7,66 (д, J=8 Гц, 1H), 7,88 (д, J=8 Гц, 1H), 8,11 (д, J=8 Гц, 1H), 8,28 (д, J=8 Гц, 1H), 9,85 (с, 1H).

Соединение 38: Точка плавления: 177-179°C.

Соединение 39: из эндо-(1S)-1,3,3-триметилбицикло[2.2.1]гептан-2-амина.
Точка плавления: 130-132°C (ДСК).

Соединение 40: из эндо-(1S)-1,3,3-триметилбицикло[2.2.1]гептан-2-амина.
1H-ЯМР (300 MГц, CDCl3): δ 0,89 (с, 3H), 0,96 (т, J=7 Гц, 3H), 1,12 (с, 3H), 1,17-1,27 (м, 5H), 1,40-1,60 (м, 2H), 1,67-1,81 (м, 3H), 2,15 (с, 3H), 2,70-2,95 (м, 2H), 3,78 (дд, J~10 и 2 Гц, 1H), 7,18-7,23 (м, 2H), 7,34 (ушир.д, J~10 Гц, 1H), 7,48-7,57 (м, 3H).
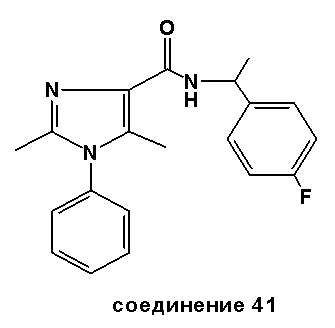
Соединение 41: Точка плавления: 117,5-120°C (ДСК).
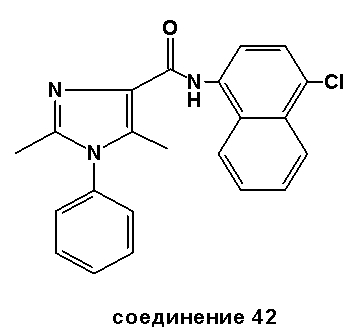
Соединение 42: Точка плавления: 193-196°C (ДСК).
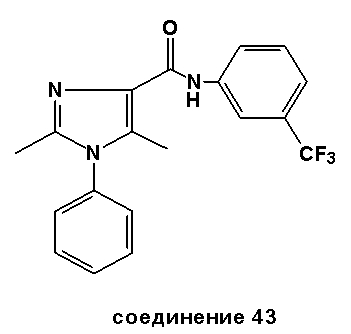
Соединение 43: Точка плавления: 157-159°C (ДСК).
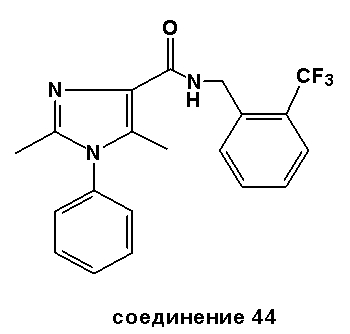
Соединение 44: Точка плавления: 76-79°C (ДСК).
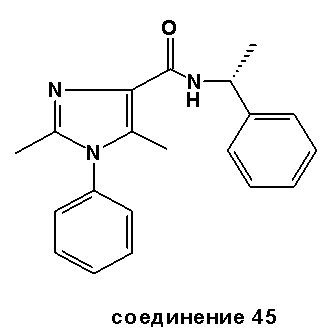
Соединение 45: из R-(+)-фенилэтиламина.
1H-ЯМР (300 MГц, CDCl3): δ 1,58-1,61 (м, 3H), 2,17 (с, 3H), 2,33 (с, 3H), 5,25-5,35 (м, 1H), 7,15-7,54 (м, 11H).
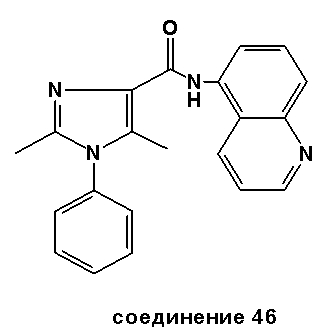
Соединение 46: Точка плавления: 139-141°C (ДСК).
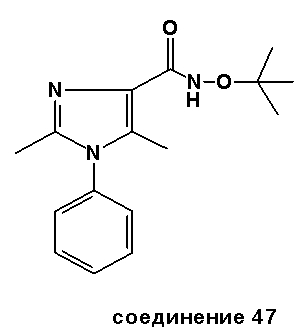
Соединение 47: 1H-ЯМР (400 MГц, CDCl3): δ 1,10 (с, 9H), 1,69 (с, 3H), 2,24 (с, 3H), 7,00-7,06 (м, 2H), 7,46-7,55 (м, 3H), пик NH невидим и вероятно слит с пиком H2O при δ 1,60.
Синтез соединения 48
К перемешиваемому магнитной мешалкой раствору 2,5-диметил-1-фенил-1H-имидазол-4-карбоновой кислоты (0,66 г, 0,00306 моль) в дихлорметане (35 мл) последовательно добавляли диизопропилэтиламин (DIPEA) (3,1 мл), CIP (гексафторфосфат 2-хлор-1,3-диметилимидазолиния) (2,55 г) и 3-гидроксиадамантанамин (0,612 г, 0,00366 моль). Полученная смесь реагировала при 20°C в течение 16 час, после чего была сконцентрирована в вакууме. Полученный остаток собирали дихлорметаном и промывали 5%-м водным раствором NaHCO3. Органический слой высушивали над MgSO4, отфильтровывали и концентрировали в вакууме. Полученный остаток очищали флэш-хроматографией (дихлорметан/метанол = 98/2 (об./об.)) с получением N-(3-гидроксиадамант-1-ил)-2,5-диметил-1-фенил-1H-имидазол-4-карбоксамида (0,75 г, выход 67%). Rf (силикагель/дихлорметан/метанол = 98/2 (об./об.)) ~0,6. Точка плавления: 215-220°C.

Аналогично были получены соединения 49-85:
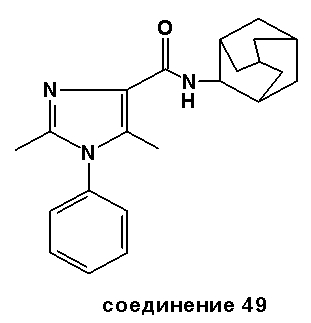
Соединение 49: Точка плавления: 245-247°C.
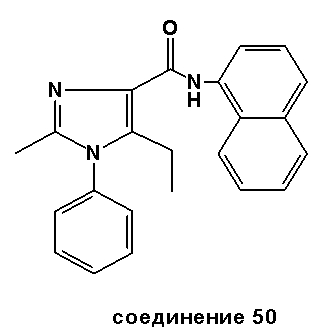
Соединение 50: Точка плавления: 251-253°C.

Соединение 51: (из рацемического эндо-2-аминобицикло[2.2.1]гептана:
1H-ЯМР (400 MГц, ДМСО-d6): δ 0,85-1,64 (м, 8H), 2,13 (с, 3H), 2,21 (ушир.с, 1H), 2,24 (с, 3H), 2,40 (ушир.с, 1H), 4,07-4,16 (м, 1H), 7,34 (ушир.д, J~8 Гц, 2H), 7,40 (ушир.д, J~7 Гц, 1H), 7,52-7,61 (м, 3H).

Соединение 52: (из норадамантиламина): Точка плавления: 147-150°C.
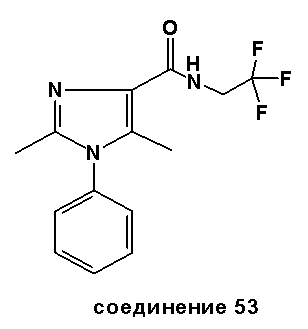
Соединение 53: Точка плавления: 111-113°C.
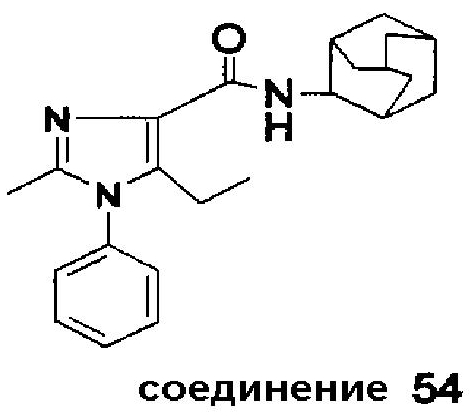
Соединение 54: Точка плавления: 204-207°C.

Соединение 55: Точка плавления: 115-117°C.
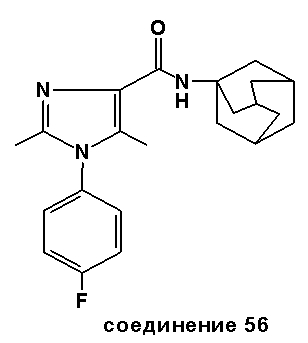
Соединение 56: Точка плавления: 208-210°C.
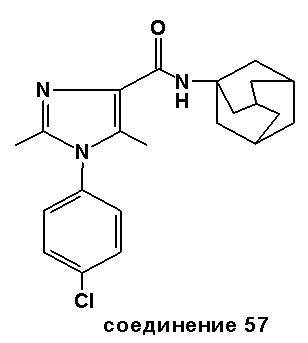
Соединение 57: Точка плавления: 243-245°C.
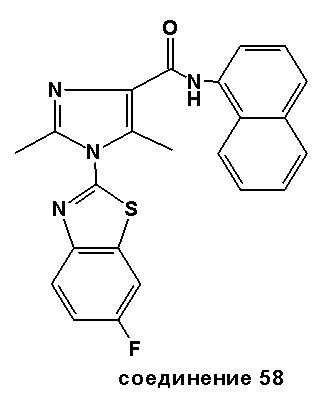
Соединение 58: Точка плавления: 178-181°C.
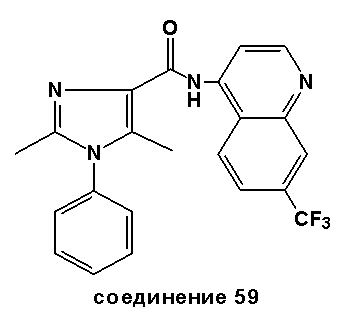
Соединение 59: 1H-ЯМР (300 MГц, CDCl3): δ 2,28 (с, 3H), 2,43 (с, 3H), 7,23-7,27 (м, 2H), 7,55-7,60 (м, 3H), 7,79 (дд, J=9 и 2 Гц, 1H), 8,22 (д, J=9 Гц, 1H), 8,42 (с, 1H), 8,62 (д, J~5 Гц, 1H), 8,94 (д, J=5 Гц, 1H), 10,25 (ушир.с, 1H).
Точка плавления: 198,5°C (ДСК).

Соединение 60: 1H-ЯМР (300 MГц, CDCl3): δ 2,29 (с, 3H), 2,43 (с, 3H), 7,23-7,27 (м, 2H), 7,54-7,60 (м, 3H), 7,70-7,76 (м, 2H), 7,95 (д, J=8 Гц, 1H), 8,17-8,21 (м, 1H), 8,27-8,29 (м, 1H), 8,63 (д, J=8 Гц, 1H), 10,20 (ушир.с, 1H).
Точка плавления: 241,5°C (ДСК).
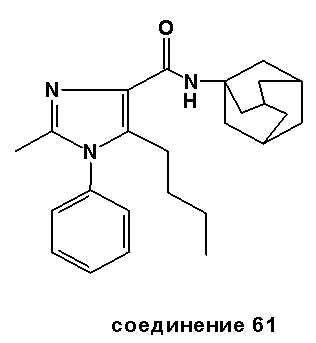
Соединение 61: Точка плавления: 171-172°C.
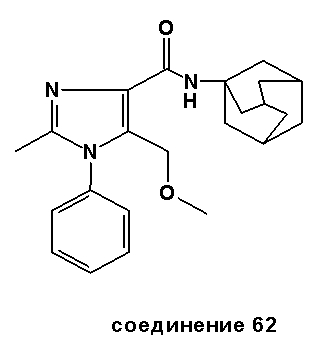
Соединение 62: Точка плавления: ~113°C. Rf (диэтиловый эфир/петролейный эфир = 1/1 (об./об.)) ~0,15.
1H-ЯМР (400 MГц, CDCl3): δ 1,66-1,78 (м, 6H), 2,08-2,18 (м, 9H), 2,19 (с, 3H), 3,22 (с, 3H), 4,59 (с, 3H), 7,06 (ушир.с, 1H), 7,25-7,30 (м, 2H), 7,47-7,55 (м, 3H).
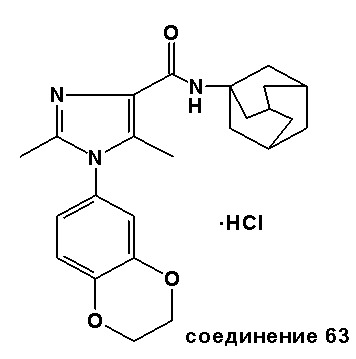
Соединение 63: Точка плавления: 221-223°C.
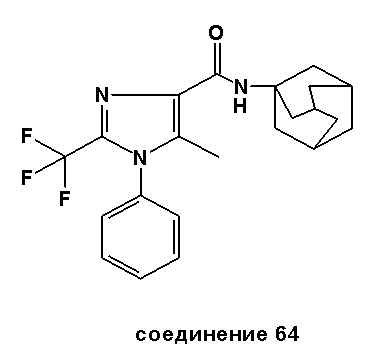
Соединение 64: Точка плавления: 170-172°C.
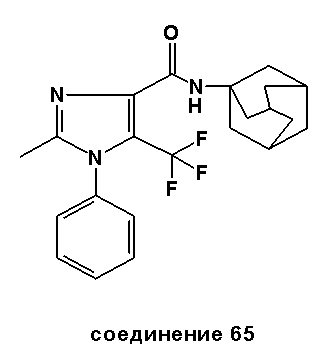
Соединение 65: Точка плавления: 168-170°C.
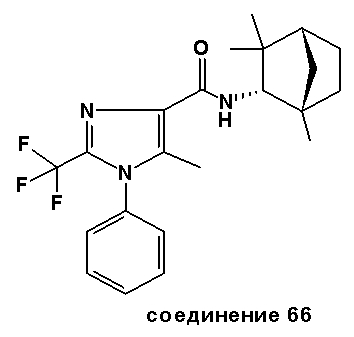
Соединение 66: (из эндо-(1S)-1,3,3-триметилбицикло[2.2.1]гептан-2-амина).
Точка плавления: 102-107°C.
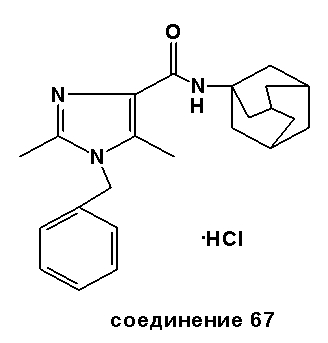
Соединение 67: Точка плавления: 166-168°C.
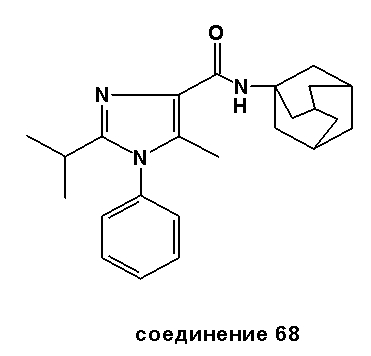
Соединение 68: Точка плавления: 208-210°C.

Соединение 69: Точка плавления: 154-156°C.
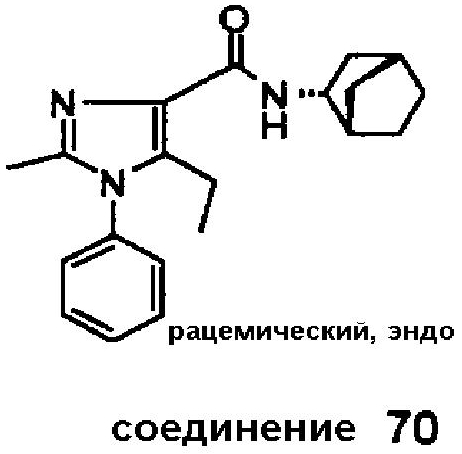
Соединение 70: (из рацемического эндо-2-аминобицикло[2.2.1]гептана).
Точка плавления: 165-167°C.
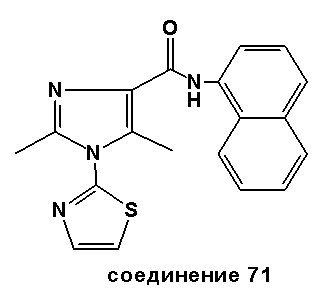
Соединение 71: Точка плавления: 69-72°C.
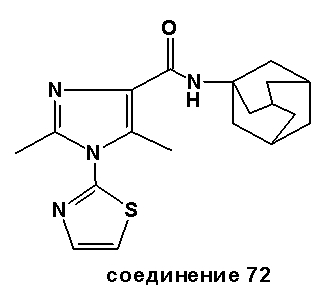
Соединение 72: 1H-ЯМР (400 MГц, CDCl3): δ 1,66-1,78 (м, 6H), 2,08-2,17 (м, 9H), 2,32 (с, 3H), 2,51 (с, 3H), 6,95 (ушир.с, 1H), 7,51 (д, J=4 Гц, 1H), 7,83 (д, J=4 Гц, 1H).
Точка плавления: 130-133°C.
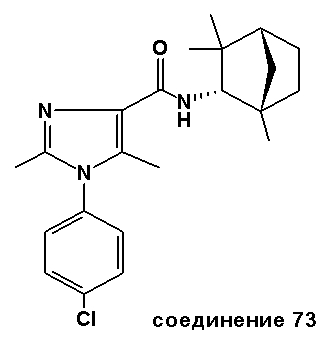
Соединение 73: (из эндо-(1S)-1,3,3-триметилбицикло[2.2.1]гептан-2-амина).
Точка плавления: 146-148°C.

Соединение 74: 1H-ЯМР (400 MГц, CDCl3): δ 1,65-1,78 (м, 6H), 2,08-2,19 (м, 12H), 2,27 (с, 3H), 3,78 (с, 3H), 6,97 (ушир.с, 1H), 7,03-7,12 (м, 3H), 7,43-7,49 (м, 1H).

Соединение 75: 1H-ЯМР (400 MГц, CDCl3): δ 2,21 (с, 3H), 2,37 (с, 3H), 3,82 (с, 3H), 7,07-7,13 (м, 2H), 7,16-7,21 (м, 1H), 7,46-7,59 (м, 4H), 7,66 (д, J=8 Гц, 1H), 7,87 (д, J=8 Гц, 1H), 8,13 (д, J=8 Гц, 1H), 8,28 (д, J=8 Гц, 1H), 9,70 (ушир.с, 1H).
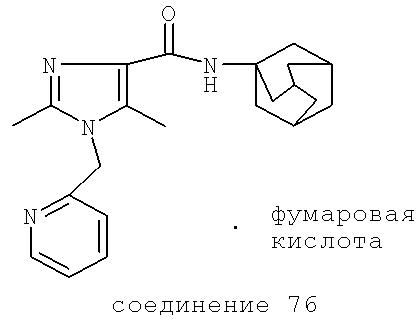
Соединение 76: Точка плавления: 217-219°С.
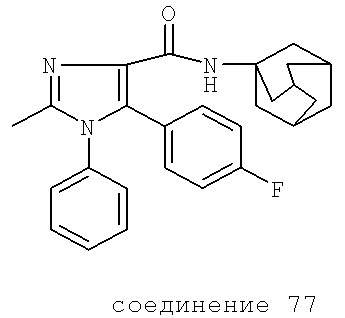
Соединение 77: Точка плавления: 217-218°С. В синтезе этого конкретного соединения в последней стадии реакции в качестве сшивающего реагента использовали хлорид 2-хлор-1,3-диметилимидазолиния вместо CIP.
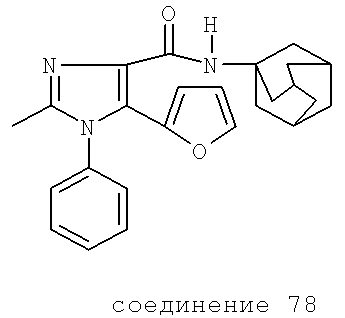
Соединение 78: Точка плавления: 186-187°С. В синтезе этого конкретного соединения в последней стадии реакции в качестве сшивающего реагента использовали хлорид 2-хлор-1,3-диметилимидазолиния вместо CIP.
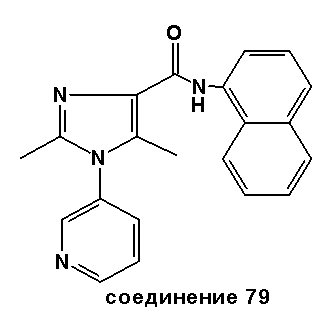
Соединение 79: Точка плавления: 123-125°C.
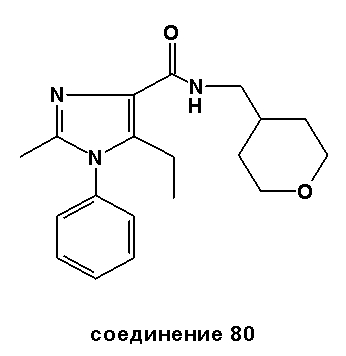
Соединение 80: Точка плавления: 214-217°C.
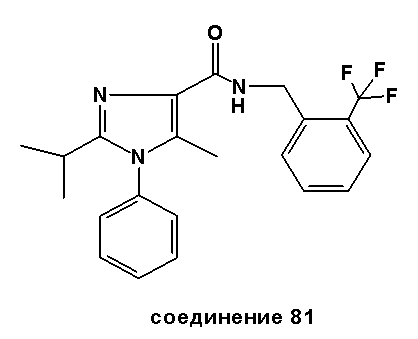
Соединение 81: Точка плавления: 149-150°C.
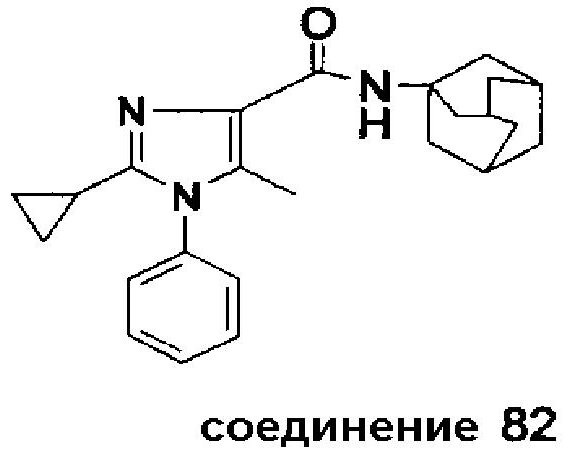
Соединение 82: 1H-ЯМР (400 MГц, CDCl3): δ 0,75-0,80 (м, 2H), 0,97-1,03 (м, 2H), 1,45-1,52 (м, 1H), 1,65-1,78 (м, 6H), 2,08-2,18 (м, 9H), 2,34 (с, 3H), 6,98 (ушир.с, 1H), 7,23-7,28 (м, 2H), 7,45-7,56 (м, 3H).
В синтезе этого конкретного соединения в последней стадии реакции в качестве сшивающего реагента использовали хлорид 2-хлор-1,3-диметилимидазолиния вместо CIP.
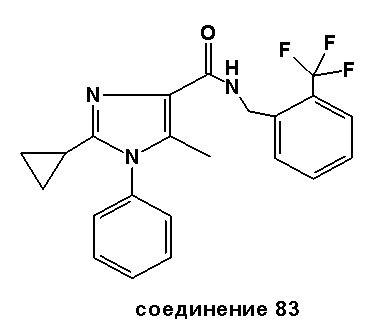
Соединение 83: 1H-ЯМР (400 MГц, CDCl3): δ 0,75-0,80 (м, 2H), 0,97-1,02 (м, 2H), 1,45-1,52 (м, 1H), 2,38 (с, 3H), 4,80 (ушир.д, J=7 Гц, 2H), 7,25-7,30 (м, 2H), 7,35 (ушир.т, J=7 Гц, 1H), 7,47-7,68 (м, 7H).
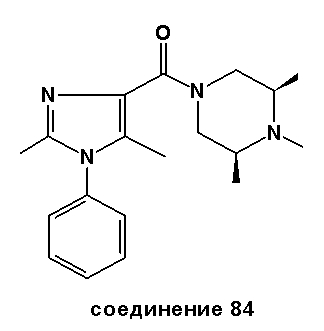
Соединение 84: Точка плавления: 136-137°C.
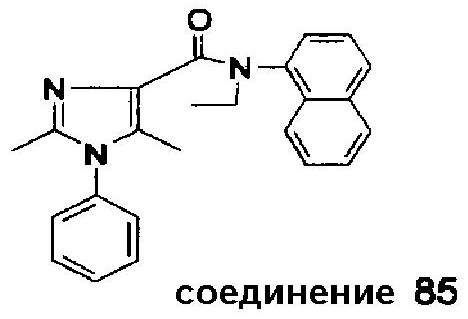
Соединение 85: Rf (дихлорметан/метанол = 98/2 (об./об.))=0,2

Соединение 86: Точка плавления: 242-244°C. MH+ (свободное основание) = 368. Соединение 86 было получено из рацемического экзо-2-аминобицикло[2.2.1]гептана и метилового эфира 2-ацетиламино-3-оксомасляной кислоты, аналогично синтезу соединения 36, как описано в описании выше, часть C.
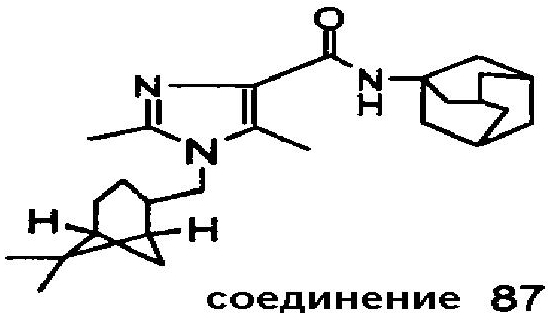
Соединение 87: Точка плавления: 181-183°C. MH+ = 410. Соединение 87 было получено из (-)-цис-миртаниламин (CAS 38235-68-6) и метилового эфира 2-ацетиламино-3-оксомасляной кислоты, аналогично синтезу, как описано в описании выше для соединения 36, часть C.
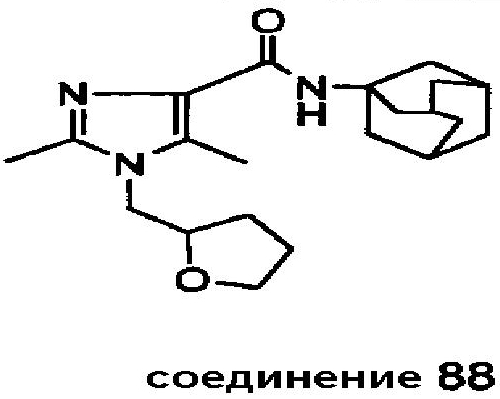
Соединение 88: Rf (дихлорметан/метанол = 97/3 (об./об.)) = 0,2. В синтезе этого конкретного соединения в последней стадии реакции в качестве сшивающего реагента использовался хлорид 2-хлор-1,3-диметилимидазолиния вместо CIP.
Синтез соединения 89
Часть A: К перемешиваемой магнитной мешалкой суспензии 2,5-диметил-1-фенил-1H-имидазол-4-карбоновой кислоты (0,4 г, 1,85 ммоль) в CHCl3 (4 мл) добавляли оксалилхлорид (0,34 г, 2,685 ммоль), и полученная смесь реагировала при 58°C в течение 2 час, после чего была сконцентрирована в вакууме. Полученный остаток собирали дихлорметаном с последующим добавлением диизопропилэтиламина (0,28 г, 2,148 ммоль). Затем к реакционной смеси медленно добавляли раствор 2,3-дихлоранилина (0,35 г, 2,146 ммоль) в дихлорметане (5 мл), и полученная смесь реагировала в течение 2 час при комнатной температуре, после чего была сконцентрирована в вакууме. Полученный остаток очищали флэш-хроматографией (дихлорметан) с получением N-(2,3-дихлорфенил)-2,5-диметил-1-фенил-1H-имидазол-4-карбоксамида (соединение 89) (0,24 г, выход 36%).
Точка плавления: 127-129°C.
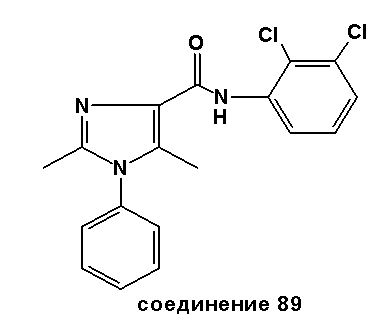
Аналогично были получены соединения 90-114:
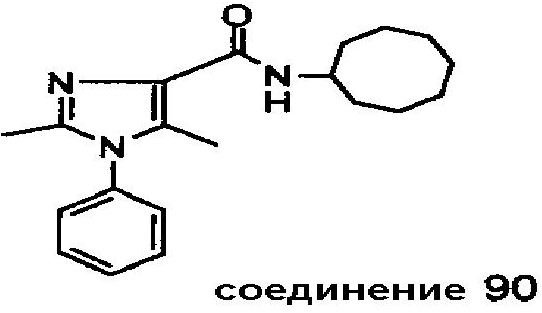
Соединение 90: 1H-ЯМР (400 MГц, CDCl3): δ 1,50-1,78 (м, 12H), 1,88-1,98 (м, 2H), 2,18 (с, 3H), 2,34 (с, 3H), 4,12-4,23 (м, 1H), 7,10-7,20 (м, 3H), 7,48-7,57 (м, 3H).
LC/MS: время удерживания: 2,88 мин; MH+ = 326.
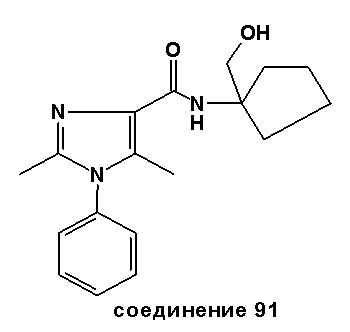
Соединение 91: 1H-ЯМР (400 MГц, CDCl3): δ 1,65-2,07 (м, 9H), 2,17 (с, 3H), 2,32 (с, 3H), 3,73 (с, 2H), 7,16-7,20 (м, 2H), 7,41 (ушир.с, 1H), 7,49-7,57 (м, 3H).
LC/MS: время удерживания: 2,22 мин; MH+ = 314.
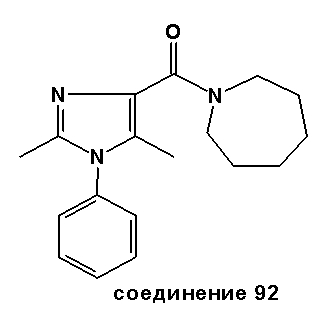
Соединение 92: 1H-ЯМР (400 MГц, CDCl3): δ 1,56-1,66 (м, 4H), 1,73-1,87 (м, 4H), 2,18 (ушир.с, 6H), 3,65 (т, J=7 Гц, 2H), 3,91 (т, J=7 Гц, 2H), 7,19-7,23 (м, 2H), 7,47-7,56 (м, 3H).
LC/MS: время удерживания: 2,12 мин; MH+ = 297.
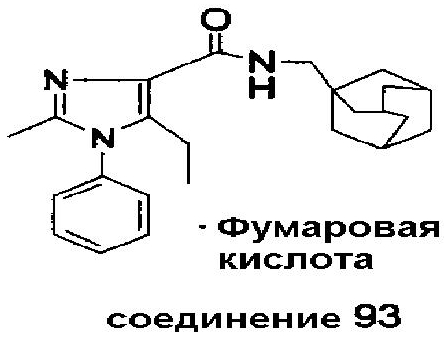
Соединение 93: Rf (дихлорметан/метанол = 95/5 (об./об.)) = 0,65.
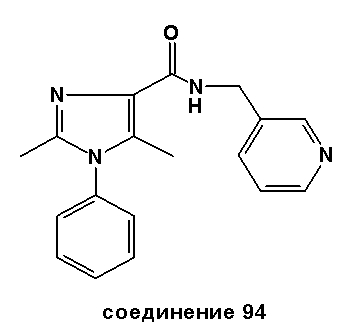
Соединение 94: LC/MS: время удерживания: 1,88 мин; MH+ = 307.
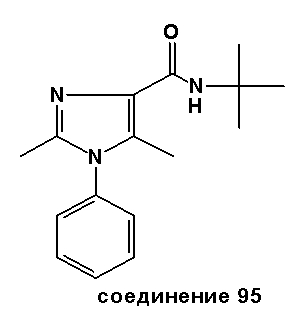
Соединение 95: Точка плавления: 134-135°C.
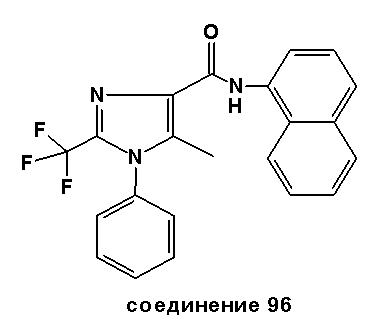
Соединение 96: Точка плавления: 119-121°C.
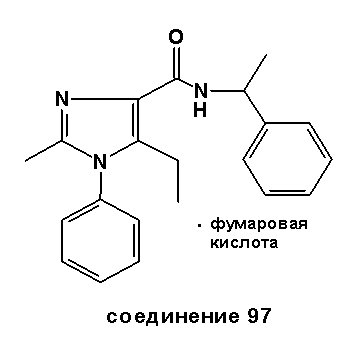
Соединение 97: Rf (дихлорметан/метанол = 97/3 (об./об.)) = 0,6.
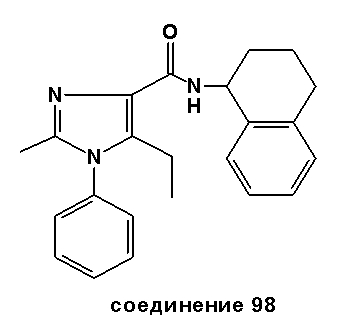
Соединение 98: Точка плавления: 125-127°C.
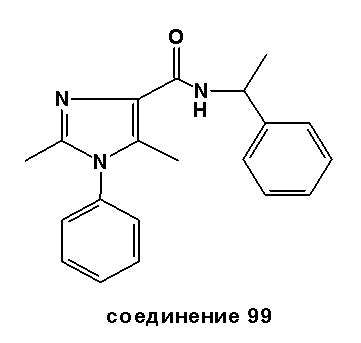
Соединение 99: 1H-ЯМР (400 MГц, CDCl3): δ 1,60 (д, J=7 Гц, 3H), 2,17 (с, 3H), 2,33 (с, 3H), 5,30 (квинтет, J=7 Гц, 1H), 7,15-7,54 (м, 11H).
LC/MS: время удерживания: 2,60 мин; MH+ = 320.
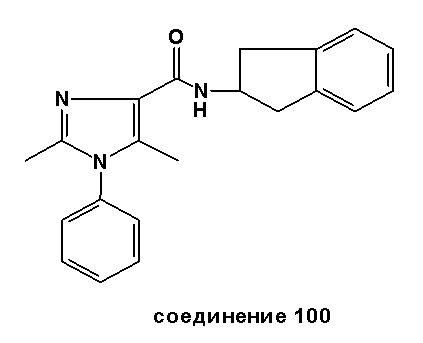
Соединение 100: 1H-ЯМР (400 MГц, CDCl3): δ 2,15 (с, 3H), 2,36 (с, 3H), 2,97 (дд, J~15 и 6 Гц, 2H), 3,40 (дд, J~15 и 8 Гц, 2H), 4,88-4,98 (м, 1H), 7,16-7,27 (м, 6H), 7,37 (ушир.д, J~8 Гц, 1H), 7,48-7,57 (м, 3H).
LC/MS: время удерживания: 2,63 мин; MH+ = 332.
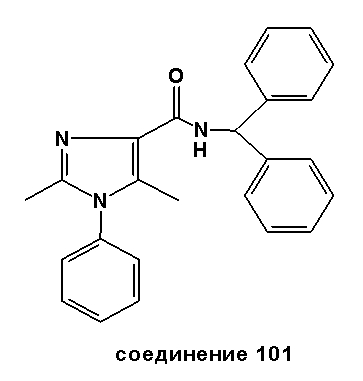
Соединение 101: 1H-ЯМР (400 MГц, CDCl3): δ 2,18 (с, 3H), 2,34 (с, 3H), 6,44 (д, J=8 Гц, 1H), 7,15-7,38 (м, 12H), 7,48-7,57 (м, 3H), 7,92 (ушир.д, J~8 Гц, 1H).
LC/MS: время удерживания: 3,59 мин; MH+ = 382.
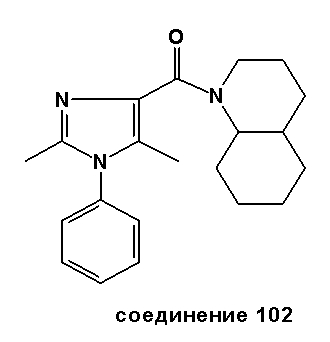
Соединение 102: LC/MS: время удерживания: 1,30 мин; MH+ = 338.
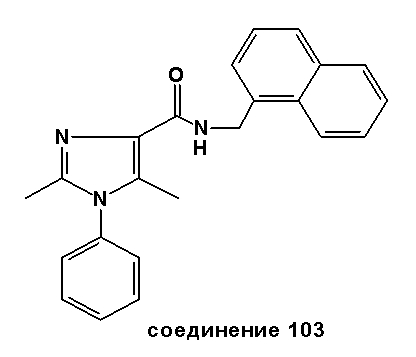
Соединение 103: LC/MS: время удерживания: 2,81 мин; MH+ = 356.
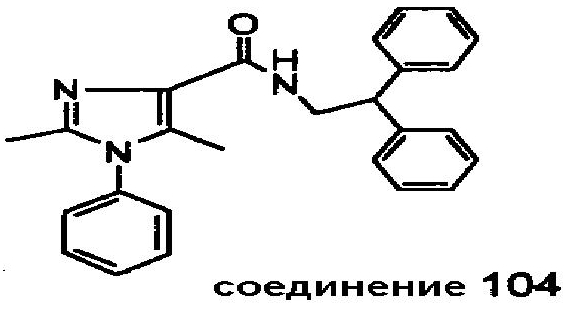
Соединение 104: LC/MS: время удерживания: 2,98 мин; MH+ = 396.

Соединение 105: LC/MS: время удерживания: 2,17 мин; MH+ = 300.
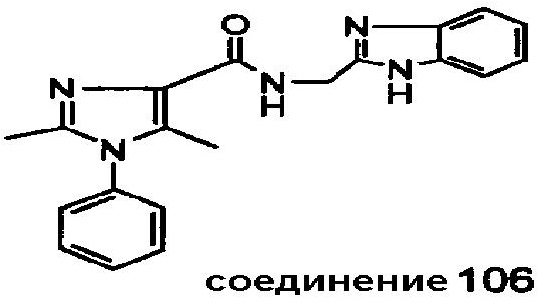
Соединение 106: LC/MS: время удерживания: 2,08 мин; MH+ = 346.
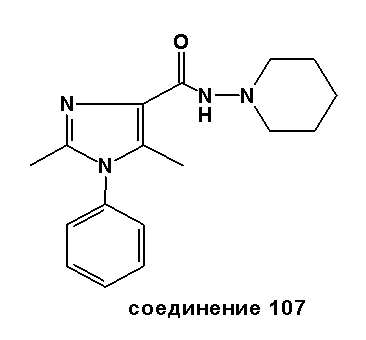
Соединение 107: Точка плавления: 117-118°C.

Соединение 108: Точка плавления: 123-125°C.
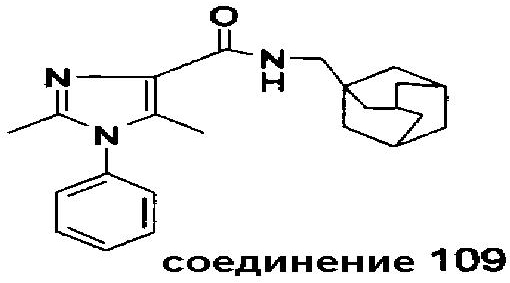
Соединение 109: Точка плавления: 130-132°C.
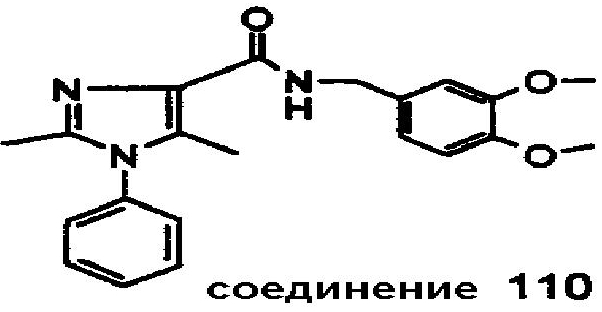
Соединение 110: 1H-ЯМР (400 MГц, CDCl3): δ 2,17 (с, 3H), 2,37 (с, 3H), 3,86 (с, 3H), 3,88 (с, 3H), 4,55 (д, J~6 Гц, 2H), 6,82 (д, J=8 Гц, 1H), 6,90-6,95 (м, 2H), 7,17-7,21 (м, 2H), 7,45 (ушир.с, 1H), 7,50-7,57 (м, 3H).

Соединение 111: Rf (дихлорметан/метанол = 95/5 (об./об.)) = 0,65.
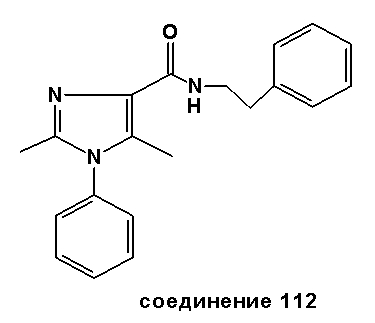
Соединение 112: 1H-ЯМР (400 MГц, CDCl3): δ 2,16 (с, 3H), 2,35 (с, 3H), 2,93 (т, J=7 Гц, 2H), 3,66 (кв., J~7 Гц, 2H), 7,16-7,34 (м, 8H), 7,48-7,56 (м, 3H).
LC/MS: время удерживания: 3,13 мин; MH+ = 320.
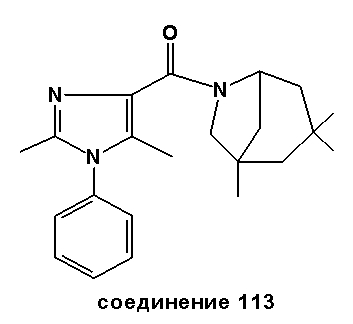
Соединение 113: LC/MS: время удерживания: 2,67 мин; MH+ = 352.
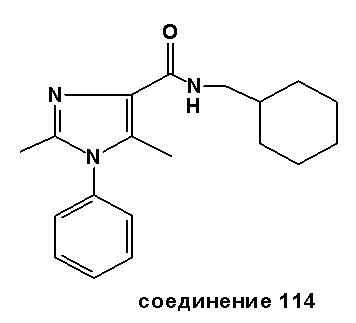
Соединение 114: 1H-ЯМР (400 MГц, CDCl3): δ 0,94-1,05 (м, 2H), 1,11-1,31 (м, 3H), 1,52-1,87 (м, 6H), 2,18 (с, 3H), 2,35 (с, 3H), 3,25 (т, J=7 Гц, 2H), 7,16-7,21 (м, 2H), 7,22-7,29 (м, 1H), 7,48-7,57 (м, 3H).
LC/MS: время удерживания: 2,76 мин; MH+ = 312.
ПРИМЕР 3: ЛЕКАРСТВЕННАЯ ФОРМА СОЕДИНЕНИЯ 1
Для орального (p.o.) введения: К требуемому количеству (0,5-5 мг) твердого соединения 1 в стеклянной пробирке добавляли некоторое количество стеклянных бус и твердое вещество измельчали путем встряхивания 2 мин. После добавления 1 мл 1%-го раствора метилцеллюлозы в воде и 2% (об./об.) Poloxamer 188 (Lutrol F68) соединение суспендировали встряхиванием в течение 10 мин. Затем pH доводили до 7 несколькими каплями водного NaOH (0,1 н.). Оставшиеся в суспензии частицы далее суспендировали при использовании ультразвуковой ванны.
Для внутриперитонеального (i.p.) введения: К требуемому количеству (0,5-15 мг) твердого соединения 1 в стеклянной пробирке добавляли некоторое количество стеклянных бус и твердое вещество измельчали путем встряхивания 2 мин. После добавления 1 мл 1%-го раствора метилцеллюлозы и 5%-го маннита в воде, соединение суспендировали встряхиванием в течение 10 мин. pH доводили до 7.
ПРИМЕР 4: РЕЗУЛЬТАТЫ ФАРМАКОЛОГИЧЕСКОГО ТЕСТА
Данные по аффинности каннабиноидного рецептора, полученные согласно методикам, приведенным выше, показаны в таблице ниже. BMS-I, BMS-II, BMS-III представляют собой три имидазола, приведенные в качестве примеров в WO 01/58869 (там примеры 64, 65 и 66 соответственно). Все три указанные определенные производные имидазола содержат L-фенилаланинпроизводную карбоксамидную группу в положении 4 их (1H)-имидазольной группы, как показано ниже. Настоящее изобретение включает новые производные 1H-имидазола, в которых отсутствует указанная L-фенилаланинпроизводная карбоксамидная группа, но которые имеют приблизительно в 100 раз более высокое сродство к рецептору CB2 по сравнению с соединениями из предшествующего уровня техники, приведенными в примерах WO 01/58869, как становится очевидным из данных, приведенных в таблице 1.
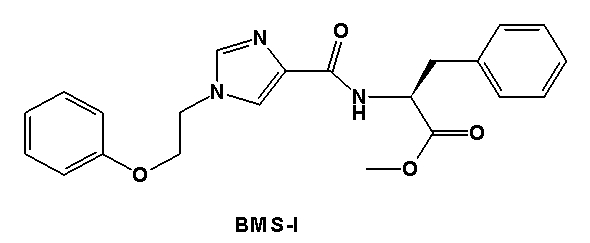
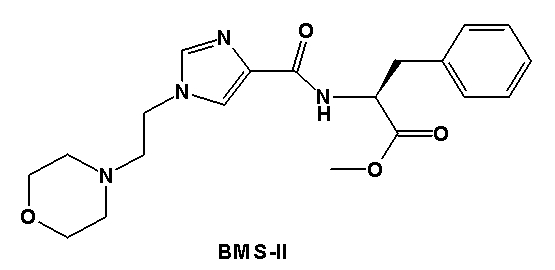
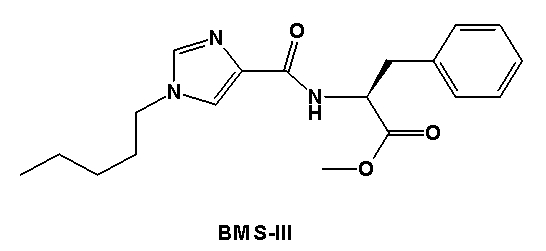
рецептор человека
рецептор человека
- = Не определено.
| название | год | авторы | номер документа |
|---|---|---|---|
| ИНГИБИТОР СВЯЗЫВАНИЯ СФИНГОЗИН-1-ФОСФАТА | 2007 |
|
RU2395499C2 |
| ПРОИЗВОДНЫЕ ИМИДАЗОЛИНА, ОБЛАДАЮЩИЕ CB-АНТАГОНИСТИЧЕСКОЙ АКТИВНОСТЬЮ | 2005 |
|
RU2357958C2 |
| ПРОИЗВОДНЫЕ 1Н-ИМИДАЗОЛА В КАЧЕСТВЕ МОДУЛЯТОРОВ КАННАБИНОИДНЫХ РЕЦЕПТОРОВ | 2004 |
|
RU2337907C2 |
| 1,3,5-ТРИЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ 4,5-ДИГИДРО-1Н-ПИРАЗОЛА, ОБЛАДАЮЩИЕ СВ-АНТАГОНИСТИЧЕСКОЙ АКТИВНОСТЬЮ | 2005 |
|
RU2360904C2 |
| ЦИКЛИЧЕСКИЕ (АЗА) ИНДОЛИЗИНКАРБОКСАМИДЫ, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМНЕНИЕ В КАЧЕСТВЕ ФАРМАЦЕВТИЧЕСКИХ СРЕДСТВ | 2010 |
|
RU2539574C2 |
| ПРОИЗВОДНЫЕ АМИНОХИНОЛОНА, ЗАМЕЩЕННЫЕ ФЕНИЛЬНОЙ ИЛИ ГЕТЕРОАРОМАТИЧЕСКОЙ ГРУППОЙ | 1993 |
|
RU2124510C1 |
| КАРБОСТИРИЛЬНОЕ СОЕДИНЕНИЕ | 2005 |
|
RU2430920C2 |
| ПРОИЗВОДНЫЕ ИМИДАЗОЛА, АКТИВНЫЕ В ОТНОШЕНИИ РЕЦЕПТОРА СВ1 | 2005 |
|
RU2377238C2 |
| СТИМУЛЯТОРЫ СЕКРЕЦИИ ГОРМОНА РОСТА | 1996 |
|
RU2172742C2 |
| ПРОИЗВОДНЫЕ 2,3-ДИГИДРО-6-НИТРОИМИДАЗО [2,1-b] ОКСАЗОЛА ДЛЯ ЛЕЧЕНИЯ ТУБЕРКУЛЕЗА | 2004 |
|
RU2365593C2 |
Настоящее изобретение относится к новым производным 1H-имидазола формулы I, в которой R1 представляет собой водород, атом галогена, C1-3-алкильную группу, причем указанная C1-3-алкильная группа может включать 1-3 атома фтора, или R1 представляет собой циклопропильную, циано или метилсульфанильную группу, R2 представляет собой фенильную группу, которая может быть замещена 1 заместителем Y, выбранным из метокси, хлора, фтора, трифторметила и циано, или R2 представляет собой пиридильную группу, при условии, что R2 не является 6-метил-2-пиридильной группой, или R2 представляет собой полностью насыщенную 6-7-членную моноциклическую, конденсированную бициклическую кольцевую систему или бензотиазолильную, бензодиоксановую или тиазольную группу, причем указанные группы могут быть замещены 1 атомом фтора, или R2 представляет собой группу общей формулы СН2-R5, в которой R5 представляет собой фенильную группу или полностью насыщенную 7-членную конденсированную бициклическую карбоциклическую кольцевую систему, или R5 представляет собой пиперидиновую или тетрагидрофурановую кольцевую систему, которая может быть замещена метилом, или R2 представляет собой метилсульфониламино (С3) алкильную группу, R3 представляет собой водород, атом галогена, C1-6-алкилсульфонильную, цианогруппу, или R3 представляет собой C1-8-алкильную группу, причем указанная C1-8-алкильная группа может быть замещена 1-3 атомами фтора, или R3 представляет собой фенильную группу, которая замещена заместителем Y, где Y имеет значение, определенное выше, или R3 представляет собой фуранильную группу, R4 представляет собой одну из подгрупп (i) или (ii), где R6 представляет собой C4-8 разветвленную или линейную алкильную группу или нафтильную группу, R7 представляет собой атом водорода, линейную C1-6-алкильную группу, R8 представляет собой С2-6-алкильную группу, замещенную 1-3 атомами фтора, или R8 представляет собой С3-8-циклоалкильную группу, пиперидиновую группу, С3-8-циклоалкил-С1-2-алкильную группу, тетрагидрофуранил-С1-2-алкильную группу, С5-10-бициклоалкильную группу, C5-10-бициклоалкил-С1-2-алкильную группу, С6-10-трициклоалкильную группу, С6-10-трициклоалкил-С1-2-алкильную группу, причем указанные группы могут быть замещены 1-3 заместителями, выбранными из метила или гидрокси, или R8 представляет собой фенильную группу, замещенную 1-2 заместителями Y, определенными выше, или R8 представляет собой нафтильную, 1,2,3,4-тетрагидронафтильную или инданильную группу, причем указанные группы могут быть замещены 1 заместителем Y, или R8 представляет собой фенил-С1-3-алкильную группу, дифенил-С1-3-алкильную группу, причем указанные группы могут быть замещены по их фенильному кольцу 1 заместителем Y, где Y имеет значение, упомянутое выше, или R8 представляет собой бензильную группу, замещенную 2 заместителями Y, или R8 представляет собой хинолинильную, пиридинильную, бензимидазольную или нафтилметильную группу, которая может быть замещена заместителем Y, где Y имеет значение, упомянутое выше, или R8 представляет собой азабицикло[3.3.0]октанильную группу, при условии, что R8 не является ни 6-метоксибензотиазол-2-ильной группой, ни [3-хлор-5-(трифторметил)пирид-2-ил]метильной группой, или R7 и R8 вместе с атомом азота, с которым они связаны, образуют насыщенную, неароматическую, моноциклическую или бициклическую гетероциклическую группу, включающую только один атом азота, имеющую 7-10 кольцевых атомов, которые могут быть замещены 3 C1-3-алкильными группами, или R7 и R8 вместе с атомом азота, с которым они связаны, образуют насыщенную моноциклическую гетероциклическую группу, необязательно включающую другой атом N, имеющую 6 кольцевых атомов, причем указанная гетероциклическая группа замещена C1-3-алкильными группами, при условии, что R7 и R8 вместе с атомом азота, с которым они связаны, не образуют триметилзамещенную азабицикло[3.2.1]октанильную группу, а также их стереоизомеры и фармакологически приемлемые соли указанных соединений формулы (I) и их стереоизомеров. Также изобретение относится к промежуточным соединениям формулы XIV, фармацевтической композиции на основе соединения формулы I, способу получения такой фармацевтической композиции и применению соединения формулы I. Технический результат: получены новые производные 1Н-имидазола, которые являются модуляторами каннабиноидных СВ2-рецепторов. 5 н. и 3 з.п. формулы, 2 табл.
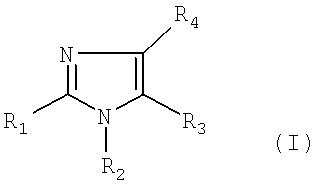

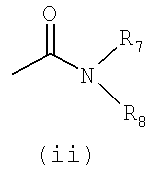
1. Соединения формулы (I)
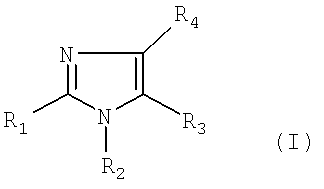
в которой R1 представляет собой водород или атом галогена или C1-3-алкильную группу, причем указанная С1-3-алкильная группа может включать 1-3 атома фтора, или R1 представляет собой циклопропильную, циано или метилсульфанильную группу,
R2 представляет собой фенильную группу, которая может быть замещена 1 заместителем Y, выбранным из метокси, хлора, фтора, трифторметила и циано, или
R2 представляет собой пиридильную группу,
при условии, что R2 не является 6-метил-2-пиридильной группой, или
R2 представляет собой полностью насыщенную 6-7-членную моноциклическую, конденсированную бициклическую кольцевую систему, или
R2 представляет собой бензотиазолильную, бензодиоксановую или тиазольную группу, причем указанные группы могут быть замещены 1 атомом фтора, или
R2 представляет собой группу общей формулы CH2-R5, в которой R5 представляет собой фенильную группу, или R5 представляет собой полностью насыщенную 7-членную конденсированную бициклическую карбоциклическую кольцевую систему, или R5 представляет собой пиперидиновую или тетрагидрофурановую кольцевую систему, которая может быть замещена метилом, или
R2 представляет собой метилсульфониламино (С3) алкильную группу,
R3 представляет собой водород, или атом галогена, или C1-6-алкилсульфонильную или цианогруппу, или
R3 представляет собой C1-8-алкильную группу, причем указанная C1-8-алкильная группа может быть замещена 1-3 атомами фтора, или R3 представляет собой фенильную группу, которая замещена заместителем Y, где Y имеет значение, определенное выше, или R3 представляет собой фуранильную группу,
R4 представляет собой одну из подгрупп (i) или (ii)

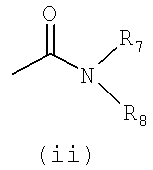
где R6 представляет собой C4-8 разветвленную или линейную алкильную группу
или R6 представляет собой нафтильную группу,
R7 представляет собой атом водорода или линейную C1-6-алкильную группу,
R8 представляет собой С3-6-алкильную группу, замещенную 1-3 атомами фтора, или
R8 представляет собой С3-8-циклоалкильную группу, пиперидиновую группу, С3-8-циклоалкил-С1-2-алкильную группу, тетрагидрофуранил-С1-2-алкильную группу, С5-10-бициклоалкильную группу, С5-10-бициклоалкил-C1-2-алкильную группу, С6-10-трициклоалкильную группу, С6-10-трициклоалкил-С1-2-алкильную группу, причем указанные группы могут быть замещены 1-3 заместителями, выбранными из метила или гидрокси, или
R8 представляет собой фенильную группу, замещенную 1-2 заместителями Y, определенными выше, или
R8 представляет собой нафтильную, 1,2,3,4-тетрагидронафтильную или инданильную группу, причем указанные группы могут быть замещены 1 заместителем Y, или
R8 представляет собой фенил-С1-3-алкильную группу, дифенил-С1-3-алкильную группу, причем указанные группы могут быть замещены по их фенильному кольцу 1 заместителем Y, где Y имеет значение, упомянутое выше, или
R8 представляет собой бензильную группу, замещенную 2 заместителями Y, или
R8 представляет собой хинолинильную, пиридинильную, бензимидазольную или нафтилметильную группу, которая может быть замещена заместителем Y, где Y имеет значение, упомянутое выше, или
R8 представляет собой азабицикло[3.3.0]октанильную группу,
при условии, что R8 не является ни 6-метоксибензотиазол-2-ильной группой, ни [3-хлор-5-(трифторметил)пирид-2-ил]метильной группой,
или R7 и R8 вместе с атомом азота, с которым они связаны, образуют насыщенную, неароматическую, моноциклическую или бициклическую гетероциклическую группу, включающую только один атом азота, имеющую 7-10 кольцевых атомов, которые могут быть замещены 3 C1-3-алкильными группами,
или R7 и R8 вместе с атомом азота, с которым они связаны, образуют насыщенную моноциклическую гетероциклическую группу, необязательно включающую другой атом N, имеющую 6 кольцевых атомов, причем указанная гетероциклическая группа замещена C1-3-алкильными группами,
при условии, что R7 и R8 вместе с атомом азота, с которым они связаны, не образуют триметилзамещенную азабицикло[3.2.1]октанильную группу,
а также их стереоизомеры и фармакологически приемлемые соли указанных соединений формулы (1) и их стереоизомеров.
2. Соединения по п.1, где R4 представляет подгруппу (ii)

где R1, R2, R3, R7 и R8 имеют значения, как приведено в п.1.
3. Соединение формулы (XIV)
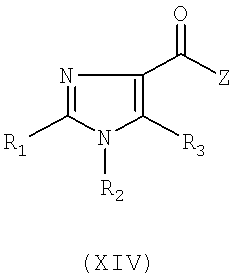
в которой Z представляет собой С1-3-алкоксигруппу, в которой R1, R2 и R3 имеют значения, как приведено в п.1,
при условии, что R2 не является фенильной, 4-метилфенильной или 4-метоксифенильной группой,
причем указанные соединения являются полезными в синтезе соединений общей формулы (I).
4. Фармацевтическая композиция, обладающая модулирующей рецепторы каннабиноидов СВ2 активностью, включающая фармакологически активное количество соединения по одному из пп.1 и 2 или его соли в качестве активного компонента, и фармацевтически приемлемый носитель и/или фармацевтически приемлемое вспомогательное вещество.
5. Способ получения фармацевтической композиции по п.4, отличающийся тем, что соединение по одному из пп.1 и 2 или его соль смешивают с фармацевтически приемлемым носителем и/или фармацевтически приемлемым вспомогательным веществом.
6. Соединение по любому из пп.1 и 2 или его соль для использования в качестве лекарственного средства для лечения расстройств, вовлекающих нейротрансмиссию каннабиноидных СВ2-рецепторов.
7. Применение соединения по пп.1 и 2 для приготовления фармацевтической композиции для лечения расстройств, вовлекающих нейротрансмиссию каннабиноидных СВ2-рецепторов.
8. Применение по п.7, где указанные расстройства выбирают из расстройств иммунной системы, воспалительных расстройств, болезни Хантингтона, рассеянного склероза, аллергии, рака и боли, включая невропатическую боль.
Авторы
Даты
2011-01-27—Публикация
2006-02-16—Подача