Область техники
Изобретение относится к новым имидазольным соединениям, обладающим фармакологической активностью, к способу их получения и к фармацевтической композиции, содержащей эти соединения.
Предпосылки создания изобретения
Аденозин (Ado) является эндогенным пуриновым нуклеозидом, выделяемым клетками при нормальном метаболическом механизме. Ado обладает широким разнообразием биологических активностей, а именно, сильными противовоспалительными и иммуносупрессивными свойствами, защитными действиями при сердечно-сосудистой и церебрососудистой ишемии, противосудорожным действием и модулирующим действием на агрегацию тромбоцитов, липолиз, гликогенез, кровоток и передачу нервного импульса. Ado проявляет свое биологическое действие путем связывания с его рецепторами, находящимися на клеточной мембране. Поэтому благотворное лечение при многих заболеваниях состоит в осуществлении фармакологического повышения концентраций внеклеточного Ado.
Аденозиндезаминаза (АДА) катализирует по существу необратимое дезаминирование аденозина или дезоксиаденозина до инозина или дезоксиинозина соответственно. В последние 10 лет АДА, который, как считали, находится в цитозоле, был обнаружен на поверхности многих клеток. Таким образом, блокирование активности АДА специфическим ингибитором является потенциальным способом повышения концентраций Ado в биологических системах и благотворным лечением при многих заболеваниях.
Известно, что некоторые соединения обладают действием ингибирования активности АДА (J.Med.Chem., 27, 274-278, 1984; ibid., 31, 390-393, 1988; ibid., 34, 1187-1192, 1991; ibid., 35, 4180-4184, 1992; ibid., 37, 305-308, 1994; ibid., 37, 3844-3849, 1994 и WO 98/02166).
Известные имидазольные соединения с другой фармацевтической активностью, а не с ингибирующим АДА действием, описаны в патенте США №4451478 и WO 97/26883.
Кроме того, сообщалось о некоторых имидазольных производных, обладающих ингибирующим АДА действием, например, как описано в Drug Development Research 28, 253-258, 1993.
Описание изобретения
Изобретение относится к новым имидазольным соединениям, которые обладают фармацевтической активностью, такой как ингибирующее АДА действие, к способу их получения, к фармацевтической композиции, их содержащей, и к их применению.
Одним из объектов данного изобретения являются новые имидазольные соединения, которые обладают ингибирующим АДА действием.
Другой объект данного изобретения представляет собой способ получения имидазольных соединений.
Еще одним объектом данного изобретения является получение фармацевтической композиции, содержащей имидазольное соединение в качестве активного ингредиента.
Еще одним объектом данного изобретения является использование имидазольного соединения для производства лекарственного средства для лечения или профилактики различных заболеваний или способ лечения или профилактики различных заболеваний путем введения имидазольного соединения в количестве, эффективном для повышения концентрации аденозина.
Имидазольные соединения настоящего изобретения могут быть представлены следующей формулой (I):
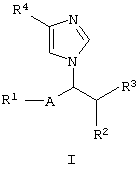
где R1 представляет водород, гидрокси, защищенный гидрокси или арил, необязательно замещенный подходящим(и) заместителем(ями);
R2 представляет водород или низший алкил;
R3 представляет гидрокси или защищенный гидрокси;
R4 представляет циано, (гидрокси)иминоамино(низший)алкил, карбокси, защищенный карбокси, гетероциклическую группу, необязательно замещенную амино, или карбамоил, необязательно замещенный подходящим(и) заместителем(ями);
-А- представляет –Q- или -O-Q-, где Q является одинарной связью или низшим алкиленом, при условии, что когда R2 является низшим алкилом, то R1 является гидрокси, защищенным гидрокси или арилом, необязательно замещенным подходящим(и) заместителем(ями),
его пролекарством или их солями.
Соединение (I), его пролекарство или их соль могут быть получены с помощью следующих способов. В следующих формулах соединения могут быть пролекарствами или их солями.
Способ 1.

где R1, R2, R3, R4 и А, как указано выше, и Х представляют собой гидрокси или удаляемую группу, при условии, что R3 не является гидрокси.
В этом способе соединение (I) может быть получено путем взаимодействия соединения (IV), где Х является гидрокси, с алкансульфонилхлоридом (т.е. метансульфонилхлоридом и т.д.) или арилсульфонилхлоридом (т.е. толуолсульфонилхлоридом и т.д.) в присутствии основания, такого как триэтиламин или пиридин, в растворителе, таком как дихлорметан, хлороформ, тетрагидрофуран или диэтиловый эфир, при температуре от 0°С до комнатной в течение примерно 1 часа, и взаимодействия полученного сульфоната с соединением (III) в присутствии основания, такого как гидрид натрия, трет-бутоксид калия или карбонат калия, в таком растворителе, как диметилформамид (ДМФ), при температуре от комнатной до 100°С в течение от 5 до 100 часов. Альтернативно соединение (III) может быть приведено во взаимодействие с соединением (IV) в присутствии основания, такого как метоксид натрия, трет-бутоксид калия или гидрид натрия, с получением соединения (I).
Соединение (I), где R3 является гидрокси, может быть получено с помощью следующего способа:

На схеме реакции R1 и R4, как указано выше, и R’ является защищающей гидроксилгруппой.
В способе 2 соединение (I-1) может быть получено путем восстановления соединения (II) с использованием восстанавливающего агента, такого как боргидрид натрия, в таком растворителе, как метанол, этанол, тетрагидрофуран или вода, при температуре от 0°С до температуры кипения с обратным холодильником в течение от 30 минут до 72 часов.
Когда соединение (I) содержит защищенную гидроксильную группу, защищенная гидроксильная группа может быть превращена в гидроксильную группу известным методом, например путем реакции соединения с удаляющим защиту агентом, таким как гидроксид палладия на углероде/циклогексан, йодтриметилсилан или тетрабутиламмония фторид, в таком растворителе, как этанол, хлороформ или тетрагидрофуран.
Соединение (I), где R4 является (гидрокси)иминоамино(низший)алкилом, гетероциклической группой или замещенным карбамоилом, может быть получено из соединения (I), где R4 является циано или защищенным карбокси, путем взаимодействия последнего с соединением, соответствующим R4 первого, с соответствующим конденсирующим веществом, таким как метоксид натрия, или без него, при температуре от комнатной до 120°С в течение от 2 до 72 часов.
Исходное соединение (II) может быть получено с помощью следующей реакции:

На схеме реакции R1, R4, R’ и А, как указано выше.
Эта реакция может быть осуществлена таким же образом, что и при способе 1.
В нижеследующем детально объяснены соответствующие примеры определений, которые включены в объем изобретения.
Термин “низший” означает группу, имеющую от 1 до 6 атомов углерода, если не предусмотрено иное.
Подходящий “низший алкил” и фрагмент низшего алкила в “низшем алкокси” включают низший алкил с прямой или разветвленной цепью, такой как метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил, гексил или тому подобное, причем предпочтителен метил.
Подходящий “низший алкилен” может быть с прямой или разветвленной цепью, имеющей от 1 до 8 атомов углерода, таким как метилен, этилен, триметилен, тетраметилен, пентаметилен, гексаметилен или тому подобное.
Подходящий “защищенный гидрокси” включает низший алкокси, необязательно замещенный арилом; ацилокси или три(низший)алкилсилилокси (т.е. триметилсилилокси, трет-бутилдиметилсилилокси и т.д.) или т.п.
Подходящие защитные для гидроксила группы в защищенной гидроксильной группе включают низший алкил, необязательно замещенный арилом; ацилокси, три(низший)алкилсилилокси (т.е. триметилсилилокси, трет-бутилдиметилсилилокси и т.д.) или т.п.
Подходящий “галоген” включает фтор, хлор, бром или йод.
Подходящий “арил” или арильная часть “ароила” включает фенил, нафтил, толил, ксилил или т.п., причем предпочтительны фенил и нафтил.
Подходящий “защищенный карбокси” включает низший алкоксикарбонил (например, метоксикарбонил, этоксикарбонил, пропоксикарбонил, бутоксикарбонил, 2,2,2-трихлорэтоксикарбонил и т.д.), арилоксикарбонил (например, феноксикарбонил, 4-нитрофеноксикарбонил и т.д.), ар(низший)алкоксикарбонил (например, бензилоксикарбонил, 4-нитробензилоксикарбонил и т.д.) или т.п.
Подходящие защитные для карбоксигруппы в защищенной карбоксигруппе включают низший алкил (например, метил, этил или трет-бутил), галоген(низший)алкил (например, 2-йодметил или 2,2,2-трихлорэтил), ар(низший)алкил (например, бензил, тритил, 4-метоксибензил, 4-нитробензил, фенетил, бис(метоксифенил)метил, 3,4-диметоксибензил или 4-гидрокси-3,5-ди-трет-бутилбензил), арил (например, фенил, нафтил, толил или ксилил) и т.п. Более подходящими примерами являются низший алкил, такой как метил, этил или трет-бутил, и ар(низший)алкил, такой как бензил.
Подходящий “ацил” и ацильная часть “ацилокси” включают низший алканоил, ароил или т.п.
Подходящий “низший алканоил” включает формил, ацетил, пропионил, бутирил, изобутирил, валерил, изовалерил, пивалоил, гексаноил или т.п.
Подходящий “ароил” может быть бензоилом, нафтоилом, толуоилом, ксилоилом или т.п.
В определении, если не указано иначе, “низший алканоил” и “ароил” могут быть замещенными одним заместителем или более, выбранными из галогена, циано, нитро, низшего алкила и их сочетания.
Подходящий “ацилокси” включает ацетилокси, трифторацетилокси или т.п.
Подходящая “удаляемая группа” может быть галогеном, ацилокси (например, ацетилокси, трифторацетилокси и т.д.), низшим алкилсульфонилокси (например, метансульфонилокси и т.д.), триарилфосфинокси (например, -O-P+(C6H5)3 и т.д.) или т.п.
Подходящий(е) “заместитель(и)” “карбамоила” включают амино, гидрокси, низший алкил, низший алкилсульфонил и аминоимино(низший)алкил, необязательно замещенные гидрокси или т.п.
Подходящий(е) “заместитель(ли)” “арила” включают низший алкил, необязательно замещенный гидрокси или защищенным карбокси; низший алкокси, необязательно замещенный арилом; гидрокси; амино; ацил; галоген; карбокси; защищенный карбокси, карбамоил; низший алкилендиокси или т.п.
Подходящая “гетероциклическая группа” содержит по меньшей мере один гетероатом, выбранный из атомов азота, серы и кислорода, и может быть насыщенной или ненасыщенной, моноциклической или полициклической гетероциклической группой. Предпочтительные примеры гетероциклической группы включают N-содержащие гетероциклические группы, описанные ниже:
(1) ненасыщенную гетероциклическую 3- - 7-членную, предпочтительно 5- или 6-членную гетеромоноциклическую группу, содержащую от 1 до 4 атомов азота, например пирролил, пирролинил, имидазолил, пиразолил, пиридил, пиримидинил, пиразинил, пиридазинил, триазолил (например, 4Н-1,2,4-триазолил, 1Н-1,2,3-триазолил, 2Н-1,2,3-триазолил и т.д.), тетразолил (например, 1H-тетразолил, 2Н-тетразолил и т.д.) и т.д.;
(2) насыщенную 3- - 7-членную, предпочтительно 5- или 6-членную гетеромоноциклическую группу, содержащую от 1 до 4 атомов азота (например, пирролидинил, имидазолидинил, пиперидил, пиперазинил и т.д.);
(3) ненасыщенную 3- - 7-членную, предпочтительно 5- или 6-членную гетеромоноциклическую группу, содержащую 1-2 атома кислорода и 1-3 атома азота, например оксазолил, изоксазолил, оксадиазолил (например, 1,2,4-оксадиазолил, 1,2,4-оксадиазолинил, 1,3,4-оксадиазолил, 1,2,5-оксадиазолил и т.д.) и т.д.;
(4) насыщенную 3- - 7-членную, предпочтительно 5- или 6-членную гетеромоноциклическую группу, содержащую от 1 до 2 атомов кислорода и от 1 до 3 атомов азота (например, морфолинил и т.д.);
(5) ненасыщенную 3- - 7-членную, предпочтительно 5- или 6-членную гетеромоноциклическую группу, содержащую 1-2 атома серы и от 1 до 3 атомов азота, например тиазолил, тиадиазолил (например, 1,2,4-тиадиазолил, 1,3,4-тиадиазолил, 1,2,5-тиадиазолил и т.д.) и т.д.;
(6) насыщенную 3- - 7-членную, предпочтительно 5- или 6-членную гетеромоноциклическую группу, содержащую от 1 до 2 атомов серы и 1-3 атома азота (например, тиоморфолинил, тиазолидинил и т.д.) и т.п.
Среди приведенного выше более предпочтительными гетероциклическими группами, включаемыми в R4, являются упомянутые выше (1), из которых наиболее предпочтительными являются триазолил или тетразолил.
Подходящими солями соединений данного изобретения являются фармацевтически приемлемые обычные нетоксичные соли, и они могут быть солями присоединения органической кислоты (например, формиатом, ацетатом, трифторацетатом, малеатом, тартратом, оксалатом, метансульфонатом, бензолсульфонатом, толуолсульфонатом и т.д.), солями присоединения неорганической кислоты (например, гидрохлоридом, гидробромидом, сульфатом, фосфатом и т.д.), солью аминокислоты (например, солью аспарагиновой кислоты, солью глутаминовой кислоты и т.д.) или т.п.
“Пролекарство” означает производные соединений данного изобретения, имеющие химически или метаболически разрушаемую группу, которая становится фармакологически активной после биотрансформации.
Соединения формулы (I) могут содержать один центр асимметрии или более, и, таким образом, они могут существовать в виде энантиомеров или диастереоизомеров. Кроме того, некоторые соединения формулы (I), которые содержат алкенильные группы, могут существовать в виде цис- или транс-изомеров. В каждом случае изобретение включает как смеси, так и отдельные индивидуальные изомеры.
Соединения формулы (I) могут также существовать в таутомерных формах, и данное изобретение включает как смеси, так и отдельные индивидуальные таутомеры.
Соединение формулы (I) и его соль могут быть в форме сольвата, который входит в объем данного изобретения. Сольват предпочтительно включает гидрат и этанолят.
В объем изобретения включаются также радиоактивно меченые производные соединений формулы (I), которые пригодны для биологических исследований.
Соединение данного изобретения может быть очищено любым из общепринятых методов очистки, используемых для очистки органических соединений, таким как перекристаллизация, колоночная хроматография, тонкослойная хроматография, высокоэффективная жидкостная хроматография и т.п. Соединения могут быть идентифицированы общепринятыми методами, такими как ЯМР-спектроскопия, масс-спектроскопия, ИК-спектроскопия, элементный анализ и определение температуры плавления.
Данное соединение (I), его пролекарство и их соли могут применяться сами по себе или в форме смеси, предпочтительно с фармацевтическим наполнителем или носителем.
Активный ингредиент этого изобретения может использоваться в виде фармацевтического препарата, например, в твердой, полутвердой или жидкой форме, который содержит соединение (I) в качестве активного ингредиента, в смеси с органическим или неорганическим носителем или эксципиентом, пригодным для наружного (местного) применения, энтерального, внутривенного, внутримышечного, парентерального введения или нанесения на слизистые. Активный ингредиент может быть составлен в рецептуре, например, с общепринятыми, нетоксичными, фармацевтически приемлемыми носителями для мази, крема, пластыря, таблеток, гранул, капсул, суппозиториев, раствора (в физиологическом растворе соли, например), эмульсии, суспензии (в оливковом масле, например), аэрозолей, пилюль, порошков, сиропов, инъекционных форм, пастилок, припарок, ароматических вод, лосьонов, защечных таблеток, подъязычных таблеток, капель в нос и других форм, подходящих для применения. Носителями, которые могут использоваться, являются вода, воск, глюкоза, лактоза, камедь акации, желатин, маннит, крахмал, клеящее вещество, трисиликат магния, тальк, зерновой крахмал, кератин, парафин, коллоидный кремнезем, картофельный крахмал, мочевина и другие носители, пригодные для использования при производстве препаратов в твердой, полутвердой или жидкой форме, и, кроме того, могут использоваться вспомогательные вещества, стабилизаторы, загустители, красители и отдушки. Активное соединение включается в фармацевтическую композицию в эффективном количестве, достаточном для получения желаемого эффекта на болезненный процесс или болезненное состояние.
Активный ингредиент может быть включен в рецептуру, например, препаратов для перорального применения, препаратов для инъекций, препаратов для наружного применения, препаратов для ингаляций, препаратов для нанесения на слизистые оболочки.
Млекопитающие, которых можно лечить с помощью данного изобретения, включают млекопитающих домашнего скота, таких как коровы, лошади и т.д., домашних животных, таких как собаки, кошки, крысы и т.д., и людей, предпочтительно людей.
Хотя дозировка терапевтически эффективного количества соединения (I) будет меняться в зависимости от возраста и состояния каждого отдельного пациента, средняя разовая доза для пациента-человека, равная примерно 0,01 мг, 0,1 мг, 1 мг, 10 мг, 50 мг, 100 мг, 250 мг и 1000 мг соединения (I), может быть эффективной для лечения вышеупомянутых заболеваний. В основном соединение (I) может прописываться в количестве между 0,01 мг и примерно 1000 мг в сутки на пациента.
Соединение (I) и его фармацевтически приемлемые соли настоящего изобретения обладают ингибирующей АДА активностью и, таким образом, пригодны для иммуномодуляции, особенно иммуносупрессии, противовоспалительного действия и лечения и профилактики различных заболеваний, в отношении которых эффективен Ado. Примерами этих заболеваний являются следующие:
а) аутоиммунные заболевания и воспалительные состояния, например различные коллагенозы с болями, аутоиммунные заболевания, различные нарушения иммунитета и т.п. у людей и животных, и более конкретно, что касается лечения и/или профилактики воспаления и боли в суставах и мышцах (например, ревматоидный артрит, ревматоидный спондилит, остеоартрит, подагрический артрит и т.д.), воспалительное состояние кожи (например солнечный ожог, экзема и т.д.), воспаление глаз (например, конъюнктивит), заболевание легких, в которое вовлечено воспаление (например, астма, бронхит, болезнь любителей голубей, легкие фермера (экзогенный аллергический альвеолит и т.д.), состояние желудочно-кишечного тракта, связанное с воспалением (например, ящурные язвы, болезнь Крона, атрофический гастрит, язвенный колит, заболевания брюшной полости, региональный илеит, синдром раздраженной толстой кишки (слизистый колит) и т.д.), гингивит (воспаление, боль и отек после операции или травмы), гипертермия, боль и другие состояния, связанные с воспалением, системная красная волчанка, склеродермия, полимиозит, полихондрит, узелковый периартериит, анкилозирующий спондилоартрит, хронические воспалительные состояния почек (например, нефротический синдром, гломерулонефрит, мембранозный нефрит и т.д.), острый нефрит, ревматическая лихорадка, синдром Шегрена, болезнь Бехчета, тиреоидит, диабет I типа, дерматомиозит, хронический активный гепатит, острый гепатит, миастения гравис, идиопатический синдром мальабсорбции, болезнь Грейвса, множественный склероз, первичный цирроз печени, синдром Рейтера, аутоиммунные гематологические заболевания (например, гемолитическая анемия, чисто эритроцитарная анемия, идиопатическая тромбоцитопения; апластическая анемия и т.д.), миастения гравис, увеит, контактный дерматит, псориаз, болезнь Кавасаки, саркоидоз, грануломатоз Вегнера, болезнь Ходжкина или т.п.;
b) отторжение органного или тканевого алло- или ксенотрансплантата, например почки, печени, сердца, легкого, совместно сердца-легких, костного мозга, островковых клеток, клеток кожи, клеток селезенки, хромаффинных и продуцирующих допамин клеток, тонкого кишечника или трансплантата роговицы. Лечение и/или профилактика реакции трансплантат-против-хозяина, такой, которая происходит после трансплантации костного мозга;
c) различные лейкемии, включая вызываемые вирусом, или различные индуцируемые лимфомы и
d) заболевания, которые возникают или усугубляются недостаточным кровотоком через конкретный орган или его часть, например сердечные приступы или “удары”, заболевания из-за нарушения микроциркуляции при сахарном диабете, атеросклероз или явления в результате менее продолжительного прекращения кровотока (например, стенокардия, преходящие приступы ишемии, ишемия кишечника, ишемия почек, синдром Шарко скелетных мышц, мигрень, феномен Рейно) и т.п.
Любые патенты, патентные заявки и публикации, процитированные здесь, включены в виде ссылки.
Чтобы проиллюстрировать полезность предмета изобретения соединения (I), ниже представлены данные фармакологического испытания соединения (I).
Анализ по ферменту аденозиндезаминаза (АДА)
Испытуемое соединение:
1-(1-гидрокси-4-фенил-2-бутил)имидазол-4-карбоксамид
(Пример 1)
Метод испытания:
Скорость реакции (V) измеряют по изменению поглощения при 265 нм (А265), происходящего в результате дезаминирования аденозина. Человеческую АДА экспрессировали в дефицитном по АДА бактериальном штамме, выделяли и очищали. Реакционные смеси в общем объеме, равном 200 мкл, содержали 25 мЕ/мл АДА и различные концентрации аденозина и испытуемых соединений в 10 мМ фосфатно-буферном физиологическом растворе (рН 7,4). Реакцию начинали путем добавления АДА к смеси аденозина и испытуемого соединения. Реакцию прослеживали при комнатной температуре путем регистрации снижения А265 в течение 5 минут на SPECTRAmax 250 (Molecular Devices, USA) для автоматического расчета Vmax. Значения константы ингибирования (Ki) испытуемых соединений определяли по графику Диксона.
Результаты:
Испытуемое соединение: Ki = 5,9 мкМ.
Индуцируемое эндотоксином продуирование цитокинов
Испытуемое соединение:
1-(1-гидрокси-4-фенил-2-бутил)имидазол-4-карбоксамид
Метод испытания:
Мышам BALB/c (самцы, 7-недельного возраста) делали в/в инъекцию 0,1 мг/кг липополисахаридов (ЛПС) в общем объеме 0,2 мл физиологического раствора. Гепаринизированные образцы крови отбирали через один час после инъекции ЛПС и плазму собирали с помощью центрифугирования. Количества TNF-α (цитокина воспаления) и IL-10 (противовоспалительного цитокина) в плазме определяли с помощью твердофазного иммуноферментного анализа. Испытуемые соединения вводили за 30 минут перед инъекцией ЛПС.
Результаты представлены в таблицах 1 и 2.
Результаты:

Наилучший способ осуществления изобретения
Последующие “Получения” и “Примеры” даны в целях детальной иллюстрации данного изобретения, но не должны истолковываться как ограничение объема данного изобретения.
Получение 1.
Смесь метил 4-имидазолкарбоксилата (5,0 г) и хлорида аммония (539 мг) в водном 28% растворе NН3 (75 мл) нагревают при 100°С в стальной герметизированной трубке в течение 5,5 часов. После охлаждения реакционную смесь концентрируют под вакуумом. Остаток перемешивают со смешанным растворителем из ацетона, этанола и воды (5:5:1, всего 25 мл). Полученный осадок собирают фильтрованием и промывают тем же смешанным растворителем и сушат под вакуумом с получением 4-имидазол-карбоксамида (4,63 г) в виде белого твердого вещества.
Т.пл: 211-214°С.
ИК (КВr): 3500-2600, 1652 см-1.
1H ЯМР (ДМСО-d6), δ: 7,06(1Н, шир.с), 7,34(1Н, шир.с), 7,58(1Н, с), 7,69(1Н, с).
МАСС: 112 (М+Н)+.
Получение 2.
Триэтиламин (583 мг) по каплям добавляют к перемешиваемой смеси этил (R)-2-гидрокси-4-фенилбутирата (1,0 г) и метансульфонилхлорида (660 мг) в дихлорметане (10 мл) при температуре ледяной бани. Через 40 минут реакционную смесь распределяют между дихлорметаном и водой. Органический слой промывают насыщенным раствором соли, сушат над сульфатом магния и концентрируют под вакуумом с получением этил-(R)-метилсульфонилокси-4-фенилбутирата (1,37 г) в виде масла. Это вещество использовали сразу же без дополнительной очистки. К раствору 4-имидазолкарбоксамида (534 мг) в ДМФ (8 мл) добавляют NaH (60% в минеральном масле, 192 мг) при комнатной температуре. Реакционную смесь перемешивают в течение 30 минут. Добавляют метансульфонат, полученный ранее, и полученную смесь перемешивают в течение 3 часов при 60°С.
Реакционную смесь охлаждают до 10°С на ледяной бане и нерастворенное вещество отфильтровывают и тщательно промывают метиленхлоридом. Фильтрат и промывную жидкость объединяют и затем промывают насыщенным раствором соли. Органический слой сушат над сульфатом натрия и концентрируют под вакуумом. Остаток очищают хроматографией на силикагеле (45 г) с элюированием хлороформом/метанолом (30:1) с получением 2-(4-карбамоил-1-имидазолил)-4-фенилбутирата (556 мг).
ИК (чистое): 3500-2800, 1741, 1666 см-1.
1H ЯМР (СDСl3), δ: 1,26(3Н, т, J=7,1 Гц), 2,3-2,68(4Н, м), 4,20(3Н, кв, J=7,1 Гц), 4,60(1Н, дд, J=9,8, 9,8 Гц), 5,44(1Н, шир.с), 6,96(1Н, шир.с), 7,08-7,35(5Н, м), 7,46(1Н, с), 7,72(1Н, с).
МАСС: 302 (М+Н)+.
Получение 3.
2-Гидроксиоктановую кислоту (1,0 г) перемешивают в 10% растворе хлористого водорода в метаноле (20 мл) при комнатной температуре. Через 1,5 часа реакционную смесь выпаривают при пониженном давлении. Остаток распределяют между этилацетатом и водой. Органический слой промывают водным раствором NаНСО3 и сушат над сульфатом натрия. Выпаривание растворителя при пониженном давлении дает метил-2-гидроксиоктаноат (0,684 г) в виде бесцветного масла.
ИК (чистое): 3463, 2952, 2927, 2859, 1735 см-1,
1H ЯМР (СDСl3), δ: 0,88(3Н, т, J=6,5 Гц), 1,25-1,90 (10Н, м), 2,70(1Н, шир.с), 3,79(3Н, с), 4,19(1Н, шир.).
МАСС: 175 (М+Н)+.
Получение 4.
Следующие соединения были получены способом, подобным способу из раздела “Получение 2”.
(1) Метил α-(4-карбамоил-1-имидазолил)фенилацетат получают из метилманделата и 4-имидазолкарбоксамида, полученного в разделе “Получение 1”.
ИК (КВr): 3500-2800, 1752, 1675 см-1.
1H ЯМР (СDСl3), δ: 3,84(3Н, с), 5,48(1Н, шир.с), 5,93(1Н, с), 7,06(1Н, шир.с), 7,24-7,46(5Н, м), 7,60(1Н, с), 7,67(1Н, с).
МАСС: 260 (M+H)+.
(2) Метил 2-(4-карбамоил-1-имидазолил)октаноат получали из 4-имидазолкарбоксамида, полученного в разделе “Получение 1”, и метил 2-гидроксиоктаната, полученного в разделе “Получение 3”.
Т.пл.: 63,5-65,5°С.
ИК (КВr): 3400-2800, 1753, 1671 см-1.
1H ЯМР (СDСl3), δ: 0,87(3Н, т, J=6,5 Гц), 1,05-1,45 (6Н, м), 1,90-2,20(4Н, м), 3,77(3Н, с), 4,71(1Н, дд, J=9,6, 5,6 Гц), 5,52(1Н, с), 7,10(1Н, с), 7,59(1Н, с), 7,72(1Н, с).
МАСС: 268 (М+Н)+.
Получение 5.
NaH (60% в минеральном масле, 60 мг) добавляют к перемешиваемому раствору 4-имидазолкарбоксамида (полученного в разделе “Получение 1”) (167 мг) в ДМФ (3,5 мл), и реакционную смесь перемешивают в течение 1,5 часов при 55°С. К этой смеси добавляют этил 2-бромвалерат (0,153 мл) и реакционную смесь перемешивают в течение 3 часов при 55-60°С. Реакционную смесь выливают в воду и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над сульфатом магния и концентрируют под вакуумом. Остаток очищают хроматографией на силикагеле (12 г) с элюированием хлороформом/метанолом (25:1) с получением этил-2-(4-карбамоил-1-имидазолил)валерата (150 мг).
Т.пл.: 95°С.
ИК (КВr): 3343, 3197, 2964, 1751, 1681 см-1.
1H ЯМР (ДМСО-d6), δ: 0,86(3Н, т, 3=1,2 Гц), 1,13(2Н, м), 1,20(3Н, т, J=7,1 Гц), 2,05(2Н, кв, J=7,2 Гц), 4,14(2Н, кв, J=7,1 Гц), 5,16(1Н, т, J=7,2 Гц), 7,10(1Н, с), 7,30(1Н, с), 7,73(1Н, с), 7,78(1Н, с).
МАСС: 240 (М+Н)+.
Получение 6.
1-(2-Оксотетрагидрофуран-3-ил)имидазол-4-карбоксамид получали из 4-имидазолкарбоксамида, полученного в разделе “Получение 1”, и α-бром-γ-бутиролактона, полученного по способу, подобному способу из раздела “Получение 5”.
ИК (KBr): 3700-3100, 1779, 1745, 1600 см-1.
МАСС: 196 (М+Н)+.
Получение 7.
Трифторметансульфоновую кислоту (1,13 г) добавляют к перемешиваемой смеси этил (S)-(-)-лактата (5,90 г) и бензил-2,2,2-трихлорацетимидата (15,15 г) в циклогексане (70 мл) и метиленхлориде (35 мл) при комнатной температуре в атмосфере азота. После перемешивания в течение 18 часов реакционную смесь фильтруют. Фильтрат разбавляют циклогексаном и затем последовательно промывают насыщенным раствором NаНСО3 (100 мл) и Н2О (100 мл). Органический слой сушат над сульфатом натрия и концентрируют под вакуумом. Остаток очищают хроматографией на силикагеле (260 г) с элюированием гексаном/этилацетатом (30:1) с получением этил (S)-2-(бензилокси)-пропионата (6,48 г).
ИК (чистое): 3100-2800, 1743, 1139 см-1.
1H ЯМР (СDСl3), δ: 1,26(3Н, т, J=7,0 Гц), 1,44(3Н, д, J=6,8 Гц), 4,05(1Н, кв, J=6,8 Гц), 4,22(2Н, кв, J=7,0 Гц), 4,40-4,75(2Н, м), 7,10-7,39(5Н, м).
МАСС: 231 (M+Na)+.
[α]28’5=-76,0° (С=0,50, EtOH).
Получение 8.
Раствор 1,ОМ ДИБАЛ (гидрида диизобутилалюминия) в гексане (10 мл) по каплям добавляют к перемешиваемому раствору этил (S)-2-(бензилокси)пропионата (полученного в разделе “получение 7”) (2,08 г) в метиленхлориде (20 мл) при -78°С (сухой лед/ацетон) в течение 5 минут в атмосфере азота. Через 20 минут к смеси при -78°С по каплям добавляют метанол (1,6 мл) и полученную смесь перемешивают при комнатной температуре в течение 30 минут. Смесь фильтруют через слой целита (Celite) и твердое вещество на фильтре промывают метиленхлоридом. Объединенные фильтраты концентрируют под вакуумом. Объединенный остаток очищают хроматографией на силикагеле (35 г) с элюированием гексаном/этилацетатом (30:1) с получением (S)-2-(бензилокси)пропиональдегида (810 мг).
ИК (чистое): 3100-2800, 1735, 1095 см-1.
1H ЯМР (СDСl3), δ: 1,33(3Н, д, J=6,9 Гц), 3,9(1Н, м), 4,60(2Н, м), 7,10-7,40(5Н, м), 9,67(1Н, с)
МАСС: 163 (М-Н)+.
[α]26’8=-34,7° (С=0,50, EtOH).
Получение 9.
Иодид триметилсульфоксония (1,22 г) добавляют к перемешиваемой суспензии гидрида натрия (60% в минеральном масле, 234 мг) в диметилсульфоксиде (12 мл) и диметоксиэтане (10 мл) при температуре от -3 до -4°С в атмосфере азота. Через 10 минут к смеси по каплям в течение 5 минут, при той же температуре добавляют раствор (S)-2-(бензилокси)пропиональдегида (полученного в разделе “Получение 8”) (800 мг) в диметоксиэтане (2 мл) и полученную смесь перемешивают в течение 30 минут при комнатной температуре. Смесь выливают в холодный насыщенный раствор хлорида аммония (50 мл) и экстрагируют этилацетатом (100 мл). Органический слой промывают насыщенным раствором соли (50 мл), сушат над сульфатом магния и концентрируют под вакуумом. Остаток очищают хроматографией на силикагеле (20 г) с элюированием гексаном/этилацетатом (30:1) с получением (3S)-3-бензилокси-1,2-эпоксибутана (507 мг).
ИК (чистое): 2981, 2927, 2865, 1241, 1103 см-1.
1H ЯМР (СDСl3), δ: 1,29(3Н, м), 2,40-3,55(4Н, м), 4,50-4,85(2Н, м), 7,10-7,40(5Н, м).
МАСС: 201 (M+Na)+.
Получение 10.
К перемешиваемой смеси хлорида лития (20,2 мг) и хлорида меди (II) (32 мг) в тетрагидрофуране (10 мл) при -78°С (сухой лед/ацетон) в течение периода, равного 10 минутам, в атмосфере азота по каплям добавляют раствор 2,0 М бензилмагнийхлорида в тетрагидрофуране (2,38 мл). К этой смеси при -78°С в течение 10 минут добавляют по каплям раствор (3S)-3-бензилокси-1,2-эпоксибутана (полученный в разделе “Получение 9”) (425 мг) в тетрагидрофуране (10 мл). Полученную смесь перемешивают при -78°С в течение 2,5 часов и затем ей дают нагреться до комнатной температуры и перемешивают в течение ночи. Реакционную смесь обрабатывают насыщенным раствором хлорида аммония (20 мл) при температуре ледяной бани и затем разбавляют этилацетатом (100 мл). Органический слой промывают Н2O (50 мл) и насыщенным раствором соли (50 мл), сушат над сульфатом магния и концентрируют под вакуумом. Остаток очищают хроматографией на силикагеле (20 г) с элюированием гексаном/этилацетатом (10:1) с получением (2S)-2-бензилокси-5-фенилпентан-3-ола (620 мг).
ИК (чистое): 3444, 2931, 2865 см-1.
1H ЯМР (CDCl3), δ: 1,14-2,00(3H, м), 1,60-1,85(1Н, м), 2,55-3,00(3H, м), 3,30-3,85(3H, м), 4,35-4,75(2Н, м), 7,05-7,40(10Н, м).
МАСС: 293 (М+Na)+.
Получение 11.
Следующие соединения были получены по способу, подобному способу из раздела “Получение 10”.
(1) (2S)-2-Бензилокси-6-фенилгексан-3-ол был получен из (3S)-3-бензилокси-1,2-эпоксибутана (полученного в “Получении 9”) и фенетилмагнийхлорида.
ИК (чистое): 3436, 2933, 2861 см-1.
1H ЯМР (СDСl3), δ: 1,05-1,20(3H, м), 1,30-2,00(4Н, м), 2,00-2,80(3H, м), 3,25-3,85(2Н, м), 4,35-4,75(2Н, м), 7,05-7,45(10Н, м).
МАСС: 285 (M+Na)+.
(2) (2S)-2-Бензилокси-5-(1-нафтил)пентан-3-ол получали из (3S)-3-бензилокси-1,2-эпоксибутана (полученного в “Получении 9”) и 1-нафтилметилмагнийхлорида (J.Am.Chem.Sоc., 1943, 65, 295).
ИК (чистое): 3700-3100, 3100-2800, 1087, 1076 см-1.
1H ЯМР (СDСl3), δ: 1,10-1,20(3H, м), 1,75-2,00 (2Н, м), 2,15-2,75(1Н, м), 2,95-3,95(4Н, м), 4,40-4,75(2Н, м), 7,20-7,60(9Н, м), 7,65-7,20(3H, м).
(3) (2S,3S)-2-(Бензилокси)-5-(2-метилфенил)пентан-3-ол получали из соединения, полученного в “Получении 9”, и 2-метилбензилхлорида.
1H ЯМР (СDСl3), δ: 1,19(3H, д, J=6 Гц), 1,6-1,8 (2Н, м), 2,32(3H, с), 2,64(1Н, д, J=3 Гц), 2,6-3,0(2Н, м), 3,3-3,6 (2Н, м), 4,43(1Н, д, J=11 Гц), 4,67(1Н, д, J=11 Гц), 7,1-7,3 (9Н, м).
МАСС: 307 (M+Na)+.
(4) (2S,3S)-2-(Бензилокси)-5-(2-хлорфенил)пентан-3-ол получали из соединения, полученного в “Получении 9”.
1H ЯМР (СDСl3), δ: 1,17(3H, д, J=5 Гц), 1,6-1, 9 (2Н, м), 2,64(1Н, д, J=3 Гц), 2,7-3,1(2Н, м), 3,4-3,5(2Н, м), 4,44 (1Н, д, J=12 Гц), 4,67(1Н, д, J=12 Гц), 7,1-7,4(9Н, м).
МАСС: 327 (M+Na)+.
(5) (2S,3S)-2-(Бензилокси)-5-(2-метоксифенил)пентан-3-ол получали из соединения, полученного в “Получении 9”.
1H ЯМР (СDСl3), δ: 1,18(3H, д, J=6 Гц), 1,6-1,9 (2Н, м), 2,6-3,0(3H, м), 3,4-3,5(2Н, м), 3,82(3H, с), 4,44(1Н, д, J=12 Гц), 4,66(1Н, д, J=12 Гц), 6,8-7,0 (2Н, м), 7,1-7,4(7Н, м).
МАСС: 323 (M+Na)+.
(6) (2S,3S)-2-(Бензилокси)-5-(2-гексилоксифенил)пентан-3-ол получали из соединения, полученного в “Получении 9”.
1H ЯМР (СDСl3), δ: 0,90(3H, т, J=6 Гц), 1,18(3H, д, J=6 Гц), 1,2-1,6(6Н, м), 1,6-1,9(4Н, м), 2,66(1Н, д, J=3 Гц), 2,7-2,9(2Н, м), 3,4-3,5(2Н, м), 3,96(2Н, т, J=6 Гц), 4,44 (1Н, д, J=11 Гц), 4,66(1Н, д, J=11 Гц), 6,8-7,0(2Н, м), 7,1-7,3(7Н, м).
МАСС: 393 (M+Na)+.
(7) (2S,3S)-2-(Бензилокси)-5-(2,3-дихлорфенил)пентан-3-ол получали из соединения, полученного в “Получении 9”.
1H ЯМР (СDСl3), δ: 1,19(3H, д, J=5 Гц), 1,6-1,9 (2Н, м), 2,65(1Н, д, J=3 Гц), 2,7-3,1(23, м), 3,3-3,5(2Н, м), 4,43 (1Н, д, J=11 Гц), 4,67(1Н, д, J=11 Гц), 7,0-7,5(8Н, м).
МАСС: 361 (M+Na)+.
(8) (2S,3S)-2-(Бензилокси)-5-(2-фенетилоксифенил)пентан-3-ол получали из соединения, полученного в “Получении 9”.
1H ЯМР (СDСl3), δ: 1,14(3H, д, J=6 Гц), 1,6-1,8 (2Н, м), 2,5-3,0(3H, м), 3,10(2Н, т, J=7 Гц), 3,3-3,5(2Н, м), 4,18 (2Н, т, J=7 Гц), 4,43(1Н, д, J=11 Гц), 4,65(1Н, д, J=11 Гц), 6,7-7,4(14Н, м).
МАСС: 413 (M+Na)+.
(9) (2S,3S)-2-(Бензилокси)-5-(2,3-диметилфенил)пентан-3-ол получали из соединения, полученного в “Получении 9”.
1H ЯМР (СDСl3), δ: 1,19(3H, д, J=6 Гц), 1,6-1,8 (2Н, м), 2,22(3H, с), 2,28(3H, с), 2,6-3,0(3H, м), 3,3-3,6(2Н, м), 4,43(1Н, д, J=11 Гц), 4,67(1Н, д, J=11 Гц), 7,02(3H, с), 7,2-7,4(5Н, м).
МАСС: 321 (M+Na)+.
(10) (2S,3S)-2-(Бензилокси)-5-[2,3-(метилендиокси)фенил]-пентан-3-ол получали из соединения, полученного в “Получении 9”.
ЯМР (СDСl3), δ: 1,19(3H, д, J=6 Гц), 1,6-1,9(2Н, м), 2,6-2,9(3H, м), 3,3-3,5(2Н, м), 4,43(1Н, д, J=12 Гц), 4,67(1Н, д, J=12 Гц), 5,92(2Н, с), 6,6-6,8(3H, м), 7,33(5Н, с).
МАСС: 337 (M+Na)+.
Получение 12.
К перемешиваемому раствору Pd(OAc)2 (340 мг), nВu3Р (613 мг) и Et3N (1,99 г) в ДМФ (30 мл) добавляют метил 2-гидрокси-3-бутеноат (1,76 г) с последующим добавлением 1-йоднафталина (5,0 г) и реакционную смесь перемешивают при 100°С в течение 2,5 часов. Реакционную смесь выливают в воду (300 мл) и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над сульфатом магния и выпаривают под вакуумом. Остаток очищают колоночной хроматографией на силикагеле (130 г) с элюированием гексаном/этилацетатом (50:1) с получением метил 4-(1-нафтил)-2-оксобутирата (254 мг) в виде красного масла.
ИК (чистое): 3050, 2954, 1739, 1725 см-1.
1H ЯМР (СDСl3), δ: 3,25-3,55(4Н, м), 3,86(3H, с), 7,25-8,10 (7Н, м).
Получение 13.
NaBH4 (22 мг) порциями добавляют к охлаждаемому льдом раствору метил 4-(1-нафтил)-2-оксобутирата (полученного в “Получении 12”) (252,5 мг) в ТГФ (5 мл) - H2O (1,0 мл). После того, как завершается добавление, реакционную смесь перемешивают при температуре ледяной бани в течение 30 минут. Добавляют воду (4 мл) и полученную смесь перемешивают в течение нескольких минут и затем экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над сульфатом магния и выпаривают под вакуумом. Остаток очищают колоночной хроматографией на силикагеле (5 г) с элюированием гексаном/этилацетатом (10:1) с получением метил 2-гидрокси-4-(1-нафтил)бутирата (84,4 мг) в виде бесцветного масла.
ИК (чистое): 3700-3100, 3052, 2954, 1739, 1236, 1103 см-1.
1H ЯМР (СDСl3), δ: 2,03-2,31 (2Н, м), 2,91(1Н, д, J=5,2 Гц), 3,23(2Н, т, J=7,9 Гц), 3,75(3H, с), 4,29(1Н, м), 7,30-8,10(7Н, м).
МАСС: 245 (М+Н)+.
Получение 14.
NaBH4 (1,82 г) порциями добавляют к охлаждаемому льдом раствору этил(R)-2-гидрокси-4-фенетилбутирата (2,0 г) в метаноле (40 мл). После того, как завершается добавление, реакционную смесь перемешивают при комнатной температуре в течение 45 минут. Добавляют воду (20 мл) и полученную смесь перемешивают в течение нескольких минут и затем выпаривают под пониженным давлением. Остаток экстрагируют этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над сульфатом магния. Выпаривание растворителя под пониженным давлением дает (R)-4-фенилбутан-1,2-диол (1,63 г) в виде бесцветного масла. Это вещество используют для следующей реакции без дополнительной очистки.
Имидазол (1,96 г) добавляют к охлаждаемому льдом раствору диола в ДМФ (20 мл) с последующим добавлением трет-бутилдиметилсилилхлорида (1,52 г). Через 1 час ледяную баню удаляют и затем смесь перемешивают при комнатной температуре в течение ночи.
Реакционную смесь выливают в воду (200 мл) и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над сульфатом магния и выпаривают под вакуумом. Остаток очищают колоночной хроматографией на силикагеле (50 г) с элюированием гексаном/этилацетатом (50:1) с получением (R)-1-(трет-бутилдиметилсилилокси)-4-фенилбутан-2-ола (2,10 г) в виде бесцветного масла.
ИК (чистое): 3800-3100, 2950, 2931, 2859, 1253, 1116, 1081 см-1.
1H ЯМР (СDСl3), δ: 0,52(6Н, с), 0,90(9Н, с), 1,60-1,85 (2Н, м), 2,45(1Н, д, J=3,6 Гц), 2,60-2,95(2Н, м), 3,35-3,75 (3H, м), 7,15-7,35(5Н, м).
МАСС: 281 (М+Н)+.
Получение 15.
Следующие соединения получали по методике, подобной процедуре из раздела “Получение 12”.
(1) Метил 4-(3-метилфенил)-2-оксобутират получали в виде бледно-желтого масла из 3-йодтолуола и метил 2-гидрокси-3-бутеноата.
ИК (чистое): 2954, 2923, 1731, 1238, 1074 см-1.
1H ЯМР (СDСl3), δ: 2,33(3H, с), 2,92(2Н, т, J=7,5 Гц), 3,18(2Н, т, J=7,5 Гц), 3,86(3H, с), 6,90-7,25(4Н, м).
(2) Метил 4-[3-(трифторметил)фенил]-2-оксобутират получали в виде масла из 3-йодбензотрифторида и метил-2-гидрокси-3-бутеноата.
ИК (чистое): 2958, 1739, 1728, 1241 см-1.
1H ЯМР (СDСl3), δ: 3,03(2Н, т, J=7,4 Гц), 3,22(2Н, т, J=7,4 Гц), 3,87(3H, с), 7,35-7,55(4Н, м).
(3) Метил 4-[3-(трет-бутилдиметилсилилокси)фенил]-2-оксобутират получали в виде желтого масла из 3-(трет-бутилдиметилсилилокси)йодбензола и метил-2-гидрокси-3-бутеноата.
ИК (чистое): 2954, 2935, 2857, 1731, 1594, 1244 см-1.
1H ЯМР (СDСl3), δ: 0,19(6Н, с), 0,98(9Н, с), 2,90(2Н, т, J=7,6 Гц), 3,16(2Н, т, J=7,6 Гц), 3,86(3H, с), 6,65-6,85(3H, м), 7,15(1Н, м).
МАСС: 323 (М+Н)+.
Получение 16.
Следующие соединения получали по методике, подобной процедуре из раздела “Получение 13”.
(1) Метил 2-гидрокси-4-(3-метилфенил)бутират получали в виде бесцветного масла из соединения, полученного в “Получении 15(1)”.
ИК (чистое): 3700-3100, 3016, 2954, 2859, 1733, 1234, 1099 см-1.
1H ЯМР (СDСl3), δ: 1,80-2,20(2Н, м), 2,33(3H, с), 2,65-2,85(3H, м), 3,76(3H, с), 4,20(1Н, м), 6,95-7,25(4Н, м).
МАСС: 209 (М+Н)+.
(2) Метил 2-гидрокси-4-[3-(трифторметил)фенил]бутират получали из соединения, полученного в “Получении 15(2)”.
ИК (чистое): 3700-3200, 3016, 2956, 1739, 1328, 1122, 703 см-1.
1H ЯМР (СDСl3), δ: 1,85-2,25(2Н, м), 2,70-2,95 (3H, м), 3,76(3H, с), 4,18(1Н, м), 7,35-7,55(4Н, м).
(3) Метил 2-гидрокси-4-[3-(трет-бутилдиметилсилилокси)-фенил]бутират получали в виде бесцветного масла из соединения, полученного в “Получении 15(3)”.
ИК (чистое): 3700-3100, 2954, 2857, 1739, 1595, 1479, 1444, 1273 см-1.
1H ЯМР (СDСl3), δ: 0,19(6Н, с), 0,98(9Н, с), 1,80-2,20 (2Н, м), 2,65-2,80(3H, м), 3,77(3H, с), 4,18(1Н, м), 6,65-6,90(3H, м), 7,13(1Н, м).
МАСС: 325 (М+Н)+.
Получение 17.
Следующие соединения получали по методике, подобной процедуре из раздела “Получение 2”.
(1) Метил 2-(4-карбамоил-1-имидазолил)-4-(1-нафтил)бутират получали из соединения, полученного в “Получении 1”, и соединения, полученного в “Получении 13”.
ИК (KBr): 3343, 3185, 1745, 1662 см-1.
1H ЯМР (СDСl3), δ: 2,40-3,25 (4Н, м), 3,73(3H, м), 4,71 (1Н, м), 5,42(1Н, шир.с), 6,98(1Н, шир.с), 7,19(1Н, д, J=6, 9 Гц), 7,35-7,60(4Н, м), 7,74-7,95(4Н, м).
МАСС: 338 (М+Н)+.
(2) Метил 2-(4-карбамоил-1-имидазолил)-4-(3-метилфенил)-бутират получали из соединения, полученного в “Получении 1”, и соединения, полученного в “Получении 16(1)”.
ИК (чистое): 3800-2800, 1745, 1658 см-1.
1H ЯМР (СDСl3), δ: 2,25-2,75(7Н, м), 3,75(3H, с), 4,64 (1H, м), 5,43(1Н, шир.с), 6,85-7,25(5Н, м), 7,45(1Н, с), 7,71(1Н, с).
МАСС: 302 (М+Н)+.
(3) Метил 2-(4-карбамоил-1-имидазолил)-4-[3-(трифторметил)фенил]бутират получали из соединения, полученного в “Получении 1”, и соединения, полученного в “Получении 16(2)”.
ИК (чистое): 3700-2800, 1743, 1236 см-1.
1H ЯМР (СDСl3), δ: 2,25-2,80(4Н, м), 3,77(3H, м), 4,65 (1H, м), 5,43(1Н, шир.с), 6,96(1Н, шир.с), 7,20-7,55(5Н, м), 7,73(1Н, с).
МАСС: 356 (М+Н)+.
(4) Метил 2-(4-карбамоил-1-имидазолил)-4-(3-гидроксифенил)бутират получали из соединения, полученного в “Получении 1”, и соединения, полученного в “Получении 16(3)”.
ИК (чистое): 3800-2800, 1745, 1664, 1590, 1267, 1234 см-1.
1H ЯМР (СDСl3), δ: 2,20-2,80 (4Н, м), 3,76(3H, с), 4,65 (1H, м), 5,64(1Н, шир.с), 6,50-6,85(3H, м), 6,90-7,30(2Н, м), 7,55(1Н, с), 7,73(1Н, с).
МАСС: 304 (М+Н)+.
Получение 18.
К перемешиваемому раствору Pd(OAc)2 (40 мг, 0,18 ммоль), nВu3Р (71 мг, 0,35 ммоль) и Et3N (232 мг, 2,29 ммоль) в ДМФ (5 мл) добавляют 3-бутен-1,2-диол (155 мг, 1,76 ммоль) с последующим добавлением 4-йодтолуола (500 мг, 2,29 ммоль) и реакционную смесь перемешивают при 100°С в течение 1,5 часов. Реакционную смесь выливают в воду (50 мл) и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат (сульфат магния) и выпаривают под вакуумом. Остаток очищают колоночной хроматографией на силикагеле (10 г) с элюированием толуолом/этилацетатом (50:1) с получением 1-гидрокси-4-(п-толил)бутан-2-она (230 мг, 73,4%) в виде бледно-желтого твердого вещества.
К охлаждаемому льдом раствору 1-гидрокси-4-(п-толил)-бутан-2-она в ДМФ (5 мл) добавляют имидазол (264 мг, 3,88 ммоль) с последующим добавлением трет-бутилдиметилсилилхлорида (234 мг, 1,55 ммоль). Через 30 минут ледяную баню удаляют и затем смесь перемешивают в течение ночи при комнатной температуре. Реакционную смесь выливают в воду (50 мл) и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат (сульфат магния) и концентрируют под вакуумом. Остаток очищают колоночной хроматографией на силикагеле (8 г) с элюированием гексаном/этилацетатом (50:1) с получением 1-(трет-бутилдиметилсилилокси)-4-(4-метилфенил)бутан-2-она (350 мг, 67,9) в виде бесцветного масла.
ИК (чистое): 2933, 2857, 1726, 1255, 1105, 842 см-1.
1H ЯМР (СDСl3), δ: 0,07(6Н, с), 0,91(9Н, с), 2,31(3H, с), 2,75-2,95(4Н, м), 4,14(2Н, с), 7,08(4Н, с).
Получение 19.
1-(Трет-бутилдиметилсилилокси)-4-[3-(этоксикарбонил)-фенил]бутан-2-он (1,62 г, 42,7%) получали в виде бесцветного масла по методике, подобной процедуре из “Получения 18”, из этил 3-йодбензоата и 3-бутен-1,2-диола.
ИК (чистое): 2929, 2858, 1720, 1238, 1103 см-1.
1H ЯМР (СDСl3), δ: 0,07(6Н, с), 0,91(9Н, с), 1,40(3H, т, J=7,1 Гц), 2,75-3,05(4Н, м), 4,15(2Н, с), 4,37(2Н, кв, J=7,1 Гц), 7,30-7,45(2Н, м), 7,85-7,95(2Н, м).
МАСС: 351 (М+Н)+.
Получение 20.
К перемешиваемому раствору Pd(OAc)2 (75 мг, 0,34 ммоль), nBu3Р (136 мг, 0,67 ммоль) и Et3N (442 мг, 4,37 ммоль) в ДМФ (10 мл) добавляют 3-бутен-1,2-диол (296 мг, 3,36 ммоль) с последующим добавлением метил-3-бромфенилацетата (1,0 г, 4,37 ммоль) и реакционную смесь перемешивают при 100°С в течение 5 часов. Реакционную смесь выливают в воду (100 мл) и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат (сульфат магния) и выпаривают под вакуумом. Остаток очищают колоночной хроматографией на силикагеле (25 г) с элюированием толуолом/этилацетатом (20:1) с получением метил 3-(4-гидрокси-3-оксобутил)фенилацетата (193 мг, 24,4%) в виде масла.
ИК (чистое): 3700-3100, 2950, 1732, 1261, 1159, 1069 см-1.
1H ЯМР (СDСl3), δ: 2,73(2Н, т, J=7,5 Гц), 2,96(2Н, т, J=7,5 Гц), 3,06(1Н, т, J=4,8 Гц), 3,60(2Н, с), 3,70(3H, с), 4,19(2Н, д, J=4,8 Гц), 7,05-7,35(4Н, м).
МАСС: 237 (М+Н)+.
Получение 21.
Следующие соединения получали по методике, подобной процедуре из раздела “Получение 13”.
(1) 1(трет-Бутилдиметилсилилокси)-4-(4-метилфенил)бутан-2-ол получали в виде бесцветного масла из соединения, полученного в “Получении 18”.
ИК (чистое): 3442, 2931, 2859, 1463, 1254, 1116 см-1.
1H ЯМР (СDСl3), δ: 0,06(6Н, с), 0,90(9Н, с), 1,60-1,85 (2Н, м), 2,32(3H, с), 2,44(1Н, д, J=3,5 Гц), 2,55-2,90(2Н, м), 3,30-3,80(3H, м), 7,10(4Н, с).
МАСС: 295 (М+Н)+.
(2) 1-(трет-Бутилдиметилсилилокси)-4-[3-(этоксикарбонил)-фенил]бутан-2-ол получали в виде бесцветного масла из соединения, полученного в “Получении 19”.
ИК (чистое): 3700-3100, 2933, 2860, 1718, 1279, 1110 см-1.
1H ЯМР (СDСl3), δ: 0,07(6Н, с), 0,90(9Н, с), 1,40(3H, т, J=7,1 Гц), 1,65-1,85(2Н, м), 2,46(1Н, д, J-3,4 Гц), 2,65-3,00(2Н, м), 3,35-3,75(3H, м), 4,37(2Н, кв, J=7,1 Гц), 7,30-7,45(2Н, м), 7,80-7,95(2Н, м).
МАСС: 353(М+Н)+.
(3) Метил 3-[4-(трет-бутилдиметилсилилокси)-3-гидроксибутил]фенилацетат получали в виде бесцветного масла из соединения, полученного в “Получении 22”.
ИК (чистое): 3800-3100, 2931, 2858, 1741, 1250, 1119 см-1.
1H ЯМР (СDСl3), δ: 0,07(6Н, с), 0,90(9Н, с), 1,60-1,80 (2Н, м), 2,45(1Н, д, J=3,6 Гц), 2,55-2,95(2Н, м), 3,35-3,75 (8Н, м), 7,05-7,35(4Н, м).
МАСС: 353 (M+H)+.
Получение 22.
К охлаждаемому льдом раствору метил 3-(4-гидрокси-3-оксобутил)фенилацетата (472 мг, 2,00 ммоль) в ДМФ (10 мл) добавляют имидазол (264 мг, 3,88 ммоль) с последующим добавлением трет-бутилдиметилсилилхлорида (408 мг, 5,99 ммоль). Через 30 минут ледяную баню удаляют и затем смесь перемешивают в течение ночи при комнатной температуре. Реакционную смесь выливают в воду (100 мл) и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат (сульфат магния) и концентрируют под вакуумом. Остаток очищают колоночной хроматографией на силикагеле (20 г) с элюированием гексаном/этилацетатом (10:1) с получением метил 3-[4-(трет-бутилдиметилсилилокси)-3-оксобутил]фенилацетата (664 мг, 94,9%) в виде бесцветного масла.
ИК (чистое): 2952, 2933, 2856, 1738, 1250, 1153, 1101 см-1.
1H ЯМР (СDСl3), δ: 0,07(6H, с), 0,91(9Н, с), 2,75-3,00 (4Н, м), 3,60(2Н, с), 3,69(3H, с), 4,15(2Н, с), 7,05-7,30 (4Н, м).
МАСС: 351 (M+H)+.
Получение 23.
Раствор этил 2-(4-карбамоил-1-имидазолил)-4-фенилбутирата (полученного в “Получении 2”) в ДМФ (5 мл) добавляют к охлаждаемому льдом раствору РОСl3 (0,71 мл) в ДМФ (6 мл) в атмосфере азота. Через 1,5 часа растворитель выливают в воду (50 мл) и раствор нейтрализуют насыщенным NaHCO3 водн. Полученную смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над сульфатом натрия и концентрируют под вакуумом. Остаток очищают колоночной хроматографией на силикагеле (16 г) с элюированием хлороформом/метанолом (100:1) с получением этил 2-(4-циано-1-имидазолил)-4-фенилбутирата (435 мг, 101,2%).
ИК (чистое): 3132, 2978, 2933, 2235, 1741, 1236, 1157 см-1.
1H ЯМР (СDСl3), δ: 1,28(3H, т, J=7,1 Гц), 2,20-2,80(4Н, м), 4,23(2H, кв, J=7,1 Гц), 4,63(1Н, м), 7,00-7,40(5Н, м), 7,53(1Н, с), 7,58(1Н, с).
МАСС: 284 (М+Н)+.
Получение 24.
1-(трет-Бутилдиметилсилилокси)-3-феноксипропан-2-ол получали из 3-фенокси-1,2-пропандиола и трет-бутилдиметилсилилхлорида по методике, подобной процедуре из “Получения 22”.
ИК (чистое): 3700-3100, 2931, 2860, 1244, 1092 см-1.
1H ЯМР (СDСl3), δ: 0,08(6Н, с), 0,90(9Н, с), 2,54(1Н, д, J=5,4 Гц), 3,75-4,15(5Н, м), 6,85-7,05 (3H, м), 7,25-7,35 (2Н, м).
МАСС: 283 (М+Н)+.
Получение 25.
1-Нафтилметилмагнийхлорид получают из стружек магния (2,88 г) и 1-(хлорметил)нафталина (6,98 г) в эфире (80 мл) по методу J.Am.Chem.Soc., (1943) 65, 295. Раствор хлорида лития (167 мг) и хлорида меди (II) (266 мг) в ТГФ (10 мл) по каплям добавляют к эфирному раствору реактива Гриньяра с последующим добавлением раствора (2RS,3S)-3-(бензилокси)-1,2-эпоксибутана (3,52 г) в эфире (30 мл) при температуре ниже -70°С. Смесь перемешивают при -78°С в течение 1 часа и затем дают нагреться до комнатной температуры и перемешивают в течение ночи. После охлаждения смесь гасят насыщенным водным раствором хлорида аммония (100 мл). Нерастворившееся вещество отфильтровывают через целит и осадок на фильтре промывают эфиром. Фильтрат и промывки объединяют и органический слой промывают водой и насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют под вакуумом с получением масла. Флэш-хроматография (гексан : этилацетат = 9:1 → 4:1) дает (2S,3S)-2-бензилокси-5-(1-нафтил)пентан-3-ола (2,66 г, 42,0%) в виде первого элюата и (23,3R)-2-бензилокси-5-(1-нафтил)пентан-3-ола (1,36 г, 21,5%) в виде второго элюата.
(2S,3S)-2-бензилокси-5-(1-нафтил)пентан-3-ол
ИК (чистое): 3558, 3458, 2870, 1078 см-1.
1H ЯМР (СDСl3), δ: 1,17(3H, д, J=6,0 Гц), 1,89(2Н, м), 2,70(1Н, д, J=4,0 Гц), 3,15(1Н, м), 3,30-3,60(3H, м), 4,43 (1Н, д, J=11,4 Гц), 4,67(1Н, д, J=11,4 Гц), 7,20-8,15 (12Н, м).
[α]
(2S,3R)-2-бензилокси-5-(1-нафтил)пентан-3-ол
ИК (чистое): 3556, 3458, 2871, 1088 см-1.
1H ЯМР (СDСl3), δ: 1,16(3H, д, J=6,3 Гц), 1,86(2Н, м), 2,19(1Н, д, J=4,0 Гц), 3,11(1Н, м), 3,32-3,55(2Н, м), 3,87 (1Н, м), 4,47(1Н, д, J=11,8 Гц), 4,60(1Н, д, J=11,8 Гц), 7,19-8,06(12Н, м).
[α]
Получение 26.
Раствор (S)-2-(бензилокси)пропаналя (Bull.Chem.Soc. Jpn., (1989) 62, 3038) (16,25 г) в эфире (200 мл) добавляют к суспензии бромида цинка (26,75 г) в эфире (50 мл) при температуре ниже 6°С и затем добавляют эфирный раствор 2-(1-нафтил)этилмагний бромида, полученный из 2-(1-нафтил)этил-бромида (46,55 г) и магниевых стружек (9,63 г) в эфире (300 мл), при температуре ниже 8°С. Смесь перемешивают при 4°С в течение 1 часа и затем добавляют ТГФ (200 мл). Конечную смесь перемешивают в течение ночи при комнатной температуре. После охлаждения смесь гасят насыщенным водным раствором хлорида аммония (200 мл) и нерастворимое вещество отфильтровывают. Фильтрат экстрагируют этилацетатом и экстракт промывают насыщенным раствором соли, сушат и концентрируют под вакуумом. Флэш-хроматография (гексан : этилацетат = 9:1) дает (2S,3S)-2-бензилокси-5-(1-нафтил)пентан-3-ол (9,78 г, 30,8%) в виде масла.
Получение 27.
К охлаждаемому льдом раствору (2S,3S)-2-бензилокси-5-(1-нафтил)пентан-3-ола (полученному в “Получении 26”) (7,43 г) в дихлорметане (100 мл) добавляют метансульфонилхлорид (2,15 мл) с последующим добавлением триэтиламина (3,88 мл). Смесь перемешивают при 4°С в течение 40 минут. После разбавления дихлорметаном смесь промывают водой и насыщенным раствором соли и концентрируют под вакуумом с получением (2S,3S)-2-бензилокси-5-(1-нафтил)-3-пентилметансульфоната (9,92 г, 107,4%) в виде масла. Этот продукт непосредственно используется на следующей стадии без дополнительной очистки.
ИК (чистое): 1344, 1173 см-1.
1H ЯМР (СDСl3), δ: 1,23(3H, д, J=6,4 Гц), 2,04-2,25(2Н, м), 2,98(3H, с), 3,06-3,33(2Н, м), 3,82(1Н, м), 4,44(1Н, д, J=11,5 Гц), 4,64(1Н, д, J=11,5 Гц), 4,80(1Н, м), 7,25-8,02 (12Н, м).
Получение 28.
Следующее соединение было получено по методике, подобной процедуре из раздела “Получение 25”.
(1) (2S,3S)-2-(Бензилокси)-5-[2-(трифторметил)фенил]пентан-3-ол получали из (S)-2-(бензилокси)пропаналя.
1H ЯМР (СDСl3), δ: 1,19(3H, д, J=6 Гц), 1,6-1,9(2Н, м), 2,67(1Н, д, J=3 Гц), 2,7-3,2(2Н, м), 3,3-3,6(2Н, м), 4,44 (1H, д, J=11 Гц), 4,67(1Н, д, J=11 Гц), 7,2-7,7(9Н, м).
МАСС: 361 (M+Na)+.
(2) (2S,3S)-2-(трет-Бутилдиметилсилилокси)-5-фенилпентан-3-ол получали из (S)-2-(трет-бутилдиметилсилилокси)пропаналя (Synthesis, 1996, 652), (3,0 г) и 2-фенетилбромида.
ИК (чистое): 3573, 3473, 2935, 1078 см-1.
1H ЯМР (СDСl3), δ: 0,09(6Н, с), 0,90(9Н, с), 1,13(3H, д, J=6,2 Гц), 1,66-1,77(2Н, м), 2,42(1Н, д, J=5,3 Гц), 2,60-2,95(2Н, м), 3,30(1Н, м), 3,65(1Н, м), 7,14-7, 32 (5Н, м).
МС: (ESI, m/z): 317 (M+Na)+.
[α]
(3) (2S,3S)-2-(трет-Диметилсилилокси)-5-[2(бензилокси)-фенил]пентан-3-ол получали из (S)-2-(трет-бутилдиметилсилилокси) пропаналя.
1H ЯМР (СDСl3), δ: 0,05(3H, с), 0,06(3H, с), 0,88(9Н, с), 1,08(3H, д, J=6 Гц), 1,6-1,9(2Н, м), 2,40(1Н, д, J=5 Гц), 2,6-3,0(2Н, м), 3,2-3,4(1Н, м), 3,6-3,7(1Н, м), 5,09 (2Н, с), 6,8-7,5(9Н, м).
МС: 423 (M+Na)+.
(4) (2S,3S)-2-(Бензилокси)-5-(2-нафтил)пентан-3-ол получали из (S)-2-(бензилокси)пропаналя.
ИК (чистое): 3442, 1078 см-1.
1H ЯМР (СDСl3), δ: 1,18(3H, д, J=6 Гц), 1,7-2,0 (2Н, м), 2,64(1Н, д, J=3 Гц), 2,7-3,1(2Н, м), 3,3-3,6(2Н, м), 4,43 (1H, д, J=11 Гц), 4,67(1Н, д, J=11 Гц), 7,2-7,6(8Н, м), 7,64 (1H, с), 7,6-7,9(3H, м).
МС: 343 (М+Na)+.
(5) (2S,3S)-2-(Бензилокси)-6-(1-нафтил) гексан-3-ол получали из (S)-2-(бензилокси)пропаналя.
ИК (чистое): 3437, 1081 см-1.
1H ЯМР (СDСl3), δ: 1,18(3H, д, J=6 Гц), 1,5-1,7(2Н, м), 1,7-2,2(2Н, м), 2,59(1Н, д, J=4 Гц), 3,0-3,2(2Н, м), 3,3-3,6(2Н, м), 4,41(1Н, д, J=11 Гц), 4,66(1Н, д, J=11 Гц), 7,2-7,6(9Н, м), 7,70(1Н, д, J=8 Гц), 7,7-8,1(2Н, м).
МАСС: 357 (M+Na)+.
Получение 29.
Следующие соединения были получены по методике, подобной процедуре из раздела “Получение 27”.
(1) (2S,3R) -2-Бензилокси-5-(1-нафтил)-3-пентилметансульфонат получали из (2S,3R)-2-бензилокси-5-(1-нафтил)пентан-3-ола, полученного в “Получении 25”.
ИК (чистое): 1346, 1171 см-1.
1H ЯМР (СDСl3), δ: 1,23(3H, д, J=6,4 Гц), 1,80-2,25 (2Н, м), 3,08(3H, с), 3,10(1Н, м), 3,40(1Н, м), 3,64(1Н, м), 4,58(2Н, с), 5,04(1Н, м), 7, 30-8, 05 (12Н, м).
(2) (2S,3S)-2(трет-Бутилдиметилсилилокси)-5-фенил-3-пентилметансульфонат получали из (2S,3S)-2-(трет-бутилдиметилсилилокси)-5-фенилпентан-3-ола (полученного в “Получении 28(2)”).
ИК (чистое): 2935, 1352, 1171 см-1.
1H ЯМР (СDСl3), δ: 0,03(3H, с), 0,06(3H, с), 0,86(9Н, с), 1,17 (3H, д, J=6,2 Гц), 1,80-2,20(2Н, м), 1, 60-2,90(2Н, м), 3,01(3H, с), 4,10(1Н, м), 4,53(1Н, м), 7,10-7,40(5Н, м).
Пример 1.
NaBH4 (491 мг) порциями добавляют к охлаждаемому льдом раствору этил-2-(4-карбамоил-1-имидазолил)-4-фенилбутирата (полученного в “Получении 2”) (391 мг) в метаноле (20 мл) в атмосфере азота. После завершения добавления реакционную смесь перемешивают в течение 30 минут при комнатной температуре. Добавляют воду и полученную смесь перемешивают в течение нескольких минут и затем выпаривают под пониженным давлением. Остаток распределяют между хлороформом и водой. Органический слой промывают насыщенным раствором соли, сушат над сульфатом натрия. Выпаривание растворителя под пониженным давлением дает 1-(1-гидрокси-4-фенил-2-бутил)имидазол-4-карбоксамид (347 мг) в виде белого твердого вещества.
Т.пл. 127,0-129,5°С.
ИК (KBr): 3500-2700, 1664 см-1.
1H ЯМР (ДМСО-d6), δ: 2,06(2Н, кв, J=7,6 Гц), 2,39(2Н, т, J=7,6 Гц), 3,63(2Н, т, J=5,5 Гц), 4,10(1Н, квин., J=6,4 Гц), 5,01(1Н, т, J=5,3 Гц), 7,04(1Н, шир.с), 7,10-7,33(6Н, м), 7,70(1Н, с), 7,75(1Н, с).
МАСС: 260 (М+Н)+.
Пример 2.
Следующее соединение было получено способом, подобным способу из примера 1.
(1) 1-(2-Гидрокси-1-фенилэтил)имидазол-4-карбоксамид получали из соединения, полученного в “Получении 4(1)”.
Т.пл. 147-149°С.
ИК (KBr): 3324, 3187, 1668 см-1.
1H ЯМР (СDСl3), δ: 4,26(2Н, д, J=5,4 Гц), 5,35(2Н, шир), 7,05(1Н, шир), 7,10-7,50(5Н, м), 7,64(1Н, с), 7,75(1Н, с).
МАСС: 232 (М+Н)+.
(2) 1-(1-Гидрокси-2-октил)имидазол-4-карбоксамид получали из соединения, полученного в “Получении 4(2)”.
Т.пл. 97,5-100,5°С.
ИК (KBr): 3324, 3178, 2927, 2857, 1662 см-1.
1H ЯМР (СDСl3), δ: 0,83(3H, т, J=6,5 Гц), 0, 90-1,35 (8Н, м), 1,60-1,80(2Н, м), 3,60(2Н, т, J=5,6 Гц), 4,09 (1Н, квин., J=6,5 Гц), 4,98(1Н, т, J=5,3 Гц), 7,00(1Н, с), 7,22(1Н, с), 7,67(2Н, с).
МАСС: 240 (М+Н)+.
(3) 1-(1-Гидрокси-2-пентил)имидазол-4-карбоксамид получали из соединения, полученного в “Получении 5”.
Т.пл. 160°С.
ИК (KBr): 3336, 3172, 1654 см-1.
1H ЯМР (ДМСО-d6), δ: 0,84(3H, т, J=7,2 Гц), 1,10(2Н, м), 1,70(2Н, кв, J=7,5 Гц), 3,61(2Н, т, J=5,4 Гц), 4,12(1Н, квин, J=6,5 Гц), 4,99(1Н, т, J=5,4 Гц), 7,01(1Н, с), 7,24 (1Н, с), 7,69(2Н, с).
МАСС: 198 (М+Н)+.
(4) 1-(1,4-Дигидрокси-2-бутил)имидазол-4-карбоксамид получали из соединения, полученного в “Получении 6”.
ИК (KBr): 3700-3100, 1670 см-1.
1H ЯМР (ДМСО-d6), δ: 1,86(2Н, м), 3,10-3,45(2Н, м), 3,62(2Н, т, J=5,5 Гц), 4,29(1Н, м), 4,60(1Н, т, J=5,0 Гц), 5,01 (1Н, т, J=5,3 Гц), 7,02(1Н, с), 7,25(1Н, с), 7,65(2Н, с), 7,68(1Н, с).
МАСС: 200 (М+Н)+.
(5) 1-[1-Гидрокси-4-(1-нафтил)-2-бутил]имидазол-4-карбоксамид получали из соединения, полученного в “Получении 17(1)”.
Т.пл. 138-140°С.
ИК (KBr): 3600-2800, 1660, 1598 см-1.
1H ЯМР (ДМСО-d6), δ: 2,17(2Н, т, J=7,7 Гц), 2,70-3,10(2Н, м), 3,68(2Н, т, J=5,4 Гц), 4,27(1Н, м), 5,04(1Н, т, J=5,3 Гц), 7,06(1Н, шир.с), 7,20-7,60(5Н, м), 7,75-8,00(5Н, м).
МАСС: 310 (М+Н)+.
(6) 1-[1-Гидрокси-4-(3-метилфенил)-2-бутил]имидазол-4-карбоксамид получали в виде белого твердого вещества из соединения, полученного в “Получении 17(2)”.
Т.пл. 115,5-117,5°С.
ИК (KBr): 3325, 3195, 3110, 2935, 2854, 1662, 1604 см-1.
1H ЯМР (ДМСО-d6), δ: 1,90-2,50(7Н, м), 3,62(2Н, м), 4,10(1Н, м), 5,01(1Н, шир), 6,85-7,40(6Н, м), 7,70(1Н, с), 7,74 (1Н, с).
МАСС: 274 (М+Н)+.
(7) 1-{1-Гидрокси-4-[3-(трифторметил)фенил]-2-бутил}имидазол-4-карбоксамид получали в виде белого твердого вещества из соединения, полученного в “Получении 17(3)”.
Т.пл.: 103-106°С.
ИК (KBr): 3332, 3195, 3143, 1670, 1335 см-1.
1H ЯМР (ДМСО-d6), δ: 2,11 (2Н, кв, J=8,0 Гц), 2,35-2,75 (2Н, м), 3,64(2Н, м), 4,13(1Н, м), 5,03(1Н, шир.с), 7,03(1Н, шир.с), 7,26(1Н, шир.с), 7,40-7,65(4Н, м), 7,71(1Н, с), 7,77 (1Н, с).
МАСС: 328 (М+Н)+.
(8) 1-[1-Гидрокси-4-(3-гидроксифенил)-2-бутил]имидазол-4-карбоксамид получали из соединения, полученного в “Получении 17 (4)”.
ИК (KBr): 3700-2800, 1658, 1600 см-1.
1H ЯМР (ДМСО-d6), δ: 1,90-2,50 (4Н, м), 3,62(2Н, м), 4,14 (1Н, м), 5,09(1Н, т, J=5,3 Гц), 6,45-6,65(3H, м), 6,95-7,60 (4Н, м), 7,74(1Н, с), 7,80(1Н, с), 9,37(1Н, с).
МАСС: 276 (М+Н)+.
Пример 3.
Следующие соединения были получены способом, подобным способу из “Получения 2”.
1-[(2S)-2-(Бензилокси)-5-фенил-3-пентил]имидазол-4-карбоксамид получали из соединения, полученного в “Получении 1”, и соединения, полученного в “Получении 10”.
ИК (чистое): 3700-2800, 1673, 1658 см-1.
1H ЯМР (СDСl3), δ: 0,98-1,08(3H, м), 2,10-2,75 (4Н, м), 3,60-4,00(2Н, м), 4,05-4,70(2Н, м), 5,39(1Н, шир.с), 6,90-7,10(3H, м), 7,15-7,45(9Н, м), 7,67(1Н, дд, J=6,1, 1,3 Гц).
МАСС: 364 (М+Н)+, 386 (M+Na)+.
(2) 1-[(2S)-2-(Бензилокси)-6-фенил-3-гексил]имидазол-4-карбоксамид получали из соединения, полученного в “Получении 1”, и соединения, полученного в “Получении 11(1)”.
ИК (чистое): 3500-2800, 1666, 1589, 1236, 1095 см-1.
1H ЯМР (СDСl3), δ: 0,98-1,08(3H, м), 1,30-2,20(4Н, м), 2,30-3,20(2Н, м), 3,50-4,10(2Н, м), 4,20-4,65(2Н, м), 5,37 (1Н, шир.с), 6,95(1Н, шир.с), 7,00-7,80(12Н, м).
МАСС: 378 (M+H)+.
(3) 1-[(2S)-2-(Бензилокси)-5-(1-нафтил)-3-пентил]имидазол-4-карбоксамид получали из соединения, полученного в “Получении 1”, и соединения, полученного в “Получении 11(2)”.
ИК (чистое): 3500-2800, 1666, 1594, 1236, 1097 см-1.
1H ЯМР (СDСl3), δ: 1,04(3H, д, J=6,2 Гц), 2,10-2,60(2Н, м), 2,70-3,15(2Н, м), 3,50-4,10(2Н, м), 4,20-4,65(2Н, м), 5,41(1Н, шир.с), 7,01(1Н, шир.с), 7,10-7,60(9Н, м), 7,65-7,95(5Н, м).
МАСС: 414 (М+Н)+.
(4) 1-[1-(трет-Бутилдиметилсилилокси)-4-(4-метилфенил)-2-бутил]имидазол-4-карбоксамид получали из соединения, полученного в “Получении 1”, и соединения, полученного в “Получении 21(1)”.
1H ЯМР (СDСl3), δ: -0,07(3H, с), -0,05(3H, с), 0,84(9Н, с), 1,95-2,25(2Н, м), 2,32(3H, с), 2,35-2,80(2Н, м), 3,65-4,10(3H, м), 5,40(1Н, шир.с), 6,90-7,15(5Н, м), 7,44(1Н, с), 7,64 (1Н, с).
МАСС: 388 (М+Н)+.
(5) 1-{1-(трет-Бутилдиметилсилилокси)-4-[3-(этоксикарбонил)фенил]-2-бутил}имидазол-4-карбоксамид получали из соединения, полученного в “Получении 1”, и соединения, полученного в “Получении 21(2)”.
ИК (чистое): 3700-3050, 2931, 2860, 1716, 1666, 1595, 1240, 1095 см-1.
1H ЯМР (СDСl3), δ: -0,06(3H, с), -0,04(3H, с), 0,83(9Н, с), 1,41(3H, т, J=7,1 Гц), 2,18(2Н, м), 2,40-2,80(2Н, м), 3,60-4,10(3H, м), 4,39(2Н, kb, J=7,1 Гц), 5,37(1Н, шир.с), 6,95(1Н, шир.с), 7,20-7,42(2Н, м), 7,45(1Н, с), 7,65(1Н, с), 7,75-7,95(2Н, м).
МАСС: 446(М+Н)+.
(6) 1-{1-(трет-Бутилдиметилсилилокси)-4-{3-[(метоксикарбонил) метил]фенил}-2-бутил}имидазол-4-карбоксамид получали из соединения, полученного в “Получении 1”, и соединения, полученного в “Получении 21(3)”.
ИК (чистое): 3800-3000, 2952, 2858, 1739, 1676, 1257, 1126 см-1.
1H ЯМР (СDСl3), δ: -0,07(3H, с), -0,04(3H, с), 0,83(9Н, с), 2,05-2,25(2Н, м), 2,30-2,75(2Н, м), 3,60(3H, с), 3,70-3,85(5Н, м), 3,98(1Н, м), 5,39(1Н, шир.с), 6,90-7,35(5Н, м), 7,46(1Н, с), 7,65(1Н, с).
МАСС: 446(M+H)+.
(7) 1-(1-Гидрокси-3-фенокси-2-пропил)имидазол-4-карбоксамид получали из соединения, полученного в “Получении 1”, и соединения, полученного в “Получении 24”.
Т.пл.: 147,5-149,5°С.
ИК (KBr): 3330, 3188, 1662, 1600, 1246 см-1.
1H ЯМР (ДМСО-d6), δ: 3,80-4,30(5Н, м), 5,53(1Н, д, J=4,1 Гц), 6,85-7,10(4Н, м), 7,20-7,40(3H, м), 7,63(2Н,с).
МАСС: 262 (М+Н)+.
(8) 1-[(2S,3R)-2(Бензилокси)-5-(2-метилфенил)-3-пентил]-имидазол-4-карбоксамид получали из соединения, полученного в “Получении 1”, и соединения, полученного в “Получении 11(3)”.
1H ЯМР (СDСl3), δ: 1,07(3H, д, J=6 Гц), 2,0-2,6(4Н, м), 2,18(3H, с), 3,6-3,8(1Н, м), 3,9-4,1(1Н, м), 4,38(1Н, д, J=11 Гц), 4,58(1Н, д, J=11 Гц), 5,39(1Н, с), 6,9-7,4 (10Н, м), 7,45(1Н, д, J=1 Гц), 7,67(1Н, д, J=1 Гц).
МАСС: 378 (М+Н)+.
(9) 1-[(2S,3R)-2-(Бензилокси)-5-(2-хлорфенил)-3-пентил]-имидазол-4-карбоксамид получали из соединения, полученного в “Получении I”, и соединения, полученного в “Получении 11(4)”.
1H ЯМР (СDСl3), δ: 1,08(3H, д, J=6 Гц), 2,0-2,5(2Н, м), 2,5-2,7(2Н, м), 3,6-3,7(1Н, м), 3,9-4,1(1Н, м), 4,38(1Н, д, J=12 Гц), 4,58(1Н, д, J=12 Гц), 5,37(1Н, с), 6,9-7,4 (10Н, м), 7,48(1Н, д, J=1 Гц), 7,67(1Н, д, J=1 Гц).
МАСС: 420 (M+Na)+.
(10) 1-[(2S,3R)-2-(Бензилокси)-5-(2-метоксифенил)-3-пентил]имидазол-4-карбоксамид получали из соединения, полученного в “Получении 1”, и соединения, полученного в “Получении 11(5)”.
1H ЯМР (СDСl3), δ: 1,04(3H, д, J=6 Гц), 2,0-2,6(4Н, м), 3,6-3,7(1Н, м), 3,80(3H, с), 3,9-4,1(1Н, м), 4,39(1Н, д, J=12 Гц), 4,57(1Н, д, J=12 Гц), 5,38(1Н, с), 6,8-7,4(10Н, м), 7,45(1Н, д, J=1 Гц), 7,69(1Н, д, J=1 Гц).
МАСС: 394 (M+H)+.
(11) 1-[(2S,3R)-2-(Бензилокси)-5-(2-гексилоксифенил)-3-пентил]имидазол-4-карбоксамид получали из соединения, полученного в “Получении 1”, и соединения, полученного в “Получении 11(6)”.
1H ЯМР (СDСl3), δ: 0,8-1,0(3H, м), 1,05(3H, д, J=6 Гц), 1,2-1,5(6Н, м), 1,6-1,9(2Н, м), 2,0-2,6(4Н, м), 3,6-3,7(1Н, м), 3,8-4,0(3H, м), 4,38(1Н, д, J=12 Гц), 4,56(1Н, д, J=12 Гц), 5,37(1Н, с), 6,8-7,4(10Н, м), 7,44(1Н,с), 7,67(1Н,с).
МАСС: 464 (М+Н)+.
(12) 1-[(2S,3R)-2-(Бензилокси)-5-(2,3-дихлорфенил)-3-пентил]имидазол-4-карбоксамид получали из соединения, полученного в “Получении 1”, и соединения, полученного в “Получении 11(7)”.
1H ЯМР (СDСl3), δ: 1,08(3H, д, J=6 Гц), 2,0-2,5(2Н, м), 2,5-2,7(2Н, м), 3,6-4,1(2Н, м), 4,38(1Н, д, J=12 Гц), 4,59 (1Н, д, J=12 Гц), 5,45(1Н, с), 6,9-7,4(9Н, м), 7,48(1Н, д, J=1 Гц), 7,67(1Н, д, J=1 Гц).
МАСС: 432(M+H)+.
(13) 1-[(2S,3R)-2-(Бензилокси)-5-(2-фенетилоксифенил)-3-пентил]имидазол-4-карбоксамид получали из соединения, полученного в “Получении 1”, и соединения, полученного в “Получении 11(8)”.
1H ЯМР (СDСl3), δ: 0,99(3H, д, J=6 Гц), 1,9-2, 6 (4Н, м), 3,06(2Н, т, J=7 Гц), 3,5-3,6 (1Н, м), 3,8-4,6(5Н, м), 5,34 (1Н, с), 6,7-7,0(3H, м), 7,1-7,4(13Н, м), 7,62(1Н, д, J=1 Гц).
МАСС: 484(M+H)+.
(14) 1-[(2S,3R)-2-(Бензилокси)-5-(2,3-диметилфенил)-3-пентил]имидазол-4-карбоксамид получали из соединения, полученного в “Получении 1”, и соединения, полученного в “Получении 11(9)”.
1H ЯМР (СDСl3), δ: 1,06(3H, д, J=6 Гц), 2,0-2,6(4Н, м), 2,09(3H, с), 2,26(3H, с), 3,6-3,7(1Н, м), 3,9-4,1(1Н, м), 4,38(1Н, д, J=12 Гц), 4,58(1Н, д, J=12 Гц), 5,39(1Н, с), 6,7-7,4(9Н, м), 7,46(1Н, д, J=1 Гц), 7,67(1Н, д, J=1 Гц).
МАСС: 392 (М+Н)+.
(15) 1-{(2S,3R)-2(Бензилокси)-5-[2(трифторметил)фенил]-3-пентил}имидазол-4-карбоксамид получали из соединения, полученного в “Получении 1”, и соединения, полученного в “Получении 28(1)”.
1H ЯМР (СDСl3), δ: 1,09(3H, д, J=6 Гц), 2,0-2,8(4Н, м), 3,6-3,8(1Н, м), 3,9-4,1(1Н, м), 4,39(1Н, д, J=12 Гц), 4,59 (1Н, д, J=12 Гц), 5,40(1Н, с), 6,9-7,7(12Н, м).
МАСС: 432 (M+H)+.
(16) 1-{(2S,3R)-2-(Бензилокси)-5-[2,3-(метилендиокси)фенил]-3-пентил}имидазол-4-карбоксамид получали из соединения, полученного в “Получении 1”, и соединения, полученного в “Получении 11(10)”.
1H ЯМР (СDСl3), δ: 1,06(3H, д, J=6 Гц), 2,0-2,6(4Н, м), 3,6-4,0(2Н, м), 4,38(1Н, д, J=12 Гц), 4,58(1Н, д, J=12 Гц), 5,38(1Н, с), 5,90(2Н, с), 6,4-6,8(3H, м), 6,96(1Н, с), 7,2-7,4(5Н, м), 7,43(1Н, д, J=1 Гц), 7,65(1Н, д, J=1 Гц).
МС: 408 (М+Н)+.
(17). 1-[(2S,3R)-2-(трет-Бутилдиметилсилилокси)-5-(2-бензилоксифенил)-3-пентил]имидазол-4-карбоксамид получали из соединения, полученного в “Получении 1”, и соединения, полученного в “Получении 28(3)”.
1H ЯМР (СDСl3), δ: -0,07(3H, с), -0,02(3H, c), 0,84(9Н, с), 0,93(3H, д, J=6 Гц), 1,8-2,8(4Н, м), 3,7-3,9(2Н, м), 5,07(2Н, с), 5,35(1Н, с), 6,8-7,4(11Н, м), 7,61(1Н, с).
МС: 494 (М+Н)+.
(18) 1-[(2S,3R)-2-(Бензилокси)-5-(2-нафтил)-3-пентил]-имидазол-4-карбоксамид получали из соединения, полученного в “Получении 1”, и соединения, полученного в “Получении 28(4)”.
ИК (чистое): 1662 см-1.
1H ЯМР (СDСl3), δ: 1,06(3H, д, J=6 Гц), 2,1-2,9(4Н, м), 3,6-3,8(1Н, м), 3,8-4,1(1Н, м), 4,37(1Н, д, J=12 Гц), 4,57 (1Н, д, J=12 Гц), 5,45(1Н, с), 7,0(1Н, с), 7,2-7,8(1Н, м).
МАСС: 414 (М+Н)+.
(19) 1-[(2S,3R)-2-(Бензилокси)-6-(1-нафтил)-3-гексил]-имидазол-4-карбоксамид получали из соединения, полученного в “Получении 1”, и соединения, полученного в “Получении 28(5)”.
ИК (чистое): 1658 см-1.
1H ЯМР (СDСl3), δ: 1,04(3H, д, J=6 Гц), 1,5-2,3(4Н, м), 2,9-3,2 (2Н, м), 3,5-3,7(1Н, м), 3,8-4,1(1Н, м), 4,37(1Н, д, J=12 Гц), 4,57(1Н, д, J=12 Гц), 5,51(1Н, с), 6,97(1Н, с), 7,1-8,0(14Н, м).
МАСС: 428 (M+H)+.
(20) Метил 1-[(2S,3R)-2-бензилокси-5-(1-нафтил)-3-пентил]-имидазол-4-карбоксилат получали из (2S,3S)-2-бензилокси-5-(1-нафтил)пентан-3-ола (полученного в “Получении 26”) и метил имидазол-4-карбоксилата.
ИК (чистое): 2945, 1726, 1672 см-1.
1H ЯМР (СDСl3), δ: 1,06(3H, д, J=6,2 Гц), 2,15-2,60(2Н, м), 2,75-3,10(2Н, м), 3,65(1Н, м), 3,91(3H, с), 3,96(1Н, м), 4,33(1Н, д, J=11,5 Гц), 4,55(1Н, д, J=11,5 Гц), 7,10-7,90 (14Н, м).
МАСС: (APCI, m/z): 429 (М+Н)+.
[α]
Пример 4.
Двадцатипроцентный гидроксид палладия на угле (30 мг) добавляют к перемешиваемому раствору 1-[(2S)-2-бензилокси-5-фенил-3-пентил]имидазол-4-карбоксамида (полученного в примере 3(1)) (107 мг) в циклогексане (5 мл) и этаноле (12,5 мл). Полученную смесь перемешивают при температуре кипения с обратным холодильником в течение 12 часов. После охлаждения до комнатной температуры смесь фильтруют через целит и нерастворенное вещество на фильтре промывают этанолом. Фильтрат и промывки объединяют и затем концентрируют под вакуумом. Полученный остаток очищают колоночной хроматографией на силикагеле (3 г) с элюированием хлороформом/метанолом (50:1) с получением 1-[(2S)-2-гидрокси-5-фенил-3-пентил]имидазол-4-карбоксамида (69,1 мг).
ИК (KBr): 3338, 2969, 1658 см-1.
1H ЯМР (ДМСО-d6), δ: 0,84-0,93(3H, м), 2,00-2,50(4Н, м), 3,70-4,00(2Н, м), 4,95-5,10(1Н, м), 6,95-7,40(7Н, м), 7,66 (1Н, д, J=2,2 Гц), 7,72(1Н, д, J=4,1 Гц).
МАСС: 274 (М+Н)+.
Пример 5.
Следующие соединения были получены таким же образом, что и в примере 4.
(1) 1-[(2S)-2-Гидрокси-6-фенил-3-гексил]имидазол-4-карбоксамид получали из соединения, полученного в примере 3(2).
ИК (KBr): 3700-2800, 1660, 1594 см-1.
1H ЯМР (ДМСО-d6), δ: 0,80-1,00(3H, м), 1,15-1,55(2Н, м), 1,60-2,05(2Н, м), 2,40-2,70(2Н, м), 3,70-4,10(2Н, м), 4,95-5,10(1Н, м), 6,90-7,35(7Н, м), 7,60-7,75(2Н, м).
МАСС: 288 (М+Н)+.
(2) (2S)-2-Гидрокси-5-(1-нафтил)-3-пентилимидазол-4-карбоксамид получали из соединения, полученного в примере 3(3).
Т.пл.: 95-98°С.
ИК (KBr): 3336, 1658, 1594 см-1.
1H ЯМР (ДМСО-d6), δ: 0,80-1,00(3H, м), 2,05-2,45(2Н, м), 2,60-3,15(2Н, м), 3,70-4,20(2Н, м), 5,05-5,15(1H, м), 7,07 (1Н, шир.с), 7,20-7,60(5Н, м), 7,70-8,00(5Н, м).
МАСС: 324 (М+Н)+.
Пример 6.
Триэтиламин (1,06 г) по каплям добавляют к перемешиваемой смеси (R)-1-(трет-бутилдиметилсилилокси)-4-фенилбутан-2-ола (полученного в “Получении 14”) (2,10 г) и метансульфонилхлорида (1,20 г) в дихлорметане (20 мл) при температуре ледяной бани. Через 1 час реакционную смесь распределяют между дихлорметаном и водой. Органический слой промывают насыщенным раствором соли и сушат над MgSO4 и концентрируют под вакуумом с получением метансульфоната (2,74 г) в виде масла. Это вещество используют для следующей реакции без дополнительной очистки.
NaH (60% в минеральном масле, 299 мг) добавляют к раствору метил-4-имидазолкарбоксилата (942 мг) в ДМФ (20 мл) при комнатной температуре. Реакционную смесь перемешивают в течение 30 минут. Добавляют метансульфонат, полученный выше, и полученную смесь перемешивают в течение 37 часов при 70°С.
Реакционную смесь охлаждают до 10°С на ледяной бане и нерастворившееся вещество отфильтровывают и тщательно промывают дихлорметаном. Фильтрат и промывную жидкость объединяют и затем промывают насыщенным раствором соли. Органический слой сушат над сульфатом натрия и концентрируют под вакуумом. Остаток очищают колоночной хроматографией на силикагеле (50 г) с элюированием толуолом/этилацетатом (20:1) с получением метил (S)-1-[1-(трет-бутилдиметилсилилокси)-4-фенил-2-бутил]имидазол-4-карбоксилата (1,52 г).
ИК (чистое): 2950, 2933, 2857, 1725, 1675, 1189, 1122 см-1.
1H ЯМР (СDСl3), δ: -0,06(3H, с), -0,05(3H, с), 0,84(9Н, с), 2,10-2,25(2Н, м), 2,35-2,75(2Н, м), 3,70-3,80(2Н, м), 3,91(3H, с), 4,00(1Н, м), 7,05-7,38(5Н, м), 7,51(1Н, с), 7,69(1Н, с).
МАСС: 359 (М+Н)+.
Пример 7.
Раствор 28% NaOMe в метаноле (772 мг) добавляют к охлаждаемому льдом раствору гидрохлорида аминогуанидина (332 мг) в метаноле (5 мл). Через 10 минут к смеси добавляют метил (3)-1-[1-(трет-бутилдиметилсилилокси)-4-фенил-2-бутил]-имидазол-4-карбоксилат (полученный в примере 6) (389 мг) в метаноле (2 мл) и полученную смесь перемешивают при температуре кипения с обратным холодильником в течение 22 часов. После охлаждения нерастворенное вещество удаляют и затем фильтрат выпаривают. Остаток разбавляют водой и раствор подкисляют до рН 4 6N НСl водн. Полученную смесь промывают СНСl3. Водный слой очищают HP-20 (50 см3) колоночной хроматографией с элюированием водой/2-пропанолом (9:1) и лиофилизируют с получением (S)-2-[4-(5-амино-1,2,4-триазол-3-ил)-1-имидазолил]-4-фенилбутан-1-ол (107 мг).
Т.пл.: 80°С (разложение).
ИК (KBr): 3700-2700, 1641, 1602, 1238, 1058 см-1.
1H ЯМР (ДМСО-d6), δ: 1,95-2,60 (4Н, м), 3,64(2Н, шир.с), 4,10(1Н, м), 5,02(1Н, шир.с), 5,40(2Н, шир), 7,10-7,35(6Н, м), 7,55(1Н, с), 7,70(1Н, с).
МАСС: 299 (М+Н)+.
Пример 8.
Раствор 28% NaOMe в метаноле (583 мг) добавляют к охлаждаемому льдом раствору гидрохлорида гуанидина (307 мг) в ДМФ (5 мл). Через 10 минут к смеси добавляют метил (3)-1-[1-(трет-бутилдиметилсилилокси)-4-фенил-2-бутил]имидазол-4-карбоксилат (полученный в примере 6) (250 мг) в ДМФ (2 мл) и полученную смесь перемешивают при 100°С в течение 5 часов. После охлаждения реакционную смесь выливают в воду (30 мл) и раствор промывают этилацетатом. Водный слой очищают HP-20 (40 см3) колоночной хроматографией с элюированием водой/2-пропанолом (9:1) и лиофилизируют с получением (S)-1-[1-гидрокси-4-фенил-2-бутил]имидазол-4-карбонилгуанидина (55,4 мг).
Т.пл.: 111-113°С.
ИК (KBr): 3700-2700, 1639, 1592, 1517, 1405 см-1.
1H ЯМР (ДМСО-d6), δ: 1,90-2,60 (4Н, м), 3,62(2Н, д, J=5,0 Гц), 4,07(1Н, м), 5,02(1Н, шир.с), 7,00-8,00(11H, м).
МАСС: 302 (М+Н)+.
Пример 9.
К охлаждаемому льдом раствору 1-[1-(трет-бутилдиметилсилилокси) -4-(4-метилфенил)-2-бутил]имидазол-4-карбоксамида (полученного в примере 3(4)) (194 мг, 0,50 ммоль) в ТГФ (5 мл) по каплям добавляют 1,0М Bu4NF в ТГФ (1,0 мл). После того, как добавление завершается, реакционную смесь перемешивают при температуре ледяной бани в течение 1 часа. Добавляют 25% AcONH4 (4 мл) и полученную смесь перемешивают в течение нескольких минут и затем экстрагируют хлороформом. Органический слой промывают насыщенным раствором соли, сушат (сульфат натрия) и концентрируют под вакуумом. Остаток очищают колоночной хроматографией на силикагеле (5 г) с элюированием хлороформом/этанолом (20:1) с получением 1-[1-гидрокси-4-(4-метилфенил)-2-бутил] имидазол-4-карбоксамида (44,9 мг, 32,9%) в виде белого твердого вещества.
Т.пл.: 138-141°С.
ИК (KBr): 3320, 3193, 2852, 1693, 1668, 1606 см-1.
1H ЯМР (ДМСО-d6), δ: 1,90-2,15(2Н, м), 2,20-2,50(5Н, м), 3,61(2Н, т, J=5,4 Гц), 4,08(1Н, м), 5,00(1Н, т, J=5,3 Гц), 6,90-7,15(5Н, м), 7,27(1Н, шир.с), 7,69(1Н, с), 7,74(1Н, с).
МАСС: 274 (М+Н)+.
Пример 10.
Следующие соединения получали по методике, подобной процедуре из примера 9.
(1) 1-{1-Гидрокси-4-[3-(этоксикарбонил)фенил]-2-бутил}-имидазол-4-карбоксамид получали из соединения, полученного в примере 3(5).
Т.пл.: 92-95°С.
ИК (KBr): 3322, 3193, 2954, 1720, 1662, 1604, 1278 см-1.
1H ЯМР (ДМСО-d6), δ: 1,32(3H, т, J=7,1 Гц), 2,00-2,20 (2Н, м), 2,35-2,55(2Н, м), 3,64(2Н, шир.), 4,31(2Н, кв, J= 7,1 Гц), 5,03(1Н, шир.с), 7,03(1Н, шир.с), 7,26(1Н, шир.с), 7,40-7,50(2Н, м), 7,65-7,85(4Н, м).
МАСС: 332 (М+Н)+.
(2) 1-{1-Гидрокси-4-[3-(метоксикарбонилметил)фенил]-2-бутил}имидазол-4-карбоксамид получали из соединения, полученного в примере 3(6).
Т.пл.: 138,5-141,0°С.
ИК (KBr): 3600-3000, 2951, 1738, 1651, 1583, 1267 см-1.
1H ЯМР (ДМСО-d6), δ: 1,90-2,20 (2Н, м), 2,20-2,50 (2Н, м), 3,50-3,75(7Н, м), 4,10(1Н, м), 5,01(1Н, т, J=5,3 Гц), 6,90-7,35(6Н, м), 7,70(1Н, с), 7,75(1Н, с).
МАСС: 332 (М+Н)+.
(3) 1-[(2S,3R)-2-Гидрокси-5-(2-бензилоксифенил)-3-пентил]имидазол-4-карбоксамид получали из соединения, полученного в примере 3(17).
1H ЯМР (СDСl3), δ: 1,02(3H, д, J=6 Гц), 1,9-2,8(5Н, м), 3,8-4,0(2Н, м), 5,07(2Н, с), 5,38(1Н, с), 6,8-7,4(11Н, м), 7,66(1Н, д, J=1 Гц).
МС: 380 (М+Н)+.
[α]
Пример 11.
К перемешиваемому раствору 1-{1-гидрокси-4-[3-(этоксикарбонил)фенил]-2-бутил}имидазол-4-карбоксамида (полученного в примере 10(1)) (60 мг, 0,18 ммоль) в формамиде (1,5 мл) добавляют метоксид натрия (39 мг, 0,72 ммоль) и реакционную смесь перемешивают при 110°С в течение 3 часов. После охлаждения реакционную смесь выливают в воду (5 мл). Остаток очищают HP-20 колоночной хроматографией (16 см3) с элюированием водой/2-пропанолом (9:1) и лиофилизируют с получением 1-[4-(3-карбамоилфенил)-1-гидрокси-2-бутил]имидазол-4-карбоксамида (39,2 мг, 71,6%) в виде аморфного твердого вещества.
ИК (KBr): 3700-2800, 1660, 1592, 1402 см-1.
1H ЯМР (ДМСО-d6), δ: 2,09(2Н, м), 2,30-2,65 (2Н, м), 3,64 (2Н, т, J=5,4 Гц), 4,14(1Н, м), 5,04(1Н, т, J=5,3 Гц), 7,05 (1Н, шир.с), 7,20-7,50(4Н, м), 7,65-7,85(4Н, м), 7,93(1Н, шир. с).
МАСС: 332 (М+Н)+.
Пример 12.
Следующие соединения были получены по методике, подобной процедуре из примера 1.
(1) 1-{1-Гидрокси-4-[3-(2-гидроксиэтил)фенил]-2-бутил}-имидазол-4-карбоксамид получали из соединения, полученного в примере 10(2).
ИК (KBr): 3700-3000, 2927, 2861, 1658, 1595, 1414, 1055 см-1.
1H ЯМР (ДМСО-d6), δ: 1,90-2,20(2Н, м), 2,20-2,50(2Н, м), 2,68(2Н, т, J=7,1 Гц), 3,50-3,70(4Н, м), 4,10(1Н, м), 4,61 (1Н, т, J=5,2 Гц), 5,01(1Н, т, J=5,4 Гц), 6,90-7,35(6Н, м), 7,70(1Н, с), 7,74(1Н, с).
МАСС: 304 (М+Н)+.
(2) 1-[1-Гидрокси-4-фенил-2-бутил]имидазол-4-карбонитрил получали из соединения, полученного в “Получении 23”.
Т.пл.: 111-115°С.
ИК (KBr): 3500-3000, 2943, 2867, 2237, 1078 см-1.
1H ЯМР (ДМСО-d6), δ: 1,95-2,60(4Н, м), 3,55-3,70(2Н, м), 4,18(1Н, м), 5,06(1Н, т, J=5,4 Гц), 7,05-7,35(5Н, м), 7,93 (1Н, с), 8,25(1Н, с).
МАСС: 242 (М+Н)+.
Пример 13.
Смесь метил (S)-1-[1-(трет-бутилдиметилсилилокси)-4-фенил-2-бутил]имидазол-4-карбоксилата (полученного в примере 6) (300 мг, 0,77 ммоль) и моногидрата гидразина (5 мл) в ДМФ (3 мл) перемешивают в течение 2 часов при 100°С.
После охлаждения реакционную смесь выливают в воду (10 мл) и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над сульфатом натрия и выпаривают под вакуумом. Остаток очищают колоночной хроматографией на силикагеле (10 г) с элюированием хлороформом/метанолом (100:1) с получением (S)-1-[1-(трет-бутилдиметилсилилокси)-4-фенил-2-бутил]имидазол-4-карбогидразида (274 мг, 91,5%).
ИК (чистое): 3700-3000, 2933, 2858, 1646, 1568, 1466, 1252, 1120 см-1.
1H ЯМР (СDСl3), δ: -0,07(3H, с), -0,05(3H, с), 0,83(9Н, с), 2,05-2,75(4Н, м), 3,65-4,10(5Н, м), 7,00-7,40(5Н, м), 7,43(1Н, с), 7,63(1Н, с).
МАСС: 389 (М+Н)+.
Пример 14.
Порошок NaOMe (417 мг, 7,72 ммоль) добавляют к охлаждаемому льдом раствору гидрохлорида гидроксиламина (536 мг, 7,72 ммоль) в метаноле (5 мл). Через 30 минут к смеси добавляют метил (S)-1-[1-(трет-бутилдиметилсилилокси)-4-фенил-2-бутил]имидазол-4-карбоксилат (полученный в примере 6) (389 мг, 1,0 ммоль) в метаноле (2 мл) и полученную смесь перемешивают при температуре кипения с обратным холодильником в течение 3 дней. После охлаждения нерастворенное вещество удаляют и затем фильтрат выпаривают. Остаток разбавляют водой и раствор подкисляют до рН 4 IN HCl водн. Полученную смесь промывают СНСl3. Водный слой очищают HP-20 (40 см3) колоночной хроматографией с элюированием водой/2-пропанолом (9:1) и лиофилизируют с получением (S)-1-[1-гидрокси-4-фенил-2-бутил]имидазол-4-карбогидроксамовой кислоты (92,5 мг, 43,5%) в виде аморфного твердого вещества.
ИК (чистое): 3700-2700, 1645, 1566, 1238, 1141 см-1.
1H ЯМР (ДМСО-d6), δ: 1,90-2, 60 (4Н, м), 3,63(2Н, м), 4,10 (1Н, м), 5,01(1Н, шир.), 7,05-7,40(5Н, м), 7,70(1Н, с), 7,76 (1Н, с), 8,72(1Н, шир.), 10,62(1Н, шир.с).
МАСС: 276 (М+Н)+.
Пример 15.
Порошок NaOMe (67,2 мг, 1,24 ммоль) добавляют к раствору гидрохлорида гидроксиламина (86,4 мг, 1,24 ммоль) в метаноле (2 мл) при комнатной температуре. Через 30 минут к смеси добавляют 1-(1-гидрокси-4-фенил-2-бутил)имидазол-4-карбонитрил (полученный в примере 12(2)) (100 мг, 0,41 ммоль) и полученную смесь перемешивают при температуре кипения с обратным холодильником в течение 2 часов. После охлаждения нерастворимое вещество удаляют и затем фильтрат выпаривают. Остаток очищают колоночной хроматографией на силикагеле (5 г) с элюированием хлороформом/метанолом (20:1) и концентрируют под вакуумом. Остаток растирают с изопропиловым эфиром с получением N-гидрокси-1-[1-гидрокси-4-фенил-2-бутил]имидазол-4-карбоксимидамида (86,3 мг, 76,0%) в виде аморфного твердого вещества.
ИК (KBr): 3700-2800, 1649, 1604, 1496 см-1.
1H ЯМР (ДМСО-d6), δ: 1,90-2, 60 (4Н, м), 3,62(2Н, т, J=4,9 Гц), 4,09(1Н, м), 5,04(1Н, т, J=5,2 Гц), 6,06(2Н, шир.с), 7,10-7,40(5Н, м), 7,58(1Н, с), 7,75(1Н, с), 9,41(1Н, шир.с).
МАСС: 275 (М+Н)+.
Пример 16.
Смесь 1-(1-гидрокси-4-фенил-2-бутил)имидазол-4-карбонитрила (полученного в примере 12(2)) (100 мг, 0,41 ммоль), хлорида аммония (111 мг, 2,07 ммоль) и азида натрия (135 мг, 2,07 ммоль) в ДМФ (4 мл) перемешивают при 100°С в течение 8 часов.
После охлаждения реакционную смесь выливают в воду (30 мл) и раствор промывают СНСl3. Водный слой очищают HP-20 (16 см3) колоночной хроматографией с элюированием водой/2-пропанолом (9:1) и лиофилизируют с получением 1-(1-гидрокси-4-фенил-2-бутил)-4-(5-тетразолил)имидазола (63,3 мг, 53,8%) в виде аморфного твердого вещества.
ИК (KBr): 3700-2700, 1651, 1612, 1496, 1458, 1250 см-1.
1H ЯМР (ДМСО-d6), δ: 1,95-2,60(4Н, м), 3,66(2Н, м), 4,09 (1Н, м), 5,03(1Н, шир.), 7,05-7,35(5Н, м), 7,55(1Н, с), 7,68 (1Н, с), 9,41(1Н, шир.с).
МАСС: 285 (М+Н)+.
Пример 17.
Суспензию имидазол-4-карбоксамида (полученного в “Получении 1”) (207 мг) в ДМФ (3 мл) обрабатывают гидридом натрия (60% в минеральном масле, 87 мг) при температуре ледяной бани и смесь перемешивают при комнатной температуре в течение 20 минут. Добавляют раствор (2S,3S)-2-бензилокси-5-(1-нафтил)-3-пентилметансульфоната (полученного в “Получении 27) (0,62 мг) в ДМФ (5 мл) и смесь перемешивают при 80°С в течение 48 часов. После охлаждения смесь фильтруют для удаления нерастворенного вещества. Фильтрат выливают в воду и экстрагируют этилацетатом. Экстракт промывают водой и насыщенным раствором соли, сушат и концентрируют под вакуумом. Флэш-хроматография (дихлорметан:метанол = 50:1) дает 1-[(2S,3R)-2-бензилокси-5-(1-нафтил)-3-пентил]имидазол-4-карбоксамид (221 мг, 34,4%) в виде масла.
ИК (чистое): 3458, 3332, 3184, 1666, 1593 см-1.
1H ЯМР (СDСl3), δ: 1,04(3H, д, J=6,3 Гц), 2,15-2,60(2Н, м), 2,80-3,10(2Н, м), 3,64(1Н, м), 3,98(1Н, м), 4,53(1Н, д, J=11,6 Гц), 4,55(1Н, д, J=11,6 Гц), 5,49(1Н, шир.с), 7,00 (1Н, шир.с), 7,15-7,90(14Н, м).
МАСС: (APCI, m/z): 414 (M+H)+.
[α]
Пример 18.
Следующие соединения получали по методике из примера 17.
(1) 1-[ (23,33)-2-Бензилокси-5-(1-нафтил)-3-пентил]имидазол-4-карбоксамид получали из (2S,3R)-2-бензилокси-5-(1-нафтил)-3-пентил)метансульфоната (полученного в “Получении 29(1)” (1,99 г) и имидазол-4-карбоксамида (0,67 г).
ИК (чистое): 3460, 3330, 3182, 1668, 1593 см-1.
1H ЯМР (СDСl3), δ: 1,03(3H, д, J=6,2 Гц), 2,15-2,55(2Н, м), 2,74-3,03(2Н, м), 3,66(1Н, м), 3,86(1Н, м), 4,26(1Н, д, J=11,6 Гц), 4,56(1Н, д, J=11,6 Гц), 5,52(1Н, шир.с), 7,02 (1Н, шир.с), 7,12-7,50 (10Н, м), 7, 71-7, 88 (4Н, м).
МАСС: (APCI, m/z): 414 (M+H)+.
[α]
(2) 1-[(2S,3R)-2-(трет-Бутилдиметилсилилокси)-5-фенил-3-пентил]имидазол-4-карбоксамид получали из (2S,3S)-4-(трет-бутилдиметилсилилокси)-5-фенил-3-пентилметансульфоната (полученного в “Получении 29(2)”) и имидазол-4-карбоксамида (полученного в “Получении 1”) по методике примера 17.
ИК (чистое): 3465, 3332, 3188, 2935, 1672, 1599 см-1.
1H ЯМР (СDСl3), δ: -0,24(3H, с), 0,10(3H, с), 0,88(9Н, с), 0,98(3H, д, J=6,1 Гц), 2,09(1Н, м), 2,20-2,45(2Н, м), 2,62(1Н, м), 3,77(1Н, м), 3,88(1Н, м), 5,47(1Н, шир.с), 6,98 (1H, шир.с), 7,06(2Н, д, J=6,4 Гц), 7,20-7,33(3H, м), 7,38 (1H, д, J=1,1 Гц), 7,62(1Н, д, J=1,1 Гц).
МС: (APCI, m/z): 388 (М+Н)+.
[a]
Пример 19.
Следующие соединения были получены по методике, подобной процедуре из примера 9.
(1) (S)-1-[1-Гидрокси-4-фенил-2-бутил]имидазол-4-карбогидразид получали в виде аморфного твердого вещества из соединения, полученного в примере 13.
1H ЯМР (ДМСО-d6), δ: 2,00-2,55(4Н, м), 3,63(2Н, т, J=5,2 Гц), 4,10(1Н, м), 4,33(2Н, шир.), 5,01(1Н, т, J=5,3 Гц), 7,10-7,35(5Н, м), 7,70(1Н, с), 7,77(1Н, с), 8,97(1Н, шир.с).
МАСС: 275 (М+Н)+.
(2) 1-[(2S,3R)-2-Гидрокси-5-фенил-3-пентил]имидазол-4-карбоксамид получали из соединения, полученного в примере 18(2).
ИК (KBr): 3336, 1658, 1593 см-1.
1H ЯМР (ДМСО-d6), δ: 0,87(3H, д, J=6,0 Гц), 2,00-2,40 (4Н, м), 3,75-3,95(2Н, м), 5,08(1Н, д, J=4,8 Гц), 7,07(1Н, шир.с), 7,10-7,30(6Н, м), 7,72(1Н, с), 7,74(1Н, с).
МС (APCI, m/z): 274 (М+Н)+.
[α]
Пример 20.
Смесь метил 1-[(2S,3R)-2-бензилокси-5-(1-нафтил)-3-пентил]имидазол-4-карбоксилата (полученного в примере 3(20)) (160 мг) в гидроксиде аммония (10 мл) и ДМФ (5 мл) нагревают при 100°С в течение 8 часов в запаянной пробирке и затем концентрируют под вакуумом. Флэш-хроматография (дихлорметан : метанол = 20:1) дает 1-[(2S,3R)-2-бензилокси-5-(1-нафтил)-3-пентил]имидазол-4-карбоксамид (144 мг, 93,3%) в виде масла.
Пример 21.
1-[(2S,3R)-2-Бензилокси-5-(1-нафтил)-3-пентил]имидазол-4-карбоксамид (полученный в примере 17 или 20) (5,07 г) растворяют в смеси этанола (300 мл) и циклогексана (150 мл) и затем добавляют гидроксид палладия (20% на угле, 5,0 г). Смесь нагревают при температуре кипения с обратным холодильником в течение 3 дней. После охлаждения катализатор отфильтровывают и промывают этанолом. Объединенные фильтрат и промывки концентрируют под вакуумом. Флэш-хроматография (дихлорметан : метанол = 10:1) дает 1-[(2S,3R)-2-гидрокси-5-(1-нафтил)-3-пентил]имидазол-4-карбоксамид (2,71 г, 68,4%) в виде пены.
ИК (KBr): 3334, 1666, 1593 см-1.
1H ЯМР (ДМСО-d6), δ: 0,88(3H, д, J=6,2 Гц), 2,10-2,40 (2Н, м), 2,60-2,95(2Н, м), 3,83(1Н, м), 4,05(1Н, м), 5,09(1Н, д, J=4,9 Гц), 7,10(1Н, шир.с), 7,25(1Н, д, J=6,3 Гц), 7,34(1Н, шир.с), 7,42(1Н, т, J=7,6 Гц), 7,49-7,54(2Н, м), 7,76-7,94 (5Н, м).
МАСС (APCI, m/z): 324 (М+Н)+.
[α]
Пример 22.
1-[(2S,3S)-2-Гидрокси-5-(1-нафтил)-3-пентил]имидазол-4-карбоксамид получали из соединения, полученного в примере 18(1), по методике, подобной процедуре из примера 21.
ИК (KBr): 3334, 1658, 1593 см-1.
1H ЯМР (ДМСО-d6), δ: 0,91(3H, д, J-6,3 Гц), 2,10-2,30 (2Н, м), 2,60-3,05(2Н, м), 3,95(1Н, м), 4,13(1Н, м), 5,05(1Н, д, J=4,1 Гц), 7,06(1Н, шир.с), 7,25-7,55(5Н, м), 7,75-7,95 (5Н, м).
МАСС (APCI, m/z): 324 (М+Н)+.
[α]
Пример 23.
Следующие соединения были получены по методике, подобной процедуре из примера 4.
(1) 1-[(2S,3R)-2-Гидрокси-5-(2-метилфенил)-3-пентил] имидазол-4-карбоксамид получали из соединения, полученного в примере 3(8).
Т.пл.: 60-62°С.
1H ЯМР (СDСl3), δ: 1,11(3H, д, J=6 Гц), 2,0-2,6(5Н, м), 2,20(3H, с), 3,8-4,1(2Н, м), 5,47(1Н, с), 6,9-7,2(5Н, м), 7,46(1Н, д, J=1 Гц), 7,73(1Н, д, J=1 Гц).
МАСС: 288 (M+H)+.
[α]
(2) 1-[(2S,3R)-2-Гидрокси-5-(метоксифенил)-3-пентил]имидазол-4-карбоксамид получали из соединения, полученного в примере 3(10).
1H ЯМР (СDСl3), δ: 1,09(3H, д, J=6 Гц), 2,0-2,7(5Н, м), 3,81(3H, с), 3,9-4,0(2Н, м), 5,40(1Н, с), 6,8-7,3(5Н, м), 7,46(1Н, д, J=1 Гц), 7,72(1Н, д, J=1 Гц).
МАСС: 304 (М+Н)+.
[α]
(3) 1-[(2S,3R)-2-Гидрокси-5-(2-гексилоксифенил)-3-пентил]-имидазол-4-карбоксамид получали из соединения, полученного в примере 3(11).
1H ЯМР (СDСl3), δ: 0,8-1,0(3H, м), 1,09(3H, д, J=6 Гц), 1,2-1,5(6Н, м), 1,7-1,9(3H, м), 2,0-2,7(4Н, м), 3,8-4,0(4Н, м), 5,35(1Н, с), 6,8-7,3(5Н, м), 7,45(1Н, с), 7,69(1Н, с).
МАСС: 374 (М+Н)+.
[α]
(4) 1-[(2S,3R)-2-Гидрокси-5-(2-гидроксифенил)-3-пентил]-имидазол-4-карбоксамид получали из соединения, полученного в примере 3(13).
1H ЯМР (ДМСО-d6), δ: 0,87(3H, д, J=6 Гц), 1,9-2,4 (4Н, м), 3,7-4,0(2Н, м), 5,05(1Н, д, J=5 Гц), 6,6-7,3(6Н, м), 7,71 (2Н, с), 9,29(1Н, с).
МАСС: 290 (М+Н)+.
(5) 1-[(2S,3R)-2-Гидрокси-5-(2,3-диметилфенил)-3-пентил]-имидазол-4-карбоксамид получали из соединения, полученного в примере 3(14).
1H ЯМР (СDСl3), δ: 1,10(3H, д, J=6 Гц), 2,0-2,6(5Н, м), 2,11(3H, с), 2,26(3H, с), 3,9-4,0(2Н, м), 5,43(1Н, с), 6,8-7,1(4Н, м), 7,47(1Н, д, J=1 Гц), 7,72(1Н, д, J=1 Гц).
МАСС: 302 (М+Н)+.
[α]
(6) 1-[(2S,3R)-2-Гидрокси-5-[2-(трифторметил)фенил]-3-пентил]имидазол-4-карбоксамид получали из соединения, полученного в примере 3(15).
1H ЯМР (СDСl3), δ: 1,13(3H, д, J=6 Гц), 2,0-2,4(3H, м), 2,5-2,8(2Н, м), 3,9-4,1(2Н, м), 5,42(1Н, с), 6,9-7,8(7Н, м).
МАСС: 342 (М+Н)+.
[α]
(7) Метил 1[(2S,3R)-2-гидрокси-5-(1-нафтил)-3-пентил]-имидазол-4-карбоксилат получали из соединения, полученного в примере 3(20).
ЯМР (СDСl3), δ: 1,09(3H, д, J=6 Гц), 1,9-2, 6 (3H, м), 2,8-3,2(2Н, м), 3,92(3H, с), 3,9-4,1(2Н, м), 7,1-7,9(9Н, м).
МАСС: 339 (М+Н)+.
(8) 1-{(2S,3R)-2-Гидрокси-5[2,3(метилендиокси)фенил]-3-пентил}имидазол-4-карбоксамид получали из соединения, полученного в примере 3(16).
1H ЯМР (СDСl3), δ: 1,11(3H, д, J=6 Гц), 2,1-2,7(5Н, м), 3,8-4,1(2Н, м), 5,44(1Н, с), 5,92(2Н, с), 6,5-6,8(3H, м), 6,99(1Н, с), 7,44(1Н, д, J=1 Гц), 7,70(1Н, д, J=1 Гц).
МС: 318 (М+Н)+.
[α]
(9) 1-[(2S,3R)-2-Гидрокси-5-(2-нафтил)-3-пентил]имидазол-4-карбоксамид получали из соединения, полученного в примере 3(18).
ИК (KBr): 3340, 1658 см-1.
1H ЯМР (СDСl3), δ: 1,10(3H, д, J=6 Гц), 2,1-2,4(3H, м), 2,4-2,7(1Н, м), 2,7-2,9(1Н, м), 3,8-4,1(2Н, м), 5,46(1Н, с), 7,00(1Н, с), 7,2-7,9(9Н, м).
МС: 324 (М+Н)+.
[α]
(10) 1-[(2S,3R)-2-Гидрокси-6-(1-нафтил)-3-гексил]имидазол-4-карбоксамид получали из соединения, полученного в примере 3(19).
ИК (KBr): 3340, 1658 см-1.
1H ЯМР (СDСl3), δ: 1,08(3H, д, J=6 Гц), 1,5-2,2 (5Н, м), 3,06(2Н, т, J=8 Гц), 3,8-4,0(2Н, м), 5,48(1Н, с), 6,98(1Н, с), 7,2-8,0(9Н, м).
МС: 338 (М+Н)+.
Пример 24.
Смесь 1-[(2S,3R)-2-(бензилокси)-5-(2-хлорфенил)-3-пентил]имидазол-4-карбоксамида (полученного в примере 3(9)) (40 мг) и йодтриметилсилана (0,02 мл) в хлороформе (1 мл) перемешивают при комнатной температуре в течение 2 часов. Смесь выливают в метанол и все выпаривают под вакуумом. Остаток собирают в этилацетат, промывают последовательно водой, водным раствором бисульфита натрия и бикарбоната натрия и сушат. Остаток, оставшийся после выпаривания растворителя, очищают колоночной хроматографией на силикагеле с элюированием смесью дихлорметана и метанола (20:1) с получением белого порошка из 1-[(2S,3R)-2-гидрокси-5-(2-хлорфенил)-3-пентил]имидазол-4-карбоксамида (6,1 мг).
1H ЯМР (СDСl3), δ: 1,12(3H, д, J=6 Гц), 1,9-2,4 (3H, м), 2,5-2,7(2Н, м), 3,9-4,1(2Н, м), 5,40(1Н, с), 6,9-7,4(5Н, м), 7,49(1Н, д, J=1 Гц), 7,72(1Н, д, J=1 Гц).
МАСС: 308 (M+H)+.
[α]
Пример 25.
1-[(2S,3R)-2-Гидрокси-5-(2,3-дихлорфенил)-3-пентил]имидазол-4-карбоксамид получали по методике, подобной процедуре из примера 24, из соединения, полученного в примере 3(12).
Т.пл.: 70-75°С.
1H ЯМР (СDСl3), δ: 1,13 (3H, д, J=6 Гц), 1,98(1Н, д, J=5 Гц), 2,1-2,4(2Н, м), 2,6-2,8(2Н, м), 3,9-4,1(2Н, м), 5,39 (1Н, с), 6,9-7,4(4Н, м), 7,49(1Н, д, J=1 Гц), 7,72(1Н, д, J=1 Гц).
МАСС: 342 (M+H)+.
[α]
Пример 26.
Метил 1-[(2S,3R)-2-(бензилокси)-5-(1-нафтил)-3-пентил]-имидазол-4-карбоксилат получали по методике, подобной процедуре из примера 6, из метил 4-имидазолкарбоксилата и соединения, полученного в “Получении 27”.
1H ЯМР (СDСl3), δ: 1,06(3H, д, J=6 Гц), 2,1-2,6(2Н, м), 2,7-3,1(2Н, м), 3,6-3,7(1Н, м), 3,97(3H, с), 3,9-4,1(1Н, м), 4,33(1Н, д, J=11 Гц), 4,56(1Н, д, J=11 Гц), 7,1-7,9(14Н, м).
МАСС: 429 (М+Н)+.
Пример 27.
Соль уксусной кислоты 1-[(2S,3R)-2-гидрокси-5-(1-нафтил)-3-пентил]имидазол-4-карбонилгуанидина получали по методике, подобной процедуре из примера 8, из соединения, полученного в примере 23(7).
1H ЯМР (ДМСО-d6), δ: 0,90(3H, д, J=6 Гц), 1,88(3H, с), 2,1-2,5(2Н, м), 2,6-3,0(2Н, м), 3,8-4,2(2Н, м), 5,15(1Н, шир.с), 7,2-8,0(9Н, м).
МАСС: 366 (М+Н)+.
[α]
Пример 28.
Смесь 1-[(2S,3R)-2-гидрокси-5-(2-гидроксифенил)-3-пентил]имидазол-4-карбоксамида (полученного в примере 23(4)) (4,1 мг), 1-бром-3-фенилпропана (7 мг) и карбоната калия (4 мг) в N,N-диметилформамиде (0,5 мл) перемешивают в течение ночи при комнатной температуре. Смесь собирают в этилацетат, дважды промывают водой, сушат и выпаривают. Остаток очищают колоночной хроматографией на силикагеле с элюированием смесью дихлорметана и метанола (20:1) с получением бесцветного смолистого масла 1-{(2S,3R)-2-гидрокси-5-[2-(3-фенилпропокси)-фенил]-3-пентил}имидазол-4-карбоксамида (4,9 мг).
1H ЯМР (СDСl3), δ: 1,08(3H, д, J=6 Гц), 2,0-2,9(9Н, м), 3,9-4,0(4Н, м), 5,39(1Н, с), 6,7-7,4(10Н, м), 7,45(1Н, с), 7,71(1Н, с).
МС: 408 (М+Н)+.
Пример 29.
Смесь метил 1-[(2S,3R)-2-гидрокси-5-(1-нафтил)-3-пентил]-имидазол-4-карбоксилата (полученного в примере 23(7)) (25 мг) и метиламина (40% в воде; 1 мл) в тетрагидрофуране (3 мл) нагревают в стальной герметически закрытой трубке при 120°С в течение ночи. Смесь собирают в дихлорметан, промывают водой, сушат и выпаривают. Остаток очищают колоночной хроматографией на силикагеле с элюированием смесью дихлорметана и метанола (30:1) с получением белого порошка N-метил-1-[(2S,3R)-2-гидрокси-5-(1-нафтил)-3-пентил]имидазол-4-карбоксамида (18,6 мг).
1H ЯМР (СDСl3), δ: 1,07(3H, д, J=6 Гц), 2,1-2,5(3H, м), 2,7-3,1(2Н, м), 3,01(3H, д, J=7 Гц), 3,8-4,0(2Н, м), 7,0-7,9 (10Н, м).
МС: 338 (М+Н)+.
[α]
Пример 30.
Смесь метил 1-[(2S,3R)-2-бензилокси-5-(1-нафтил)-3-пентил]имидазол-4-карбоксилата (полученного в примере 3(20)) (97 мг) и гидроксида натрия (12 мг) в этаноле (2 мл) и воде (0,2 мл) перемешивают при комнатной температуре в течение ночи. Растворитель выпаривают и остаток собирают в смесь этилацетата и воды. Водный слой отделяют, подкисляют до рН 3 соляной кислотой и экстрагируют этилацетатом. Экстракт сушат и выпаривают с получением бледно-коричневого порошка 1-[(2S,3R)-2-бензилокси-5-(1-нафтил)-3-пентил]имидазол-4-карбоновой кислоты (84,5 мг).
1H ЯМР (СDСl3), δ: 1,07(3H, д, J=6 Гц), 2,2-2,6(2Н, м), 2,8-3,2(2Н, м), 3,5-3,7(1Н, м), 3,9-4,1(1Н, м), 4,34(1Н, д, J=12 Гц), 4,55(1Н, д, J=12 Гц), 7,1-7,9(14Н, м).
МС: 415 (М+Н)+.
Пример 31.
Смесь 1-[(2S,3R)-2-бензилокси-5-(1-нафтил)-3-пентил]имидазол-4-карбоновой кислоты (полученной в примере 30) (55 мг), метансульфонамида (12,7 мг), 4-диметиламинопиридина (24,3 мг) и гидрохлорида 1-этил-3-(3’-диметиламинопропил)карбодиимида (51,2 мг) в N,N-диметилформамиде (2 мл) перемешивают при комнатной температуре в течение трех дней. Добавляют этилацетат и воду и все подкисляют до рН 3 соляной кислотой. Органический слой сушат и выпаривают. Остаток очищают колоночной хроматографией на силикагеле с элюированием смесью дихлорметана и метанола (20:1) с получением бледно-желтого смолистого масла N-метилсульфонил-1-[(2S,3R)-2-бензилокси-5-(1-нафтил)-3-пентил]имидазол-4-карбоксамида (18 мг).
1H ЯМР (СDСl3), δ: 1,05(3H, д, J=6 Гц), 2,2-2,5(2Н, м), 2,8-3,1(2Н, м), 3,40(3H, с), 3,6-3,7(1Н, м), 3,9-4,1(1Н, м), 4,2-4,6(2Н, м), 7,0-7,9(14Н, м).
МС: 490 (М-Н)+.
Пример 32.
N-Метилсульфонил-1-[(2S,3R)-2-гидрокси-5-(1-нафтил)-3-пентил]имидазол-4-карбоксамид получали из соединения, полученного в примере 31, по методике из примера 4.
1H ЯМР (CDCl3+CD3OD), δ: 0,97(3H, д, J=6 Гц), 2,0-2,3 (2Н, м), 2,7-3,1(2Н, м), 3,06(3H, с), 3,8-4,1(2Н, м), 7,1-7,9(9Н, м).
МС: 402 (М+Н)+.
Промышленное применение
Имидазольные соединения данного изобретения обладают ингибирующей АДА активностью и, таким образом, могут повышать концентрацию Ado. Так как Ado является эффективным в отношении иммуномодуляции, особенно иммуносупрессии, противовоспалительного действия и лечения и профилактики различных заболеваний, имидазольные соединения данного изобретения пригодны для лечения или профилактики заболеваний, в отношении которых эффективен Ado.
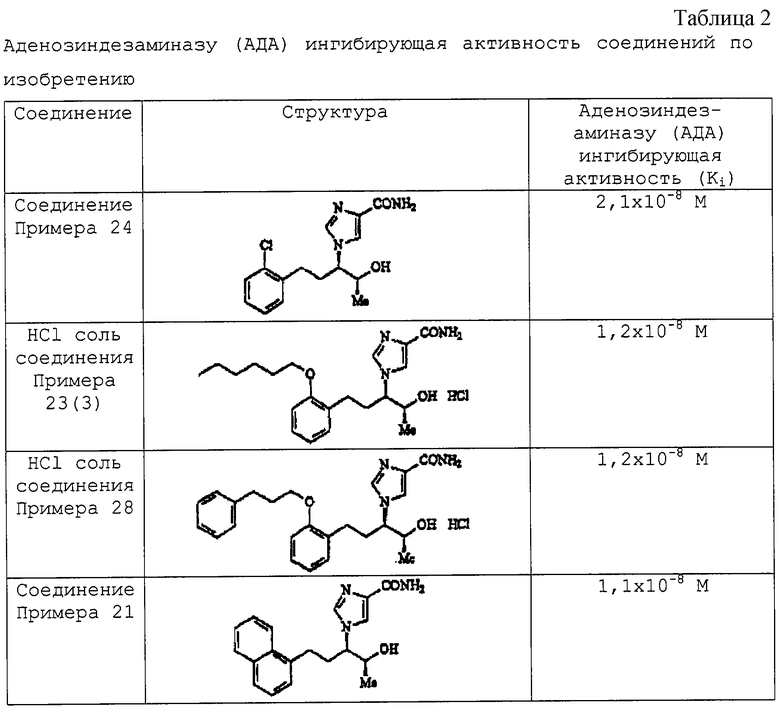
| название | год | авторы | номер документа |
|---|---|---|---|
| БЕНЗОПИРАНОВОЕ ПРОИЗВОДНОЕ И ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ЕГО ОСНОВЕ | 2000 |
|
RU2234502C2 |
| НОВЫЙ ИНГИБИТОР β-ЛАКТАМАЗЫ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2019 |
|
RU2800050C2 |
| НОВЫЙ ИНГИБИТОР бета-ЛАКТАМАЗЫ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2013 |
|
RU2693898C2 |
| СОЕДИНЕНИЯ N, N-ЗАМЕЩЕННОГО ЦИКЛИЧЕСКОГО АМИНА | 1999 |
|
RU2232156C2 |
| АЗОЛЬНЫЕ СОЕДИНЕНИЯ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ПРОТИВОГРИБКОВАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ ГРИБКОВОЙ ИНФЕКЦИИ | 1998 |
|
RU2189982C2 |
| ПРОИЗВОДНЫЕ ДИАМИНОВ | 2002 |
|
RU2319699C2 |
| ПРОИЗВОДНЫЕ ДИАМИНА | 2002 |
|
RU2314303C2 |
| СОЕДИНЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ПРЕДОТВРАЩЕНИЯ ГИБЕЛИ НЕРВНЫХ КЛЕТОК, СПОСОБ ПРОФИЛАКТИКИ | 2001 |
|
RU2230060C2 |
| ПРОИЗВОДНЫЕ АЗОТСОДЕРЖАЩИХ ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ И СПОСОБ ЛЕЧЕНИЯ РАССТРОЙСТВ, ХАРАКТЕРИЗУЮЩИХСЯ ПОРАЖЕНИЕМ НЕЙРОНОВ | 2000 |
|
RU2241709C2 |
| ПОЛИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ И СПОСОБЫ ЦЕЛЕНАПРАВЛЕННОЙ ДЕГРАДАЦИИ ПОЛИПЕПТИДОВ БЫСТРО УСКОРЕННОЙ ФИБРОСАРКОМЫ | 2019 |
|
RU2830173C2 |
Изобретение относится к новым имидазольным соединениям формулы I:
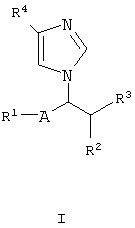
где R1 представляет водород, гидрокси, защищенный гидрокси или арил, необязательно замещенный подходящим(и) заместителем(ями), выбранными из группы, состоящей из галоген(низшего)алкила, галогена, гидрокси, защищенного карбокси, карбамоила, низшего алкилендиокси, низшего алкокси, необязательно замещенного арилом, и низшего алкила, необязательно замещенного гидрокси или защищенного карбокси; R2 представляет водород или низший алкил; R3 представляет гидрокси или защищенного гидрокси; R4 представляет циано, (гидрокси)иминоамино(низший)алкил, карбокси, защищенный карбокси, N-содержащую гетероциклическую группу, необязательно замещенную амино, или карбамоил, необязательно замещенный подходящим(ями) заместителем(ями), выбранными из группы, состоящей из амино, гидрокси, низшего алкила, низшего алкилсульфонила и аминоимино(низшего)алкила, необязательно замещенного гидрокси; и -А- представляет -Q- или -O-Q-, где Q является одинарной связью или низшим алкиленом, или его соль, при условии, что когда R2 является низшим алкилом, то R1 представляет гидрокси, защищенный гидрокси или арил, необязательно замещенный подходящим(и) заместителем(ями), указанными выше, и также при условии, что соединение формулы I не представляет собой 1-(гидроксиэтил)-4-(этоксикарбонил)имидазол или анилид 1-(2-гидроксиэтил)имидазол-4-карбоновой кислоты. Изобретение также относится к способу получения этих соединений, к способу ингибирования аденозиндезаминазы и к фармацевтической композиции, обладающей аденозиндезаминазу ингибирующей активностью, на основе этих соединений. Технический результат – получение новых соединений и лекарственных средств на их основе в целях профилактики и лечения заболеваний, в отношении которых эффективен аденозин. 3 с. и 6 з.п. ф-лы, 2 табл.
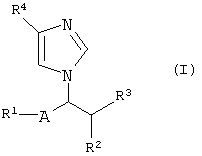
где R1 представляет водород, гидрокси, защищенный гидрокси или арил, необязательно замещенный подходящим(и) заместителем(ями), выбранными из группы, состоящей из галоген(низшего)алкила, галогена, гидрокси, защищенного карбокси, карбамоила, низшего алкилендиокси, низшего алкокси, необязательно замещенного арилом, и низшего алкила, необязательно замещенного гидрокси или защищенным карбокси;
R2 представляет водород или низший алкил;
R3 представляет гидрокси или защищенный гидрокси;
R4 представляет циано, (гидрокси)иминоамино(низший)алкил, карбокси, защищенный карбокси, N-содержащую гетероциклическую группу, необязательно замещенную амино, или карбамоил, необязательно замещенный подходящим(ями) заместителем(ями), выбранными из группы, состоящей из амино, гидрокси, низшего алкила, низшего алкилсульфонила и аминоимино(низшего)алкила, необязательно замещенного гидрокси;
-А- представляет -Q- или -O-Q-, где Q является одинарной связью или низшим алкиленом,
или его соль, при условии, что когда R2 является низшим алкилом, то R1 представляет гидрокси, защищенный гидрокси или арил, необязательно замещенный подходящим(и) заместителем(ями), указанными выше, и также при условии, что соединение формулы I не представляет собой 1-(гидроксиэтил)-4-(этоксикарбонил)имидазол или анилид 1-(2-гидроксиэтил)имидазол-4-карбоновой кислоты.
(1) 1-(1-гидрокси-4-фенил-2-бутил) имидазол-4-карбоксамида;
(2)1-[(2S)-2-гидрокси-5-фенил-3-пентил]имидазол-4-карбоксамида;
(3) 1-[(2S,3R)-2-гидрокси-5-(2-бензилоксифенил)-3-пентил]имидазол-4-карбоксамида;
(4) 1-[(2S,3R)-2-гидрокси-5-(1-нафтил)-3-пентил]имидазол-4-карбоксамида;
(5) 1-[(2S,3R)-2-гидрокси-5-(2-гексилоксифенил)-3-пентил]имидазол-4-карбоксамида;
(6) 1-[(2S,3R)-2-гидрокси-5-(2-нафтил)-3-пентил]имидазол-4-карбоксамида;
(7) 1-[(2S,3R)-2-гидрокси-5-(2-хлорфенил)-3-пентил]имидазол-4-карбоксамида;
(8) 1-[(2S,3R)-2-гидрокси-5-(2,3-дихлорфенил)-3-пентил]имидазол-4-карбоксамида;
(9) 1-[(2S, 3R)-2-гидрокси-5-(1-нафтил)-3-пентил]имидазол-4-карбонилгуанидина;
(10) 1-{(2S,3R)-2-гидрокси-5-[2-(3-фенилпропокси)фенил]-3-пентил}имидазол-4-карбоксамида.

где R4 имеет значения, указанные выше,
с соединением формулы (IV)
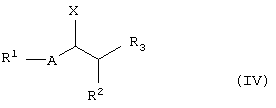
где R1, R2, R3 и А имеют указанные выше значения;
Х представляет собой гидрокси или удаляемую группу при условии, что R3 не является гидрокси.
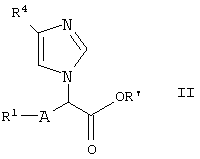
где R1 и R4 имеют значения, указанные выше;
R’ представляет собой защищающую гидроксил группу,
с восстанавливающим агентом.
Приоритет по пунктам и признакам:
| ПИОТРОВСКИЙ Л.Б | |||
| Журнал общей химии | |||
| Электрическое сопротивление для нагревательных приборов и нагревательный элемент для этих приборов | 1922 |
|
SU1997A1 |
| Приспособление для получения кинематографических стерео снимков | 1919 |
|
SU67A1 |
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Кипятильник (стерилизатор) для воды | 1925 |
|
SU855A1 |
| Chinese Medical Journal | |||
| Способ получения фтористых солей | 1914 |
|
SU1980A1 |
| Искусственный двухслойный мельничный жернов | 1921 |
|
SU217A1 |
| CRISTALLI G | |||
| et al | |||
| Journal of Medicinal Chemistry | |||
| Циркуль-угломер | 1920 |
|
SU1991A1 |
| Геликоптерный винт | 1921 |
|
SU1187A1 |
| VARGEESE С | |||
| et al | |||
| Journal of Medicinal Chemistry | |||
| Прибор для охлаждения жидкостей в зимнее время | 1921 |
|
SU1994A1 |
| Водоочистительный аппарат при кипятильнике | 1925 |
|
SU3844A1 |
| WO 9802166 A1, 22.01.1998 | |||
| US 5703084 A, 30.12.1997 | |||
| СПОСОБ ПОЛУЧЕНИЯ 9-ЗАМЕЩЕННЫХ ПРОИЗВОДНЫХ ГУАНИНА И 1-ЗАМЕЩЕННЫЕ 5-(ТИОКАРБАМОИЛ)АМИНО-1Н-ИМИДАЗОЛ-4-КАРБОКСАМИДЫ | 1991 |
|
RU2042668C1 |
Авторы
Даты
2004-12-27—Публикация
1999-07-22—Подача