Изобретение относится к медицине, а также к физиологии движений и электрофизиологии и может быть использовано для моделирования и обучения методам лечения и реабилитации людей с вертебро-спинальной патологией.
Нарушение проводимости спинного мозга вследствие травмы или заболевания спинного мозга приводит к частичной или полной обездвиженности таких больных, к нарушению функций практически всех органов, расположенных ниже места повреждения спинного мозга. Актуальность проблемы реабилитации спинальных больных обусловлена большой распространенностью позвоночно-спинномозговой травмы, высокими показателями летальности и инвалидизации, отсутствием общепринятых подходов к лечению и реабилитации данной категории пострадавших. Количество спинальных больных в индустриальных странах ежегодно увеличивается. Если в 50-е годы в СССР позвоночно-спинномозговые травмы составляли 0,2-0,3% общего числа случаев травм опорно-двигательного аппарата, а в 60-е годы их количество достигало 4,1%, то в 80-е годы - уже 67%. Стойкая утрата трудоспособности отмечается у 80-98% пациентов с позвоночно-спинномозговой травмой. После первичного устранения последствий травмы весь объем лечебных мероприятий направлен на предотвращение формирования рубцово-спаечного процесса в спинном мозге и в позвоночном канале, на борьбу с инфекционными осложнениями, на уменьшение боли с помощью накожной или прямой электростимуляции спинного мозга. Известно, что восстановление движений и чувствительности в течение первой недели после травмы свидетельствует о благоприятном прогнозе, а любая дисфункция, сохраняющаяся у больного более 6 месяцев, скорее всего, оказывается хронической. Специфическое лечение спинальных больных, нацеленное на восстановление движений, ходьбы, в настоящее время не известно.
В связи с тем, что проблема восстановления локомоции остается нерешенной, развитие учебных моделей для восстановления естественных шагательных движений у спинальных больных чрезвычайно актуально.
За ближайшие аналоги могут быть приняты «Способ лечения больных с хроническим поражением спинного мозга» (RU 2204423) и «Способ лечения больных с хроническим поражением спинного мозга» (RU 2000121379). В этих изобретениях электрическая стимуляция поясничного утолщения спинного мозга с помощью электродов, наложенных на твердую мозговую оболочку спинного мозга (dura mater), вызывает координированные локомоторные движения при облегченном положении больного, лежащего на спине или на боку с подвешенными на балканских рамах ногами. Отличие между этими изобретениями состоит в том, что в одном из них (RU 2000121379) предложен способ самостоятельной электростимуляции с помощью имплантированной на постоянной основе системы для хронической стимуляции. Однако известные способы электрической стимуляции спинного мозга вызывали только «элементы шагательных движений» без самостоятельной поддержки веса тела пациента.
Нами было установлено, что локомоторная активность, вызванная электрической эпидуральной стимуляцией спинного мозга, опосредуется серотонинергической системой спинного мозга [4]. В экспериментах на децеребрированных кошках показано, что шагательные движения, вызванные электрической эпидуральной стимуляцией поясничного утолщения спинного мозга, исчезали после введения антагонистов серотониновых рецепторов, а именно ципрогептадина и кетанзерина (антагонисты серотониновых рецепторов 5-НТ2 типа). Исследования подтвердили гипотезу о ведущей роли серотонинергической системы в регуляции локомоции, вызванной эпидуральной стимуляцией спинного мозга. В экспериментах на крысах с полной перерезкой спинного мозга было показано, что системное введение квипазина, неселективного агониста серотониновых рецепторов, качественно улучшает восстановление шагательных движений задних конечностей крыс, обусловленное локомоторными тренировками на тредбане, а также приводит к восстановлению опорных реакций задних конечностей, которые являются составным элементом реакции поддержки веса тела [5, 6]. На мышах и крысах было показано, что как введение квипазина (неселективный агонист рецепторов серотонина), так и вещества 8-OH-DPAT (агонист серотониновых рецепторов 5-НТ1А и 5НТ7 типов) способствует восстановлению локомоции у животных с полной перерезкой спинного мозга [7, 8].
Задача - стимуляция серотонинергической системы спинного мозга для вызова координированных шагательных движений и полная поддержка веса тела модели спинализированной крысы.
Сущность способа моделирования хронического поражении спинного мозга и обучения его лечению на мелких лабораторных животных состоит в полной перерезке спинного мозга крыс на нижнегрудном уровне (Th7) с последующей электрической стимуляцией двух сегментов спинного мозга (L2 и S1) с помощью электродов, расположенных на дорсальной поверхности этих сегментов, а также в введении квипазина и 8-OHDPAT. При этом задние конечности крысы опираются на ленту тредбана. Способ отличается тем, что интраперитонеально вводят квипазин (0.3 мг/кг), через 5 мин подкожно вводят 8-OHDPAT (0.1-0.3 мг/кг), через 10 мин после этого начинают одновременную электростимуляцию L2 и S1 сегментов спинного мозга. Стимулируют одновременно, прямоугольными импульсами с длительностью 0.2 мс, частотой 40-50 Гц, с интенсивностью 1-4 B. Комплексное воздействие начинают с 7-ого дня после перезки, проводят ежедневно курсом 7 дней.
Особенность заявляемого способа воздействия на спинной мозг состоит в введении агонистов рецепторов серотонина с одновременной стимуляцией L2 и S1 сегментов спинного мозга с помощью вживленных в них электродов. В экспериментах на взрослых крысах, хронически спинализированных на нижнегрудном уровне (Th7), исследовали эффекты сочетанного введения квипазина и 8-OH-DPAT в сочетании с одновременной электрической эпидуральной стимуляцией двух сегментов спинного мозга для инициации локомоторного поведения. Через одну неделю после перерезки спинного мозга у крыс при введении квипазина (0.3 мг/кг, интраперитонеально) и 8-OHDPAT (0.1-0.3 мг/кг, подкожно) в ответ на движение ленты тредбана возникали кратковременные периоды нерегулярных движений задних конечностей с незначительной поддержкой веса тела. Для облегчения вызванной локомоции после введения препаратов синхронно стимулировали поясничный L2 и крестцовый S1 сегменты спинного мозга через предварительно вживленные на дорсальную поверхность спинного мозга электроды. Комплекс фармакологического и электрического воздействия на спинной мозг вызывала хорошо координированные шагательные движения задних конечностей с полной поддержкой веса тела в ответ на движение ленты тредбана. Эффект от воздействия был зарегистрирован через 1 неделю после полной перерезки спинного мозга без предварительной активации спинного мозга. Ежедневные тренировки спинальных крыс, состоящие в том, что крысам вводили квипазин и 8-OHDPAT, затем начинали электрическую стимуляцию спинного мозга в сочетании с локомоторной тренировкой на тредбане, начатые на 7-ой день после перерезки спинного мозга, приводили к тому, что на 14-ый день после перерезки спинного мозга функция поддержки веса тела у крыс восстанавливалось на 100%.
Указанная совокупность существенных признаков заявляемого способа обеспечивает через 1 неделю после перерезки спинного мозга одновременное вовлечение в активность системы генерации шагательного ритма и системы регуляции мышечного тонуса, обеспечивает полноценную ходьбу при отсутствии супраспинальных влияний. При таком комплексном воздействии появляется необходимый тонус мышц задних конечностей и возникает шагательный ритм, в результате чего животное осуществляет координированные шагательные движения с самостоятельной поддержкой веса тела. Этот результат открывает хорошую перспективу использования фармакологической стимуляции серотонинергической системы спинного мозга в сочетании с электрической многоканальной стимуляцией нижних отделов спинного мозга для восстановления ходьбы и обеспечения постурального контроля у спинальных больных.
Пример. Модель выполнена на взрослых самках крыс линии Sprague-Dawley (250-300 г). Все манипуляции с животными осуществлялись в соответствии с законом «О защите животных от жестокого обращения» гл. IV, ст.10, 4679/11 ГК от 01.12.1999. Перерезку спинного мозга на нижнегрудном уровне Т7 проводили по стандартной методике в соответствии с международными стандартами, под глубоким наркозом [9]. Эпидуральные электроды, представляющие собой многожильный провод в тефлоновой изоляции (AS632; Cooner Wire, Chatsworth, CA), имплантировали на заднюю поверхность спинного мозга, по средней линии, в области L2 и S1 сегментов. С поверхности провода удаляли на протяжении 1 мм изоляцию в месте контакта провода с dura mater, подшивали к dura mater. Другой конец каждого провода соединяли с разъемом, жестко фиксируемым на черепе крысы. Общую «землю», такой же многожильный провод в тефлоновой изоляции с зачищенным на протяжении 1 см кончиком, помещали подкожно по средней линии спины. Биполярные электроды для регистрации электромиографического сигнала, сделанные из такого же провода, имплантировали унилатерально в m.vastus lateralis, m.semitendinosus, m.medial gastrocnemius и m.tibialis anterior. Концы всех электродов выводили на разъем, зафиксированный на черепе крысы.
Фармакологическую и электрическую стимуляцию спинного мозга проводили через 7 дней после полной перерезки спинного мозга. Крыс помещали в устройство фиксации так, чтобы задние конечности опирались на ленту тредбана. Производили компьютерную регистрацию отводимой электромиографической активности, шагательные движения записывали на видеокамеру. Степень внешней поддержки веса тела контролировали автоматическим устройством, управляемым с компьютера. Первоначально обеспечивали 100% поддержки веса тела (животные только касались задними конечностями ленты тредбана).
Квипазин (Sigma-Aldrich, Q1004) вводили интраперитонеально, 0.3 мг/кг. Через 5 минут после квипазина водили 8-OHDPAT (Sigma-Aldrich, Н-141), подкожно, 0.1-0.3 мг/кг. Электрическую стимуляцию проводили через 10 минут после введения последнего препарата, с помощью стимулятора Grass S88 (Grass Instruments). L2 и S1 сегменты спинного мозга стимулировали одновременно, прямоугольными импульсами (длительность 0.2 мс), с частотой 40-50 Гц, с интенсивностью 1-4 B.
Начиная с 7-ого дня после перерезки спинного мозга проводили ежедневные тренировки спинальных крыс. Тренировка состояла в следующем, после введения квипазина и 8-OHDPAT начинали электрическую стимуляцию спинного мозга в сочетании с контактом задних конечностей с движущейся лентой тредбана. Тренировки проводили ежедневно в течение 7 дней, по 30 минут.
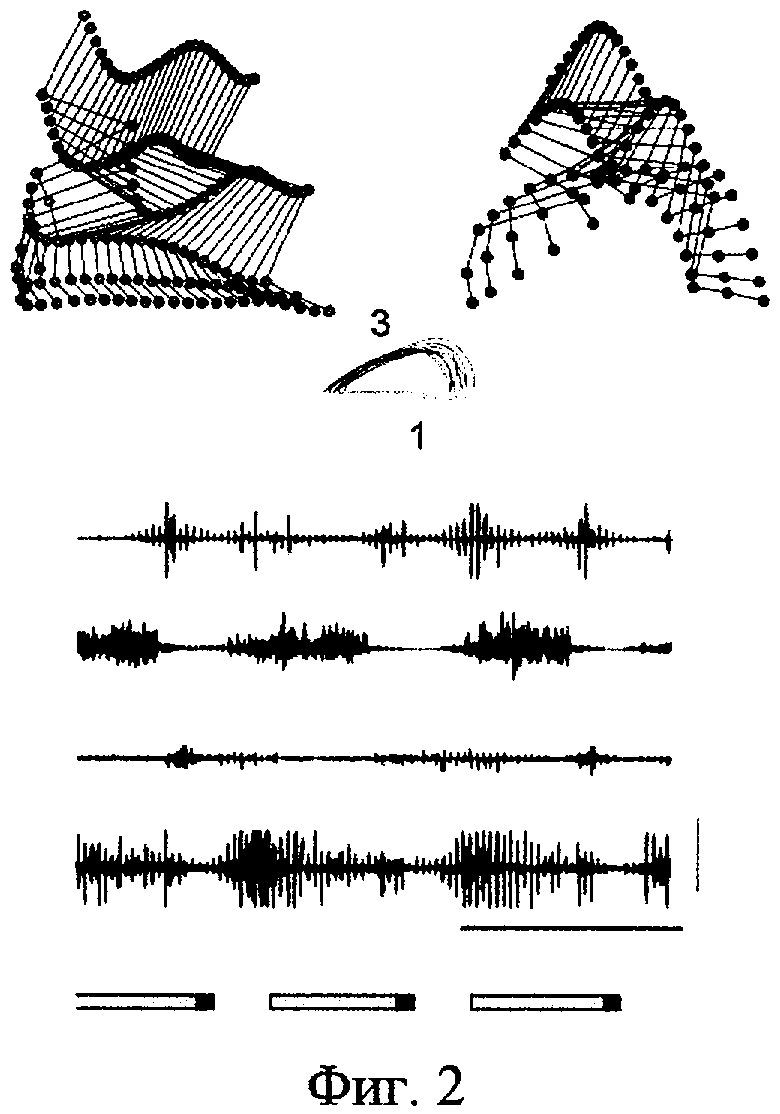
Эффект электрической стимуляции L2 и S1 сегментов спинного мозга крыс через 7 дней после полной перерезки спинного мозга на уровне Т7 представлен на фиг.1. Верхний ряд - реконструкция движений суставов задней конечности по видеозаписи, временные срезы. Средний ряд -реконструкция траектории движений стопы, демонстрирует положение стопы во время фазы опоры (1), волочения (2) и фазы переноса (3). Нижний ряд - суммарные интегрированные электромиографические записи четырех мышц задней конечности: VL - m.vastus lateralis; ST - m.semitentinosus; MG - m.medial gastrocnemius; ТА - m.tibialis anterior. Вертикальная отметка на записи электромиографической активности соответствует 2 мВ, горизонтальная - 1 сек. Внизу показана продолжительность шагательного цикла с фазой опоры и фазой переноса.
Эффект фармакологического воздействия на спинной мозг с последующей электрической стимуляцией L2 и S1 сегментов спинного мозга крыс через 7 дней после полной перерезки спинного мозга на уровне Т7 представлен на фиг.2. Обозначения те же, что и на предыдущем рисунке. Введение агонистов серотонинергической системы, сочетанное с электрической стимуляцией спинного мозга L2 и S1 сегментов спинного мозга, через 1 неделю после перерезки спинного мозга приводило к восстановлению координированных шагательных движений с хорошо выраженной фазой опоры и переноса, прекращению волочения стопы по ленте тредбана. Это связано с восстановлением функции поддержки веса тела. На электромиографической записи видна чередующаяся пачечная активность мышц агонистов и антагонистов, характерная для нормально организованного акта шагания.
Введение квипазина и 8-OHDPAT и электрическая стимуляция спинного мозга, начатые на 7-ой день после перерезки спинного мозга, приводили к тому, что на 14-ый день после перерезки спинного мозга функция поддержки веса тела у крыс восстанавливалось на 100%.
Способ воздействия на спинной мозг позволяет вызывать координированные шагательные движения задних конечностей с самостоятельной поддержкой веса тела у животных с полным перерывом спинного мозга через 1 неделю после перерыва спинного мозга. Назначение - в физиологии движений для изучения управления локомоторным поведением, а также для разработки и освоения методов лечения и реабилитации людей с вертеброспинальной патологией.
ЛИТЕРАТУРА
1. Способ лечения больных с хроническим поражением спинного мозга. Патент RU 22204423.
2. Способ лечения больных с хроническим поражением спинного мозга. Патент RU 2000121379.
3. Gerasimenko Y. et al. Propriospinal by-pass of the serotonergic system that can facilitate stepping. J. Neuroscience. In press.
4. Ichiyama M.R. et al, Dose dependence of the 5-HT agonist quipazine in facilitating spinal stepping in the rat with epidural stimulation. Neurosc. Lett. 438(2008) 281-285.
5. Гилерович Е.Г. и др. Экспериментальное исследование поврежденного спинного мозга крыс после активации рецепторов серотонина. ДАН. В печати.
6. Landry, E.S., et al. Contribution of spinal 5-HT1A and 5-HT7 receptors to locomotor-like movement induced by 8-OH-DPAT in spinal cord-transected mice. Eur. J. Neurosci. 24, 535-546 (2006).
7. Antri, M., et al. 5-HT1A receptors are involved in short - and long-term processes responsible for 5-HT-induced locomotor function recovery in chronic spinal rat. Eur. J. Neurosci. 18, 1963-1972 (2003).
8. Мошонкина T.P. и др. Морфофункциональные основы восстановления локомоторных движений у крыс с полной перерезкой спинного мозга. БЭБМ. 2004. №8. С.225-229.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ МОДЕЛИРОВАНИЯ И ОБУЧЕНИЯ ЛЕЧЕНИЮ БОЛЬНЫХ С ХРОНИЧЕСКИМ ПОРАЖЕНИЕМ СПИННОГО МОЗГА | 2008 |
|
RU2418319C2 |
| СПОСОБ МОДЕЛИРОВАНИЯ ЛЕЧЕНИЯ БОЛЬНЫХ С ХРОНИЧЕСКИМ ПОРАЖЕНИЕМ СПИННОГО МОЗГА НА ЛАБОРАТОРНЫХ ЖИВОТНЫХ | 2011 |
|
RU2466756C1 |
| Способ моделирования лечения больных с двигательными и висцеральными расстройствами на лабораторных животных. | 2020 |
|
RU2749634C1 |
| СПОСОБ ЛЕЧЕНИЯ ХРОНИЧЕСКОГО ПОРАЖЕНИЯ СПИННОГО МОЗГА В ЭКСПЕРИМЕНТЕ | 2008 |
|
RU2392016C2 |
| СПОСОБ ЛЕЧЕНИЯ БОЛЬНЫХ С ХРОНИЧЕСКИМ ПОРАЖЕНИЕМ СПИННОГО МОЗГА | 2000 |
|
RU2204423C2 |
| Способ лечения травматического повреждения спинного мозга | 2021 |
|
RU2758760C1 |
| СПОСОБ ИССЛЕДОВАНИЯ ПОДДЕРЖАНИЯ РАВНОВЕСИЯ У ДЕЦЕРЕБРИРОВАННЫХ ЛАБОРАТОРНЫХ ЖИВОТНЫХ | 2009 |
|
RU2393761C1 |
| СПОСОБ ЛЕЧЕНИЯ БОЛЬНЫХ С ПОРАЖЕНИЕМ СПИННОГО МОЗГА | 1996 |
|
RU2130326C1 |
| СПОСОБ НАКОЖНОЙ ЭЛЕКТРОСТИМУЛЯЦИИ СПИННОГО МОЗГА | 2012 |
|
RU2529471C2 |
| СПОСОБ ВЫЗОВА ЛОКОМОЦИИ У БОЛЬНЫХ С ПОРАЖЕНИЕМ СПИННОГО МОЗГА | 1997 |
|
RU2142737C1 |
Изобретение относится к медицине, а именно к физиологии движений и электрофизиологии. Осуществляют полную перерезку мозга крыс на нижнегрудном уровне Th7. Затем проводят электростимуляцию электродами, размещенными на дорсальной поверхности спинного мозга на сегментах L2 и S1, а также введение квипазина и 8-OHDPAT. Задние конечности животного опираются на ленту тредбана. При этом квипазин вводят интраперитонеально, 0.3 мг/кг, 8-OHDPAT вводят через 5 мин, подкожно, 0.1-0.3 мг/кг, электростимуляцию начинают через 10 мин. Сегменты спинного мозга L2 и S1 стимулируют одновременно, прямоугольными импульсами с длительностью 0.2 мс, частотой 40-50 Гц, с интенсивностью 1-4 В. Комплексное воздействие начинают с 7-ого дня после перезки и проводят ежедневно, курсом 7 дней. Способ позволяет вызвать координированные шагательные движения. 2 ил.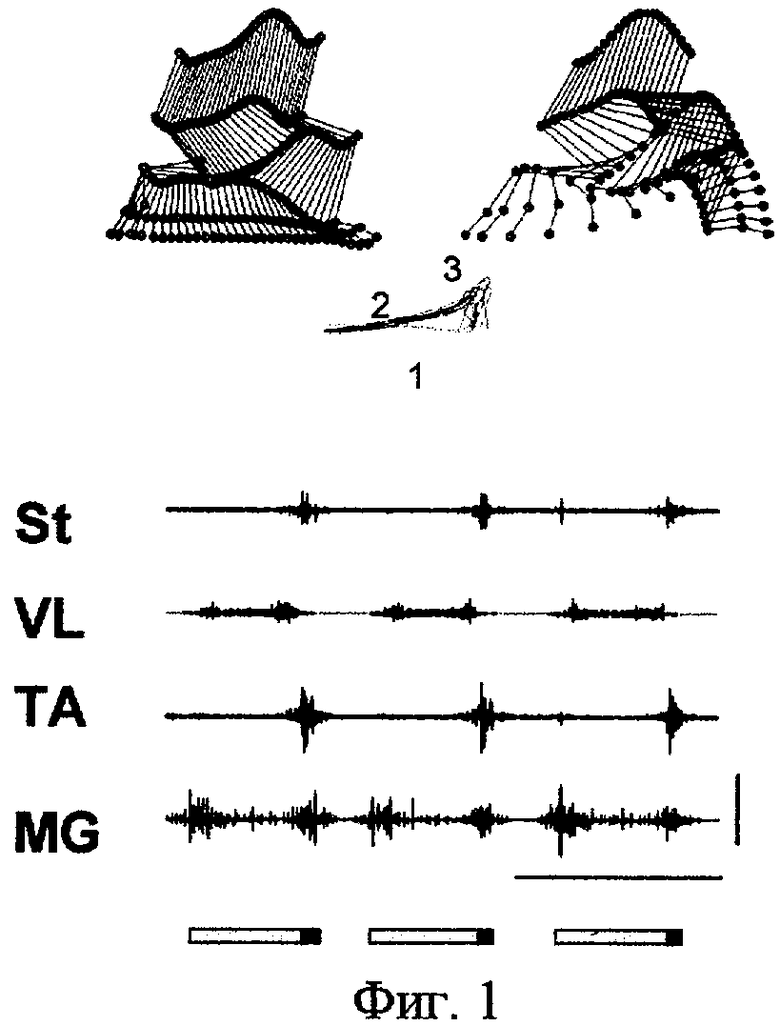
Способ моделирования хронического поражения спинного мозга и обучение его лечению на мелких лабораторных животных, включающий полную перерезку мозга крыс на нижнегрудном уровне Th7, последующую электростимуляцию электродами, размещенными на дорсальной поверхности спинного мозга на сегментах L2 и S1, а также введение квипазина и 8-OHDPAT, при этом задние конечности опираются на ленту тредбана, отличающийся тем, что
вводят квипазин интраперитонеально 0,3 мг/кг,
вводят 8-OHDPAT через 5 мин подкожно 0,1-0,3 мг/кг,
электростимуляцию начинают через 10 мин после этого - сегменты спинного мозга L2 и S1 стимулируют одновременно, прямоугольными импульсами с длительностью 0,2 мс, частотой 40-50 Гц, с интенсивностью 1-4 В,
комплексно воздействуют, начиная с 7-ого дня после перерезки, ежедневно, курсом 7 дней.
| СПОСОБ ЛЕЧЕНИЯ БОЛЬНЫХ С ХРОНИЧЕСКИМ ПОРАЖЕНИЕМ СПИННОГО МОЗГА | 2000 |
|
RU2204423C2 |
| СПОСОБ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ ПОВРЕЖДЕНИЙ СПИННОГО МОЗГА ПРИ ПОЗВОНОЧНО-СПИННОМОЗГОВОЙ ТРАВМЕ | 2005 |
|
RU2291722C1 |
| СОЕДИНИТЕЛЬНЫЙ ЭЛЕМЕНТ КОЧЕТОВА ДЛЯ БЛОКОВ СЕЙСМОСТОЙКОГО СООРУЖЕНИЯ | 2016 |
|
RU2611645C1 |
| Справочник Нейротравматология | |||
| / Под ред | |||
| Коновалова | |||
| - М.: Институт нейрохирургии РАМН, ИПЦ Вазарферрщ, 1994, с.243-244 | |||
| KUH S.U et al | |||
| Functional recovery after human umbilical cord blood cells transplantation with brain-derived neutrophic factor into the spinal cord injured rat | |||
| Acta Neurochir (Wien) | |||
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
Авторы
Даты
2011-02-10—Публикация
2009-06-30—Подача