Настоящее изобретение относится к новым производным 1,1-диоксотриморфолинилиндолилметанона, их получению, содержащим их фармацевтическим композициям и их применению в качестве лекарственных средств. Активные соединения по настоящему изобретению применяются при лечении ожирения и других заболеваний.
В частности, настоящее изобретение относится к соединениям общей формулы
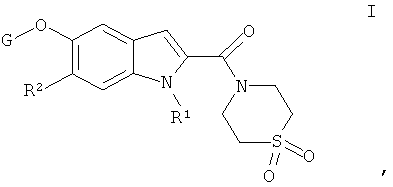
где
R1 выбирают из группы, включающей водород, низший алкил, низший гидроксиалкил, низший алкоксиалкил, низший галогеналкил, низший циклоалкилалкил, низший алканоил, низший алкоксикарбонил, низший цианоалкил, низший алкилсульфонил,
фенилсульфонил, где фенильное кольцо может быть незамещенным или замещенным одной или двумя группами, независимо выбранными из низшего алкила, галогена, цианогруппы, низшего галогеналкила, низшей алкоксигруппы, низшей галогеналкоксигруппы и низшего гидроксиалкила;
фенил, незамещенный или замещенный одной или двумя группами, независимо выбранными из низшего алкила, галогена, цианогруппы, низшего галогеналкила, низшей алкоксигруппы, низшей галогеналкоксигруппы и низшего гидроксиалкила;
низший фенилалкил, где фенильное кольцо может быть незамещенным или замещенным одной или двумя группами, независимо выбранными из низшего алкила, галогена, цианогруппы, низшего галогеналкила, низшей алкоксигруппы, низшей галогеналкоксигруппы и низшего гидроксиалкила; и
гетероарил, незамещенный или замещенный одной или двумя группами, независимо выбранными из низшего алкила, низшей алкоксигруппы, галогена, низшего галогеналкила, низшей галогеналкоксигруппы и цианогруппы;
R2 обозначает водород или галоген;
G обозначает группу, выбранную из

где
m обозначает 0, 1 или 2;
R3 выбирают из низшего алкила, низшего галогеналкила, циклоалкила, галогенциклоалкила, низшего циклоалкилалкила и низшего фенилалкила;
n обозначает 0, 1 или 2;
R4 обозначает низший алкил;
Р обозначает 0, 1 или 2;
Q обозначает 0, 1 или 2;
А выбирают из CR10R10', О и S;
R5, R5', R6, R6', R7, R7', R10 и R10' независимо друг от друга выбрают из группы, включающей водород, низший алкил, гидроксигруппу, галоген и диалкиламиногруппу,или
R6 и R10 вместе образуют двойную связь;
R8 обозначает низший алкил;
R9 обозначает С3-С6алкил;
и их фармацевтически приемлемым солям.
Соединения формулы I являются обратными антагонистами и/или обратными агонистами гистамин 3 рецептора (Н3 рецептор).
Гистамин (2-(4-имидазолил)этиламин) является одним из аминэргических нейромедиаторов, которые широко распространены во всем организме, например, желудочно-кишечном тракте (Burks 1994 in Johnson L.R. ed., Physiology of the Gastrointestinal Tract, Raven Press, NY, pp.211-242). Гистамин регулирует целый ряд патофизиологических случаев, связанных с пищеварением, типа секреции желудочной кислоты, кишечную моторику (Leurs et al., Br. J. Pharmacol. 1991, 102, pp 179-185), вазомоторные ответы, кишечные воспалительные ответы и аллергические реакции (Raithel et al., Int. Arch. Allergy Immunol, 1995, 108, 127-133). В головном мозге млекопитающих гистамин синтезируется в гистаминэргических клетках организма, которые сосредоточены в бугристососковых ядрах заднего базального гипоталамуса. Из него гистаминэргические клетки организма поступают в различные отделы головного мозга (Panula et al., Proc. Natl. Acad. Sci. USA 1984, 81, 2572-2576; Inagaki et al., J. Comp. Neurol 1988, 273, 283-300).
Согласно настоящим представлениям гистамин опосредует все свои акции как в ЦНС, так и в периферической нервной системе, посредством четырех гистаминовых рецепторов, гистамин H1, Н2, H3 и Н4 рецепторов.
Н3 рецепторы, в основном, локализованы в центральной нервной системе (ЦНС). В качестве ауторецептора Н3 рецепторы существенно ингибируют синтез и секрецию гистамина из гистаминэргических нейронов (Arrang et al., Nature 1983, 302, 832-837; Arrang et al., Neuroscience 1987, 23, 149-157). В качестве гетерорецепторов Н3 рецепторы также модулируют высвобождение других нейромедиаторов таких, как ацетилхолин, допамин, серотонин и норэпинефрин, наряду с другими, в обеих нервных системах и периферических органах таких, как легкие, сердечно-сосудистая система и желудочно-кишечный тракт (Clapham & Kilpatrik, Br. J. Pharmacol. 1982, 107, 919-923; Blandina et al. in The Histamine Н3 Receptors (Leurs R.L. and Timmermann H. eds, 1998, p.27-40, Elsevier, Amsterdam, The Netherlands). Н3 рецепторы проявляют значительную активность, то-есть даже в отсутствие экзогенного гистамина, рецептор тонически активирован. В случае ингибиторного рецептора такого, как Н3 рецептор, эта присущая ему активность вызывает тоническое ингибирование нейромедиаторной секреции. Вследствие этого является важным, что H3R антагонист может также обладать активностью обратного агониста как по отношению к воздействиям экзогенного гистамина, так и к переходу рецептора из его существенно активной (ингибирующей) формы в нейтральное состояние.
Широкое распределение Н3 рецептора в ЦНС млекопитающих указывает на физиологическую роль этого рецептора, вследствие чего предполагается, что он является терапевтически потенциальной мишенью для новых разрабатываемых лекарств при различных показаниях.
Введение H3R лигандов в виде антагонистов, обратных агонистов, агонистов или частичных агонистов может оказывать влияние на уровни гистамина или секрецию нейромедиаторов в центральной и периферической нервной системе и поэтому может применяться при лечении некоторых заболеваний. Такие заболевания включают ожирение (Masaki et al; Endocrinol. 2003, 144, 2741-2748; Hancock et al., European J. of Pharmacol. 2004, 487, 183-197), сердечно-сосудистые заболевания такие, как острый инфаркт миокарда, деменцию и когнитивные заболевания такие, как гиперактивный дефицит внимания (ADHD) и болезнь Альцгеймера, нейрологические болезни такие, как шизофрения, депрессия, эпилепсия, болезнь Паркинсона и припадки или конвульсии, расстройства сна, нарколепсия, боль, желудочно-кишечные расстройства, вестибулярная дисфункция такая, как болезнь Меньера, лекарственное злоупотребление и болезнь движения (Timmermann, J. Med. Chem. 1990, 33, 4-11).
Вследствие этого объектом настоящего изобретения является селективное, прямое превращение антагонистов Н3 рецептора в обратные агонисты. Такие антагонисты/обратные агонисты применяются в качестве терапевтически активных субстанций, особенно при лечении и/или профилактике болезней, которые ассоциируются с модулированием Н3 рецепторов.
В настоящем описании термин "алкил", один или в комбинации с другими группами, относится к разветвленному или линейному моновалентному насыщенному алифатическому углеводородному радикалу, содержащему от 1 до 20 атомов углерода, предпочтительно от 1 до 16 атомов углерода, более предпочтительно от 1 до 10 атомов углерода.
Термин "низший алкил" или "С1-С8алкил", один или в комбинации с другими группами, означает линейную или разветвленную алкильную группу, содержащую от 1 до 8 атомов углерода, предпочтительно линейную или разветвленную алкильную группу, содержащую от 1 до 6 атомов углерода, и особенно предпочтительно линейную или разветвленную алкильную группу, содержащую от 1 до 4 атомов углерода. Примерами линейных и разветвленных С1-С8алкильных групп является метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, изомерные пентилы, изомерные гексилы, изомерные гептилы, изомерные октилы, предпочтительно метил и этил и наиболее предпочтительно, метил.
Термин "низший алкенил" или "С2-8-алкенил", один или в комбинации с другими группами, означает линейный или разветвленный углеводородный радикал, включающий олефиновую связь и до 8, предпочтительно до 6, особенно предпочтительно до 4 атомов углерода. Примерами алкенильных групп являются этенил, 1-пропенил, 2-пропенил, изопропенил, 1-бутенил, 2-бутенил, 3-бутенил и изобутенил. Предпочтительным является 2-пропенил.
Термин "низший алкинил" или "С2-8алкинил", один или в комбинации с другими группами, означает линейный или разветвленный углеводородный радикал, включающий до 8, предпочтительно до 6, особенно предпочтительно до 4 атомов углерода. Примерами алкинильных групп являются этинил, 1-пропинил или 2-пропинил. Предпочтительным является 2-пропинил.
Термин "циклоалкил" или "С3-7циклоалкил" означает насыщенную карбоциклическую группу, содержащую от 3 до 7 атомов углерода, такую как циклопропил, циклобутил, циклопентил, циклогексил или циклогептил. Особенно предпочтительными являются циклопропил, циклопентил и циклогексил.
Термин "низший циклоалкилалкил" или "С3-7циклоалкилС1-8алкил" относится к низшим алкильным группам по определению выше, где, по крайней мере, один из атомов водорода низшей алкильной группы замещен циклоалкилом. Предпочтительным является циклопропилметил.
Термин "алкоксигруппа" относится к группе R'-O-, где R' означает низший алкил по определению выше. Примерами низших алкоксигрупп являются, например, метоксигруппа, этоксигруппа, н-пропоксигруппа, изопропоксигруппа, н-бутоксигруппа, изобутоксигруппа, втор-бутоксигруппа и трет-бутоксигруппа, предпочтительно метоксигруппа и этоксигруппа, наиболее предпочтительно метоксигруппа.
Термин "низший алкоксиалкил" или "С1-8алкоксиС1-8алкил" относится к низшим алкильным группам по определению выше, где, по крайней мере, один из атомов водорода низших алкильных групп замещен алкоксигруппой, предпочтительно метоксигруппой или этоксигруппой. Среди низших алкоксиалкильных групп предпочтительными являются 2-метоксиэтил или 3-метоксипропил.
Термин "алкилсульфанил" или "С1-8алкилсульфанил" относится к группе R'-S-, где R' обозначает низший алкил, а термин "низший алкил" имеет данное ранее значение. Примерами алкилсульфанильных групп являются, например, метилсульфанил или этилсульфанил.
Термин "низший алкилсульфанилалкил" или "С1-8алкилсульфанилС1-8алкил" относится к низшим алкильным группам по определению выше, где, по крайней мере, один из атомов водорода низших алкильных групп замещен алкилсульфанильной группой, предпочтительно метилсульфанилом. Примером предпочтительной низшей алкилсульфанилалкильной группы является 2-метилсульфанилэтил.
Термин "алкилсульфонил" или "низший алкилсульфонил" относится к группе R'-S(O)2-, где R' обозначает низший алкил, имеющий данное ранее значение. Примерами алкилсульфонильных групп являются, например, метилсульфонил или этилсульфонил.
Термин "галоген" относится к фтору, хлору, брому и йоду, при этом фтор, хлор и бром являются предпочтительными.
Термин "низший галогеналкил" или "галогенС1-8алкил" относится к низшим алкильным группам по определению выше, где, по крайней мере, один из атомов водорода низшей алкильной группы замещен атомом галогена, предпочтительно фтором или хлором, наиболее предпочтительно фтором. Предпочтительные галогенированные низшие алкильные группы включают трифторметильную, дифторметильную, фторметильную и хлорметильную группы, при этом трифторметильная группа является особенно предпочтительной.
Термин "низшая галогеналкоксигруппа" или "галогенС1-8алкоксигруппа" относится к низшим алкоксигруппам по определению выше, где, по крайней мере, один из атомов водорода низшей алкоксигруппы замещен атомом галогена, предпочтительно фтором или хлором, наиболее предпочтительно фтором. Предпочтительные галогенированные низшие алкильные группы включают трифторметоксигруппу, дифторметоксигруппу, фторметоксигруппу и хлорметоксигруппу, при этом трифторметоксигруппа является особенно предпочтительной.
Термин "низший гидроксиалкил" или "гидроксиС1-8алкил" относится к низшим алкильным группам по определению выше, где, по крайней мере, один из атомов водорода низшей алкильной группы замещен гидроксигруппой. Примерами низших гидроксиалкильных групп являются гидроксиметил или гидроксиэтил.
Термин "диалкиламиногруппа" относится к группе -NR'R”, где R' и R” обозначают низший алкил, а термин "низший алкил" имеет данное ранее значение. Предпочтительной диалкиламиногруппой является диметиламиногруппа.
Термин "низший диалкиламиноалкил" или "С1-8диалкиламиноС1-8алкил" относится к низшим алкильным группам по определению выше, где, по крайней мере, один из атомов водорода низшей алкильной группы замещен диалкиламиногруппой, предпочтительно диметиламиногруппой. Предпочтительной низшей диалкиламиноалкильной группой является 3-диметиламинопропил.
Термин "низший алканоил" относится к группе -CO-R', где R' обозначает низший алкил, и термин "низший алкил" имеет данное ранее значение. Предпочтительной является группа -CO-R', где R' обозначает метил, а именно ацетильная группа.
Термин "низший алкоксикарбонил" или "С1-8алкоксикарбонил" относится к группе -COOR', где R' обозначает низший алкил, и термин "низший алкил" имеет данное ранее значение. Предпочтительной является группа -COOR', где R' обозначает метил.
Термин "карбамоил" относится к группе -CO-NH2.
Термин "диалкилкарбамоил" или "C1-8-диалкилкарбамоил" относится к группе
-CO-NR'R", где R' и R” обозначают низший алкил, и термин "низший алкил" имеет данное ранее значение. Предпочтительной диалкилкарбамоильной группой является диметилкарбамоил.
Термин "низший диалкилкарбамоилалкил" или "С1-8диалкилкарбамоил-С1-8алкил" относится к низшим алкильным группам по определению выше, где, по крайней мере, один из атомов водорода низшей алкильной группы замещен диалкилкарбамоилом по определению выше. Предпочтительной низшей диалкилкарбамоилалкильной группой является диметилкарбамоилметил.
Термин "низший фенилалкил" или "фенилС1-8алкил" относится к низшим алкильным группам по определению выше, где, по крайней мере, один из атомов водорода низшей алкильной группы замещен фенильной группой. Предпочтительной низшей фенилалкильной группой является бензил или фенэтил.
Термин "гетероарил" относится к ароматической, 5- или 6-членной кольцевой системе, которая может включать один, два или три атома, выбранные из азота, кислорода и/или серы. Примерами гетероарильных групп являются, например, фурил, пиридил, пиразинил, пиримидинил, пиридазинил, тиенил, изоксазолил, тиазолил, изотиазолил, оксазолил, имидазолил или пирролил. Особенно предпочтительными являются фурил и пиридил.
Термин "низший гетероарилалкил" или "гетероарилС1-8алкил" относится к низшим алкильным группам по определению выше, где, по крайней мере, один из атомов водорода низшей алкильной группы замещен гетероарильной группой по определению выше.
Термин "гетероциклил" относится к насыщенному или частично ненасыщенному 5- или 6-членному кольцу, которое может включать один, два или три атома, выбранные из азота, кислорода и/или серы. Примеры гетероциклильных колец включают пиперидинил, пиперазинил, азепинил, пирролидинил, пиразолидинил, имидазолинил, имидазолидинил, пиридинил, пиридазинил, пиримидинил, оксазолидинил, изооксазолидинил, морфолинил, тиазолидинил, изотиазолидинил, тиадиазолидинил, тригидрофурил, тетрагидрофурил, тригидропиранил, тетрагидропиранил и триморфолинил. Предпочтительной гетероциклильной группой является пиперидинил.
Термин "низший гетероциклилалкил" или "гетероциклилС1-8алкил" относится к низшим алкильным группам по определению выше, где, по крайней мере, один из атомов водорода низшей алкильной группы замещен гетероциклильной группой по определению выше.
Термин "фармацевтически приемлемые соли" относится к таким солям, которые сохраняют биологическую эффективность и свойства свободных оснований или свободных кислот, и которые не являются нежелательными ни с биологической, ни с любой другой точек зрения. Соли образуются с неорганическими кислотами такими, как хлористоводородная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и подобными им, предпочтительно, с хлористоводородной кислотой, и органическими кислотами такими, как уксусная кислота, пропионовая кислота, гликолевая кислота, пировиноградная кислота, щавелевая кислота, малеиновая кислота, малоновая кислота, салициловая кислота, янтарная кислота, фумаровая кислота, виннокаменная кислота, лимонная кислота, бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, п-толуолсульфоновая кислота, N-ацетилцистеин и им подобными. Кроме того, соли могут быть получены путем присоединения неорганического или органического основания к свободной кислоте. Соли, полученные с неорганическим основанием, включают, не лимитируя, натриевую, калиевую, литиевую, аммониевую, кальциевую, магниевую соли и им подобные. Соли, полученные с неорганическим основанием, включают, не лимитируя, соли первичных, вторичных и третичных аминов, замещенных аминов, включая натуральные замещенные амины, циклические амины и основные ионообменные смолы такие, как изопропиламин, триметиламин, диэтиламин, триэтиламин, трипропиламин, этаноламин, лизин, аргинин, N-этилпиперидин, пиперидин, полимерные смолы и им подобные. Соединения формулы I могут находиться в форме цвиттер-ионов. Особенно предпочтительными фармацевтически приемлемыми солями соединений формулы I являются хлористоводородные соли.
Соединения формулы I могут быть также сольватированы, например гидратированы. Сольватирование может иметь место в процессе их получения, например, вследствие гигроскопических свойств исходных безводных соединений формулы I (гидратация). Термин "фармацевтически приемлемые соли" включает также физиологически приемлемые сольваты.
Термин "изомеры" подразумевает соединения, имеющие идентичные молекулярные формулы, но отличающиеся природой или последовательностью связывания атомов или расположением атомов в пространстве. Изомеры, отличающиеся расположением атомов в пространстве, называются "стереоизомерами". Стереоизомеры, не являющиеся зеркальным отображением друг друга, обозначаются термином "диастереоизомеры", а стереоизомеры, зеркальные отображения которых не совместимы, обозначаются термином "энантиомеры", или, иногда, оптические изомеры. Атом углерода, который связан с четырьмя неидентичными заместителями, обозначается термином "хиральный центр".
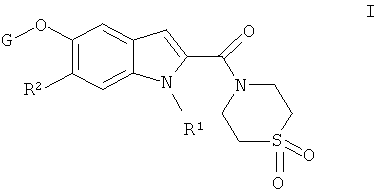
Конкретно, настоящее изобретение относится к соединениям общей формулы
 ,
,
где
R1 выбирают из группы, включающей водород, низший алкил, низший гидроксиалкил, низший алкоксиалкил, низший галогеналкил, низший циклоалкилалкил, низший алканоил, низший алкоксикарбонил, низший цианоалкил, низший алкилсульфонил,
фенилсульфонил, где фенильное кольцо может быть незамещенным или замещенным одной или двумя группами, независимо выбранными из низшего алкила, галогена, цианогруппы, низшего галогеналкила, низшей алкоксигруппы, низшей галогеналкоксигруппы и низшего гидроксиалкила;
фенил, незамещенный или замещенный одной или двумя группами, независимо выбранными из низшего алкила, галогена, цианогруппы, низшего галогеналкила, низшей алкоксигруппы, низшей галогеналкоксигруппы и низшего гидроксиалкила;
низший фенилалкил, где фенильное кольцо может быть незамещенным или замещенным одной или двумя группами, независимо выбранными из низшего алкила, галогена, цианогруппы, низшего галогеналкила, низшей алкоксигруппы, низшей галогеналкоксигруппы и низшего гидроксиалкила; и
гетероарил, незамещенный или замещенный одной или двумя группами, независимо выбранными из низшего алкила, низшей алкоксигруппы, галогена, низшего галогеналкила, низшей галогеналкоксигруппы и цианогруппы;
R2 обозначает водород или галоген;
G обозначает группу, выбранную из

где m обозначает 0, 1 или 2;
R3 выбирают из низшего алкила, низшего галогеналкила, циклоалкила, галогенциклоалкила, низшего циклоалкилалкила и низшего фенилалкила;
n обозначает 0, 1 или 2;
R4 обозначает низший алкил;
p обозначает 0, 1 или 2;
Q обозначает 0, 1 или 2;
А выбирают из CR10R10', О и S;
R5, R5', R6, R6', R7, R7', R10 и R10' независимо друг от друга выбирают из группы, включающей водород, низший алкил, гидроксигруппу, галоген и диалкиламиногруппу, или
R6 и R10 вместе образуют двойную связь;
R8 обозначает низший алкил;
R9 обозначает С3-С6алкил;
и их фармацевтически приемлемым солям.
Кроме того, предпочтительными соединениями формулы I по настоящему изобретению являются такие, где R1 выбирают из группы, включающей
водород, низший алкил, низший гидроксиалкил, низший алкоксиалкил, низший галогеналкил, низший циклоалкилалкил, низший цианоалкил,
низший алкилсульфонил и
фенил, незамещенный или замещенным одной или двумя группами, независимо выбранными из низшего алкила, галогена, цианогруппы, низшего галогеналкила, низшей алкоксигруппы, низшей галогеналкоксигруппы и низшего гидроксиалкила.
Более предпочтительными являются такие соединения формулы I, где R1 выбирают из группы, включающей водород, низший алкил и низший галогеналкил, при этом особенно предпочтительными являются такие соединения, где R1 обозначает водород, или такие соединения, где R1 обозначает низший галогеналкил. Наиболее предпочтительно, когда R1 обозначает трифторэтил.
Кроме того, предпочтительными соединениями формулы I являются такие соединения, где R1 обозначает низший цианоалкил. Особенно предпочтительным является 1-цианоэтил (пропионитрил).
Также предпочтительными соединениями формулы I по настоящему изобретению являются такие соединения, где R1 обозначает низший гидроксиалкил или низший алкоксиалкил. Более предпочтительно, R1 выбирают из группы, включающей 2-гидроксиэтил, 3-гидроксипропил, 2-метоксиэтил и 3-метоксипропил.
Кроме того, соединениями формулы I по настоящему изобретению являются предпочтительно соединения, где R1 обозначает гетероарил, незамещенный или замещенный одной или двумя группами, независимо выбранными из низшего алкила, низшей алкоксигруппы, галогена, низшего галогеналкила, низшей галогеналкоксигруппы и цианогруппы. Наиболее предпочтительно, гетероарилом является пиридил или пиримидинил.
R2 обозначает водород или галоген. Соединения формулы I, где R2 выбирают из группы, включающей водород, хлор и бром, являются предпочтительными.
Особенно предпочтительными соединениями формулы I по изобретению являются такие соединени, где R2 обозначает водород.
Кроме того, предпочтительными соединениями формулы I по настоящему изобретению являются такие соединения, где G обозначает

где m обозначает 0, 1 или 2, и R3 выбирают из низшего алкила, низшего галогеналкила, циклоалкила, галогенциклоалкила, низшего циклоалкилалкила и низшего фенилалкила.
Внутри этой группы, предпочтительными являются такие соединения формулы I, где R3 обозначает низший алкил. Наиболее предпочтительно, R3 обозначает изопропил.
Предпочтительными являются такие соединения формулы I, где m обозначает 1, что подразумевает соединения, где G1 представляет собой пиперидинил.
Также предпочтительными являются соединения формулы I, где m обозначает 0, что подразумевает соединения, где G1 представляет собой пирролидинил.
Кроме того, предпочтительными являются соединения формулы I по настоящему изобретению, где G представляет собой

где n обозначает 0, 1 или 2 и R4 обозначает низший алкил.
Также предпочтительными являются соединения формулы I по настоящему изобретению, где G представляет собой

где p обозначает 0, 1 или 2, q обозначает 0, 1 или 2; А выбирают из CR10R10', О и S; и R5, R5', R6, R6', R7, R7', R10 и R10' независимо друг от друга выбирают из группы, включающей водород, низший алкил, гидроксигруппу, галоген и диалкиламиногруппу, или R6 и R10 вместе образуют двойную связь.
Кроме того, предпочтительными являются соединения формулы I по настоящему изобретению, где G представляет собой

где q обозначает 0, 1 или 2, R8 обозначает низший алкил и R9 обозначает низший алкил.
Особенно предпочтительно соединениями формулы I по настоящему изобретению являются следующие:
(1,1-диоксотиоморфолин-4-ил)-[5-(1-изопропилпиперидин-4-илокси)-1-(2,2,2-трифторэтил)-1Н-индол-2-ил]метанон,
(1,1-диоксотиоморфолин-4-ил)-[5-(1-изопропилпиперидин-4-илокси)-1Н-индол-2-ил]метанон,
(1,1-диоксотиоморфолин-4-ил)-[1-изопропил-5-(1-изопропилпиперидин-4-илокси)-1Н-индол-2-ил]метанон,
(1,1-диоксотиоморфолин-4-ил)-[5-(1-изопропилпирролидин-3S-илокси)-1Н-индол-2-ил]метанон,
5-[2-(1,1-диоксо-1λ6-тиоморфолин-4-карбонил)-5-(1-изопропилпиперидин-4-илокси)индол-1-ил]пиридин-2-карбонитрил,
[6-бром-5-(1-изопропилпиперидин-4-илокси)-1Н-индол-2-ил]-(1,1-диоксо-1λ6-тиоморфолин-4-ил)метанон,
[6-бром-1-изопропил-5-(1-изопропилпиперидин-4-илокси)-1Н-индол-2-ил]-(1,1-диоксо-1λ6-тиоморфолин-4-ил)метанон,
[6-бром-5-(1-изопропилпиперидин-4-илокси)-1-(2,2,2-трифторэтил)-1Н-индол-2-ил]-(1,1-диоксо-1λ6-тиоморфолин-4-ил)метанон,
[6-бром-1-(2-хлорпиридин-4-ил)-5-(1-изопропилпиперидин-4-илокси)-1Н-индол-2-ил]-(1,1-диоксо-1λ6-тиоморфолин-4-ил)метанон,
(1,1-диоксо-1λ6-тиоморфолин-4-ил)-[5-(1-изопропилпиперидин-4-илокси)-1-(3-трифторметилфенил)-1Н-индол-2-ил]метанон,
[1-(2-хлорпиридин-4-ил)-5-(1-изопропилпиперидин-4-илокси)-1Н-индол-2-ил]-(1,1-диоксо-1λ6-тиоморфолин-4-ил)метанон,
2-[2-(1,1-диоксо-1λ6-тиоморфолин-4-карбонил)-5-(1-изопропилпиперидин-4-илокси)индол-1-ил]пропионитрил,
(1,1-диоксо-1λ6-тиоморфолин-4-ил)-[5-(1-изопропилпиперидин-4-илокси)-1-пиримидин-5-ил-1Н-индол-2-ил]метанон,
[6-бром-5-(1-изопропилпиперидин-4-илокси)-1-(2-метоксиэтил)-1Н-индол-2-ил]-(1,1-диоксо-1λ6-тиоморфолин-4-ил)метанон,
[6-бром-5-(1-изопропилпиперидин-4-илокси)-1-(3-метоксипропил)-1Н-индол-2-ил]-(1,1-диоксо-1λ6-тиоморфолин-4-ил)метанон,
[6-бром-1-(2-гидроксиэтил)-5-(1-изопропилпиперидин-4-илокси)-1Н-индол-2-ил]-(1,1-диоксо-1λ6-тиоморфолин-4-ил)метанон,
[6-бром-1-(3-гидроксипропил)-5-(1-изопропилпиперидин-4-илокси)-1Н-индол-2-ил]-(1,1-диоксо-1λ6-тиоморфолин-4-ил)метанон,
(S)-2-[2-(1,1-диоксо-1λ6-тиоморфолин-4-карбонил)-5-(1-изопропилпиперидин-4-илокси)индол-1-ил]пропионитрил,
(R)-2-[2-(1,1-диоксо-1λ6-тиоморфолин-4-карбонил)-5-(1-изопропилпиперидин-4-илокси)индол-1-ил]пропионитрил,
[5-(1-циклобутилпиперидин-4-илокси)-1-изопропил-1Н-индол-2-ил]-(1,1-диоксо-1λ6-тиоморфолин-4-ил)метанон,
и их фармацевтически приемлемые соли.
Кроме того, фармацевтически приемлемые соли соединений формулы I и фармацевтически приемлемые сложные эфиры соединений формулы I отдельно составляют предпочтительные варианты настоящего изобретения.
Соединения формулы I могут образовать кислотно-аддитивные соли с кислотами такими, как стандартные фармацевтически приемлемые кислоты, например, гидрохлориды, гидробромиды, фосфаты, ацетаты, фумараты, малеаты, салицилаты, сульфаты, пуриваты, цитраты, лактаты, манделаты, тартраты и метансульфонаты. Предпочтительными являются гидрохлориды. Сольваты и гидраты соединений формулы I и их соли также включены в настоящее изобретение.
Соединения формулы I могут иметь один или более асимметрических атомов углерода и могут существовать в форме оптически чистых энантиомеров, смесей энантиомеров таких, как, например, рацематы, оптически чистых диастереоизомеров, смеси диастереоизомеров, диастереоизомерных рацематов или смесей диастереоизомерных рацематов. Оптически активные формы могут быть получены, например, посредством разделения рацематов с помощью асимметрического синтеза или асимметрической хроматографии (хроматография с хиральными адсорбентами или элюантом). Изобретение включает все эти формы.
Следует понимать, что соединения общей формулы I по настоящему изобретению могут быть дериватизированы по функциональным группам с получением производных, способны превращаться в исходное соединение в условиях in vivo. Физиологически приемлемые метаболически лабильные производные, способные к продуцированию исходных соединений общей формулы I в условиях in vivo, также включены в объем настоящего изобретения.
Следующим аспектом по настоящему изобретению является способ получения соединений формулы I по определению выше, заключающийся в том, что
а) соединение формулы II
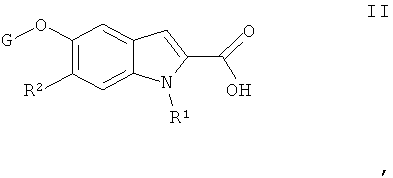
или его соль,
где R1 и R2 определены выше, вводят в реакцию с амином формулы III

с получением соединения общей формулы I

где R1, R2 и G определены выше, и
б) при необходимости, выделяют полученное соединение в виде фармацевтически приемлемой кислотно-аддитивной соли.
Термин «соль соединения общей формулы II» включает все кислотно-аддитивные соли с кислотами, например гидрохлориды, гидробромиды, фосфаты, ацетаты, фумараты, малеаты, салицилаты, сульфаты, пуриваты, цитраты, лактаты, манделаты, тартраты и метансульфонаты. Предпочтительными являются гидрохлориды. Кроме того, эти гидрохлоридные соли могут содержать эквивалент щелочно-хлоридной соли такой, как хлорид лития, хлорид натрия или хлорид калия.
Более конкретно, соединения формулы I могут быть получены с помощью методов, приведенных ниже в примерах или аналогичными методами. Получение соединений формулы I по настоящему изобретению может быть осуществлено посредством отдельно проводимых реакций или путем объединенных в одну синтетическую схему. Синтезы соединений по изобретению представлены на следующих схемах. Методы проведения реакции и очистки полученных продуктов известны специалистам в данной области техники. Заместители и индексы, используемые в данном описании методов, имеют значения, приведенные выше, если не указано иначе.
Схема 1
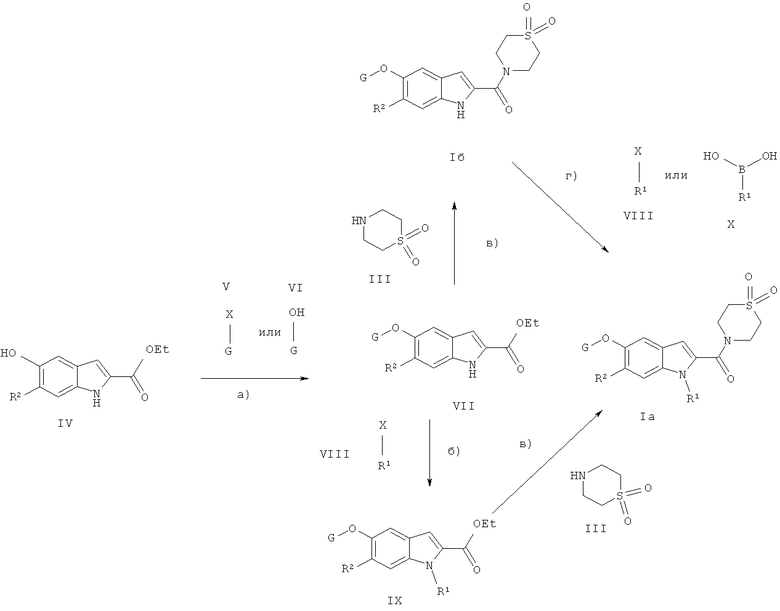
Соединения общей формулы I могут быть получены согласно схеме 1 следующим образом:
а) Синтез сложных эфиров широко описан в литературе, и методики известны из области техники (например, реакционные условия для проведения таких реакций описаны в литературе: Comprehensive Organic Transformations: A Guide to Functional Group Preparations, 2nd Edition, Richard C.Larock. John Wiley & Sons, New York, NY. 1999). При этом эффективным является применение реакционных условий, которые в общем применяются в так называемой «реакции Митцуноби», которая известна из области техники и подробно описана (Hughes, David L. The Mitsunobu reaction. Organic Reactions, New York, 1992 42 335-656)/ Нами была использована конденсация фенольного спирта (IV) со спиртами HO-G (VI) (либо коммерчески доступными, либо успешно получаемыми методами, приведенными в ссылках, либо методами, известными из области техники) при условии использования фосфина такого, как трибутилфосфин или трифенилфосфин и им подобных, и диазосоединения типа диэтилазодикарбоксилат, диизопропилазодикарбоксилат (необязательно связанных с полимером), ди-трет-бутилазодикарбоксилат, тетраметилазодикарбоксамид и им подобные, в растворителях, обычно применяемых в таких реакциях, типа тетрагидрофурана, толуола, дихлорметана и им подобных. Не существует ограничения относительно природы применяемого растворителя, при условии, что он не оказывает вредного воздействия на реакцию или вводимые реагенты, и что он растворяет реагенты, по крайней мере, в достаточной степени. Реакция может протекать в широком интервале температур и точное значение температуры не является критической для изобретения. Было установлено, что реакция успешно протекает в интервале от комнатной температуры до температуры кипения растворителя. Время, требуемое для проведения реакции, может широко варьироваться в зависимости от многих факторов, особенно от реакционной температуры и природы реагентов. Кроме того, интервал времени от 0,5 ч до нескольких дней обычно является достаточным для получения соединений формулы VII.
Альтернативно, в реакции могут быть использованы соединения формулы IV, в которых фенольный ОН замещен на G-X (V) (либо коммерчески доступные, либо успешно получаемые методами, приведенными в ссылках, либо методами, известными из области техники). Условия проведения такого типа реакций широко описаны в литературе и известны из области техники. Уходящей группой X может быть любой галоген или псевдогалогеновая группа (например, трифторметилметансульфонил, п-толуолсульфонил, метансульфонил и им подобные). Реакция может протекать в присутствии или отсутствие растворителя и, предпочтительно, в присутствии основания. Растворители типа N,N-диметилформамида, N,N-диметилацетамида, тетрагидрофурана, диэтиловоого эфира, диоксана, ацетонитрила, бутанона и им подобных были успешно использованы. Не существует ограничения относительно природы применяемого растворителя, при условии, что он не оказывает вредного воздействия на реакцию или вводимые реагенты и что он растворяет реагенты, по крайней мере, в достаточной степени. Обычно реакция проводится в присутствии основания. Подходящие основания включают гидрид натрия, N-этилдиизопропиламин, карбонаты натрия и цезия и им подобные. Реакция может протекать в широком интервале температур, при этом точное значение температуры не является критической для изобретения. Время, требуемое для проведения реакции, может широко варьироваться в зависимости от многих факторов, особенно от реакционной температуры и природы реагентов. Кроме того, интервал времени от 0,5 ч до нескольких дней обычно является достаточным для получения соединений формулы VII.
б) В реакции могут быть использованы соединения формулы соединения VII, в которых индольный NH может быть замещен низшим алкилом, бензилом, алкилом, алканоилом и сульфонилом, например, посредством реакции с алкилирующим, ацилирующим или сульфонилирующим агентом (либо коммерчески доступным, либо успешно получаемым методами, приведенными в ссылках, либо методами, известными из области техники). Типичными примерами алкилирующего или ацилирующего агента VIII являются метилйодид, 2-бромпропан, 2,2,2-трифторэтилметансульфонат, метансульфонилхлорид или фенилсульфонилхлорид. Условия проведения такого типа реакций, в общем, широко описаны в литературе и известны из области техники. Х обозначает уходящую группу такую, как любой галоген (хлор, бром, йод) или псевдогалогеновую группу (например, трифторметилметансульфонил, п-толуолсульфонил, метансульфонил и им подобные). Реакция может протекать в присутствии или отсутствие растворителя и, предпочтительно, в присутствии основания. Были успешно использованы растворители типа N,N-диметилформамида, N,N-диметилацетамида, тетрагидрофурана, диэтилового эфира, диоксана, ацетонитрила, бутанона и им подобных. Не существует ограничения относительно природы применяемого растворителя, при условии, что он не оказывает вредного воздействия на реакцию или вводимые реагенты и что он растворяет реагенты, по крайней мере, в достаточной степени. Обычно реакция проводится в присутствии основания. Подходящие основания включают гидрид натрия, N-этилдиизопропиламин, карбонаты натрия и цезия и им подобные. Реакция может протекать в широком интервале температур, при этом точное значение температуры не является критической для изобретения. Время, требуемое для проведения реакции, может широко варьироваться в зависимости от многих факторов, особенно от реакционной температуры и природы реагентов. Кроме того, интервал времени от 0,5 ч до нескольких дней обычно является достаточным для получения соединений формулы IX.
в) Соединения формулы IX переводят в свободные кислоты в щелочных условиях, например, с использованием моногидрата гидроксида лития в качестве основания. Свободную кислоту или ее любую подходящую соль конденсируют с тиоморфолин-1,1-диоксидом (предложена Syntec, ref M1201) с помощью метода, известного из области техники (реакционные условия для проведения таких реакций, например, описаны в литературе: Comprehensive Organic Transformations: A Guide to Functional Group Preparations, 2nd Edition, Richard C. Larock. John Wiley & Sons, New York, NY. 1999). Было установлено, что применение тетрафторбората 2-(1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония и изопропилэтиламина в диметилформамиде, успешно приводит к соединениям общей формулы Iа.
г) Индолы (Iб) могут быть требуемыми продуктами, однако они необязательно могут быть использованы в последующей реакции алкилирования, как описано выше, по пункту (б) с получением требуемого соединения (Iа).
Альтернативно, соединения (Iб) могут быть алкилированы или арилированы с помощью бороновой кислоты или сложного эфира бороновой кислоты формулы Х (либо коммерчески доступны, либо успешно получаемы методами, приведенными в ссылках, либо методами, известными из области техники). Условия проведения такого типа реакций широко описаны в литературе и известны из области техники (см., например, Mederski, W. W. К. R.; Lefort, M.; Germann, M. Kux, D. TeTpahedron, 1999, 55, 12757). R1 может обозначать любой арил, циклоалкил или гетероарильное соединение.
Альтернативно, соединения (Iб) могут быть арилированы соединениями общей формулы R1-X (либо коммерчески доступными, либо успешно получаемыми методами, приведенными в ссылках, либо методами, известными из области техники). Условия проведения такого типа реакций широко описаны в литературе и известны из области техники (см., например, Watanabe, M; Nishiyama, M.; Yamamoto, Т.; Koie, Y, Tetrahedron Letters, 2000, 41, 481; Old, D.W.; Harris. M.C.; Buchwald, S. L 2000, 2, 10, 1403; Klapars, A.; Antilla, J.C.; Huang, X.; Buchwald, S. L. J. Am. Chem. Soc., 2001, 123, 7727). Уходящей группой Х может быть любой галоген (хлор, бром, йод) или псевдогалогеновая группа (например, трифторметилметансульфонил, п-толуолсульфонил, метансульфонил и им подобные) и R1 может обозначать любую арильную или гетероарильную группу.
Как описано выше, соединения формулы I по настоящему изобретению могут быть применены в качестве лекарственных средств для лечения и/или профилактики болезней, которые ассоциируются с модулированием Н3 рецепторов.
В этом контексте, выражение «болезни, ассоциируемые с модулированием Н3 рецепторов» подразумевает болезни, лечение и/или профилактика которых может быть осуществлена с помощью модулирования Н3 рецепторов. Такие болезни включают, не лимитируя, ожирение, метаболический синдром (синдром X), нейрологические болезни, включая болезнь Альцгеймера, деменцию, старческую дисфункцию памяти, средние когнитивные нарушения, когнитивный дефицит, гиперактивный дефицит внимания, эпилепсию, нейропатическую боль, воспалительную боль, мигрень, болезнь Паркинсона, рассеянный склероз, удар, головокружение, шизофрению, депрессию, аддикцию, болезнь движения и расстройство сна, нарколепсию и другие болезни, включая астму, аллергию, индуцируемые аллергией ответы дыхательных путей, застой, хроническую обструктивную болезнь легких и желудочно-кишечные заболевания.
В предпочтительном аспекте, выражение «болезни, ассоциируемые с модулированием Н3 рецепторов» относятся к ожирению, метаболическому синдрому (синдром X) и другим болезням, связанным с питанием, при этом ожирение является особенно предпочтительным.
Изобретение, кроме того, относится также к фармацевтическим композициям, включающим соединения по определению выше и фармацевтически приемлемые носитель и/или наполнитель.
Кроме того, изобретение относится к соединениям по определению выше для применения в качестве терапевтически активных субстанций, особенно в качестве терапевтически активных субстанций для лечения и/или профилактики болезней, которые ассоциируются с модулированием Н3 рецепторов.
В другом варианте изобретение относится к способу лечения и/или профилактики болезней, которые ассоциируются с модулированием Н3 рецепторов, заключающемуся во введении терапевтически эффективного количества соединения общей формулы I человеку или животному. Способ лечения и/или профилактики ожирения является предпочтительным.
Изобретение далее относится к применению соединений формулы I по определению выше для лечения и/или профилактики болезней, которые ассоциируются с модулированием Н3 рецепторов.
Изобретение, кроме того, относится к применению соединений формулы I по определению выше при получении лекарственных средств для лечения и/или профилактики болезней, которые ассоциируются с модулированием Н3 рецепторов. Применение соединений формулы I по определению выше для получения лекарственных средств для лечения и/или профилактики ожирения является предпочтительным.
Кроме того, настоящее изобретение относится к применению соединения формулы I для получения лекарственного средства для лечения и/или профилактики ожирения у пациента, который принимает лечение ингибитором липазы и, особенно когда ингибитором липазы является орлистат.
Предпочтительным объектом по настоящему изобретению является способ лечения или профилактики ожирения и родственных ожирению болезней, заключающийся во введении терапевтически эффективного количества соединения общей формулы I в комбинации или сочетании с терапевтически эффективным количеством других лекарств для лечения ожирения или заболеваний, связанных с питанием, так, что вместе они дают эффективное ослабление болезни. Другие подходящие лекарства включают, не лимитируя, снижающие аппетит агенты, ингибиторы липазы, ингибиторы селективного захвата серотонина (SSRI) и агенты, стимулирующие метаболизм жира в организме. Комбинации или сочетания упомянутых агентов могут быть введены раздельно, последовательно или одновременно.
Термин "ингибитор липазы" относится к соединениям, которые способны ингибировать действие липаз, например желудочных и панкреатических липаз, например таким, как орлистат и липстатин, которые описаны в US 4598089 и являются потенциальными ингибиторами липаз. Липстатин является натуральным продуктом микробиологического происхождения, а орлистат представляет собой продукт гидрирования липстатина. Другие ингибиторы липазы включают класс соединений, в общем относящихся к панклицинам, которые являются аналогами орлистата (Mutoh et al, 1994). Термин "ингибитор липазы " относится также к полимер-связанной липазе, например описанной в WO 99/34786 (Geltex Pharmaceuticals Inc.). Такие полимеры характеризуются тем, что они замещены одной или более группами, которые ингибируют липазы. Термин "ингибитор липазы" включает также фармацевтически приемлемые соли этих соединений. Термин "ингибитор липазы" предпочтительно относится к тетрагидролипстатину. Введение терапевтически эффективного количества соединения согласно формуле I в комбинации или сочетании с терапевтически эффективным количеством тетрагидролипстатина является особенно предпочтительным.
Тетрагидролипстатин (орлистат) является известным соединением, применяемым для контроля или профилактики ожирения и гиперлипидемии. Например, в US 4598089, опубликованном 1 июля 1986 г., раскрываются процессы получения орлистата, а в US 6004996, раскрываются соответствующие фармацевтические композиции. Кроме того, соответствующие фармацевтические композиции описаны, например, в публикациях WO 00/09122 и WO 00/09123. Дополнительно, способы получения орлистата раскрыты в европейских патентных заявках 0185359, 0189577, 0443449 и 0524495.
Подходящие анорексические агенты, применяемые в комбинации с соединением по настоящему изобретению, включают, не лимитируя, APD356, аминорекс, амфехлораль, амфетамин, аксокин, бензфетамин, бупропион, хлорфентермин, клобензорекс, клофорекс, кломинорекс, клортермин, СР945598, циклекседрин, CYT009-GhrQb, дексфенфлюрамин, декстроамфетамин, диэтилпропион, дифеметоксидин, N-этиламфетамин, фенбутразат, фенфлюрамин, фенизорекс, фенпропорекс, флюдарекс, флюминорекс, фурфурилметиламфетамин, левамфетамин, левофацетопиран, мазиндол, мефенорекс, метамфетрамон, метамфетамин, метрелептин, норпсевдоэфедрин, пенторекс, фендиметразин, фенметразин, фентермин, фенилпропаноламин, писилорекс, римонабант, сибутрамин, SLV319, SNAP 7941, SRI 47778 (суринабант), стероидные растительные экстракты (например, Р57) и ТМ30338 и их фармацевтически приемлемые соли.
Наиболее предпочтительными аноректическими агентами являются сибутрамин, римонабант и фентермин.
Подходящие селективные ингибиторы обратного захвата серотонина, используемые в комбинации с соединением по настоящему изобретению, включают: флюоксетин, флювохамин, пароксетин, сетралин и их фармацевтически приемлемые соли.
Подходящие агенты, которые стимулируют метаболизм жиров организма, включают, не лимитируя, агониста гормона роста (например, AOD-9604).
Применение соединения общей формулы I при получении лекарственного средства для лечения и профилактики ожирения у пациента, который также принимает лечение соединениями, выбранными из группы, включающей ингибитор липазы, аноректический агент, ингибитор селективного обратного захвата серотонина и агент, стимулирующий метаболизм жиров организма, также является объектом по настоящему изобретению.
Применение соединения общей формулы I при получении лекарственного средства для лечения и профилактики ожирения у пациента, который также принимает лечение ингибитором липазы, предпочтительно тетрагидролипстатином, также является объектом по настоящему изобретению.
Кроме того, предпочтительный объект по изобретению представляет способ лечения или профилактики диабета типа II (инсулин-независимого сахарного диабета (NIDDM)) у человека, включающий введение терапевтически эффективного количества соединения формулы I в комбинации или сочетании с терапевтически эффективным количеством ингибитора липазы, особенно где ингибитором липазы является тетрагидролипстатин. Также объектом по изобретению является способ, описанный выше для совместного, раздельного или последовательного введения соединения формулы I и ингибитора липазы, в частности тетрагидролипстатина.
Кроме того, предпочтительный объект по изобретению представляет способ лечения или профилактики диабета типа II (инсулин-независимого сахарного диабета (NIDDM)) у человека, включающий введение терапевтически эффективного количества соединения формулы I в комбинации или сочетании с терапевтически эффективным количеством антидиабетического агента.
Термин "антидиабетический агент" относится к соединениям, выбранным из группы, включающей 1) PPARγ агонисты такие, как пилглитазон (актоз) или розиглитазон (авандия) и им подобные; 2) бигуаниды такие, как метформин (глюкофаг) и им подобные; 3) сульфонилмочевины такие, как глибенкламид, глимепирид (амарил), глипизид (глюкотрол), глубурид (DiaBeta) и им подобные; 4) нонсульфонилмочевины такие, как натеглинид (старликс), репаглимид (прандин) и им подобные; 5) PPARα/γ агонисты такие, как GW-2331 и им подобные; 6) DPP-IV- ингибиторы такие, как LAF-237 (вилдаглиптин), МК-0431, BMS-477118 (саксаглиптин) или GSK23A и им подобные; 7) активаторы глюкокиназы такие, как соединения, раскрытые, например, в WO 00/58293 А1, и им подобные; 8) ингибиторы α-глюкозидазы такие, как акарбоз (прекоз) или миглитол (глизет) и им подобные.
Также объектом по изобретению является способ, описанный выше, для совместного, раздельного или последовательного введения соединения формулы I и терапевтически эффективного количества антидиабетического агента.
Применение соединения общей формулы I при получении лекарственного средства для лечения и профилактики диабета типа II у пациента, который также получает лечение антидиабетическим агентом, также является объектом по настоящему изобретению.
Кроме того, по предпочтительному объекту по изобретению предлагается способ лечения или профилактики дислипидемии у человека, включающий введение терапевтически эффективного количества соединения формулы I в комбинации или сочетании с терапевтически эффективным количеством липид-понижающего агента.
Термин "липид-понижающий агент" относится к соединениям, выбранным из группы, включающей 1) секвестраторы желчных кислот такие, как холестирамин (кюистран), колестирол (колестид) и им подобные; 2) ингибиторы HMG-CoA редуктазы такие, как аторвастин (липитор), керивастатин (бэйкол), флювастатин (лескол), правастатин (правахол), симвастатин (зокор) и им подобные; 3) ингибиторы абсорбции холестерина такие, как эзетимиб и им подобные; 4) СЕТР ингибиторы такие, как торцетрапиб, JTT 705 и им подобные; 5) PPARα - агонисты такие, как беклофибрат, гемфиброзил (лопид), фенофибрат (липидил), бензафибрат (безалип) и им подобные; 6) ингибиторы липопротеинового синтеза такие, как ниацин и им подобные; и 7) агонисты рецептора ниацина такие, как никотиновая кислота и им подобные.
Также объектом по изобретению является способ, описанный выше, для совместного, раздельного или последовательного введения соединения формулы I и терапевтически эффективного количества липид-понижающего агента.
Применение соединения общей формулы I при получении лекарственного средства для лечения и профилактики липидемии у пациента, который также получает лечение липид-понижающим агентом, также является объектом по настоящему изобретению.
Кроме того, в предпочтительном варианте по изобретению предлагается способ лечения или профилактики гипертензии у человека, включающий введение терапевтически эффективного количества соединения формулы I в комбинации или сочетании с терапевтически эффективным количеством антигипертензивного агента.
Термин "антигипертензивный агент" или "агент, понижающий кровяное давление" относится к соединениям, выбранными из группы, включающей 1) ингибиторы ангиотензин-превращающего фермента (АСЕ), включающие беназеприл (лотенсин), каптоприл (капотен), эналаприл (вазотек), фозиноприл (моноприл), лизиноприл (принивил, зестрил), моэксеприл (униваск), периндоприл (коверсум), кьюнаприл (аккуприл), рамиприл (альтак), трандоприл (мавик) и им подобные; 2) антагонисты ангиотензин II рецептора, включающие кандесартан (атаканд), эпросартан (теветен), ирбесартан (авапро), лозартан (козаар), телмисартан (микадискл), валсартан (диован) и им подобные; 3) адренэргические блокаторы (периферийные и центральные) такие, как β-адренэргические блокаторы, включающие ацебуталол (сектрол), атенолол (тенормин), бетаксолол (керлон), бисопролол (цебета), картеолол (картрол), метопролол (лопрессор; топрол-XL), надолол (коргард), пенбуталол (леватол), пиндолол (вискен), пропранолол (индерал), тимолол (блокадрен) и им подобные; α/β-адренэргические блокаторы, включая карведилол (корег), лабеталол (нормодин) и им подобные; α-1-адренэргические блокаторы, включая празосин (минипресс), доксазосин (кардура), теразосин (хитрин), феноксибензамин (дибензилин) и им подобные; периферийные адренэргические-нейрональные блокаторы, включая гуанадрел (хилорель), гуанэтидин (исмелин), резерпин (серпасил) и им подобные; α-2-адренэргические блокаторы, включая α-метилдопу (альдомет), хлонидин (катапрес), гуанабенц (витенсин), гуанфацин (тенекс) и им подобные; 4) средства, расширяющие кровеносные сосуды (вазодилаторы), включая гидралазин (апресолин), миноксидил (лонитрен), хлонидин (катапрес) и им подобные; 5) блокаторы кальциевых каналов, включая амлодипин (норваск), фелодипин (плендил), исрадипин (динакирк), никардипин (кардин sr), нифедипин (прокардиа, адалат), нисольдипин (сулар), дилтиазем (кардизем), вирапамил (изоптил) и им подобные; 6) диуретики такие, как тиазиды и тиазид-подобные агенты, включая гидрохлортиазид (гидродиурил, микрозид), хлортиазид (диурил), хлорталидон (гидратон), индапамид (лозол), метолазон (микрос) и им подобные; петельные (loop) диуретики такие, как буметанид (бумекс) и фуросимид (лазикс), этакриновая кислота (эдекрин), торсемид (демадекс) и им подобные; калий-сберегающие диуретики, включая амилорид (мидамор), триамтерен (дурениум), спиронолактон (альдактон) и тиаменид (симкор) и им подобные; 7) ингибиторы тирозингидроксилазы, включая метирозин (демсер) и им подобные; 8) ингибиторы нейтральной эндопептидазы, включая BMS-186716 (омапатрилат), UK-79300 (кандоксатрил), экадотрил (синорфан), ВР-1137 (фасидотрил), UK-79300 (сампатрилат) и им подобные; и 9) антагонисты эндотелина, включая тезосентан (RO0610612), А308165 и им подобные.
Также объектом по изобретению является способ, описанный выше, для совместного, раздельного или последовательного введения соединения формулы I и терапевтически эффективного количества антигипертензивного агента.
Применение соединения общей формулы I при получении лекарственного средства для лечения и профилактики гипертензии у пациента, который также получает лечение антигипертензивным агентом, также является объектом по настоящему изобретению.
Как описано выше, соединения формулы I и их фармацевтически приемлемые соли обладают различными фармакологическими свойствами. В частности, было установлено, что соединения по настоящему изобретению являются хорошими антагонистами и/или обратными агонистами гистамин 3 рецептора (H3R).
Следующий тест проводился для определения активности соединений формулы (I).
Анализ связывания с 3Н-(R)-α-метилгистамином
Эксперименты по насыщению связывания проводились с использованием HR3-CHO мембран, полученных, как описано в Takahashi, К, Tokita, S., Kotani, Н. (2003) J. Pharmacol. Exp. Therapeutics, 307, 213-218.
Соответствующее количество мембраны (от 60 до 80 мкг белка/ячейку) инкубировали с возрастающими концентрациями дигидрохлорида 3H(R)-α-метилгистамина (от 0,10 до 10 нМ). Неспецифическое связывание определяли, используя 200-кратный избыток тригидробромида (R)-α-метилгистамина (500 нМ конечная концентрация). Инкубирование проводили при комнатной температуре (встряхивание в течение 3 ч в глубоко-ячеистых планшетах). Конечный объем в каждой ячейке составлял 250 мкл. За инкубированием следовала быстрая фильтрация на GF/B фильтрах (предварительное пропитывание 100 мкл 0,5% PEI в Tris 50 мМ, встряхивание при 200 об/мин в течение 3 ч). Фильтрация проводилась с помощью клеточного харвестера, и фильтровальные планшеты затем пять раз отмывались холодным буфером для промывки, содержащим 0,5 М NaCl. После харвестирования планшеты высушивались при температуре 55°С в течение 60 мин, затем к ним добавлялась сцинтилляционная жидкость (Microscint 40, 40 микрол в каждую ячейку) и количество радиоактивности на фильтре определялось на Packard top-приборе после встряхивания планшетов в течение 2 ч при 200 об/мин при комнатной температуре.
Буфер для связывания: 50 мМ Tris-HCl pH 7,4 и 5 мМ MgCl2×6H2O рН 7,4.
Буфер для отмывки: 50 мМ Tris-HCl рН 7,4 и 5 мМ MgCl2×6H2O и 0,5 М NaCl рН 7,4.
Непрямое измерение сродства H3R обратных агонистов: 12 выбранных соединений в возрастающих концентрациях (в интервале от 10 мкМ до 0,3 нМ) постоянно тестировались в экспериментах конкурентного связывания с использованием мембран человеческой HR3-CHO линии клеток. Соответствующее количество белка, например, приблизительно 500 имп./мин связывания RAMH при Kd, инкубировали в течение 1 ч при комнатной температуре с конечным объемом 250 мкл в 96-ячеистых планшетах в присутствии 3Н(R)-α-метилгистамина (1 нМ конечная концентрация = Kd). Неспецифическое связывание определялось с использованием 200-кратного избытка холодного тригидробромида (R)-α-метилгистамина.
Все соединения тестировались при каждой одной концентрации в двойном повторе. Соединения, которые проявляли ингибирование [3H]-RAMH более чем 50%, были протестированы снова для определения IC50 в эксперименте сериального разбавления. Ki были вычислены из IC50 на основе уравнения Cheng-Prusoff (Cheng, Y., Prusoff, WH (1973) Biochem. Pharmacol., 22, 3099-3108).
Соединения по настоящему изобретению показали Ki величины в интервале от 0,1 нМ до приблизительно 1000 нМ, предпочтительно приблизительно от 0,1 нМ до 300 нМ и более предпочтительно приблизительно от 0,1 нМ до 100 нМ.
В следующей таблице представлены измеренные величины для некоторых выбранных соединений по настоящему изобретению.
Демонстрация активности биологического связывания соединений по настоящему изобретению может быть проведена в анализах in vitro, ex vivo и in vivo, которые хорошо известны из области техники. Например, для демонстрации эффективности фармацевтического агента при лечении связанных с ожирением заболеваний таких, как диабет, синдром Х или атеросклеротическая болезнь, и родственных заболеваний таких, как гипертриглицеридемия и гиперхолестеремия, могут быть применены следующие анализы.
Метод измерения уровней глюкозы в крови
db/db Мышей (получены из Jackson Laboratories, Bar Harbor, ME) обескровливают (через глазную или хвостовую вену) и группируют согласно эквивалентному значению уровней глюкозы в крови. Затем им оральным путем вводится доза (посредством зондирования в фармацевтически приемлемом растворителе) тестируемого соединения один раз ежедневно в течение от 7 до 14 дней. После этого животные вновь обескровливаются через глазную или хвостовую вену, и в крови определяются уровни глюкозы.
Метод измерения уровней триглицеридов
hApoAl мышей (получены из Jackson Laboratories, Bar Harbor, ME) обескровливают (через глазную или хвостовую вену) и группируют согласно эквивалентному значению уровней сывороточных триглицеридов. Затем им оральным путем вводится доза (посредством зондирования в фармацевтически приемлемом растворителе) тестируемого соединения один раз ежедневно в течение от 7 до 14 дней. После этого животные вновь обескровливаются через глазную или хвостовую вену, и в крови определяются уровни сывороточных триглицеридов.
Метод измерения уровней холестерина высокой плотности
Для определения уровней плазменного холестерина высокой плотности (ЛВП) hApoAl мышей обескровливают (через глазную или хвостовую вену) и группируют согласно эквивалентному значению уровней плазменного хлестерина высокой плотности. Затем мышам оральным путем вводится доза (посредством зондирования в фармацевтически приемлемом растворителе) тестируемого соединения один раз ежедневно в течение от 7 до 14 дней, а на следующий день после этого животные вновь обескровливаются. Плазму анализируют на ЛВП-холестерин.
Соединения формулы (I) и их фармацевтически приемлемые соли и сложные эфиры могут быть использованы в качестве лекарственных средств, например, в форме фармацевтических препаратов для энтерального, парентерального или топического введения. Они могут быть введены, например, перорально, например, в форме таблеток, таблеток в оболочке, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий, ректально, например, в форме суппозиториев, парентерально, например, в виде инъекционных или инфузионных растворов, или топически, например, в форме мазей, кремов или масел.
Приготовление фармацевтических препаратов может осуществляться с использованием методик, хорошо известных специалистам в области техники, и заключается во внесении описанных соединений формулы (I) и их фармацевтически приемлемых производных в лекарства, приготовленные по официально утвержденной прописи, вместе с подходящими, инертными, терапевтически совместимыми твердыми или жидкими носителями и, при необходимости, обычными фармацевтическим наполнителями.
В качестве подходящих материалов для носителей могут использоваться как неорганические, так и органические материалы. Так, например, лактоза, кукурузный крахмал или их производные, тальк, стеариновая кислота или ее соли могут быть использованы в качестве носителей для таблеток, таблеток в оболочке, драже и твердых желатиновых капсул. Подходящими носителями для мягких желатиновых капсул могут служить, например, растительные масла, воски, жиры и полутвердые или жидкие полиолы (в зависимости от природы активного ингредиента не являющиеся носителями). Подходящими носителями для получения растворов и сиропов являются, например, вода, полиолы, сахароза, инвертный сахар и им подобные. Подходящими носителями для инъекционных растворов являются, например, вода, спирты, полиолы, глицерин и растительные масла. Подходящими носителями для суппозиториев являются, например, натуральные и гидрированные масла, воски, жиры и полутвердые или жидкие полиолы. Подходящими носителями для топических препаратов являются глицериды, полусинтетические и синтетические глицериды, гидрированные масла, жидкие воски, жидкие парафины, жидкие жирные спирты, стеролы, полиэтиленгликоли и производные целлюлозы.
Обычные стабилизаторы, консерванты, смачивающие и эмульсионные агенты, улучшающие консистенцию агенты, вкусовые агенты, соли для установки осмотического давления, буферные субстанции, солюбилизаторы, красители, маскирующие агенты и оксиданты рассматриваются в качестве фармацевтических наполнителей.
Дозирование соединений формулы (I) может варьироваться в широких пределах в зависимости от подлежащей контролю болезни, возраста и индивидуального состояния пациента и способа введения и должно, конечно, соответствовать индивидуальным требованиям в каждом отдельном случае. Для взрослого пациента рекомендуемая суточная доза составляет от 1 мг до приблизительно 1000 мг, в частности, от 1 мг до приблизительно 100 мг. В зависимости от дозирования считается удобным вводить суточную дозу в виде нескольких разовых доз.
Фармацевтические препараты содержат соответственно от 0,1 до 500 мг, предпочтительно, от 0,5 до 100 мг соединения общей формулы (I).
Следующие примеры иллюстрируют настоящее изобретение более детально. Они, однако, ни в коей мере не лимитируют его объема.
Примеры
Промежуточное соединение (I): этиловый эфир 5-(1-изопропилпиперидин-4-илокси)-1Н-индол-2-карбоновой кислоты
а) Стадия 1: 1-Изопропилпиперидин-4-ол
К холодному (0°С) раствору 1-изопропилпиреридиона (от фирмы Chemie Brunschwig AG, 100 г, 1,0 экв.) в этаноле (500 мл) добавляют боргидрид натрия (19,3 г, 0,7 экв.) небольшими порциями. Реакционную смесь оставляют самопроизвольно нагреваться до комнатной температуры и перемешивают в течение ночи. После концентрирования в вакууме добавляют ледяную воду (1 кг), водный раствор гидроксида натрия (28 мас.%, 0,5 л) и дихлорметан (1 л). Смесь энергично перемешивают в течение 4 ч, после чего водный слой экстрагируют дихлорметаном. Объединенные органические слои промывают рассолом, высушивают над сульфатом натрия, фильтруют и очищают с помощью фракционированной вакуумной дистилляции (20 мбар). Одну фракцию (95°С при 20 мбар) выделяют, получая 61,3 г (выход 60%) названное в заголовке соединение в виде бесцветного масла. МС (m/e): 144,5 (МН+, 100%).
б) Стадия 2: этиловый эфир 5-(1-изопропилпирролидин-3-илокси)-1Н-индол-2-карбоновой кислоты
К холодной (0°С) смеси этилового эфира 5-гидрокси-1Н-индол-2-карбоновой кислоты (10 г, 1,0 экв.), 1-изопропилпиперидин-4-ола (промежуточное соединение (1), стадия 1, 7,32 г, 1,05 экв.) и трифенилфосфина (15,3 г, 1,2 экв.) в тетрагидрофуране (280 мл) медленно добавляют раствор диизопропилазодикарбоксилата (11,8 г, 1,2 экв.) в тетрагидрофуране (20 мл). Смесь перемешивают в течение 30 мин при температуре 0°С и в течение ночи при комнатной температуре, концентрируют в вакууме, растворяют в метилбутиловом эфире (310 мл), промывают водным раствором гидроксида натрия (0,5-нормальный), рассолом, высушивают над Na2SO4, фильтруют и выпаривают. Остаток очищают на силикагеле, элюируя смесью дихлорметан/метанол/аммиак. Выделенную фракцию высушивают в вакууме, получая 7,0 г (выход 43%) требуемого продукта в виде белого твердого вещества. МС (m/е): 331,5 (МН+, 100%)
Пример 1: (1,1-Диоксотиоморфолин-4-ил)-[5-(1-изопропилпиперидин-4-илокси)-1-(2,2,2-трифторэтил)-1Н-индол-2-ил]метанон
а) Стадия 1: этиловый эфир 5-(1-изопропилпиперидин-4-илокси)-1-(2,2,2-трифторэтил)-1Н-индол-2-карбоновой кислоты
К смеси этилового эфира 5-(1-изопропилпирролидин-3-илокси)-1Н-индол-2-карбоновой кислоты (промежуточное соединение, 4 г, 1,0 экв.) в диметилформамиде (40 мл) добавляют гидрид натрия (дисперсия в масле, 60 мас.%, 533 мг, 1,1 экв.) несколькими порциями. Раствор перемешивают в течение 30 мин при температуре 70°С. Затем добавляют 2,2,2-трифторэтилтрифторметансульфонат (3,37 г, 1,2 экв.) и реакционную смесь перемешивают при температуре 70°С в течение ночи. Затем реакционную смесь пропорционируют между водным раствором гидрокарбоната натрия и этилацетатом. Органический слой промывают водой и рассолом, выпаривают в вакууме и затем очищают на силикагеле, элюируя смесью дихлорметан/метанол/аммиак. Выделенную фракцию высушивают в вакууме, получая 3,9 г (выход 78%) требуемого продукта в виде беловатого твердого вещества. МС (m/e): 413,5 (МН+, 100%).
б) Стадия 2: 5-(1-Изопропилпиперидин-4-илокси)-1-(2,2,2-трифторэтил)-1Н-индол-2-карбоновая кислота (хлористоводородная соль с 1 экв. хлорида лития)
К раствору этилового эфира 5-(1-изопропилпиперидин-4-илокси)-1-(2,2,2-трифторэтил)-1Н-индол-2-карбоновой кислоты (3,9 г, 1,0 экв.) в тетрагидрофуране (30 мл), воды (15 мл) и метанола (7 мл) добавляют моногидрат гидроксида лития (460 мг, 1,16 экв.). Реакционную смесь нагревают с обратным холодильником в течение ночи. После концентрирования в вакууме остаток подкисляют (рН 2) хлористоводородной кислотой (2-нормальной). Образовавшуюся смесь высушивают в вакууме, получая 4,4 г (выход 99%) требуемого продукта в виде беловатого твердого вещества. МС (m/e): 462,5 (М-Н-, 100%).
в) Стадия 3: (1,1-Диоксотиоморфолин-4-ил)-[5-(1-изопропилпиперидин-4-илокси)-1-(2,2,2-трифторэтил)-1Н-индол-2-ил]метанон
Смесь 5-(1-изопропилпиперидин-4-илокси)-1-(2,2,2-трифторэтил)-1Н-индол-2-карбоновой кислоты (хлористоводородная соль с одним экв. хлорида лития, 650 мг, 1,0 экв.), тетрафторборат 2-(1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония (563 мг, 1,2 экв.), тиоморфолин-1,1-диоксида (предоставлен фирмой Syntec, ref. M1201) и диизопропилэтиламина (1,22 мл, 5 экв.) в диметилформамиде перемешивают при комнатной температуре в течение 24 ч, а затем пропорционируют между водным раствором гидрокарбоната натрия и этилацетатом. Водный слой экстрагируют этилацетатом и объединенные органические слои промывают водой и рассолом, высушивают над сульфатом натрия, фильтруют, выпаривают в вакууме и очищают на силикагеле, элюируя смесью дихлорметан/метанол/аммиак. Выделенную фракцию высушивают в вакууме, получая 468 мг (выход 66%) требуемого продукта в виде беловатого твердого вещества. МС (m/e): 502,5 (МH+, 100%).
Пример 2: (1,1-Диоксотиоморфолин-4-ил)-[5-(1-изопропилпиперидин-4-илокси)-1Н-индол-2-ил]метанон
а) Стадия 1: 5-(1-Изопропилпиперидин-4-илокси)-1Н-индол-2-карбоновая кислота (хлористоводородная соль с одним экв. хлорида лития)
Смесь этилового эфира 5-(1-изопропилпирролидин-3-илокси)-1Н-индол-2-карбоновой кислоты (промежуточное соединение (1), 1,98 г, 1,0 экв.) и моногидрата гидроксида лития (300 мг, 1,15 ммолей) в тетрагидрофуране (30 мл), метанола (30 мл) и воды (15 мл) нагревают при температуре 100°С в течение 2 ч. Органические растворители удаляют и добавляют 1-нормальный водный рествор НСl до получения рН раствора в интервале от 2 до 3. Затем смесь выпаривают без досушивания и используют без дальнейшей очистки на следующей стадии. МС (m/е): 301,5 (М-Н-, 100%).
б) Стадия 2: (1,1-Диоксотиоморфолин-4-ил)-[5-(1-изопропилпиперидин-4-илокси)-1Н-индол-2-ил]метанон
Аналогично методике, описанной при синтезе примера 1, стадия 3, названное в заголовке соединение синтезируют из 5-(1-изопропилпиперидин-4-илокси)-1Н-индол-2-карбоновой кислоты (хлористоводородная соль с одним экв. хлорида лития) (пример 2, стадия 1) и тиоморфолин-1,1-диоксида (предоставлен фирмой Syntec, ref. M1201). Названное в заголовке соединение получено с 75%-ным выходом в виде белого твердого вещества. МС (m/e): 420,5 (МН+, 100%).
Пример 3: (1,1-Диоксотиоморфолин-4-ил)-[1-изопропил-5-(1-изопропилпиперидин-4-илокси)-1Н-индол-2-ил]метанон
К смеси (1,1-диоксотиоморфолин-4-ил)-[5-(1-изопропилпиперидин-4-илокси)-1Н-индол-2-ил]метанона (пример 2, 100 мг, 1,0 экв.) и изопропилметансульфоната (67 мг, 2,0 экв.) в диметилформамиде (4 мл) добавляют карбонат цезия (156 мг, 2,0 экв.). Раствор перемешивают в течение 22 ч при температуре 95°С. Реакционную смесь концентрируют в вакууме и остаток распределяют между водой и метил-трет-бутиловым эфиром. Водный слой экстрагируют метил-трет-бутиловым эфиром. Объединенный органический слой промывают рассолом, высушивают над сульфатом натрия, фильтруют, концентрируют в вакууме, а затем очищают на силикагеле, элюируя смесью циклогексан/этилацетат. Выделенную фракцию высушивают в вакууме, получая 52 мг (выход 47%) требуемого продукта в виде беловатого твердого вещества. МС (m/e): 462,5 (МН+, 100%)
Пример 4: (1,1-Диоксотиоморфолин-4-ил)-[5-(1-изопропилпирролидин-3S-илокси)-1Н-индол-2-ил]метанон
а) Стадия 1: этиловый эфир 5-((S)-1-бензилпирролидин-3-илокси)-1Н-индол-2-карбоновой кислоты
К холодной (0°С) смеси этил-5-гидроксииндол-2-карбоксилата (предоставлен фирмой Biosynth, Н-6350, 20,5 г, 1,0 экв.), (R)-1-бензил-3-пирролидинола (23 г, 1,3 экв.) и три-н-бутилфосфина (58 мл, 2,0 экв.) медленно добавляют 1,1'-(азодикарбонил)дипиперидин (50,4 г, 2,0 экв.) несколькими порциями. Реакционную смесь перемешивают при комнатной температуре в течение ночи и затем отфильтровывают. Фильтрат концентрируют в вакууме и добавляют диэтиловый эфир. Осадок отфильтровывают, фильтрат концентрируют в вакууме и очищают на силикагеле, элюируя смесью дихлорметан/метанол/аммиак. Выделенную фракцию высушивают в вакууме, получая 18 мг (выход 49%) требуемого продукта в виде слегка желтой пены. МС (m/e): 365,5 (МН+, 100%).
б) Стадия 2: этиловый эфир 5-((S)-1-изопропилпирролидин-3-илокси)-1Н-индол-2-карбоновой кислоты
К смеси этилового эфира 5-((S)-1-бензилпирролидин-3-илокси)-1Н-индол-2-карбоновой кислоты (18,0 г, 1,0 экв.) и уксусной кислоты (28 мл, 10 экв.) в этаноле (500 мл) добавляют палладий на активированном угле (10 мас.%, 2,0 г, 0,04 экв.) и реакционный сосуд продувают водородом (1 атм). Реакционную смесь перемешивают в течение 18 ч при комнатной температуре, затем отфильтровывают и концентрируют в вакууме. Остаток (28,4 г) растворяют в диметилформамиде (500 мл) и добавляют карбонат калия. Смесь перемешивают в течение 15 мин при комнатной температуре. Затем добавляют 2-йодпропан (42 г, 5,0 экв.) и смесь перемешивают в течение 4 ч при температуре 50°С. Реакционную смесь отфильтровывают и фильтрат выпаривают в вакууме. Остаток растворяют в ацетоне, отфильтровывают и фильтрат выпаривают в вакууме, очищают на силикагеле, элюируя смесью дихлорметан/метанол/аммиак. Выделенную фракцию высушивают в вакууме, получая 9,3 г (выход 59%) требуемого продукта в виде слегка коричневого твердого вещества. МС (m/e): 317,4 (МН+, 100%).
в) Стадия 3: 5-((S)-1-Изопропилпирролидин-3-илокси)-1Н-индол-2-карбоновая кислота (хлористоводородная соль с 1 экв. хлорида лития)
К раствору этилового эфира 5-((S)-1-изопропилпирролидин-3-илокси)-1Н-индол-2-карбоновой кислоты (8,9 г, 1,0 экв.) в тетрагидрофуране (100 мл), воды (50 мл) и метанола (10 мл) добавляют моногидрат гидроксида лития (1,3 г, 1,10 экв.). Реакционную смесь нагревают с обратным холодильником в течение ночи, а затем концентрируют в вакууме. Остаток подкисляют (рН 2) хлористоводородной кислотой (2-нормальной). Образовавшуюся смесь высушивают в вакууме, получая 10,5 г (выход 100%) требуемого продукта в виде коричневой пены. МС (m/е): 287,0 (М-Н-, 100%).
г) Стадия 4: (1,1-Диоксотиоморфолин-4-ил)-[5-(1-изопропилпирролидин-3S-илокси)-1Н-индол-2-ил]метанон
Аналогично методике, описанной для синтеза примера 1, стадия 3, названное в заголовке соединение получают из 5-((S)-1-изопропилпирролидин-3-илокси)-1Н-индол-2-карбоновой кислоты (хлористоводородная соль с 1 экв. хлорида лития (пример 4, стадия 3) и тиоморфолин-1,1-диоксид (предоставлен фирмой Syntec, ref. M1201). Требуемый продукт получают с выходом 67% в виде белого твердого вещества. МС (m/е): 406,5 (МH+, 100%).
Пример 5: 5-[2-(1,1-Диоксо-1λ6-тиоморфолин-4-карбонил)-5-(1-изопропилпиперидин-4-илокси)индол-1-ил]пиридин-2-карбонитрил
К смеси (1,1-диоксотиоморфолин-4-ил)-[5-(1-изопропилпиперидин-4-илокси)-1Н-индол-2-ил]метанона (пример 2, 150 мг, 1,0 экв.), безводного ацетата меди(II) (131 мг, 2 экв.), пиридина (120 микрол, 4 экв.) в дихлорметане (3,5 мл), прибавляют пинаколовый эфир 2-цианопиридин-5-бороновой кислоты (247 мг, 3 экв.). Реакционную смесь перемешивают в течение 4 дней, а затем концентрируют в вакууме. Остаток очищают на силикагеле, элюируя смесью дихлорметан/ метанол в соотношении 98:2. Выделенную фракцию высушивают в вакууме, получая 57 мг (выход 23%) требуемого продукта в виде слегка желтого масла. МС (m/e): 522,5 (МН+, 100%).
Пример 6: [6-Бром-5-(1-изопропилпиперидин-4-илокси)-1Н-индол-2-ил]-(1,1-диоксо-1λ6-тиоморфолин-4-ил)метанон
а) Стадия 1: этиловый эфир 6-бром-5-гидрокси-1Н-индол-2-карбоновой кислоты
Раствор этилового эфира 6-бром-5-метокси-1Н-индол-2-карбоновой кислоты (8,30 г, 27,8 ммолей) (полученного согласно J. Org. Chem. 1974, 39, 3580) в 160 мл дихлорметана охлаждают до температуры -78°С. При этой температуре к раствору добавляют 55,7 мл трибромида бора (55,7 ммолей; 1-молярный раствор в дихлорметане). Раствор оставляют самопроизвольно нагреваться до комнатной температуры, после чего оставляют еще на 30 мин. Затем раствор переносят в 10%-ный водный раствор бикарбоната натрия, фазы разделяют и водную фазу трижды экстрагируют этилацетатом. Объединенные органические слои промывают водой, рассолом, высушивают над сульфатом магния, фильтруют и выпаривают. Остаток очищают с помощью ускоренной хроматографии на силикагеле, элюируя смесью н-гексан: этилацетат (в соотношении 2:1), получая 5,7 г (выход 72%) продукта в виде светло-желтого твердого вещества. МС (m/e): 282,2 (М-Н+, 100%).
б) Стадия 2: этиловый эфир 6-бром-5-(1-изопропилпиперидин-4-илокси)-1Н-индол-2-карбоновой кислоты
К суспензии 0,25 г этилового эфира (0,88 ммолей) 6-бром-5-гидрокси-1Н-индол-2-карбоновой кислоты в 5 мл тетрагидрофурана добавляют 0,15 г (1,05 ммолей) 1-изопропилпиперидин-4-ола (коммерчески доступен) и 0,28 г (1,07 ммолей) трибутилфосфина. Суспензию охлаждают до температуры 0°С, добавляют 0,244 г (1,06 ммолей) ди-трет-бутилазодикарбоксилата и реакцию оставляют самопроизвольно нагреваться до комнатной температуры. Через 48 ч суспензию фильтруют и фильтрат выпаривают. Остаток очищают с помощью ускоренной хроматографии на силикагеле, элюируя смесью дихлорметан: метанол (в соотношении от 100:0 до 60:40), получая 0,20 г (выход 55%) продукта в виде светло-желтой пены. МС (m/е): 409,0 (М-Н+, 100%).
в) Стадия 3: 6-Бром-5-(1-изопропилпиперидин-4-илокси)-1Н-индол-2-карбоновая кислота (хлористоводородная соль в смеси с хлоридом лития)
Смесь этилового эфира 6-бром-5-(1-изопропилпиперидин-4-илокси)-1Н-индол-2-карбоновой кислоты (3,4 г, 1,0 экв.) и гидроксида лития (249 мг, 1,25 экв.) в смеси тетрагидрофурана (170 мл) с водой (85 мл) нагревают с обратным холодильником в течение 2 ч, а затем растворители удаляют в вакууме и доводят рН приблизительно до 2. Суспензию высушивают азеотропной перегонкой воды (с толуолом), получая 3,95 г требуемого продукта в виде светло-желтого твердого вещества, которое используют без дальнейшей очистки. МС (m/e): 416,5 (М-Н+, 100%).
г) Стадия 4: [6-Бром-5-(1-изопропилпиперидин-4-илокси)-1Н-индол-2-ил]-(1,1-диоксо-1λ6-тиоморфолин-4-ил)метанон
Аналогично методике, описанной для синтеза примера 1, стадия 3, названное в заголовке соединение получают из 6-бром-5-(1-изопропилпиперидин-4-илокси)-1Н-индол-2-карбоновой кислоты (хлористоводородная соль в смеси с хлоридом лития) (пример 6, стадия 3) и тиоморфолин-1,1-диоксида (предоставлен фирмой Syntec, ref. M1201). Требуемый продукт получают с выходом 60% в виде светло-желтого твердого вещества. МС (m/е): 499,5 (МН+ 100%).
Пример 7: [6-Бром-1-изопропил-5-(1-изопропилпиперидин-4-илокси)-1Н-индол-2-ил]-(1,1-диоксо-1λ6-тиоморфолин-4-ил)метанон
Аналогично методике, описанной для синтеза примера 3, названное в заголовке соединение получают из [6-бром-5-(1-изопропилпиперидин-4-илокси)-1Н-индол-2-ил]-(1,1-диоксо-1λ6-тиоморфолин-4-ил)метанона (пример 6, стадия 4) и изопропилметансульфоната. Требуемый продукт получают с выходом 69% в виде светло-желтого твердого вещества. МС (m/е): 540,3 (М+Н, 100%).
Пример 8: [6-Бром-5-(1-изопропилпиперидин-4-илокси)-1-(2,2,2-трифторэтил)-1Н-индол-2-ил]-(1,1-диоксо-1λ6-тиоморфолин-4-ил)метанон
Аналогично методике, описанной для синтеза примера 1, стадия 1, названное в заголовке соединение получают из [6-бром-5-(1-изопропилпиперидин-4-илокси)-1Н-индол-2-ил]-(1,1-диоксо-1λ6-тиоморфолин-4-ил)метанона (пример 6, стадия 4) и 2,2,2-трифторэтилтрифторметансульфоната. Требуемый продукт получают с выходом 15% в виде белого твердого вещества. МС (m/e): 580,1 (М+Н, 100%).
Пример 9: [6-Бром-1-(2-хлорпиридин-4-ил)-5-(1-изопропилпиперидин-4-илокси)-1Н-индол-2-ил]-(1,1-диоксо-1λ6-тиоморфолин-4-ил)метанон
Аналогично методике, описанной для синтеза примера 5, названное в заголовке соединение получают из [6-бром-5-(1-изопропилпиперидин-4-илокси)-1Н-индол-2-ил]-(1,1-диоксо-1λ6-тиоморфолин-4-ил)метанона (пример 6, стадия 4) и 2-хлорпиридин-4-бороновой кислоты с выходом 7% в виде белого твердого вещества. МС (m/e): 609,0 (М+Н, 100%).
Пример 10: (1,1-Диоксо-1λ6-тиоморфолин-4-ил)-[5-(1-изопропилпиперидин-4-илокси)-1-(3-трифторметилфенил)-1Н-индол-2-ил]метанон
Аналогично методике, описанной для синтеза примера 5, названное в заголовке соединение получают из (1,1-диоксотиоморфолин-4-ил)-[5-(1-изопропилпиперидин-4-илокси)-1Н-индол-2-ил]метанона (пример 2) и (3-трифторметил)фенилбороновой кислоты с выходом 77% в виде светло-желтого твердого вещества. МС (m/e): 564,5 (МН+, 100%).
Пример 11: [1-(2-Хлорпиридин-4-ил)-5-(1-изопропилпиперидин-4-илокси)-1Н-индол-2-ил]-(1,1-диоксо-1λ6-тиоморфолин-4-ил)метанон
Аналогично методике, описанной для синтеза примера 5, названное в заголовке соединение получают из (1,1-диоксотиоморфолин-4-ил)-[5-(1-изопропилпиперидин-4-илокси)-1Н-индол-2-ил]метанона (пример 2) и 2-хлорпиридин-4-бороновой кислоты с выходом 8% в виде беловатого твердого вещества. МС (m/e): 531,5 (М+, 100%).
Пример 12: рац-2-[2-(1,1-Диоксо-1λ6-тиоморфолин-4-карбонил)-5-(1-изопропилпиперидин-4-илокси)индол-1-ил]пропионитрил
Аналогично методике, описанной для синтеза примера 1, стадия 1, названное в заголовке соединение получают из (1,1-диоксотиоморфолин-4-ил)-[5-(1-изопропилпиперидин-4-илокси)-1Н-индол-2-ил]метанона (пример 2) и 2-бромпропионитрила с выходом 20% в виде светло-желтой пены. МС (m/e): 473,6 (МН+, 100%).
Пример 13: (1,1-Диоксо-1λ6-тиоморфолин-4-ил)-[5-(1-изопропилпиперидин-4-илокси)-1-пиримидин-5-ил-1Н-индол-2-ил]метанон
К смеси (1,1-диоксотиоморфолин-4-ил)-[5-(1-изопропилпиперидин-4-илокси)-1Н-индол-2-ил]метанона (пример 2, 1 г, 1,0 экв.), транс-1,2-диаминоциклогексана (186 микрол, 0,65 экв.), йодида меди (I) (54 мг, 0,12 экв.), фосфата калия (1,06 г, 2,1 экв.) и карбоната калия (692 мг, 2,1 экв.) в диоксане (20 мл) добавляют 5-бромпиримидин (417 мг, 1,1 экв.). Реакционную смесь перемешивают в течение 5 дней и затем концентрируют в вакууме, после чего остаток очищают на силикагеле, элюируя смесью дихлорметан/метанол в соотношении 98:2. Выделенную фракцию высушивают в вакууме, получая 158 мг (выход 13%) требуемого продукта в виде светло-желтого масла. МС (m/e): 498,6 (MH+, 100%).
Пример 14: [6-Бром-5-(1-изопропилпиперидин-4-илокси)-1-(2-метоксиэтил)-1Н-индол-2-ил]-(1,1-диоксо-1λ6-тиоморфолин-4-ил)метанон
Аналогично методике, описанной для синтеза примера 1, стадия 1, названное в заголовке соединение получают из [6-бром-5-(1-изопропилпиперидин-4-илокси)-1Н-индол-2-ил]-(1,1-диоксо-1λ6-тиоморфолин-4-ил)метанона (пример 6, стадия 4) и (2-бромэтил)метилового эфира с выходом 70% в виде белой пены. МС (m/е): 556,3 (М+Н, 100%).
Пример 15: [6-Бром-5-(1-изопропилпиперидин-4-илокси)-1-(3-метоксипропил)-1Н-индол-2-ил]-(1,1-диоксо-1λ6-тиоморфолин-4-ил)метанон
Аналогично методике, описанной для синтеза примера 1, стадия 1, названное в заголовке соединение получают из [6-бром-5-(1-изопропилпиперидин-4-илокси)-1Н-индол-2-ил]-(1,1-диоксо-1λ6-тиоморфолин-4-ил)метанона (пример 6, стадия 4) и 1-бром-3-метоксипропана с выходом 65% в виде светло-желтой пены. МС (m/e): 570,4 (М+Н, 70%).
Пример 16: [6-Бром-1-(2-гидроксиэтил)-5-(1-изопропилпиперидин-4-илокси)-1Н-индол-2-ил]-(1,1-диоксо-1λ6-тиоморфолин-4-ил)метанон
а) стадия 1: [6-Бром-1-[2-(трет-бутилдиметилсиланилокси)этил]-5-(1-изопропилпиперидин-4-илокси)-1Н-индол-2-ил]-(1,1-диоксо-1λ6-тиоморфолин-4-ил)метанон
Аналогично методике, описанной для синтеза примера 1, стадия 1, названное в заголовке соединение получают из [6-бром-5-(1-изопропилпиперидин-4-илокси)-1Н-индол-2-ил]-(1,1-диоксо-1λ6,-тиоморфолин-4-ил)метанона (пример 6, стадия 4) и (2-бромэтокси)-трет-бутилдиметилсилана с выходом 50% в виде бесцветного масла. МС (m/e): 656,4 (М+Н, 50%).
б) стадия 2: [6-Бром-1-(2-гидроксиэтил)-5-(1-изопропилпиперидин-4-илокси)-1Н-индол-2-ил]-(1,1-диоксо-1λ6-тиоморфолин-4-ил)метанон
Смесь [6-бром-1-[2-(трет-бутилдиметилсиланилокси)этил]-5-(1-изопропилпиперидин-4-илокси)-1Н-индол-2-ил]-(1,1-диоксо-1λ6-тиоморфолин-4-ил)метанона (130 мг, 1,0 экв.) и трифторуксусной кислоты в дихлорметане перемешивают в течение 1 ч при комнатной температуре и концентрируют в вакууме. Сырую смесь распределяют между водным раствором гидроксида натрия и дихлорметаном. Водный слой экстрагируют дихлорметаном. Объединенные органические слои промывают рассолом, высушивают над сульфатом натрия, фильтруют и выпаривают в вакууме, получая 106 мг (выход 99%) требуемого продукта в виде белой пены. МС (m/e): 542,1 (М+Н, 100%).
Пример 17: [6-Бром-1-(3-гидроксипропил)-5-(1-изопропилпиперидин-4-илокси)-1Н-индол-2-ил]-(1,1-диоксо-1λ6-тиоморфолин-4-ил)метанон
а) Стадия 1: [6-Бром-1-[3-(трет-бутилдиметилсиланилокси)пропил]-5-(1-изопропилпиперидин-4-илокси)-1Н-индол-2-ил]-(1,1-диоксо-1λ6-тиоморфолин-4-ил)метанон
Аналогично методике, описанной для синтеза примера 1, стадия 1, названное в заголовке соединение получают из [6-бром-5-(1-изопропилпиперидин-4-илокси)-1Н-индол-2-ил]-(1,1-диоксо-1λ6-тиоморфолин-4-ил)метанона (пример 6, стадия 4) и (3-бромпропокси)-трет-бутилдиметилсилана с выходом 65% в виде бесцветного масла. МС (m/e): 670,5 (М+Н, 100%).
б) Стадия 2: [6-Бром-1-(3-гидроксипропил)-5-(1-изопропилпиперидин-4-илокси)-1Н-индол-2-ил]-(1,1-диоксо-1λ6-тиоморфолин-4-ил)метанон
Аналогично методике, описанной для синтеза примера 16, стадия 1, названное в заголовке соединение получают из [6-бром-1-[3-(трет-бутилдиметилсиланилокси)пропил]-5-(1-изопропилпиперидин-4-илокси)-1Н-индол-2-ил]-(1,1-диоксо-1λ6-тиоморфолин-4-ил)метанона (пример 17, стадия 1) с выходом 99% в виде белой пены. МС (m/e): 556,5 (М+Н, 70%).
Примеры 18 и 19: (S)-2-[2-(1,1-Диоксо-λ6-тиоморфолин-4-карбонил)-5-(1-изопропилпиперидин-4-илокси)индол-1-ил]пропионитрил и (R)-2-[2-(1,1-диоксо-1λ6-тиоморфолин-4-карбонил)-5-(1-изопропилпиперидин-4-илокси)индол-1-ил]пропионитрил
Рацемическую смесь рац-2-[2-(1,1-диоксо-1λ6-тиоморфолин-4-карбонил)-5-(1-изопропилпиперидин-4-илокси)индол-1-ил]пропионитрила (пример 12, 190 мг) в этаноле (8 мл) разлагают с помощью хиральной хроматографии, используя DAICEL Chiralcel OD со смесью этанол/гептан в соотношении 25:75. Две фракции противоположного оптического вращения выделяют и высушивают в вакууме.
Фракция 1, отрицательное вращение при 220 нм, 60 мг желтого твердого вещества, (32%) МС (m/е): 473,5 (МН+, 100%).
Фракция 2, положительное вращение при 220 нм, 84 мг твердого желтого вещества, (44%) МС (m/е): 473,5 (МН+, 100%).
Пример 20: [5-(1-Циклобутилпиперидин-4-илокси)-1-изопропил-1Н-индол-2-ил]-(1,1-диоксо-1λ6-тиоморфолин-4-ил)метанон
а) Стадия 1: этиловый эфир 5-бензилокси-1-изопропил-1Н-индол-2-карбоновой кислоты
К смеси этилового эфира 5-бензилоксииндол-2-карбоновой кислоты (30 г, 1,0 экв.) и карбоната цезия (58 г, 1,75 экв.) в ацетонитриле (200 мл) добавляют изопропилметансульфонат (24,8 г, 1,75 экв.). Реакционную смесь нагревают с обратным холодильником в течение 18 ч, а затем концентрируют в вакууме. Остаток распределяют между водой и метил-трет-бутиловым эфиром. Водный слой экстрагируют метил-трет-бутиловым эфиром и объединенные органические слои промывают рассолом, высушивают над сульфатом натрия, фильтруют и высушивают в вакууме, затем очищают на силикагеле, элюируя смесью дихлорметан/метанол в соотношении 98:2. Сырое вещество очищают с помощью кристаллизации в метаноле и высушивают в вакууме, получая 31 г (выход 90%) требуемого продукта в виде беловатого масла. МС (m/e): 338,4 (МН+, 100%).
б) Стадия 2: 5-Бензилокси-1-изопропил-1Н-индол-2-карбоновая кислота
Этиловый эфир 5-бензилокси-1-изопропил-1Н-индол-2-карбоновой кислоты (47,5 г, 1,0 экв.) и гидроксид лития (6,56 г, 1,1 экв.) в смеси тетрагидрофурана (360 мл), воду (180 мл) и метанол (120 мл) нагревают с обратным холодильником в течение 2 ч, а затем реакционную смесь концентрируют в вакууме. Остаток энергично перемешивают в водном растворе хлористоводородной кислоты (2-нормальный, конечное значение рН 2). Осадок белого цвета фильтруют, промывают водой, а затем высушивают в вакууме, получая 41,6 г (выход 96%) требуемого продукта в виде белого масла. МС (m/e): 308,5 (М-Н, 100%).
в) Стадия 3: 5-Гидрокси-1-изопропил-1Н-индол-2-карбоновая кислота
Смесь 5-бензилокси-1-изопропил-1Н-индол-2-карбоновой кислоты (41,6 г, 1,0 экв.) и палладия на активированном угле (10%-ный, 4,3 г, 0,03 экв.) в этилацетате (330 мл) и этаноле (235 мл) продувают водородом, затем энергично перемешивают в течение 2,5 ч при комнатной температуре. Образовавшуюся вновь суспензию фильтруют через слой дикалита. Остаток на фильтре промывают смесью этилацетата и этанола, а затем жидкость выпаривают в вакууме, получая 26,3 г (количественный выход) требуемого продукта в виде беловатого масла. МС (m/е): 218,2 (М-Н, 100%).
г) Стадия 4: (1,1-Диоксо-1λ6-тиоморфолин-4-ил)-(5-гидрокси-1-изопропил-1Н-индол-2-ил)метанон
Аналогично методике, описанной для синтеза примера 1, стадия 3, названное в заголовке соединение получают из 5-гидрокси-1-изопропил-1Н-индол-2-карбоновой кислоты (пример 20, стадия 3) и тиоморфолин-1,1-диоксида (предоставлен фирмой Syntec, ref. M1201) с выходом 75% в виде белого твердого вещества. МС (m/e): 335,5 (М-Н, 100%).
д) Стадия 5: трет-бутиловый эфир 4-[2-(1,1-диоксо-1λ6-тиоморфолин-4-карбонил)-1-изопропил-1Н-индол-5-илокси]пиперидин-1-карбоновой кислоты
К холодной (0°С) смеси (1,1-диоксо-1λ6-тиоморфолин-4-ил)-(5-гидрокси-1-изопропил-1Н-индол-2-ил)метанона (890 мг, 1,0 экв.), 1-трет-бутилоксикарбонил-4-гидроксипиперидина (659 мг, 1,2 экв.) и трифенилфосфина (858 мг, 1,2 экв.) в тетрагидрофуране (6 мл) добавляют по каплям раствор ди-трет-бутилазодикарбоксилата (746 мг, 1,0 экв.) в тетрагидрофуране (4 мл). Реакционную смесь перемешивают в течение 15 ч при комнатной температуре, концентрируют в вакууме, затем очищают на силикагеле, элюируя смесью циклогексан/этилацетат.
Фракцию выделяют, получая 434 мг (выход 31,6%) требуемого продукта в виде белого масла. МС (m/e): 520,7 (МН+, 100%).
е) Стадия 6: (1,1-Диоксо-1λ6-тиоморфолин-4-ил)-[1-изопропил-5-(пиперидин-4-илокси)-1Н-индол-2-ил]метанон
К холодной (0°С) смеси трет-бутилового эфира 4-[2-(1,1-диоксо-1λ6-тиоморфолин-4-карбонил)-1-изопропил-1Н-индол-5-илокси]пиперидин-1-карбоновой кислоты (410 мг, 1,0 экв.) в дихлорметане (8 мл) добавляют по каплям трифторуксусную кислоту (920 мг, 10 экв.). Смесь перемешивают в течение ночи при комнатной температуре, а затем концентрируют в вакууме. Остаток распределяют между водным раствором карбоната калия и этилацетатом. Водный слой экстрагируют этилацетатом и объединенные органические слои высушивают над сульфатом натрия, фильтруют и высушивают в вакууме. Остаток затем очищают на силикагеле, элюируя смесью дихлорметан/метанол/аммиак в соотношении 95:5:0.25, получая 296 мг (выход 86%) требуемого продукта в виде беловатого масла. МС (m/е): 420,4 (МН+, 100%).
ж) Стадия 7: [5-(1-Циклобутилпиперидин-4-илокси)-1-изопропил-1Н-индол-2-ил]-(1,1-диоксо-1λ6-тиоморфолин-4-ил)метанон
К смеси (1,1-диоксо-1λ6-тиоморфолин-4-ил)-[1-изопропил-5-(пиперидин-4-илокси)-1Н-индол-2-ил]метанона (268 мг, 1,0 экв.) в уксусной кислоте (115 мг, 3,0 экв.) добавляют раствор циклобутана (90 мг, 2,0 экв.) в тетрагидрофуране (8 мл). Смесь перемешивают в течение 2 ч при температуре 55°С. Затем смесь охлаждают до комнатной температуры и добавляют триацетоксиборгидрид натрия (279 мг, 2,0 экв.). Реакционную смесь перемешивают в течение ночи при температуре 65°С. Остаток распределяют между водой и этилацетатом. Органический слой промывают водным раствором гидрокарбоната натрия, высушивают над сульфатом натрия, фильтруют и высушивают в вакууме. Затем остаток очищают на силикагеле, элюируя смесью дихлорметан/метанол и получая 97 мг (выход 32%) требуемого продукта в виде беловатого масла. МС (m/e): 474,5 (МН+, 100%).
Пример А
Покрытые оболочкой таблетки, содержащие следующие ингредиенты, могут быть получены стандартным методом:
Активный ингредиент просеивают и смешивают с микрокристаллической целлюлозой, после чего смесь гранулируют с помощью раствора поливинилпирролидона в воде. Гранулят смешивают с натрий крахмал гликолятом и стеаратом магния и запрессовывают, получая ядра массой 120 или 350 мг соответственно. Ядра лакируют с помощью водного раствора/суспензии вышеназванной пленочной оболочки.
Пример Б
Капсулы, содержащие следующие ингредиенты, могут быть получены стандартным методом:
Компоненты просеивают, смешивают и этой смесью заполняют капсулы размером 2.
Пример В
Инъекционные растворы имеют следующий состав:
Пример Г
Мягкие желатиновые капсулы, содержащие следующие ингредиенты, могут быть получены стандартным методом:
Активный ингредиент растворяют в теплом расплаве других ингредиентов, полученной смесью заполняют мягкие желатиновые капсулы соответствующего размера. Заполненные мягкие желатиновые капсулы обрабатывают согласно обычным процедурам.
Пример Д
Пакетики, содержащие следующие ингредиенты, могут быть получены стандартным методом:
Активный ингредиент смешивают с лактозой, микрокристаллической целлюлозой и натрийкарбоксиметилцеллюлозой, после чего смесь гранулируют со смесью поливинилпирролидона в воде. Гранулят смешивают со стеаратом магния и вкусовыми добавками и заполняют смесью пакетики.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ХИНОЛИНА | 2005 |
|
RU2391338C2 |
| ПРОИЗВОДНЫЕ НАФТАЛИНА, ПРИГОДНЫЕ В КАЧЕСТВЕ ЛИГАНДОВ РЕЦЕПТОРОВ 3 ГИСТАМИНА | 2005 |
|
RU2387638C2 |
| ПРОИЗВОДНЫЕ ИНДОЛА В КАЧЕСТВЕ АНТАГОНИСТОВ ГИСТАМИНОВЫХ РЕЦЕПТОРОВ | 2005 |
|
RU2382778C2 |
| ПИПЕРАЗИНО[1,2-А]ИНДОЛ-1-ОНЫ И [1,4]ДИАЗЕПИНО[1,2-А]ИНДОЛ-1-ОН | 2014 |
|
RU2628126C2 |
| ПРОИЗВОДНЫЕ 2-АМИНО-ПИРИМИДИНА В КАЧЕСТВЕ ИНГИБИТОРОВ JNK | 2011 |
|
RU2572247C2 |
| ПРОИЗВОДНЫЕ БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ ФАКТОРА Ха | 2004 |
|
RU2346944C2 |
| НОВЫЕ ФЕНИЛАМИДНЫЕ ИЛИ ПИРИДИЛАМИДНЫЕ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ АГОНИСТОВ GPBAR1 | 2009 |
|
RU2533887C2 |
| ПРОИЗВОДНЫЕ СУЛЬТАМА | 2010 |
|
RU2565752C2 |
| ИНДОЛ-2-КАРБОКСАМИДЫ В КАЧЕСТВЕ ИНГИБИТОРОВ ФАКТОРА Ха И/ИЛИ VIIa, ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ИХ ОСНОВЕ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2002 |
|
RU2299881C2 |
| ПРОИЗВОДНЫЕ АЗАИНДОЛ-2-КАРБОКСАМИДА | 2006 |
|
RU2417226C2 |
Описываются соединения формулы I

где R1 выбран из группы, включающей водород, низший алкил, низший гидроксиалкил, низший алкоксиалкил, низший галогеналкил, низший цианоалкил; фенил, незамещенный или замещенный; низший фенилалкил, где фенильное кольцо может быть незамещенным или замещенным; и гетероарил, выбранный из пиридила и пиримидинила; R2 обозначает водород или галоген; G обозначает группу, выбранную из

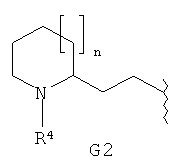 ,
,
где m обозначает 0, 1; R3 выбран из низшего алкила, циклоалкила и низшего циклоалкилалкила; n обозначает 0, 1; R4 обозначает низший алкил, а также фармацевтические композиции. Данные соединения применяются для лечения и/или профилактики болезней, ассоциируемых с модулированием Н3 рецепторов. 2 н. и 17 з.п. ф-лы, 1 табл.
1. Соединения общей формулы
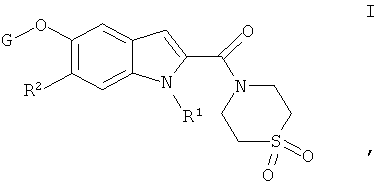
где R1 выбран из группы, включающей водород, низший алкил, низший гидроксиалкил, низший алкоксиалкил, низший галогеналкил, низший цианоалкил;
фенил, незамещенный или замещенный одной или двумя группами, независимо выбранными из низшего алкила, галогена, цианогруппы, низшего галогеналкила, низшей алкоксигруппы, низшей галогеналкоксигруппы и низшего гидроксиалкила;
низший фенилалкил, где фенильное кольцо может быть незамещенным или замещенным одной или двумя группами, независимо выбранными из низшего алкила, галогена, цианогруппы, низшего галогеналкила, низшей алкоксигруппы, низшей галогеналкоксигруппы и низшего гидроксиалкила; и
гетероарил, выбранный из пиридила и пиримидинила, незамещенный или замещенный одной или двумя группами, независимо выбранными из галогена и цианогруппы;
R2 обозначает водород или галоген;
G обозначает группу, выбранную из

 ,
,
где m обозначает 0, 1;
R3 выбран из низшего алкила, циклоалкила и низшего циклоалкилалкила;
n обозначает 0, 1;
R4 обозначает низший алкил;
и их фармацевтически приемлемые соли.
2. Соединения формулы I по п.1, где R1 выбран из группы, включающей водород, низший алкил, низший гидроксиалкил, низший алкоксиалкил, низший галогеналкил, низший цианоалкил, и
фенил, незамещенный или замещенный одной или двумя группами, независимо выбранными из низшего алкила, галогена, цианогруппы, низшего галогеналкила, низшей алкоксигруппы, низшей галогеналкоксигруппы и низшего гидроксиалкила.
3. Соединения формулы I по п.1, где R1 выбран из группы, включающей водород, низший алкил и низший галогеналкил.
4. Соединения формулы I по п.1, где R1 обозначает водород.
5. Соединения формулы I по п.1, где R1 обозначает низший галогеналкил.
6. Соединения формулы I по п.1, где R1 обозначает низший цианоалкил.
7. Соединения формулы I по п.1, где R1 обозначает гетероарил, выбранный из пиридила и пиримидинила, незамещенный или замещенный одной или двумя группами, независимо выбранными из галогена и цианогруппы.
8. Соединения формулы I по п.1, где R2 обозначает водород.
9. Соединения формулы I по п.1, где R2 обозначает галоген.
10. Соединения формулы I по п.1, где G обозначает

где m обозначает 0, 1, и R3 выбран из низшего алкила, циклоалкила и низшего циклоалкилалкила.
11. Соединения формулы I по п.1, где m обозначает 0 или 1, и R3 обозначает низший алкил.
12. Соединения формулы I по п.11, где R3 обозначает изопропил.
13. Соединения формулы I по п.1, где G обозначает

где n обозначает 0, 1, и R4 обозначает низший алкил.
14. Соединения формулы I по п.1, выбранные из группы, включающей:
(1,1-диоксотиоморфолин-4-ил)-[5-(1-изопропилпиперидин-4-илокси)-1-(2,2,2-трифторэтил)-1Н-индол-2-ил]метанон,
(1,1-диоксотиоморфолин-4-ил)-[5-(1-изопропилпиперидин-4-илокси)-1Н-индол-2-ил]метанон,
(1,1-диоксотиоморфолин-4-ил)-[1-изопропил-5-(1-изопропилпиперидин-4-илокси)-1Н-индол-2-ил]метанон,
(1,1-диоксотиоморфолин-4-ил)-[5-(1-изопропилпирролидин-3S-илокси)-1Н-индол-2-ил]метанон,
и их фармацевтически приемлемые соли.
15. Соединения формулы I по п.1, выбранные из группы, включающей:
5-[2-(1,1-диоксо-1λ6-тиоморфолин-4-карбонил)-5-(1-изопропилпиперидин-4-илокси)индол-1-ил]пиридин-2-карбонитрил,
[6-бром-5-(1-изопропилпиперидин-4-илокси)-1Н-индол-2-ил]-(1,1-диоксо-1λ6-тиoмopфoлин-4-ил)мeтaнoн,
[6-бром-1-изопропил-5-(1-изопропилпиперидин-4-илокси)-1Н-индол-2-ил]-(1,1-диоксо-1λ6-тиоморфолин-4-ил)метанон,
[6-бром-5-(1-изопропилпиперидин-4-илокси)-1-(2,2,2-трифторэтил)-1Н-индол-2-ил]-(1,1-диоксо-1λ6-тиoмopфoлин-4-ил)мeтaнoн,
[6-бром-1-(2-хлорпиридин-4-ил)-5-(1-изопропилпиперидин-4-илокси)-1Н-индол-2-ил]-(1,1-диоксо-1λ6-тиoмopфoлин-4-ил)мeтaнoн,
(1,1-диоксо-1λ6-тиоморфолин-4-ил)-[5-(1-изопропилпиперидин-4-илокси)-1-(3-трифторметилфенил)-1Н-индол-2-ил]метанон,
[1-(2-хлорпиридин-4-ил)-5-(1-изопропилпиперидин-4-илокси)-1Н-индол-2-ил]-(1,1-диоксо-1λ6-тиoмopфoлин-4-ил)мeтaнoн,
2-[2-(1,1-диоксо-1λ6-тиоморфолин-4-карбонил)-5-(1-изопропилпиперидин-4-илокси)индол-1-ил]пропионитрил,
(1,1-диоксо-1λ6-тиоморфолин-4-ил)-[5-(1-изопропилпиперидин-4-илокси)-1-пиримидин-5-ил-1Н-индол-2-ил]метанон,
[6-бром-5-(1-изопропилпиперидин-4-илокси)-1-(2-метоксиэтил)-1Н-индол-2-ил]-(1,1-диоксо-1λ6-тиoмopфoлин-4-ил)мeтaнoн,
[6-бром-5-(1-изопропилпиперидин-4-илокси)-1-(3-метоксипропил)-1Н-индол-2-ил]-(1,1-диоксо-1λ6-тиоморфолин-4-ил)метанон,
[6-бром-1-(2-гидроксиэтил)-5-(1-изопропилпиперидин-4-илокси)-1Н-индол-2-ил]-(1,1-диоксо-1λ6-тиoмopфoлин-4-ил)мeтaнoн,
[6-бром-1-(3-гидроксипропил)-5-(1-изопропилпиперидин-4-илокси)-1Н-индол-2-ил]-(1,1-диоксо-1λ6-тиoмopфoлин-4-ил)мeтaнoн,
(S)-2-[2-(1,1-диоксо-1λ6-тиоморфолин-4-карбонил)-5-(1-изопропилпиперидин-4-илокси)индол-1-ил]пропионитрил,
(R)-2-[2-(1,1-диоксо-1λ6-тиоморфолин-4-карбонил)-5-(1-изопропилпиперидин-4-илокси)индол-1-ил]пропионитрил,
[5-(1-циклобутилпиперидин-4-илокси)-1-изопропил-1Н-индол-2-ил]-(1,1-диоксо-1λ6-тиoмopфoлин-4-ил)мeтaнoн,
и их фармацевтически приемлемые соли.
16. Фармацевтические композиции, обладающие антагонистической и/или обратной агонистической активностью в отношении рецептора гистамина 3 (H3R), включающие соединение по п.1, а также фармацевтически приемлемый носитель и/или наполнитель.
17. Фармацевтические композиции по п.16 для лечения и/или профилактики болезней, ассоциируемых с модулированием Н3 рецепторов.
18. Соединения по п.1, обладающие антагонистической и/или обратной агонистической активностью в отношении рецептора гистамина 3 (H3R), для применения в качестве терапевтически активных веществ.
19. Соединения по п.1, обладающие антагонистической и/или обратной агонистической активностью в отношении рецептора гистамина 3 (H3R), для применения в качестве терапевтически активных веществ для лечения и/или профилактики заболеваний, ассоциированных с модулированием Н3 рецепторов.
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| EP 0978512 A1, 09.02.2000 | |||
| Производные индола как ингибиторы фактора Ха | 1998 |
|
RU2225397C2 |
Авторы
Даты
2011-02-20—Публикация
2006-11-20—Подача