Настоящее изобретение относится к соединениям формулы I
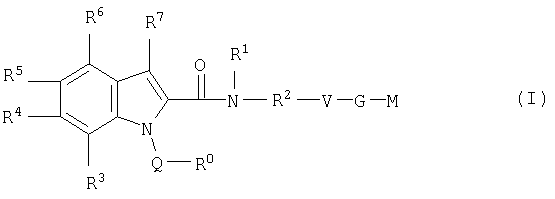
в которой R0; R1; R2; R3; R4; R5; R6; R7; Q; V, G и М имеют значения, указанные ниже. Соединения формулы I представляют собой ценные фармакологически активные соединения. Они проявляют значительный антитромботический эффект и являются пригодными, например, при лечении и профилактике сердечно-сосудистых расстройств, таких как тромбоэмболические заболевания или рестенозы. Они представляют собой обратимые ингибиторы фактора Ха (Fxa) и/или фактора VIIa (FVIIa), ферментов свертывания крови, и могут в общем случае применяться в условиях, в которых присутствует нежелательная активность фактора Ха и/или фактора VIla, или для лечения или предотвращения которых намереваются осуществить ингибирование фактора Ха и/или фактора VIla. Изобретение, кроме того, относится к способам получения соединений формулы I, их применению особенно в качестве активных ингредиентов фармацевтических средств и включающим их фармацевтическим препаратам.
Нормальный гемостаз является результатом сложного баланса между процессами инициации свертывания, образования и растворения сгустков. Сложные взаимодействия между клетками крови, специфическими белками плазмы и поверхностью сосудов поддерживают текучесть крови, пока не происходит повреждение и потеря крови (ЕР-А-987274). Многие значительные болезненные состояния относят к аномальному гемостазу. Например, местное образование тромба вследствие разрыва атеросклеротической бляшки представляет собой основную причину острого инфаркта миокарда и нестабильной стенокардии. Лечение окклюзивного коронарного тромба посредством либо тромболитического лечения или чрескожной ангиопластики могут сопровождаться острой тромболитической закупоркой пораженного сосуда.
Сохраняется потребность в безопасных и эффективных терапевтических антикоагулянтах для ограничения или предотвращения образования тромба. Наиболее желательна разработка средств, которые ингибируют коагуляцию без непосредственного ингибирования тромбина, но ингибируя другие стадии в каскаде коагуляции, такие как активность фактора Ха и/или фактора VIIa. В настоящее время полагают, что ингибиторы фактора Ха приводят к меньшему риску кровотечения, чем ингибиторы тромбина (А.Е.Р. Adang & J.B.M. Rewinkel, Drugs of the Future 2000, 25, 369-383).
Низкомолекулярные, специфические по отношению к фактору Ха ингибиторы свертывания крови, которые являются эффективными, но не вызывают нежелательных побочных эффектов, описаны, например, в WO-A-95/29189. Однако, представляя собой эффективный специфический по отношению к фактору Ха ингибитор свертывания крови, кроме того, желательно, чтобы такие ингибиторы также обладали дальнейшими преимущественными свойствами, например стабильностью в плазме и печени и селективностью по отношению к другим сериновым протеазам, ингибирование которых не подразумевается, таких как тромбин. Существует постоянная потребность в дальнейших специфических по отношению к фактору Ха ингибиторах свертывания крови, которые являются эффективными и также имеют вышеперечисленные преимущества.
Специфическое ингибирование каталитического комплекса фактор VIIa/тканевый фактор с использованием моноклональных антител (WO-A-92/06711) или белка, такого как инактивированный хлорметилкетоном фактор VIIa (WO-A-96/12800, WO-A-97/47651), представляет собой крайне эффективное средство контроля образования тромба, вызванного острым артериальным повреждением или тромботическими осложнениями, относящимися к бактериальной септицемии. Существует также экспериментальное доказательство, позволяющее предположить, что ингибирование активности комплекса фактор VIIa/тканевый фактор ингибирует рестеноз после баллонной ангиопластики. Исследования кровотечения были проведены на бабуинах и показали, что ингибирование комплекса фактор VIIa/тканевый фактор имеет наиболее широкое окно безопасности по отношению к терапевтической эффективности и риску кровотечения любого тестированного антикоагулянтного подхода, включая ингибирование тромбина, тромбоцитов и фактора Ха. Некоторые ингибиторы фактора VIIa уже описаны. ЕР-А-987274, например, раскрывает соединения, содержащие трипептидный блок, который ингибирует фактор VIIa. Однако собственный профиль данных соединений все еще не является идеальным и существует постоянная потребность в дальнейших низкомолекулярных ингибирующих фактор VIIa ингибиторах свертывания крови. WO-A-99/33800 раскрывает производные индола, которые ингибируют активность фактора Ха.
Настоящее изобретение удовлетворяет вышеуказанным требованиям, предоставляя новые соединения формулы I, которые проявляют лучшую ингибирующую активность по отношению к фактору Ха и/или фактору VIIa и представляют собой благоприятные средства с высокой биодоступностью.
Таким образом, настоящее изобретение относится к соединениям формулы I

где R0 представляет собой
1. моноциклический или бициклический 6-14-членный арил, где арил моно-, ди- или тризамещен независимо один от другого радикалом R8,
2. моноциклический или бициклический 4-14-членный гетероарил из группы, состоящей из пиридила, пиримидинила, индолила, изоиндолила, индазолила, фталазинила, хинолила, изохинолила, бензотиофена, хиназолинила и фенилпиридила, где указанный гетероарил является незамещенным или моно-, ди- или тризамещен независимо один от другого радикалом R8, или
3. моноциклический или бициклический 4-14-членный гетероарил, содержащий один, два, три или четыре гетероатома, выбранных из азота, серы или кислорода, где указанный гетероарил является незамещенным или моно-, ди- или тризамещен независимо один от другого радикалом R8, и который дополнительно замещен моноциклическим или бициклическим 4-14-членным гетероарилом, содержащим один, два, три или четыре гетероатома, выбранных из азота, серы или кислорода, где гетероарил является незамещенным или моно-, ди- или тризамещен независимо один от другого радикалом R8,
R8 представляет собой
1. галоген,
2. -NO2,
3. -CN,
4. -C(O)-NH2,
5. -ОН,
6. -NH2,
7. -OCF3,
8. моноциклический или бициклический 4-14-членный арил, где арил моно-, ди- или тризамещен независимо один от другого галогеном или -О-(C1-C8)алкилом,
9. -(C1-C8) алкил, где алкил является незамещенным или моно-, ди- или тризамещен независимо один от другого галогеном, NH2, -ОН или остатком метокси, или
10. -О-(C1-C8) алкил, где алкил является незамещенным или моно-, ди- или тризамещен независимо один от другого галогеном, NH2, -ОН или остатком метокси,
при условии, что R8 представляет собой, по меньшей мере, один галоген, -C(O)-NH2 или остаток -О-(C1-C8) алкила, если R0 представляет собой моноциклический или бициклический 6-14-членный арил,
Q представляет собой прямую связь, -С(О)-, -(C0-C2)алкилен-C(O)-NR10-, -NR10-C(O)-NR10-, -NR10-C(O)-, -SO2-, -(C1-C6)алкилен, где алкилен является незамещенным или моно-, ди- или тризамещен независимо один от другого галогеном, -NH2 или -ОН, или -(С3-С6)циклоалкилен, где циклоалкилен является незамещенным или моно-, ди- или тризамещен независимо один от другого галогеном, -NH2 или -ОН;
R1 представляет собой атом водорода, -(C1-C4)алкил, где алкил является незамещенным или замещен от одного до трех раз радикалом R13, или моноциклический или бициклический 4-14-членный гетероарил, где указанный гетероарил является незамещенным или моно-, ди- или тризамещен независимо один от другого радикалом R14,
R2 представляет собой прямую связь или -(C1-C4)алкилен, или R1 и R7 вместе с атомами, с которыми они связаны, могут образовывать 4-7-членную циклическую группу, содержащую до 1, 2, 3 или 4 гетероатомов, выбранных из азота, серы или кислорода, где указанная циклическая группа является незамещенной или моно-, ди- или тризамещена независимо одна от другой радикалом R14,
R1-N-R2-V может образовывать 4-7-членную циклическую группу, содержащую до 1, 2, 3 или 4 гетероатомов, выбранных из азота, серы или кислорода, где указанная циклическая группа является незамещенной или моно-, ди- или тризамещена независимо одна от другой радикалом R14,
R14 представляет собой галоген, -ОН, =O, -(C1-C8)алкил, -(С1-С4)алкокси, -NO2, -С(О)-ОН, -CN, -NH2, -С(О)-О-(C1-C4) алкил, -(C1-C8)алкилсульфонил, SO2, -С(О)-NH-(C1-C8) алкил, -C(O)-N[(С1-С8)алкил]2, -NR10-C(O)-NH-(C1-C8)алкил, -С(О)-NH2, -SR10 или -NR10-C(O)-NH-[(С1-С8)алкил]2,
где R10 представляет собой атом водорода, -(С1-С3)перфторалкил или -(C1-C6)алкил,
V представляет собой
1. 3-7-членный циклический остаток, содержащий до 1, 2, 3 или 4 гетероатомов, выбранных из азота, серы или кислорода, где указанный циклический остаток является незамещенным или моно-, ди- или тризамещен независимо один от другого радикалом R14,
2. 6-14-членный арил, где арил является незамещенным или моно-, ди- или тризамещен независимо один от другого радикалом R14, или
3. моноциклический или бициклический 4-14-членный гетероарил, где указанный гетероарил является незамещенным или моно-, ди- или тризамещен независимо один от другого радикалом R14,
G представляет собой прямую связь, - (CH2)m-NR10-SO2-NR10-(СН2)n-, -(СН2)m-СН(ОН)-(СН2)n-, -(СН2)m-, - (СН2)m-O-(СН2)n-, -(СН2)m-С(О)-NR10-(СН2)n-, -(СН2)-SO2-(СН2)n-, -(СН2)m-NR10-C(О)-NR10-(CH2)n-, -(CH2)m-NR10-C(O)-(CH2)n-, - (СН2)m-С(О)-(CH2)n-, -(СН2)-S-(СН2)n-, -(CH2)m-SO2-NR10-(CH2)n-, -(СН2)m-NR10-SO2-(СН2)n-, -(СН2)m-NR10-, -(CH2)m-O-C(O)-NR10-(CH2)n- или - (CH2)m-NR10-C(О)-О-(СН2)n-,
n и m независимо один от другого являются одинаковыми или различными и представляют собой целые числа 0, 1, 2, 3, 4, 5 или 6,
R10 представляет собой атом водорода, -(C1-С3)перфторалкил или -(C1-С6) алкил,
М представляет собой
1. атом водорода,
2. -(C1-C8)алкил, где алкил является незамещенным или моно-, ди- или тризамещен независимо один от другого радикалом R14,
3. -C(O)-NR11R12,
4. -(CH2)m-N(R10)2,
5. -(C6-C14)арил, где арил является незамещенным или моно-, ди- или тризамещен независимо один от другого радикалом R14,
6. - (C4-C14)гетероарил, где гетероарил является незамещенным или моно-, ди- или тризамещен независимо один от другого радикалом R14,
7. (С3-С7)циклоалкил, где указанный циклоалкил является незамещенным или моно-, ди- или тризамещен независимо один от другого радикалом R14, или
8. 3-7-членный циклический остаток, содержащий до 1, 2, 3 или 4 гетероатома, выбранных из азота, серы или кислорода, где указанный циклический остаток является незамещенным или моно-, ди- или тризамещен независимо один от другого радикалом R14, где R14 такой, как определено выше,
R11 и R12 являются независимо один от другого одинаковыми или различными и представляют собой
1. атом водорода,
2. - (C1-С6) алкил, где алкил является незамещенным или моно-, ди- или тризамещен независимо один от другого радикалом R13,
3. -(C6-C14)арил(C1-C4)алкил-, где алкил и арил независимо один от другого являются незамещенными или моно-, ди- или тризамещены радикалом R13,
4. -(C6-C14)арил-, где арил является незамещенным или моно-, ди- или тризамещен независимо один от другого радикалом R13,
5. -(C4-C14) гетероарил, где гетероарил является незамещенным или моно-, ди- или тризамещен независимо один от другого радикалом R13, или
6. (C4-C14)гетероарил(C1-C4)алкил-, где алкил и гетероарил независимо один от другого являются незамещенными или моно-, ди- или три замещены радикалом R13,
R11 и R12 вместе с атомом азота, с которым они связаны, могут образовывать насыщенное 5-7-членное моноциклическое гетероциклическое кольцо, которое дополнительно к атому азота может содержать один или два одинаковых или различных кольцевых гетероатома, выбранных из кислорода, серы или азота, где указанное гетероциклическое кольцо является незамещенным или моно-, ди- или тризамещено независимо одно от другого радикалом R13,
R13 представляет собой галоген, -NO2, -CN, =O, -ОН, -(C1-C8)алкил, -(C1-C8)алкокси, -CF3, фенил, фенилокси, -С(О)-O-R11, фенил (C1-C4)алкокси-, -С(О)-N-R11R12, -NR11R12, -NR10-SO2-R10, -S-R10, -SOn-R10, где n равно 1 или 2, -SO2-NR11R12 или -C(O)-R10, -(C0-C4)алкил-С(O)-O-C(R15R16)-O-C(O)-R17, -(C0-C4)алкил-С(О)-О-C(R15R16)-O-C(O)O-R17 или остаток формулы Va
где R10, R11, R12 - такие, как определено выше, и R15, R16 или R17 - такие, как определено ниже,
R15 и R16 представляют собой независимо один от другого водород, -(C1-С6)алкил или вместе с атомом углерода, с которым они связаны, могут образовывать 3-6-членное карбоциклическое кольцо, которое является незамещенным или замещено от одного до трех раз радикалом R10,
R17 представляет собой -(C1-C6)алкил, -(C1-С8)циклоалкил, -(C1-С6)алкил(C1-C8)циклоалкил, где указанный циклоалкил является незамещенным или замещен от одного до трех раз радикалом R10, и
R3, R4, R5, R6 и R7 независимо один от другого являются одинаковыми или различными и представляют собой
a) атом водорода,
b) галоген,
c) -(C1-C4)алкил, где алкил является незамещенным или замещен от одного до трех раз радикалом R13,
d) -(C1-С3)перфторалкил,
e) фенил, где фенил является незамещенным или замещен от одного до трех раз радикалом R13,
f) -О-(C1-C4)алкил, где алкил является незамещенным или замещен от одного до трех раз радикалом R13,
g) -NO2,
h) -CN,
i) -ОН,
j) фенилокси-, где фенилокси является незамещенным или замещен от одного до трех раз радикалом R13,
jj) бензилокси-, где бензилокси является незамещенным или замещен от одного до трех раз радикалом R13,
k) -C(O)-O-R11,
l) -C(O)-N-R11R12,
m) -NR11R12,
n) -NR10-SO2-R10,
o) -S-R10,
p) -SOn-R10, где n равно 1 или 2,
q) -SO2-NR11R12,
r) -C(O)-R10, где R10 такой, как определено выше,
s) -C(O)-O-C(R15R16)-O-C(O)O-R17, где R15, R16 и R17 - такие, как определено выше,
t) -C(O)-O-C(R15R16)-O-C(O)O-R17, где R15, R16 и R17 - такие, как определено выше,
u) остаток формулы Va
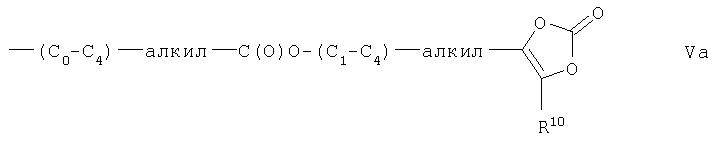
где R10 - такой, как определено выше,
v) остаток формулы Vb или Vc

w) -NR10-(C1-C4)алкил, где алкил является незамещенным или замещен от одного до трех раз радикалом R13,
х) -OCF3 или
y) остаток из следующего списка:
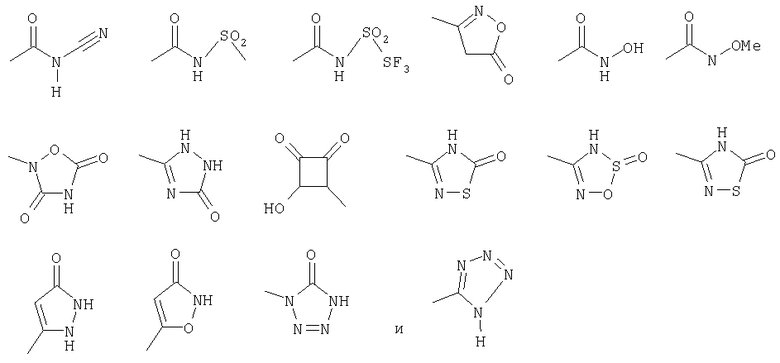
где R10, R11, R12 и R13 - такие, как определено выше,
во всех его стереоизомерных формах и их смесях в любом соотношении и к его физиологически переносимым солям.
Настоящее изобретение также относится к соединениям формулы I, где
R0 представляет собой
1. фенил, где фенил является незамещенным или моно-, ди- или тризамещен независимо один от другого радикалом R8,
2. бициклический 5-14-членный гетероарил, выбранный из группы, состоящей из индолила, изоиндолила, бензофуранила, бензотиофенила, 1,3-бензодиоксолила, индазолила, бензимидазолила, бензоксазолила, бензотиазолила, хинолинила, изохинолинила, хроманила, изохроманила, циннолинила, хиназолинила, хиноксалинила, фталазинила, пиридоимидазолила, пиридопиридинила, пиридопиримидинила, пуринила и птеридинила, где указанный гетероарил является незамещенным или моно-, ди- или тризамещен независимо один от другого радикалом R8,
и дополнительно замещен остатком, выбранным из группы, состоящей из пиридила, 2-пиридила, 3-пиридила, 4-пиридила, пирролила, 2-пирролила, 3-пирролила, фурила, 2-фурила, 3-фурила; тиенила, 2-тиенила, 3-тиенила, имидазолила, пиразолила, оксазолила, изоксазолила, тиазолила, триазолила, изотиазолила, тиадиазолила, тетразолила, пиримидинила, пиридазинила и пиразинила, где указанный остаток является незамещенным или моно-, ди- или тризамещен независимо один от другого радикалом R8,
3. моноциклический 5-14-членный гетероарил из группы, состоящей из пиридила, 2-пиридила, 3-пиридила, 4-пиридила, пирролила, 2-пирролила, 3-пирролила, фурила, 2-фурила, 3-фурила; тиенила, 2-тиенила, 3-тиенила, имидазолила, пиразолила, оксазолила, изоксазолила, тиазолила, тиадиазолила, изотиазолила, триазолила, тетразолила, пиридазинила и пиразинила, где указанный гетероарил является незамещенным или моно-, ди- или тризамещен независимо один от другого радикалом R8,
и дополнительно замещен остатком, выбранным из группы, состоящей из пиридила, 2-пиридила, 3-пиридила, 4-пиридила, пирролила, 2-пирролила, 3-пирролила, фурила, 2-фурила, 3-фурила; тиенила, 2-тиенила, 3-тиенила, имидазолила, пиразолила, оксазолила, изоксазолила, тиазолила, тиадиазолила, изотиазолила, триазолила, тетразолила, пиридазинила и пиразинила, где указанный остаток является незамещенным или моно-, ди- или тризамещен независимо один от другого радикалом R8,
R8 представляет собой
1. галоген, такой как F, Cl, Br или I,
2. -C(O)-NH2,
3. -(C1-C4)алкил, где алкил является незамещенным или моно-, ди- или тризамещен независимо один от другого галогеном, ОН или остатком метокси, или
4. -О-(C1-C4)алкил, где алкил является незамещенным или моно-, ди- или тризамещен независимо один от другого галогеном или остатком метокси,
при условии, что R8 представляет собой, по меньшей мере, один галоген, -C(O)-NH2 или остаток -О-(C1-C8)алкила, если R0 представляет собой моноциклический или бициклический 6-14-членный арил,
Q представляет собой прямую связь, -С(О)-, -SO2- или - (C1-C6)алкилен, -(С0-С2)алкилен-С(О)-NR10-,
R1 представляет собой атом водорода или -(C1-С2)алкил,
R2 представляет собой прямую связь или -(C1-C2)алкилен или
R1-N-R2-V может образовывать 5-7-членную циклическую группу, содержащую пиперидин, пиперазин, пиридин, пиримидин, пирролидин, пирролидинон, 1,2,3-триазин, 1,2,4-триазин, 1,3,5-триазин, 1,2,3-триазол, 1,2,4-триазол, тетразин, тетразол, 1,2-диазепин, 1,3-диазепин, 1,4-диазепин, азепин, кетопиперазин, оксазол, изоксазол, изоксазолидин, 2-изоксазолин, морфолин, тиазол, изотиазол, тиадиазол или тиоморфолин, где указанная циклическая группа является незамещенной или моно-, ди- или тризамещена независимо одна от другой радикалом R14,
R14 представляет собой галоген, -(C1-C4)алкил или -NH2,
V представляет собой
1. 3-7-членный циклический остаток из группы, содержащей соединения, которые являются производными азиридина, азирина, азетидина, пиррола, пирролидина, пиридонила, имидазола, пиразола, 1,2,3-триазола, 1,2,4-триазола, тетразола, пиридина, пиримидина, пиразина, 1,2,3-триазина, 1,2,4-триазина, 1,3,5-триазина, тетразина, тетразола, азепина, диазирина, 1,2-диазепина, 1,3-диазепина, 1,4-диазепина, пиридазина, пиперидина, пиперазина, пирролидинона, кетопиперазина, фурана, пирана, диоксола, оксазола, изоксазола, 2-изоксазолина, изоксазолидина, морфолина, оксирана, оксазиридина, 1,3-диоксолена, 1,2-оксазина, 1,3-оксазина, 1,4-оксазина, оксазиридина, тиофена, тиопирана, тиэтана, тиазола, изотиазола, изотиазолина, изотиазолидина, 1,2-оксатиолана, тиопирана, 1,2-тиазина, 1,3-тиазола, 1,3-тиазина, 1,4-тиазина, тиадиазина или тиоморфолина, где указанный циклический остаток является незамещенным или моно-, ди- или тризамещен независимо один от другого радикалом R14,
2. фенил, где фенил является незамещенным или моно-, ди- или тризамещен независимо один от другого радикалом R14, или
3. бициклический 5-14-членный гетероарил, из группы, содержащей хинолил, изохинолил и хиноксалинил, где указанный гетероарил является незамещенным или моно-, ди- или тризамещен независимо один от другого радикалом R14,
G представляет собой прямую связь, -(CH2)m- или -(CH2)m-NR10-,
m представляет собой целые числа 0, 1, 2, 3 или 4,
R10 представляет собой атом водорода, -(C1-С3)перфторалкил или -(C1-C4)алкил,
M представляет собой
1. атом водорода,
2. -(C6-C14)гетероарил, где гетероарил представляет собой остаток из группы, которая может являться производной пиперидина, пиперазина, пиридина, пиримидина, пирролидина, пирролидинона, пиридонила, имидазола, пиридазина, пиразина, 1,2,3-триазина, 1,2,4-триазина, 1,3,5-триазина, 1,1,3-триазола, 1,2,4-триазола, тетразина, тетразола, 1,2-диазепина, 1,3-диазепина, 1,4-диазепина, азепина, кетопиперазина, оксазола, изоксазола, изоксазолидина, 2-изоксазолина, морфолина, тиазола, изотиазола, тетрагидропирана, тиадиазола или тиоморфолина, где указанный гетероарил является незамещенным или моно-, ди- или тризамещен независимо один от другого радикалом R14,
3. -(C1-C6)алкил, где указанный алкил является незамещенным или моно-, ди- или тризамещен независимо один от другого радикалом R14, или
4. (С3-С6)циклоалкил,
R3, R4, R5, R6 и R7 независимо один от другого являются одинаковыми или различными и представляют собой
a) атом водорода,
b) F, Cl, Br,
c) -(C1-C4)алкил, где алкил является незамещенным или замещен радикалом R13,
d) -CF3,
е) фенил, где фенил является незамещенным или замещен от одного до трех раз радикалом R13,
f) -O-(C1-C4)алкил, где алкил является незамещенным или замещен радикалом R13,
g) -NO2,
h) -CN,
i) -ОН,
j) фенилокси-, где фенилокси является незамещенным или замещен радикалом R13,
jj) бензилокси-, где бензилокси является незамещенным или замещен радикалом R13,
k) -C(O)-O-R11,
l) -C(O)-N-R11R12,
m) -NR11R12,
n) -NR10-SO2-R10,
o) -SOn-R10, где n равно 1 или 2,
p) -SO2-NR11R12,
q) -C(O)-R10,
r) -C(O)-O-C(R15R16)-O-C(O)-R17, где R15, R16 и R17 - такие, как определено выше,
s) -C(O)-O-C(R15R16)-O-C(O)O-R17, где R15, R16 и R17 - такие, как определено выше
t) остаток формулы Va
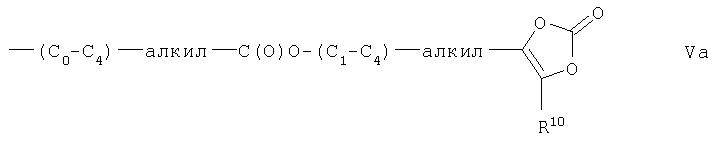
u) остаток формулы Vb или Vc

v) -OCF3 или
w) остаток из следующего списка:
R13 представляет собой галоген, -NO2, -CN,=O, -ОН, -(С1-С8)алкокси, -CF3, -C(O)-O-R11, -С(О)-N-R11R12, -NR11R12, -NR10-SO2-R10, SOn-R10, где n равно 1 или 2, -SO2-NR11R12, -C(O)-R10, -(C0-C4)алкил-С(O)-O-C(R15R16)-O-C(O)-R17, -(C0-C4)алкил-С(О)-О-C(R15R16)-O-C(O)O-R17 или остаток формулы Va
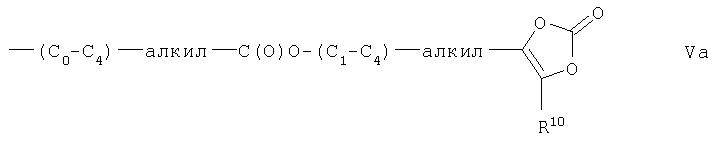
где R10, R11, R12, R15, R16 или R17 - такие, как определено выше,
во всех его стереоизомерных формах и их смесях в любом соотношении и его физиологически переносимые соли.
Настоящее изобретение также относится к соединениям формулы I, где
R0 представляет собой
1. фенил, где фенил является незамещенным или моно-, ди- или тризамещен независимо один от другого радикалом R8,
2. моноциклический 4-14-членный гетероарил, выбранный из группы, состоящей из тиенила, тиадиазолила, изоксазолила и тиазолила, где указанный гетероарил замещен остатком, выбранным из группы тиенила, 2-тиенила и 3-тиенила, где указанный остаток является незамещенным или моно- или дизамещен независимо один от другого радикалом R8,
R8 представляет собой F, Cl, Br, -ОСН3, -С(О)-NH2 или -OCF3, Q представляет собой прямую связь, -С(О)-, -SO2-, метилен или этилен,
R1 представляет собой атом водорода, R2 представляет собой прямую связь или метилен, или
R1-N-R2-V может образовывать 5-7-членную циклическую группу, содержащую пирролидин, пиперидин и пиперазин,
R13 представляет собой -C(O)-O-R11, -С(О)-N-R11R12, -NR11R12, -NR10-SO2-R10, -SOn-R10, где n равно 1 или 2, -SO2-NR11R12, -С(О)-R10, -(С0-С4)алкил-С(О)-ОС(R15R16)-O-С(О)-R17, -(С0-С4)алкил-С(О)-ОС(R15R16)-O-C(O)O-R17 или остаток формулы Va
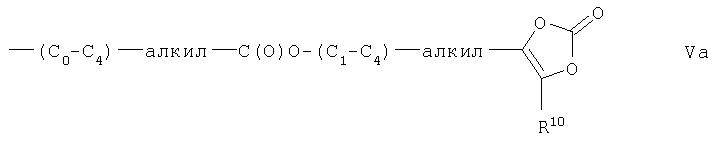
где R10, R11, R12, R15, R16 или R17 - такие, как определено выше,
R14 представляет собой галоген, метил, этил или -NH2,
V представляет собой
1. остаток из группы, содержащей соединения, которые являются производными изохинолина, хинолина, хиназолина, пиперидина, азетидина, пирролидина, тетрагидропирана, пиперазина и изоксазола, где указанный циклический остаток является незамещенным или моно- или дизамещен независимо один от другого радикалом R14, или
2. фенил, где фенил является незамещенным или моно- или дизамещен независимо один от другого радикалом R14, или
G представляет собой прямую связь, -(СН2)m- или -(CH2)m-NR10-,
m представляет собой целые числа 0, 1 или 2, R10 представляет собой атом водорода или -(C1-C4)алкил,
М представляет собой атом водорода, -(C2-C4)алкил, имидазолил, пиразолил, пирролидинил, тетрагидропиранил, пиперидинил, пиридинил, пиримидил, пиразинил, пиридазинил или (С3-С6)циклоалкил, где указанные циклические остатки являются незамещенными или моно- или дизамещены независимо один от другого радикалом R14,
R3, R4, R5, R6 и R7 независимо один от другого являются одинаковыми или различными и представляют собой
a) атом водорода,
b) F, Cl,
c) (C1-C4)алкил, где алкил является незамещенным или замещен радикалом R13,
d) фенил, где фенил является незамещенным или замещен от одного до трех раз радикалом R13,
e) -О-(C1-C4)алкил, где алкил является незамещенным или замещен радикалом R13,
f) -C(O)-O-R11,
g) -C(O)-N-R11R12,
h) -NR11R12,
i) -NR10-SO2-R10,
j) -SO2-NR11R12,
k) -C(O)-R10,
l) -С(О)-O-С(R15R16)-O-С(О)-R17, где R15, R16 и R17 - такие, как определено выше,
m) -C(O)-O-C(R15R16)-O-C(O)O-R17, где R15, R16 и R17 - такие, как определено выше,
n) остаток формулы Va
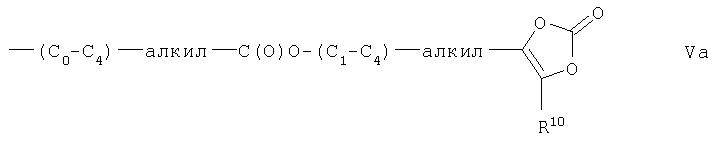
о) остаток формулы Vb или Vc

р) остаток из следующего списка:
во всех его стереоизомерных формах и их смесях в любом соотношении и его физиологически переносимые соли.
Настоящее изобретение также относится к соединениям формулы I, которые представляют собой
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-5-метансульфонил-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-5-нитро-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 5-бензилокси-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-5-метансульфонил-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 5-хлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-5-метансульфонил-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-5-метокси-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-6-метокси-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-5-метил-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-4,6-диметокси-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-5,6-диметокси-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-7-нитро-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-5-трифторметокси-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-7-метил-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-7-(2,2-диметилпропиониламино)-1H-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-4-метокси-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-3-фенил-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-6-гидрокси-5-метокси-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-4,6-дифтор-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
(1-изопропилпиперидин-4-ил)амид 7-хлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 6-хлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-5-этил-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-5-фтор-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-5-нитро-3-фенил-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил) амид 5-хлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-3-фенил-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-5,7-дифтор-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-5,7-динитро-1Н-индол-2-карбоновой кислоты,
(3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-7-метил-1Н-индол-2-карбоновой кислоты,
(3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-5-нитро-1Н-индол-2-карбоновой кислоты,
{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-ил}-[4-(пиридин-4-иламино)пиперидин-1-ил]метанон,
{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-5-нитро-1Н-индол-2-ил}-[4-(пиридин-4-иламино)пиперидин-1-ил]метанон,
{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-7-метил-1Н-индол-2-ил}-[4-(пиридин-4-иламино)пиперидин-1-ил]метанон,
{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-ил}-(4-изопропиламинопиперидин-1-ил)метанон,
{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-7-метил-1Н-индол-2-ил}-(4-изопропиламинопиперидин-1-ил)метанон,
(1-этилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-этилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-7-метил-1Н-индол-2-карбоновой кислоты,
{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-ил}-(4-пирролидин-1-илпиперидин-1-ил)метанон,
[1,4']бипиперидинил-1'-ил{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-ил}метанон,
(3-пиридин-4-ил-4,5-дигидроизоксазол-5-илметил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-ил}-(4-пиридин-4-илметилпипразин-1-ил)метанон,
(1-изопропилпиперидин-4-илметил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил] -1Н-индол-2-карбоновой кислоты,
(3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-илметил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-циклопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
[1-(тетрагидропиран-4-ил)пиперидин-4-ил)]амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-циклопентилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-циклогексилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-(3-метоксибензил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-илметил)амид 1-(3-метоксибензил)-1Н-индол-2-карбоновой кислоты,
(3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-илметил)амид 1-(3-метоксибензил)-1Н-индол-2-карбоновой кислоты,
(4-изопропиламинопиперидин-1-ил)-[1-(3-метоксибензил)-1Н-индол-2-ил]метанон,
(3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-ил)амид 1-(3-метоксибензил)-1Н-индол-2-карбоновой кислоты,
[1-(3-метоксибензил)-1Н-индол-2-ил]-[4-(пиридин-4-иламино)пиперидин-1-ил]метанон,
(1-изопропилпиперидин-4-ил)амид 4-метокси-1-(3-метоксибензил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 5-хлор-1-(3-метоксибензил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 6-метокси-1-(3-метоксибензил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-(3-метоксибензил)-5-метил-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 5-бензилокси-1-(3-метоксибензил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-(3-метоксибензил)-5-нитро-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 5-метокси-1-(3-метоксибензил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-(3-метоксибензоил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-(3-метоксибензолсульфонил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-(4-метоксифенил)-1Н-индол-2-карбоновой кислоты,
(3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-ил)амид 1-(4-метоксифенил)-1Н-индол-2-карбоновой кислоты,
(4-изопропиламинопиперидин-4-ил)-[1-(4-метоксифенил)-1Н-индол-2-ил]метанон,
(1-изопропилпиперидин-4-ил)амид 1-(3-метоксифенил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-(3-хлорфенил)-1Н-индол-2-карбоновой кислоты,
(3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-ил)амид 1-(3-хлорфенил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-илметил)амид 1-(3-хлорфенил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-(3,5-дихлорфенил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-(4-хлорфенил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-(6-хлорбензо[b]тиофен-2-илметил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)-[1,3,4]тиадиазол-2-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[3-(5-хлортиофен-2-ил)изоксазол-5-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 3-хлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 3-бром-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-(4-хлорбензил)-1Н-индол-2-карбоновой кислоты,
(3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-ил)амид 1-(4-хлорбензил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-(2,4-дихлорбензил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-(4-метоксибензил)-1Н-индол-2-карбоновой кислоты,
(4-изопропиламинопиперидин-1-ил)-[1-(4-метоксибензил)-1Н-индол-2-ил]метанон,
(1-изопропилпиперидин-4-ил)амид 1-(4-трифторметоксибензил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-(2-хлорбензил)-1Н-индол-2-карбоновой кислоты,
(3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-ил)амид 1-(2-хлорбензил)-1Н-индол-2-карбоновой кислоты,
(3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-илметил)амид 1-(2-хлорбензил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-(3,5-дихлорбензил)-1Н-индол-2-карбоновой кислоты,
[1-(3,5-дихлорбензил)-1Н-индол-2-ил]-(4-изопропиламинопиперидин-1-ил)метанон,
(1-изопропилпиперидин-4-ил)амид 3-фтор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-3-циано-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-3-циано-7-метил-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[2-(5-хлортиофен-2-ил)тиазол-5-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-(3-хлорбензил)-1Н-индол-2-карбоновой кислоты,
[1-(3-хлорбензил)-1Н-индол-2-ил]-(4-изопропиламинопиперидин-1-ил)метанон,
(1-изопропилпиперидин-4-ил)амид 1-[2-(4-хлорфенил)этил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[2-(2,4-дихлорфенил)этил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[2-(3-метоксифенил)этил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[2-(4-хлорфенил)этил]-4-метокси-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 4-бром-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-4-метил-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 5-бром-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-5-циано-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-4-трифторметил-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-4,7-диметил-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-4,7-диметокси-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 4,7-дихлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 5,7-дихлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 4-хлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(4-метилпиперазин-1-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
этиловый эфир [{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-7-метил-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусной кислоты,
[{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-7-метил-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусная кислота,
[(1-(1-этилпропил)пиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-метилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
[(1-(2,2,2-трифторэтил)пиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-формилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-карбамоилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-метансульфонилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-ацетилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
[1-(2-хлорпиримидин-4-ил)пиперидин-4-ил]амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-пиримидин-4-илпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-ил}-[4-(пиридин-4-илокси)пиперидин-1-ил]метанон,
[4-(1Н-имидазол-4-ил)фенил]амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(4-пиридин-3-ил)тиазол-2-ил]амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
[3-(пирролидин-1-карбонил)-4,5-дигидроизоксазол-5-илметил]амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изобутилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-пропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
метиловый эфир 4-({1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбонил}амино)пиперидин-1-карбоновой кислоты,
(4-изопропилпиперазин-1-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(4-этилпиперазин-1-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
пиридин-4-ил(3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
пиридин-4-ил(3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-5-нитро-1Н-индол-2-карбоновой кислоты,
(3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-3-циано-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-3,7-дийод-4-метокси-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-3,7-дициано-4-метокси-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[2-(4-хлорфенил)тиазол-4-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-(1,7-дихлоризохинолин-3-илметил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[3-(4-хлорфенил)изоксазол-5-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(4-хлорфенил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[3-(4-хлорфенил)-[1,2,4]оксадиазол-5-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[(5-хлорпиридин-2-илкарбамоил)метил]-5-метансульфонил-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[(4-хлорфенилкарбамоил)метил]-5-метансульфонил-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 5-хлор-1-[(5-хлорпиридин-2-илкарбамоил)метил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[(5-хлорпиридин-2-илкарбамоил)метил]-5-фтор-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[(5-хлорпиридин-2-илкарбамоил)метил]-5,7-дифтор-1Н-индол-2-карбоновой кислоты,
(1-этилпирролидин-3-ил)амид S-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-этилпирролидин-3-ил)амид R-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпирролидин-3-ил)амид R-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпирролидин-3-ил)амид S-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
этиловый эфир [{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-4-трифторметил-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусной кислоты,
этиловый эфир [{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-4,7-диметокси-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусной кислоты,
этиловый эфир [{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-4,7-диметокси-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусной кислоты,
этиловый эфир [{4,7-дихлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусной кислоты,
этиловый эфир [{5,7-дихлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусной кислоты,
этиловый эфир [{4-хлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусной кислоты,
[{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-4-трифторметил-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусная кислота,
[{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-4,7-диметил-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусная кислота
[{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-4,7-диметокси-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусная кислота,
[{4,7-дихлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусная кислота,
[{5,7-дихлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусная кислота,
[{4-хлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусная кислота,
изопропиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновой кислоты,
1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновая кислота,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил) изоксазол-3-илметил)-5-гидроксиметил-1Н-индол-2-карбоновой кислоты,
этиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновой кислоты,
метиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновой кислоты,
2,2-диметилпропионилоксиметиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновой кислоты,
изопропиловый эфир 1-[5-(5-хлортиофен-2-ил)-[1,3,4]тиадиазол-2-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновой кислоты,
1-[5-(5-хлортиофен-2-ил)-[1,3,4]тиадиазол-2-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1H-индол-5-карбоновая кислота,
изопропиловый эфир 1-[(4-хлорфенилкарбамоил)метил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновой кислоты,
1-[(4-хлорфенилкарбамоил)метил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновая кислота,
метиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил] -2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-4-карбоновой кислоты,
1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1H-индол-4-карбоновая кислота,
2-[(1-изопропилпиперидин-4-ил)амид] 5-амида 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2,5-дикарбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[4-хлорфенилкарбамоил)метил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-хлортиофен-2-илкарбамоил)метил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[4-хлор-2-фторфенилкарбамоил)метил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[(5-хлорпиридин-2-илкарбамоил)метил]-1Н-индол-2-карбоновой кислоты,
(3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-илметил)амид 1-[(4-хлорфенилкарбамоил)метил]-1Н-индол-2-карбоновой кислоты,
(3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-ил)амид 1-[(4-хлорфенилкарбамоил)метил]-1Н-индол-2-карбоновой кислоты,
N-(4-хлорфенил)-2-{2-[4-(пиридин-4-иламино)пиперидин-1-карбонил]индол-1-ил}ацетамид,
(1-циклопропилпиперидин-4-ил)амид 1-[(4-хлорфенилкарбамоил)метил]-1Н-индол-2-карбоновой кислоты,
N-(4-хлорфенил)-2-[2-(4-пирролидин-1-илпиперидин-1-карбонил]индол-1-ил}ацетамид,
(1-изопропилпиперидин-4-ил)амид 1-[(4-хлорфенилкарбамоил)метил]-5-нитро-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 5-амино-4-хлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-цианометилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
[1-(2-гидроксиэтил)пиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
[1-(2-метоксиэтил)пиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-карбамоилметилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-метилкарбамоилметилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
[1-(1Н-имидазол-2-илметилпиперидин-4-ил]амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
[1-(2-диметиламиноацетил)пиперидин-4-ил]амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
1-этоксикарбонилоксиэтиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновой кислоты,
1-этоксикарбонилоксиэтиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-4-карбоновой кислоты,
2,2-диметилпропионилоксиметиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-4-карбоновой кислоты,
1-(2,2-диметилпропионилокси)этиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновой кислоты,
1-(2,2-диметилпропионилокси)этиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-4-карбоновой кислоты,
5-метил-2-оксо[1,3]диоксол-4-илметил-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновой кислоты,
5-метил-2-оксо[1,3]диоксол-4-илметил-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-4-карбоновой кислоты,
1-циклогексилкарбонилоксиэтиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновой кислоты или
1-циклогексилкарбонилоксиэтиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1H-индол-4-карбоновой кислоты.
В общем случае значение любой группы, остатка, гетероатома, номера и т.д., которые могут встречаться более чем один раз в соединениях формулы I является независимым от значения данной группы, остатка, гетероатома, номера и т.д. в любом другом случае. Все группы, остатки, гетероатомы, номера и т.д., которые могут встречаться более чем один раз в соединениях формулы I, могут быть одинаковыми или различными.
Как использовано в данном описании, термин алкил следует понимать в наиболее широком смысле для обозначения углеводородных остатков, которые могут быть линейными, т.е. с прямой цепью, или разветвленными, и которые могут представлять собой ациклические или циклические остатки или включать любое сочетание ациклических и циклических субъединиц. Кроме того, термин алкил, как использовано в данном описании, точно включает насыщенные группы, также как и ненасыщенные группы, причем последние группы содержат одну или более, например одну, две или три, двойные связи и/или тройные связи, при условии, что двойные связи не расположены в циклической алкильной группе таким образом, что приводит к созданию ароматической системы. Все эти утверждения также применимы, если алкильная группа встречается в качестве заместителя у другого остатка, например в остатке алкилокси, алкилоксикарбонильном остатке или арилалкильном остатке. Примеры алкильных остатков, содержащих 1, 2, 3, 4, 5, 6, 7 или 8 атомов углерода, представляют собой метил, этил, пропил, бутил, пентил, гексил, гептил или октил, н-изомеры всех данных остатков, изопропил, изобутил, 1-метилбутил, изопентил, неопентил, 2,2-диметилбутил, 2-метилпентил, 3-метилпентил, изогексил, втор-бутил, трет-бутил, трет-пентил, втор-бутил, трет-бутил или трет-пентил.
Ненасыщенные алкильные остатки представляют собой, например, алкенильные остатки, такие как винил, 1-пропенил, 2-пропенил (=аллил), 2-бутенил, 3-бутенил, 2-метил-2-бутенил, 3-метил-2-бутенил, 5-гексенил или 1,3-пентадиенил, или алкинильные остатки, такие как этинил, 1-пропинил, 2-пропинил (=пропаргил) или 2-бутинил. Алкильные остатки могут также быть ненасыщенными, когда они замещены.
Примеры циклических алкильных остатков представляют собой циклоалкильные остатки, содержащие 3, 4, 5 или 6 кольцевых атомов углерода, как циклопропил, циклобутил, циклопентил или циклогексил, которые также могут быть замещенными и/или ненасыщенными. Ненасыщенные циклические алкильные группы и ненасыщенные циклоалкильные группы подобные, например, циклопентенилу или циклогексенилу, могут быть связаны через любой атом углерода.
Конечно, циклическая алкильная группа должна содержать, по меньшей мере, три атома углерода, и ненасыщенная алкильная группа должна содержать, по меньшей мере, два атома углерода. Таким образом, следует понимать, что такая группа, как (C1-C8)алкил, включает, среди прочего, насыщенный ациклический (C1-C8)алкил, (С3-С6)циклоалкил и ненасыщенный (C2-C8)алкил, подобный (C2-C8)алкенилу или (C2-C8)алкинилу. Аналогично следует понимать, что такая группа, как (C1-C4)алкил, включает, среди прочего, насыщенный ациклический (C1-C4)алкил и ненасыщенный (С2-С4)алкил, подобный (С2-С4)алкенилу или (С2-С4)алкинилу.
Если не указано иначе, термин алкил предпочтительно включает ациклические насыщенные углеводородные остатки, которые содержат от одного до шести углеродных атомов и которые могут быть линейными или разветвленными. Конкретная группа насыщенных ациклических алкильных остатков образована (C1-C4)алкильными остатками, такими как метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил и трет-бутил.
Если не указано иначе и безотносительно к любым конкретным заместителям, связанным с алкильными группами, которые указаны в определении соединений формулы I, алкильные группы в общем случае могут быть незамещенными или замещены одним или более, например одним, двумя или тремя, одинаковыми или различными заместителями. Любой тип заместителей, присутствующих в замещенных алкильных остатках, может присутствовать в любом желательном положении, при условии, что замещение не приводит к нестабильной молекуле. Примеры замещенных алкильных остатков представляют собой алкильные остатки, в которых один или более, например, 1, 2 или 3, атома водорода замещены атомами галогена, в частности атомами фтора.
Термин "моно- или бициклический 4-14-членный гетероарил" относится к (С4-С14)арилу, в котором один или более из 5-14 атомов кольца заменены гетероатомами, такими как азот, кислород или сера. Примерами являются азоцинил, бензимидазолил, бензофуранил, бензотиофуранил, бензотиофенил, бензоксазолил, бензотиазолил, бензотриазолил, бензотетразолил, бензизоксазолил, бензизотиазолил, бензимидазалинил, карбазолил, 4Н-карбазолил, карболинил, хроманил, хроменил, циннолинил, декагидроциннолинил, 2Н,6Н-1,5,2-дитиазинил, дигидрофуро[2,3-b]тетрагидрофуран, фуранил, фуразанил, имидазолидинил, имидазолинил, имидазолил, 1H-индазолил, индолинил, индолизинил, индолил, 3Н-индолил, изобензофуранил, изохроманил, изоиндазолил, изоиндолинил, изоиндолил, изохинолинил (бензимидазолил), изотиазолил, изоксазолил, морфолинил, нафтиридинил, октагидроизохинолинил, оксадиазолил, 1,2,3-оксадиазолил, 1,2, 4-оксадиазолил, 1,2,5-оксадиазолил, 1,3,4-оксадиазолил, оксазолидинил, оксазолил, оксазолидинил, пиримидинил, фенантридинил, фенантролинил, феназинил, фенотиазинил, феноксатиинил, феноксазинил, фталазинил, пиперазинил, пиперидинил, птеридинил, пуринил, пиранил, пиразинил, пироазолидинил, пиразолинил, пиразолил, пиридазинил, пиридооксазол, пиридоимидазол, пиридотиазол, пиридинил, пиридил, пиримидинил, пирролидинил, пирролинил, 2Н-пирролил, пирролил, хиназолинил, хинолинил, 4Н-хинолизинил, хиноксалинил, хинуклидинил, тетрагидрофуранил, тетрагидроизохинолинил, тетрагидрохинолинил, 6Н-1,2,5-тиадазинил, 1,2,3-тиадиазолил, 1,2,4-тиадиазолил, 1,2,5-тиадиазолил, 1,3,4-тиадиазолил и ксантенил. Предпочтительными являются пиридил, такой как 2-пиридил, 3-пиридил или 4-пиридил; пирролил, такой как 2-пирролил и 3-пирролил; фурил, такой как 2-фурил и 3-фурил; тиенил, такой как 2-тиенил и 3-тиенил; имидазолил, пиразолил, оксазолил, изоксазолил, тиазолил, изотиазолил, тетразолил, пиридазинил, пиразинил, пиримидинил, индолил, изоиндолил, бензофуранил, бензотиофенил, 1,3-бензодиоксолил, индазолил, бензимидазолил, бензоксазолил, бензотиазолил, хинолинил, изохинолинил, хроманил, изохроманил, циннолинил, хиназолинил, хиноксалинил, фталазинил, пиридоимидазолил, пиридопиридинил, пиридопиримидинил, пуринил и птеридинил.
Выражение "R1 и R2 вместе с атомом азота и V, с которыми они связаны, образуют 5-7-членную циклическую структуру" относится к структурам гетероциклов, которые могут быть производными соединений, таких как пиперидин, пиперазин, пиридин, пиримидин, пирролидин, пирролидинон, 1,2,3-триазин, 1,2,4-триазин, 1,3,5-триазин, 1,2,3-триазол, 1,2,4-триазол, тетразин, тетразол, 1,2-диазепин, 1,3-диазепин, 1,4-диазепин, азепин, кетопиперазин, оксазол, изоксазол, изоксазолидин, 2-изоксазолин, морфолин, тиазол, изотиазол, тиадиазол или тиоморфолин.
Выражение "3-7-членный циклический остаток, содержащий до 1, 2, 3 или 4 гетероатомов" относится к структурам гетероциклов, которые могут быть производными соединений, таких как азиридин, азирин, азетидин, пиррол, пирролидин, имидазол, пиразол, 1,2,3-триазол, 1,2,4-триазол, тетразол, пиридин, пиримидин, пиразин, 1,2,3-триазин, 1,2,4-триазин, 1,3,5-триазин, тетразин, тетразол, азепин, диазирин, 1,2-диазепин, 1,3-диазепин, 1,4-диазепин, пиридазин, пиперидин, пиперазин, пирролидинон, кетопиперазин, фуран, пиран, диоксол, оксазол, изоксазол, 2-изоксазолин, изоксазолидин, морфолин, оксиран, оксазиридин, 1,3-диоксолен, 1,2-оксазин, 1,3-оксазин, 1,4-оксазин, оксазиридин, тиофен, тиопиран, тиэтан, тиазол, изотиазол, изотиазолин, изотиазолидин, 1,2-оксатиолан, тиопиран, 1,2-тиазин, 1,3-тиазол, 1,3-тиазин, 1,4-тиазин, тиадиазин или тиоморфолин.
Выражение "R11 и R12 вместе с атомом азота, с которым они связаны, образуют насыщенное или ненасыщенное 5-7-членное моноциклическое гетероциклическое кольцо" относится к остаткам, которые могут являться производными таких соединений, как пиперидин, пиперазин, пиридин, пиримидин, пирролидин, пирролидинон, 1,2,3-триазин, 1,2,4-триазин, 1,3,5-триазин, 1,2,3-триазол, 1,2,4-триазол, тетразин, тетразол, 1,2-диазепин, 1,3-диазепин, 1,4-диазепин, азепин, кетопиперазин, оксазол, изоксазол, изоксазолидин, 2-изоксазолин, морфолин, тиазол, изотиазол, тиадиазол или тиоморфолин.
Тот факт, что многие из вышеперечисленных названий гетероциклов представляют собой химические названия ненасыщенных или ароматических циклических систем, не означает, что 4-15-членная моно- или полициклическая группа может быть производной только от соответствующей циклической системы. Названия в данном случае служат только для описания циклической системы в отношении к размеру кольца и числу гетероатомов и их относительных положений. Как объяснено выше, 4-15-членная моно- или полициклическая группа может быть насыщенной или частично ненасыщенной или ароматической и может, таким образом, являться производной не только вышеперечисленных самих гетероциклов, но также их частично или полностью гидрированных аналогов, а также их более высоконенасыщенных аналогов, если данное применимо. В качестве примеров полностью или частично гидрированных аналогов вышеперечисленных гетероциклов, от которых данная группа может происходить, могут быть приведены следующие: пирролин, пирролидин, тетрагидрофуран, тетрагидротиофен, дигидропиридин, тетрагидропиридин, пиперидин, 1,3-диоксолан, 2-имидазолин, имидазолидин, 4,5-дигидро-1,3-оксазол, 1,3-оксазолидин, 4,5-дигидро-1,3-тиазол, 1,3-тиазолидин, пергидро-1,4-диоксан, пиперазин, пергидро-1,4-оксазин (=морфолин), пергидро-1,4-тиазин (=тиоморфолин), пергидроазепин, индолин, изоиндолин, 1,2,3,4-тетрагидрохинолин, 1,2,3,4-тетрагидроизохинолин и т.д.
4-15-членная моно- или полициклическая группа может быть связана через любой углеродный атом кольца и, в случае азотсодержащих гетероциклов, через любой подходящий атом азота кольца. Таким образом, например, остаток пирролила может представлять собой 1-пирролил, 2-пирролил или 3-пирролил, остаток пирролидинила может представлять собой пирролидин-1-ил(=пирролидино), пирролидин-2-ил или пирролидин-3-ил, остаток пиридинила может представлять собой пиридин-2-ил, пиридин-3-ил или пиридин-4-ил, остаток пиперидинила может представлять собой пиперидин-1-ил (=пиперидино), пиперидин-2-ил, пиперидин-3-ил или пиперидин-4-ил. Фурил может представлять собой 2-фурил или 3-фурил, тиенил может представлять собой 2-тиенил или 3-тиенил, имидазолил может представлять собой имидазол-1-ил, имидазол-2-ил, имидазол-4-ил или имидазол-5-ил, 1,3-оксазолил может представлять собой 1,3-оксазол-2-ил, 1,3-оксазол-4-ил или 1,3-оксазол-5-ил, 1,3-тиазолил может представлять собой 1,3-тиазол-2-ил, 1,3-тиазол-4-ил или 1,3-тиазол-5-ил, пиримидинил может представлять собой пиримидин-2-ил, пиримидин-4-ил (=6-пиримидинил) или 5-пиримидинил, пиперазинил может представлять собой пиперазин-1-ил (=пиперазин-4-ил=пиперазино) или пиперазин-2-ил. Индолил может представлять собой индол-1-ил, индол-2-ил, индол-3-ил, индол-4-ил, индол-5-ил, индол-6-ил или индол-7-ил. Аналогичным образом бензимидазолильный, бензоксазолильный и бензотазолильный остатки могут быть связаны через положение 2 и через любое из положений 4, 5, 6 и 7. Хинолинил может представлять собой хинолин-2-ил, хинолин-3-ил, хинолин-4-ил, хинолин-5-ил, хинолин-6-ил, хинолин-7-ил или хинолин-8-ил, изохинолинил может представлять собой изохинолин-1-ил, изохинолин-3-ил, изохинолин-4-ил, изохинолин-5-ил, изохинолин-6-ил, изохинолин-7-ил или изохинолин-8-ил. В дополнение к связанным через любое из положений, указанных для хинолинила и изохинолинила, 1,2,3,4-тетрагидрохинолинил и 1,2,3,4-тетрагидроизохинолинил могут быть также связаны через атомы азота в положении 1 и положении 2 соответственно.
Если не указано иначе и безотносительно к любым конкретным заместителям, связанным с 4-15-членной моно- или полициклической группой или любыми другими гетероциклическими группами, которые указаны в определении соединений формулы I, 4-15-членная моно- или полициклическая группа может быть незамещенной или замещена по атомам углерода кольца одним или более, например одним, двумя, тремя, четырьмя или пятью, одинаковыми или различными заместителями, такими как (C1-C8)алкил, в частности (C1-C4)алкил, (C1-C8)алкокси, в частности (C1-C4)алкокси, (C1-C4)алкилтио, галоген, нитро, амино, ((C1-C4)алкил)карбониламино, подобно ацетиламино, трифторметил, трифторметокси, гидрокси, оксо, гидрокси(С1-С4)алкил, такие как, например, гидроксиметил или 1-гидроксиэтил или 2-гидроксиэтил, метилендиокси, этилендиокси, формил, ацетил, циано, аминосульфонил, метилсульфонил, гидроксикарбонил, аминокарбонил, (C1-C4)алкилоксикарбонил, необязательно замещенный фенил, необязательно замещенный фенокси, бензил, необязательно замещенный по фенильной группе, и т.д. Заместители могут присутствовать в любом желательном положении при условии, что данное приводит к стабильной молекуле. Конечно, оксогруппа не может присутствовать в ароматическом кольце. Каждый подходящий атом азота кольца в 4-15-членной моно- или полициклической группе может независимо от каждого другого быть незамещенным, т.е. нести атом водорода, или быть замещенным, т.е. нести заместитель, подобно (C1-C8)алкилу, например (C1-C4)алкилу, такому как метил или этил, необязательно замещенный фенил, фенил(C1-C4)алкил, например бензил, необязательно замещенный по фенильной группе, гидрокси(С2-С4)алкил, такой как, например, 2-гидроксиэтил, ацетил или другая ацильная группа, метилсульфонил или другая сульфонильная группа, аминокарбонил, (C1-C4)алкилоксикарбонил и т.д. В общем случае, в соединениях формулы I азотсодержащие гетероциклы могут также присутствовать в виде N-оксидов или четвертичных солей. Атомы серы в кольце могут быть окислены до сульфоксида или до сульфона. Таким образом, например, остаток тетрагидротиенила может присутствовать в виде остатка S,S-диоксотетрагидротиенила или остаток тиоморфолинила, подобно тиоморфолинил-4-илу, может присутствовать как 1-оксотиоморфолин-4-ил или 1,1-диоксотиоморфолин-4-ил. Замещенная 4-15-членная моно- или полициклическая группа, которая может присутствовать в конкретном положении соединений формулы I, может независимо от других групп быть замещенной заместителями, выбранными из любой желаемой подгруппы заместителей, перечисленных выше и/или в определении такой группы.
3-7-членная моноциклическая группа может быть связана через любой углеродный атом кольца и, в случае азотсодержащих гетероциклов, через любой подходящий атом азота кольца. Таким образом, например, остаток пирролила может представлять собой 1-пирролил, 2-пирролил или 3-пирролил, остаток пирролидинила может представлять собой пирролидин-1-ил (=пирролидино), пирролидин-2-ил или пирролидин-3-ил, остаток пиридинила может представлять собой пиридин-2-ил, пиридин-3-ил или пиридин-4-ил, остаток пиперидинила может представлять собой пиперидин-1-ил (=пиперидино), пиперидин-2-ил, пиперидин-3-ил или пиперидин-4-ил. Фурил может представлять собой 2-фурил или 3-фурил, тиенил может представлять собой 2-тиенил или 3-тиенил, имидазолил может представлять собой имидазол-1-ил, имидазол-2-ил, имидазол-4-ил или имидазол-5-ил, 1,3-оксазолил может представлять собой 1,3-оксазол-2-ил, 1,3-оксазол-4-ил или 1,3-оксазол-5-ил, 1,3-тиазолил может представлять собой 1,3-тиазол-2-ил, 1,3-тиазол-4-ил или 1,3-тиазол-5-ил, пиримидинил может представлять собой пиримидин-2-ил, пиримидин-4-ил (=6-пиримидинил) или 5-пиримидинил, пиперазинил может представлять собой пиперазин-1-ил (=пиперазин-4-ил=пиперазино) или пиперазин-2-ил. Если не указано иначе и безотносительно к любым конкретным заместителям, связанным с 3-7-членной моно- или полициклической группой или любыми другими гетероциклическими группами, которые указаны в определении соединений формулы I, может быть незамещенной или замещена по атомам углерода кольца одним или более, например одним, двумя, тремя, четырьмя или пятью, одинаковыми или различными заместителями, такими как (C1-C8)алкил, в частности (C1-C4)алкил, (C1-C8)алкокси, в частности (C1-C4)алкокси, (C1-C4)алкилтио, галоген, нитро, амино, ((C1-C4)алкил)карбониламино, подобно ацетиламино, трифторметил, трифторметокси, гидрокси, оксо, гидрокси-(C1-C4)алкил, такие как, например, гидроксиметил или 1-гидроксиэтил или 2-гидроксиэтил, метилендиокси, этилендиокси, формил, ацетил, циано, аминосульфонил, метилсульфонил, гидроксикарбонил, аминокарбонил, (C1-C4)алкилоксикарбонил, необязательно замещенный фенил, необязательно замещенный фенокси, бензил, необязательно замещенный по фенильной группе, и т.д. Заместители могут присутствовать в любом желательном положении при условии, что данное приводит к стабильной молекуле. Конечно, оксогруппа не может присутствовать в ароматическом кольце. Каждый подходящий атом азота кольца в 3-7-членной моноциклической группе может независимо от каждого другого быть незамещенным, т.е. нести атом водорода, или быть замещенным, т.е. нести заместитель, такой как (C1-C8)алкил, например (C1-C4)алкил, такой как метил или этил, необязательно замещенный фенил, фенил(C1-C4)алкил, например бензил, необязательно замещенный по фенильной группе, гидрокси(С2-С4)алкил, такой как, например, 2-гидроксиэтил, ацетил или другая ацильная группа, метилсульфонил или другая сульфонильная группа, аминокарбонил, (C1-C4)алкилоксикарбонил и т.д. В общем случае в соединениях формулы I азотсодержащие гетероциклы могут также присутствовать в виде N-оксидов или четвертичных солей. Атомы серы в кольце могут быть окислены до сульфоксида или до сульфона. Таким образом, например, остаток тетрагидротиенила может присутствовать в виде остатка 3,3-диоксотетрагидротиенила или остаток тиоморфолинила, подобно тиоморфолинил-4-илу, может присутствовать в виде 1-оксотиоморфолин-4-ила или 1,1-диоксотиоморфолин-4-ила. Замещенная 3-7-членная моноциклическая группа, которая может присутствовать в конкретном положении соединений формулы I, может независимо от других групп быть замещенной заместителями, выбранными из любой желаемой подгруппы заместителей, перечисленных выше и/или в определении такой группы.
Галоген представляет собой фтор, хлор, бром или йод, предпочтительно фтор, хлор или бром, особенно предпочтительно хлор или бром.
Оптически активные атомы углерода, представленные в соединениях формулы I, могут независимо друг от друга иметь R-конфигурацию или S-конфигурацию. Соединения могут быть представлены в форме чистых энантиомеров или чистых диастереомеров или в форме смесей энантиомеров и/или диастереомеров, например в форме рацематов. Настоящее изобретение относится к чистым энантиомерам или смесям энантиомеров, также как и к чистым диастереомерам или смесям диастереомеров. Изобретение включает смеси двух или более чем двух стереоизомеров формулы I и оно включает все соотношения стереоизомеров в смесях. В случае, если соединения формулы I могут быть представлены как Е изомеры или Z изомеры (или цис-изомеры или транс-изомеры) изобретение относится как к чистым Е изомерам и чистым Z изомерам, так и к смесям E/Z во всех соотношениях. Изобретение также включает все таутомерные формы соединений формулы I.
Диастереомеры, включая E/Z изомеры, могут быть разделены на индивидуальные изомеры, например, хроматографией. Рацематы могут быть разделены на два энантиомера общепринятыми способами, например хроматографией на хиральных фазах, или разделением, например, кристаллизацией диастереомерных солей, полученных с оптически активными кислотами или основаниями. Стереохимически однородные соединения формулы I могут быть также получены с использованием стереохимически однородных исходных веществ или стереоселективных реакций.
Физиологически переносимые соли соединений формулы I представляют собой нетоксичные соли, которые являются физиологически приемлемыми, в частности фармацевтически используемые соли. Такие соли соединений формулы I, содержащие кислотные группы, например карбоксильную группу СООН, представляют собой, например, соли щелочных металлов или соли щелочноземельных металлов, такие как соли натрия, соли калия, соли магния и соли кальция, а также соли с физиологически переносимыми четвертичными аммониевыми ионами, такими как тетраметиламмоний или тетраэтиламмоний, и соли присоединения кислот с аммиаком и физиологически переносимыми органическими аминами, такими как метиламин, диметиламин, триметиламин, этиламин, триэтиламин, этаноламин или трис-(2-гидроксиэтил) амин. Основные группы, содержащиеся в соединениях формулы I, например аминогруппы или гуанидиногруппы, образуют соли присоединения кислот, например, с неорганическими кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, серная кислота, азотная кислота или фосфорная кислота, или с органическими карбоновыми кислотами и сульфоновыми кислотами, такими как муравьиная кислота, уксусная кислота, щавелевая кислота, лимонная кислота, молочная кислота, яблочная кислота, янтарная кислота, малоновая кислота, бензойная кислота, малеиновая кислота, фумаровая кислота, винная кислота, метансульфоновая кислота или п-толуолсульфоновая кислота. Соединения формулы I, которые одновременно содержат основную группу и кислотную группу, например гуанидиногруппу и карбоксильную группу, могут также быть представлены в виде цвиттерионов (бетаинов), которые также включены в настоящее изобретение.
Соли соединений формулы I могут быть получены общепринятыми способами, известными специалистам в данной области, например объединением соединения формулы I с неорганической или органической кислотой или основанием в растворителе или диспергирующем средстве, или из других солей путем катионного или анионного обмена. Настоящее изобретение также включает все соли соединений формулы I, которые, вследствие низкой физиологической переносимости, не являются непосредственно подходящими для использования в фармацевтических средствах, но являются пригодными, например, в качестве промежуточных соединений для осуществления дальнейших химических модификаций соединений формулы I или в качестве исходных веществ для получения физиологически переносимых солей.
Настоящее изобретение, кроме того, включает все сольваты соединений формулы I, например гидраты или аддукты со спиртами.
Данное изобретение также включает производные и модификации соединений формулы I, например пролекарства, защищенные формы или другие физиологически переносимые производные, а также активные метаболиты соединений формулы I. Данное изобретение относится, в частности, к пролекарствам и защищенным формам соединений формулы I, которые могут быть преобразованы в соединения формулы I в физиологических условиях. Пригодные пролекарства для соединений формулы I, т.е. химически модифицированные производные соединений формулы I, обладающие свойствами, которые улучшены в желаемом направлении, например, по отношению к растворимости, биодоступности или продолжительности действия, являются известными специалистам в данной области. Более подробная информация, относящаяся к пролекарствам, может быть найдена в стандартной литературе, как, например, в Design of Prodrugs, H. Bungaard (ed.), Elsevier, 1985, Fleisher et al. Advanced Drug Delivery Reviews 19 (1996), 115-130, или H. Bungaard, Drugs of the Future 16 (1991) 443, которые все включены в настоящее описание посредством ссылки. Пригодные пролекарства для соединений формулы I представляют собой особенно ацильные пролекарства и карбаматные пролекарства ацилируемых азотсодержащих групп, таких как амино и гуанидиногруппы, а также сложноэфирные пролекарства и амидные пролекарства групп карбоновой кислоты, которые могут быть представлены в соединениях формулы I. В ацильных пролекарствах и карбаматных пролекарствах один или более, например один или два, атома водорода у атомов азота в таких группах заменены ацильной группой или карбаматом, предпочтительно (C1-С6)алкоксикарбонильной группой. Пригодные ацильные и карбаматные группы для ацильных и карбаматных пролекарств представляют собой, например, группы Rp1-CO и Rp2-O-CO-, в которых Rp1 представляет собой водород, (C1-C18)алкил, (С3-C8)циклоалкил, (С3-С8)циклоалкил(C1-C4)алкил-, (C6-C14)арил, Het-, (С6-С14)арил(С1-С4)алкил- или Het-(C1-C4)алкил-, и в которых Rp2 имеет значения, указанные для Rp1, за исключением водорода.
Особенно предпочтительные соединения формулы I представляют собой такие соединения, в которых два или более остатков определены, как указано выше для предпочтительных соединений формулы I, или остатки могут иметь одно или некоторые из конкретных обозначений остатков, данных в их общих определениях или в определениях предпочтительных соединений, приведенных выше. Все возможные сочетания определений, данных для предпочтительных определений или конкретных обозначений остатков, явно представляют собой предмет настоящего изобретения.
Также в отношении всех предпочтительных соединений формулы I все их стереоизомерные формы и их смеси в любом соотношении и их физиологически приемлемые соли определенно являются предметом настоящего изобретения, также как и их пролекарства. Аналогично также во всех предпочтительных соединениях формулы I все остатки, которые представлены более одного раза в молекуле, являются независимыми друг от друга и могут быть одинаковыми или различными.
Соединения формулы I могут быть получены с использованием методик и методов, которые сами по себе являются хорошо известными и признанными обычным специалистом в данной области. Исходные вещества или билдинг-блоки для использования в общих синтетических методиках, которые могут быть применены для получения соединений формулы I, являются легко доступными для обычного специалиста в данной области. Во многих случаях они являются коммерчески доступными или описаны в литературе. Иначе их можно получить из легко доступных соединений-предшественников по аналогии с методиками, описанными в литературе, или по методикам или аналогично методикам, описанным в данной заявке.
В общем случае соединения формулы I могут быть получены в ходе конвергентного синтеза, связыванием двух или более фрагментов, которые могут быть ретросинтетически образованы из формулы I. Более конкретно подходящим образом замещенные исходные индольные производные используют в качестве билдинг-блоков при получении соединений формулы I. В случае их коммерческой недоступности такие индольные производные могут быть получены в соответствии с хорошо известными стандартными методиками для образования индольной циклической системы, такими, например, как индольный синтез Фишера, индольный синтез Маделунга, индольный синтез, исходящий из N-хлоранилинов и 3-кетосульфидов, описанный Gassman et al., индольный синтез Бишлера, индольный синтез Рейсерта или индольный синтез Неницеску. Посредством выбора подходящих молекул-предшественников данные индольные синтезы позволяют осуществлять введения разнообразия заместителей в различные положения индольной системы, которые далее могут быть химически модифицированы, чтобы, в конечном счете, образовать молекулу формулы I, имеющую желаемую схему заместителей. В качестве одного из всесторонних обзоров, в котором можно найти многочисленные детали и литературные ссылки по химии индолов и синтетические методики для их получения, авторы ссылаются на W.J. Hoolihan (ed.), "Indoles, Part One", volume 25, 1972, из серии "The Chemistry of Heterocyclic Compounds", A. Weissberger and E.C. Taylor (ed.), John Wiley & Sons.
Примеры многих коммерчески доступных индольных производных, которые являются пригодными в качестве исходных веществ для получения соединений формулы I, представляют собой следующие (перечисленные кислоты являются коммерчески доступными в виде свободных кислот как таковых и/или в виде метиловых или этиловых эфиров): индол-2-карбоновая кислота, индол-3-карбоновая кислота, индол-3-уксусная кислота, 3-(3-индолил)пропионовая кислота, индол-2,3-дикарбоновая кислота, 3-этоксикарбонилметилиндол-2-карбоновая кислота, З-метилиндол-2-карбоновая кислота, 5-фториндол-2-карбоновая кислота, 5-хлориндол-2-карбоновая кислота, 5-броминдол-2-карбоновая кислота, 5-метоксииндол-2-карбоновая кислота, 5-гидроксииндол-2-карбоновая кислота, 5,6-диметоксииндол-2-карбоновая кислота, 4-бензилоксииндол-2-карбоновая кислота, 5-бензилоксииндол-2-карбоновая кислота, 6-бензилокси-5-метоксииндол-2-карбоновая кислота, 5-метилиндол-2-карбоновая кислота, 5-этилиндол-2-карбоновая кислота, 7-метилиндол-2-карбоновая кислота, 4-метоксииндол-2-карбоновая кислота, 6-метоксииндол-2-карбоновая кислота, 4,6-диметоксииндол-2-карбоновая кислота, 4,6-дихлорииндол-2-карбоновая кислота, 5-нитроиндол-2-карбоновая кислота, 5-метилсульфонилиндол-2-карбоновая кислота, 7-нитроиндол-2-карбоновая кислота, 7-трет-бутилкарбониламиноиндол-2-карбоновая кислота, 7-(3-трифторметилбензоиламино)индол-2-карбоновая кислота, 7-(4-метоксифенилсульфониламино)индол-2-карбоновая кислота, 5-бром-3-метилиндол-2-карбоновая кислота, 3-(2-карбоксиэтил)-6-хлориндол-2-карбоновая кислота.
Если исходные индольные производные нужно синтезировать, данное может быть осуществлено, например, в соответствии с хорошо известными синтезами индолов, приведенными выше. Ниже они кратко пояснены, однако, они являются стандартными методиками, всесторонне обсужденными в литературе и хорошо известными специалисту в данной области.
Индольный синтез Фишера включает кислотную циклизацию фенилгидразонов, например, общей формулы 2

которые могут быть получены различными способами и где R30, R31 и R32 и n могут иметь большое разнообразие значений. Кроме водорода и алкила R31 и R32 могут, в частности, означать сложноэфирные группы или метильные или этильные группы, или 2,2,2-трифторэтильные группы, несущие сложноэфирную группу, в виде заместителя, делая возможным, таким образом, введение в индольную молекулу фрагмента (СН2)р-СО, встречающегося в группах R2 и/или R3 в соединениях формулы I. В качестве примеров многих литературных ссылок, описывающих синтез индольных производных в соответствии с синтезом Фишера, кроме приведенной выше книги под редакцией Houlihan, упоминаются следующие статьи: F.G. Salituro et al., J. Med. Chem. 33 (1990) 2944; N.M. Gray et al., J. Med. Chem. 34 (1991) 1283; J.Sh. Chikvaidze et al., Khim. Geterotsikl. Soedin. (1991) 1508; S.P. Hiremath et al., Indian J. Chem. 19 (1980) 770; J. Bornstein, J. Amer. Chem. Soc. 79 (1957) 1745; S. Wagaw, В. Yang and S. Buchwald, J. Am. Chem. Soc. 121 (1999), 10251, или Y. Murakami, Y. Yokoyama, T. Miura, H. Hirasawa Y. Kamimura and M. Izaki, Heterocycles 22 (1984) 1211.
Индольный синтез Рейссерта включает восстановительную циклизацию о-нитрофенилпировиноградных кислот или их сложных эфиров, например, общей формулы 3
в которой группы R30 могут иметь большое разнообразие значений и могут быть представлены во всех положениях бензольного кольца. Индольный синтез Рейссерта приводит к производным индол-2-карбоновых кислот. Производные пировиноградной кислоты формулы 3 могут быть получены конденсацией сложных эфиров щавелевых кислот с замещенными о-нитротолуолами. В качестве литературных ссылок, кроме приведенной выше книги под редакцией Houlihan и упомянутых в ней литературных статей, приводятся, например, статьи H.G.Lindwall and G.J.Mantell, J. Org Chem. 18 (1953), 345, или Н.Burton and J.L.Stoves, J. Chem. Soc. (1937), 1726, или W. Noland, F. Buude, Org. Synth Coll. Vol. V. J. Wiley, New York, (1973) 567.
Другой способ достижения региоселективного доступа к индольной структуре включает палладиевый катализ, например о-галогенанилины (Х=Cl, Br, I) или о-трифторметансульфонилоксианилины (X=OTf) общей формулы 4 могут быть циклизованы в индолы с использованием некоторых алкинов по адаптированным методикам, описанным J. Ezquerra, С. Pedegral. С. Lamas, J. Barluenga, M. Perez, M. Garcia-Martin, J. Gonzalez, J. Org. Chem. 61 (1996), 5805, или F. Ujjainwalla, D. Warner, Tetrahedron Lett. 39 (1998) 5355 и, кроме того, A. Rodriguez, С. Koradin, W. Dohle, P. Knochel, Angew. Chem. 112 (2000) 2607; или R. Larock, E. Yum, M. Refvik, J. Org. Chem. 63 (1998) 7653; R. Larock, E. Yum, J. Am. Chem. Soc. 113 (1991) 6689; R. Larock, J. Org. Chem. 66 (2001) 412.
Альтернативно индольная структура может быть построена при использовании разнообразия кетонов в условиях палладиевого катализа путем адаптации и модификации методики, описанной С. Chen, D. Liebermann, R. Larsen, T. Verhoeven and P. Reider J. Org. Chem. 62 (1997) 2676, как указано ниже.

В соответствии с индольным синтезом Бишлера  -анилинокетоны, например, общей формулы 10
-анилинокетоны, например, общей формулы 10
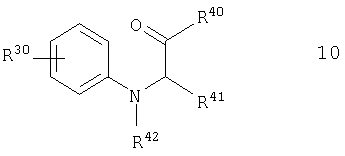
могут быть циклизованы в производные индола.
Индольный синтез Неницеску предоставляет ценный путь к производным индол-3-карбоновой кислоты, несущим гидроксигруппу в положении 5. Он включает взаимодействие парабензохинона с ∃-аминокротонатом, например, соединений формулы 11 и 12
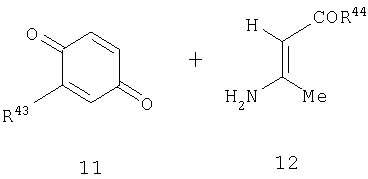
Дальнейший путь к специфически замещенным производным индола проходит через 2,3-дигидроиндолы (индолины), которые могут быть легко получены восстановлением индолов, например, гидрированием или циклизацией подходящих производных фенилэтиламина. Индолины могут претерпевать разнообразие реакций электрофильного ароматического замещения, позволяющее введение различных заместителей в бензольное ядро молекулы индола. Индолины могут далее быть дегидрированы в соответствующие индолы, например, реагентами, такими как хлоранил, или палладием вместе с акцепторм водорода. Вновь подробности данных синтезов можно найти в указанной выше книге под редакцией Houlihan.
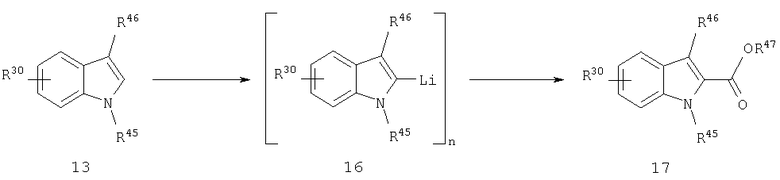
Кроме того, индолы могут быть преобразованы в соответствующие карбоновые кислоты или сложные эфиры карбоновых кислот литиированием положения 2 индолов общей формулы 13 и последующим взаимодействием с диоксидом углерода или алкилхлорформиатом в соответствии с I. Hasan, E. Marinelli, L. Lin, F. Fowler, A. Levy, J. Org. Chem. 46 (1981) 157; Т. Kline J. Heterocycl. Chem. 22 (1985) 505; J.-R. Dormoy, A. Heymes, Tetrahedron 49, (1993) 2885; E. Desarbre, S. Coudret, C. Meheust, J.-Y. Merour, Tetrahedron 53 (1997) 3637, как указано ниже:
R45 означает водород или защитную группу, подобно, например, бензолсульфонилу или трет-бутоксикарбонилу.
В зависимости от заместителей в исходных веществах в некоторых индольных синтезах могут быть получены смеси позиционных изомеров, которые, однако, могут быть разделены современными методами разделения подобно, например, препаративной ВЭЖХ.
Далее, чтобы получить желаемые заместители в бензольном ядре и в гетероциклическом ядре циклической системы индола в формуле I, функциональные группы, введенные в циклическую систему в процессе индольного синтеза, могут быть химически модифицированы. Например, индолы, несущие атом водорода в положении 2 или положении 3, могут быть также получены омылением и последующим декарбоксилированием индолов, несущих сложноэфирную группу в соответствующем положении. Группы карбоновой кислоты и группы уксусной кислоты в положении 2 или положении 3 могут быть преобразованы в их гомологи обычными реакциями для удлинения цепи карбоновых кислот. Атомы галогена могут быть введены в положение 2 или положение 3, например, взаимодействием соответствующего индолинона с галогенирующим агентом, таким как пентахлорид фосфора, аналогично способу, описанному J.C. Powers, J. Org. Chem. 31 (1966) 2627. Исходные индолиноны для такого синтеза могут быть получены из 2-аминофенилуксусных кислот. Исходные производные индола для получения соединений формулы I, несущие галогеновый заместитель в положении 3, могут также быть получены в соответствии с методиками, описанными в литературе, подобно следующей. Для фторирования производных этилового эфира 1Н-индол-2-карбоновой кислоты в положение 3 выбранным реагентом является трифлат N-фтор-2,4,6-триметилпиридиния (Т. Umemoto, S. Fukami, G. Tomizawa, К. Harazawa, К. Kawada, К. Tomita J. Am. Chem. Soc. 112 (1990) 8563). Хлорирование производных этилового эфира 1Н-индол-2-карбоновой кислоты в положение 3 реакцией с сульфурилхлоридом в бензоле приводит к получению этилового эфира 3-хлор-1Н-индол-2-карбоновой кислоты (Chem. Abstr. 1962, 344i-3442b); такой же результат может быть получен посредством NCS (D. Comins, M. Killpack, Tetrahedron Lett. 33 (1989) 4337; M. Brennan, К. Erickson, F. Szmlac, M. Tansey, J. Thornton, Heterocycles 24 (1986) 2879). Бромирование производных этилового эфира 1Н-индол-2-карбоновой кислоты в положение 3 может быть достигнуто реакцией с NBS (M. Tani, H. Ikegami, M. Tashiro, T. Hiura, H. Tsukioka, Heterocycles 34 (1992) 2349). Аналогично методикам, описанным выше, NIS может быть эффективно использован для йодирования производных этилового эфира 1Н-индол-2-карбоновой кислоты в положение 3. Кроме того, для йодирования производных этилового эфира 1Н-индол-2-карбоновой кислоты в положение 3 эффективным является применение йода (Т. Sakamoto, Т. Nagano, Y. Kondo, H. Yamanaka Chem. Pharm. Bull. 36 (1988) 2248).
В особенности группы, представленные в циклической системе индола, могут быть модифицированы рядом реакций и, таким образом, могут быть получены требуемые остатки R1a, R1b, R1c, R1d и R1e. Например, нитрогруппы могут быть восстановлены в аминогруппу различными восстанавливающими агентами, такими как сульфиды, дитиониты, комплексные гидриды, или каталитическим гидрированием. Восстановление нитрогруппы может также быть осуществлено на поздней стадии синтеза соединения формулы I, и восстановление нитрогруппы в аминогруппу может также происходить одновременно с реакцией, проводимой по другой функциональной группе, например, при взаимодействии группы, такой как цианогруппа, с сульфидом водорода или при гидрировании группы. Чтобы ввести или создать остатки R1a-e, аминогруппы могут быть далее модифицированы в соответствии со стандартными методиками алкилирования, например, взаимодействием с (замещенными) алкилгалогенидами, или посредством восстановительного аминирования карбонильных соединений в соответствии со стандартными методиками ацилирования, например, взаимодействием с активированными производными карбоновых кислот, такими как хлорангидриды кислот, ангидриды, активированные сложные эфиры или другие, или реакцией с карбоновыми кислотами в присутствии активирующего агента, или в соответствии со стандартными методиками сульфонилирования, например, реакцией с сульфонилхлоридами. Карбоновые кислоты, хлориды карбоновых кислот или сложные эфиры карбоновых кислот могут быть введены по методикам, описанным F. Santangelo, С. Casagrande, G. Norchini, F. Gerii, Synth. Commun. 23 (1993) 2717; P. Beswick, С. Greenwood, Т. Mowlem, G. Nechvatal, D. Widdowson, Tetrahedron 44 (1988) 7325; V. Collot, M. Schmitt, P. Marwah, J. Bourguignon, Heterocycles 51 (1999) 2823. Галогены или гидроксигруппы через трифлат или нонафлат, или первичные амины через их соль диазония, или после интерконверсии в соответствующий станнан, или бороновая кислота, представленная в структуре индола, могут быть преобразованы в разнообразие других функциональных групп, как, например -CN, -CF3, простые эфиры, кислоты, сложные эфиры, амиды, амины, алкильные или арильные группы, опосредованные посредством переходных металлов, а именно палладиевыми или никелевыми катализаторами или солями меди и реагентами, на которые, например, ссылаются ниже (F. Diederich, P. Stang, Metal-catalyzed Cross-coupling Reactions, Wiley-VCH, 1998; или M. Beller, С. Bolm, Transition Metals for Organic Synthesis, Wiley-VCH, 1998; J. Tsuji, Palladium Reagents and Catalysts, Wiley, 1996; J. Hartwig, Angew. Chem. 110 (1998) 2154; В. Yang, S. Buchwald, J. Organomet. Chem. 576 (1999) 125; Т. Sakamoto, К. Ohsawa, J. Chem. Soc. Perkin Trans I, (1999), 2323; D. Nichols, S. Freskas, D. Marona-Lewicka, X. Huang, B. Roth, G. Gudelsky, J. Nash, J. Med. Chem, 37 (1994), 4347; P. Lam, С. dark, S. Saubern, J. Adams, M. Winters, D. Chan, A. Combs, Tetrahedron Lett., 39 (1998) 2941; D. Chan, К. Monaco, R. Wang, M. Winters, Tetrahedron Lett., 39 (1998) 2933; V. Farina, V. Krishnamurthy, W. Scott, The Stille Reaction, Wiley, 1994; A. Klaspars, X. Huang, S. Buchwald, J. Am. Chem. Soc. 124 (2002) 7421; F. Kwong, A. Klapars, S. Buchwald, Org. Lett. 4 (2002) 581; M. Wolter, G. Nordmann, G. Job, S. Buchwald, 4 (2002) 973).
Сложноэфирные группы, представленные в бензольном ядре, могут быть гидролизованы до соответствующих карбоновых кислот, которые после активации могут далее взаимодействовать с аминами или спиртами в стандартных условиях. Простые эфирные группы, представленные в бензольном ядре, например бензилоксигруппы или другие легко отщепляемые эфирные группы, могут быть отщеплены с получением гидроксигрупп, которые далее могут взаимодействовать с различными агентами, например с агентами этерификации или активирующими агентами, что позволяет осуществлять замену гидроксигруппы другими группами. Серосодержащие группы могут взаимодействовать аналогично.
В ходе синтеза для модификации групп R50 или R8', присоединенных к циклической системе индола с применением методологии параллельного синтеза, кроме разнообразия реакций, крайне полезным может быть катализ палладием или солью меди. Такие реакции описаны, например, у F. Diederich, P. Stang, Metal-catalyzed Cross-coupling Reactions, Wiley-VCH, 1998; или M. Beller, С. Bolm, Transition Metals for Organic Synthesis, Wiley-VCH, 1998; J. Tsuji, Palladium Reagents and Catalysts, Wiley, 1996; J. Hartwig, Angew. Chem. 110 (1998) 2154; В. Yang, S. Buchwald, J. Organomet. Chem. 576 (1999) 125; P. Lam, С. Clark, S. Saubern, J. Adams, M. Winters, D. Chan, A. Combs, Tetrahedron Lett., 39 (1998) 2941; D. Chan, К. Monaco, R. Wang, M. Winters, Tetrahedron Lett., 39 (1998) 2933; J. Wolfe, H. Tomori, J. Sadight, J. Yin, S. Buchwald, J. Org. Chem. 65 (2000) 1158; V. Farina, V. Krishnamurthy, W. Scott, The Stille Reaction, Wiley, 1994; A. Klaspars, X. Huang, S. Buchwald, J. Am. Chem. Soc. 124 (2002) 7421; F. Kwong, A. Klapars, S. Buchwald, Org. Lett. 4 (2002) 581; M. Wolter, G. Nordmann, G. Job, S. Buchwald, 4 (2002) 973.
Указанные выше реакции для преобразования функциональных групп, кроме того, в общем виде, обширно описаны в учебниках по органической химии, таких как M. Smith, J. March, March's Advanced Organic Chemistry, Wiley-VCH, 2001, и в научных трудах, таких как Houben-Weyl, "Methoden der Organischen Chemie" (Methods of Organic Chemistry), Georg Thieme Verlag, Stuttgart, Germany или "Organic Reactions", John Wiley & Sons, New York, или R.C. Larock, "Comprehensive Organic Transformations", Wiley-VCH, 2nd ed (1999), В. Trost, I. Fleming (eds.) Comprehensive Organic Synthesis, Pergamon, 1991; A. Katritzky, C. Rees, E. Scriven Comprehensive Heterocyclic Chemistry II, Elsenier Science, 1996), в которых можно найти подробности реакций и первичный литературный источник. Вследствие того факта, что в настоящем случае функциональные группы присоединены к индольному кольцу, в некоторых случаях может возникнуть необходимость специфически адаптировать реакционные условия или выбрать конкретные реагенты из разнообразия реагентов, которые в принципе можно использовать в реакции преобразования или иначе предпринять конкретные меры для достижения желаемого преобразования, например, использовать методы с защитными группами. Однако нахождение подходящих реакционных вариантов и реакционных условий в таких случаях не вызывает никаких проблем для специалиста в данной области.
Структурные элементы, представленные в остатках в положении 1 индольного кольца в соединениях формулы I и в группе COR8 в положении 2 и/или в положении 3 индольного кольца могут быть введены в исходное индольное производное, получаемое, как описано выше, последовательными реакционными стадиями с использованием методологий параллельного синтеза, как и приведено ниже, с использованием методик, которые сами по себе являются хорошо известными специалисту в данной области.
Остатки R8', которые могут быть введены в формулу 14, например, конденсацией соответствующей карбоновой кислоты формулы 14 с соединением формулы HR8', т.е. с амином формулы HN(R1')R2'-V-G-M, с получением соединения формулы 15. Соединение формулы 15, полученное таким образом, может уже содержать требуемые конечные группы, т.е. группы R8' и R50 могут представлять собой группы -N(R1)R2-V-G-M и R0-Q-, как определено в формуле I или необязательно в соединении формулы 15, полученном таким образом, последовательно остаток или остатки R8' и остаток R50 преобразуются в остатки -N(R1)R2-V-G-M и R0-Q- соответственно с получением желаемого соединения формулы I.
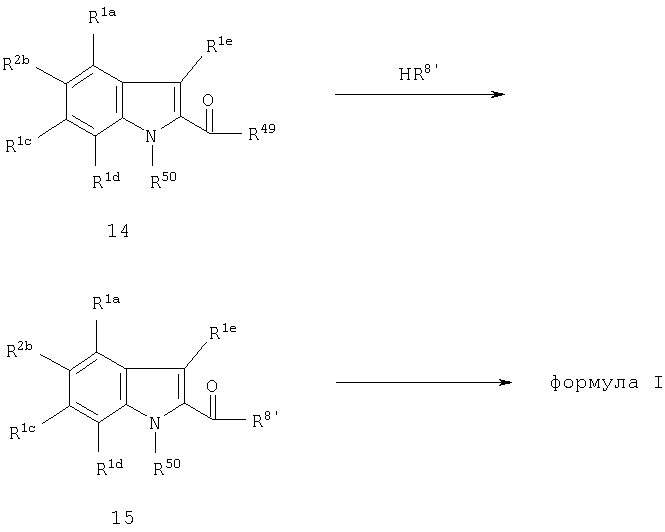
Таким образом, остатки R8' и остатки R1' и R2'-V-G-M, содержащиеся в структуре, могут иметь значения R1 и R2-V-G-M соответственно приведенные выше, или в дополнение к остаткам R1' и R2'-V-G-M функциональные группы могут быть также представлены в виде групп, которые могут последовательно быть трансформированы в конечные группы R1 и R2-V-G-M, т.е. функциональные группы могут быть представлены в виде групп-предшественников или производных, например, в защищенном виде. В ходе получения соединений формулы I в общем случае может быть благоприятным или необходимым вводить функциональные группы, которые уменьшают или предотвращают нежелательные реакции или побочные реакции на соответственной стадии синтеза, в виде групп-предшественников, которые позднее преобразовывают в требуемые функциональные группы, или временно блокировать функциональные группы с помощью стратегии защитных групп, подходящих для решения проблемы синтеза. Такие стратегии хорошо известны специалистам в данной области (см. например, Greene and Wuts, Protective Groups in Organic Synthesis, Wiley, 1991, или Р. Kocienski, Protecting Groups, Thieme 1994). В качестве примеров групп-предшественников могут быть приведены нитрогруппы и цианогруппы, которые на поздней стадии могут быть трансформированы в производные карбоновой кислоты или восстановлены в аминометильные группы или нитрогруппы, которые могут быть трансформированы восстановлением, таким как каталитическое гидрирование, в аминогруппы. Защитные группы могут также иметь значение твердой фазы, и отщепление от твердой фазы означает удаление защитной группы. Применение таких методов известно специалистам в данной области (Burgess К. (Ed.) Solid Phase Organic Synthesis, New York: Wiley, 2000). Например, фенольная гидроксигруппа может быть присоединена к тритилполиститрольной смоле, которая служит защитной группой, и молекула отщепляется от данной смолы обработкой ТФУК на поздней стадии синтеза.
Остаток R50 в соединениях формул 14 и 15 может означать группу -Q-R0, как определено выше, которая окончательно должна быть представлена в требуемой целевой молекуле формулы I, или он может означать группу, которая может последовательно быть трансформирована в группу -Q-R0, например, группу-предшественник или производное группы -Q-R0, в котором функциональные группы представлены в защищенном виде, или R50 может означать атом водорода или защитную группу для атома азота индольного кольца. Аналогичным образом, остатки R1e, R1a, R1b, R1c и R1d в формулах 14 и 15 имеют соответствующие определения R7, R6, R5, R4 и R3 в формуле I, как определено выше, однако для синтеза соединений формулы I данные остатки также могут быть, в принципе, представлены на стадии конденсации соединения формулы 14 с соединением формулы HR8', давая соединение формулы 15 в форме групп-предшественников или в защищенной форме.
Остатки R49 в соединениях формулы 14, которые могут быть одинаковыми или различными, могут представлять собой, например, гидрокси или (C1-C4)алкокси, т.е. группы COR49, представленные в соединениях формулы 14, могут представлять собой, например, свободные карбоновые кислоты или их сложные эфиры, такие как алкиловые эфиры, какими могут являться группы COR8 в соединениях формулы I. Группы COR49 могут также представлять собой любое другое активированное производное карбоновой кислоты, которое позволяет проводить образование амида, образование сложного эфира или образование сложного тиоэфира с соединением формулы HR8'. Группа COR49 может также представлять собой, например, хлорангидрид кислоты, активированный сложный эфир, подобный замещенному фениловому эфиру, азолид, подобный имидазолиду, азид или смешанный ангидрид, например смешанный ангидрид сложного эфира карбоновой кислоты или сульфоновой кислоты, производные которых могут все быть получены из карбоновой кислоты по стандартным методикам и могут взаимодействовать с амином, спиртом или меркаптаном формулы HR8' в стандартных условиях. Группа СООН карбоновой кислоты, представляющая COR49 в соединении формулы 14, может быть получена, например, из сложноэфирной группы, введенной в индольную систему в процессе индольного синтеза стандартными методиками гидролиза.
Соединения формулы I, в которых группа COR8 является сложноэфирной группой, могут также быть получены из соединений формулы 14, в которых COR49 представляет собой группу карбоновой кислоты, посредством общепринятых реакций этерификации, как, например, взаимодействие кислоты со спиртом в условиях кислотного катализа, или алкилирование соли карбоновой кислоты электрофилом, таким как алкилгалогенид, или трансэтерификацией из другого сложного эфира. Соединения формулы I, в которых группа COR8 является амидной группой, могут быть получены из аминов и соединений формулы 14, в которых COR49 является группой карбоновой кислоты или ее сложного эфира, посредством общепринятых реакций аминирования. Особенно для получения амидов, соединения формулы 14, в которых COR49 является группой карбоновой кислоты, могут быть конденсированы в стандартных условиях с соединениями HR8', которые являются аминами, с помощью общепринятых конденсирующих агентов, используемых в пептидном синтезе. Такие конденсирующие реагенты представляют собой, например, карбодиимиды, как дициклогексилкарбодиимид (DCC) или диизопропилкарбодиимид, карбонилдиазолы, такие как карбонилдиимидазол (CDI) и подобные реагенты, пропилфосфоновый ангидрид, тетрафторборат О-((циано(этоксикарбонил)метилен)амино-N,N,N',N'-тетраметилурония (TOTU), диэтилфосфорилцианид (DEPC) или бис-(2-оксо-3-оксазолидинил)фосфорилхлорид (ВОР-Cl) и многие другие.
Если остаток -Q-R0 представлен в индоле формулы I или остаток R50 представлен в индоле формулы 14, или остаток, в котором функциональные группы в составе остатка -Q-R0 или R50 представлены в защищенном виде или в виде группы-предшественника, не введены еще во время предыдущей стадии, например в процессе синтеза индольного ядра, данные остатки могут быть, например, введены в положение 1 индольной системы по общепринятым литературным методикам, хорошо известным специалисту в данной области, для N-алкилирования, восстановительного аминирования, N-арилирования, N-ацилирования или N-сульфонилирования кольцевых атомов азота гетероциклов. Исходное индольное производное для использования в такой реакции несет атом водорода в положении 1. N-Алкилирование кольцевого атома азота может, например, проводиться в стандартных условиях, предпочтительно в присутствии основания, с использованием алкилирующего соединения формулы LG-Q-R0 или формулы R50-LG, где атом в группе Q или группе R50, связанный с группой LG, в данном случае представляет собой алифатический атом углерода алкильного фрагмента и LG является уходящей группой, например галогеном, таким как хлор, бром или йод, или сульфонилоксигруппой, такой как тозилокси, мезилокси или трифторметилсульфонилокси. LG может, например, также являться гидроксигруппой, которая для достижения реакции алкилирования активируется общепринятым активирующим агентом. Для получения соединений, где А представляет собой прямую связь и ароматическая группа напрямую связана с положением 1 индольной системы, могут применяться общепринятые методики арилирования. Например, в качестве арилирующих агентов могут использоваться арилфториды, такие как алкилфторбензоаты или 4-фторфенилметилсульфоны. Такие способы описаны, например, у S. Stabler, Jahangir, Synth. Commun. 24 (1994) 123; I. Khanna, R. Weier, Y. Yu, X. Xu. F. Koszyk, J. Med. Chem. 40 (1997) 1634. Альтернативно, большое разнообразие замещенных арилйодидов, арилбромидов или арилтрифлатов может служить в качестве арилирующих агентов по положению 1 индольной системы в опосредованной солью меди или палладием реакции в соответствии с R. Sarges, H. Howard, К. Кое, A. Wessmann, J. Med. Chem, 32 (1989) 437; P. Unangst, D. Connor, R. Stabler, R. Weikert, J. Hettrocecl. Chem, 24 (1987) 811; G. Tokmakov, I. Grandberg, Tetrahedron 51 (1995) 2091; D. Odd, M. Harris, S. Buchwald, Org. Lett. 2 (2000) 1403, G. Mann, J. Hartwig, M. Driver, C. Fernandez-Rivas, J. Am. Chem. Soc. 120 (1998) 824; J. Hartwig, M. Kawatsura, S. Hauk, K. Shaughnessy, L. J. Org. Chem. 64 (1999) 5575. Кроме того, такие арилирования могут также завершаться реакцией с широким рядом замещенных арилбороновых кислот, как продемонстрировано, например, W. Mederski, M. Lefort, M. Germann, D. Kux, Tetrahedron 55 (1999) 12757.
В ходе синтеза использование микроволнового оборудования для ускорения, облегчения или обеспечения реакций может быть благоприятным или даже требоваться во многих случаях. Некоторые реакции, например, описаны J.L. Krstenansky, I. Cotteril, Curr. Opin. Drug. Disc. & Development., 4 (2000), 454; P. Lidstrom, J. Tierney, B. Wathey, J. Westman, Tetrahedron, 57 (2001, 9225; M. Larhed, A. Hallberg, Drug Discovery Today, 8 (2001) 406; S. Caddick, Tetrahedron, 51 (1995) 10403.
Предпочтительные способы включают, но не ограничены описанными в примерах.
Соединения настоящего изобретения представляют собой ингибиторы сериновой протеазы, которые ингибируют активность ферментов коагуляции крови: факторов Ха и/или фактора VIIa. В особенности, они являются высоко активными ингибиторами фактора Ха. Они являются специфическими ингибиторами сериновой протеазы постольку, поскольку они не ингибируют в значительной степени активность других протеаз, ингибирование которых не желательно. Активность соединений формулы I может быть определена, например, в анализах, описанных ниже, или в других анализах, известных специалистам в данной области. По отношению к ингибированию фактора Ха предпочтительное воплощение данного изобретения включает соединения, которые обладают Ki мкМ 1 для ингибирования фактора Ха, как определено в анализе, описанном ниже, с сопутствующим ингибированием фактора VIIa или без него и которое предпочтительно не ингибирует по существу активность других протеаз, включенных в коагуляцию и фибринолиз, ингибирование которых не желательно (при использовании той же концентрации ингибитора). Соединения данного изобретения ингибируют каталитическую активность фактора Ха либо непосредственно в составе протромбиназного комплекса или в виде растворимой субъединицы, или не напрямую ингибируя встраивание фактора Ха в протромбиназный комплекс.
Настоящее изобретение также относится к соединениям формулы I и/или их физиологически переносимым солям, и/или их пролекарствам для применения в качестве фармацевтических средств (или лекарственных средств), к применению соединений формулы I и/или их физиологически переносимых солей, и/или их пролекарств для производства фармацевтических средств для ингибирования фактора Ха и/или фактора VIIa или для оказания влияния на коагуляцию крови, воспалительный ответ или фибринолиз, или для лечения или профилактики заболеваний, приведенных выше или ниже, например, для производства фармацевтических средств для лечения и профилактики сердечно-сосудистых расстройств, тромбоэмболических заболеваний или рестенозов. Данное изобретение также относится к применению соединений формулы I и/или их физиологически переносимых солей, и/или их пролекарств для ингибирования фактора Ха и/или фактора VIIa или для оказания влияния на коагуляцию крови или фибринолиз, или для лечения или профилактики заболеваний, указанных выше или ниже, например для применения в лечении и профилактике сердечно-сосудистых расстройств, тромбоэмболических заболеваний или рестенозов, и к способам лечения, направленным на такие задачи, включая способы для указанных лечения и профилактики. Настоящее изобретения также относится к фармацевтическим препаратам (или фармацевтическим композициям), которые содержат эффективное количество, по меньшей мере, одного соединения формулы I и/или его физиологически переносимых солей, и/или его пролекарств в дополнение к общепринятому фармацевтически приемлемому носителю, т.е. одному или более фармацевтически приемлемому веществу-носителю или эксципиентам и/или вспомогательным веществам или добавкам.
Данное изобретение также относится к лечению болезненных состояний, таких как аномальное тромбообразование, острый инфаркт миокарда, нестабильная стенокардия, тромбоэмболизм, острая закупорка сосуда, ассоциированная с тромболитической терапией или чрескожной транслюминальной коронарной ангиопластикой, преходящие ишемические приступы, удар, патологическое тромбообразование, происходящее в венах нижних конечностей после абдоминальной, коленной и бедренной хирургии, риск легочного тромбоэмболизма или рассеянная системная внутрисосудистая коагулопатия, происходящая в сосудистых системах во время септического шока, некоторых вирусных инфекций или рака.
Соединения формулы I и их физиологически переносимые соли и их пролекарства могут вводиться животным, предпочтительно млекопитающим, и, в частности, людям в виде фармацевтических средств для лечения или профилактики. Они могут вводиться сами по себе или в смесях с еще одним или в виде фармацевтических препаратов, которые позволяют осуществлять энтеральное или парентеральное введение.
Фармацевтические средства могут вводиться перорально, например, в форме пилюль, таблеток, лакированных таблеток, таблеток с покрытием, гранул, жестких и мягких желатиновых капсул, растворов, сиропов, эмульсий, суспензий или аэрозольных смесей. Введение, однако, может также осуществляться ректально, например, в форме суппозиториев, или парентерально, например, внутривенно, внутримышечно или подкожно, в форме инъекционных растворов или инфузионных растворов, микрокапсул, имплантатов или стержней, или чрескожно или местно, например, в форме мазей, растворов или микстур, или другими путями, например в форме аэрозолей или назальных спреев.
Фармацевтические препараты в соответствии с изобретением получают способами, известными как таковые и знакомыми специалисту в данной области, фармацевтически пригодные инертные неорганические и/или органические носители используются в дополнение к соединению (соединениям) формулы I и/или его (их) физиологически приемлемым солям, и/или его (их) пролекарствам. Для изготовления пилюль, таблеток, таблеток с покрытием и жестких желатиновых капсул возможно использовать, например, лактозу, кукурузный крахмал или их производные, тальк, стеариновую кислоту или ее соли и т.д. Носители для мягких желатиновых капсул и суппозиториев представляют собой, например, жиры, воски, полутвердые и жидкие полиолы, природные или отвержденные масла и т.д. Подходящими носителями для производства растворов, например инъекционных растворов или эмульсий, или сиропов являются, например, вода, физиологический раствор, спирты, глицерин, полиолы, сахароза, инвертированный сахар, глюкоза, растительные масла и т.д. Подходящими носителями для микрокапсул, имплантатов или стержней являются, например, сополимеры гликолевой кислоты и молочной кислоты. Фармацевтические препараты обычно содержат приблизительно 0,5%-90% по массе соединений формулы I и/или их физиологически переносимых солей, и/или их пролекарств. Количество активного ингредиента формулы I и/или его физиологически переносимых солей, и/или его пролекарств в фармацевтических препаратах обычно составляет приблизительно от 0,5 до 1000 мг, предпочтительно приблизительно от 1 до 500 мг.
В дополнение к активным ингредиентам формулы I и/или их физиологически приемлемым солям, и/или пролекарствам и веществам носителей фармацевтические препараты могут содержать добавки, такие как, например, наполнители, дезинтеграторы, связующие, лубриканты, увлажняющие агенты, стабилизаторы, эмульгаторы, консерванты, подсластители, пигменты, отдушки, ароматизаторы, загустители, разбавители, буферные вещества, растворители, солюбилизаторы, агенты для достижения депонирующего эффекта, соли для изменения осмотического давления, покрывающие агенты или антиоксиданты. Они также могут содержать два или более соединений формулы I. В случае, когда фармацевтический препарат содержит одно или более соединений формулы I и/или его физиологически переносимых солей, и/или его пролекарств, выбор индивидуальных соединений может быть направлен на конкретный общий фармакологический профиль фармацевтического препарата. Например, высоко активное соединение с более короткой продолжительностью действия может быть объединено с долго действующим соединением с более низкой активностью. Гибкость, допускаемая по отношению к выбору заместителей в соединениях формулы I, делает возможным высокую степень контроля над биологическими и физико-химическими свойствами соединений и, таким образом, позволяет осуществлять выбор таких требуемых соединений. Кроме того, в дополнение к, по меньшей мере, одному соединению формулы I и/или его физиологически переносимым солям и/или его пролекарствам, фармацевтические препараты могут также содержать один или несколько других терапевтически или профилактически активных ингредиентов.
В качестве ингибиторов фактора Ха и/или фактора VIIa соединения формулы I и/или их физиологически переносимые соли, и/или их пролекарства в целом являются пригодными для лечения и профилактики состояний, в которых активность фактора Ха и/или фактора VIIa играет роль или имеет нежелательный эффект или на которые можно благоприятно влиять, путем ингибирования фактора Ха и/или фактора VIIa, или если уменьшение их активности желательно для терапевта. Так как ингибирование фактора Ха и/или фактора VIIa влияет на коагуляцию крови и фибринолиз, соединения формулы I и их физиологически переносимые соли, и их пролекарства в целом являются пригодными для снижения свертываемости крови или для лечения и профилактики состояний, при которых активность системы коагуляции крови играет роль или имеет нежелательную степень или на которые можно благоприятно влиять, снижая свертываемость крови, или для предотвращения, облегчения или лечения которых пониженная активность системы коагуляции крови является желательной для терапевта. Конкретным предметом настоящего изобретения, таким образом, являются снижение или ингибирование нежелательной свертываемости крови, в частности, у пациента путем введения эффективного количества соединения I или его физиологически переносимой соли, или пролекарства, а также фармацевтические препараты для данных целей.
Состояния, при которых соединение формулы I может благоприятно использоваться, включают, например, сердечно-сосудистые расстройства, тромбоэмболические заболевания или осложнения, ассоциированные, например, с инфекцией или хирургическим вмешательством. Соединения настоящего изобретения могут также применяться для уменьшения воспалительного ответа. Примерами специфических нарушений, для лечения или профилактики которых могут использоваться соединения формулы I, представляют собой коронарную болезнь, инфаркт миокарда, стенокардию, сосудистый рестеноз, например рестеноз после ангиопластики, такой как РТСА, респираторный дистресс-синдром взрослых, множественное повреждение органов, удар и рассеянное внутрисосудистое нарушение свертываемости. Примерами родственных осложнений, ассоциированных с хирургией, являются тромбозы, такие как тромбоз глубокой вены и тромбоз проксимальной вены, которые могут происходить после хирургического вмешательства. С точки зрения их фармакологической активности соединения данного изобретения могут замещать или дополнять другие антикоагулянтные средства, такие как гепарин. Применение соединения изобретения может приводить, например, к экономии средств по сравнению с другими антикоагулянтами. При использовании соединений формулы I доза может варьироваться в пределах широкого диапазона и, как обычно и хорошо известно терапевту, ее приспосабливают к индивидуальным условиям в каждом отдельном случае. Она зависит, например, от конкретного применяемого соединения, от природы и тяжести заболевания, подлежащего лечению, от режима и графика введения или от того, является ли состояние для лечения острым или хроническим, либо проводят профилактику. Соответствующую дозировку можно установить, применяя клинические подходы, хорошо известные в области медицины. В общем случае, суточная доза для достижения желаемых результатов для взрослого, имеющего массу приблизительно 75 кг, составляет от 0,01 до 100 мг/кг, предпочтительно от 0,1 до 50 мг/кг, в частности от 0,1 до 10 мг/кг (в каждом случае в мг на 1 кг массы тела). Суточная доза может быть разделена, в частности, в случае введения относительно больших количеств, на несколько, например 2, 3 или 4, частичных введений. Как обычно, в зависимости от индивидуального поведения, может быть необходимым делать отклонения вверх или вниз от указанной суточной дозы.
Соединение формулы I может также благоприятно применяться в качестве антикоагулянта вне пациента. Например, эффективное количество соединения изобретения может контактировать со свежеотобранным образцом крови для предотвращения коагуляции образца крови. Далее, соединения формулы I и его соли могут использоваться для диагностических целей, например при диагностике in vitro, и в качестве вспомогательного средства в биохимических исследованиях. Например, соединение формулы I может быть использовано в анализе для идентификации фактора Ха и/или фактора VIIa или для выделения фактора Ха и/или фактора VIIa в по существу очищенной форме. Соединение изобретения может быть помечено, например, радиоактивным изотопом, и меченое соединение, связанное с фактором Ха и/или фактором VIIa, далее детектируют, используя общепринятый способ, используемый для детектирования конкретной метки. Таким образом, соединение формулы I или его соль могут быть использованы в качестве зонда для детектирования местоположения или величины активности фактора Ха и/или фактора VIIa in vivo, in vitro или ex vivo.
Кроме того, соединения формулы I могут использоваться в качестве промежуточных продуктов синтеза для получения других соединений, в частности других фармацевтически активных ингредиентов, которые можно получить из соединений формулы I, например, введением заместителей или модификацией функциональных групп.
Общие синтетические последовательности для получения соединений, применимых в настоящем изобретении, выделены в примерах, приведенных ниже. Как объяснение, так и действительная методика для различных аспектов настоящего изобретения описаны, где необходимо. Подразумевают, что следующие примеры служат просто для иллюстрации настоящего изобретения и не ограничивают его ни по объему, ни по сущности. Специалисты в данной области легко поймут, что известные вариации условий и способов, описанных в примерах, могут быть использованы для синтеза соединений настоящего изобретения.
Следует понимать, что изменения, которые не влияют по существу на активность различных воплощений данного изобретения, включены в изобретение, раскрываемое в настоящем описании. Таким образом, подразумевают, что следующие примеры иллюстрируют, но не ограничивают настоящее изобретение.
Примеры
Когда на конечной стадии синтеза соединения используется кислота, такая как трифторуксусная кислота или уксусная кислота, например, когда трифторуксусную кислоту используют для удаления трет-бутильной группы или когда соединение очищают хроматографией, используя элюент, который содержит такую кислоту, в некоторых случаях в зависимости от методики обработки, например деталей сушки вымораживанием, соединение получают частично или полностью в виде соли используемой кислоты, например, в виде соли уксусной кислоты или соли трифторуксусной кислоты, или соли хлористоводородной кислоты. Используемые сокращения:
Пример 1: (1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
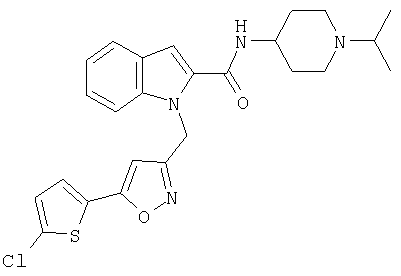
(i) трет-Бутиловый эфир (1-изопропилпиперидин-4-ил)карбаминовой кислоты
К раствору 5,0 г трет-бутилового эфира пиперидин-4-илкарбаминовой кислоты в 15 мл метанола добавляют 7,34 мл ацетона, 3,14 г Na(CN)BH3 и 0,3 мл уксусной кислоты. После перемешивания в течение 16 часов при комнатной температуре растворитель удаляют при пониженном давлении и остаток распределяют между 30 мл воды и 30 мл этилацетата. Органический слой промывают насыщенным раствором Na2CO3, водой и затем сушат над Na2SO4. Растворитель удаляют при пониженном давлении с получением продукта в виде белого твердого вещества. Выход 4,8 г. MC(ES+): m/e=243.
(ii) 1-Изопропилпиперидин-4-иламин
К 4,8 г трет-бутилового эфира (1-изопропилпиперидин-4-ил)карбаминовой кислоты в 15 мл метанола добавляют 20 мл метанольной хлористоводородной кислоты (8 М) и смесь перемешивают в течение 16 часов. Удалением растворителя при пониженном давлении с последующим удалением остаточных летучих продуктов совместным упариванием дважды с толуолом получают продукт. Выход 5,42 г. MC(ES+): m/e=143.
(iii) Метиловый эфир 1Н-индол-2-карбоновой кислоты
2 г 1Н-индол-2-карбоновой кислоты растворяют в 15 мл метанольной хлористоводородной кислоты (8 М) и смесь перемешивают в течение 16 часов. После удаления растворителя при пониженном давлении остаточные летучие продукты удаляют совместной отгонкой дважды с 10 мл толуола. Оставшееся твердое вещество слегка желтого цвета подвергают последующему взаимодействию без дальнейшей очистки. Выход 2,3 г
(iv) Метиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
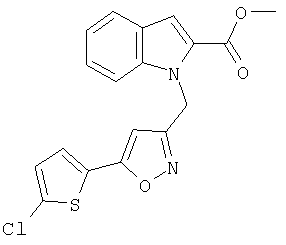
К раствору 244,2 мг метилового эфира 1Н-индол-2-карбоновой кислоты в 2 мл ДМФА при комнатной температуре добавляют 52,2 мг гидрида натрия (60% в масле). После перемешивания в течение 30 мин добавляют 500 мг 3-бромметил-5-(5-хлортиофен-2-ил)изоксазола [полученного путем адаптации методики, описанной Ewing, William R.; Becker, Michael R.; Choi-Sledeski, Yong Mi; Puuls, Heinz W.; He, Wei; Condon, Stephen M.; Davis, Roderick S.; Hanney, Barbara A.; Spada, Alfred P.; Burns, Christopher J.; Jiang, John Z.; Li, Aiwen; Myers, Michael R.; Lau, Wan F.; Poll, Gregory В.; РСТ Int. Appl. (2001), 460 pp. WO 0107436 A2] и смесь нагревают в течение 1 час при 80°С. После дальнейшего охлаждения реакционной смеси до КТ и добавления 5 мл воды смесь фильтруют через картридж chem elut®, элюируя этилацетатом. После концентрирования при пониженном давлении остаток непосредственно подвергают последующей реакции омыления без дальнейшей очистки. Выход 288 мг. MC(ES+): m/e=373.
(v) 1-[5-(5-Хлортиофен-2-ил)изоксазол-3-илметил]-1H-индол-2-карбоновая кислота
К раствору 288 мг метилового эфира 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты в 10 мл ТГФ добавляют 3 мл воды и 57,0 мг моногидрата гидроксида лития. После перемешивания в течение 2 час при 60°С реакционную смесь охлаждают до КТ. Смесь подкисляют полуконцентрированной хлористоводородной кислотой. Полученный осадок собирают фильтрованием и промывают 3 мл воды. Продукт получают в виде белого твердого вещества, которое сушат при пониженном давлении.
Выход 253 мг. MC(ES+): m/e=359, изотопное распределение атомов хлора.
(vi) (1-Изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
К раствору 117 мг 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты в 1 мл ДХМ и 0,17 мл NEt3 добавляют 76 мг ВОР-Cl при КТ и смесь перемешивают в течение 30 мин. После добавления 81 мг гидрохлорида 1-изопропилпиперидин-4-иламина смесь перемешивают в течение ночи. После удаления растворителя при пониженном давлении остаток очищают препаративной ВЭЖХ (С18 колонка с обращенной фазой, элюирование градиентом смеси H2O/MeCN с 0,1% ТФУК). Фракции, содержащие продукт, выпаривают и лиофилизируют с получением белого твердого вещества. Продукт получают в виде его трифторацетатной соли.
Выход 93 мг. МС (ES+): m/e=483, изотопное распределение атомов хлора.
По аналогичной методике примера 1 получают следующие соединения.
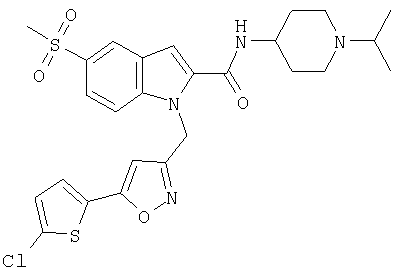
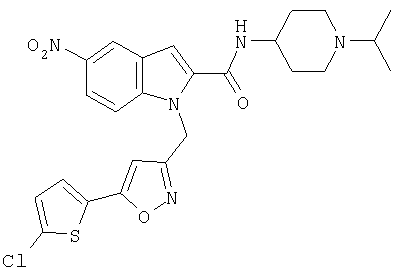
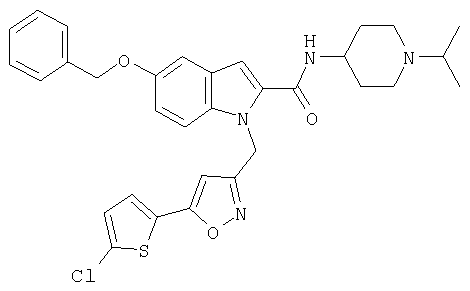
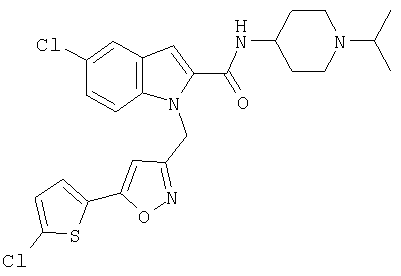
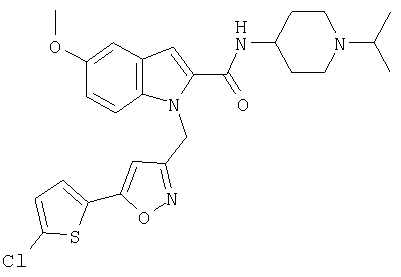
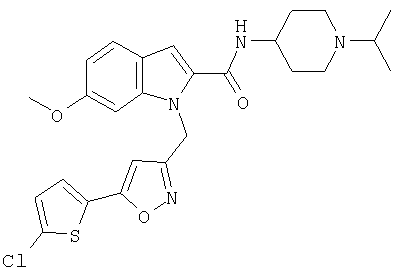
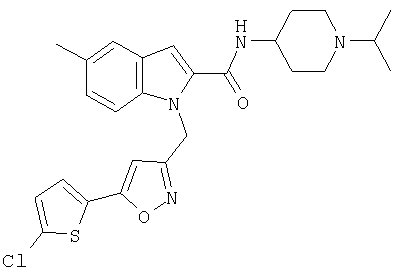
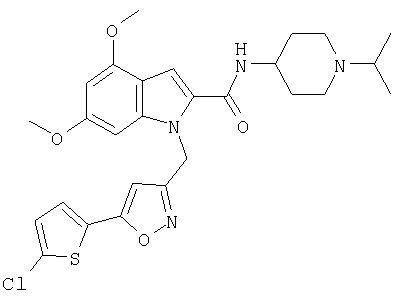
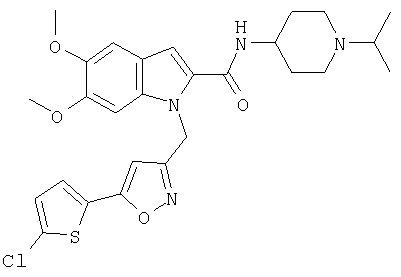
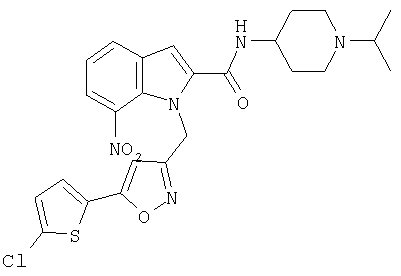
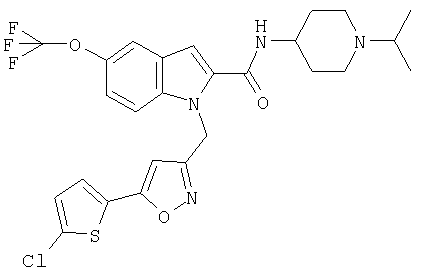

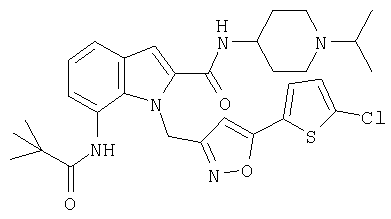
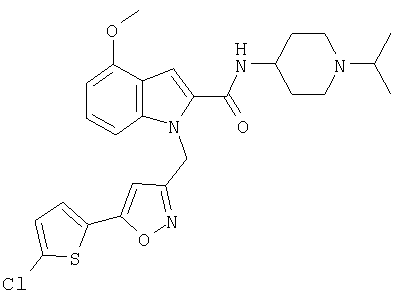
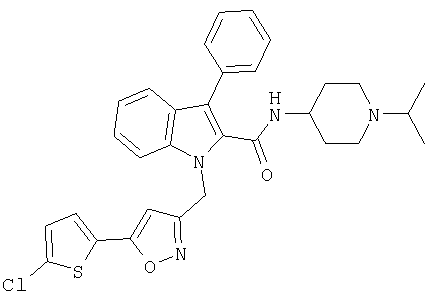
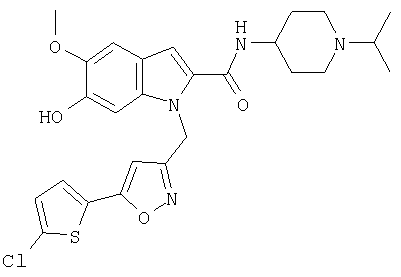
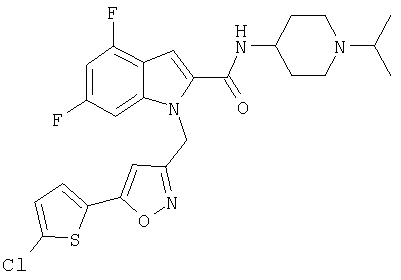
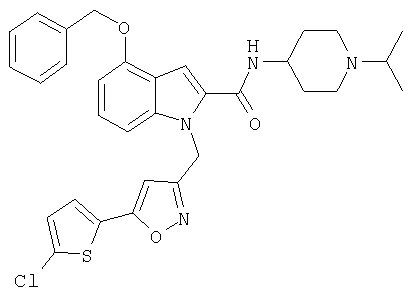
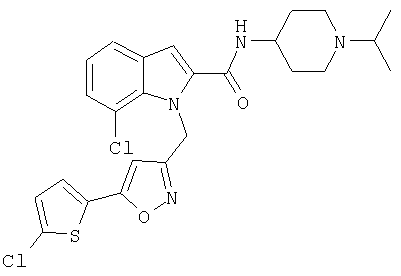
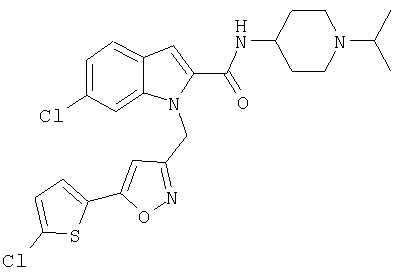
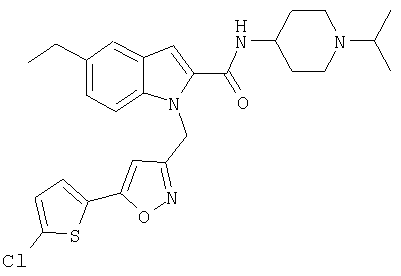
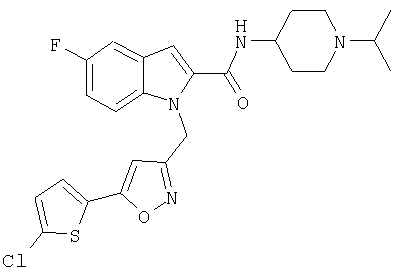
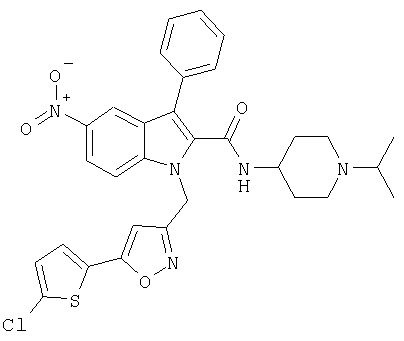
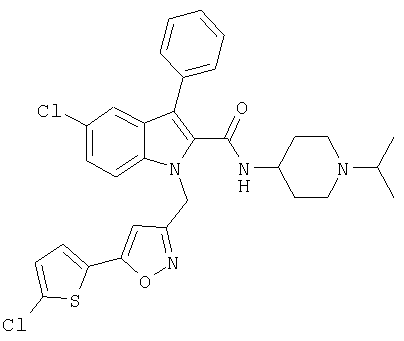

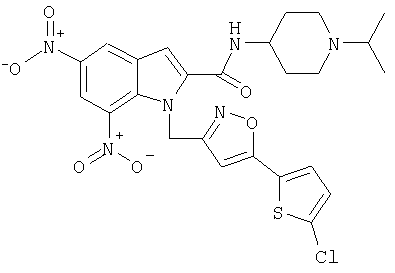
Пример 28: (3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
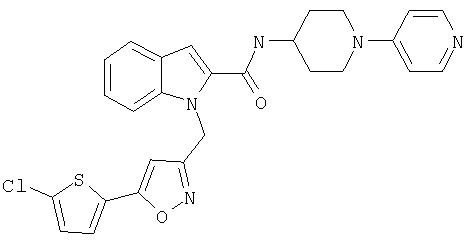
(i) трет-Бутиловый эфир (3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-ил)карбаминовой кислоты

Раствор 3 г трет-бутилового эфира пиперидин-4-илкарбаминовой кислоты и 2,5 г 4-хлорпиридина в 9 мл смеси н-бутанол/вода/Net3 (1:1:1) нагревают при 100°С в течение 48 час. Раствор охлаждают до КТ, разбавляют ДХМ и промывают раствором NaHCO3 и далее водой. Органический слой сушат над Na2SO4 и растворитель удаляют при пониженном давлении. Хроматографической очисткой остатка на силикагеле с ДХМ в качестве элюента, после упаривания фракций, содержащих продукт, получают белую пену. Выход 1,7 г.
(ii) 3,4,5,6-Тетрагидро-2Н-[1,4']бипиридинил-4-иламин
К раствору 4 г трет-бутилового эфира (3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-ил)карбаминовой кислоты в 4 мл ДХМ при КТ добавляют 12 мл ТФУК. После перемешивания в течение 20 час раствор разбавляют 20 мл толуола и выпаривают при пониженном давлении. Остаток совместно отгоняют дважды с толуолом и используют в последующих реакциях без дальнейшей очистки. Продукт получают в виде его трифторацетатной соли.
Выход 2,1 г
(iii) (3,4,5,6-Тетрагидро-2Н-[1,4']бипиридинил-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
Указанное в заголовке соединение получают по аналогичной методике примера 1 с тем отличием, что вместо 1-изопропилпиперидин-4-иламина используют 3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-иламин.
МС (ESI+): m/е=518, изотопное распределение атомов хлора.
Пример 29: (3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-7-метил-1Н-индол-2-карбоновой кислоты

Указанное в заголовке соединение получают по аналогичной методике примера 28 с тем отличием, что вместо 1Н-индол-2-карбоновой кислоты используют 7-метил-1Н-индол-2-карбоновую кислоту.
МС (ESI+): m/е=532, изотопное распределение атомов хлора.
Пример 30: (3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-5-нитро-1Н-индол-2-карбоновой кислоты

Указанное в заголовке соединение получают по аналогичной методике примера 28 с тем отличием, что вместо 1Н-индол-2-карбоновой кислоты используют 5-нитро-1Н-индол-2-карбоновую кислоту.
МС (ESI+): m/е=563, изотопное распределение атомов хлора.
Пример 31: {1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1H-индол-2-ил}-[4-(пиридин-4-иламино)пиперидин-1-ил]метанон
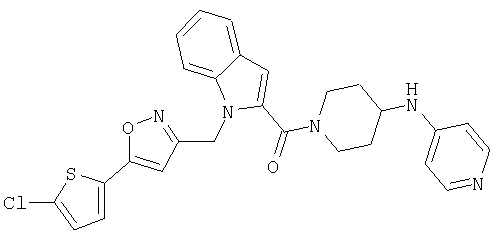
(i) трет-Бутиловый эфир 4-(пиридин-4-иламино)пиперидин-1-карбоновой кислоты

Раствор 2,5 г трет-бутилового эфира 4-аминопиперидин-1-карбоновой кислоты и 2,5 г 4-хлорпиридина в 9 мл смеси н-бутанол/вода/NEt3 (1:1:1) нагревают при 100°С в течение 85 час. Далее раствор охлаждают до КТ, разбавляют ДХМ и промывают раствором NaHCO3 и далее водой. Органический слой сушат над Na2SO4 и растворитель удаляют при пониженном давлении. Хроматографической очисткой остатка на силикагеле с ДХМ в качестве элюента, после упаривания фракций, содержащих продукт, получают белую пену. Выход 1,7 г
(ii) Пиперидин-4-илпиридин-4-иламин
К раствору 1,7 г трет-бутилового эфира 4-(пиридин-4-иламино)пиперидин-1-карбоновой кислоты в 4 мл ДХМ при КТ добавляют 12 мл ТФУК. После перемешивания в течение 20 час раствор разбавляют 20 мл толуола и выпаривают при пониженном давлении. Остаток совместно отгоняют дважды с толуолом и используют в последующих реакциях без дальнейшей очистки. Продукт получают в виде его трифторацетатной соли. Выход 4,0 г.
(iii) {1-[5-(5-Хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-ил}-[4-(пиридин-4-иламино)пиперидин-1-ил]метанон
Указанное в заголовке соединение получают по аналогичной методике примера 1 с тем отличием, что вместо 1-изопропилпиперидин-4-иламина используют пиперидин-4-илпиридин-4-иламин.
МС (ESI+): m/е=518, изотопное распределение атомов хлора.
Пример 32: {1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-5-нитро-1Н-индол-2-ил}-[4-(пиридин-4-иламино)пиперидин-1-ил]метанон
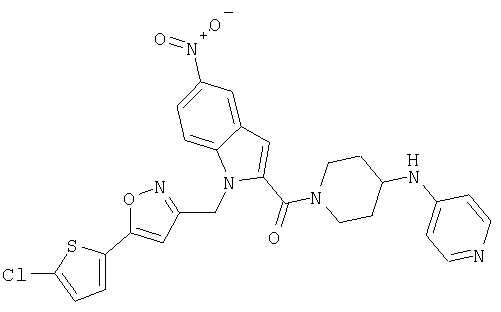
Указанное в заголовке соединение получают по аналогичной методике примера 31 с тем отличием, что вместо 1Н-индол-2-1Н-индол-2-карбоновой кислоты используют 5-нитро-1Н-индол-2-карбоновую кислоту.
МС (ESI+): m/e=563, изотопное распределение атомов хлора.
Пример 33: {1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-7-метил-1Н-индол-2-ил}-[4-(пиридин-4-иламино)пиперидин-1-ил]метанон
Указанное в заголовке соединение получают по аналогичной методике примера 31 с тем отличием, что вместо 1Н-индол-2-карбоновой кислоты используют 7-метил-1Н-индол-2-карбоновую кислоту.
МС (ESI+): m/e=532, изотопное распределение атомов хлора.
Пример 34: {1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-ил}-(4-изопропиламинопиперидин-1-ил)метанон
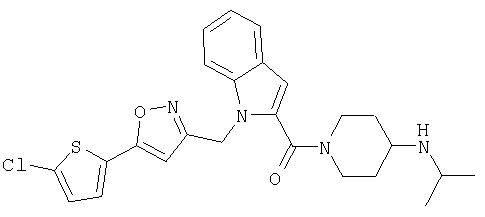
(i) трет-Бутиловый эфир 4-изопропиламинопиперидин-1-карбоновой кислоты
К раствору 1,5 г трет-бутилового эфира 4-аминопиперидин-1-карбоновой кислоты в 20 мл ацетонитрила добавляют 2,6 мл ацетона, 0,94 г Na(CN)BH3 и 0,3 мл уксусной кислоты. После перемешивания в течение 16 час при КТ растворитель удаляют при пониженном давлении и остаток распределяют между 30 мл воды и 30 мл этилацетата. Органический слой промывают насыщенным раствором Na2CO3, водой и сушат над Na2SO4. Удалением растворителя при пониженном давлении получают белое твердое вещество.
Выход 2,8 г. МС (ESI+): m/e=243.
(ii) Изопропилпиперидин-4-иламин
К раствору 2,8 г трет-бутилового эфира 4-изопропиламинопиперидин-1-карбоновой кислоты в 8 мл ДХМ при КТ добавляют 4 мл ТФУК. После перемешивания в течение 20 час раствор разбавляют 20 мл толуола и выпаривают при пониженном давлении. Остаток совместно отгоняют дважды с толуолом и используют в последующих реакциях без дальнейшей очистки. Продукт получают в виде его трифторацетатной соли.
Выход 4,4 г. МС (ESI+): m/e=143.
(iii) {1-[5-(5-Хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-ил}-(4-изопропиламинопиперидин-1-ил)метанон
Указанное в заголовке соединение получают по аналогичной методике примера 1 с тем отличием, что вместо 1-изопропилпиперидин-4-иламина используют изопропилпиперидин-4-иламин.
МС (ESI+): m/e=483, изотопное распределение атомов хлора.
Пример 35: {1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-7-метил-1Н-индол-2-ил}-(4-изопропиламинопиперидин-1-ил)метанон

Указанное в заголовке соединение получают по аналогичной методике примера 1 с тем отличием, что вместо 1Н-индол-2-карбоновой кислоты используют 7-метил-1Н-индол-2-карбоновую кислоту.
МС (ESI+): m/е=497, изотопное распределение атомов хлора.
Пример 36: (1-этилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
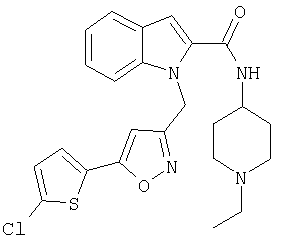
(i) трет-Бутиловый эфир (1-этилпиперидин-4-ил)карбаминовой кислоты
К раствору 5 г трет-бутилового эфира пиперидин-4-илкарбаминовой кислоты в 20 мл метанола добавляют 5,6 мл ацетальдегида, 3,2 г Na(CN)BH3 и 3,2 мл уксусной кислоты. После перемешивания в течение 16 час при КТ растворитель удаляют при пониженном давлении и остаток распределяют между 30 мл воды и 200 мл этилацетата. Органический слой промывают насыщенным раствором Na2СО3, водой и сушат над Na2SO4. Удалением растворителя при пониженном давлении получают белое твердое вещество. Выход 4,4 г.
(ii) 1-Этилпиперидин-4-иламин
К 4,4 г трет-бутилового эфира (1-этилпиперидин-4-ил)карбаминовой кислоты в 15 мл метанола добавляют 20 мл метанольной хлористоводородной кислоты (8 М) и смесь перемешивают в течение 16 ч. Удалением растворителя при пониженном давлении получают белое твердое вещество, которое совместно упаривают дважды с толуолом. Продукт получают в виде его гидрохлорида.
Выход 4,3 г.
(iii) (1-Этилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
Указанное в заголовке соединение получают по аналогичной методике примера 1 с тем отличием, что вместо 1-изопропилпиперидин-4-иламина используют 1-этилпиперидин-4-иламин.
МС (ESI+): m/e=469, изотопное распределение атомов хлора.
Пример 37: (1-этилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-7-метил-1Н-индол-2-карбоновой кислоты

Указанное в заголовке соединение получают по аналогичной методике примера 36 с тем отличием, что вместо 1Н-индол-2-карбоновой кислоты используют 7-метил-1Н-индол-2-карбоновую кислоту.
МС (ESI+): m/е=483, изотопное распределение атомов хлора.
Пример 38: {1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-ил}-(4-пирролидин-1-илпиперидин-1-ил)метанон
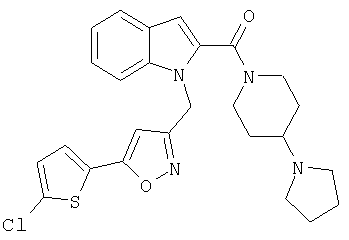
Указанное в заголовке соединение получают по аналогичной методике примера 1 с тем отличием, что вместо 1-изопропилпиперидин-4-иламина используют 4-пирролидин-1-илпиперидин.
МС (ESI+): m/е=509, изотопное распределение атомов хлора.
Пример 39: {1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-ил}-[4-(1-метилпиперидин-4-ил)пиперазин-1-ил]метанон

Указанное в заголовке соединение получают по аналогичной методике примера 1 с тем отличием, что вместо 1-изопропилпиперидин-4-иламина используют 1-(1-метилпиперидин-4-ил)пиперазин.
МС (ESI+): m/e=524, изотопное распределение атомов хлора.
Пример 40: [1,4']бипиперидинил-1'-ил-{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-ил}метанон

Указанное в заголовке соединение получают по аналогичной методике примера 1 с тем отличием, что вместо 1-изопропилпиперидин-4-иламина используют [1,4']бипиперидинил.
МС (ESI+): m/e=523, изотопное распределение атомов хлора.
Пример 41: (3-пиридин-4-ил-4,5-дигидроизоксазол-5-илметил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
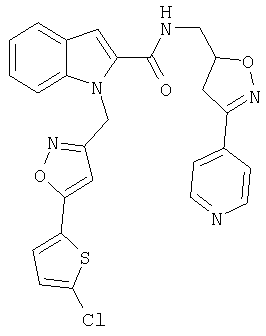
Указанное в заголовке соединение получают по аналогичной методике примера 1 с тем отличием, что вместо 1-изопропилпиперидин-4-иламина используют С-(3-пиридин-4-ил-4,5-дигидроизоксазол-5-ил)метиламин.
МС (ESI+): m/е=518, изотопное распределение атомов хлора.
Пример 42: (4-аминохиназолин-7-илметил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
Указанное в заголовке соединение получают по аналогичной методике примера 1 с тем отличием, что вместо 1-изопропилпиперидин-4-иламина используют 7-аминометилхиназолин-4-иламин [Ewing, William R. PCT Int. Appl. (2001), 466 pp. WO 0107436 A2].
MC (ESI+): m/e=518, изотопное распределение атомов хлора.
Пример 43: {1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-ил}-(4-пиридин-4-илметилпиперазин-1-ил)метанон
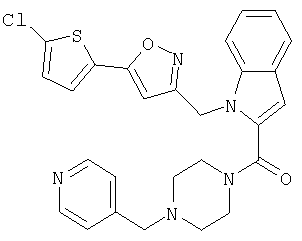
Указанное в заголовке соединение получают по аналогичной методике примера 1 с тем отличием, что вместо 1-изопропилпиперидин-4-иламина используют 1-пиридин-4-илметилпиперазин
MC (ESI+): m/е=518, изотопное распределение атомов хлора.
Пример 44: 3,5-дихлорбензиламид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
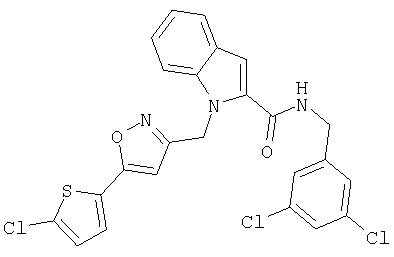
Указанное в заголовке соединение получают по аналогичной методике примера 1 с тем отличием, что вместо 1-изопропилпиперидин-4-иламина используют 3,5-дихлорбензиламин.
MC (ESI+): m/е=516, изотопное распределение атомов хлора.
Пример 45: (4-трет-бутилфенил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
Указанное в заголовке соединение получают по аналогичной методике примера 1 с тем отличием, что вместо 1-изопропилпиперидин-4-иламина используют 4-трет-бутилфениламин.
МС (ESI+): m/е=490, изотопное распределение атомов хлора.
Пример 46: (1-изопропилпиперидин-4-илметил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
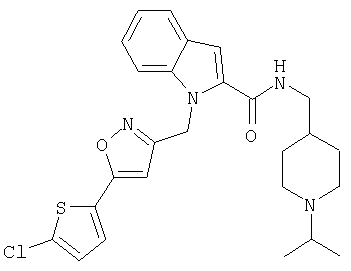
(i) трет-Бутиловый эфир (1-изопропилпиперидин-4-илметил)карбаминовой кислоты
К раствору 1 г трет-бутилового эфира пиперидин-4-илкарбаминовой кислоты в 20 мл ацетонитрила добавляют 2,6 мл ацетона и 586 мг Na(CN)BH3. После перемешивания в течение 16 час при КТ растворитель удаляют при пониженном давлении и остаток распределяют между 30 мл воды и 30 мл этилацетата. Органический слой промывают насыщенным раствором Na2CO3, водой и сушат над Na2SO4. Удалением растворителя при пониженном давлении получают белое твердое вещество.
Выход 802 мг.
(ii) С-(1-Изопропилпиперидин-4-ил)метиламин
К раствору 802 мг трет-бутилового эфира (1-изопропилпиперидин-4-илметил)карбаминовой кислоты в 5 мл ДХМ добавляют при комнатной температуре 4 мл ТФУК. После перемешивания в течение 20 ч раствор разбавляют 20 мл толуола и выпаривают при пониженном давлении. Остаток совместно отгоняют дважды с толуолом и используют в последующих реакциях без дальнейшей очистки. Продукт получают в виде его трифторацетатной соли. Выход 1,7 г.
(iii) (1-Изопропилпиперидин-4-илметил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
Указанное в заголовке соединение получают по аналогичной методике примера 1 с тем отличием, что вместо 1-изопропилпиперидин-4-иламина используют С-(1-изопропилпиперидин-4-ил)метиламин.
МС (ESI+): m/e=496, изотопное распределение атомов хлора.
Пример 47: (3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-илметил)амид индол-2-карбоновой кислоты
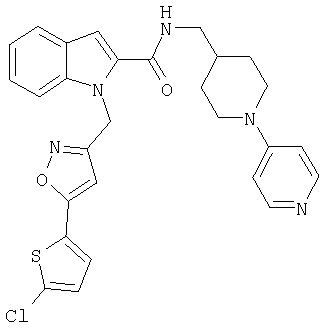
(i) трет-Бутиловый эфир (3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-илметил)карбаминовой кислоты
Суспензию 5 г (23,3 ммоль) трет-бутилового эфира пиперидин-4-илметилкарбаминовой кислоты и 3,85 г (25,7 ммоль) гидрохлорида 4-хлорпиридина в 15 мл смеси н-BuOH/H2O/NEt3 (1:1:1) кипятят с обратным холодильником в течение 3 дней. После удаления растворителя при пониженном давлении остаток очищают хроматографией на силикагеле со смесью ДХМ/МеОН (100:1→50:1→10:1-5:1). Продукт получают в виде белого твердого вещества.
Выход 4,3 г.
(ii) С-(3,4,5,6-Тетрагидро-2Н-[1,4']бипиридинил-4-ил)метиламин
К раствору 4,58 г трет-бутилового эфира (3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-илметил)карбаминовой кислоты в 12 мл ДХМ добавляют при комнатной температуре 12 мл ТФУК. После перемешивания в течение 30 мин раствор разбавляют 20 мл толуола и выпаривают при пониженном давлении. Остаток отгоняют дважды совместно с толуолом и используют в последующих реакциях без дальнейшей очистки. Продукт получают в виде его трифторацетатной соли.
Выход 3,3 г.
(iii) (3,4,5,6-Тетрагидро-2Н-[1,4']бипиридинил-4-илметил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
Указанное в заголовке соединение получают по аналогичной методике примера 1 с тем отличием, что вместо 1-изопропилпиперидин-4-иламина используют С-(3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-ил)метиламин.
МС (ESI+): m/е=532, изотопное распределение атомов хлора.
Пример 48: (1-циклопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
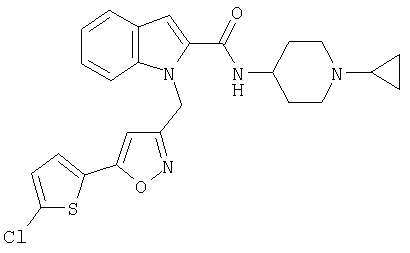
(i) трет-Бутиловый эфир (1-циклопропилпиперидин-4-ил)карбаминовой кислоты
К суспензии 1 г трет-бутилового эфира пиперидин-4-илметилкарбаминовой кислоты, 2 г свежеактивированного молекулярного сита 3А, 1 мл уксусной кислоты, 6 мл 1-этоксициклопропилокситриметилсилана в 25 мл метанола добавляют 22,5 мл Na(CN)BH3 (1 M в ТГФ) и кипятят с обратным холодильником в течение 2 час. Реакционную смесь фильтруют через слой целита, концентрируют при пониженном давлении и остаток переносят в этилацетат. Органический слой промывают 1 M NaOH и насыщенным раствором NaCl и окончательно сушат над Na2SO4. Упариванием растворителей при пониженном давлении получают прозрачное масло. Выход 1,44 г.
(ii) 1-Циклопропилпиперидин-4-иламин
К раствору 0,72 г трет-бутилового эфира (1-циклопропилпиперидин-4-ил)карбаминовой кислоты в 5 мл ДХМ при КТ добавляют 3 мл ТФУК. После перемешивания в течение 20 час раствор разбавляют 20 мл толуола и выпаривают при пониженном давлении. Остаток отгоняют дважды совместно с толуолом и используют в последующих реакциях без дальнейшей очистки. Продукт получают в виде его трифторацетатной соли.
Выход 870 мг.
(iii) (1-Циклопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
Указанное в заголовке соединение получают по аналогичной методике примера 1 с тем отличием, что вместо 1-изопропилпиперидин-4-иламина используют 1-циклопропилпиперидин-4-иламин.
МС (ESI+): m/е=481, изотопное распределение атомов хлора.
Пример 49: [1-(тетрагидропиран-4-ил)пиперидин-4-ил]амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
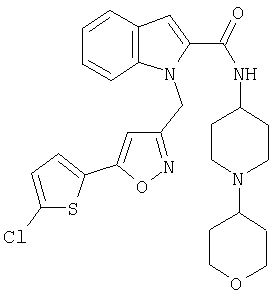
(i) трет-Бутиловый эфир 4-({1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбонил}амино)пиперидин-1-карбоновой кислоты
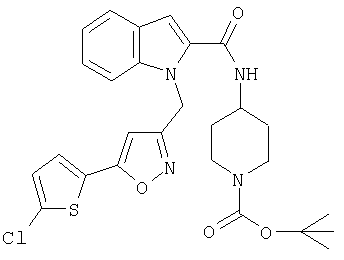
К раствору 1 г 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты и 1,4 мл NEM в 5 мл ДХМ добавляют 0,9 г TOTU и смесь перемешивают в течение 30 мин при КТ. Далее добавляют 0,7 г трет-бутилового эфира 4-аминопиперидин-1-карбоновой кислоты и реакционную смесь перемешивают в течение 16 час. После удаления растворителя при пониженном давлении остаток очищают хроматографией на силикагеле с использованием смеси этилацетат/гептан (4:1) в качестве элюента. Фракции, содержащие продукт, упаривают с получением белой пены. Выход 1 г.
(ii) Пиперидин-4-иламид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
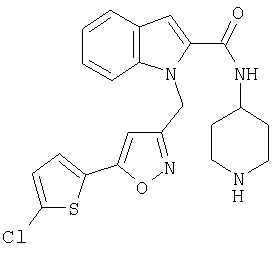
К 1 г трет-бутилового эфира 4-({1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбонил}амино)пиперидин-1-карбоновой кислоты добавляют 10 мл метанольной хлористоводородной кислоты (8 М) и смесь перемешивают при КТ в течение 2 час. После удаления растворителя при пониженном давлении остаток отгоняют дважды совместно с 10 мл толуола. Полученное твердое вещество слегка желтого цвета используют в последующей реакции без дальнейшей очистки.
Выход 0,85 г.
(iii) [1-(Тетрагидропиран-4-ил)пиперидин-4-ил]амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
В раствор 50 мг пиперидин-4-иламида 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты и 35 мг тетрагидропиран-4-она в 2 мл ацетонитрила вводят 14 мг Na(CN)BH3. После перемешивания при КТ в течение 16 час реакционную смесь концентрируют при пониженном давлении и очищают препаративной ВЭЖХ (C 18 колонка с обращенной фазой, элюирование градиентом смеси H2O/MeCN с 0,5% ТФУК). Фракции, содержащие продукт, упаривают и лиофилизируют. Продукт получают в виде его трифторацетатной соли.
Выход 14 мг МС (ESI+): m/е=525, изотопное распределение атомов хлора.
По аналогичной методике примера 49 получают следующие соединения.
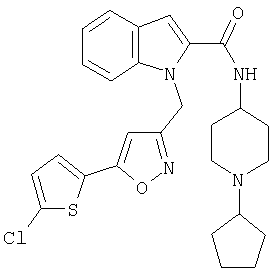
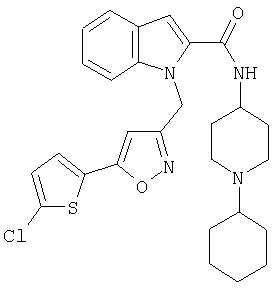
Пример 52: (1-изопропилпиперидин-4-ил)амид 1-(3-метоксибензил)-1Н-индол-2-карбоновой кислоты
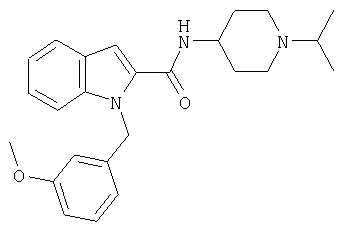
Указанное в заголовке соединение получают по аналогичной методике примера 1 с тем отличием, что вместо 3-бромметил-5-(5-хлортиофен-2-ил)изоксазола используют 1-бромметил-3-метоксибензол. МС (ESI+): m/е=406.
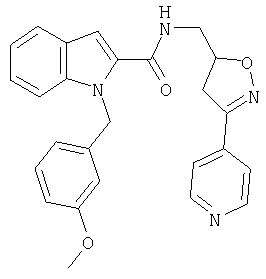
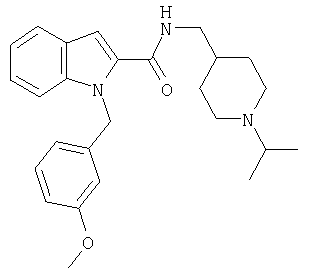
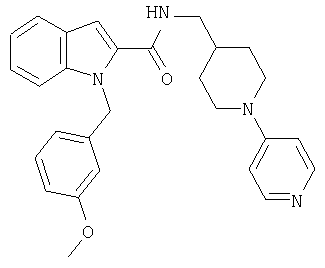
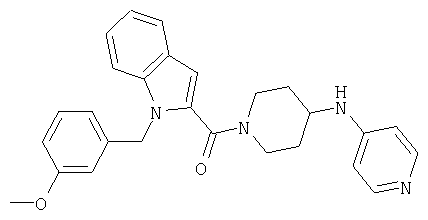
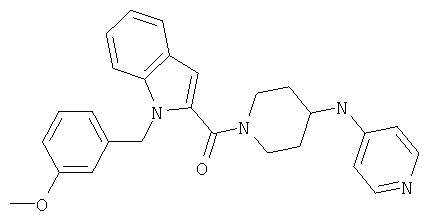


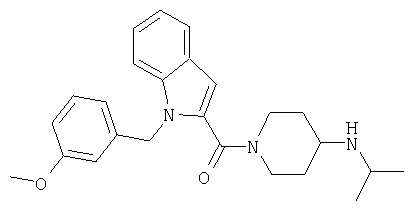


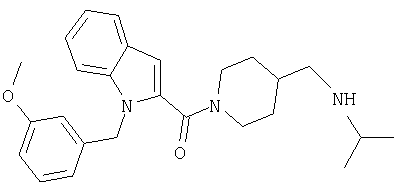
Пример 65: (4-пиридин-4-илфенил)амид 1-(3-метоксибензил)-1Н-индол-2-карбоновой кислоты
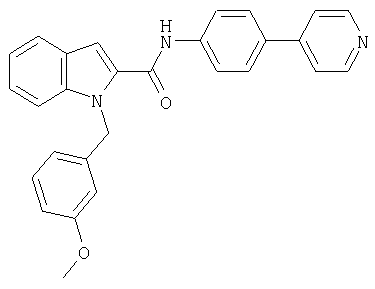
(i) (4-Йодфенил)амид 1-(3-метоксибензил)-1Н-индол-2-карбоновой кислоты
К раствору 500 мг 1-(3-метоксибензил)-1Н-индол-2-карбоновой кислоты в 8 мл ДХМ и 0,9 мл NEt3 при КТ добавляют 452 мг ВОР-Cl и смесь перемешивают в течение 30 мин. После добавления 583 мг 4-йодфениламина смесь перемешивают в течение 16 час. Далее растворитель удаляют при пониженном давлении с получением белого осадка, который промывают 1 мл смеси МеОН/ДХМ (1:1). Выход 380 мг.
(ii) (4-Пиридин-4-илфенил)амид 1-(3-метоксибензил)-1Н-индол-2-карбоновой кислоты
Раствор 100 мг (4-йодфенил)амида 1-(3-метоксибензил)-1Н-индол-2-карбоновой кислоты, 31 мг 4-пиридилбороновой кислоты и 200 мкл водного раствора Na2CO3 (2 M) в 5 мл диметоксиэтана (DME) продувают аргоном в течение 15 мин. Далее добавляют 20 мг Pd(PPh3)4 и смесь нагревают при 80°С в течение 16 час. Окончательно добавляют 3 мл насыщенного раствора NaHCO3 и смесь фильтруют через картридж chem elut® с элюированием этилацетатом. После последующего удаления растворителя при пониженном давлении остаток очищают препаративной ВЭЖХ (С18 колонка с обращенной фазой, элюирование градиентом смеси H2O/MeCN с 0,1% ТФУК). Фракции, содержащие продукт, упаривают и лиофилизируют с получением белого твердого вещества. Продукт получают в виде его трифторацетатной соли. Выход 15 мг
MC(ESI+): m/e=434.
Пример 66: (1-изопропилпиперидин-4-ил)амид 4-метокси-1-(3-метоксибензил)-1Н-индол-2-карбоновой кислоты

Указанное в заголовке соединение получают по аналогичной методике примера 52 с тем отличием, что вместо 1Н-индол-2-карбоновой кислоты используют 4-метокси-1Н-индол-2-карбоновую кислоту.
МС (ESI+): m/е=436.
Пример 67: (1-изопропилпиперидин-4-ил)амид 5-хлор-1-(3-метоксибензил)-1Н-индол-2-карбоновой кислоты

Указанное в заголовке соединение получают по аналогичной методике примера 57 с тем отличием, что вместо 1Н-индол-2-карбоновой кислоты используют 5-хлор-1Н-индол-2-карбоновую кислоту.
МС (ESI+): m/е=440, изотопное распределение атомов хлора.
Пример 68: (1-изопропилпиперидин-4-ил) амид 6-метокси-1-(3-метоксибензил)-1Н-индол-2-карбоновой кислоты
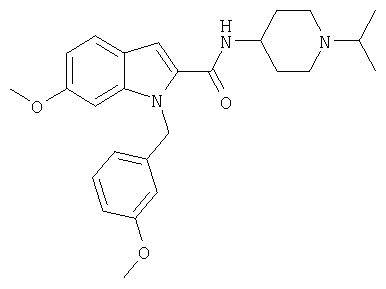
Указанное в заголовке соединение получают по аналогичной методике примера 52 с тем отличием, что вместо 1Н-индол-2-карбоновой кислоты используют 6-метокси-1H-индол-2-карбоновую кислоту.
МС (ESI+): m/е=436.
Пример 69: (1-изопропилпиперидин-4-ил)амид 1-(3-метоксибензил)-5-метил-1Н-индол-2-карбоновой кислоты
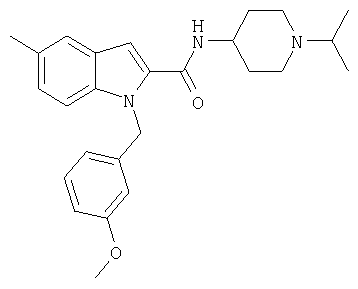
Указанное в заголовке соединение получают по аналогичной методике примера 52 с тем отличием, что вместо 1Н-индол-2-карбоновой кислоты используют 5-метил-1Н-индол-2-карбоновую кислоту.
МС (ESI+): m/е=420.
Пример 70: (1-изопропилпиперидин-4-ил)амид 5-бензилокси-1-(3-метоксибензил)-1Н-индол-2-карбоновой кислоты
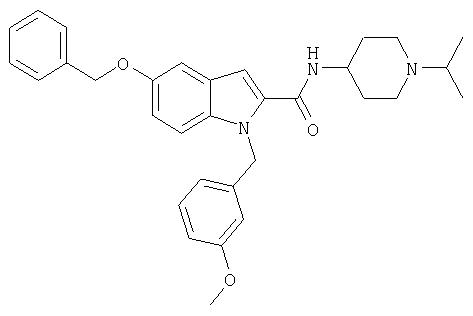
Указанное в заголовке соединение получают по аналогичной методике примера 52 с тем отличием, что вместо 1Н-индол-2-карбоновой кислоты используют 5-бензилокси-1Н-индол-2-карбоновую кислоту.
МС (ESI+): m/е=512.
Пример 71: (1-изопропилпиперидин-4-ил)амид 1-(3-метоксибензил)-5-нитро-1Н-индол-2-карбоновой кислоты
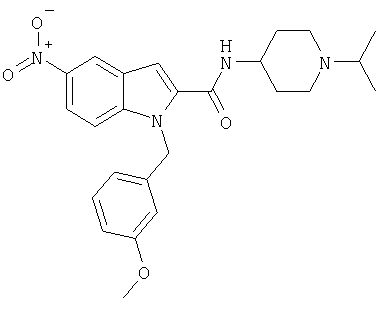
Указанное в заголовке соединение получают по аналогичной методике примера 52 с тем отличием, что вместо 1Н-индол-2-карбоновой кислоты используют 5-нитро-1Н-индол-2-карбоновую кислоту.
МС (ESI+): m/е=451.
Пример 72: (1-изопропилпиперидин-4-ил)амид 5-метокси-1-(3-метоксибензил)-1Н-индол-2-карбоновой кислоты
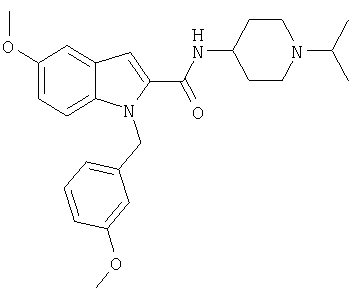
Указанное в заголовке соединение получают по аналогичной методике примера 52 с тем отличием, что вместо 1Н-индол-2-карбоновой кислоты используют 5-метокси-1Н-индол-2-карбоновую кислоту.
МС (ESI+): m/е=436.
Пример 73: (1-изопропилпиперидин-4-ил)амид 1-(3-метоксибензоил)-1Н-индол-2-карбоновой кислоты
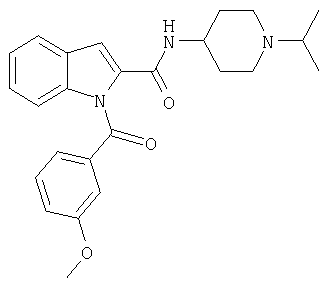
Указанное в заголовке соединение получают по аналогичной методике примера 1 с тем отличием, что вместо 3-бромметил-5-(5-хлортиофен-2-ил)изоксазола используют 3-метоксибензоилхлорид.
МС (ESI+): m/е=420.
Пример 74: (1-изопропилпиперидин-4-ил)амид 1-(3-метоксибензолсульфонил)-1Н-индол-2-карбоновой кислоты
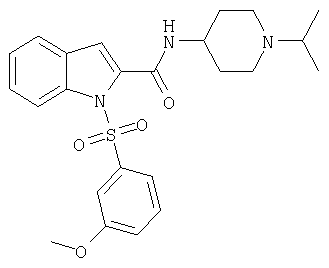
Указанное в заголовке соединение получают по аналогичной методике примера 1 с тем отличием, что вместо 3-бромметил-5-(5-хлортиофен-2-ил)изоксазола используют 3-метоксибензлсульфонилхлорид.
МС (ESI+): m/е=456.
Пример 75: (1-изопропилпиперидин-4-ил)амид 1-(4-метоксифенил)-1Н-индол-2-карбоновой кислоты
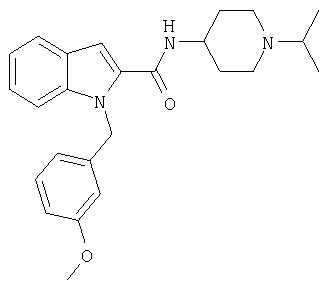
(i) Метиловый эфир 1-(4-метоксифенил)-1Н-индол-2-карбоновой кислоты
К суспензии 2 г метилового эфира 1Н-индол-2-карбоновой кислоты, 3,2 г 4-метоксифенилбороновой кислоты, 2 г молекулярного сита (4Å), 1,7 мл пиридина, 3 мл NEt3 в 40 мл ДХМ добавляют 3,9 г Cu(ОАс)2. Суспензию перемешивают в течение 3 дней при КТ и в течение 2 дней при 50°С, далее добавляют 3 мл насыщенного раствора NaHCO3 и смесь фильтруют через картридж chem elut® с элюированием этилацетатом. После концентрирования при пониженном давлении и хроматографической очистки на силикагеле смесью этилацетат/гептан (4:1) фракции, содержащие продукт, упаривают. Выход 3 г.
(ii) 1-(4-Метоксифенил)-1Н-индол-2-карбоновая кислота
К раствору 3 г метилового эфира 1-(4-метоксифенил)-1Н-индол-2-карбоновой кислоты в 50 мл ТГФ добавляют 10 мл воды и 0,58 г моногидрата гидроксида лития. После перемешивания в течение 2 час при 60°С реакционную смесь охлаждают до КТ. Смесь подкисляют полуконцентрированной хлористоводородной кислотой, осадок собирают фильтрованием и промывают 10 мл воды. Продукт получают в виде белого твердого вещества, которое сушат при пониженном давлении. Выход 520 мг.
(vi) (1-Изопропилпиперидин-4-ил)амид 1-(4-метоксифенил)-1Н-индол-2-карбоновой кислоты
К раствору 36 мг 1-(4-метоксифенил)-1Н-индол-2-карбоновой кислоты в 1 мл ДХМ и 0,17 мл NEt3 при КТ добавляют 34 мг ВОР-Cl и смесь перемешивают в течение 30 мин. После добавления 57 мг гидрохлорида 1-изопропилпиперидин-4-иламина смесь перемешивают в течение ночи. Далее растворитель удаляют при пониженном давлении и остаток очищают препаративной ВЭЖХ (С18 колонка с обращенной фазой, элюирование градиентом смеси H2O/MeCN с 0,1% ТФУК). Фракции, содержащие продукт, упаривают и лиофилизируют с получением белого твердого вещества. Продукт получают в виде его трифторацетатной соли.
Выход 14 мг MC (ESI+): m/e=329.
По аналогичной методике примера 75 получают следующие соединения.
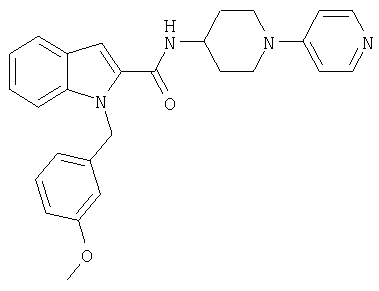

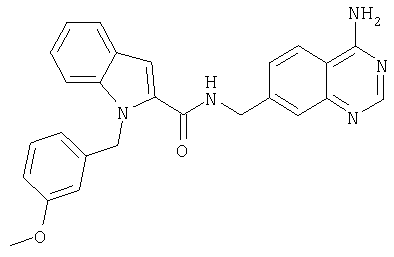
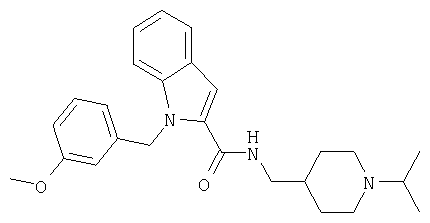
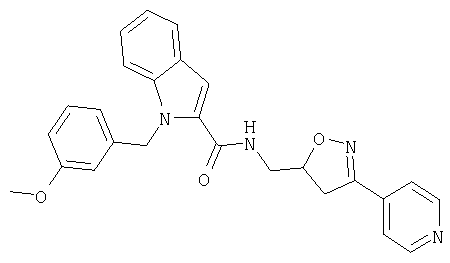
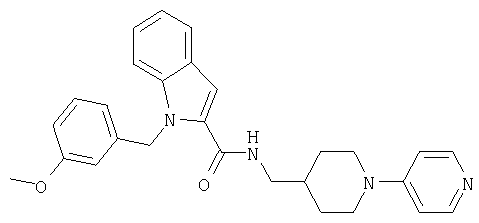

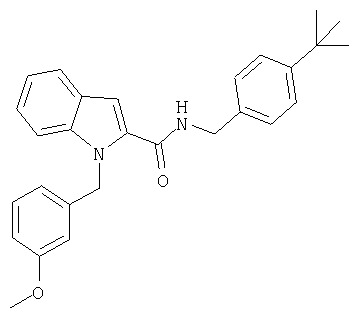


Пример 86: 4-пиридин-4-илбензиламид 1-(4-метоксифенил)-1Н-индол-2-карбоновой кислоты
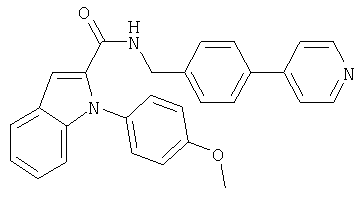
(i) трет-Бутиловый эфир (4-бромбензил)карбаминовой кислоты
К раствору 5 г 4-бромбензиламина и 7 мл NEt3 в 30 мл ДХМ добавляют 5,4 г Boc2O. После перемешивания в течение 16 час при КТ реакционную смесь концентрируют и осадок собирают фильтрованием. Твердый продукт сушат при пониженном давлении и используют в последующей реакции без дальнейшей очистки. Выход 6,5 г.
(ii) трет-Бутиловый эфир (4-пиридин-4-илбензил)карбаминовой кислоты
Раствор 500 мг трет-бутилового эфира (4-бромбензил)карбаминовой кислоты, 213 мг 4-пиридилбороновой кислоты и 500 мкл водного раствора Na2CO3 (2 M) в 5 мл диметоксиэтана продувают аргоном в течение 15 мин. Далее добавляют 60 мг Pd(PPh3)4 и смесь нагревают при 100°С в течение 16 час. Окончательно добавляют 10 мл насыщенного раствора NaHCO3 и смесь фильтруют через картридж chem elut® с элюированием этилацетатом. После последующего удаления растворителя при пониженном давлении остаток очищают хроматографией на силикагеле с этилацетатом в качестве элюента. Фракции, содержащие продукт, упаривают с получением белого твердого вещества. Выход 490 мг.
(iii) 4-Пиридин-4-илбензиламин
К раствору 490 мг трет-бутилового эфира (4-пиридин-4-илбензил)карбаминовой кислоты в 2 мл ДХМ при КТ добавляют 3 мл ТФУК. После перемешивания в течение 12 часов реакционную смесь разбавляют 10 мл толуола и упаривают при пониженном давлении с получением коричневой пены. Продукт получают в виде его трифторацетатной соли. Выход 330 мг
(iv) 4-Пиридин-4-илбензиламид 1-(4-метоксифенил)-1H-индол-2-карбоновой кислоты
К раствору 50 мг 1-(4-метоксифенил)-1Н-индол-2-карбоновой кислоты и 100 мкл NEt3 в 2 мл ДХМ при КТ добавляют 47 мг ВОР-Cl. Через 1 час добавляют 51 мг 4-пиридин-4-илбензиламина и реакционную смесь перемешивают в течение 16 час. После удаления растворителя при пониженном давлении остаток очищают препаративной ВЭЖХ (С18 колонка с обращенной фазой, элюирование градиентом смеси H2O/MeCN с 0,1% ТФУК). Фракции, содержащие продукт, упаривают и лиофилизируют с получением белого твердого вещества. Продукт получают в виде его трифторацетатной соли.
Выход 27 мг. MC (ESI+): m/e=434.
Пример 87: (1-изопропилпиперидин-4-ил)амид 1-(3-метоксифенил)-1Н-индол-2-карбоновой кислоты
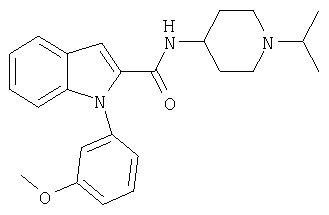
Указанное в заголовке соединение получают по аналогичной методике примера 75 с тем отличием, что вместо 4-метоксифенилбороновой кислоты используют 3-метоксифенилбороновую кислоту.
MC (ESI+): m/e=392.
Пример 88: (1-изопропилпиперидин-4-ил)амид 1-(3-хлорфенил)-1Н-индол-2-карбоновой кислоты
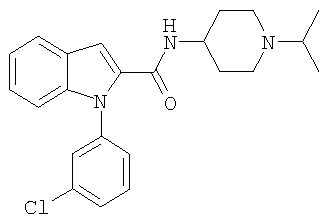
Указанное в заголовке соединение получают по аналогичной методике примера 75 с тем отличием, что вместо 4-метоксифенилбороновой кислоты используют 3-хлорфенилбороновую кислоту.
MC (ESI+): m/e=396, изотопное распределение атомов хлора.
По аналогичной методике примера 88 получают следующие соединения.
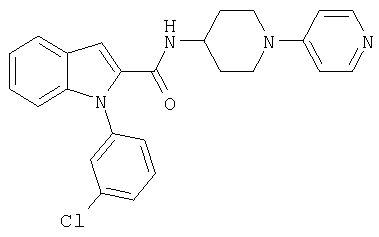
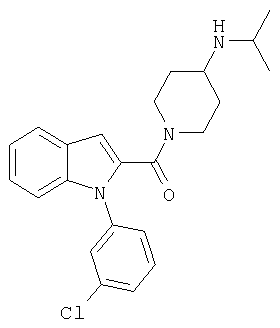

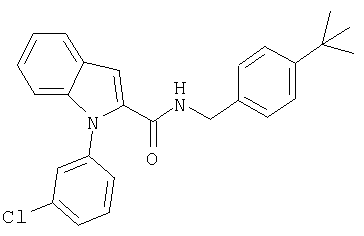

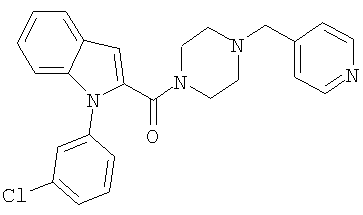
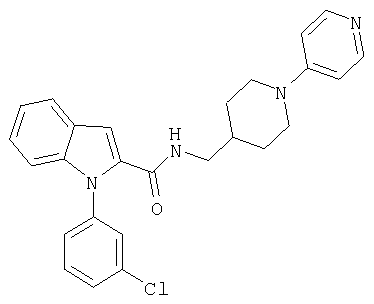
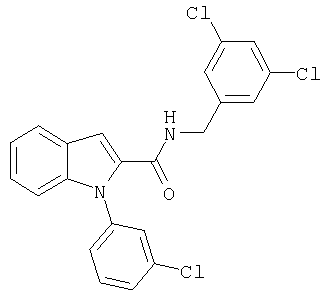
Пример 98: 4-пиридин-4-илбензиламид 1-(3-хлорфенил)-1Н-индол-2-карбоновой кислоты
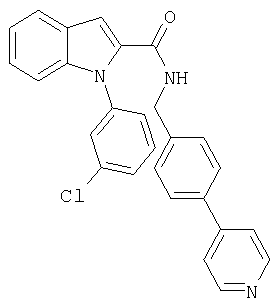
Указанное в заголовке соединение получают по аналогичной методике примера 86 с тем отличием, что вместо 1-(4-метоксифенил)-1Н-индол-2-карбоновой кислоты используют 1-(3-хлорфенил)-1Н-индол-2-карбоновую кислоту.
MC (ESI+): m/e=438, изотопное распределение атомов хлора.
Пример 99: (1-изопропилпиперидин-4-ил)амид 1-(3,5-дихлорфенил)-1Н-индол-2-карбоновой кислоты
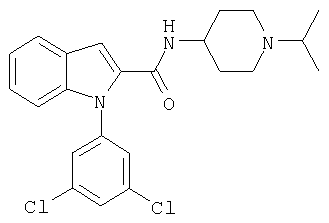
Указанное в заголовке соединение получают по аналогичной методике примера 75 с тем отличием, что вместо 4-метоксифенилбороновой кислоты используют 3,5-дихлорфенилбороновую кислоту.
MC (ESI+): m/e=430, изотопное распределение атомов хлора.
По аналогичной методике примера 99 получают следующие соединения.
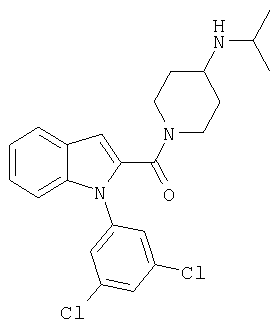
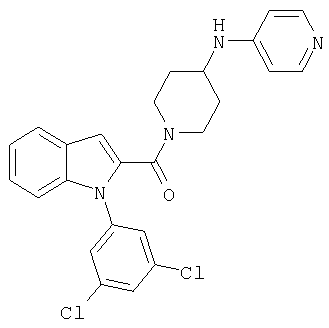
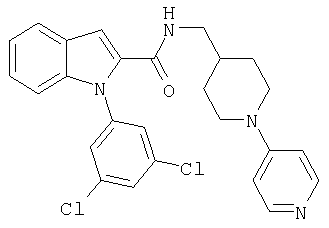
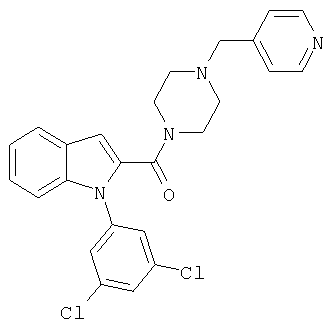
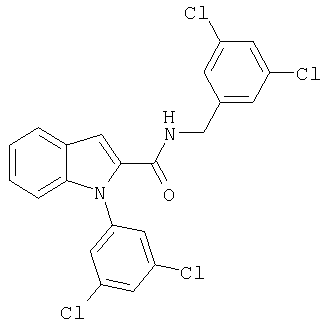
Пример 106: (1-изопропилпиперидин-4-ил)амид 1-(4-хлорфенил)-1Н-индол-2-карбоновой кислоты
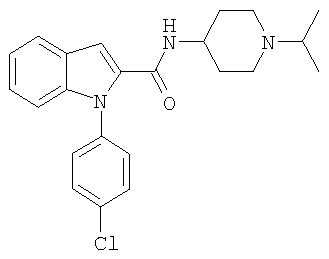
Указанное в заголовке соединение получают по аналогичной методике примера 75 с тем отличием, что вместо 4-метоксифенилбороновой кислоты используют 4-хлорфенилбороновую кислоту.
MC (ESI+): m/e=396, изотопное распределение атомов хлора.
По аналогичной методике примера 107 получают следующие соединения.
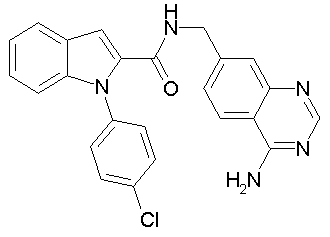
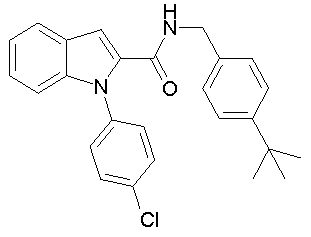
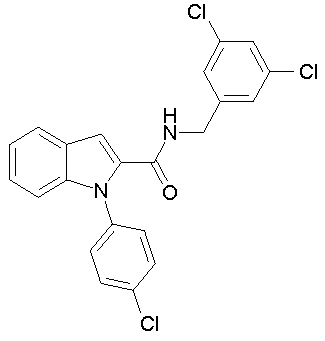


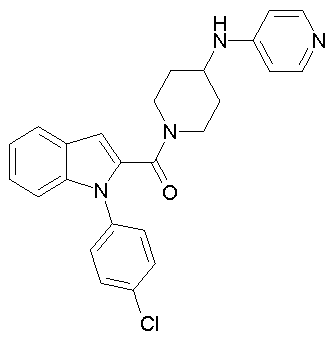
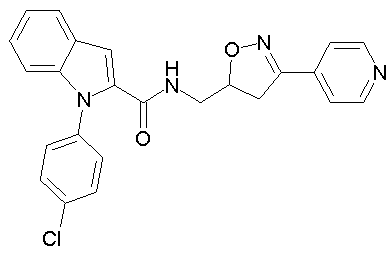
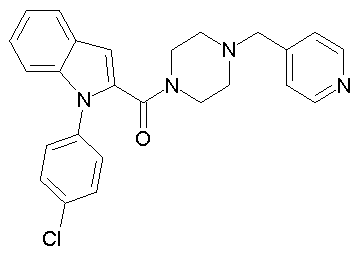
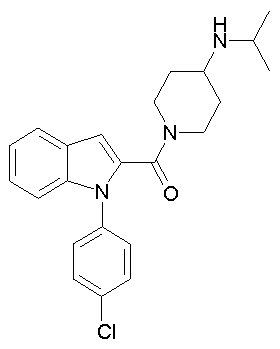
Пример 117: 4-пиридин-4-илбензиламид 1-(4-хлорфенил)-1Н-индол-2-карбоновой кислоты
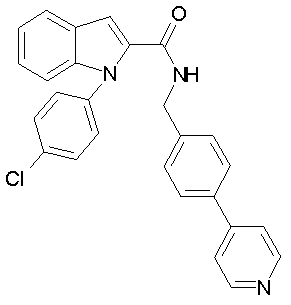
Указанное в заголовке соединение получают по аналогичной методике примера 86 с тем отличием, что вместо 1-(4-метоксифенил)-1Н-индол-2-карбоновой кислоты используют 1-(4-хлорфенил)-1Н-индол-2-карбоновую кислоту.
MC (ESI+): m/e=438, изотопное распределение атомов хлора.
Пример 118: (1-изопропилпиперидин-4-ил)амид 1-(4-аминохиназолин-7-илметил)-1Н-индол-2-карбоновой кислоты
Указанное в заголовке соединение получают по аналогичной методике примера 1 с тем отличием, что вместо 3-бромметил-5-(5-хлортиофен-2-ил)изоксазола используют 7-бромметилхиназолин-4-иламин [полученный путем адаптации методики, описанной Ewing, William R.; Becker, Michael R.; Choi-Sledeski, Yong Mi; Puuls, Heinz W.; He, Wei; Condon, Stephen M.; Davis, Roderick S.; Hanney, Barbara A.; Spada, Alfred P.; Burns, Christopher J.; Jiang, John Z.; Li, Aiwen; Myers, Michael R.; Lau, Wan F.; Poli, Gregory В.; PCT Int. Appl. (2001), 460 pp. WO 0107436 A2].
MC (ESI+): m/e=443.
Пример 119: (1-изопропилпиперидин-4-ил)амид 1-(6-хлорбензо[b]тиофен-2-илметил)-1Н-индол-2-карбоновой кислоты
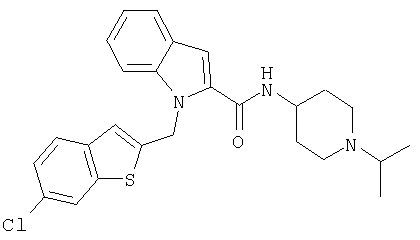
Указанное в заголовке соединение получают по аналогичной методике примера 1 с тем отличием, что вместо 3-бромметил-5-(5-хлортиофен-2-ил)изоксазола используют 2-бромметил-6-хлор-бензо[b]тиофен [полученный путем адаптации методики, описанной Ewing, William R. et al. in PCT Int. Appl. (1999), 300 pp. WO 9937304 Al, и Ewing, William R. et al. PCT Int. Appl. (2001), 460 pp. WO 0107436 A2].
MC(ESI+): m/e=466, изотопное распределение атомов хлора.
Пример 120: (1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)-[1,3,4]тиадиазол-2-илметил]-1Н-индол-2-карбоновой кислоты
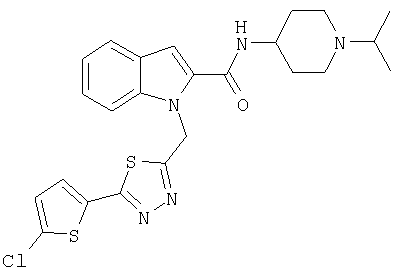
Указанное в заголовке соединение получают по аналогичной методике примера 1 с тем отличием, что вместо 3-бромметил-5-(5-хлортиофен-2-ил)изоксазола используют 2-бромметил-5-(5-хлортиофен-2-ил)-[1,3,4]тиадиазол [полученный путем адаптации методики, описанной Ewing, William R. et al. PCT Int. Appl. (2001), 460 pp. WO 0107436 A2].
MC (ESI+): m/e=500, изотопное распределение атомов хлора.
Пример 121: (1-изопропилпиперидин-4-ил)амид 1-[3-(5-хлортиофен-2-ил)изоксазол-5-илметил]-1Н-индол-2-карбоновой кислоты
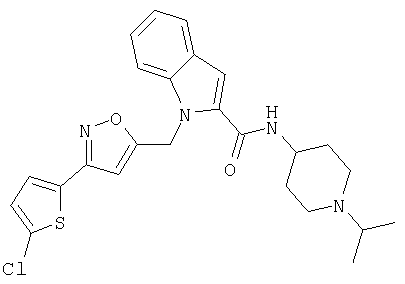
Указанное в заголовке соединение получают по аналогичной методике примера 1 с тем отличием, что вместо 3-бромметил-5-(5-хлортиофен-2-ил)изоксазола используют 5-бромметил-3-(5-хлортиофен-2-ил)изоксазол [Ewing, William R. et al. PCT Int. Appl. (2001), 460 pp. WO 0107436 A2].
MC (ESI+): m/e=483, изотопное распределение атомов хлора.
Пример 122: (1-изопропилпиперидин-4-ил)амид 3-хлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
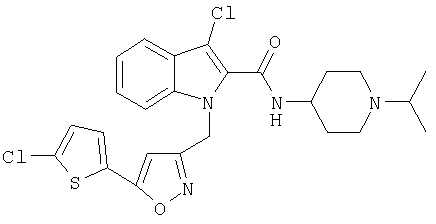
К раствору 40 мг 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты добавляют (1-изопропилпиперидин-4-ил)амид в 1 мл ДХМ, 17 мг NCS и смесь перемешивают при КТ в течение 16 час. Окончательно реакционную смесь непосредственно очищают препаративной ОФ-ВЭЖХ с элюированием градиентом 0-100% ацетонитрила в воде (+0,01% трифторуксусной кислоты). После лиофилизации продукт получают в виде его трифторацетатной соли.
Выход 15 мг. MC (ESI+): m/e=517, изотопное распределение атомов хлора.
Пример 123: (1-изопропилпиперидин-4-ил)амид 3-бром-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
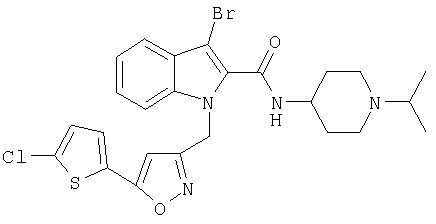
К раствору 40 мг 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты добавляют (1-изопропилпиперидин-4-ил)амид в 1 мл ДХМ, 22 мг NBS и смесь перемешивают при КТ в течение ночи. Окончательно реакционную смесь непосредственно очищают препаративной ОФ-ВЭЖХ с элюированием градиентом 0-100% ацетонитрила в воде (+0,01% трифторуксусной кислоты). После лиофилизации продукт получают в виде его трифторацетатной соли.
Выход 18 мг. MC (ESI+): m/e=562, изотопное распределение атомов хлора.
Пример 124: (1-изопропилпиперидин-4-ил)амид 1-(4-хлорбензил)-1Н-индол-2-карбоновой кислоты
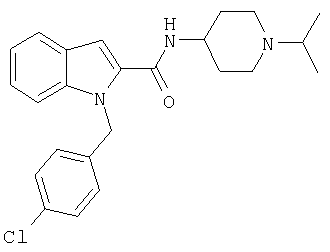
Указанное в заголовке соединение получают по аналогичной методике примера 1 с тем отличием, что вместо 3-бромметил-5-(5-хлортиофен-2-ил)изоксазола используют 1-хлорметил-4-хлорбензол.
MC (ESI+): m/e=410, изотопное распределение атомов хлора.
По аналогичной методике примера 124 получают следующие соединения.
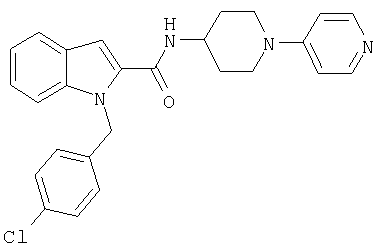
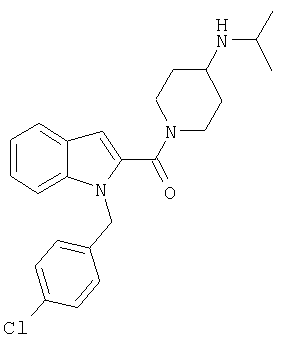
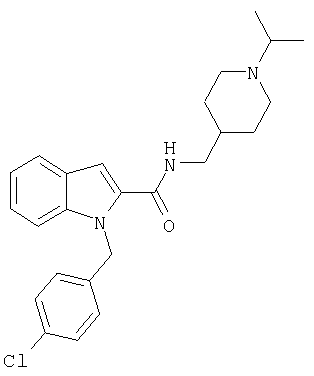
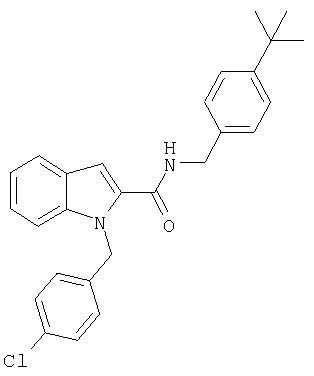
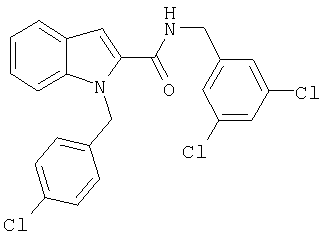
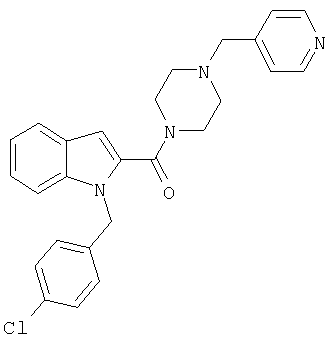
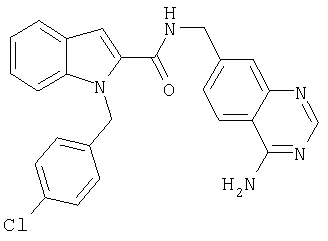
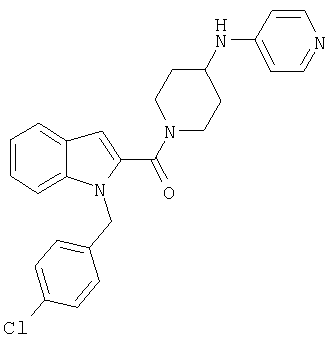
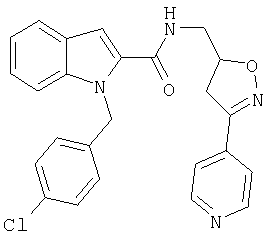

Пример 135: (1-изопропилпиперидин-4-ил)амид 1-(2,4-дихлорбензил)-1Н-индол-2-карбоновой кислоты
Указанное в заголовке соединение получают по аналогичной методике примера 1 с тем отличием, что вместо 3-бромметил-5-(5-хлортиофен-2-ил)изоксазола используют 1-хлорметил-2,4-дихлорбензол.
MC (ESI+): m/e=444, изотопное распределение атомов хлора.
По аналогичной методике примера 135 получают следующие соединения.
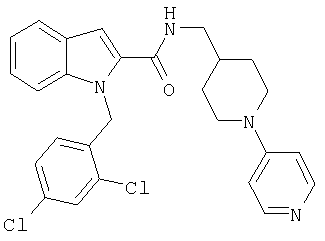
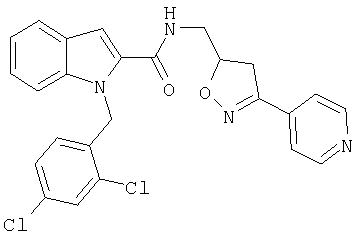
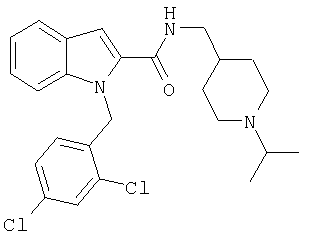

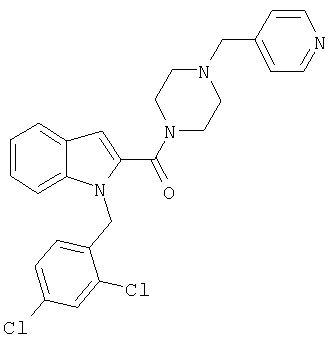
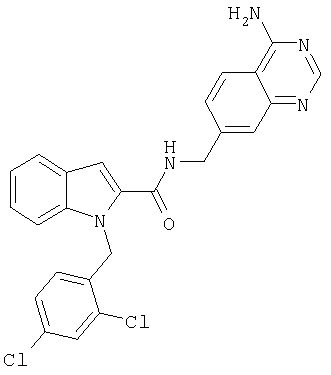

Пример 144: (1-изопропилпиперидин-4-ил)амид 1-(4-метоксибензил)-1Н-индол-2-карбоновой кислоты
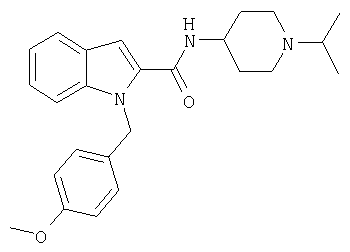
Указанное в заголовке соединение получают по аналогичной методике примера 1 с тем отличием, что вместо 3-бромметил-5-(5-хлортиофен-2-ил)изоксазола используют 1-хлорметил-4-метоксибензол.
MC (ESI+): m/e=406.
Пример 145: (4-изопропиламинопиперидин-1-ил)-[1-(4-метоксибензил)-1Н-индол-2-ил]метанон
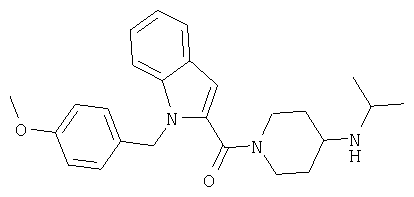
Указанное в заголовке соединение получают по аналогичной методике примера 1 с тем отличием, что вместо 1-изопропилпиперидин-4-иламина используют 4-изопропилпиперидин-1-иламин.
MC (ESI+): m/e=406.
Пример 146: (1-изопропилпиперидин-4-ил)амид 1-(4-трифторметоксибензил)-1Н-индол-2-карбоновой кислоты
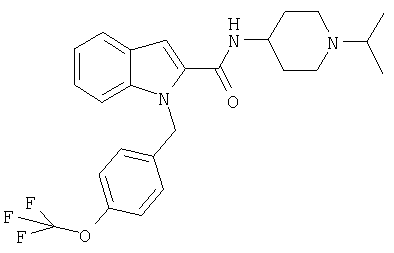
Указанное в заголовке соединение получают по аналогичной методике примера 1 с тем отличием, что вместо 3-бромметил-5-(5-хлортиофен-2-ил)изоксазола используют 1-бромметил-4-трифторметоксибензол.
MC (ESI+): m/e=459.
Пример 147: (4-изопропиламинопиперидин-1-ил)-[1-(4-трифторметоксибензил)-1Н-индол-2-ил]метанон
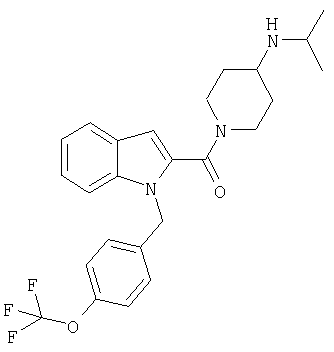
Указанное в заголовке соединение получают по аналогичной методике примера 146 с тем отличием, что вместо 1-изопропилпиперидин-4-иламина используют изопропилпиперидин-4-иламин.
MC (ESI+): m/e=459.
Пример 148: (1-изопропилпиперидин-4-ил)амид 1-(2-хлорбензил)-1Н-индол-2-карбоновой кислоты
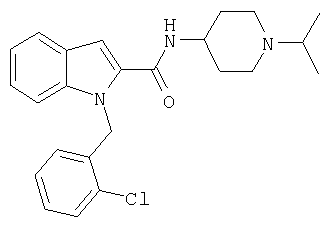
Указанное в заголовке соединение получают по аналогичной методике примера 1 с тем отличием, что вместо 3-бромметил-5-(5-хлортиофен-2-ил)изоксазола используют 1-бромметил-2-хлорбензол.
MC (ESI+): m/e=410, изотопное распределение атомов хлора.
По аналогичной методике примера 148 получают следующие соединения.
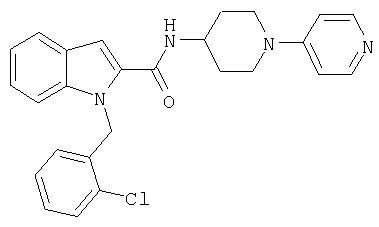
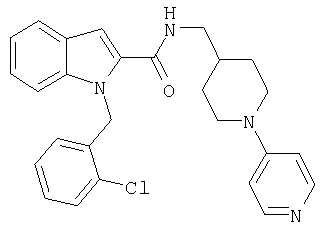
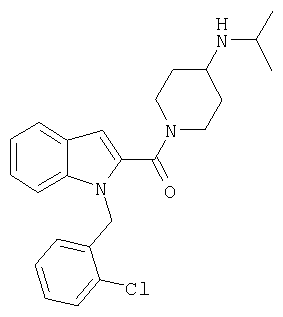

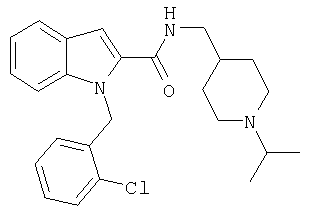
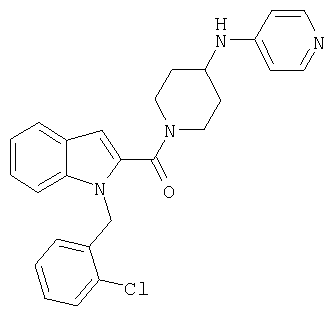
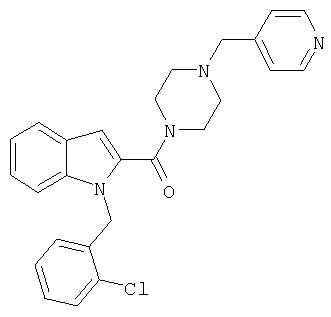
Пример 157: (1-изопропилпиперидин-4-ил)амид 1-(3,5-дихлорбензил)-1Н-индол-2-карбоновой кислоты
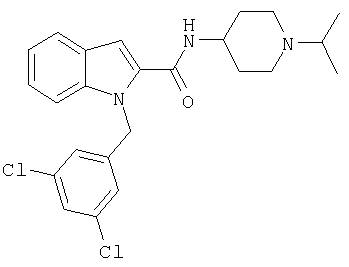
Указанное в заголовке соединение получают по аналогичной методике примера 1 с тем отличием, что вместо 3-бромметил-5-(5-хлортиофен-2-ил)изоксазола используют 1-хлорметил-3,5-дихлорбензол.
MC (ESI+): m/e=444, изотопное распределение атомов хлора.
Пример 158: [1-(3,5-дихлорбензил)-1Н-индол-2-ил]-(4-изопропиламинопиперидин-1-ил)метанон
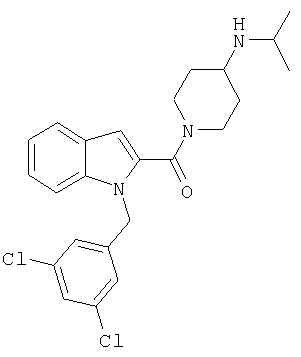
Указанное в заголовке соединение получают по аналогичной методике примера 157 с тем отличием, что вместо 1-изопропилпиперидин-4-иламина используют изопропилпиперидин-4-иламин.
MC (ESI+): m/e=443, изотопное распределение атомов хлора.
Пример 159: (1-изопропилпиперидин-4-ил)амид 3-фтор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
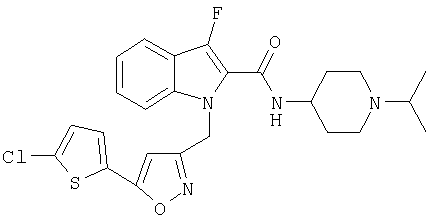
К раствору 40 мг (1-изопропилпиперидин-4-ил)амида 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты в 1 мл ДХМ добавляют 22 мг трифлата N-фторпиридиния и смесь перемешивают при КТ в течение 4 дней. Окончательно реакционную смесь непосредственно очищают препаративной ОФ-ВЭЖХ с элюированием градиентом 0-100% ацетонитрила в воде (+0,01% трифторуксусной кислоты). После лиофилизации продукт получают в виде его трифторацетатной соли.
Выход 22 мг MC (ESI+): m/e=501, изотопное распределение атомов хлора.
Пример 160: (1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-3-циано-1Н-индол-2-карбоновой кислоты
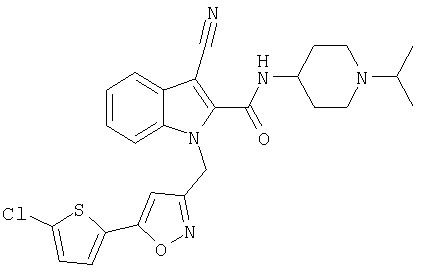
(i) Метиловый эфир 3-йод-1Н-индол-2-карбоновой кислоты
К раствору 2 г метилового эфира 1Н-индол-2-карбоновой кислоты и 2,1 г КОН в 20 мл ДМФА по каплям при КТ добавляют раствор 2,7 г 12 в 10 мл ДМФА. После 30 мин реакционную смесь разбавляют раствором 2,5 г NaHSO3 в 100 мл воды. Продукт собирают в виде белого осадка фильтрованием и промывают 10 мл воды. Выход 3 г.
(ii) Метиловый эфир 3-циано-1Н-индол-2-карбоновой кислоты
К раствору 2 г метилового эфира 3-йод-1Н-индол-2-карбоновой кислоты в 10 мл ДМФА и 20 мл ТГФ добавляют 1,5 г CuCN, 434 мг Et4NCN и 461 мг DPPF и смесь продувают аргоном в течение 15 мин. Далее вводят 254 мг Pd2(dba)3 и реакционную смесь нагревают при 80°С в течение 5 час. Окончательно добавляют 10 мл насыщенного раствора NaHCO3 и смесь фильтруют через картридж chem elut® с элюированием ДХМ. После дальнейшего удаления растворителя при пониженном давлении остаток очищают хроматографией на силикагеле с этилацетатом в качестве элюента. Фракции, содержащие продукт, упаривают с получением белого твердого вещества. Выход 1,2 г.
(iii) Метиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-3-циано-1Н-индол-2-карбоновой кислоты
Данное соединение получают, применяя методику, аналогичную описанной для получения соединения примера 1 (iv), используя метиловый эфир 3-циано-1Н-индол-2-карбоновой кислоты в качестве исходного вещества.
(iv) 1-[5-(5-Хлортиофен-2-ил)изоксазол-3-илметил]-3-циано-1Н-индол-2-карбоновая кислота
Данное соединение получают, применяя методику, аналогичную описанной для получения соединения примера 1 (v), используя метиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-3-циано-1Н-индол-2-карбоновой кислоты в качестве исходного вещества.
(v) (1-Изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-3-циано-1Н-индол-2-карбоновой кислоты
Данное соединение получают, применяя методику, аналогичную описанной для получения соединения примера 1 (vi), используя 1-[5- (5-хлортиофен-2-ил)изоксазол-3-илметил]-3-циано-1Н-индол-2-карбоновую кислоту в качестве исходного вещества.
МС (ESI+): m/е=508, изотопное распределение атомов хлора.
Пример 161: (1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-3-циано-7-метил-1Н-индол-2-карбоновой кислоты
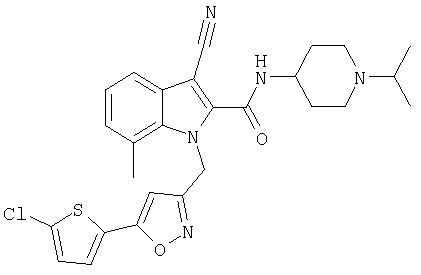
Данное соединение получают по аналогичной методике примера 86 с тем отличием, что вместо метилового эфира 1Н-индол-2-карбоновой кислоты используют метиловый эфир 7-метил-1Н-индол-2-карбоновой кислоты.
МС (ESI+): m/е=522, изотопное распределение атомов хлора.
Пример 162: (1-изопропилпиперидин-4-ил)амид 1-[2-(5-хлортиофен-2-ил)изоксазол-5-илметил]-1Н-индол-2-карбоновой кислоты
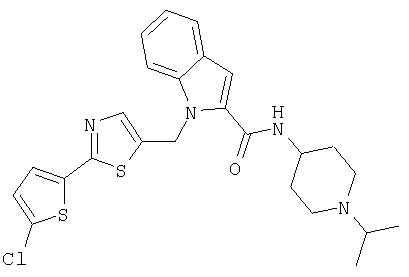
Указанное в заголовке соединение получают по аналогичной методике примера 1 с тем отличием, что вместо 3-бромметил-5-(5-хлортиофен-2-ил)изоксазола используют 5-бромметил-2-(5-хлортиофен-2-ил)тиазол [полученный по адаптированной методике, описанной Ewing, William R. et al.; PCT Int. Appl. (2001), 460 pp. WO 0107436 A2].
MC (ESI+): m/e=499, изотопное распределение атомов хлора.
Пример 163: (1-изопропилпиперидин-4-ил)амид 1-(3-хлорбензил)-1Н-индол-2-карбоновой кислоты

Указанное в заголовке соединение получают по аналогичной методике примера 1 с тем отличием, что вместо 3-бромметил-5-(5-хлортиофен-2-ил)изоксазола используют 1-бромметил-3-хлорбензол.
MC (ESI+): m/e=410, изотопное распределение атомов хлора.
Пример 164: [1-(3-хлорбензил)-1Н-индол-2-ил]-(4-изопропиламинопиперидин-1-ил)метанон
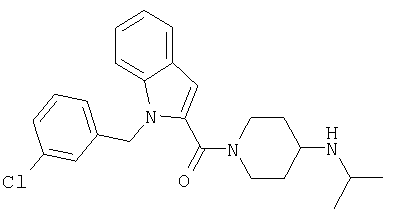
Указанное в заголовке соединение получают по аналогичной методике примера 163 с тем отличием, что вместо 1-изопропилпиперидин-4-иламина используют изопропилпиперидин-4-иламин.
MC (ESI+): m/e=409, изотопное распределение атомов хлора.
Пример 165: (1-изопропилпиперидин-4-ил)амид 1-(3-карбамоилбензил)-1Н-индол-2-карбоновой кислоты
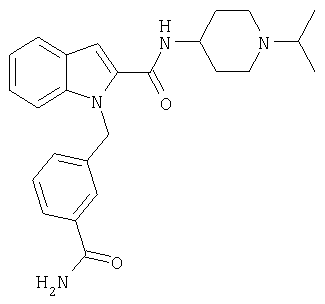
Указанное в заголовке соединение получают по аналогичной методике примера 1 с тем отличием, что вместо 3-бромметил-5-(5-хлортиофен-2-ил)изоксазола используют 3-бромметилбензамид.
MC (ESI+): m/e=419.
Пример 166: 3-[2-(4-изопропиламинопиперидин-1-карбонил)индол-1-илметил]бензамид
Указанное в заголовке соединение получают по аналогичной методике примера 165 с тем отличием, что вместо 1-изопропилпиперидин-4-иламина используют изопропилпиперидин-4-иламин.
MC (ESI+): m/e=419.
Пример 167: (1-изопропилпиперидин-4-ил)амид 1-(3,5-диметоксибензил)-1Н-индол-2-карбоновой кислоты

Указанное в заголовке соединение получают по аналогичной методике примера 1 с тем отличием, что вместо 3-бромметил-5-(5-хлортиофен-2-ил)изоксазола используют 1-хлорметил-3,5-диметоксибензол.
MC (ESI+): m/e=435.
Пример 168: [1-(3,5-диметоксибензил)-1Н-индол-2-ил]-(4-изопропиламинопиперидин-1-ил)метанон
Указанное в заголовке соединение получают по аналогичной методике примера 167 с тем отличием, что вместо 1-изопропилпиперидин-4-иламина используют изопропилпиперидин-4-иламин.
MC (ESI+): m/e=435.
Пример 169: (1-изопропилпиперидин-4-ил)амид 1-[2-(4-хлорфенил)этил]-1Н-индол-2-карбоновой кислоты
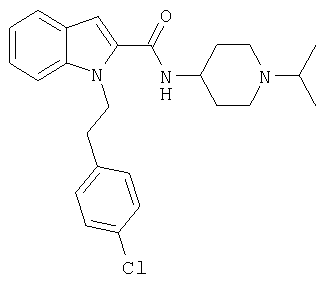
(i) 2-(4-Хлорфенил)этиловый эфир толуол-4-сульфоновой кислоты
5 г (31,9 ммоль) 2-(4-хлорфенил)этанола растворяют в 100 мл пиридина и раствор охлаждают до 0°С. К раствору добавляют 6,09 г (31,9 ммоль) пара-толуолсульфонилхлорида и реакционную смесь перемешивают при 0°С в течение 2 час, далее при комнатной температуре в течение 16 час. Растворитель удаляют при пониженном давлении, остаток переносят в этилацетат и раствор промывают однократно насыщенным водным раствором бикарбоната натрия, однократно водой и однократно насыщенным водным раствором хлорида натрия. Органическую фазу сушат сульфатом натрия, фильтруют и удаляют растворитель при пониженном давлении. Соединение перекристаллизовывают из смеси н-гептан/этилацетат.
Выход 6,23 г. МС (CI+): m/e=311, изотопное распределение атомов хлора.
(ii) Этиловый эфир 1-[2-(4-хлорфенил)этил]-1Н-индол-2-карбоновой кислоты
0,5 г (2,6 ммоль) этилового эфира 1Н-индол-2-карбоновой кислоты растворяют в ДМФА и добавляют 116 мг (2,9 ммоль) гидрида натрия (60% дисперсия в минеральном масле). Раствор перемешивают в течение 30 мин при комнатной температуре, далее охлаждают до -78°С. К данному охлажденному раствору добавляют раствор 0,82 г (2,6 ммоль) 2-(4-хлорфенил)этилового эфира толуол-4-сульфоновой кислоты в ДМФА. Раствор нагревают до КТ и перемешивают в течение 16 час. Растворитель удаляют при пониженном давлении, остаток переносят в этилацетат и раствор промывают однократно насыщенным водным раствором бикарбоната натрия, однократно водой и однократно насыщенным водным раствором хлорида натрия. Органическую фазу сушат сульфатом магния, фильтруют и удаляют растворитель при пониженном давлении. Остаток хроматографируют на силикагеле с элюированием градиентом смеси н-гептан/этилацетат.
Выход 480 мг. МС (CI+): m/е=328, изотопное распределение атомов хлора.
(iii) 1-[2-(4-Хлорфенил)этил]-1Н-индол-2-карбоновая кислота
480 мг (1,5 ммоль) этилового эфира 1-[2-(4-хлорфенил)этил]-1Н-индол-2-карбоновой кислоты растворяют в 5 мл диоксана и добавляют 5 мл 2 н. водного раствора гидроксида натрия. Реакционную смесь нагревают при 60°С в течение 2 час, далее охлаждают до 0°С. Раствор разбавляют 10 мл воды и доводят рН раствора до значения от 2 до 3 добавлением концентрированного водного раствора HCl до осаждения продукта. Продукт отфильтровывают и сушат при пониженном давлении.
Выход 390 мг. МС (CI+): m/e=300, изотопное распределение атомов хлора.
(iv) (1-Изопропилпиперидин-4-ил)амид 1-[2-(4-хлорфенил)этил]-1Н-индол-2-карбоновой кислоты
50 мг (0,2 ммоль) этилового эфира 1-[2-(4-хлорфенил)этил]-1Н-индол-2-карбоновой кислоты растворяют в 2 мл ДМФА и добавляют 54,7 мг (0,2 ммоль) TOTU и 0,21 мл (1,7 ммоль) NEM. Данный раствор перемешивают при комнатной температуре в течение 30 мин. Добавляют 35,9 мг (0,2 ммоль) дигидрохлорида 1-изопропилпиперидин-4-иламина и полученный раствор перемешивают при комнатной температуре в течение 16 час. Продукт очищают препаративной ОФ-ВЭЖХ с элюированием градиентом 0-100% ацетонитрила в воде (+0,01% трифторуксусной кислоты). После лиофилизации продукт получают в виде его трифторацетатной соли.
Выход 46,9 мг. МС (TOF-ESI+): m/e=424, изотопное распределение атомов хлора.
Пример 170: (1-изопропилпиперидин-4-ил)амид 1-[2-(2,4-дихлорфенил)этил]-1Н-индол-2-карбоновой кислоты
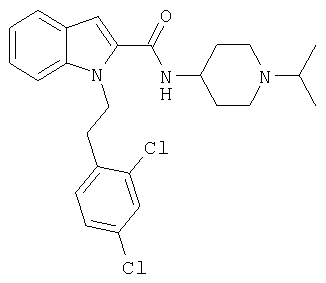
(i) 2-(2,4-Дихлорфенил)этиловый эфир толуол-4-сульфоновой кислоты
Данное соединение получают, применяя методику, аналогичную описанной для получения соединения примера 169 (i), используя 2-(2,4-дихлорфенил)этанол в качестве исходного вещества. Данное соединение перекристаллизовывают из смеси н-гептан/этилацетат.
Выход 7,12 г. МС (CI+): m/e=345, изотопное распределение атомов хлора.
(ii) Этиловый эфир 1-[2-(2,4-дихлорфенил)этил]-1Н-индол-2-карбоновой кислоты
Данное соединение получают, применяя методику, аналогичную описанной для получения соединения примера 169 (ii), используя 2-(2,4-дихлорфенил)этиловый эфир толуол-4-сульфоновой кислоты в качестве исходного вещества.
Выход 91 мг. МС (ЖХ-МС-ESI+): m/e=362, изотопное распределение атомов хлора.
(iii) 1-[2-(2,4-Дихлорфенил)этил]-1Н-индол-2-карбоновая кислота
Данное соединение получают, применяя методику, аналогичную описанной для получения соединения примера 169 (iii), используя этиловый эфир 1-[2-(2,4-дихлорфенил)этил]-1Н-индол-2-карбоновой кислоты в качестве исходного вещества.
Выход 69 мг. МС (CI+): m/e=334, изотопное распределение атомов хлора.
(iv) (1-Изопропилпиперидин-4-ил)амид 1-[2-(2,4-дихлорфенил)этил]-1Н-индол-2-карбоновой кислоты
Данное соединение получают, применяя методику, аналогичную описанной для получения соединения примера 169 (iv), используя 1-[2-(2,4-дихлорфенил)этил]-1Н-индол-2-карбоновую кислоту в качестве исходного вещества.
Выход 69 мг. МС (CI+): m/e=334, изотопное распределение атомов хлора.
Пример 171: (1-изопропилпиперидин-4-ил)амид 1-[2-(3-метоксифенил)этил]-1Н-индол-2-карбоновой кислоты
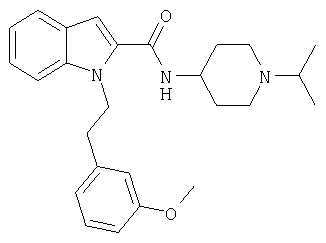
(i) 2- (3-Метоксифенил)этиловый эфир толуол-4-сульфоновой кислоты
Данное соединение получают, применяя методику, аналогичную описанной для получения соединения примера 169 (i), используя 2-(3-метоксифенил)этанол в качестве исходного вещества. Данное соединение хроматографируют на силикагеле с элюированием смесью н-гептан/этилацетат (4:1).
Выход 5,13 г. МС (CI+): m/e=306 (М+).
(ii) Этиловый эфир 1-[2-(3-метоксифенил)этил]-1Н-индол-2-карбоновой кислоты
Данное соединение получают, применяя методику, аналогичную описанной для получения соединения примера 169 (ii), используя 2-(3-метоксифенил)этиловый эфир толуол-4-сульфоновой кислоты в качестве исходного вещества.
Выход 554 мг. МС (ЖХ-MC-ESI+): m/е=324 (М+Н+).
(iii) 1-[2-(3-Метоксифенил)этил]-1Н-индол-2-карбоновая кислота
Данное соединение получают, применяя методику, аналогичную описанной для получения соединения примера 169 (iii), используя этиловый эфир 1-[2-(3-метоксифенил)этил]-1Н-индол-2-карбоновой кислоты в качестве исходного вещества.
Выход 384 мг. МС (CI+): m/e=296 (М+Н+).
(iv) (1-Изопропилпиперидин-4-ил)амид 1-[2-(3-метоксифенил)этил]-1Н-индол-2-карбоновой кислоты
Данное соединение получают, применяя методику, аналогичную описанной для получения соединения примера 169 (iv), используя 1-[2-(3-метоксифенил)этил]-1H-индол-2-карбоновую кислоту в качестве исходного вещества.
Выход 44 мг. МС(ЖХ-МС-ESI): m/e=419 (M+).
Пример 172: (1-изопропилпиперидин-4-ил)амид 1-[2-(4-хлорфенил)этил]-4-метокси-1Н-индол-2-карбоновой кислоты
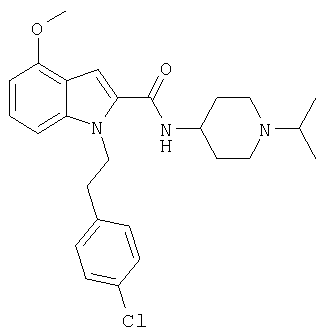
Указанное в заголовке соединение получают по аналогичной методике примера 169 с тем отличием, что используют в качестве исходного вещества метиловый эфир 4-метокси-1Н-индол-2-карбоновой кислоты.
Выход 67 мг. MC(ES+): m/e=454 (M+), изотопное распределение атомов хлора.
Пример 173: (1-изопропилпиперидин-4-ил)амид 4-бром-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
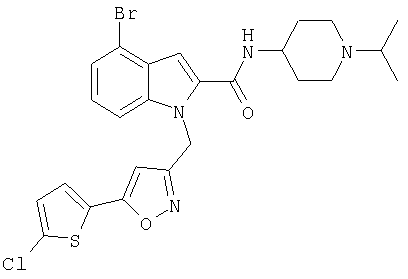
Указанное в заголовке соединение получают по аналогичной методике примера 1 с тем отличием, что вместо 1Н-индол-2-карбоновой кислоты используют 4-бром-1Н-индол-2-карбоновую кислоту.
MC (ESI+): m/e=562, изотопное распределение атомов хлора.
Пример 174: (1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-4-метил-1Н-индол-2-карбоновой кислоты
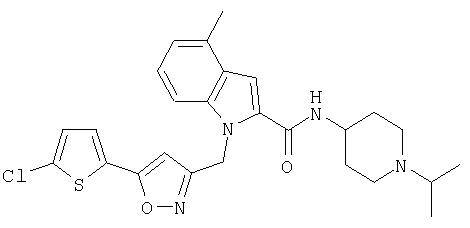
Указанное в заголовке соединение получают по аналогичной методике примера 1 с тем отличием, что вместо 1Н-индол-2-карбоновой кислоты используют 4-метил-1Н-индол-2-карбоновую кислоту.
MC (ESI+): m/e=497, изотопное распределение атомов хлора.
Пример 175: (1-изопропилпиперидин-4-ил)амид 5-бром-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
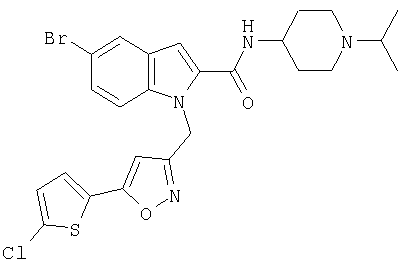
Указанное в заголовке соединение получают по аналогичной методике примера 1 с тем отличием, что вместо 1Н-индол-2-карбоновой кислоты используют 5-бром-1Н-индол-2-карбоновую кислоту.
MC (ESI+): m/e=562, изотопное распределение атомов хлора.
Пример 176: (1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-5-циано-1Н-индол-2-карбоновой кислоты
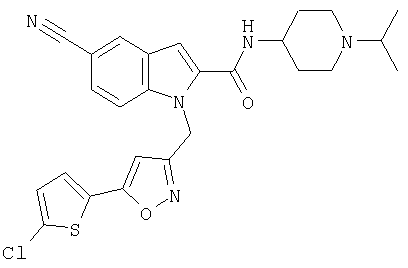
Указанное в заголовке соединение получают по аналогичной методике примера 1 с тем отличием, что вместо 1Н-индол-2-карбоновой кислоты используют 5-циано-1Н-индол-2-карбоновую кислоту.
MC (ESI+): m/e=508, изотопное распределение атомов хлора.
Пример 177: (1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-4-трифторметил-1Н-индол-2-карбоновой кислоты
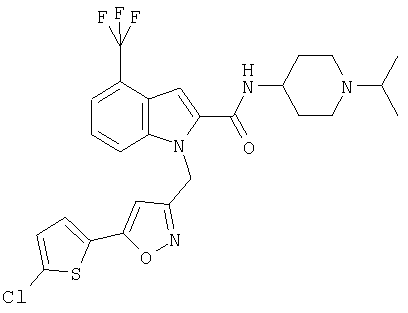
Указанное в заголовке соединение получают по аналогичной методике примера 1 с тем отличием, что вместо 1Н-индол-2-карбоновой кислоты используют 4-трифторметил-1Н-индол-2-карбоновую кислоту.
MC (ESI+): m/e=551, изотопное распределение атомов хлора.
Пример 178: (1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-4,7-диметил-1Н-индол-2-карбоновой кислоты
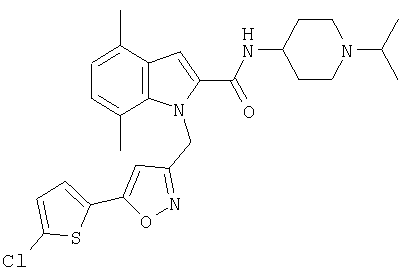
Указанное в заголовке соединение получают по аналогичной методике примера 1 с тем отличием, что вместо 1Н-индол-2-карбоновой кислоты используют 4,7-диметил-1Н-индол-2-карбоновую кислоту.
MC (ESI+): m/e=511, изотопное распределение атомов хлора.
Пример 179: (1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-4,7-диметокси-1Н-индол-2-карбоновой кислоты
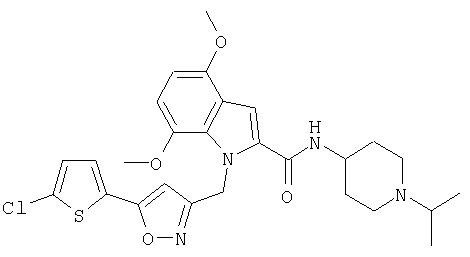
Указанное в заголовке соединение получают по аналогичной методике примера 1 с тем отличием, что вместо 1Н-индол-2-карбоновой кислоты используют 4,7-диметокси-1Н-индол-2-карбоновую кислоту.
MC (ESI+): m/e=543, изотопное распределение атомов хлора.
Пример 180: (1-изопропилпиперидин-4-ил)амид 4,7-дихлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
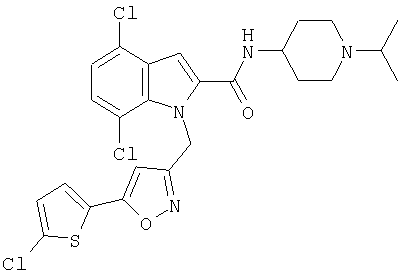
Указанное в заголовке соединение получают по аналогичной методике примера 1 с тем отличием, что вместо 1Н-индол-2-карбоновой кислоты используют 4,7-дихлор-1Н-индол-2-карбоновую кислоту.
MC (ESI+): m/e=551, изотопное распределение атомов хлора.
Пример 181: (1-изопропилпиперидин-4-ил)амид 5,7-дихлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
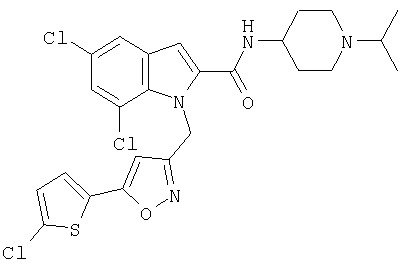
Указанное в заголовке соединение получают по аналогичной методике примера 1 с тем отличием, что вместо 1Н-индол-2-карбоновой кислоты используют 5,7-дихлор-1Н-индол-2-карбоновую кислоту.
MC (ESI+): m/e=551, изотопное распределение атомов хлора.
Пример 182: (1-изопропилпиперидин-4-ил)амид 4-хлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
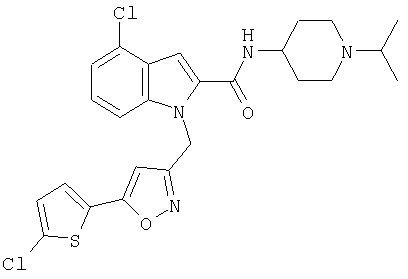
Указанное в заголовке соединение получают по аналогичной методике примера 1 с тем отличием, что вместо 1Н-индол-2-карбоновой кислоты используют 4-хлор-1Н-индол-2-карбоновую кислоту.
MC (ESI+): m/e=517, изотопное распределение атомов хлора.
Пример 183: (4-метипиперазин-1-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
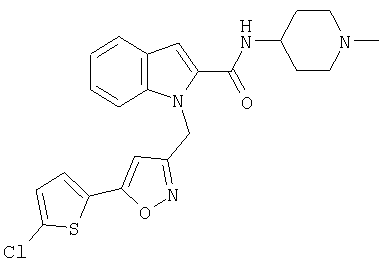
Указанное в заголовке соединение получают по аналогичной методике примера 1 с тем отличием, что вместо 1-изопропилпиперидин-4-иламина используют 4-метилпиперазин-1-иламин.
MC (ESI+): m/e=456, изотопное распределение атомов хлора.
Пример 184: этиловый эфир [{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-7-метил-1Н-индол-2-карбонил}- (1-изопропилпиперидин-4-ил)амино]уксусной кислоты
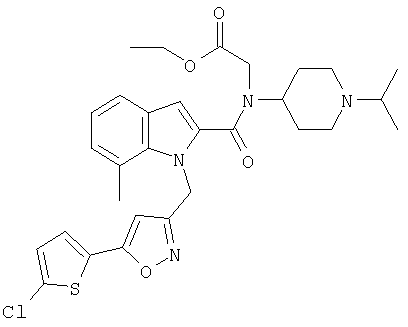
(i) Этиловый эфир (1-изопропилпиперидин-4-иламино)уксусной кислоты
К раствору 1 г гидрохлорида 1-изопропилпиперидин-4-иламина в 10 мл ДМФА добавляют 1,2 г этилового эфира 2-бромуксусной кислоты, 2,3 г Cs2СО3 и 2 мл NEt3 и реакционную смесь перемешивают в течение 2 час при КТ. Окончательно добавляют 10 мл насыщенного раствора NaHCO3 и смесь фильтруют через картридж chem elut® с элюированием ДХМ. После выпаривания растворителя при пониженном давлении продукт получают в виде белой пены и используют в последующей реакции без дальнейшей очистки. Выход 1,3 г.
(ii) Этиловый эфир [{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-7-метил-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусной кислоты
К раствору 70 мг 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-7-метил-1Н-индол-2-карбоновой кислоты в 1 мл ДМФА добавляют 0,1 мл NEt3, 47 мг ВОР-Cl и 81 мг этилового эфира (1-изопропилпиперидин-4-иламино)уксусной кислоты и смесь перемешивают в течение 16 час. После удаления растворителя при пониженном давлении остаток фильтруют через картридж chem elut® с элюированием этилацетатом и далее очищают препаративной ВЭЖХ (С18 колонка с обращенной фазой, элюирование градиентом смеси H2O/MeCN с 0,1% ТФУК). Фракции, содержащие продукт, упаривают и лиофилизируют с получением белого твердого вещества. Продукт получают в виде его трифторацетатной соли.
Выход 9,3 мг. МС (ES+): m/e=583, изотопное распределение атомов хлора.
Пример 185: [{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-7-метил-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусная кислота
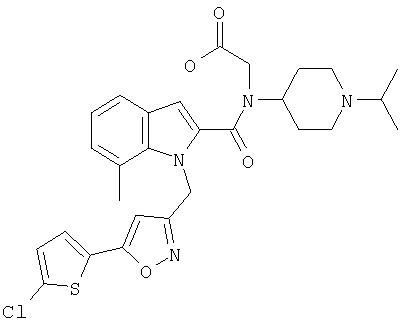
К раствору 15 мг этилового эфира [{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-7-метил-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусной кислоты в 2 мл смеси вода/ТГФ (1:2) добавляют 25 мкл водного раствора NaOH (2 M) и реакционную смесь перемешивают в течение 16 час при КТ. Реакционную смесь подкисляют добавлением хлористоводородной кислоты (5 М), концентрируют при пониженном давлении и остаток переносят в ДХМ. Неорганические соли отфильтровывают, фильтрат концентрируют при пониженном давлении, переносят в 1 мл воды и лиофилизируют с получением белого твердого вещества. Продукт получают в виде его HCl соли.
Выход 5 мг. МС (ES+): m/е=555, изотопное распределение атомов хлора.
Пример 186: [1-(1-этилпропил)пиперидин-4-ил)]амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты

Указанное в заголовке соединение получают по аналогичной методике примера 49 с тем отличием, что вместо тетрагидропиран-4-она используют пентан-3-он.
MC (ESI+): m/e=511, изотопное распределение атомов хлора.
Пример 187: (1-метилпиперидин-4-ил)]амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
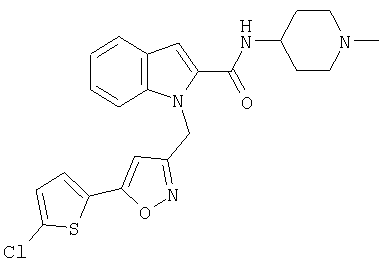
К раствору 50 мг пиперидин-4-иламида 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты в 1 мл ДМФА и 40 мкл NEt3 при КТ добавляют 24 мг метилйодида и реакционную смесь перемешивают в течение 4 час. После удаления растворителя при пониженном давлении остаток непосредственно очищают препаративной ОФ-ВЭЖХ с элюированием градиентом 0-100% ацетонитрила в воде (+0,01% трифторуксусной кислоты). После лиофилизации продукт получают в виде его трифторацетатной соли.
Выход 32 мг. MC (ES+): m/e=455, изотопное распределение атомов хлора.
Пример 188: [1-(2,2,2-трифторэтил)пиперидин-4-ил)]амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
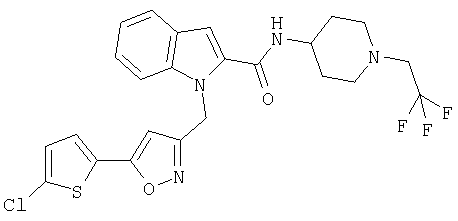
Указанное в заголовке соединение получают по аналогичной методике примера 187 с тем отличием, что 2-йод-1,1,1-трифторэтан используют вместо метилйодида.
MC (ESI+): m/e=523, изотопное распределение атомов хлора.
Пример 189: (1-формилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
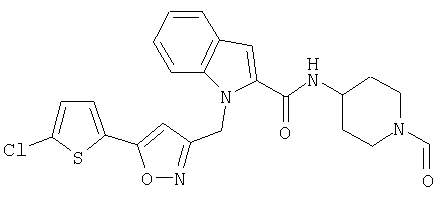
Раствор 50 мг пиперидин-4-иламида 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1H-индол-2-карбоновой кислоты в 2 мл муравьиной кислоты нагревают при 100°С в течение 5 часов. После удаления растворителя при пониженном давлении остаток непосредственно очищают препаративной ОФ-ВЭЖХ с элюированием градиентом 0-100% ацетонитрила в воде (+0,01% трифторуксусной кислоты). После лиофилизации продукт получают в виде белого твердого вещества.
Выход 14 мг. MC (ES+): m/e=469, изотопное распределение атомов хлора.
Пример 190: (1-карбамоилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
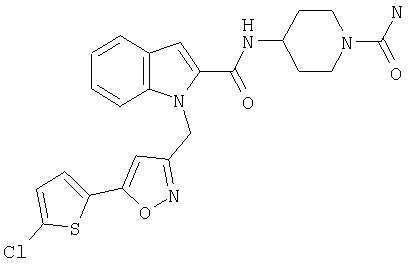
К раствору 50 мг пиперидин-4-иламида 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты в 2 мл уксусной кислоты добавляют 14 мг KOCN при КТ и перемешивают в течение ночи. После удаления растворителя при пониженном давлении остаток непосредственно очищают препаративной ОФ-ВЭЖХ с элюированием градиентом 0-100% ацетонитрила в воде (+0,01% трифторуксусной кислоты). После лиофилизации продукт получают в виде белого твердого вещества.
Выход 31 мг. MC (ES+): m/e=484, изотопное распределение атомов хлора.
Пример 191: (1-метансульфонилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
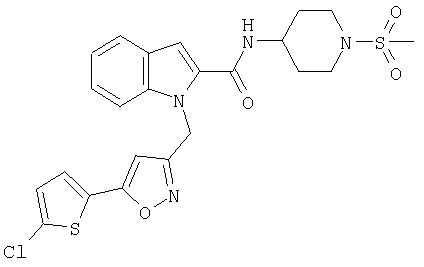
К раствору 50 мг пиперидин-4-иламида 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты в 2 мл ДХМ при КТ добавляют 0,3 мл NEt3 и 20 мг метансульфонилхлорида и перемешивают в течение 16 час. После удаления растворителя при пониженном давлении остаток непосредственно очищают препаративной ОФ-ВЭЖХ с элюированием градиентом 0-100% ацетонитрила в воде (+0,01% трифторуксусной кислоты). После лиофилизации продукт получают в виде белого твердого вещества.
Выход 23 мг. MC (ES+): m/e=519, изотопное распределение атомов хлора.
Пример 192: (1-ацетилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
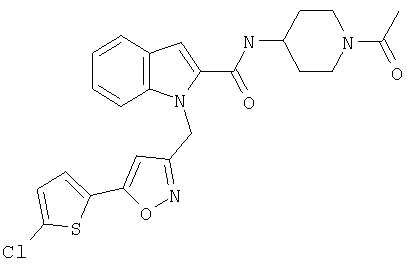
К раствору 50 мг пиперидин-4-иламида 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты в 2 мл ДХМ при КТ добавляют 0,3 мл NEt3 и 11 мг ангидрида уксусной кислоты и перемешивают в течение ночи. После удаления растворителя при пониженном давлении остаток непосредственно очищают препаративной ОФ-ВЭЖХ с элюированием градиентом 0-100% ацетонитрила в воде (+0,01% трифторуксусной кислоты). После лиофилизации продукт получают в виде белого твердого вещества.
Выход 24 мг. MC (ES+): m/e=483, изотопное распределение атомов хлора.
Пример 193: [1-(2-хлорпиримидин-4-ил)пиперидин-4-ил]амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты

(i) трет-Бутиловый эфир [1-(2-хлорпиримидин-4-ил)пиперидин-4-ил]карбаминовой кислоты
К раствору 500 мг трет-бутилового эфира пиперидин-4-илкарбаминовой кислоты в 6 мл смеси н-BuOH/вода/NEt3 (1:1:1) добавляют 557 мг 2,4-дихлорпиримидина и реакционную смесь нагревают при 100°С в течение ночи. После охлаждения реакционной смеси до КТ растворитель выпаривают при пониженном давлении и остаток переносят в этилацетат, промывают дважды водой и далее насыщенным раствором соли. Органический слой сушат над Na2SO4 и растворитель удаляют при пониженном давлении. Остаток очищают хроматографией на силикагеле с элюированием смесью этилацетат/гептан 2:1. Фракции, содержащие продукт, упаривают при пониженном давлении с получением белого твердого вещества. Выход 630 мг.
(ii) 1-(2-Хлорпиримидин-4-ил)пиперидин-4-иламин
К раствору 250 мг трет-бутилового эфира [1-(2-хлорпиримидин-4-ил)пиперидин-4-ил]карбаминовой кислоты в 1 мл ДХМ добавляют 1 мл ТФУК и смесь перемешивают в течение 2 час при КТ. Далее добавляют 10 мл толуола и растворители удаляют при пониженном давлении. Остаток отгоняют дважды с толуолом с получением желтого масла. Продукт получают в виде его трифторацетатной соли. Выход 367 мг.
(iii) [1-(2-Хлорпиримидин-4-ил)пиперидин-4-ил]амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1H-индол-2-карбоновой кислоты
К раствору 100 мг 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты в 3 мл ДХМ добавляют 91 мг TOTU и 0,13 мл NEM. Данный раствор перемешивают при комнатной температуре в течение 30 мин. Далее добавляют 148 мг трифторацетата 1-(2-хлорпиримидин-4-ил)пиперидин-4-иламина и полученный раствор перемешивают при комнатной температуре в течение 16 час. Продукт очищают препаративной ОФ-ВЭЖХ с элюированием градиентом 0-100% ацетонитрила в воде (+0,01% трифторуксусной кислоты). После лиофилизации продукт получают в виде его трифторацетатной соли.
Выход 71 мг. MC (ES+): m/e=553, изотопное распределение атомов хлора.
Пример 194: (1-пиримидин-4-илпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
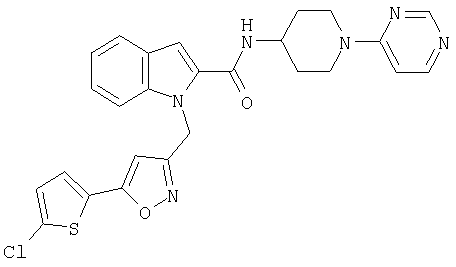
(i) трет-Бутиловый эфир (1-пиримидин-4-илпиперидин-4-ил)карбаминовой кислоты
К раствору 395 мг трет-бутилового эфира [1-(2-хлорпиримидин-4-ил)пиперидин-4-ил]карбаминовой кислоты в 10 мл этанола и 0,3 мл уксусной кислоты добавляют 20 мг Pd/C (10%) и смесь продувают аргоном в течение 10 мин. Далее содержимое колбы перемешивают в атмосфере водорода в течение 5 час при КТ. После добавления 10 мл этилацетата реакционную смесь фильтруют через слой целита. Растворитель выпаривают при пониженном давлении и остаток отгоняют дважды с толуолом с получением продукта в виде белого твердого вещества. Выход 468 мг.
(ii) 1-Пиримидин-4-илпиперидин-4-иламин
К раствору 468 мг трет-бутилового эфира (1-пиримидин-4-илпиперидин-4-ил)карбаминовой кислоты в 2 мл ДХМ добавляют 2 мл ТФУК и смесь перемешивают в течение 2 час при КТ. Далее добавляют 10 мл толуола и растворители удаляют при пониженном давлении. Остаток отгоняют дважды с толуолом с получением желтого масла. Продукт получают в виде его трифторацетатной соли. Выход 703 мг.
(iii) (1-Пиримидин-4-илпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
К раствору 100 мг 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты в 3 мл ДХМ добавляют 91 мг TOTU и 0,13 мл NEM. Данный раствор перемешивают при комнатной температуре в течение 30 мин. Далее добавляют 135 мг трифторацетата 1-пиримидин-4-илпиперидин-4-иламина и полученный раствор перемешивают при комнатной температуре в течение 16 час. Продукт очищают препаративной ОФ-ВЭЖХ с элюированием градиентом 0-100% ацетонитрила в воде (+0,01% трифторуксусной кислоты). После лиофилизации продукт получают в виде его трифторацетатной соли.
Выход 52 мг. MC (ES+): m/e=519, изотопное распределение атомов хлора.
Пример 195: {1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-ил}-[4-(пиридин-4-илокси)пиперидин-1-ил]метанон
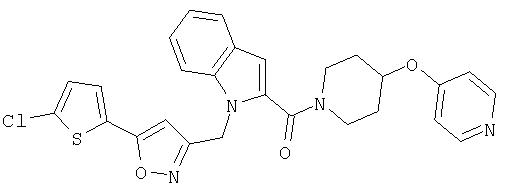
Указанное в заголовке соединение получают по аналогичной методике примера 1 с тем отличием, что используют 4-(пиперидин-4-илокси)пиридин [полученный по адаптированной методике, описанной Baxter, Andrew Douglas; Owen, David Alan; Montana, John Gary; Robert John PCT Int. Appi. (1999), 44 pp. WO 9924399 Al] вместо 1-изопропилпиперидин-4-иламина.
MC (ESI+): m/e=519, изотопное распределение атомов хлора.
Пример 196: [4-(1Н-имидазол-4-ил)фенил]амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
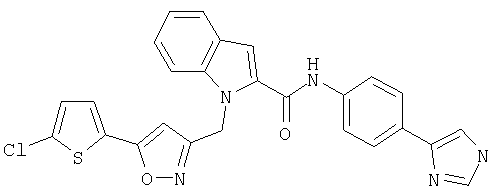
Указанное в заголовке соединение получают по аналогичной методике примера 1 с тем отличием, что используют 4-(1Н-имидазол-4-ил)фениламин вместо 1-изопропилпиперидин-4-иламина.
MC (ESI+): m/e=500, изотопное распределение атомов хлора.
Пример 197: (4-пиридин-3-илтиазол-2-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
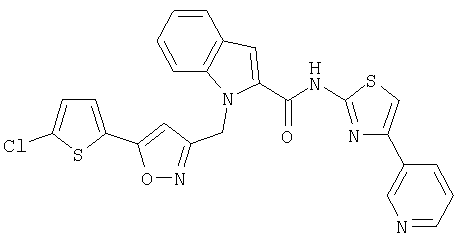
Указанное в заголовке соединение получают по аналогичной методике примера 1 с тем отличием, что используют 4-пиридин-3-илтиазол-2-иламин вместо 1-изопропилпиперидин-4-иламина.
MC (ESI+): m/e=518, изотопное распределение атомов хлора.
Пример 198: [3-(пирролидин-1-карбонил)-4,5-дигидроизоксазол-5-илметил]амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
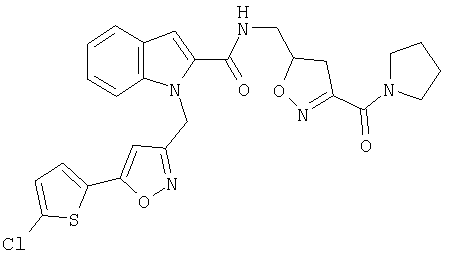
Указанное в заголовке соединение получают по аналогичной методике примера 1 с тем отличием, что используют (5-аминометил-4,5-дигидроизоксазол-3-ил)пирролидин-1-илметанон вместо 1-изопропилпиперидин-4-иламина.
MC (ESI+): m/e=538, изотопное распределение атомов хлора.
Пример 199: (1-изобутилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
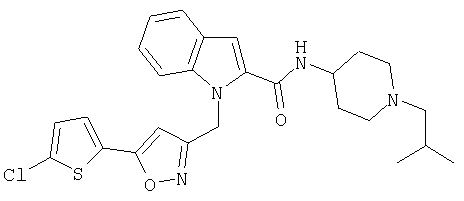
Указанное в заголовке соединение получают по аналогичной методике примера 187 с тем отличием, что 1-йодо-2-метилпропан используют вместо метилйодида.
MC (ESI+): m/e=497, изотопное распределение атомов хлора.
Пример 200: (1-пропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
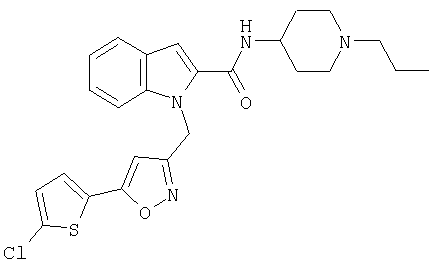
Указанное в заголовке соединение получают по аналогичной методике примера 187 с тем отличием, что 1-йодопропан используют вместо метилйодида.
MC (ESI+): m/e=483, изотопное распределение атомов хлора.
Пример 201: метиловый эфир 4-({1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбонил}амино)пиперидин-1-карбоновой кислоты

К раствору 50 мг пиперидин-4-иламида 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты в 2 мл ДХМ при КТ добавляют 0,3 мл NEt3 и 20 мг метилхлорформиата и перемешивают в течение ночи. После удаления растворителя при пониженном давлении остаток непосредственно очищают препаративной ОФ-ВЭЖХ с элюированием градиентом 0-100% ацетонитрила в воде (+0,01% трифторуксусной кислоты). После лиофилизации продукт получают в виде его трифторацетатной соли как белое твердое вещество.
Выход 24 мг. MC (ES+): m/e=499, изотопное распределение атомов хлора.
Пример 202: (4-изопропилпиперазин-1-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
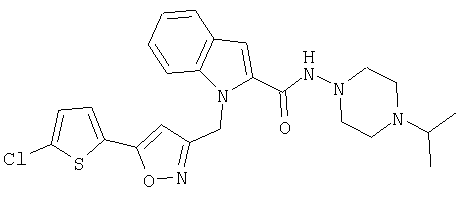
(i) трет-Бутиловый эфир 4-аминопиперазин-1-карбоновой кислоты
К раствору пиперазин-1-иламина в 20 мл ТГФ и 1,37 мл NEt3 при 0°С добавляют по каплям 2,2 г Вос2О в 5 мл ТГФ. Реакционную смесь перемешивают в течение 16 час при КТ, далее добавляют 50 мл этилацетата и 20 мл воды. Органический слой отделяют, промывают насыщенным раствором соли и сушат над Na2SO4. После удаления растворителя при пониженном давлении продукт получают в виде белого твердого вещества. Выход 1,53 г.
(ii) трет-Бутиловый эфир 4-({1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбонил}амино)пиперазин-1-карбоновой кислоты
К раствору 1 г 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1H-индол-2-карбоновой кислоты и 1,3 мл NEM в 8 мл ДХМ добавляют 914 мг TOTU и смесь перемешивают в течение 30 мин при КТ. Далее добавляют 673 мг трет-бутилового эфира 4-аминопиперазин-1-карбоновой кислоты и реакционную смесь перемешивают в течение ночи. После удаления растворителя при пониженном давлении остаток непосредственно очищают хроматографией на силикагеле с элюированием градиентом смеси этилацетат/гептан. Выход 1,1 г.
(iv) Пиперазин-1-иламид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
К 1,1 г трет-бутилового эфира 4-({1-[5-(5-хлортиофен-2-ил) изоксазол-3-илметил]-1Н-индол-2-карбонил}амино)пиперазин-1-карбоновой кислоты в 5 мл МеОН добавляют 20 мл насыщенного метанольного раствора HCl и реакционную смесь перемешивают в течение 5 час при КТ. Далее добавляют 70 мл толуола и растворители выпаривают при пониженном давлении с получением желтого твердого вещества. Продукт получают в виде его трифторацетатной соли. Выход 941 мг.
(v) (4-Изопропилпиперазин-1-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
К 100 мг пиперазин-1-иламида 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты в 2 мл метанола и 2 мл ДМФА и 0,2 мл ацетона добавляют 0,42 мл Na(CN)ВН3 в ТГФ (1 М) и смесь нагревают при 80°С в течение 30 мин. После охлаждения реакционной смеси до КТ растворитель удаляют при пониженном давлении и остаток непосредственно очищают препаративной ОФ-ВЭЖХ с элюированием градиентом 0-100% ацетонитрила в воде (+0,01% трифторуксусной кислоты). После лиофилизации продукт получают в виде его трифторацетатной соли.
Выход 39 мг. MC(ESI+): m/e=484, изотопное распределение атомов хлора.
Пример 203: (4-этилпиперазин-1-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
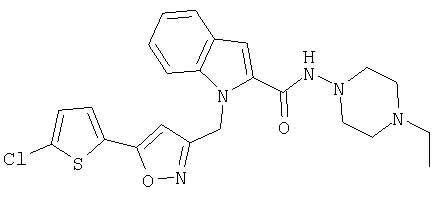
Указанное в заголовке соединение получают по аналогичной методике примера 202 с тем отличием, что ацетальдегид используют вместо ацетона на стадии восстановительного аминирования.
MC(ESI+): m/e=470, изотопное распределение атомов хлора.
Пример 204: пиридин-4-ил(3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
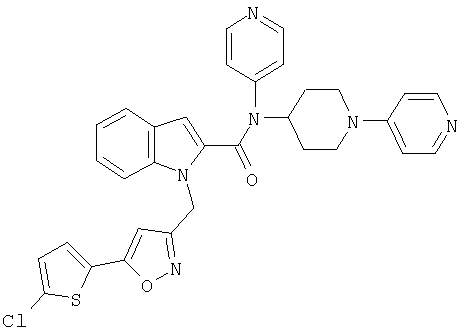
(i) трет-Бутиловый эфир пиридин-4-ил(3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-ил)карбаминовой кислоты
Раствор 5 г трет-бутилового эфира пиперидин-4-илкарбаминовой кислоты и 8 г гидрохлорида 4-хлорпиридина в 9 мл смеси н-бутанол/вода/NEt3 (1:1:1) нагревают при 100°С в течение 48 час. Далее реакционную смесь охлаждают до КТ, концентрируют при пониженном давлении и непосредственно очищают хроматографией на силикагеле с элюированием ДХМ. Фракции, содержащие продукт, упаривают при пониженном давлении с получением белой пены. Выход 7 г.
(ii) Пиридинил-4-ил(3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-ил)амин
К 2 г трет-бутилового эфира пиридин-4-ил(3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-ил)карбаминовой кислоты в 10 мл МеОН добавляют 30 мл насыщенного метанольного раствора HCl и перемешивают в течение 5 час при КТ. Далее добавляют 70 мл толуола и растворители выпаривают при пониженном давлении с получением желтого твердого вещества. Продукт получают в виде его трифторацетатной соли. Выход 1,6 г.
(iii) Пиридин-4-ил(3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1H-индол-2-карбоновой кислоты
К раствору 200 мг 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты и 0,3 мл NEM в 2 мл ДХМ добавляют 182 мг TOTU и смесь перемешивают в течение 30 мин при КТ. Далее добавляют 170 мг пиридин-4-ил(3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-ил)амина и реакционную смесь перемешивают в течение 16 час. После удаления растворителя при пониженном давлении остаток непосредственно очищают препаративной ОФ-ВЭЖХ с элюированием градиентом 0-100% ацетонитрила в воде (+0,01% трифторуксусной кислоты). После лиофилизации продукт получают в виде его трифторацетатной соли.
Выход 39 мг. MC(ESI+): m/e=595, изотопное распределение атомов хлора.
Пример 205: пиридин-4-ил(3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-5-нитро-1Н-индол-2-карбоновой кислоты

Указанное в заголовке соединение получают по аналогичной методике примера 204 с тем отличием, что используют 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-5-нитро-1Н-индол-2-карбоновую карбоновую кислоту вместо 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты.
MC (ESI+): m/e=642, изотопное распределение атомов хлора.
Пример 206: (3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-3-циано-1H-индол-2-карбоновой кислоты
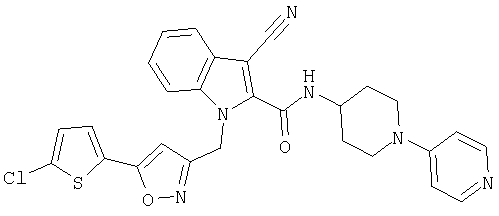
Указанное в заголовке соединение получают по аналогичной методике примера 160 с тем отличием, что используют 3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-иламин вместо 1-изопропилпиперидин-4-иламина.
MC (ESI+): m/e=543, изотопное распределение атомов хлора.
Пример 207: (1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-3,7-дийод-4-метокси-1Н-индол-2-карбоновой кислоты
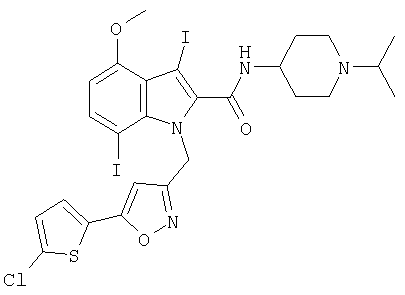
(i) Метиловый эфир 3,7-дийод-4-метокси-1Н-индол-2-карбоновой кислоты
К раствору 1 г метилового эфира 4-метокси-1Н-индол-2-карбоновой кислоты в 15 мл ДХМ при КТ добавляют 5,4 г тетрафторбората бис(пиридин)йодония (I) и реакционную смесь перемешивают в течение ночи. Далее реакционную смесь разбавляют 20 мл ДХМ и промывают насыщенным раствором Na2S2O3 и водой. Органический слой отделяют, сушат над Na2SO4 и растворитель удаляют при пониженном давлении. Остаток используют в последующей реакции без дальнейшей очистки. Выход 1,6 г.
(ii) 1-[5-(5-Хлортиофен-2-ил)изоксазол-3-илметил]-3,7-дийод-4-метокси-1Н-индол-2-карбоновая кислота.
К раствору 200 мг метилового эфира 3, 7-дийод-4-метокси-1Н-индол-2-карбоновой кислоты в 2 мл ДМФА при комнатной температуре добавляют 20 мг гидрида натрия (60% в масле). После перемешивания в течение 30 мин добавляют 121 мг 3-бромметил-5-(5-хлортиофен-2-ил)изоксазола [полученный путем адаптации методики, описанной Ewing, William R.; Becker, Michael R.; Choi-Sledeski, Yong Mi; Puuls, Heinz W.; He, Wei; Condon, Stephen M.; Davis, Roderick S.; Hanney, Barbara A.; Spada, Alfred P.; Burns, Christopher J.; Jiang, John Z.; Li, Aiwen; Myers, Michael R.; Lau, Wan F.; Poli, Gregory В.; РСТ Int. Appl. (2001), 460 pp. WO 0107436 A2] и смесь нагревают в течение 1 час при 60°С. После дальнейшего охлаждения реакционной смеси до КТ и добавления 5 мл воды смесь фильтруют через картридж chem elut®, элюируя этилацетатом. После концентрирования при пониженном давлении остаток обрабатывают 30 мг моногидрата гидроксида лития в смеси ТГФ/вода (2:1). После перемешивания в течение 2 час при 60°С реакционную смесь охлаждают до КТ. Смесь подкисляют полуконцентрированной хлористоводородной кислотой до рН 2, осадок собирают фильтрованием и промывают 3 мл воды. Продукт получают в виде белого твердого вещества, которое сушат при пониженном давлении. Выход 200 мг.
(vi) (1-Изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-3,7-дийод-4-метокси-1Н-индол-2-карбоновой кислоты
К раствору 100 мг 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-3,7-дийод-4-метокси-1Н-индол-2-карбоновой кислоты и 0,1 мл NEM в 2 мл ДХМ добавляют 63 мг TOTU и смесь перемешивают в течение 30 мин при КТ. Далее добавляют 41 мг гидрохлорида 1-изопропилпиперидин-4-иламина и реакционную смесь перемешивают в течение 2 час. После удаления растворителя при пониженном давлении остаток непосредственно очищают препаративной ОФ-ВЭЖХ с элюированием градиентом 0-100% ацетонитрила в воде (+0,01% трифторуксусной кислоты). После лиофилизации продукт получают в виде его трифторацетатной соли.
Выход 67 мг. MC (ESI+): m/e=765, изотопное распределение атомов хлора.
Пример 208: (1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-3,7-дициано-4-метокси-1Н-индол-2-карбоновой кислоты
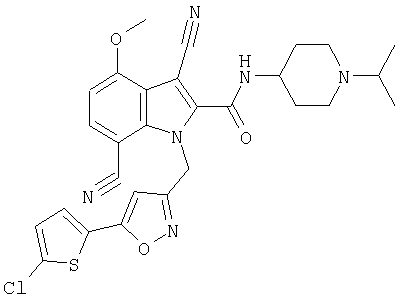
К раствору 20 мг (1-изопропилпиперидин-4-ил)амида 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-3,7-дийод-4-метокси-1Н-индол-2-карбоновой кислоты в 1 мл ДМФА и 1 мл ТГФ добавляют мг CuCN, 4 мг Et4NCN, 5 мг DPPE и смесь продувают аргоном в течение 15 мин. Далее вводят 3 мг Pd2(dba)3 и реакционную смесь нагревают в течение 5 мин при 120°С в условиях микроволнового облучения (150 Вт, прибор СЕМ DiscoverTM). Окончательно добавляют 10 мл насыщенного раствора NaHCO3 и смесь фильтруют через картридж chem elut® с элюированием ДХМ. После удаления растворителя при пониженном давлении остаток непосредственно очищают препаративной ОФ-ВЭЖХ с элюированием градиентом 0-100% ацетонитрила в воде (+0,01% трифторуксусной кислоты). После лиофилизации продукт получают в виде его трифторацетатной соли.
Выход 3 мг. MC (ESI+): m/e=563, изотопное распределение атомов хлора.
Пример 209: (1-изопропилпиперидин-4-ил)амид 1-[2-(4-хлорфенил)тиазол-4-илметил]-1Н-индол-2-карбоновой кислоты
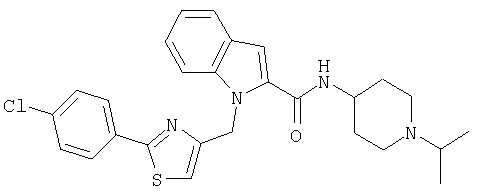
Указанное в заголовке соединение получают по аналогичной методике примера 1 с тем отличием, что на стадии алкилирования используют 4-хлорметил-2-(4-хлорфенил)тиазол вместо 3-бромметил-5-(5-хлортиофен-2-ил)изоксазола.
MC (ESI+): m/e=493, изотопное распределение атомов хлора.
Пример 210: (1-изопропилпиперидин-4-ил)амид 1-(1,7-дихлоризохинолин-3-илметил]-1Н-индол-2-карбоновой кислоты
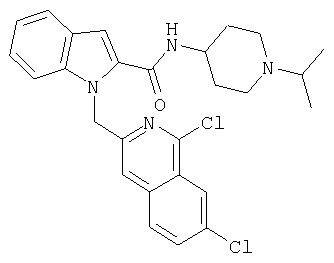
Указанное в заголовке соединение получают по аналогичной методике примера 1 с тем отличием, что на стадии алкилирования используют 3-бромметил-1,7-дихлоризохинолин [полученный путем адаптации методики, описанной Ewing, William R.; Becker, Michael R.; Choi-Sledeski, Yong Mi; Puuls, Heinz W.; He, Wei; Condon, Stephen M.; Davis, Roderick S.; Hanney, Barbara A.; Spada, Alfred P.; Burns, Christopher J.; Jiang, John Z.; Li, Aiwen; Myers, Michael R.; Lau, Wan F.; Poli, Gregory В.; PCT Int. Appi. (1999), 300 pp.WO 9937304 A1] вместо 3-бромметил-5-(5-хлортиофен-2-ил)изоксазола.
MC (ESI+): m/e=495, изотопное распределение атомов хлора.
Пример 211: (1-изопропилпиперидин-4-ил)амид 1-[3-(4-хлорфенил)изоксазол-5-илметил]-1Н-индол-2-карбоновой кислоты

Указанное в заголовке соединение получают по аналогичной методике примера 1 с тем отличием, что на стадии алкилирования используют 5-хлорметил-3-(4-хлорфенил)изоксазол вместо 3-бромметил-5-(5-хлортиофен-2-ил)изоксазола.
MC (ESI+): m/e=477, изотопное распределение атомов хлора.
Пример 212: (1-изопропилпиперидин-4-ил)амид 1-[5-(4-хлорфенил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
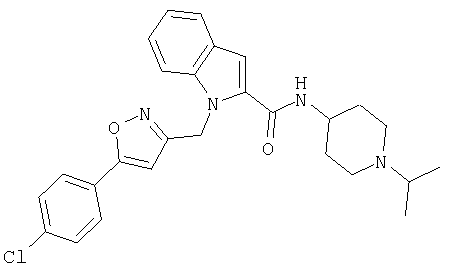
Указанное в заголовке соединение получают по аналогичной методике примера 1 с тем отличием, что на стадии алкилирования используют 3-хлорметил-5-(4-хлорфенил)изоксазол вместо 3-бромметил-5-(5-хлортиофен-2-ил)изоксазола.
MC (ESI+): m/e=477, изотопное распределение атомов хлора.
Пример 213: (1-изопропилпиперидин-4-ил)амид 1-[3-(4-хлорфенил)-[1,2,4]оксадиазол-5-илметил]-1H-индол-2-карбоновой кислоты
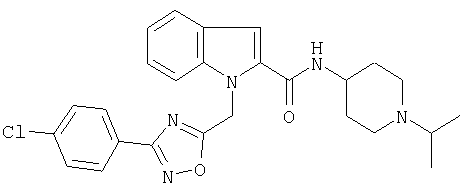
Указанное в заголовке соединение получают по аналогичной методике примера 1 с тем отличием, что на стадии алкилирования используют 5-хлорметил-3-(4-хлорфенил)-[1,2,4]оксадиазол вместо 3-бромметил-5-(5-хлортиофен-2-ил)изоксазола.
MC (ESI+): m/e=478, изотопное распределение атомов хлора.
Пример 214: (1-изопропилпиперидин-4-ил)амид 1-[(5-хлорпиридин-2-илкарбамоил)метил]-5-метансульфонил-1Н-индол-2-карбоновой кислоты
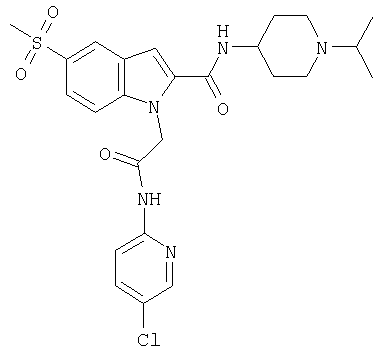
(i) 2-Бром-N-(5-хлорпиридин-2-ил)ацетамид
К раствору 5 г 5-хлорпиридин-2-иламина и 1,5 мл пиридина в 30 мл толуола по каплям при охлаждении льдом добавляют 8 г бромацетилбромида в 10 мл толуола. Спустя 2 час осадок выделяют фильтрованием и перекристаллизовывают из толуола с получением белого твердого вещества. Выход 12 г.
(ii) 1-[(5-Хлорпиридин-2-илкарбамоил)метил]-5-метансульфонил-1Н-индол-2-карбоновая кислота.
К раствору 1 г метилового эфира 5-метансульфонил-1Н-индол-2-карбоновой кислоты в 10 мл ДМФА при КТ добавляют 158 мг гидрида натрия (60% в масле). После перемешивания в течение 10 мин добавляют 985 мг 2-бром-N-(5-хлорпиридин-2-ил)ацетамида и смесь перемешивают в течение 2 час. После добавления 7 мл воды смесь фильтруют через картридж chem elut® с элюированием этилацетатом и концентрируют при пониженном давлении. Остаток переносят в 10 мл смеси вода/ТГФ (1:2) и обрабатывают 2 мл водного раствора КОН (10%). После перемешивания в течение 16 час при КТ реакционную смесь подкисляют хлористоводородной кислотой (5 М). Осадок собирают фильтрованием и сушат в вакууме с получением продукта в виде желтого твердого вещества. Выход 1,1 г.
(iii) (1-Изопропилпиперидин-4-ил)амид 1-[(5-хлорпиридин-2-илкарбамоил)метил]-5-метансульфонил-1Н-индол-2-карбоновой кислоты
К раствору 500 мг 1-[(5-хлорпиридин-2-илкарбамоил)метил]-5-метансульфонил-1Н-индол-2-карбоновой кислоты в 5 мл ДМФА и 0,7 мл NEt3 при КТ добавляют 312 мг ВОР-Cl и 264 мг гидрохлорида 1-изопропилпиперидин-4-иламина и смесь перемешивают в течение 16 час. Далее растворитель удаляют при пониженном давлении и остаток очищают препаративной ВЭЖХ (С18 колонка с обращенной фазой, элюирование градиентом смеси H2O/MeCN с 0,1% ТФУК). Фракции, содержащие продукт, упаривают и лиофилизируют с получением белого твердого вещества. Продукт получают в виде его трифторацетатной соли.
Выход 364 мг. МС (ES+): m/e=532, изотопное распределение атомов хлора.
Пример 215: (1-изопропилпиперидин-4-ил)амид 1-[(4-хлорфенилкарбамоил)метил]-5-метансульфонил-1Н-индол-2-карбоновойкислоты
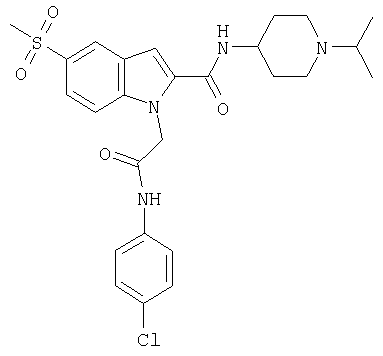
Указанное в заголовке соединение получают по аналогичной методике примера 214 с тем отличием, что на стадии алкилирования используют 2-бром-N-(4-хлорфенил)ацетамид вместо 2-бром-N-(5-хлорпиридин-2-ил)ацетамида.
MC (ESI+): m/e=531, изотопное распределение атомов хлора.
Пример 216: (1-изопропилпиперидин-4-ил)амид 5-хлор-1-[(5-хлорпиридин-2-илкарбамоил)метил]-1Н-индол-2-карбоновой кислоты
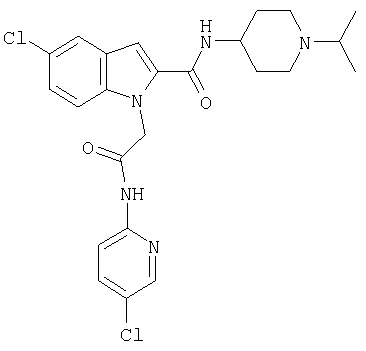
Указанное в заголовке соединение получают по аналогичной методике примера 214 с тем отличием, что используют метиловый эфир 5-хлор-1Н-индол-2-карбоновой кислоты вместо метилового эфира 5-метансульфонил-1Н-индол-2-карбоновой кислоты.
MC (ESI+) m/e=488, изотопное распределение атомов хлора.
Пример 217: (1-изопропилпиперидин-4-ил)амид 1-[(5-хлорпиридин-2-илкарбамоил)метил]-5-фтор-1Н-индол-2-карбоновой кислоты
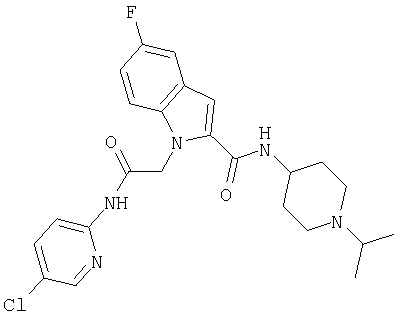
Указанное в заголовке соединение получают по аналогичной методике примера 214 с тем отличием, что используют метиловый эфир 5-фтор-1Н-индол-2-карбоновой кислоты вместо метилового эфира 5-метансульфонил-1Н-индол-2-карбоновой кислоты.
MC (ESI+): m/e=472, изотопное распределение атомов хлора.
Пример 218: (1-изопропилпиперидин-4-ил)амид 1-[(5-хлорпиридин-2-илкарбамоил)метил]-5,7-дифтор-1Н-индол-2-карбоновой кислоты
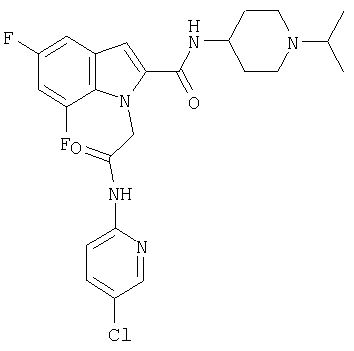
Указанное в заголовке соединение получают по аналогичной методике примера 214 с тем отличием, что используют метиловый эфир 5,7-дифтор-1Н-индол-2-карбоновой кислоты вместо метилового эфира 5-метансульфонил-1Н-индол-2-карбоновой кислоты.
MC (ESI+): m/e=490, изотопное распределение атомов хлора.
Пример 219: (1-этилпирролидин-3-ил)амид S-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
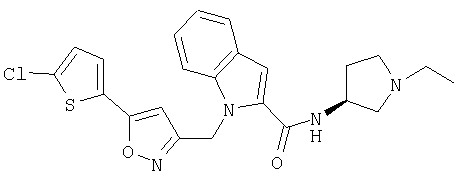
Указанное в заголовке соединение получают по аналогичной методике примера 36 с тем отличием, что на стадии восстановительного аминирования используют 3S-3-трет-бутоксикарбонилпирролидин вместо трет-бутилового эфира (1-изопропилпиперидин-4-ил)карбаминовой кислоты.
MC (ESI+): m/e=455, изотопное распределение атомов хлора.
Пример 220: (1-этилпирролидин-3-ил)амид R-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
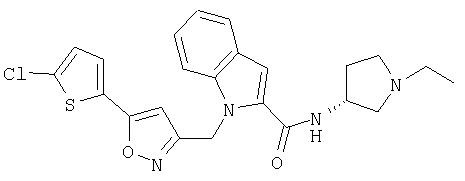
Указанное в заголовке соединение получают по аналогичной методике примера 36 с тем отличием, что на стадии восстановительного аминирования используют 3R-3-трет- бутоксикарбонилпирролидин вместо трет-бутилового эфира (1-изопропилпиперидин-4-ил)карбаминовой кислоты.
MC (ESI+): m/e=455, изотопное распределение атомов хлора.
Пример 221: (1-изопропилпирролидин-3-ил)амид R-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
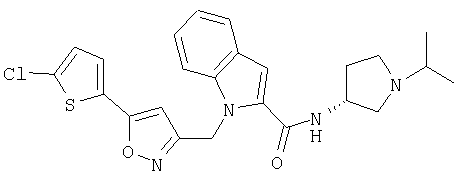
Указанное в заголовке соединение получают по аналогичной методике примера 1 с тем отличием, что на стадии восстановительного аминирования используют 3R-3-трет-бутоксикарбонилпирролидин вместо трет-бутилового эфира (1-изопропилпиперидин-4-ил)карбаминовой кислоты.
MC (ESI+): m/e=469, изотопное распределение атомов хлора.
Пример 222: (1-изопропилпирролидин-3-ил)амид S-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты

Указанное в заголовке соединение получают по аналогичной методике примера 1 с тем отличием, что на стадии восстановительного аминирования используют 3S-3-трет-бутоксикарбонилпирролидин вместо трет-бутилового эфира (1-изопропилпиперидин-4-ил)карбаминовой кислоты.
MC(ESI+): m/e=469, изотопное распределение атомов хлора.
Пример 223: этиловый эфир [{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-4-трифторметил-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусной кислоты
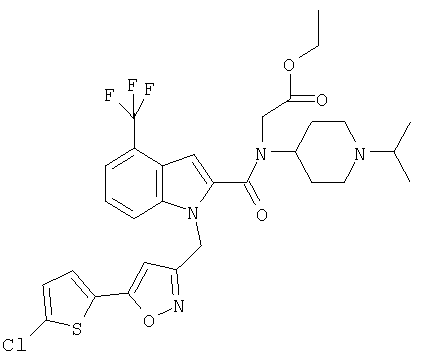
Указанное в заголовке соединение получают по аналогичной методике примера 184 с тем отличием, что используют 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-4-трифторметил-1Н-индол-2-карбоновую кислоту вместо 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-7-метил-1Н-индол-2-карбоновой кислоты.
MC (ESI+): m/e=637, изотопное распределение атомов хлора.
Пример 224: этиловый эфир [{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-4,7-диметил-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусной кислоты
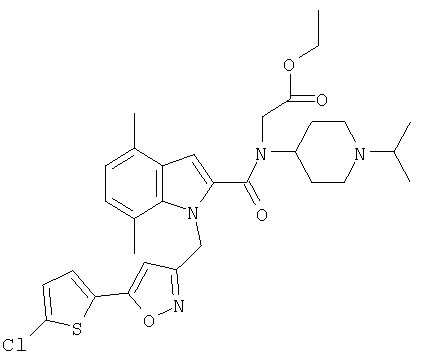
Указанное в заголовке соединение получают по аналогичной методике примера 184 с тем отличием, что используют 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-4,7-диметил-1Н-индол-2-карбоновую кислоту вместо 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-7-метил-1Н-индол-2-карбоновой кислоты.
MC (ESI+): m/e=597, изотопное распределение атомов хлора.
Пример 225: этиловый эфир [{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-4,7-диметокси-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусной кислоты
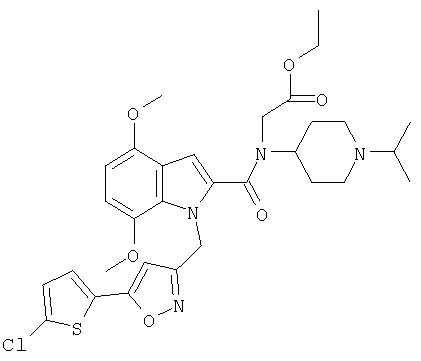
Указанное в заголовке соединение получают по аналогичной методике примера 184 с тем отличием, что используют 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-4,7-диметокси-1Н-индол-2-карбоновую кислоту вместо 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-7-метил-1Н-индол-2-карбоновой кислоты.
MC (ESI+): m/e=629, изотопное распределение атомов хлора.
Пример 226: этиловый эфир [{4,7-дихлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1H-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусной кислоты
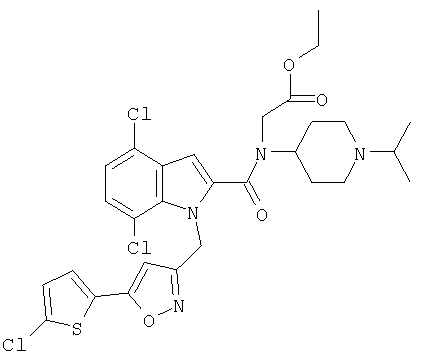
Указанное в заголовке соединение получают по аналогичной методике примера 184 с тем отличием, что используют 4,7-дихлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновую кислоту вместо 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил] -7-метил-1Н-индол-2-карбоновой кислоты.
MC (ESI+): m/e=638, изотопное распределение атомов хлора.
Пример 227: этиловый эфир [{5,7-дихлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусной кислоты

Указанное в заголовке соединение получают по аналогичной методике примера 184 с тем отличием, что используют 5,7-дихлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновую кислоту вместо илметил]-7-метил-1Н-индол-2-карбоновой кислоты.
MC (ESI+): m/e=638, изотопное распределение атомов хлора.
Пример 228: этиловый эфир [{4-хлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1H-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусной кислоты
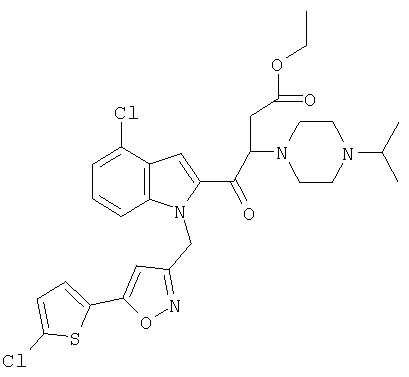
Указанное в заголовке соединение получают по аналогичной методике примера 184 с тем отличием, что используют 4-хлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1H-индол-2-карбоновую кислоту вместо 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-7-метил-1Н-индол-2-карбоновой кислоты.
MC (ESI+): m/e=603, изотопное распределение атомов хлора.
Пример 229: [{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-4-трифторметил-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусная кислота
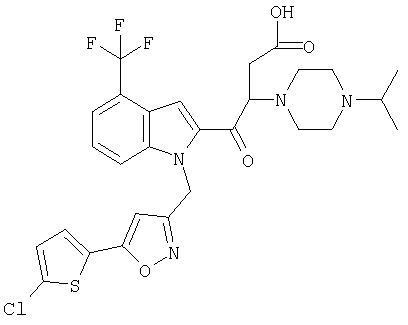
Указанное в заголовке соединение получают по аналогичной методике примера 185 с тем отличием, что используют этиловый эфир [{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-4-трифторметил-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусной кислоты вместо этилового эфира [{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-7-метил-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусной кислоты.
MC (ESI+): m/e=609, изотопное распределение атомов хлора.
Пример 230: [{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-4,7-диметил-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусная кислота

Указанное в заголовке соединение получают по аналогичной методике примера 185 с тем отличием, что используют этиловый эфир [{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-4,7-диметил-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусной кислоты вместо этилового эфира [{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-7-метил-1Н-индол-2-карбонил}- (1-изопропилпиперидин-4-ил)амино]уксусной кислоты.
MC (ESI+): m/e=601, изотопное распределение атомов хлора.
Пример 231: [{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]- 4,7-диметокси-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусная кислота
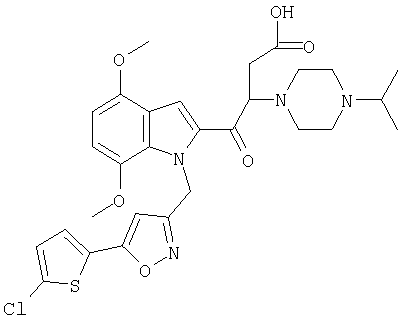
Указанное в заголовке соединение получают по аналогичной методике примера 185 с тем отличием, что используют этиловый эфир [{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-4,7-диметокси-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусной кислоты вместо этилового эфира [{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-7-метил-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусной кислоты.
MC (ESI+): m/e=601, изотопное распределение атомов хлора.
Пример 232: [{4,7-дихлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусная кислота
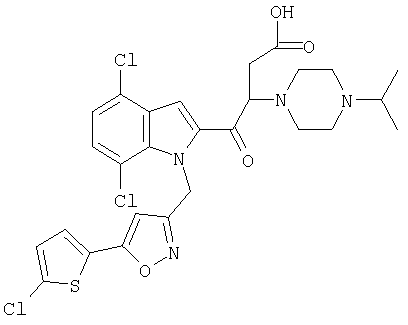
Указанное в заголовке соединение получают по аналогичной методике примера 185 с тем отличием, что используют этиловый эфир [{4,7-дихлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусной кислоты вместо этилового эфира [{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-7-метил-1Н-индол-2-карбонил}- (1-изопропилпиперидин-4-ил)амино]уксусной кислоты.
MC (ESI+): m/e=609, изотопное распределение атомов хлора.
Пример 233: [{5,7-дихлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусная кислота
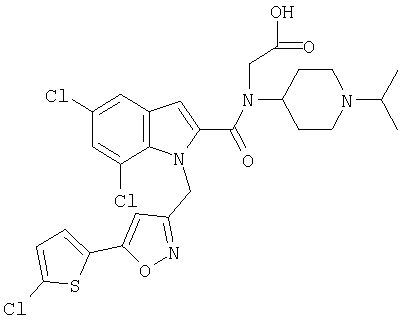
Указанное в заголовке соединение получают по аналогичной методике примера 185 с тем отличием, что используют этиловый эфир [{5,7-дихлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусной кислоты вместо этилового эфира [{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-7-метил-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусной кислоты.
MC (ESI+): m/e=609, изотопное распределение атомов хлора.
Пример 234: [{4-хлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусная кислота

Указанное в заголовке соединение получают по аналогичной методике примера 185 с тем отличием, что используют этиловый эфир [{4-хлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусной кислоты вместо этилового эфира [{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-7-метил-1Н-индол-2-карбонил}- (1-изопропилпиперидин-4-ил)амино]уксусной кислоты. MC (ESI+): m/e=575, изотопное распределение атомов хлора.
Пример 235: изопропиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил]-1Н-индол-5-карбоновой кислоты
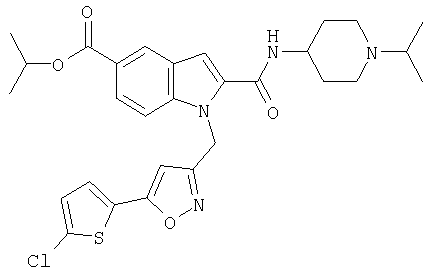
(i) 5-Изопропиловый эфир 2-этилового эфира 1Н-индол-2,5-дикарбоновой кислоты
К раствору 15,5 г AlCl3 в 400 мл ДХМ по каплям добавляют 10 мл оксалилдихлорида. Далее спустя 30 мин добавляют 10 г этилового эфира 1Н-индол-2-карбоновой кислоты в 100 мл ДХМ и реакционную смесь перемешивают в течение 2 час. Реакционную смесь выливают на измельченный лед и экстрагируют дважды 500 мл ДХМ. Органический слой сушат над MgSO4 и растворитель удаляют при пониженном давлении. Остаток переносят в 300 мл пропан-2-ола и перемешивают в течение 4 час при комнатной температуре. После концентрирования реакционной смеси при пониженном давлении остаток очищают хроматографией на силикагеле с элюированием градиентом смеси этилацетат/гептан (1:10→4:1). Выход 2,71 г.
(ii) 5-Изопропиловый эфир 2-этилового эфира 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2,5-дикарбоновой кислоты
Данное соединение получают, применяя методику, аналогичную описанной для получения соединения примера 1 (iv), используя 5-изопропиловый эфир 2-этилового эфира 1Н-индол-2,5-дикарбоновой кислоты в качестве исходного вещества. Соединение очищают хроматографией на силикагеле с элюированием смесью н-гептан/этилацетат (6:1).
Выход 6,3 г. MC (ESI+): m/e=473 (M+) изотопное распределение атомов хлора.
(iii) 5-Изопропиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2,5-дикарбоновой кислоты
К раствору 6,21 г 5-изопропилового эфира 2-этилового эфира 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2,5-дикарбоновой кислоты в 100 мл ТГФ и 40 мл МеОН добавляют 52 мл водного раствора 1 М LiOH и перемешивают в течение 2 час. Органические растворители удаляют при пониженном давлении и остаток подкисляют 2 М хлористоводородной кислотой до рН 2. Осажденный продукт собирают фильтрованием и сушат над P2O5 в вакууме с получением белого твердого вещества. Выход 5,77 г.
(iv) Изопропиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил]-1Н-индол-5-карбоновой кислоты
К раствору 5,77 г 5-изопропилового эфира 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2,5-дикарбоновой кислоты и 2,79 г гидрохлорида 1-изопропилпиперидин-4-иламина в 100 мл ДМФА добавляют 4,25 г TOTU и 6,6 мл DIPEA и смесь перемешивают в течение 3 час при комнатной температуре. После удаления растворителя при пониженном давлении остаток растворяют в 200 мл этилацетата и промывают насыщенным раствором NaHCO3. Органический слой сушат над MgSO4. После удаления растворителя при пониженном давлении остаток очищают хроматографией на силикагеле с элюированием смесью ДХМ/МеОН/АсОН/Н2О (95:5:0,5:0,5). Фракции, содержащие продукт, собирают и растворитель выпаривают при пониженном давлении. Продукт получают в виде его трифторацетатной соли.
Выход 6,13 г. МС (ES+): m/e=569, изотопное распределение атомов хлора.
Пример 236: 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновая кислота
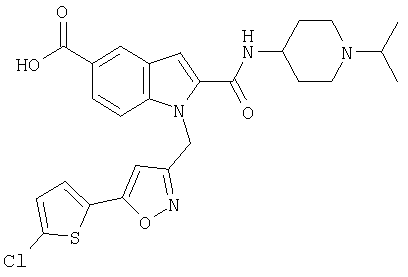
К раствору 6,13 г изопропилового эфира 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновой кислоты в 200 мл МеОН добавляют 54 мл 1 М водного раствора LiOH и нагревают в течение 24 час при 60°С. Реакционную смесь концентрируют при пониженном давлении и подкисляют 2 М хлористоводородной кислотой до рН 3. Далее смесь экстрагируют этилацетатом (2×200 мл) и органический слой сушат над MgSO4, что приводит после выпаривания растворителя при пониженном давлении к получению 5,3 г неочищенной кислоты в виде желтого твердого вещества. 600 мг данной кислоты очищают препаративной ВЭЖХ (С18 колонка с обращенной фазой, элюирование градиентом смеси Н2О/MeCN с 0,1% ТФУК). Фракции, содержащие продукт, упаривают и лиофилизируют после добавления 2 М хлористоводородной кислоты с получением белого твердого вещества. Продукт получают в виде его гидрохлорида.
Выход 280 мг. МС (ES+): m/е=527, изотопное распределение атомов хлора.
Пример 237: (1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-5-гидроксиметил-1Н-индол-2-карбоновой кислоты
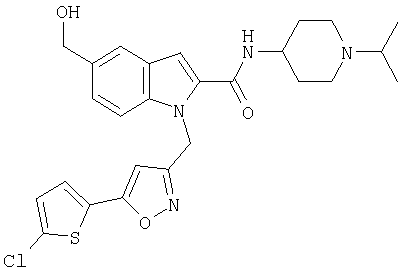
К раствору 100 мг 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновой кислоты и 50 мкл NEt3 в 4 мл ТГФ при -7°С добавляют 17 мкл этилхлорформиата. После перемешивания в течение 2 час при -7°С реакционную смесь фильтруют, фильтрат обрабатывают 24 мг NaBH4 и нагревают до комнатной температуры. Спустя 2 час добавляют дополнительные 24 мг NaBH4 и реакционную смесь перемешивают в течение 16 час. Далее в течение 2 час добавляют 110 мкл МеОН в 4 мл ТГФ и реакционную смесь перемешивают в течение дополнительных 4 час при комнатной температуре. После удаления растворителей при пониженном давлении остаток очищают хроматографией на силикагеле с элюированием смесью ДХМ/МеОН (8:2). Фракции, содержащие продукт, собирают и упаривают при пониженном давлении.
Выход 39 мг. MC(ES+): m/e=513, изотопное распределение атомов хлора.
Пример 238: этиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновой кислоты
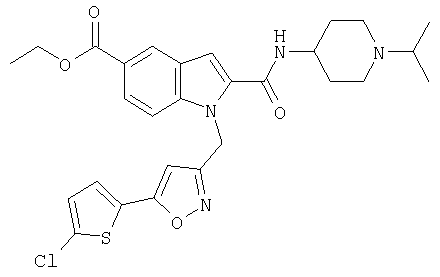
К раствору 0,6 г 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновой кислоты в 10 мл ДМФА последовательно добавляют 0,4 мл EtOH, 110 мг DMAP и 256 мг DCC и реакционную смесь перемешивают в течение 16 час при комнатной температуре. Осадок далее отфильтровывают, фильтрат концентрируют и очищают хроматографией на силикагеле с элюированием смесью ДХМ/МеОН/АсОН/Н2О (95:3:0,5:0,5). Фракции, содержащие продукт, собирают и растворитель выпаривают при пониженном давлении.
Выход 418 мг МС (ES+): m/е=555, изотопное распределение атомов хлора.
Пример 239: метиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновой кислоты
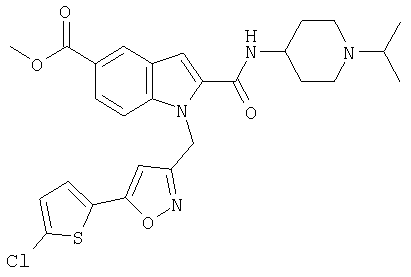
Указанное в заголовке соединение получают по аналогичной методике примера 238 с тем отличием, что на стадии этерификации используют метанол вместо этанола.
MC (ES+): m/e=541, изотопное распределение атомов хлора.
Альтернативно указанное в заголовке соединение может быть получено по следующей методике.
(i) 5-Метиловый эфир 1Н-индол-2,5-дикарбоновой кислоты
Раствор 25 г метилового эфира 4-аммно-3-йодбензойной кислоты, 19 мл 2-оксопропионовой кислоты, 30,4 г 1,4-диазабицикло[2.2.2]октана и 1 г Pd(OAc)2 нагревают в атмосфере аргона при 100°С. После 5 час реакционную смесь концентрируют при пониженном давлении и остаток распределяют между 300 мл этилацетата и 200 мл 1 М хлористоводородной кислоты. Органический слой сушат над MgSO4 и растворитель удаляют при пониженном давлении с получением желтого твердого вещества (6,4 г). Из водного слоя дополнительный продукт медленно осаждается в виде белого твердого вещества (7,9 г), которое собирают фильтрованием. Обе фракции объединяют, сушат в вакууме и используют в следующей реакции без дальнейшей очистки.
Выход 14,3 г. MC (ES+): m/e=220.
(ii) 5-Метиловый эфир 2-трет-бутилового эфира 1Н-индол-2,5-дикарбоновой кислоты
К 13 г 5-метилового эфира 1Н-индол-2,5-дикарбоновой кислоты в 300 мл толуола при 80°С по каплям добавляют 59 мл ди-трет-бутоксиметилдиметиламина. Далее реакционную смесь нагревают при кипячении с обратным холодильником в течение дополнительных 6 час. После удаления растворителей при пониженном давлении остаток растворяют в 300 мл ДХМ и промывают насыщенным водным раствором NaHCO3 (2×100 мл). Органический слой сушат над MgSO4 и концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле с элюированием градиентом смеси н-гептан/этилацетат. Фракции, содержащие продукт, собирают и концентрируют при пониженном давлении.
Выход 8,3 г. MC (ES+): m/e=276.
(iii) 5-Метиловый эфир 2-трет-бутилового эфира 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2,5-дикарбоновой кислоты
Данное соединение получают, применяя методику, аналогичную описанной для получения соединения примера 1 (iv), используя 5-метиловый эфир трет-бутилового эфира 1Н-индол-2,5-дикарбоновой кислоты в качестве исходного вещества. Соединение хроматографируют на силикагеле с элюированием смесью н-гептан/этилацетат (6:1).
Выход 9,6 г. MC (ESI+): m/e=417, изотопное распределение атомов хлора.
(iv) 5-Метиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2,5-дикарбоновой кислоты
9,5 г 5-метилового эфира 2-трет-бутилового эфира 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2,5-дикарбоновой кислоты растворяют в 300 мл трифторуксусной кислоты и перемешивают в течение 1 час при КТ. Далее добавляют 200 мл толуола и растворители удаляют при пониженном давлении. Данную методику повторяют три раза, далее остаток сушат в вакууме. Выход 8,4 г.
(v) метиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновой кислоты
Данное соединение получают, применяя методику, аналогичную описанной для получения соединения примера 1 (vi), используя 5-метиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2,5-дикарбоновой кислоты в качестве исходного вещества. Соединение хроматографируют на силикагеле с элюированием смесью ДХМ/МеОН/АсОН/Н2О (95:3:0,5:0,5).
Выход 10 г. MC (ESI+): m/e=541, изотопное распределение атомов хлора.
Пример 240: 2,2-диметилпропионилоксиметиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновой кислоты
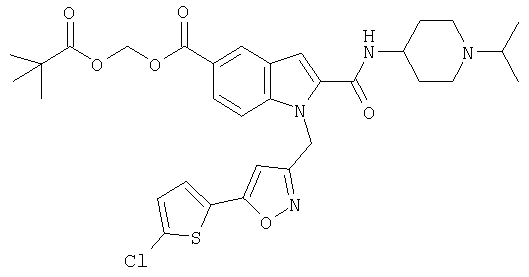
К раствору 1,2 г 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновой кислоты в 30 мл ДМФА добавляют 0,641 г хлорметилового эфира 2,2-диметилпропионовой кислоты и 885 мкл NEt3 и реакционную смесь перемешивают в течение 5 час при 60°С. Далее добавляют дополнительные 0,32 г хлорметилового эфира 2,2-диметилпропионовой кислоты и 295 мкл NEt3 и реакционную смесь перемешивают в течение 6 час при 60°С. После удаления растворителя при пониженном давлении остаток растворяют в CH2Cl2 и раствор промывают водой. Фазы разделяют и органическую фазу (после сушки над Na2SO4) концентрируют в вакууме. Остаток очищают препаративной ОФ-ВЭЖХ с элюированием градиентом 0-100% ацетонитрила в воде (+0,01% трифторуксусной кислоты). После добавления 1 М хлористоводородной кислоты и лиофилизации в смеси ацетонитрил/вода продукт получают в виде его гидрохлорида.
Выход 1,17 г MC (ESI+): m/e=641, изотопное распределение атомов хлора.
Пример 241: изопропиловый эфир 1-[5-(5-хлортиофен-2-ил)-[1,3,4]тиадиазол-2-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновой кислоты
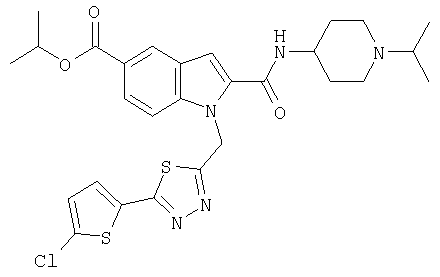
Указанное в заголовке соединение получают по аналогичной методике примера 235 с тем отличием, что используют 2-бромметил-5-(5-хлортиофен-2-ил)-[1,3,4]тиадиазол [полученный по адаптированной методике, описанной Ewing, William R. et al. PCT Int. Appl. (2001), 460 pp.WO 0107436 A2] вместо 3-бромметил-5-(5-хлортиофен-2-ил)изоксазола.
MC (ESI+): m/e=586, изотопное распределение атомов хлора.
Пример 242: 1-[5-(5-хлортиофен-2-ил)-[1,3,4]тиадиазол-2-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновой кислоты
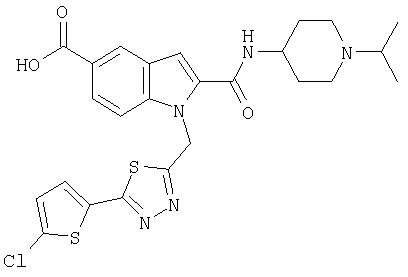
Указанное в заголовке соединение получают по аналогичной методике примера 236 с тем отличием, что используют изопропиловый эфир 1-[5-(5-хлортиофен-2-ил)-[1,3,4]тиадиазол-2-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновой кислоты вместо изопропилового эфира 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновой кислоты.
MC (ESI+): m/e=544, изотопное распределение атомов хлора.
Пример 243: изопропиловый эфир 1-[(4-хлорфенилкарбамоил)метил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновой кислоты
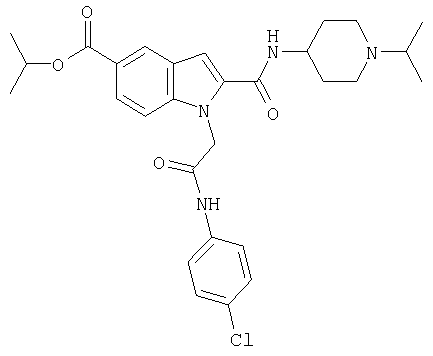
(i) 5-Изопропиловый эфир 1Н-индол-2,5-дикарбоновой кислоты
К раствору 855 мг 5-изопропилового эфира 2-этилового эфира 1Н-индол-2,5-дикарбоновой кислоты в 50 мл МеОН добавляют 12,4 мл 1 М водного раствора LiOH. После нагревания реакционной смеси при 50°С в течение 1 час органические растворители удаляют при пониженном давлении и остаток подкисляют до рН 2 1 М хлористоводородной кислотой. Осажденный продукт собирают фильтрованием и сушат в вакууме. Выход 673 мг.
(ii) Изопропиловый эфир 2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновой кислоты
К раствору 673 мг 5-изопропилового эфира 1Н-индол-2,5-дикарбоновой кислоты и 702 мг гидрохлорида 1-изопропилпиперидин-4-иламина в 20 мл ДМФА добавляют 1,07 г TOTU и 1,67 мл DIPEA и смесь перемешивают в течение 1 час при комнатной температуре. После удаления растворителя при пониженном давлении остаток растворяют в 100 мл ДХМ и промывают насыщенным раствором NaHCO3. Органический слой сушат над MgSO4. После удаления растворителя при пониженном давлении остаток очищают хроматографией на силикагеле с элюированием смесью ДХМ/МеОН/АсОН/Н2О (95:5:0,5:0,5). Фракции, содержащие продукт, собирают и растворитель выпаривают при пониженном давлении. Продукт получают в виде его ацетатной соли. Выход 698 мг.
(iii) 2-Бром-N-(4-хлорфенил)ацетамид
К раствору 5 г 4-хлорфениламина и 1,5 мл пиридина в 30 мл толуола при охлаждении льдом по каплям добавляют 8 г бромацетилбромида, растворенного в 10 мл толуола. Спустя 2 час осадок выделяют фильтрованием и перекристаллизовывают из толуола с получением белого твердого вещества. Выход 10 г.
(iv) Изопропиловый эфир 1-[(4-хлорфенилкарбамоил)метил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновой кислоты
К раствору 100 мг изопропилового эфира 2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновой кислоты в 2 мл ДМФА при КТ добавляют 8 мг гидрида натрия (60% в масле). После 30 мин добавляют 67 мг 2-бром-N-(4-хлорфенил)ацетамида и реакционную смесь перемешивают в течение 3 час. После удаления растворителя при пониженном давлении остаток очищают препаративной ОФ-ВЭЖХ с элюированием градиентом 0-100% ацетонитрила в воде (+0,01% трифторуксусной кислоты). После лиофилизации продукт получают в виде его трифторацетатной соли.
Выход 66 мг МС (ESI+): m/е=539, изотопное распределение атомов хлора.
Пример 244: 1-[(4-хлорфенилкарбамоил)метил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновая кислота

К раствору 1,2 г изопропилового эфира 1-[(4-хлорфенилкарбамоил)метил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновой кислоты в 150 мл МеОН добавляют 11 мл 1 М водного раствора LiOH и реакционную смесь нагревают при 60°С в течение 24 час. Далее после концентрирования при пониженном давлении остаток подкисляют до рН 2 2 М хлористоводородной кислотой. Осажденный продукт собирают фильтрованием и очищают хроматографией на силикагеле с элюированием смесью ДХМ/МеОН/АсОН/Н2О (95:3:0,5:0,5). Фракции, содержащие продукт, собирают и концентрируют при пониженном давлении. После добавления 3 мл 2 М хлористоводородной кислоты и лиофилизации продукт получают в виде его гидрохлорида.
Выход 499 мг. МС (ESI+): m/е=497, изотопное распределение атомов хлора.
Пример 245: метиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-4-карбоновой кислоты
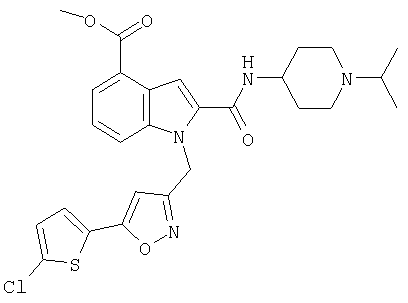
(i) трет-Бутиловый эфир 4-бром-1Н-индол-2-карбоновой кислоты
К 7 г 4-бром-1Н-индол-2-карбоновой кислоты в 150 мл толуола при 80°С по каплям добавляют 28 мл ди-трет-бутоксиметилдиметиламина. Реакционную смесь нагревают при кипячении с обратным холодильником в течение дополнительных 12 час.После удаления растворителей при пониженном давлении остаток растворяют в 200 мл ДХМ и промывают насыщенным водным раствором NaHCO3 (2×50 мл). Органический слой сушат над MgSO4 и концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле с элюированием смесью н-гептан/этилацетат (9:1). Фракции, содержащие продукт, собирают и концентрируют при пониженном давлении.
Выход 6,5 г. МС (ESI+): m/e=297.
(ii) 4-Метиловый эфир 2-трет-бутилового эфира 1Н-индол-2,4-дикарбоновой кислоты
К раствору 7,3 г трет-бутилового эфира 4-бром-1Н-индол-2-карбоновой кислоты в 100 мл ДМФА добавляют 6,8 мл NEt3, 276 мг Pd(OAc)2, 128 мг 1,1'-бис(дифенилфосфино)ферроцена и 12 мл МеОН и продувают аргоном в течение 15 мин. Данный раствор далее продувают монооксидом углерода и нагревают при 70°С в течение 4 час. Реакционную смесь концентрируют при пониженном давлении, остаток растворяют в 200 мл ДХМ и промывают 100 мл воды. Органический слой сушат над MgSO4 и после удаления растворителя при пониженном давлении остаток очищают хроматографией на силикагеле с элюированием смесью н-гептан/этилацетат (9:1). Фракции, содержащие продукт, собирают и концентрируют при пониженном давлении.
Выход 3,8 г. МС (ESI+): m/e=276.
(iii) 4-Метиловый эфир 2-трет-бутилового эфира 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2,4-дикарбоновой кислоты
Данное соединение получают, применяя методику, аналогичную описанной для получения соединения примера 1 (iv), используя 4-метиловый эфир 2-трет-бутилового эфира 1Н-индол-2,4-дикарбоновой кислоты в качестве исходного вещества. Соединение хроматографируют на силикагеле с элюированием смесью н-гептан/этилацетат (6:1).
Выход 4,1 г. МС (ESI+): m/e=473 (M+), изотопное распределение атомов хлора.
(iv) 4-Метиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2,4-дикарбоновой кислоты
4,1 г 4-метилового эфира 2-трет-бутилового эфира 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2,4-дикарбоновой кислоты растворяют в 100 мл трифторуксусной кислоты и перемешивают в течение 1 час при КТ. Далее добавляют 100 мл толуола и растворители удаляют при пониженном давлении. Данную методику повторяют три раза, далее остаток сушат в вакууме.
Выход 3,4 г. МС (ESI+): m/e=416, изотопное распределение атомов хлора.
(v) Метиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-4-карбоновой кислоты
Данное соединение получают, применяя методику, аналогичную описанной для получения соединения примера 235 (iv), используя 4-метиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2,4-дикарбоновой кислоты в качестве исходного вещества. Соединение хроматографируют на силикагеле с элюированием смесью ДХМ/МеОН/АсОН/Н2O (95:3:0,5:0,5).
Выход 4,2 г. МС (ESI+): m/e=541, изотопное распределение атомов хлора.
Пример 246: 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-4-карбоновая кислота
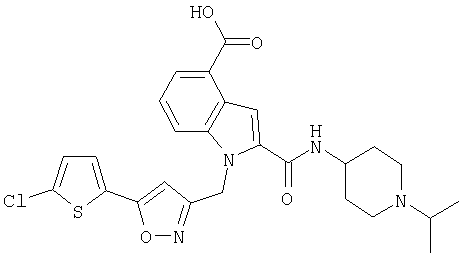
Данное соединение получают, применяя методику, аналогичную описанной для получения соединения примера 236, используя метиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1H-индол-4-карбоновой кислоты в качестве исходного вещества. Соединение хроматографируют на силикагеле с элюированием смесью ДХМ/МеОН/АсОН/Н2O (95:3:0,5:0,5).
МС (ESI+): m/е=527 (М+), изотопное распределение атомов хлора.
Пример 247: 2-[(1-изопропилпиперидин-4-ил)амид] 5-амида 1-[5- (5-хлортиофен-2-ил)изоксазол-3-илметил]-1H-индол-4-карбоновой кислоты
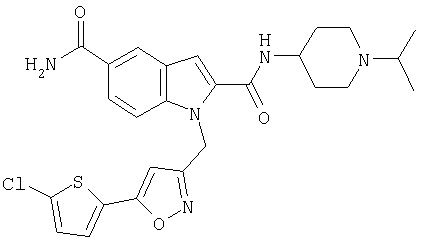
Указанное в заголовке соединение выделяют как побочный продукт в примере 176.
МС (ES+): m/е=526, изотопное распределение атомов хлора.
Пример 248: (1-изопропилпиперидин-4-ил)амид 1-[(4-хлорфенилкарбамоил)метил]-1Н-индол-2-карбоновой кислоты
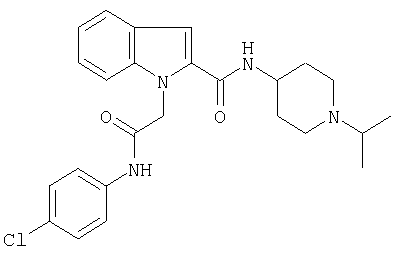
(i) Бензиловый эфир 1Н-индол-2-карбоновой кислоты
К раствору 10,32 г 1Н-индол-2-карбоновой кислоты в 100 мл тетрагидрофурана добавляют 10,38 г диимидазол-1-илметанона и смесь перемешивают в течение 20 мин при комнатной температуре. К смеси добавляют 7,29 мл фенилметанола и реакционную смесь кипятят с обратным холодильником в течение 10 час. Смеси дают охладиться до температуры окружающей среды и далее распределяют между 200 мл воды и 200 мл дихлорметана. Органический слой промывают дополнительным количеством воды и далее сушат над сульфатом натрия. После фильтрования растворитель удаляют при пониженном давлении, получают белое твердое вещество. Остаток непосредственно подвергают последующей реакции без дальнейшей очистки.
Выход 18,8 г. МС (ES+): m/e=252, изотопное распределение атомов хлора.
1H-ЯМР (400 МГц, ДМСО/ТМС): δ=7,65 (д, 1Н); 7,40 (м, 7Н); 7,25 (т, 1Н); 7,20 (с, 1Н); 7,07 (т, 1Н); 5,39 (с,2Н).
(ii) Бензиловый эфир 1-трет-бутоксикарбонилметил-1Н-индол-2-карбоновой кислоты
К раствору 18,80 г бензилового эфира 1Н-индол-2-карбоновой кислоты в 70 мл N,N-диметилформамида при 0°С добавляют 1,98 г гидрида натрия. После перемешивания в течение 1 час к смеси добавляют 15,91 мл трет-бутилового эфира бромуксусной кислоты и реакционную смесь перемешивают в течение 2 часов при комнатной температуре. После удаления растворителя при пониженном давлении остаток распределяют между 300 мл воды и 300 мл дихлорметана. Водный слой промывают дважды дополнительными 200 мл дихлорметана. Далее объединенные органические фазы промывают насыщенным водным раствором хлорида натрия. После фильтрования растворитель удаляют при пониженном давлении и остаток кристаллизуют из смеси этоксиэтан/гептан. Продукт получают в виде белого твердого вещества.
1Н-ЯМР (400 МГц, ДМСО/ТМС): δ=7,70 (д, 1Н); 7,62 (д, 1Н); 7,46 (д, 2Н); 7,38 (м, 5Н); 7,15 (т, 1Н); 5,35 (с, 2Н); 5,28 (с, 2Н); 1,39 (с, 9Н).
(iii) 1-трет-Бутоксикарбонилметил-1Н-индол-2-карбоновая кислота
К раствору 3,0 г бензилового эфира 1-трет-бутоксикарбонилметил-1Н-индол-2-карбоновой кислоты в смеси 10 мл N,N-диметилформамида и 10 мл этанола добавляют 0,5 г палладия, 5% на углероде. Реакционную смесь перемешивают в течение 2 часов в атмосфере водорода. Смесь фильтруют через картридж chem elut® и соединение элюируют этанолом. После концентрирования при пониженном давлении остаток непосредственно подвергают последующей реакции без дальнейшей очистки. Выход 2,2 г.
1H-ЯМР (400 МГц, ДМСО/ТМС): δ=12,50 (с, 1Н); 7,68 (д, 1Н); 7,59 (д, 1Н); 7,31 (т, 1Н); 7,25 (с, 1Н); 7,13 (т, 1Н); 5,26 (с, 2Н); 1,40 (с, 9Н).
(iv) трет-Бутил[2-(1-изопропилпиперидин-4-илкарбамоил)индол-1-ил]ацетат
К раствору 0,5 г 1-трет-бутоксикарбонилметил-1Н-индол-2-карбоновой кислоты и 0,91 мл N-этилморфолина в 3 мл дихлорметана добавляют 0,6 г тетрафторбората O-[(этоксикарбонил)цианометиленамино]-N,N,N',N'-тетраметилурония и смесь перемешивают в течение 30 мин при комнатной температуре. К смеси добавляют 0,39 г 1-изопропилпиперидин-4-иламина и реакционную смесь далее перемешивают в течение 1 час. После удаления растворителя при пониженном давлении остаток распределяют между 15 мл воды и 15 мл дихлорметана. Органический слой промывают дополнительным количеством воды и далее сушат над сульфатом натрия. После фильтрования растворитель удаляют при пониженном давлении и получают белое твердое вещество. Остаток непосредственно подвергают последующей реакции без дальнейшей очистки.
Выход 0,51 г. МС (ES+): m/e=400.
1H-ЯМР (400 МГц, ДМСО/ТМС): δ=8,38 (д, 1Н); 7,63 (д, 1Н); 7,51 (д, 1Н); 7,25 (т, 1Н); 7,20 (с, 1Н); 7,11 (т, 1Н); 5,27 (с, 2Н); 3,55 (м, 1Н); 2,82 (м, 2Н); 2,30 (м, 1Н), 2,18 (м, 2Н); 1,77 (м, 2Н); 1,55 (м, 2Н); 1,39 (с, 9Н); 0,98 (д, 6Н).
(v) [2-(1-Изопропилпиперидин-4-илкарбамоил)индол-1-ил]уксусная кислота
К 0,51 г трет-бутил[2-(1-изопропилпиперидин-4-илкарбамоил)индол-1-ил]ацетата в 5 мл дихлорметана добавляют 1 мл трифторуксусной кислоты и смесь перемешивают в течение 16 часов. Удалением растворителя при пониженном давлении получают белое твердое вещество, которые отгоняют дважды с 15 мл толуола. Продукт получают в виде его трифторацетатной соли.
Выход 0,43 г. МС (ES+): m/e=344.
1H-ЯМР (400 МГц, ДМСО/ТМС): δ=12,6 (1Н); 9,17 (с, 1Н); 8,56 (д, 1Н); 7,66 (д, 1Н); 7,53 (д, 1Н); 7,27 (т, 1Н); 7,25 (с, 1Н); 7,11 (т, 1Н); 5,30 (с, 2Н); 4,02 (м, 1Н); 3,43 (м, 2Н); 3,10 (м, 2Н), 2,06 (м, ЗН); 1,83 (м, 2Н); 1,25 (д, 6Н).
(vi) (1-Изопропилпиперидин-4-ил)амид 1-[(4-хлорфенилкарбамоил)метил]-1Н-индол-2-карбоновой кислоты
К суспензии 50 мг [2-(1-изопропилпиперидин-4-илкарбамоил)индол-1-ил]уксусной кислоты при комнатной температуре добавляют 22 мг 4-хлорфениламина и 37 мг бис(2-оксо-3-оксазолидинил)фосфинилхлорида в 1 мл дихлорметана и 0,08 мл N-этилморфолина и смесь перемешивают в течение 16 часов. После удаления растворителя при пониженном давлении остаток очищают препаративной ВЭЖХ (С18 колонка с обращенной фазой, элюирование градиентом смеси вода/ацетонитрил с 0,1% трифторуксусной кислотой). Фракции, содержащие продукт, упаривают и лиофилизируют с получением белого твердого вещества. Продукт получают в виде его трифторацетатной соли.
Выход 12,6 мг. МС (ES+): m/e=453, изотопное распределение атомов хлора.
1Н-ЯМР (300 МГц, ДМСО/ТМС): δ=10,44 (с, 1Н); 8,95 (с, 1Н); 8,58 (д, 1Н); 7,67 (д, 1Н); 7,60 (д, 2Н); 7,58 (д, 1Н); 7,35 (д, 2Н); 7,28 (т, 1Н); 7,25 (с, 1Н); 7,13 (т, 1Н); 5,45 (с, 2Н); 4,03 (с, 1Н); 3,43 (м, 2Н); 3,08 (м, 2Н), 2,05 (м, 3Н); 1,80 (м, 2Н); 1,23 (д, 6Н).
Пример 249: (1-изопропилпиперидин-4-ил)амид 1-[(5-хлортиофен-2-илкарбамоил)метил]-1Н-индол-2-карбоновой кислоты
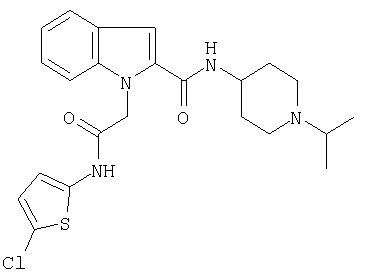
Указанное в заголовке соединение получают по аналогичной методике примера 248 с тем отличием, что используют 5-хлортиофен-2-иламин [полученный по методике, опубликованной в Synth. Comm. 1977, 255-256] вместо 4-хлорфениламина.
МС (ESI+): m/e=459, изотопное распределение атомов хлора.
1H-ЯМР (300 МГц, ДМСО/ТМС): δ=11,72 (с, 1Н); 8,90 (с, 1Н); 8,57 (д, 1Н); 7,68 (д, 1Н); 7,58 (д, 1Н); 7,27 (т, 1Н); 7,25 (с, 1Н); 7,14 (т, 1Н); 6,88 (д, 1Н); 6,53 (д, 1Н); 5,46 (с, 2Н); 4,00 (с, 1Н); 3,43 (м, 2Н); 3,08 (м, 2Н), 2,03 (м, 3Н); 1,80 (м, 2Н); 1,23 (д, 6Н).
Пример 250: (1-изопропилпиперидин-4-ил)амид 1-[(4-хлор-2-фторфенилкарбамоил)метил]-1Н-индол-2-карбоновой кислоты
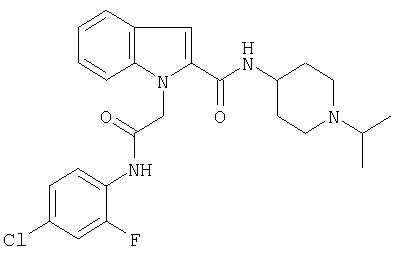
Указанное в заголовке соединение получают по аналогичной методике примера 248 с тем отличием, что используют 4-хлор-2-фторфениламин вместо 4-хлорфениламина.
МС (ESI+): m/е=471, изотопное распределение атомов хлора.
1H-ЯМР (300 МГц, ДМСО/ТМС): δ=10,24 (с, 1Н); 8,93 (с, 1Н); 8,60 (д, 1Н); 7,95 (т, 1Н); 7,68 (д, 1Н); 7,55 (д, 1Н); 7,50 (д, 1Н); 7,26 (д, 1Н); 7,24 (с, 1Н); 7,22 (с, 1Н); 7,13 (т, 1Н); 5,48 (с, 2Н); 4,04 (с, 1Н); 3,43 (м, 2Н); 3,10 (м, 2Н); 2,08 (м, 3Н); 1,80 (м, 2Н); 1,25 (д, 6Н).
Пример 251: (1-изопропилпиперидин-4-ил)амид 1-[(5-хлорпиридин-2-илкарбамоил)метил]-1H-индол-2-карбоновой кислоты
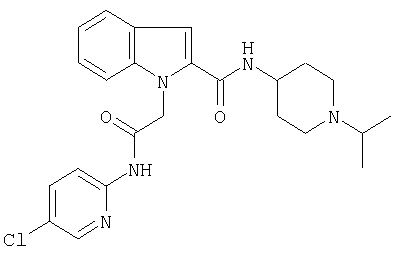
Указанное в заголовке соединение получают по аналогичной методике примера 248 с тем отличием, что используют 5-хлорпиридин-2-иламин вместо 4-хлорфениламина.
МС (ESI+): m/е=454, изотопное распределение атомов хлора.
1H-ЯМР (300 МГц, ДМСО/ТМС): δ=10,99 (с, 1Н); 8,90 (с, 1Н); 8,58 (д, 1Н); 8,39 (д, 1Н); 7,97 (д, 1Н); 7,87 (дд, 1Н); 7,68 (д, 1Н); 7,56 (д, 1Н); 7,27 (т, 1Н); 7,25 (с, 1Н); 7,13 (т, 1Н); 5,45 (с, 2Н); 4,02 (с, 1Н); 3,43 (м, 2Н); 3,08 (м, 2Н); 2,03 (м, 3Н); 1,80 (м, 2Н); 1,23 (д, 6Н).
Пример 252: (3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-илметил)амид 1-[(4-хлорфенилкарбамоил)метил]-1Н-индол-2-карбоновой кислоты
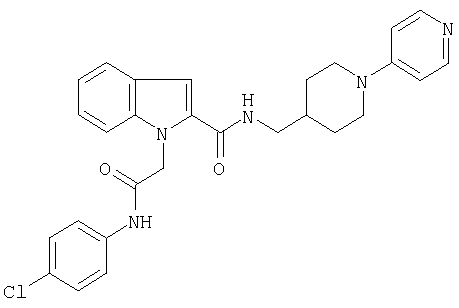
(i) Этиловый эфир 1-[(4-хлорфенилкарбамоил)метил]-1H-индол-2-карбоновой кислоты
К раствору 1,0 г этилового эфира 1Н-индол-2-карбоновой кислоты в 10 мл N,N-диметилформамида при 0°С добавляют 0,14 г гидрида натрия. После перемешивания в течение 30 мин добавляют 1,58 г 2-бром-N-(4-хлорфенил)ацетамида и смесь перемешивают в течение 2 часов при комнатной температуре. После разбавления 15 мл воды смесь фильтруют через картридж chem elut® и соединение элюируют этилацетатом. После концентрирования при пониженном давлении остаток непосредственно подвергают последующей реакции омыления без дальнейшей очистки.
Выход 1,45 г. МС (ESI+): m/е=357, изотопное распределение атомов хлора.
(ii) 1-[(4-Хлорфенилкарбамоил)метил]-1Н-индол-2-карбоновая кислота
К раствору 1,45 г этилового эфира 1-[(4-хлорфенилкарбамоил)метил]-1Н-индол-2-карбоновой кислоты в 100 мл тетрагидрофурана добавляют 30 мл воды и 0,59 г гидроксида калия. После перемешивания в течение 2 часов при комнатной температуре реакционную смесь подкисляют 6 н. хлористоводородной кислотой. Осадок собирают фильтрованием и промывают 20 мл воды. Продукт получают в виде белого твердого вещества и сушат при пониженном давлении.
Выход 1,37 г. МС (ESI+): m/e=329, изотопное распределение атомов хлора.
1H-ЯМР (400 МГц, ДМСО/ТМС): δ=10,50 (с, 1Н); 7,70 (д, 1Н); 7,61 (д, 2Н); 7,58 (д, 1Н); 7,37 (д, 2Н); 7,32 (т, 1Н); 7,25 (с, 1Н); 7,14 (т, 1Н); 5,44 (с, 2Н).
(iii) (3,4,5,6-Тетрагидро-2Н-[1,4']бипиридинил-4-илметил)амид 1-[(4-хлорфенилкарбамоил)метил]-1Н-индол-2-карбоновой кислоты
К суспензии 50 мг 1-[(4-хлорфенилкарбамоил)метил]-1Н-индол-2-карбоновой кислоты добавляют 97 мг (3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-ил)метиламина и 38,7 мг бис(2-оксо-3-оксазолидинил)фосфинилхлорида в 1 мл N,N-диметилформамида и 61,7 мкл триэтиламина. После перемешивания при комнатной температуре в течение 16 часов растворитель удаляют при пониженном давлении и остаток очищают препаративной ВЭЖХ (С18 колонка с обращенной фазой, элюирование градиентом смеси вода/ацетонитрил с 0,1% трифторуксусной кислотой). Фракции, содержащие продукт, упаривают и лиофилизируют с получением белого твердого вещества. Продукт получают в виде его трифторацетатной соли.
Выход 6,9 мг. МС (ES+): m/е=502, изотопное распределение атомов хлора.
1H-ЯМР (300 МГц, ДМСО/ТМС): δ=13,14 (с, 1Н); 10,45 (с, 1Н), 8,63 (т, 1Н); 8,17 (д, 2Н); 7,64 (д, 1Н); 7,61 (д, 2Н); 7,56 (д, 1Н); 7,38 (д, 2Н); 7,26 (т, 1Н); 7,17 (с, 1Н); 7,12 (м, 3Н); 5,43 (с, 2Н); 4,13 (д, 2Н); 3,13 (м, 4Н); 1,80 (м, 2Н); 1,21 (м, 3Н).
Пример 253: (3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-ил)амид 1-[(4-хлорфенилкарбамоил)метил]-1Н-индол-2-карбоновой кислоты
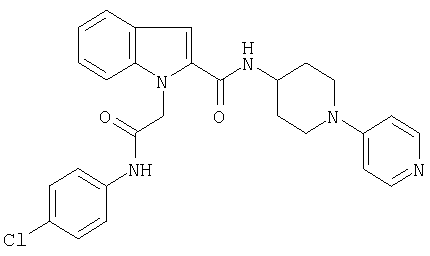
Указанное в заголовке соединение получают по аналогичной методике примера 252 с тем отличием, что используют 3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-иламин вместо (3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-ил)метиламина.
МС (ES+): m/e=488, изотопное распределение атомов хлора.
1H-ЯМР (300 МГц, ДМСО/ТМС): δ=13,23 (с, 1Н); 10,44 (с, 1Н); 8,43 (д, 1Н); 8,23 (д, 2Н); 7,65 (д, 1Н); 7,61 (д, 2Н); 7,56 (д, 1Н); 7,35 (д, 2Н); 7,23 (м, 4Н); 7,12 (т, 1Н); 5,44 (с, 2Н); 4,20 (м, 3Н); 3,32 (м, 2Н); 1,95 (м, 2Н); 1,58 (м, 2Н).
Пример 254: N-(4-хлорфенил)-2-{2-[4-(пиридин-4-иламино)пиперидин-1-карбонил]индол-1-ил}ацетамид

Указанное в заголовке соединение получают по аналогичной методике примера 252, используя пиперидин-4-илпиридинил-4-иламин вместо (3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-ил)метиламина.
МС (ES+): m/е=488, изотопное распределение атомов хлора.
1H-ЯМР (300 МГц, ДМСО/ТМС): δ=13,24 (с, 1Н); 10,45 (с, 1Н); 8,43 (д, 1Н); 8,23 (д, 2Н); 7,64 (д, 1Н); 7,60 (д, 2Н); 7,55 (д, 1Н); 7,35 (д, 2Н); 7,22 (м, 4Н); 7,11 (т, 1Н); 5,44 (с, 2Н); 4,20 (м, 3Н); 3,33 (м, 2Н); 1,95 (м, 2Н); 1,57 (м, 2Н).
Пример 255: (1-циклопропилпиперидин-4-ил)амид 1-[(4-хлорфенилкарбамоил)метил]-1Н-индол-2-карбоновой кислоты
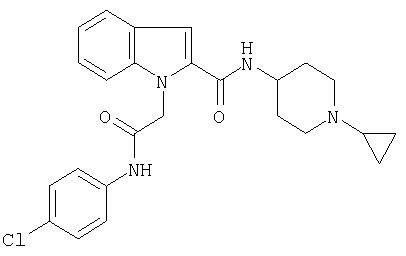
Указанное в заголовке соединение получают по аналогичной методике примера 252 с тем отличием, что используют 1-циклопропилпиперидин-4-иламин вместо (3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-ил)метиламина.
МС (ES+): m/е=451, изотопное распределение атомов хлора.
1H-ЯМР (300 МГц, ДМСО/ТМС): δ=10,44 (с, 1Н); 8,78 (с, 1Н); 8,57 (д, 1Н); 7,68 (д, 1Н); 7,60 (д, 2Н); 7,57 (д, 1Н); 7,36 (д, 2Н); 7,27 (т, 1Н); 7,23 (с, 1Н); 7,12 (т, 1Н); 5,44 (с, 2Н); 3,44 (м, 2Н); 3,25 (м, 2Н); 2,03 (м, 3Н); 1,73 (м, 2Н); 0,84 (м, 5Н).
Пример 256: N-(4-хлорфенил)-2-[2-(4-пирролидин-1-илпиперидин-1-карбонил)индол-1-ил]ацетамид
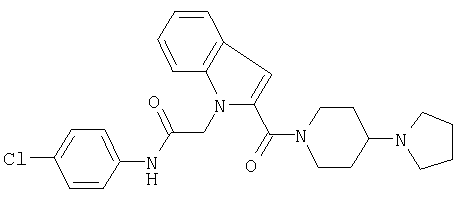
Указанное в заголовке соединение получают по аналогичной методике примера 252, используя 4-пирролидин-1-илпиперидин вместо (3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-ил)метиламина.
МС (ES+): m/е=465, изотопное распределение атомов хлора.
1H-ЯМР (300 МГц, ДМСО/ТМС): δ=10,53 (с, 1Н); 9,64 (с, 1Н); 7,64 (д, 1Н); 7,57 (м, 3Н); 7,36 (д, 2Н); 7,26 (т, 1Н); 7,13 (т, 1Н); 6,76 (с, 1Н); 5,20 (с, 2Н); 4,45 (с, 2Н); 3,45 (м, 3Н); 3,06 (м, 3Н); 1,97 (м, 7Н); 1,55 (с, 2Н).
Пример 257: (1-изопропилпиперидин-4-ил)амид 1-[(4-хлорфенилкарбамоил)метил]-5-нитро-1Н-индол-2-карбоновой кислоты
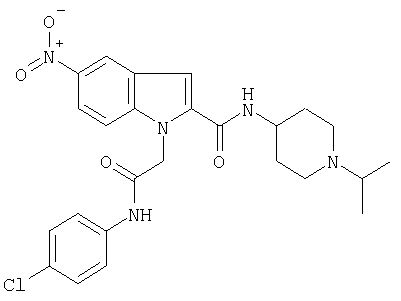
Указанное в заголовке соединение получают по аналогичной методике примера 248 с тем отличием, что используют этиловый эфир 5-нитро-1Н-индол-2-карбоновой кислоты вместо этилового эфира незамещенной 1Н-индол-2-карбоновой кислоты.
МС (ES+): m/е=498, изотопное распределение атомов хлора.
1H-ЯМР (300 МГц, ДМСО/ТМС): δ=10,53 (с, 1Н); 8,98 (с, 1Н); 8,83 (д, 1Н); 8,74 (с, 1Н); 8,14 (д, 1Н); 7,85 (д, 1Н); 7,59 (д, 2Н); 7,50 (с, 1Н); 7,38 (д, 2Н); 5,52 (с, 2Н); 4,02 (м, 1Н); 3,45 (м, 2Н); 3,07 (м, 2Н); 2,03 (м, 3Н); 1,81 (м, 2Н); 1,25 (д, 6Н).
Пример 258: (1-изопропилпиперидин-4-ил)амид 5-амино-4-хлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
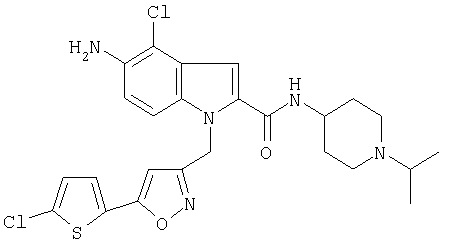
24,4 мг (1-изопропилпиперидин-4-ил)амида 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-5-нитро-1Н-индол-2-карбоновой кислоты добавляют к раствору 58,5 мг дигидрата хлорида олова в 1 мл этанола. Добавляют 0,5 мл 12 н. водной хлористоводородной кислоты и смесь перемешивают при комнатной температуре в течение 16 час. После охлаждения реакционной смеси ее подщелачивают до рН 12 насыщенным водным раствором гидроксида натрия и продукт выделяют фильтрованием. Продукт получают в виде белого твердого вещества, которое сушат при пониженном давлении.
Выход 10,0 мг. МС (ES+): m/е=532, изотопное распределение атомов хлора.
1H-ЯМР (300 МГц, ДМСО/ТМС): δ=8,40 (д, 1Н); 7,56 (д, 1Н); 7,28 (д, 1Н); 7,24 (д, 1Н); 7,07 (с, 1Н); 6,86 (д, 1Н); 6,54 (с, 1Н); 5,83 (с, 2Н); 4,97 (с, 2Н); 3,70 (м, 1Н); 2,78 (м, 2Н); 2,68 (м, 1Н); 2,14 (м, 2Н); 1,78 (м, 2Н); 1,53 (м, 2Н); 0,96 (д, 6Н).
Пример 259: (1-цианометилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты

К суспензии 50 мг пиперидин-4-иламида 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты в 1 мл этанола добавляют 43,5 мг карбоната калия, 14,5 мкл триэтиламина и 7,3 мкл бромацетонитрила. После перемешивания при комнатной температуре в течение 16 часов растворитель удаляют при пониженном давлении и остаток очищают препаративной ВЭЖХ (С 18 колонка с обращенной фазой, элюирование градиентом смеси вода/ацетонитрил с 0,1% трифторуксусной кислотой). Фракции, содержащие продукт, упаривают и лиофилизируют с получением белого твердого вещества. Продукт получают в виде его трифторацетатной соли.
Выход 13,8 мг. МС (ES+): m/е=480, изотопное распределение атомов хлора.
1H-ЯМР (300 МГц, ДМСО/ТМС): δ=8,49 (д, 1Н); 7,67 (д, 1Н); 7,58 (д, 1Н); 7,55 (д, 1Н); 7,28 (т, 1Н); 7,25 (д, 1Н); 7,22 (с, 1Н); 7,13 (т, 1Н); 6,59 (с, 1Н); 5,90 (с, 2Н); 3,87 (м, 3Н); 3,00 (м, 2Н); 2,48 (м, 2Н); 1,91 (м, 2Н); 1,67 (м, 2Н).
Пример 260: [1-(2-гидроксиэтил)пиперидин-4-ил]амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
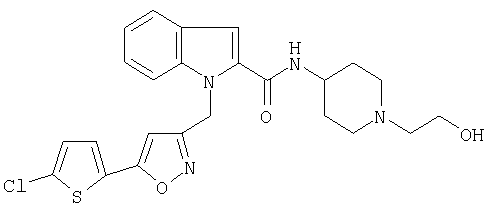
Указанное в заголовке соединение получают по аналогичной методике примера 259 с тем отличием, что используют 2-бромэтанол вместо бромацетонитрила.
МС (ES+): m/е=485, изотопное распределение атомов хлора.
1H-ЯМР (300 МГц, ДМСО/ТМС): 5=9,35 (с, 1Н); 8,63 (м, 1Н); 7,68 (д, 1Н); 7,61 (д, 1Н); 7,55 (д, 1Н); 7,30 (т, 1Н); 7,25 (м, 2Н); 7,14 (т, 1Н); 6,59 (с, 1Н); 5,90 (с, 2Н); 5,33 (с, 1Н); 4,04 (м, 1Н); 3,76 (м, 2Н); 3,56 (м, 2Н); 3,33 (м, 2Н); 3,12 (м, 2Н); 2,02 (м, 2Н); 1,87 (м, 1Н); 1,73 (м, 1Н).
Пример 261: [1-(2-метоксиэтил)пиперидин-4-ил]амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
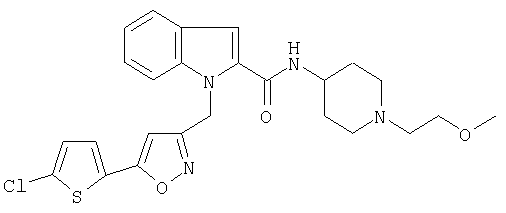
Указанное в заголовке соединение получают по аналогичной методике примера 259 с тем отличием, что используют 1-бром-2-метоксиэтан вместо бромацетонитрила и ацетонитрил в качестве растворителя.
МС (ES+): m/е=499, изотопное распределение атомов хлора.
1H-ЯМР (300 МГц, ДМСО/ТМС): δ=9,30 (с, 1Н); 8,65 (д, 1Н); 7,68 (д, 1Н); 7,60 (д, 1Н); 7,54 (д, 1Н); 7,30 (т, 1Н); 7,25 (м, 2Н); 7,15 (т, 1Н); 6,58 (с, 1Н); 5,90 (с, 2Н); 4,02 (м, 1Н); 3,67 (т, 2Н); 3,54 (м, 2Н); 3,33 (с, 3Н); 3,28 (т, 2Н); 3,10 (м, 2Н); 2,04 (м, 2Н); 1,83 (м, 2Н).
Пример 262: (1-карбамоилметилпиперидин-4-ил]амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
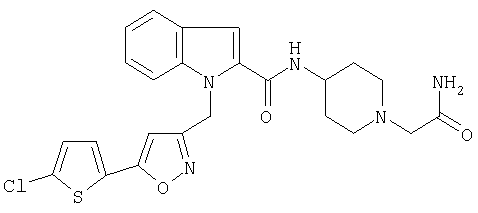
К суспензии 50 мг пиперидин-4-иламида 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты в 1 мл ацетонитрила добавляют 42,4 мкл этилдиизопропиламина и 29,4 мг 2-хлорацетамида. Реакционную смесь перемешивают при 80°С в течение 3 часов. После удаления растворителя при пониженном давлении остаток очищают препаративной ВЭЖХ (С 18 колонка с обращенной фазой, элюирование градиентом смеси вода/ацетонитрил с 0,1% трифторуксусной кислотой). Фракции, содержащие продукт, упаривают и лиофилизируют с получением белого твердого вещества. Продукт получают в виде его трифторацетатной соли.
MC (ES+): m/e=498, изотопное распределение атомов хлора.
1H-ЯМР (300 МГц, ДМСО/ТМС): δ=9,62 (с, 1Н); 8,65 (д, 1Н); 7,94 (с, 1Н); 7,68 (м, 2Н); 7,60 (д, 1Н); 7,54 (д, 1Н); 7,28 (т, 1Н); 7,25 (м, 2Н); 7,15 (т, 1Н); 6,58 (с, 1Н); 5,90 (с, 2Н); 4,00 (м, 1Н); 3,88 (м, 2Н); 3,53 (м, 2Н); 3,16 (м, 2Н); 2,00 (м, 4Н).
Пример 263: (1-метилкарбамоилметилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
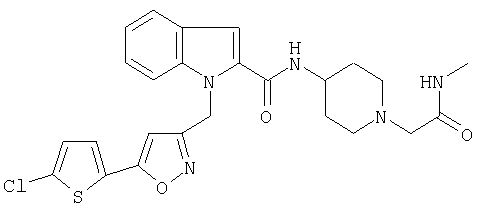
Указанное в заголовке соединение получают по аналогичной методике примера 262 с тем отличием, что используют 2-хлор-N-метилацетамид вместо 2-хлорацетамида.
MC (ES+): m/e=512, изотопное распределение атомов хлора.
1H-ЯМР (300 МГц, ДМСО/ТМС): δ=9,74 (с, 1Н); 8,65 (д, 1Н); 8,45 (с, 1Н); 7,68 (д, 1Н); 7,60 (д, 1Н); 7,53 (д, 1Н); 7,29 (т, 1Н); 7,25 (м, 2Н); 7,14 (т, 1Н); 6,56 (с, 1Н); 5,90 (с, 2Н); 4,00 (м, 1Н); 3,88 (м, 2Н); 3,53 (м, 2Н); 3,16 (м, 2Н); 2,69 (д, 3Н); 2,04 (м, 2Н); 1,92 (м, 2Н).
Пример 264: [1-(1Н-имидазол-2-илметил)пиперидин-4-ил]амид 1- [5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
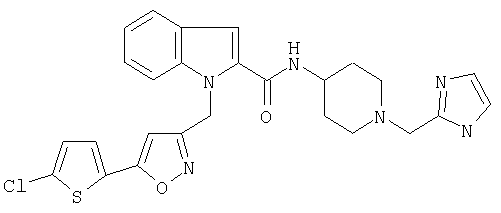
Раствор 50 мг пиперидин-4-иламида 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты в 1,5 мл 1,2-дихлорэтана обрабатывают 66,76 мг триацетоксиборогидрида натрия, 18 мкг ледяной кислоты и 11,1 мг 1H-имидазол-2-карбальдегида. После перемешивания реакционной смеси в течение 16 часов при комнатной температуре растворитель удаляют при пониженном давлении. Остаток очищают препаративной ВЭЖХ (С18 колонка с обращенной фазой, элюирование градиентом смеси вода/ацетонитрил с 0,1% трифторуксусной кислотой). Фракции, содержащие продукт, упаривают и лиофилизируют с получением белого твердого вещества. Продукт получают в виде его трифторацетатной соли.
МС (ES+): m/е=521, изотопное распределение атомов хлора.
1H-ЯМР (300 МГц, ДМСО/ТМС): δ=8,54 (д, 1Н); 7,68 (д, 1Н); 7,58 (д, 1Н); 7,53 (д, 1Н); 7,45 (с, 2Н); 7,29 (т, 1Н); 7,25 (д, 1Н); 7,22 (с, 1Н); 7,14 (т, 1Н); 6,57 (с, 1Н); 5,90 (с, 2Н); 4,13 (м, шир.); 3,87 (м, шир.); 3,18 (м, 2Н); 1,95 (м, 2Н); 1,75 (м, 2Н).
Пример 265: [1-(1-метил-1Н-имидазол-2-илметил)пиперидин-4-ил]амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
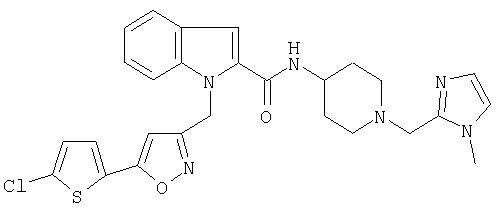
Указанное в заголовке соединение получают по аналогичной методике примера 264 с тем отличием, что используют 1-метил-1Н-имидазол-2-карбальдегид вместо 1Н-имидазол-2-карбальдегида.
МС (ES+): m/е=535, изотопное распределение атомов хлора.
1H-ЯМР (300 МГц, ДМСО/ТМС): δ=8,54 (д, 1Н); 7,68 (д, 1Н); 7,59 (д, 1Н); 7,55 (д, 1Н); 7,50 (с, 1Н); 7,29 (т, 1Н); 7,25 (д, 1Н); 7,22 (с, 1Н); 7,14 (т, 1Н); 6,57 (с, 1Н); 5,90 (с, 2Н); 4,13 (м, шир.); 3,93 (м, шир.); 3,78 (с, 3Н); 3,23 (м, шир.); 1,95 (м, 2Н); 1,75 (м, 2Н).
Пример 266: [1-(2-диметиламиноацетил)пиперидин-4-ил]амид 1-[5- (5-хлортиофен-2-ил)изоксазол-3-илметил]-1H-индол-2-карбоновой кислоты
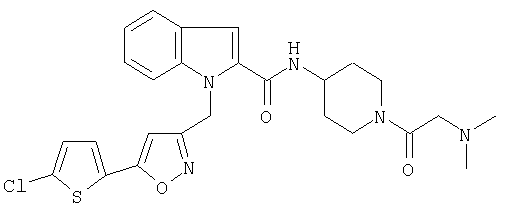
Раствор 50 мг пиперидин-4-иламида 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты в 1 мл N,N-диметилформамида обрабатывают 29,0 мг карбоната калия, 187,5 мкл этилдиизопропиламина и 16,7 мкл хлорацетилхлорида. После перемешивания реакционной смеси в течение 15 мин при комнатной температуре добавляют 19,5 мг гидрохлорида диметиламина и смесь далее перемешивают при комнатной температуре в течение 16 часов. Растворитель удаляют при пониженном давлении и остаток очищают препаративной ВЭЖХ (С18 колонка с обращенной фазой, элюирование градиентом смеси вода/ацетонитрил с 0,1% трифторуксусной кислотой). Фракции, содержащие продукт, упаривают и лиофилизируют с получением белого твердого вещества. Продукт получают в виде его трифторацетатной соли.
МС (ES+): m/е=526, изотопное распределение атомов хлора.
1H-ЯМР (300 МГц, ДМСО/ТМС), характеристические протоны для ароматических и амидных фрагментов: 9,50 (с, 1Н); 8,53 (д, 1Н); 7,68 (д, 1Н); 7,60 (д, 1Н); 7,55 (д, 1Н); 7,28 (т, 1Н); 7,25 (д, 1Н); 7,20 (с, 1Н); 7,15 (т, 1Н); 6,59 (с,1Н).
Пример 267: [1-(2-аминоацетил)пиперидин-4-ил]амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты
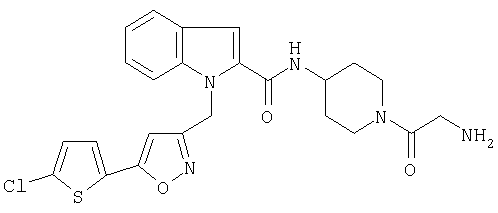
(i) трет-Бутиловый эфир {2-[4-({1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбонил}амино)пиперидин-1-ил]-2-оксоэтил}карбаминовой кислоты
К раствору 50 мг пиперидин-4-иламида 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты и 44,1 мкл N-этилморфолина в 1 мл дихлорметана добавляют 28,5 мг тетрафторбората О-[(этоксикарбонил)цианометиленамино]-N, N, N',N'-тетраметилурония и смесь перемешивают в течение 1 часа при комнатной температуре. К смеси добавляют 15,2 мг трет-бутоксикарбониламиноуксусной кислоты и реакционную смесь далее перемешивают в течение 1 час. После удаления растворителя при пониженном давлении остаток очищают препаративной ВЭЖХ (С18 колонка с обращенной фазой, элюирование градиентом смеси вода/ацетонитрил с 0,1% трифторуксусной кислотой). Фракции, содержащие продукт, упаривают и лиофилизируют с получением белого твердого вещества. Продукт получают в виде его трифторацетатной соли.
Выход 22,0 мг. МС (ES+): m/e=598.
(ii) [1-(2-Аминоацетил)пиперидин-4-ил]амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты.
Раствор 22,0 мг трет-бутилового эфира (2-[4-({1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбонил}амино)пиперидин-1-ил]-2-оксоэтил}карбаминовой кислоты в 5 мл 8 н. раствора хлористоводородной кислоты в метаноле перемешивают при комнатной температуре в течение 16 часов. К реакционной смеси добавляют 10 мл воды и полученную в результате смесь лиофилизируют с получением белого твердого вещества. Продукт получают в виде его гидрохлоридной соли.
МС (ES+): m/e=498, изотопное распределение атомов хлора.
1H-ЯМР (300 МГц, ДМСО/ТМС): δ=8,54 (д, 1Н); 8,03 (м, 2Н); 7,68 (д, 1Н); 7,59 (д, 1Н); 7,55 (д, 1Н); 7,28 (т, 1Н); 7,25 (д, 1Н); 7,22 (с, 1Н); 7,13 (т, 1Н); 6,59 (с, 1Н); 5,90 (с, 2Н); 4,35 (м, 1Н); 4,07 (м, 1Н); 3,95 (м, 1Н); 3,87 (м, 1Н); 3,73 (м, 1Н); 3,16 (м, 1Н); 2,86 (м, 1Н); 1,90 (м, 2Н); 1,54 (м, 1Н); 1,44 (м, 1Н).
Пример 268: 1-этоксикарбонилоксиэтиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновой кислоты
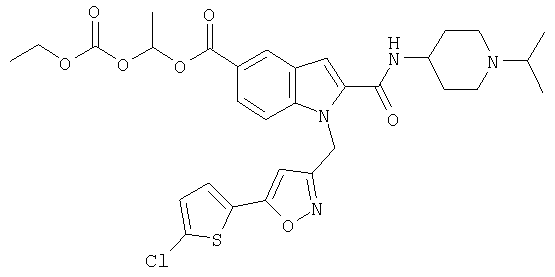
К раствору 0,39 г гидрохлорида 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновой кислоты в 15 мл ДМФА добавляют 0,23 г KI, 0,383 г К2СО3 и 0,37 мл 1-хлорэтилэтилкарбоната и реакционную смесь перемешивают в течение 3 час при 60°С в атмосфере аргона. После фильтрования и удаления растворителя при пониженном давлении остаток непосредственно очищают препаративной ВЭЖХ с элюированием градиентом 0-100% ацетонитрила в воде (+0,01% трифторуксусной кислоты). После добавления 1 М хлористоводородной кислоты и лиофилизации в смеси ацетонитрил/вода продукт получают в виде его гидрохлорида.
Выход 0,33 г. МС (ESI+): m/е=643, изотопное распределение атомов хлора.
Пример 269: 1-этоксикарбонилоксиэтиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-4-карбоновой кислоты
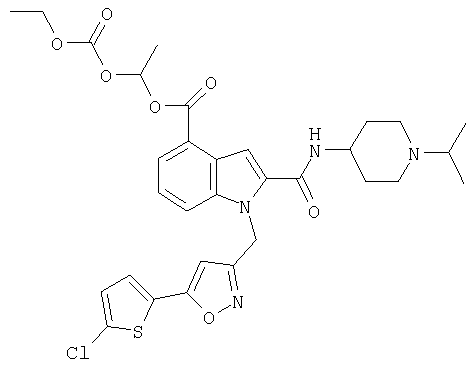
К раствору 0,6 г гидрохлорида 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-4-карбоновой кислоты в 20 мл ДМФА добавляют 0,679 г KI, 1,13 г К2СО3 и 1,094 мл 1-хлорэтилэтилкарбоната и реакционную смесь перемешивают в течение 3 час при 60°С в атмосфере аргона. После фильтрования и удаления растворителя при пониженном давлении остаток непосредственно очищают препаративной ВЭЖХ с элюированием градиентом 0-100% ацетонитрила в воде (+0,01% трифторуксусной кислоты). После добавления 1 М хлористоводородной кислоты и лиофилизации в смеси ацетонитрил/вода продукт получают в виде его гидрохлорида.
Выход 0,56 г. МС (ESI+): m/е=643, изотопное распределение атомов хлора.
Пример 270: 2,2-диметилпропионилоксиметиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-4-карбоновой кислоты
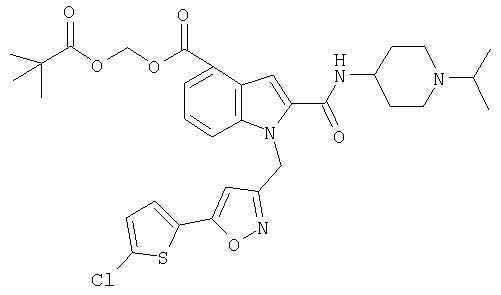
К раствору 0,6 г 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-4-карбоновой кислоты в 20 мл ДМФА добавляют 0,319 г хлорметилового эфира 2,2-диметилпропионовой кислоты и 441 мкл NEt3 и реакционную смесь перемешивают в течение 5 час при 60°С. Далее добавляют дополнительные 0,16 г хлорметилового эфира 2,2-диметилпропионовой кислоты и 147 мкл NEt3 и реакционную смесь перемешивают в течение 6 час при 60°С. После удаления растворителя при пониженном давлении остаток растворяют в СН2Cl2 и раствор промывают водой. Фазы разделяют и органическую фазу (после сушки над Na2SO4) концентрируют в вакууме. Остаток очищают препаративной ВЭЖХ с элюированием градиентом 0-100% ацетонитрила в воде (+0,01% трифторуксусной кислоты). После добавления 1 М хлористоводородной кислоты и лиофилизации в смеси ацетонитрил/вода продукт получают в виде его гидрохлорида.
Выход 0,5 г. МС (ESI+): m/е=641, изотопное распределение атомов хлора.
Пример 271: 1-(2,2-диметилпропионилокси)этиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновой кислоты
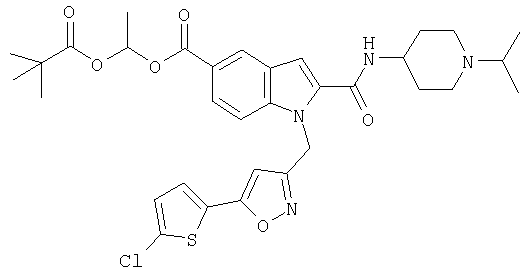
К суспензии 0,5 г 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновой кислоты в 30 мл ацетона добавляют 531 мкл DBU и смесь перемешивают в течение 15 мин при комнатной температуре. К данному раствору добавляют 0,556 г 1-бромэтилового эфира 2,2-диметилпропионовой кислоты (полученного, как описано Е. Defossa et al., Liebigs Ann. 1996, 1743-1749) и реакционную смесь перемешивают в течение 4 час при комнатной температуре. Далее добавляют дополнительные 266 мкл DBU и 0,185 г 1-бромэтилового эфира 2,2-диметилпропионовой кислоты. После 16 часов при комнатной температуре смесь концентрируют в вакууме и остаток очищают препаративной ОФ-ВЭЖХ с элюированием градиентом 0-100% ацетонитрила в воде (+0,01% трифторуксусной кислоты). После добавления 1 М хлористоводородной кислоты и лиофилизации в смеси ацетонитрил/вода продукт получают в виде его гидрохлорида.
Выход 0,48 г. МС (ESI+): m/е=655, изотопное распределение атомов хлора.
Пример 272: 1-(2,2-диметилпропионилокси)этиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-4-карбоновой кислоты
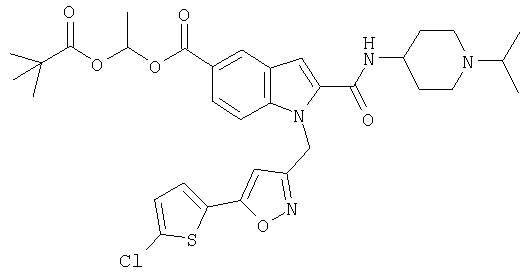
К суспензии 0,427 г 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-4-карбоновой кислоты в 30 мл ацетона добавляют 453 мкл DBU и смесь перемешивают в течение 15 мин при комнатной температуре. К данному раствору добавляют 0,475 г 1-бромэтилового эфира 2,2-диметилпропионовой кислоты (полученного, как описано Е. Defossa et al., Liebigs Ann. 1996, 1743-1749) и реакционную смесь перемешивают в течение 4 час при комнатной температуре. Далее добавляют дополнительные 227 мкл DBU и 0,158 г 1-бромэтилового эфира 2,2-диметилпропионовой кислоты. Спустя 16 часов при комнатной температуре смесь концентрируют в вакууме и остаток очищают препаративной ОФ-ВЭЖХ с элюированием градиентом 0-100% ацетонитрила в воде (+0,01% трифторуксусной кислоты). После добавления 1 М хлористоводородной кислоты и лиофилизации в смеси ацетонитрил/вода продукт получают в виде его гидрохлорида.
Выход 0,4 г. МС (ESI+): m/е=655, изотопное распределение атомов хлора.
Пример 273: 5-метил-2-оксо[1,3]диоксол-4-илметиловый эфир 1-[5- (5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-иэопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновой кислоты
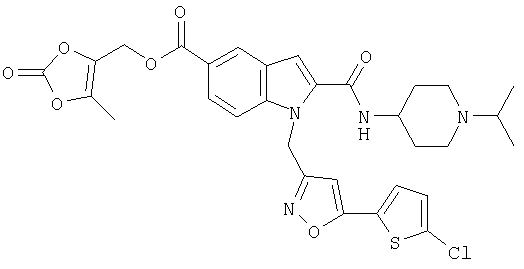
может быть получен из 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1H-индол-5-карбоновой кислоты и 4-хлорметил-5-метил[1,3]диоксол-2-она по методике, описанной Н. Yanagisawa et al., J. Med. Chem. 1996, 39, 323-338.
Пример 274: 5-метил-2-оксо[1,3]диоксол-4-илметиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-4-карбоновой кислоты

может быть получен из 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1H-индол-4-карбоновой кислоты и 4-хлорметил-5-метил[1,3]диоксол-2-она по методике, описанной Н. Yanagisawa et al., J. Med. Chem. 1996, 39, 323-338.
Пример 275: 1-циклогексилоксикарбонилоксиэтиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновой кислоты
может быть получен из 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновой кислоты и циклогексил-1-хлорэтилкарбоната по методике, описанной К. Kubo et al., J. Med. Chem. 1993, 36, 2343-2349.
Пример 276: 1-циклогексилоксикарбонилоксиэтиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-4-карбоновой кислоты
может быть получен из 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-4-карбоновой кислоты и циклогексил-1-хлорэтилкарбоната по методике, описанной К. Kubo et al., J. Med. Chem. 1993, 36, 2343-2349.
Фармакологическое тестирование
Способность соединений формулы I ингибировать фактор Ха или фактор VIIa или другие ферменты, такие как тромбин, плазмин или трипсин, может быть оценена по определению концентрации соединения формулы I, которая ингибирует активность фермента на 50%, т.е. значения IC50, которые относятся к константе ингибирования Ki. В хромогенных анализах используют очищенные ферменты. Концентрацию ингибитора, которая вызывает 50% уменьшение скорости гидролиза субстрата, определяют по линейной регрессии после построения графической зависимости относительных скоростей гидролиза (в сравнении с неингибированным контролем) от логарифма концентрации соединения формулы I. Для расчета константы ингибирования Ki значение IC50 корректируют для конкуренции с субстратом, используя формулу
Ki=IC50/{1+(концентрация субстрата/Km)},
где Km представляет константу Михаэлис-Ментен (Chen and Prusoff, Biochem. Pharmacol. 22 (1973), 3099-3108; I. H. Segal, Enzyme Kinetics, 1975, John Wiley & Sons, New York, 100-125; которые включены в данное описание посредством ссылки.
a) Анализ фактора Ха
В анализе определения ингибирования активности фактора Ха используют TBS-PEG буфер (50 мМ Трис-HCl, рН 7,8, 200 мМ NaCl, 0,05% (мас./об.) PEG-8000, 0,02% (мас./об.) NaN3). 1050 определяют, объединяя в соответствующих лунках микротитровальных планшетов Костара с разделенными лунками, 25 мкл человеческого фактора Ха (Enzyme Research Laboratories, Inc., South Bend, Indiana) в TBS-PEG; 40 мкл 10% (об./об.) ДМСО в TBS-PEG (неингибированный контроль) или различные концентрации тестируемого соединения, разведенного в 10% (об./об.) ДМСО в TBS-PEG, и субстрат S-2765 (N(а)-бензилоксикарбонил-D-Arg-Gly-L-Arg-п-нитроанилид; Kabi Pharmacia, Inc.; Franklin, Ohio) в TBS-PEG. Анализ осуществляют при предварительной инкубации соединения формулы I плюс фермент в течение 10 мин. Далее анализ инициируют добавлением субстрата для получения конечного объема, равного 100 мкл. Начальную скорость гидролиза хромогенного субстрата определяют по изменению поглощения при 405 нм, используя кинетическое устройство для считывания планшетов Bio-tek Instruments (Ceres UV900HD1) при 25°С на линейном участке временной зависимости (обычно 1,5 мин после добавления субстрата). Концентрация фермента составляет 0,5 нм и концентрация субстрата равна 140 мкМ.
b) Анализ фактора VIIa
Ингибирующую активность по отношению к фактору VIIa/тканевому фактору определяют, применяя хромогенный анализ, по существу как описано ранее (J.A. Ostrem et al. Biochemistry 37 (1998) 1053-1059, которая включена в данное описание посредством ссылки). Кинетические анализы проводят при 25°С в микротитровальных планшетах с разделенными лунками (Costar Corp., Cambridge, Massachusets), используя кинетическое устройство для считывания планшетов (Molecular Devices Spectramax 250). Типовой анализ состоит из 25 мкл человеческого фактора VIIa и TF (5 нМ и 10 нМ, относительно конечной концентрации), объединенных с 40 мкл разведении ингибитора в 10% смеси ДМСО/TBS-PEG буфер (50 мМ Tris, 15 мМ NaCl, 5 мМ CaCl2, 0,05% PEG-8000, pH 8,15). После 15 минутного периода предварительной инкубации анализ инициируют добавлением 35 мкл хромогенного субстрата S-2288 (D-Ile-Pro-Arg-п-нитроанилид, Pharmacia Hepar Inc., конечная концентрация 500 мкм). Результаты (константы ингибирования Ki (Fxa) для ингибирования фактора Ха) приведены в таблице.
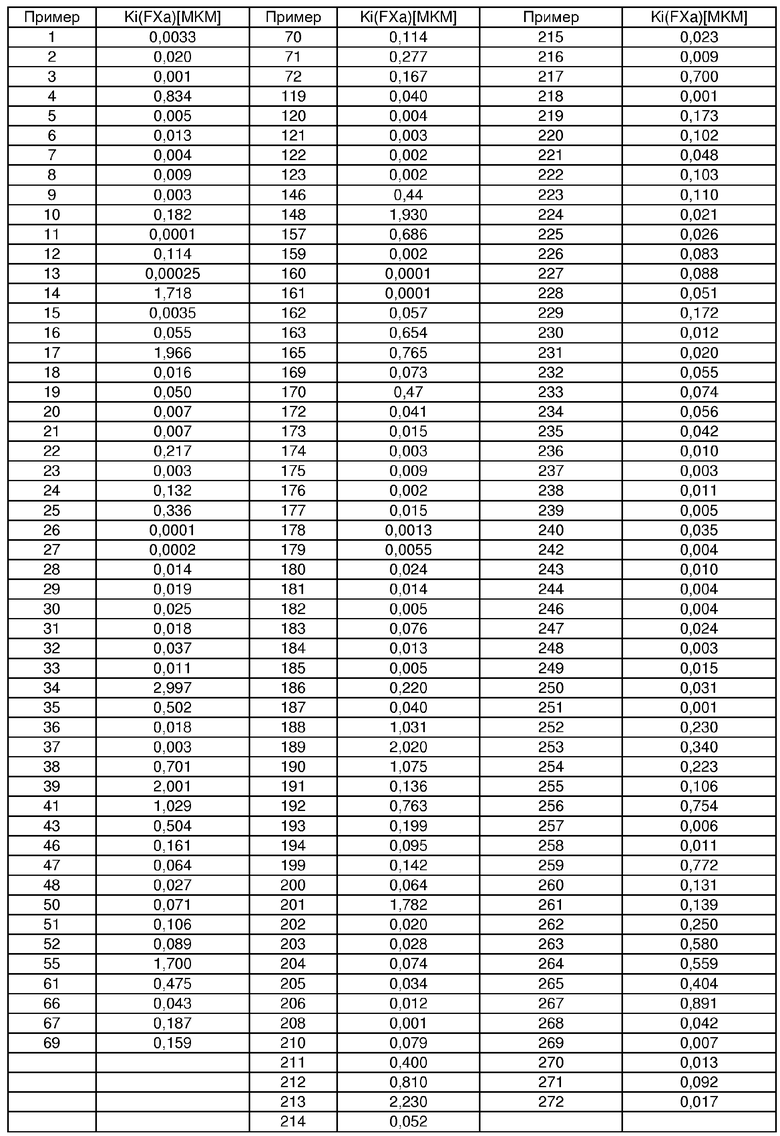
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ ФАКТОРА Ха | 2004 |
|
RU2346944C2 |
| АЗАИНДОЛЬНЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ФАКТОРА Xa | 2004 |
|
RU2330853C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ МОДУЛЯЦИИ АУТОИММУННЫХ ЗАБОЛЕВАНИЙ, СПОСОБ ПОЛУЧЕНИЯ ЭТИХ СОЕДИНЕНИЙ | 2000 |
|
RU2255937C2 |
| ПРОИЗВОДНЫЕ N-(ИМИДАЗОПИРИМИДИН-7-ИЛ)-ГЕТЕРОАРИЛАМИДОВ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ PDE10A | 2011 |
|
RU2562066C2 |
| АНТРАНИЛАМИДПИРИДИНАМИДЫ ИЗБИРАТЕЛЬНОГО ДЕЙСТВИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ VEGFR-2 И VEGFR-3 | 2002 |
|
RU2299208C2 |
| ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ 1-ОКСА-2,8-ДИАЗАСПИРО[4.5]ДЕЦ-2-ЕНА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ЛЕКАРСТВЕННОЕ СРЕДСТВО, ОБЛАДАЮЩЕЕ АНАЛЬГЕТИЧЕСКИМ ДЕЙСТВИЕМ | 2002 |
|
RU2296128C2 |
| АМИДЫ АМИНОТИОФЕНКАРБОНОВОЙ КИСЛОТЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ (ВАРИАНТЫ) И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1997 |
|
RU2184731C2 |
| ПРОИЗВОДНЫЕ ТЕТРАГИДРОКАРБАЗОЛА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ИХ ОСНОВЕ, СПОСОБ ЛЕЧЕНИЯ И/ИЛИ ПРОФИЛАКТИКИ ФИЗИОЛОГИЧЕСКИХ И/ИЛИ ПАТОЛОГИЧЕСКИХ СОСТОЯНИЙ, ОПОСРЕДОВАННЫХ LHRH РЕЦЕПТОРОМ, ПОСРЕДСТВОМ ВЫШЕНАЗВАННЫХ ПРОИЗВОДНЫХ | 2008 |
|
RU2497806C9 |
| ПРОИЗВОДНЫЕ ИНДОЛИЛПИПЕРИДИНА В КАЧЕСТВЕ АНТИГИСТАМИННЫХ И ПРОТИВОАЛЛЕРГИЧЕСКИХ СРЕДСТВ | 2000 |
|
RU2246493C2 |
| ПРОИЗВОДНЫЕ ХИНАЗОЛИНА ДЛЯ ТОРМОЖЕНИЯ РОСТА РАКОВЫХ КЛЕТОК И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2005 |
|
RU2362773C2 |
Настоящее изобретение относится к новым соединениям формулы (I), во всех их стереоизомерных формах и их смесях в любом соотношении и к их физиологически переносимым солям, обладающим свойствами ингибиторов фактора Ха и/или VIla, к лекарственному средству на их основе, к способу их получения и их применению для получения фармацевтических средств для ингибирования фактора Ха и/или фактора VIIa или для оказания влияния на коагуляцию крови или фибринолиз. 4 н. и 6 з.п. ф-лы, 12 табл.
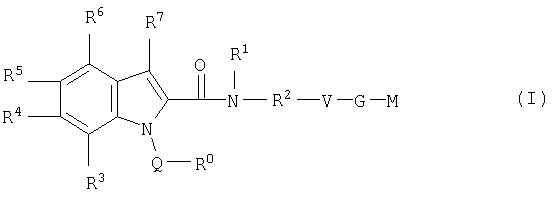
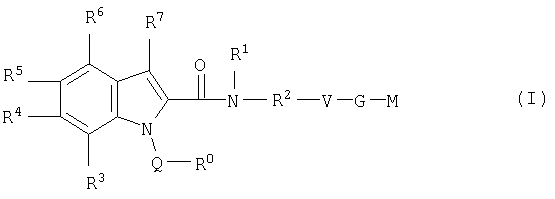
где R0 представляет собой
при условии, что R0 не является фенилом, когда Q представляет собой прямую связь,
R8 представляет собой галоген; -C(O)-NH2; -NH2; -OCF3; фенил, моно-, ди- или тризамещен галогеном; -O-(С1-С8)алкил, где алкил является незамещенным или моно-, ди- или тризамещенным галогеном,
при условии, что R8 представляет собой, по меньшей мере, один галоген, остаток -C(O)-NH2 или -O-(С1-С8)алкила, если R0 представляет собой фенил;
Q представляет собой прямую связь, -С(O)-, -(С0-С2)алкилен -С(O)-NR10-, -SO2-, -(С1-С6)алкилен;
R1 представляет собой атом водорода, -(С1-С4)алкил, где алкил является незамещенным или замещенным от одного до трех раз радикалом R13; или пиридил;
R2 представляет собой прямую связь или -(С1-С4)алкилен; или
R1-N-R2-V может образовывать 6-членный циклический остаток, содержащий 1 или 2 атома азота;
R10 представляет собой атом водорода;
V представляет собой
G представляет собой прямую связь, -(СН2)m-, -(СН2)-SO2-(СН2)n-, -(СН2)m-NR10-, (СН2)m-С(O)-(СН2)n-, -(СН2)n, -O-(СН2)n-,
n и m независимо один от другого являются одинаковыми или различными и представляют собой целые числа 0, 1, 2, 3, 4, 5 или 6;
R14 представляет собой галоген, -ОН, -(С1-С8)алкил, -(С1-С4)алкокси, -CN,-NH2,-С(O)-O-(С1-С4)алкил, -C(O)-NH2;
R10 представляет собой атом водорода или -(С1-С6)алкил;
М представляет собой атом водорода; -(С1-С8)алкил, где алкил является незамещенным или моно-, ди- или тризамещенным независимо один от другого радикалом R14;-С(О)-NR11NR12; -(CH2)m-NR10; C5- или С6-гетероарил, содержащий один или два атома азота, где гетероарил является незамещенным или моно-, ди- или тризамещенным независимо один от другого радикалом R14; С3-, C5- или С6-циклоалкил, где указанный циклоалкил является незамещенным или моно-, ди- или тризамещенным независимо один от другого радикалом R14; или 6-членный циклический остаток, содержащий до 1 или 2 гетероатома, выбранных из азота или кислорода, где указанный циклический остаток является незамещенным или моно-, ди- или тризамещенным независимо один от другого радикалом R14;
R11 и R12 являются независимо один от другого одинаковыми или различными и представляют собой атом водорода; -(С1-С6)алкил; или
R11 и R12 вместе с атомом азота, с которым они связаны, могут образовывать насыщенное 5-членное моноциклическое гетероциклическое кольцо;
R13 представляет собой галоген; =O; -ОН; -(С1-С8)алкил; -(С1-С8)алкокси; фенил; -C(O)-O-R11;
R3, R4, R5, R6 и R7 независимо один от другого являются одинаковыми или различными и представляют собой атом водорода; галоген; -(С1-С4)алкил, где алкил является незамещенным или замещенным от одного до трех раз радикалом R13; -(С1-С3)перфторалкил; фенил; -O-(С1-С4)алкил; -NO2; -CN; -ОН; бензилокси-; -C(O)-R10; -С(O)-N-R11R12; -NR11R12; -SOn-R10, где n равно 1 или 2; -С(O)-O-C(R15R16)-O-C(O)CO-R17; -C(O)-O-C(R15R16)-O-C(O)-R17; -NR10-(С1-C4)алкил, где алкил является незамещенным или замещенным от одного до трех раз радикалом R13;
R15 и R16 представляют собой независимо один от другого водород, -(C1-С6)алкил;
R17 представляет собой -(С1-С6)алкил,
во всех его стереоизомерных формах и их смесях в любом соотношении и его физиологически переносимые соли.
R0 представляет собой
и дополнительно замещен остатком, выбранным из группы, состоящей из тиенила, 2-тиенил или 3-тиенила, где указанный остаток является незамещенным или моно-, ди- или тризамещенным независимо один от другого радикалом R8,
R8 представляет собой галоген, такой как F, Cl, Br или I; -C(O)-NH2 или -O-(С1-С4)алкил, где алкил является незамещенным или моно-, ди- или тризамещенным галогеном,
при условии, что R8 представляет собой, по меньшей мере, один галоген, остаток -C(O)-NH2 или -O-(C1-C8)алкила, если R0 представляет собой фенил,
Q представляет собой прямую связь, -С(О)-, -SO2- или -(С1-С6)алкилен, -(С0-С2)алкилен -С(О)-NR10-;
R1 представляет собой атом водорода или -(С1-С2)алкил;
R2 представляет собой прямую связь или-(С1-С2)алкилен; или
R1-N-R2-V может образовывать 6-членную циклическую группу, включающую пиперидин, пиперазин, пиридин или пиримидин;
R14 представляет собой галоген, -(С1-С4)алкил или -NH2;
V представляет собой
G представляет собой прямую связь, -(СН2)m- или -(CH2)m-NR10-;
m представляет собой целые числа 0, 1, 2, 3 или 4;
R1 представляет собой атом водорода или-(С1-С4)алкил;
М представляет собой атом водорода; C5-или С6-гетероарил, где гетероарил представляет собой остаток, выбранный из группы, которая может являться производной пиперидина, пиперазина, пиридина, пиримидина, пирролидина, имидазола, пиридазина или пиразина, где указанный гетероарил является незамещенным или моно-, ди- или тризамещенным независимо один от другого радикалом R14; -(С1-С6)алкил, где указанный алкил является незамещенным или моно-, ди- или тризамещенным независимо один от другого радикалом R14, или С3-, С5- или С6-циклоалкил;
R3, R4, R5, R6 и R7 независимо один от другого являются одинаковыми или различными и представляют собой атом водорода; F, Cl или Br; -(С1-С4)алкил, где алкил является незамещенным или замещен радикалом R13; -CF3; фенил; -O-(C1-С4)алкил; -NO2; -CN; -ОН; бензилокси-; -C(O)-R10; -C(O)-N-R11R12; -NR1R12; -SOn-R10, где n равно 1 или 2; -C(O)-O-C(R15R16)-O-C(O)-R17; -C(O)-O-C(R15R16)-O-C(O)O-R17;
R13 представляет собой галоген, =O, -ОН, -(С1-С8)алкокси, -C(O)-O-R11,
во всех его стереоизомерных формах и их смесях в любом соотношении и его физиологически переносимые соли.
R0 представляет собой
фенил, где фенил является моно-, ди- или тризамещен независимо один от другого радикалом R8,
моноциклический 5-членный гетероарил, выбранный из группы, состоящей из тиадиазолила, изоксазолила и тиазолила, где указанный гетероарил замещен остатком, выбранным из группы тиенила, 2-тиенил или 3-тиенила, где указанный остаток является незамещенным или моно- или дизамещенным независимо один от другого радикалом R8,
R8 представляет собой F, Cl, Br, -ОСН3, -С(O)-NH2 или -OCF3;
Q представляет собой прямую связь, -С(O)-, -SO2-метилен или этилен;
R1 представляет собой атом водорода;
R2 представляет собой прямую связь или метилен; или
R1-N-R2-V может образовывать 6-членную циклическую группу, включающую пиперидин и пиперазин;
R13 представляет собой -C(O)-O-R11;
R14 представляет собой галоген, метил, этил или -NH2;
V представляет собой остаток из группы, включающей остаток изохинолина, хинолина, хиназолина, пиперидина и изоксазола, где указанный циклический остаток является незамещенным или моно- или дизамещен независимо один от другого радикалом R14; или фенил, где фенил является незамещенным или моно- или дизамещен независимо один от другого радикалом R14;
G представляет собой прямую связь, -(СН2)m- или-(CH2)m-NR10-;
m представляет собой целые числа 0, 1 или 2;
R10 представляет собой атом водорода или -(С1-С4)алкил;
М представляет собой атом водорода, -(С2-С4)алкил, имидазолил, пиразолил, пирролидинил, пиперидинил, тетрагидропиранил, пиридинил, пиримидил, пиразинил, пиридазинил; или С3-, С5- или С6-циклоалкил, где указанные циклические остатки являются незамещенными или моно- или дизамещены независимо один от другого радикалом R14;
R3, R4, R5, R6 и R7 независимо один от другого являются одинаковыми или различными и представляют собой атом водорода; F, Cl; -(С1-С4)алкил, где алкил является незамещенным или замещен радикалом R13; фенил; -O-(С1-С4)алкил; -C(O)-R10, -С(О)-N-R11R12; -NR11R12; -C(O)-O-C(R15R16)-O-C(O)-R17; -C(O)-O-C(R15R16)-O-C(O)-R17,
во всех его стереоизомерных формах и их смесях в любом соотношении и его физиологически переносимые соли.
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-5-метансульфонил-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-5-нитро-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 5-бензилокси-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 5-хлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-3Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-5-метокси-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-6-метокси-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-5-метил-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-4,6-диметокси-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-5,6-диметокси-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-7-нитро-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-5-трифторметокси-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-7-метил-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-7-(2,2-диметилпропиониламино)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-4-метокси-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-3-фенил-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-6-гидрокси-5-метокси-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-4,6-дифтор-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 4-бензилокси-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 7-хлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 6-хлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-5-этил-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-5-фтор-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-5-нитро-3-фенил-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 5-хлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-3-фенил-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-5,7-дифтор-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-5,7-динитро-1Н-индол-2-карбоновой кислоты,
(3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-7-метил-1Н-индол-2-карбоновой кислоты,
(3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-5-нитро-1Н-индол-2-карбоновой кислоты,
{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-ил}-[4-(пиридин-4-иламино)пиперидин-1-ил]метанон,
{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-5-нитро-1Н-индол-2-ил}-[4-(пиридин-4-иламино)пиперидин-1-ил]метанон,
{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-7-метил-1Н-индол-2-ил}-[4-(пиридин-4-иламино)пиперидин-1-ил]метанон,
{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-ил}-(4-изопропиламинопиперидин-1-ил)метанон,
{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-7-метил-1Н-индол-2-ил}-(4-изопропиламинопиперидин-1-ил)метанон,
(1-этилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-этилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-7-метил-1Н-индол-2-карбоновой кислоты,
{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-ил}-(4-пирролидин-1-илпиперидин-1-ил)метанон,
[1,4']бипиперидинил-1'-ил{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-ил}метанон,
(3-пиридин-4-ил-4,5-дигидроизоксазол-5-илметил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-ил}-(4-пиридин-4-илметилпиперазин-1-ил)метанон,
(1-изопропилпиперидин-4-илметил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-илметил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-циклопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
[1-(тетрагидропиран-4-ил)пиперидин-4-ил)]амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-циклопентилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-циклогексилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-(3-метоксибензил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-илметил)амид 1-(3-метоксибензил)-1Н-индол-2-карбоновой кислоты,
(3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-илметил)амид 1-(3-метоксибензил)-1Н-индол-2-карбоновой кислоты,
(4-изопропиламинопиперидин-1-ил)-[1-(3-метоксибензил)-1Н-индол-2-ил]метанон,
(3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-ил)амид 1-(3-метоксибензил)-1Н-индол-2-карбоновой кислоты,
[1-(3-метоксибензил)-1Н-индол-2-ил]-[4-(пиридин-4-иламино)пиперидин-1-ил]метанон,
(1-изопропилпиперидин-4-ил)амид 4-метокси-1-(3-метоксибензил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 5-хлор-1-(3-метоксибензил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 6-метокси-1-(3-метоксибензил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-(3-метоксибензил)-5-метил-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 5-бензилокси-1-(3-метоксибензил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-(3-метоксибензил)-5-нитро-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 5-метокси-1-(3-метоксибензил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-(3-метоксибензоил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-(3-метоксибензолсульфонил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-(4-метоксифенил)-1Н-индол-2-карбоновой кислоты,
(3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-ил)амид 1-(4-метоксифенил)-1Н-индол-2-карбоновой кислоты,
(4-изопропиламинопиперидин-4-ил)-[1-(4-метоксифенил)-1Н-индол-2-ил]метанон,
(1-изопропилпиперидин-4-ил)амид 1-(3-метоксифенил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-(3-хлорфенил)-1Н-индол-2-карбоновой кислоты,
(3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-ил)амид 1-(3-хлорфенил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-илметил)амид 1-(3-хлорфенил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-(3,5-дихлорфенил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-(4-хлорфенил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-(6-хлорбензо [b]тиофен-2-илметил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)-[1,3,4]тиадиазол-2-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[3-(5-хлортиофен-2-ил)изоксазол-5-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 3-хлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 3-бром-1-[5-(5-хлортиофен-2-ил) изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-(4-хлорбензил)-1Н-индол-2-карбоновой кислоты,
(3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-ил)амид 1-(4-хлорбензил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-(2,4-дихлорбензил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-(4-метоксибензил)-1Н-индол-2-карбоновой кислоты,
(4-изопропиламинопиперидин-1-ил)-[1-(4-метоксибензил)-1Н-индол-2-ил]метанон,
(1-изопропилпиперидин-4-ил)амид 1-(4-трифторметоксибензил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-(2-хлорбензил)-1Н-индол-2-карбоновой кислоты,
(3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-ил)амид 1-(2-хлорбензил)-1Н-индол-2-карбоновой кислоты,
(3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-илметил)амид 1-(2-хлорбензил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-(3,5-дихлорбензил)-1Н-индол-2-карбоновой кислоты,
[1-(3,5-дихлорбензил)-1Н-индол-2-ил]-(4-изопропиламинопиперидин-1-ил)метанон,
(1-изопропилпиперидин-4-ил)амид 3-фтор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-3-циано-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-3-циано-7-метил-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[2-(5-хлортиофен-2-ил)тиазол-5-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-(3-хлорбензил)-1Н-индол-2-карбоновой кислоты,
[1-(3-хлорбензил)-1Н-индол-2-ил]-(4-изопропиламинопиперидин-1-ил)метанон,
(1-изопропилпиперидин-4-ил)амид 1-[2-(4-хлорфенил)этил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[2-(2,4-дихлорфенил)этил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[2-(3-метоксифенил)этил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[2-(4-хлорфенил)этил]-4-метокси-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 4-бром-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-4-метил-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 5-бром-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-5-циано-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-4-трифторметил-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-4,7-диметил-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-4,7-диметокси-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 4,7-дихлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 5,7-дихлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 4-хлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(4-метилпиперазин-1-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
этиловый эфир [{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-7-метил-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусной кислоты,
[{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-7-метил-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусная кислота,
[(1-(1-этилпропил)пиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-метилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил) изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
[(1-(2,2,2-трифторэтил)пиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-формилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-карбамоилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-метансульфонилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-ацетилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
[1-(2-хлорпиримидин-4-ил)пиперидин-4-ил]амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-пиримидин-4-илпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-ил}-[4-(пиридин-4-илокси)пиперидин-1-ил]метанон,
[4-(1Н-имидазол-4-ил)фенил]амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(4-пиридин-3-ил)тиазол-2-ил]амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
[3-(пирролидин-1-карбонил)-4,5-дигидроизоксазол-5-илметил] амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изобутилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-пропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
метиловый эфир 4-({1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбонил}амино)пиперидин-1-карбоновой кислоты,
(4-изопропилпиперазин-1-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(4-этилпиперазин-1-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
пиридин-4-ил(3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
пиридин-4-ил(3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-5-нитро-1Н-индол-2-карбоновой кислоты,
(3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-3-циано-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-3,7-дийод-4-метокси-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-3,7-дициано-4-метокси-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[2-(4-хлорфенил)тиазол-4-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-(1,7-дихлоризохинолин-3-илметил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[3-(4-хлорфенил)изоксазол-5-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(4-хлорфенил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[3-(4-хлорфенил)-[1,2,4]оксадиазол-5-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[(5-хлорпиридин-2-илкарбамоил)метил]-5-метансульфонил-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[(4-хлорфенилкарбамоил)метил]-5-метансульфонил-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 5-хлор-1-[(5-хлорпиридин-2-илкарбамоил)метил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[(5-хлорпиридин-2-илкарбамоил)метил]-5-фтор-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[(5-хлорпиридин-2-илкарбамоил)метил]-5,7-дифтор-1Н-индол-2-карбоновой кислоты,
(1-этилпирролидин-3-ил)амид S-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-этилпирролидин-3-ил)амид R-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпирролидин-3-ил)амид R-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпирролидин-3-ил)амид S-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
этиловый эфир [{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-4-трифторметил-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусной кислоты,
этиловый эфир [{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-4,7-диметокси-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусной кислоты,
этиловый эфир [{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-4,7-диметокси-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусной кислоты,
этиловый эфир [{4,7-дихлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусной кислоты,
этиловый эфир [{5,7-дихлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусной кислоты,
этиловый эфир [{4-хлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусной кислоты,
[{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-4-трифторметил-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусная кислота,
[{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-4,7-диметил-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусная кислота,
[{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-4,7-диметокси-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусная кислота,
[{4,7-дихлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусная кислота,
[{5,7-дихлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусная кислота,
[{4-хлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусная кислота,
изопропиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновой кислоты,
1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновая кислота,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил)-5-гидроксиметил-1Н-индол-2-карбоновой кислоты,
этиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновой кислоты,
метиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновой кислоты,
2,2-диметилпропионилоксиметиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновой кислоты,
изопропиловый эфир 1-[5-(5-хлортиофен-2-ил)-[1,3,4]тиадиазол-2-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновой кислоты,
1-[5-(5-хлортиофен-2-ил)-[1,3,4]тиадиазол-2-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновая кислота,
изопропиловый эфир 1-[4-хлорфенилкарбамоил)метил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновой кислоты,
1-[4-хлорфенилкарбамоил)метил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновая кислота,
метиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил] 2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-4-карбоновой кислоты,
1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-4-карбоновая кислота,
2-[(1-изопропилпиперидин-4-ил)амид] 5-амида 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2,5-дикарбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[4-хлорфенилкарбамоил)метил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-хлортиофен-2-илкарбамоил)метил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[4-хлор-2-фтор-фенилкарбамоил)метил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[(5-хлорпиридин-2-илкарбамоил)метил]-1Н-индол-2-карбоновой кислоты,
(3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-илметил)амид 1-[(4-хлорфенилкарбамоил)метил]-1Н-индол-2-карбоновой кислоты,
(3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-ил)амид 1-[(4-хлорфенилкарбамоил)метил]-1Н-индол-2-карбоновой кислоты,
N-(4-хлорфенил)-2-{2-[4-(пиридин-4-иламино)пиперидин-1-карбонил]индол-1-ил}ацетамид,
(1-циклопропилпиперидин-4-ил)амид 1-[(4-хлорфенилкарбамоил)метил]-1Н-индол-2-карбоновой кислоты,
N-(4-хлорфенил)-2-[2-(4-пирролидин-1-илпиперидин-1-карбонил]индол-1-ил}ацетамид,
(1-изопропилпиперидин-4-ил)амид 1-[(4-хлорфенилкарбамоил)метил]-5-нитро-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 5-амино-4-хлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-цианометилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
[1-(2-гидроксиэтил)пиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
[1-(2-метоксиэтил)пиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-карбамоилметилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-метилкарбамоилметилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
[1-(1Н-имидазол-2-илметилпиперидин-4-ил]амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
[1-(2-диметиламиноацетил)пиперидин-4-ил]амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
1-этоксикарбонилоксиэтиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновой кислоты,
1-этоксикарбонилоксиэтиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-4-карбоновой кислоты,
2,2-диметилпропионилоксиметиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-4-карбоновой кислоты,
1-(2,2-диметилпропионилокси)этиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновой кислоты,
1-(2,2-диметилпропионилокси)этиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-4-карбоновой кислоты,
5-метил-2-оксо-[1,3]диоксол-4-илметил 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновой кислоты,
5-метил-2-оксо-[1,3]диоксол-4-илметил 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-4-карбоновой кислоты,
1-циклогексилкарбонилоксиэтиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновой кислоты или
1-циклогексилкарбонилоксиэтиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-4-карбоновой кислоты.
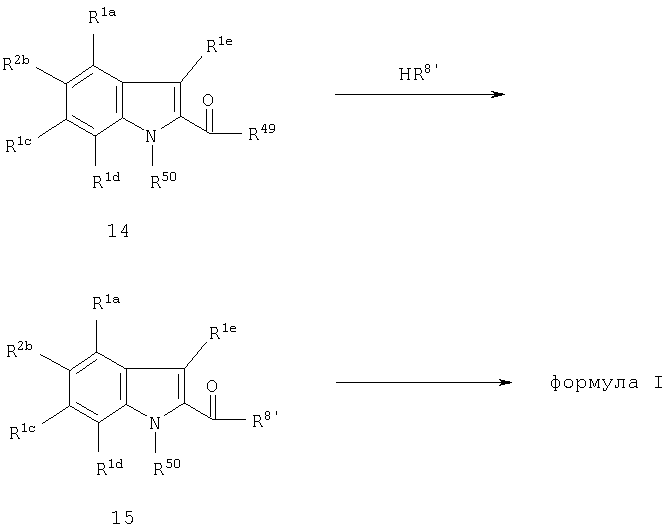
где остаток R8 является донором -N(R1)-R2-V-G-M, как указано в пп.1-4, но где в R8' функциональные группы могут также присутствовать в виде групп, которые последовательно трансформируются в конечные функциональные группы, представленные в -N(R1)-R2-V-G-M, где группа-C(O)-R49 может представлять собой группу карбоновой кислоты или ее производных, где остаток R50 означает группу -Q-R0 и где группы R1e, R1a, R1b, R1c и R1d в формулах 14 и 15 имеют соответствующие определения R7, R6, R5, R4 и R3 в формуле I, как определено в пп.1-4, или функциональные группы в них могут также быть представлены в защищенной форме.

во всех его стереоизомерных формах и их смесей в любом соотношении и/или его физиологически переносимых солей для получения фармацевтических средств для ингибирования фактора Ха и/или фактора VIIa или для оказания влияния на коагуляцию крови или фибринолиз, где
R0 представляет собой
при условии, что R0 не является фенилом, когда Q представляет собой прямую связь,
R8 представляет собой галоген; -C(O)-NH2; -NH2; -OCF3; фенил, моно-, ди- или тризамещен галогеном; -O-(C1-C8)алкил, где алкил является незамещенным или моно-, ди- или тризамещенным галогеном;
при условии, что R представляет собой, по меньшей мере, один галоген, остаток -C(О)-NH2 или -О-(C1-C8)алкила, если R0 представляет собой фенил;
Q представляет собой прямую связь, -С(О)-, -(С0-С2)алкилен -С(О)-NR10-, -SO2-, -(С1-С6)алкилен;
R1 представляет собой атом водорода, -(С1-С4)алкил, где алкил является незамещенным или замещенным от одного до трех раз радикалом R13; или пиридил;
R2 представляет собой прямую связь или -(С1-С4)алкилен; или
R1-N-R2-V может образовывать 6-членный циклический остаток, содержащий 1 или 2 атома азота;
R10 представляет собой атом водорода;
V представляет собой
G представляет собой прямую связь, -(СН2)m-, (СН2)-SO2-(СН2)n-, -(СН2)m-NR10-, (СН2)m-С(O)-(СН2)n-, -(СН2)n, -O-(СН2)n-,
n и m независимо один от другого являются одинаковыми или различными и представляют собой целые числа 0, 1, 2, 3, 4, 5 или 6;
R14 представляет собой галоген, -ОН, -(С1-С8)алкил, -(С1-С4)алкокси, -CN, -NH2,-С(O)-O-(С1-С4)алкил, -C(O)-NH2;
R10 представляет собой атом водорода или-(С1-С6)алкил;
М представляет собой атом водорода; -(С1-С8)алкил, где алкил является незамещенным или моно-, ди- или тризамещенным независимо один от другого радикалом R14; -С(O)NR11R12; -(CH2)m-NR10; C5- или С6-гетероарил, содержащий один или два атома азота, где гетероарил является незамещенным или моно-, ди- или тризамещенным независимо один от другого радикалом R14; С3-, С5- или С6-циклоалкил, где указанный циклоалкил является незамещенным или моно-, ди- или тризамещенным независимо один от другого радикалом R14; или 6-членный циклический остаток, содержащий до 1 или 2 гетероатома, выбранных из азота или кислорода, где указанный циклический остаток является незамещенным или моно-, ди- или тризамещенным независимо один от другого радикалом R14;
R11и R12 являются независимо один от другого одинаковыми или различными и представляют собой атом водорода; -(С1-С6)алкил, или
R11 и R12 вместе с атомом азота, с которым они связаны, могут образовывать насыщенное 5-членное моноциклическое гетероциклическое кольцо;
R13 представляет собой галоген; =O; -ОН; -(С1-С8)алкил; -(C1-C8)алкокси; фенил; -C(О)-O-R11;
R3, R4, R5, R6 и R7 независимо один от другого являются одинаковыми или различными и представляют собой атом водорода; галоген; -(С1-С4)алкил, где алкил является незамещенным или замещенным от одного до трех раз радикалом R13; -(С1-С3)перфторалкил; фенил; -O-(С1-С4)алкил; -NO2; -CN; -ОН; бензилокси-; -C(O)-R10;-С(O)-N-R11R12; -NR11R12; -SOn-R10, где n равно 1 или 2; -С(O)-O-C(R15R16)-O-C(O)-R17; -C(O)-O-C(R15R16)-O-C(O)O-R17; -NRl0-(C1-C4)алкил, где алкил является незамещенным или замещенным от одного до трех раз радикалом R13;
R15 и R16 представляют собой независимо один от другого водород, -(С1-С6)алкил;
R17 представляет собой -(С1-С6)алкил.
R0 представляет собой
и дополнительно замещен остатком, выбранным из группы, состоящей из тиенила, 2-тиенил или 3-тиенила, где указанный остаток является незамещенным или моно-, ди- или тризамещенным независимо один от другого радикалом R8,
R8 представляет собой галоген, такой как F, Cl, Br или I; -C(O)-NH2 или -O-(С1-С4)алкил, где алкил является незамещенным или моно-, ди- или тризамещенным галогеном,
при условии, что R8 представляет собой, по меньшей мере, один галоген, остаток -C(O)-NH2 или -O-(C1-C8)алкила, если R0 представляет собой фенил,
Q представляет собой прямую связь, -С(О)-, -SO2- или -(С1-С6)алкилен, -(С0-С2)алкилен -С(О)-NR10-;
R1 представляет собой атом водорода или -(С1-С2)алкил;
R2 представляет собой прямую связь или -(С1-С2)алкилен; или
R1-N-R2-V может образовывать 6-членную циклическую группу, включающую пиперидин, пиперазин, пиридин или пиримидин;
R14 представляет собой галоген, -(С1-С4)алкил или -NH2;
V представляет собой
G представляет собой прямую связь, -(CH2)m- или -(CH2)m-NR10-;
m представляет собой целые числа 0, 1, 2, 3 или 4;
R10 представляет собой атом водорода или -(С1-С4)алкил;
М представляет собой атом водорода; С5- или С6-гетероарил, где гетероарил представляет собой остаток, выбранный из группы, которая может являться производной пиперидина, пиперазина, пиридина, пиримидина, пирролидина, имидазола, пиридазина или пиразина, где указанный гетероарил является незамещенным или моно-, ди- или тризамещенным независимо один от другого радикалом R14; -(С1-С6)алкил, где указанный алкил является незамещенным или моно-, ди- или тризамещенным независимо один от другого радикалом R14, или С3-, С5-или С6-циклоалкил;
R3, R4, R5, R6 и R7 независимо один от другого являются одинаковыми или различными и представляют собой атом водорода; F, Cl или Br; -(С1-С4)алкил, где алкил является незамещенным или замещен радикалом R13; -CF3; фенил; -O-(C1-С4)алкил; -NO2; -CN; -ОН; бензилокси-; -C(O)-R10; -С(О)-N-R11R2; -NR11R12; -SOn-R10, где n равно 1 или 2; -C(O)-O-C(R15R16)-O-C(O)-R17; -C(O)-O-C(R15R16)-O-C(O)O-R17;
R13 представляет собой галоген, =O, -ОН, -(С1-С8)алкокси, -C(O)-O-R11.
R0 представляет собой
фенил, где фенил является моно-, ди- или тризамещен независимо один от другого радикалом R8,
моноциклический 5-членный гетероарил, выбранный из группы, состоящей из тиадиазолила, изоксазолила и тиазолила, где указанный гетероарил замещен остатком, выбранным из группы тиенила, 2-тиенил или 3-тиенила, где указанный остаток является незамещенным или моно- или дизамещенным независимо один от другого радикалом R8,
R8 представляет собой F, Cl, Br, -ОСН3, -C(O)-NH2 или -OCF3;
Q представляет собой прямую связь, -С(O)-, -SO2- метилен или этилен;
R1 представляет собой атом водорода;
R2 представляет собой прямую связь или метилен; или
R1-N-R2-V может образовывать 6-членную циклическую группу, включающую пиперидин и пиперазин;
R13 представляет собой -C(O)-O-R11;
R14 представляет собой галоген, метил, этил или -NH2;
V представляет собой остаток из группы, включающей остаток изохинолина, хинолина, хиназолина, пиперидина и изоксазола, где указанный циклический остаток является незамещенным или моно- или дизамещен независимо один от другого радикалом R14; или фенил, где фенил является незамещенным или моно- или дизамещен независимо один от другого радикалом R14;
G представляет собой прямую связь, -(СН2)m- или -(CH2)m-NR10-;
m представляет собой целые числа 0, 1 или 2;
R10 представляет собой атом водорода или -(С1-С4)алкил;
М представляет собой атом водорода, -(С2-С4)алкил, имидазолил, пиразолил, пирролидинил, пиперидинил, тетрагидропиранил, пиридинил, пиримидил, пиразинил, пиридазинил; или С3-, С5- или С6-циклоалкил, где указанные циклические остатки являются незамещенными или моно- или дизамещены независимо один от другого радикалом R14;
R3, R4, R5, R6 и R7 независимо один от другого являются одинаковыми или различными и представляют собой атом водорода; F, Cl; -(С1-С4)алкил, где алкил является незамещенным или замещен радикалом R13; фенил; -O-(С1-С4)алкил; -C(O)-R10, -С(О)-N-R11R12; -NR11R12; -C(O)-O-C(R15R16)-O-C(O)-R17; -С(O)-O-C(R15R16)-O-C(O)-R17.
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-5-метансульфонил-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-5-нитро-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 5-бензилокси-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 5-хлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-5-метокси-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-6-метокси-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-5-метил-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-4,6-диметокси-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-5,6-диметокси-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-7-нитро-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-5-трифторметокси-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-7-метил-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-7-(2,2-диметилпропиониламино)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-4-метокси-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-3-фенил-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-6-гидрокси-5-метокси-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-4,6-дифтор-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 4-бензилокси-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 7-хлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 6-хлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-5-этил-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-5-фтор-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил) изоксазол-3-илметил]-5-нитро-3-фенил-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 5-хлор-1-[5-(5-хлортиофен-2-ил) изоксазол-3-илметил]-3-фенил-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-5,7-дифтор-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-5,7-динитро-1Н-индол-2-карбоновой кислоты,
(3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-7-метил-1Н-индол-2-карбоновой кислоты,
(3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-5-нитро-1Н-индол-2-карбоновой кислоты,
{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-ил}-[4-(пиридин-4-иламино)пиперидин-1-ил]метанон,
{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-5-нитро-1Н-индол-2-ил}-[4-(пиридин-4-иламино)пиперидин-1-ил]метанон,
{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-7-метил-1Н-индол-2-ил}-[4-(пиридин-4-иламино)пиперидин-1-ил]метанон,
{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-ил}-(4-изопропиламинопиперидин-1-ил)метанон,
{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-7-метил-1Н-индол-2-ил}-(4-изопропиламинопиперидин-1-ил)метанон,
(1-этилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-этилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-7-метил-1Н-индол-2-карбоновой кислоты,
{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-ил}-(4-пирролидин-1-илпиперидин-1-ил)метанон,
[1,4']бипиперидинил-1'-ил{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-ил} метанон,
(3-пиридин-4-ил-4,5-дигидроизоксазол-5-илметил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-ил}-(4-пиридин-4-илметилпиперазин-1-ил)метанон,
(1-изопропилпиперидин-4-илметил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-илметил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-циклопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
[1-(тетрагидропиран-4-ил)пиперидин-4-ил)]амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-циклопентилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил) изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-циклогексилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-(3-метоксибензил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-илметил)амид 1-(3-метоксибензил)-1Н-индол-2-карбоновой кислоты,
(3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-илметил)амид 1-(3-метоксибензил)-1Н-индол-2-карбоновой кислоты,
(4-изопропиламинопиперидин-1-ил)-[1-(3-метоксибензил)-1Н-индол-2-ил]метанон,
(3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-ил)амид 1-(3-метоксибензил)-1Н-индол-2-карбоновой кислоты,
[1-(3-метоксибензил)-1Н-индол-2-ил]-[4-(пиридин-4-иламино)пиперидин-1-ил]метанон,
(1-изопропилпиперидин-4-ил)амид 4-метокси-1-(3-метоксибензил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 5-хлор-1-(3-метоксибензил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 6-метокси-1-(3-метоксибензил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-(3-метоксибензил)-5-метил-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 5-бензилокси-1-(3-метоксибензил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-(3-метоксибензил)-5-нитро-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 5-метокси-1-(3-метоксибензил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-(3-метоксибензоил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-(3-метоксибензолсульфонил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-(4-метоксифенил)-1Н-индол-2-карбоновой кислоты,
(3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-ил)амид 1-(4-метоксифенил)-1Н-индол-2-карбоновой кислоты,
(4-изопропиламинопиперидин-4-ил)-[1-(4-метоксифенил)-1Н-индол-2-ил]метанон,
(1-изопропилпиперидин-4-ил)амид 1-(3-метоксифенил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-(3-хлорфенил)-1Н-индол-2-карбоновой кислоты,
(3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-ил)амид 1-(3-хлорфенил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-илметил)амид 1-(3-хлорфенил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-(3,5-дихлорфенил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил) амид 1-(4-хлорфенил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-(6-хлорбензо[b]тиофен-2-илметил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)-[1,3,4]тиадиазол-2-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[3-(5-хлортиофен-2-ил)изоксазол-5-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 3-хлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 3-бром-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-(4-хлорбензил)-1Н-индол-2-карбоновой кислоты,
(3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-ил)амид 1-(4-хлорбензил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-(2,4-дихлорбензил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-(4-метоксибензил)-1Н-индол-2-карбоновой кислоты,
(4-изопропиламинопиперидин-1-ил)-[1-(4-метоксибензил)-1Н-индол-2-ил]метанон,
(1-изопропилпиперидин-4-ил)амид 1-(4-трифторметоксибензил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-(2-хлорбензил)-1Н-индол-2-карбоновой кислоты,
(3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-ил)амид 1-(2-хлорбензил)-1Н-индол-2-карбоновой кислоты,
(3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-илметил)амид 1-(2-хлорбензил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-(3,5-дихлорбензил)-1Н-индол-2-карбоновой кислоты,
[1-(3,5-дихлорбензил)-1Н-индол-2-ил]-(4-изопропиламинопиперидин-1-ил)метанон,
(1-изопропилпиперидин-4-ил)амид 3-фтор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-3-циано-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-3-циано-7-метил-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[2-(5-хлортиофен-2-ил)тиазол-5-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-(3-хлорбензил)-1Н-индол-2-карбоновой кислоты,
[1-(3-хлорбензил)-1Н-индол-2-ил]-(4-изопропиламинопиперидин-1-ил)метанон,
(1-изопропилпиперидин-4-ил)амид 1-[2-(4-хлорфенил)этил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[2-(2,4-дихлорфенил)этил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[2-(3-метоксифенил)этил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[2-(4-хлорфенил)этил]-4-метокси-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 4-бром-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-4-метил-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 5-бром-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-5-циано-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-4-трифторметил-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-4,7-диметил-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-4,7-диметокси-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 4,7-дихлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 5,7-дихлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 4-хлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(4-метилпиперазин-1-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
этиловый эфир [{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-7-метил-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусной кислоты,
[{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-7-метил-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусная кислота,
[(1-(1-этилпропил)пиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-метилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
[(1-(2,2,2-трифторэтил)пиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-формилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-карбамоилпиперидин-4-ил) амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-метансульфонилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-ацетилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
[1-(2-хлорпиримидин-4-ил)пиперидин-4-ил]амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-пиримидин-4-илпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-ил}-[4-(пиридин-4-илокси)пиперидин-1-ил]метанон,
[4-(1Н˜имидазол-4-ил)фенил]амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(4-пиридин-3-ил)тиазол-2-ил]амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
[3-(пирролидин-1-карбонил)-4,5-дигидроизоксазол-5-илметил] амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изобутилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-пропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
метиловый эфир 4-({1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбонил}амино)пиперидин-1-карбоновой кислоты,
(4-изопропилпиперазин-1-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(4-этилпиперазин-1-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
пиридин-4-ил(3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
пиридин-4-ил(3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-5-нитро-1Н-индол-2-карбоновой кислоты,
(3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-3-циано-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-3,7-дийод-4-метокси-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-3,7-дициано-4-метокси-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[2-(4-хлорфенил)тиазол-4-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-(1,7-дихлоризохинолин-3-илметил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[3-(4-хлорфенил)изоксазол-5-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-(4-хлорфенил)изоксазол-3-илметил]-3-Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[3-(4-хлорфенил)-[1,2,4]оксадиазол-5-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[(5-хлорпиридин-2-илкарбамоил)метил]-5-метансульфонил-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[(4-хлорфенилкарбамоил)метил]-5-метансульфонил-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 5-хлор-1-[(5-хлорпиридин-2-илкарбамоил)метил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[(5-хлорпиридин-2-илкарбамоил)метил]-5-фтор-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[(5-хлорпиридин-2-илкарбамоил)метил]-5,7-дифтор-1Н-индол-2-карбоновой кислоты,
(1-этилпирролидин-3-ил)амид S-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-этилпирролидин-3-ил)амид R-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпирролидин-3-ил)амид R-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпирролидин-3-ил)амид S-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
этиловый эфир [{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-4-трифторметил-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусной кислоты,
этиловый эфир [{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-4,7-диметокси-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусной кислоты,
этиловый эфир [{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-4,7-диметокси-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусной кислоты,
этиловый эфир [{4,7-дихлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусной кислоты,
этиловый эфир [{5,7-дихлор-1-[5-(5-хлортиофен-2˜ ил)изоксазол-3-илметил]-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусной кислоты,
этиловый эфир [{4-хлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусной кислоты,
[{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-4-трифторметил-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусная кислота,
[{1-[5-(3-хлортиофен-2-ил)изоксазол-3-илметил]-4,7-диметил-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусная кислота,
[{1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-4,7-диметокси-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусная кислота,
[{4,7-дихлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусная кислота,
[{5,7-дихлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусная кислота,
[{4-хлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбонил}-(1-изопропилпиперидин-4-ил)амино]уксусная кислота,
изопропиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновой кислоты,
1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновая кислота,
(1-изопропилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил)-5-гидроксиметил-1Н-индол-2-карбоновой кислоты,
этиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновой кислоты,
метиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновой кислоты,
2,2-диметилпропионилоксиметиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновой кислоты,
изопропиловый эфир 1-[5-(5-хлортиофен-2-ил)-[1,3,4]тиадиазол-2-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновой кислоты,
1-[5-(5-хлортиофен-2-ил)-[1,3,4]тиадиазол-2-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновая кислота,
изопропиловый эфир 1-[4-хлорфенилкарбамоил)метил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновой кислоты,
1-[4-хлорфенилкарбамоил)метил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновая кислота,
метиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-4-карбоновой кислоты,
1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-4-карбоновая кислота,
2-[(1-изопропилпиперидин-4-ил)амид] 5-амида 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2,5-дикарбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[4-хлорфенилкарбамоил)метил)-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[5-хлортиофен-2-илкарбамоил)метил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[4-хлор-2-фтор-фенилкарбамоил)метил]-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 1-[(5-хлорпиридин-2-илкарбамоил)метил]-1Н-индол-2-карбоновой кислоты,
(3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-илметил)амид 1-[(4-хлорфенилкарбамоил)метил]-1Н-индол-2-карбоновой кислоты,
(3,4,5,6-тетрагидро-2Н-[1,4']бипиридинил-4-ил)амид 1-[(4-хлорфенилкарбамоил)метил]-1Н-индол-2-карбоновой кислоты,
N-(4-хлорфенил)-2-{2-[4-(пиридин-4-иламино)пиперидин-1-карбонил]индол-1-ил}ацетамид,
(1-циклопропилпиперидин-4-ил)амид 1-[(4-хлорфенилкарбамоил)метил]-1Н-индол-2-карбоновой кислоты,
N-(4-хлорфенил)-2-[2-(4-пирролидин-1-илпиперидин-1-карбонил]индол-1-ил}ацетамид,
(1-изопропилпиперидин-4-ил)амид 1-[(4-хлорфенилкарбамоил)метил]-5-нитро-1Н-индол-2-карбоновой кислоты,
(1-изопропилпиперидин-4-ил)амид 5-амино-4-хлор-1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-цианометилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
[1-(2-гидроксиэтил)пиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
[1-(2-метоксиэтил)пиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-карбамоилметилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
(1-метилкарбамоилметилпиперидин-4-ил)амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
[1-(1Н-имидазол-2-илметилпиперидин-4-ил]амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
[1-(2-диметиламиноацетил)пиперидин-4-ил]амид 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-1Н-индол-2-карбоновой кислоты,
1-этоксикарбонилоксиэтиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновой кислоты,
1-этоксикарбонилоксиэтиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-4-карбоновой кислоты,
2,2-диметилпропионилоксиметиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-4-карбоновой кислоты,
1-(2,2-диметилпропионилокси)этиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновой кислоты,
1-(2,2-диметилпропионилокси)этиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-4-карбоновой кислоты,
5-метил-2-оксо-[1,3]диоксол-4-илметил 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновой кислоты,
5-метил-2-оксо-[1,3]диоксол-4-илметил 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-4-карбоновой кислоты,
1-циклогексилкарбонилоксиэтиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-5-карбоновой кислоты или
1-циклогексилкарбонилоксиэтиловый эфир 1-[5-(5-хлортиофен-2-ил)изоксазол-3-илметил]-2-(1-изопропилпиперидин-4-илкарбамоил)-1Н-индол-4-карбоновой кислоты.
| ЗАМЕЩЕННЫЕ N-(ИНДОЛ-2-КАРБОНИЛ)-ГЛИЦИНАМИДЫ И ИХ ПРОИЗВОДНЫЕ, СПОСОБЫ ЛЕЧЕНИЯ И ФАРМКОМПОЗИЦИЯ | 1996 |
|
RU2143424C1 |
| Домовый номерной фонарь, служащий одновременно для указания названия улицы и номера дома и для освещения прилежащего участка улицы | 1917 |
|
SU93A1 |
| Разборный с внутренней печью кипятильник | 1922 |
|
SU9A1 |
| СПОСОБ ВЫРАЩИВАНИЯ МИКРООРГАНИЗМОВ | 0 |
|
SU186367A1 |
| Р.С.UNANGST ET AL | |||
| Novel Indolecarboxamidotetrazoles as Potential Antiallergy Agents | |||
| J.Med | |||
| Chem., 1989, vol.32, №6, pp.1360-1366. | |||
Авторы
Даты
2007-05-27—Публикация
2002-11-08—Подача