Область техники, к которой относится изобретение
Изобретение относится к противомикробным средствам или устройствам, которые контактируют с микроорганизмами и/или которые желательно содержать свободными от аккумулирования и/или адгезии микроорганизмов. Субстрат или поверхность устройства проявляет противомикробное средство изобретения.
Уровень техники
В различных ситуациях и применениях, например при медицинском обслуживании, пищевой обработке и хранении пищи, важно, чтобы устройства и продукты, которые используют, были свободными от роста или пролиферации микроорганизмов. Не в меньшей степени это чрезвычайно важно по отношению к медицинским устройствам, которые вводятся в контакт с пациентами в госпитале, так как зараженные устройства могут участвовать в распространении заболевания и микроорганизмов, что может серьезно повлиять на здоровье многих пациентов.
Например, было бы очень полезно, если бы устройства и продукты, которые контактируют с потенциально вредными микроорганизмами, обладали способностью ингибировать или уничтожать бактерии и/или другие микроорганизмы, такие как вирусы и грибки, чтобы препятствовать распространению заболеваний.
Задача состоит в предотвращении начальной колонизации, которая впоследствии может создать биопленку. Начальная фаза колонизации может быть подавлена либо ингибированием, либо уничтожением микроорганизмов.
Известно, что для получения такой защиты поверхность в устройстве снабжают ионами металлов, такими как ионы элементов Ag и Ni. Часто Ag используют в виде сплава для высвобождения Ag+-ионов с подходящей скоростью в окружающую среду, таким путем предотвращают аккумулирование микроорганизмов.
Однако одной из проблем данного решения является адгезия металла или сплава на рассматриваемой поверхности. Кроме того, противомикробное действие нелегко контролируется, и дополнительно поверхность, покрытая ионами металла, может проявлять цитотоксические эффекты.
US-А-6475434 раскрывает проникающую через биопленку композицию для удаления биопленок, образованных и состоящих из инфекционных микроорганизмов, а также для покрытия медицинских устройств с целью предотвращения образования таких биопленок. Композиция содержит цистеин и их аналоги или производные, предназначенные для выбора в качестве одного из компонентов. Роль цистеина или компонента, родственного цистеину, не ясна, и особенно для применений для покрытий они используются в комбинации с известными противомикробными средствами, такими как рифамицины, тетрациклины и пенициллины. То есть, как показано в примерах 2 и 3 в US-А-6475434, единственный цистеиновый испытанный компонент (который представляет собой N-ацетилцистеин) не проявляет эффекта, если не объединен с испытанными антибиотиками. Кроме того, для биопленочной защиты все компоненты наносят пропиткой устройства или смешиванием с материалом устройства в процессе производства. Компоненты затем становятся физически связанными адгезией и проникновением в материал устройства, что означает, что их функция в большой степени имеет место при их высвобождении в окружающую среду. Особенно при применении в медицине такие концепции требуют точного контроля баланса между противомикробным, цитотоксическим и иммуногенным эффектами. Так как диффузия является зависимой от времени и температуры, то хранение и долговечность устройств с покрытием также становятся проблемами для серьезного рассмотрения.
Авторами Olofsson et al. (Applied and Environmental Microbiology, August 2003; 69(8), 4814-4822) описано, что N-ацетилцистеин может влиять на бактериальный рост в растворе. Другие эффекты N-ацетилцистеина состояли в уменьшении адгезии бактерий многих видов на поверхностях нержавеющей стали или облегчении прикрепления биопленки на поверхностях нержавеющей стали.
Главная цель данного изобретения состоит в обеспечении противомикробного средства, обладающего способностью предотвращать или, по меньшей мере, значительно уменьшать аккумулирование и/или адгезию индивидуальных микроорганизмов на поверхности устройства стабильным и долговременным способом.
Данная цель осуществляется согласно первому аспекту изобретения, относящемуся к противомикробному средству, содержащему субстрат с ковалентно связанным цистеиновым соединением.
В частности, изобретение относится к противомикробному средству, в котором цистеиновое соединение присоединено при помощи S-S мостика через спейсерную молекулу с субстратом. Спейсер содержит углеродную цепь, необязательно прерванную одним или несколькими гетероатомами, например, O, S, N, P или Si, и цепь необязательно замещена одной или несколькими алкильными группами, предпочтительно низшими алкильными группами с 1-6 атомами углерода, гидроксильными группами или алкоксигруппами. В примерах, представленных ниже, цистеиновое соединение присоединено в терминальном положении спейсера при помощи S-S мостика, что представляет собой предпочтительный вариант осуществления изобретения. Однако возможны также другие положения в спейсерной цепи, поскольку цистеиновая функция подвержена действию окружающей среды.
Согласно предпочтительному варианту осуществления изобретения цистеинсодержащий лиганд, присоединенный к субстрату, имеет общую формулу:
(1) R1-X-L-S-S-(цистеиновый компонент)
в которой
- R1 представляет собой растворимый или нерастворимый субстрат; например твердую поверхность или растворимую органическую молекулу или полимер;
- X представляет собой связывающую группу от реакции конденсации между субстратом и L;
- L представляет собой спейсерную молекулу, выбранную из группы, содержащей (СН2)m, где m равно 1-20, предпочтительно 1-12, 1-8 или 1-6; (СН2СН2О)n(СН2)р или (СН(СН3)СН2О)n(СН2)р, где n равно 1-1000, предпочтительно 1-100 или 3-50, и р равно 1-20, предпочтительно 1-12, 1-10 или 1-6. Сегмент (СН2)р присоединен к дисульфидному мостику, но может необязательно также находиться между сегментами (СН2СН2О)n и/или (СН(СН3)СН2О)n в блок-сополимере;
- цистеиновый компонент в данном описании относится к остатку цистеинового соединения, включающего цистеин, аналог цистеина или цистеиновое производное, обеспечивающее противомикробную активность, которая по существу одинакова или имеет сравнимый уровень с активностью, сопоставимой с цистеином. Отмечено, что вариант осуществления изобретения, где цистеиновое соединение присоединено при помощи S-S мостика, содержащего одну S из тиольной группы цистеина и одну S из спейсерной молекулы, имеет особое значение, по меньшей мере, в некоторых применениях из-за его исключительной противомикробной активности.
Таким образом, предлагается противомикробное средство, которое ковалентно присоединено к поверхности устройства и которое вследствие исключительно полезных эффектов ковалентно связанного цистеина проявляет высокое и длительное воздействие, смотрите примеры, представленные ниже, на индивидуальные микроорганизмы, и тем самым предотвращает или по существу ингибирует адгезию и аккумулирование индивидуальных микроорганизмов. Таким образом, данное изобретение представляет огромный потенциал для всех применений, где желательно, если поверхность или субстрат будут проявлять противомикробные/антибактериальные свойства. Дополнительное и существенное преимущество изобретения, как показано заявителями, состоит в том, что средство изобретения показывает отсутствие цитотоксических эффектов, что делает его полезным во многих различных применениях.
В одном из аспектов данного изобретения различные устройства, которые желательно содержать свободными от аккумулирования и/или адгезии микроорганизмов, покрывают полностью или частично противомикробным средством согласно изобретению.
В дополнительном аспекте данное изобретение относится к применению противомикробного средства изобретения для предотвращения роста и/или пролиферации микроорганизмов на субстрате и/или поверхности устройства.
В противоположность US-A-6475434 в данном изобретении предлагается способ, чтобы получить цистеин или родственный цистеину компонент, ковалентно присоединенный к субстрату. Основное применение изобретения состоит в обеспечении противомикробного покрытия на твердом устройстве. По данной концепции противомикробные средства перманентно прикреплены к поверхности и противомикробный эффект имеет место при поверхностном контакте, а не от реакции с высвобождаемыми средствами, что будет в большой степени снижать риск вредных воздействий в биологической окружающей среде. Это представляет собой главное отличие по сравнению с ранее известными способами в данной области в тех случаях, когда цистеин предложен в качестве такого высвобождаемого средства. Кроме того, ковалентным присоединением поверхность может быть сделана более специфической через концентрацию поверхности и химическую структуру. Таким образом, не только поверхностно связанный цистеин или цистеиновый родственный компонент сам по себе, но, по меньшей мере, в некоторых применениях также и дисульфидная связь, с помощью которой он прикреплен к поверхности, представляет собой одну из изобретенных особенностей данной концепции относительно противомикробного эффекта. Кроме того, ковалентное присоединение обеспечивает поверхность, которая в месте нахождения, а также при хранении является исключительной по консистенции и долговечности по сравнению с поверхностями, где диффузия и утечка активных средств представляют собой главную проблему.
“Противомикробное средство” включает субстрат, который модифицирован для проявления ковалентно связанного цистеинового компонента и оказывает влияние на предупреждение или, по меньшей мере, значительно на предотвращение аккумулирования и/или пролиферации, по меньшей мере, одного специфического микроорганизма. Данный эффект можно наблюдать, например, в способах, известных в данной области, например способах, использованных в разделе, где описаны примеры настоящего описания.
“Цистеиновый компонент” включает остаток цистеина, цистеиновый аналог или цистеиновое производное с наличием противомикробного эффекта, например гомоцистеин или N-замещенные цистеины, такие как N-ацетил-L-цистеин и N-алкилированные цистеины.
“Субстрат” (R1) включает любое изделие, устройство, молекулу или полимер, растворимый или нерастворимый, который может быть функционализирован для создания противомикробных свойств связыванием цистеинового компонента. Особый интерес представляют собой твердые изделия, подобные медицинским устройствам, которые предназначены для использования внутри или в контакте с телом человека или животного, особенно с чувствительными тканями и жидкостями организма. Данный перечень потенциальных применений является огромным, смотрите ниже, и включает имплантаты, трубчатые дренажные катетеры и так далее, предназначенные для использования, например, в экстракорпоральных применениях, дренаж (например, ухо или гидроцефалия), диализ, контактные линзы, внутриглазные линзы, искусственные кожи, аппараты для диализа, аппараты искусственного кровообращения, сшивающие материалы, устройства для лечения ран, стоматологические продукты, парентеральное введение, доставку лекарственного средства, стенты, насосы (например, для инсулина), слуховые аппараты, шприцы, пейсмекеры и так далее.
“Предотвращение” или “ингибирование” включает способность остановить или значительно снизить рост, и/или пролиферацию, и/или аккумулирование и/или значительно уменьшить жизнеспособность микроорганизмов в месте, где присутствует средство изобретения.
Главный потенциал данного изобретения состоит в создании возможности для обеспечения противомикробной поверхности на твердом устройстве, которое потенциально контактирует с микроорганизмами и которое желательно поддерживать свободным от аккумулирования и/или пролиферации микроорганизмов и/или от осуществления роли резервуара для жизнеспособных микроорганизмов. Большое число устройств, предназначенных для применения в медицине, а также при обработке пищи, где присутствие микроорганизмов может быть более или менее опасным, иллюстрирует потенциал данного изобретения. Для того чтобы сделать это возможным, заявители успешно использовали субстанцию цистеина, который, как показали авторы, проявляет неожиданно сильный противомикробный эффект, когда ковалентно связан, как описано и заявлено в данном описании. Противомикробные эффекты также показаны для аналогов цистеина и производных, таких как N-ацетилцистеин и гомоцистеин.
Полимеры или олигомеры этиленоксида и пропиленоксида, например полиэтиленоксид или полиэтиленгликоль, легко растворимы в воде, и, кроме того, полиэтиленоксид имеет протеин-отталкивающие свойства, которые могут добавляться к бактерицидной функции данного изобретения, особенно при применении в связи с поверхностями. В зависимости от цистеинового компонента следующие структуры представляют собой примеры подходящих лигандов, предназначенных для применения:
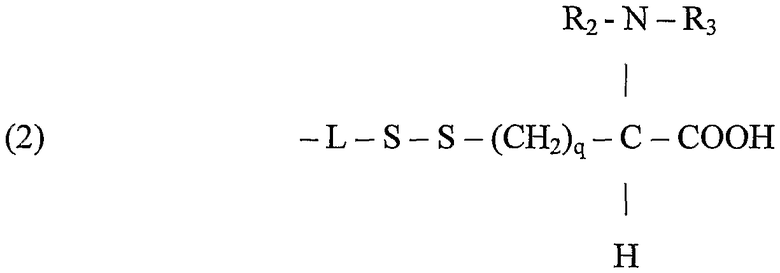
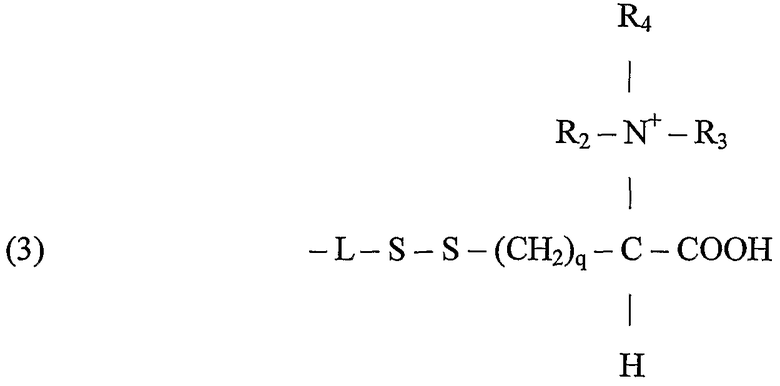
В формуле (2) заместители R2, R3 могут представлять собой водород или алкил с 1 до 20, предпочтительно от 1 до 12, более предпочтительно от 1 до 6 атомами углерода в любой комбинации в R2 и R3 и q может также изменяться, как m и р для метиленовых составляющих сегмента L, как описано ранее, например, от 1 до 20, предпочтительно от 1 до 12, более предпочтительно от 1 до 6. Когда q = 1 и R2 = R3 = H, цистеиновый компонент становится остатком цистеина, который подобно цистеиновым гомологам и производным связывается при помощи тиольной группы, которая вносит одну серу в дисульфидную связь. В дополнение к прямому алкилированию цистеиновой аминогруппы R2 и R3 алкилы могут быть присоединены через амидную связь, включающую азот цистеинового компонента, например, когда R2 означает водород и R3 означает метил, цистеиновый компонент становится ацетилцистеином.
В формуле (3) R2, R3, R4 представляют собой алкильные заместители, которые дают положительно заряженную четвертичную аминогруппу. В данном случае число атомов углерода в алкильных цепях R2, R3, R4 заместителей может изменяться от 1 до 25, предпочтительно от 1 до 18 в любой комбинации. Кроме того, q может также изменяться, как m и р для метиленовых составляющих L сегмента, как описано ранее, например, от 1 до 20, предпочтительно от 1 до 12, более предпочтительно от 1 до 6.
В зависимости от рН заряженные ионные группы могут также встречаться как протонированные аминогруппы в (2) и карбоксилатные группы в (2) и (3).
Связывание -Х- между субстратом R1 и лигандом получают химическими реакциями между функциональными группами R1 и перспективным лигандом. Если R1 имеет химическую функциональную группу Y и лиганд функциональную группу Z, что при взаимодействии дает Х, то принципиальная реакция связывания, где опущены побочные продукты, может быть записана как:
(4) R1-Y + Z-L-S-S-(цистеиновый компонент) →
→ R1-X-L-S-S-(цистеиновый компонент)
В зависимости от выбора Y и Z и условий реакции полученная группа Х может представлять собой амид, вторичный амин, сложный эфир, простой эфир, гидразин, уретан, мочевину, карбонат и др. Доступно большое число специфических и эффективных реакций, которые хорошо разработаны в органической химии. Группы Y, Z и X, а также и реакции, представленные в настоящем описании, поэтому являются примерами и при этом не ограничивают изобретение.
Группы Y и Z в примерах от (а) до (р) можно обменивать между собой у R1 и лиганда, получая то же самое связующее звено Х, но с обратным расположением элементов между R1 и лигандом. Например, когда функциональные группы в (а) обменивают до Y = NH2 и Z = СООН, связующее звено Х имеет вид НNOC. В примерах (е) и (f) первоначально полученный имин, обычно известный, как основание Шиффа, восстанавливают до связующего звена в виде вторичного амина с помощью NaCNBH3. Часто используют промежуточные стадии для повышения селективности и выхода. Хорошо известные примеры представляют собой активацию карбоксильной группы (Y) в (а) с карбодиимидом и/или N-гидроксисукцинилимидом перед образованием амида с аминогруппой (Z). Аминогруппы могут быть активированы с дисукцинимидилкарбонатом для образования мочевинного связующего звена с другой аминогруппой.
В дополнение к карбоксильным и аминогруппам также применимы гидроксильные группы в большом ряду реакций конденсации:
- последующая дериватизация в карбонаты с получением группы Z в (h), где φ означает бензольное кольцо, или в трезилатные группы, как в (m) и (n);
- последующая активация гидроксильных групп в тозил- или сукцинимидилкарбонатные группы или обработка с Вr2 или CNBr для реакций конденсации с нуклеофилами, подобными аминам и/или тиолам;
- две гидроксильные группы могут быть связаны вместе с фосгеном для образования карбонатного связующего звена.
Исчерпывающие обзоры по химии связывания с помощью реакций, упоминаемых в данном описании, а также дополнительные реакции конденсации имеются в литературе (Ref. Herman S. et al. J. Bioact. Compat. Pol. 1995, 10, 145-187).
В примере (s) в таблице 1, R1• означает твердый субстрат со свободными радикалами, доступными для взаимодействия с ненасыщенными группами, проиллюстрированными, но без ограничения только ими, этиленовыми, акриловыми или метакриловыми двойными связями. Применением мономеров, которые имеют лиганд -L-S-S-(цистеиновый компонент), прикрепленный к реакционноспособным углерод-углеродным связям, могут быть получены олигомерные или полимерные цепи, которые ковалентно связаны с субстратом и которые содержат лиганд в виде боковых групп. Концентрацию данных боковых групп в олигомерных или полимерных цепях можно контролировать сополимеризацией с подходящими мономерами, представленными, но без ограничения только ими, акриловой и метакриловой кислотами или сложными эфирами или акриламидом. Другой путь предполагает применение мономеров, подобных малеиновой кислоте, малеиновому ангидриду, тиглиновой кислоте или аллиламину, которые легко связываются с поверхностью, снабженной свободными радикалами, но сильно снижают развитие цепи. Функциональные группы, предоставляемые данными мономерами, то есть ангидридные, карбоксильные или аминные, поэтому станут ограниченными очень тонким поверхностным слоем на субстрате. По данному способу каждое связывание лиганда будет происходить в основном за счет терминального прикрепления прямо к функциональным группам на поверхности, таким образом обеспечивается другая структура по сравнению с той, которая получается, когда лиганд участвует в графт-полимеризации.
Реакция конденсации с R1-Y может проходить согласно уравнению (4) при условии, что группа Y селективно взаимодействует с группой Z лиганда, а не с амино или карбоксильной группами в цистеиновом компоненте.
В случаях, где группа Y не может взаимодействовать исключительно с группой Z лиганда, представленного формулой:
(5) Z-L-S-S-(цистеиновый компонент),
но также с амино и/или карбоксильной группой цистеинового компонента, данные группы, если требуется, могут быть защищены замещением или этерификацией, соответственно. Аминогруппа может быть защищена заместителями, проиллюстрированными третичным бутилоксикарбонилом (трет-BuO). Это необходимо только в случае, когда аминогруппа не алкилирована до третичных или четвертичных аминов, как показано в уравнениях (2) и (3). Карбоксильная группа цистеинового компонента может быть защищена метилированием. После реакции конденсации между R1-Y и Z-лигандом для получения Х связанного лиганда по уравнению (4) трет-BuO и сложноэфирные метильные группы могут быть удалены кислотным и щелочным гидролизом, соответственно, и, таким образом, регенерируется начальная структура Z-лиганда. При наличии данных выборов Z-лиганд, определенный в уравнениях (2)-(4) и формулой (5) и к тому же доступный, с различными функциональностями Z представляет собой отдельный продукт данного изобретения, предназначенный для применения в качестве сборного компонента для одноступенчатого модифицирования функционализированных поверхностей. Данный аспект изобретения также охватывает пример, описанный ранее, где функциональность Y субстрата является свободнорадикальной и функциональность Z лиганда представляет собой ненасыщенную реакционноспособную углерод-углеродную связь.
Когда функциональная группа Y присоединена к твердому субстрату, лиганд может быть синтезирован в месте нахождения на поверхности субстрата. Это является преимуществом, заключающимся в том, что нереагирующие группы Y, а также побочные продукты устраняются на промежуточных стадиях.
По данной процедуре первая стадия будет представлять взаимодействие R1-Y поверхности с соединением, имеющим общее строение
(6) Z-L-S-S-R5,
где L имеет то же определение, что и раньше, и где заместитель R5 легко замещается при взаимодействии с тиолами, образуя новую дисульфидную связь с тиольным соединением.
Первая стадия конденсации может быть выражена в виде:
(7) R1-Y + Z-L-S-S-R5 →
→ R1-X-L-S-S-R5
и следующая стадия:
(8) R1-X-L-S-S-R5 + HS-цистеиновый компонент →
→ R1-X-L-S-S-цистеиновый компонент (+ R5HS)
Обычный пример R5 представляет собой пиридинил, но также применяют дансил. В альтернативном случае дисульфидная связь в (6) может относиться к тиосульфатной группе, которая будет также давать дисульфидный мостик при взаимодействии с тиолом.
Кроме того, имеется альтернативный способ получения по существу такой же химической структуры, как и ранее, и который также находится в объеме данного изобретения. В данном случае тиольный сегмент или группа -L-SH присоединяется к R1 через связывающую группу Х и где L и Х определены, как и ранее, и -SH представляет собой терминальную тиольную группу. Данный продукт может взаимодействовать исключительно с тиольной группой цистеинового компонента в присутствии окислителей с образованием дисульфидного связующего звена с цистеиновым компонентом:
(9) R1-X-L-SН + HS-(цистеиновый компонент) →
→ R1-X-L-S-S-(цистеиновый компонент)
+ (Н2 или водородсодержащий побочный продукт)
Когда цистеиновый компонент окончательно связывается согласно формуле (9), получается противомикробный лиганд, который ковалентно присоединен к R1, как схематически показано в формуле (9).
Функционализация поверхности полимерных материалов, таких как пластмассы, каучук, целлюлозы и т.д., может быть достигнута привитой сополимеризацией или адсорбцией соединений, несущих функциональные группы, такие как, например, карбоксильные или аминные. Осуществление привитой сополимеризации, которое дает ковалентную связь к субстрату, требует функционализацию поверхности. Соединения, которые могут взаимодействовать со свободными радикалами, подвержены привитой сополимеризации в течение или после активации УФ, электронным потоком или гамма-излучением или газовой плазмой. В данных способах свободные радикалы могут появиться в полимерных субстратах, которые могут инициировать привитую сополимеризацию на таких субстратах. Данные способы модифицирования для твердых полимерных субстратов представлены примером (q) в таблице 1. В данном процессе привитая сополимеризация обычно включает развитие цепи из поверхности субстрата, известная как графт-полимеризация.
Мономеры, которые часто используют в свободнорадикальной графт-полимеризации, представляют собой акриловые соединения, такие как акриловая кислота, метакриловая кислота и их сложные эфиры или акриламид, а также винилпирролидон. Графт-полимеризацией таких мономеров, содержащих функциональные группы, например карбоксил, амино, галогены и т.д., твердая поверхность может быть снабжена ковалентно связанными функциональными группами для ковалентного прикрепления противомикробного лиганда. Специальное применение графт-полимеризации, также охваченное данным изобретением, было описано ранее, где противомикробный лиганд, представленный в формуле (6), можно подвергнуть графт-полимеризации, когда Z представляет собой свободнорадикальную реакционноспособную группу, содержащую реакционноспособные ненасыщенные углерод-углеродные связи. Это дало бы противомикробные лиганды в качестве боковых групп в графт-полимеризованных цепях, концентрацию и расположение которых можно контролировать графт-полимеризацией с подходящими виниловыми и акриловыми мономерами. Однако, как также ранее было описано, противомикробный лиганд может быть терминально прикреплен прямо к субстрату. В данном случае функционализацию субстрата делают на первой стадии с помощью мономолекулярной графт-сополимеризации с ненасыщенными соединениями, имеющими незначительный рост цепи, такими как малеиновый ангидрид, малеиновая кислота и трифлиновая кислота или самообрывающийся мономер, подобный аллиламину. С помощью данной процедуры функциональные группы могут появиться на поверхности для непосредственного терминального прикрепления противомикробного лиганда химическим связыванием. Также в случаях, когда виниловый или акриловый лиганд в формуле (6) не будет полимеризоваться, например, по пространственным причинам, он должен прикрепиться непосредственно терминальной реакцией со свободными радикалами на субстрате.
В случаях, где субстрат как таковой представляет собой способный гидролизоваться полимерный материал, такой как сложный полиэфир (РЕТ), полиамид (Nylon™, Nomex™, Kevlar™) или полиакрилат (РММА), функционализация поверхности может быть получена гидролизом в растворе основания или кислоты. Сложные полиэфиры должны дать карбоксильные и гидроксильные группы и полиамиды - карбоксильные и аминные группы, которые можно использовать в последующих модификациях с применением конденсации или адсорбции.
Металлические субстраты, подобные нержавеющей стали, могут представлять собой поверхность, функционализированную карбоксильными группами излучением или плазменной обработкой. Медицинские изделия, подобные стентам, карбоксилируются под действием газовой плазмы силана и акриловой кислоты. Золотые и серебряные поверхности можно подвергать привитой сополимеризации использованием их реакционной способности по отношению к тиольным и дисульфидным соединениям, которые должны также нести другие группы, подобные карбоксилу или амину. Также для металлических субстратов свободнорадикальную графт-сополимеризацию поверхностей можно осуществлять катодной поляризацией субстратов, проводящих электрический ток, в течение воздействия мономеров, способных к образованию ковалентных связей при реакции со свободными радикалами. Поверхностная графт-полимеризация является аналогичной графт-сополимеризации для твердых полимерных субстратов, исходя из инициирования, развития и мономеров, и также представлена примером (s) в таблице 1.
Когда поверхностное модифицирование полимерных субстратов проводят через адсорбцию, грунтование субстрата часто проводят химическим окислением, обработкой в коронном разряде или окислительной газовой плазмой для получения гидрофильных и ионных групп в поверхностном слое. Один из примеров представляет собой адсорбцию полиэтиленимина на полимерных субстратах, которые окислены перманганатом или персульфатом. Полученные аминоповерхности можно использовать для химических реакций связывания, а также адсорбции отрицательно заряженных полимеров, таких как полиакриловая кислота, декстрансульфат или гепарин при подходящем рН. Часто такие полиэлектролиты в их ионнозаряженных состояниях адсорбируются в чередующие слои со свойствами, представляющими интерес в наиболее удаленном от центра слое. В основном, карбоксилирование металлических поверхностей часто осуществляют адсорбцией полиакриловой или полиметакриловой кислоты. Как описано выше, они затем могут быть аминированы химическим связыванием или ионной адсорбцией, например, полиэтиленимина или полиаллиламина.
Другой способ для получения адсорбции, который не требует никакой начальной функционализации субстрата, представляет собой применение блок-сополимеров, содержащих как гидрофобные, так и гидрофильные блоки, или сегменты, которые будут селективно адсорбировать и функционализировать поверхность субстрата. Такие типичные блок-сополимеры представляют собой полиэтиленгликоль-полипропилен (Pluronic) и полиакрилаты-полистирол, полиакрилаты-полиэтилен, полибутадиены-полистирол и другие, которые могут также содержать амино или карбоксильные функциональные группы.
По определению противомикробный лиганд -L-S-S-(цистеиновый компонент) данного изобретения всегда ковалентно связан с субстратом R1.
Однако, так как определение R1 включает органические и полимерные соединения, R1 будет также охватывать полимеры, которые впоследствии способны к связыванию с твердым субстратом за счет ковалентного связывания или адсорбции.
Варианты ковалентного связывания бактерицидного средства данного изобретения на твердом субстрате особо выделены определением R1, включающим такое прикрепление противомикробного средства к твердому субстрату адсорбцией. В данном случае R1 является растворимым субстратом, представленным, например, способными к ионизации полимерами, такими как полиэтиленимин или полиакриловая кислота или блок-сополимеры с гидрофобными/гидрофильными блоками, такие как полиэтиленгликоль-полипропиленгликоль или полиакрилаты в блок-сополимерах с полистиролом, полиэтиленом и др. Цистеиновый компонент ковалентно связан с растворимым субстратом, который на последующей стадии иммобилизуется на твердом субстрате, как описано в данном описании.
Таким образом, модифицирование порверхности, а также последующее химическое связывание или адсорбцию, применяемые для прикрепления бактерицидных средств, можно выполнять многими различными способами. Кроме того, субстраты могут представлять собой органические и неорганические материалы, содержащие синтетические или природные полимеры, а также металлы и минералы. Поэтому способы, химические реакции и субстраты, которые присутствуют здесь и в примерах ниже, являются только описательными и неограничительными для получения бактерицидных средств и поверхностей, охваченных данным изобретением.
Поверхностная концентрация средства изобретения, такого как L-цистеин, находится в интервале от 10-11 до 10-4 моль/см2 и предпочтительно в интервале от 10-9 до 10-5 моль/см2.
Для получения ингибирования клинически или технически важных микроорганизмов 100-кратное ингибирование предпочтительно достигают согласно изобретению на клейких жизнеспособных бактериях, которые можно выделять количественно, причем начинают с большой экспозиции (титр 400 cfu/мл в исходной культуре). Это может частично зависеть от специфического организма и степени/титра экспозиции. Тестируемые условия крайне разнообразны, которые следует ожидать в действительной клинической ситуации.
Примеры микроорганизмов, по которым изобретение может быть применено для предотвращения их роста и/или пролиферации, представляют собой анаэробные и аэробные бактерии, которые включают как различные грамположительные бактерии, выбранные, но без ограничения только ими, из различных видов Staphylococci, таких как S. aureus, S. epidermides и другие коагулаза-негативные стафилококки, S. saphrophyticus, Enterococcus spp, Nesseriae (менингококки, гонококки), Streptococci (зеленящие, гемолитические и негемолитические, группа В и D, S. pneumoniae), Chlostridia (perfringens, botulinum), Bacillus megaterium, а также и различные грамотрицательные виды, выбранные, но без ограничения только ими, из различных Enterobacter spp, Escherichia coli, Klebsiella spp, Proteus, Campylobacter, Yersinia, Shigella, Salmonella, Hemophilus (influenza), Bacteriodes (fragilis, bivius), Pseudomonas (aeruginosa, cepacia), Legionella (pneumophilia). Также включенными являются микоплазма-виды и кандида-виды и различные грибки. Предпочтительные примеры бактерий представляют собой грамположительную бактерию Staphylococcus aureus, грамотрицательную бактерию Escherichia coli или грамположительную бактерию Bacillus megaterium.
Данное изобретение можно применять для предотвращения или ингибирования роста микроорганизмов на поверхностях различных аппликаций, которые могут создать проблему вследствие образования колонии или инфекции. В данном описании показано, что оно является эффективным как против грамположительных, так и грамотрицательных бактерий (грамотрицательная бактерия Escherichia coli или грамположительная бактерия Staphylococcus aureus и Bacillus megaterium). Несколько различных организмов описаны в связи с образованием колоний на катетере и инфекцией в медико-санитарном секторе и окружающей среде больницы. Данные микроорганизмы включают, но без ограничения только ими, грамположительные бактерии и грамотрицательные бактерии, перечисленные ниже. Также частую задачу представляют собой различные грибки, особенно у иммунокомпромиссных пациентов (подвергающихся трансплантации или другой иммуноподавляющей терапии и т.д.). Изобретение может быть применено там, где инфекция, образование колонии или биопленки на искусственных устройствах (катетеры, трахеостомические трубки и т.д.) может быть проблемой при медицинском обслуживании. Примеры известных и описанных микроорганизмов, переносимых катетером, и против которых может быть использовано изобретение, представляют собой (но без ограничения только ими): Staphylococci spp (такие как S. aureus, S. epidermides и другие коагулазанегативные стафилококки, такие как S. saphrophyticus); Streptococci spp (зеленящие, гемолитические и негемолитические, группа В и D, S. pneumoniae); Enterococcus spp, S. facealis; Chlostridia (perfringens, botulinum); различные Enterobacter spp, такие как Escherichia coli, Klebsiella spp (pneumonia), Enterobacter cloace, аэрогены, Proteus (mirabilis), Campylobacter, Yersinia, Shigella, Salmonella, Hemophilus (influenza), Neisseriae (meningococcus и gonococcus), Bacteroides (Bacteroides spp и фузобактерия), Pseudomonas (aeruginosa, cepacia), Legionella (pneumophilia), Serratia marcenens, Acinetobacter spp, Morganella morganii, Stenotrophomonas, Citrobacter spp, Corynebacterium spp, Burkholder cepafia, Acinetobacter spp; различные микоплазма-виды (М. avian и другие); и также грибки, такие как Candida spp, C. tropicales, C. parapsilosis, Cryptococcus neoformans, Aspergillus fumigatus, Tricosporun, Blastoschizomyces, Stenotrophomonas maltophilia, Malassezia, Bukholderia cepafia, Aspergillus.
При многих применениях данного изобретения субстрат представляет собой часть устройства, аппарата и/или поверхности, выбранных из (а) медицинских устройств, таких как экстракорпоральные медицинские устройства, которые применимы на внешней стороне организма человека или животного, или интракорпоральные медицинские устройства, которые применимы внутри организма человека или животного, (b) бакалейно-гастономические устройства и (с) другие устройства. Примеры применений, перечисленных ниже, предназначены только для демонстрации потенциала изобретения, при этом не являются никоим образом ограничивающими.
Медицинские устройства (а) включают применения, выбранные из следующих:
- искусственная кожа или покрытие ожоговых ран;
- диализ (трубки от диализного устройства);
- ушной дренаж (дренаж из полости, раны или абсцесса или во внутренней части уха);
- ушные имплантаты (имплантаты во внутренней части уха);
- устройство для улучшения слуха (помещенное вовнутрь слуховое устройство);
- трубки аппарата искусственного кровообращения (трубки от и к аппарату искусственного кровообращения);
- дренаж при гидроцефалии (дренаж из области мозга/желудочков);
- шприц (шприцы одноразового применения);
- stomis (stomi устройства);
- сшивающие материалы (сшивающие аппараты);
- лечение ран (приспособления для лечения ран, такие как пластырь);
- катетеры (одноразовые или постоянные катетерные устройства, например, центральные венозные катетеры (CVC), периферические венозные катетеры (РVC), периферически вставленные центральные катетеры, мочевые катетеры и перитонеальные катетеры);
- стоматологические продукты (продукты, имплантированные в области рта);
- имплантаты в организме (кости, про-парадонтит (продукты, имплантированные в области рта));
- инсулиновый насос (трубки от и к инсулиновому насосу);
- установки для нервов (управляющие устройства для нервов);
- пейсмекер (пейсмекер и его окружающие устройства);
- послеоперационный дренаж (устройство для дренирования после хирургии);
- дренирование из областей и/или органов и полостей внутри организма человека (абсцесс, нефростомия и подобное);
- интракорпоральные/внутрипросветные стенты (стенты, применяемые для поддержания различных просветов открытыми, например, в сосудистой системе и сосудах, в органах и тканях, в кишечной системе, желчных протоках и др.);
- трубки или оборудование, применяемые для парентерального введения жидкостей, растворов, инфузий, доставки лекарственных средств.
Бакалейно-гастрономические устройства (b) включают применения, выбранные из следующих:
- контактирующие поверхности для сырых продуктов питания или субстраты или устройства, применяемые при обработке продуктов питания (поверхности которых могут контактировать с бактериальными источниками);
- упаковки для лекарственных средств (для поддержания открывания без доступа бактерий) (упаковка для чувствительных лекарственных средств);
- устройства для доения (устройства, предназначенные для бактериальных источников в течение процессов доения);
- устройства для разбрыгзивания (устройства для разбрыгзивания и другие транспортирующие воду устройства, которые могут заселяться микроорганизмами, такие как наконечники, в бакалейно-гастрономических хранилищах);
- вальцовое устройство в области рыбной промышленности (роллеры, применяемые в рыбной промышленности для увеличения производства рыбных продуктов).
Различные устройства (с) включают применения, выбранные из следующих:
- контактные линзы (обычные контактные линзы);
- внутриглазные линзы;
- косметические упаковочные продукты (упаковки для различных косметических продуктов);
- емкости с водой (емкости с водой, которые содержат водопроводную или рециркулирующую воду);
- водопроводные трубы (трубы, которые транспортируют водопроводную или рециркулирующую воду);
- устройства для кондиционирования воздуха, охлаждения воздуха и воды;
- другие устройства для хранения продуктов или материалов, где нежелателен рост бактерий на поверхностях хранящегося материала.
Во всех данных применениях противомикробное средство изобретения связано с поверхностью устройства, как обсуждено выше, для проявления противомикробного эффекта.
В предпочтительном варианте осуществления противомикробное средство связано с поверхностью катетера, тем самым обеспечивается способность катетера предотвращать рост и/или пролиферацию микроорганизмов. Обычно внутреннюю и/или внешнюю поверхность катетера покрывают средством изобретения. Процесс покрытия поверхности катетера может быть дополнительно включен в течение или после экструзии катетера, или как отдельная стадия перед или после сборки определенного катетера. Для образцов обработанных катетеров противомикробный эффект, как показано, сохраняется после нескольких лет хранения в условиях окружающей среды. Катетеры, которые можно использовать с данным изобретением, получены от коммерческих поставщиков катетерных каналов, например Renau, Habia, Vygon, Teknofluor, Optinova, Baxter и др.
В еще одном аспекте изобретение относится к набору составных частей для применения в обработке поверхности противомикробным средством, содержащему, в отдельных отсеках, (а) предшественника противомикробного средства по пункту 1, при этом предшественник имеет формулу:
Z-L-S-S-(цистеиновый компонент),
в которой L, m и цистеиновый компонент принимают значения, определенные выше, и Z имеет функциональность лиганда, как определено выше, который может взаимодействовать с химическим соединением Y, как определено выше, давая химическое соединение Х, определенное выше, и (b) необходимые реагенты для того, чтобы предшественника ковалентно прикрепить к поверхности, где набор дополнительно содержит инструкции для применения набора. Необходимые реагенты могут содержать любые реагенты, которые являются необходимыми для осуществления реакции связывания Y и Z с получением Х (как изображено выше) и должны зависеть от специфической идентичности Y и Z. Специалисту в данной области известно, какие реагенты потребуются в каждой ситуации.
Таким образом, предложен набор, который может применяться для обработки любой желаемой поверхности противомикробным средством изобретения для придания поверхности противомикробных свойств.
Изобретение ниже будет дополнительно проиллюстрировано с помощью примеров. Данные примеры преследуют только иллюстративную цель и не должны рассматриваться как ограничивающие объем изобретения каким-либо способом.
РАЗДЕЛ ПРИМЕРОВ
Методы
Анализ ингибирования бактериального роста на модифицированных поверхностях
Штаммы бактерий
Последующий анализ выполняли с тремя (3) различными штаммами бактерий, но применения не ограничены только ими: клинический изолят (от пациента с сепсисом) грамположительной бактерии Staphylococcus aureus (клинический изолят В5381), грамположительной бактерии Bacillus megaterium (штамм Bm11), грамотрицательной бактерии Escherichia coli (штамм D21). Данный выбор бактерий содержит как грамположительные, так и грамотрицательные бактерии, включающие бактерии, которые клинически представляют собой значительные проблемы.
Приготовление бактериальной культуры для определения титра
Следующее описание направлено, но без ограничения только этим, на определение титра приблизительно 400000-800000 cfu/мл различных бактериальных культур, примененных в качестве источника экспозиции для оценки ингибирования роста бактерий на функциональных поверхностях. Среду LB (бульон Luria Bertani) заражали определенным бактериальным штаммом, но не ограничивались только этой средой. Выбранный штамм высевали на агаровую пластинку с отобранной средой накануне и позволяли ему расти в течение ночи при 37°С. Несколько колоний счищали с пластинки и использовали для заражения среды, которой затем позволяли расти до оптической плотности 0,4. Культуру разбавляли идентичной средой LB до первоначального титра приблизительно в 400000-800000 cfu/мл. Число бактерий определяли серийными разбавлениями посевов и подсчетом колоний в соответствующих разбавлениях. (Целесообразное число бактерий для счета на пластинке составляет между 30-300, как общая справка).
Предварительная обработка дисков
Диски предварительно обрабатывали в отдельных случаях инкубацией в:
a) фосфатном буферном физиологическом растворе (PBS);
b) фетальной телячьей сыворотке (FSC);
c) cтерильной среде LB;
в течение различных периодов времени: 1 час, 1,5 часа, 2,5 часа, в течение ночи, 2 дня или 7 дней, как показано в примерах, представленных ниже. Инкубацию осуществляли вращением (200 об/мин) при 37°С в стерильных пробирках Эппендорфа.
Воздействие на функциональные поверхности различных бактериальных штаммов
Поверхностно-модифицированные субстраты в форме круглых дисков помещали в стерильные пробирки Эппендорфа. Каждый диск (диаметром 5 или 9 мм) помещали в определенный объем (500 или 1000 мкл, соответственно) исходной культуры. Данные пробирки отмечали как “пробирка 1”. Диски в исходных культурах инкубировали в течение 2,5 часа при 37°С вращением (200 об/мин).
Идентичный объем исходной культуры инкубировали параллельно в качестве эталонного образца (отмеченного как “постинкубированная культура”). Его использовали для того, чтобы определить, до каких уровней титр исходной культуры (культура, в которой диски не были инкубированы) должен возрасти, когда не было воздействия дисков. Контрольные образцы (те же диски, которые применены для сравнения уровня ингибирования) инкубировали со стерильной средой LB и затем обрабатывали аналогичным образом, как отрицательный контроль для исключения заражения.
Количественная оценка анализа адгезии жизнеспособных бактерий на функциональных поверхностях
После инкубации (в данном описанном случае: 2,5 часа) диск удаляли из каждой пробирки, используя стерильный пинцет. Культуру, в которой инкубировали диск, параллельно переносили в отдельную стерильную пробирку Эппендорфа и определяли ее титр, как описано. Пинцет и диск окунали в пробирку с примерно 4 мл стерильного раствора PBS, и диск затем бросали во вторую пробирку с PBS, отмеченную как “пробирка 2”. Данную процедуру выполняли для того, чтобы устранить попадание излишка бактериальной суспензии, полученной от бактериальной культуры, в которой инкубировали диск, и, следовательно, удалить любые бактерии, которые не были непосредственно скреплены с поверхностями диска. Промытый диск помещали в пробирку Эппендорфа, отмеченную как “пробирка 3”, с 1 мл PBS и резко встряхивали на вихревом ротаторе в течение 10 минут. Прилипшие жизнеспособные бактерии, которые не были удалены на предыдущих стадиях, теперь отделялись с поверхности в раствор PBS.
Данный раствор отмечают как “промывание 1”, и определяли его титр.
Диск затем удаляют стерильным пинцетом путем окунания в пробирку с примерно 4 мл стерильного PBS, и затем бросают в другую пробирку с примерно 2 мл стерильного PBS, тем же способом, описанным выше. Диск удаляют сразу стерильным пинцетом и переносят в новую пробирку Эппендорфа, в которую добавляют 1 мл стерильного PBS, и повторяют описанную вихревую процедуру.
Раствор PBS переносят в стерильную пробирку Эппенгдорфа, отмечают как “промывание 2”, и определяют его титр.
Диск ненадолго помещали на стерильный “клинекс”- обтирочный материал для удаления излишка капель промывания 2 и затем помещали на стерильную агаровую пластинку со средой LB, которую инкубировали в течение ночи при 37°С. При появлении бактериальных колоний проводили мониторинг бактериального роста, включая кромки диска.
Определение бактериального титра в различных культурах и промывных растворах
Разбавления выполняли в средах LB, и выбранные разбавления (смотрите ниже) в случаях, где были колонии, анализировали и считали.
Объем из 100-мл серийных разбавлений следующих суспензий распространяли для:
1. Исходной культуры перед разбавлением до инкубированной культуры (OD примерно 0,4).
2. Исходной инкубированной культуры (оцененной в 400000-800000 cfu/мл); 1:100, 1:1000 и 1:10000.
3. Постинкубированных культур (как эталона, так и инкубированных с дисками); 1:1000, 1:10000, 1:100000.
4. Негативного контроля (среды без исходной бактериальной культуры).
5. Промывания 1:1:10 и 1:100.
6. Промывания 2:1:1.
Пример 1
Поликапролактон (PCL; UC 787) в виде 1-мм плотных гладких образцов с диаметром 5 мм предварительно облучали импульсным генератором (6,5 MэВ/75 Гц/4 мкс/60 мА) до дозы 1 Мрад. Образцы затем могут быть подвергнуты графт-полимеризации сразу, как описано ниже, или как сохраняемые до графт-полимеризации в жидком азоте.
После облучения, в альтернативном случае после прерванного хранения в жидком азоте, образцы PCL вводят в водный раствор акриловой кислоты (20 масс.%) и 0,1 масс.% соли Мора, термоустойчивой до 30°С. Раствор освобождали от кислорода продувкой инертного газа, который также действует как мешалка. После 2 минут в растворе акриловой кислоты образцы промывали большим количеством водопроводной воды при примерно 30°С и затем хранили в деионизированной воде перед последующим модифицированием поверхности. Ряд образцов, имеющих общую площадь в 5 см2, и эталонных образцов с отсутствием графт-полимеризации держали в течение 6 часов с определенным количеством 0,01 М NaOH при температуре окружающей среды. После потенциометрического титрования определяли поверхностную концентрацию, равную (1,8±0,2)×10-5 моль СООН/см2.
Пример 2
Отдельные растворы 1-(3-диметиламинопропил)-3-этилкарбодиимида (EDC) и N-гидроксисукцинимида (NHS) (Sigma) в деионизированной воде смешивали при 0°С, устанавливая раствор с концентрацией 0,3 М EDC и 0,075 M NHS, соответственно.
Образцы PCL с привитой акриловой кислотой, согласно примеру 1, промывали в буфере HEPES (рН 7,4) и погружали в 20 мл раствора EDC/NHS. После 10 минут встряхивания образцы промывали в деионизированной воде и добавляли с раствором 0,04 М гидрохлорида 2-(2-пиридинилдитио)этиламина (PDEA) в 0,1 М боратный буфер (рН 8,5). После 15 минут перемешивания образцы промывали в деионизированной воде и добавляли с раствором 0,5 М L-цистеина (Sigma) в 0,1 М формиатный буфер (рН 4,3) с 1 М NaCl. После промывания 1 М NaCl и деионизированной водой образцы оставляли сохнуть на воздухе и держали в эксикаторе. Анализ поверхности с помощью ЭСХА (рентгеноэлектронный спектр) (ХРS) выдал значение азота в 6,8 атом.%.
Пример 3
Образцы полиэтилена пониженной плотности (LDPE) предварительно облучали дозой в 2,5 Мрад, согласно примеру 1. После осуществления графт-полимеризации с акриловой кислотой при 50°С в течение 4 минут и всех других идентичных условий примера 1 определяли величину карбоксилирования, равную (2,7±0,2)×10-5 моль СООН/см2. Реакции связывания PDEA и L-цистеина c LDPE, содержащим привитую акриловую кислоту, проводили тем же способом как для PCL в примере 2 и получали величину для азота, равную 6,0 атом.%, согласно анализу поверхности с помощью ЭСХА.
Пример 4
Полиуретановые катетеры (Vygon®), имеющие наружный диаметр 2 мм, разрезали на полоски из 20 мм и предварительно облучали, следуя методике примера 1, до дозы 1 Мрад. Осуществление графт-полимеризации выполняли, следуя методике примера 2.
Пример 5
Связывание на аминофункциональной поверхности будет аналогичным методике примера 2. Различие состоит в том, что аминогруппа внутри PDEA замещается карбоксильной группой с образованием 2-(2-пиридилдитио)этилкарбоновой кислоты (PDEC). При взаимодействии данного соединения с аминогруппами на поверхности карбоксильная группа активируется отдельно с помощью EDC/NHS перед взаимодействием с аминной поверхностью. Последующее связывание с L-цистеином будет затем проходить по методике примера 2.
Пример 6
Эталонные поверхности получали по методике примеров 1 и 2 с разницей в том, что L-цистеин связывали непосредственно с карбоксилированной PCL поверхностью после активации с помощью EDC/NHS через аминогруппу в области цистеина, т.е. стадия связывания с PDEA была исключена, при этом устраняется дисульфидная связь, полученная при связывании с PDEA, как в примере 2.
Пример 7
Эталонные поверхности получали по методике примеров 1-3 с разницей в том, что вместо L-цистеина связывали ацетилцистеин, следуя методике примера 2.
Пример 8
Эталонные поверхности получали по методике примеров 1-3 с разницей в том, что вместо L-цистеина связывали гомоцистеин, следуя методике примера 2.
Пример 9
Ингибирование бактериального роста в культуре грамотрицательной бактерии Echerichia coli (штамм D21) тестировали с PCL дисками в 500 мкл культуральной среды LB по дискам, в сочетании с:
а) L-цистеином, прикрепленным к PCL с привитой акриловой кислотой, по примеру 1 и 2 (обозначены как “цис-диски”);
b) PCL с привитой акриловой кислотой, по примеру 1.
Начальный титр культуры составлял 513000 сfu/мл и постинкубированный титр культуры (эталон, в отсутствие диска) составлял 28000000 сfu/мл.
Культура, инкубированная с цис-дисками, показала 125-кратное ингибирование роста в культуральной среде в течение инкубации, по сравнению с постинкубированной культурой (в отсутствие диска). Ингибирование не было определено в культуре, инкубированной с дисками, содержащими акриловую кислоту, по сравнению с постинкубированной культурой (в отсутствие диска).
При тестировании слипшихся бактерий цис-диски показали 100-кратное ингибирование ряда жизнеспособных бактерий по сравнению с дисками только с акриловой кислотой при анализе прилипаемости жизнеспособных бактерий к дискам.
Бактериальный рост, окружающий кромки дисков, помещенных на агар LB, наблюдали для дисков только с акриловой кислотой, но не для цис-дисков.
Пример 10
Ингибирование бактериального роста в культуре Staphylococcus aureus (В5381, клинический изолят) тестировали с PЕ дисками в 1000 мкл бактериальной культуры. Функциональные поверхности на дисках представляли собой:
a) L-цистеин, связанный с дисками с привитой акриловой кислотой по примеру 3 (предварительно промытые/предварительно инкубированные в течение 1,5 часа в PBS);
b) L-цистеин, связанный с дисками с привитой акриловой кислотой по примеру 3 (предварительно промытые/предварительно инкубированные в течение 2 дней в PBS);
с) L-цистеин, связанный с дисками с привитой акриловой кислотой по примеру 3 (предварительно промытые/предварительно инкубированные в течение 7 дней в PBS);
d) диски с привитой акриловой кислотой по примеру 3.
Начальный титр культуры для инкубации составлял 400000 сfu/мл и постинкубированный титр составлял 10000000 сfu/мл.
Культура, инкубированная цис-дисками, предварительно промытыми 1,5 часа, проявила 25-кратное ингибирование бактериального роста, культура, инкубированная цис-дисками, предварительно промытыми 7 часов, проявила 17-кратное ингибирование бактериального роста.
Цис-диски, предварительно промытые в течение 2 дней и 7 дней, показали приблизительно в 50 раз меньше жизнеспособных бактерий, чем диски с акриловой кислотой при тестировании адгезии бактерий.
Для суммирования, ингибирование, обусловленное цис-связыванием, считают постоянным на протяжении, по меньшей мере, 7 дней.
Пример 11
Ингибирование бактериального роста в культуре грамположительной бактерии Staphylococcus aureus (В5381, клинический изолят) тестировали с полиэтиленовыми (PЕ) дисками в 1000 мкл культуры со средой LB. Функциональные поверхности представляли собой:
a) L-цистеин, связанный с дисками с привитой акриловой кислотой по примеру 3 (обозначены как “цис-диски”);
b) диски с привитой акриловой кислотой по примеру 3 (обозначены как акриловые диски);
с) диски, облученные только электронным потоком по примеру 3 (обозначены как “ЕВ диски”).
Параллельно анализировали два контрольных эксперимента с растворенным L-цистеином в культуре: 50 мкг/мл и 5 мкг/мл.
Исходная культура представляла собой состав, превышающий в 10 раз (более 4 миллионов cfu/мл) состав, описанный в количественной процедуре, который позволяет оценить эффект адгезии жизнеспособных бактерий при экстремальном воздействии на бактерии.
Культура цис-дисков показала в 8 раз меньше роста по сравнению с постинкубированной культурой. ЕВ диски не проявили значительного снижения по сравнению с постинкубированной культурой.
Не оказалось ингибирования для культур с растворенным L-цистеином.
Цис-диски показали в 25-40 раз меньше жизнеспособных прилипших бактерий по сравнению с дисками с акриловой кислотой и в 21-27 раз по сравнению с ЕВ дисками в анализе по адгезии бактерий.
Бактериальный рост, окружающий кромки дисков, наблюдали только для дисков с акриловой кислотой и ЕВ дисков.
Эффект цис-связывания на адгезию бактерий Staph. аureus на дисках, однако, является очевидным и значительным, несмотря на то, что система была подавлена.
Пример 12
Ингибирование бактериального роста в культуре Escherichia coli исследовали с PЕ дисками в 1000 мкл бактериальной культуры со средой LB. Тестируемые поверхности представляли собой:
a) L-цистеин, связанный с дисками с привитой акриловой кислотой по примеру 3 (обозначены как “цис-диски”);
b) N-ацетилцистеин, связанный с дисками с привитой акриловой кислотой по примеру 3 и 7 (обозначены как “ацетил-цис-диски”);
с) диски с привитой акриловой кислотой по примеру 3, обозначенные как “диски с акриловой кислотой”.
Все диски предварительно инкубировали в PBS в течение ночи.
Начальный титр культуры составлял 1000000 сfu/мл и постинкубированный титр культуры (без диска) составлял 50000000 сfu/мл.
Цис-диски показали 45-кратное ингибирование роста в среде культуры по сравнению с постинкубированной культурой (в отсутствие диска) в течение инкубации. Ацетил-цис-диски показали 10-кратное ингибирование в культуральной среде. Никакого ингибирования не определено в культуре с присутствием дисков с акриловой кислотой.
Цис-диски показали в 70 раз меньше жизнеспособных бактерий, чем диски с акриловой кислотой, хотя диски с ацетилцистеином показали в 7 раз меньше жизнеспособных бактерий, чем диски с акриловой кислотой, когда исследовали адгезию бактерий.
Бактериальный рост, окружающий кромки дисков, был определен вокруг всех дисков с акриловой кислотой, частично вокруг ацетил-цис-дисков, в то время как бактерии не наблюдались вокруг цис-дисков.
Пример 13
Ингибирование бактериального роста в культуре Escherichia coli (штамм D21) исследовали с PЕ дисками в 1000 мкл бактериальной культуры по диску, в сочетании с:
a) L-цистеином, прикрепленным к дискам с привитой акриловой кислотой по примеру 3 (обозначены как “цис-диски”);
b) L-цистеином, прикрепленном через аминогруппу к PE дискам с привитой акриловой кислотой по примеру 3 и 6 (обозначены как “аминосвязанные-цис-диски”);
с) диски с привитой акриловой кислотой по примеру 3 (обозначены как “диски с акриловой кислотой”).
Все диски предварительно инкубировали в стерильной cреде LB в течение ночи.
Начальный титр культуры составлял 680000 сfu/мл и послеинкубационный титр культуры (без диска) составлял 32000000 сfu/мл.
Цис-диски показали 26-кратное ингибирование бактериального роста в культуральной среде по сравнению с постинкубированной культурой (в отсутствие диска) в течение инкубации. Ни аминосвязанные цис-диски, ни диски с акриловой кислотой не показали ингибирования в среде культуры.
Цис-диски показали в 100-140 раз меньше жизнеспособных прилипших бактерий, чем диски с акриловой кислотой, хотя аминосвязанные цис-диски не показали уменьшения в количестве жизнеспособных прилипших бактерий по сравнению с дисками с акриловой кислотой, исследованными на адгезию бактерий.
Значительный бактериальный рост, окружающий кромки дисков, проанализированный на агаровых пластинках LB после промывных процедур, был определен для всех аминосвязанных дисков и дисков с акриловой кислотой, но не для цис-дисков.
Пример 14
Ингибирование бактериального роста в культуре Staphylococcus aureus (В5381, клинический изолят) тестировали с PЕ дисками в 1000 мкл бактериальной культуры со средой LB при экстремальных концентрациях бактерий. Функциональные поверхности на дисках представляли собой:
a) L-цистеин, связанный с дисками с привитой акриловой кислотой по примеру 3 (обозначены как “цис-диски”);
b) гомоцистеин, связанный с дисками с привитой акриловой кислотой по примеру 3 (обозначены как “гомоцистеиновые диски”);
b) диски с привитой акриловой кислотой по примеру 3 (обозначены как “диски с акриловой кислотой”).
Начальный титр культуры составлял 4000000 сfu/мл и постинкубационный титр культуры (без диска) составлял 80000000 сfu/мл.
Цис-диски показали 13-кратное ингибирование роста в культуральной среде по сравнению с постинкубированной культурой в отсутствие диска. Гомоцистеиновые диски показали 20-кратное ингибирование в культуральной среде.
Цис-диски показали приблизительно в 4-10 раз меньше жизнеспособных прилипших бактерий по сравнению с дисками с акриловой кислотой, и гомоцистеиновые диски показали в 2-4 раза меньше жизнеспособных бактерий по сравнению с дисками с акриловой кислотой, когда исследовали адгезию жизнеспособных бактерий при экстремальных условиях экспозиции. Был получен определяемый эффект, несмотря на блокирующие условия как для цистеиновых, так и для гомоцистеиновых дисков.
Пример 15
Долговременная продолжительность и устойчивость противомикробного эффекта была тестирована применением катетеров с модифицированной поверхностью, хранившихся в течение 3 лет.
Ингибирование бактериального роста в культуре Escherichia coli D21 тестировали с полиуретановыми катетерами Vygon (пример 4) в 1000 мкл бактериальной культуры со средой LB. Данные модифицированные цистеином образцы катетеров хранились в течение 3 лет в условиях окружающей среды вместе с эталонными поверхностями (облученные с помощью ЕВ и с привитой акриловой кислотой по примеру 4). Перед экспериментом данные катетеры (длина 20 мм) разрезали пополам, получая 2 кусочка длиною 10 мм. Функциональные поверхности на дисках представляли собой:
a) L-цистеин, связанный с катетерами Vygon с привитой акриловой кислотой по примеру 4, обозначены как цис-катетеры (предварительно промытые/предварительно инкубированные в течение 2 часов в PBS);
b) катетеры Vygon, облученные с помощью ЕВ (часть примера 1 и пример 4) (предварительно промытые/предварительно инкубированные в течение 2 часов в PBS).
Начальный титр культуры для инкубации составлял 264000 сfu/мл и постинкубированный титр культуры составлял 52000000 сfu/мл, когда образец катетера отсутствовал.
Культура, инкубированная цис-катетерами (предварительно промытыми 2 часа), показала 34-кратное ингибирование бактериального роста по сравнению с посткультурой без диска.
Культура, инкубированная катетерами Vygon, облученными с помощью ЕВ (предварительно промытыми 2 часа) (контрольные материалы), не показала ингибирования по сравнению с постинкубированной культурой без катетера.
Цис-катетеры показали в 130 раз меньше жизнеспособных бактерий по сравнению с катетерами Vygon, облученными с помощью ЕВ, когда оценивали адгезию бактерий.
Для суммирования, хранение продукта в течение длительного времени не влияет опасно на противобактериальные свойства поверхностной модификации.
Пример 16
Ингибирование бактериального роста в культуре Staphylococcus aureus (B5381, клинический изолят) тестировали поверхностью полиуретанового катетера в 800 мкл бактериальной культуры со средой LB. Диски предварительно промывали в течение 1-5 часов в PBS. Данные катетеры разрезали на кусочки 5×4 мм и предварительно облучали по методике примера 1 до дозы 1 Мрад. Графт-полимеризацию осуществляли по методике примера 2.
Функциональные поверхности на дисках представляли собой:
a) PDEA-связанные образцы с привитой акриловой кислотой готовили, в основном следуя методике примера 1 и 2, со следующими модификациями: время осуществления графт-полимеризации 5 минут и ультразвуковая промывка 15 минут после графт-полимеризации;
b) образцы PDEA, полученные в (а), применяли для связывания L-цистеина, следуя методике примера 2.
Бактерицидный эффект сравнивали у образцов (а) и (b) для исследования возможного значительного влияния компонента PDEA перед связыванием с цистеином.
Начальный титр культуры составлял 800000 сfu/мл и постинкубированный титр культуры (без диска) составлял 19000000 сfu/мл. Не наблюдалась разница в постинкубированном титре между образцами типов (а) и (b). Образцы с цис-акриловой кислотой (b) показали приблизительно в 35 раз меньше жизнеспособных прилипших бактерий по сравнению с PDEA-связанными образцами с акриловой кислотой (а), когда исследовали адгезию жизнеспособных бактерий. Данный эксперимент подтверждает, что цис-компонент является значительным по бактерицидному эффекту.
Пример 17
Ингибирование бактериального роста в культуре Staphylococcus aureus (B5381) тестировали с полиуретановыми (PUR) дисками в 500 мкл бактериальной культуры со средой LB. Данные образцы разрезали на квадратные диски 5×5 мм.
Функциональные поверхности на дисках представляли собой:
(а) PUR образцы облучали с помощью ЕВ до 1 Мрад, подвергали графт-полимеризации с акриловой кислотой в течение 3 минут при 35°С и интенсивно промывали в теплой водопроводной воде и воде MilliQ, включая промывание в ультразвуковой бане в течение 15 минут, затем связывали с PDEA и в конце с L-цистеином, следуя методике примера 1 и 2. Данные образцы обозначали как “PDEA-цис”.
(b) Поверхность готовили следующим образом: PDEA с эквимолярным количеством триэтиламина подвергали взаимодействию с эквимолярным количеством акрилоилхлорида в сухом растворителе. Продукт 2-(2-пиридинилдитио)этилакриламид, обозначенный в данном описании как “PDEAm”, очищали осаждением в диэтиловом эфире, которое повторяли до тех пор, пока не получали неокрашенный чистый фильтрат. Слабо-желтый продукт сушили в вакууме. Раствор, содержащий 2,2 ммоль (0,5 г) PDEAm и 16,1 ммоль (1 г) акриловой кислоты в 5 мл воды MilliQ деаэрировали продувкой аргона в течение 10 минут и термостатировали до 35°С. PUR образцы, облученные ЕВ, (а) вынимали из хранилища с жидким азотом и погружали в раствор, где поток аргона действовал как перемешивающее устройство. Реакцию графт-полимеризации прерывали через 8 минут и образцы тщательно промывали в теплой водопроводной воде и воде MilliQ, включая промывание в ультразвуковой бане в течение 15 минут. L-цистеин связывали, следуя методике примера 1 и 2. Образцы сушили в вакууме. Данные образцы обозначали как “PDEAm-цис”.
Проводили сравнение между PDEA-цис (a) и PDEAm-цис (b). Начальный титр культуры составлял 500000 сfu/мл и постинкубированный титр культуры (без диска) составлял 20000000 сfu/мл.
PDEA-цис (a) показал 45-кратное ингибирование постинкубированного титра по сравнению с культурой без диска.
PDEAm-цис (b) показал 50-кратное ингибирование постинкубированного титра по сравнению с культурой без диска.
PDEA-цис (a) и PDEAm-цис (b) показали равное ингибирование колонии жизнеспособных бактерий, образующих единицы, когда исследовали адгезию жизнеспособных бактерий с применением способа, описанного выше. Для любого из образцов не наблюдалось бактериального роста, окружающего кромки дисков, при анализе на агаровых пластинках LB после промывных процедур.
Пример 18
Ингибирование бактериального роста в культуре грамположительной бактерии Bacillus megaterium (штамм Bm 11) анализировали с PCL диском в 500 мкл бактериальной культуры в среде LB. Функциональные поверхности представляли собой:
а) L-цистеин, связанный с PCL с привитой акриловой кислотой, как в примере 1 и 2 (обозначены как “цис-диски”);
b) PCL с привитой акриловой кислотой, как в примере 1.
Начальный титр культуры составлял 292000 сfu/мл и постинкубированный титр культуры (в отсутствие диска) составлял 9850000 сfu/мл.
Для пробирок с цис-дисками имелось 13,5-кратное ингибирование бактериального роста в культуре, инкубированной дисками, в течение инкубации по сравнению с эталонной постинкубированной культурой (в отсутствие диска). Диски только с акриловой кислотой не показали ингибирования бактериального роста в культуре по сравнению с контролем в отсутствие диска.
Тестирование адгезии жизнеспособных бактерий показало в 10-13 раз меньше жизнеспособных бактерий на цис-дисках по сравнению с дисками с акриловой кислотой.
Бактериальный рост, окружающий кромки дисков, наблюдался только для дисков, связанных с акриловой кислотой, когда диски помещали на LB пластинки после промывных процедур и инкубировали в течение ночи.
Пример 19
Цитотоксичность исследовали инкубацией различных функциональных дисков в мононуклеарных клетках периферической крови (PBMC) от доноров со здоровой кровью.
Тестируемые образцы представляли собой:
a) цис-диски (пример 2);
b) диски с акриловой кислотой (пример 1);
c) диски, облученные пучком электронов (часть примера 1) (обозначены как “ЕВ диски”);
d) контрольные клетки (инкубированные без присутствия любого диска).
Определения выполняли через 24, 48 и 69 часов, соответственно.
Количества погибших клеток составляли от 4% до 7% после 18 часов инкубации в PBMC для всех типов дисков и контролей, что указывает на отсутствие значительной разницы между цис-дисками, дисками с акриловой кислотой, ЕВ дисками или контрольными клетками, инкубированными без присутствия любого диска. Это оказалось безотносительным к тому, были промыты диски в PBS или нет.
Доли погибших клеток составляли от 10% до 15% в непромытых цис-дисках и дисках с акриловой кислотой после 48 часов инкубации. Не было значительной разницы в количестве погибших клеток между промытыми цис-дисками, дисками с акриловой кислотой, ЕВ дисками по сравнению с контрольными клетками без присутствия любого диска (5-6%).
Пролиферацию Т-клеток исследовали стимулированием митогеном фитогемагглютинина (РНА). PBMC выделяли от доноров со здоровой кровью, и клетки стимулировали с помощью РНА (Sigma, St Louise, MO, USA). Культуры подвергали вибрации с 1 мкCi метил-3Н-тимедином (Amersham, LIFE SCIENCE) 2 дня после стимулирования. Клетки собирали на фильтрах, применяя пластинчатое приспособление для сбора (Harvester 996, Tomtec, Hamden, Connecticut, USA) в последующий день, согласно инструкциям разработчика, и регистрировали в автоматическом счетчике (1450 MicroBeta Trilux, WALLAC, Sweden AB). Результаты выражали в виде отсчетов в минуту (cpm). Не оказалось никакой разницы в пролиферации клеток между любыми типами дисков и контролями.
Следующий опыт был проведен для того, чтобы исследовать, подвержена ли отрицательному влиянию способность моноцитов, полученных от РВМС, к дифференцированию в макрофаги под воздействием различных типов дисков.
РВМС от доноров со здоровой кровью помещали на чашки Петри (Primaria, Falcon, Becton Dickinson) в концентрации 10-18×106 клеток/мл в модифицированной среде Iscove с 2 мМ L-глутамина, 100 U/мл пенициллина, 100 мкг/мл стрептомицина (Gibco BRL, Grand Island NY), 10% АВ сыворотки и инкубировали при 37°С в течение ночи. Неприлипшие клетки удаляли на следующий день. Культуры интенсивно промывали, и клетки, обогащенные моноцитами, стимулировали добавлением 24-часового аллосупернатанта. Аллосупернатант готовили следующим образом: РВМС от различных доноров смешивали и инкубировали в течение 24 часов в полной среде Iscove. Затем супернатант собирали, очищали центрифугированием и применяли для стимулирования отдельных культур моноцитов. Через 2-3 дня после стимулирования культуры промывали со средой Iscove и затем выращивали в 60% среде AIM-V, 30% модифицированной среде Iscove и 10% АВ сыворотке с добавлением L-глутамина, пенициллина и стрептомицина (полная среда 60/30). Среду заменяли на свежую полную среду 60/30 каждые 3-4 дня.
Не оказалось значительной разницы между контрольными клетками или клетками, подверженными воздействию дисков различных типов, то есть хорошие и здоровые культуры макрофагов наблюдались во всех чашках Петри.
Пример 20
Цитотоксичность также анализировали измерением гемолитического эффекта дисков различных типов помещением дисков на кровяной агар, либо едва на поверхность, либо проталкиванием дисков в кровяной агар.
Тестируемые образцы представляли собой:
а) непромытые цис-диски (пример 3);
b) цис-диски, предварительно обработанные в среде LB (пример 3);
с) цис-диски, предварительно обработанные в фетальной телячьей сыворотке (FCS) (пример 3);
d) цис-катетеры Vygon (пример 4).
Диаметр лизированных зон измеряли после инкубации при 37°С в течение ночи. Положительный контроль располагался в центре каждой пластинки с кровяным агаром. При оценке диски удаляли и анализировали площадь под и вокруг расположения дисков.
Лизис не могли определить ни на одном из проанализированных дисков различных типов.
Желтое окрашивание определено примерно в 4-5 мм от кромки дисков для варианта с непромытыми цис-дисками. Для предварительно обработанных дисков, либо в среде LB, либо в фетальной телячьей сыворотке (PCS), отмечено очень слабое изменение окрашивания на ближайшей кромке диска.
В заключение, цис-диски не обладают значительным цитотоксическим эффектом на клетки крови человека.
Изобретение относится к противомикробному средству. Противомикробное средство. Способ предотвращения или ингибирования роста и/или пролиферации грамположительных бактерий и/или грамотрицательных бактерий. Субстрат, который входит в контакт с микроорганизмами и/или который желательно должен быть свободным от аккумуляции и/или адгезиии микроорганизмов. Применение противомикробного средства. Набор составных частей для применения в обработке поверхности устройства противомикробным агентом. Способ изготовления противомикробного устройства. Вышеописанное средство обладает эффективным противомикробным действием и может быть применено для покрытия поверхностей и субстратов различных устройств, таких как медицинские устройства и устройства, применяемые для обработки пищевых продуктов, для предотвращения или ингибирования аккумулирования и/или роста и/или пролиферации и/или жизнеспособности микроорганизмов и/или образования биопленки. 6 н. и 7 з.п. ф-лы, 1 табл.
1. Противомикробное средство, содержащее субстрат, где указанный субстрат представляет собой твердую поверхность или полимер, способный связываться с указанной твердой поверхностью ковалентной связью или адсорбцией с ковалентно связанным цистеиновым соединением, где указанное цистеиновое соединение присоединено при помощи S-S мостика через спейсерную молекулу к субстрату; спейсер содержит углеродную цепь, необязательно прерванную одним или несколькими гетероатомами, цепь необязательно замещена одной или несколькими алкильными группами, где указанным цистеиновым соединением является цистеин, аналог цистеина или производное цистеина.
2. Противомикробное средство по п.1, имеющее формулу субстрат-Х-L-S-S-(цистеиновый компонент), в которой
- L представляет собой спейсерную молекулу, выбранную из группы, содержащей (СН2)m, где m равно 1-20, необязательно прерванную одним или несколькими гетероатомами, необязательно замещенную одной или несколькими алкильными группами, (СН2СН2О)n(CH2)р или (СН(СН3)CH2O)n(СН2)р, где n равно 1-1000, и р равно 1-20; при этом сегмент (CH2)р присоединен к дисульфидному мостику и может быть необязательно расположен между сегментами (CH2CH2O)n или (СН(СН3)CH2O);
-X представляет собой связывающую группу от реакции конденсации между субстратом и L;
- цистеиновый компонент относится к остатку цистеинового соединения, включающего цистеин, аналог цистеина или цистеиновое производное.
3. Противомикробное средство по п.2, имеющее формулу
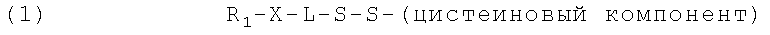 ,
,
в которой R1 представляет собой субстрат;
Х представляет собой связывающую группу, полученную в результате химической реакции сочетания;
L означает (СН2)m или (CH2CH2O)n(CH2)р,
m равно 1-8, n равно 1-100, и р равно 1-10,
где сегмент (СН2)р, когда находится вместе с (CH2CH2O)n, расположен между сегментом (CH2CH2O)n и дисульфидной связью.
4. Противомикробное средство по п.1, в котором -L-S-S-(цистеиновый компонент) включает соединение формулы (2) или (3):
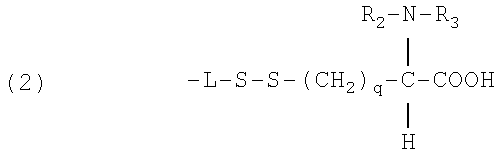
где R2 и R3 представляют собой водород или алкил с 1-25 атомами углерода, в любой комбинации; q принимает значение в интервале от 1-20, или
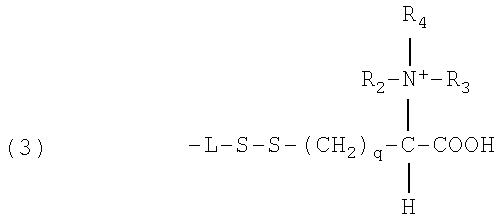
где R2, R3, R4 представляют собой алкильные заместители с 1-25, в любой комбинации; q принимает значение 1-20.
5. Противомикробное средство по п.4, где один из R2 или R3, описанные формулой (2), может быть присоединен через амидную связь, включающую азот цистеинового компонента.
6. Способ предотвращения, или ингибирования роста, и/или пролиферации грамположительных бактерий и/или грамотрицательных бактерий, включающий контактирование микроорганизмов с противомикробным средством по п.1.
7. Способ по п.6, где грамотрицательные бактериии включают Escherichia coli, или грамположительные бактерии включают Staphylococcus aureus или Bacillus megaterium.
8. Субстрат, который входит в контакт с микроорганизмами, и/или который желательно должен быть свободным от аккумуляции и/или адгезиии микроорганизмов, отличающийся тем, что его поверхность покрыта противомикробным средством, определенным в п.1.
9. Субстрат по п.8, где субстрат представляет собой часть устройства, аппарата и/или поверхности, выбранный из (а) медицинских устройств, (b) бакалейных устройств и (с) других устройств, таких как контактные линзы, косметические упаковочные продукты, емкости для пресной воды, водопроводные трубы, устройства для хранения продуктов или материалов, где нежелателен рост бактерий на поверхностях хранящегося материала.
10. Субстрат по п.9, где устройство выбрано из искусственной кожи для ожоговых ран, устройства для диализа, дренажного устройства для ушей, ушных имплантов, устройства для улучшения слуха, трубки аппарата искусственного кровообращения, дренажа при гидроцефалии, шприца, stomis, приспособления для лечения ран, сшивающих материалов, катетеров, стоматологических продуктов, трубки или оборудования, применяемых для парентерального введения жидкостей, растворов, инфузий, доставки лекарственных средств, имплантатов в организме (кости, про-парадонтит), инсулинового насоса, установки для нервов, кардиостимулятора, дренажа из областей организма (абсцесса, полостей, органов, послеоперационный), внутрипросветных стентов (для сосудов и просветов в органах и тканях).
11. Применение противомикробного средства, определенного в пп.1-5, для предотвращения или ингибирования роста и/или пролиферации микроорганизмов на субстрате и/или поверхности.
12. Набор составных частей для применения в обработке поверхности устройства противомикробным агентом, включающий, в отдельных компартментах, (а) предшественник противомикробного средства по п.1, формулы:
Z-L-S-S-(цистеиновый компонент)
в которой L представляет собой спейсерную молекулу, выбранную из группы, включающей (CH2)m, где m равно от 1 до 20, цистеиновый компонент определяется как остаток цистеинового соединения, включающего цистеин, аналог цистеина или производное цистеина, и Z имеет функциональность лиганда, который может взаимодействовать с химическим соединением или свободным радикалом, давая связывающую группу X, и (b) реагенты для ковалентного связывания предшественника к субстрату, где набор дополнительно содержит инструкции для применения набора.
13. Способ изготовления противомикробного устройства, включающий ковалентное связывание лиганда-L-S-S-(цистиеновое соединение) с функциональными группами на поверхности устройства или с растворимым субстратом, который затем фиксируется на поверхности устройства.
| Schwandt LQ | |||
| et al | |||
| Prevention of biofilm formation by dairy products and N-acetylcysteine on voice prostheses in an artificial throat | |||
| Acta Otolaryngol | |||
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| PMID: 15515498 | |||
| Oosterhof JJ | |||
| et al | |||
| The influence of antimicrobial peptides and mucolytics on the integrity of biofilms consisting of bacteria and yeasts as affecting voice | |||
Авторы
Даты
2011-03-10—Публикация
2006-03-21—Подача