ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Данная заявка, поданная в соответствии с 37 CFR §1.53 (b), испрашивает приоритет согласно 35 USC §119(e) по предварительной заявке США с серийным номером 61/829,466, поданной 31 мая 2013 года, которая включена посредством ссылки в полном объеме.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Заявка содержит список последовательностей, который был представлен в электронном виде в формате ASCII, и приведен в настоящем описании посредством ссылки в полном объеме. Указанный материал в формате ASCII, созданный 21 мая 2014 года, получил название SEQ ID NOS 1-170, 2014.MAY.21, GNE Ref. No. P5537R1-WO_SL.txt и имеет размер 186 килобайт.
ОБЛАСТЬ ТЕХНИКИ
Изобретение относится к антителам против стеночной тейхоевой кислоты ("анти-WTA"), конъюгированной с антибиотиками и применение полученных в результате конъюгатов антитела с антибиотиком при лечении инфекционных заболеваний.
УРОВЕНЬ ТЕХНИКИ
Патогенные бактерии являются существенной причиной болезни и смерти как людей, так и животных. Видное место среди них занимает Staphylococcus aureus (S. aureus; SA), которые является основной причиной бактериальных инфекций у людей во всем мире. S. aureus могут быть причиной целого ряда болезней, от незначительных инфекций кожи до опасных для жизни заболеваний, таких как пневмония, менингит, остеомиелит, эндокардит, синдром токсического шока (TSS), бактериемия и сепсис. Их распространенность колеблется от кожи, мягких тканей, органов дыхания, костей, суставов, эндоваскулярной инфекции до раневой инфекции. Они все еще является одним из пяти наиболее распространенных причин внутрибольничных инфекций и часто являются причиной послеоперационных раневых инфекций. Каждый год около 500000 пациентов в американских больницах заражаются стафилококковой инфекцией.
За последние несколько десятилетий инфекция S. aureus становится все более и более трудной для лечения в значительной степени в связи с появлением устойчивых к метициллину S. aureus (MRSA), которые устойчивы ко всем известным бета-лактамным антибиотикам (Boucher, H.W. et al. Bad bugs, no drugs: no ESKAPE! An update from the Infectious Diseases Society of America. Clinical infectious diseases: an official publication of the Infectious Diseases Society of America 48, 1-12 (2009)). Обстоятельства являются настолько острыми, что к 2005 году заражение MRSA, как сообщается, является ведущей причиной смерти из-за одного инфекционного агента и отвечает более чем за 15000 смертей в Соединенных Штатах (DeLeo, F.R. & Chambers, H.F. Reemergence of antibiotic-resistant Staphylococcus aureus in the genomics era. The Journal of Clinical Investigation 119, 2464-2474 (2009)). Ванкомицин, линезолид и даптомицин стали антибиотиками выбора для лечения инвазивных инфекций MRSA (Boucher, Н., Miller, L.G. & Razonable, R.R. Serious infections caused by methicillin-resistant Staphylococcus aureus. Clinical infectious diseases: an official publication of the Infectious Diseases Society of America 51 Suppl 2, S183-197 (2010)). Однако, также сообщалось о снижении восприимчивости к ванкомицину и перекрестной резистентности к линезолиду и даптомицину в клинических штаммах MRSA (Nannini, Е., Murray, В.Е. & Arias, С.А. (2010) "Resistance or decreased susceptibility to glycopeptides, daptomycin, and linezolid in methicillin-resistant Staphylococcus aureus." Current opinion in pharmacology 10, 516-521). Co временем, доза ванкомицина, необходимая для преодоления резистентности достигла уровня, при котором наблюдается нефротоксичность. Таким образом, смертность и заболеваемость от инвазивных инфекций MRSA остаются высоким, несмотря на эти антибиотики.
Несмотря на то, что SA, как правило, считается внеклеточным патогеном, исследования, начавшиеся по меньшей мере 50 лет назад, открыли их способность инфицировать и выживать в различных типах клеток-хозяев, как в профессиональных фагоцитах, так в нефагоцитирующих клетках (Gresham, H.D. et al. Survival of Staphylococcus aureus inside neutrophils contributes to infection. J Immunol 164, 3713-3722 (2000); Anwar, S., Prince, L.R., Foster, S.J., Whyte, M.K. & Sabroe, I. The rise and rise of Staphylococcus aureus: laughing in the face of granulocytes. Clinical and Experimental Immunology 157, 216-224 (2009); Fraunholz, M. & Sinha, B. Intracellular staphylococcus aureus: Live-in and let die. Frontiers in cellular and infection microbiology 2, 43 (2012); Garzoni, C. & Kelley, W.L. Return of the Trojan horse: intracellular phenotype switching and immune evasion by Staphylococcus aureus. EMBO molecular medicine 3, 115-117 (2011)). Эта факультативная внутриклеточная персистенция позволяет избегать иммунитета хозяина, долгосрочно колонизировать хозяина, поддерживать состояние хронической инфекции, и, вероятно, является причиной клинических неудач, и рецидивов после обычной антибиотикотерапии. Кроме того, экспозиция внутриклеточных бактерий субоптимальным концентрациям антибиотиков может способствовать появлению штаммов, устойчивых к антибиотикам, таким образом, делая эту клиническую проблему более острой. В соответствии с этими наблюдениями лечение больных с инвазивными MRSA инфекциями, такими как бактериемия или эндокардит ванкомицином или даптомицином было связано с неудачами больше, чем в 50% (Kullar, R., Davis, S.U., Levine, D.P. & Rybak, M.J. Impact of vancomycin exposure on outcomes in patients with methicillin-resistant Staphylococcus aureus bacteremia: support for consensus guidelines suggested targets. Clinical infectious diseases: an official publication of the Infectious Diseases Society of America 52, 975-981 (2011); Fowler, V.G., Jr. et al. Daptomycin versus standard therapy for bacteremia and endocarditis caused by Staphylococcus aureus. The New England journal of medicine 355, 653-665 (2006); Yoon, Y.K., Kim, J.Y., Park, D.W., Sohn, J.W. & Kim, M.J. Predictors of persistent methicillin-resistant Staphylococcus aureus bacteraertiia in patients treated with vancomycin. The Journal of antimicrobial chemotherapy 65, 1015-1018 (2010)). Таким образом, более успешная анти-стафилококковая терапия должна включать в себя удаление внутриклеточных бактерий.
Большинство современных антибактериальных препаратов представляют собой полусинтетические модификации различных природных соединений. Они включают, например, бета-лактамные антибактериальные средства, которые включают пенициллины (продуцируемые грибами рода Penicillium), цефалоспорины и карбапенемы. Противомикробные соединения, которые по-прежнему выделяли из живых организмов; включают аминогликозиды, в то время как другие антибактериальные средства - например, сульфаниламиды, хинолоны и оксазолидиноны изготавливаются исключительно посредством химического синтеза. В соответствии с этим, многие антибактериальные соединения классифицируются на основе химического/биосинтетического происхождения как природные, полусинтетические и синтетические. Другая система классификации основана на биологической активности; по этой классификации, антибактериальные средства делятся на две большие группы в соответствии с их биологическим воздействием на микроорганизмы: бактерицидные средства убивают бактерии, а бактериостатические средства замедляют или тормозят рост бактерий.
Ансамицины представляют собой класс антибиотиков, включая рифамицин, рифампицин, рифампицин, рифабутин, рифапентин, рифалазил, ABI-1657 и аналоги вышеперечисленного, которые ингибируют бактериальную РНК-полимеразу и имеют исключительную активность в отношении грамположительных и выборочных грамотрицательных бактерий (Rothstein, D.M., et al (2003) Expert Opin. Invest. Drugs 12(2):255-271; US 7342011; US 7271165).
Сообщалось об иммунотерапии для профилактики и лечения инфекций S. aureus (в том числе MRSA). US 2011/0262477 касается использования бактериальных белков адгезии Еар, Emp и AdsA в качестве вакцин, чтобы стимулировать иммунный ответ против MRSA. WO 2000/071585 описывает изолированные моноклональные антитела, реагирующие на изоляты конкретных штаммов S. aureus. US 2011/0059085 предлагает стратегию на основе антител с использованием антител IgM, специфичных для одного или нескольких капсульных антигенов SA, хотя никаких реальных антител не было описано.
Тейхоевые кислоты (ТА) представляют собой бактериальные полисахариды, обнаруживаемые в клеточной стенке грамположительных бактерий, включая SA, Стеночные тейхоевые кислоты (WTA) являются тейхоевыми кислотами, ковалентно связанными с пептидогликановым (PDG) слоем клеточной стенки; в то время как липотейхоевые кислоты (LTA) являются тейхоевыми кислотами, ковалентно связанными с липидами цитоплазматической мембраны. Xia et al. (2010) Intl. J. Med. Microbiol. 300:148-54. Эти гликополимеры играют важнейшую роль в выживаемости бактерий в неблагоприятных условиях и в других основных клеточных процессах. Известные структуры WTA широко варьируются между видами бактерий. ТА из S. aureus состоят из повторяющихся полиолфосфатных субъединиц, таких как рибитолфосфат или глицеринфосфат. Учитывая их структурное разнообразие и изменчивость, WTA считаются привлекательными мишенями для антител и в качестве вакцин, там же.
Конъюгаты антитело-лекарственное средство (ADC), также известные как иммуноконъюгаты, представляют собой таргетированные химиотерапевтические молекулы, которые сочетают идеальные свойства как антител, так и цитотоксических препаратов, направляя мощные цитотоксические препараты на антиген-экспрессирующие опухолевые клетки (Teicher, В.А. (2009) Curr. Cancer Drug Targets 9:982-1004); тем самым повышая терапевтический индекс посредством увеличения до предела эффективность и доведения до минимума токсичность вне опухоли (Carter, P.J. and Senter P.D. (2008) The Cancer J. 14(3):154-169; Chari, R.V. (2008) Acc. Chem. Res. 41:98-107). ADC содержат нацеливающее антитело, ковалентно связанное через линкерный фрагмент с цитотоксическим лекарственным фрагментом. Иммуноконъюгаты дают возможность направленной доставки молекулы лекарственного средства в опухоль и внутриклеточного накопления в опухоли, в то время как системное введение неконъюгированных препаратов может привести к неприемлемым уровням токсичности для нормальных клеток, а также клеток опухоли, которые требуется элиминировать (Polakis Р. (2005) Curr. Opin. Pharmacol. 5:382-387). Эффективное конструирование ADC для данной антигена-мишени зависит от оптимизации таких параметров, как уровни экспрессии антигена-мишени, доступности опухоли (Kovtun, Y.V. and Goldmacher V.S. (2007) Cancer Lett. 255:232-240), выбора антитела (US 7964566), стабильности линкера (Erickson et al (2006) Cancer Res. 66(8):4426-4433; Doronina et al (2006) Bioconjugate Chem. 17:114-124; Alley et al (2008) Bioconjugate Chem. 19:759-765), механизма действия и активности цитотоксического препарата, загрузки препарата (Hamblett et al (2004) Clin. Cancer Res. 10:7063-7070) и способа конъюгации линкер-препарат с антителом (Lyon, R. et al (2012) Methods in Enzym. 502:123-138; Xie et al (2006) Expert. Opin. Biol. Ther. 6(3):281-291; Kovtun et al (2006) Cancer Res. 66(6):3214-3121; Law et al (2006) Cancer Res. 66(4):2328-2337; Wu et al (2005) Nature Biotech. 23(9):1137-1145; Lambert J. (2005) Current Opin. in Pharmacol. 5:543-549; Hamann P. (2005) Expert Opin. Ther. Patents 15(9):1087-1103; Payne, G. (2003) Cancer Cell 3:207-212; Trail et al (2003) Cancer Immunol. Immunother. 52:328-337; Syrigos and Epenetos (1999) Anticancer Res. 19:605-614).
Концепция ADC в терапии рака была также расширена на антибактериальную терапию, и в этом случае лекарственный фрагмент представляет собой антибиотик, что приводит к конъюгату антитело-антибиотик (AAC). US 5545721 и US 6660267 описывают синтез конъюгата «неспецифический иммуноглобулин-антибиотик», который связывается с поверхностью бактерии-мишени через антибиотик, и используется их для лечения сепсиса. US 7569677 и родственные патенты предлагают для возможного использования антитела, конъюгированные с антибиотиком, которые имеют антигенсвязывающий участок, специфический для бактериального антигена (например, капсульного полисахарида SA), но не имеют константную область, которая реагирует с бактериальным Fc-связывающим белком (например, стафилококковым белком А).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к композициям, называемыми "конъюгаты антитело-антибиотик" или "ААС"), содержащим антитело, конъюгированное с помощью ковалентного присоединения с одним или несколькими остатками антибиотика, выбранного из клиндамицина, новобиоцина, ретапамулина, даптомицина, GSK-2140944, CG-400549, ситафлоксацина, тейкопланина, триклозана, нафтиридона, радезолида, доксорубицина, ампициллина, ванкомицина, имипенема, дорипенема, гемцитабина, далбаванцина и азитромицина.
Один аспект настоящего изобретения представляет собой изолированное анти-WTA моноклональное антитело, содержащее легкую цепь и Н-цепь, причем L-цепь содержит CDR L1, CDR L2 и CDR L3, а Н-цепь содержит CDR H1, CDR Н2 и CDR Н3, где CDR L1, CDR L2 и CDR L3 и CDR H1, CDR Н2 и CDR Н3 содержат аминокислотные последовательности CDR, каждого из антител: 4461 (SEQ ID NO. 1-6), 4624 (SEQ ID NO. 7-12), 4399 (SEQ ID NO. 13-18) и 6267 (SEQ ID NO. 19-24) соответственно, как показано в таблицах 6А и 6В.
В одном варианте осуществления изолированное анти-WTA моноклональное антитело содержит вариабельную область тяжелой цепи, содержащую вариабельную область тяжелой цепи (VH), в котором VH содержит последовательность, идентичную по меньшей мере на 95% по длине области VH, выбранной из VH последовательностей SEQ ID No. 26, SEQ ID NO. 28, SEQ ID NO. 30, SEQ ID NO. 32 антител 4461, 4624, 4399 и 6267, соответственно. В одном варианте осуществления это антитело, дополнительно содержащее вариабельный участок L-цепи (VL), где VL содержит последовательность, идентичную по меньшей мере на 95% по длине области VL, выбранным из VI последовательностей: SEQ ID NO. 25, SEQ ID NO. 27, SEQ ID NO. 29, SEQ IN No. 31 антител 4461, 4624, 4399 и 6267, соответственно. В других вариантах осуществления идентичность последовательности составляет 96%, 97%, 98%, 99% или 100%.
В более конкретных вариантах осуществления антитело содержит:
(i) VL SEQ ID NO. 25 и VH SEQ ID NO. 26;
(ii) VL SEQ ID NO. 27 и VH SEQ ID NO. 28;
(iii) VL SEQ ID NO. 29 и VH SEQ ID NO. 30; или
(iv) VL SEQ ID NO. 31 и VH SEQ ID NO. 31.
В одном аспекте антитело по любому из предшествующих вариантов осуществления связывает WTA альфа.
В другом аспекте настоящее изобретение обеспечивает изолированное анти-WTA моноклональное антитело, содержащее легкую цепь и Н-цепь, причем L-цепь содержит CDR L1, CDR L2 и CDR L3, а Н-цепь содержит CDR H1, CDR Н2 и CDR Н3, где CDR L1, CDR L2 и CDR L3 и CDR H1, CDR Н2 CDR и Н3 содержат аминокислотные последовательности соответствующих CDR, каждого из антител, показанных на Фиг. 14 (SEQ ID NO. 33-110). В конкретном варианте осуществления эти антитела связывают WTA альфа.
В другом аспекте настоящее изобретение обеспечивает изолированное анти-WTA моноклональное антитело, специфически анти-WTA бета моноклональное антитело, которое содержит вариабельную область L-цепи (VL), где VL содержит последовательность, идентичную по меньшей мере на 95% по длине области VL выбранную из последовательностей VL, соответствующих каждому из антител 6078, 6263, 4450, 6297, 6239, 6232, 6259, 6292, 4462, 6265, 6253, 4497 и 4487, соответственно, как показано на Фиг. 17А-1 - 17А-2 в нумерации Kabat 1-107. В других вариант осуществления антитело дополнительно содержит вариабельный участок тяжелой цепи, содержащий вариабельную область тяжелой цепи (VH), в котором VH содержит последовательность, идентичную по меньшей мере на 95% по длине области VH, выбранной из последовательностей VH, соответствующей каждому из антител: 6078, 6263, 4450, 6297, 6239, 6232, 6259, 6292, 4462, 6265, 6253, 4497 и 4487, соответственно, как показано на Фиг. 17В-1, 17В-2 в нумерации Kabat 1-113. В более конкретном вариант осуществления антитела VH содержит последовательность SEQ ID NO. 112, a VL содержит SEQ ID NO. 111.
В определенном варианте осуществления изолированное антитело анти-WTA бета представляет собой антитело, в котором легкая цепь содержит последовательность SEQ ID NO. 115, а Н-цепь, имеющая цистеин, включенный посредством генетической инженерии, содержит последовательность SEQ ID NO. 116. В другом варианте осуществления антитело представляет собой антитело, в котором легкая цепь содержит последовательность SEQ ID NO. 115, и Н-цепь, имеющую цистеин, включенный посредством генетической инженерии, содержит последовательность SEQ ID NO. 117, где X обозначает М, I или V. В отличном варианте осуществления L-цепь, содержащая последовательность SEQ ID NO. 113, составляет пару с вариантом Н-цепи SEQ ID NO. 117 с Cys, включенным посредством генетической инженерии; причем вариант представляет собой вариант, где X обозначает М, I или В.
Другое изолированное антитело анти-WTA бета, обеспечиваемой настоящим изобретением, содержит тяжелую и легкую цепь, в котором тяжелая цепь содержит VH, имеющую последовательность, идентичную по меньшей мере на 95% с SEQ ID NO. 120. В дополнительном вариант осуществления это антитело дополнительно содержит VL, имеющую последовательность, идентичную по меньшей мере на 95% с SEQ ID NO. 119. В конкретном вариант осуществления антитело анти-WTA бета содержит легкую цепь и тяжелую цепь, в которой L-цепь содержит последовательность VL SEQ ID NO. 119 и H-цепь содержит последовательность VH SEQ ID NO. 120. В еще более конкретном вариант осуществления изолированное антитело, которое связывается с WTA бета, содержит L-цепь SEQ ID NO. 121 и Н-цепь SEQ ID NO. 122.
Варианты L и Н-цепей анти-WTA бета с Cys, включенным посредством генетической инженерии, могут составлять пару в любой из следующих комбинаций для формирования полных антител для конъюгации с промежуточными соединениями линкер-Abx для генерирования анти-WTA ААС по настоящему изобретению. В одном варианте осуществления L-цепь содержит последовательность SEQ ID NO. 121, а Н-цепь содержит последовательность SEQ ID NO. 124. В другом варианте осуществления изолированное антитело содержит L-цепь последовательности SEQ ID NO. 123 и Н-цепь содержащую последовательность SEQ ID NO. 124 или SEQ ID NO. 157. В конкретном варианте осуществления антитело анти-WTA бета, также как анти-WTA бета ААС по настоящему изобретению содержит L-цепь последовательности SEQ ID NO. 123.
Еще один вариант осуществления представляет собой антитело, которое связывается с тем же эпитопом, что каждое антитело анти-WTA альфа на Фиг. 13А и Фиг. 13В. Также обеспечивается антитело, которое связывается с тем же эпитопом, как каждое антитело анти-WTA бета на Фиг. 14, Фиг. 15А и 15В, Фиг. 16А и Фиг. 16B.
В дополнительном варианте осуществления антитела анти-WTA бета и анти-WTA альфа по настоящему изобретению представляют собой антигенсвязывающие фрагменты, лишенные Fc-области, предпочтительно F(ab')2 или F(ab). Таким образом, настоящее изобретение обеспечивает конъюгаты антитело-антибиотик, где WTA антитело является F(ab')2 или F(ab).
В другом аспекте изобретение обеспечивает фармацевтическую композицию содержащую любое из антител, раскрытых в настоящем описании, и фармацевтически приемлемый носитель.
В еще одном аспекте настоящее изобретение также обеспечивает изолированную нуклеиновую кислоту, кодирующую любое из антител, раскрытых в настоящем описании. В еще одном аспекте настоящее изобретение обеспечивает вектор, содержащий нуклеиновую кислоту, кодирующую любое из антител, раскрытых в настоящем описании. В дополнительном варианте осуществления вектор представляет собой экспрессионный вектор.
Настоящее изобретение также обеспечивает клетку-хозяина, содержащую нуклеиновую кислоту, кодирующую любое из антител, раскрытых в настоящем описании. В еще одном варианте осуществления клетка-хозяин является прокариотической или эукариотической.
Настоящее изобретение также обеспечивает способ получения антитела, включающий культивирование клетки-хозяина, содержащую нуклеиновую кислоту, кодирующую любое из антител, раскрытых в настоящем описании, в условиях, подходящих для экспрессии нуклеиновой кислоты; и выделение антитела, продуцируемого клеткой. В некоторых вариантах осуществления способ дополнительно включает очистку антитела.
Другой аспект настоящего изобретения представляет собой соединение конъюгат антитело-антибиотик (ААС), содержащее антитело против стеночной тейхоевой кислоты (WTA) по изобретению, ковалентно присоединенное посредством пептидного линкера к фрагменту антибиотика, выбранного из клиндамицина, новобиоцина, ретапамулина, даптомицина, GSK-2140944, CG-400549, ситафлоксацина, тейкопланина, триклозана, нафтиридона, радезолида, доксорубицина, ампициллина, ванкомицина, имипенема, дорипенема, гемцитабина, далбавацина и азитромицина.
Примерный вариант осуществления соединения конъюгата антитело-антибиотик имеет формулу:
в которой:
Ab представляет собой антитело против стеночной тейхоевой кислоты;
L представляет собой пептидный линкер, имеющий формулу:

в которой Str представляет собой растяжимый участок; Pep представляет собой пептид от двух до двенадцати аминокислотных остатков, и Y представляет собой спейсерный участок;
abx представляет собой фрагмент антибиотика; а
p представляет собой целое число от 1 до 8.
Соединения конъюгат антитело-антибиотик по настоящему изобретению могут содержать пептидный линкер, который является линкером, расщепляемым цистеиновой протеазой из S. aureus. В другом варианте осуществления линкер представляет собой линкер, расщепляемый протеазой хозяина, предпочтительно человеческой протеазой катепсином В.
В одном варианте осуществления соединения конъюгат антитело-антибиотик любого из предшествующих соединений имеет соотношение антибиотик : антитело (AAR), 2 или 4.
Другой аспект настоящего изобретения представляет собой фармацевтическую композицию, содержащую соединение конъюгат антитело-антибиотик по изобретению.
Другой аспект настоящего изобретения представляет собой способ лечения бактериальной инфекции посредством введения пациенту терапевтически эффективного количества соединения конъюгат антитело-антибиотик по любому из вышеприведенных вариантов осуществления. В одном варианте осуществления пациент является человеком. В одном варианте осуществления бактериальная инфекция представляет собой инфекцию Staphylococcus aureus. В некоторых вариантах осуществления пациенту был поставлен диагноз-инфекция Staphylococcus aureus. В некоторых вариантах осуществления лечение бактериальной инфекции включает уменьшение бактериальной нагрузки.
Кроме того, изобретение обеспечивает способ уничтожения внутриклеточных Staphylococcus aureus в клетках-хозяевах у пациента, инфицированного Staphylococcus aureus, не убивая клеток-хозяев, посредством введения соединения конъюгат анти-WTA-антибиотик по любому из вышеприведенных вариантов осуществления. Обеспечивается другой способ для уничтожения персистирующих бактериальных клеток (например, Staphylococcus aureus) in vivo посредством контактирования персистирующих бактериальных клеток с помощью ААС любого из предыдущих вариантов осуществления.
В другом варианте осуществления способ лечения дополнительно включает введение второго терапевтического агента. В другом варианте осуществления второй терапевтический агент представляет собой антибиотик, в том числе антибиотик против Staphylococcus aureus в целом или MRSA, в частности.
В одном варианте осуществления второй антибиотик, вводимый в комбинации с соединением конъюгата антитело-антибиотик по настоящему изобретению, выбирается из структурных классов: (I) аминогликозидов; (ii) бета-лактамов; (iii) макролидов/циклических пептидов; (iv) тетрациклинов; (v) фторхинолинов/фторхинолонов; (VI) и оксазолидинонов.
В одном варианте осуществления второй антибиотик, вводимый в комбинации с соединением конъюгата антитело-антибиотик по настоящему изобретению, выбирается из рифамицина, клиндамицина, новобиоцина, ретапамулина, даптомицина, GSK-2140944, CG-400549, ситафлоксацина, тейкопланина, триклозана, нафтиридона, радезолида, доксорубицина, ампициллина, ванкомицина, имипенема, дорипенема, гемцитабина, далбавацина и азитромицина.
В некоторых вариантах осуществления в настоящем описании бактериальная нагрузка в субъекте была уменьшена до неопределяемого уровня после обработки. В одном варианте осуществления посев крови будет отрицательным после лечения по сравнению с положительным посевом крови до лечения. В некоторых вариантах осуществления в настоящем описании бактериальная резистентность у субъекта не обнаруживается или является низкой. В некоторых вариантах осуществления в настоящем описании субъект не поддается лечению с помощью метициллина или ванкомицина.
Другой аспект настоящего изобретения представляет собой способ получения антитела или соединения конъюгата антитело-антибиотик по изобретению.
Другой аспект настоящего изобретения представляет собой набор для лечения бактериальной инфекции, содержащий фармацевтическую композицию по настоящему, изобретению и инструкции по применению.
Другой аспект настоящего изобретения представляет собой промежуточное соединение линкер-антибиотик, имеющее формулу:
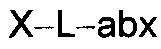
в которой:
abx представляет собой фрагмент антибиотика, выбранного из клиндамицина, новобиоцина, ретапамулина, даптомицина, GSK-2140944, CG-400549, ситафлоксацина, тейкопланина, триклозана, нафтиридона, радезолида, доксорубицина, ампициллина, ванкомицина, имипенема, дорипенема, гемцитабина, далбавацина и азитромицина;
L представляет собой пептидный линкер, ковалентно присоединенный к abx и X, и имеющий формулу:

В которой Str представляет собой растяжимый участок; Pep представляет собой пептид от двух до двенадцати аминокислотных остатков, и Y представляет собой спейсерный участок; а
X представляет собой реакционноспособную функциональную группу, выбранную из малеимида, тиола, амино, бромида, бромацетамида, йодацетамида, п-толуолсульфоната, иодида, гидроксильной, карбоксильной, пиридилдисульфида и N-гидроксисукцинимида.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1 показывает, что воздействие ванкомицина или рифампицина убивает MRSA постепенно. Ванкомицин был протестирован в дозах 2 мкг/мл (незакрашенный квадрат) и 20 мкг/мл (незакрашенный квадрат). Рифампицин протестировали в дозах 0,02 мкг/мл (незакрашенный треугольник) и 0,2 мкг/мл (незакрашенный квадрат треугольник).
Фиг. 2 показывает, что инфицированные перитонеальные клетки в состоянии переносить инфекцию к остеобластам в присутствии ванкомицина.
Фиг. 3 показывает клеточную стенку грамположительных бактерий, таких как S. aureus с представлением стеночных тейхоевых кислот (WTA), липотейхоевой кислоты (LTA) и пептидогликановых (PGN) оболочек, которые стабилизируют клеточные мембраны и обеспечивают сайты присоединения.
Фиг. 4 показывает химическую структуру и гликозильные модификации стеночной тейхоевой кислоты (WTA), подробно описанными в соответствии с определениями.
Фиг. 5 показывает возможный механизм активации препарата для конъюгатов антитело-антибиотик (ААС). Активный антибиотик (АЬ) высвобождается после интернализации ААС внутри клеток млекопитающих.
Фиг. 6А и 6В обобщают характеристики Ab из первичного скрининга библиотеки mAb, показывая положительное связывание ELISA с препаратами клеточной стенки из штамма USA300 или штамма Wood46 S. aureus, как описано в примере 21. Из Ab, которые связываются с WTA, 4 являются специфичными для WTA альфа и 13 специфически связываются с WTA бета.
Фиг. 7А показывает анализ макрофагов in vitro, демонстрирующий, что AAC уничтожает внутриклеточные MRSA.
Фиг. 7В показывает внутриклеточное уничтожение MRSA (штамм USA300) с 50 мкг/мл тио-S4497-HC-A118C-pipBOR, rifa-102 в макрофагах, остеобластах (MG63), эпителиальных клетках дыхательных путей (А549), и эндотелиальных клетках пупочной вены человека (HUVEC) по сравнению с голым, неконъюгированным антителом анти-WTA S4497. Пунктирная линия указывает на предел обнаружения для данного анализа.
Фиг. 7С показывает сравнение ААС, rifa-102 и rifa-105. MRSA опсонизировался антителом S4497 только или с ААС: rifa-102 или rifa-105 при различных концентрациях в пределах от 10 мкг/мл до 0,003 мкг/мл.
Фиг. 7D показывает, что ААС убивает внутриклеточных бактерий без ущерба для макрофагов.
Фиг. 7Е показывает выделение живых USA300 изнутри макрофагов из макрофагальных клеток, лизированных выше. Мало (в 10000 раз меньше) живых S. aureus было извлечено из макрофагов, инфицированных бактериями, опсонированных S4497-ААС, по сравнению с обработанными контрольными голыми антителами.
Фиг. 8А показывает in vivo эффективность тио-S4497-HC-A118C-MC-vc-PAB-pipBOR rifa-102 ААС в модели внутрибрюшинной инфекции в A/J мышах. Мышей инфицировали MRSA посредством внутрибрюшинной инъекции и обрабатывали с 50 мг/кг антителами S4497 только или с 50 мг/кг rifa-102 ААС (НС-А114С Kabat = НС-A118C EU) посредством внутрибрюшинной инъекции. Мышей умерщвляли на 2 день после инфицирования, а общую бактериальную нагрузку оценивали в перитониальном супернатанте (внеклеточные бактерии), перитонеальных клетках (внутриклеточные бактерии) или в почках.
Фиг. 8В показывает модель внутривенной инфекции in vivo в A/J мышах. Мышей инфицировали MRSA посредством внутривенной инъекции и обрабатывали с 50 мг/кг антителом S4497, 50 мг/кг тио-S4497-HC-A118C-MC-vc-PAB-pipBOR, rifa-102 ААС или простой смесью 50 мг/кг антитела S4497 + 0,5 мг/кг свободного рифамицина. Серая пунктирная линия показывает предел обнаружения для каждого органа.
Фиг. 9А показывает эффективность тио-S4497-HC-A118C-MC-vc-PAB-pipBOR, rifa-102 ААС в модели внутривенной инфекции посредством титрования ААС S4497-pipBOR.
Фиг. 9В показывает, что тио-S4497-HC-A118C-МС-vc-РАВ-диметил-pipBOR, rifa-105 ААС является более эффективными, чем тио-S4497-HC-A118C-MC-vc-PAB-pipBOR, rifa-102 ААС в модели внутривенной инфекции посредством титрования. При обработке с антителом S4497, rifa-102 ААС или тио-S4497-HC-A118C-МС-vc-РАВ-диметил-pipBOR, rifa-112 ААС вводили в указанных дозах через 30 минут после инфицирования. Мышей умерщвляли через 4 дня после инфицирования и определяли общее количество выживших бактерий на мышь (объединенных из 2 почек) посредством посева.
Фиг. 9С показывает, что тио-S4497-HC-A118C-МС-vc-РАВ-диметил-pipBOR, rifa-105 ААС является более эффективным, чем антитела S4497 или только антибиотик диметил-pipBOR 7 в модели внутривенной инфекции. Мышей CB17.SCID инфицировали 2×107 КОЕ MRSA посредством внутривенной инъекции. На следующий день после инфицирования мышей обрабатывали с 50 мг/кг антитела S4497, 50 мг/кг ААС rifa-105 или 0,5 мг/кг диметил-pipBOR 7 (дозой, эквивалентной антибиотику, содержащимся в 50 мг/кг ААС). Мышей умерщвляли через 4 дня после инфицирования и общее количество выживших бактерий на мышь (объединенные 2 почек) определяли посредством посева.
Фиг. 10А показывает распространенность анти-S. aureus антител в сыворотке крови человека. Пациенты, инфицированные S. aureus, или нормальные контрольные содержат в сыворотке крови большое количество антител, специфичных к WTA, с такой же специфичностью, как анти-WTA S4497. Связывание различных образцов сыворотки дикого типа (WT) с MRSA, которые экспрессируют антиген S4497, рассматривали в сравнении со связыванием с MRSA мутантного штамма TarM/TarS DKO (двойной нокаут), который не имеет модификаций сахара, которые узнаются антителом S4497.
Фиг. 10В показывает, что ААС является эффективным в присутствии физиологических уровней человеческого IgG (10 мг/мл) в анализе макрофагов in vitro со штаммом USA300 MRSA. Тио-S4497-HC-A118C-МС-vc-РАВ-диметил-pipBOR, rifa-105 является эффективным в присутствии 10 мг/мл человеческого IgG. Штамм US A300 MRSA был опсонизирован с ААС только, или с ААС, разведенным в 10 мг/мл человеческого IgG. Общее число выживших внутриклеточных бактерий оценивали через 2 дня после инфицирования.
Фиг. 10С показывает модель инфекции in vivo, демонстрирующую, что ААС является эффективным в присутствии физиологических уровней человеческого IgG. Объединенные данные из 3 независимых экспериментов с использованием двух отдельных препаратов тио-S4497-HC-A118C-MC-vc-PAB-диметил-pipBOR, rifa-105 или 112 ААС. У мышей, обработанных ААС, наблюдалось уменьшение бактериальной нагрузки больше, чем на 4 порядка (t-критерий Стьюдента р=0,0005).
Фиг. 11А показывает модель инфекции in vivo, демонстрирующая, что ААС являются более эффективными, чем действующий стандарт медицинской помощи (SOC) антибиотик ванкомицин у мышей, которые восстанавливаются с нормальным уровне человеческого IgG. Мышей обрабатывали антителом S4497 (50 мг/кг), ванкомицином (100 мг/кг), тио-S4497-HC-A118C-MC-vc-PAB-диметил-pipBOR 105 ААС (50 мг/кг) или ААС, сделанным с изотипическими контрольными антителами, которые не узнают MRSA, тио-hu-anti gD 5В5-НС-A118C-MC-vc-PAB-диметил-pipBOR 110 ААС (50 мг/кг).
Фиг. 11В показывает относительное связывание антител анти-Staph. aureus с штаммом USA300, выделенным из почек в модели инфекции in vivo, как определено посредством FACS. Антитело S4497 распознает модификацию N-ацетилглюкозамина, который связан со стеночной тейхоевой кислотой (WTA) через бета-аномерную связь на клеточной стенки S. aureus. Антитело S7578 связывается с аналогичной модификацией N-ацетилглюкозамина, который присоединен к WTA с помощью альфа-аномерной связи. Антитело rF1 представляет собой положительный контроль антитела анти-MRSA, которое распознает модификации сахара, найденные на семействе белков, заякоренных на клеточной стенке, содержащих SDR-повтор. Антитело gD представляет собой отрицательный контроль человеческих IgG1, которые не распознают S. aureus.
Фиг. 11С показывает модель инфекции in vivo, демонстрирующая, что ААС, тио-S6078-HC A114C-LCWT-MC-vc-PAB-диметил-pipBOR 129 является более эффективным, чем голое антитело анти-WTA S4497, в соответствии с той же схемой, как на Фиг. 11А, у мышей которые восстанавливаются с нормальным уровнем человеческого IgG. Мышей обрабатывали антителом S4497 (50 мг/кг) или тио-S6078-HC-A114C LCWT-MC-vc-PAB-диметил-pipBOR 129 ААС (50 мг/кг).
Фиг. 12 показывает анализ ингибирования роста, демонстрирующий, что ААС не являются токсичными для S. aureus, до тех пока линкер не расщепляется посредством катепсина В. Схема анализа высвобождения катепсина (пример 20), показана слева. ААС обрабатываются катепсином для высвобождения свободного антибиотика. Общее количество антибиотической активности в интактном ААС по сравнению с ААС, обработанным катепсином В, определяется посредством получения серийных разведений результирующей реакции и определения минимальной дозы ААС, которая способна ингибировать рост S. aureus. Правый верхний график показывает анализ высвобождения катепсина для тио-S4497-HC-A118C-MC-vc-PAB-pipBOR 102 и нижний правый график показывает анализ высвобождения катепсина для тио-S4497-HC-A118C-MC-vc-PAB диметил-pipBOR 105.
Фиг. 13А показывает выравнивание аминокислотной последовательности вариабельных областей легкой цепи (VL) четырех человеческих антител анти-WTA альфа (SEQ ID NOS 25, 27, 29 и 31, соответственно, в порядке появления). CDR последовательности CDRL1, L2 и L3 по Kabat нумерации подчеркнуты.
Фиг. 13В показывает выравнивание аминокислотной последовательности вариабельных областей тяжелой цепи (VH) четырех человеческих антител анти-WTA альфа Фиг. 13А. CDR последовательности CDR H1, Н2 и Н3 согласно Kabat нумерации подчеркнуты (SEQ ID NO 26, 28, 30 и 32, соответственно, в порядке появления).
Фиг. 14 показывает CDR последовательности L и Н цепей 13 человеческих антител анти-WTA бета (SEQ ID NO 33-110).
Фиг. 15А-1 и 15А-2 показывают выравнивание по всей длине L-цепи (легкой цепи) антител анти-WTA бета 6078 (немодифицированный) и его варианты, v2, v3, v4 (SEQ ID NO 113, 113, 115, 113, 115, 113, 115 и 115, соответственно, в порядке появления). CDR последовательности CDR17L1, L2 и L3 по Kabat нумерации подчеркнуты. Прямоугольники показывают контактирующие остатки и остатки CDR в соответствии с Kabat и Chothia. Варианты L-цепи, которые содержат Cys, включенный посредством генетической инженерии, обозначены как С в черном прямоугольнике в конце константной области (при остатке EU NO. 205 в данном случае). Вариант обозначения, например, v2LC-Cys означает вариант 2, содержащий Cys, включенный посредством генетической инженерии, в L-цепи. HCLC-Cys означает, что каждая из Н и L-цепей содержат Cys, включенный посредством генетической инженерии. Вариант 2, 3 и 4 имеют изменения в начале Н-цепи, как показано на Фиг. 15В.
Фиг. 15В-1, 15В-2, 15В-3, 15В-4 показывают выравнивание полноразмерной Н-цепи антитела (тяжелой цепи) анти-WTA бета 6078 (немодифицированной) и ее варианты, v2, v3, v4 (SEQ ID NOS 114, 139-144 и 143, соответственно, в порядке появления), которые имеют изменения в начале Н-цепи. Варианты Н-цепи, которые содержат Cys, включенный посредством генетической инженерии, обозначены как С в пунктирных прямоугольниках ближе к концу константной области (при остатке EU no. 118 в данном случае).
Фиг. 16А-1 и 16А-2 показывают выравнивание полноразмерной L-цепи антитела анти-WTA бета 4497 (немодифицированной) и Cys, включенный посредством генетической инженерии, L-цепи (SEQ ID NO 121, 123, 145 и 145, соответственно, в порядке появления). CDR последовательности CDRL1, L2 и L3 в соответствии с Kabat нумерацией подчеркнуты. Прямоугольники показывают контактирующие остатки и остатки CDR в соответствии с Kabat и Chothia. Варианты L-цепи, которые содержат Cys, включенный посредством генетической инженерии, обозначены как С в пунктирных прямоугольниках ближе к концу константной области (по остатку EU no. 205 в данном случае).
Фиг. 16В-1, 16В-2, 16В-3 показывают выравнивание полноразмерной Н-цепи антитела анти-WTA бета 4497 (немодифицированной) и ее вариант v8 с D, замененным на Е в CDR Н3 в положении 96, с или без Cys, включенного посредством генетической инженерии, (SEQ ID NOS 146-147, 157 и 147, соответственно, в порядке появления). Варианты Н-цепи, которые содержат Cys, включенный посредством генетической инженерии, обозначены как С.
Фиг. 17А-1, 17А-2, 17А-3 показывают выравнивание аминокислотной последовательности полной длины легкой цепи тринадцати человеческих антител анти-WTA бета (SEQ ID NO 113, 158-167, 121 и 168, соответственно, в порядок появления). Вариабельная область (VL) охватывает аминокислотные позиции по Kabat от 1 до 107. CDR последовательности CDRL1, L2 и L3 в соответствии с Kabat нумерацией подчеркнуты.
Фиг. от 17В-1 до 17В-6 показывают выравнивание аминокислотной последовательности тяжелой цепи полной длины тринадцати человеческих анти-WTA бета антител Фиг. 17А-1, 17А-2, 17А-3 (SEQ ID NO 114, 169, 170, 125-131, 133-134, 138 и 127, соответственно, в порядке появления). Вариабельная область (VH), охватывает положения аминокислот по Kabat 1-113. CDR последовательности CDR H1, Н2 и Н3 согласно Kabat нумерации подчеркнуты. Положение 118 Н-цепи в соответствие с Eu, отмеченная звездочкой, может быть заменена на Cys для конъюгации с лекарственной субстанцией. Остатки, выделенные черным, могут быть заменены на другие остатки, которые не влияют связывание антигена, чтобы предотвратить дезамидирование, изомеризацию аспарагиновой кислоты, окисление или N-гликозилирование.
Фиг. 18А показывает связывание антитела 4497 мутантов с клеточной стенкой S. aureus, как проанализировано посредством ELISA.
Фиг. 18В показывает сравнение антитела 4497 и его мутантов (SEQ ID NOS 132, 135, 136, 137, соответственно, в порядке появления) в выделенных положение аминокислот и относительная прочность их связывания с антигеном, как то протестировано посредством ELISA.
Фиг. 19 показывает результаты FACS-анализа антитела 6078 WT и мутантов, связывающихся с штаммом, дефицитным по белку A, USA300 (USA300-SPA), как описано в примере 23. Мутанты показали отсутствие связывания с S. aureus.
Фиг. 20 показывает, что предварительная обработка свободными антителами (50 мг/кг) не является эффективнной в модели внутривенной инфекции. BALB/C мышам вводили в качестве контроля разовую дозу носителя (PBS) или 50 мг/кг антител посредством внутривенной инъекции за 30 минут до заражения 2×107 КОЕ USA300. Группы лечения включали контрольные изотипические антитела, которые не связываются с S. aureus (gD), антитела, направленные против бета-модификации стеночной тейхоевой кислоты (4497) или антитела, направленное против альфа модификации стеночной тейхоевой кислоты (7578). Контрольным мышам дважды в день вводили 110 мг/кг ванкомицина посредством внутрибрюшинной инъекции (Vanco).
Фиг. 21 и 22 показывают, что ААС, направленные против как бета-модификации стеночной тейхоевой кислоты, так и альфа-модификации стеночной тейхоевой кислоты, являются эффективными в модели внутривенной инфекции, использующей мышей, у которых воссоздали нормальный уровень человеческих IgG. У мышей CB17.SCID воссоздали человеческие IgG с использованием режима дозирования, оптимизированного для получения постоянного уровня по меньшей мере 10 мг/мл человеческих IgG в сыворотке, и инфицировали 2×107 КОЕ USA300 посредством внутривенной инъекции. Лечение было начато через 1 день после инфицирования буфером только в качестве контроля (PBS), 60 мг/кг WTA бета ААС (136 ААС) или 60 мг/кг альфа-WTA ААС (155 ААС).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Далее приведено подробное описание некоторых вариантов осуществления изобретения, примеры которых проиллюстрированы в прилагаемых структурах и формулах. В то время как изобретение будет описано в связи с перечисленными вариантами осуществления, включая способы, материалы и примеры, такое описание не является ограничивающим, и изобретение охватывает все альтернативы, модификации и эквиваленты, в не зависимости от того, являются ли они общеизвестными, или включенными в настоящее описание. В случае, если один или несколько из включенных литературных источников, патентов и аналогичных материалов отличается от или противоречит этому описанию, включая, но не ограничиваясь определенными терминами, использования терминов, описанных методик, или тому подобное, настоящая заявка главенствует. Если не указано иное, все технические и научные термины, используемые в настоящем описании, имеют то же значение, какое обычно понимается специалистом с обычной квалификацией в данной области техники, к которой это изобретение принадлежит. Специалисту в данной области техники будут очевидны многочисленные методы и материалы, подобные или эквивалентные описанным в настоящем описании, которые могут быть использованы в практике настоящего изобретения. Настоящее изобретение никоим образом не ограничивается описанными способами и материалами.
Все публикации, патентные заявки, патенты и другие ссылки, упомянутые в настоящем описании, включены посредством ссылки во всей их полноте.
I. ОБЩИЕ МЕТОДИКИ
Методики и процедуры, описанные или упомянутые в настоящем описании, как правило, хорошо известны и обычно используются с помощью обычной методологии специалистами в данной области техники, такие как, например, широко применяемые методологии, описанные в Sambrook et al., Molecular Cloning: A Laboratory Manual 3d edition (2001) Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y.; Current Protocols in Molecular Biology (F.M. Ausubel, et al. eds., (2003)); серии Methods in Enzymology (Academic Press, Inc.): PCR 2: A Practical Approach (M.J. MacPhersoh, B.D. Hames and G.R. Taylor eds. (1995)), Harlow and Lane, eds. (1988) Antibodies, A Laboratory Manual, and Animal Cell Culture (R.I. Freshney, ed. (1987)); Oligonucleotide Synthesis (M.J. Gait, ed., 1984); Methods in Molecular Biology, Humana Press; Cell Biology: A Laboratory Notebook (J.E. Cellis, ed., 1998) Academic Press; Animal Cell Culture (R.I. Freshney), ed., 1987); Introduction to Cell and Tissue Culture (J.P. Mather and P.E. Roberts, 1998) Plenum Press; Cell and Tissue Culture: Laboratory Procedures (A. Doyle, J.B. Griffiths, and D.G. Newell, eds., 1993-8) J. Wiley and Sons; Handbook of Experimental Immunology (D.M. Weir and C.C. Blackwell, eds.); Gene Transfer Vectors for Mammalian Cells (J.M. Miller and M.P Calos, eds., 1987); PCR: The Polymerase Chain Reaction, (Mullis et al., eds., 1994); Current Protocols in Immunology (J.E. Coligan et al., eds., 1991); Short Protocols in Molecular Biology (Wiley and Sons, 1999); Immunobiology (C.A. Janeway and P. Travers, 1997); Antibodies (P. Finch, 1997); Antibodies: A Practical Approach (D. Catty., ed., IRL Press, 1988-1989); Monoclonal Antibodies: A Practical Approach (P. Shepherd and C. Deart, eds., Oxford University Press, 2000); Using Antibodies: A Laboratory Manual (E. Harlow and D. Lane (Cold Spring Harbor Laboratory Press, 1999); The Antibodies (M. Zanetti and J.D. Capra, eds., Harwood Academic Publishers, 1995); и Cancer: Principles and Practice of Oncology (V.T. DeVita et al., eds., J.B. Lippincott Company, 1993).
Номенклатура, используемая в настоящей заявке, основана на систематической номенклатуре ИЮПАК, если не указано иное. Если не указано иное, технические и научные термины, используемые в настоящем описании, имеют то же значение, которое обычно понимается специалистом с обычной квалификацией в данной области техники, к которой это изобретение принадлежит, и совместимы с: Singleton et al (1994) Dictionary of Microbiology and Molecular Biology, 2nd Ed., J. Wiley & Sons, New York, NY; и Janeway, C., Travers, P., Walport, M., Shlomchik (2001) Immunobiology, 5th Ed., Garland Publishing, New York.
II. ОПРЕДЕЛЕНИЯ
При указании числа заместителей, термин "один или несколько" относится к диапазону от одного заместителя, до максимально возможного числа замещений, т.е. замене одного водорода до замены всех атомов водорода заместителями. Термин "заместитель" обозначает атом или группу атомов, замещающих атом водорода на исходной молекуле. Термин "замещенный" означает, что указанная группа несет один или несколько заместителей. Если какая-либо группа может нести несколько заместителей и обеспечивается разнообразные возможных заместителей, заместители выбираются независимо и не должны быть одинаковыми. Термин "незамещенный" означает, что указанная группа не несет заместителей. Термин "необязательно замещенный" означает, что указанная группа является незамещенной или замещенной одним или несколькими заместителями, выбранными независимо из группы возможных заместителей. При указании числа заместителей, термин "один или несколько" означает от одного заместителя до максимально возможного числа замещения, т.е. от замены одного водорода до замены всех атомов водорода заместителями.
Термин "стеночная тейхоевая кислота" (WTA) означает анионные гликополимеры, которые ковалентно присоединены к пептидогликану с помощью фосфодиэфирной связи к С6 гидроксилу сахарам N-ацетилмурамовой кислоты. Хотя точное химическое строение может меняться в зависимости от организмов, в одном варианте осуществления WTA представляет собой рибит-тейхоевую кислоту с повторяющимися звеньями 1,5-фосфодиэфирными связями с D-рибитолом и сложного эфира D-аланина в положении 2 и гликозильных заместителей в положении 4. Гликозильные группы могут быть N-ацетилглюкозаминильными α (альфа) или β (бета), как присутствует в S. aureus. Гидроксилы на повторах альдитол/сахар алкоголь-фосфат замещены катионными сложными эфирами D-аланина и моносахаридов, таких как N-ацетилглюкозамин. В одном аспекте гидроксильные заместители включают D-аланил и альфа (α) или бета (β) GlcNHAc. В одном конкретном аспекте WTA содержит соединение формулы:
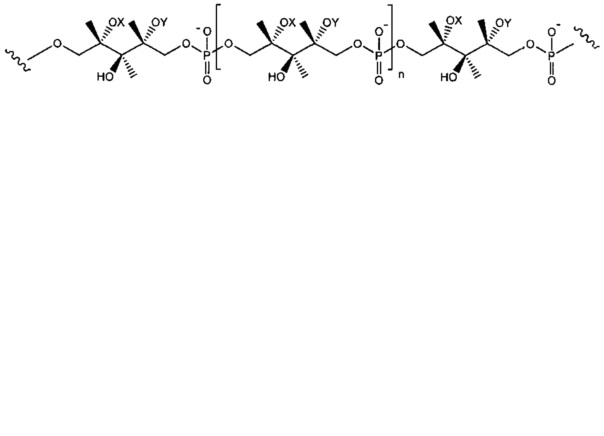
где волнистые линии указывают повторяющиеся соединяющие единицы или сайты присоединения полиальдитол-Р или пептидогликана, где X представляет собой D-аланил или -Н; и Y представляет собой α (альфа)-GlcNHAc или β (бета)-GlcNHAc.
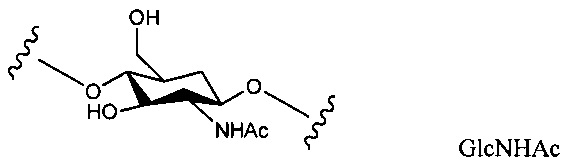
В S. aureus WTA ковалентно связана с 6-ОН N-ацетилмурамовой кислоты (MurNAc) через дисахарид, состоящий из N-ацетилглюкозамина (GlcNAc)-1-P и N-ацетилманнозамина (ManNAc), за которым следует два или три блока глицерин-фосфатов. Фактический полимер WTA таким образом состоит из 11-40 рибит-фосфатных (Rbo-P) повторяющихся звеньев. Ступенчатой синтез WTA сначала инициируется посредством фермента TagO, и штаммы S. aureus, потерявшие ген TagO (посредством искусственного удаления гена) не производят никакого WTA. Повторяющиеся единицы могут быть дополнительно удлиненны с D-аланином (D-Ala) при С2-ОН и/или с N-ацетилглюкозамином (GlcNAc) в положении С4-ОН через α- (альфа) или β- (бета) гликозидные связи. В зависимости от штамма S. aureus, или фазы роста бактерий гликозидные связи могут быть α-, β- или смесью двух аномеров.
Термин "антибиотик" (abx или Abx) включает в себя любую молекулу, которая специфически ингибирует рост или убивает микроорганизмы, такие как бактерии, но не является смертельным для хозяина в интервалах концентрации и дозировании, предполагаемых для введения. В конкретном аспекте антибиотик не является токсичным для хозяина, в интервалах вводимых концентраций и дозирования. Антибиотики, эффективные против бактерий, могут быть в общих чертах классифицированы как бактерицидные (т.е., непосредственно убивающие) или бактериостатические (т.е., предотвращающие деление). Бактерицидные антибиотики могут быть далее подразделены на антибиотики узкого спектра или антибиотики широкого спектра действия. Антибиотик широкого спектра действия является антибиотиком, эффективным против широкого спектра бактерий, включая как грамположительные, так и грамотрицательные бактерии, в отличие от антибиотиков узкого спектра действия, который эффективен против меньшего диапазона или конкретных семейств бактерий. Примеры антибиотиков включают: (i) аминогликозиды, например, амикацин, гентамицин, канамицин, неомицин нетилмицин, стрептомицин, тобрамицин, паромицин, (ii) ансамицины, например, гельданамицин, гербимицин, (iii) карбацефемы, например, лоракарбеф, (iv), карбапенемы, например, эртапенем, дорипенем, имипенем/циластатин, меропенем, (v) цефалоспорины (первое поколение), например, цефадроксил, цефазолин, цефалотин, цефалексин, (vi), цефалоспорины (второе поколение), например, цефлаклор, цефамандол, цефокситин, цефпрозил, цефуроксим, (vi), цефалоспорины (третье поколение), например, цефиксим, цефдинир, цефдиторен, цефоперазон, цефотаксим, цефподоксим, цефтазидим, цефтибутен, цефтизоксим, цефтриаксон, (vii), цефалоспорины (четвертое поколение), например, цефепим, (viii), цефалоспорины (пятое поколение), например, цефтобипрол, (ix) гликопептиды, например, тейкопланин, ванкомицин (х) макролиды, например, акситромицин, кларитромицин, диритромицин, эритромицин, рокситромицин, тролеандомицин, телитромицин, спектиномицин, (xi) монобактамы, например, акстреонам, (xii) пенициллины, например, амоксициллин, ампициллин, акслоцилин, карбенициллин, клоксациллин, диклоксациллин, флуклоксациллин, мезлоциллин, метициллин, нафциллин, оксациллин, пенициллин, пиперациллин, тикарциллин, (xiii) антибиотические полипептиды, например, бацитрацин, колистин, полимиксин, (xiv) хинолоны, например, ципрофлоксацин, эноксацин, гатифлоксацин, левофлоксацин, лемекфлоксацин, моксифлоксацин, норфлоксацин, орфлоксацин, тровафлоксацин, (xv) сульфаниламиды, например, мафенид, пронтозил, сульфацетамид, сульфаметизол, сульфаниламид, сульфасалазин, сульфизоксазол, триметоприм, триметоприм-сульфаметоксазол (ТМР-СМК), (xvi) тетрациклины, например, демеклоциклин, доксициклин, миноциклин, окситетрациклин, тетрациклин и (xvii), другие, такие как арсфенамин, хлорамфеникол, клиндамицин, линкомицин, этамбутол, фосфомицин, фузидиевая кислот, фуразолидон, изониазид, линезолид, метронидазол, мупироцин, нитрофурантоин, платенсимицин, пиразинамид, хинупристин/дальфопристин, рифампицин/рифампицин или тинидазол.
Как используется в настоящем описании, термин "WTA антитело" относится к любому антителу, которое связывается WTA, будь то WTA альфа, или WTA бета. Термины "антитело анти-стеночная тейхоевая кислот альфа" или "антитело анти-WTA альфа" или "анти-αWTA" или "антитело анти-αGlcNac WTA" используются взаимозаменяемо для обозначения антитела, которое специфически связывается стеночной тейхоевой кислотой (WTA) альфа. Аналогичным образом, термины "антитело анти-стеночная тейхоевая кислот бета" или "антитело анти-WTA бета" или "анти-βWTA" или "антитело анти-βGlcNac WTA" используются взаимозаменяемо для обозначения антитела, которое специфически связывается со стеночной тейхоевой кислотой (WTA) бета. Термины "антитело анти-Staph" и "антитело, которое связывается со Staph" относятся к антителу, которое способно связываться с антигеном на Staphylococcus aureus ("Staph" или "S. aureus") с аффинностью достаточной, чтобы антитело было полезным в качестве диагностического и/или терапевтического средства в нацеливании на Staph. В одном варианте осуществления степень связывания антитела анти-Staph к неродственному, не-Staph белку составляет менее чем около 10% связывания антитела с MRSA, как измеряется, например, с помощью радиоиммуноанализа (RIA). В некоторых вариантах осуществления антитело, которое связывается с Staph имеет константу диссоциации (Kd)≤1 мкМ, ≤100 нМ, ≤10 нМ, ≤5 нМ, ≤4 нМ, ≤3 нМ, ≤2 нМ, ≤1 нМ, ≤0,1 нМ, ≤0,01 нМ или ≤0,001 нМ (например, 10-8 М или менее, например, от 10-8 М да 10-13 М, например, от 10-9 М до 10-13 М), В некоторых вариантах осуществления антитело анти-Staph связывается с эпитопом Staph, который является консервативным среди Staph из различных видов.
Термин "метициллин-устойчивый Staphylococcus aureus" (MRSA), в качестве альтернативы известный как Staphyloccus aureus с множественной лекарственной устойчивостью или оксациллин-устойчивый Staphylococcus aureus (ORSA), относится к любому штамму Staphyloccus aureus, который устойчив к бета-лактамным антибиотикам, которые включают в пенициллины (например, метициллин, диклоксациллин, нафциллин, оксациллин и т.д.) и цефалоспорины. "Метициллин-чувствительный S. aureus" (MSSA) относится к любому штамму Staphyloccus aureus, чувствительному к бета-лактамным антибиотикам.
Термин "минимальная ингибирующая концентрация» («МИК») относится к наименьшей концентрации противомикробного действия, которая будет ингибировать видимый рост микроорганизма после инкубации в течение ночи. Методы анализа для определения МИК известны. Один метод представлен, как описано ниже в примере 18.
Термин "антитело" в данном описании используется в самом широком смысле и конкретно включает моноклональные антитела, поликлональные антитела, димеры, мультимеры, мультиспецифические антитела (например, биспецифические антитела) и антиген-связывающие фрагменты антитела (Miller et al (2003) J. of Immunology 170:4854-4861). Антитела могут быть мышиными, человеческими, гуманизированными, химерными или полученными из других видов. Антитело представляет собой белок, генерируемый иммунной системой, которое способно распознавать и связываться со специфическим антигеном (Janeway, С, Travers, P., Walport, М., Shlomchik (2001) Immuno Biology, 5th Ed., Garland Publishing, New York). Антиген-мишень обычно имеет многочисленные сайты связывания, также называемые эпитопами, узнаваемые посредством CDR на нескольких антителах. Каждое антитело, которое специфически связывается с другим эпитопом имеет отличную структуру. Таким образом, один антиген может узнаваться и связываться более чем с одним соответствующим антителом. Антитело включает в себя молекулу иммуноглобулина полной длины или иммунологически активную часть полноразмерной молекулы иммуноглобулина, то есть молекулы, которая содержит сайт связывания антигена, который иммуноспецифически связывает антиген мишени, представляющий интерес, или его части, такие мишени, включают, но не ограничиваются этим, раковая клетка или клетки, которые продуцируют аутоиммунными антитела, связанные с аутоиммунным заболеванием, инфицированная клетка или микроорганизм, такой как бактерия. Иммуноглобулин (Ig), раскрытый в настоящем описании, может быть любого изотипа, кроме IgM (например, IgG, IgE, IgD и IgA) и подкласса (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Иммуноглобулины могут быть получены из любого вида. В одном аспекте Ig имеют человеческое, мышиное или кроличье происхождение. В конкретном варианте осуществления Ig имеет человеческое происхождение.
"Класс" антитела относится к типу константного домена или константной области, которой обладают его тяжелая цепь. Существуют пять основных классов антител: IgA, IgD, IgE, IgG и IgM, и некоторые из них могут быть дополнительно подразделены на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелой цепи, которые соответствуют различным классам иммуноглобулинов, называются α, δ, ε, γ и μ, соответственно.
«Нативные антитела» относится к природным иммуноглобулиновым молекулам с различной структурой. Например, нативные IgG антитела представляют собой гетеротетрамерные гликопротеины около 150000 дальтон, состоящие из двух одинаковых легких цепей и двух одинаковых тяжелых цепей, которые связаны дисульфидными мостиками. От N- к С-концу, каждая тяжелая цепь имеет вариабельную область (VH), также называемую вариабельным тяжелым доменом или вариабельным доменом тяжелой цепи, следующими за ним три константных домена (CH1, СН2 и СН3). Аналогичным образом, от N- к С-концу, каждая легкая цепь имеет вариабельную область (VL), также называемый вариабельным легким доменом или вариабельным доменом легкой цепи, следующим за ним константным доменом легкой цепи (CL). Легкая цепь антитела может быть отнесена к одному из двух типов, называемых каппа (κ) и лямбда (λ), на основе аминокислотной последовательности их константного домена.
Термины "полноразмерное антитело", "интактное антитело» и «цельное антитело» используются в настоящем описании взаимозаменяемо для обозначения антитела, имеющего структуру по существу аналогичную структуре нативного антитела, или имеющие тяжелые цепи, которые содержат Fc-область, как определено в настоящем описании.
Термин "антиген-связывающий фрагмент" антитела относится к молекуле, отличной от интактного антитела, которая содержит часть интактного антитела, которое связывается с антигеном, с которым связывается интактное антитело. Примеры фрагментов антитела включают, но не ограничиваются этим Fv, Fab, Fab', Fab'-SH, F(ab')2; диатела; линейные антитела; молекулы одноцепочечного антитела (например scFv); и мультиспецифические антитела, образованные из фрагментов антител.
Термин "моноклональное антитело", как используется в настоящем описании, относится к антителу, полученному из популяции по существу гомогенных антител, т.е. индивидуальные антитела, составляющие популяцию, являются идентичными и/или связывают один и тот же эпитоп, за исключением возможных вариантов антител, например, содержащих встречающихся в природе мутаций или возникающие в результате процесса производства препарата моноклональных антител (например, естественных вариаций гликозилирования), причем такие варианты, обычно присутствуют в незначительных количествах. Одним из таких возможных вариантов для антител IgG1 является отщепление С-концевого лизина (K) в константной области тяжелой цепи. В отличие от препаратов поликлональных антител, которые обычно включают различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело препарата моноклонального антитела направлено против одной детерминанты на антигене. Таким образом, определение «моноклональное» указывает на характер антитела, полученного из практически гомогенной популяции антител, и не должно быть истолковано как требующее получения антитела каким-либо конкретным способом. Например, моноклональные антитела, которые будут использоваться в соответствии с настоящим изобретением, могут быть изготовлены различными методами, в том числе, но не ограничиваясь этим, методом гибридом, методами рекомбинантной ДНК, методом фагового дисплея, а также методами, использующими трансгенных животных, содержащих все или часть локусов иммуноглобулина человека, такие способы и другие иллюстративные способы получения моноклональных антител будут описаны в настоящем описании. В дополнение к их специфичности, моноклональные антитела обладают тем преимуществом, что они могут быть синтезированы не контаминированными другими антителами.
Термин "химерное антитело" означает антитело, в котором часть тяжелой и/или легкой цепи получено из конкретного источника или вида, в то время как остальная часть тяжелой и/или легкой цепи получено из другого источника или вида.
"Человеческое антитело" является антителом, которое обладает аминокислотной последовательностью, которая соответствует антителу, продуцируемому в организме человека или в клетке человека или полученное из источника, не являющегося человеком, который использует репертуары человеческих антител или других последовательностей, кодирующих человеческих антитела. Это определение человеческого антитела конкретно исключает гуманизированное антитело, содержащее нечеловеские антигенсвязывающие остатки.
"Гуманизированное антитело" относится к химерному антителу, содержащему аминокислотные остатки от нечеловеческого HVR и аминокислотные остатки от человеческого FR. В некоторых вариантах осуществления гуманизированное антитело будет по существу содержать все из по меньшей мере одного, а обычно двух вариабельных доменов, в которых все или по существу все из HVR (например, CDR) соответствуют таковым в нечеловеческом антителе, и все или по существу все FR соответствуют таковым человеческого антитела. Гуманизированное антитело необязательно может содержать по меньшей мере часть константной области антитела, полученного из человеческого антитела. "Гуманизированное форма" антитела, например, нечеловеческого антитела, относится к антителу, которое подверглось гуманизации.
Термин "вариабельная область" или "вариабельный домен" относится к домену антитела тяжелой или легкой цепи, который участвует в связывании антитела с антигеном. Вариабельные домены тяжелой цепи и легкой цепи (VH и VL, соответственно) нативного антитела обычно имеют аналогичные структуры, при этом каждый домен, содержащий четыре консервативные каркасные области (FR) и три гипервариабельные области (HVRs). (Смотри, например, Kindt et al. Kuby Immunology, 6th ed., W.H. Freeman and Co., page 91 (2007).) Единственный VH или VL домен может быть достаточным для придания антигенсвязывающей специфичности. Кроме того, антитела, которые связываются с конкретным антигеном, могут быть выделены с использованием VH или VL домена от антитела, которое связывается с антигеном для скрининга библиотеки комплементарных VL или VH доменов, соответственно. Смотри, например, Portolano et al., J. Immunol. 150:880-887 (1993); Clarkson et al., Nature 352:624-628 (1991).
Термин "гипервариабельная область", "HVR" или "HV", когда используется в настоящем описании, относится к областям вариабельного домена антитела, которые являются гипервариабельными в последовательности ("определяющая комплементарность область" или "CDR") и/или образуют структурно определенную петлю и/или содержат антиген-контактирующие остатки ("антигенные контакты"). Как правило, антитела содержат шесть HVRs; три в VH (H1, Н2, Н3), и три в VL (L1, L2, L3). В нативных антителах Н3 и L3 демонстрируют наибольшее разнообразие из шести HVRs, и Н3 в особенности, как полагают, играет уникальную роль в придании тонкой специфичности антителам. Смотри, например, Xu et al., Immunity 13:37-45 (2000); Johnson and Wu, in Methods in Molecular Biology 248:1-25 (Lo, ed., Human Press, Totowa, NJ, 2003). Действительно, встречающиеся в природе антитела верблюда, состоящие только из тяжелой цепи функциональны и стабильны в отсутствие легкой цепи. Смотри, например, Hamers-Casterman et al., Nature 363:446-448 (1993); Sheriff et al., Nature Struct. Biol. 3:733-736 (1996).
Ряд очертаний HVR применяются и охватываются в настоящем документе. Определяющие комплементарность области (CDR) по Kabat базируются на изменчивости последовательности и наиболее широко используется (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda MD. (1991)). Chothia обращает внимание на локализацию, структурных петель (Chothia and Lesk, (1987) J. Mol. Biol. 196:901-917). По отношению к антигенным контактам, см. MacCallum et al. J. Mol. Biol. 262: 732-745 (1996). AbM HVRs представляют собой компромисс между HVRs Kabat и структурными петелями Chothia, и используются в Oxford Molecular's AbM antibody modeling software. "Контактные" HVRs основаны на анализе имеющихся сложных кристаллических структур. Остатки от каждого из этих HVRs приведены ниже.
HVRs могут содержать "расширенные HVRs" как указано далее: 24-36 или 24-34 (L1), 46-56 или 50-56 (L2) и 89-97 или 89-96 (L3) в VL и 26-35 (H1), 50-65 или 49-65 (Н2) и 93-102, 94-102 или 95-102 (Н3) в VH. Если не указано иное, остатки HVR, остатки CDR и другие остатки в вариабельной области (например, остатки FR) пронумерованы в настоящем описании в соответствии с Kabat и др., см. выше.
Выражение "нумерация по Kabat остатков вариабельного домена" или "нумерация по Kabat положения аминокислоты" и их вариации, означает систему нумерации, используемую для вариабельных доменов тяжелой цепи или вариабельных доменов легкой цепи в компиляции антител по Kabat et al., см. выше. При использовании этой системы нумерации действительная линейная аминокислотная последовательность может содержать меньшее количество аминокислот или дополнительных аминокислот соответствующие укорочению или вставкам в FR- или CDR-участках вариабельного домена. Например, вариабельный домен тяжелой цепи может включать одну аминокислотную вставку (остаток 52а согласно Kabat) после остатка 52 из Н2 и вставленные остатки (например, остатки 82а, 82b, и 82с и т.д. согласно Kabat) после остатка 82 FR-участка тяжелой цепи. Нумерация остатков по Kabat может быть определена для данного антитела путем выравнивания гомологичных участков последовательности антитела со "стандартной" последовательностью с нумерацией по Kabat.
"Каркасный" или "FR" относится к остаткам вариабельного домена, отличным от остатков гипервариабельной области (HVR). FR вариабельного домена обычно состоит из четырех FR-областей: FR1, FR2, FR3 и FR4. Соответственно, последовательности HVR и FR обычно появляются в следующей последовательности в VH (или VL): FR1-H1(L1)-FR2-H2(L2)-FR3-H3(L3)-FR4.
"Человеческие акцепторные каркасные участки" для целей настоящего изобретения представляет собой структуру, содержащую аминокислотную последовательность каркасного участка вариабельного домена легкой цепи (VL) или каркасного участка вариабельного домена тяжелой цепи (VH), полученных из каркасного участка человеческого иммуноглобулина или человеческого консенсусного каркасного участка, как определено ниже. Человеческие акцепторный каркасный участок "происходящие из" каркасного участка человеческого иммуноглобулина или человеческого консенсусного каркасного участка могут содержать ту же аминокислотную последовательность, или она может содержать изменения аминокислотной последовательности. В некоторых вариантах осуществления количество аминокислотных изменений равно 10 или меньше, 9 или меньше, 8 или меньше, 7 или меньше, 6 или меньше, 5 или меньше, 4 или меньше, 3 или меньше или 2 или меньше. В некоторых вариантах осуществления последовательность человеческого акцепторного каркасного участка VL является идентичной последовательности каркасного участка VL человеческого иммуноглобулина или последовательности консенсусного человеческого каркасного участка.
"Человеческий консенсусный каркасный участок" является каркасным участком, который представляет собой наиболее часто встречающиеся аминокислотные остатки в выборке каркасных последовательностях VL или VH человеческого иммуноглобулина. Как правило, выборка последовательностей VL или VH человеческого иммуноглобулина происходит из подгруппы последовательностей вариабельных доменов. Как правило, подгруппа последовательностей является подгруппой, как определено в Kabat et al., Sequences of Proteins of Immunological Interest, Fifth Edition, NIH Publication 91-3242, Bethesda MD (1991), vols. 1-3. В одном варианте осуществления для VL подгруппа представляет собой подгруппу каппа I, как определено в Kabat et al., см. выше. В одном варианте осуществления для VH подгруппа представляет собой подгруппу III, как определено в Kabat et al., см. выше.
"Аффинность" относится к силе совокупных нековалентных взаимодействий между единственным участком связывания на молекуле (например, антитела) и его партнером по связыванию (например, антигеном). Если не указано иное, при использовании в настоящем документе, «аффинность связывания» относится к внутренней связывающей аффинности, которое отражает взаимодействие 1:1 между членами связывающейся пары (например, антителом и антигеном). Аффинность молекулы X для ее партнера Y, в основном можно представить посредством константы диссоциации (Kd). Аффинность может быть измерена, при использовании общеупотребительных способов, известных в данной области техники, включая те, которые описаны в настоящем описании.
Антитело с "созревшей аффинностью" означает антитело с одним или несколькими изменениями в одном или нескольких гипервариабельных участках (HVRs), по сравнению с исходным антителом, которое не обладает такие изменениями, причем такие изменения, приводят к улучшению аффинности антитела для антиген.
Термин "эпитоп" относится к конкретному сайту на молекуле антигена, с которым связывается антитело.
Термин "антитело, которое связывается с тем же эпитопом" в качестве антитела сравнения, относится к антителу, которое блокирует связывание антитела сравнения со своим антигеном в конкурентном анализе на 50% или более, и, наоборот, антитела сравнения блокируют связывание антитела с его антигеном в конкурентном анализе на 50% или более. Иллюстративный конкурентный анализ обеспечивается в настоящем описании.
«Голое антитело» относится к антителу, которое неконъюгировано с гетерологичным фрагментом (например, цитотоксическим фрагментом) или радиоактивной меткой. Голое антитело может присутствовать в фармацевтической композиции.
"Эффекторные функции" означают такие биологические активности, которые связаны с Fc-областью антитела, которые изменяются с изотипом антитела. Примеры эффекторных функций антитела включают: связывание C1q и комплемент-зависимой цитотоксичностью (CDC); связывание с Fc-рецептором; антителозависимая клеточно-опосредованная цитотоксичность (ADCC); фагоцитоз; понижающая регуляция рецепторов клеточной поверхности (например, рецепторов В-клеток); и активация В-клеток.
«Антителозависимая клеточно-опосредованная цитотоксичность» или ADCC означает форму цитотоксичности, при которой секретируемые Ig связываются с Fc рецепторами (FcR), присутствующими на определенных цитотоксических клетках (например, натуральных киллерах (NK), нейтрофилах и макрофагах) делая способными эти цитотоксические эффекторные клетки специфически связываться с антиген-несущей клеткой-мишенью и впоследствии убивать клетку-мишень с помощью цитотоксинов. Антитела "вооружают" цитотоксические клетки и являются необходимыми для убийства клетки-мишени по этому механизму. Первичные клетки для опосредования ADCC, NK клетки, экспрессируют Fcγ(гамма) RIII только, тогда как моноциты экспрессируют Fcγ(гамма) RI, Fcγ(гамма)RII и Fcγ(гамма)RIII. Экспрессия Fc кроветворных клеток представлена в таблице 3 на странице 464 Ravetch and Kinet, Annu. Rev. Immunol. 9: 457-92 (1991). Для оценки ADCC активности представляющей интерес молекулы может быть осуществлен in vitro ADCC-анализ, например, описанной в патентах США 5500362 или 5821337. Полезные эффекторные клетки для таких анализов включают мононуклеарные клетки периферической крови (РВМС) и клетки естественные киллеры (NK). Альтернативно или дополнительно, ADCC-активность представляющей интерес молекулы может быть оценен in vivo, например, на животной модели, такой как раскрыта в Clynes et al., PNAS USA 95:652-656 (1998).
"Фагоцитоз" относится к процессу, посредством которого возбудитель захватывается или интернализуется клеткой-хозяином (например, макрофагом или нейтрофилом). Фагоциты опосредуют фагоцитоз тремя путями: (i) непосредственно через рецепторы клеточной поверхности (например, лектины, интегрины и скэвенджер-рецепторы) (ii) усиливая комплемент - используя рецепторы комплемента (в том числе CRI, рецепторы для C3b, CR3 и CR4), связывая и переваривая патогены, опсонизированные комплементом, и (iii) усиливая антитела - используя Fc-рецепторы (в том числе FcγgammaRI, FcγgammaRIIA и FcγgammaRIIIA), чтобы связать частицы, опсонизированный антителом, которые затем интернализуются и сливаются с лизосомами превращаются в фаголизосомы. В настоящем изобретении, считается, что путь (iii) играет важную роль в доставке терапевтических препаратов ААС анти-MRSA к зараженнымм лейкоцитам, например, нейтрофилам и макрофагам (Phagocytosis of Microbes: complexity in Action by D. Underhill and A Ozinsky. (2002) Annual Review of Immunology, Vol 20:825).
"Комплемент-зависимая цитотоксичность" или "CDC" относится к лизису клетки-мишени в присутствии комплемента. Активация классического пути комплемента инициируется связыванием первого компонента системы комплемента (C1q) с антителами (соответствующего подкласса), которые связаны с распознанным ими антигеном. Для оценки активации комплемента может быть выполнен CDC-анализ, например, как описано в Gazzano-Santoro et al., J. Immunol. Methods 202: 163 (1996),
Термин "Fc-область" в настоящем описании используется для определения С-концевой области тяжелой цепи иммуноглобулина. Этот термин включает нативные последовательности Fc-областей и вариантные Fc-области. Хотя границы Fc-области тяжелой цепи иммуноглобулина могут варьироваться, Fc-область тяжелой цепи человеческого IgG обычно определяется, простираясь от аминокислотного остатка в положении Cys226 или от Pro230, до карбоксильного конца. С-концевой лизин (остаток 447 по системе EU-нумерации, также называемый EU-индексом, как описано в Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD, 1991) Fc-области может быть удален, например, при производстве или очистки антитела, либо посредством рекомбинантно сконструированной нуклеиновой кислоты, кодирующей тяжелую цепь антитела. Соответственно, композиция интактных антител может содержать популяции антител со всеми удаленными остатками K447, популяции антител без каких-либо удаленных остатков K447, и популяции антител, имеющих смесь антител с и без остатка K447. Термин "Fc-рецептор" или "FcR" также включает неонатальный рецептор, FcRn, который отвечает за перенос материнских IgG к плоду. Guyer et al., J. Immunol. 117: 587 (1976) and Kim et al., J. Immunol. 24: 249 (1994). Методы измерения связывания с FcRn известны (см., например, Ghetie and Ward, Immunol. Today 18: (12): 592-8 (1997); Ghetie et al., Nature Biotechnology 15(7): 637-40 (1997); Hinton et al., J. Biol. Chem. 279(8): 6213-6 (2004); WO 2004/92219 (Hinton et al.). Связывание с FcRn in vivo и время полужизни в сыворотке человеческих полипептидов FcRn с высоким сродством связывания могут быть проанализированы, например, у трансгенных мышей или трансфицированных клеточных линий человека, экспрессирующих человеческий FcRn, или у приматов, которым полипептиды, имеющие вариантную Fc-область, вводят. WO 2004/42072 (Presta) описывает варианты антител, у которых улучшено или уменьшено связывание с FcRs См. также, например, Shields et al., J. Biol. Chem. 9(2): 6591-6604 (2001).
Углевод, присоединенный к Fc-области может быть изменен. Нативные антитела, продуцируемые клетками млекопитающих, обычно содержат разветвленный, 2-антенарный олигосахарид, который обычно присоединяется с помощью N-связи к Asn297 домена СН2 Fc-области. См., например, Wright et al. (1997) TIBTECH 15:26-32. Олигосахариды могут включать различные углеводы, например, маннозу, N-ацетил-глюкозамин (GlcNAc), галактозу и сиаловую кислоту, а также фукозу, присоединенные к GlcNAc в "стволе" в 2-антенарной структуры олигосахаридов. В некоторых вариантах осуществления модификации олигосахаридов в IgG могут быть сделаны для того, чтобы создать IgG, с некоторыми дополнительно улучшенными свойствами. Например, модификации антитела обеспечиваются, обладанием структуры, в которой отсутствует углевод фукоза, присоединенная (прямо или косвенно) к Fc-области. Такие изменения могут улучшать функции ADCC. См., например патент США 2003/0157108 (Presta, L.); патент США 2004/0093621 (Kyowa Hakko Kogyo Co., Ltd). Примеры публикаций, относящихся к "дефукозилированным" или "фукоза-дефицитным" модификациям антител включают: патент США 2003/0157108; WO 2000/61739; WO 2001/29246; патент США 2003/0115614; патент США 2002/0164328; патент США 2004/0093621; патент США 2004/0132140; патент США 2004/0110704; патент США 2004/0110282; патент США 2004/0109865; WO 2003/085119; WO 2003/084570; WO 2005/035586; WO 2005/035778; WO 2005/053742; WO 2002/031140; Okazaki et al., J. Mol. Biol. 336: 1239-1249 (2004); Yamane-Ohnuki et al. Biotech. Bioeng. 87: 614 (2004). Examples of cell lines capable of producing defucosylated antibodies include Lee 13 CHO cells deficient in protein fucosylation (Ripka et al. Arch. Biochem. Biophys. 249:533-545 (1986); US Pat. Appl. Pub. No. 2003/0157108 A1, Presta, L; и WO 2004/056312 A1, Adams et al., особенно в примере 11), и «нокаутированные» клеточные линии, такие как гена альфа-1,6-фукозилтрансферазы, FUT8, нокаутированные клетки СНО (см., например, Yamane-Ohnuki et al., Biotech. Bioeng. 87: 614 (2004); Kanda, Y. et al, Biotechnol. Bioeng., 94(4):680-688 (2006); и WO 2003/085107).
Термин "изолированное антитело" представляет собой антитело, которое было отделено от компонентов его природного окружения. В некоторых вариантах осуществления антитело очищали до чистоты более чем 95% или 99%, как определяли, например, электрофоретически (например, SDS-PAGE, посредством изоэлектрического фокусирования (ИЭФ), посредством капиллярного электрофореза) или хроматографически (например, посредством ионообменной хроматографии или обращено-фазовой ВЭЖХ). Для обзора методов оценки чистоты антител, см., например, Flatman et al., J. Chromatogr. В 848:79-87 (2007).
Термин «изолированная нуклеиновая кислота» относится к молекуле нуклеиновой кислоты, которая был отделена от компонентов ее природного окружения. Изолированная нуклеиновая кислота, включает в себя молекулу нуклеиновой кислоты, содержащуюся в клетках, которые обычно содержат молекулу нуклеиновой кислоты, но молекула нуклеиновой кислоты присутствует вне хромосомы или хромосомной локализации, которая отличается от ее естественной хромосомной локализации.
"Изолированная нуклеиновая кислота, кодирующая антитело анти-WTA бета" относится к одной или нескольким молекулам нуклеиновых кислот, кодирующим тяжелые и легкие цепи антитела, включая такие молекулы нуклеиновой кислоты(от) в единственном векторе или отдельных векторах, и такой молекулы нуклеиновой кислоты(от), присутствующих в одном или нескольких локализациях в клетке-хозяине.
Как используется в настоящем изобретении, термин "специфически связывается с" или "специфичный для" относится к измеряемым и воспроизводимым взаимодействиям, такому как связывание между мишенью и антителом, которое определяется в присутствии мишени в присутствии гетерогенной популяции молекулы, в том числе биологических молекул. Например, антитело, которое специфически связывается с мишенью (которая может быть эпитопом), представляет собой антитело, которое связывается с этой мишенью с большей аффинностью, авидностью, более легко, и/или с большей продолжительностью, чем оно связывается с другими мишенями. В одном варианте осуществления степень связывания антитела с мишенью, неродственной WTA-бета, составляет менее чем приблизительно 10% связывания антитела с мишенью, как измеряется, например, с помощью радиоиммуноанализа (RIA). В некоторых вариантах осуществления антитело, которое специфически связывается с WTA бета, имеет константу диссоциации (Kd)≤1 мкМ, 100 нМ≤10 нм, ≤1 нМ или ≤0,1 нм. В некоторых вариантах осуществления антитело специфически связывается с эпитопом, который является консервативным для различных видов. В другом варианте осуществления специфическое связывания может включать, но не требует исключительного связывания.
«Аффинность связывания», как правило, относится к силе общей суммы нековалентных взаимодействий между одним участком связывания молекулы (например, антитела) и его партнером по связыванию (например, антигеном). Если не указано иное, используемое в настоящем описании выражение "аффинность связывания" относится к внутренней аффинности связывания, которая отражает взаимодействие 1:1 между членами связывающей пары (например, антителом и антигеном). Аффинность молекулы X для своего партнера Y в основном можно представить посредством константы диссоциации (Kd). Аффинность может быть измерена, при использовании общеупотребительных способов, известных в данной области техники, включая такие, которые описаны в настоящем описании. Низкоаффинные антитела обычно связываются с антигеном медленно и, как правило, распадаются легко, в то время как с высокоаффинные антитела обычно связываются с антигеном быстрее и, как правило, остаются связанными дольше. В данной области техники известны различные способы измерения аффинности связывания, любой из которых может быть использован для целей настоящего изобретения. Конкретные иллюстративные варианты осуществления и для измерения аффинности связывания описаны далее.
В одном варианте осуществления «Kd» или «значение Kd" согласно этому изобретению измеряют с помощью анализа связывания антигена, меченного радиоактивным изотопом (РИА), выполненного с использованием Fab-версии антитела, представляющего интерес, и его антигена, как описано в следующем анализе. Аффинность связывания антигена в растворе для Fabs измеряется путем уравновешивания Fab с минимальной концентрацией (125I)-меченного антигена в присутствии серии титрующих растворов немеченого антигена, затем связанный антиген захватывают с помощью планшета, покрытого антителами против Fab (см., например, Chen et al., (1999) J. Mol. Biol. 293:865-881). Чтобы установить условия анализа, микротитровальные планшеты (Dynex Technologies, Inc.) покрывают в течение ночи раствором (5 мкг/мл) улавливающего антитела против Fab (Cappel Labs) в 50 мМ растворе карбоната натрия (pH 9,6) и затем блокируют 2% раствором (мас./об.) бычьего сывороточного альбумина в PBS в течение от двух до пяти часов при комнатной температуре (приблизительно 23°С). Б неадсорбирующем планшете (Nunc #269620) смешивают 100 пМ или 26 пМ [125I]-антигена и серийные разбавления Fab, представляющего интерес (например, по способу, используемому для анализа антитела против VEGF, Fab-12, in Presta et al., Cancer Res. 57:4593-4599 (1997)). Затем Fab, представляющий интерес, инкубируют в течение ночи; однако инкубацию можно продолжать в течение более длительного периода времени (например, 65 часов), чтобы гарантировать достижение равновесия. Затем смеси переносят в планшет для захвата и инкубируют при комнатной температуре (например, в течение одного часа). Затем раствор удаляют и планшет промывали восемь раз 0,1% раствором поверхностно-активного вещества TWEEN-20™ в PBS. После высыхания планшетов добавляли сцинтиллятор в количестве 150 мкл/лунку (MicroScint-20; Packard) и считают планшеты на гамма-счетчике TOPCOUNT™ (Packard) в течение десяти минут. Концентрации каждого Fab, которые дают менее чем или равное 20% максимального связывания, выбираются для использования в конкурентном связывании.
В соответствии с другим вариантом осуществления Kd измеряется с помощью поверхностного плазмонного резонанса с использованием анализов BIACORE®-2000 или BIACORE®-3000 instrument (BIAcore, Inc., Piscataway, NJ) и чипов CM5 с иммобилизованным антигеном при ~10 единицах ответа (RU) при 25°С. Коротко говоря, биосенсорные чипы с карбоксиметилированным декстраном (СМ5, BIAcore Inc.) активируют гидрохлоридом N-этил-N'-(3-диметиламинопропил)карбодиимида (EDC) и N-гидроксисукцинимидом (NHS) в соответствии с инструкциями поставщика. Антиген разбавляют 10 мМ ацетата натрия, pH 4,8, до 5 мкг/мл (~0,2 мкМ) и затем вводят его со скоростью потока 5 мкл/минуту до достижения приблизительно 10 единиц ответа (RU) связанного белка. Чтобы блокировать непрореагировавшие группы, после ввода антигена вводят 1 М этаноламин.
Для измерения кинетических параметров вводят двухкратные серийные разбавления Fab (от 0,78 нМ до 500 нМ) в PBS, содержащем 0,05% поверхностно-активного вещества TWEEN 20™ (PBST) при 25°С со скоростью потока приблизительно 25 мкл/мин. Скорость ассоциации (kon) и скорость диссоциации (koff) рассчитывают, используя простую модель связывания Ленгмюра один к одному (BIAcore® Evaluation Software version 3.2) путем одновременного подгона сенсограмм ассоциации и диссоциации. Равновесную константу диссоциации (Kd) рассчитывают как отношение ratio koff/kon. См., например, Chen et al., J. Mol. Biol. 293:865-881 (1999). Если on-скорость, определенная с помощью упомянутого выше метода поверхностного плазмонного резонанса, превышает 106 М-1 с-1, то данную скорость можно определить методом тушения флуоресценции, который позволяет измерять увеличение или уменьшение интенсивности эмиссии флуоресценции (длина волны возбуждения 295 нм; длина волны эмиссии 340 нм, полоса пропускания 16 нм) при 25°С и концентрации антитела против антигена 20 нМ (Fab-форма) в PBS, pH 7,2, в присутствии увеличивающихся концентраций антигена, определяемых с помощью спектрометра, такого как спектрофотометр с остановленным потоком (Aviv Instruments) или спектрофотометр SLM-Aminco серии 8000 (ThermoSpectronic) с кюветой, оборудованной мешалкой.
Термины "on-скорость", или "скорость ассоциации", или "ассоциативная скорость", или "kon", в соответствии с настоящим изобретением можно определять с помощью описанного выше метода поверхностного плазмонного резонанса с использованием BIACORE®-2000 или BIACORE®-3000 system (BIAcore, Inc., Piscataway, NJ).
Термины "клетка-хозяин", "линия клетка-хозяин" и "культура клетки-хозяина» используются взаимозаменяемо и относятся к клеткам, в которые была введена экзогенная нуклеиновая кислота, включая потомства таких клеток. Клетки-хозяева включают в себя "трансформантов" и "трансформированные клетки", которые включают первичную трансформированную клетку и потомство, выделенное из нее независимо от числа пассажей. Потомство не может быть полностью идентичным по содержанию нуклеиновых кислот на родительскую клетку, но могут содержать мутации. Мутантное потомство, которое имеет ту же функцию или биологическую активность, скринированное или отобранное для в первоначально трансформированной клетки включены в настоящем описании.
Термин «вектор», как используется в настоящем описании, относится к молекуле нуклеиновой кислоты, способной переносить связанную с ней другую нуклеиновую кислоту. Этот термин включает вектор как структуру самореплицирующейся нуклеиновой кислоты, а также вектор, инкорпорированный в геном клетки-хозяина, в которую он был введен. Некоторые векторы способны регулировать экспрессию нуклеиновых кислот, с которыми они функционально связаны. Такие векторы называют в настоящем описании "экспрессирующими векторами".
"Процент идентичности (%) аминокислотной последовательности" в применении к пептидной или полипептидной последовательности определяют как процент аминокислотных остатков в последовательности-кандидате, идентичных аминокислотным остаткам в идентифицированной пептидной или полипептидной последовательности, путем выравнивания последовательностей и, при необходимости, введения гэпов для получения максимального процента идентичности последовательности, причем консервативные замены не считают частью идентичности последовательности. Выравнивание последовательностей с целью определения процента идентичности аминокислотной последовательности можно осуществить разными способами, известными в данной области техники, например с помощью широко доступного программного обеспечения, такого, как BLAST, BLAST-2, ALIGN или Megalign (DNASTAR). Специалисты в данной области техники могут определить параметры, подходящие для проведения выравнивания, в том числе любые алгоритмы, необходимые для достижения максимального выравнивания по всей длине сравниваемых последовательностей. В целях настоящего изобретения значения % идентичности аминокислотных последовательностей получают с помощью компьютерной программы для сравнения последовательностей ALIGN-2. Компьютерная программа для сравнения последовательностей ALIGN-2 разработана Genentech, Inc., а исходный код, зарегистрирован с сопровождающей документацией в ведомстве по охране авторских прав США, Washington D.C., 20559, под номером TXU510087. Программа ALIGN-2 поставляется Genentech, Inc., South San Francisco, California, или ее можно компилировать из исходного кода. Программу ALIGN-2 можно скомпилировать для применения на операционной системе UNIX, предпочтительно цифровой UNIX V4.0D. Все параметры сравнения последовательностей определяются программой ALIGN-2 и не изменяются.
В тех случаях, когда используют ALIGN-2 для сравнения аминокислотных последовательностей, % идентичности аминокислотной последовательности данной аминокислотной последовательности А по сравнению или по отношению с данной последовательностью В, (или иначе можно сказать, что некоторая аминокислотная последовательность А содержит определенный % идентичности аминокислотной последовательности по сравнению с данной аминокислотной последовательностью В, или по отношению к данной аминокислотной последовательности В), рассчитывают следующим образом: в 100 умноженное на дробь X/Y, где X означает число аминокислотных остатков последовательности А, которые программа для сравнения последовательностей ALIGN-2 идентифицирует как идентичные соответствующим остаткам последовательности В, и где Y означает общее число аминокислотных остатков последовательности В. Следует учитывать, что если длина аминокислотной последовательности А не равна длине аминокислотной последовательности В, % идентичности аминокислотной последовательности А по отношению к В не равен % идентичности аминокислотной последовательности В по отношению к А. Если специально не указано иное, все значения % идентичности аминокислотной последовательности, используемые в настоящем описании, получены, как описано.
Термин "антибиотик типа рифамицина" означает класс или группу антибиотиков, имеющих структуру рифамицина, или структуру, подобную рифамицину.
При указании числа заместителей, термин "один или несколько" относится к диапазону от одного заместителя до максимально возможного числа замещений, т.е. от замены одного водорода до замены всех водородов заместителями. Термин "заместитель" обозначает атом или группу атомов, замещающих атом водорода исходной молекулы. Термин "замещенный" означает, что указанную группу несет один или несколько заместителей. Если какая-либо группа может нести несколько заместителей, и обеспечивается разнообразные возможных заместителей, заместители выбираются независимо и не должны быть одинаковыми. Термин "незамещенный" означает, что указанная группа не несет заместителей. Термин "необязательно замещенный" означает, что указанная группа является незамещенной или замещенной одним или несколькими заместителями, независимо выбранными, из группы возможных заместителей. При указании числа заместителей, термин "один или несколько" означает от одного заместителя до максимально возможного числа замещений, т.е. от замены одного водорода до замены всех водородов заместителями.
Термин "алкил", используемый в настоящем описании, относится к насыщенному линейному или с разветвленному одновалентному углеводородному радикалу, содержащему от одного до двенадцати атомов углерода (С1-С12), где алкильный радикал может быть необязательно замещен независимо одним или несколькими заместителями, описанными ниже. В другом варианте осуществления алкильный радикал имеет от одного до восьми атомов углерода (C1-C8), или от одного до шести атомов углерода (C1-С6). Примеры алкильных групп включают, но не ограничиваются этим, метил (Me, -СН3), этил (Et, -СН2СН3), 1-пропил (н-Pr, н-пропил, СН2СН2СН3), 2-пропил (i-Pr, изо-пропил, -СН(СН3)2), 1-бутил (н-Bu, н-бутил, -СН2СН2СН2СН3), 2-метил-1-пропил (i-Bu, изо-бутил, -СН2СН(СН3)2), 2-бутил (s-Bu, втор-бутил, -СН(СН3)СН2СН3), 2-метил-2-пропил (трет-Bu, трет-бутил, -С(СН3)3), 1-пентил (н-пентил, СН2СН2СН2СН2СН3), 2-пентил (-СН(СН3)СН2СН2СН3), 3-пентил (-СН(СН2СН3)2), 2-метил-2-бутил (-СН(СН3)СН(СН3)2), 3-метил-2-бутил (-СН(СН3)СН(СН3)2), 3-метил-1-бутил (-СН2СН2СН(СН3)2), 2-метил-1-бутил (-СН2СН(СН3)СН2СН3), 1-гексил (-СН2СН2СН2СН2СН2СН3), 2-гексил (-СН(СН3)СН2СН2СН2СН3), 3-гексил (-СН(СН2СН3)(СН2СН2СН3)), 2-метил-2-пентил (-С(СН3)2СН2СН2СН3), 3-метил-2-пентил (-СН(СН3)СН(СН3)СН2СН3), 4-метил-2-пентил (-СН(СНз)СН2СН(СН3)2), 3-метил-3-пентил (-С(СН3)(СН2СН3)2), 2-метил-3-пентил (-СН(СН2СН3)СН(СН3)2), 2,3-диметил-2-бутил (-С(СН3)2СН(СН3)2), 3,3-диметил-2-бутил (-СН(СН3)С(СН3)3, 1-гептил, 1-октил и тому подобное.
Термин "алкилен", используемый в настоящем описании, относится к насыщенному линейному или разветвленному двухвалентному углеводородному радикалу, от одного до двенадцати атомов углерода (С1-С12), где алкиленовый радикал может быть необязательно замещен независимо одним или несколькими заместителями, описанными ниже. В другом варианте осуществления алкиленовый радикал содержит от одного до восьми атомов углерода (C1-C8), или от одного до шести атомов углерода (C1-С6). Примеры алкиленовых групп включают, но не ограничиваются этим, метилен (-СН2-), этилен (-СН2СН2-), пропилен (-СН2СН2СН2-), и тому подобное.
Термин "алкенил" относится к линейному или разветвленному одновалентному углеводородному радикалу, содержащему от двух до восьми атомов углерода (С2-C8) с по меньшей мере одним сайтом ненасыщенности, т.е. углерод-углеродной, sp2 двойной связью, в котором алкенильный радикал может быть необязательно замещенным независимо одним или несколькими заместителями, описанными в настоящем описании, и включает в себя радикалы, имеющие "цис" и "транс" ориентацию, или, альтернативно, "Е" и "Z" ориентацию. Примеры включают, но не ограничиваются этим, этиленил или винил (-СН=СН2), аллил (-СН2СН=СН2), и тому подобное.
Термин "алкенилен" относится линейному или разветвленному двухвалентному углеводородному радикалу, содержащему от двух до восьми атомов углерода (С2-С8) с по меньшей мере одним сайтом ненасыщенности, т.е. углерод-углеродной, sp2 двойной связью, в котором алкениленовый радикал может быть необязательно замещенным независимо одним или несколькими заместителями, описанными в настоящем описании, и включает в себя радикалы, имеющие "цис" и "транс" ориентацию, или, альтернативно, "Е" и "Z" ориентацию. Примеры включают, но не ограничиваются этим, этилэтилен или винилен (-СН=СН-), аллил (-СН2СН=СН-), и тому подобное.
Термин "алкинил" относится к линейному или разветвленному одновалентному углеводородному радикалу, содержащему от двух до восьми атомов углерода (С2-С8) с по меньшей мере одним сайтом ненасыщенности, т.е. углерод-углеродной, sp тройной связью, в котором алкинильный радикал может быть необязательно замещенным независимо одним или несколькими заместителями, описанными в настоящем описании. Примеры включают, но не ограничиваются этим, этинил (-С≡СН), пропинил (пропаргил, -СН2С≡СН), и тому подобное.
Термин "алкинилен" относится к линейному или разветвленному двухвалентному углеводородному радикалу, содержащему от двух до восьми атомов углерода (С2-С8) с по меньшей мере одним сайтом ненасыщенности, т.е. углерод-углеродной sp тройной связью, в котором алкиниленовый радикал может быть необязательно замещенным независимо одним или несколькими заместителями, описанными в настоящем описании. Примеры включают, но не ограничиваются этим, этинилен (-C≡С-), пропинилен (пропаргилен, -СН2С≡С-), и тому подобное.
Термины "карбоцикл", "карбоциклил", "карбоциклическое кольцо" и "циклоалкил" относится к одновалентному неароматическому, насыщенному или частично ненасыщенному кольцу, имеющему от 3 до 12 атомов углерода (С3-С12) в качестве моноциклического кольца или от 7 до 12 атомов углерода в качестве бициклического кольца. Бициклические карбоциклы, имеющие от 7 до 12 атомов могут быть аранжированы, например, как бицикло [4, 5], [5, 5], [5, 6] или [6, 6] системы, и бициклические карбоциклы, имеющие 9 или 10 атомов в цикле могут быть аранжированы как бицикло [5, 6] или [6, 6] системы, или как мостиковые системы, такие как бицикло [2.2.1] гептан, бицикло [2.2.2] октан и бицикло [3.2.2] нонан. Спиро фрагменты, также включены в объем этого определения. Примеры моноциклических карбоциклов включают, но не ограничиваются этим, циклопропан, циклобутил, циклопентил, 1-циклопент-1-енил, 1-циклопент-2-енил, 1-циклопент-3-енил, циклогексил, 1-циклогексен-1-енил, 1-циклогекс-2-енил, 1-циклогексен-3-енил, циклогексадиенил, циклогептил, циклооктил, циклононил, циклодецил, циклоундецил, циклододецил и тому подобное. Карбоциклильные группы необязательно замещены независимо одним или несколькими заместителями, описанными в настоящем описании.
"Арил" означает одновалентный ароматический углеводородный радикал-, содержащий 6-20 атомов углерода (С6-С20), полученный удалением одного атома водорода от одного атома углерода исходной ароматической циклической системы. Некоторые арильные группы представлены в примерах структур как "Ar". Арил включает бициклические радикалы, содержащие ароматическое кольцо, конденсированное с насыщенным, частично ненасыщенным кольцом или ароматическим карбоциклическим кольцом. Типичные арильные группы включают, но не ограничиваются этим, радикалы, полученные из бензола (фенил), замещенные бензолы, нафталин, антрацен, бифенил, инденил, инданил, 1,2-дигидронафталин, 1,2,3,4-тетрагидронафтил и тому подобное. Арильные группы необязательно замещены независимо одним или несколькими заместителями, описанными в настоящем описании.
"Арилен" означает двухвалентный ароматический углеводородный радикал, содержащий 6-20 атомов углерода (С6-С20), полученной удалением двух атомов водорода от двух атомов углерода исходной ароматической циклической системы. Некоторые ариленовые группы представлены в примерах структур как "Ar". Арилены включают бициклические радикалы, содержащие ароматическое кольцо, конденсированное с насыщенным, частично ненасыщенным кольцом или ароматическим карбоциклическим кольцом. Типичные ариленовые группы включают, но не ограничиваются этим, радикалы, полученные из бензола (фенилен), замещенные бензолы, нафталин, антрацен, бифенилен, инденелен, инденилен, 1,2-дигидронафталин, 1,2,3,4-тетрагидронафтил и тому подобное. Ариленовые группы необязательно замещены одним или несколькими заместителями, описанными в настоящем описании.
Термины "гетероцикл", "гетероциклил" и "гетероциклическое кольцо" используются в настоящем описании взаимозаменяемо и относятся к насыщенному или частично ненасыщенному (т.е. имеющему одну или несколько двойных и/или тройных связей в кольце) карбоциклическому радикалу из от 3 до около 20 кольцевых атомов, в котором по меньшей мере один кольцевой атом представляет собой гетероатом, выбранный из азота, кислорода, фосфора и серы, а остальные кольцевые атомы представляют собой С, где один или несколько кольцевых атомов необязательно замещен независимо одним или несколькими заместителями, описанными ниже. Гетероцикл может быть моноциклическим, имеющим 3-7 членные кольца (от 2 до 6 атомов углерода и от 1 до 4 гетероатомов, выбранных из N, О, Р, и S) или бицикл, имеющий от 7 до 10 членов в кольце (от 4 до 9 атомов углерода, и от 1 до 6 гетероатомов, выбранных из N, О, Р и S), например: бицикло [4, 5], [5, 5], [5, 6] или [6, 6] системы. Гетероциклы описаны в Paquette, Leo A.; "Principles of Modern Heterocyclic Chemistry" (W.A. Benjamin, New York, 1968), в частности, Chapters 1, 3, 4, 6, 7, и 9; "The Chemistry of Heterocyclic Compounds, A series of Monographs" (John Wiley & Sons, New York, 1950 по настоящее время), в частности, Volumes 13, 14, 16, 19, и 28; и J. Am. Chem. Soc. (1960) 82:5566. "Гетероциклил" включает также радикалы, где гетероциклические радикалы конденсированы с насыщенным, частично ненасыщенным кольцом или ароматическим карбоциклическим или гетероциклическим кольцом. Примеры гетероциклических колец включают, но не ограничиваются этим, морфолин-4-ил, пиперидин-1-ил, пиперазинил, пиперазин-4-ил-2-он, пиперазин-4-ил-3-он, пирролидин-1-ил, тиоморфолин-4-ил, S-диоксотиоморфолин-4-ил, азокан-1-ил, азетидин-1-ил, октагидропиридо[1,2-а]пиразин-2-ил, [1,4]диазепан-1-ил, пирролидинил, тетрагидрофуранил, дигидрофуранил, тетрагидротиенил, тетрагидропиранил, дигидропиранил, тетрагидротиопиранил, пиперидино, морфолино, тиоморфолино, тиоксанил, пиперазинил, гомопиперазинил, азетидинил, оксетанил, тиетанил, гомопиперидинил, оксепанил, тиепанил, оксазепинил, диазепинил, тиазепинила, 2-пирролинил, 3-пирролинил, индолинил, 2Н-пиранил, 4Н-пиранил, диоксанил, 1,3-диоксоланил, пиразолинил, дитианил, дитиоланил, дигидропиранил, дигидротиенил, дигидрофуранил, пимидазолинилиразонидинил, имидазолидинил, 3-азабицикло[3.1.0]гексанил, 3-азабицикло[4.1.0]гептанил, азабицикло[2.2.2]гексанил, 3Н-индолил хинолизинил и N-пиридилмочевины. Спиро фрагменты также включены в объем этого определения. Примеры гетероциклической группы, где 2 кольцевых атома замещены оксо (=О) фрагментами представляют собой пиримидиноил и 1,1-диоксо-тиоморфолинил. Эти гетероциклические группы в настоящем описании необязательно замещены независимо одним или несколькими заместителями, описанными в настоящем описании.
Термин "гетероарил" обозначает одновалентный ароматический радикал, содержащий от 5-, 6- или 7-членные кольца, и включает в себя системы конденсированных колец (по меньшей мере, одно из которых является ароматическим) из 5-20 атомами углерода, содержащими один или несколько гетероатомов, независимо выбранных из азота, кислорода и серы. Примерами гетероарильных групп являются пиридинил (в том числе, например, 2-гидроксипиридинил), имидазолил, имидазопиридинил, пиримидинил (в том числе, например, 4-гидроксипиримидинил), пиразолил, триазолил, пиразинил, тетразолил, фурил, тиенил, изоксазолил, тиазолил, оксадиазолил, оксазолил, изотиазолил, пирролил, хинолинил, изохинолинил, тетрагидроизохинолинил, индолил, бензимидазолил, бензофуранил, циннолинил, индазолил, индолизинил, фталазинил, пиридазинил, триазинил, изоиндолил, птеридинил, пуринил, оксадиазолил, триазолил, тиадиазолил, тиадиазолил, фуразанил, бензофуразанил, бензотиофенил, бензотиазолил, бензоксазолил, хиназолинил, хиноксалинил, нафтиридинил и фуропиридинил. Гетероарильные группы являются необязательно замещенными независимо одним или несколькими заместителями, описанными в настоящем описании.
Гетероциклические или гетероарильные группы могут быть соединены через атом углерода (углерод-связанные) или через атом азота (азот-связанные), где такое возможно. В качестве примера и без ограничения, углерод-связанные гетероциклы или гетероарилы связываются в положениях 2, 3, 4, 5 или 6 пиридина, в положении 3, 4, 5 или 6 пиридазина, в положении 2, 4, 5 или 6 пиримидина, в положении 2, 3, 5 или 6 пиразина, положении 2, 3, 4 или 5 фурана, тетрагидрофурана, тиофена, пиррола или тетрагидропиррола, в положении 2, 4 или 5 оксазола, имидазола или тиазола, в положении 3, 4 или 5 изоксазола, пиразола или изотиазола, в положении 2 или 3 азиридина, в положении 2, 3 или 4 азетидина, в положении 2, 3, 4, 5, 6, 7 или 8 хинолина или в положении 1, 3, 4, 5, 6, 7 или 8 изохинолина.
В качестве примера и без ограничения, азот-связанные гетероциклы или гетероарилы связываются в положении 1 азиридина, азетидина, пиррола, пирролидина, 2-пирролина, 3-пирролина, имидазола, имидазолидина, 2-имидазолина, 3-имидазолина, пиразола, пиразолина, 2-пиразолина, 3-пиразолина, пиперидина, пиперазина, индола, индолина, 1Н-индазола, в положении 2 изоиндола или изоиндолина, в положении 4 морфолина и в положении 9 карбазола или β-карболина.
"Метаболит" представляет собой продукт, образующийся в организме за счет метаболизма определенного соединения или его соли. Метаболиты соединения можно идентифицировать с помощью общепринятых методик, известных в данной области техники, и определять их активности с помощью испытаний, таких как описанные в настоящем описании. Такие продукты, например, могут быть результатом окисления, восстановления, гидролиза, амидирования, дезамидирования, этерификации, деэтерификации, ферментативного расщепления и т.п. вводимого соединения. Соответственно изобретение включает метаболиты соединений по данному изобретению, включая соединения, образующиеся в результате процесса контактирования соединения формулы I по настоящему изобретению с млекопитающим в течение периода времени, достаточного для образования его метаболического продукта.
Термин "фармацевтическая композиция" относится к препарату, который находится в такой форме, чтобы обеспечить биологическую активность активного ингредиента, содержащегося в нем, чтобы быть эффективным, и который не содержит дополнительных компонентов, которые проявляют недопустимую токсичность для субъекта, которому композиция будет вводиться.
"Стерильная" композиция является асептической или свободной от всех живых микроорганизмов и их спор.
"Стабильная" композиция представляет собой композицию, в которой белок сохраняет по существу свою физическую и химическую стабильность и целостность при хранении. Различные аналитические методы для измерения стабильности белка доступны в данной области техники и рассматриваются в Peptide and Protein Drug Delivery, 247-301, Vincent Lee Ed., Marcel Dekker, Inc., New York, New York, Pubs. (1991) и Jones. A. Adv. Drug Delivery Rev. 10: 29-90 (1993). Стабильность может быть измерена при выбранной температуре в течение выбранного периода времени. Для быстрого скрининга, препарат можно хранить при 40°С в течение от 2 недель до 1 месяца, после чего измеряется стабильность. Если композиция подлежит хранению при температуре 2-8°С, то как правило, композиция должна быть стабильной при температуре 30°С или 40°С по меньшей мере в течение 1 месяца и/или стабильной при 2-8°С по меньшей мере в течение 2-х лет. Если композиция подлежит хранению при 30°С, то как правило, композиция должна быть стабильной в течение по меньшей мере в течение 2-х лет при 30°С и/или стабильна при 40°С по меньшей мере в течение 6 месяцев. Например, степень агрегации при хранении может быть использована в качестве индикатора стабильности белка. Таким образом, "стабильная" композиция может быть композицией, в которой менее чем около 10% и предпочтительно менее чем около 5% белка присутствуют как агрегаты в композиции. В других вариантах осуществления может быть определено любое увеличение образования агрегатов во время хранения композиции.
"Изотоническая" композиция, представляет собой композицию, которая имеет по существу то же осмотическое давление, как у человеческой крови. Изотонические композиции, как правило, имеют осмотическое давление от около 250 до 350 мОсм. Термин "гипотоническая" описывает композицию с осмотическим давлением ниже, чем у человеческой крови. Соответственно, термин "гипертоническая" используется для описания композиции с осмотическим давлением выше, чем у человеческой крови. Изотоничность можно измерить, используя осмометр, например, на основе давление пара или на основе замораживания льда. Композиции по настоящему изобретению являются гипертонической в результате добавления соли и/или буфера.
"Носители", как используется в настоящем описании, включают фармацевтически приемлемые носители, вспомогательные вещества или стабилизаторы, которые являются нетоксичными для клетки или млекопитающего, будучи подвергнуты воздействию в используемых дозах и концентрациях. Часто физиологически приемлемый носитель представляет собой водный pH забуференный раствор. Примеры физиологически приемлемых носителей включают буферы, такие как фосфатный, цитратный и других органических кислот; антиоксиданты, включая аскорбиновую кислоту; низкомолекулярные полипептиды (менее чем около 10 остатков); белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как ЭДТА; сахарные спирты, такие как маннит и сорбит; солеобразующие противоионы, такие как натрий; и/или неионные поверхностно-активные вещества, такие как TWEEN®, полиэтиленгликоль (ПЭГ) и PLURONICS™.
"Фармацевтически приемлемый носитель" относится к ингредиенту в фармацевтической композиции, отличному активного ингредиента, который является нетоксичным для субъекта. Фармацевтически приемлемый носитель включает в себя, но не ограничивается этим, буфер, вспомогательное вещество, стабилизатор или консервант.
"Фармацевтически приемлемая кислота" включает неорганические и органические кислоты, которые являются нетоксичными в концентрации и способе, в которых они используются. Например, подходящие неорганические кислоты включают хлористоводородную, хлорную, бромистоводородную, иодистоводородную, азотную, серную, сульфоновую, сульфиновую, сульфаниловую, фосфорную, угольную и т.п. Подходящие органические кислоты включают линейные и разветвленные, ароматические, циклические, циклоалифатические, арилалифатические, гетероциклические, насыщенные, ненасыщенные, моно-, ди- и трикарбоновые, включая например, муравьиную, уксусную, 2-гликолевую, трифторуксусную, фенилуксусную, триметилуксусную, трет-бутилуксусную, антраниловую, пропановую, 2-оксипропановую, 2-оксопропановую, пропандиовую, циклопентанпропионовую, циклопентанпропионовую, 3-фенилпропионовую, бутановую, бутандиовую, бензойную, 3-(4-гидроксибензоил)бензойную, 2-ацетоксибензойную, аскорбиновую, коричную, лаурилсерную, стеариновую, муконовую, миндальную, янтарную, эмбоновую, фумаровую, яблочную, малеиновую, гидроксималеиновую, малоновую, молочную, лимонную, винную, гликолевую, глюконовую, глюконовую, пировиноградную, глиоксалевую, щавелевую, метансульфоновую, янтарную, салициловую, фталевую, пальмитиновую, тиоциановую, метансульфоновую, этансульфоновую, 1,2-этандисульфоновую, 2-гидроксиэтансульфоновую, бензолсульфоновую, 4-хлорбензолсульфокислоту, нафталин-2-сульфоновую, п-толуолсульфокислоту, камфорсульфоновую, 4-метилбицикло[2.2.2]-окт-2-ен-1-карбоновую, глюкогептоновую, 4,4'-метилен-3-(гидрокси-2-ен-1-карбоновую кислоту), гидроксинафтойную.
"Фармацевтически приемлемые основания" включают неорганические и органические основания, которые являются нетоксичными в концентрации и способе, в которых они используются. Например, подходящие основания включают основания, образованные из неорганических оснований, образуемые металлами, такими как литий, натрий, калий, магний, кальций, аммоний, железо, цинк, медь, марганец, алюминий, N-метилглюкамин, морфолин, пиперидин и органических нетоксичных оснований, включающих, первичные, вторичные и третичные амины, замещенные амины, циклические амины и основные ионообменные смолы, [например, N(R')4+ (где R' независимо представляет собой Н или С1-4алкил, например, аммоний, Трис)], например, изопропиламин, триметиламин, диэтиламин, триэтиламин, трипропиламин, этаноламин, 2-диэтиламиноэтанол, триметамин, дициклогексиламин, лизин, аргинин, гистидин, кофеин, прокаин, гидрабамин, холин, бетаин, этилендиамин, глюкозамин, метилглюкамин, теобромин, пурины, пиперазин, пиперидин, N-этилпиперидин, полиаминовые смолы и тому подобное. Особенно предпочтительными органическими нетоксичными основаниями являются изопропиламин, диэтиламин, этаноламин, триметиламин, дициклогексиламин, холин и кофеин.
Дополнительные фармацевтически приемлемые кислоты и основания, используемые в настоящем изобретении, включают такие, которые получены из аминокислот, например, гистидина, глицина, фенилаланина, аспарагиновой кислоты, глутаминовой кислоты, лизина и аспарагина.
"Фармацевтически приемлемые" буферы и соли включают соли, полученные как из кислоты, так и основно-аддитивные соли из указанных выше кислот и оснований. Конкретные буферы и/или соли включают гистидин, сукцинат и ацетат.
"Фармацевтически приемлемый сахар" представляет собой молекулу, которая в сочетании с представляющим интерес белком, значительно предотвращает или снижает химическую и/или физическую нестабильность белка при хранении. Когда препарат предназначен для лиофилизации, а затем восстановления, "фармацевтически приемлемые сахара" могут быть также известны как "лиопротекторы". Примеры Сахаров и их соответствующих сахарных спиртов включают: аминокислоты, такие как мононатрий глутамат или гистидин; метиламин, такой как бетаин; лиотропная соль, такая как сульфат магния; полиол, такой как трехатомный или сахарные спирты с более высокой молекулярной массой, например, глицерин, декстран, эритрит, глицерол, арабит, ксилит сорбит и маннит; пропиленгликоль; полиэтиленгликоль; PLURONICS®; и их комбинации. Дополнительные примеры лиопротекторов включают глицерин и желатин, и сахара мелибиозу, мелецитозу, раффинозу, стахиозу и маннотриозу. Примеры восстанавливающих сахаров включают глюкозу, мальтозу, лактозу, мальтулозу, изомальтулозу и лактулозу. Примеры нередуцирующих сахаров включают в себя нередуцирующие гликозиды полигидроксисоединений, выбранные из сахарных спиртов и других полиспиртов с прямой цепью. Предпочтительными сахарными спиртами являются моногликозиды, в частности соединения, полученные восстановлением дисахаридов, таких как лактоза, мальтоза, лактулоза и мальтулоза. Гликозидная боковая группа может быть либо глюкозидной, либо галактозидной. Дополнительными примерами сахароспиртов являются глюцит, мальтит, лактит и изомальтоза. Предпочтительными фармацевтически приемлемыми сахарами являются нередуцирующие сахара трегалоза или сахароза. Фармацевтически приемлемые сахара добавляли к композиции в "протективном количестве" (например, перед лиофилизацией), что означает, что белок по существу сохраняет свою физическую и химическую стабильность и целостность во время хранения (например, после восстановления и хранения).
"Разбавитель", представляющий интерес в настоящем описании, представляет собой разбавитель, который является фармацевтически приемлемым (безопасным и нетоксичным для введения человеку) и является полезным для получения жидкой композиции, такой как композиция, восстановленная после лиофилизации. Примеры разбавителей включают в себя стерильную воду, бактериостатическую воду для инъекции (BWFI), раствор с забуференным pH (например, забуференный фосфатом солевой раствор), стерильный физиологический раствор, раствор Рингера или раствор декстрозы. В альтернативном варианте осуществления разбавители могут включать в себя водные растворы солей и/или буферы.
"Консервант" представляет собой соединение, которое может быть добавлено к композициям в настоящем описании, чтобы уменьшить бактериальную активность. Добавление консерванта может, например, облегчать получение композиции для многоразового использования (мультидозируемой композиции). Примеры возможных консервантов включают в себя октадецилдиметилбензиламмоний хлорид, гексаметоний хлорид, бензалконий хлорид (смесь алкилбензилдиметиламмоний хлоридов, в которых алкильные группы являются длинноцепочечными, и бензэтоний хлорид). Другие типы консервантов включают в себя ароматические спирты, такие как фенол, бутиловый и бензиловый спирт, алкилпарабены, такие как метил- или пропилпарабен, катехин, резорцин, циклогексанол, 3-пентанол и м-крезол. Наиболее предпочтительным консервантом для данного изобретения является бензиловый спирт.
"Индивидуум" или "субъект" или "пациент" представляет собой млекопитающее. Млекопитающие включают, но не ограничиваются этим, домашних животных (например, коровы, овцы, кошки, собаки, лошади), приматов (например, людей и приматов, отличных от человека, таких как обезьяны), кроликов и грызунов (например, мышей и крыс). В некоторых вариантах осуществления индивидуумом или субъектом является человеком.
Используемый в настоящем описании термин "лечение" (и его грамматические варианты осуществления, такие как «лечить» или «лечение») относится к клиническому вмешательству, направленному на изменение естественного течение болезни индивидуума, ткани или клеток, которые лечат в течение клинической патологии. Желательные эффекты лечения включают в себя, но не ограничиваются этим, уменьшение скорости прогрессирования заболевания, облегчение или временное ослабление болезненного состояния, и ремиссия или улучшение прогноза, всех измеримых специалистом в данной области техники, таким как врач. В одном варианте осуществления лечение может означать предотвращение возникновения или рецидива заболевания, ослабление симптомов, уменьшение любых прямых или косвенных патологических последствий заболевания, предотвращение инфекции, уменьшение скорости прогрессирования инфекционного заболевания, улучшение или временное облегчение состояния заболевания и ремиссия или улучшение прогноза. В некоторых вариантах осуществления антитела по изобретению используется для задержки развития заболевания или замедления прогрессирования инфекционного заболевания.
Как используется в настоящем описании, "в сочетании с" относится к введению одного лечебного воздействия, в дополнение к другим методам лечения. Таким образом, "в сочетании с" относится к введению одного лечебного воздействия до, во время или после введения другого метода лечения для человека.
Термин "фагосома" относится к интернализованному мембраноокруженному эндоцитозному пузырьку фагоцитирующей клетки. Фагосома может быть инициирована посредством прямого, антителозависимого или комплемент-опосредованного фагоцитоза. Термин "фаголизосомы" относится к интернализированным клеточным пузырькам, которые сливаются с одной или несколькими лизосомами.
Бактерии традиционно делятся на две основные группы, грамположительные (Gm+) и грамотрицательные (Gm-), на основе их удерживания красителя по Граму. Грамположительные бактерии окружены единственной липидной мембраной, и они обычно содержат толстый слой (20-80 нм) пептидогликана, ответственного за сохранение окрашивания по Граму. Грамположительные бактерии являются бактериями, которые окрашиваются в темно-синий или фиолетовый цвет окрашиванием по Граму. В противоположность этому, грамотрицательные бактерии, не могут сохранить окрашивание кристаллическим фиолетовым, вместо этого поглощая контрастный краситель (сафранин или фуксин), и проявляясь красным или розовым. Клеточные стенки грамположительных бактерий, как правило, не имеют внешнюю мембрану, характерную для грам-отрицательных бактерий.
Термин "бактериемия" относится к присутствию бактерий в крови, которое обычно детектируется посредством посева крови. Бактерии могут попадать в кровоток, как серьезные осложнения инфекций (например, пневмонии или менингита), во время операции (особенно, когда это касается слизистых оболочек, таких как желудочно-кишечного тракта), или из-за катетеров и инородных тел, попадающих в артерии или вены. Бактериемия может иметь несколько последствий. Иммунный ответ на бактерии может вызывать сепсис и септический шок, который имеет относительно высокую смертность. Бактерии могут также использовать кровь для распространения на другие части тела, вызывая инфекции в отдалении от первоначального очага инфекции. Примеры включают в себя эндокардит или остеомиелит.
"Терапевтически эффективное количество" означает минимальную концентрацию, необходимую для осуществления измеримого улучшения конкретного расстройства. Терапевтически эффективное количество в настоящем описании может меняться в зависимости от таких факторов, как состояние болезни, возраст, пол и масса пациента, а также от способности антитела вызывать желаемый ответ у индивидуума. Терапевтически эффективное количество также представляет собой количество, при котором любые токсические или вредные эффекты антитела перевешиваются терапевтически благоприятными эффектами. В одном варианте осуществления изобретения терапевтически эффективное количество представляет собой количество, эффективное для снижения бактериемии при инфекции in vivo. В одном аспекте "терапевтически эффективное количество" представляет собой по меньшей мере такое количество, которое эффективно уменьшает бактериальную нагрузку или колониеобразующие единицы (КОЕ) в образцах, выделенных из пациента, таких как кровь, по меньшей мере на одну единицу log по отношению к образцу перед введением лекарственного средства. В более конкретном аспекте уменьшение составляет по меньшей мере 2 единицы log. В другом аспекте уменьшение составляет 3, 4, 5 единиц log. В еще одном аспекте это уменьшение ниже уровней обнаружения. В другом варианте осуществления терапевтически эффективное количество представляет собой количество ААС в одной или нескольких дозах, вводимых в течение всего периода лечения, которые обеспечивают отрицательный посев крови (то есть, отсутствует рост бактерий, которые являются мишенью ААС) по сравнению с положительным посевом крови до или в начале лечения инфицированного пациента.
"Профилактически эффективное количество" относится к количеству, эффективному в дозах и в течение периодов времени, необходимых для достижения желаемого профилактического результата. Обычно, но не обязательно, так как профилактическую дозу используют у субъектов заранее, на более ранней стадии болезни, или даже перед воздействием условий, где риск заражения повышен, профилактически эффективное количество может быть меньше, чем терапевтически эффективное количество. В одном варианте осуществления профилактически эффективное количество является по меньшей мере количеством, эффективным для уменьшения, предотвращения возникновения или распространения инфекции от одной клетки к другой.
"Хроническое" введение относится к введению лекарственного средства(в) в непрерывном, в отличие от острого режиме, с тем чтобы сохранить первоначальный терапевтический эффект (активность) в течение продолжительного периода времени. "Дробное" введение представляет собой лечение, которое проводят не последовательно, без перерыва, а которое имеет циклический характер.
Термин "вкладыш в упаковку" используется для обозначения инструкций, обычно включаемых в коммерческие упаковки терапевтических продуктов, которые содержат информацию о показаниях, использовании, дозировки, введении, комбинированной терапии, противопоказаниях и/или предупреждениях, касающихся применения таких терапевтических продуктов.
Термин "хиральный" относится к молекулам, которые обладают свойством несовместимости с зеркальным отображением, в то время как термин "ахиральный" относится к молекулам, которые совмещаются со своим зеркальным отображением.
Термин "стереоизомеры" относится к соединениям, которые имеют одинаковую химическую структуру, но отличаются по расположению атомов или групп в пространстве.
"Диастереомер" относится к стереоизомеру с двумя или несколькими хиральными центрами и, молекулы которых не являются зеркальным отображением друг друга. Диастереомеры обладают различными физическими свойствами, например точки плавления, точки кипения, спектральными свойствами и реакционной способностью. Смеси диастереомеров можно разделить посредством аналитических процедур с высоким разрешением, таких как электрофорез и хроматография.
"Энантиомеры" относятся к двум стереоизомерным соединениям, которые совпадают при наложении с зеркальным отражением.
Стереохимические определения и соглашения, используемые в настоящем документе, как правило, следуют из S.P. Parker, Ed., McGraw-Hill Dictionary of Chemical Terms (1984) McGraw-Hill Book Company, New York; и Eliel, E. and Wilen, S., Stereochemistry of Organic Compounds (1994) John Wiley & Sons, Inc., New York. Многие органические соединения существуют в оптически активных формах, т.е., они обладают способностью вращать плоскость плоско-поляризованного света. При описании оптически активного соединения используются префиксы D и L или R и S, для обозначения абсолютной конфигурации молекулы относительно ее хирального центра (ов). Префиксы d и l или (+) и (-) используются для обозначения знака вращения плоскополяризованного света соединением, причем (-) или 1 означает, что соединение является левовращающим. Соединение с префиксом (+) или d является правовращающим. Для данной химической структуры эти стереоизомеры являются идентичными за исключением тою, что они являются зеркальными отражениями друг друга. Конкретный стереоизомер может также называться энантиомером, и смесь таких изомеров часто называют энантиомерной смесью. Смесь энантиомеров 50:50 называют рацемической смесью или рацематом, которая может встречаться там, где не было никакой стереоселективности или стереоспецифичности в химической реакции или процессе. Термины "рацемическая смесь" и "рацемат" относятся к эквимолярной смеси двух энантиомерных видов, которая лишена оптической активности.
Термин "защитная группа" относится к заместителю, который обычно используют для блокирования или защиты конкретной функциональности в процессе взаимодействия других функциональных групп на соединении. Например, "амино-защитная группа" обозначает заместитель, присоединенный к аминогруппе, который блокирует или защищает функциональную аминогруппу в соединении. Подходящие защитные для аминогруппы группы включают, но не ограничиваются этим, ацетил, трифторацетил, трет-бутоксикарбонил (ВОС), бензилоксикарбонил (CBZ) и 9-флуоренилметиленоксикарбонил (Fmoc). Для общего описания защитных групп и об их использовании см. Т.W. Greene, Protective Groups in Organic Synthesis, John Wiley & Sons, New York, 1991, или более позднее издание.
Термин "около", используемый в настоящем описании, относится к обычному диапазону ошибок для соответствующего значения, хорошо известному специалисту в данной области техники. Ссылка на "около" значения или параметра в настоящем описании включает (и описывает) варианты осуществления, которые указывают на это значение или параметр как таковой.
Как используются в настоящем описании и в прилагаемой формуле изобретения, формы единственного числа "a", "an" и "the" включают и множественное число, если в контексте ясно не указано иное. Например, ссылка на «антитело» представляет собой ссылку на одно из многих антител, таких как молярные количества, и включает в себя их эквиваленты, известные специалистам в данной области техники, и так далее.
II. КОМПОЗИЦИИ И СПОСОБЫ
КОНЪЮГАТЫ АНТИТЕЛО-АНТИБИОТИК (ААС)
Соединения ААС по настоящему изобретению включают в себя соединения с антибактериальной активностью, эффективные против ряда патогенов человека и ветеринарных грамположительных, грамотрицательных патогенов, в том числе стафилококков. В иллюстративном варианте осуществления соединения ААС включают конъюгированное рекомбинантное антитело, модифицированное цистеином, т.е., ковалентно присоединенное посредством линкера, к фрагменту антибиотика, выбранного из клиндамицина, новобиоцина, ретапамулина, даптомицина, GSK-2140944, CG-400549, ситафлоксацина, тейкопланина, триклозана, нафтиридона, радезолида, доксорубицина, ампициллина, ванкомицина, имипенема, дорипенема, гемцитабина, далбавацина и азитромицина. Биологическая активность фрагмента антибиотика модулируется посредством конъюгации с антителом. Конъюгаты антитела-антибиотик (ААС) по изобретению селективно доставляют эффективную дозу антибактериального средства к сайту инфекции в результате чего приводит к более высокой селективности, т.е. при увеличении терапевтического индекса ("терапевтического окна») может быть достигнута более низкая эффективная доза
Изобретение обеспечивает новую антибактериальную терапию, которая направлена на предотвращение уклонения от антибиотика, посредством нацеливания на популяции бактерий, которые уклоняются от обычной терапии антибиотиками. Новая антибактериальная терапия достигается посредством конъюгата антитело-антибиотик (ААС), в котором антитело, специфичное в компонентам клеточной стенки, найденным на S. aureus (включая MRSA) химически связывают с мощным антибиотиком. Антибиотик соединяется с антителом с помощью расщепляемого протеазой пептидного линкера, который предназначен для расщепления катепсином В, лизосомальной протеазой, найденной в большинстве типов клеток млекопитающих (Dubowchik et al (2002) Bioconj. Chem. 13:855-869). ААС действует как пролекарство, в котором антибиотик не активен (из-за большого размера антитела) до тех пор, пока линкер не будет расщеплен. Постольку поскольку значительная часть S. aureus, обнаруживаемых при естественной инфекции поглощаются клетками-хозяевами, в первую очередь нейтрофилами и макрофагами, в некоторый момент течения инфекции у хозяина, и во время, проведенное внутри клетки-хозяева обеспечивают широкую возможность для бактерии, чтобы уклониться от антибиотической активности. ААС по изобретению предназначены для связывания с S. aureus и освобождению антибиотика внутри фаголизосомы после того, как бактерии поглощаются клетками-хозяевами. Благодаря этому механизму ААС способны концентрировать активный антибиотик специфически в местах, где S. aureus плохо доступен для обычных антибиотиков. В то время как изобретение не ограничивается или определяется посредством конкретных механизмов действия, ААС улучшает антибиотической активность по трем потенциальным механизмам: (1) ААС доставляет антибиотик внутрь клеток млекопитающих, которые поглотили бактерии, тем самым увеличивай эффективность антибиотиков, которые слабо диффундируют в фаголизосомы, где бактерии изолированы. (2) ААС опсонизируют бактерии - тем самым увеличивая поглощение свободных бактерий фагоцитами - и высвобождают антибиотик локально, чтобы убить бактерии, пока они изолированы в фаголизосах. (3) ААС улучшают период полураспада антибиотиков in vivo (улучшают фармакокинетику), связывая антибиотик с антителом. Улучшенная фармакокинетика ААС способна доставлять достаточно антибиотика в места, где S. aureus концентрируется при ограничении общей дозы антибиотика, который должен вводиться системно. Это свойство должно способствовать долгосрочной терапии с помощью ААС для нацеливания на хроническую инфекцию с минимальными побочными эффектами антибиотиков.
Настоящая заявка описывает генерацию новых терапевтических агентов - конъюгированных анти-WTA антител и их использование в лечении инфекций грамположительных (Gm+) бактерий, включая инфекции S. aureus. Эти антитела способны нацеливаться на популяции Gm+ бактерий, которые уклоняются от обычной антибиотикотерапии.
Соединение конъюгат антитело-антибиотик по настоящему изобретению содержит антитело против стеночной тейхоевой кислоты бета (WTA бета), ковалентно связанное с помощью пептидного линкера с антибиотиком, выбранного из клиндамицина, новобиоцина, ретапамулина, даптомицина, GSK-2140944, CG-400549, ситафлоксацина, тейкопланина, триклозана, нафтиридона, радезолида, доксорубицина, ампициллина, ванкомицина, имипенема, дорипенема, гемцитабина, далбавацина и азитромицина.
В одном варианте осуществления конъюгат антитело-антибиотик имеет формулу:
в которой:
Ab представляет собой антитело против стеночной тейхоевой кислоты;
L представляет собой пептидный линкер, имеющий формулу:
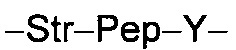
где Str представляет собой растяжимый участок; Pep представляет собой пептид от двух до двенадцати аминокислотных остатков, и Y представляет собой спейсерный участок;
abx представляет собой антибиотик; а
p означает целое число от 1 до 8.
Количество фрагментов антибиотика, которые могут быть конъюгированы посредством реакционноспособного линкерного фрагмента с молекулой антитела, может быть ограничено числом свободных остатков цистеина, которые вводятся с помощью методов, описанных в настоящем описании. Иллюстративный ААС формулы I поэтому содержит антитела, которые имеют 1, 2, 3, или 4 аминокислоты цистеин, вставленные рекомбинантными методами. (Lyon, R. et al (2012) Methods in Enzym. 502:123-138).
АНТИТЕЛА ПРОТИВ СТЕНОЧНОЙ ТЕЙХОЕВОЙ КИСЛОТЫ (WTA)
В настоящем описании раскрываются некоторые анти-WTA антитела и конъюгированные анти-WTA антитела, которые связываются с WTA, экпрессирующимися на ряде Gm+ бактерий, включая Staphylococcus aureus. Анти-WTA антитела могут выбираться и производится с помощью методов, представленных в патенте США 8283294; Meijer PJ et al (2006) J Mol Biol. 358(3):764-72; Lantto J, et al (2011) J Virol. 85(4): 1820-33, и в примере 21 ниже. Изобретение обеспечивает композиции этих анти-WTA антител.
Клеточная стенка грамположительных бактерий состоит из толстой оболочки нескольких пептидогликанновых (PGN) слоев, которые не только стабилизируют клеточные мембраны, но также обеспечивают множество сайтов, к которым другие молекулы могут присоединяться (Фиг.3). Основным классом этих гликопротеинов клеточной поверхности являются тейхоевые кислоты ("ТА"), которые представляют собой молекулы богатые фосфатами, найденных на многих белках, связывающих гликаны (GPB). ТА бывают двух типов: (1) липотейхоевая кислота ("LTA"), которая заякорена в плазматической мембране и простирается от клеточной поверхности в пептидогликановый слой; и (2) стеночная ТА (WTA), которая ковалентно присоединена к пептидогликану и простирается через клеточную стенку и за ее пределами (Фиг. 3). WTA может составлять более чем 60% от общей массы клеточной стенки в GPB. В результате она представляет собой высоко экспрессированный антиген клеточной поверхности.
Химические структуры WTA различаются среди организмов. В S. aureus WTA ковалентно связана с 6-ОН N-ацетилмурамовой кислотой (MurNAc) через дисахарид, состоящий из N-ацетилглюкозамина (GlcNAc)-1-Р и N-ацетилманнозамина (ManNAc), за которым следует около двух или трех единиц глицеринфосфатов (Фиг. 4). Полноразмерный полимер WTA состоит из примерно 11-40 рибитфосфатных (Rbo-P) повторяющихся звеньев. Ступенчатой синтез WTA сначала инициируется посредством фермента, обозначаемого как TagO, а штаммы S. aureus с отсутствующим геном TagO (посредством делеции гена) не вырабатывают какого-либо WTA. Повторяющиеся единицы могут быть дополнительно надстраиваться D-аланином (D-Ala) в С2-ОН и/или N-ацетилглюкозамином (GlcNAc) в положении С4-ОН через α-(альфа) или β-(бета) гликозидные связи. В зависимости от штамма S. aureus, или фазы роста бактерий гликозидные связи могут быть α-, β-, или смесью двух аномеров. Эти модификации сахара GlcNAc надстраиваются посредством двух специфических гликозилтрансфераз (Gtfs), полученных из S. aureus; Tarm Gtf опосредует α-гликозидные связи, в то время как TarS Gtfs опосредует β(бета) гликозидные связи.
Принимая во внимание убедительное доказательство того, что внутриклеточный пул MRSA защищен от антибиотиков, были разработаны новые терапевтические композиции в соответствие с настоящим изобретением, чтобы предотвратить этот способ избегания от антибиотика с помощью специфического антитела к S. aureus для присоединения антибиотика к бактерии таким образом, что, когда бактерии поглощается или иным интернализуется клеткой-хозяином in vivo, она проносит антибиотик в клетку-хозяина.
В одном аспекте настоящее изобретение обеспечивает анти-WTA антитела, которые представляют собой анти-WTAα или анти-WTAβ антитела. В другом аспекте настоящее изобретение обеспечивает анти-Staph aureus антитела. В качестве примера антитела были клонированы из В-клеток от пациентов, инфицированных S. aureus (как описано в примере 21). В одном варианте осуществления анти-WTA и анти-Staph aureus антитела представляли собой человеческие моноклональные антитела. Изобретение охватывает химерные антитела и гуманизированные антитела, содержащие CDR существующих WTA антител.
Для терапевтического применения WTA антитела по изобретению для конъюгации с антибиотиками для получения ААС, могут быть любого изотипа кроме IgM. В одном варианте осуществления WTA антитела представляют собой изотип IgG человека. В более конкретных вариантах осуществления WTA антитела представляют собой IgG1 человека.
Фиг. 6А и 6Б перечисляют антитела, которые являются анти-WTAα или анти-WTAβ. В заявке и чертежах антитела, обозначаемые посредством 4-значного номера (например, 4497), также могут быть обозначаться с предшествующим "S", например, S4497; оба наименования относятся к тому же антителу, которое представляет немодифицированную последовательность антитела дикого типа (WT). Варианты антитела обозначаются "v" после номера антитела, например, 4497.v8. Если не указано иное (например, посредством номера варианта), аминокислотные последовательности, указаны оригинальные, немодифицированные/неизмененные последовательности. Эти антитела могут быть изменены в одном или нескольких остатках, например, для улучшения pK, стабильности, экспрессии, технологичности (например, как описано в приведенных ниже примерах), при сохранении в основном, практически такой же или улучшенной аффинности связывания с антигеном, по сравнению с немодифицированным антителом дикого типа. Варианты настоящих антител WTA, имеющих консервативные аминокислотные замены, охватываются настоящим изобретением. Ниже, если не указано иное, нумерация CDR соответствует нумерации Kabat, а нумерации константного домена соответствует с нумерации EU.
Фиг. 13А и 13В обеспечивают выравнивание аминокислотных последовательностей вариабельных областей легкой цепи (VL) и вариабельной области тяжелой цепи (VH), соответственно для четырех человеческих антител анти-WTA альфа. В CDR последовательностей CDR L1, L2, L3 и CDR H1, Н2, Н3, приведенные согласно нумерации Kabat, подчеркнуты.
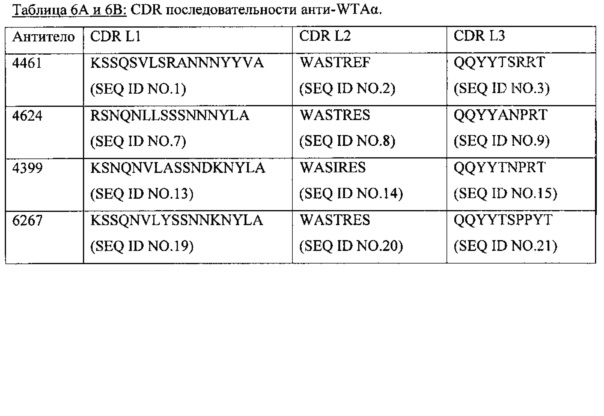
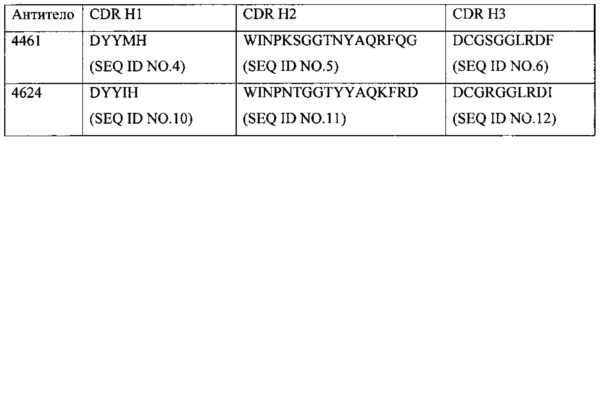

Последовательности каждой пары VL и VH представляют собой следующее:
4461 вариабельная область легкой цепи
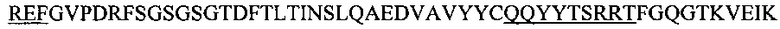 (SEQ ID NO. 25)
(SEQ ID NO. 25)
4461 вариабельная область тяжелой цепи
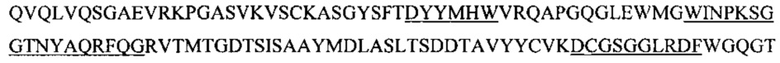
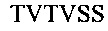 (SEQ ID NO. 26)
(SEQ ID NO. 26)
4624 вариабельная область легкой цепи

 (SEQ ID NO. 27)
(SEQ ID NO. 27)
4624 вариабельная область тяжелой цепи

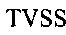 (SEQ ID NO. 28)
(SEQ ID NO. 28)
4399 вариабельная область легкой цепи
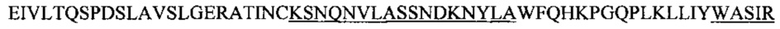
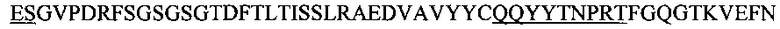 (SEQ ID NO. 29)
(SEQ ID NO. 29)
4399 вариабельная область тяжелой цепи

 (SEQ ID NO. 30)
(SEQ ID NO. 30)
6267 вариабельная область легкой цепи
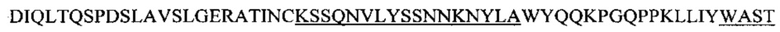
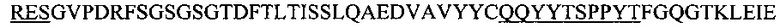 (SEQ ID NO. 31)
(SEQ ID NO. 31)
6267 вариабельная область тяжелой цепи
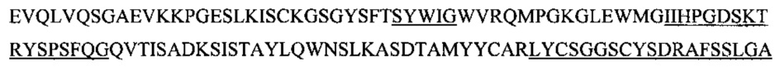
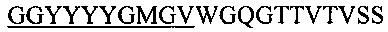 (SEQ ID NO. 32).
(SEQ ID NO. 32).
Настоящее изобретение обеспечивает изолированное моноклональное антитело, которое связывается со стеночной тейхоевой кислотой (WTA), содержащее легкую цепь и Н-цепь, причем L-цепь, содержит CDR L1, L2, L3, и Н-цепь, содержит CDR H1, Н2, Н3, в которых CDR L1, L2, L3 и H1, Н2, Н3, содержат аминокислотные последовательности из CDR, каждого из антител 4461 (SEQ ID NO. 1-6), 4624 (SEQ ID NO. 7-12), 4399 (SEQ ID NO. 13-18) и 6267 (SEQ ID NO. 19-24), соответственно, как показано в таблице 6А и 6В.
В другом варианте осуществления изолированное моноклональное антитело, которое связывает WTA, содержит вариабельную область Н-цепи (VH) и вариабельную область L-цепи (VL), в которых VH содержит последовательность, идентичную по меньшей мере на 95% по длине последовательности VH области каждого из антител 4461, 4624, 4399 и 6267, соответственно. В еще одном конкретном аспекте идентичность последовательности составляет 96%, 97%, 98%, 99% или 100%.
Настоящее изобретение также обеспечивает антитела анти-WTA бета, содержащие CDR последовательности L и Н-цепи, как показано на Фиг. 14. В одном варианте осуществления изолированные моноклональные антитела анти-WTA бета содержат CDR L1, L2, L3 и H1, Н2, Н3, выбранные из группы, состоящей из CDR каждого из 13 антител на Фиг. 14. В другом варианте осуществления настоящее изобретение обеспечивает изолированные антитела анти-WTA бета, содержащие последовательность, идентичную по меньшей мере на 95% по длине доменов V области каждого из 13 антител. В еще одном конкретном аспекте идентичность последовательности составляет 96%, 97%, 98%, 99% или 100%.
Из 13 антител анти-WTA бета, 6078 и 4497 были модифицированы, чтобы создать варианты i), имеющие Cys, введенные с помощью генетической инженерии, в одну или обе L и Н-цепи для конъюгации промежуточным соединением линкер-антибиотик, и ii) в которых первый остаток Q в Н-цепи был бы заменен на Е (v2) или первые два остатка QM были заменены на EI или EV (v3 и v4).
Фиг. 15А-1 и 15А-2 обеспечивают аминокислотную последовательность полной длины L-цепи антитела 6078 (немодифицированного) анти-WTA бета и его варианты v2, v3, v4. Варианты L-цепи, которые содержат Cys, включенный посредством генетической инженерии, обозначены как С в черный прямоугольнике в конце константной области (по EU остаток no. 205 в данном случае). Вариант обозначения, например, v2LC-Cys означает вариант 2, содержащий Cys, включенный посредством генетической инженерии, в L-цепи. HCLC-Cys означает как Н, так и L-цепи антитела содержат Cys, включенный посредством генетической инженерии. Фиг. 15В-1 - 15В-4 показывают выравнивание полноразмерной Н-цепи антитела 6078 (немодифицированный) анти-WTA бета и его варианты v2, v3, v4, которые имеют замены первого или первых двух остатков Н-цепи. Варианты Н-цепи, которые содержат Cys, включенный посредством генетической инженерии, обозначены как С в черном прямоугольнике в конце константной области (по EU остаток no. 118).
6078 вариабельная область легкой цепи (VL)
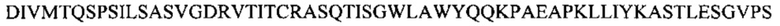
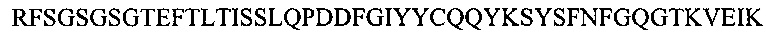 (SEQ ID NO. 111)
(SEQ ID NO. 111)
6078 вариабельная область тяжелой цепи (VH)

6078 легкая цепь

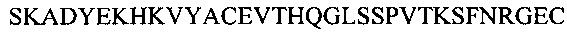 (SEQ ID NO. 113)
(SEQ ID NO. 113)
6078 Цистеин-модифицированная легкая цепь
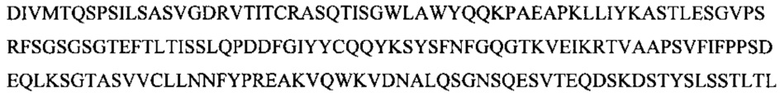
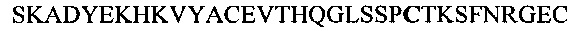 (SEQ ID NO. 115)
(SEQ ID NO. 115)
6078 Тяжелая цепь WT полной длины

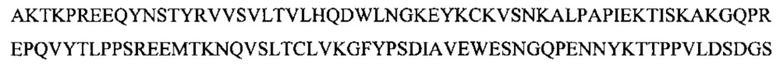
 (SEQ ID NO. 114)
(SEQ ID NO. 114)
6078 вариант (v2, v3 или v4) тяжелой цепи полной длины,

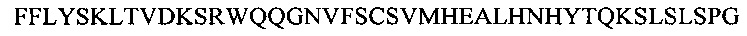 (SEQ ID NO. 116) в
(SEQ ID NO. 116) в
котором X может быть М, I или V.
6078 вариант (v2, v3 или v4), Cys-модифицированная тяжелая цепь

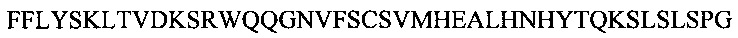 (SEQ ID NO. 117) в котором X означает М, I или V.
(SEQ ID NO. 117) в котором X означает М, I или V.
В одном варианте осуществления настоящее изобретение обеспечивает изолированное антитело анти-WTA бета, содержащее тяжелую цепь и легкую, где тяжелая цепь содержит VH, имеющий последовательность, идентичную SEQ ID NO. 112 по меньшей мере на 95%. В дополнительном варианте осуществления это антитело дополнительно содержит VL, имеющий последовательность, идентичную SEQ ID NO. 111 по меньшей мере но 95%. В конкретном варианте осуществления антитело анти-WTA бета содержит легкую цепь и тяжелую цепь, в которой L-цепь содержит VL SEQ ID NO. 111 и Н-цепь содержит VH SEQ ID NO. 112. В еще более конкретном варианте осуществления изолированное антитело анти-WTA бета содержит L-цепь SEQ ID NO. 113 и Н-цепь SEQ ID NO. 114.
Варианты 6078 Cys-модифицированных Н и L-цепей могут быть спарены в любой из следующих комбинаций для формирования полных антител, конъюгированных с промежуточным соединением линкер-Abx, чтобы генерировать ААС анти-WTA по изобретению. Немодифицированная L-цепь (SEQ ID NO. 113) может быть спарена с Cys-модифицированным вариантом SEQ ID NO. 117 Н-цепи; вариант может быть вариантом, где X представляет собой М, I или V. Cys-модифицированная L-цепь SEQ ID NO. 115 может быть спарена с: Н-цепью SEQ ID NO. 114; вариантом Н цепи SEQ ID NO. 116 или вариантом Cys-модифицированной Н-цепи SEQ ID NO. 117 (в этой версии, как Н, так и L-цепей модифицированы Cys, посредством генетической инженерии). В конкретном варианте осуществления антитело анти-WTA бета и ААС анти-WTA бета по изобретению содержат L-цепь SEQ ID NO. 115 и Н-цепь SEQ ID NO. 116.
Фиг. 16А-1 и 16А-2 обеспечивают L-цепь полной длины антитела 4497 анти-WTA бета (немодифицированное) и его варианты v8. Варианты L-цепи, которые содержат Cys, включенный посредством генетической инженерии, обозначены как С в черном прямоугольнике на конце константной области (остаток по EU no. 205). Фиг. 16В-1, 16В-2, 16В-3 показывают выравнивание полноразмерной Н-цепи антитела 4497 анти-WTA бета (немодифицированный) и его варианта v8 с D замененной на Е в CDR Н3 в положении 96, с или без Cys, включенного посредством генетической инженерии. Варианты Н-цепи, которые содержат Cys, включенный посредством ген генетической инженерии, обозначены как С в черном прямоугольнике в конце константной области (остаток по EU no. 118 в данном случае). Немодифицированный CDR H3 представляет собой GDGGLDD (SEQ ID NO. 104); 4497v8 CDR Н3 представляет собой GDGGLDD (SEQ ID NO. 118).
4497 вариабельная область легкой цепи
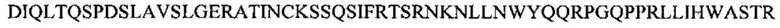
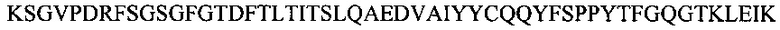 (SEQ ID NO. 119)
(SEQ ID NO. 119)
4497 вариабельная область тяжелой цепи

 (SEQ ID NO. 120)
(SEQ ID NO. 120)
4497.v8 вариабельная область тяжелой цепи

 (SEQ ID NO. 156)
(SEQ ID NO. 156)
4497 легкая цепь

 (SEQ ID NO. 121)
(SEQ ID NO. 121)
4497 v.8 тяжелой цепи

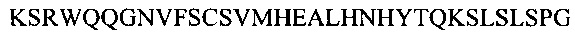 (SEQ ID NO. 122)
(SEQ ID NO. 122)
4497 легкая цепь, модифицированная Cys
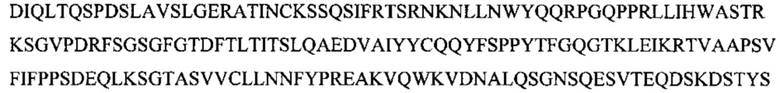
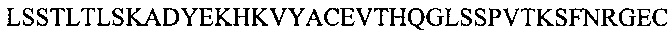 (SEQ ID NO. 123)
(SEQ ID NO. 123)
4497.v8- тяжелая цепь v8

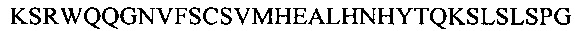 (SEQ ID NO. 157)
(SEQ ID NO. 157)
4497.v8 тяжелая цепь, модифицированная Cys v8


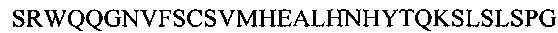 (SEQ ID NO. 124)
(SEQ ID NO. 124)
Другое изолированное антитело анти-WTA бета, обеспечиваемое посредством настоящего изобретения, содержит тяжелую цепь и легкую, где тяжелая цепь содержит VH, имеющую последовательность, идентичную SEQ ID NO. 120 по меньшей мере на 95%. В дополнительном варианте осуществления это антитело дополнительно содержит VL, имеющую последовательность, идентичную SEQ ID NO. 119 по меньшей мере на 95%. В конкретном варианте осуществления антитело анти-WTA бета содержит легкую цепь и тяжелую цепь, где L-цепь содержит VL SEQ ID NO. 119 и Н-цепь содержит VH SEQ ID NO. 120. В еще более конкретном варианте осуществления изолированное антитело анти-WTA бета содержит L-цепь SEQ ID NO. 121 и Н-цепь SEQ ID NO. 122.
4497 Cys-модифицированные варианты Н и L-цепей могут быть спарены в любой из следующих комбинаций для формирования полных антител для конъюгирования с промежуточным соединением линкер-Abx, чтобы генерировать ААС анти-WTA по изобретению. Немодифицированная L-цепь (SEQ ID NO. 121) может быть спарена с Cys-модифицированным вариантом Н-цепи SEQ ID NO. 124. Cys-модифицированная L-цепь SEQ ID NO. 123 может быть спарена с: вариантом Н-цепи SEQ ID NO. 157; или Cys-модифицированным вариантом Н-цепи SEQ ID NO. 124 (в этой версии как Н, так и L-цепи содержат Cys, включенный посредством генетической инженерии). В конкретном варианте осуществления антитело анти-WTA бета и ААС анти-WTA бета по изобретению содержат L-цепь SEQ ID NO. 123.
Еще один вариант осуществления представляет собой антитело, которое связывается с тем же эпитопом, как каждый из антител анти-WTA альфа на Фиг. 13А и Фиг. 13В. Также обеспечивается антитело, которое связывается с тем же эпитопом, как каждое из антител анти-WTA бета на Фиг. 14, Фиг. 15А и 15В, и 16А и Фиг. 16В. Такие композиции могут дополнительно содержать подходящие вспомогательные вещества, такие как фармацевтически приемлемыми вспомогательные вещества (носители) в том числе буферы, кислоты, основания, сахара, разбавители, консерванты и т.п., которые хорошо известны в данной области техники, и описаны в настоящем Документе. Настоящие способы и композиции могут быть использованы по отдельности или в комбинации с другими способами и/или агентами для лечения инфекционных заболеваний.
Связывание антител анти-WTA с WTA зависит от аномерной ориентации модификаций сахара GlcNAc в WTA. WTA модифицируются посредством модификаций сахара N-ацетилглюкозамина (GlcNAc) в положении С4-ОН через альфа- или бета-гликозидные связи, посредством Tarm-гликозилтрансферазы или TarS-гликозилтрансферазы, соответственно. В соответствии с этим, препараты клеточной стенки из мутантных штаммов по гликозилтрансферазе, лишенных Tarm (ΔTarM), TarS (ΔTarS), или как Tarm, так и TarS (ΔTarM/ΔTarS), были подвергнуты анализу с помощью иммуноблоттинга с антителами против WTA. WTA-антитела (S7574), специфичные для α-GlcNAc модификации в WTA, не связываются с препаратом клеточной стенки из штамма ΔTarM. И наоборот, WTA-антитела (S4462), специфичные для β-GlcNAc модификации в WTA, не связываются с препаратом клеточной стенки из штамма ΔTarS. Как и ожидалось, оба эти антитела не связываются с препаратами клеточной стенки из штамма с делеционного штамма с отсутствием обоих гликозилтрансфераз (ΔTarM/ΔTarS), а также штаммом, лишенным WTA (ΔTagO). В соответствии с таким анализом/антитела были охарактеризованы как анти-α-GlcNAc WTA mAb, или как анти-β-GlcNAc WTA mAb, как указано в таблице на Фиг. 6А и 6В.
Остатки аминокислоты цистеин могут быть вставлены методами генетической инженерии в реакционноспособные сайты в антитела и в те, которые не образуют внутрицепочечные или межмолекулярные дисульфидные связи (Junutula, et al., 2008b Nature Biotech., 26(8):925-932; Dornan et al (2009) Blood 114(13):2721-2729; US 7521541; US 7723485; WO 2009/052249, Shen et al (2012) Nature Biotech., 30(2):184-191; Junutula et al (2008) Jour of Immun. Methods 332:41-52). Цистеиновые тиолы вставленных цистеинов могут реагировать с линкерными реагентами или промежуточными соединениями линкер-антибиотик по настоящему изобретению, которые имеют тиол-реактивные, электрофильные группы, такие как малеимид или альфа-галогенамиды с образованием ААС с модифицированными цистеином антителами (TnoMabs) и фрагментами антибиотика (abx). Таким образом могла быть разработана контролируема и известна локализация фрагмента антибиотика. Загрузка антибиотика может контролироваться, так как введенные тиольные группы цистеина, как правило, вступают в реакцию с тиол-реактивным линкерными реагентами или промежуточными соединениями линкер-антибиотик с высоким выходом. Сконструированное антитело анти-WTA для введения аминокислоты цистеин посредством замены в единственном сайте в тяжелой или легкой цепи, дает два новых цистеина в симметричном тетрамере антитела. Могла быть достигнута загрузка около двух фрагментов антибиотика и достигнута почти полная гомогенность продукта конъюгации ААС.
В некоторых вариантах осуществления может быть желательным создание антител анти-WTA с введенными остатками цистеина, например, "тиоMAbs", в которых один или несколько остатков в антителе заменены остатками цистеина. В конкретных вариантах осуществления заменяемые остатки встречаются в доступных участках антитела. Посредством замены тех остатков цистеина, реактивные тиольные группы, таким образом, располагаются в доступных участках антитела и могут быть использованы для конъюгации антитела с другими группами, такими как фрагменты антибиотика или фрагменты линкер-антибиотик, чтобы создать иммуноконъюгат, как описано далее в настоящем документе. В некоторых вариантах осуществления один или несколько из следующих остатков может быть заменен цистеином, в том числе V205 (Kabat нумерация) в легкой цепи; А118 (EU нумерация) в тяжелой цепи; и S400 (EU нумерация) в тяжелой цепи Fc-области. В качестве неограничивающего примера модифицированной цистеином тяжелой цепи A118C (SEQ ID NO: 149) и легкой цепи (V205C SEQ ID NO: 151) показаны мутанты антитела анти-WTA. Модифицированные цистеином антитела анти-WTA могут генерироваться, как ранее описано (Junutula, et al., 2008b Nature Biotech., 26(8):925-932; US 7521541; US 2011/0301334).
В другом варианте осуществления настоящее изобретение относится к изолированному антителу анти-WTA, содержащему тяжелую цепь и легкую, где тяжелая цепь содержит последовательность константной области тяжелой цепи дикого типа или мутант с введенным с помощью генетической инженерии цистеином (ТиоMab) и легкая цепь содержит последовательность константной области легкой цепи дикого типа или мутант с введенным с помощью генетической инженерии цистеином (ТиоMab). В одном аспекте тяжелая цепь имеет последовательность, идентичную по меньшей мере на 95%, к:
константной области тяжелой цепи (IgG1) дикого типа

 (SEQ ID NO: 148)
(SEQ ID NO: 148)
константной области тяжелой цепи (IgG1), A118C "ТиоMab"

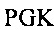 (SEQ ID NO: 149)
(SEQ ID NO: 149)
и легкая цепь имеет по меньшей мере 95% идентичность последовательности к:
константной области легкой цепи (каппа) дикого типа

(SEQ ID NO: 150)
константной области легкой цепи (каппа), V205C "ТиоMab"

(SEQ ID NO: 151)
ААС по изобретению включают в себя антитела, модифицированные цистеином анти-WTA, в которых одна или несколько аминокислот дикого типа или родительские антитела анти-WTA заменяются на аминокислоту цистеин. Любая форма антитела может быть сконструирована таким образом, т.е. мутированной. Например, родительский Fab-фрагмент антитела может быть сконструирован так с образованием Fab, модифицированного цистеином, который упоминается в настоящем описании как "ТиоFab". Аналогичным образом, родительское моноклональное антитело, может быть сконструировано так с образованием "ТиоMab." Следует отметить, что единственный мутационный сайт дает единственный остаток введенного цистеина в ТиоFab, в то время как единственный мутационный сайт дает два остатка введенного цистеина в ТиоMab, из-за димерной природы антитела IgG. Мутанты с замененными ("модифицированными") остатками цистеина (Cys) оцениваются по реакционной способности вновь введенных с помощью генетической инженерии.
ФРАГМЕНТЫ АНТИБИОТИКА
Фрагмент антибиотика (abx) конъюгатов антитело-антибиотик (ААС) по настоящему изобретению представляет собой антибиотик или группу, которые обладают цитотоксическим или цитостатическим эффектом. Широкое разнообразие антибиотиков по химической структуре и механизму действия могут быть конъюгированы с анти-WTA антителами, и проверены на их антибактериальные свойства. Антибиотики могут быть протестированы на антимикробную активность посредством измерения их минимальной ингибирующей концентрации (МИК), используя стандартный МИК-анализ in vitro (Tomioka et al., (1993) Antimicrob. Agents Chemother. 37:67).
Антибиотики, конъюгированные с антителами анти-WTA, описываются в таблицах 2 и 3, и в примерах, и включающие клиндамицин, новобиоцин, ретапамулин, даптомицин GSK-2140944, CG-400549, ситафлоксацин, тейкопланина, триклозан, нафтиридон, радезолид, доксорубицин, ампициллин, ванкомицин, имипенем, дорипенем, гемцитабин, далбавацин и азитромицин. Механизмы бактерицидного и бактериостатического действия таких антибиотиков включают, но не ограничиваются этим: (i) ингибирование синтеза клеточной стенки, удлинение пептидогликана (ванкомицин, тейкопланин, далбавацин); (ii) ингибирование синтеза клеточной стенки, сшивание с пенициллинсвязывающишми белками (имипенем, дорипенем, ампициллин); (iii) деполяризация клеточной мембраны (даптомицин); (iv) нарушение репликации ДНК (гемцитабин); (v) связывание с ДНК (доксорубицин); (vi) еноил АСР-редуктаза FABI (CG-400549, триклозан, нафтиридон); (vii) ингибирование рибосомального синтеза белка, рибосома 30S (клиндамицин, ретапамулин, радезолид); и (viii) ингибиторы топоизомеразы (topoIIA) (новобиоцин, ситафлоксацин, GSK-2140944). Структурно большинство антибиотиков могут быть сгруппированы в: (i) аминогликозиды; (ii) бета-лактамы; (iii) макролиды/циклические пептиды; (iv) тетрациклины; (v) фторхинолины/фторхинолоны; (vi) и оксазолидиноны. См.: Shaw, K. and Barbachyn, М. (2011) Ann. N.Y. Acad. Sci. 1241:48-70; Sutcliffe, J. (2011) Ann. N.Y. Acad. Sci. 1241:122-152.
ПЕПТИДНЫЕ ЛИНКЕРЫ
"Пептидный линкер" (L) представляет собой бифункциональный или многофункциональный фрагмент, который ковалентно присоединяется к одному или нескольким остаткам антибиотиков (abx) и фрагменту антитела (Ab) с образованием конъюгаты антитело-антибиотик (ААС) формулы I. Пептидные линкеры в ААС являются субстратами для расщепления внутриклеточными протеазами, включая условия в лизосомах. Протеазы включает в себя различные катепсины и каспазы. Расщепление пептидного линкера ААС внутри клетки может освободить антибиотик типа рифамицина с антибактериальными эффектами.
Количество активного антибиотика, высвобождаемого при расщеплении ААС может быть измерено с помощью анализа высвобождения каспазы примера 20.
Конъюгаты антитело-антибиотик (ААС) может быть легко получен с использованием линкерного реагента или промежуточного соединения линкер-антибиотик, имеющий реакционноспособную функциональность для связывания с антибиотиками (abx) и с антителом (Ab). В одном иллюстративном варианте осуществления цистеиновый тиол цистеина сконструированного антитела (Ab), модифицированного цистеином, может образовывать связь с функциональной группой линкерного реагента, фрагмента антибиотика или промежуточного соединения антибиотик-линкер.
В одном аспекте пептидный линкерный фрагмент ААС, линкерный реагент или промежуточное соединение линкер-антибиотик имеют реакционноспособный сайт, который имеет электрофильного группу, которая реагирует с нуклеофильным цистеином, присутствующим на антителе. Цистеиновый тиол антитела реагирует с электрофильной группой на линкерном реагенте или линкер-антибиотик с образованием ковалентной связи. Полезные электрофильные группы включают, но не ограничиваются этим, малеимидная и галогенацетамидная группы.
Антитела, модифицированные цистеином, реагируют с линкерными реагентами или промежуточными соединениями линкер-антибиотик, с электрофилъными функциональными группами, такими как малеимид или α-галоген карбонил, в соответствии с методом конъюгации на странице 766 Klussman, et al (2004), Bioconjugate Chemistry 15(4):765-773, и в соответствии с протоколом примера 24.
В другом варианте осуществления реакционно-способная группа линкерного реагента или промежуточного соединения линкер-антибиотик содержит функциональную тиол-реактивную группу, которая может образовывать связь со свободным цистеиновым тиолом антитела. Примеры тиол-реактивных функциональных групп включают, но не ограничиваются этим, малеимид, α-галогенацетил, активированные сложные эфиры, такие как сукцинимидные эфиры, 4-нитрофениловые эфиры, пентафторфениловые эфиры, тетрафторфениловые эфиры, ангидриды, хлорангидриды, сульфонилхлориды, изоцианаты и изотиоцианаты.
В другом варианте осуществления линкерный реагент или промежуточное соединение антибиотик-линкер имеют реакционно-способную функциональную группу, которая имеет нуклеофильную группу, которая реагирует с электрофильной группой, присутствующей на антителе. Полезные электрофильные группы на антителе включают, но не ограничиваются этим, пиридилдисульфид, карбонильные группы альдегидов и кетонов. Гетероатом нуклеофильной группы линкерного реагента или промежуточное соединение антибиотик-линкер могут реагировать с электрофильной группой на антителе и образовывать ковалентную связь с фрагментом антитела. Полезные нуклеофильные группы на линкерном реагенте, или промежуточном соединении антибиотик-линкер включают, но не ограничиваются этим, гидразид, оксим, амино, тиол, гидразин, тиосемикарбазон, гидразинкарбоксилат и арилгидразид. Электрофильные группы на антителе обеспечивают удобный сайт для прикрепления к линкерному реагенту, или промежуточному соединению антибиотик-линкер.
Пептидный линкер может содержать один или несколько линкерных компонентов. Примерные линкерные компоненты включают пептидный фрагмент, 6-малеимидокапроил ("МС"), малеимидопропаноил ("MP"), валин-цитруллин ("val-cit" или "vc"), аланин фенилаланин ("ala-phe"), и п-аминобензилоксикарбонил ("РАВ"), N-сукцинимидил-4-(2-пиридилтио)пентаноат ("SPP"), и 4-(N-малеимидометил)циклогексан-1-карбоновая кислота ("МСС"). Различные линкерные компоненты известны в данной области техники, некоторые из которых описаны ниже.
В другом варианте осуществления линкер может быть замещен группами, которые модулируют растворимость или реакционную способность. Например, заряженный заместитель, такой как сульфонат (-SO3-) или аммоний, может увеличить растворимость реагента в воде и облегчать реакцию сочетания линкерного реагента с антителом или фрагментом антибиотика, или облегчить реакцию сочетания Ab-L (промежуточное соединение антитело-линкер) с abx, или abx-L (промежуточное соединение антибиотик линкер) с антителом, в зависимости от способа синтеза, используемого для получения ААС.
ААС по изобретению явным образом рассматриваются, но не ограничиваются этим, ААС, полученные с линкерными реагентами: ВМРЕО, BMPS, EMCS, GMBS, HBVS, LC-SMCC, MBS, МРВН, SBAP, SIA, SIAB, SMCC, SMPB, SMPH, sulfo-EMCS, sulfo-GMBS, sulfo-KMUS, sulfo-MBS, sulfo-SIAB, sulfo-SMCC, sulfo-SMPB, SVSB (сукцинимидил-(4-винилсульфон)бензоат) и бис-малеимидные реагенты, такие как DTME, ВМВ, BMDB, ВМН, ВМОЕ, BM(PEG)2 и BM(PEG)3. Бис-малеимидные реагенты позволяют присоединение тиольной группы модифицированного цистеином антитела к тиол-содержащему фрагменту антибиотика, метке или линкерному интермедиату последовательным или конвергентным способом. Другие функциональные группы, отличные от малеимида, которые реагируют с тиольной группой цистеина сконструированного антитела, фрагмента антибиотика, или промежуточного соединения линкер-антибиотик включают иодацетамид, бромацетамид, винилпиридин, дисульфид, пиридилдисульфид изоцианат и изотиоцианат.
Полезные линкерные реагенты могут быть получены с помощью других коммерческих источников, таких как Molecular Biosciences Inc. (Boulder, CO), или синтезируются в соответствии с процедурами, описанными в Toki et al (2002) J. Org. Chem. 67:1866-1872; Dubowchik, et al. (1997) Tetrahedron Letters, 38:5257-60; Walker, M.A. (1995) J. Org. Chem. 60:5352-5355; Frisch et al (1996) Bioconjugate Chem. 7:180-186; US 6214345; WO 02/088172; US 2003130189; US 2003096743; WO 03/026577; WO 03/043583; и WO 04/032828.
В другом варианте осуществления пептидный линкерный фрагмент ААС содержит линкер дендритного типа для ковалентного присоединения более чем одного фрагмента антибиотика через разветвления, многофункционального линкерного фрагмента к антителу (Sun et al (2002) Bioorganic & Medicinal Chemistry Letters 12:2213-2215; Sun et al (2003) Bioorganic & Medicinal Chemistry 11:1761-1768). Дендритные линкеры могут увеличивать молярное соотношение антибиотика к антителу, т.е. загрузку, которая связана с эффективностью ААС. Таким образом, когда антитело, модифицированное цистеином, несет только одну реакционноспособную цистеиновую тиоловую группу, множество фрагментов антибиотика могут быть присоединены через дендритный линкер.
В некоторых вариантах осуществления ААС формулы I, пептидный линкер имеет формулу:
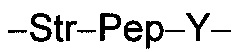
где Str представляет собой растяжимый участок, ковалентно присоединенный к антителу против стеночной тейхоевой кислоты (WTA); Pep представляет собой пептид из двух-двенадцати аминокислотных остатков, и Y представляет собой спейсерный участок, ковалентно присоединенный к антибиотику. Примерные вариант осуществления таких линкеров описаны в патенте США 7498298, специально включены в описание посредством ссылки.
В одном варианте осуществления носилки участок "Str" имеет формулу:
где R6 выбираются из группы, состоящей из C1-С10 алкилен-, -С3-С8 карбоцикло, -O-(С1-С8 алкил)-, -арилен-, -C1-C10 алкилен-арилен-, -арилен-С1-С10 алкилен, -C1-C10 алкилен (С3-С8 карбоцикло)-, -(С3-С8 карбоцикло)-C1-C10-алкилен, -С3-С8 гетероцикло-, -C1-С10 алкилен (С3-С8 гетероцикло)-, -(С3-С8 гетероцикло)-C1-C10-алкилен, - -(CH2CH2O)r-, и -(CH2CH2O)r-СН2-; и r представляет собой целое число в диапазоне от 1 до 10.
Примерные растяжимые участки, показаны ниже (где волнистая линия указывает участки ковалентного присоединения у антителу):
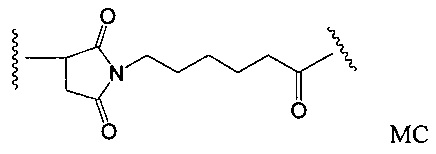
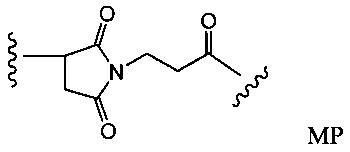
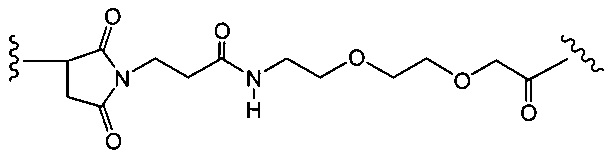
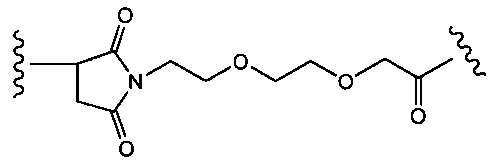
 .
.
Пептидный участок "Pep" содержит два или несколько аминокислотных остатков, которые встречаются в природе, включая двадцать главных аминокислот, а также минорные аминокислоты, такие как цитруллин, которые хорошо известны в области биохимии. Аминокислоты отличаются своей боковой цепью. Таким образом, пептидный участок содержит две или несколько аминокислотных боковых цепей, в том числе, но не ограничиваясь этим, -СН3 (аланин), -CH2CH2CH2NHC(NH)NH2 (аргинин), -CH2C(O)NH2 (аспарагин), -CH2CO2H (аспарагиновая кислота), -CH2CH2CH2NHC(O)NH2 (цитруллин), -CH2SH (цистеин), -CH2CH2CO2H (глутаминовая кислота), -CH2CH2C(O)NH2 (глютамин), -Н (глицин), -СН2 (имидазолил) (гистидин), -СН(СН3)СН2СН3 (изолейцин), -СН2СН(СН3)СН3 (лейцин), -CH2CH2CH2CH2NH2 (лизин), -CH2CH2SCH3 (метионин), -СН2(С6Н5) (фенилаланин), -СН2СН2СН2- (пролин), -СН2ОН (серин), -СН(ОН)СН3 (треонин), -СН2 (индол) (триптофан), -СН2(р-С6Н4ОН) (тирозин), -СНСН(СН3)СН3 (валин). См. страницу 1076-1077, "Organic Chemistry" 5th Ed. John McMurry, Brooks/Cole pub. (2000). Аминокислотные остатки пептидного участка включают все стереоизомеры, и могут быть в D- или L-конфигурации. В одном варианте осуществления Pep включает от двух до двенадцати аминокислотных остатков, независимо выбранных из глицина, аланина, фенилаланина, лизина, аргинина, валина и цитруллина. В одном таком варианте осуществления аминокислотный участок позволяет расщеплять линкер посредством протеазы, таким образом облегчая высвобождение антибиотика из ААС при воздействии внутриклеточных протеаз, таких как лизосомальные ферменты (Doronina et al. (2003) Nat. Biotechnol. 21:778-784). Примеры аминокислотных участков включают, но не ограничиваются этим, дипептид, трипептид, тетрапептид и пентапептид. Примерные дипептиды включают в себя: валин-цитруллин (vc или val-cit), аланин-фенилаланин (af или ala-phe); фенилаланин-лизин (fk или phe-lys); или N-метил-валин-цитруллин (Me-val-cit). Примеры трипептидов включают: глицин-валин-цитруллин (gly-val-cit) и глицин-глицин-глицин (gly-gly-gly). Пептидные линкеры могут быть получены путем образования пептидной связи между двумя или более аминокислотами и/или пептидными фрагментами. Такие пептидные связи могут быть получены, например, в соответствии со способом синтеза в жидкой фазе ( and
and  (1965) "The Peptides", volume 1, pp 76-136, Academic Press), который хорошо известен в области пептидной химии. Аминокислотные участки могут быть разработаны и оптимизированы в их селективности в отношении ферментативного расщепления с помощью конкретного фермента, например, ассоциированный с опухолью протеазой, катепсинами В, С и D, или протеазой плазмином.
(1965) "The Peptides", volume 1, pp 76-136, Academic Press), который хорошо известен в области пептидной химии. Аминокислотные участки могут быть разработаны и оптимизированы в их селективности в отношении ферментативного расщепления с помощью конкретного фермента, например, ассоциированный с опухолью протеазой, катепсинами В, С и D, или протеазой плазмином.
В одном варианте осуществления спейсерный участок Y включает пара-аминобензил (РАВ) или пара-аминобензилоксикарбонил (РАВС). "не-самоотщепляющийся" спейсерный участок представляет собой спейсерный участок, в котором часть или весь спейсерный участок остается связанными с молекулой антибиотика при ферментативном (например, протеолитическом) расщеплении ААС. Примеры не-самоотщепляющихся спейсерных участков включают, но не ограничиваются этим, глициновый спейсерный участок и глицин-глициновый спейсерный участок. Другие комбинации пептидных спейсеров, чувствительных к ферментативному расщеплению, специфичных к последовательности, также рассматриваются. Например, ферментативное расщепление ААС, содержащей глицин-глициновый спейсерный участок посредством протеазы, ассоциированной с опухолевой клеткой, должно приводить к высвобождению фрагмента глицин-глицин-антибиотик из оставшейся части ААС. В одном таком варианте осуществления фрагмент глицин-глицин-антибиотик затем подвергался отдельной стадии гидролиза в опухолевой клетке, таким образом отщепляя глицин-глициновый спейсерный участок от фрагмента антибиотика.
Спейсерный участок позволяет высвобождать фрагмент антибиотика без отдельной стадии гидролиза. Спейсерный участок может быть "самоотщепляющимся" или "не-самоотщепляющимся". В некоторых вариантах осуществления спейсерный участок линкера содержит п-аминобензиловый участок (РАВ). В одном таком варианте осуществления р-аминобензиловый спирт присоединяется к аминокислотному участку посредством амидной связи, карбамата, метилкарбамата или карбоната между п-аминобензиловой группой и фрагментом антибиотика (Hamann et al. (2005) Expert Opin. Ther. Patents (2005) 15:1087-1103). В одном варианте осуществления спейсерный участок представляет собой п-аминобензилоксикарбонил (РАВ).
В одном варианте осуществления антибиотик образует четвертичный амин, такой как диметиламинопиперидиловую группу при присоединении к РАВ-спейсерному участку пептидного линкера. Примерами таких четвертичных аминов являются промежуточные соединения линкер-антибиотик (LA) в 51, 53, 67, 70 из таблицы 2. Четвертичноаммониевая группа может модулировать отщепление фрагмента антибиотика для оптимизации антибактериальных эффектов ААС. В другом варианте осуществления антибиотик связан с РАВС-спейсерным участком пептидного линкера, образуя карбаматную функциональную группу в ААС. Такая карбаматная функциональная группа также может оптимизировать антибактериальные эффекты ААС. Примеры промежуточных соединений РАВС-карбаматный линкер-антибиотик представляют собой 54, 55, 56, 57, 58, 60, 61, 62, 63, 64, 65, 66, 67, 69 из таблицы 2.
Другие примеры саморасщепляющихся спейсеров включают, но не ограничиваются этим, ароматические соединения, которые электронно аналогичны РАВ-группе, такие как производные 2-аминоимидазол-5-метанола (US 7375078; Hay et al. (1999) Bioorg. Med. Chem. Lett. 9:2237) и орто- или пара-аминобензилацетали. Могут быть использованы спейсеры, которые подвергались циклизации при гидролизе амидной связи, такие как амиды замещенной и незамещенной 4-аминомасляной кислоты (Rodrigues et al (1995) Chemistry Biology 2:223), соответственно замещенные бицикло[2.2.1] и бицикло[2.2.2]кольцевые системы (Storm et al (1972) J. Amer. Chem. Soc. 94:5815) и амиды 2-аминопропионовой кислоты (Amsberry, et al (1990) J. Org. Chem. 55:5867). Элиминирование аминосодержащих препаратов, которые замещаются у глицина (Kingsbury et al (1984) J. Med. Chem. 27:1447) также являются примерами самоотщепляющихся спейсеров, используемых в ААС.
ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ ЛИНКЕР-АНТИБИОТИК, ИСПОЛЬЗУЕМЫЕ ДЛЯ ААС
Промежуточные соединения линкер-антибиотик таблицы 2 получали сочетанием в остатка антибиотика с реагентом пептид-линкер, как показано в Фиг. 17-19 и примерах 1-17. Линкерные реагенты получали способами, описанными в WO 2012113847; US 7659241; US 7498298; US 20090111756; US 20090018086; US 6214345; Dubowehik et al (2002) Bioconjugate Chem. 13(4):855-869, и включают:
4-((S)-2-((S)-2-(6-(2,5-Диоксо-2,5-дигидро-1Н-пиррол-1-ил)гексамидо)-3-метилбутанамидо)-5-уреидопентанамидо)бензил 4-нитрофенил карбонат:
6-(2,5-Диоксо-2,5-дигидро-1Н-пиррол-1-ил)-N-((S)-1-((S)-1-(4-(гидроксиметил)фениламино)-1-оксо-5-уреидопентан-2-иламино)-3-метил-1-оксобутан-2-ил)гексанамид:
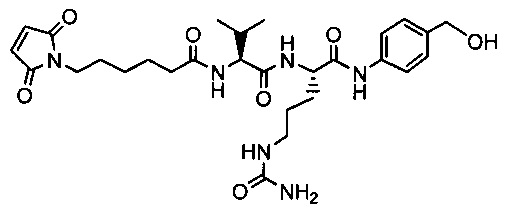
N-((S)-1-((S)-1-(4-(Хлорметил)фениламино)-1-оксо-5-уреидопентан-2-иламино)-3-метил-1-оксобутан-2-ил)-6-(2,5-диоксо-2,5-дигидро-1Н-пиррол-1-ил)гексанамид:
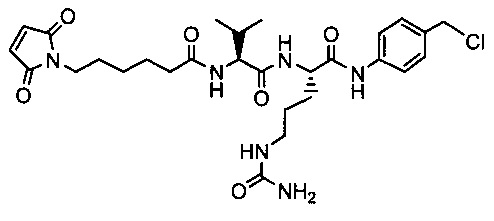
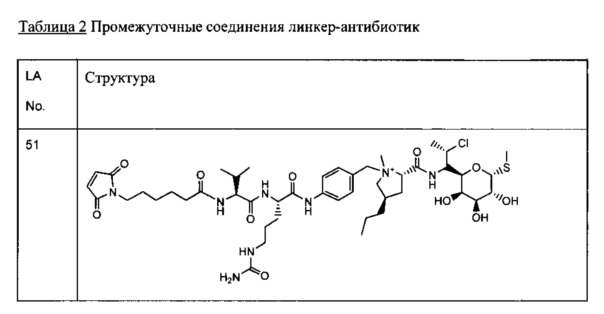
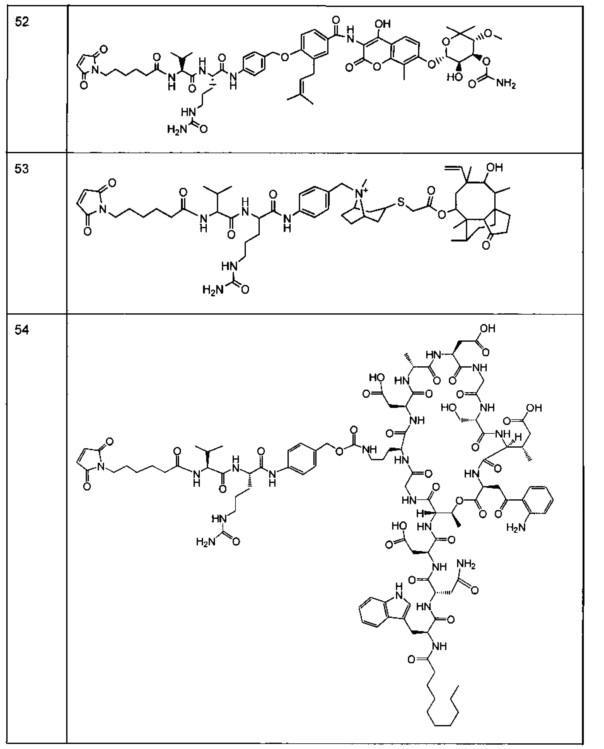
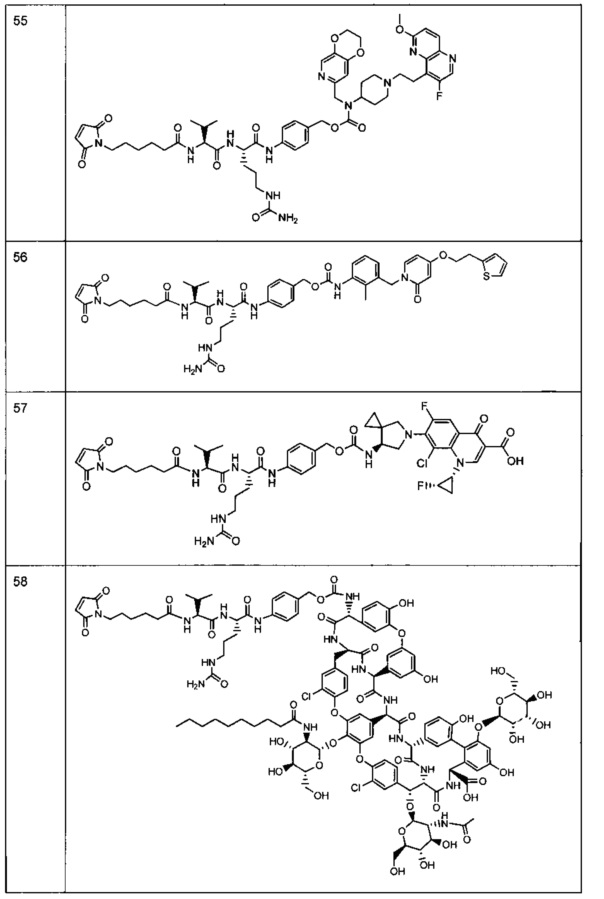
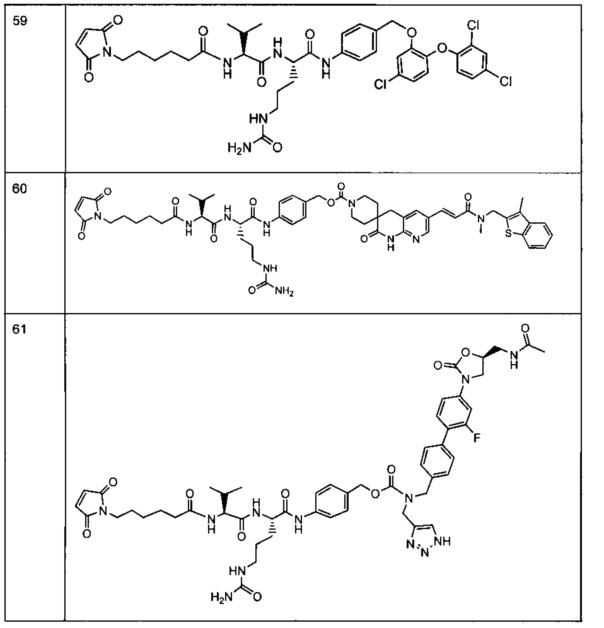
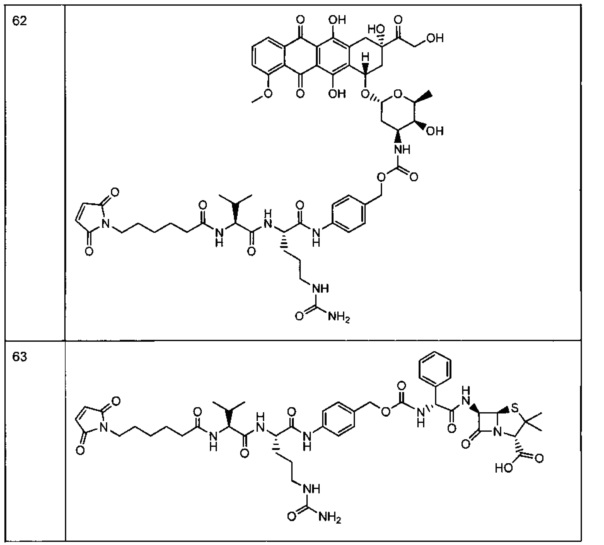
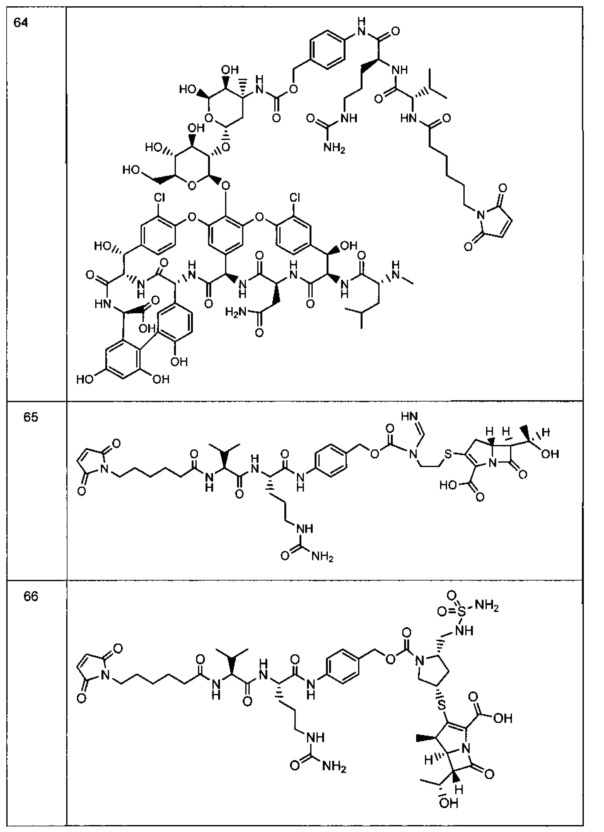
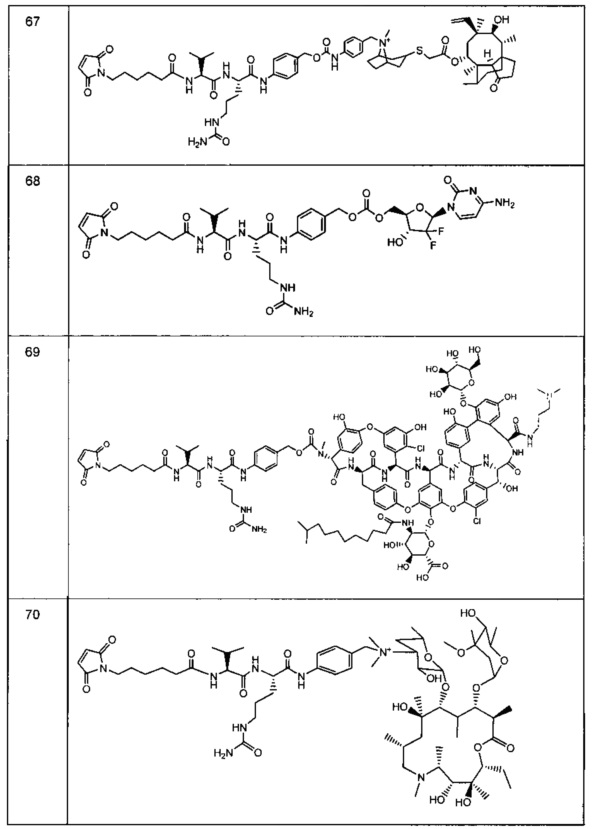
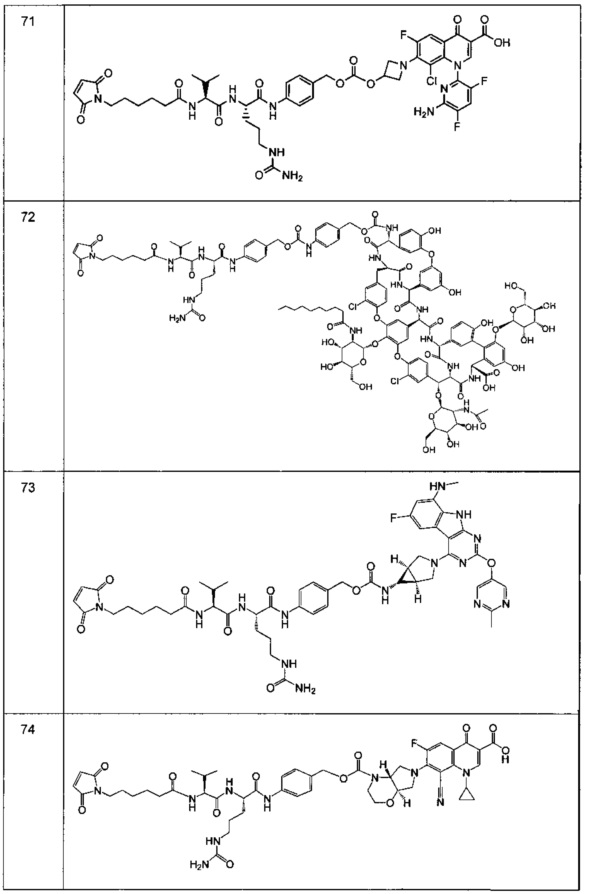
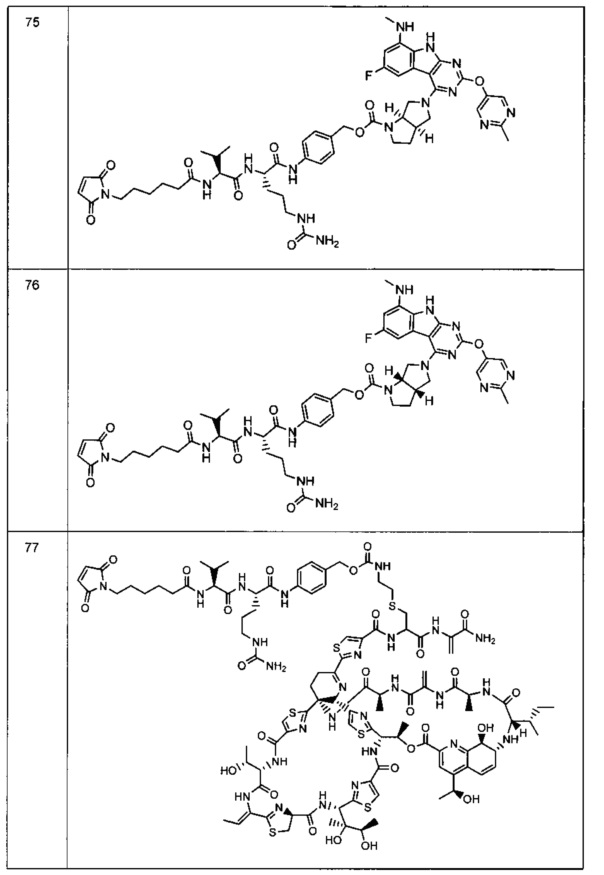
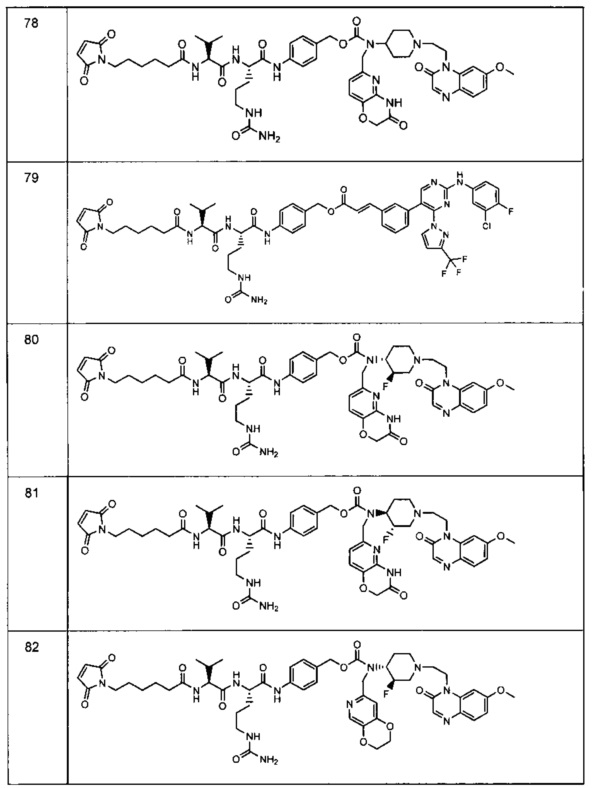
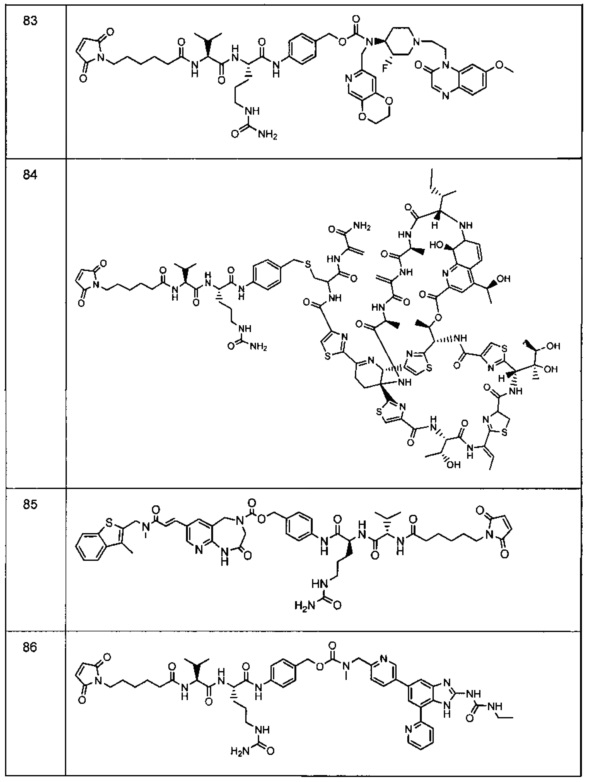
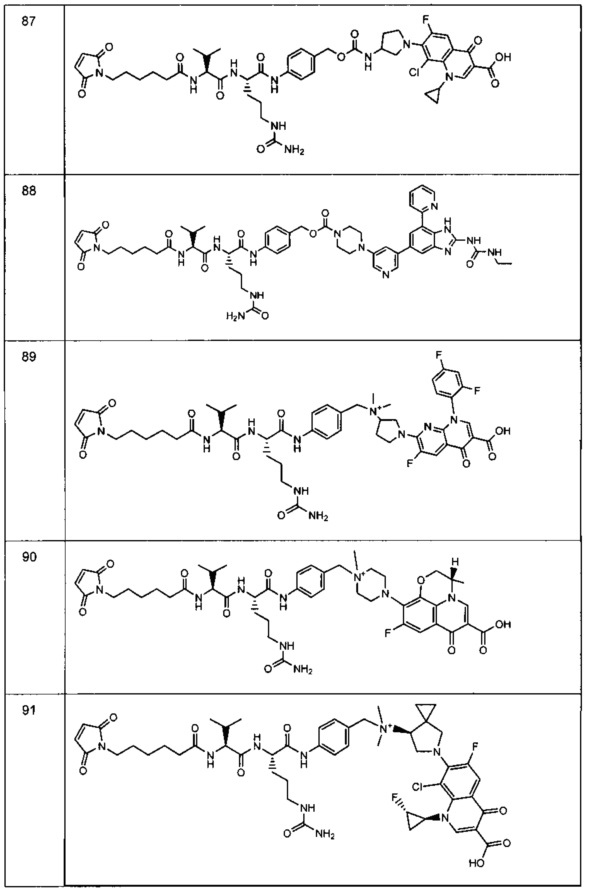
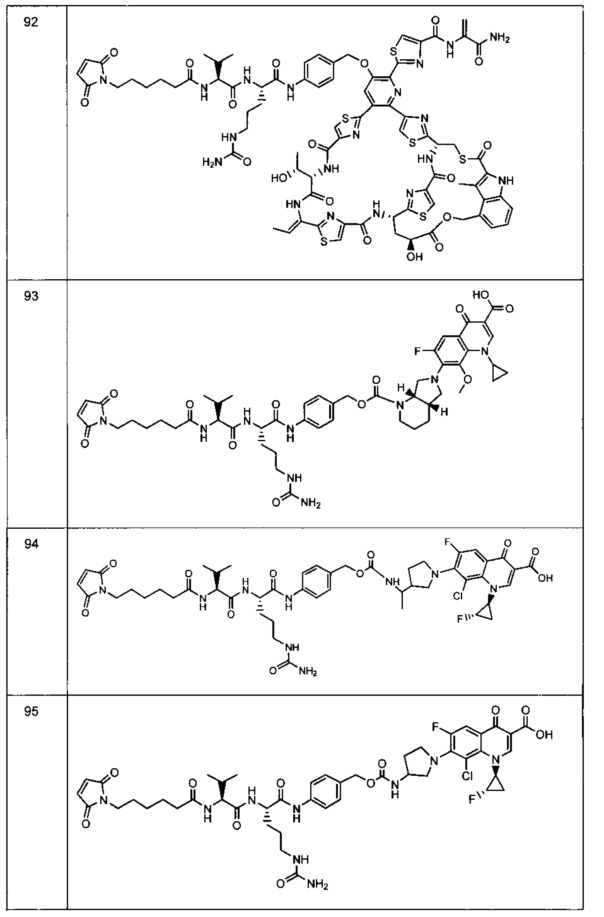
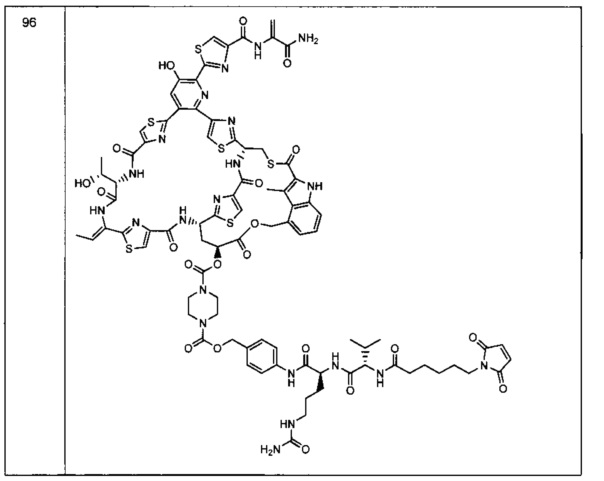
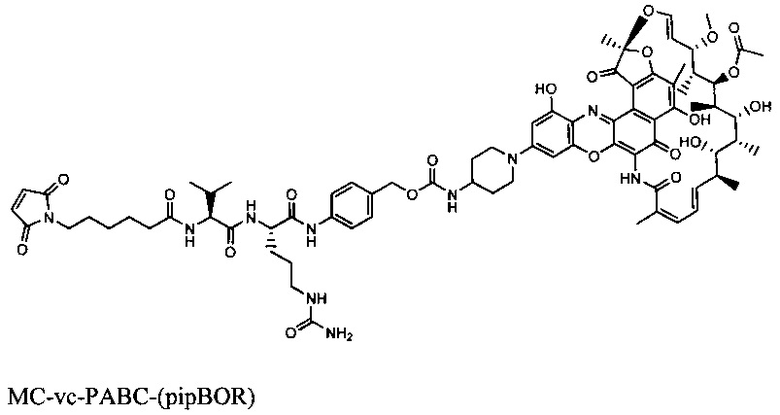
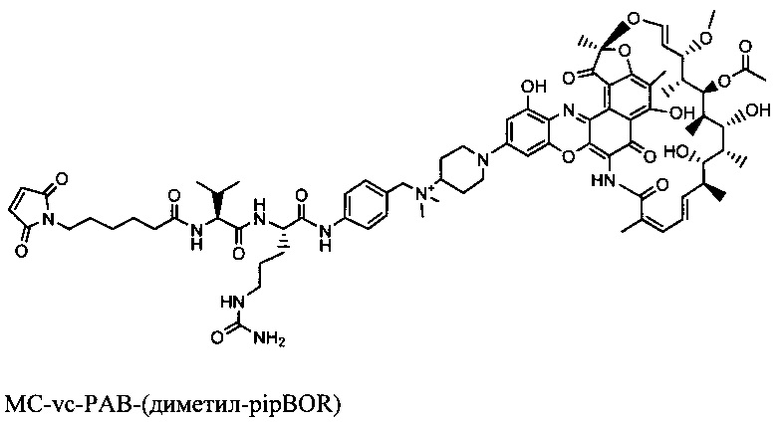
Конъюгаты антитело-антибиотик получали также с помощью антибиотиков рифамицинового типа. ААС соединение, тио-S4497-HC-A118C-MC-vc-PABC-(pipBOR) rifa-102, получали посредством конъюгации тио-S4497 НС-A118C антитела, модифицированного цистеином, и промежуточного соединения линкер-антибиотик, МС-vc-PABC-(pipBOR). ААС соединение, тио-S4497-HC-A118C-МС-vc-РАВ-(диметил-pipBOR) rifa-105, получали посредством конъюгации тио-S4497 НС-А118С антитела, модифицированного цистеином, и промежуточного соединения линкер-антибиотик, МС-vc-РАВ-(диметил-pipBOR). Два ААС отличаются оксикарбонильной (rifa-102) и диметилированной амино группой (rifa-105) между линкером и фрагментом антибиотика.
ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ КОНЪЮГАТОВ АНТИТЕЛО-АНТИБИОТИК
Антитело S4497 ковалентно присоединяется к промежуточным соединениям линкер-антибиотик в таблице 2 через пептидный линкер, расщепляемый протеазой для образования конъюгатов антитело-антибиотик (ААС) таблицы 3. Линкер, предназначен для расщепления лизосомальными протеазами, включая катепсины В, D и другими, которые распознают пептидные участки, включающие дипептид валин-цитруллин (val-cit, vc) (Dubowchik et al (2002) Bioconj. Chem. 13:855-869). Генерация промежуточного соединения линкер-антибиотик, состоящего из антибиотика и линкера MC-vc-PAB и других, подробно описано в примерах 1-17. Линкер сконструирован таким образом, что расщепление амидной связи в остатке РАВ отзделяет антитело от антибиотика в активном состоянии.
Фиг. 5 показывает возможный механизм активации препарата для конъюгатов антитело-антибиотик (ААС). Активный антибиотик (Ab) высвобождается только после интернализации ААС внутрь клеток млекопитающих. Fab-область антитела в ААС связывается с S. aureus, в то время как часть Fc-область ААС усиливает поглощение бактерий путем Fc-рецептор-опосредованного связывания с фагоцитирующими клетками, включая нейтрофилов и макрофагов. После интернализации в фаголызосомы, val-cit линкер расщепляется лизосомальными протеазами, что приводит к высвобождению активного антибиотика внутри фаголизосомы.
Один из вариантов осуществления соединения конъюгат антитело-антибиотик (ААС) по данному изобретению включает в себя следующее:
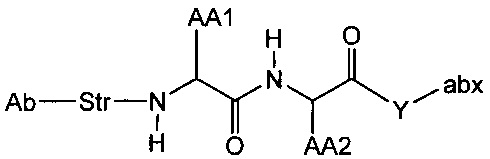
где АА1 и АА2 независимо выбираются из аминокислотных боковых цепей, включающих формулы:
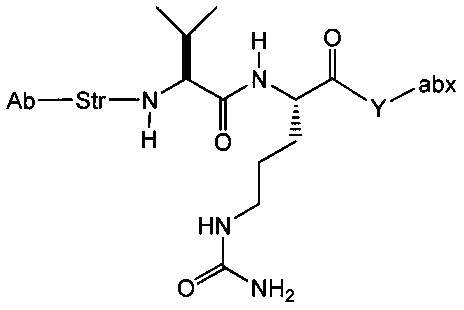
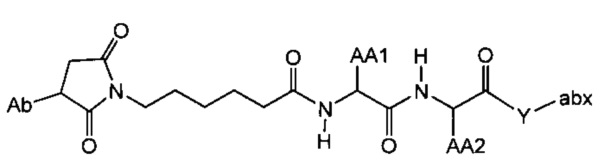 .
.
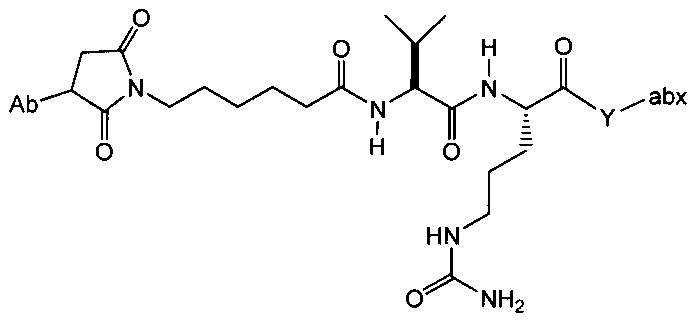 .
.
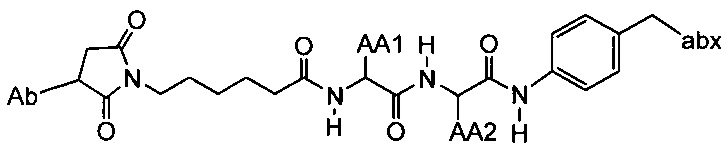 .
.
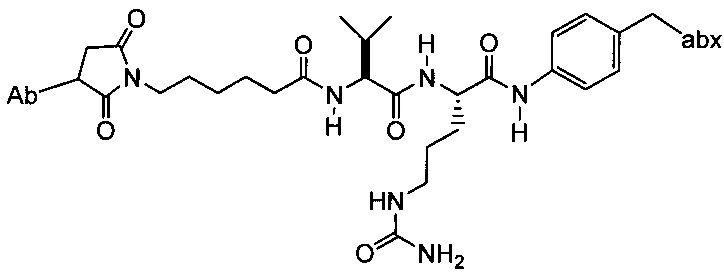 .
.
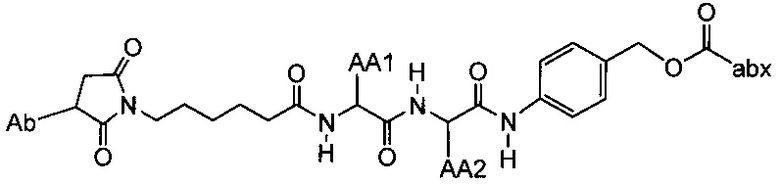
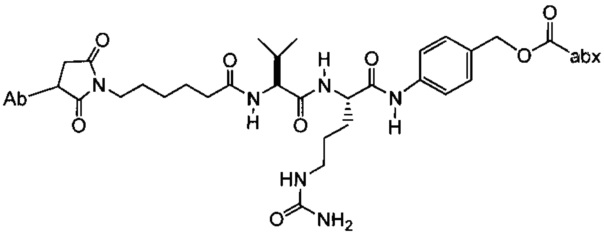 .
.
Вариант осуществления соединения конъюгата антитело-антибиотик по настоящему изобретению включает в себя антитело против стеночной тейхоевой кислоты (WTA) по любому из п. 1-8, ковалентно присоединенный пептидным линкером к антибиотику, выбранному из клиндамицина, новобиоцина, ретапамулина, даптомицина, GSK-2140944, CG-400549, ситафлоксацина, тейкопланина, триклозана, нафтиридона радезолида, доксорубицина, ампициллина, ванкомицина, имипенема, дорипенема, гемцитабина, далбавацина и азитромицина.
ЗАГРУЗКА ААС АНТИБИОТИКОМ
Загрузка антибиотиком представлена числом р, среднее число фрагментов антибиотика (abx) на молекулу антитела в формуле I. Загрузка антибиотиком может варьироваться от 1 до 20 остатков антибиотиков (D) на антитело. ААС формулы I включают совокупность или пул антител, конъюгированных с набором фрагментов антибиотика, от 1 до 20. Среднее количество фрагментов антибиотика на молекулу антитела в препаратах ААС из реакций конъюгации можно охарактеризовать с помощью обычных средств, таких как масс-спектроскопии, ELISA анализ и ВЭЖХ. Количественное распределение ААС в терминах p также может быть определено. В некоторых случаях, разделение, очистка и характеризация гомогенного ААС, где р обозначает определенное значение из ААС с другими загрузками антибиотиком может быть достигнуто с помощью таких средств, как обращенно-фазовая ВЭЖХ или электрофорез.
Для некоторых конъюгатов антитело-антибиотик p может быть ограничено количеством сайтов присоединения на антителе. Например, если место присоединение представляет собой цистеиновый тиол, как и в иллюстративных вариантах осуществления выше, антитело может иметь только одну или несколько цистеиновых тиоловых групп, или может иметь только одну или несколько достаточно реакционноспособных тиоловых групп, через которые линкер может быть присоединен. В некоторых вариантах осуществления более высокая загрузка антибиотиком, например, p>5, может привести к агрегации, утрате растворимости, токсичности или потери способности проникать в клетку некоторых конъюгатов антитело-антибиотик. В некоторых вариантах осуществления загрузка антибиотиком для ААС по изобретению составляет от 1 до около 8; от около 2 до около 6; или от около 3 до около 5.
В некоторых вариантах осуществления с антителом в течение реакции конъюгации конъюгируют менее чем теоретический максимум фрагментов антибиотика. Антитело может содержать, например, остатки лизина, которые не реагируют с промежуточным соединением антибиотик-линкер или линкерным реагентом, как описано ниже. Как правило, антитела не содержат много свободных и реакционноспособных цистеиновых тиоловых групп, которые могут быть связаны с фрагментом антибиотика; действительно наибольшее количество цистеиновых тиоловых остатков в антителах присутствуют в виде дисульфидных мостиков. В некоторых вариантах осуществления антитело может быть восстановлено восстанавливающим агентом, таким как дитиотреитол (DTT) или трикарбонилэтилфосфин (ТСЕР), при частичной или полных восстановительных условиях, чтобы генерировать реакционноспособные цистеиновые тиоловые группы. В некоторых вариантах осуществления антитело подвергали денатурирующим условиям для того, чтобы выявить реактивные нуклеофильные группы, такие как лизин или цистеин.
Загрузку (отношение антибиотик/антитело "AAR") ААС можно контролировать различными способами, например, посредством: (i), ограничения молярного избытка промежуточного соединения антибиотик-линкер или линкерного реагента по отношению к антителу, (ii) ограничения времени реакции конъюгации или температуры, и (iii) частичные или ограниченные восстановительные условия для модификации цистеинового тиола.
Следует понимать, что когда более чем одна нуклеофильная группа реагирует с промежуточным соединением антибиотик-линкер или линкерным реагентом, и затем с реагентом фрагмента антибиотика, то полученный продукт представляет собой смесь ААС-соединений с распределением одного или более фрагментов антибиотика, присоединенных к антителу. Среднее количество фрагментов антибиотика на антитело может быть рассчитано с помощью анализа из смеси посредством ELISA двойного антитела, который является специфическими для антитела и специфическими для антибиотика. Отдельные молекулы ААС могут быть идентифицированы в смеси посредством масс-спектроскопии и разделены с помощью ВЭЖХ, например, посредством гидрофобной хроматографии (см., например, McDonagh et al (2006) Prot. Engr. Design & Selection 19(7):299-307; Hamblett et al (2004) Clin. Cancer Res. 10:7063-7070; Hamblett, K.J., et al. "Effect of drug loading on the pharmacology, pharmacokinetics, and toxicity of an anti-CD30 antibody-drug conjugate," Abstract No. 624, American Association for Cancer Research, 2004 Annual Meeting, March 27-31, 2004, Proceedings of the AACR, Volume 45, March 2004; Alley, S.C., et al. "Controlling the location of drug attachment in antibody-drug conjugates," Abstract No. 627, American Association for Cancer Research, 2004 Annual Meeting, March 27-31, 2004, Proceedings of the AACR, Volume 45, March 2004). В некоторых вариантах осуществления гомогенный ААС с единственным значением нагрузки может быть выделен из конъюгационной смеси с помощью электрофореза или хроматографии. Модифицированные цистеином антитела по изобретению позволяют получать более гомогенные препараты, так как реакционноспособный участок на антителе в основном ограничивается тиоловыми группами цистеинов, введенных методами генетической инженерии. В одном варианте осуществления среднее число фрагментов антибиотика на антитело находится в диапазоне от около 1 до около 20. В некоторых вариантах осуществления диапазон выбирается и контролируется от около 1 до 4.
СПОСОБЫ ПОЛУЧЕНИЯ КОНЪЮГАТОВ АНТИТЕЛО-АНТИБИОТИК
ААС формулы I могут быть получены несколькими способами, использующими реакции органической химии, условия и реагенты, известные специалистам в данной области техники, в том числе: (1) реакцию нуклеофильной группы антитела с двухвалентным линкерным реагентом с образованием Ab-L через ковалентную связь с последующей реакцией с фрагментом антибиотика abx; и (2) взаимодействие нуклеофильной группы фрагмента антибиотика с двухвалентным линкерным реагентом с образованием L-abx, через ковалентную связь с последующей реакцией с нуклеофильной группой антитела. Примеры способов получения ААС формулы I с помощью второго пути описаны в патенте США 7498298, который в явно выраженной форме включен в данное описание посредством ссылки.
Нуклеофильные группы на антителах включают, но не ограничиваются этим: (i) N-концевые, (ii) аминогруппы боковой цепи, например лизина, (iii) тиольные группы боковой цепи, например, цистеина, и (iv) гидроксильные или аминогруппы сахаров, для гликозилированных антител. Аминные, тиоловые и гидроксильные группы являются нуклеофильными и способны вступать в реакцию с образованием ковалентных связей с электрофильными группами на линкерных фрагментах и линкерных реагентах в том числе: (i) активированные сложные эфиры, такие как NHS-эфиры, HOBt-эфиры, галогенформиаты и галогенангидриды кислот; (ii) алкил- и бензилгалогениды, такие как галогенацетамиды; (iii) альдегиды, кетоны, карбоксильные и малеимидные группы. Некоторые антитела имеют восстанавливаемые межцепочечные дисульфиды, т.е. цистеиновые мостики. Антитела могут быть переведены в реактивную форму для конъюгации с линкерными реагентами посредством обработки восстановителем, таким как DTT (дитиотреитол) или трикарбонилэтилфосфин (ТСЕР), таким образом, чтобы антитело полностью или частично восстановилось. Каждый цистеиновый мостик, таким образом, образует, теоретически, два реактивных тиоловых нуклеофилов. Дополнительные нуклеофильные группы могут быть введены в антитело посредством модификации остатков лизина, например, с помощью реакции остатков лизина с 2-иминотиоланом (реагент Траута), в результате чего амин превращается в тиол. Реактивные тиоловые группы могут быть введены в антитело посредством введения одного, двух, трех, четырех или более остатков цистеина (например, посредством получения варианта антител, содержащих один или несколько ненативных остатков аминокислоты цистеина).
Конъюгаты антитело-антибиотик по изобретению могут быть также получены путем реакции между электрофильными группами на антителе, такими как альдегидные или кетонные карбонильные группы, с нуклеофильной группой на линкерном реагенте или антибиотике. Полезные нуклеофильные группы на линкерном реагенте, включают, но не ограничиваются этим, гидразид, оксим, амино, гидразин, тиосемикарбазон, гидразинкарбоксилат и арилгидразид. В одном варианте осуществления антитело модифицируется для введения электрофильных групп, способных реагировать с нуклеофильными заместителями на линкерном реагенте, или антибиотике. В другом варианте осуществления сахара гликозилированных антител могут быть окислены, например периодатными окисляющими реагентами, для образования альдегидных или кетонных групп, которые могут реагировать с аминогруппой линкерных реагентов или фрагментов антибиотиков. Полученные иминные группы основания Шиффа могут образовывать стабильную связь, или могут быть восстановлены, например, боргидридными реагентами с образованием стабильных аминных связей. В одном варианте осуществления реакция углеводной части гликозилированного антитела либо галактозооксидазой, либо метапериодатом натрия может давать карбонильные группы (альдегидов и кетонов) на антителе, которые могут реагировать с соответствующими группами на антибиотике (Hermanson, Bioconjugate Techniques). В другом варианте осуществления антитела, содержащие N-концевые остатков серина или треонина могут реагировать с метапериодатом натрия, что приводит к образованию альдегида вместо первой аминокислоты (Geoghegan & Stroh, (1992) Bioconjugate Chem. 3:138-146; US 5362852). Такой альдегид может взаимодействовать с фрагментом антибиотика или, линкерным нуклеофилом.
Нуклеофильные группы на фрагменте антибиотика включают, но не ограничиваются этим: аминные, тиоловые, гидроксильные, гидразидные, оксимовые, гидразиновые, тиосемикарбазоновые, гидразинкарбоксилатные и арилгидразидные группы, способные реагировать с образованием ковалентных связей с электрофильными группами на линкерных фрагментах и линкерных реагентах в том числе: (i) активированные сложные эфиры, такие как сложные эфиры NHS, HOBt-эфиры, галогенформиаты и галогенангидриды кислот; (ii) алкил- и бензилгалогениды, такие как галогенацетамиды; (iii) альдегиды, кетоны, карбоксильные и малеимидные группы.
Конъюгаты антитела-антибиотик (ААС) в таблице 3 получали посредством конъюгации описанных анти-WTA антител и промежуточных соединений линкер-антибиотик таблицы 2, и в соответствии со способами, описанными в примере 24. ААС были испытаны на эффективность посредством in vitro анализа макрофагов (Пример 18) и in vivo мышиной модели почек (пример 19).
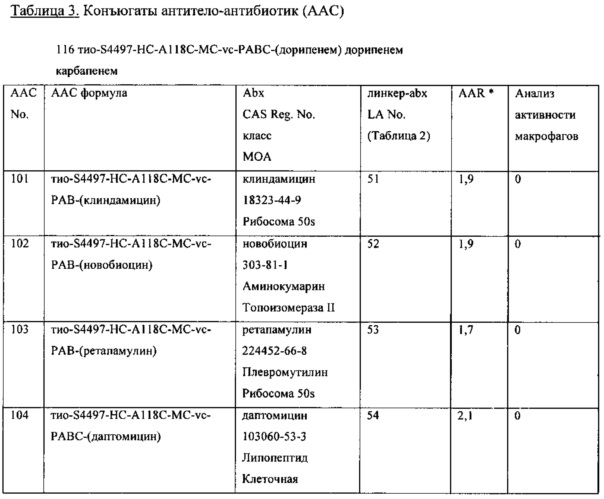
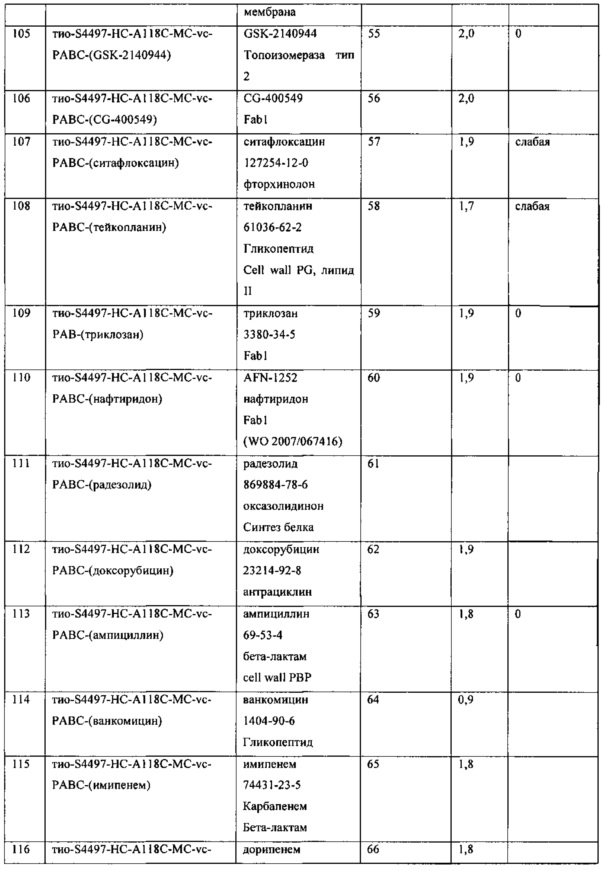
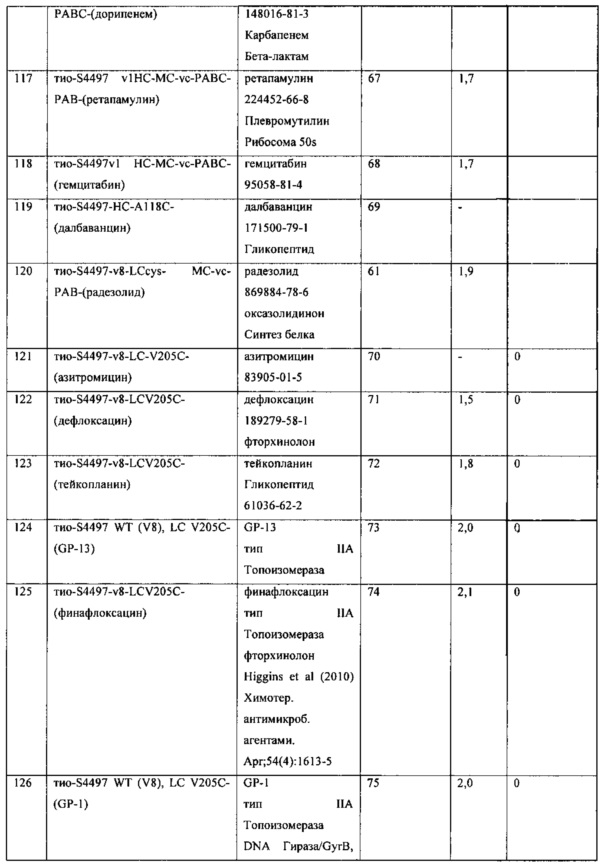
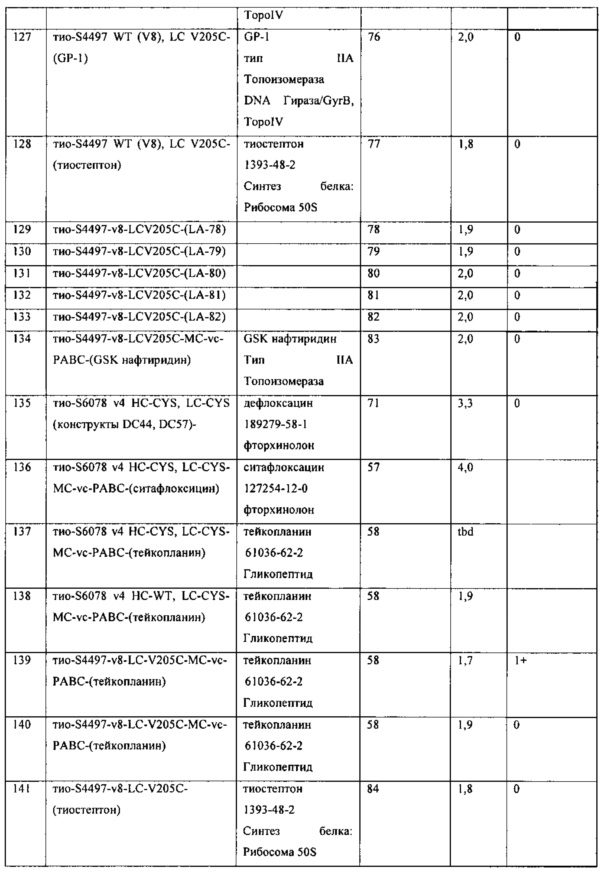
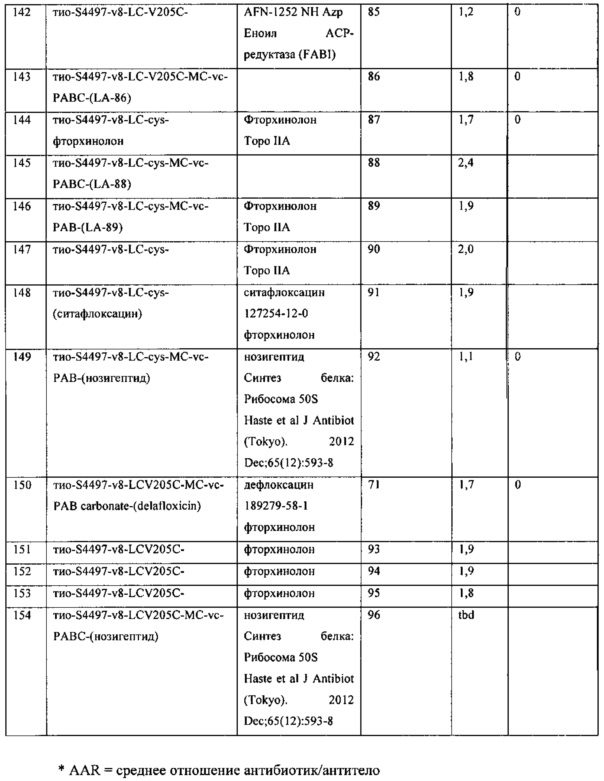
Дикий тип ("WT"), мутантное антитело с «инженерным» Cys ("тио"), легкая цепь ("LC"), тяжелая цепь ("НС"), 6-малеимидокапроил ("МС"), малеимидопропаноил ("MP"), валин-цитруллин ("val-cit" или "vc"), аланин-фенилаланин ("ala-phe"), п-аминобензил ("РАВ") и п-аминобензилоксикарбонил ("РАВС"), НС-А114С Kabat = HC-A118C EU
АНАЛИЗ IN VITRO, ДЕМОНСТРИРУЮЩИЙ, ЧТО ААС УБИВАЮТ ВНУТРИКЛЕТОЧНЫЕ MRSA
Эксперименты in vitro подтверждают, что высвобождение из ААС активного антибиотика происходит только после того, как линкер между антителом и антибиотиком расщепляется с помощью соответствующего фермента, такого как катепсин В. MRSA культивировали в течение ночи в нормальных бактериальных питательные средах до 10 мкг/мл ААС. Инкубация MRSA с ААС S4497-pipBOR или S4497-диметил-pipBOR не приводила к ингибированию роста бактерий если ААС не были предварительно обработаны катепсином В для высвобождения активного антибиотика. Анализ in vitro, использующий мышиные перитонеальные макрофаги подтвердил, что ААС высвобождают активный антибиотик и убивают MRSA внутри фагоцитов (пример 18). ААС, содержащий антитело rFl, которое связывается с семейством белков ассоциированных с клеточными стенками, конъюгировали с производными рифамицина. S. aureus (штамм Newman) обрабатывали различными дозами rF1-ААС или эквивалентными дозами либо только антителами, только рифампицином или смесью антител и свободного рифампицина, чтобы позволить связыванию антитела с бактерией (опсонизация), и через 1 час инкубации опсонированные бактерии поглощались макрофагами (Фиг. 7А).
Фиг. 7А показывает анализ макрофагов in vitro, демонстрирующий, что ААС убивают внутриклеточные MRSA. S. aureus (Newman) инкубировали только с антителом rF1, только со свободным рифампицином, с простой смесью антитела rF1 плюс свободный рифампицин, комбинированный при том же соотношении антител к антибиотику, которое найдено в ААС, или rF1-ААС в течение 1 часа и добавленного к мышиным макрофагам. Макрофаги инкубировали при 37°С в течение 2 часов, чтобы произошел фагоцитоз. После того, как фагоцитоз закончился, инфекцирующую смесь заменяли на нормальную питательную среду с добавлением 50 мкг/мл гентамицина, чтобы ингибировать рост внеклеточных бактерий, и общее количество выживших внутриклеточных бактерий определяли через 2 дня после инфицирования посредством посева.
Макрофаги инфицировали в течение 2 часов и инфекцию был удаляли и заменяли на среды, содержащие гентамицин, чтобы убить все оставшиеся внеклеточные бактерии, которые не были поглощены макрофагами. Через 2 дня, макрофагов лизировали и общее количество выживших внутриклеточных бактерий определяли посредством посева на чашках с агаром. Анализ показал, что лечение с помощью ААС приводило к более чем 100 кратному уменьшению количества внутриклеточных бактерий по сравнению с обработкой с простой смесью антитела rF1 плюс свободный рифампицин, комбинированный с тем же соотношением антитела к антибиотику, которое найдено ААС (Фиг. 7А),
MRSA может проникать в ряд нефагоцитирующих типов клеток, включая остеобласты и различные типы эпителиальных и эндотелиальных клеток (Garzoni and Kelly, (2008) Trends in Microbiology). MRSA может инфицировать линию клеток остеобластов (MG63), линию эпителиальных клеток дыхательных путей (А549) и первичную культуру эндотелиальных клеток пупочной вены человека (HUVEC). Фиг. 7В показывает внутриклеточное уничтожение MRSA (штамм USA300) с помощью 50 мкг/мл ААС 102 S4497-pipBOR в макрофагах, остеобластах (MG63), эпителиальных клеток дыхательных путей (А549) и эндотелиальных клеток пупочной вены человека (HUVEC), причем голое, неконъюгированное антитело S4497 не делает этого. Эти типы клеток, вероятно, экспрессируют более низкие суммарные уровни катепсина В, чем профессиональные фагоцитирующие клетки, такие как макрофаги, однако MRSA, обработанные с помощью 50 мкг/мл, эффективно были уничтожены после интернализации во всех этих трех линий клеток. Пунктирная линия указывает на предел обнаружения анализа.
In vitro анализ проводили для сравнения активности ААС, ролученных с вариациями в линкере, который соединяет антитело с антибиотиком. ААС S4497-диметил-pipBOR является более мощным, чем ААС S4497-pipBOR в макрофагов в анализе внутриклеточного уничтожения. ААС S4497-pipBOR и ААС 84497-диметил-pipBOR титровали для определения минимальной эффективной дозы в нашем анализе внутриклеточного уничтожения в макрофагах (Фиг. 7С). Обработка с по меньшей мере 2 мкг/мл ААС может быть необходимой для достижения оптимального клиренса внутриклеточных бактерий.
Фиг. 7С показывает сравнение ААС, сконструированного с pipBOR 51 с диметил-pipBOR (Dime-pipBOR) 54. MRSA опсонизировали с антителом S4497 только или с ААС: S4497-pipBOR 102 или S4497-диметил-pipBOR 105 в различных концентрациях, начиная от 10 мкг/мл до 0,003 мкг/мл. Эти данные показали, что для обоих ААС оптимальное уничтожение происходило, когда ААС исследовали при более чем 2 мкг/мл с дозозависимой потерей активности, что стало очевидным при 0,4 мкг/мл. Общий уровень гибели был значительно выше с ААС S4497 диметил-pipBOR 105. Обработка с более высокими дозами ААС S4497-диметил-pipBOR 105 элиминировала внутриклеточные бактерии до уровня ниже предела обнаружения и наблюдали более 300 кратную гибель при использовании субоптимальной дозы 0,4 мкг/мл ААС.
При 100 мкг/мл тейкопланина ААС 108 уменьшает КОЕ/лунку от 10000 до около 500. Кроме того, при 100 мкг/мл, то ситафлоксацин ААС 107 КОЕ/лунку уменьшает также от 10000 до около 5000.
Фиг. 7D показывает, что ААС убивает внутриклеточные бактерии без ущерба для макрофагов. USA300 штамм S. aureus предварительно инкубировали с 50 мкг/мл S4497 антителом против S. aureus (антитело) или с 50 мкг/мл тио-S4497-HC-A118C-MC-vc-PAB-диметил-pipBOR 105 ААС в течение 1 часа, чтобы дать возможность связаться антителам с бактериями. Опсонированные бактерии добавляли к мышиным перитонеальным макрофагам при множественном заражении 10-20 бактериями на макрофаг и инкубировали при 37°С в течение 2 часов, чтобы позволить произойти фагоцитозу. После того как фагоцитоз был завершен, свободные бактерии удаляли, и макрофаги культивировали в течение 2 дней в нормальных питательных средах с добавлением 50 мкг/мл гентамицина, для уничтожения неинтернационализировавшихся бактерий. В конце периода культивирования, выживание макрофагов оценивали путем определения высвобождения цитоплазматической лактатдегидрогеназы (LDH) в надосадочную культуральную жидкость. Общее количество ЛДГ, высвобожденное из каждой лунки, сравнивали с контрольными лунками, содержащими макрофаги, которых лизировали добавлением поверхностно-активного вещества в лунки. Измеряли степень лизиса макрофагальных клеток в лунках, обработанных поверхностно-активным веществом, неинфицированных макрофагов, макрофагов, инфицированных US A300, предварительно опсонизированных с помощью S4497 антитела, или макрофагов, инфицированных USA300, предварительно опсонизированных с помощью тио-S4497-HC-A118C-MC-vc-РАВ-диметил-pipBOR 105 ААС.
Фиг. 7Е показывает восстановление живых USA300 из внутренности макрофагов из макрофагальных клеток, лизированных, как описано выше. Макрофаги лизировали и серийные разведения клеточного лизата высевали для подсчета количества выживших внутриклеточных бактерий.
Фиг. 9 показывает исследование ингибирование роста, демонстрирующее, что ААС не являются токсичными для S. aureus, если линкер не расщепляется посредством катепсина В. Принципиальная схема анализа высвобождения катепсина (пример 20) показана слева. ААС обрабатывают катепсином В для высвобождения свободного антибиотика. Общее количество антибиотической активности в интактном по сравнению с катепсин-обработанными ААС определяется посредством приготовления серийных разведений результирующей реакции и определения минимальной дозы ААС, которая способна ингибировать рост S. aureus. Правый верхний график показывает анализа высвобождения катепсина для тио-S4497-HC-A118C-MC-vc-PAB-pipBOR 102, а нижний правый график показывает анализ высвобождения катепсина для тио-S4497-HC-A118C-МС-vc-РАВ-диметил-pipBOR 105.
ЭФФЕКТИВНОСТЬ IN VIVO КОНЪЮГАТОВ АНТИТЕЛО-АНТИБИОТИК
Была разработана in vivo модель перитонита на мышах, чтобы проверить эффективность ААС. В этой модели мышей инфицировали посредством внутрибрюшинной инъекции (IP) MRSA и бактериальную нагрузку контролировали через 2 дня после инфицирования в перитонеальной жидкости и почках. Бактерии, полученные из брюшной полости, могли быть найдены либо как свободно плавающие внеклеточные бактерии, либо как интернализованные внутри перитонеальных клеток - в первую очередь нейтрофилов и макрофагов - которые рекрутируются в места инфекции. Хотя внеклеточные бактерии, идентифицированные в этой модели, по всей видимости, оказались чувствительными к обработке антибиотиками, внутриклеточные бактерии, как было показано, являются неотвечающими на лечение посредством ряда клинически значимых антибиотиков, включая рифампин (Sandberg et al (2009) Antimicrobial Agents Chemother) и, следовательно, всей видимости, оказались отличной мишенью для проверки эффективности нашего ААС.
Фиг. 8А показывает эффективность in vivo S4497-pipBOR ААС 102. Модель внутрибрюшинной инфекции у A/J мышей. Мышей инфицировали 5×107 КОЕ MRSA посредством внутрибрюшинной инъекции и обрабатывали только 50 мг/кг антителами S4497 (50 мг/кг) или 50 мг/кг S4497-pipBOR ААС 102 посредством внутрибрюшинной инъекции (протокол 11-2032А). Мышей умерщвляли через 2 дня после инфицирования, а общую бактериальную нагрузку оценивали в брюшном супернатанте (внеклеточные бактерии), перитонеальные клетки (внутриклеточные бактерии) или в почках.
A/J мышей инфицировали с USA300 и вводили 50 мг/кг либо антитело S4497, либо S4497-pipBOR ААС 102 через тридцать минут после инфицирования. Через 2 дня мышей умерщвляли и контролировали бактериальную нагрузку в перитонеальных смывах и почках. Чтобы различить внеклеточные и внутриклеточные бактерии, перитонеальные смывы аккуратно центрифугировали для отделения супернатанта, содержащего внеклеточные бактерии и перитонеальные клетки. Перитонеальные клетки обрабатывали лизостафином, чтобы убить любые контаминирующие внеклеточные бактерии, и лизировали, чтобы посчитать общее количество внутриклеточных бактерий на момент сбора клеток. Хотя мыши, обработанные только антителом собрали между 105 и 106 КОЕ как внутриклеточных, так и внеклеточных бактерий в перитонеальные смывы, и между 104 и 106 бактерий в почках, мыши, обработанные S4497-pipBOR ААС, очистились от инфекции ниже предела обнаружения. Эти данные показали, что, хотя ААС предназначен для высвобождения активного антибиотика внутри фаголизосомы, наблюдалось отличное очищение как от внутриклеточных, так и внеклеточных пулов MRSA. Так как внеклеточные бактерии не погибли непосредственно от ААС, тот факт, что эти бактерии также были удалены посредством обработки ААС предполагает, что либо значительная часть внеклеточных бактерий была поглощена клетками в какое-то время в течение инфекции, либо что ААС способен усиливать поглощение внеклеточных бактерий, тем самым увеличивая относительную пропорцию бактерий, которые являются внутриклеточными, где они эффективно уничтожаются ААС.
Также была проверена эффективность ААС в модели внутривенной инфекции. В этой модели S. aureus поглощаются циркулирующими нейтрофилами вскоре после инфицирования, так что большинство бактерий, находящиеся в крови, связываются с клетками-хозяевами в течение нескольких минут после инфицирования (Rogers, et al (1956) J. Exp. Med. 103:713-742). A/J мышей инфицировали 2×106 КОЕ MRSA посредством внутривенной инъекции, а затем обрабатывали 50 мг/кг ААС посредством внутривенной инъекции через 30 минут после инфицирования. В этой модели первичным сайтом инфекции являются почки, и у мышей развиваются обширные абсцессы, которые обнаруживаются в течение двух дней после инфицирования и не могут быть ликвидированы за 30 дней при отсутствии лечения. Обработка с помощью 50 мг/кг в S4497-pipBOR ААС 102 ликвидировали инфекцию у всех исследованных мышей (Фиг. 8В).
Фиг. 8В показывает модель внутривенной инфекции A/J мышей. Мышей инфицировали 2×106 КОЕ посредством внутривенной инъекции и обрабатывали с помощью 50 мг/кг антитела S4497, 50 мг/кг S4497-pipBOR ААС 102 или простой смесью 50 мг/кг S4497 антитела +0,5 мг/кг свободного рифамицина. Лекарственные средства были доставлены посредством внутривенной инъекции через 30 минут после инфицирования, и почки исследовали через 4 дня после инфицирования. Серая пунктирная линия показывает предел обнаружения для каждого органа. В контрольных группах, обработанных с помощью только 50 мг/кг S4497 антитела или простой смесью 50 мг/кг S4497 антитела плюс 0,5 мг/кг свободного рифамицина (в дозе, эквивалентной антибиотику, присутствующему в 50 мг/кг ААС) эффекта не наблюдалось.
Эффективность ААС, сконструированного с помощью с pipBOR и диметил-pipBOR фрагментов антибиотика сравнивали в модели внутривенного заражения in vivo у A/J мышей. S4497-pipBOR ААС 102 (Фиг. 9А) или S4497-диметил-pipBOR ААС 105 (Фиг. 9В) вводили в различных дозах от 50 мг/кг до 2 мг/кг через 30 минут после инфицирования, и почки исследовали через 4 дня после инфицирования, чтобы определить общую бактериальную нагрузку. Фиг. 9А показывает эффективность pipBOR ААС 102 в модели внутривенной инфекции посредством титрования S4497-pipBOR ААС 102. Семинедельных самок A/J мышей инфицировали 2×106 КОЕ MRSA (штамм USA300) посредством внутривенной инъекции в хвостовую вену. Фиг. 9В показывает эффективности диметил-pipBOR ААС 105 в модели внутривенной инфекции посредством титрования ААС S4497-диметил-pipBOR 105. Лекарственные средства с S4497 антителом, ААС 102 или ААС 105 вводили в указанных дозах через 30 минут после инфицирования. Мышей умерщвляли через 4 дня после инфицирования и общее количество выживших бактерий на мышь (2 объединенные почки) определяли посредством посева.
Оба ААС были эффективны при самой высокой дозе 50 мг/кг, однако S4497-pipBOR ААС 102 был только частично эффективен в более низких дозах. S4497-диметил-pipBOR ААС 105 приводил к полному очищению от бактерий при дозах выше 10 мг/кг. Последующие эксперименты показали, что дозы выше 15 мг/кг, были необходимы для уверенной бактериальной очистки. Фиг. 9А и 9Б показывают, что тио-S4497-HG-A118C-MC-vc-PAB-диметил-pipBOR 105 ААС является более эффективным, чем тио-S4497-HC-A118C-MC-vc-PAB-pipBOR 102 ААС в модели внутривенной инфекции, указывая на эффект карбамата (51) и диметилпиперидила (54), как структурного различия между 102 и 105, соответственно.
Мышей обрабатывали с помощью ААС через 30 минут после инфицирования. Чтобы лучше повторять условия, которые, вероятно, возникают у больных, нуждающихся в лечении от MRSA, определяли, является ли ААС эффективным при очистке установленной инфекции и как связывание антибиотика с анти-S. aureus антителом обеспечивает определенные преимущества перед лечением только антибиотиками. С этой целью сравнивали эффективность ААС с эквивалентной дозой антибиотик-диметил-pipBOR.
Фиг. 9С показывает CB17.SCID мышей, зараженных 2×107 КОЕ MRSA посредством внутривенной инъекции (протокол 12-2418). На следующий день после инфицирования мышей обрабатывали 50 мг/кг антителом S4497, 50 мг/кг S4497 диметил-pipBOR ААС 105 или 0,5 мг/кг диметил-pipBOR антибиотик 7, в дозе антибиотика, эквивалентной той, в которой он содержится в 50 мг/кг ААС). Мышей умерщвляли через 4 дня после инфицирования и определяли общее количество выживших бактерий на мышь (объединенные 2 почки) посредством посева. Обработка с 50 мг/кг S4497-диметил-pipBOR ААС была явно эффективна при введении через 1 день после инфицирования, тогда как при обработке с эквивалентной дозой диметил-pipBOR только не удалось очистить от инфекции.
ОБРАБОТКА С ААС ЯВЛЯЕТСЯ ЭФФЕКТИВНОЙ В ПРИСУТСТВИИ АНТИТЕЛ ЧЕЛОВЕКА И ПРЕВОСХОДИТ ОБРАБОТКУ В СООТВЕТСТВИИ С ТЕКУЩИМ СТАНДАРТОМ МЕДИЦИНСКОЙ ПОМОЩИ (SOC) ВАНКОМИЦИНОМ
S4497 антитела клонировали из В-клеток, полученных из пациентов, инфицированных S. aureus. Это вызвало опасения, что нормальная человеческая сыворотка или сыворотка, присутствующая в пациентах, инфицированных MRSA, может содержать анти-MRSA антитела, которые могли бы конкурировать за связывание с нашим ААС. Для решения этой проблемы, человеческая сыворотка, полученная из нормальных здоровых доноров и панели больных MRSA, была протестирована для оценки общего уровня анти-MRSA антител, которые распознают тот же антиген, что и ААС. Был разработан анализ на основе ИФА с использованием препаратов клеточной стенки из MRSA. Чтобы ограничить не антиген-специфическое связывание к препаратам клеточной стенки в этих анализах, был использован штамм MRSA, который является дефицитным по гену белка А. Белок А связывается с Fc-областью антител IgG. Связывание различных образцов сыворотки дикого типа (WT) с MRSA, которые экспрессируют S4497 антиген (Фиг. 10А, WT), исследовали в сравнении со связыванием с мутантом MRSA штамм TarM/TarS DKO (двойной нокаут), в котором отсутствует модификации сахара, которые узнаются антителом S4497. Фиг. 10А показывает распространенность анти-S. aureus антител в сыворотке крови человека. Пациенты, инфицированные S. aureus, или нормальный контроль содержали большое количество сывороточных антител, специфических к WTA, с той же специфичностью, что и анти-WTA S4497.
Стандартную кривую генерировали с использованием моноклональных антител, которые хорошо связываются с тем же антигеном, которое узнается S4497. Посредством сравнения уровня связывания в образцах сыворотки с сигналом, полученным от антитела, используемого для генерации стандартной кривой, оценивали уровень анти-MRSA-антител, присутствующих в сыворотке, полученных от нормальных здоровых доноров и MRSA-пациентов, или в препаратах общих IgG, выделенных из нормальной сыворотки (Фиг. 10А). Нормальная человеческая сыворотка содержит 10-15 мг/мл общего IgG (Manz et al. (2005) Annu Rev. Immunol. 23:367). Анализ реактивности анти-MRSA в разных образцах сыворотки показал, что до 300 мкг/мл этих антител являются потенциально реактивными с тем же антигеном, узнаваемым посредством S4497 и, следовательно, могут конкурировать за связывание с ААС.
S4497 антитела использовали, чтобы генерировать ААС для изучения свойств, включающих очень высокое связывание MRSA (по оценкам 50000 сайтов связывания на бактерию). Достаточное число ААС может быть способным связываться с MRSA даже в присутствии конкурирующих антител, обнаруженных в сыворотке человека. Чтобы проверить это непосредственно, S4497-диметил-pipBOR ААС в буфере, дополненном 10 мг/мл человеческого IgG (Фиг. 10В, +IGIV) оттитровывали, и измеряли уровень внутриклеточного уничтожения с помощью анализа внутриклеточного уничтожения в макрофагах.
Фиг. 10В показывает модель инфекции in vivo, демонстрирующую, что ААС является эффективным в присутствии физиологических уровней человеческого IgG. Анализ макрофагов in vitro со штаммом USA300 MRSA показывает, что S4497-диметил-pipBOR ААС 105 является эффективным в присутствии 10 мг/мл человеческого IgG. USA300 штамм MRSA опсонизировали с помощью ААС только, или с помощью ААС, разбавленного в 10 мг/мл IgG человека в течение 1 часа при 37°С при встряхивании. Опсонированные бактерии добавляли непосредственно к мышиным перитонеальным макрофагам и инкубировали в течение 2 часов, чтобы произошел фагоцитоз. После инфицирования макрофагальную культуру поддерживали в полной среде с гентамицином, и оценивали общее количество выживших внутриклеточных бактерий через 2 дня после инфицирования. Эти данные показали, что, хотя человеческие IgG действительно ингибируют уничтожение посредством ААС при более низких дозах, отличное уничтожение достигается с использованием доз выше 10 мкг/мл, концентрации антитела, которая легко достижима in vivo. Нормальный сывороточный IgG может уменьшить функциональный эффект 105 ААС. Так как максимальная активность но внутриклеточному уничтожению в макрофагах посредством ААС может потребовать как высокую степень связывания антигена, так и эффективное взаимодействие с FcRs (для опсонофагоцитоза), предсуществующие в сыворотке антитела могут как конкурировать за связывание с WTA, так и образующиеся соответствующие иммунные комплексы могут конкурировать за связывание с FcRs на макрофагах.
Чтобы подтвердить, что ААС будет эффективным в присутствии конкурирующих человеческих антител in vivo, модель инфекции in vivo была изменена, чтобы генерировать мышей, которые экспрессируют нормальный уровень человеческого IgG в сыворотке. CB17:SCID мышей, у которых отсутствует как Т-клетки, так и В-клетки и, поэтому они не имеют антител в сыворотке (Bosna & Carroll, (1991) Ann Rev Immunol. 9:323), восстанавливали ежедневно вводя высококонцентрированные человеческих IgG (IGIV) по 10 мг/мл человеческого IgG Предварительные исследования подтвердили, что у этих мышей, называемых SCID:huIgG, действительно поддерживался уровень по меньшей мере 10 мг/мл человеческих IgG в сыворотке, и что эти мыши были также чувствительны к инфекции с MRSA по сравнению с необработанными контрольными. SCID:huIgG мышей инфицировали MRSA и обрабатывали либо с S4497 антителом, либо с ААС S4497-диметил-pipBOR (50 мг/кг) через 1 день после инфицирования. Через четыре дня после инфицирования оценивали бактериальную нагрузку в почках (Фиг. 10С).
Фиг. 10С показывает объединенные данные от 3 независимых экспериментов, использующих 2 отдельных препарата тио-S4497-HC-A118C-МС-vc-РАВ-диметил-pipBOR ААС 105 или 112. CB17.SCID мышей восстанавливали с помощью человеческих IgG с использованием режима дозирования, оптимизированного для получения постоянного уровня по меньшей мере 10 мг/мл человеческих IgG в сыворотке. Мышей обрабатывали антителом S4497 (50 мг/кг), или S4497-диметил-pipBOR AAC (50 мг/кг). У мышей, обработанных ААС, наблюдалось уменьшение бактериальной нагрузки больше, чем на 4 порядка в (t-критерий Стьюдента р=0,0005). У мышей, обработанных S4497-диметил-pipBOR ААС по сравнению с контрольными мышами, обработанными с S4497 антителами, бактериальные нагрузки были в среднем более чем в 10000 par ниже, что свидетельствует о том, что ААС явно эффективен даже в присутствии высоких уровней конкурирующих человеческих анти-MRSA антител.
Эффективность ААС сравнивали с эффективностью лечения с помощью ванкомицина, современного стандарта лечения MRSA-инфекций. Фиг. 11А показывает модели инфекции in vivo, демонстрирующей, что ААС более эффективны, чем современный стандарт лечения (SOC) с помощью антибиотика ванкомицина у мышей, которых восстановили до нормального уровня человеческих IgG. Мышам CB17.SCID восстанавливали с помощью человеческих IgG с использованием режима дозирования, оптимизированного для получения постоянного уровня по меньшей мере 10 мг/мл человеческих IgG в сыворотке. Мышей обрабатывали с антителом S4497 (50 мг/кг), ванкомицином (100 мг/кг), S4497-диметил-pipBOR ААС (50 мг/кг, 112) или ААС, сконструированном изотипическим контрольным антителом, которое не узнает MRSA, тио-hu-anti gD 5B5-HC-A118C-MC-vc-PAB-диметил-pipBOR ААС 110 (50 мг/кг). Мыши, получающие ААС, получали одну дозу ААС на 1 день после инфицирования посредством внутривенной инъекции. Мыши, получающие обработку ванкомицином, получали два раза в день инъекции антибиотика посредством внутрибрюшинной инъекции. Всех мышей умерщвляли на 4-й день после инфицирования, а общее число выживших бактерий на одну мышь (объединенные 2 почки) определяли посредством посева.
Обработка ванкомицином является эффективным при лечении MRSA-инфекции в нашей мышиной модели внутривенной инфекции, если обработка начата через 30 минут после инфицирования. Дозирование дважды в день с 100 мг/кг ванкомицина не приводит к освобождению от инфекции, а только в состоянии уменьшить бактериальную нагрузку примерно в 50 раз, когда лечение было начато более чем через 1 день после инфицирования (Фиг. 11А). Поразительно, обработка с помощью однократной дозы S4497-диметил-pipBOR ААС через 1 день после инфицирования способна освободить от инфекции большинство мышей. Удивительно, обработка с помощью контрольных ААС сконструированными с человеческими антителами IgG, которые не узнают S. aureus (gD-ААС), имеет некоторую эффективностью в этой модели. gD-антитела не узнают S. aureus посредством антигенсвязывающего участка, однако антитело способно связываться с белком А, найденным на S. aureus.
Фиг. 11С показывает модель инфекции in vivo, демонстрирующая, что ААС, тио-S6078-HC A114C-LCWT-MC-vc-PAB-диметил-pipBOR, rifa-129 является более эффективным, чем голое антитело анти-WTA S4497, в соответствии с тем же режимом, как на Фиг. 11А, у мышей, у которых восстанавливают нормальные уровни человеческего IgG. У мышей CB17.SCID восстанавливали IgG человека с использованием режима дозирования, оптимизированного для получения постоянного уровня по меньшей мере 10 мг/мл человеческих IgG в сыворотке. Мышей обрабатывали антителом S4497 (50 мг/кг) или тио-S6078-HC-A114C LCWT-MC-vc-PAB-диметил-pipBOR, rifa-129 ААС (50 мг/кг).
Анализ FACS, показал, что окрашивание при высоких концентрациях gD антитела на бактериях, выделенных из инфекций in vivo, дает низкий уровень связывания с S. aureus по отношению к связыванию анти-MRSA антител с MRSA, выделенных из инфицированных почек (Фиг. 11В). Мышей инфицировали MRSA посредством внутривенной инъекции и инфицированные почки удаляли через 3 дня после инфицирования и гомогенизировали. Анти-MRSA или контрольные антитела метили Alexa-488 и исследовали в диапазоне концентраций от 0,08 мкг/мл и 50 мкг/мл. Антитело S4497 распознает модификацию N-ацетилглюкозамина, который связан со стеночной тейхоевой кислотой (WTA) через бета-аномерную связь на клеточной стенке S. aureus. Антитело 7578 связывается с аналогичным модификации N-ацетилглюкозамина, который присоединен к WTA с помощью альфа-аномерной связи. Антитело rF1 является положительным контролем для анти-MRSA антитела, которое распознает модификации сахара, найденные на семействе белков, заякоренных на клеточной стенке, содержащих SDR-повтор (повтор серин аспартат). gD-антитело представляет собой отрицательный контроль человеческих IgG1, которые не распознают S. aureus. Хотя в целом уровень связывания с gD-антителом значительно ниже, чем полученный с антителом S4497 (по оценкам, по меньшей мере, в 30 раз ниже, посредством анализа FACS, Фиг. 11В), ограниченная эффективность, наблюдаемая с gD-AAC, показывает, что даже низкий уровень связывания ААС на MRSA in vivo достаточен, чтобы получить эффективность, которая очевидно эквивалентна уменьшению КОЕ, полученная с ванкомицином.
Приведенные выше данные ясно показывают, что ААС способны уничтожить внутриклеточные MRSA, и что S4497-pipBOR и S4497 диметил-pipBOR ААС эффективны при ограничении инфекции MRSA как in vitro, так и in vivo. ААС по изобретению действуют, убивая бактерии внутри клеток млекопитающих и таким образом обеспечивают уникальный терапевтический препарат, который является более эффективным для уничтожения популяций бактерий, которые устойчивы к обработке ванкомицином.
Фиг. 20 показывает, что предварительная обработка с 50 мг/кг свободных антител не эффективна в модели внутривенной инфекции. BALB/C мышам вводили в разовой дозе носитель в качестве контроля (PBS) или 50 мг/кг антител посредством внутривенной инъекции за 30 минут перед инфицированием 2×107 КОЕ USA300. Лечебные группы включали изотипические контрольные антитела, которые не связывается с S; aureus (gD), антитело, направленное против бета-модификации стеночной тейхоевой кислоты (4497) или антитело, направленное против альфа-модификации стеночной тейхоевой кислоты (7578). Контрольным мышам дважды в день вводили в качестве средства для лечения 110 мг/кг ванкомицина посредством внутрибрюшинной инъекции (Vanco). Всех мышей умерщвляли на 4-й день после инфицирования, и определяли общее число выживших бактерий в почках (объединенные 2 почки) посредством посева. Хотя предварительная обработка ванкомицином освобождала от инфекции во всех подвергаемых испытанию мышей, предварительная обработка антителами, направленными против клеточной стенки S. aureus, не оказывает никакого влияния на бактериальные нагрузки.
Фиг. 21 и 22 показывают, что ААС, направленный против бета-модификации стеночной тейхоевой кислоты или альфа-модификации стеночной тейхоевой кислоты, являются эффективными в модели внутривенной инфекции на мышах, у которых восстанавливают нормальный уровень человеческого IgG. У мышей CB17.SCID восстанавливали IgG человека с использованием режима дозирования, оптимизированного для получения постоянного уровня по меньшей мере 10 мг/мл человеческих IgG в сыворотке и инфицировали 2×107 КОЕ USA300 посредством внутривенной инъекции. Обработку начинали через 1 день после инфицирования буфером только в качестве контроля (PBS), 60 мг/кг бета-WTA ААС (136 ААС) или 60 мг/кг альфа-WTA ААС (155 ААС). Мышей умерщвляли на 4-й день после инфицирования, и определяли общее число выживших бактерий из почек (объединенные 2 почки, Фиг. 21) и сердца (Фиг. 22) посредством посева. Обработка с бета-WTA ААС приводила к 100000-кратному снижению бактериальной нагрузки в почках по сравнению с мышами, которых обрабатывали носителем в качестве контроля. Обработка с ААС альфа-WTA приводила в среднем к 9000-кратному снижению бактериальной нагрузки в почках.
На сегодняшний день остается неясным, почему в доступные настоящее время антибиотики часто оказываются неэффективными для уничтожения внутриклеточных депо бактерий. Антибиотики могут потерпеть неудачу потому, что либо они не достигают достаточной концентрации внутри клеток, либо потому, что они не входят в фаголизосомальный компатмент, где обитают бактерии внутриклеточного депо, либо потому, что они могут быть подвергаться воздействию эффлюксных насосов, которые удаляют антибиотик из клеток млекопитающих. Антибиотики могут повреждаться в жестких условиях, найденных внутри фаголизосомы, включая низкий pH, восстанавливающие агенты и окисляющие агенты, которые высвобождаются, в частности, для того чтобы уничтожить фагоцитированные бактерии. Кроме того, антибиотики могут потерпеть неудачу потому, что в бактерии стимулируются защитные механизмы или не могут произвести делениеи внутри фаголизосомы и поэтому оказываются временно нечувствительными к антибиотикам. Относительная важность этих механизмов устойчивости к антибиотикам будет отличаться для разных патогенов и для каждого антибиотика. Антибиотический компонент нашего ААС, pipBOR и диметил-pipBOR действительно является более мощным, чем рифампицин что касается уничтожения внутриклеточных MRSA при исследовании в виде свободных антибиотиков. Связь этих антибиотиков с антителом обеспечивает реальное дозозависимое увеличение эффективности, что проявляется in vivo (Фиг. 9С). В этом случае улучшается эффективность в ААС по сравнению с антибиотиком только, скорее всего, вследствие комбинации его способности опсонизировать бактерии и улучшенной фармакокинетики ААС. Большинство свободных антибиотиков быстро выводятся in vivo и требуют повторного приема с высокой концентрацией антибиотика, чтобы поддерживать достаточную концентрацию антибиотика в сыворотке крови. В противоположность этому, ААС имеют длинные периоды полураспада в сыворотке вследствие присутствия части молекулы антитела. Так как ААС высвобождает антибиотик только после связывания с S. aureus, причем транспортируясь вместе с бактерией в ограниченное пространство фаголизосомы, они концентрируют небольшие дозы антибиотиков специфически в нише, где большинство антибиотиков терпит неудачу. Таким образом, в дополнение к нацеливанию в защищенные резервуары внутриклеточных бактерий, AAC могут облегчать использование более мощных антибиотиков, которые могут оказаться слишком токсичными для использования в качестве единственного агента, посредством ограничения высвобождения антибиотика местом, где он наиболее необходим.
МЕТОДЫ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ИНФЕКЦИЙ С ПОМОЩЬЮ КОНЪЮГАТОВ АНТИТЕЛО-АНТИБИОТИК
ААС по изобретению являются полезными в качестве противомикробных агентов, эффективных против ряда патогенов человека и животных, грамположительных бактерий, в том числе стафилококков, например S. aureus, S. saprophyticus и S. simulans; Listeria, например, Listeria monocytogenes; Enterococci, например, E. faecalis; Streptococci, например, S. pneumoniae; Clostridium, например, C. difficile.
Стойкая бактериемия может быть результатом интернализации в клетки-хозяев. Хотя пока нет полного понимания этого, интернализованные патогены способны избежать иммунного распознавания посредством выживания внутри клеток-хозяев. Такие организмы включают S. aureus, Salmonella (например, S. typi, S. choreraesuis и S. enteritidis), Legionella (например, L. pneumophila), Listeria (например, L. monocytogenes), Brucella (например, В. abortus, В. melitensis, В. suis), Chlamydia (C. pneumoniea, C. trachomati), Rickettsia spp., Shigella (например, S. flexneri), и mycobacteria.
После поступления в кровоток S. aureus может привести к метастатической инфекции практически в любом органе. Вторичные инфекции встречаются примерно в одной трети случаев перед началом терапии (Fowler et al., (2003) Arch. Intern. Med. 163:2066-2072), и даже у 10% пациентов после начала терапии (Khatib et al., (2006) Scand. J. Infect. Dis., 38:7-14). Признаками инфекций являются крупные резервуары гноя, разрушение ткани, и формирование абсцессов (все из которых содержат в больших количествах нейтрофилы). В то время как только у около 5% больных развиваются осложнения, если бактериемия резко уменьшается в течение 48 часов, уровни повышаются до 40%, если бактериемия персистирует за пределами трех дней.
В то время как S. aureus, как правило, считаются внеклеточным патогенном, которые секретирует токсины, существуют доказательства того, что они могут выжить в эндотелиальных клетках, кератиноцитах, фибробластах и остеокластах (Alexander et al, (2001) Appl. Microbiol. Biotechnol. 56:361-366; Garzoni et al, (2009) Trends Microbiol. 17:59-65). Нейтрофилы и макрофаги являются ключевыми компонентами врожденного иммунного ответа организма-хозяина на бактериальные инфекции. Эти клетки интернализуют S. aureus посредством фагоцитоза, который может быть усилен за счет антител, комплемента или лектинов хозяина, таких как манноза-связывающий белок, которые могут связываться одновременно с патогеном и нейтрофилами, макрофагами и другими профессиональными фагоцитами. Как упоминалось ранее, S. aureus не тольх выживает в среде лизосом, но в действительности может использовать это в качестве механизма для развития персистентности в организме-хозяине.
Конъюгаты антитело-антибиотик (ААС) по изобретению имеют значительные терапевтические преимущества для лечения внутриклеточных патогенов, в том числе таких, которые живут в фаголизосомах. В одном варианте осуществления патоген интернализуется в клетках лейкоцитов и внутриклеточный компонент представляет собой фаголизосому. В интактном ААС вариабельная область антитела связывается с антигеном клеточной поверхности на бактерии (опсонизация). Не ограничиваясь какой-либо одной теории, одним механизмом, посредством антительного компонента ААС, связываясь с бактериальной клеточной поверхностью, бактерии становятся привлекательными для фагоцитов. Fc-часть антитела связывается с Fc-рецептором на фагоцитах, что облегчает фагоцитоз. После того, как комплекс ААС-бактерии фагоцитируются, при слиянии с лизосомой с ААС-линкер расщепляется под воздействием фаголизосомальных ферментов, высвобождая активный антибиотик. Вследствие ограниченного пространства и относительно высокой локальной концентрации abx (около 104 на бактерию), это приводит к тому, что фаголизосома больше не поддерживает выживание внутриклеточного возбудителя (Фиг. 5). Поскольку ААС является по существу неактивным пролекарством, терапевтический индекс антибиотика может быть расширен по отношению к свободной (неконъюгированной форме). Антитело обеспечивает специфическое нацеливание на патоген, в то время как расщепляемый линкер расщепляется в условиях, характерных для внутриклеточной локализации возбудителя. Эффект может быть как непосредственно на опсонизированный патоген, а также на другие патоген, которые совместно локализованы в фаголизосоме. В конкретном аспекте патоген представляет собой S. aureus.
Толерантность к антибиотику представляет собой способность болезнетворного возбудителя противостоять уничтожение антибиотиками и другими препаратами и механистически отличается от множественной лекарственной устойчивости (Lewis K (2007). "Persister cells, dormancy and infectious disease". Nature Reviews Microbiology 5 (1) 48-56. doi:10.1038/nrmicro1557). Скорее всего, эта форма толерантности обусловливается небольшой субпопуляцией микробных клеток, называемых персистерами (Bigger JW (14 October 1944). "Treatment of staphylococcal infections with penicillin by intermittent sterilization". Lancet 244 (6320): 497-500). Эти клетки не обладают множественной лекарственной устойчивостью в классическом смысле, а, скорее, представляет собой дормантные клетки, которые устойчивы к обработке антибиотиками, которые могут убить их генетически идентичных сиблингов. Эта толерантность к антибиотикам индуцируется посредством физиологического состояния с отсутствием или крайне редким делением. Когда антимикробное лечение не удается искоренить эти клетки-персистеры, они становятся резервуаром для рекуррентных хронических инфекций. Конъюгаты антитело-антибиотик по изобретению обладают уникальным свойством убивать эти клетки-персистеры и подавлять появление бактериальных популяций с мультилекарственной толерантностью.
В другом варианте осуществления ААС согласно изобретению может быть использован для лечения инфекции, независимо от внутриклеточного компартмента, в которой патоген выживает.
В другом варианте осуществления ААС также могут быть использованы для нацеливания на бактерии в планктонных формах или форме биопленки (пример: S: aureus, K. pneumonia, Е. coli, A. baumannii, P. aeruginosa и Enterobacteriaceae) посредством опосредованной антителами опсонизации, которая приводит к интернализации профессиональными фагоцитами. Когда фагосомы сливаются с лизосомой, достаточно высокие концентрации свободного антибиотика высвобождаются из ААС в кислой или протеолитической среде фаголизосомы для уничтожения фагоцитированного патогена.
Способы лечения инфекции с помощью конъюгатов антитело-антибиотик (ААС) по изобретению, включают лечение бактериальных инфекций легких, таких как S. aureus пневмония или туберкулезные инфекции, бактериальные глазные инфекции, такие как трахома и конъюнктивит, сердечные, мозговые или кожные инфекции, инфекции желудочно-кишечного тракта, такие как диарея путешественника, остеомиелит, неспецифический язвенный колит, синдром раздраженной толстой кишки (IBS), болезнь Крона, и IBD (воспалительное заболевание кишечника) в общем, бактериальный менингит и абсцессы в любом органе, таких как мышцы, печень, оболочки головного мозга или легкие. Бактериальные инфекции могут быть и в других частях тела, таких, как мочевыводящие пути, кровоток, раны или места введения катетера. ААС по изобретению полезны для трудно поддающихся лечению инфекций, которые включают биопленки, имплантаты или сайты тканей, недосягаемые для действия цитостатических препаратов (например, остеомиелит и инфекции протезирования суставов), и инфекции с высокой смертностью, такие как внутрибольничные пневмонии и бактериемии. Уязвимые группы пациентов, которые могут быть обработаны для предотвращения инфекции Staphylococcal aureus включают пациентов гемодиализа, пациентов с ослабленным иммунитетом, пациентов в отделениях интенсивной терапии и некоторых хирургических пациентов.
В другом аспекте настоящее изобретение относится к способу уничтожения, лечения или профилактики микробной инфекции у животного, предпочтительно млекопитающего и наиболее предпочтительно у человека, который включает введение животному ААС или фармацевтической композиции с ААС по изобретению. Кроме того, настоящее изобретение предназначается для лечения или профилактики заболеваний, ассоциированных с такими микробными инфекциями, или которые воспользовавшись ситуацией следуют из таких микробных инфекций). Такие методы лечения или профилактики могут включать пероральное, местное, внутривенное, внутримышечное или подкожное введение композиции по настоящему изобретению. Например, перед операцией или же перед введением внутривенного катетера, в отделение интенсивной терапии, в трансплантационной медицине, во время или после химиотерапии рака; или других действий, которые несут высокий риск инфекции, ААС по изобретению могут быть введены, чтобы предотвратить возникновение или распространение инфекции.
Бактериальная инфекция может быть вызвана бактериями в активной и неактивной форме, и ААС вводят в количестве и в течение времени, достаточным для лечения как активной, так и неактивной, скрытой формы бактериальной инфекции, длительность лечения которых больше, чем необходимо для лечения активной формы бактериальной инфекции.
Анализ различных Gram+ бактерий, показал, что WTA бета экспрессируется на всех S. aureus, включая MRSA и MSSA штаммы, также штаммы, отличные от Staph aureus, такие как S. saprophyticus и S. simulans. WTA альфа (альфа-GlcNAc рибит WTA) присутствует на большинстве, но не во всех S. aureus, а также присутствует на Listeria monocytogenes. WTA не присутствует на грамотрицательных бактериях. Поэтому одним из аспектов настоящего изобретения является способ лечения пациента, инфицированного S. aureus, или S. saprophyticus, или S. simulans посредством введения терапевтически эффективного количества анти-WTA бета-ААС по изобретению. Другой аспект настоящего изобретения представляет собой способ лечения пациента, инфицированного S. aureus или Listeria monocytogenes посредством введения терапевтически эффективного количества анти-WTA альфа-ААС по изобретению. Изобретение также относится к способу профилактики инфекций S. ureus, или S. saprophyticus, или S. simulans посредством введения терапевтически эффективного количества анти-WTA бета-ААС по изобретению в стационарных условиях, таких как операционные, ожоговые пациенты, и при трансплантации органов.
Лечение пациента, нуждающегося в лечении бактериальной инфекции, как определено врачом, специалистом в данной области техники, возможно, уже состоялось, но не нуждается в диагностике о виде бактерий, которыми он/она инфицированы. Поскольку состояние пациента с бактериальной инфекции может изменяться к худшему очень быстро, в течение нескольких часов, пациенту при поступлении в больницу можно вводить анти-WTA-AAC по изобретению вместе с одним или несколькими Abx в соответствии со стандартом лечения, такого как ванкомицин. Когда диагностические результаты становятся доступны и указывают на наличие, например, S. aureus в инфекции, пациент может продолжать лечение с помощью анти-WTA ААС. Таким образом, в одном варианте осуществления способа лечения бактериальной инфекции или в частности инфекции S. aureus пациенту вводят терапевтически эффективное количество анти-WTA бета ААС.
В способах лечения или профилактики в соответствии с настоящим изобретением ААС по изобретению можно вводить в качестве единственного терапевтического агента, либо в сочетании с другими агентами, такими как те, которые описаны ниже. ААС по изобретению показывает превосходство над ванкомицином в лечении. MRSA в доклинических моделях. Сравнение ААС и SOC (стандарт лечения) может быть осуществлено, например, посредством сравнения уменьшения смертности.
Пациент, проходящий лечение, будет оцениваться по чувствительности к лечению ААС посредством различных измеримых факторов. Примеры признаков и симптомов, которые врачи могут использовать для оценки улучшения состояния своих пациентов, включает в себя следующее: нормализация количества лейкоцитов, если оно был повышен на момент постановки диагноза, нормализация температуры тела, если она была повышена (лихорадка) на момент постановки диагноза, очищение культуры клеток крови, визуальное улучшение раны, включая меньшую эритему и дренаж гноя, уменьшения требований к искусственной вентиляции легких, таких как уменьшение требуемого кислорода или пониженную интенсивность вентиляции пациента, который находится на искусственной вентиляции легких, полный отказ от вентиляции легких, если пациент находился на искусственной вентиляции легких во время диагностики, меньшее использование препаратов для поддержки стабильного кровяного давления, если эти препараты требовались на момент постановки диагноза, нормализации лабораторных отклонений от нормы, которые предполагают отказ органов-мишеней, таких как повышенный креатинин или тесты на функцию печени, если они были ненормальными на момент постановки диагноза, и улучшение рентгенологической визуализации (например, рентгена грудной клетки, которые ранее предполагало пневмонию, показывая рассасывание). У пациента в отделении интенсивной терапии, эти факторы могут быть измерены по меньшей мере ежедневно. За лихорадкой можно тщательно следить, так как белые кровяные клетки, в том числе абсолютное количество нейтрофилов, а также доказательства того, что "сдвиг лейкоцитарной формулы влево" (появление бластов, указывающих на увеличение продукции нейтрофилов в ответ на активную инфекцию) уже решен.
В контексте настоящих способов лечения в соответствии с настоящим изобретением пациент с бактериальной инфекцией, как полагают, вылечивается, если существует значительное измеримое улучшение по оценке врача специалиста в данной области техники, по меньшей мере, двух или более из предшествующих факторы по сравнению с оценками, признаками или симптомами перед или в начале лечения или на момент постановки диагноза. В некоторых вариантах осуществления существует измеримое улучшение в 3, 4, 5, 6 или более вышеупомянутых факторах. В некоторых вариантах осуществления улучшение измеренных факторов составляет по меньшей мере 50%, 60%, 70%, 80%, 90%, 95% или 100% по сравнению со значениями перед лечением. Как правило, пациент может считаться полностью вылеченным от бактериальной инфекции (например, инфекции S. aureus), если измеримые улучшения пациента включают в себя следующее: i) повторный посев крови или тканевой культуры (обычно несколько), который не показывают рост бактерий, которыми был первоначально идентифицирован; ii) повышенная температура нормализуется; iii) WBC (абсолютное содержание лейкоцитов) нормализуется; и iv) свидетельство, что недостаточность органов-мишеней (легкие, печень, почки, сосудистый коллапс) устранилась либо полностью, либо частично, учитывая предварительно существующие сопутствующие заболевания, которые имел пациент.
Дозирование
В любом из вышеприведенных аспектах в лечении инфицированного пациента дозировка ААС обычно составляет от около 0,001 до 1000 мг/кг/день. В одном варианте осуществления пациента с бактериальной инфекцией обрабатывают дозой ААС в диапазоне от около 1 мг/кг до около 100 мг/кг, как правило, от около 5 мг/кг до около 90 мг/кг, более конкретно, от 10 мг/кг до 50 мг/кг. ААС может вводиться ежедневно (например, разовая доза от 5 до 50 мг/кг/день) или реже (например, разовая доза 5, 12,5 или 25 мг/кг/неделю). Разовая доза может быть разделена на 2 дня, например, 25 мг/кг в один день и 25 мг/кг на следующий день. Пациенту может вводиться разовая доза каждые 3 дня (q3D), от одного раза в неделю до раз в две недели (qOW), продолжительностью в 1-8 недель. В одном варианте осуществления пациенту вводят ААС по изобретению с помощью внутривенной инъекции один раз в неделю в течение 2-6 недель со стандартом лечения (SOC) для лечения бактериальной инфекции, такой как стафилококковая инфекция. Продолжительность лечения будет продиктовано состоянием пациента или выраженностью инфекции, например продолжительность 2 недели для неосложненной бактериемией или 6 недель для бактериемии с эндокардитом.
В одном варианте осуществления ААС вводили в начальной дозе от 2,5 до 100 мг/кг в течение от одного до семи последовательных дней с последующей поддерживающей дозой от 0,005 до 10 мг/кг один раз каждые от одного до семи дней в течение одного месяца.
Способ введения
Для лечения бактериальных инфекций ААС по настоящему изобретению может быть введен в любой из предшествующих доз внутривенно (вв) или подкожно. В одном варианте осуществления WTA-AAC вводили внутривенно. В конкретном варианте осуществления WTA-AAC, вводимое посредством вв введения представляет собой WTA-бета-ААС, более конкретно, в котором антитело WTA-бета представляет собой антитело, выбранное из группы антител с аминокислотными последовательностями, как описано на Фиг. 14, Фиг. 15А, Фиг. 15В, Фиг. 16А и Фиг. 16В.
Комбинированная терапия
ААС можно вводить в сочетании с одним или несколькими дополнительными, например вторыми, терапевтическими или профилактическими средствами в зависимости от обстоятельств, как определяется лечащим врачом пациента.
В одном варианте осуществления второй антибиотик вводили в сочетании с соединением конъюгата антитело-антибиотик по настоящему изобретению выбранному из структурных классов: (i) аминогликозидов; (ii) бета-лактамов; (iii) макролидов/циклических пептидов; (iv) тетрациклинов; (v) фторхинолинов/фторхинолонов; (vi) и оксазолидинонов. См: Shaw, K. and Barbachyn, М. (2011) Ann. N.Y. Acad. Sci. 1241:48-70; Sutcliffe, J. (2011) Ann. N.Y. Acad. Sci. 1241:122-152.
В одном варианте осуществления второй антибиотик, вводимый в сочетании с соединением конъюгата антитело-антибиотик по настоящему изобретению, выбирается из клиндамицина, новобиоцина, ретапамулина, даптомицина, GSK-2140944, CG-400549, ситафлоксацина, тейкопланина, триклозана, нафтиридона, радезолида, доксорубицина, ампициллина, ванкомицина, имипенема, дорипенема, гемцитабина, далбавацина и азитромицина.
Дополнительные примеры таких дополнительных терапевтических или профилактических агентов представляют собой противовоспалительные агенты (например, нестероидные противовоспалительные препараты (НПВП; например, детопрофен, диклофенак, дифлунизал, этодолак, фенопрофен, флурбипрофен, ибупрофен, индометацин, кетопрофен, меклофенамат, мефенамическая кислота, мелоксикам, набумеон, напроксен натрий, оксапрозин, пироксикам, сулиндак, толметин, целекоксиб, рофекоксиб, аспирин, холин салицилат, салсалат, и салицилат натрия и магния) и стероиды (например, кортизон, дексаметазон, гидрокортизон, метилпреднизолон, преднизолон, преднизон, триамцинолон)), антибактериальные агенты (например, азитромицин, кларитромицин, эритромицин, гатифлоксацин, левофлоксацин, амоксициллин, метронидазол, пенициллин G, пенициллин V, метициллин, оксациллин, клоксациллин, диклоксациллин, нафциллин, ампициллин, карбенициллин, тикарциллин, мезлоциллин, пиперациллин, азлоциллин, темоциллин, сепалотин, цефапирин, цефрадин, цефалоридин, цефазолин, цефамандол, цефуроксим, цефалексин, цефпрозил, цефаклор, лоракарбеф, цефокситин, цефметозол, цефотаксим, цефтизоксим, цефтриаксон, цефоперазон, цефтазидим, цефиксим, цефподоксим, цефтибутен, цефдинир, цефпиром, цефепим, BAL5788, BAL9141, имипенем, эртапенем, меропенем, азтреонам, клавуланат, сульбактам, тазобактам, стрептомицин, неомицин, канамицин, паромицин, гентамицин, тобрамицин, амикацин, нетилмицином, спектиномицин, сизомицин, дибекалин, изепамицин, тетрациклин, хлортетрациклин, демеклоциклин, миноциклин, окситетрациклин, метациклин, доксициклин, телитромицин, АВТ-773, линкомицин, клиндамицин, ванкомицин, оритаванцин, далбавацин, тейкопланин, хинупристин и дальфопристин, сульфаниламид, п-аминобензойная кислота, сульфадиазин, сульфизоксазол, сульфаметоксазол, сульфаталидин, линезолид, налидиксовая кислота, оксолиновая кислота, норфлоксацин, перфлоксацин, эноксацин, офлоксацин, ципрофлоксацин, темафлоксацин, ломефлоксацин, флероксацин, грепафлоксацин, спарфлоксацин, тровафлоксацина, клинафлоксацин, моксифлоксацин, гемифлоксацин, ситафлоксацин, даптомицин, гареноксацин, рамопланин, фаропенем, полимиксин, тигециклин, AZD2563 или триметоприм) антибактериальные антитела, включая антитела к тому же или другому антигену из ААС, нацеливаемому антигену, ингибиторы агрегации тромбоцитов (например, абциксимаб, аспирин, цилостазол, клопидогрел, дипиридамол, эптифибатид, тиклопидин или тирофибан), антикоагулянты (например, дальтепарин, данапароидом, эноксапарин, гепарин, тинзапарин или варфарин), жаропонижающие (например, ацетаминофен) или гиполипидемических средств (например, холестирамин, колестипол, никотиновая кислота, гемфиброзил, пробукол, эзетимиб, статины или такие как аторвастатин, розувастатин, ловастатин, симвастатин, правастатин, церивастатин и флувастатин). В одном варианте осуществления ААС по изобретению вводят в сочетании с стандартным методом лечения (SOC) для S. aureus (включая метициллин-устойчивые и метициллин-чувствительные штаммы). MSSA обычно, как правило, обрабатывают посредством нафциллина или оксациллина, a MRSA, как правило, обрабатывают посредством ванкомицина или цефазолина. Эти дополнительные агенты могут вводиться в течение 14 дней, 7 дней, 1 дня, 12 часов или 1 часа введения ААС, или одновременно с ним. Дополнительные терапевтические агенты могут присутствовать в одинаковых или различных фармацевтических композициях как ААС. Если они присутствуют в различных фармацевтических композициях, могут быть использованы различные способы введения. Например, ААС можно вводить внутривенно или подкожно, в то время как второй агент можно вводить перорально.
ФАРМАЦЕВТИЧЕСКИЕ СОСТАВЫ
Настоящее изобретение обеспечивает также фармацевтические композиции, содержащие ААС, и способы лечения бактериальной инфекции с помощью фармацевтических композиций, содержащих ААС. Такие композиции могут дополнительно содержать подходящие вспомогательные вещества, такие как фармацевтически приемлемые наполнители (носители), включая буферы, кислоты, основания, сахара, разбавители, консерванты и т.п., которые хорошо известны в данной области техники, и описанные в настоящем описании. Настоящие способы и композиции могут быть использованы отдельно или в комбинации с другими способами и/или агентами для лечения инфекционных заболеваний.
В одном аспекте изобретение предлагает фармацевтические композиции, содержащие по меньшей мере одно антитело по изобретению и/или по меньшей мере один конъюгат его антитело-антибиотик (ААС). В некоторых вариантах осуществления фармацевтическая композиция содержит 1) антитело по изобретению и/или его ААС, и 2) фармацевтически приемлемый носитель. В некоторых вариантах осуществления фармацевтическая композиция содержит 1) антитело по изобретению и/или его ААС и необязательно, 2) по меньшей мере, один дополнительный терапевтический агент.
Фармацевтические композиции, содержащие антитело или ААС по изобретению, готовят для хранения посредством смешивания антитела или ААС, имеющего требуемую степень чистоты, с необязательными физиологически приемлемыми носителями, вспомогательными веществами или стабилизаторами (Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980)) в виде водных растворов или лиофилизированных или других высушенных композиций. Приемлемые носители, вспомогательные вещества или стабилизаторы являются нетоксичными для реципиентов в используемых дозах и концентрациях и включают буферы, такие как фосфатный, цитратный, гистидиновый и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как хлорид октадецилдиметилбензиламмония; хлорид гексаметония; хлорид бензалкония, хлорид бензетония); фенол, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехин; резорцин; циклогексанол; 3-пентанол; и м-крезол); низкомолекулярные (менее чем около 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин, лизин; или моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как ЭДТА; сахара, такие как сахароза, маннит, трегалоза или сорбит; образующие соль противоионы, такие как натрий; комплексы металлов (например, Zn-белковые комплексы); и/или неионные ПАВ, такие как TWEEN™, PLURONICS™ или полиэтиленгликоль (ПЭГ). Фармацевтические препараты, которые будут использоваться для введения in vivo обычно представляют собой стерильные, что легко осуществляется посредством фильтрации через стерильные фильтрационные мембраны.
Активные ингредиенты могут быть также заключены в микрокапсулы, получаемые, например, методиками коацервации или межфазной полимеризации, например, гидроксиметилцеллюлозные или желатиновые микрокапсулы и поли(метилметакрилатные) микрокапсулы, соответственно, в коллоидные системы доставки лекарственных средств (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие методики описаны в Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980).
Могут быть получены препараты с замедленным высвобождением. Подходящие примеры препаратов с замедленным высвобождением включают полупроницаемые матрицы из твердых гидрофобных полимеров, содержащих антитело или ААС по изобретению, матрицы которых находятся в виде формованных изделий, например пленок или микрокапсул. Примеры матриц с замедленным высвобождением включают сложные полиэфиры, гидрогели (например, поли(2-гидроксиэтилметакрилат) или поли(виниловый спирт)), полилактиды (патент США. No. 3773919), сополимеры L-глутаминовой кислоты и γ-этил-L-глутамата, неразлагаемый этиленвинилацетат, разлагаемые сополимеры молочной кислоты и гликолевой кислоты, такие как LUPRON DEPOT™, (инъецируемые микросферы, состоящие из сополимера молочной кислоты-гликолевсй кислоты и ацетата лейпролида), и поли-D-(-)-3-гидроксимасляной кислоты. В то время как полимеры, такие как этилен-винилацетата и молочной кислоты-гликолевой кислоты способны высвобождать молекулы в течение более 100 дней, некоторые гидрогели высвобождают белки в течение более коротких периодов времени. Если инкапсулированные антитела или ААС остаются в организме в течение длительного времени, они могут денатурировать или агрегировать в результате воздействия влаги при 37°С, что приводит к потере биологической активности и возможным изменениям в иммуногенности. Могут быть разработаны рациональные стратегии для стабилизации в зависимости от вовлеченного механизма. Например, если было обнаружено, что механизм агрегации представляет собой образование межмолекулярной S-S связи посредством тиол-дисульфидного обмена, то стабилизация может быть достигнута посредством модификации сульфгидрильных остатков, лиофилизации из кислых растворов, контролированием содержания влаги, использованием соответствующих добавок и разработкой специфических композиций полимерных матриц.
Антитело может быть приготовлено в любой подходящей форме для доставки к клетке/ткани-мишени. Например, антитела могут быть приготовлены в виде липосом, небольшой везикулы, состоящей из различных типов липидов, фосфолипидов и/или поверхностно-активных веществ, которые являются полезными для доставки лекарственного средства у млекопитающих. Компоненты липосомы обычно располагаются таким образом, что образуют бислой, подобно расположению липидов в биологических мембранах. Липосомы, содержащие антитело, получают способами, известными в данной области, такими, как описанные в Epstein et al., (1985) Proc. Natl. Acad. Sci. USA 82:3688; Hwang et al., (1980) Proc. Natl Acad. Sci. USA 77:4030; US 4485045; US 4544545; WO 97/38731; US 5013556
Особенно полезные липосомы могут быть получены посредством метода выпаривания обращенной фазы с использованием липидной композиции, содержащей фосфатидилхолин, холестерин и ПЭГ-производные фосфатидилэтаноламина (PEG-РЕ). Липосомы экструдируют через фильтры с определенным размером пор, чтобы получить липосомы требуемого диаметра. Fab'-фрагменты антитела по настоящему изобретению можно конъюгировать с липосомами, как описано в Martin et al., (1982) J. Biol. Chem. 257:286-288 с помощью реакции дисульфидного обмена. Химиотерапевтическое средство необязательно находится внутри липосомы (Gabizon et al., (1989) J. National Cancer Inst. 81(19):1484).
СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ДИАГНОСТИКИ И ОБНАРУЖЕНИЯ
В некоторых вариантах осуществления любое из антител, обеспечивемых в настоящем описании, является полезным для обнаружения присутствия MRSA в биологическом образце. Термин "обнаружение", используемый в настоящем описании, включает количественное или качественное обнаружение. А "биологический образец" включает, например, кровь, сыворотку, плазму, ткани, мокроту, аспират, мазок и т.д.
В одном варианте осуществления обеспечиваются антитела анти-WTA для использования в способе диагностики или обнаружения. В дополнительном аспекте обеспечивается способ обнаружения присутствия WTA в биологическом образце. В некоторых вариантах осуществления способ включает контактирование биологического образца с антителом анти-WTA, как описано в настоящем описании в условиях, позволяющих связывание антитела анти-WTA с WTA, и обнаружение того, образуется ли комплекс между антителом анти-WTA и WTA в биологическом образце. Такой метод может быть методом in vitro или in vivo. В одном варианте осуществления антитело анти-MRSA используется для выбора субъектов, приемлемых для терапии с помощью антитела анти-MRSA, например, где MRSA является биомаркером для отбора пациентов.
В одном примерном варианте осуществления антитело анти-WTA используют для обнаружения in vivo, например, с помощью визуализации in vivo, MRSA-положительную инфекцию у субъекта, например, для целей диагностики, прогнозировании или стадирования лечения инфекции, определения соответствующего курса лечения или контроля ответа инфекции на терапию. Одним способом, известным в данной области техники для обнаружения in vivo, является иммуно-позитронно-эмиссионная томография (иммуно-ПЭТ), как описано, например, в van Dongen et al., (2007) The Oncologist 12:1379-1389 и Verel et al., (2003) J. Nucl. Med. 44:1271-1281. В таких вариантах осуществления обеспечиватся способ для обнаружения Staph-положительный инфекции у субъекта, причем способ включает введение меченого антитела анти-Staph субъекту, имеющему или предположительно имеющему Staph-положительную инфекцию, и обнаружение меченого антитела анти-Staph в субъекте, в котором обнаружение меченого антитела анти-Staph указывает на Staph-положительную инфекцию у субъекта. В некоторых из таких вариантов осуществления меченое антитело анти-Staph включает антитело анти-Staph, конъюгированное с эмиттером позитронов, например, 68Ga, 18F, 64Cu, 86Y, 76Br, 89Zr и 124I В конкретном варианте осуществления эмиттером позитронов является 89Zr.
В других вариантах осуществления способ диагностики или обнаружения включает контактирование первого антитела анти-Staph, иммобилизованного на подложке, с биологическим образцом для тестирования на наличие Staph, подвергающий взаимодействию субстрата со вторым антителом анти-Staph, и определяя будет ли второе антитело анти-Staph связываться с комплексом между первым антителом анти-Staph и Staph в биологическом образце. Подложка может быть любой поддерживающей средой, например, стеклом, металлом, керамикой, полимерными шариками, слайдами, чипами и другими субстратами. В некоторых вариантах осуществления биологический образец содержит клетку или ткань (например, материал биопсии, включая злокачественные или потенциально злокачественные ткани: колоректальные, эндометриальные, панкреатические или ткани яичников). В некоторых вариантах осуществления первое или второе антитело анти-Staph является любым из антител, описанных я настоящем описании. В таких вариантах осуществления второе антитело анти-WTA может быть антителом анти-WTA S4497, S4462, S6978, S4487 или антителами, полученные от них, как описано в настоящем описании.
Примеры расстройств, которые могут быть диагностированы или обнаружены по любому из указанным выше вариантам осуществления включают в себя MRSA-положительную инфекцию, с использованием теста, такого как иммуногистохимия (IHC) или in situ гибридизация (ISH). В некоторых вариантах осуществления Staph-положительная инфекция является инфекцией, которая экспрессирует Staph в соответствии с анализом ПЦР с обратной транскриптазой (RT-PCR), который обнаруживает Staph мРНК. В некоторых вариантах осуществления RT-PCR является количественной RT-PCR (Francois Р and Schrenzel J (2008). "Rapid Diagnosis and Typing of Staphylococcus aureus". Staphylococcus: Molecular Genetics. Caister Academic Press; Mackay IM, ed. (2007)), и ПЦР в реальном времени ("Real-Time PCR in Microbiology: From Diagnosis to Characterization. Caister Academic Press).
В некоторых вариантах осуществления обеспечиваются меченые антитела против стеночной тейхоевой кислоты (WTA). Метки включают, но не ограничиваются этим, метки или фрагменты, которые обнаруживаются непосредственно (такие как люминесцентные, хромофорные, электронно-плотные, хемилюминесцентные и радиоактивные метки), а также фрагменты, такие как ферменты или лиганды, которые обнаруживаются косвенно, например, через ферментативную реакцию или молекулярное взаимодействие. Примеры меток включают, но не ограничиваются этим, радиоизотопы, 32Р, 14С, 125I, 3Н 131I, флуорофоры, такие как хелаты редкоземельных металлов или флуоресцеин и его производные, родамин и его производные, дансил, умбеллиферон, люциферазы, например, люцифераза светлячка и бактериальная люцифераза (US 4737456), люциферин, 2,3-дигидрофталазиндионы, пероксидаза хрена (HRP), щелочная фосфатаза, β-галактозидаза, глюкоамилаза, лизоцим, сахаридоксидазы, например, глюкозооксидаза, галактозооксидаза и глюкозо-6-фосфат дегидрогеназа, гетероциклические оксидазы, такие как уриказа и ксантиноксидаза, конъюгированные с ферментом, который использует пероксид водорода для окисления предшественника красителя, таких как HRP, лактопероксидаза или микропероксидаза, биотин/азидин, спиновые метки, метки бактериофага, устойчивые свободные радикалы и тому подобное. В другом варианте осуществления метка представляет собой позитронный эмиттер: Позитронные эмиттеры включают, но не ограничиваются этим, 68Ga, 18F, 64Cu, 86Y, 76Br, 89Zr и 124I. В конкретном вариант осуществления позитронный эмиттер представляет собой 89Zr.
Клинически симптомы инфекций MRSA схожи с симптомами метициллин-чувствительных S. aureus (MSSA), и включают в себя абсцессы и флегмоны. Часто абсцессы сопровождаются зонами центрального некроза. Фурункулы (гнойники) также являются общими, в особенности в контексте вспышки заболевания MRSA. Поражения могут быть также неверно истолкованы, как укус паука из-за общего покраснения, которое прогрессирует центру некроза. Кроме того, инфекции могут появиться как импетиго, фолликулит, глубинные абсцессы, гнойный миозит, остеомиелит, некротический фасциит, стафилококковый синдром токсического шока, пневмония и сепсис. Серьезные системные инфекции являются более распространенными среди лиц с историей потребления инъекционных наркотиков, диабетом или другими иммунодефицитными состояниями.
Стандартные варианты лечения MRSA-инфекций включают консервативные механические параметры, такие как: (i) теплые компрессы и обертывания, (ii) рассечение и дренаж, и (iii) удаление внешнего устройства (например, катетера), которое вызвало инфекцию. Для более серьезных инфекций, особенно тех, которые демонстрируют целлюлит, назначают антибиотики (abx). Для инфекции от легкой до умеренной антибиотики включают триметоприм-сульфаметоксазол (TMP-SMX), клиндамицин, доксициклин, миноциклин, тетрациклин, рифампицин, ванкомицин, линезолид. Как правило, схема лечения происходит в течение 5-10 с периодическим повторным осмотром и оценкой во время и после периода лечения.
Дополнительные варианты лечения включают деколонизацию, особенно в условиях, когда пациент испытывает повторяющиеся инфекции или, где они находятся в среде, в которой вспышка заболевания MRSA продолжается. Деколонизации представляет собой процедуру, где удаляется флора, закрывающая ноздри пациента. Это делается с помощью местного применения 2% мази мупироцина обильно в обе ноздри в течение 5-10 дней и местного очищения с помощью 4% хлоргексидина в течение 5 дней.
ГОТОВОЕ ИЗДЕЛИЕ
В другом аспекте настоящего изобретения обеспечивается готовое изделие, содержащее вещества, пригодные для лечения, профилактики и/или диагностики нарушений, описанных выше. Готовое изделие содержит контейнер и этикетку или вкладыш в упаковку или ассоциированное с контейнером. Подходящие контейнеры включают, например, бутылки, флаконы, шприцы и пакеты для раствора для внутривенных инъекций и т.д. Контейнеры могут быть изготовлены из различных материалов, таких как стекло или пластик. Контейнер содержит композицию, которая сама по себе или в сочетании с другой композицией является эффективной для лечения, предотвращения и/или диагностики расстройств, и может иметь стерильное входное отверстие (например, контейнер может быть пакетом для раствора для внутривенных инъекций или флаконом, имеющий пробку, прокалываемую от иглой для подкожных инъекций). По меньшей мере один активный агент в композиции представляет собой антитело или иммуноконъюгат согласно изобретению. Этикетка или вкладыш в упаковку показывает, что композиция используется для лечения выбранного состояния. Кроме того, изделие может содержать (а) первый контейнер с композицией, содержащейся в нем, где композиция содержит антитело или иммуноконъюгат согласно изобретению; и (b) второй контейнер с композицией, содержащейся в нем, где композиция содержит дополнительный цитотоксический или иной терапевтический агент. Готовое изделие в этом варианте осуществления изобретения может дополнительно содержать вкладыш упаковки, указывающий, что эти композиции могут быть использованы для лечения конкретного состояния. Альтернативно или дополнительно, готовое изделие может дополнительно содержать второй (или третий) контейнер, содержащий фармацевтически приемлемый буфер, такой как бактериостатическая вода для инъекций (BWFI), забуференный фосфатом физиологический раствор, раствор декстрозы или раствор Рингера. Он может дополнительно включать другие материалы, желательные с коммерческой точки зрения, и точки зрения пользователя, включая другие буферы, разбавители, фильтры, иглы и шприцы.
ПРИМЕРЫ
Ниже приведены примеры способов и композиций по настоящему изобретению. Следует понимать, что различные другие варианты осуществления могут быть реализованы, с учетом общего описания, обеспеченного выше.
Пример 1 MC-vc-PAB-клиндамицин 51
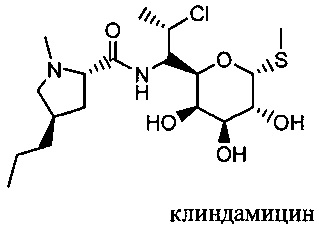
В небольшом пузырке, 0,6 М раствор N-((S)-1-((S)-1-(4-(хлорметил)фениламино)-1-оксо-5-уреидопентан-2-иламино)-3-метил-1-оксобутан-2-ил)-6-(2,5-диоксо-2,5-дигидро-1Н-пиррол-1-ил)гексанамид 9 (0,027 ммоль, 0,027 ммоль, 1,0, 16 мг) в ДМФА добавляли к (2S,4R)-N-[(1S,2S)-2-хлор-1-[(2R,3R,4S,5R,6R)-3,4,5-тригидрокси-6-метилсульфанил-тетрагидропиран-2-ил]пропил]-1-метил-4-пропил-пирролидин-2-карбоксамид (Клиндамицин, ChemPacific, Cat #33613, 1 экв., 0,027 ммоль, 1,0, 11 мг) в N,N-диметилформамиде (ДМФА, 0,1 мл, 1 ммоль, 50, 90 мг). Смесь перемешивали при 0°С в течение 5 мин и добавляли N,N-диизопропилэтиламин (4 экв., 0,11 ммоль, 4,0, 14 мг). Реакционную смесь перемешивали при этой температуре до комнатной температуры в течение 2 часов на открытом воздухе и контролировали в течение 2 дней с помощью ЖХ/МС, затем очищали на ВЭЖХ в кислых условиях с получением MC-vc-PAB-клиндамицина 51 с выходом 27%. M/Z=979,8
Пример 2 MC-vc-PAB-новобиоцин 52
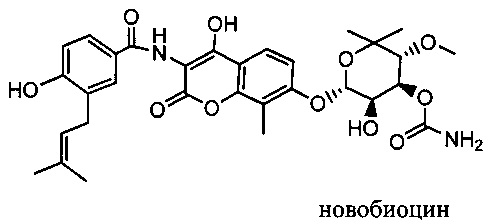
В небольшом пузырке N-((S)-1-((S)-1-(4-(хлорметил)фениламино)-1-оксо-5-уреидопентан-2-иламино)-3-метил-1-оксобутан-2-ил)-6-(2,5-диоксо-2,5-дигидро-1Н-пиррол-1-ил)гексанамид 9 (100% по массе) в N,N-диметилформамиде (100 мкл, 1,28 ммоль, 47, 94,4 мг), охлаждали до 0°С. К этой смеси добавляли [(3R,4S,5R,6R)-5-гидрокси-6-[4-гидрокси-3-[[4-гидрокси-3-(3-метилбут-2-енил)бензоил]амино]-8-метил-2-оксо-хромен-7-ил]окси-3-метокси-2,2-диметил-тетрагидропиран-4-ил]карбамат (новобиоцин, Sigma Aldrich, Cat # N1628-1G, 1 экв., 0,027 ммоль, 1,0, 17 мг). Смесь перемешивали 5 минут, а затем добавляли карбонат калия (15 экв., 0,41 ммоль, 15, 57 мг>и перемешивали на ледяной бане в течение 3 часов. Розовую смесь разбавляли ДМФА, фильтровали и собранный фильтрат очищали с помощью ВЭЖХ в кислых условиях с получением MC-vc-PAB-новобиоцина 52 с выходом 14%. FA H2O/MeCN. M/Z=1168,3.
Пример 3 MC-vc-PAB-ретапамулин 53
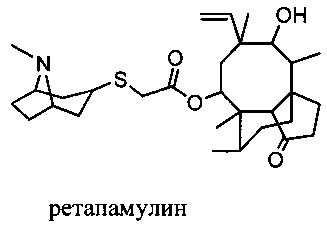
После процедуры получения 51, N-((S)-1-((S)-1-(4-(хлорметил)фениламино)-1-оксо-5-уреидопентан-2-иламино)-3-метил-1-оксобутан-2-ил)-6-(2,5-диоксо-2,5-дигидро-1Н-пиррол-1-ил)гексанамид 9 и ретапамулин (Chem Shuttle) реагировали с образованием MC-vc-PAB-ретапамулина 53 с выходом 18%. M/Z=1072,93
Пример 4 MC-vc-PAB-даптомицин 54
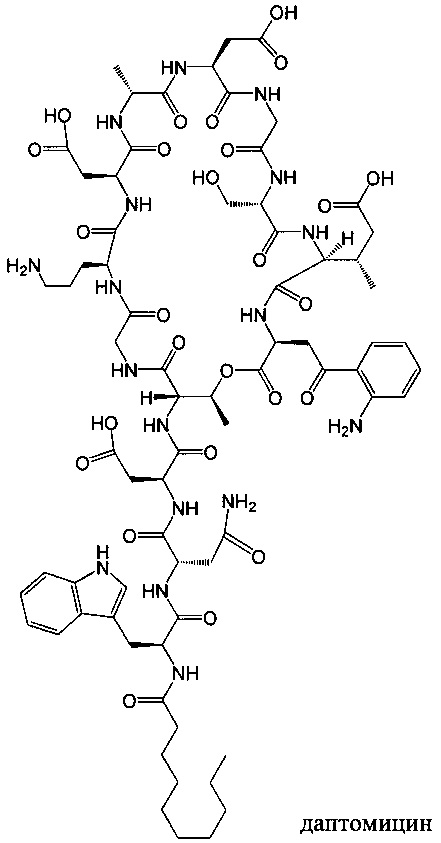
В небольшом пузырке 4-((S)-2-((S)-2-(6-(2,5-диоксо-2,5-дигидро-1Н-пиррол-1-ил)гексамидо)-3-метилбутанамидо)-5-уреидопентанамидо)бензил 4-нитрофенил карбонат 6 (5 мг, 0,006777 ммоль, 1,0 экв., 5 мг) и (3S)-3-[[(2S)-4-амино-2-[[(2S)-2-(деканоиламино)-3-(1Н-индол-3-ил)пропаноил]амино]-4-оксо-бутаноил]амино]-4-[[(3S,6S,9S,15S,18R,21S,24R,30S,31S)-3-[2-(2-аминофенил)-2-оксо-этил]-24-(3-аминопропил)-15,21-бис(карбоксиметил)-9-(гидроксиметил)-6-[(1S)-3-гидрокси-1-метил-3-оксо-пропил]-18,31-диметил-2,5,8,11,14,17,20,23,26,29-декаоксо-1-окса-4,7,10,13,16,19,22,25,28-ноназациклогентриаконт-30-ил]амино]-4-оксо-бутановую кислоту (даптомицин, Enzo Life Science, Cat# BML-A201-0020, 1 экв., 0,006777 ммоль, 1,00 экв., 10,98 мг) помещали в ДМФА (0,2 мл, 3 ммоль, 400 экв., 200 мг). К этой смеси добавляли N,N-диизопропилэтиламин (1,5 экв., 0,01017 ммоль, 1,500 экв., 1,327 мг), а затем 1-гидроксибензотриазол (HOBt, 0,3 экв., 0,002033 ммоль, 0,3000, 0,2775 мг). Смесь перемешивали при комнатной температуре в герметичном сосуде в течение 4 часов, затем перемешивали в течение ночи. Смесь разбавляли ДМФА, очищали с помощью ВЭЖХ в кислых условиях FA H2O/MeCN с получением 6,6 мг MC-vc-PAB-даптомицина 54 с выходом 44%. M/Z=1622.
Пример 5 MC-vc-PAB-(GSK-2140944) 55
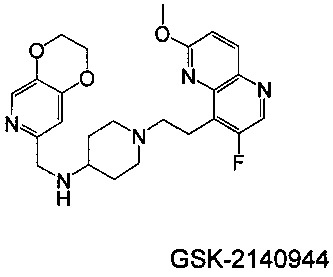
GSK-2140944 получали в соответствии с: Miles et al (2011) Bioorganic & Medicinal Chemistry Letters, 21(24), 7489-7495. После процедуры получения 54, 4-((S)-2-((S)-2-(6-(2,5-диоксо-2,5-дигидро-1Н-пиррол-1-ил)гексамидо)-3-метилбутанамидо)-5-уреидопентанамидо)бензил 4-нитрофенил карбонат 6 и GSK-2140944 реагировали с образованием MC-vc-PAB-GSK-2140944 55 с 25% выходом. M/Z=1098,18.
Пример 6 MC-vc-PAB-(CG-400549) 56
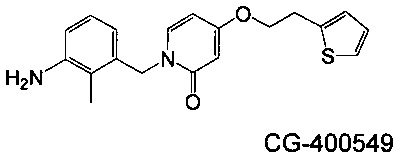
После процедуры получения 54, 4-((S)-2-((S)-2-(6-(2,5-диоксо-2,5-дигидро-1Н-пиррол-1-ил)гексамидо)-3-метилбутанамидо)-5-уреидопентанамидо)бензил 4-нитрофенил карбонат 6 и CG-400549 (Astatech Inc, Cat#52038) взаимодействовали с образованием МС-vc-PAB-(CG-400549) 56 с 7,6% выходом. M/Z=939,5.
Пример 7 MC-vc-PAB-ситафлоксацин 57
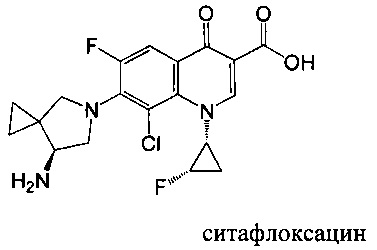
В небольшом пузырьке 4-((S)-2-((S)-2-(6-(2,5-диоксо-2,5-дигидро-1Н-пиррол-1-ил)гексамидо)-3-метилбутанамидо)-5-уреидопентанамидо)бензил 4-нитрофенил карбонат 6 (35 мг, 0,04744 ммоль, 1,000, 35 мг) и 7-[(7S)-7-амино-5-азаспиро[2.4]гептан-5-ил]-8-хлор-6-фтор-1-[(1R,2S)-2-фторциклопропил]-4-оксо-хинолин-3-карбоновую кислоту (ситафлоксацин, Toronto Research Chemicals Cat#S490920, 1 экв., 0,04744 ммоль, 1,000, 19,44 мг) растворяли в ДМФА (0,2 мл, 3 ммоль, 50, 200 мг). К этой смеси добавляли N,N-диизопропилэтиламид (1,5 экв., 0,07116 ммоль, 1,500, 9,290 мг). Реакционную смесь перемешивали в течение 3 часов, разбавляли ДМФА и очищали непосредственно на ВЭЖХ в кислых условиях FA Н2О/MeCN с получением MC-vc-PAB-ситафлоксацина 57 с 23% выходом. M/Z: 1008,6.
Пример 8 MC-vc-PAB-тейкопланин 58
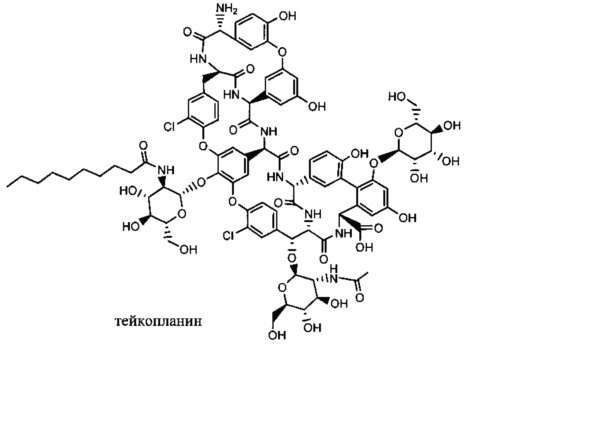
После процедуры получения 54, 4-((S)-2-((S)-2-(6-(2,5-диоксо-2,5-дигидро-1Н-пиррол-1-ил)гексамидо)-3-метилбутанамидо)-5-уреидопентанамидо)бензил 4-нитрофенил карбонат 6 и тейкопланин (тейкомицин, Cat#15152) взаимодействовали с образованием MC-vc-PAB-тейкопланина 58 с выходом 13%. M/Z=1240,6.
Пример 9 MC-vc-PAB-триклозан 59
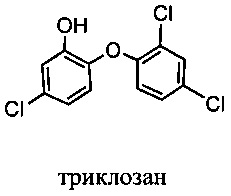
После процедуры получения 52, N-((S)-1-((S)-1-(4-(хлорметил)фениламино)-1-оксо-5-уреидопентан-2-иламино)-3-метил-1-оксобутан-2-ил)-6-(2,5-диоксо-2,5-дигидро-1Н-пиррол-1-ил)гексанамид 9 и триклозан (Irgasan, Sigma Aldrich, Cat # 72779-5G-F) реагировали с образованием MC-vc-PAB-триклозана с выходом 7,5%. M/Z=845,5.
Пример 10 MC-vc-PAB-нафтиридон 60
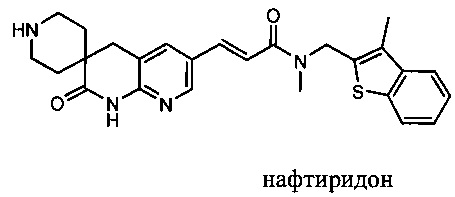
После процедуры получения 57, 4-((S)-2-((S)-2-(6-(2,5-диоксо-2,5-дигидро-1Н-пиррол-1-ил)гексамидо)-3-метилбутанамидо)-5-уреидопентанамидо)бензил 4-нитрофенил карбонат 6 и нафтиридон, описанного выше, (Е)-N-метил-N-((3-метилбензо[b]тиофен-2-ил)метил)-3-(2-оксо-2,4-дигидро-1Н-спиро[[1,8]нафтиридин-3,4'-пиперидин]-6-ил)акриламид, полученный способами в Sampson et al (2009) Bioorganic & Medicinal Chemistry Letters, 19(18):5355-5358, реагировали с образованием MC-vc-PAB-нафтиридона 60 с выходом 50%. M/Z=1105,26.
Пример 11 MC-vc-PAB-радезолид 61
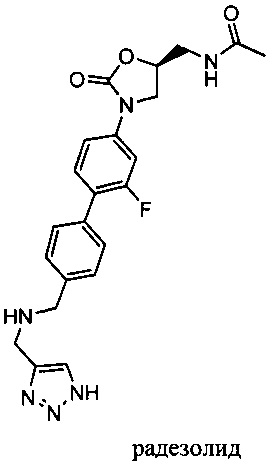
После процедуры получения 54, 4-((S)-2-((S)-2-(6-(2,5-диоксо-2,5-дигидро-1Н-пиррол-1-ил)гексамидо)-3-метилбутанамидо)-5-уреидопентанамидо)бензил 4-нитрофенил карбонат 6 и радезолид 72070-119 ChemExpress, Cat#HY-14800 давали MC-vc-PAB-радезолид 61 с выходом 8,5%. M/Z=1037,6.
Пример 12 MC-vc-PAB-доксорубицин 62
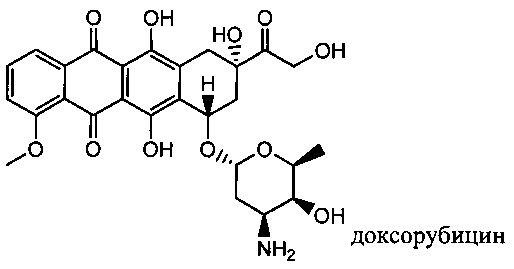
После процедуры получения 57, 4-((S)-2-((S)-2-(6-(2,5-диоксо-2,5-дигидро-1Н-пиррол-1-ил)гексамидо)-3-метилбутанамидо)-5-уреидопентанамидо)бензил 4-нитрофенил карбонат 6 и доксорубицин (Alexis Corporation, Cat# 380-042-М025) реагировали с образованием MC-vc-PAB-доксорубицина 62 с выходом 36%. M/Z=1142,6.
Пример 13 MC-vc-PAB-ампициллин 63
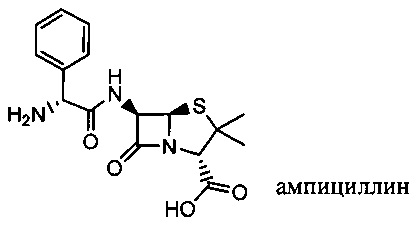
После процедуры получения 57, 4-((S)-2-((S)-2-(6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексамидо)-3-метилбутанамидо)-5-уреидопентанамидо)бензил 4-нитрофенил карбонат 6 и ампициллин (Sigma Aldrich, Cat # A8351-5G) реагировали с образованием MC-vc-PAB-ампициллина 63 с выходом 52%. M/Z=948,5.
Пример 14 MC-vc-PAB-ванкомицин 64
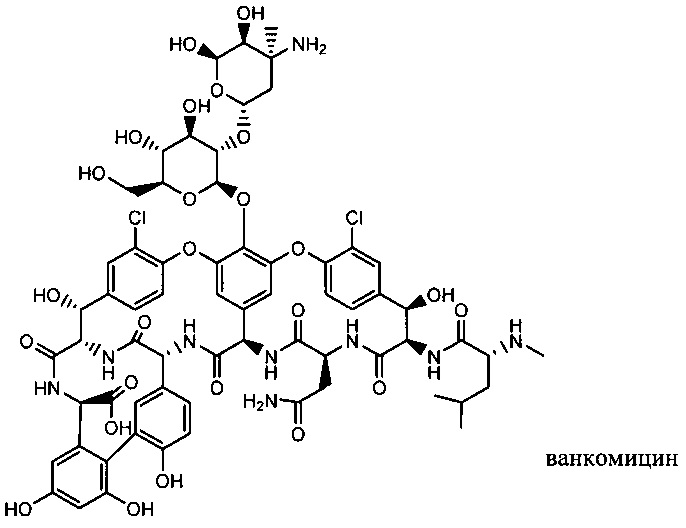
После процедуры получения 57, 4-((S)-2-((S)-2-(6-(2,5-диоксо-2,5-дигидро-1Н-пиррол-1-ил)гексамидо)-3-метилбутанамидо)-5-уреидопентанамидо)бензил 4-нитрофенил карбонат 6 и ванкомицин (Sigma Aldrich, Cat. #861987) реагировали с образованием МС-vc-PAB-ванкомицина 64. M/Z=2047,87.
Пример 15 MC-vc-PAB-имипенем 65
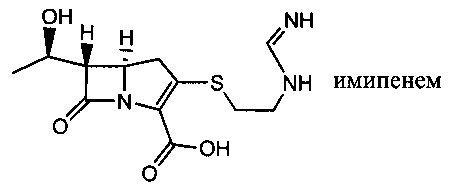
После процедуры получения 54, 4-((S)-2-((S)-2-(6-(2,5-диоксо-2,5-дигидро-1Н-пиррол-1-ил)гексамидо)-3-метилбутанамидо)-5-уреидопентанамидо)бензил 4-нитрофенил карбонат 6 и имипенем Astatech Inc, Cat# 64221-86-9) реагировали с образованием MC-vc-РАВ-имипенема 65 с выходом 6,5%. M/Z=899,5.
Пример 16 MC-vc-PAB-дорипенем 66
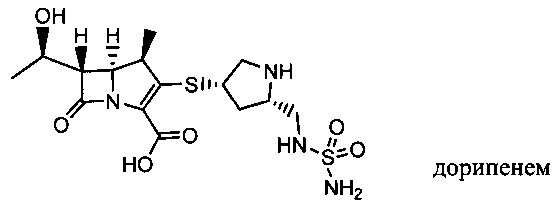
После процедуры получения 54, 4-((S)-2-((S)-2-(6-(2,5-диоксо-2,5-дигидро-1Н-пиррол-1-ил)гексамидо)-3-метилбутанамидо)-5-уреидопентанамидо)бензил 4-нитрофенил карбонат 6 и дорипенем (AK Scientific, Cat#P521) реагировали с образованием MC-vc-РАВ-дорипенема 66 с 23%) выходом. M/Z=1019,7.
Пример 17а MC-vc-PAB-pipBOR
Фрагменты антибиотика типа рифамицина могут быть синтезированы способами, аналогичными, описанным в патенте США 4610919; в патенте США 4983602; в патенте США 5786349; в патенте США 5981522; в патенте США 4859661; в патенте США 7271165; в заявке США 2011/0178001; Seligson, et al., (2001) Anti-Cancer Drugs 12:305-13; Chem. Pharm. Bull., (1993) 41:148, каждый из которых включен в данное описание посредством ссылки).
2-Нитробензол-1,3-диол 1 гидрировали в атмосфере водорода в присутствии палладия/угле в растворителе этаноле с получением 2-аминобензол-1,3-диола 2. изолированного в виде гидрохлорида. Моно-защита 2 с трет.-бутилдиметилсилил хлоридом и триэтиламином в смеси дихлорметан/тетрагидрофуран давала: 2-амино-3-(трет-бутилдиметилсилилокси)фенол 3. Рифамицин S (ChemShuttle Inc., Fremont, CA, US 7342011; US 7271165, US 7547692) подвергали взаимодействию с 3 посредством окислительной конденсации с оксидом марганца или газообразного кислорода в толуоле при комнатной температуре с получением TBS-защищенного бензоксазинорифамицина 4. Взаимодействие 4 с пиперидин-4-амином и оксидом марганца давало пиперидилбензоксазино рифамицин (pipBOR) 5.
Пиперидилбензоксазинорифамицин (pipBOR) 5 (0,02 ммоль) и 4-((S)-2-((S)-2-(6-(2,5-диоксо-2,5-дигидро-1Н-пиррол-1-ил)гексамидо)-3-метилбутанамидо)-5-уреидопентанамидо)бензил 4-нитрофенил карбонат 6 (0,02 ммоль) смешивали в ДМФА (0,4 мл) при комнатной температуре (RT). К этой смеси добавляли 2,5 эквивалента N,N'-диизопропилэтиламина. Раствор перемешивали от одного до около 12 часов, и контролировали с помощью ЖХ/МС. По окончании раствор разбавляли ДМФА и впрыскивали на ВЭЖХ и очищали в кислых условиях с получением MC-vc-PAB-pipBOR M/Z=1498,9. Выход 40%.
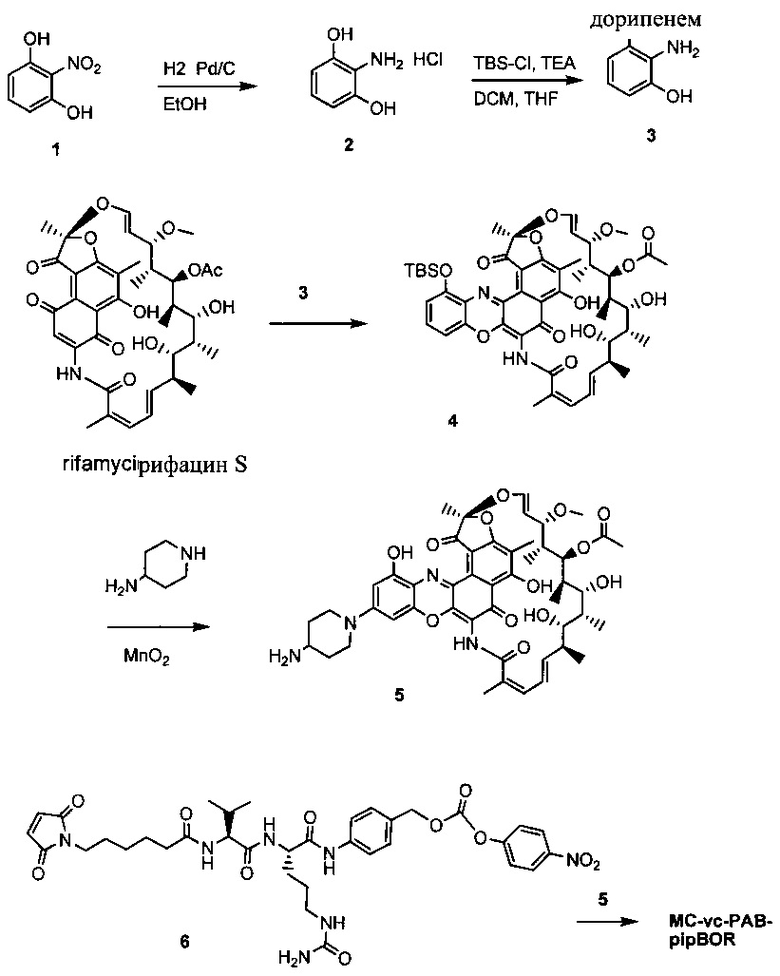
Пример 17b МС-vc-РАВ-диметил-pipBOR
Реакция N,N-диметилпиперидин-4-амина с TBS-защищенным бензоксазинорифамицином 4 давала диметил-пиперидил бензоксазино рифамицин (диметил pipBOR) 7.
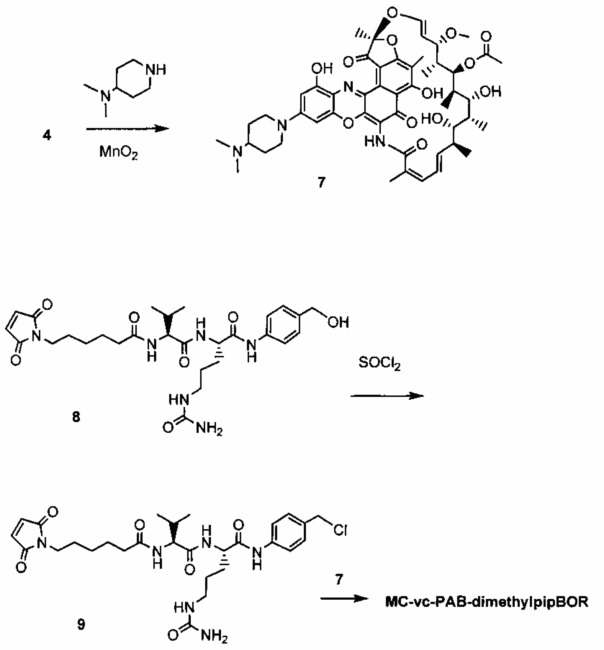
6-(2,5-Диоксо-2,5-дигидро-1Н-пиррол-1-ил)-N-((S)-1-((S)-1-(4-(гидроксиметил)фениламино)-1-оксо-5-уреидопентан-2-иламино)-3-метил-1-оксобутан-2-ил)гексанамид 8, полученный в соответствии с процедурами в WO 2012113847; US 7659241; US 7498298; US 20090111756; US 20090018086; US 6214345; Dubowchik et al (2002) Bioconjugate Chem. 13(4):855-869 (1,009 г, 1,762 ммоль, 1,000, 1009 мг) растворяли в N,N-диметилформамиде (6 мл, 77 ммоль, 44, 5700 мг). К этой смеси добавляли раствор тионилхлорида (1,1 экв., 1,938 ммоль, 1,100, 231 мг) в дихлорметане (ДХМ) (1 мл, 15,44 ммоль, 8,765, 1325 мг) порциями по каплям (1/2 добавляли в течение 1 часа, перемешивали один час при комнатной температуре (RT) затем добавляли вторую половину в течение следующего другого часа). Раствор оставался желтого цвета. Другие 0,6 экв. тионилхлорида добавляли осторожно в виде раствора в 0,5 мл ДХМ по каплям. Реакция осталась желтого цвета и ее перемешивали закупоренной в течение ночи при комнатной температуре. Реакцию контролировали с помощью ЖХ/МС до 88% бензилхлоридного продукта 9. Дополнительно добавляли 0,22 экв. тионилхлорида по каплям в виде раствора в 0,3 мл дихлорметана. Когда реакция достигла 92% бензилхлорида 9, через реакционную смесь барботировали N2. Концентрация восстановилась с 0,3 М до 0,6 М. Продукт N-((S)-1-((S)-1-(4-(хлорметил)фениламино)-1-оксо-5-уреидопентан-2-иламино)-3-метил-1-оксобутан-2-ил)-6-(2,5-диоксо-2,5-дигидро-1Н-пиррол-1-ил)гексанамид 9 хранили в холодильнике в виде 0,6 М раствора и использовали как есть. M/Z 591,3, выход 92%.
В колбе N-((S)-1-((S)-1-(4-(хлорметил)фениламино)-1-оксо-5-уреидопентан-2-иламино)-3-метил-1-оксобутан-2-ил)-6-(2,5-диоксо-2,5-дигидро-1Н-пиррол-1-ил)гексанамид 9, (0,9 ммоль) охлаждали до 0°С и добавляли диметил-пиперидилбензоксазинорифамицин (диметил-pipBOR) 7 (0,75 г, 0,81 ммоль, 0,46, 750 мг). Смесь разбавляли еще 1,5 мл ДМФА, чтобы достичь 0,3 М. Перемешивали открытым на воздухе в течение 30 минут. Добавляли N,N-диизопропилэтиламин (3,5 ммоль, 3,5 ммоль 2,0 460 мг), и реакцию перемешивали в течение ночи открытым на воздухе. В течение 4-х дней 4 раза добавляли 0,2 экв. основания N,N-диизопропилэтиламина, в то время как реакционную смесь перемешивали открытым на воздухе до тех пор, пока в реакции не появились признаки остановки прогрессирования. Реакционную смесь разбавляли ДМФА и очищали с помощью ВЭЖХ (20-60% ACN/FA Н2О) несколькими порциями, получая MC-vc-PAB-диметил-pipBOR. M/Z=1482,8, выход: 32%.
Пример 18 Внутриклеточные MRSA защищены от антибиотиков
Этот пример доказывает, что MRSA могут выжить внутри клеток in vivo. При инфекции внутриклеточные MRSA защищены от антибиотиков и способны выжить при обработке антибиотиками (такого как ванкомицин SOC), что позволяет передач) инфекции от одной клетки к другой.
Определение МИК для внеклеточных бактерий: МИК для внеклеточных бактерий определяли посредством приготовления последовательных 2-кратных разведений антибиотика в триптическом соевом бульоне. Разбавления антибиотика получали в четырех дублях в 96-луночных планшетах для культивирования. MRSA (штамм NRS384 USA300) брали из экспоненциально растущей культуры и разбавляли до 1×104 КОЕ/мл. Бактерии культивировали в присутствии антибиотика в течение 18-24 часов при встряхивании при 37°С, и рост бактерий определяли путем считывания оптической плотности (OD) при 630 нм. МИК определяют как дозу антибиотика, которая ингибирует рост бактерий на >90%.
Определение МИК для внутриклеточных бактерий: МИК для внутриклеточных бактерий определяли для бактерий, которые были изолированы внутри перитонеальных макрофагов мышей. Макрофаги высевали в 24-луночные планшеты для культивирования при плотности 4×105 клеток/мл и инфицировали MRSA (штамм NRS384 USA300) в соотношении 10-20 бактерий на макрофаг. Культуры макрофагов поддерживали в питательной среде с добавлением 50 мкг/мл гентамицина, чтобы ингибировать рост внеклеточных бактерий и исследуемые антибиотики добавляли к ростовой среде через 1 день после инфицирования. Выживание внутриклеточных бактерий оценивали через 24 часа после добавления антибиотиков. Макрофаги лизировали с помощью солевого раствора Хенкса с добавлением 0,1% бычьего сывороточного альбумина и 0,1% Triton-X, и проводили серийные разведения лизата в растворе фосфатно-солевого буфера, содержащего 0,05% Твин-20. Число выживших внутриклеточных бактерий определяли посредством посева на чашки с триптическим соевым агаром с 5% дефибринированной овечьей крови.
Выделение перитонеальных макрофагов: Перитонеальные макрофаги выделяли из брюшины 6-8-недельных мышей Balb/c (Charles River Laboratories, Hollister, CA). Для повышения выхода макрофагов, мышей предварительно обрабатывали с помощью внутрибрюшинной инъекции 1 мл тиогликолятной среды (Becton Dickinson). Тиогликолятную среду готовили в концентрации 4% в воде, стерилизовали автоклавированием, и выдерживали в течение от 20 дней до 6 месяцев перед использованием. Перитонеальные макрофаги собирали через 4 дня после обработки с тиогликолятом посредством промывки брюшной полости холодным фосфатно-буферным раствором. Макрофаги высевали в среду Игл в модификации Дульбекко (DMEM) с добавлением 10% фетальной телячьей сыворотки и 10 мМ HEPES без антибиотиков, при плотности 4×105 клеток/лунку в 24-луночные культуральные планшеты. Макрофаги культивировали в течение ночи, чтобы обеспечить прикрепление к планшету. Этот анализ также использовался для тестирования внутриклеточного уничтожения в нефагоцитирующих типах клеток. Клеточные линии MG63 (CRL-1427) и 549 (CCL185) получали из АТСС, и поддерживали в среде для культуры ткани RPMI 1640 С добавлением 10 мМ Hepes и 10% фетальной телячьей сыворотки (RPMI-10). Клетки HUVEC получали от Lonza и поддерживали в полной среде для культивирования эндотелиальных клеток EGM (Lonza, Walkersville, MD).
Заражение макрофагов опсонизированными MRSA: USA300 штамм MRSA (NRS384) получали из хранилища NARSA (Chantilly, Virginia). Некоторые эксперименты использовали штамм Newman S. aureus (АТСС25904). Во всех экспериментах бактерии культивировали в триптическом соевом бульоне. Для оценки внутриклеточной гибели посредством ААС, брали USA300 из экспоненциально растущей культуры и промывали НВ (сбалансированный солевой раствор Хенкса, дополненный 10 мМ HEPES и 0,1% бычьим сывороточным альбумином). ААС или антитела разбавляли в НВ и инкубировали с бактериями в течение 1 часа, чтобы дать возможность антителам связаться с бактериями (опсонизация), и опсонизированные бактерии использовали для инфицирования макрофагов в соотношении 10-20 бактерий на макрофаг (4×106 бактерий в 250 мкл НВ на лунку. Макрофаги предварительно промывали бессывороточной средой DMEM непосредственно перед инфекцией и инфицировали посредством инкубации при 37°С в увлажненном инкубаторе тканевых культур с 5% СО2, чтобы обеспечить фагоцитоз бактерий. Через 2 часа инфекционную смесь удаляли и заменяли нормальной ростовой средой (DMEM, дополненной 10% фетальной телячьей сывороткой, 10 мМ HEPES, и гентамицин добавляли при 50 мкг/мл, чтобы предотвратить рост внеклеточных бактерий. В конце инкубационного периода макрофаги промывали бессывороточной средой, и клетки лизировали в НВ, дополненной 0,1% Тритон-Х (лизирует макрофаги, не повреждая внутриклеточные бактерии). В некоторых экспериментах жизнеспособность макрофагов оценивали в конце периода культивирования посредством обнаружения высвобождения цитоплазматической лактатдегидрогеназы (ЛДГ) в культуральный супернатант с использованием LDH Cytotoxicity Detection Kit (продукт 11644793001, Roche Diagnostics Corp., Indianapolis, IN). Супернатанты собирали и немедленно анализировали в соответствии с инструкциями изготовителя. Серийные разведения лизата были сделаны в фосфатном буферном солевом растворе с добавлением 0,05% Tween-20 (для разрушения агрегатов бактерий) и общее количество выживших внутриклеточных бактерий определяли посредством посева на триптическом соевом агаре с 5% дефибринированной овечьей кровью.
Генерация перитонеалъных клеток, инфицированных MRSA. 6-8 недельных самок А/J мышей (JAX™ Mice, Jackson Laboratories) инфицировали 1×108 КОЕ штамм NRS384 USA300 посредством перитонеальной инъекции. Перитонеальные смывы собирали через 1-й день после инфицирования, и инфицированные перитонеальные клетки обрабатывали 50 мкг/мл лизостафина, разбавленного в буфере Hepes с добавлением 0,1% БСА (НВ буфер) в течение 30 минут при 37°С. Перитонеальные клетки затем промывали 2 раза ледяным буфером НВ. Перитонеальные клетки разбавляли до 1×106 клеток/мл в среде тканевой культуры RPMI 1640 с добавлением 10 мМ Hepes и 10% фетальной телячьей сыворотки и 5 мкг/мл ванкомицина. Свободные MRSA из первичной инфекции хранили течение ночи при 4°С в растворе фосфатно-солевого буфера в качестве контроля для внеклеточных бактерий, которые не подвергались уничтожению нейтрофилами.
Перенос инфекции от перитонеалъных клеток к остеобластам: клеточную линию остеобластов MG63 получали из АТСС CRL-(1427) и хранили в среде культуры ткани RPMI 1640 с добавлением 10 мМ Hepes и 10% фетальной телячьей сыворотки (RPMI-10). Остеобласты высевали в 24-луночные планшеты для культивирования тканей и культивировали до получения конфлюэнтного слоя. В день эксперимента остеобласты промывали один раз в среде RPMI (без добавок). MRSA или инфицированные перитонеальные клетки разбавляли в полной RPMI-10 и добавляли ванкомицин в концентрации 5 мкг/мл непосредственно перед инфекцией. Перитонеальные клеттси добавляли в остеобласты в 1×106 перитонеалъных клеток/мл. Образец клеток лизировали с помощью 0,1% тритона-Х для определения фактической концентрации живых внутриклеточных бактерий во время инфекции. Фактический титр для всех инфекций определяли посевом последовательных разбавлений бактерий на триптический соевый агар с 5% дефибринированной овечьей крови.
Остеобласты MG63 высевали в 4-х луночные стеклянные слайд-камеры и культивировали в среде культуры ткани RPMI 1640 с добавлением 10 мМ Hepes и 10% фетальной телячьей сыворотки (RPMI-10), пока они не сформированы конфлюэнтный слой. В день инфицирования лунки промывали бессывороточной средой и инфицировали суспензией инфицированных перитонеальных клеток или штаммом USA300 MRSA, разведенного в полной среде RPMI-10 с добавлением 5 мкг/мл ванкомицина. На следующий день после инфицирования клетки промывали фосфатно-солевым буфером (PBS) и фиксировали в течение 30 минут при комнатной температуре в PBS с 2% параформальдегида. Лунки промывали 3 раза PBS и пермеабилизировали с помощью PBS с 0,1% сапонина в течение 30 минут при комнатной температуре.
Иммунофлуоресценция: MRSA идентифицировали посредством окрашивания 20 мкг/мл кроличьего анти-Staph 20920, (Abcam, Cambridge, MA) с последующим антикроличьего родамином (Jackson ImmunoResearch, 711-026-152). Клеточные мембраны перитонеальных клеток окрашивали с помощью Cholera-Toxin-Beta subunit-biotin (Invitrogen, Carlsbad, CA) с последующим streptavidin Cy5 (BD Biosciences San Jose, CA). Связывание холерного токсина с перитонеальными клетками было подтверждено совместным окрашиванием с anti-CD11b Alexa 488 clone M1/70 (BD biosciences). Слайды установливали с Prolong Gold with DAPI (Invitrogen, Carlsbad CA). Слайды просматривали с помощью конфокального микроскопа Leica SPE. Изображения собирали в виде серии срезов по оси Z и получали конечные двумерные изображения в режиме максимальной проекции.
Выживание S. aureus внутри клеток млекопитающих обеспечивает нишу для выживания, которая сохраняет хроническую инфекцию в присутствии антибиотикотерапии. S. aureus может инфицировать и выживать внутри ряда типов клеток млекопитающих, включая нейтрофилы, макрофаги, остеобласты и эпителиальные клетки (Garzoni, С. and W.L. Kelley (2009) Trends Microbiol 17(2): 59-65). Чтобы проверить, непосредственно защищены ли внутриклеточные MRSA от антибиотиков, ряд клинически утвержденных антибиотиков сравнивали по их способности убивать внеклеточные MRSA, культивируемые на стандартных бактериальных питательных средах, с их способностью убивать внутриклеточные MRSA, которые изолированы в мышиных макрофагах (таблица 1), Для анализа были выбраны мышиные перитонеальные макрофаги, так как эти клетки представляют собой генетически нормальный основной тип клеток, которые являются естественным компонентом врожденного иммунного ответа на S. aureus. Анализ подтвердил, что эти клетки могут быть легко инфицированы и культивированы in vitro. MRSA могут выживать внутри клеток в течение шести дней после инфицирования макрофагов (Kubica, М., K. Guzik, et al. (2008) PLoS One 3(1): e1409). Чтобы проверить внутриклеточный эффект антибиотиков, макрофаги инфицировали MRSA, и культивировали в присутствии гентамицина, антибиотика, который, как известно, является неактивным внутри фаголизосомы из-за плохого поглощения антибиотика клеткой (Vaudaux, P. and F.A. Waldvogel (1979) Antimicrob Agents Chemother 16(6): 743-749). Исследуемые антибиотики добавляли в культуральную среду (в дополнение к гентамицину) через один день после инфицирования в диапазоне доз, выбранных для включения клинически достижимых сывороточных уровней (показано Сmax в сыворотке в таблице 1). Это анализ показал, что, хотя внеклеточные MRSA является весьма чувствительными к ингибированию роста малых доз ванкомицина, линезолида, даптомицина или рифампицина в жидкой культуре, ни одному из четырех антибиотиков не удалось убить тот же штамм внутриклеточных MRSA, который был изолирован в макрофагах. Примечательно, что даже рифампицин, который, как сообщатся, является одним из лучших антибиотиков для лечения внутриклеточных инфекций, таких при туберкулез, приводил к минимальной гибели внутриклеточных MRSA в течение времени и диапазона доз эксперимента.
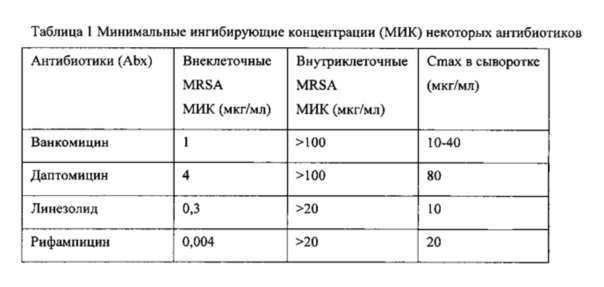
Вышеприведенные данные подтверждают, что внутриклеточные бактерии защищены от антибиотиков в течение времени, в которое они изолированы внутри клеток. Однако MRSA не считаются истинным внутриклеточные патогенами в том, что они не способны инфицировать соседние клетки путем непосредственной передачи от клетки к клетке, и большинство инфицированных клеток в конечном итоге лизируют, освобождая внутриклеточных бактерий. Таким образом, остается по-прежнему возможным, что внутриклеточный пул после высвобождения, неизбежно будет подвергаться воздействию внеклеточных антибиотиков по меньшей мере временно, даже если бактерии были немедленно поглощены соседними клетками. Поглощение свободных MRSA макрофагами требует от 15 до 90 минут (данные не показаны), предполагая, что если бактерии были способны противостоять кратковременному воздействию антибиотика, они могут по-прежнему быть защищены во внутриклеточной нише, перемещаясь последовательно от умирающей клетки к новому хозяину. Чтобы определить, является ли кратковременное воздействие антибиотиков достаточным, чтобы убить MRSA, были протестированы ванкомицин, современный стандарт лечения инфекций MRSA, и рифампицин. MRSA забирали из активно растущей культуры и разбавляли до 1×106 бактерий/мл в нормальном питательной среде. Антибиотики добавляли двумя дозами, представляющими между 2х и 10х ожидаемой минимальной ингибирующей концентрации (МИК). Пробы отбирали в различные моменты времени от 30 минут до 5 часов, и антибиотик удаляли центрифугированием и разбавлением. Общее число выживших бактерий в культуре определяли посредством посева на чашках с агаром.
Фиг. 1 показывает сравнение времени выживания для ванкомицина (Vanco) и рифампицина (Rifa) на активно делящихся MRSA. MRSA культивировали в течение 5 часов в среде TSB в присутствии антибиотиков. В течение указанных периодов времени, образец культуры отбирали и антибиотик удаляли центрифугированием. Общее количество выживших бактерий в определяли в каждый момент времени посредством посева. Ванкомицин был испытан при 2 мкг/мл (пустые квадраты) и 20 мкг/мл (сплошные квадраты). Рифампицин был протестирован на 0,02 мкг/мл (пустые треугольники) и 0,2 мкг/мл (сплошные треугольники). Эти данные (Фиг. 1) показали, что хотя оба антибиотика были способны эффективно подавлять рост бактерий, и наблюдалось 100 кратное уменьшение жизнеспособных бактерий за 5 часов, бактерии уничтожались постепенно в течение 5-часового периода наблюдения и 90% бактерий оставались жизнеспособными в течение первых двух часов антибиотикотерапии, что оставляет достаточно времени для потенциального поглощения клетками-хозяевами.
Внутриклеточные депо для MRSA исследовали на предмет передачи инфекции к пермиссивной внутриклеточной ниши в присутствии ванкомицина. S. aureus могут выживать внутри остеобластов и внутриклеточные депо S. aureus были обнаружены у пациентов с остеомиелитом, состояние, при котором хроническая инфекция S. aureus, как известно, трудно поддается лечению антибиотиками (Thwaites and Gant, (2011) Nature Reviews Microbiology 9:215-222; Ellington et al., (2006) J. Orthopedic Research 24(1): 87-93; Bosse et al., (2005) J. Bone and Joint Surgery, 87(6): 1343-1347). Был разработан анализ in vitro с использованием клеточной линии остеобластов MG63, так как это линия клеток, как сообщается, способна укрывать внутриклеточных S. aureus (Garzoni and Kelly, (2008) Trends in Microbiology). Этот анализ подтвердил, что MRSA могут инфицировать клетки MG63, и жизнеспособные внутриклеточные бактерий могут быть восстановлены из инфицированных клеток MG63 до 6 дней in vitro. Чтобы создать пул внутриклеточных S. aureus, перитонеальные клетки забирали из мышей, которых инфицировали посредством перитонеальной инъекции MRSA (Фиг. 2).
Фиг. 2 показывает передачу инфекции от инфицированных перитонеальных клеток к остеобластам в присутствии ванкомицина. Чтобы создать пул внутриклеточных S. aureus мышей A/J инфицировали MRSA, и инфицированные перитонеальные клетки забирали на 1-й день после инфицирования. Аналогично генерируемые клетки, как было доложено, сохраняли жизнеспособными внутриклеточные бактерии, которые способны переносить инфекцию в модели инфекции in vivo (Gresham et al J Immunol 2000; 164:3713-3722). Зараженные перитонеальные клетки состоят из смеси первичных нейтрофилов и макрофагов и примерно 10% клеток, с обитающими в них внутриклеточными бактериями. Клетки обрабатывали с помощью лизостафина для удаления внеклеточных бактерий и суспендировали в ростовой среде с добавлением 5 мкг/мл ванкомицина. Образец перитонеальных клеток, использованных для инфицирования, лизировали для определения точной дозы жизнеспособных внутриклеточных MRSA во время инициирования инфекции, и различные дозы свободного внеклеточного MRSA также разбавляли в среде с ванкомицином для сравнения. Перитонеальные клетки (внутриклеточные MRSA), или свободные бактерии (внеклеточные MRSA) добавляли затем к монослоям остеобластов MG63 и культивировали в течение 4 часов (пустые столбцы) или 1 день (сплошные столбцы). Общее число выживших внутриклеточных бактерий в каждой лунке определяли посредством посева клеточных лизатов на чашках с агаром. Внутриклеточные MRSA были защищены от ванкомицина по сравнению с контрольными внеклеточными MRSA. Лунки, инфицированные 3×104 внутриклеточными бактериями давали 8750 внутриклеточных бактерий (около 1 трети от дозы инфекции) через 1 день после инфицирования, в то время как внеклеточные бактерии были эффективно уничтожены, так как инфекция с аналогичной дозой свободных MRSA давала только 375 внутриклеточных бактерий на 1 день после инфицирования.
Иммунофлуоресцентная микроскопия продемонстрировала передачу инфекции от перитонеальных клеток к остеобластам MG63. Перитонеальные клетки собирали от мышей через 1 день после инфицирования MRSA и обрабатывали лизостафином, чтобы убить контаминирующие внеклеточные бактерии (внутриклеточные инфекция). Свободные MRSA забирали из активно растущей культуры и промывали в PBS (внеклеточная инфекция). Общее количество жизнеспособных бактерий в образцах внутриклеточной и внеклеточной инфекций подтверждали посредством посева на чашках с агаром, и оба образца суспендировали в среде с 5 мкг/мл ванкомицина непосредственно перед добавлением к конфлюэнтным слоям остеобластов MG63, культивированных в слайд-камерах. На следующий день после инфицирования клетки MG63 промывали, чтобы удалить внеклеточные бактерии, пермеабилизировали и окрашивали анти-S. aureus антителами для выявления внутриклеточных MRSA и холерным токсином, который связывается преимущественно с мембранами перитонеальных клеток. Все клеточные ядра были окрашены совместно с DAPI, что подтверждает, что монослой MG63 остался интактным. Срезы исследовали с помощью конфокальной микроскопии.
Лунки, инфицированные перитонеальными клетками, содержащими конфлюэнтный монослой клеток MG63, и перитонеальные макрофаги были хорошо видны в верхней части слоя MG63. Многие из макрофагов были четко инфицированы MRSA, которые были видны в виде кластеров красных бактерий в одноцветном изображении или в виде белых частиц в накладываемом изображении. В дополнение к инфицированным макрофагам, четкие примеры наблюдались для бактерий, которые были связаны только с клетками MG63. Эти инфицированные клетки MG63 были также видны в лунках, которые инфицировали свободными MRSA. Для инфицирования свободными MRSA требуются гораздо более больше посевного материала для достижения аналогичного уровня инфекции в клетках MG63.
Приведенные выше результаты установили, что как свободные MRSA, так и внутриклеточные MRSA способны выживать и заразить клетки MG63 в присутствии ванкомицина. Бактерии от внутриклеточной инфекции были значительно в большей степени способны выживать при обработке ванкомицином, чем свободные бактерии в этих условиях. Заражение 3×104 КОЕ внутриклеточными бактериями давали 8,7×103 КОЕ внутриклеточных бактерий на 1-й день после инфицирования. Заражение аналогичной дозой свободных бактерий давали только 375 внутриклеточных бактерий на 1-й день после инфицирования, что показывает, что внутриклеточные бактерии в 20 раз лучше способны выживать, чем свободные бактерии. Все инфицирующие дозы восстанавливались лучше внутриклеточными бактериями (от 1,5 до 6 раз), когда из лунок собирали на 1 день по сравнению с 4 часами после инфицирования. Так как ванкомицин полностью ингибирует рост при добавлении к свободным MRSA (Фиг. 1), эти данные свидетельствуют о том, что MRSA должны реплицироваться в какой-то момент, несмотря на постоянное воздействие ванкомицина в культуральной среде. Хотя MRSA не реплицируются в значительной степени внутри макрофагов мышей (наши неопубликованные наблюдения), есть немало свидетельств, что S. aureus в состоянии избежать фаголизосомы и реплицироваться в цитоплазме нефагоцитирующих типов клеток (Jarry, Т.М., G. Memmi, et al. (2008; Cell Microbiol 10(9): 1801-1814). Вместе вышеприведенные наблюдения показывают, что даже при постоянном воздействии ванкомицина, свободные MRSA могут инфицировать клетки, и внутриклеточные MRSA могут переходить из одной клетки в другую клетку. Эти наблюдения показывают потенциальный механизм для поддержания и даже распространения инфекции, которая может возникнуть в присутствии постоянной антибактериальной терапии.
Пример 19 Модели инфекции in vivo.
Модель перитонита. 7 недельные самки A/J мышей (Jackson Laboratories) инфицировали инъекцией с 5×107 КОЕ USA300. Мышей умерщвляли через 2 дня после инфицирования, и брюшину промывали 5 мл холодного забуференного фосфатом физиологического раствора (PBS). Почки гомогенизировали в 5 мл PBS, как описано ниже для модели внутривенной инфекции. Перитонеальные смывы центрифугировали в течение 5 минут при 1000 оборотов в минуту при 4°С в настольной центрифуге. Супернатант собирали в качестве внеклеточных бактерий, и клеточный осадок, содержащий перитонеальные клетки, собирали как внутриклеточную фракцию. Клетки обрабатывали 50 мкг/мл лизостафина течение 20 минут при температуре 37°С, чтобы убить контаминирующие внеклеточные бактерии. Перитонеальные клетки промывали 3 раза в ледяной PBS, чтобы удалить лизостафин перед анализом. Для подсчета количества внутриклеточных КОЕ перитонеальные клетки лизировали в НВ (сбалансированный солевой раствор Хенкса с добавлением 10 мМ HEPES, и 1% бычьего сывороточного альбумина) с 0,1% Triton-X, и были сделаны серийные разведения лизата в PBS с 0,05% Tween-20.
Модель внутривенной инфекции: 7 недельных самок мышей использовали для всех экспериментов in vivo, и инфицирование проводили посредством внутривенной инъекции в хвостовую вену. A/J мышей (Jackson Lab) инфицировали в дозе 2×106 КОЕ. BALB/C мышей (Charles River Laboratories, Hollister, CA) инфицировали дозой 2×107 КОЕ. Для исследований, изучающих роль конкурирующих человеческих IgG (SCID IVIG model), CB17.SCID мышей (Charles River Laboratories, Hollister, CA) восстанавливали с помощью GammaGard S/D IGIV Immune Globulin (ASD Healthcare, Brooks KY), используя оптимизированный режим дозирования для достижения постоянных сывороточных уровней >10 мг/мл человеческого IgG. IGIV вводили с начальной внутривенной дозой 30 мг на мышь с последующей второй дозой 15 мг/мышь посредством интраперитонеальной инъекции через 6 часов, и последующей ежедневной дозировкой 15 мг на мышь интраперитонеально в течение 3 последовательных дней. Мышей инфицировали через 4 часа после первой дозы IGIV с 2×107 КОЕ MRSA, разведенного в забуференном фосфатом физиологическом растворе с помощью внутривенной инъекции. Мышей, которые получали ванкомицин, обрабатывали дважды в день внутрибрюшинными инъекциями по 100 мг/кг ванкомицина, начиная от 6 до 24 часов после инфицирования на протяжении всего исследования. Экспериментальное терапевтическое средство (ААС, анти-MRSA антитела или свободные диметил-pipBOR-антибиотик) разбавляли в забуференном фосфатом физиологическом растворе и вводили с помощью единственной внутривенной инъекции от 30 минут до 24 часов после инфицирования. Всех мышей умерщвляли на 4 день после инфицирования, и почки собирали в 5 мл забуференный фосфатом физиологический раствор. Образцы тканей гомогенизировали с помощью GentleMACS Dissociator™ (Miltenyi Biotec, Auburn, CA). Общее количество восстановленных бактерий на мышь (2 почки) определяли посредством посева последовательных разбавлений гомогената ткани в PBS, Tween 0,05% на триптическом соевом агаре с 5% дефибринированной овечьей крови.
Пример 20 Анализ высвобождения катепсина/каспазы
Для определения количества активного антибиотика, высвобождаемого из ААС после обработки катепсином ААС разбавляли до 200 мкг/мл в буфере для катепсина (20 мМ ацетата натрия, 1 мМ ЭДТА, 5 мМ L-цистеин). См: стр. 863 в Dubowchik et al (2002) Bioconj. Chem. 13:855-869, включенную посредством ссылки для целей данного анализа. Катепсин В (из бычьей селезенки, Sigma С7800) добавляли при 10 мкг/мл, и образцы инкубировали в течение 1 часа при 37°С. В качестве контроля ААС только инкубировали в буфере. Реакцию останавливали добавлением 10 объемов бактериальной питательной среды, триптического соевого бульона, pH 7,4 (TSB). Чтобы оценить общее высвобождение активного антибиотика, были сделаны серийные разведения реакционной смеси в четырех дублях в TSB в 96-луночных планшетах и добавляли штамм USA300 S. aureus в каждую лунку в конечной концентрации 2×103 КОЕ/мл. Культуры инкубировали в течение ночи при 3°С при встряхивании, и бактериальный рост измеряли, считывая оптическую плотность при 630 нм с использованием планшет-ридера.
Пример 21 Получение анти-WTA антител
Генерирование антител, скрининг и селекция
Сокращения: MRSA (метициллин-устойчивые S. aureus); MSSA (метициллин-чувствительные S. aureus); VISA (промежуточно-устойчивые к ванкомицину S. aureus); LTA (липотейхоевая кислота); TSB (триптический соевый бульон); CWP (препарат клеточной стенки).
Человеческие антитела IgG были клонированы из периферических В-клеток из пациентов после S. aureus инфекции с помощью Symplex™ технологии (Symphogen, Lyngby, Denmark), которая сохраняет родственное спаривание антител тяжелых и легких цепей, как описано в патенте США 8283294: "Method for cloning cognate antibodies"; Meijer PJ et al. Journal of Molecular Biology 358:764-772 (2006); и Lantto J et al. J Virol. 85(4): 1820-33 (Feb 2011); Плазматические и клетки памяти использовались в качестве генетического источника для рекомбинантных репертуаров IgG полной длины. Отдельные клоны антитела экспрессировались посредством трансфекцией клеток млекопитающих, как описано в Meijer PJ, et al. Methods in Molecular Biology 525: 261-277, xiv. (2009). Супернатанты, содержащие антитела полной длины IgG1, собирали через семь дней и использовали для скрининга связывания антигена путем непрямого ELISA при первичном скрининге. Была создана библиотека моноклональных антител (mAb), показывающих положительный ИФА связывания с препаратами клеточной стенки из USA300 или штамма Wood46 S. aureus. Антитела впоследствии продуцировали в 200 мл транзиентной трансфекции и очищали с помощью хроматографии с белком A (MabSelect SuRe, GE Life Sciences, Piscataway, NJ) для дальнейшего тестирования. Для увеличения масштаба производства антител, антитела получали в клетках СНО. Векторы, кодирующие VL и VH, трансфицировали в клетки СНО, и IgG очищали из клеточной культуральной среде с помощью аффинной хроматографии с белком А.
Фиг. 6А и 6В обобщают первичный скрининг антител посредством ИФА. Все (за исключением 4569) были выделены при скрининге смеси препаратов клеточной стенки USA300 (обедненная железом : TSB в соотношении 96:4). Все GlcNAc бета (за исключением 6259), SDR и PGN (4479) моноклональные антитела также были положительными для PGN и WTA в первичном скрининге. Все GlcNAc альфа были найдены исключительно посредством скрининга для связывания с USA300 CW mix. 4569 (LTA-специфичные) был найден посредством скрининга на Wood46 CWP.
Селекция анти-WTA моноклональных антител (mAb) из библиотеки с использованием проточной цитометрии ex vivo
Каждое mAb в этой библиотеке задавалось для трех критериев селекции: (1) относительная интенсивность связывания mAb с поверхностью MRSA, как указание на высокий уровень экспрессии соответствующего родственного антигена, что будет благоприятствовать эффективной доставке антибиотика; (2) согласованность mAb связывания с MRSA, выделенных из разнообразных вариететов инфицированных тканей, как указание на стабильную экспрессию родственного антигена на поверхности MRSA in vivo в течение инфекций; и (3) связывающая способность mAb к панели клинических штаммов S. aureus, как указание на сохранение экспрессии родственного поверхностного антигена. С этой целью использовалась проточная цитометрия для исследования всех этих заранее выбранных культуральных супернатантов моноклональных антител в библиотеке на реактивность с S. aureus из различных инфицированных тканей и из различных штаммов S. aureus.
Все моноклональные антитела из библиотеки были проанализированы на их способность к связыванию с MRSA из инфицированных почек, селезенки, печени и легких мышей, которые были инфицированы MRSA USA300; и в сердцах или почках из кроликов, которые были инфицированы USA300 COL в кроличьей модели эндокардита. Способность антитела распознавать S. aureus из различных инфицированных тканей повышает вероятность терапевтического антитела быть активным при широком разнообразии различных клинических инфекций S. aureus. Бактерии анализировались немедленно после сбора от органов, то есть без субкультивирования, чтобы предотвратить фенотипические изменения, вызываемые в условиях культивирования in vitro. Мы ранее наблюдали, что несколько поверхностных антигенов S. aureus, будучи экспрессируемыми во время культивирования in vitro, теряли экспрессию в инфицированных тканях. Антитела, направленные против таких антигенов вряд ли могли быть полезными для лечения инфекций. При анализе этой библиотеки mAb на различных инфицированных тканях эти наблюдения подтверждались для значительного количества антител, которые показали значительное связывание с бактериями S. aureus из культуры, но отсутствие связывания с бактериями от всех протестированных инфицированных тканей. Некоторые антитела связывались с бактериями из некоторых, но не всех протестированных инфицированных тканей. Таким образом, в настоящем изобретении, мы выбрали антитела, которые способны распознавать бактерии из всех испытанных условиях инфекции. Параметры, которые оценивались были (1) относительная интенсивность флуоресценции, в качестве меры представленности антигена; (2) количество органов, которые окрашиваются положительно, в качестве меры стабильности экспрессии антигенов; и (3) связывающая способность mAb к панели клинических штаммов S. aureus как показатель сохранения экспрессии родственного поверхностного антигена. Интенсивность флуоресценции протестированных антител определяли как по отношению к изотипическому контрольному антителу, которое было направлено против нерелевантного антигена, например, моноклональное антитело IgG1 против вируса герпеса gD:5237 (ссылка ниже). Моноклональные антитела против WTA-бета показали не только наивысшую представленность антигена, но также показали очень унифицированное связывание с MRSA от всех инфицированных тканей протестированных и указанных выше.
Кроме того, мы протестировали способность этих mAbs связываться с следующими штаммами S. aureus, которые культивировались in vitro в TSB: USA300 (MRSA), USA400 (MRSA), COL (MRSA), MRSA252 (MRSA), Wood46 (MSSA), Rosenbach (MSSA), Newman (MSSA) и Mu50 (VISA). Было найдено, что анти-WTA бета моноклональные антитела, но не анти-WTA альфа моноклональные антитела оказались реактивными с всеми этими штаммами. Анализ связывания с различными штаммами показал, что WTA бета являются более консервативными, чем WTA альфа, и поэтому больше подходят для ААС.
Пример 22 Характеристика антител со специфичностью против стеночной тейхоевой кислоты на S. aureus.
i) Подтверждение WTA-специфичности антител
Препараты клеточной стенки (CWP) из S. aureus штамма дикого типа (WT) и мутантного штамма S. aureus с отсутствующей WTA (ΔTagO; штамм WTA-нуль) были получены посредством инкубации 40 мг гранулированных штаммов S. aureus с 1 мл 10 мМ Трис-HCl (pH 7,4) с добавлением 30% раффинозы, 100 мкг/мл лизостафина (Cell Sciences, Canton, MA), и смесью ингибиторов протеаз без EDTA (Roche, Pleasanton, CA) в течение 30 мин при 37°С. Лизаты центрифугировали при 11600×g в течение 5 мин и собирали надосадочную жидкость, содержащую компоненты клеточной стенки. Для иммуноблот-анализа белки разделяли на 4-12% трис-глициновом геле и переносили на нитроцеллюлозную мембрану (Invitrogen, Carlsbad, CA), а затем посредством блоттинга с указанными протестированными антителами против WTA, или с контрольными антителами против PGN и LTA.
Иммуноблоттинг показывает, что антитела против WTA связываются с препаратами клеточной стенки WT из WT S. aureus, но не с препаратами клеточной стенки из штамма ΔTagO, потерявших WTA. Контрольные антитела против пептидогликана (анти-PGN) и липотейхоевой кислоты (анти-LTA) связываются хорошо с обоими препаратами клеточной стенки. Эти данные указывают на специфичность тест-антител против WTA.
ii) Проточная цитометрия для определения степени связывания mAb с поверхностью MRSA
Экспрессия поверхностного антигена целых бактерий из инфицированных тканей были проанализированы с помощью проточной цитометрии с использованием следующего протокола. Для антител, окрашивающих бактерии из инфицированных тканей мышей, 6-8 недельным самкам мышей C57BL/6 (Charles River, Wilmington, MA) внутривенно вводили 108 КОЕ USA300 с логарифмической фазы роста в PBS. Органы мыши забирали через два дня после инфицирования. Инфекционный эндокардит (IE) кролика был сформирован, как ранее описано в Tattevin P. et al. Antimicrobial agents and chemotherapy 54: 610-613 (2010). Кроликам вводили внутривенно 5×107 КОЕ штамма COL MRSA в стационарной фазы роста, и патологическое разрастание ткани сердца собирали восемнадцать часов спустя. Обработку ванкомицином (30 мг/кг) проводили внутривенно дважды в сутки через 18 ч после инфицирования 7×107 КОЕ стационарной фчзы.
Для лизиса клеток мыши или кролика ткани гомогенизировали в М пробирках (Miltenyi, Auburn, CA) с использованием gentleMACS cell dissociator (Miltenyi), с последующей инкубацией в течение 10 мин при комнатной температуре в PBS, содержащем 0,1% Тритон-Х100 (Thermo), 10 мкг/мл DNAseI (Roche) и смесь ингибиторов протеаз Complete Mini (Roche). Суспензии пропускали через 40-микронный фильтр (BD), и промывали HBSS без фенолового красного, с добавлением 0,1% БСА без IgG (Sigma) и 10 мМ Hepes, рН 7,4 (НВ буфер). Бактериальные суспензии затем инкубировали с 300 мкг/мл IgG кролика (Sigma) в буфере НВ в течение 1 ч при комнатной температуре (RT), чтобы блокировать неспецифическое связывание IgG. Бактерии окрашивали 2 мкг/мл первичными антителами, в том числе rF1 или изотопическими контрольными IgGl mAb против вируса герпеса gD:5237 (Nakamura GR et al., J Virol 67: 6179-6191 (1993)) и затем с флуоресцентными вторичными антителами против человеческих IgG (Jackson Immunoresearch, West Grove, PA). Для того, чтобы быть способными дифференцировать бактерии из дебриса ткани мыши или кролика, проводили двойное окрашивание с использованием 20 мкг/мл мышиных mAb 702 против пептидогликана S. aureus (Abcam, Cambridge, MA) и вторичное антитело, меченное флуорохромом против мышиных IgG (Jackson ImmunoResearch). Бактерии промывали и анализировали с помощью FACSCalibur (BD). Во время анализа проточной цитометрии бактерии проходили селекцию по времени на положительное окрашивание mAb 702 от участков двойной флуоресценции.
iii) Измерение сродства связывания с S. aureus и антигенной плотности на MRSA
Таблица 5 показывает анализ равновесного связывания MRSA-антител, связывающихся со штаммом Newman-ΔSPA, и антигенной плотности на бактерии.
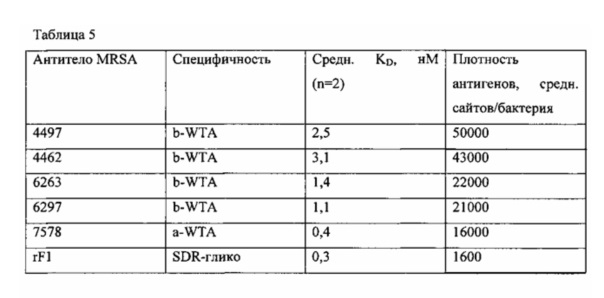
KD и антигенную плотность получали с помощью анализа связывания с клеткой с использованием радиоактивного лиганда при следующих условиях анализа: DMEM + 2,5% мышиной сыворотки связывающий буфер; раствор для связывания в течение 2 ч при комнатной температуре (RT); и используя 400000 бактерий/лунку.
Антитело 6263 является подобным 6078, в том, что последовательности очень похожи. За исключением второго остатка (R вместо G) в CDR Н3, все другие CDR последовательности L и Н-цепи являются идентичными.
Пример 23 Мутанты WTA-антител, модифицированные методами генетической инженерии
Вкратце, VH область каждого из антител WTA бета, были клонированы и связаны с константной областью гамма 1 человеческой Н-цепи, и VL область связана с константной областью каппа для экспрессии антител IgG1. В некоторых случаях в диком типе последовательности делали замены в определенных положениях, чтобы улучшить стабильность антитела, как описано ниже. Затем были сконструированы антитела (ТиоMabs), с введенными цистеинами методами генетической инженерии.
i. Связывание вариабельных областей с константными областями,,
VH области антител WTA бета, идентифицированных из библиотеки человеческих антител, как описывалось выше, связывали с человеческой константной областью γ1, чтобы создать антител IgG1 полной длины. L-цепи представляли собой каппа L-цепи.
ii. Создание вариантов стабильности
Антитела WTA на Фиг. 14, (смотри, в частности, Фиг. 15А, 15В, 16А, 16В) были сконструированы, чтобы улучшить определенные свойства (например, чтобы избежать дезамидирования, изомеризацию аспарагиновой кислоты, окисление или N-связанное гликозилирование) и тестировали на сохранение связывания с антигеном, а также химическую стабильность после аминокислотных замен. Одноцепочечная ДНК клонов, кодирующих тяжелые цепи или легкие очищали от фаговых частиц M13KO7, выращенных в клетках E. coli CJ236 с использованием QIAprep Spin М13 kit (Qiagen). 5' фосфорилированные синтетические олигонуклеотиды с последовательностями:
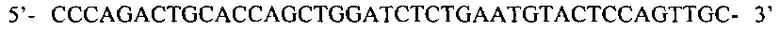 (SEQ ID NO. 152)
(SEQ ID NO. 152)
 (SEQ ID NO. 153)
(SEQ ID NO. 153)
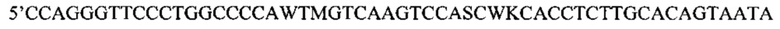
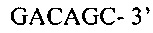 (SEQ ID NO. 154); и
(SEQ ID NO. 154); и
 (SEQ ID NO. 155) (коды IUPAC)
(SEQ ID NO. 155) (коды IUPAC)
использовали, чтобы мутировать клоны, кодирующие антитела посредством олигонуклеотид-направленного сайт-специфического мутагенеза, как описывается посредством сайт-специфического мутагенеза в соответствии с методологией, как описано в Kunkel, Т.А. (1985). Rapid and efficient site-specific mutagenesis without phenotypic selection. Proceedings of the National Academy of Sciences USA 82(2): 488-492. Мутагенизированную ДНК использовали для трансформации Е. coli XL1-Blue cells (Agilent Technologies) и высевали на чашки с бульоном Лурия, содержащим 50 мкг/мл карбенициллина. Колонии индивидуально собирали и выращивают в жидкой среде, бульон Лурия, содержащим 50 мкг/мл карбенициллина. Минипрепарат ДНК секвенировали, чтобы подтвердить наличие мутаций.
Для антитела 6078, вторая аминокислота в VH, Met (Met-2), склона к окислению. Поэтому Met-2 заменяли на Ile или Val, чтобы избежать окисления остатка. Так как замена Met-2 может повлиять на аффинность связывания, мутанты были протестированы на связывание с Staph CWP посредством ИФА.
Мотивы "DG" или "DD" в CDR Н3 оказались склонны к трансформации в изо-аспарагиновую кислоту. Антитело 4497 содержит DG в CDR Н3 в положениях 96 и 97 (Фиг. 18В) и было изменено для стабильности. CDR Н3, как правило, имеет решающее значение для связывания антигена, поэтому были протестированы на связывание антигена и химической стабильности несколько мутантов (Фиг. 18А). Мутант D96E (V8) сохраняет связывание с антигеном, подобно дикому типу антитела 4497 (Фиг. 18А; Фиг. 18б), и является стабильным и не образует изо-аспарагиновой кислоты.
Staph CWP ELISA
Для анализа мутантов антитела S6078 препарат клеточной стенки (WT) обработанный лизостафином USA300 ΔSPA S. aureus, состоящий из 1×109 микроорганизмов/мл разбавляли 1/100 в 0,05 карбонате натрия рН 9,6 и наносили на 384-луночные планшеты для ELISA (Nunc; Neptune, NJ) во время инкубации в течение ночи при 4°С. Планшеты промывали PBS плюс 0,05% Tween-20, и блокировали в течение 2х часовой инкубации с PBS плюс 0,5% бычьего сывороточного альбумина (БСА). Эту и все последующие инкубации проводили при комнатной температуре и осторожном встряхивании. Образцы антител разбавляли в образце/стандартном буфере для разбавления (PBS, 0,5% БСА, 0,05% Tween 20, 0,25% CHAPS, 5 мМ ЭДТА, 0,35 М NaCl, 15 частей на миллион проклина, (рН 7,4)), помещали в промытые планшеты и инкубировали в течение 1,5-2 часов. Планшет-связанные анти-S. aureus антитела детектировали в течение 1-часовой инкубации с конъюгированным с пероксидазой козьим антителом против человеческих IgG IgG(Fcγ) F(ab')2-фрагмента (Jackson ImmunoResearch; West Grove, PA), разбавленного до 40 нг/мл в буфере для анализа (PBS, 0,5% БСА, 15 частей на миллион проклина, 0,05% Твин 20). После последней промывки добавляли тетраметилбензидин (KPL, Gaithersburg, MD), цвет развивался в течение 5-10 минут, и реакцию останавливали с помощью 1 М фосфорной кислоты. Планшеты считывали при 450 нм с 620 нм стандартом с использованием микропланшет-ридера.
iii. Генерирование мутантов с введенными цистеинами методами генетической инженерии (TuoMabs)
TnoMabs полной длины были получены посредством введения цистеина в Н-цепь (СН1) в или L-цепь (Сκ) в заданном положении, как ранее рассказано/обосновано и описано ниже, чтобы обеспечить конъюгацию антитела с промежуточным соединением линкер-антибиотик. Н и L-цепи затем клонировали в отдельных плазмидах, и плазмиды, кодирующие Н и L котрансфицируют в 293 клетки, где они экспрессируются и собираются в интактные антитела. Как Н, так и L-цепи также могут быть клонированы в одной и той же экспрессионной плазмиде. Собираются IgG1, имеющие от 2 Cys, включенные посредством генетической инженерии, по одному в каждую из Н-цепей, либо 2 Cys, включенных посредством генетической инженерии, по одному в каждую из L-цепей или комбинацию из 2 Н и 2 L-цепи, каждая с «инженерным» Cys (HCLCCys) были получены посредством экспрессии нужной комбинации cys-мутантных цепях и цепей дикого типа.
Фиг. 15А и 15В показывают 6078 WT и мутантные антитела с комбинацией НС Cys и LC Cys. Мутанты 6078 были также протестированы на их способность связываться с USA300 Staph А, дефицитными по белку А из ночной культуры. Из результатов анализа FACS, как показано на Фиг. 19, мутантные антитела связывали USA300 аналогично с 6078 WT (неизмененным) антителом; замены аминокислот в мутантах не нарушали связывание с Staph A. gD является неспецифическим антителом отрицательного контроля.
Пример 24. Получение анти-WTA конъюгатов антитело-антибиотик
Конъюгаты антитела против стеночной тейхоевой кислоты с антибиотиком (ААС) в таблице 3, получали путем конъюгирования антитела анти-WTA с промежуточным соединением линкер-антибиотик, в том числе соединения из табл. 2. Перед конъюгированием антитела анти-WTA частично восстанавливают с помощью ТСЕР с использованием стандартных методов, в соответствии с методологией, описанной в WO 2004/010957, находки которой включены посредством ссылки для этой цели. Частично восстановленные антитела, конъюгировали с промежуточным соединением линкер-антибиотик с использованием стандартных методов, в соответствии с методологией, описанной, например, в Doronina et al. (2003) Nat. Biotechnol. 21:778-784 и US 2005/0238649 A1. Вкратце, частично восстановленные антитела комбинировали с промежуточным соединением линкер-антибиотик, давая возможность для конъюгации промежуточного соединения линкер-антибиотик с восстановленными остатками цистеина в молекуле антитела. Реакции конъюгации останавливали и ААС очищали. Определяли загрузку антибиотика (среднее число остатков антибиотика на антитело) для каждого ААС, и она составляла между около 1 и около 2 для антител против стеночной тейхоевой кислоты с единственным цистеиновым мутантным сайтом, введенным методами генетической инженерии.
Восстановление/окисление TuoMabs для конъюгации: Моноклональные антитела полной длины с «инженерным» цистеином (ТиоMabs - Junutula, et al., 2008b Nature Biotech., 26(8):925-932; Dornan et al (2009) Blood 114(13):2721-2729; US 7521541; US 7723485; WO 2009/052249, Shen et al (2012) Nature Biotech., 30(2): 184-191; Junutula et al (2008) Jour of Immun. Methods 332:41-52), экспрессированные в клетках СНО, восстанавливали с приблизительно 20-40-кратным избытком ТСЕР (трис(2-карбоксиэтил)фосфин гидрохлоридом или ДТТ (дитиотреитолом) в 50 мМ Трис рН 7,5 с 2 мМ ЭДТА в течение 3 ч при 37°С или в течение ночи при комнатной температуре (Getz et al (1999) Anal. Biochem. Vol 273:73-80; Soltec Ventures, Beverly, MA). Восстановленные ТиоMab разбавляли и наносили на колонку HiTrap S в 10 мМ ацетата натрия, рН 5, и элюировали PBS, содержащим 0,3 М хлорид натрия. Альтернативно, антитело подкисляют посредством добавления 1/20th объема 10%-ной уксусной кислоты, разбавляли 10 мМ сукцината рН 5, загружали в колонку и затем промывали 10 объемами колонки сукцинатного буфера. Колонку элюировали 50 мМ Трис рН 7,5, 2 мМ ЭДТА.
Элюированный восстановленный ТиоMab обрабатывали 15-кратным мольным избытком DHAA (дегидроаскорбиновой кислоты) или 200 нМ водным сульфатом меди (CuSO4). Окисление межцепных дисульфидных связей завершалось в течение трех часов или более. Окисление атмосферным воздухом также было эффективным. Повторное окисленные антитела диализовали в 20 мМ сукцинате натрия рН 5, 150 мМ NaCl, 2 мМ ЭДТА, и хранили в замороженном виде при -20°С.
Конъюгация Tuo-Mabs с промежуточным соединением линкер-антибиотик: Деблокированные, повторно окисленные, тио-антитела (ТиоMab) подвергали взаимодействию с 6-8-кратным избытком промежуточного соединения линкер-антибиотик из таблицы 2 (из сток-раствора ДМСО при концентрации 20 мМ) в 50 мМ Трис, рН 8, пока реакция не завершалось (16-24 часов), как определяли методом ЖХ-МС анализа реакционной смеси.
Неочищенные конъюгаты антитело-антибиотик (ААС) затем наноси пи на катионообменную колонку после разбавления 20 мМ сукцината натрия, рН 5. Колонку промывали по меньшей мере 10 объемами колонки 20 мМ сукцината натрия; рН 5, и антитела элюировали с помощью PBS. ААС формулировали в 20 мМ His/ацетат, рН 5, с 240 мМ сахарозы, используя колонки для гель фильтрации. ААС характеризовали посредством ультрафиолетовой спектроскопии для определения концентрации белка, аналитической SEC (гель-хроматографией) для анализа агрегации, и ЖХ-МС перед и после обработки с лизил-С-эндопептидазой.
Гель-хроматографию проводили, используя колонку Shodex KW802.5 0,2 М в фосфате калия рН 6,2 с 0,25 мм хлорида калия и 15% IPA (изопропиловый спирт) при скорости потока 0,75 мл/мин. Агрегированое состояние ААС определяли путем интегрирования площади элюированного пика по поглощению при 280 нм.
Анализ ЖХ-МС проводили с использованием прибора Agilent 6520 QTOF ESI instrument. В качестве примера, ААС, полученные с использованием этой химии, обрабатывали 1:500 масса/масса лизил-С-эндопептидазой (Promega) в Трис, рН 7,5, в течение 30 мин при 37°С. Полученные фрагменты расщепления наносили на колонку 1000А, 8 мкм PLRP-S, нагретой до 80°С, и элюировали с градиентом от 30% В до 40% В в течение 5 минут. Мобильная фаза А: Н2О 0,05% TFA (трифторуксусная кислота). Подвижная фаза В: ацетонитрил с 0,04% TFA. Скорость потока: 0,5 мл/мин. Элюирование белка контролировали с помощью УФ-детекции поглощения при 280 нм перед МС-анализом с ионизацией электрораспылением. Как правило, достигается хроматографическое разрешение неконъюгированного Fc фрагмента, остаточного неконъюгированного Fab и Fab-антибиотик. Полученные m/z-спектры подвергали деконволюции с использованием программного обеспечения Масс Hunter™ (Agilent Technologies), чтобы рассчитать массу фрагментов антител.
Хотя настоящее изобретение было описано в некоторых деталях посредством иллюстраций и примеров в целях ясности понимания, описания и примеры не должны быть истолкованы как ограничивающие объем изобретения. Раскрытие всей патентной и научной литературы, цитируемой в настоящем описании, в явно выраженной форме включены во всей своей полноте посредством ссылки.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОНЪЮГАТЫ АНТИТЕЛА К STAPHYLOCOCCUS AUREUS С РИФАМИЦИНОМ И ИХ ПРИМЕНЕНИЕ | 2015 |
|
RU2731055C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ И ПРЕДУПРЕЖДЕНИЯ ИНФЕКЦИЙ, ВЫЗВАННЫХ Staphylococcus aureus | 2015 |
|
RU2636780C1 |
| КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ ГРИБКОВЫХ И БАКТЕРИАЛЬНЫХ ПАТОГЕНОВ | 2014 |
|
RU2717306C2 |
| МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА ПРОТИВ БЕЛКА РВР2-А И ГОМОЛОГИЧНЫХ ПОСЛЕДОВАТЕЛЬНОСТЕЙ ДЛЯ ЛЕЧЕНИЯ ЗАРАЖЕНИЯ БАКТЕРИЯМИ И ИММУНОДИАГНОСТИКИ БАКТЕРИЙ ТИПА Firmicutes | 2010 |
|
RU2575070C2 |
| ЛЕЧЕНИЕ ИНФЕКЦИИ, ВЫЗЫВАЕМОЙ МИКРООРГАНИЗМАМИ | 2002 |
|
RU2303460C2 |
| КОНЪЮГАТЫ АНТИ-РТК7 АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2015 |
|
RU2708075C2 |
| АНТИ-ТАТ226 АНТИТЕЛА И ИММУНОКОНЪЮГАТЫ | 2007 |
|
RU2448980C2 |
| АНТИ-НЕR2 АНТИТЕЛО И ЕГО КОНЪЮГАТ | 2014 |
|
RU2656161C1 |
| АНТИТЕЛА И ИММУНОКОНЪЮГАТЫ И ИХ ПРИМЕНЕНИЯ | 2007 |
|
RU2639543C9 |
| КОМБИНАЦИИ ЛИЗИНА БАКТЕРИОФАГА И АНТИБИОТИКА ПРОТИВ ГРАМ-ПОЛОЖИТЕЛЬНЫХ БАКТЕРИЙ | 2013 |
|
RU2659208C2 |

































































































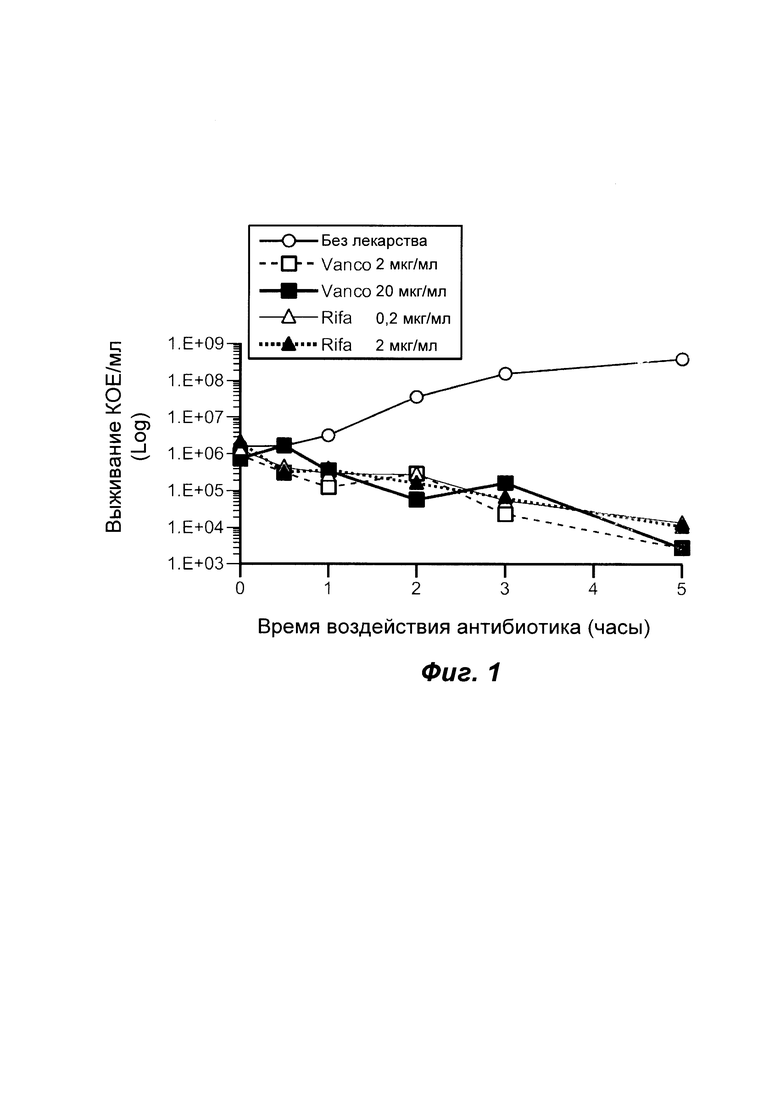
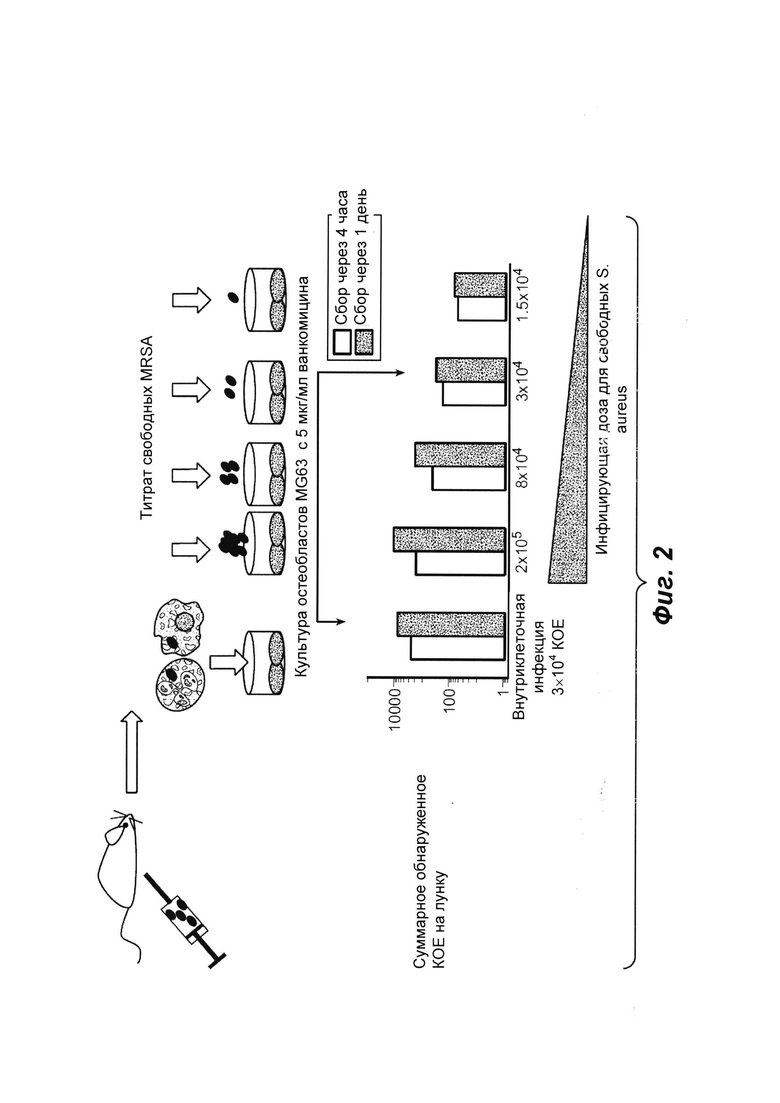
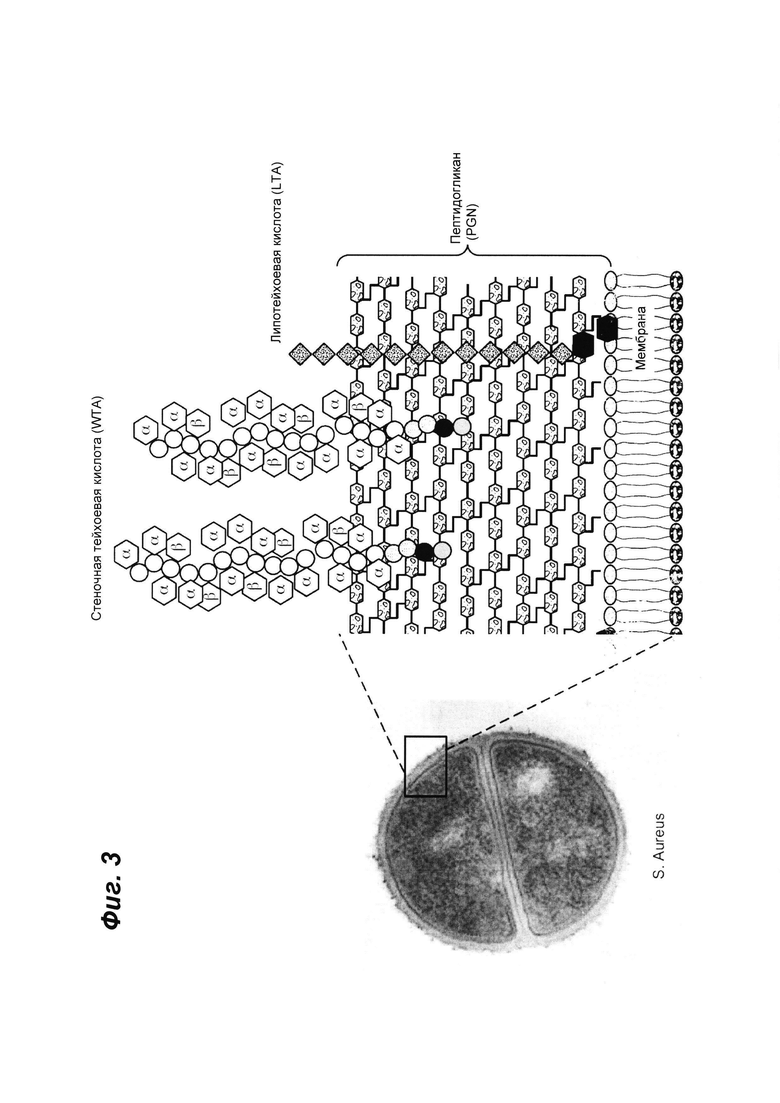
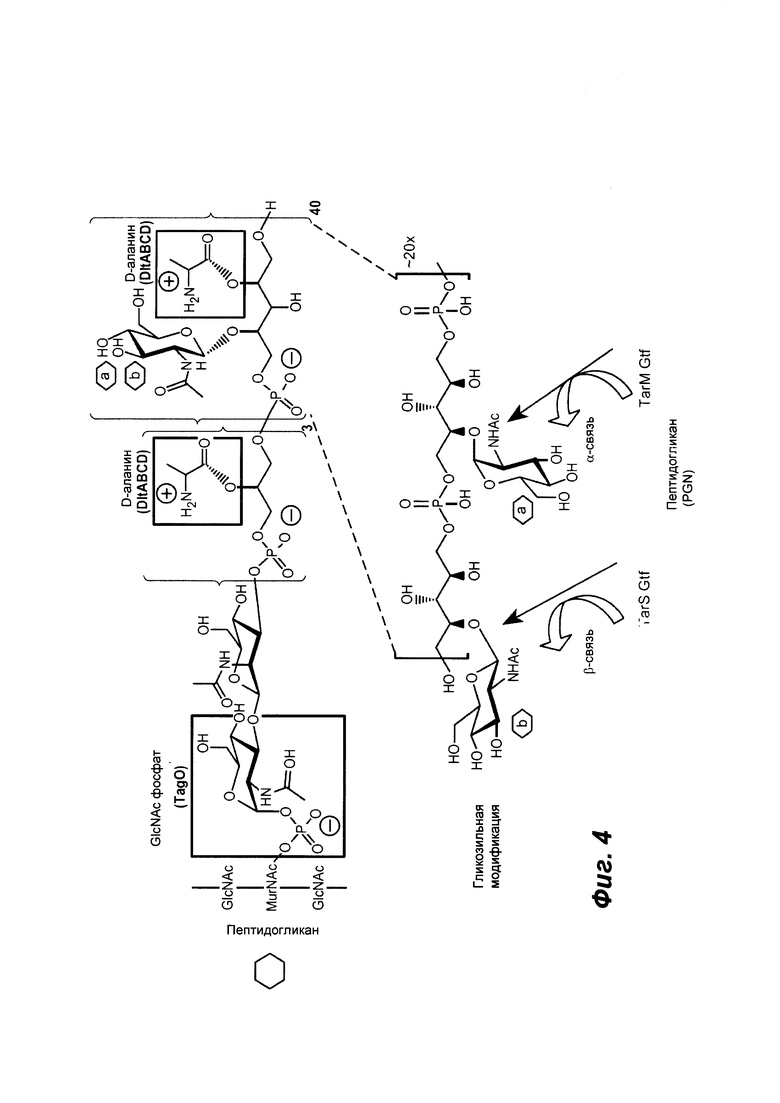
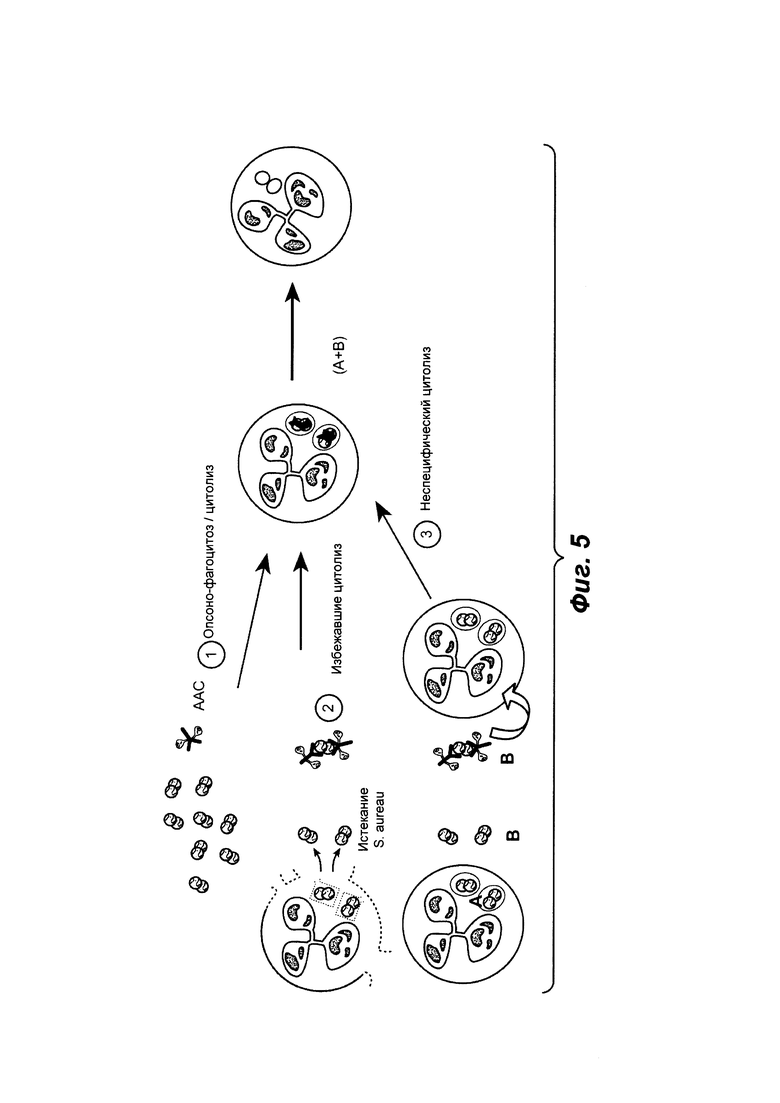
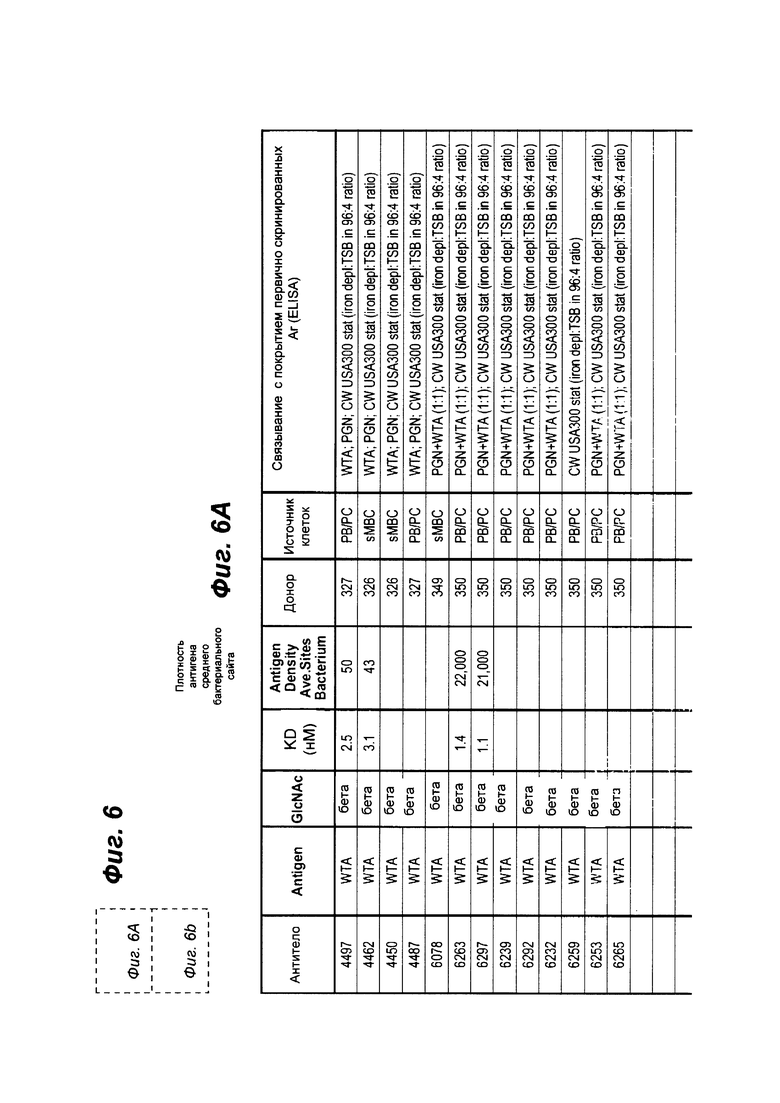
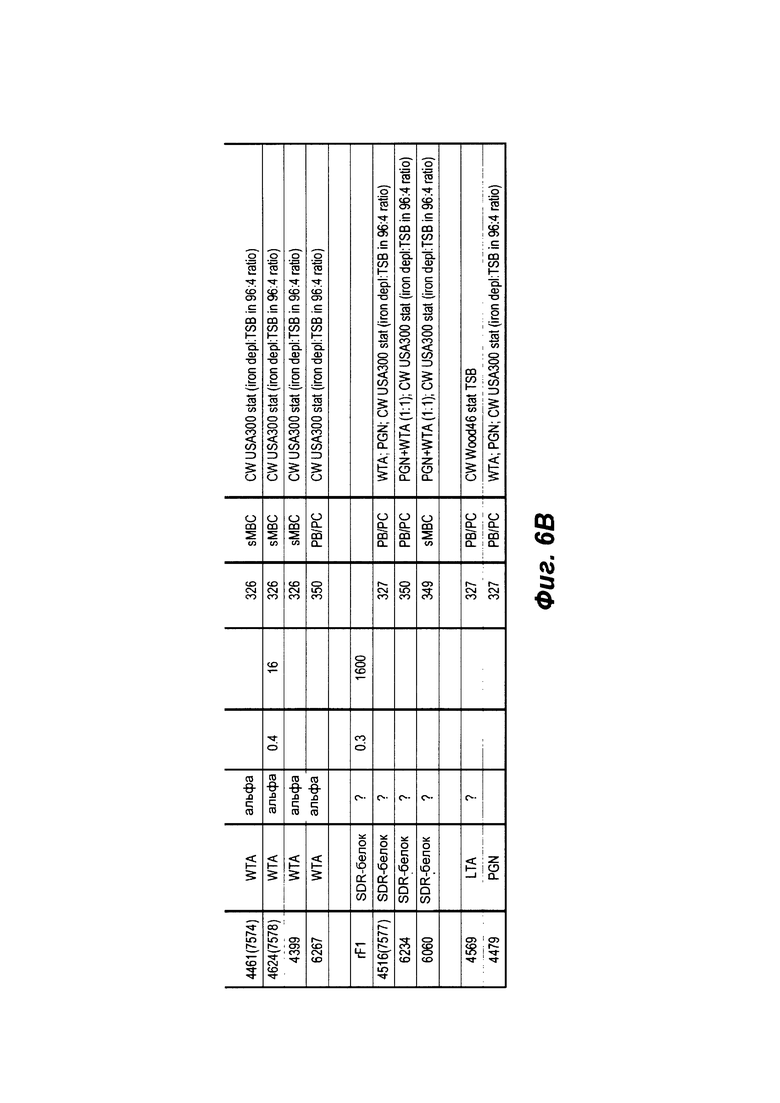
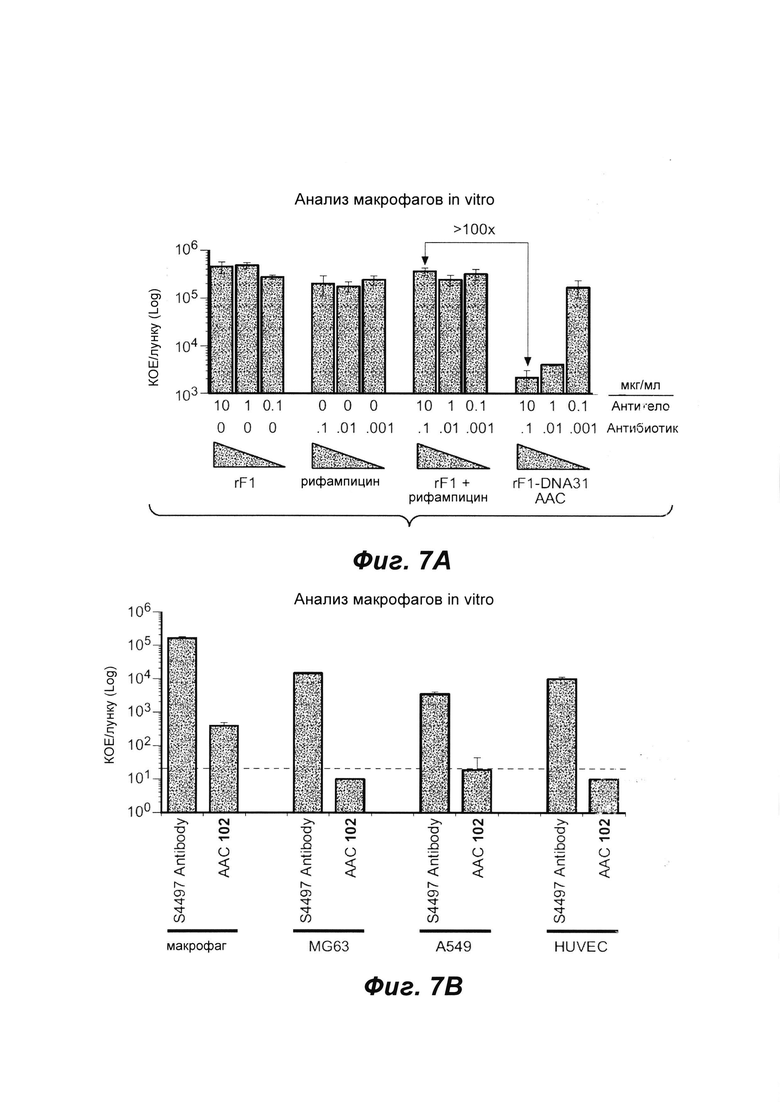
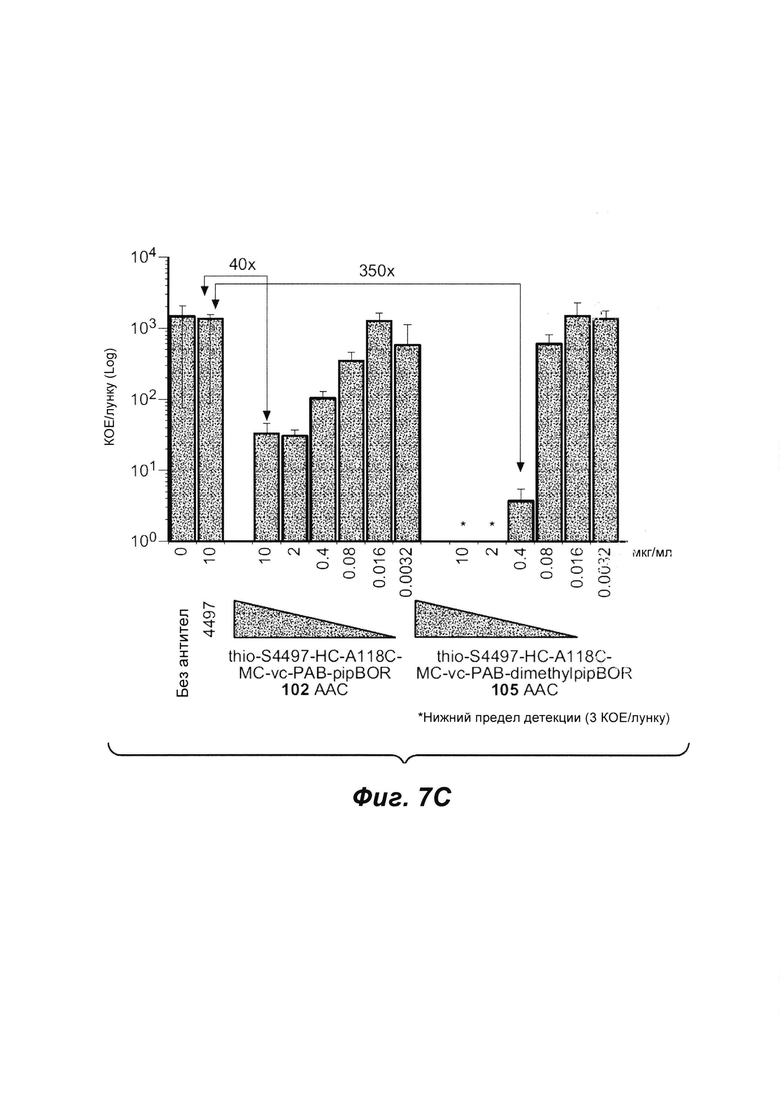
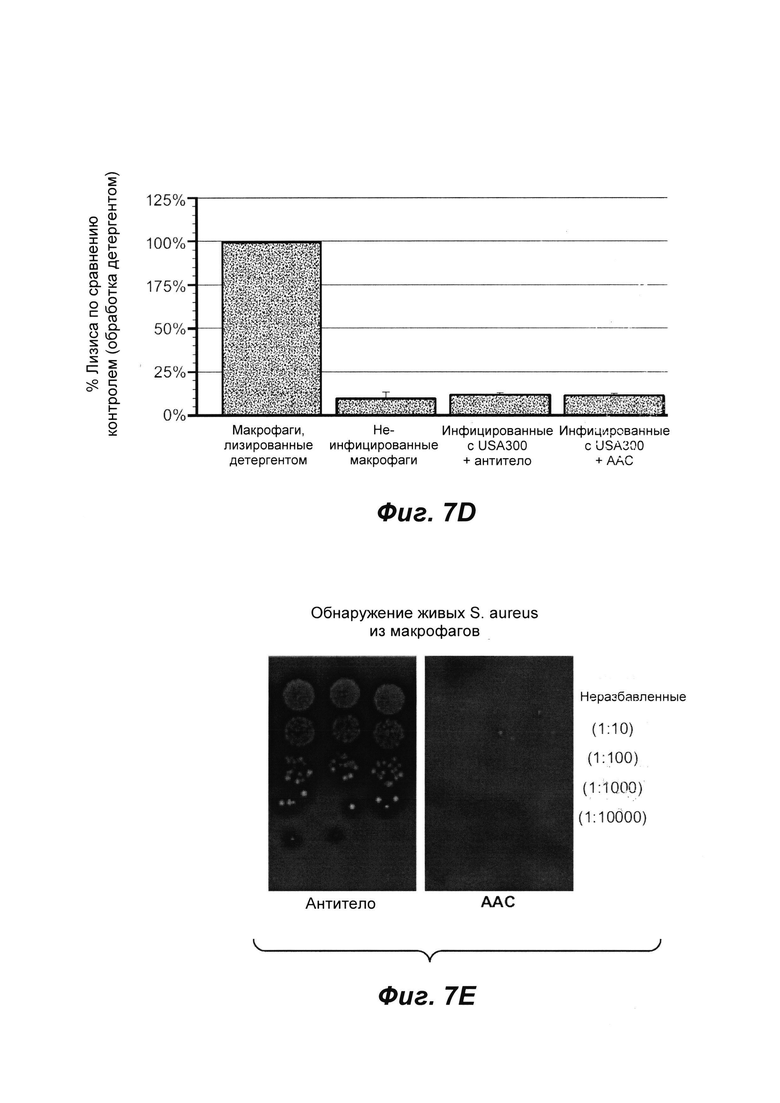
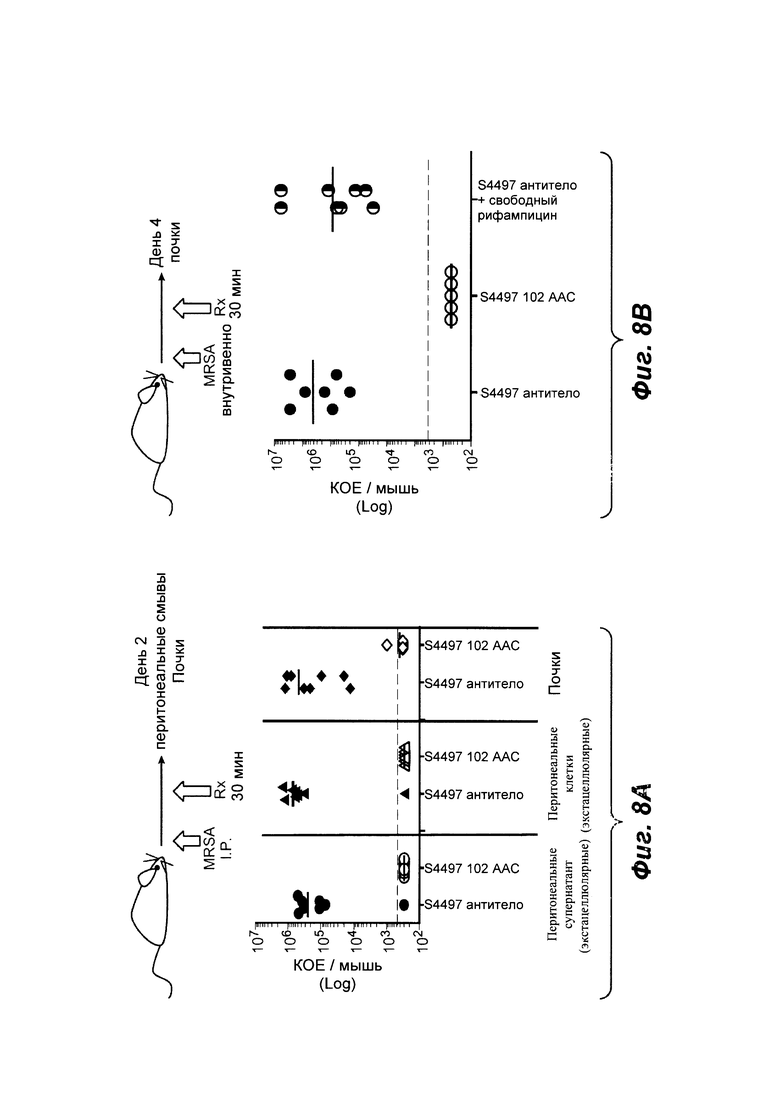
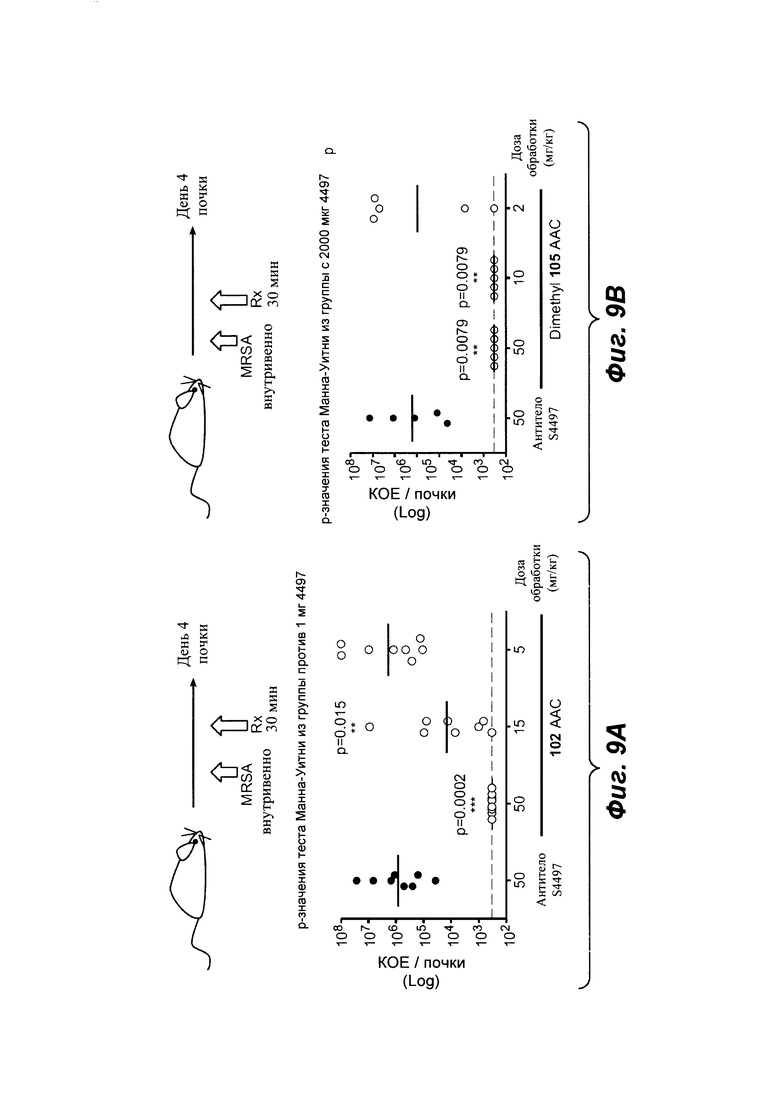
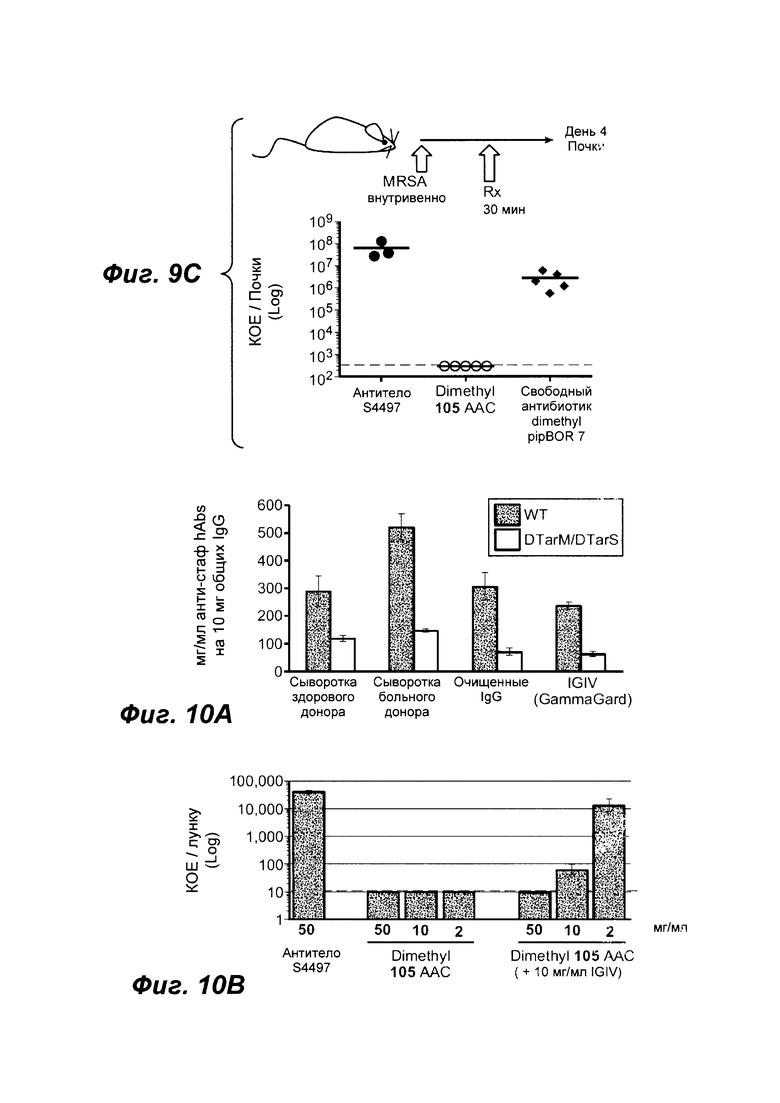
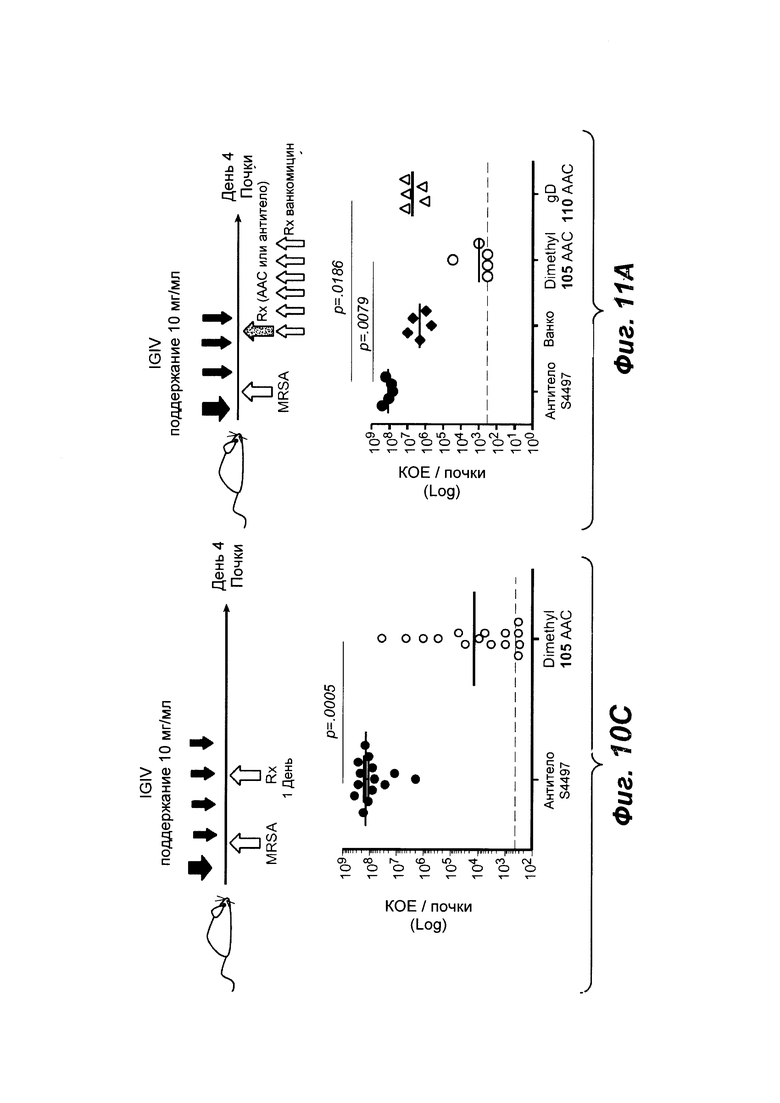
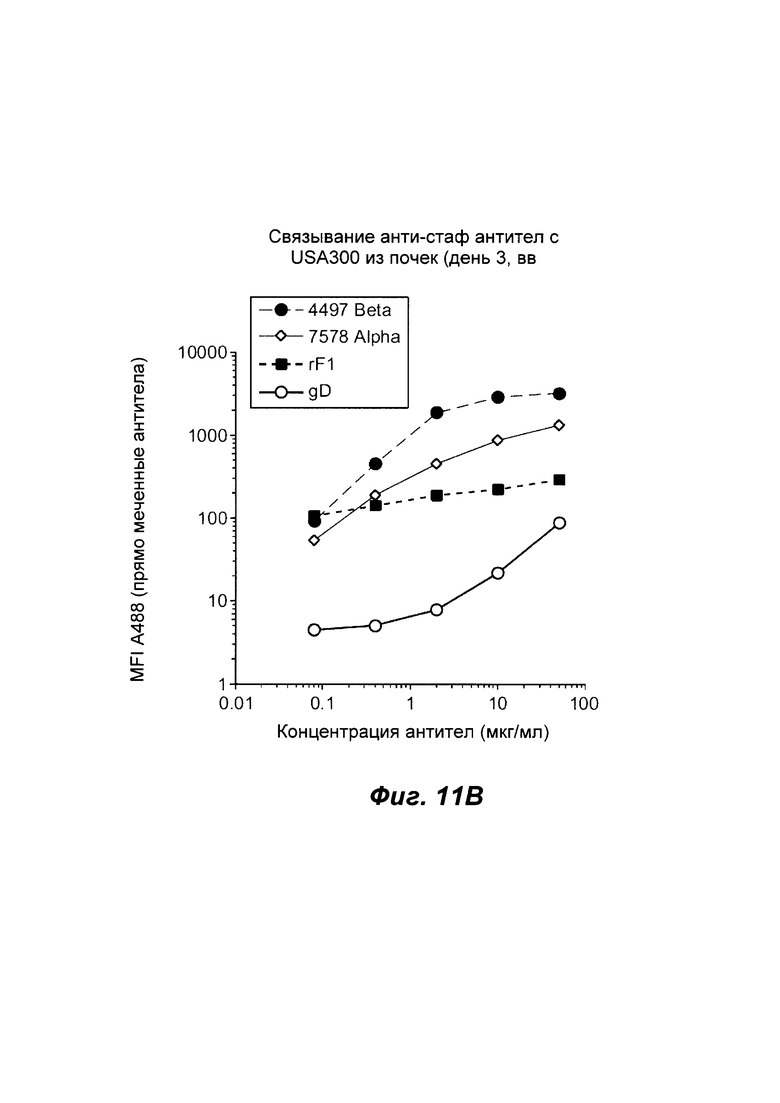
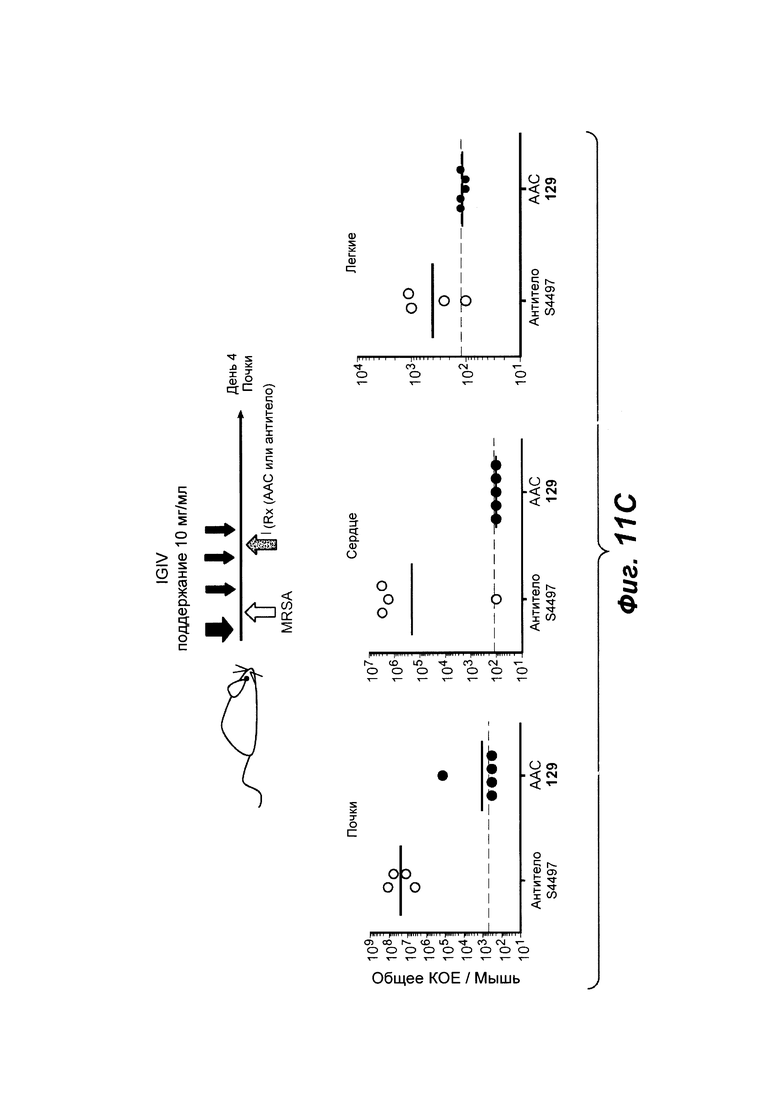
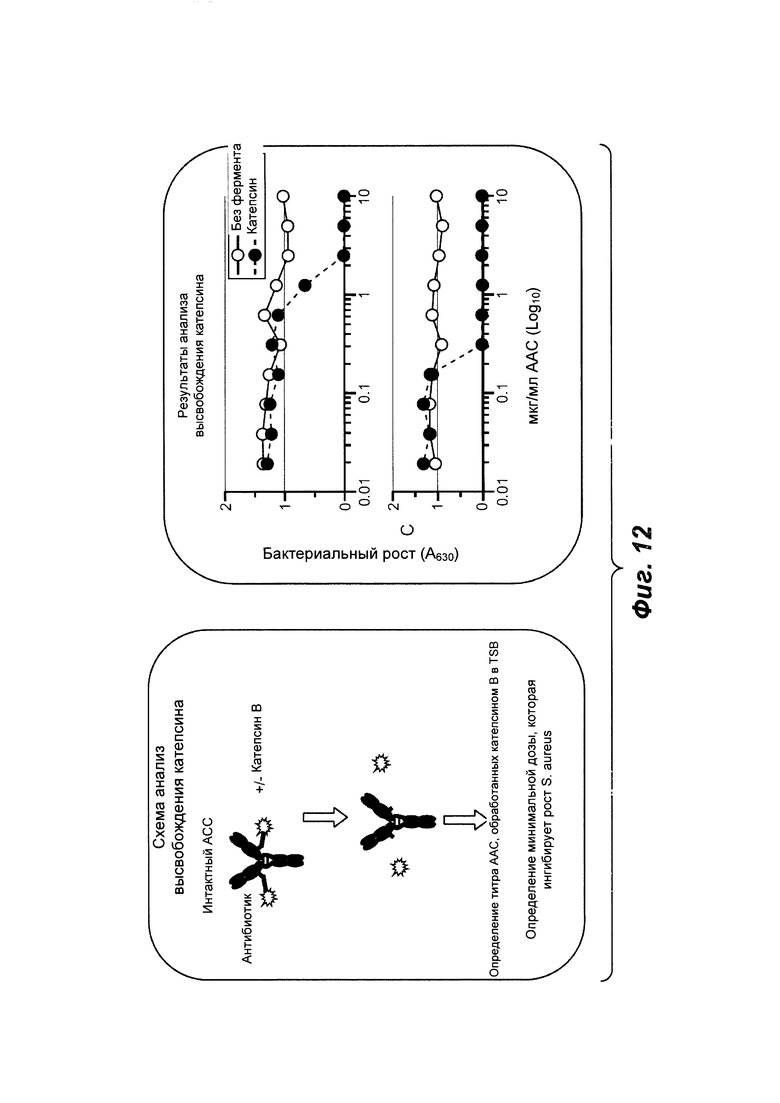
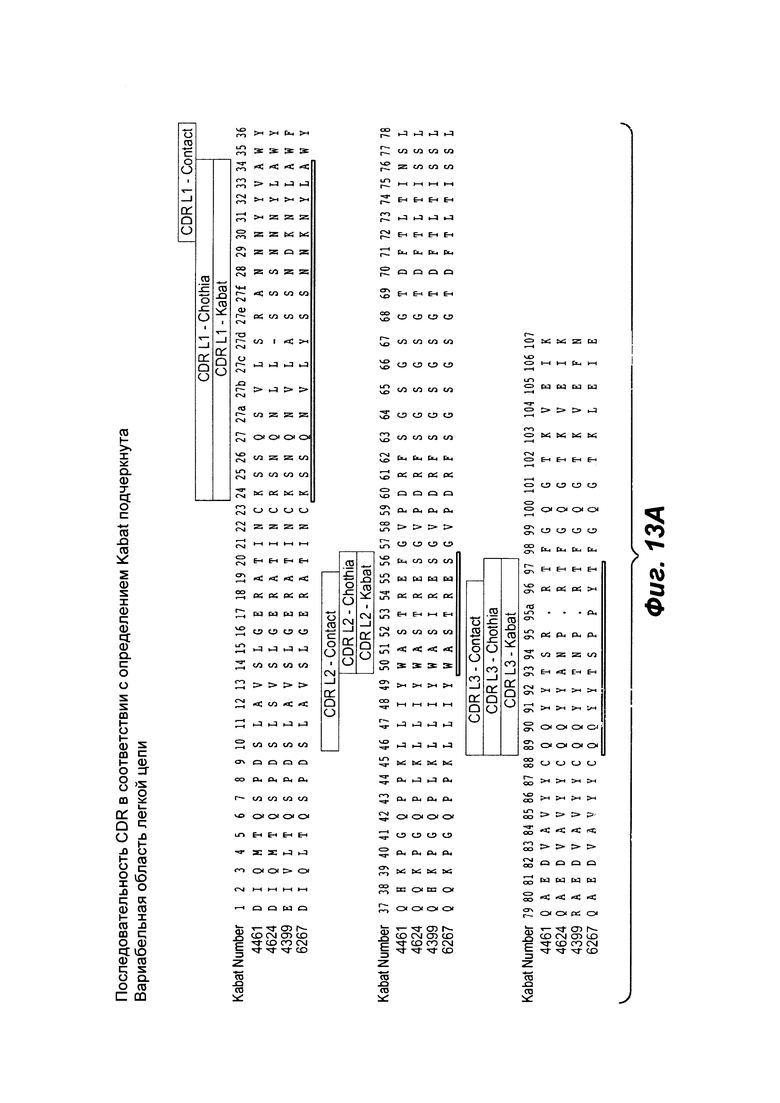
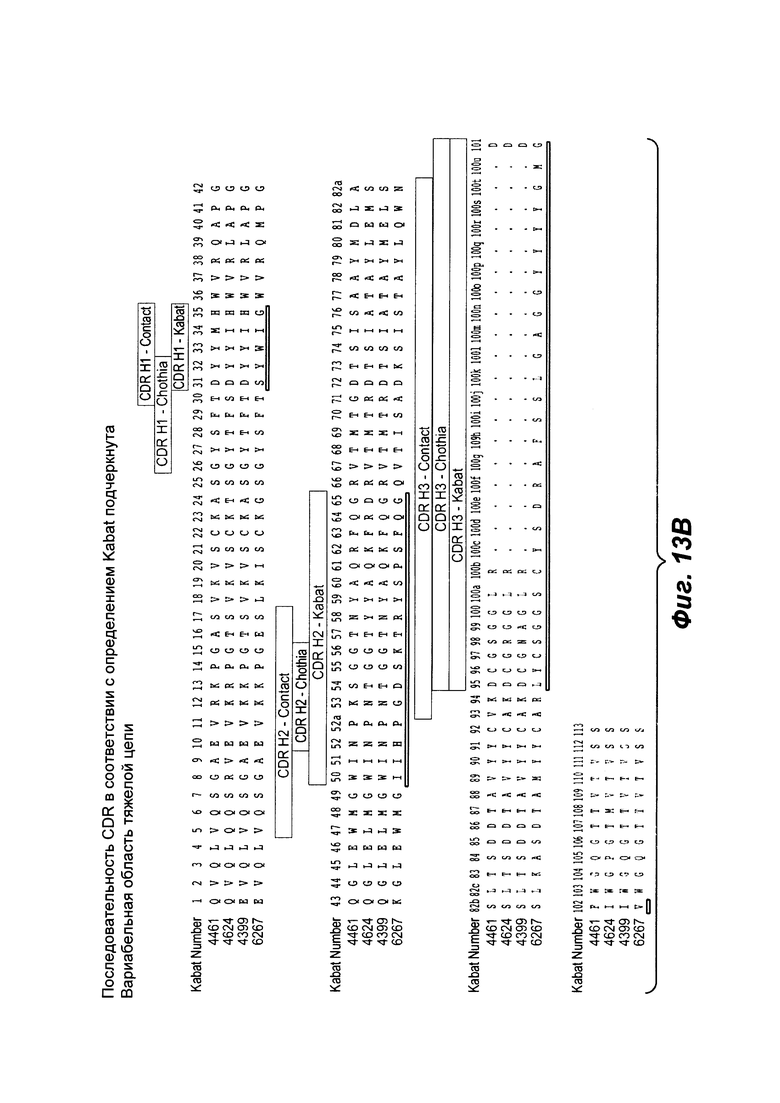
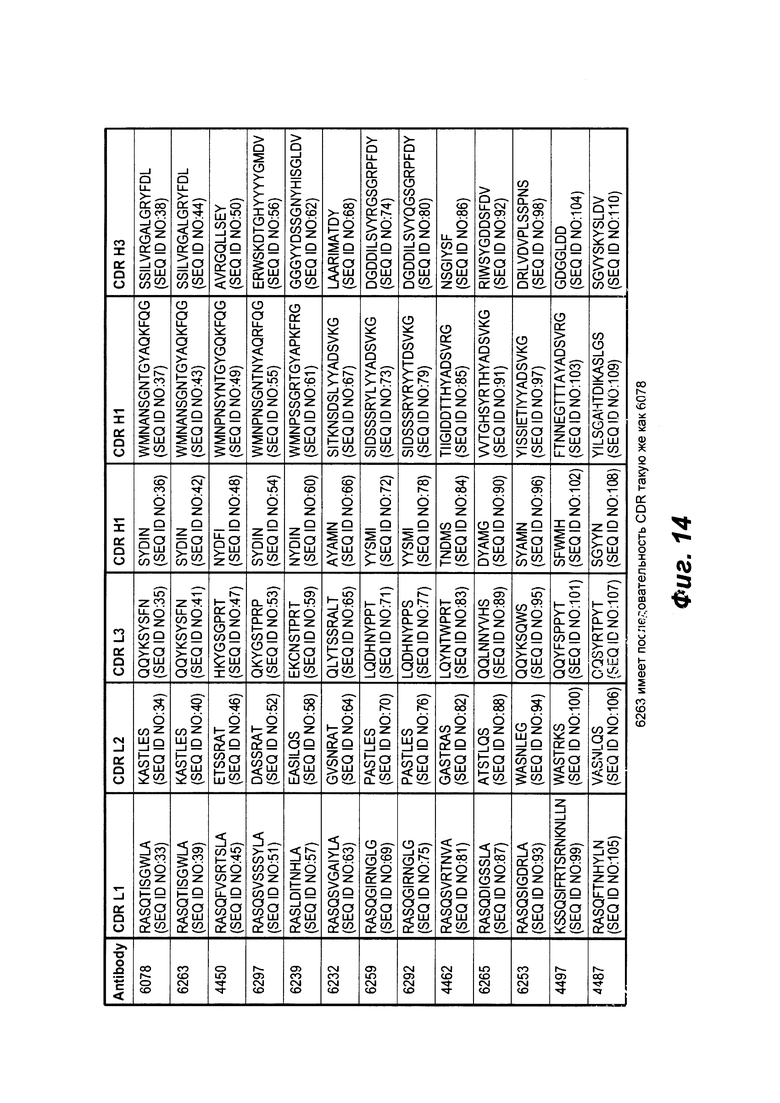
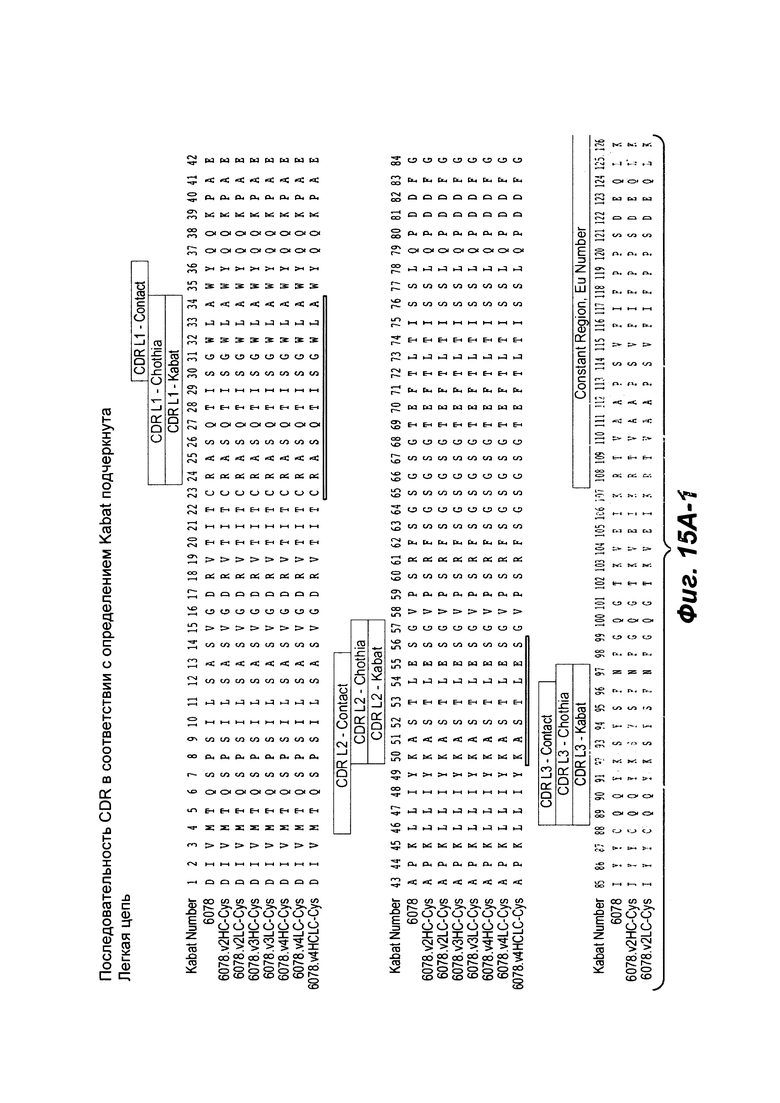
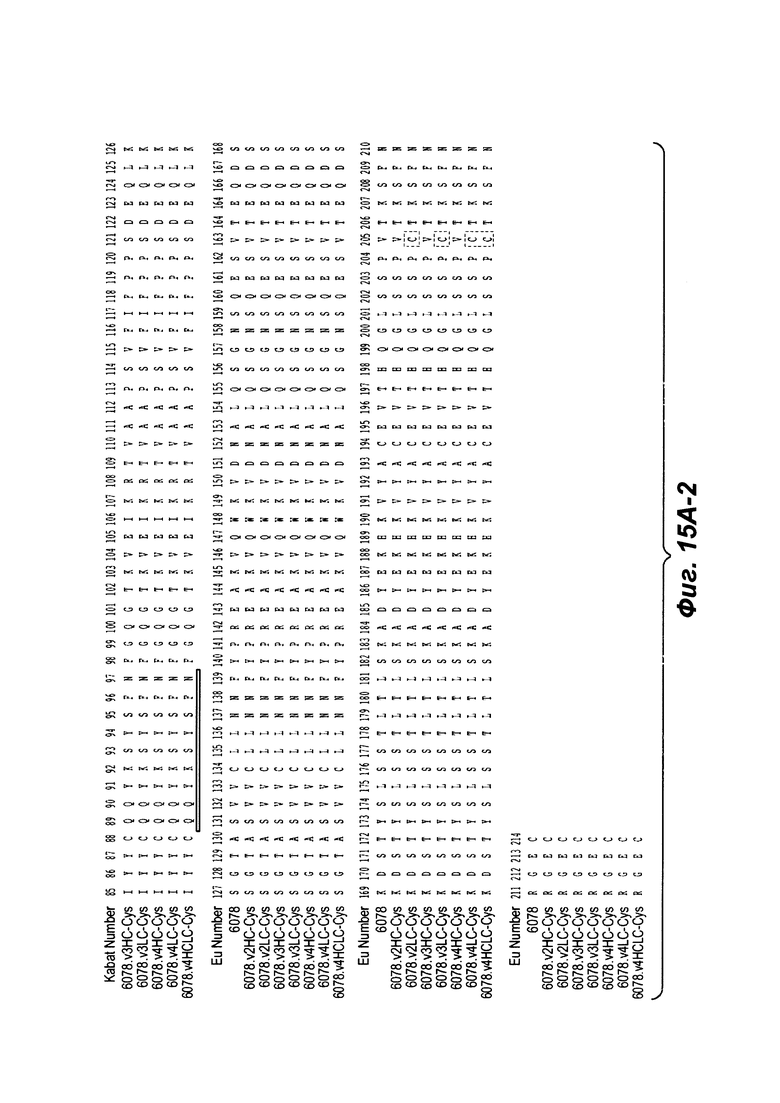
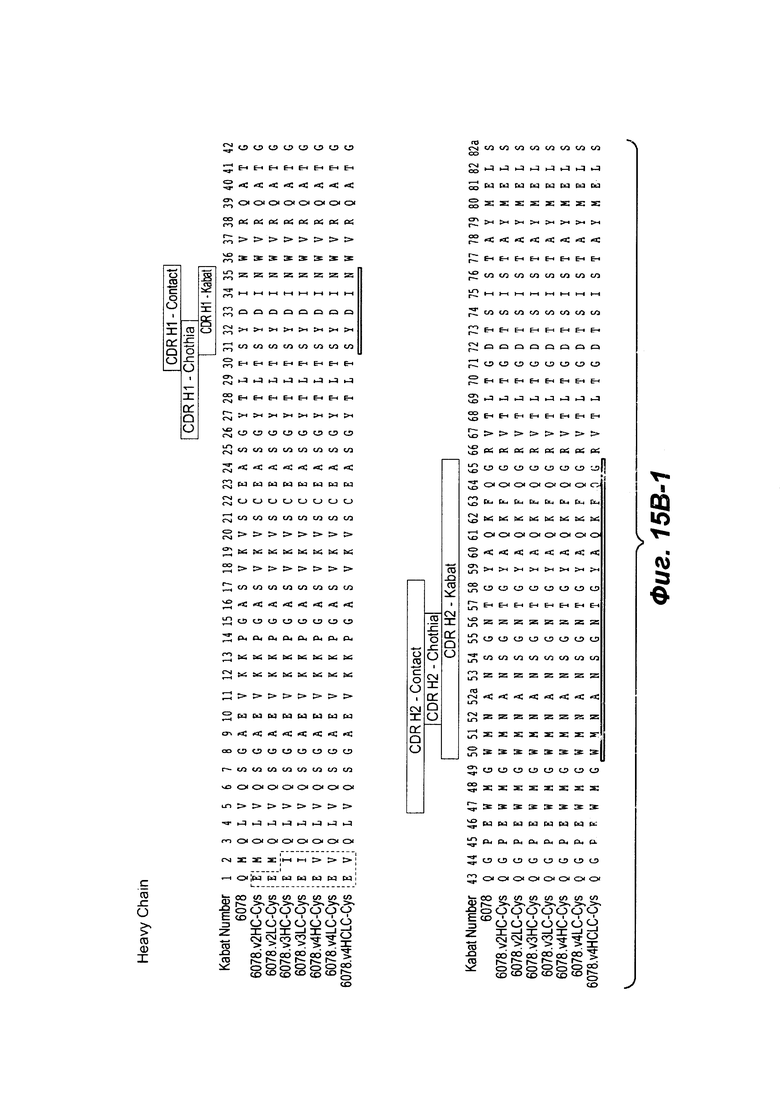
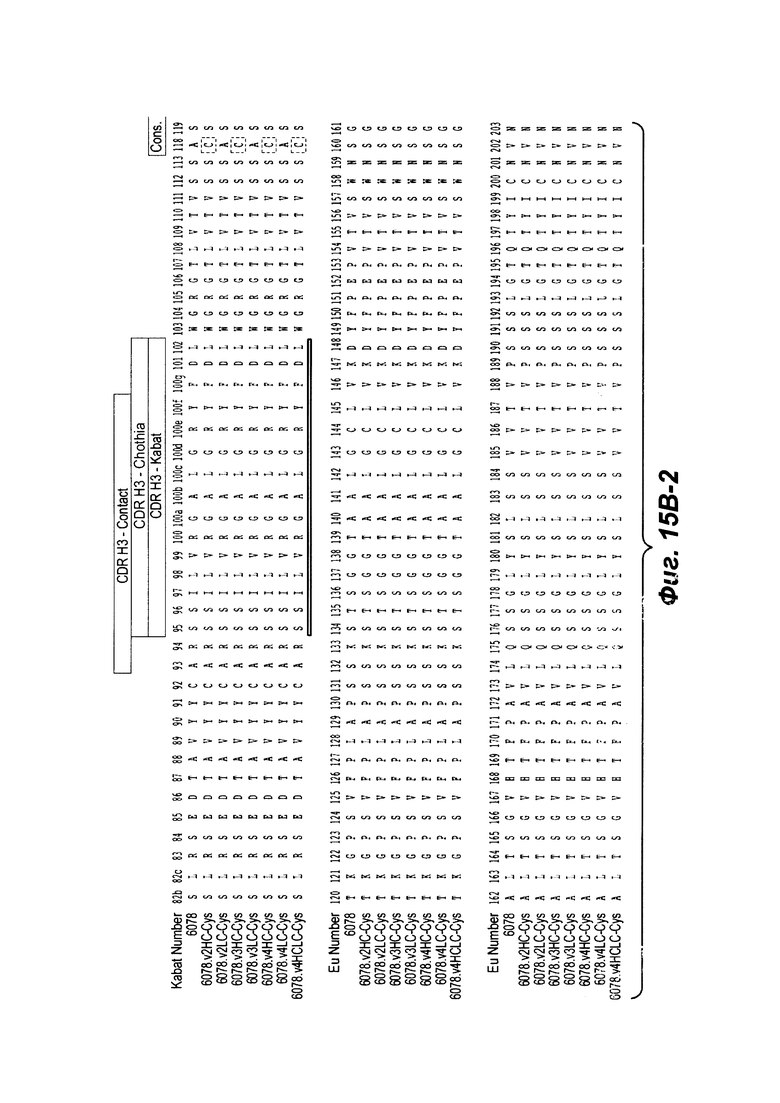
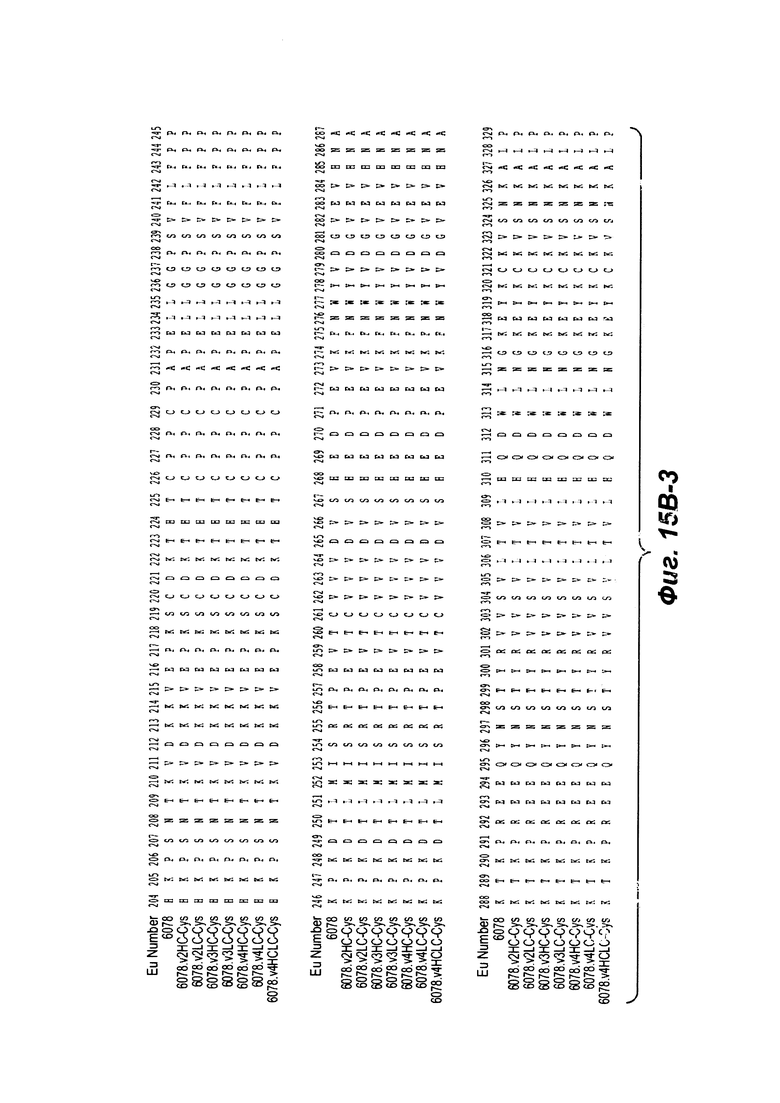
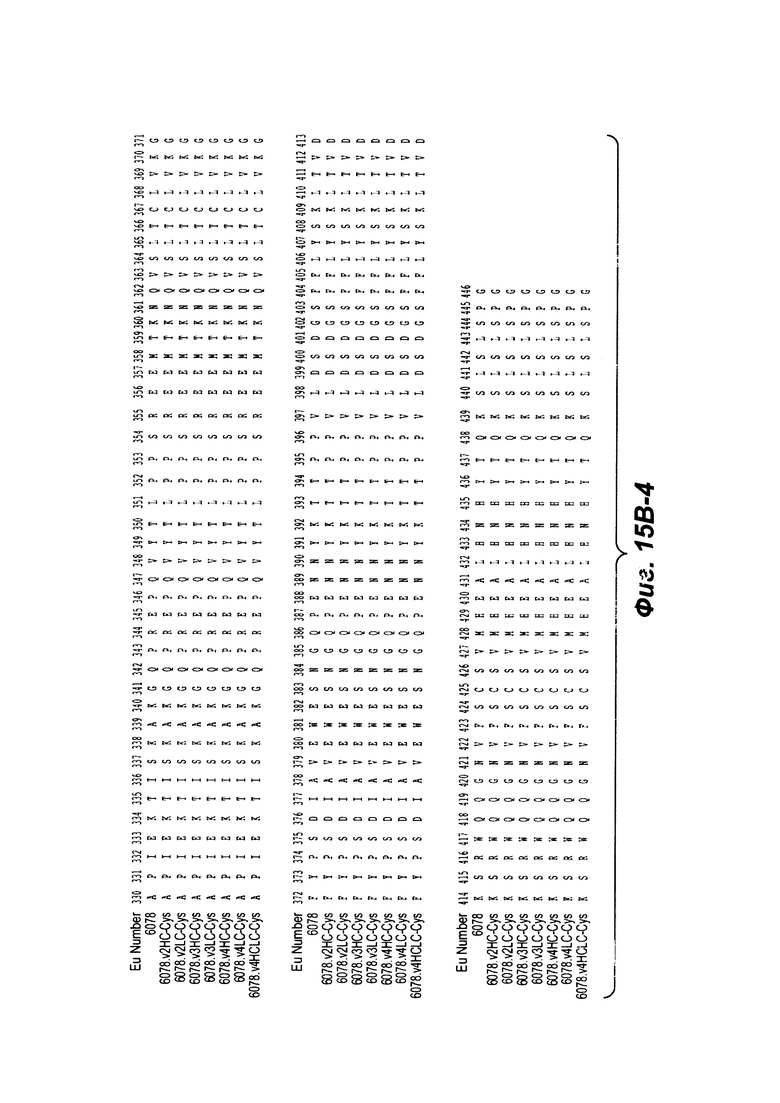
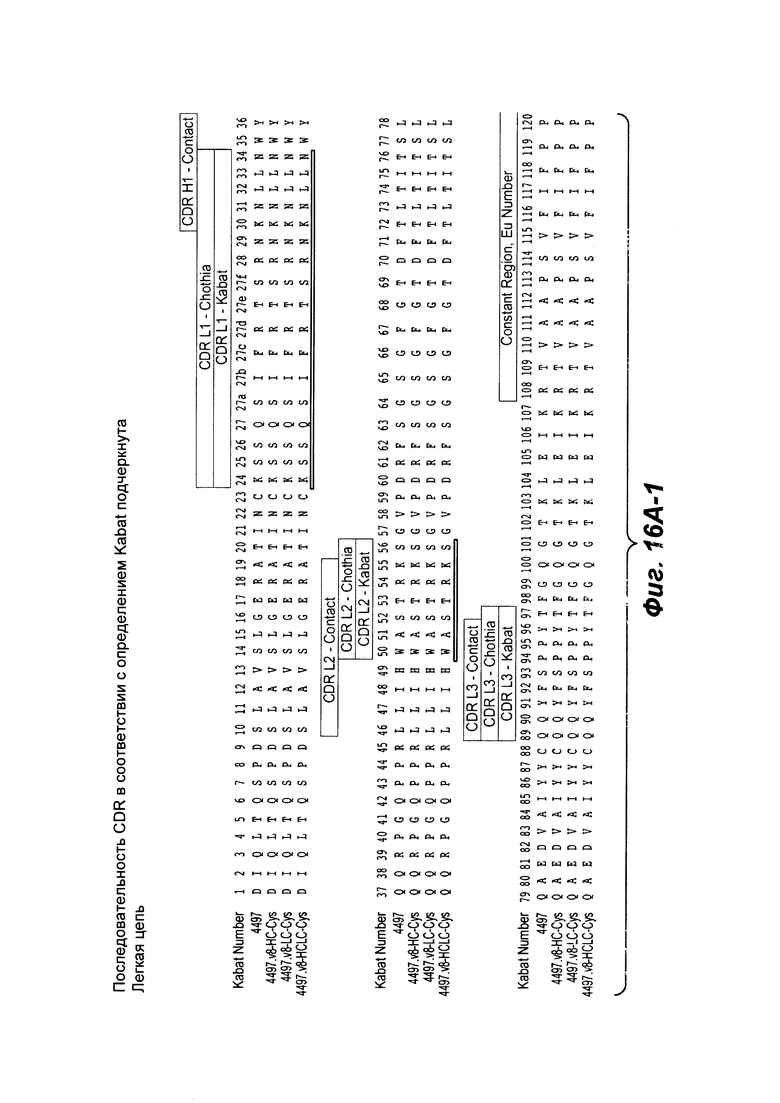
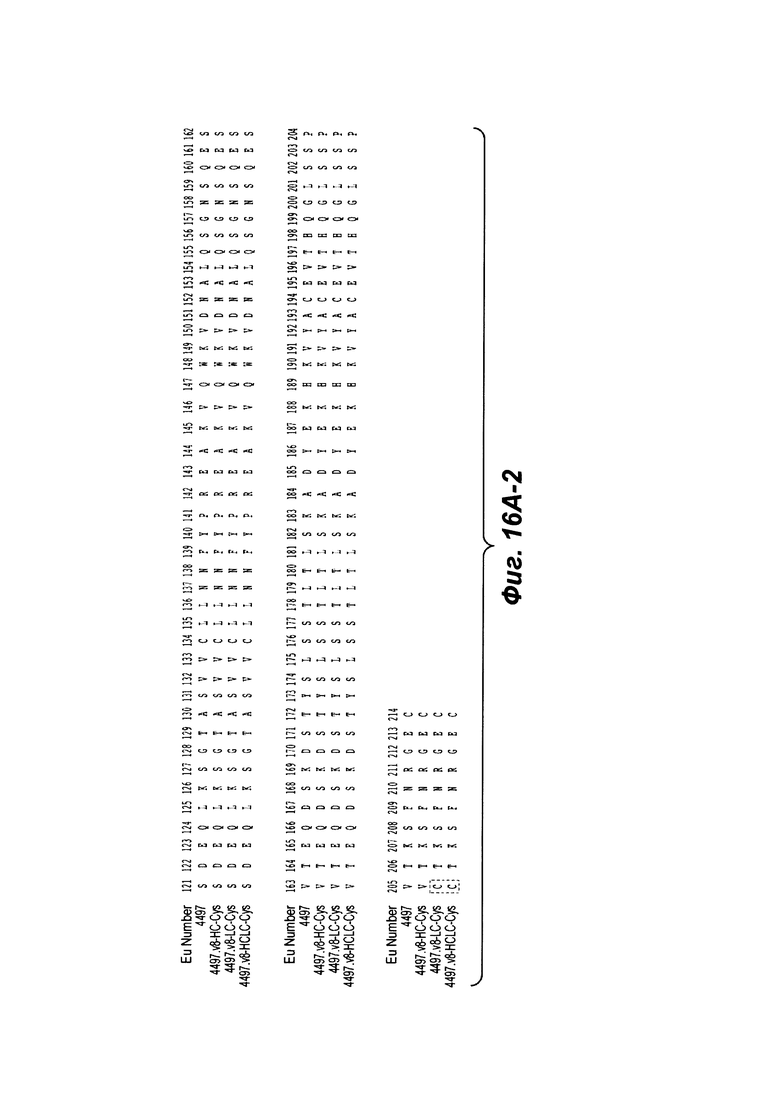
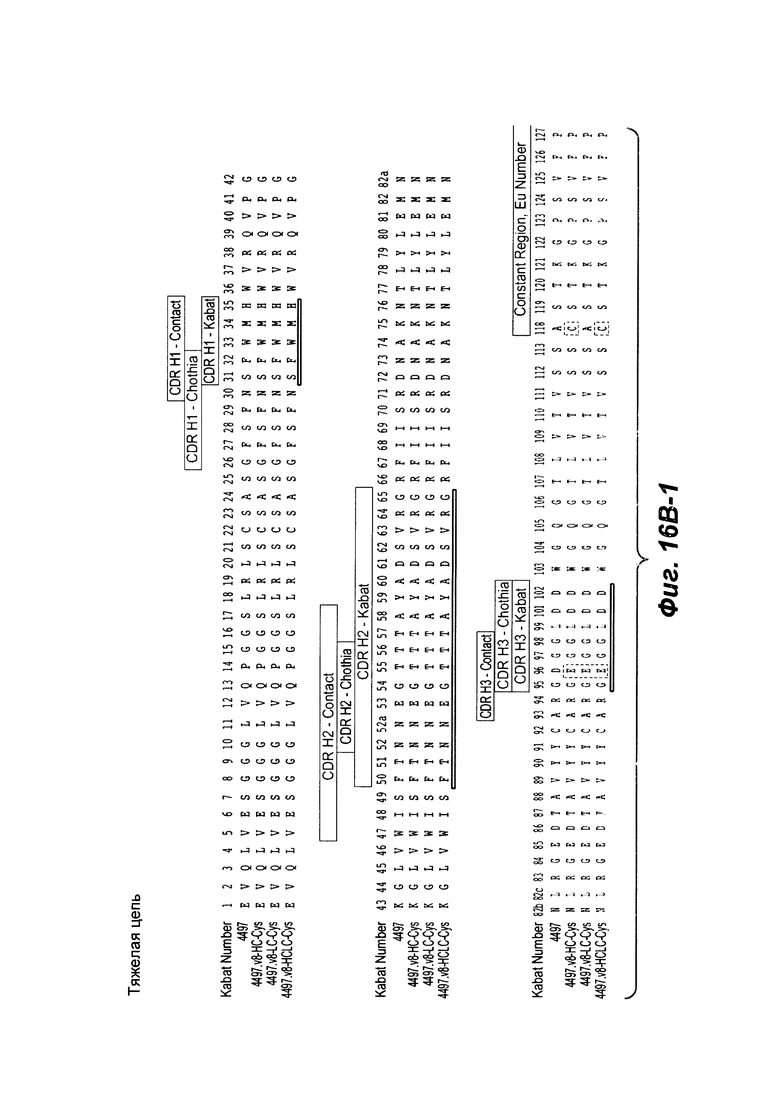
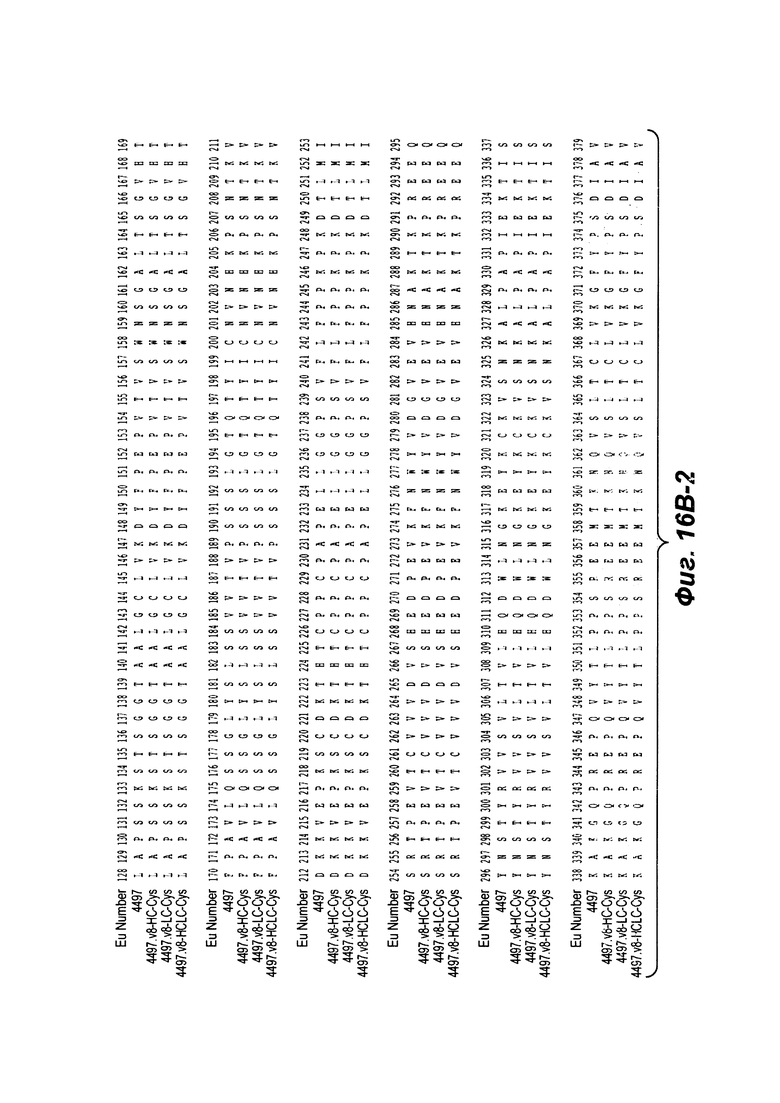
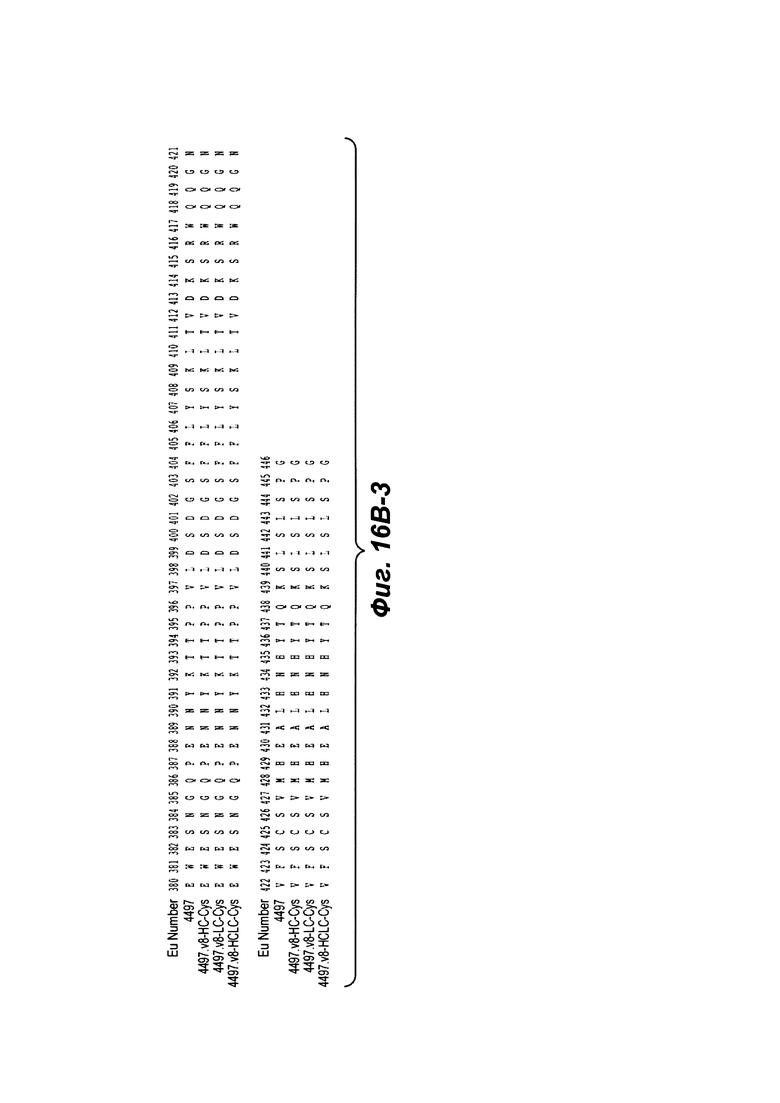
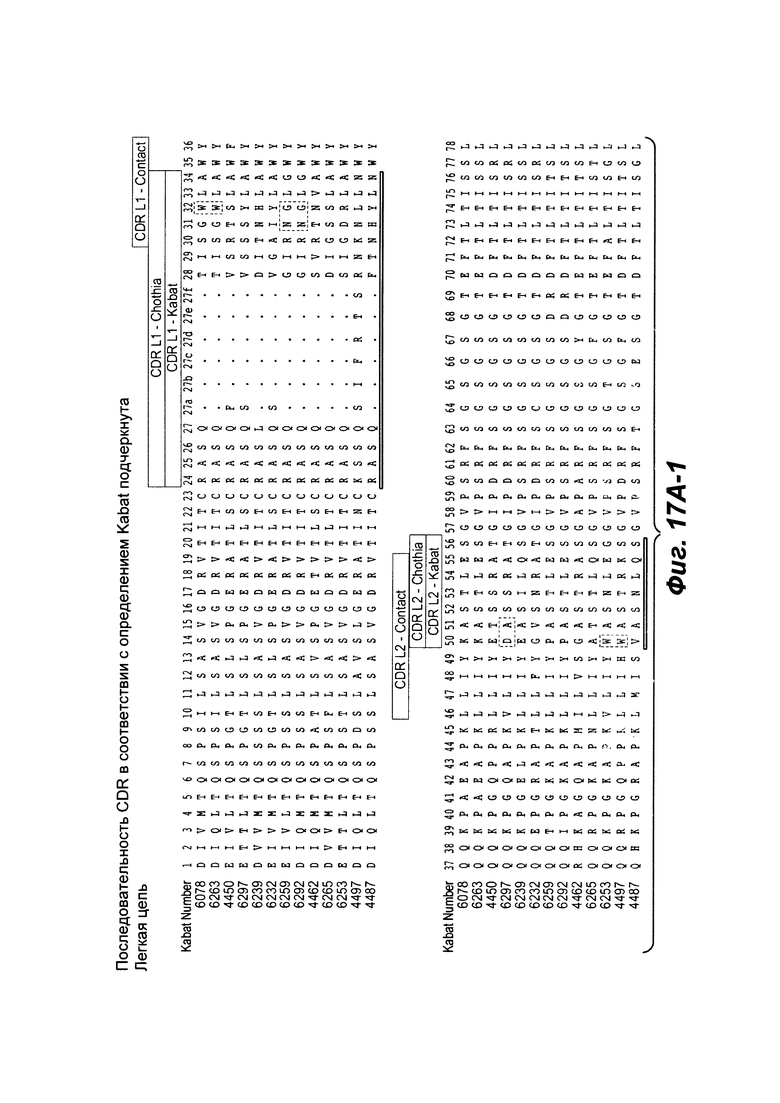
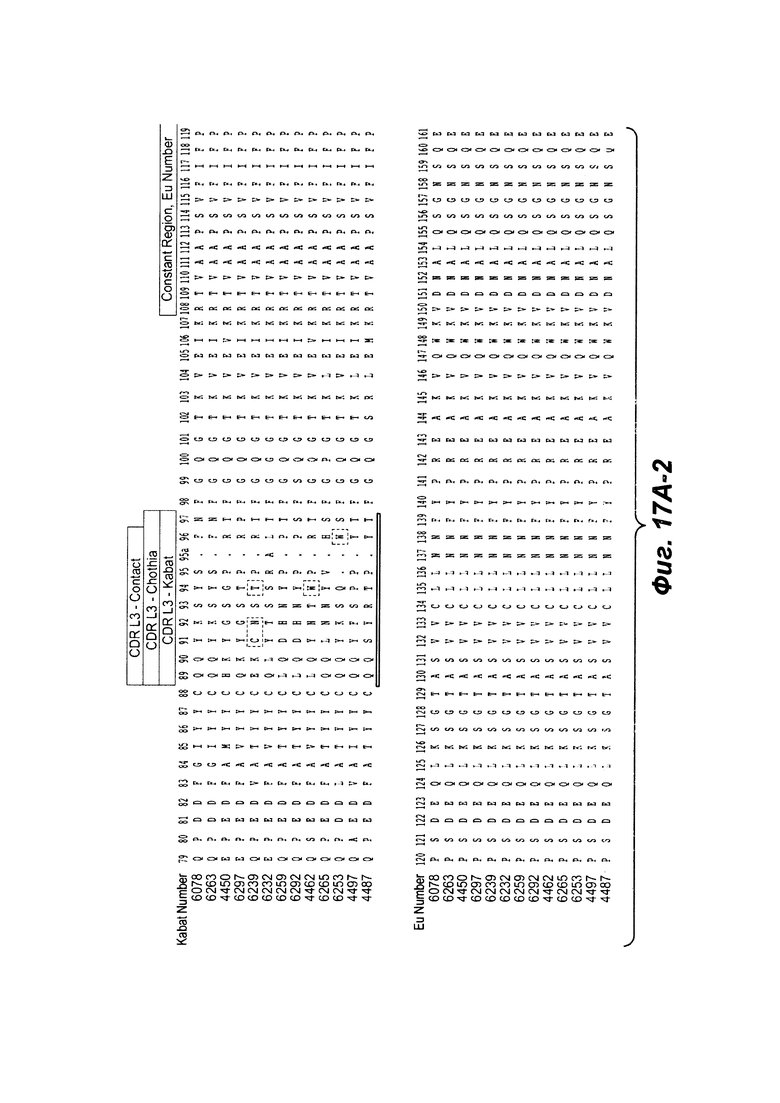
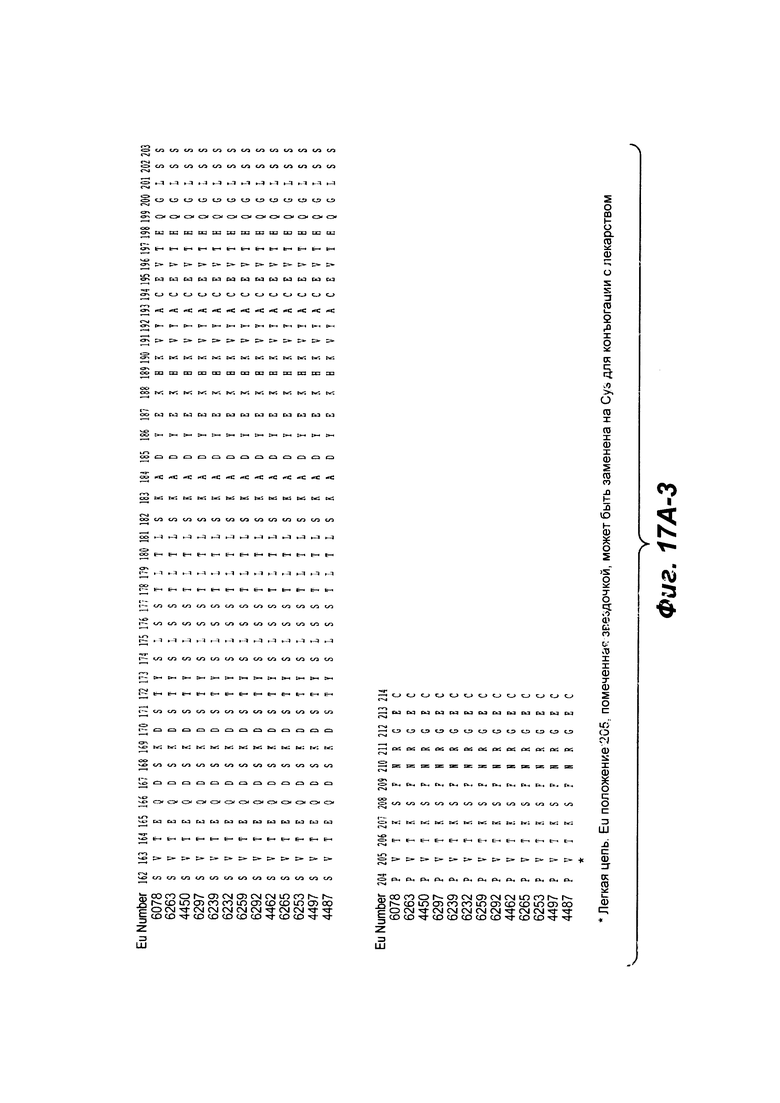
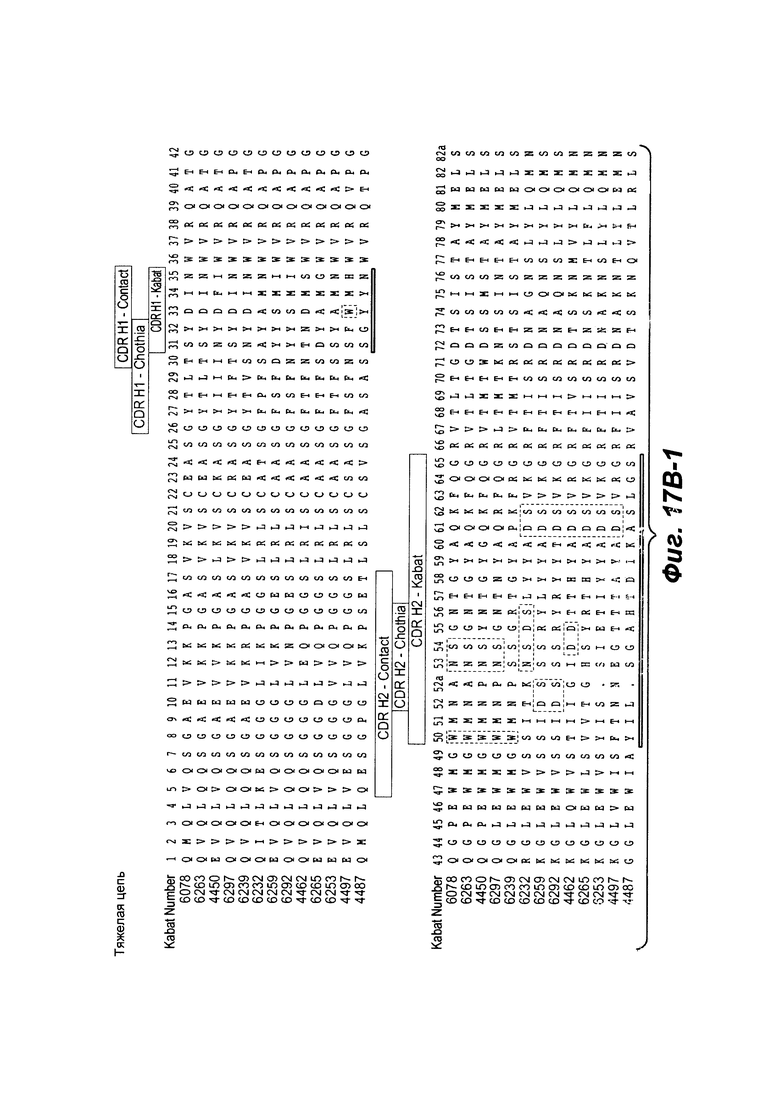
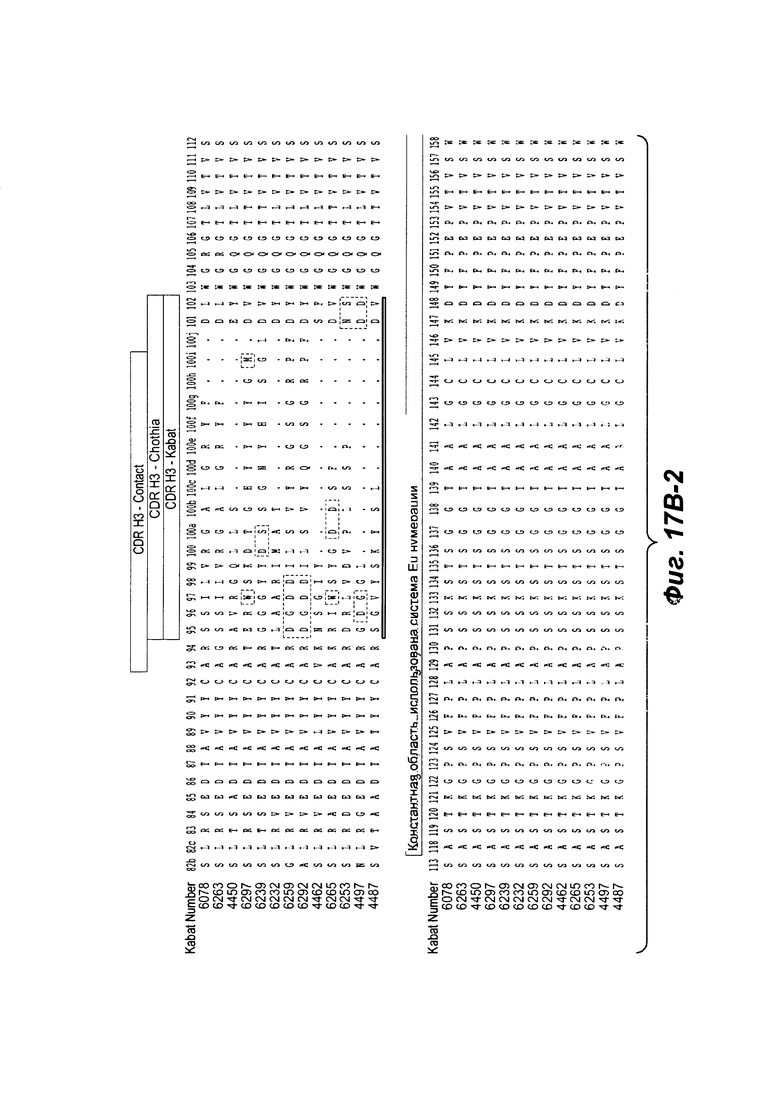
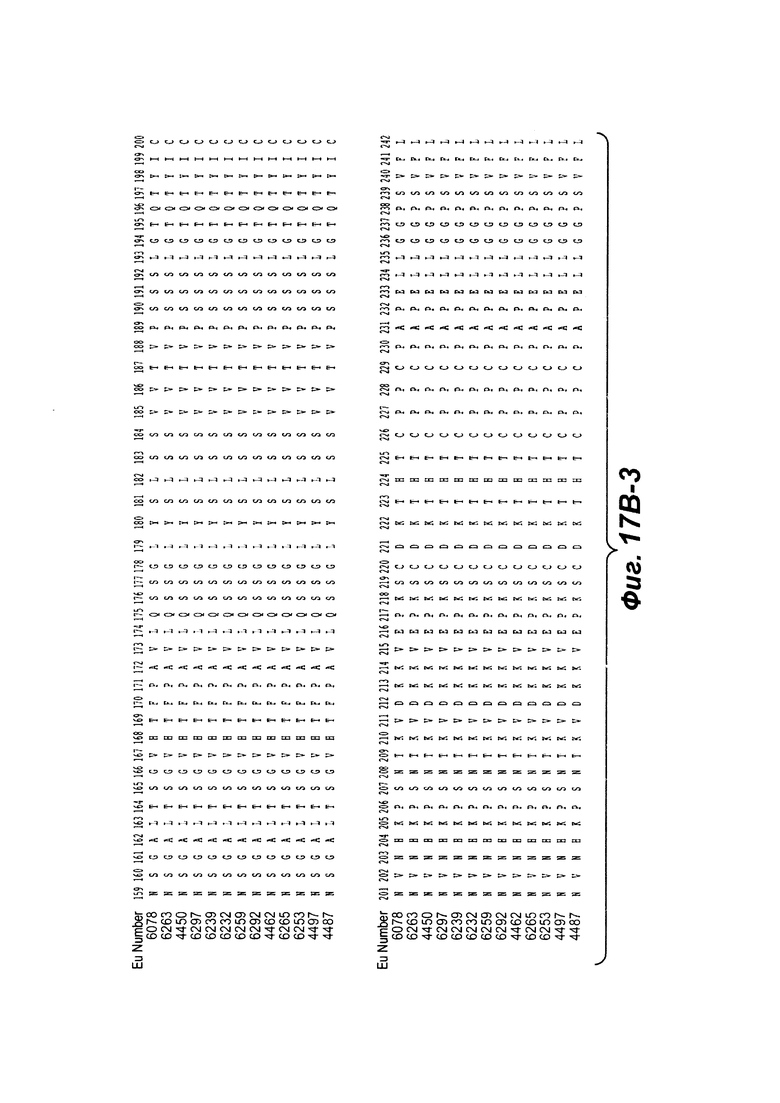
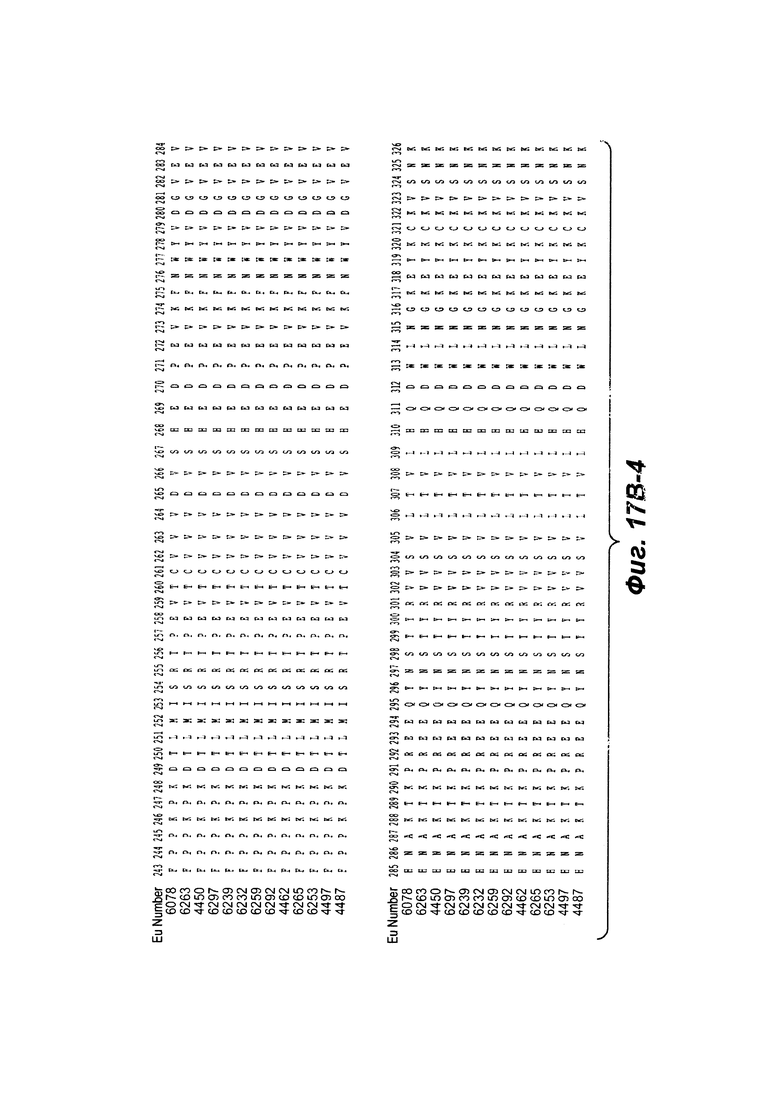
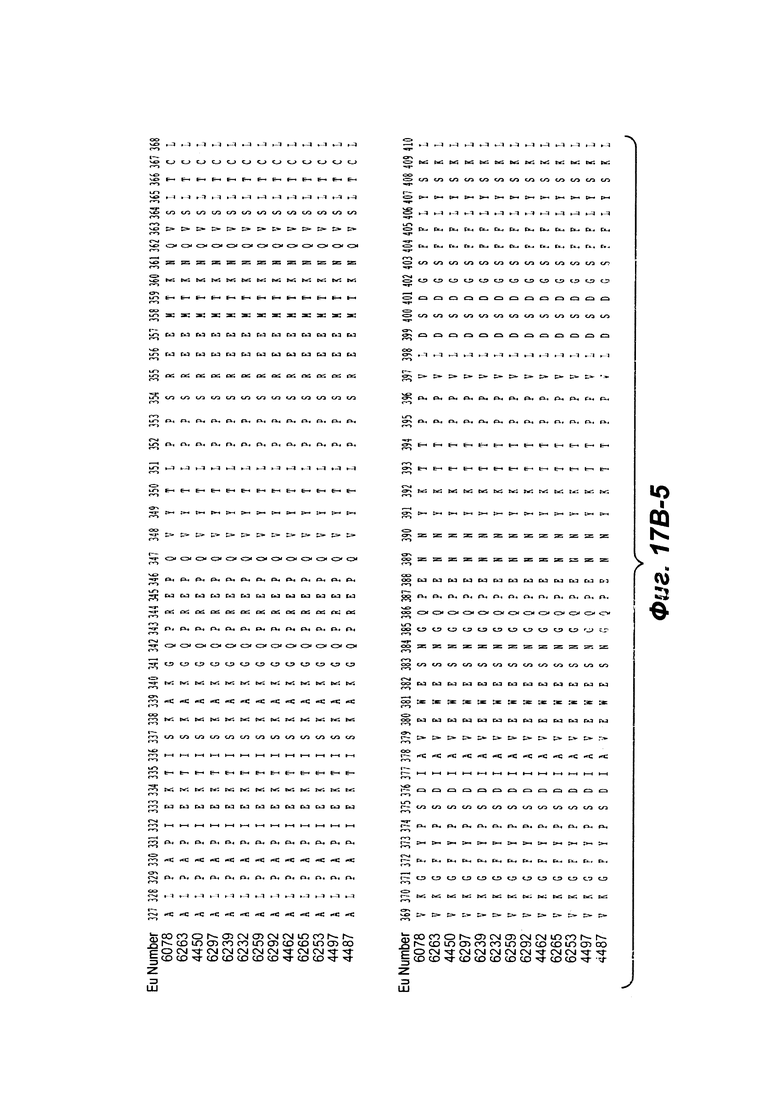
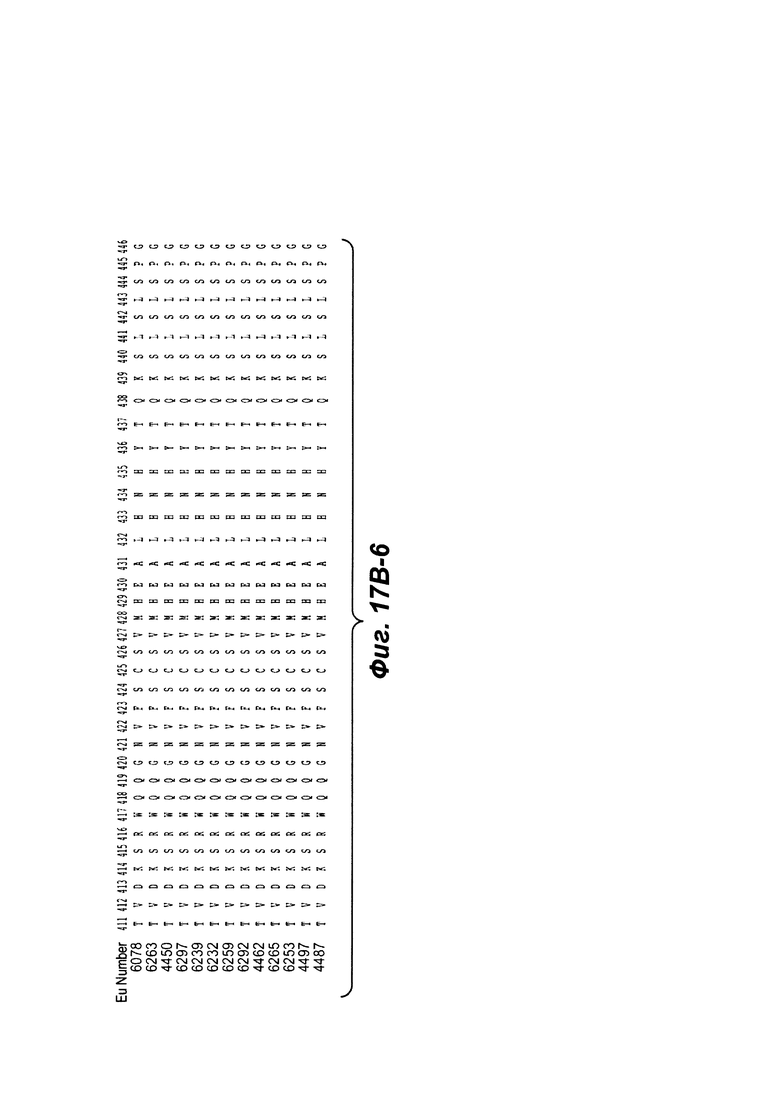
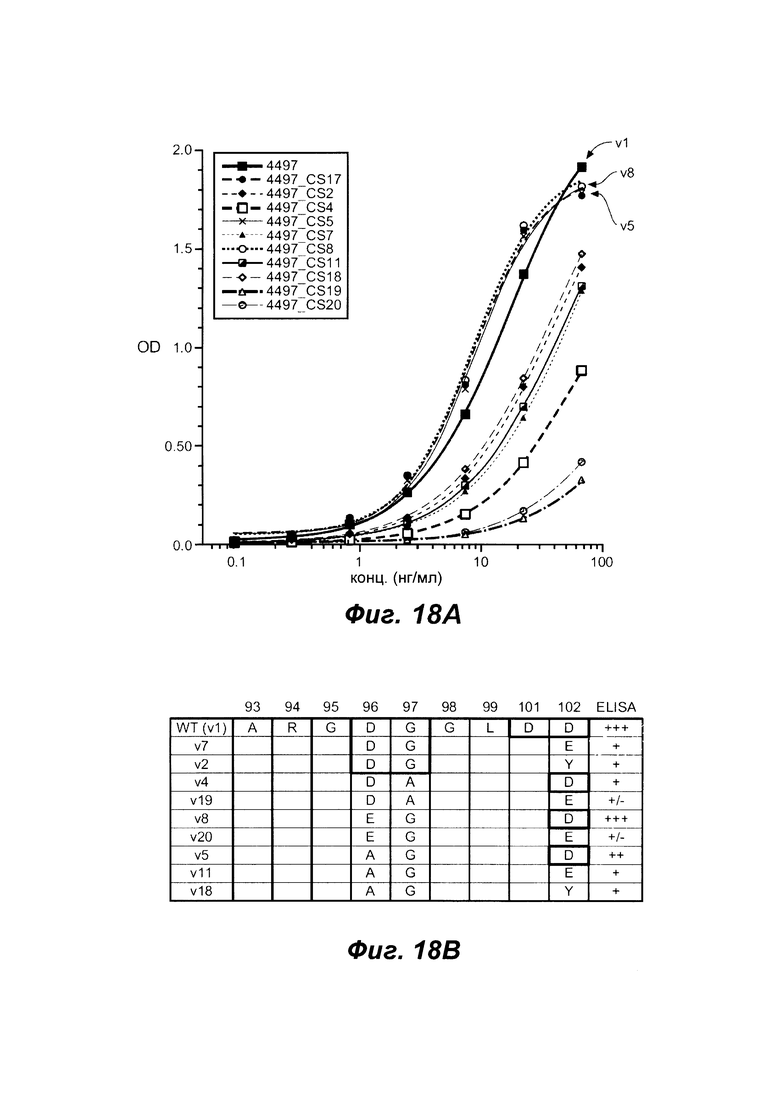
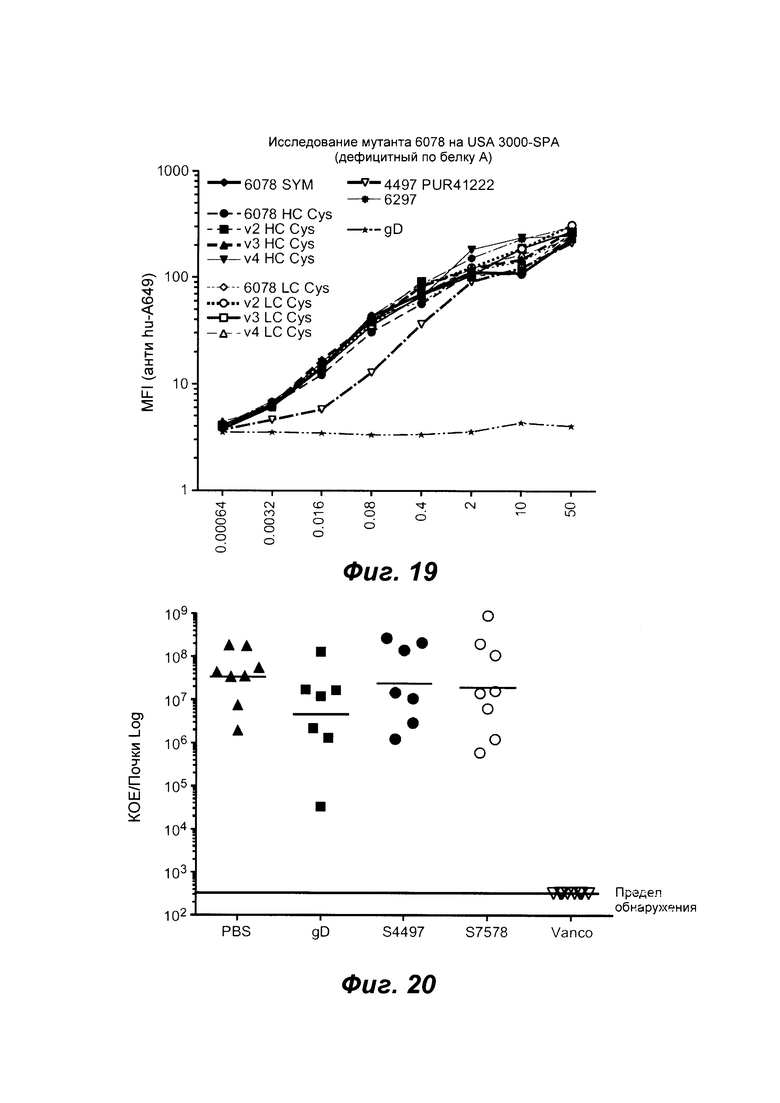
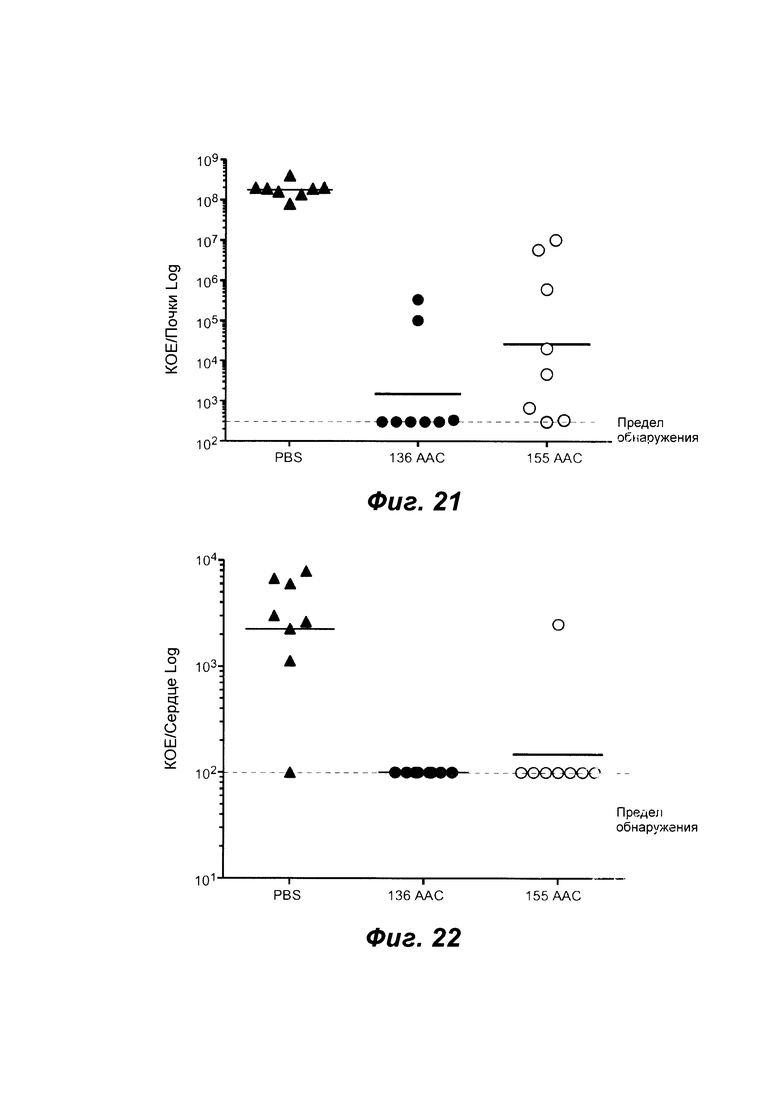
Изобретение относится к области биохимии, в частности к конъюгату анти-WTA (стеночная тейхоевая кислота) антитело-антибиотик для лечения бактериальной инфекции, вызванной Staphylococcus aureus, а также к фармацевтической композиции, его содержащей. Также раскрыт способ получения конъюгата анти-WTA антитело-антибиотик, включающий конъюгирование промежуточного соединения антибиотик-линкер с анти-WTA антителом. Изобретение позволяет эффективно осуществлять лечение бактериальной инфекции, вызванной Staphylococcus aureus. 3 н. и 20 з.п. ф-лы, 22 ил., 5 табл., 24 пр.
1. Конъюгат анти-WTA (стеночная тейхоевая кислота) антитело-антибиотик для лечения бактериальной инфекции, вызванной Staphylococcus aureus, содержащий анти-WTA моноклональное антитело, где анти-WTA антитело связывается с Staphylococcus aureus и ковалентно присоединено посредством расщепляемого протеазой пептидного линкера к фрагменту антибиотика, выбранного из клиндамицина, новобиоцина, ретапамулина, даптомицина,
CG-400549, имеющего структуру
 CG-400549 ситафлоксацина, тейкопланина, триклозана, нафтиридона, радезолида, доксорубицина, ампициллина, ванкомицина и имипенема, дорипенема, где
CG-400549 ситафлоксацина, тейкопланина, триклозана, нафтиридона, радезолида, доксорубицина, ампициллина, ванкомицина и имипенема, дорипенема, где
(a) VL анти-WTA моноклонального антитела содержит CDR L1, включающий последовательность KSSQSIFRTSRNKNLLN (SEQ ID NO: 99), CDR L2, включающий последовательность WASTRKS (SEQ ID NO: 100), и CDR L3, включающий последовательность QQYFSPPYT (SEQ ID NO: 101); и VH анти-WTA антитела содержит CDR H1, включающий последовательность SFWMH (SEQ ID NO: 102), CDR Н2, включающий последовательность FTNNEGTTTAYADSVRG (SEQ ID NO: 103), и CDR Н3, включающий последовательность GEGGLDD (SEQ ID NO: 118) или GDGGLDD (SEQ ID NO: 104), или
(b) VL анти-WTA моноклонального антитела содержит CDR L1, включающий последовательность RASQTISGWLA (SEQ ID NO: 33), CDR L2, включающий последовательность KASTLES (SEQ ID NO: 34), и CDR L3, включающий последовательность QQYKSYSFN (SEQ ID NO: 35); и VH анти-WTA антитела содержит CDR H1, включающий последовательность SYDIN (SEQ ID NO: 36), CDR Н2, включающий последовательность WMNANSGNTGYAQKFQG (SEQ ID NO: 37), и CDR Н3, включающий последовательность SSILVRGALGRYFDL (SEQ ID NO: 38).
2. Конъюгат анти-WTA антитело-антибиотик по п. 1, где антитело содержит VL, включающую аминокислотную последовательность, идентичную по меньшей мере на 95% по длине VL последовательности SEQ ID NO. 119.
3. Конъюгат анти-WTA антитело-антибиотик по п. 1, где антитело содержит VH, включающую аминокислотную последовательность, идентичную по меньшей мере на 95% по длине VH последовательности SEQ ID NO. 156.
4. Конъюгат анти-WTA антитело-антибиотик по п. 1, где антитело содержит VL и VH, где VL содержит последовательность SEQ ID NO. 119 и VH содержит последовательность SEQ ID NO. 156.
5. Конъюгат анти-WTA антитело-антибиотик по п. 1, где антитело содержит легкую цепь (LC), где LC содержит аминокислотную последовательность SEQ ID NO. 145 и тяжелую цепь (НС), где НС содержит аминокислотную последовательность SEQ ID NO. 157.
6. Конъюгат анти-WTA антитело-антибиотик по любому из предшествующих пунктов, где анти-WTA антитело связывается с метициллин-устойчивыми Staphylococcus aureus (MRSA).
7. Конъюгат анти-WTA антитело-антибиотик по любому из предшествующих пунктов, где
(i) фрагмент антибиотика содержит четвертичный амин, присоединенный к пептидному линкеру и/или (ii) пептидный линкер присоединяют к цистеину или цистеину анти-WTA антитела, введенному методами генетической инженерии, и/или (iii) пептидный линкер представляет собой линкер, расщепляемый цистеиновой протеазой.
8. Конъюгат анти-WTA антитело-антибиотик по п. 7, где пептидный линкер представляет расщепляемый человеческой протеазой катепсином В линкер или val-cit дипептидный линкер.
9. Конъюгат анти-WTA антитело-антибиотик по п. 1, имеющий формулу:
Ab-(L-abx)p,
в которой:
Ab представляет собой антитело против стеночной тейхоевой кислоты;
L представляет собой пептидный линкер, имеющий формулу:
-Str-Pep-Y-,
в которой Str представляет собой стретчер; Pep представляет собой пептид из от двух до двенадцати аминокислотных остатков, и Y представляет собой спейсерный участок; abx представляет собой фрагмент антибиотика; а
p представляет собой целое число от 1 до 8.
10. Конъюгат анти-WTA антитело-антибиотик по п. 9, где пептидный линкер имеет формулу:
-Str-Pep-Y-,
в которой Str представляет собой стретчер, ковалентно присоединенный к антителу против стеночной тейхоевой кислоты (WTA); Pep представляет собой пептид из от двух до двенадцати аминокислотных остатков, и Y представляет собой спейсерный участок, ковалентно присоединенный к фрагменту антибиотика.
11. Конъюгат анти-WTA антитело-антибиотик по п. 10, где (a) Str имеет формулу:
в которой R6 выбирают из группы, состоящей из C1-С10-алкилен, -С3-C8 карбоцикло, -O-(C1-C8 алкил)-, -арилен-, C1-C10 алкилен-арилен-, -арилен-C1-С10 алкилен, -C1-C10 алкилен-(С3-C8 карбоцикло)-, -(С3-С8 карбоцикло)-C1-С10-алкилен, -С3-C8 гетероцикло-, -C1-С10 алкилен(С3-С8 гетероцикло)-, -(С3-С8 гетероцикло)-C1-C10-алкилен, -(CH2CH2O)r-, и -(CH2CH2O)r-CH2-; и r представляет собой целое число в диапазоне от 1 до 10 и необязательно, где R6 представляет собой -(CH2)5- и/или (b) Pep содержит от двух до двенадцати аминокислотных остатков, независимо выбранных из глицина, аланина, фенилаланина, лизина, аргинина, валина и цитруллина, и необязательно, где Pep выбирают из валин-цитруллина (val-cit, vc) и фенилаланин-лизина (fk) и/или Y содержит пара-аминобензил или пара-аминобензилоксикарбонил.
12. Конъюгат анти-WTA антитело-антибиотик по п. 9, имеющий формулу:
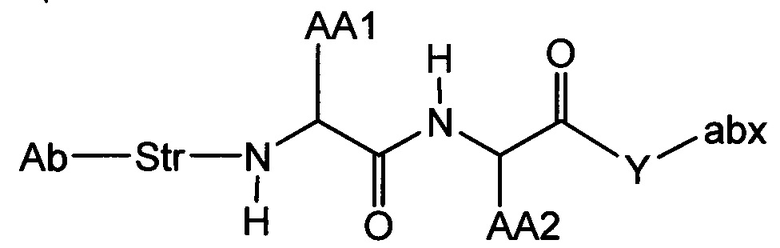
в которой АА1 и АА2 независимо выбираются из боковых цепей аминокислоты и необязательно, где боковая цепь аминокислоты независимо выбирается из Н, -СН3, -СН2(С6Н5), -CH2CH2CH2CH2NH2, -CH2CH2CH2NHC(NH)NH2, -СНСН(СН3)СН3 и -CH2CH2CH2NHC(O)NH2.
13. Конъюгат анти-WTA антитело-антибиотик по п. 12, выбранный из формулы:
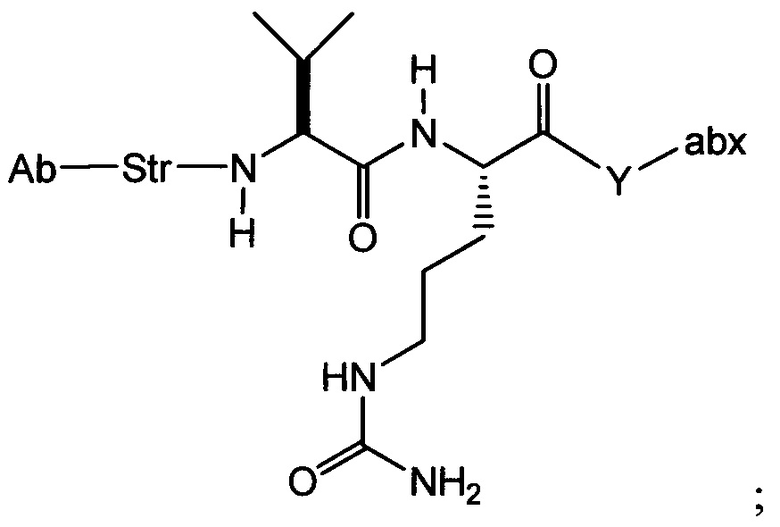
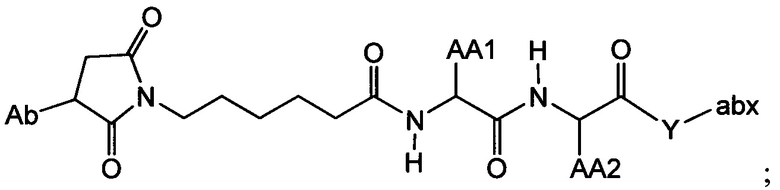
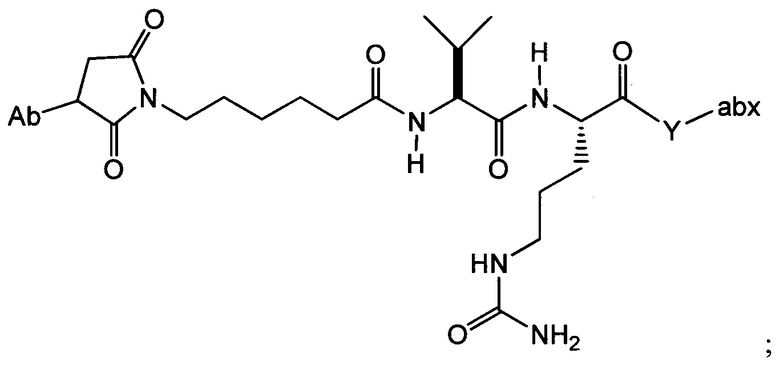
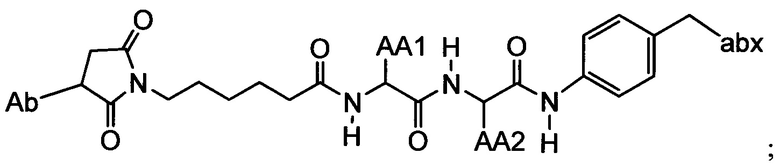
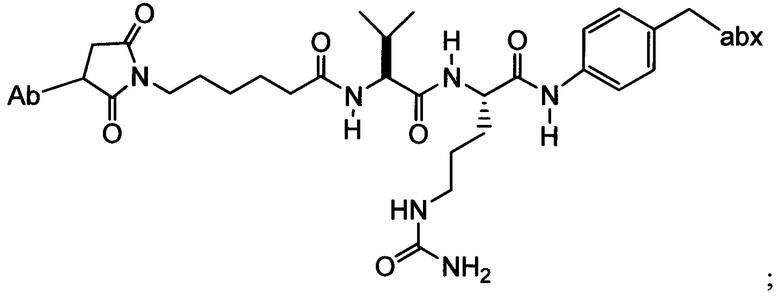
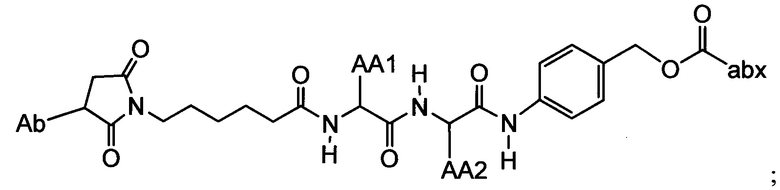
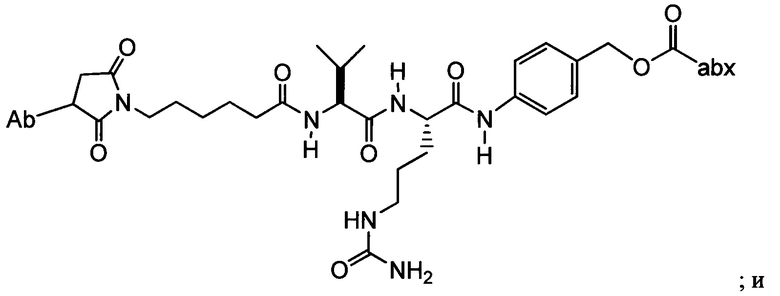
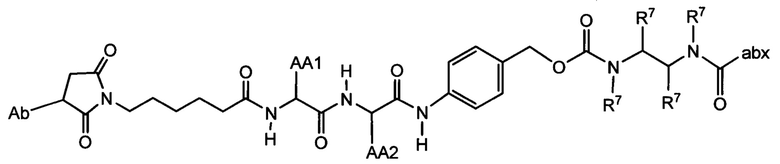 , в которой R7 независимо выбирается из Н и С1-С12 алкила.
, в которой R7 независимо выбирается из Н и С1-С12 алкила.
14. Фармацевтическая композиция для лечения бактериальной инфекции Staphylococcus aureus, содержащая эффективное количество конъюгата анти-WTA антитело-антибиотик по любому из пп. 1-13 и фармацевтически приемлемый носитель, выбранный из буфера, вспомогательного вещества, стабилизатора или консерванта.
15. Способ получения конъюгата анти-WTA антитело-антибиотик по любому из пп. 1-13, включающий конъюгирование промежуточного соединения антибиотик-линкер с анти-WTA антителом, при этом промежуточное соединение антибиотик-линкер выбрано из:
X-L-abx,
где:
abx представляет собой фрагмент антибиотика, выбранного из клиндамицина,
новобиоцина, ретапамулина, даптомицина,  , CG-400549, ситафлоксацина, тейкопланина, триклозана, нафтиридона, радезолида, доксорубицина, ампициллина, ванкомицина, имипенема и дорипенема;
, CG-400549, ситафлоксацина, тейкопланина, триклозана, нафтиридона, радезолида, доксорубицина, ампициллина, ванкомицина, имипенема и дорипенема;
L представляет собой пептидный линкер, ковалентно присоединенный к abx и X и имеющий формулу:
-Str-Pep-Y-,
в которой Str представляет собой стретчер; Pep представляет собой пептид из от двух до двенадцати аминокислотных остатков, и Y представляет собой спейсерный участок; и X представляет собой реакционноспособную функциональную группу, выбранную из малеимида, тиола, амино, бромида, бромацетамида, йодацетамида, п-толуолсульфоната, иодида, гидроксила, карбоксила, пиридилдисульфида и N-гидроксисукцинимида, где
(a) VL анти-WTA моноклонального антитела содержит CDR L1, включающий последовательность KSSQSIFRTSRNKNLLN (SEQ ID NO: 99), CDR L2, включающий последовательность WASTRKS (SEQ ID NO: 100), и CDR L3, включающий последовательность QQYFSPPYT (SEQ ID NO: 101); и VH анти-WTA антитела содержит CDR H1, включающий последовательность SFWMH (SEQ ID NO: 102), CDR Н2, включающий последовательность FTNNEGTTTAYADSVRG (SEQ ID NO: 103), и CDR Н3, включающий последовательность GEGGLDD (SEQ ID NO: 118) или GDGGLDD (SEQ ID NO: 104), или
(b) VL анти-WTA моноклонального антитела содержит CDR L1, включающий последовательность RASQTISGWLA (SEQ ID NO: 33), CDR L2, включающий последовательность KASTLES (SEQ ID NO: 34), и CDR L3, включающий последовательность QQYKSYSFN (SEQ ID NO: 35); и VH анти-WTA антитела содержит CDR H1, включающий последовательность SYDIN (SEQ ID NO: 36), CDR H2, включающий последовательность WMNANSGNTGYAQKFQG (SEQ ID NO: 37), и CDR Н3, включающий последовательность SSILVRGALGRYFDL (SEQ ID NO: 38).
16. Способ по п. 15, в котором X представляет собой
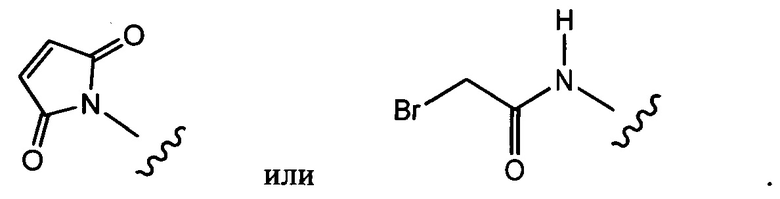
17. Способ по п. 15, в котором промежуточное соединение антибиотик-линкер выбрано из:
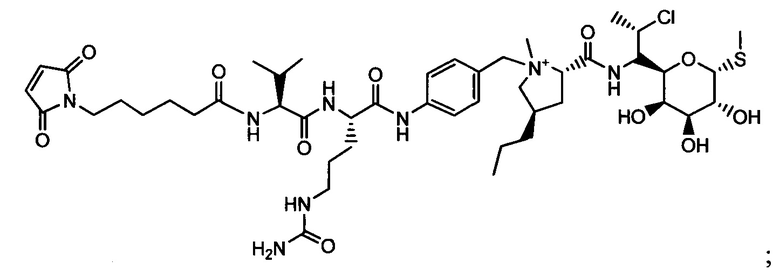
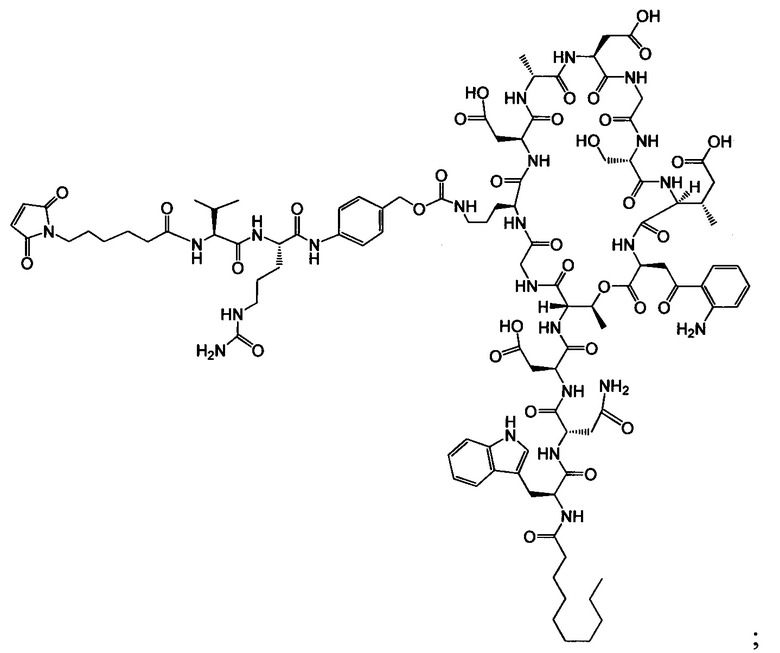
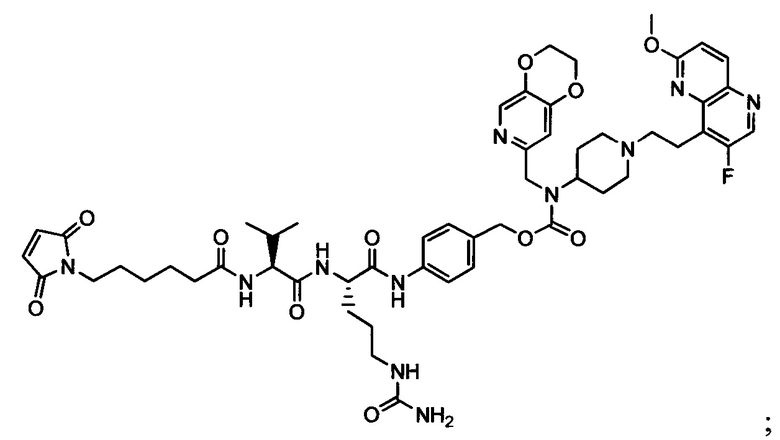
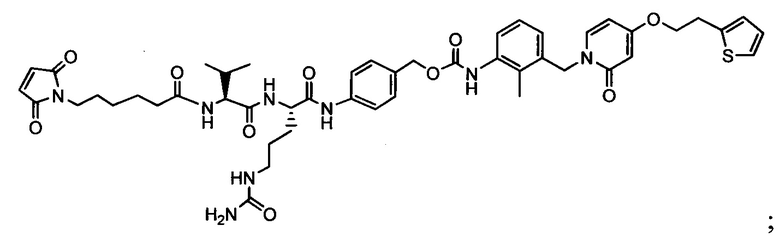
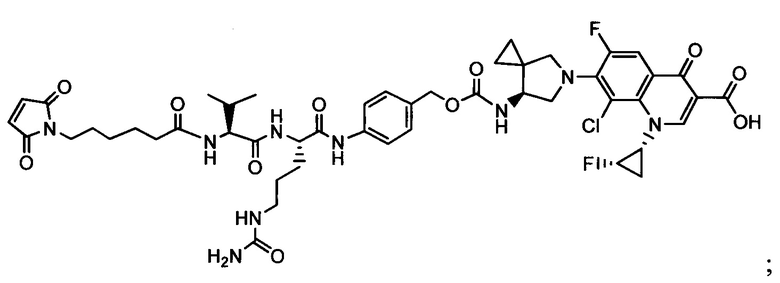
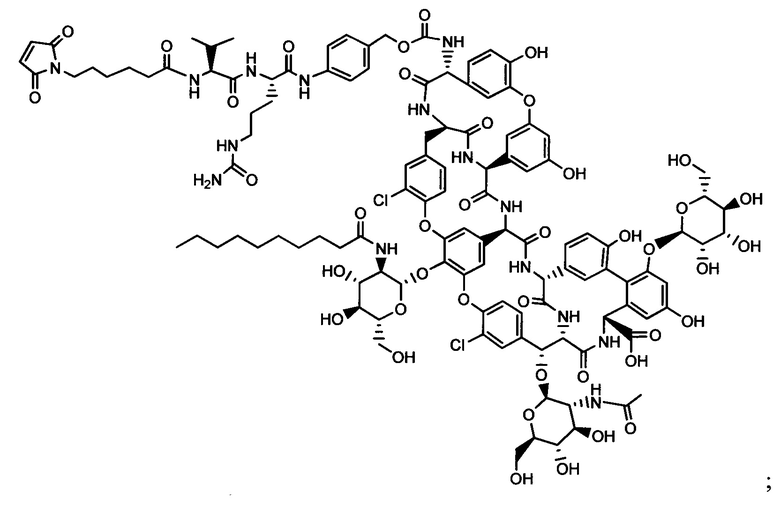
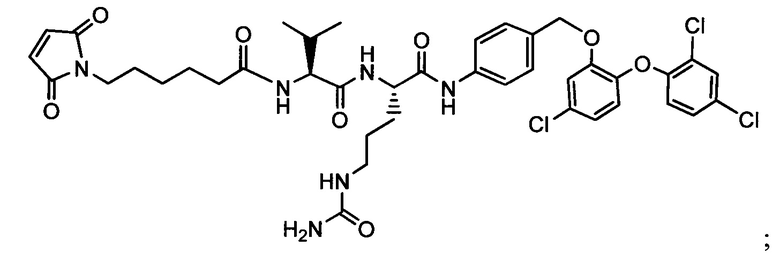
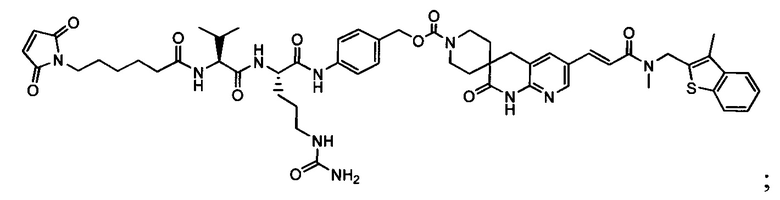
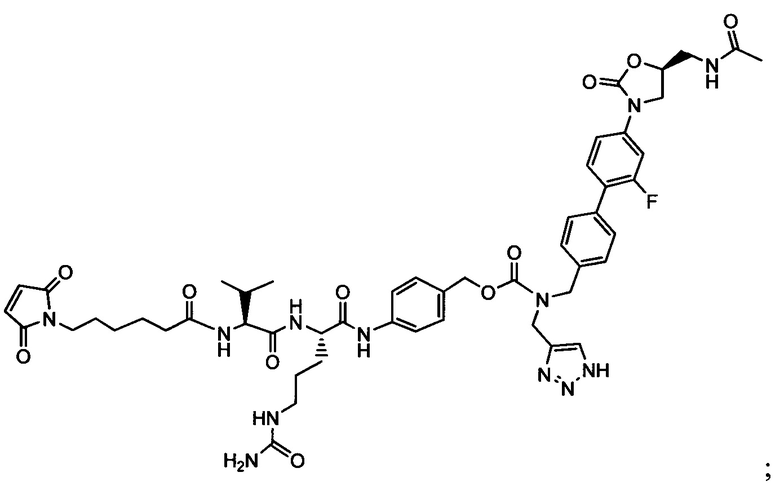
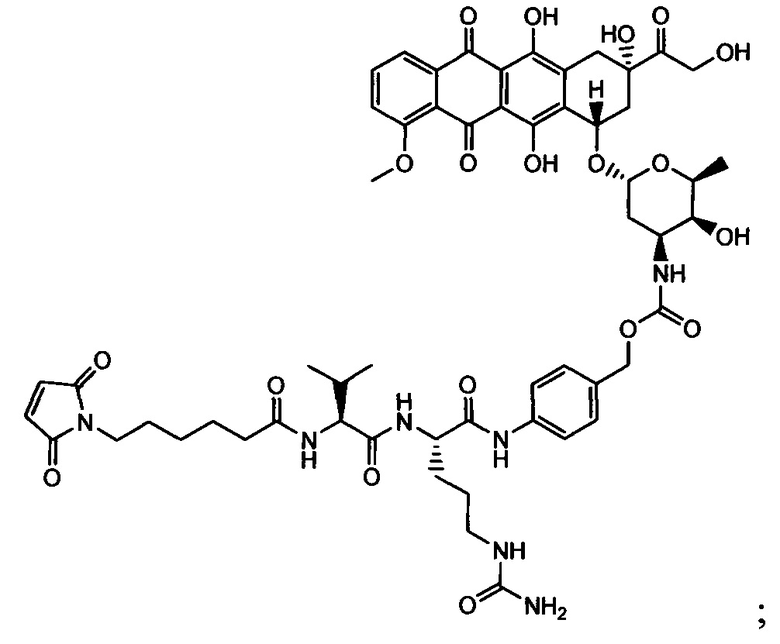
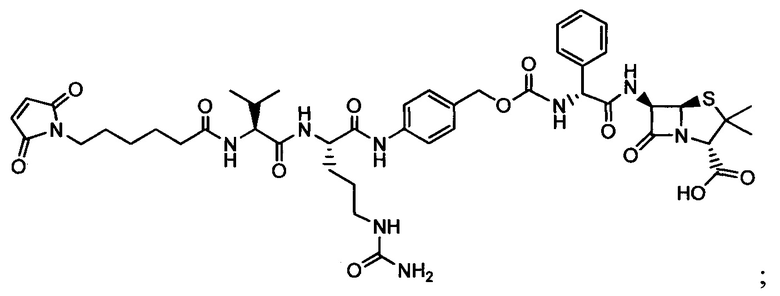
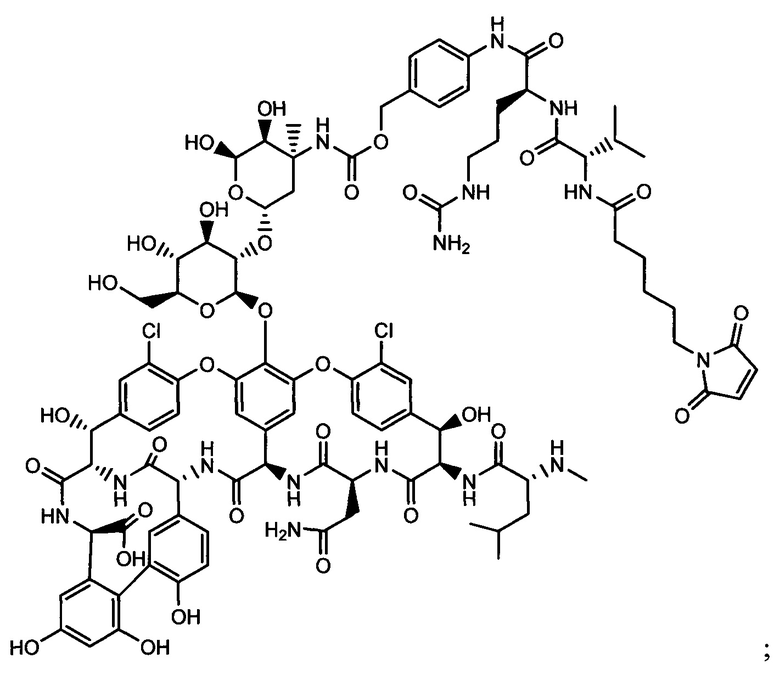
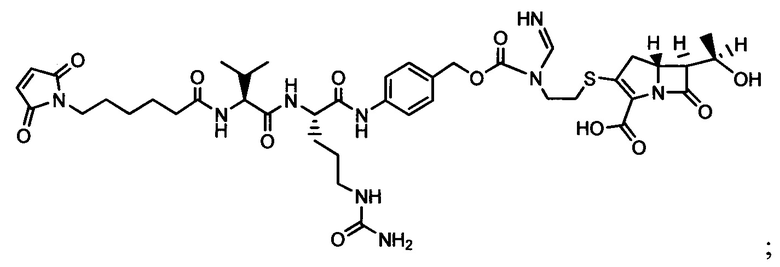
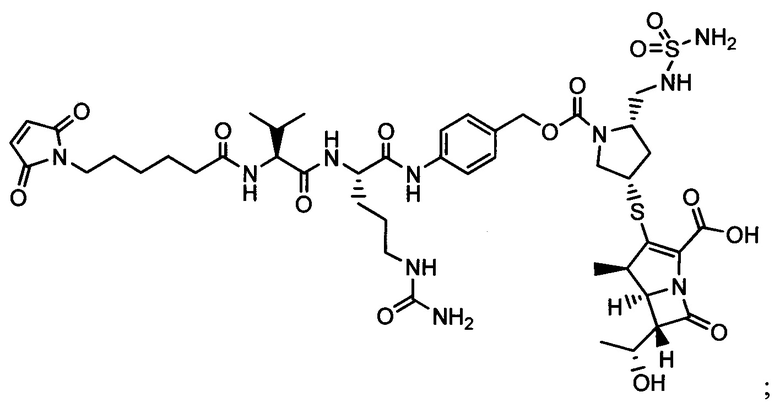
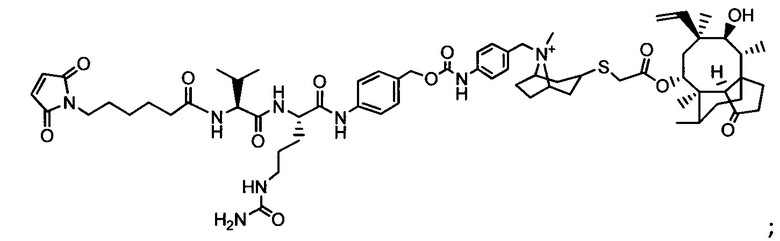
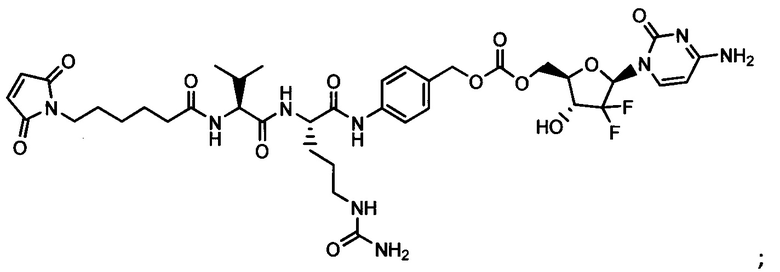
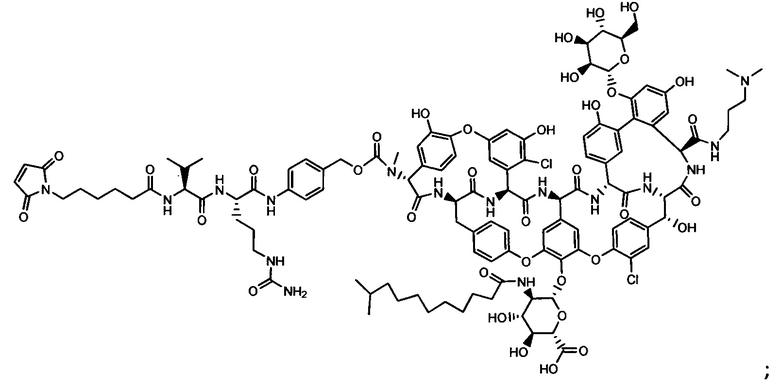
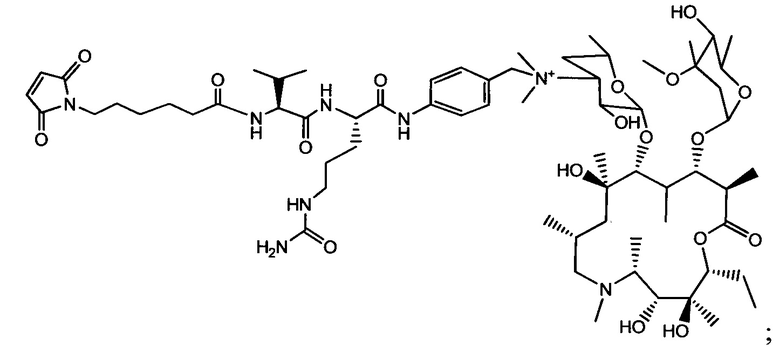
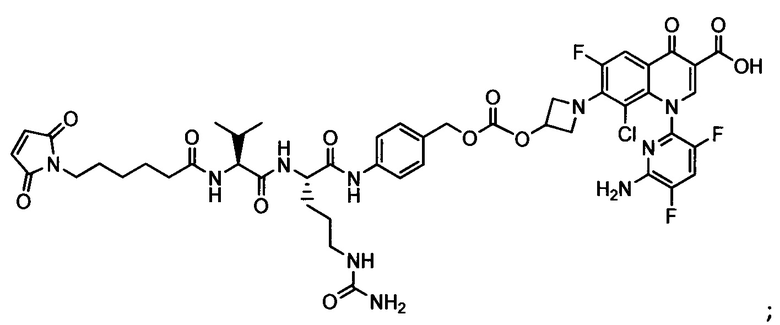
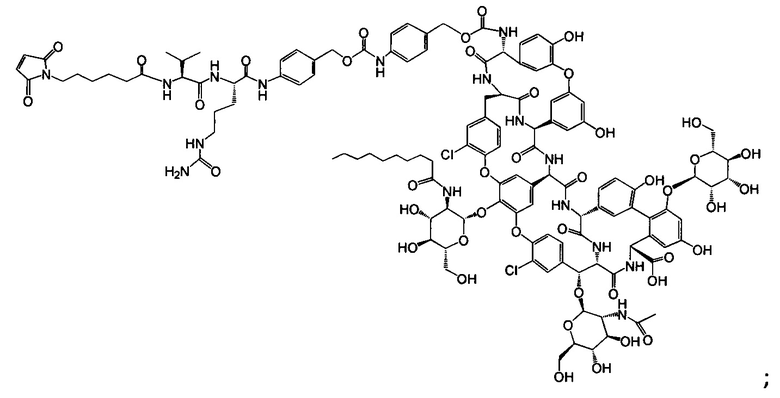
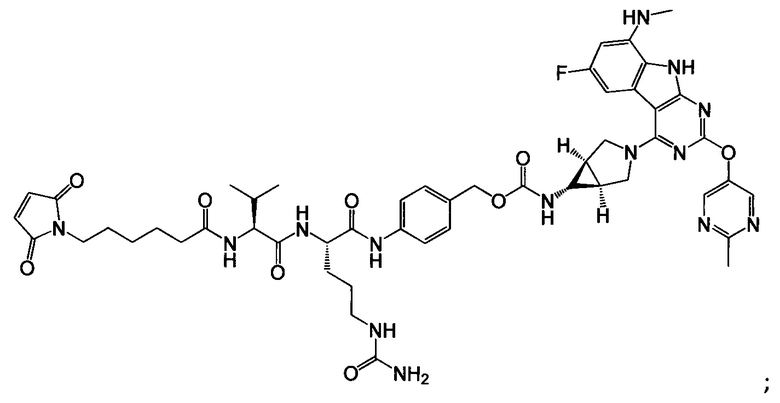
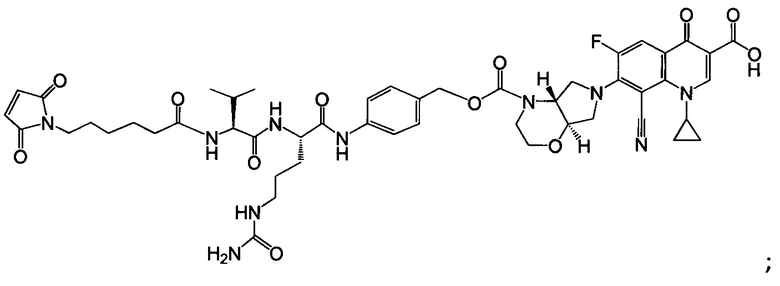
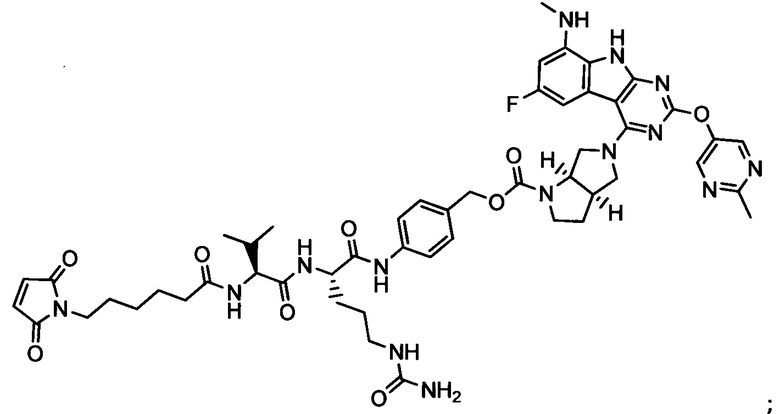
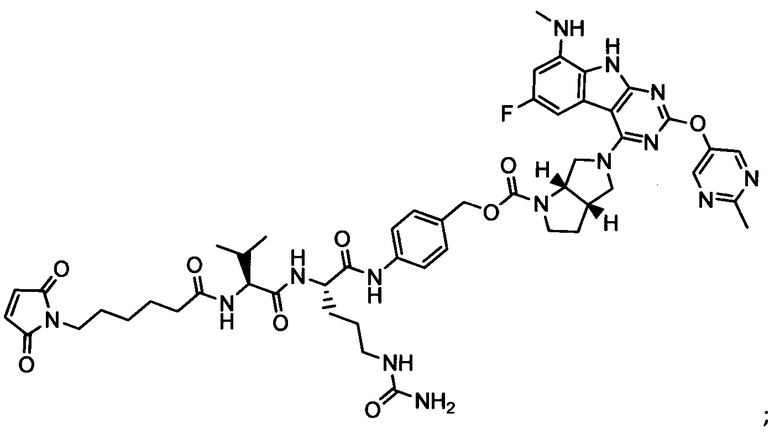
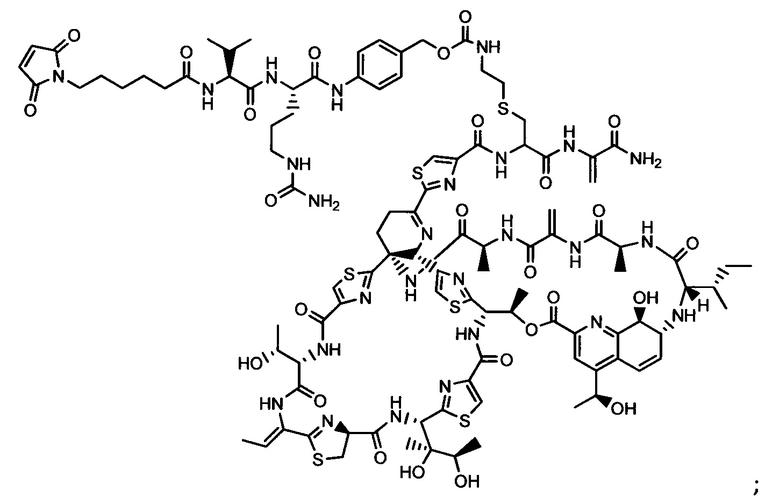
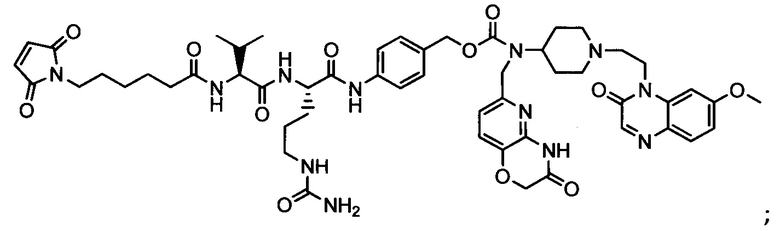
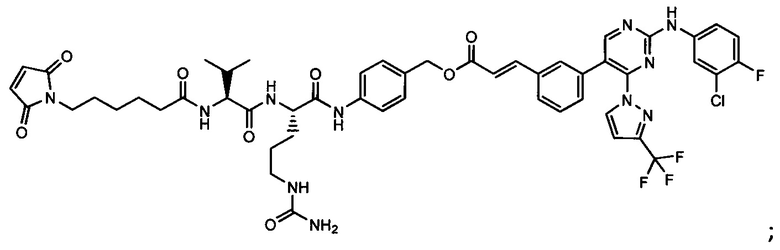
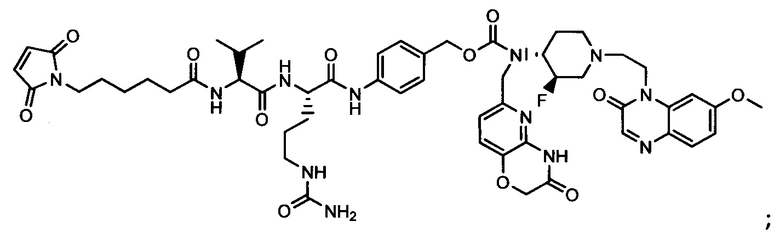
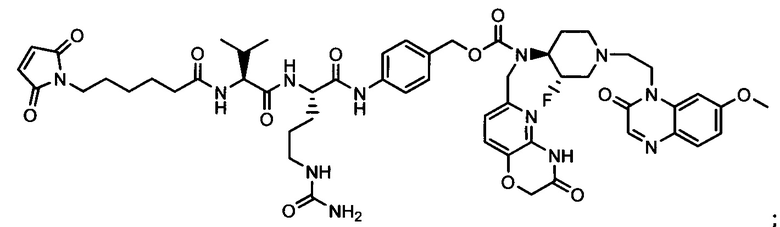
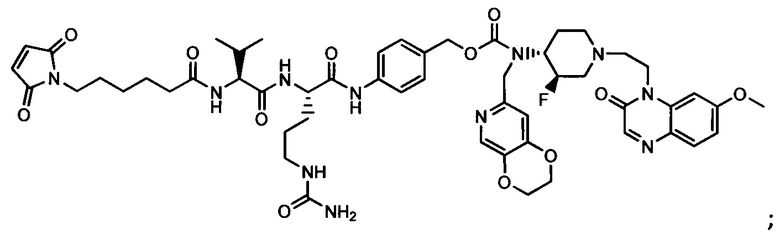
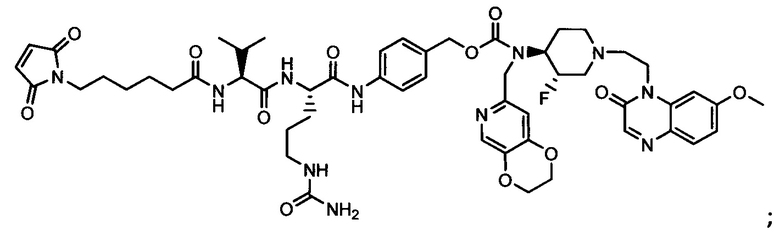
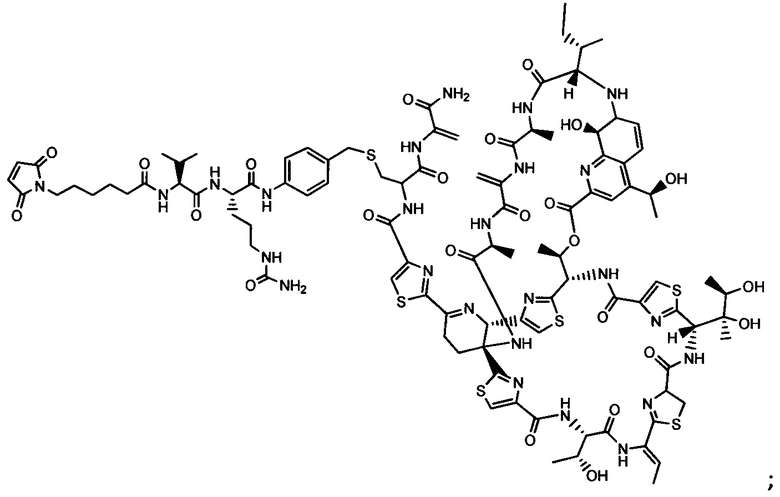
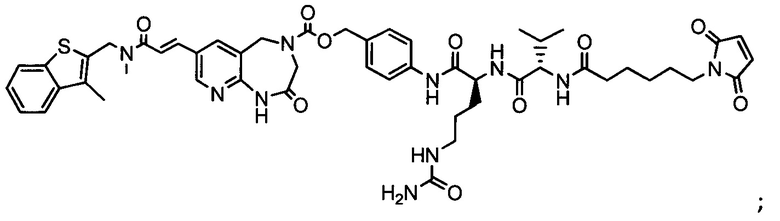
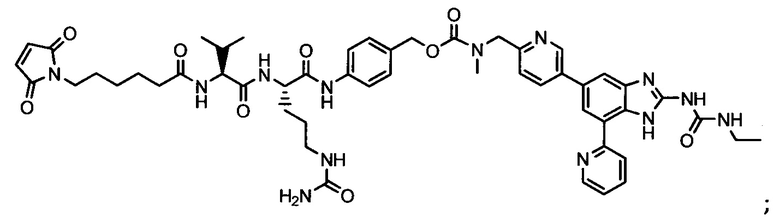
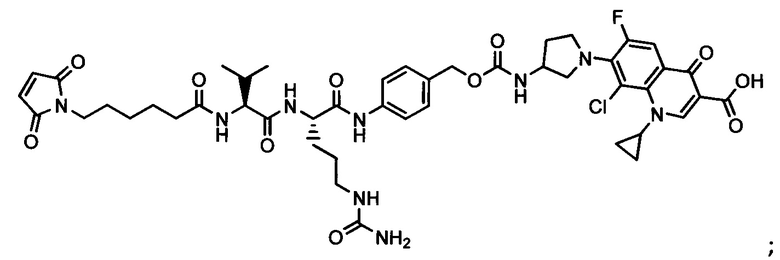
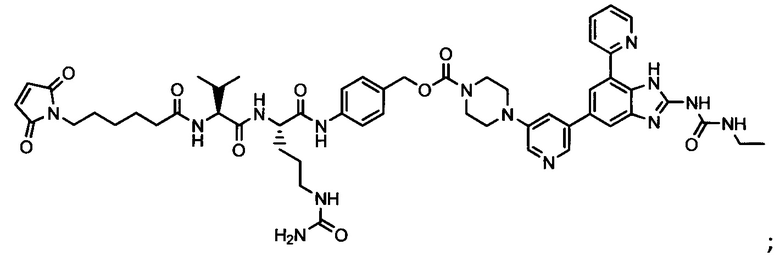
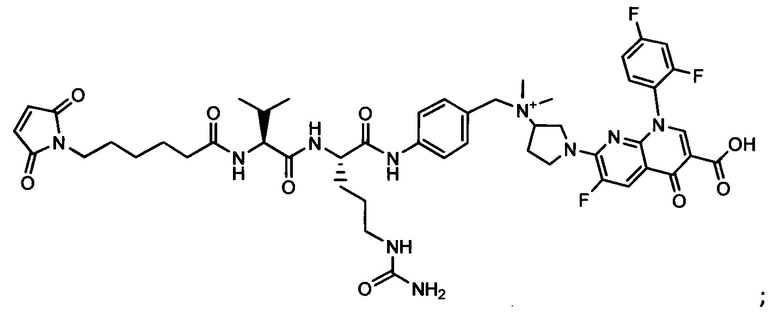
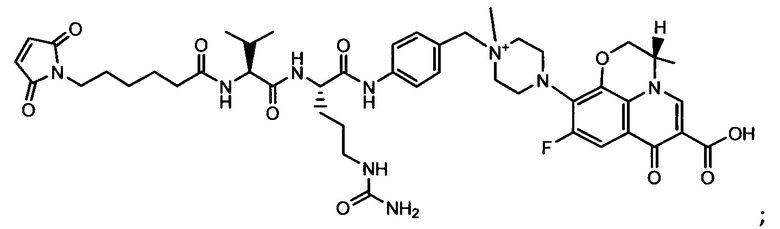
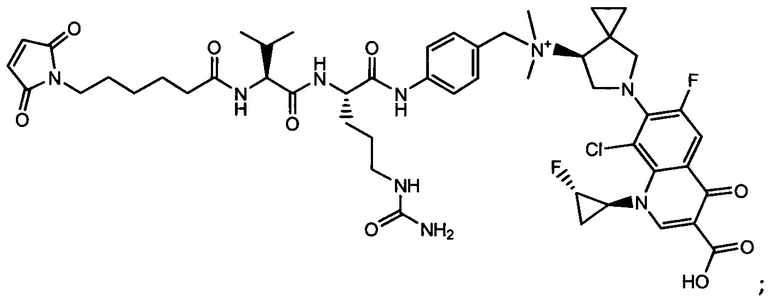
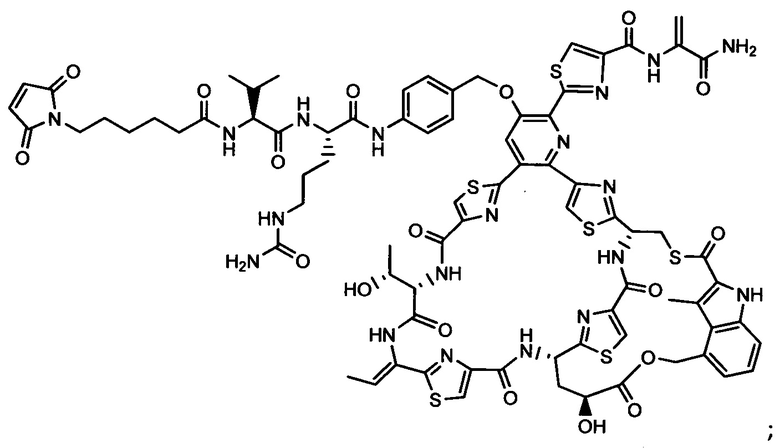
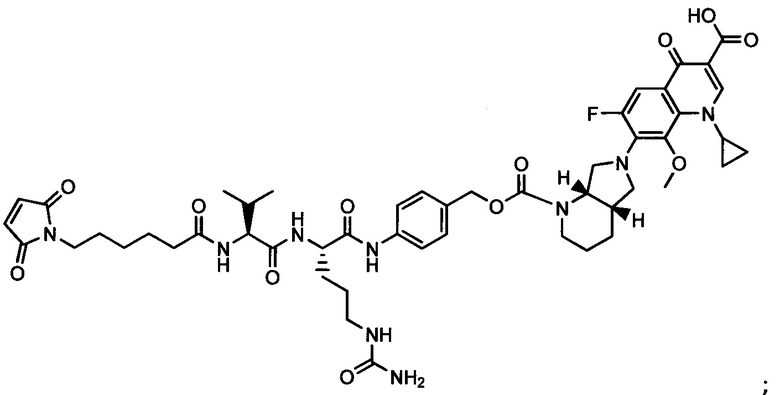
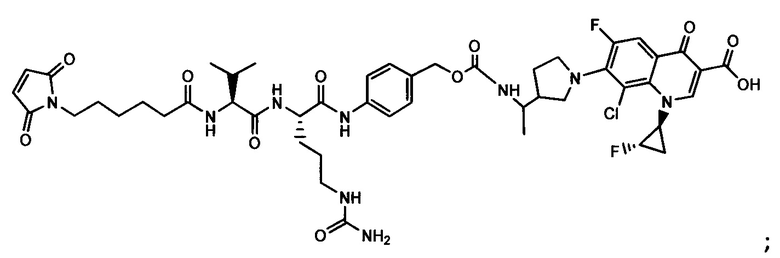
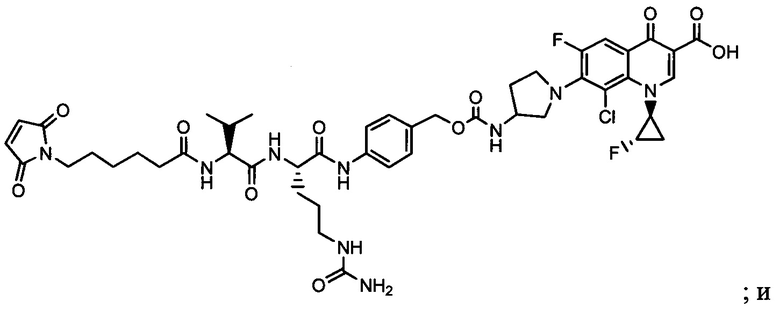
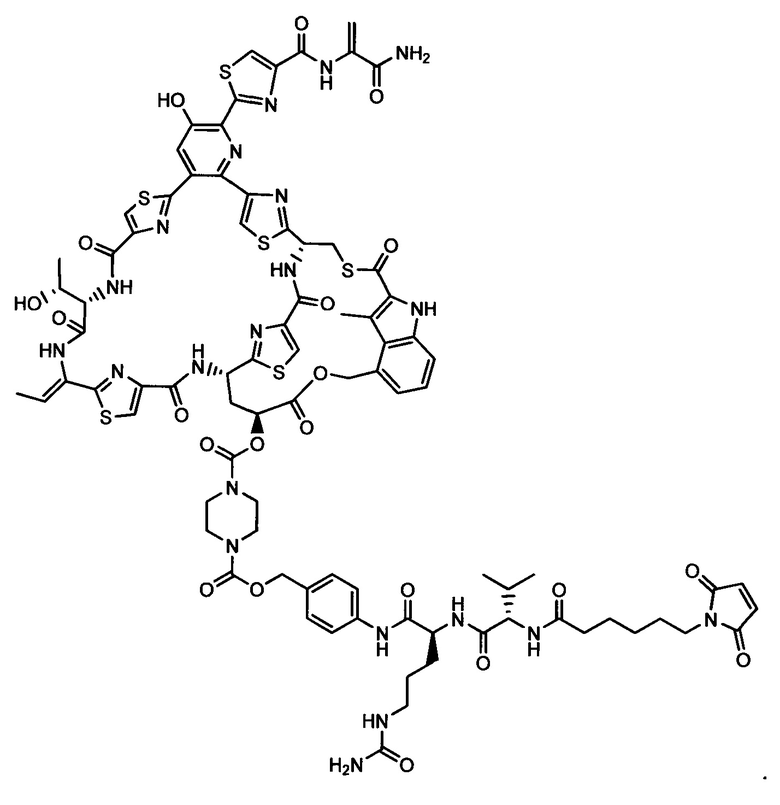
18. Конъюгат анти-WTA антитело-антибиотик по любому из пп. 1-13 для применения в способе лечения бактериальной инфекции Staphylococcus aureus посредством введения терапевтически эффективного количества конъюгата анти-WTA антитело-антибиотик.
19. Конъюгат анти-WTA антитело-антибиотик по любому из пп. 1-13 для применения в способе уничтожения внутриклеточных Staphylococcus aureus в клетках-хозяевах у пациента, инфицированного Staphylococcus aureus, без уничтожения клеток-хозяев.
20. Конъюгат анти-WTA антитело-антибиотик по п. 18 или 19, дополнительно включающий введение терапевтически эффективного количества второго терапевтического агента.
21. Конъюгат анти-WTA антитело-антибиотик по п. 20, где второй терапевтический агент представляет собой антибиотик.
22. Конъюгат анти-WTA антитело-антибиотик по п. 21, где антибиотик выбирается из структурных классов, состоящих из: (i) аминогликозидов; (ii) бета-лактамов; (iii) макролидов/циклических пептидов; (iv) тетрациклинов; (v) фторхинолинов/фторхинолонов; и (VI) оксазолидинонов.
23. Конъюгат анти-WTA антитело-антибиотик по п. 21, где антибиотик выбирается из группы, состоящей из антибиотика типа рифамицина, клиндамицина, новобиоцина, ретапамулина, даптомицина,  CG-400549, ситафлоксацина, тейкопланина, триклозана, нафтиридона, радезолида, доксорубицина, ампициллина, ванкомицина, имипенема, дорипенема, гемцитабина, далбаванцина и азитромицина.
CG-400549, ситафлоксацина, тейкопланина, триклозана, нафтиридона, радезолида, доксорубицина, ампициллина, ванкомицина, имипенема, дорипенема, гемцитабина, далбаванцина и азитромицина.
| WO2004050846 A2, 17.06.2004 | |||
| WO2011008092 A2, 20.01.2011 | |||
| WO2005081711 A2, 09.09.2005 | |||
| US6322788 B1, 27.11.2001 | |||
| Приспособление для коромысла в системе тормозной рычажной передачи электрических и воздушных тормозов | 1929 |
|
SU16717A1 |
Авторы
Даты
2019-05-06—Публикация
2014-05-22—Подача