ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Область изобретения
Данное изобретение относится к поддержанию или потенциированию эндогенных неврологических и нейропсихологических эффектов систем нейропептида Y головного мозга (NPY) введением ингибиторов дипептидилпептидазы IV (DP IV) и DP IV-подобных ферментов. Далее данное изобретение относится к лечению гипертензии, лихорадочного состояния, расстройства сна, анорексии, связанных с тревожностью нарушений, в том числе депрессии, припадков, в том числе эпилепсии, синдрома отмены лекарственного средства и алкоголизма, нейродегенеративных нарушений, в том числе нарушения когнитивной функции и деменции, и психоневрологических нарушений, в том числе шизофрении, через потенциирование опосредованных рецептором Y1 NPY эффектов в центральной нервной системе (ЦНС).
Предшествующий уровень
DP IV и NPY
DP IV (CD26; EC 3.4.14.5) является экзопептидазой с тройной функциональной ролью. DP IV участвует в высвобождении дипептидов Хаа-Pro из N-конца полипептидов, циркулирующих в кровотоке гормонов и хемокинов (Mentlein et al., 1999; Pauly et al., 1999), в Т-клеточнозависимых иммунных реакциях (Kahne et al., 1999; Korom et al., 1997) и в метастазировании (Chang et al., 1998; 2000). DP IV селективно расщепляет пептиды после предпоследних N-концевых остатков пролина и аланина. Эндогенные субстраты для этого фермента включают инкретины, такие как глюкозазависимые инсулинотропные полипептиды, такие как GIP и GLP-1. В присутствии DP IV эти гормоны ферментативно расщепляются в неактивные формы.
Обнаружение NPY
Нейропептид Y (NPY), пептид из 36 аминокислот, принадлежащий к семейству панкреатических полипептидов, был впервые выделен из головного мозга свиньи в 1982 году (Tatemoto and Mutt, 1982). NPY присутствует во всех симпатических нервах, иннервирующих сердечно-сосудистую систему, и является наиболее изобилующим пептидом в головном мозге и сердце. Кроме того, в крысах, но не в человеке, NPY был также найден вненейронно в тромбоцитах и эндотелии (Zukovska-Grojec et al., 1993). Первоначально NPY был известен как сильнодействующий вазоконстриктор и нейромодулятор. Предполагалось, что высвобождаемый стрессом, физической нагрузкой и ишемией миокарда NPY участвует в коронарной болезни сердца, застойной сердечной недостаточности и гипертензии (Zukovska-Grojec et al., 1998). Более недавно вследствие сильной способности NPY стимулировать потребление пищи было предположено, что он играет роль в ожирении и диабете (Kalra et al., 1999). Более поздние открытия показывают, что NPY является также митогеном для клеток гладких мышц сосудов, в частности аорты крыс (Zukovska-Grojec et al., 1999).
Исследование, связанное с NPY, сосредоточилось по меньшей мере на трех основных направлениях: (1) котрансмиссии и симпатической вазоконстрикции вследствие его коэкспрессии с норадреналином; (2) нейротрансмиссии и функционировании в ЦНС вследствие сильных окончательных эффектов; и (3) эволюции NPY, так как NPY является одним из наиболее высококонсервативных известных биоактивных пептидов (Colmers and Wahlestedt, 1993; Lundberg, 1996; Wahlestedt and Reis, 1993; Wettstein et al., 1996). NPY действует по меньшей мере на шести рецепторах (Y1-Y6) с варьирующейся фармакологией пептида и отличающимся распределением в ЦНС (Gehlert, 1998) (таблица 1).
Распределение NPY, подтипов рецепторов NPY и мРНК
Распределение самого NPY, рецепторного белка NPY и их мРНК в ЦНС головного мозга человека и крысы рассматривалось недавно в обзоре (Dumont Y, Jacues D, St-Pierre, J.-A. Tong, Y., Parker, R., Herzog H and Quirion, R., 2000; in Handbook of Chemical Neuroanatomy, Vol.16: Peptide Receptors, Part I; Quirion, R., Bjorklund, A. and Hokfeld, T., editors). Краткий обзор дается в таблице 1.
NPY-содержащие нейроны обнаруживаются в назальной слизистой оболочке различных видов, в том числе человека, часто ассоциированные с железистыми ацинусами и кровеносными сосудами (Baraniuk et al., 1990; Grunditz et al., 1994). Стимуляция парасиматической иннервации назальной слизистой оболочки (видиева нерва) у собак увеличивает кровоток в этом районе и вызывает главным образом устойчивость к атропину. Внутривенное введение NPY уменьшает вазодилатацию, обусловленную стимуляцией парасимпатического нерва, эффект, который не имитируется YI-селективным агонистом NPY [Leu31, Pro34]NPY, но заметно имитируется при введении агониста Y2-рецептора NPY N-ацетил[Leu28,Leu31JNPY(24-36) (Lacroix et al., 1994). Это согласуется с предсинаптическим опосредованным Y2-подобным рецептором NPY ингибированием высвобождения трансмиттера из терминалей парасимпатических нервов.
Функция рецептора NPY
NPY является, бесспорно, наиболее распространенным нейропептидом, обнаруженным до настоящего времени, с широким распределением в ЦНС и периферической нервной системе (PNS). NPY образует семейство пептидов вместе с пептидом YY (PYY) (приблизительно 70% гомология) и панкреатическим полипептидом (РР) (приблизительно 50% гомология); как NPY, так и PYY являются чрезвычайно биоактивными, тогда как РР обычно является гораздо менее активным (Gehlert, 1998; Wahlestedt and Reis, 1993) (таблица 2).
Два подтипа рецепторов NPY были названы Y1-рецептор нейропептида Y (постсинаптический) и Y2-рецептор нейропептида Y (пресинаптический) на основании различных реакций на укороченный аналог родственного пептида YY-(13-36) в сравнении с нейропептидом Y в системах анализа in vitro (Wahlestedt et al., 1986). Активация нейронных пресинаптических рецепторов NPY обычно ингибирует нервную активность, уменьшая высвобождение нейротрансмиттеров в ответ на нервные импульсы и в ответ на локальные факторы, влияющие на высвобождение нейротрансмиттеров (Wahlrstedt et al., 1986). Классификация пресинаптических рецепторов или рецепторов Y2 нейропептида Y основана на действиях пептида YY (13-36), но во многих системах эта молекула, а также нейропептид Y-(13-36) не проявляют прессорной (повышающей кровяное давление) активности (Rioux et al., 1986; Lundberg et al., 1988; Potter et al., 1989). Некоторыми это интерпретировалось как указание на то, что в некоторых сосудистых ложах имеются два типа рецепторов нейропептида Y (как Yj-рецептор нейропептида Y, так и Y2-рецептор нейропептида Y) на постсинаптических мембранах (Schwartz et al., 1989). Однако отсутствие селективности этих молекул может быть обусловлено сохранением частичной агонистической активности на рецепторах Yj, которая позволяет им индуцировать уменьшенную функциональную реакцию. Ранее был описан 13-36-аналог нейропептида Y, (Leu 17, Glu", Ala 21, Ala 22, Glu 23, LeU28, LeU31)-нейропептид Y-(13-36) (ANA нейропептид Y-(13-36)), который проявляет пресинаптическую активность, эквивалентную полноразмерной молекуле нейропептида Y, в исследованиях in vivo (Potter et al., 1989).
Кроме этих исторически хорошо определенных рецепторов нейропептида Y, предполагалось существование ряда других подтипов (Y3, Y4, Y5 и Y6) на фармакологической основе (Michel et al., 1998), и детали клонирования рецепторов, соответствующих Y1, Y2, Y4 и Y5, были опубликованы (Herzog et al., 1992; Gerald et al., 1995; Bard et al., 1995; Gerald et al., 1996) (таблица 1). Распределение и физиологическое значение этих различных подтипов рецепторов еще должны выясняться. Хотя существует некоторое противоречие в отношении селективности укороченных форм нейропептида Y для одного или другого подтипа рецепторов (Potter et al., 1989), возникающая картина подтверждает первоначальную классификацию на подтипы пре- и постсинаптических рецепторов. Были установлены клеточные линии, которые экспрессируют специфически один подтип рецептора нейропептида Y, и развитие рецептор-селективных аналогов нейропептида Y сосредоточилось в основном на характеристиках связывания в этих клеточных линиях (Sheikh et al., 1989; Aakerlund et al., 1990; Fuhlendorff et al., 1990). Недавно была клонирована кДНК, кодирующая рецептор Y1 нейропептида Y, и клеточные линии, экспрессирующие этот клонированный рецептор, анализировали как на специфическое связывание аналогов нейропептида Y (Herzog et al., 1992), так и на функциональные реакции, индуцируемые конкретными аналогами. Из таких исследований связывания, объединенных с последующими исследованиями in vivo, два аналога были классифицированы как действующие специфически на постсинаптическом рецепторе Y1 нейропептида Y. Эти селективные в отношении рецептора Y нейропептида Y аналоги, (Pro 34)-нейропептид Y и (Leu", Pro 34)-нейропептид Y, имитируют действие нейропептида Y в повышении кровяного давления, а также имеют такое же связывание с клеточными линиями, экспрессирующими только рецепторы Y нейропептида Y, например клеточной линией SK-N-MC нейробластомы человека и линиями фибробластов, экспрессирующими клонированный Y-рецептор нейропептида Y (Herzog et al., 1992). Ни один из них не проявляет действие Y2-рецептора нейропептида Y, ингибирование сердечного вагусного действия in vitro, манифестацию ингибирования высвобождения ацетилхолина (Potter et al., 1991; Potter and McCloskey, 1992).
Распределение и функция подтипов рецепторов NPY в ЦНС
Развитие высокоаффинных, непептидных антагонистов NPY, BIBP3226 и BIBO3304 облегчило функциональную характеристику рецепторов NPY, так как это соединение проявляет селективность в отношении Y1R, будучи лишенным активности по меньшей мере на рецепторах Y2R, Y3R и Y4R (Doods et al., 1996). Недавно были описаны два антагониста рецептора Y2. Один является TASP-молекулой (Grouzmann et al., 1997), другой - непептидным антагонистом (Wieland et al., 1999), и становятся известными другие непептидные соединения, специфические в отношении рецептора (Daniels et al., 1995). Таким образом, блокада специфического рецептора в головном мозге позволила бы функционально охарактеризовать поведенческие и физиологические эффекты, опосредуемые рецепторами NPY в центральной нервной системе. Кроме того, были получены мыши, лишенные Y1R, и они являются доступными (Pedrazzini et al., 1998). Нейроны, проявляющие NPY-подобную иммунореактивность и экспрессию рецептора NPY, являются обильными в ЦНС (таблица 1) и, возможно, в наибольшем количестве обнаруживаемыми в гипоталамусе и так называемых лимбических структурах, но они локализованы также совместно с моноаминергическими нейронами ствола мозга и GABA-ергическими нейронами коры головного мозга (Chronwall, 1985; Dumont et al., 1996).
Подтипы рецепторов и пептидная селективность
NPY, тревожность и депрессия
Анксиолитикподобные эффекты NPY были продемонстрированы с использованием теста приподнятого крестообразного лабиринта (Montgomery), теста наказуемого питья (Vogel) и теста наказуемой реакции (Geller-Seifter), причем сила и эффективность совпадали с силой и эффективностью бензодиазепинов (Griebel, 1999; Heilig et al., 1989; Wettstein et al., 1995). NPY действует подобно анксиолитику на реакцию на новые условия (Heilig and Murison, 1987; von Horsten et al., 1998b) и производит анксиолитикподобные эффекты в тесте с приподнятым крестообразным лабиринтом и в других связанных с тревожностью тестах (Wahlestedt and Reis, 1993; Wahlestedt et al., 1993). Интересно, что обработанные антисмысловым рецептором Y1 крысы обнаружили заметное связанное с тревожностью поведение без изменений опорно-двигательной активности и потребления корма (Wahlestedt et al., 1993). Кроме того, в штамме крыс - Flinder генетической модели депрессии - экспрессия мРНК рецептора Y1 уменьшалась в различных кортикальных районах и зубчатой извилине гиппокампа, тогда как экспрессия мРНК рецептора Y2 не отличалась от контролей (Caberlotto et al., 1998). Эктомия обонятельной луковицы в крысе была разработана в качестве модели депрессии (Leonard and Tuite, 1981). В этой модели большинство изменений являются сходными с изменениями, обнаруживаемыми в депрессивных пациентах (Song et al., 1996). 7-дневное i.c.v. введение NPY в крыс с эктомией обонятельной луковицы ослабляло поведенческие нарушения и недостаточность нейротрансмиттера в этой модели (Song et al., 1996). Рецепторы NPY Y1, Y2 и, возможно, Y5, по-видимому, участвуют в регуляции уровней тревожности в грызунах, причем Y1-опосредованные эффекты являются наилучшим образом охарактеризованными (Heilig et al., 1993; Kask et al., 1998b). Таким образом, можно сделать вывод, что эндогенный NPY противодействует стрессу и тревожности (Heilig et al., 1994). Кроме того, эти данные предполагают, что подтип рецепторов Y1 может участвовать в связанном с тревожностью и депрессией поведением. Кроме того, Kask et al. (1996) сообщали, что i.c.v. инъекция антагониста Y1, BIBP3226, давала эффекты, подобные эффектам анксиогеннных агентов, в тесте с приподнятым крестообразным лабиринтом, без какого-либо опорно-двигательного нарушения. Этот эффект может быть воспроизведен введением BIBP3226 в серое вещество около дорсального водопровода мозга (Сильвиева водопровода), но не в locus coeruleus (голубое место) или паравентрикулярное ядро гипоталамуса (Kask et al., 1998c). Кроме того, BIBP3226 и GR231118, введенные в серое вещество около дорсального водопровода мозга (Сильвиева водопровода), уменьшали время, проводимое для активного "социального взаимодействия" у крыс (Kask et al., 1998d). Участки головного мозга, которые являются важными для антистрессорного действия NPY, включают в себя, но не ограничиваются ими, миндалевидное тело (Sajdyk et al., 1999, Thorsell et al., 1999), голубое место (Kask et al., 1998c) и дорсальное серое вещество около водопровода головного мозга (Kask et al., 1998a, b). NPY миндалевидного тела не высвобождается в условиях низкого стресса, так как блокада Y1R NPY посредством BIBP3226 или BIBO3304 не увеличивала тревожность, как измерено в тесте приподнятого крестообразного лабиринта и "социального взаимодействия" (Kask et al., 1998b; Sajdyk, 1999). Однако, по-видимому, существует постоянный NPY-эргический тонус в дорсальном сером веществе около водопровода головного мозга, где антагонист Y1R NPY имел подобные анксиогенным эффекты в обеих экспериментальных моделях тревожности (Kask et al., a, b). Таким образом, в некоторых участках головного мозга может существовать регуляция тревожности посредством тонуса через системы NPY.
Неврологические и психофизиологические эффекты систем NPY ЦНС: плейотропия
Таким образом, многочисленные исследования были направлены на исследование физиологических функций NPY и его аналогов в ЦНС (в отношении обзоров см.: Kalra and Crowley, 1992; Dumont et al., 1992; Stanley, 1993; Wahlestedt and Reis, 1993; Grundemar et al., 1993; Gehlert, 1994, 1998; Colmers and Bleakman, 1994; Wettstein et al., 1995; Heilig and Widerlow, 1995; Munglani et al., 1996; Inui, 1999; Bischoff and Michel, 1999; Vezzani et al., 1999) и продемонстрировали широкий диапазон эффектов. В настоящее время не существуют фармакологические подходы к извлечению пользы из этих различных физиологических функций.
Существующие в настоящее время проблемы в лечении связанных с тревожностью нарушений с использованием бензодиазепинов или NPY
Существующие способы для лечения тревожности сопровождаются несколькими проблемами:
Бензодиазепины, которые обычно используют в качестве анксиолитических агентов, являются неприродными соединениями с низкой селективностью или без селективности. Наряду с их анксиолитической активностью, бензодиазепины проявляют седативные и антиэпилептические эффекты и, как предполагается, влияют на мышечную релаксацию. К сожалению, они связаны с рядом нежелательных побочных эффектов, а именно усталостью, сонливостью, отсутствием концентрации, снижением внимания и реактивности. Долгосрочное применение бензодиазепинов вызывает неврологические нарушения, такие как атаксия, головокружение, потерю рефлекса, мышечные нарушения и нарушения речи. Считается, что долгосрочное лечение бензодиазепинами влечет за собой зависимость и привыкание.
Прямое i.c.v. введение нейропептида Y в течение продолжительного лечения тревожности в пациентах является невозможным.
Присутствие DP IV-активности и DP IV-подобной активности в головном мозге млекопитающих
Hartel-Schenk et al., 1990, исследовали появление DP IV во время развития в органах крыс Wistar в дни 10, 16 и 21 беременности и в дни 1, 4, 8, 13, 21 и 60 после родов, сравнивая иммуногистохимию и гистохимию активности. Во всех исследованных тканях иммунореактивность с поликлональным антителом появлялась раньше, чем активность DP IV, и присутствовала уже в день 10 беременности в плазматических мембранах эмбриональных и экстраэмбриональных (децидуальных) клетках. В этих и других участках, например эндотелии капилляров мозга и эпителии трахеи или бронхов, иммунореактивность с поликлональным антителом уменьшалась или исчезала после родов и активность фермента никогда не развивалась. Иммунореактивность с моноклональными антителами появлялась позднее, чем иммунореактивность с поликлональным антителом, и большей частью в структурах, где была впоследствии обнаружена активность DP IV. Моноклональное антитело против эпитопа D обнаружило высокую реактивность в эпидидимальном протоке, почечных собирающих каналах и во всех доменах плазматической мембраны гепатоцитов, где не наблюдали ни активности, ни иммунореактивности DP IV с другими антителами. Их результаты предполагают также, что DP IV может присутствовать в виде молекулы до того, как он становится каталитически активным, и что иммунореактивность появляется в большем числе сайтов, чем активность DP IV. С использованием иммуногистохимических способов Bernstein et al., 1987, исследовали присутствие иммунореактивности дипептидиламинопептидазы IV в материале головного мозга, полученном из плодов человека, новорожденных и пожилых лиц. Было обнаружено, что белок фермента в изобилии присутствует в незрелой ЦНС человека. В противоположность этому головной мозг взрослого человека содержит гораздо меньшую иммунореактивность дипептидиламинопептидазы IV. Обсуждается, что этот фермент может играть важную роль в пролиферации и/или дифференцировке нейронов, в частности в отношении его возможного действия на определенные нейротрофические пептиды (IGF II, гормон роста). Аминопептидаза М (АРМ), аминопептидаза А (АРА), дипептидилпептидаза IV (DP IV) и гамма-глутамилтрансфераза (GGT) были продемонстрированы гистохимически в криостатных срезах головного мозга крысы, чтобы показать распределение реакции в эпендиме, хороидальном сплетении и мягкой и паутинной оболочке мозга (лептоменинксе). GGT обнаруживался только в клеточных мембранах эпендимных клеток и в мягкой и паутинной оболочке мозга; однако АРА, АРМ и DP IV обнаружили различную степень активности в эндотелии капилляров хороидального сплетения, а также в мягкой и паутинной оболочке головного мозга (Mitro & Lojda, 1988). Kato et al., 1979, обнаружили Х-пролилдипептидиламинопептидазную активность в головном мозге крыс и исследовали изменения, связанные с развитием в различном возрасте. Общая активность фермента в расчете на мозг увеличивалась до 4-недельного возраста и затем уменьшалась во время созревания. Удельная активность в мозге молодых крыс была более высокой, чем удельная активность в мозге взрослых крыс. Свойства этого фермента головного мозга отличались от свойств этого фермента из гипофиза и других тканей. Nassel et al., 2000, исследовали появление пролинспецифической DP IV-активности в тканях тараканов. Частично очищенную DP IV-активность характеризовали из головного мозга и средней кишки L. maderae с использованием Gly-Pro-4-нитроанилида в качестве субстрата. Наивысшую активность получали из фракции мембран кишечника; приблизительно в 10 раз меньшую активность (на миллиграмм белка) получали из мембран головного мозга. Сообщалось, что, хотя 55% общей активности постпролиндипептидиламинопептидазы в мозге морской свинки были связаны с растворимой фракцией этих клеток, остальная активность широко распределена по фракциям частиц. Однако значительная доля этой относящейся к частицам активности связана с фракцией синаптосомальных мембран (O'Connor & O'Cuinn, 1986). Гистохимическое исследование с использованием световой и электронной микроскопии выявило присутствие активности дипептидилпептидазы IV в тельцах Майсснера кожи безволосового макака. Активность этого фермента была обнаружена в фибробластподобных клетках, образующих неполную капсулу вокруг телец Майсснера. Отличающийся электроноплотный продукт реакции, обусловленный активностью дипептидилпептидазы IV, постоянно локализовался в плазматической мембране специализированных клетках Шванна (леммоцитах), окутывающих немиелинизированную часть сенсорных аксонов. Их аксолемма была лишена продукта реакции дипептидилпептидазы IV (Dubovy, 1988).
De Bault & Mitro, 1994, исследовали локализацию мембранных протеаз глутамиламинопептидазы (ЕАР), микросомной аланиламинопептидазы (mAAP), дипептидилпептидазы IV (DP IV) и гамма-глутамилтранспептидазы (гамма-GTP) в сосудах субфорникального органа (SFO), эпендимы, которая покрывает поверхность SFO, и смежных структур головного мозга. Результаты гистохимических реакций фермента показали сильную активность ЕАР, mAAP и гамма-GTP, но в противоположность вышеупомянутым открытиям отсутствие DP IV в микрососудах SFO. Эпендима, которая покрывает SFO, была положительной в отношении гамма-GTP, но отрицательной в отношении других исследованных протеаз. Результаты авторов данного изобретения показали, что спектр ферментов в большинстве сосудов SFO является сходным со спектром микрососудов смежной ткани мозга, которые были положительными в отношении ЕАР, mAAP и гамма-GTP, но отрицательными в отношении DP IV. С использованием антител против кДНК для DP IV Hong et al., 1989, оценили тканевое распределение DP IV с применением молекулярных подходов в крысе. Иммуноблот-анализ показал, что DP IV присутствует в почке, легком и тонкой кишке на высоких уровнях, в печени и селезенке на умеренных уровнях и в сердце на низких уровнях. Самые высокие уровни мРНК для DP IV были обнаружены в почке и тонкой кишке в сравнении с умеренными уровнями, обнаруженными в легком, печени и селезенке. Самые низкие уровни мРНК DP IV были найдены в желудке, яичке, сердце, мышце и головном мозгу.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Целью данного изобретения является обеспечение лекарственного средства, полезного для неврологических и психофизиологических эффектов. В частности, целью данного изобретения является обеспечение лекарственного средства, полезного для поведенческой и/или неврологической адаптивной реактивности на стресс, в том числе тревожности.
Кроме того, целью данного изобретения является преодоление или уменьшение вышеупомянутых проблем предшествующего уровня техники обеспечением фармакологического подхода, который приводит к постоянной или пролонгированной активности и/или эффекта NPY в головном мозге млекопитающих.
Эти цели достигнуты посредством применения ингибитора дипептидилпептидазы IV (DP IV или CD26) или DP IV-подобного фермента для получения лекарственного средства для модуляции поведенческой и/или неврологической реактивности на стресс, в том числе тревожности.
Это приводит к усилению эндогенных неврологических или нейропсихологических эффектов, опосредуемых рецепторами Y1 NPY, в том числе, но не только, уменьшению тревожности, лечению гипертензии, лихорадочного состояния, расстройства сна, анорексии, связанных с тревожностью нарушений, в том числе депрессии, припадков, в том числе эпилепсии, синдрома отмены лекарственного средства и алкоголизма, нейродегенеративных нарушений, в том числе шизофрении, диагностируемых у субъекта.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
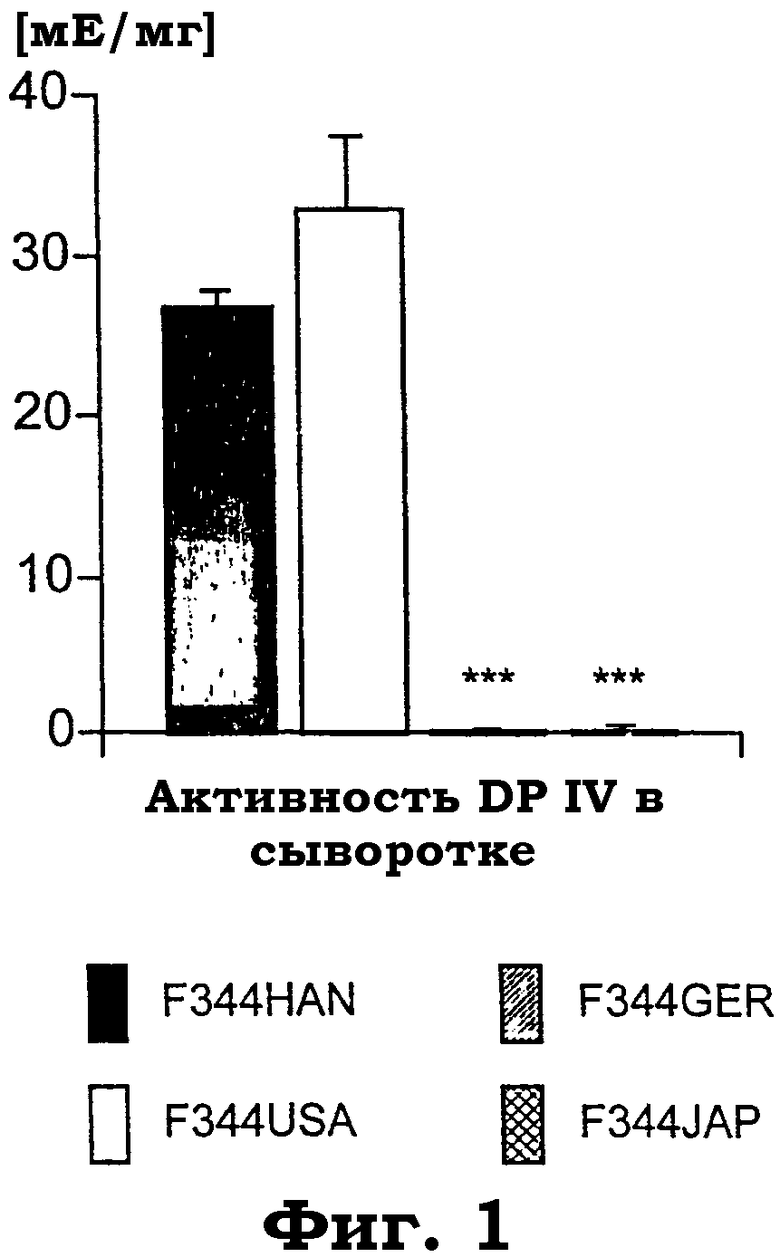
Фиг.1 показывает ферментативную активность DP IV в сыворотке субштаммов крыс Fischer 344 (F344) от животноводов из Ганновера (HAN), Соединенных Штатов (США), Германии (GER) и Японии (JAP). Результаты являются средними значениями (±SEM) (±стандартная ошибка среднего) 4-5 животных, сходных по возрасту, на генотип. Дисперсионный анализ выявил значимое действие "субштамма" с F(3, 15): 50,4, р<0,0001. Звездочки указывают значимые post hoc эффекты PLSD против субштаммов "дикого типа" F344USA и F344HAN ("***"=p<0,0001).
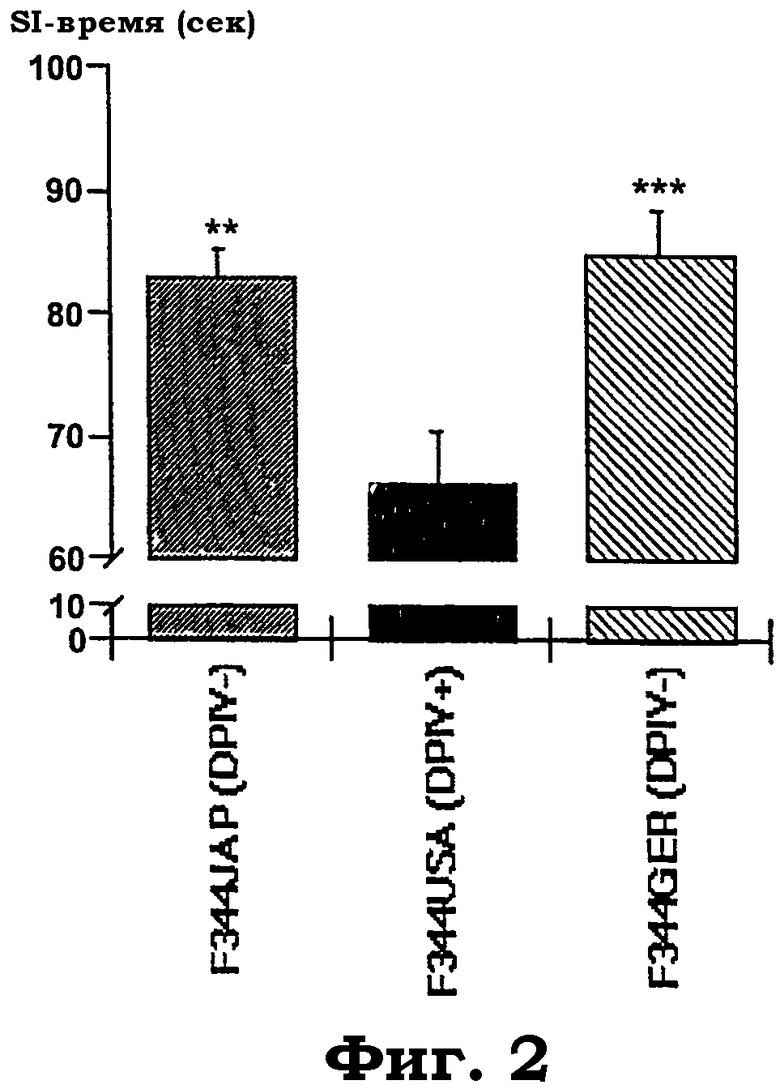
Фиг.2 показывает время, расходуемое во время активного "социального взаимодействия" (SI) в субштаммах крыс Fischer 344 (F344) от животноводов из Японии (JAP), Соединенных Штатов (USA) и Германии (GER). Увеличение времени SI в тесте "социального взаимодействия" крыс для определения тревожности интерпретируется как анксиолитикподобная реакция. Результаты являются средними значениями (±SEM) (±стандартная ошибка среднего) 12 животных, сходных по возрасту, на генотип. Дисперсионный анализ выявил значимое действие "субштамма" с F(2, 32): 8,8, р<0,0009. Звездочки указывают значимые post hoc эффекты PLSD против субштаммов крыс "дикого типа" F344USA ("**"=p<0,01; "***"=p<0,001).
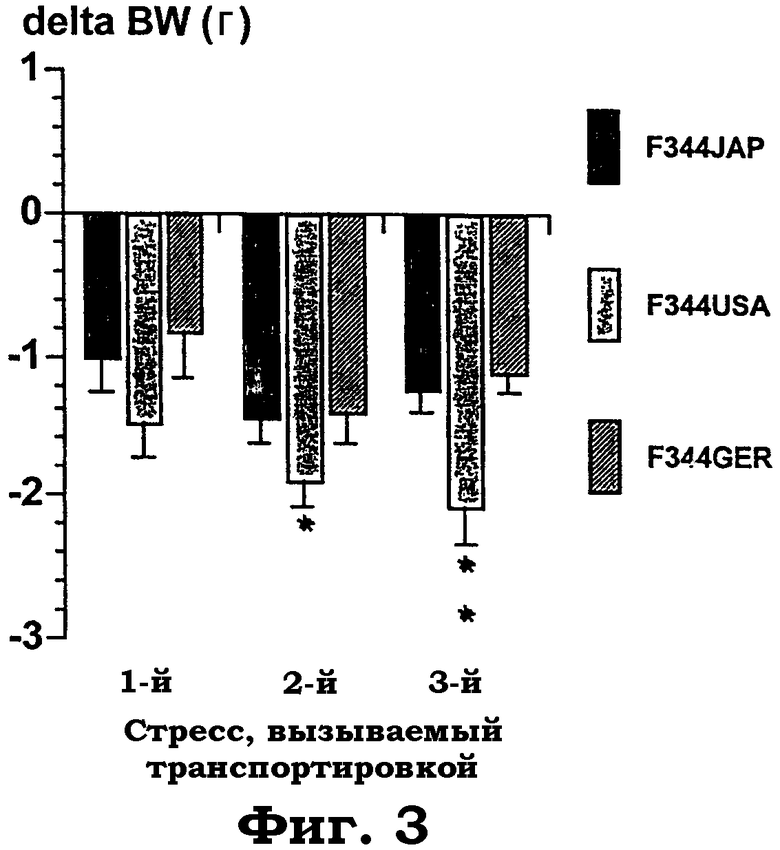
Фиг.3 показывает изменение веса тела после стресса в течение трех последующих дней. В течение трех последующих дней животных одного возраста от животноводов из Японии (JAP), Соединенных Штатов (USA) и Германии (GER) по отдельности транспортировали в новую камеру и оставляли в ней на 1 час. В первый день использовали новую клетку, содержащую опилки, и животных помещали в стандартный стеллаж для животных. На второй день процедура была такой же, за исключением того, что клетка была без опилок. Процедура стресса на третий день была той же самой, что и на второй день, за исключением того, что клетку помещали на нижнюю часть новой камеры. Дисперсионный анализ для повторяемых измерений выявил значимое действие "субштамма" с F(2, 30): 13,5, р<0,0004. Звездочки указывают значимые post hoc эффекты PLSD однофакторных ANOVA, разделенных на дни, против субштаммов крыс "дикого типа" F344USA ("*"=p<0,05; "**"=p<0,01).
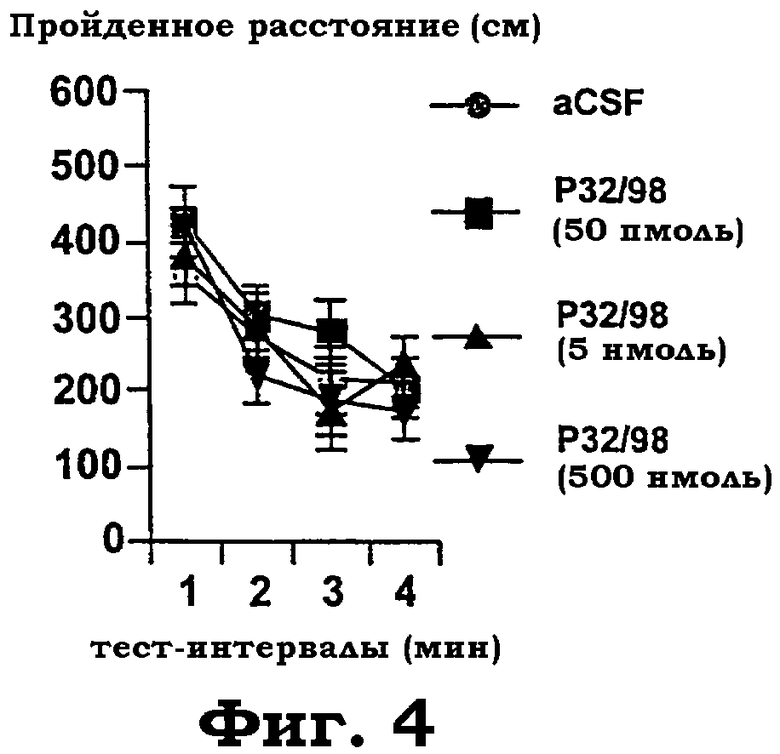
Фиг.4 показывает действие i.c.v. обработки изолейцилтиазолидином на расстояние, проходимое за четыре последующие минуты тестирования в "открытом поле". Дисперсионный анализ для повторяемых измерений не выявил значимого действия обработки на этот параметр активности F(3, 78): 0,7, р<0,5, нет значимого различия).
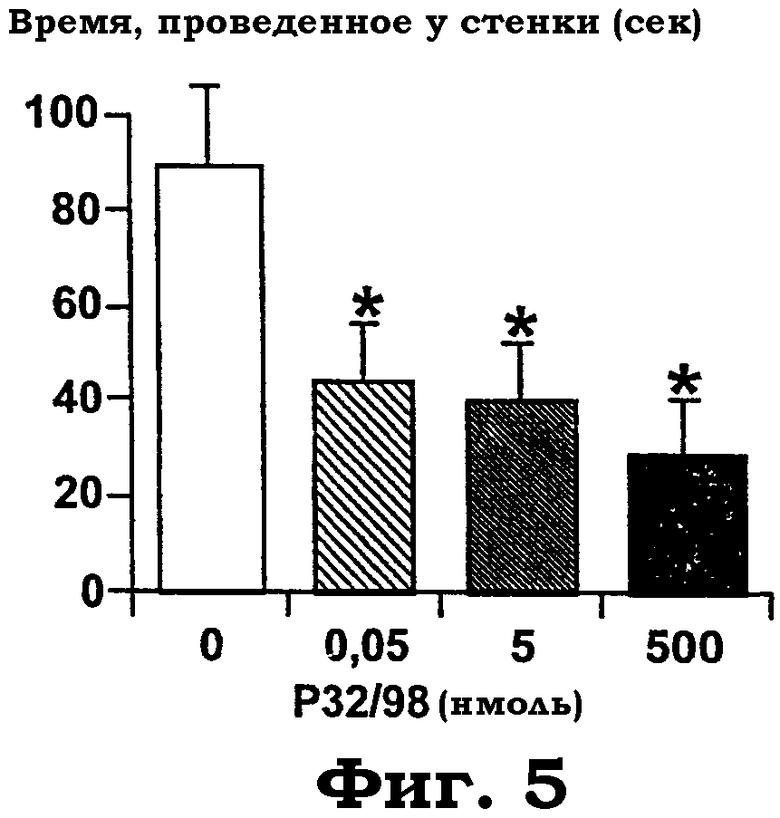
Фиг.5 показывает действие i.c.v. обработки изолейцилтиазолидином на время, проведенное около стенки, в виде суммы четырех последующих минут тестирования в "открытом поле". Дисперсионный анализ выявил значимое действие "обработки" c F(3, 26): 4,1, р=0,015. Звездочки показывают значимые post hoc эффекты PLSD против "aCFS"-контролей ("*"=p<0,05).
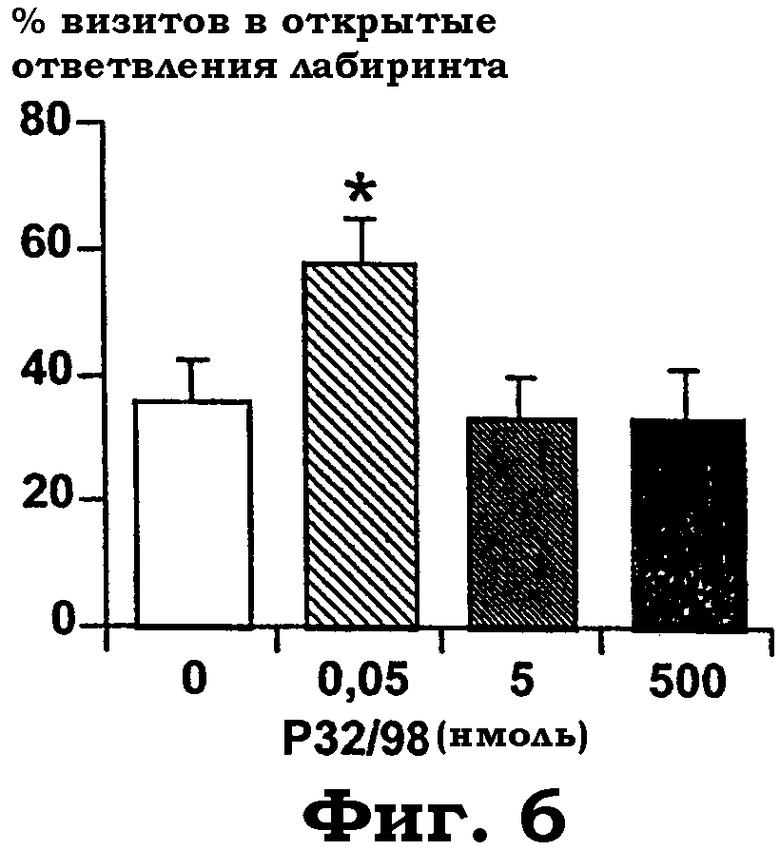
Фиг.6 показывает действие i.c.v. обработки изолейцилтиазолидином на процент времени, проведенного на открытых ответвлениях приподнятого крестообразного лабиринта (ЕРМ). Дисперсионный анализ выявил значимое действие "обработки" c F(3, 26): 3,0, р=0,048. Звездочки показывают значимые post hoc эффекты PLSD против "aCFS"-контролей ("*"=p<0,05).
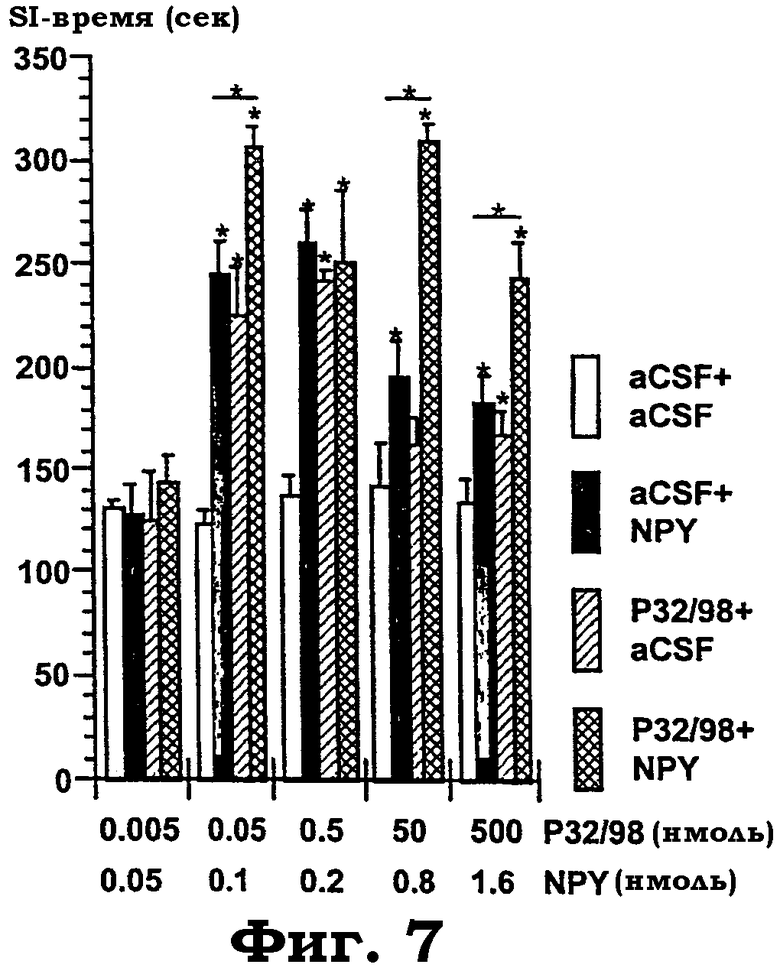
Фиг.7 показывает объединенную i.c.v. обработку aCSF, изолейцилтиазодином и NPY в комбинациях при различных дозах (изолейцилтиазолидин: 5 пмоль - 500 нмоль; NPY: 50 пмоль - 1,6 нмоль). Измеряли время, проведенное в активном "социальном взаимодействии" (SI-время) в анксиолитическом тесте "социального взаимодействия". Увеличение SI-времени является показателем анксиолитикподобного эффекта. После приучения к процедуре испытания животных несколько раз тестировали со случайным образом выбранной обработкой и всегда новыми партнерами взаимодействия. Тесты отделяли по меньшей мере 4-мя днями один от другого. Для каждого теста, охватывающего четыре группы из 5-6 животных на каждое условие, дисперсионный анализ выявил следующие значимые эффекты "обработки" (aCSF+aCSF; aCSF+NPY; изолейцилтиазолидин+aCSF; изолейцилтиазолидин+NPY) слева направо: изолейцилтиазолидин 5 пмоль+NPY 50 пмоль: F(3, 18): 0,25, p=0,8, н.з.; изолейцилтиазолидин 50 пмоль+NPY 100 пмоль: F(3, 18): 22,4, p<0,0001; изолейцилтиазолидин 500 пмоль+NPY 200 пмоль F(3, 20): 8,6, p<0,007; изолейцилтиазолидин 50 нмоль+NPY 0,8 нмоль: F(3, 20): 23,3, p<0,0001; и изолейцилтиазолидин 500 нмоль+NPY 1,6 нмоль: F(3, 20): 11,2, p<0,0008. Звездочки показывают значимые post hoc эффекты PLSD против "aCFS+aCSF"-контролей и, как показано столбиками, между aCSF+NPY против изолейцилтиазолидин+NPY ("*"=p<0,05).
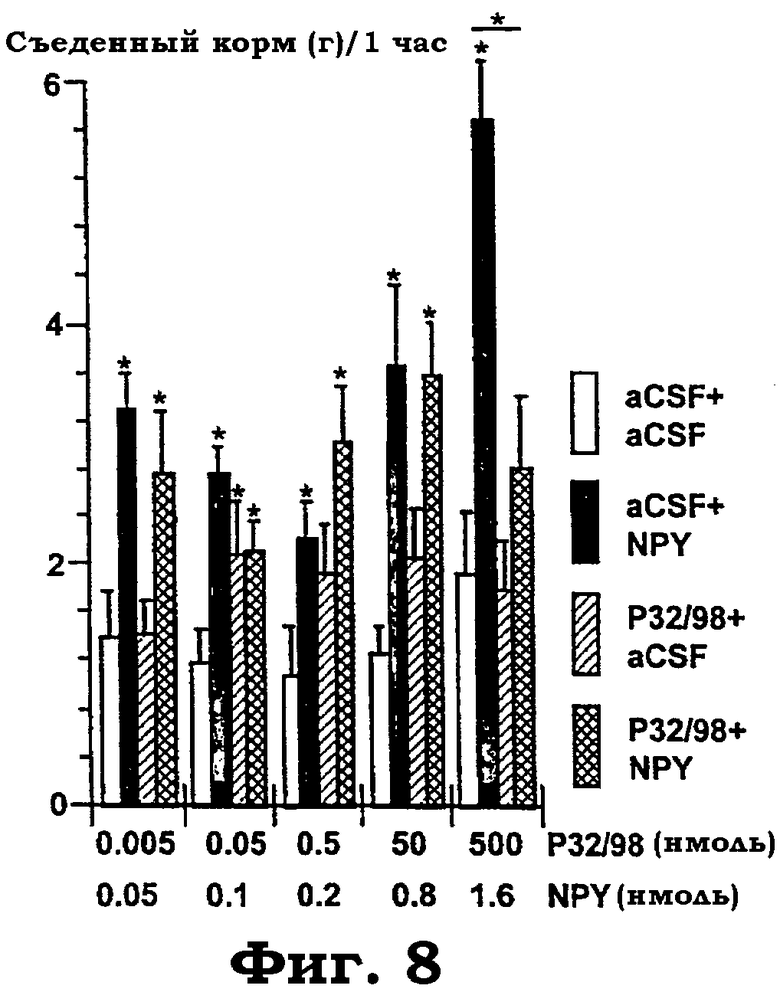
Фиг.8 показывает объединенную i.c.v. обработку aCSF, изолейцилтиазодином и NPY в комбинациях при различных дозах (изолейцилтиазолидин: 5 пмоль - 500 нмоль; NPY: 50 пмоль - 1,6 нмоль). Измеряли количество корма, съеденного в пределах 1 часа. Животных несколько раз тестировали со случайным образом выбранной обработкой. Тесты отделяли по меньшей мере 4-мя днями один от другого. Для каждого теста, охватывающего четыре группы из 5-6 животных на каждое условие, дисперсионный анализ выявил следующие значимые эффекты "обработки" (aCSF+aCSF; aCSF+NPY; изолейцилтиазолидин+aCSF; изолейцилтиазолидин+NPY) слева направо: изолейцилтиазолидин 5 пмоль+NPY 50 пмоль: F(3, 18): 7,0, p=0,0025; изолейцилтиазолидин 50 пмоль+NPY 100 пмоль: F(3, 20): 4,5, p<0,016; изолейцилтиазолидин 500 пмоль+NPY 200 пмоль F(3, 20): 4,4, p<0,015; изолейцилтиазолидин 50 нмоль+NPY 0,8 нмоль: F(3, 20): 6,6, p<0,0027; и изолейцилтиазолидин 500 нмоль+NPY 1,6 нмоль: F(3, 20): 13,7, p<0,0001. Звездочки показывают значимые post hoc эффекты PLSD против "aCFS+aCSF"-контролей и, как показано столбиками, между aCSF+NPY против изолейцилтиазолидин+NPY ("*"=p<0,05).
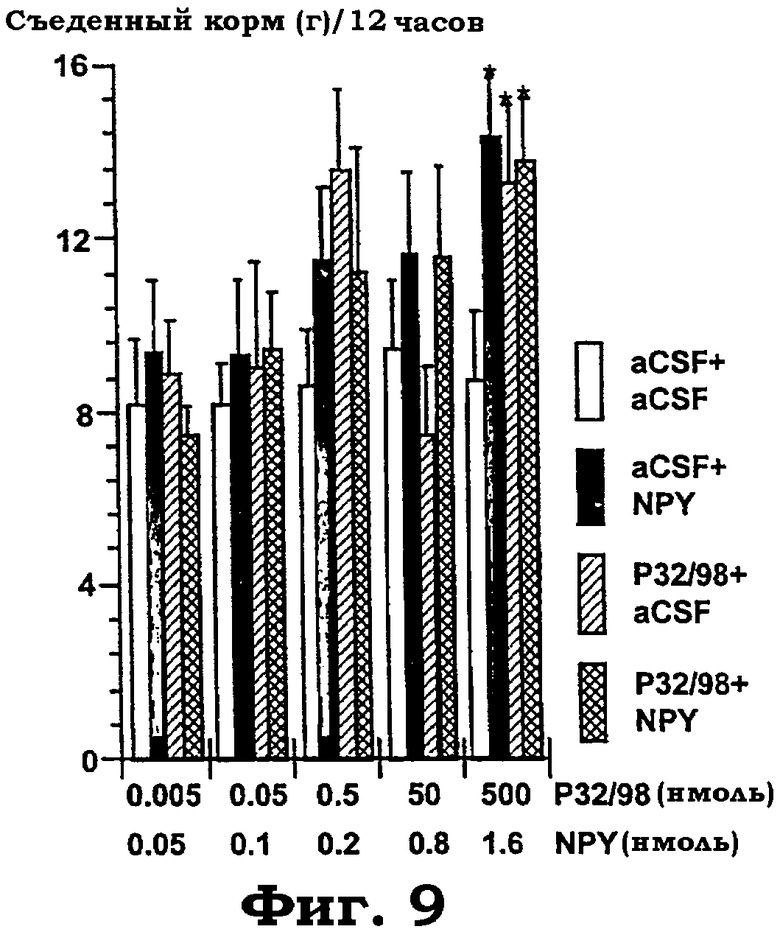
Фиг.9 показывает объединенную i.c.v. обработку aCSF, изолейцилтиазодином и NPY в комбинациях при различных дозах (изолейцилтиазолидин: 5 пмоль - 500 нмоль; NPY: 50 пмоль - 1,6 нмоль). Измеряли количество корма, съеденного в пределах 12 часов. Для каждого теста, охватывающего четыре группы из 5-6 животных на каждое условие, дисперсионный анализ выявил следующие значимые эффекты "обработки" (aCSF+aCSF; aCSF+NPY; изолейцилтиазолидин+aCSF; изолейцилтиазолидин+NPY) слева направо: изолейцилтиазолидин 5 пмоль+NPY 50 пмоль: F(3, 18): 0,5, p=0,7, н.з.; изолейцилтиазолидин 50 пмоль+NPY 100 пмоль: F(3, 20): 0,17, p<0,9, н.з.; изолейцилтиазолидин 500 пмоль+NPY 200 пмоль F(3, 20): 1,1, p<0,34, н.з.; изолейцилтиазолидин 50 нмоль+NPY 0,8 нмоль: F(3, 20): 1,2, p<0,3; и изолейцилтиазолидин 500 нмоль+NPY 1,6 нмоль: F(3, 20): 3,4, p<0,039. Звездочки показывают значимые post hoc эффекты PLSD против "aCFS+aCSF"-контролей и, как показано столбиками, между aCSF+NPY против изолейцилтиазолидин+NPY ("*"=p<0,05).
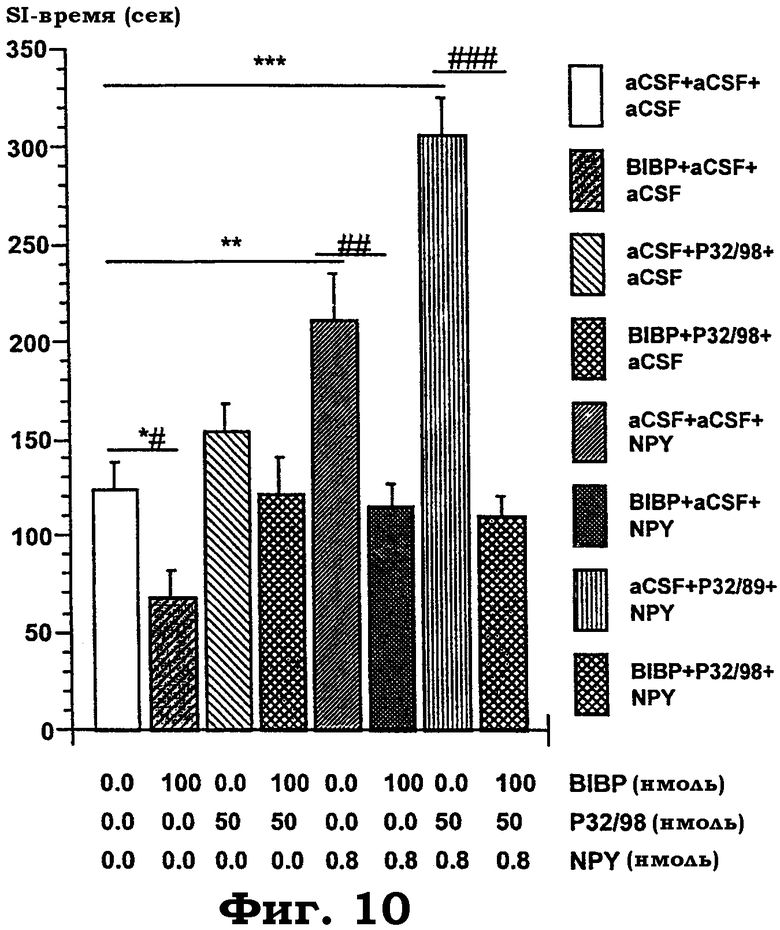
Фиг.10 показывает объединенную i.c.v. обработку с использованием антагониста Y1R BIBP3226, изолейцилтиазодина и NPY в комбинациях (BIBP3226: 100 нмоль; изолейцилтиазолидин: 50 нмоль; NPY: 0,8 нмоль). Измеряли время, проведенное в активном "социальном взаимодействии" (SI-время) в анксиолитическом тесте "социального взаимодействия". Увеличение SI-времени является показателем анксиолитикподобного эффекта. После приучения к процедуре испытания животных случайным образом относили к протоколам i.c.v. обработки и к партнерам взаимодействия, получавшим ту же самую обработку. Тесты охватывали две последовательные повторности с 6-8 животными в целом на каждое условие обработки. Дисперсионный анализ выявил значимое действие "обработки" с F(7, 44): 33,6, p<0,0001 для следующих групп: (1) aCSF+aCSF+aCSF; (2) BIBP+aCSF+aCSF; (3) aCSF+изолейцилтиазолидин+aCSF; (4) BIBP+изолейцилтиазолидин+aCSF; (5) aCSF+aCSF+NPY; (6) BIBP+aCSF+NPY; (7) aCSF+Р32/89+NPY; (8) BIBP+изолейцилтиазолидин+NPY. Уровень значимости в post hoc сравнениях против контролей (aCSF+aCSF+aCSF) показан звездочками с "*"=p<0,05; "**"=p<0,01; "***"=p<0,001) и против соответствующей обработки антагонистом (BIBP+n.n.) символами "#" c "#"=p<0,05; "##"=p<0,01; "###"=p<0,001). Все данные представлены в виде среднего значения±стандартная ошибка среднего (±SEM).
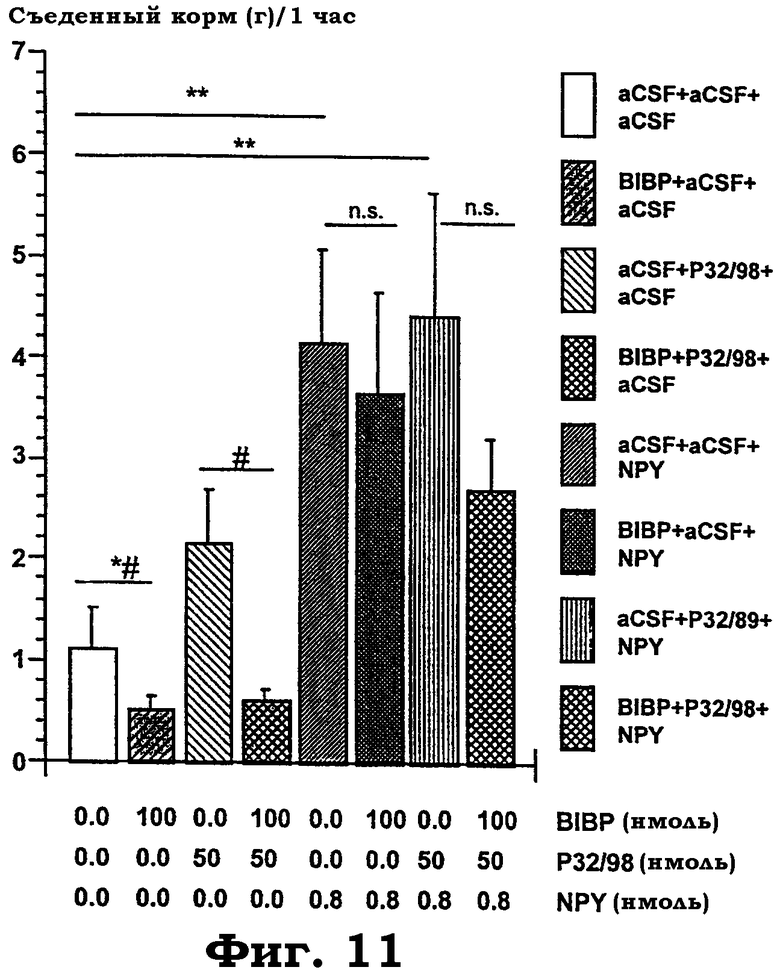
Фиг.11 показывает действие комбинированной i.c.v. обработки на 1-часовое потребление корма с использованием антагониста Y1R BIBP3226, изолейцилтиазодина и NPY в комбинациях (BIBP3226: 100 нмоль; изолейцилтиазолидин: 50 нмоль; NPY: 0,8 нмоль). После приучения к процедуре испытания животных случайным образом относили к протоколам i.c.v. обработки и к партнерам взаимодействия, получавшим ту же самую обработку. Тесты охватывали две последовательные повторности с 6-8 животными в целом на каждое условие обработки. Дисперсионный анализ выявил значимое действие "обработки" с F(7, 44): 5,4, p<0,0002 для следующих групп: (1) aCSF+aCSF+aCSF; (2) BIBP+aCSF+aCSF; (3) aCSF+изолейцилтиазолидин+aCSF; (4) BIBP+изолейцилтиазолидин+aCSF; (5) aCSF+aCSF+NPY; (6) BIBP+aCSF+NPY; (7) aCSF+Р32/89+NPY; (8) BIBP+изолейцилтиазолидин+NPY. Уровень значимости в post hoc сравнениях против контролей (aCSF+aCSF+aCSF) показан звездочками с "*"=p<0,05; "**"=p<0,01; "***"=p<0,001) и против соответствующей обработки антагонистом (BIBP+n.n.) символами "#" c "#"=p<0,05; "##"=p<0,01; "###"=p<0,001). Все данные представлены в виде среднего значения±стандартная ошибка среднего (±SEM).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В противоположность другим предлагаемым способам в данной области данное изобретение обеспечивает приемлемую для перорального введения терапию с низкомолекулярными ингибиторами дипептидилпептидазы IV или DP IV-подобными ферментами. Данное изобретение представляет новый подход для лечения тревожности и других неврологических или психологических нарушений у млекопитающих. Этот подход является благоприятным для пользователя, коммерчески применимым и пригодным для применения в терапевтической программе лечения, в частности, касающейся заболевания человека.
Примерами приемлемых для перорального введения низкомолекулярных ингибиторов дипептидилпептидазы IV являются такие агенты, как N-(N'-замещенный глицил)-2-цианопирролидины, L-треоизолейцилтиазолидин, L-аллоизолейцилтиазолидин, L-треоизолейцилпирролидин, L-аллоизолейцилтиазолидин и L-аллоизолейцилпирролидин. Они описаны в US 6001155, WO 99/61431, WO 99/67278, WO 99/67279, DE 19834591, WO 97/40832, DE 19616486 С2, WO 98/19998, WO 00/07617, WO 99/38501 и WO 99/46272, описания которых включены здесь в качестве ссылки в их полном виде. Задачей этих агентов является ингибирование DP IV и посредством этого снижение уровней глюкозы в крови для эффективного лечения гипергликемии и сопутствующего заболевания, связанного с повышенными уровнями глюкозы в крови.
DP IV является ферментом, который представляет собой экзопептидазу, которая селективно расщепляет пептиды после предпоследних N-концевых остатков пролина и аланина. Эндогенные субстраты для этого фермента включают в себя инкретины, такие как глюкозазависимые инсулинотропные полипептиды, подобные GIP и GLP-1. В присутствии DP IV эти гормоны ферментативно восстанавливаются в неактивные формы. Неактивная форма GIP и GLP-1 не могут индуцировать секрецию инсулина, таким образом уровни глюкозы крови повышаются, особенно в гипергликемическом состоянии. Повышенные уровни глюкозы крови были ассоциированы со многими различными патологиями, в том числе сахарным диабетом (Типа 1 и 2) и осложениями, сопровождающими сахарный диабет. DP IV-подобные ферменты могут быть, например, отобраны подверганием пептидаз тесту на селективность расщепления пептидов после предпоследних N-концевых остатков пролина и аланина, с отбором пептидазы, которая выполняет такое расщепление, и выделением этой пептидазы.
Было также обнаружено, что DP IV играет роль в опосредованных Т-клетками иммунных реакциях, например, при трансплантации органов. Было показано, что ингибирование DP IV пролонгирует сердечные аллотрансплантаты. Кроме того, ингибирование DP IV способствует супрессии ревматоидного артрита. DP IV приписывали также роль в проникновении ВИЧ в Т-клетки (Т-клетки-хелперы).
Эти различные эффекты ингибиторов дипептидилпептидазы IV подразумевают их воздействие на нормальные здоровые ткани и органы при их применении для лечения патологически измененной ткани. Задачей данного изобретения является развитие нацеленных на головной мозг агентов, которые поддерживают, увеличивают или пролонгируют эффект или активность NPY и которые проявляют высокую биодоступность и точно предсказуемое время активности в ткани-мишени.
Примерами мишеньспецифических, пригодных для перорального введения низкомолекулярных агентов являются пролекарства стабильных и нестабильных ингибиторов дипептидилпептидазы IV, которые имеют общую формулу А-В-С, где А представляет аминокислоту, В представляет химическую связь между А и С или аминокислоту и С представляет нестабильный или стабильный ингибитор дипептидилпептидазы IV соответственно. Они описаны в WO 99/67278, WO 99/67279, описания которых включены здесь в качестве ссылки в их полном виде.
Данное изобретение относится к новому способу, в котором введение ингибитора фермента дипептидилпептидазы (DP IV или CD26) или DP IV-подобной ферментативной активности в головном мозге млекопитающх приводит к причинному следствию уменьшенной деградации нейропептида Y (NPY). Такая обработка будет приводить к уменьшению или задержке уменьшения концентрации функционально активного NPY (1-36).
В соответствии с данным изобретением было обнаружено, что эффект и/или активность NPY в головном мозге млекопитающих, в частности людей, может поддерживаться или пролонгироваться введением ингибиторов дипептидилпептидазы IV (DP IV) или DP IV-подобного фермента. Посредством этого деградация NPY в головном мозге может быть уменьшена. Это приводит к ослаблению или улучшению психосоматических, депрессивных и/или психоневрологических заболеваний. Данное изобретение представляет, в частности, новый подход для лечения тревожности и других неврологических или психологических нарушений. Этот подход является благоприятным для пользователя, коммерчески применимым и пригодным для применения в терапевтической программе лечения, в частности, касающейся заболевания человека.
Открытие, что введение ингибиторов DP IV или DP IV-подобных ферментов может предупреждать или замедлять деградацию NPY в головном мозге, является особенно удивительным по следующим причинам: Hong et al., 1989, оценивали распределение по тканям DP IV в тканях крыс с использованием антител против кДНК для DP IV. Иммуноблот-анализ показал, что DP IV присутствует в почке, легком и тонкой кишке при высоких уровнях, в печени и селезенке при умеренных уровнях и в сердце при низких уровнях. Наивысшие уровни мРНК для DP IV были обнаружены в почке и тонкой кишке в сравнении с умеренными уровнями, найденными в легком, печени и селезенке. Самые низкие уровни мРНК DP IV были обнаружены в желудке, яичке, сердце, мышце и головном мозгу.
Hartel-Schenk et al., 1990, исследовали появление DP IV во время развития в органах крыс Wistar в дни 10, 16 и 21 беременности и в дни 1, 4, 8, 13, 21 и 60 после родов, сравнивая иммуногистохимию и гистохимию активности. Во всех исследованных тканях иммунореактивность с поликлональным антителом появлялась раньше, чем активность DP IV, и присутствовала уже в день 10 беременности в плазматических мембранах эмбриональных и экстраэмбриональных (децидуальных) клетках. В этих и других участках, например эндотелии капилляров мозга и эпителии трахеи и бронхов, иммунореактивность с поликлональным антителом уменьшалась или исчезала после родов и активность фермента больше не развивалась. Иммунореактивность с моноклональными антителами появлялась позднее, чем иммунореактивность с поликлональным антителом, и большей частью в структурах, где была впоследствии обнаружена активность DP IV. Моноклональное антитело против эпитопа D обнаружило высокую реактивность в эпидидимальном протоке, почечных собирающих каналах и во всех доменах плазматической мембраны гепатоцитов, где не наблюдали ни активности, ни иммунореактивности DP IV с другими антителами. Их результаты предполагают также, что DP IV может присутствовать в виде молекулы до того, как он становится каталитически активным, и что иммунореактивность появляется в большем числе участков, чем активность DP IV. С использованием иммуногистохимических способов Bernstein et al., 1987, исследовали присутствие иммунореактивности дипептидиламинопептидазы IV в материале головного мозга, полученном из плодов человека, новорожденных и пожилых лиц. Было обнаружено, что белок фермента в изобилии присутствует в незрелой ЦНС человека. В противоположность этому головной мозг взрослого человека содержит гораздо меньшую иммунореактивность дипептидиламинопептидазы. Обсуждается, что этот фермент может играть важную роль в пролиферации и/или дифференцировке нейронов, в частности, в отношении его возможного действия на определенные нейротрофические пептиды (IGF II, гормон роста). De Bault & Mitro, 1994, исследовали локализацию мембранных протеаз глутамиламинопептидазы (ЕАР), микросомной аланиламинопептидазы (mAAP), дипептидилпептидазы IV (DP IV) и гамма-глутамилтранспептидазы (гамма-GTP) в сосудах субфорникального органа (SFO), эпендимы, которая покрывает поверхность SFO, и смежных структур головного мозга. Результаты гистохимических реакций фермента показали сильную активность ЕАР, mAAP и гамма-GTP, но в противоположность вышеупомянутым открытиям отсутствие DP IV в микрососудах SFO. Эпендима, которая покрывает SFO, была положительной в отношении гамма-GTP, но отрицательной в отношении других исследованных протеаз. Их результаты показали, что спектр ферментов в большинстве сосудов SFO является сходным со спектром ферментов микрососудов смежной ткани мозга, которые были положительными в отношении ЕАР, mAAP и гамма-GTP, но отрицательными в отношении DP IV.
В противоположность этим открытиям данное изобретение показывает, что введение ингибиторов DP IV, таких как изолейцилтиазолидин, производит анксиолитический эффект в крысах. Неожиданно, данное изобретение показывает, что введение ингибитора DP IV изолейцилтиазолидина проявляет анксиолитическое действие в крысах. Специфической молекулярной мишенью для изолейцилтиазолидина в головном мозге является не фермент DP IV, который был выделен из плаценты Mentlein (1993) и который он использовал для его исследований in vitro. Тот факт, что ингибитор DP IV изолейцилтиазолидин ослабляет тревожность после i.c.v. введения в крысах, обеспечивает доказательство, что эта мишень данного изобретения является одним единственным ферментом DP IV или набором DP IV-подобных ферментов.
В результате полученной усиленной стабильности эндогенного NPY (1-36), вызываемой введением ингибиторов DP IV, активность NPY поддерживается, увеличивается или пролонгируется, приводя к функционально активной активности рецептора Y1 NPY, содействуя - среди прочего - антидепрессивному, анксиолитическому и антигипертензивному эффектам (см. выше).
Способ данного изобретения для лечения тревожности в животном, в том числе в человеке, нуждающемся в этом, включает потенциирование присутствия NPY введением ингибиторов активности DP IV или родственных ферментов. В большинстве обстоятельств может быть предпочтительным пероральное введение ингибитора DP IV. Введением ингибитора активности DP IV или DP IV-подобных ферментов период полужизни в организме активной формы NPY будет ощутимо удлиняться, увеличиваться или поддерживаться при физиологических условиях. Продленное присутствие активного NPY будет усиливать активность рецептора Y1 NPY.
Данное изобретение обеспечивает также фармацевтические композиции. Такие композиции содержат терапевтически (или профилактически) эффективное количество ингибитора (и/или сахарной пилюли для сопровождения введения ингибитора DP IV) и фармацевтически приемлемый носитель или наполнитель, в частности, приспособленный для нацеливания на головной мозг. Подходящие носители включают, но не ограничиваются ими, солевой раствор, забуференный солевой раствор, декстрозу, воду, глицерин, этанол и их комбинации. Носитель и композицию получают предпочтительно в условиях хорошей лабораторной практики, и наиболее предпочтительно они являются стерильными. Препарат выбирают идеально для соответствия способу введения в соответствии с общепринятой практикой.
Подходящие фармацевтически приемлемые носители включают, но не ограничиваются ими, воду, солевые растворы (например, NaCl), спирты, аравийскую камедь, растительные масла, бензиловые спирты, полиэтиленгликоли, желатин, углеводы, такие как лактоза, амилоза или крахмал, стеарат магния, тальк, вязкий парафин, масло для парфюмерного производства, эфиры жирных кислот, гидроксиметилцеллюлозу, поливинилпирролидон и т.д. Фармацевтические препараты могут быть стерилизованы и, если желательно, смешаны со вспомогательными агентами, например смазывающими веществами, консервантами, стабилизаторами, увлажняющими агентами, эмульгаторами, солями для влияния на осмотическое давление, буферами, красящими, улучшающими вкус и запах и/или ароматическими веществами и т.п., которые не реагируют вредным образом с активными соединениями, но улучшают стабильность, технологичность и/или эстетическую привлекательность.
Эти композиции, если желательно, могут также содержать малые количества увлажняющих или эмульгирующих агентов или забуферивающих рН агентов. Кроме того, композиция может быть жидким раствором, суспензией, эмульсией, таблеткой, пилюлей, капсулой, препаратом замедленного высвобождения (пролонгированного действия) или порошком. Кроме того, композиция может быть приготовлена в виде суппозитория с общепринятыми связывающими агентами и носителями, такими как триглицериды. Пероральные композиции могут включать в себя стандартные носители, такие как маннит, лактоза, крахмал, стеарат магния, поливинилпирролидон, натрийсахарин, целлюлоза, карбонат магния фармацевтической чистоты и т.д.
Далее эти композиции могут быть приготовлены в соответствии с рутинными процедурами в виде фармацевтической композиции, адаптированной для внутривенного введения человеку. Обычно композиции для внутривенного введения являются растворами в стерильном изотоническом водном буфере. В случае необходимости композиция может включать также солюбилизирующий агент и локальный анестезирующий агент для облегчения боли в месте инъекции. Обычно эти ингредиенты поставляются либо в виде отдельных компонентов, либо смешанными вместе в форме унифицированной (стандартной) дозы, например в виде сухого лиофилизированного порошка или безводного концентрата, в герметически заделанном контейнере, таком как ампула или подушечка, в зависимости от качества активного соединения. Если композиция вводится инфузией, она может быть налита в инфузионный флакон, содержащий стерильную воду фармацевтической чистоты, солевой раствор или смесь декстроза/вода. При введении композиции инъекцией может быть обеспечена ампула стерильной воды для инъекций или солевого раствора, так что ингредиенты могут быть смешаны перед введением.
Наконец, композиции данного изобретения могут быть приготовлены в виде нейтральной или солевой формы. Фармацевтически приемлемые соли включают соли, образованные со свободными аминогруппами, например соли, образованные из хлористоводородной, фосфорной, уксусной, щавелевой, винной кислоты и т.д., и соли, образованные из гидроксидов натрия, аммония, кальция, железа(III), изопропиламина, триэтиламина, 2-этиламиноэтанола, гистидина прокаина и т.д.
Количество композиции данного изобретения, которое будет эффективным в лечении конкретного нарушения или состояния, будет зависеть от характера нарушения или состояния, и может быть определено стандартными клиническими способами. Кроме того, для облегчения определения оптимальных диапазонов доз могут использоваться необязательно анализы in vitro и/или in vivo. Точная доза для применения в композиции будет также зависеть от способа введения и тяжести заболевания или нарушения, и решение о дозе должно быть принято в соответствии с оценкой лечащего врача и обстоятельств, связанных с каждым отдельным пациентом.
Специалисту в данной области должно быть понятно, что многочисленные изменения могут быть произведены в отношении примеров и инструкций, даваемых здесь, в том числе в отношении генерирования различных ингибиторов DP IV и других терапевтических композиций, без отклонения от идеи или объема данного изобретения.
Теперь данное изобретение будет иллюстрироваться со ссылкой на следующие примеры, с особым вниманием в отношении анксиолитического и защищающего против стресса действия в генетической модели недостаточности DP IV (пример 1), в отношении анксиолитического действия фармакологических доз ингибиторов DP IV в ЦНС (пример 2), в отношении взаимодействия и потенциирования NPY-опосредованных анксиолитических эффектов (пример 3) и в отношении характеристики анксиолитического механизма на основе потенциирования опосредованных рецептором Y1 NPY эффектов (пример 4).
ПРИМЕРЫ ИЗОБРЕТЕНИЯ
Пример 1
Спонтанные мутации гена DP IV, наблюдаемые в субштаммах крыс Fischer (F344), обеспечивают модель для исследования роли DP IV в регуляции поведения и адаптации к стрессу. Мутации в крысах F344 приводят к отсутствию DP IV-подобной ферментативной активности и были найдены в субштаммах из Германии (GER) и Японии (JAP) (Thompson et al., 1991; Tsuji et al., 1992), тогда как крысы от животноводов Соединенных Штатов (США) и Ганновера (HAN) обнаруживают значительную активность этого фермента. В крысах F344JAP замена G633R в белке CD26 вызывает значительно уменьшенную экспрессию мутантного неактивного фермента (Tsuji et al., 1992; Cheng et al., 1999), тогда как другой DP IV-отрицательный субштамм F344GER экспрессирует неактивный мутантный фермент (Thompson et al., 1991). Таким образом, крысу F344JAP рассматривали как модель с "нокаутом белка" (Cheng et al., 1999), в то время как субштамм F344GER мог представлять модель "сверхэкспрессии белка" (Shingu, Helfritz, Meyer, Schmidt, Mentlein, von Horsten, представленная работа). На основании этих открытий прямое сравнение мутантных субштаммов F344JAP и F344GER с крысами F344USA "дикого типа" позволило бы дифференцировать между ролью экспрессии и активности DP IV в поведенческой регуляции и других неврологических и психофизиологических функциях in vivo. В данном примере авторы изобретения сообщают, что недостаточные по DP IV субштаммы F344 являются менее беспокойными и менее чувствительными к индуцируемым стрессом физиологическим изменениям.
Животные. Субштаммы F344USA, F344JAP и F344GER получали из разных стран через Charles River Germany. Крыс F344HAN, первоначально произведенных из субштамма F344USA, получали из селекционной колонии в Центральной лаборатории по разведению животных при Hannover Medical School (в отношении дополнительной информации см.: http://www.mh-hannover.de/institut/tierlabor/ f344.htm). Все субштаммы разводили в течение одного поколения в Центральной лаборатории по разведению животных в Ганновере и содержали в не содержащей конкретных патогенов установке при 25°С при цикле 12 часов света - 12 часов темноты (свет включали в 07.00 ч) со свободным доступом ad libitum к корму и воде. Для экспериментов использовали соответствующие по возрасту потомства F1 всех субштаммов. Все процедуры исследования и ухода за животными были одобрены District Government, Hannover, Germany.
Количественное определение активности DP IV в ткани субштаммов F344. Пробы плазмы, легкого и различных других тканей хранили в замороженном виде при -80°С до использования. Ткань гомогенизировали и активность фермента DP IV детектировали инкубированием субстрата, глицилпролин-п-нитроанилида (gly-Pro-pNA, 1 мг/мл в ЗФР) (Bachem, Germany), и развитие окраски измеряли при 405 нм.
Тест "социального взаимодействия" (SI). Тест SI проводили, как впервые описано File (1980), и валидизировали первоначально в лаборатории (Kask, Nguyen, Pabst, von Horsten, представлено). Двух крыс, подходящих в отношении генотипа и веса тела, вынимали из клеток и подвергали обстановке тестирования. Местом действия было квадратное "открытое поле" (50×50×50 см), изготовленное из алюминия, помещенное внутри камеры со звуковой изоляцией (Coulbourn Instruments, Lehigh Valley, PA). В отношении подробностей устройства см. предыдущее исследование авторов (von Horsten et al., 1998c). "Открытое поле" освещали фотолампой красного света (Philips PF712E; 1,3 люкс). Крысы не были знакомы с этим устройством. Поведение подвергали мониторингу с использованием видеокамеры, помещенной над полем внутри камеры для испытания/изоляции. SI-поведение обеих крыс регистрировали с использованием подключенного монитора, помещенного снаружи на верхней части камеры. Следующие параметры оценивались наблюдателем (HPN), не имеющим представления о субштамме крыс: продолжительность времени, затраченного на обнюхивание, преследование, ползание над и под другими крысами, но не пассивный контакт тел (при отдыхе, во время сна). Увеличение SI-времени считается анксиолитикподобной реакцией.
Индуцированная стрессом потеря веса тела. В течение трех последовательных дней подходящих по возрасту животных от животноводов Японии (JAP), Соединенных Штатов (USA) и Германии (GER) индивидуально транспортировали в новую камеру и оставляли там на 1 час. В первый день использовали новую клетку, содержащую опилки, и животных помещали в стандартный стеллаж для животных. На второй день процедура была такой же, за исключением того, что клетка была без опилок. Процедура стресса на третий день была такой же, что и на второй день, за исключением того, что клетку помещали на нижнюю часть новой камеры.
Статистический анализ. Данные из повторяемых наблюдений анализировали двухфакторными дисперсионными анализами для повторяемых измерений (ANOVA) (факторы: "субштамм" и "изменение веса тела после стресса" в качестве повторяемых измерений). Результаты, полученные из простых измерений, таких как активность DP IV или SI-время, анализировали однофакторным (фактор: "субштамм") ANOVA. Звездочки указывают значимые post hoc эффекты против субштамма F344USA (контроль), полученные с использованием PLSD Фишера. Все данные представлены в виде среднего±S.E.M.
Активность DP IV в субштаммах F344. Согласно литературе субштаммы F344GER и F344JAP не имеют эндогенной активности DP IV (фиг.1). Таким образом, эти крысы обеспечивают генетическую модель для исследования физиологической роли активности DP IV в поведенческой регуляции.
Тревожность в тесте социального взаимодействия: Субштаммы F344, которые не имеют активности DP IV (F344JAP и F344GER), проводили значимо больше времени в активном социальном взаимодействии с новым местом действия (фиг.2). Таким образом, отсутствие эндогенной DP IV-подобной активности опосредует анксиолитикподобные эффекты.
Индуцированная стрессом потеря веса тела: F344JAP и F344GER теряют значимо меньше веса тела после повторяемого несколько раз 1-часового стресса транспортировки. Таким образом, отсутствие эндогенной DP IV-подобной активности в этих субштаммах уменьшает физиологические изменения, индуцируемые умеренным стрессом (фиг.3).
Вместе эти данные демонстрируют, что в генетической модели DP IV-недостаточных крыс F344 отсутствие эндогенной активности DP IV вызывает анксиолитикподобные и защищающие от стресса эффекты.
Пример 2
В предыдущем примере авторы продемонстрировали, что тревожность и чувствительность к стрессу были уменьшенными в генетической модели недостаточности DP IV. В данном примере авторы сообщают, что центральное введение (i.c.v.) ингибитора DP IV изолейцилтиазолидина приводит к анксиолитикподобным эффектам в хорошо установленном тесте тревожности в грызунах, в тесте приподнятого крестообразного лабиринта. Кроме того, авторы сообщают, что эмоциональность крыс в ответ на новые условия, измеренные посредством примера "открытого поля" (Denenberg et al., 1968), является менее выраженной в обработанных изолейцилтиазолидином крысах, без влияния на активность.
Животные. Самцов крыс WistarF/Han (WF) (Центральная лаборатория по разведению животных при Hannover Medical School, Germany (в отношении дополнительной информации см.: http://www.mh-hannover.de/institut/tierlabor/f344.htm) с весом 350-390 г содержали в звуконепроницаемой камере с регулируемой температурой (24,0±0,5°С) в не содержащих специфических патогенов условиях с циклом 12/12 темнота/свет (свет включали в 07.00 ч с уровнем освещения 80 люкс). Корм (гранулы лабораторного корма Altromin) и водопроводная вода были доступны ad libitum. При анестезии смесью кетамин/ксилазин (100/5 мг/кг, i.p.) крыс фиксировали в стереотаксической раме Kopf и имплантировали канюлей (из пластика, Inc., Roanoke, VA, USA) выше латерального желудочка. Все процедуры исследования и ухода за животными были одобрены Lower Saxony district government (Hannover, Germany) и соответствовали принципам, описанным в European Community's Council Directive of 24 November 1986 (86/609/EEC).
Хирургия и i.c.v. введение. Для хирургии крыс анестезировали и подготавливали с использованием i.c.v. канюль (координаты: А: 0,7 мм каудально, L: 1,4 мм латерально относительно брегмы; и V: 3,2 мм вентрально относительно поверхности черепа; зубная дуга+3,0 выше линии, соединяющей уши) с использованием стандартных стереотаксических процедур, как описано подробно в другом месте (von Horsten et al., 1998a, b, c). После 7-дневного периода восстановления после хирургии, успешное канюлирование желудочка головного мозга подтверждали реакцией потребления воды с использованием ангиотензина (von Horsten et al., 1998a). Крыс, проявляющих положительную реакцию потребления воды (n=40), затем приучали к экспериментальному манипулированию ежедневными симулируемыми (ложными) инъекциями в течение семи дней.
Животных случайным образом делили на четыре экспериментальные группы (n=8-10 на группу), которые выполняли различные поведенческие тесты экспериментальной тревожности. Животных в каждой группе обрабатывали одинаковым образом в каждой фазе, и они получали i.c.v. инъекции за 60 мин перед поведенческим тестированием: искусственной цереброспинальной жидкости (aCSF) (контроль), изолейцилтиазолидина (0,05 нмоль), изолейцилтиазолидина (5 нмоль) и изолейцилтиазолидина (500 нмоль). Изолейцилтиазолидин доводили до конечной концентрации с использованием забуференной aCSF и вводили в объеме 5 мкл/мин в правый латеральный желудочек. Канюлю подсоединяли к микрошприцу Гамильтона с полиэтиленовой трубкой приблизительно 30 см и все соединения инфузировали при скорости 5,0 мкл/мин с использованием многоканального инфузионного насоса TSE (Bad Homburg, Germany).
Ответ на новые условия (тест "открытого поля"). Различия в реакции на новые условия, индуцированные антагонизмом DP IV в ЦНС, исследовали с использованием теста "открытого поля" (OF). Общая процедура описана подробно в другом месте (von Horsten et al., 1993, 1998d). Однако были введены следующие модификации: во время фазы темноты крыс помещали в квадратное 50×50 см OF в звуконепроницаемой камере, освещаемое красной фотолампой. Спонтанную активность во время одной непрерывной сессии (тест-времени) 15 минут регистрировали с использованием системы анализатора видеотраекторных данных (E61-21 Video Path Analyser system, Coulbourn instruments, PA, U.S.A). Эта система анализатора определяет поведение при 15-одноминутных интервалах, анализируя 14 элементов информации: время у стенки, время в углу, время в квадрантах 1-4, время отдыха и время на задних лапках (все в секундах), стереоскопические события, вращения по часовой стрелке, вращения против часовой стрелки (все в виде целых чисел) и проходимое расстояние (см). Кроме того, общее число фекальных комков считалось после каждой сессии (каждого тест-времени), и случаи и продолжительность (сек) поведения чистки регистрировались одновременно из видеомонитора лицом, которыму не была известна обработка этих животных (von Horsten et al., 1998 с).
Тестирование с приподнятым крестообразным лабиринтом. Устройство приподнятого крестообразного лабиринта и тест-процедуру адаптировали согласно Fernandes and File (1996) на основании общих рассмотрений и валидизации для использования с крысами. Е+-аппарат (TSE Systems, Bad Homburg, Germany) был изготовлен из серого пластика и имел два открытых ответвления (50×10 см) и два закрытых ответвления того же самого размера со стенками высотой 40 см, приподнятых на 50 см выше земли. Лабиринт был оборудован датчиками световых пучков, которые обеспечивали возможность компьтеризованного измерения производительности Е+. Лабиринт освещали красной лампой (Philips PF712E; 1,5 люкс), помещенной на 30 см выше лабиринта, так что закрытые ответвления оставались в тени. В начале эксперимента крысу помещали на центральную платформу (10×10 см) головой к закрытому ответвлению и давали ей свободно обследовать лабиринт в течение 5 минут. Рассчитывали следующие параметры: общее число вхождений в ответвления (ТА); вхождения в закрытые ответвления (СА); вхождения в открытые ответвления (ОА); процентную частоту вхождений в открытые ответвления (%ОА: ОА×100/ТА); общую продолжительность испытания (ТТ): 300 сек; продолжительность пребывания в закрытых ответвлениях (время в закрытых ответвлениях; CLT); процентная доля CLT в общей продолжительности пребывания в ответвлениях (CLT×100/АТ); продолжительность пребывания в открытых ответвлениях (время в открытых ответвлениях; OT); процентная доля OT в общей продолжительности пребывания в ответвлениях (ОT×100/АТ). Кроме стандартных пространственно-временных измерений, регистрировали "время, проведенное на центральной площадке и процент этого времени" (время в центре, СТ: продолжительность пребывания на платформе в секундах; процентная доля СТ в продолжительности испытания, %СТ: СТ×100/ТТ). Увеличение времени, проведенного на открытых ответвлениях, интерпретируется как анксиолитическая реакция, уменьшение этого параметра как анксиогенная реакция, тогда как число вхождений в закрытые ответвления обеспечивает указание об общей активности (Pellow et al., 1985).
Статистический анализ. Для статистического анализа необработанные поведенческие данные из каждой тест-минуты анализировали двухфакторными дисперсионными анализами для повторяемых измерений (ANOVA) (факторы: обработка и время в виде повторяемых измерений). Результаты, полученные в целом из сессии, анализировали однофакторным (фактор: обработка) ANOVA. Звездочки указывают значимые post hoc эффекты против aCSF (контроль), полученные с использованием PLSD Фишера. Все данные представлены в виде среднего ±S.E.M.
Реакция на изолейцилтиазолидин в "открытом поле": изолейцилтиазолидин не действовал на активность в открытом поле в широком диапазоне доз (фиг.4). В качестве характеристики уменьшенной эмоциональности в открытом поле использовали зависимое от дозы уменьшение времени, проведенного вблизи стенки, индуцированное изолейцилтиазолидином (фиг.5). Даже очень низкая доза 50 пмоль была эффективной.
Реакция на изолейцилтиазолидин в тесте ЕРМ: изолейцилтиазолидин в низкой дозе (50 пмоль) увеличивал процент времени, проведенного на открытых ответвлениях лабиринта, что указывает на анксиолитическое действие (фиг.6). Вместе эти данные показывают впервые, что введение фармакологических доз ингибитора DP IV изолейцилтиазолидина производит зависимые от дозы анксиолитические действия в двух моделях тревожности животных.
Пример 3
В данном примере авторы сообщают, что само центральное введение (i.c.v.) ингибитора DP IV изолейцилтиазолидина имеет также зависимые от дозы анксиолитические эффекты в тесте социального взаимодействия, определяющем тревожность. Авторы также сообщают, что величина снятия тревожности (анксиолизиса) изолейцилтиазолидином сходна с величиной, производимой NPY. Кроме того, авторы показывают, что комбинированное применение изолейцилтиазолидина и NPY оказывает аддитивное анксиолитическое действие в тесте SI. Наконец, авторы показывают, что обработка только изолейцилтиазолидином и в комбинации оказывает меньшее действие на 1-часовое и 12-часовое потребление корма.
Животные. Самцов крыс WistarF/Han (WF) (Центральная лаборатория по разведению животных при Hannover Medical School, Germany (в отношении дополнительной информации см.: http://www.mh-hannover.de/institut/tierlabor/f344.htm) с весом 330-370 г содержали в звуконепроницаемой камере с регулируемой температурой (24,0±0,5°С) в не содержащих специфических патогенов условиях с циклом 12/12 темнота/свет (свет включали в 07.00 ч с уровнем освещения 80 люкс). Корм (гранулы лабораторного корма Altromin) и водопроводная вода были доступны ad libitum. При анестезии смесью кетамин/ксилазин (100/5 мг/кг, i.p.) крыс фиксировали в стереотаксической раме Kopf и имплантировали канюлей (Plastic One, Inc., Roanoke, VA, USA) выше латерального желудочка. Все процедуры исследования и ухода за животными были одобрены Lower Saxony district government (Hannover, Germany) и соответствовали принципам, описанным в European Community's Council Directive of 24 November 1986 (86/609/EEC).
Хирургия и i.c.v. введение. Для хирургии крыс анестезировали и подготавливали с использованием i.c.v. канюль (координаты: А: 0,7 мм каудально, L: 1,4 мм латерально относительно брегмы; и V: 3,2 мм вентрально относительно поверхности черепа; зубная дуга+3,0 выше линии, соединяющей уши) с использованием стандартных стереотаксических процедур, как описано подробно в другом месте (von Horsten et al., 1998a, b, c). После 7-дневного периода восстановления после хирургии успешное канюлирование желудочка головного мозга подтверждали реакцией потребления воды с использованием ангиотензина (von Horsten et al., 1998a). Крыс, проявляющих положительную реакцию потребления воды (n=59), затем приучали к экспериментальному манипулированию ежедневными симулируемыми (ложными) инъекциями в течение семи дней.
Животных случайным образом делили на две экспериментальные группы (n=5-6 на группу), которые выполняли последующий SI-тест тревожности. Животных в каждой группе обрабатывали одинаковым образом в каждой фазе, и они получали i.c.v. инъекции за 60 мин и за 45 мин перед поведенческим тестированием с различными дозами (изолейцилтиазолидин: 5 пмоль - 500 нмоль; NPY: 50 пмоль - 1,6 нмоль). Изолейцилтиазолидин доводили до конечной концентрации с использованием забуференной aCSF и вводили в объеме 5 мкл/мин в правый латеральный желудочек. Канюлю подсоединяли к микрошприцу Гамильтона с полиэтиленовой трубкой приблизительно 30 см и все соединения инфузировали в общем объеме 5,0 мкл при скорости 5,0 мкл/мин с использованием многоканального инфузионного насоса TSE (Bad Homburg, Germany). Измеряли время, проведенное в активном социальном взаимодействии (SI-время) и количество корма при 1-часовом и 12-часовом потреблении корма. Животных несколько раз тестировали со случайно выбранной обработкой и всегда новыми партнерами взаимдодействия. Тесты отделяли по меньшей мере 4-мя днями один от другого и всегда проводили в темном цикле. Выполняли пять серий тестов. Каждый тест охватывал четыре группы (aCSF+aCSF; aCSF+NPY; изолейцилтиазолидин+aCSF; изолейцилтиазолидин+NPY) с 5-6 животными на каждое условие.
Тест "социального взаимодействия" (SI). Тест SI проводили, как впервые описано File (1980), и валидизировали первоначально в лаборатории (Kask, Nguyen, Pabst, von Horsten, представлено). Двух крыс, подходящих в отношении генотипа и веса тела, вынимали из клеток и подвергали обстановке тестирования. Местом действия было квадратное "открытое поле" (50×50×50 см), изготовленное из алюминия, помещенное внутри камеры со звуковой изоляцией (Coulbourn Instruments, Lehigh Valley, PA). В отношении подробностей устройства см. предыдущее исследование авторов (von Horsten et al., 1998c). "Открытое поле" освещали фотолампой красного света (Philips PF712E; 1,3 люкс). Крысы не были знакомы с этим устройством. Поведение подвергали мониторингу с использованием видеокамеры, помещенной над полем внутри камеры для испытания/изоляции. SI-поведение обеих крыс регистрировали с использованием подключенного монитора, помещенного снаружи на верхней части камеры. Следующие параметры оценивались наблюдателем (HPN), не имеющим представления о субштамме крыс: продолжительность времени, затраченного на обнюхивание, преследование, ползание над и под другими крысами, но не пассивный контакт тел (при отдыхе, во время сна). Увеличение SI-времени считается анксиолитикподобной реакцией.
Статистический анализ. Данные из повторяемых наблюдений (потребление корма) анализировали двухфакторными дисперсионными анализами для повторяемых измерений (ANOVA) (факторы: "субштамм" и "потребление корма" в качестве повторяемых измерений). Результаты, полученные из простых измерений, таких как активность DP IV или SI-время, анализировали однофакторным (фактор: "субштамм") ANOVA. Звездочки указывают значимые post hoc эффекты против aCSF+aCSF (контроль), полученные с использованием PLSD Фишера. Все данные представлены в виде среднего±S.E.M.
Зависимое от дозы анксиолитическое действие в SI-тесте, вызываемое изолейцилтиазолидином. Центральное введение ингибитора DP IV изолейцилтиазолидина (группа aCSF+изолейцилтиазолидин: 5 пмоль - 500 нмоль) производило зависимые от дозы анксиолитикподобные эффекты в "форме колокола" в тесте социального взаимодействия на тревожность (фиг.7). Это показывает, что изолейцилтиазолидин действует также и в SI-тесте как сильное анксиолитикподобное соединение, подобно тестам ЕРМ и открытого поля (см. пример 2). I.c.v. введение NPY (0,05-1,6 нмоль) имело сходное анксиолитикподобное действие (фиг.7). Это открытие повторяет известное анксиолитическое действие NPY, описанное в предшествующем уровне техники. Сравнение опосредованных изолейцилтиазолидином эффектов с эффектами NPY показывает, что этот ингибитор имеет сходную эффективность. Интересно, что предобработка изолейцилтиазолидином с последующей обработкой NPY производила аддитивный эффект на протяжении широкого диапазона доз (фиг.7), что позволяет предположить, что эти соединения действуют через один и тот же механизм. Как описано в предшествующем уровне техники, этот механизм является, наиболее вероятно, активацией рецепторов Y1 ЦНС.
Малые эффекты изолейцилтиазолидина на потребление корма. Фиг.8 и фиг.9 показывают, что при 1 часе NPY производил "U-образное" зависимое от дозы действие на потребление пищи (фиг.8). Изолейцилтиазолидин производил умеренное действие на потребление пищи, которое достигает значимости только при дозе 0,05 нмоль (фиг.8). Объединенная обработка изолейцилтиазолидином с последующей обработкой NPY не отличалась от одного NPY (за исключением действия при наивысших нефизиологических дозах), что предполагает, что действие NPY на потребление корма не опосредуется механизмом, на который влияет изолейцилтиазолидин. Большинство данных предшествующего уровня показывают, что действие NPY на потребление корма в темном цикле опосредуется прежде всего рецептором Y5. Никакая из обработок не влияет на ночное потребление корма, за исключением чрезвычайно высоких доз (фиг.9). Таким образом, введение в ЦНС ингибитора DP IV изолейцилтиазолидина не влияет на основные регуляторные системы потребления пищи (т.е. рецептор Y5 NPY).
Пример 4
В данном примере авторы сообщают о механизме потенциирования опосредованных NPY анксиолитикподобных эффектов при умеренных дозах (изолейцилтиазолидин, 50 нмоль; NPY 0,8 нмоль), как показано на фиг.7 примера 3. Авторы подтверждают, что предобработка с использованием антагониста рецептора Y1 NPY BIBP3226 может блокировать индуцируемое изолейцилтиазолидином потенциирование NPY-опосредованного анксиолитикподобного действия на SI-поведение, и кроме того, показывают, что на 1-часовые эффекты потребления корма только частично влияет блокада Y1R.
Животные. Самцов крыс WistarF/Han (WF) (Центральная лаборатория по разведению животных при Hannover Medical School, Germany (в отношении дополнительной информации см.: http://www.mh-hannover.de/institut/tierlabor/f344.htm) с весом 330±31 г (±SD) содержали в звуконепроницаемой камере с регулируемой температурой (24,0±0,5°С) в не содержащих специфических патогенов условиях с циклом 12/12 темнота/свет (свет включали в 07.00 ч с уровнем освещения 80 люкс). Корм (гранулы лабораторного корма Altromin) и водопроводная вода были доступны ad libitum. При анестезии смесью кетамин/ксилазин (100/5 мг/кг, i.p.) крыс фиксировали в стереотаксической раме Kopf и имплантировали канюлей (Plastic One, Inc., Roanoke, VA, USA) выше латерального желудочка. Все процедуры исследования и ухода за животными были одобрены Lower Saxony district government (Hannover, Germany) и соответствовали принципам, описанным в European Community's Council Directive of 24 November 1986 (86/609/EEC).
Хирургия и i.c.v. введение. Для хирургии крыс анестезировали и подготавливали с использованием i.c.v. канюль (координаты: А: 0,7 мм каудально, L: 1,4 мм латерально относительно брегмы; и V: 3,2 мм вентрально относительно поверхности черепа; зубная дуга+3,0 выше линии, соединяющей уши) с использованием стандартных стереотаксических процедур, как описано подробно в другом месте (von Horsten et al., 1998a,b,c). После 7-дневного периода восстановления после хирургии успешное канюлирование желудочка головного мозга подтверждали реакцией потребления воды с использованием ангиотензина (von Horsten et al., 1998a). Крыс, проявляющих положительную реакцию потребления воды (n=56), затем приучали к экспериментальному манипулированию ежедневными симулируемыми (ложными) инъекциями в течение семи дней.
Животных случайным образом делили на восемь экспериментальных групп (n=6-8 на группу), которые выполняли последующий SI-тест тревожности: (1) aCSF+aCSF+aCSF; (2) BIBP+aCSF+aCSF; (3) aCSF+изолейцилтиазолидин+aCSF; (4) BIBP+изолейцилтиазолидин+aCSF; (5) aCSF+aCSF+NPY; (6) BIBP+aCSF+NPY; (7) aCSF+Р32/89+NPY; (8) BIBP+изолейцилтиазолидин+NPY. Животных в каждой группе обрабатывали одинаковым образом в каждой фазе, и они получали i.c.v. инъекции за 60 мин и за 55 мин перед поведенческим тестированием. Эксперименты включали в себя две ночи с группами, уравновешенными для обоих темных циклов. Инъекционную канюлю подсоединяли к микрошприцу Гамильтона с полиэтиленовой трубкой приблизительно 30 см и все соединения инфузировали в общем объеме 5,0 мкл при скорости 5,0 мкл/мин с использованием многоканального инфузионного насоса TSE (Bad Homburg, Germany). Измеряли время, проведенное в активном социальном взаимодействии (SI-время), и 1-часовое и 12-часовое потребление корма.
Пептиды и антагонист. Крысиный нейропептид Y1-36 получали из Polypeptide Laboratories (Wolfenbuttel, Germany). Антагонист рецептора Y1 NPY BIBP3226 покупали из American Peptide Company, Sunnyvale, CA, USA (Номер по каталогу: 60-1-22 В). Все лекарственные средства растворяли в стерильной воде и конечные разведения производили с использованием aCSF.
Тест "социального взаимодействия" (SI). Тест SI проводили, как впервые описано File (1980), и валидизировали первоначально в лаборатории (Kask, Nguyen, Pabst, von Horsten, представлено). Двух крыс, подходящих для обработки, вынимали из клеток и подвергали обстановке тестирования. Местом действия было квадратное "открытое поле" (50×50×50 см), изготовленное из алюминия, помещенное внутри камеры со звуковой изоляцией (Coulbourn Instruments, Lehigh Valley, PA). В отношении подробностей устройства см. предыдущее исследование авторов (von Horsten et al., 1998c). "Открытое поле" освещали фотолампой красного света (Philips PF712E; 1,3 люкс). Крысы не были знакомы с этим устройством. Поведение подвергали мониторингу с использованием видеокамеры, помещенной над полем внутри камеры для испытания/изоляции. SI-поведение обеих крыс регистрировали с использованием подключенного монитора, помещенного снаружи на верхней части камеры. Следующие параметры оценивались наблюдателем (HPN), не имеющим представления о субштамме крыс: продолжительность времени, затраченного на обнюхивание, преследование, ползание над и под другими крысами, но не пассивный контакт тел (при отдыхе, во время сна). Увеличение SI-времени считается анксиолитикподобной реакцией.
Статистический анализ. Данные, полученные из измерений SI-времени и 1-часового потребления корма, анализировали однофакторным (фактор: "обработка") ANOVA. Кроме того, трехфакторный анализ (факторы: "антагонист", "ингибитор", "NPY") выполняли для подтверждения общих выводов (данные не показаны). Звездочки указывают значимые post hoc эффекты против aCSF+aCSF+aCSF (контроль), тогда как знак "#" указывает значимое различие обработки антагонистом Y1R против соответствующей обработки без антагониста, полученное с использованием PLSD Фишера. Уровень значимости в post hoc сравнениях показан звездочками с "*"=p<0,05; "**"=p<0,01; "***"=p<0,001; и символами "#" c "#"=p<0,05; "##"=p<0,01; "###"=p<0,001). Все данные представлены в виде среднего значения±стандартная ошибка среднего (±SEM).
Опосредованное рецептором Y1 NPY потенциирование NPY-индуцированного анксиолизиса в SI-тесте с использованием предобработки изолейцилтиазолидином. Объединенное центральное введение изолейцилтиазолидина в дозе 50 нмоль и NPY в дозе 0,8 нмоль разительно потенциирует анксиолитикподобное действие NPY в SI-тесте (фиг.10). Это открытие повторяет при соответствующих дозах наблюдение, показанное на фиг.7. В этой дозе обработка одним гемифумаратом изолейцилтиазолидина (р32/98) не действует подобно анксиолитику. Однако эндогенное социальное/исследовательское поведение, анксиолитикподобное действие NPY и потенциированное анксиолитическое действие NPY, индуцированные объединенной обработкой изолейцилтиазолидин+NPY, все антагонистически подавлялись блокадой рецептора Y1. Это указывает на связанную с тонусом регуляцию уровней тревожности через рецептор Y1 NPY в ЦНС и, кроме того, доказывает, что анксиолитикподобное действие NPY, а также потенциированное анксиолитическое действие, индуцированные объединенной обработкой, являются, все, первично опосредованными рецептором Y1. Спонтанное потребление пищи и NPY-индуцированное потребление пищи являются лишь частично опосредованными Y1R, и незначимое небольшое увеличение потребления пищи, индуцированное обработкой изолейцилтиазолидином, блокируется антагонистами Y1R (фиг.11).








| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ДЛЯ ЛЕЧЕНИЯ НЕВРОЛОГИЧЕСКИХ И НЕЙРОПСИХОЛОГИЧЕСКИХ НАРУШЕНИЙ | 2001 |
|
RU2286149C2 |
| СПОСОБ УЛУЧШЕНИЯ ПЕРЕДАЧИ СИГНАЛА В ОСТРОВКАХ ЛАНГЕРГАНСА ПРИ САХАРНОМ ДИАБЕТЕ И ЕГО ПРОФИЛАКТИКЕ | 2001 |
|
RU2261096C2 |
| СПОСОБ СНИЖЕНИЯ ДОСТУПНОСТИ ПИТАТЕЛЬНОГО ВЕЩЕСТВА, СПОСОБ ПОДАВЛЕНИЯ АППЕТИТА | 2001 |
|
RU2275207C2 |
| СРЕДСТВО ДЛЯ КУПИРОВАНИЯ АЛКОГОЛЬНОГО АБСТИНЕНТНОГО СИНДРОМА | 2012 |
|
RU2521226C2 |
| НОВЫЕ ИНГИБИТОРЫ ДИПЕПТИДИЛПЕПТИДАЗЫ IV И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ПРОТИВОРАКОВЫХ АГЕНТОВ | 2002 |
|
RU2299066C2 |
| ВЕКТОР | 2017 |
|
RU2749479C1 |
| ПРОИЗВОДНЫЕ АМИНОВ ИЛИ АМИДОВ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ АНТАГОНИЗИРОВАНИЯ РЕЦЕПТОРА Y5 НЕЙРОПЕПТИДА NPY | 2000 |
|
RU2228927C2 |
| СПОСОБ (ВАРИАНТЫ) И СРЕДСТВО ДЛЯ МОДИФИКАЦИИ ПИЩЕВОГО ПОВЕДЕНИЯ | 2002 |
|
RU2519748C2 |
| ПРИМЕНЕНИЕ КАРНОЗОЛА И/ИЛИ РОЗМАНОЛА ДЛЯ ПОВЫШЕНИЯ АКТИВНОСТИ НЕЙРОРЕЦЕПТОРОВ | 2007 |
|
RU2440012C2 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ИШЕМИЧЕСКИХ ПОРАЖЕНИЙ МОЗГА | 2004 |
|
RU2288714C2 |
Изобретение относится к медицине и фармации и представляет собой применение ингибитора дипептидилпептидазы IV (DP IV или CD 26) или DP IV-подобного фермента для получения лекарственного средства для лечения депрессии. Изобретение обеспечивает развитие нацеленных на головной мозг агентов, которые поддерживают, увеличивают или пролонгируют эффект или активность NPY и которые проявляют высокую биодоступность и точно предсказуемое время активности в ткани-мишени. 5 з.п. ф-лы, 11 ил., 2 табл.
1. Применение ингибитора дипептидилпептидазы IV (DP IV или CD 26) или DP IV-подобного фермента для получения лекарственного средства для лечения депрессии.
2. Применение по п.1 для получения лекарственного средства для уменьшения деградации эндогенного нейропептида Y (NPY), локализованного в ЦНС.
3. Применение по п.1 или 2, характеризующееся тем, что ингибиторы используют в комбинации с нейропептидом Y.
4. Применение по любому из предшествующих пунктов, характеризующееся тем, что ингибиторы присутствуют в физиологически совместимом носителе для доставки лекарственного средства.
5. Применение по любому из предшествующих пунктов, характеризующееся тем, что ингибиторы приготовлены в виде пролекарств этих ингибиторов.
6. Применение по любому из предшествующих пунктов, характеризующееся тем, что ингибиторы используют парентерально, энтерально, перорально, ингаляционно или в виде суппозитория.
| WO 9946272 А, 16.09.1999 | |||
| DE 29909210 U1, 09.09.1999 | |||
| Энциклопедический словарь медицинских терминов, издание второе./ Под ред | |||
| академика РАМН В.И.Покровского | |||
| - М.: Медицина, 2001, с.264-265. |
Авторы
Даты
2011-04-20—Публикация
2006-06-20—Подача