Область изобретения
Настоящее изобретение относится к лечению или профилактике синдрома гиперстимуляции яичников (OHSS) с использованием агониста дофамина. В некоторых воплощениях, агонист дофамина представляет собой хинаголид (Norprolac®), каберголин (Dostinex®) или бромокриптин (Parlodel®).
Предшествующий уровень техники
Бесплодие поражает примерно 5 миллионов американских женщин в Соединенных Штатах (примерно 10-15%). Причиной бесплодия могут быть многие факторы, включая патологии матки (такие как фибролейомиома), дисфункцию яичников, эндометриоз (присутствие ткани матки в эктопических локализациях, таких как яичники), рубцовую ткань от предшествующих хирургических вмешательств, тиреоидные проблемы или другие гормональные дисбалансы, заболевания, передающиеся половым путем, другие инфекции или необъясненное бесплодие (идиопатическое бесплодие). Одна первопричина бесплодия представляет собой хроническую ановуляцию из-за гипоэстрогенного гипогонадизма. Это нарушение связано с эстрогеном сыворотки в постменопаузальных пределах, нормальным по отношению к низкому фолликулостимулирующему гормону (FSH), что вызывает нерегулярные менструации и аменорею. У этих пациентов обычно нормальные уровни пролактина. Вторую причину бесплодия объясняют гипергонадотропным гипогонадизмом. Эти пациенты имеют повышенные уровни FSH и постменопаузального эстрогена. Эта категория включает пациентов с преждевременным угасанием функции яичников.
Другие причины бесплодия включают гиперпролактинемию, которая приводит к низким уровням лютеинизирующего гормона (LH) и FSH, что приводит к нарушению ответа положительной обратной связи секреции гонадотропного гормона, вызванной эстрогенами; гипотиреоз, который приводит к гиперпролактинемии; гипоталамо-гипофизарную дисфункцию, вызванную сниженным количеством телесного жира вследствие чрезмерной потери массы тела из-за интенсивной физической нагрузки, пищевых расстройств или опухолей; дефекты фазы лютеинизации (недостаточная продукция прогестерона яичником или слабый ответ матки на прогестерон) и андрогенизацию, например синдром поликистоза яичников (PCOS). PCOS характеризуют расстройства менструации (олигоменорея или дисфункциональное маточное кровотечение), усиленный рост волос по мужскому типу (гирсутизм), акне, алопеция, ожирение и бесплодие (Blankstein et al., Infertility, 1998; 83: 97-102).
Кроме того, дополнительные причины ановуляции включают синдром резистентных яичников, аутоиммунный оофорит и преждевременное угасание функции яичников. Синдром резистентных яичников характеризуют аменорея, эндогенная гипергонадотропинемия и резистентность к экзогенным гонадотропинам. Гистологически развивающиеся фолликулы почти полностью отсутствуют. Точная причина неизвестна, и существует несколько теорий, включающих дефицит рецепторов FSH и LH в яичнике, присутствие антител к рецепторам гонадотропинов и пострецепторный дефект. Галактоземия нередко сопровождает синдром резистентных яичников и может быть причинным фактором. Аутоиммунный оофорит характеризуется воспалением яичников, приводящим к их деструкции, атрофии и фиброзу с потерей фертильности и гормональной продукции яичников. В 10 процентах случаев это ведет к преждевременному угасанию функции яичников (POF). Женщины с POF имеют преждевременную менопаузу в возрасте до 40 лет.
В заключение, особенности образа жизни, такие как употребление крепких алкогольных напитков и/или кофеина, курение или применение запрещенных лекарственных средств, также связаны со сниженной фертильностью.
Бесплодие обычно лечат агентами, индуцирующими овуляцию, называемыми обычно лекарственными средствами от бесплодия. Типичные агенты, индуцирующие овуляцию, включают менопаузальные гонадотропные гормоны человека (hMG), хорионический гонадотропный гормон человека (hCG), кломифен, FSH, лютеинизирующий гормон (LH), гонадолиберин (GnRH), их аналоги и комбинации вышеупомянутого (Derman et al., Drug Safety, 1994; 11: 408-21). Эти лекарственные средства действуют посредством различных механизмов в зависимости от причины или предполагаемой причины бесплодия. Например, бромокриптин, агонист дофамина, снижает секрецию пролактина у женщин с гиперпролактинемией, в то время как другие агенты, такие как кломифен, увеличивают продукцию FSH.
В дополнение, экстракорпоральное оплодотворение (IVF) обычно используют при всех видах бесплодия. IVF включает процесс, при котором зрелые яйцеклетки забирают из яичников, оплодотворяют семенной жидкостью в лабораторной посуде и затем в течение нескольких дней полученные эмбрионы имплантируют в матку. Перед забором яйцеклетки яичники стимулируют, используя лекарственные средства от бесплодия, такие как Pergonal® (hMG) или Metrodin® (комбинация FSH и LH). Некоторые разновидности IVF включают перенос гамет в маточные трубы (GIFT), перенос зигот в маточные трубы (ZIFT), внутрицитоплазматическую инъекцию сперматозоида (ICSI) и внутриматочное осеменение. В последнем случае очищенную фракцию высоко подвижных сперматозоидов помещают в шейку или высоко в полость матки после гиперстимуляции яичников (также известной как «контролируемая стимуляция яичников» или «индукция овуляции») лекарственными средствами от бесплодия. Дефекты фазы лютеинизации с большей вероятностью происходят при более высоких уровнях эстрогенов, продуцированных во время индукции овуляции, либо самой по себе, либо с IVF-методиками.
Синдром гиперстимуляции яичников
Синдром гиперстимуляции яичников (OHSS) представляет собой осложнение овариальной индукционной терапии, включающей применение гонадотропных гормонов, таких как hCG, во время лечения бесплодия или перед IVF и родственных процедур. По клиническим и сонографическим критериям могут быть выделены три степени OHSS. Легкий OHSS связан с легким желудочно-кишечным дискомфортом, включая диарею, и яичники при сонографическом обследовании обычно меньше 5 см в диаметре. При умеренном OHSS яичники имеют размеры от 5 до 10 см, и при тяжелой форме яичники превышают 10 см в диаметре. Тяжелый OHSS характеризуется присутствием свободной внутрибрюшинной жидкости (асцит) из-за повышенной сосудистой проницаемости. Также описаны плевральные выпоты, гипотензия и олигоурия. У пациента могут быть жидкостные и электролитные нарушения и повышенный риск перекрута увеличенных яичников. Тяжелый OHSS встречается менее чем у 2% пациентов.
Гипотензия вызвана экстравазацией богатой белками жидкости и сокращением сосудистого объема, олигоурия/анурия вызвана сниженным кровоснабжением почек из-за сниженного сосудистого объема и/или напряженного асцита, легочные признаки вызваны поднятой диафрагмой и/или гидротораксом. Риск тромбоэмболии увеличивается в результате гемоконцентрации, сниженного периферического кровотока и обездвиженности из-за вздутия живота и боли. Жизнеугрожающие осложнения OHSS включают почечную недостаточность, респираторный дистресс-синдром взрослых (ARDS), кровотечение из разрыва яичника и тромбоэмболию.
Сонографические и лабораторные данные помогают предсказать, у каких пациентов наиболее вероятно развитие. Уровни эстрадиола представляют собой наиболее точный индикатор. Уровень 4000-6000 пг/мл или более во время введения hCG коррелирует с более высоким риском развития синдрома. В дополнение, развитие в яичнике более чем восьми фолликулов также коррелирует с повышенным риском развития OHSS. Другие факторы риска OHSS включают следующие факторы, независимо увеличивающие риск развития синдрома гиперстимуляции яичников (OHSS): молодой возраст, малая масса тела, синдром поликистоза яичников (PCOS), высокие дозы экзогенных гонадотропных гормонов, высокие абсолютные или быстро возрастающие уровни эстрадиола сыворотки и предшествующие эпизоды OHSS.
Лечение и профилактика. Лечение легкого OHSS обычно представляет собой применение пероральных анальгетиков и воздержание. При умеренном OHSS лечение состоит из более мощных анальгетиков, противорвотных средств и частого мониторинга, например, регулярными сонограммами, ежедневным мониторингом массы тела и частыми серийными лабораторными определениями гематокрита, электролитов и креатинина сыворотки. В дополнение, следует ограничить прием жидкости и интенсивную физическую нагрузку. Госпитализация обычно необходима для мониторинга и лечения пациентов с тяжелым OHSS.
Для тех, у кого предполагают высокий риск OHSS, в лечении бесплодия оправдано снижение доз hCG примерно на половину. В дополнение, последующее добавление прогестерона, в противоположность добавлению hCG, может также снизить риск OHSS. Внутривенное введение альбумина (25%) также применяют при повышенных уровнях эстрадиола или при наличии в анамнезе предшествующего OHSS, хотя исследования эффективности этого противоречивы и лечение альбумином представляет собой риск усиления асцита, аллергических реакций и передачи вирусов/прионов.
Хотя причиной OHSS в первую очередь является индукция овуляции во время лечения бесплодия, также было сообщено об OHSS у пациентов с мутациями гена фолликулостимулирующего гормона (FSH) (Smits et al., New Engl. J. Med. 2003; Volume 349: 760-66).
В заключение, в этой области остается потребность в эффективных способах лечения для профилактики и лечения OHSS.
Краткое изложение сущности изобретения
Согласно настоящему изобретению предложен способ профилактики синдрома гиперстимуляции яичников, включающий введение субъекту, проходящему лечение от бесплодия гонадотропным гормоном, эффективного количества агониста дофамина в фармацевтически приемлемом носителе.
В другом воплощении лечение от бесплодия представляет собой часть процедуры, такой как экстракорпоральное оплодотворение (IVF), внутрицитоплазматическая инъекция сперматозоида (ICSI), перенос гамет в маточные трубы (GIFT), перенос зигот в маточные трубы (ZIFT) и внутриматочное осеменение во время контролируемой стимуляции яичников или индукции овуляции.
Типичные дофаминовые агонисты, предполагаемые для профилактики по настоящему изобретению, включают хинаголид (Norprolac®), перголид (Permax®), каберголин (Dostinex®), прамипексол (Mirapex®), ропинирол (Requip®), талипексол и бромокриптин (Parlodel®).
В предпочтительном воплощении агонист дофамина представляет собой хинаголид (Norprolac®), каберголин (Dostinex®) или бромокриптин (Parlodel®), более предпочтительно хинаголид (Norprolac®).
В другом воплощении где расстройство представляет собой андрогенизацию, агонист дофамина не представляет собой каберголин (Dostinex®).
В одном воплощении доза хинаголида (Norprolac®), применяемая для профилактики OHSS, составляет примерно от 0,025 до 0,6 мг/сутки, предпочтительно от 0,05 до 0,3 мг/сутки.
В другом воплощении доза каберголина (Dostinex®), применяемая для профилактики OHSS, составляет примерно от 0,05 до 1,0 мг/сутки, предпочтительно примерно 0,5 мг/сутки.
В третьем воплощении доза бромокриптина (Parlodel®), применяемая для профилактики OHSS, составляет от примерно 5,0 мг/сутки до примерно 25 мг/сутки.
В одном воплощении агонист дофамина вводят во время контролируемой стимуляции яичников (гонадотропными гормонами или другими агентами) и перед стимуляцией окончательного созревания/овуляции гонадотропным гормоном.
В другом воплощении агонист дофамина вводят перед стимуляцией окончательной овуляции путем введения хорионического гонадотропного гормона человека.
В другом воплощении агонист дофамина вводят начиная со дня введения хорионического гонадотропного гормона человека.
В альтернативном воплощении агонист дофамина вводят перед введением хорионического гонадотропного гормона человека.
В еще одном воплощении агонист дофамина вводят в течение от примерно 5 до примерно 48 суток, предпочтительно от примерно 7 до примерно 28 суток.
В еще одном воплощении агонист дофамина вводят в течение от примерно 5 до примерно 48 суток после введения гонадотропного гормона для стимуляции яичников, предпочтительно от примерно 7 до примерно 28 суток после введения гонадотропного гормона для стимуляции яичников.
В альтернативном воплощении агонист дофамина вводят на протяжении периода от примерно 5 до примерно 48 суток после начала введения гонадотропного гормона для стимуляции яичников, предпочтительно от примерно 7 до примерно 28 суток после начала введения гонадотропного гормона для стимуляции яичников.
В альтернативном воплощении агонист дофамина вводят начиная со дня введения гонадотропного гормона и вводят в течение по меньшей мере примерно от 6 до 8 дней.
В альтернативном воплощении агонист дофамина вводят начиная со дня введения гонадотропного гормона и вводят в течение примерно от 6 до 8 дней.
В другом воплощении агонист дофамина каберголин вводят в течение примерно от 6 до 8 дней после введения гонадотропного гормона человека.
Согласно настоящему изобретению также предложен способ лечения синдрома гиперстимуляции яичников, включающий введение субъекту, нуждающемуся в таком лечении, эффективного для лечения синдрома гиперстимуляции яичников количества агониста дофамина в фармацевтически приемлемом носителе.
В одном воплощении синдром гиперстимуляции яичников связан с введением гонадотропного гормона.
В другом воплощении синдром гиперстимуляции яичников является идиопатическим.
В другом воплощении синдром гиперстимуляции яичников связан с беременностью.
В другом воплощении синдром гиперстимуляции яичников является от умеренного до тяжелого, и субъект может быть госпитализирован.
Агонисты дофамина предполагаемые для лечения, включают хинаголид (Norprolac®), перголид (Permax®), каберголин (Dostinex®), прамипексол (Mirapex®), ропинирол (Requip®), талипексол и бромокриптин (Parlodel®).
В предпочтительном воплощении агонист дофамина представляет собой хинаголид (Norprolac®), каберголин (Dostinex®) или бромокриптин (Parlodel®), более предпочтительно хинаголид (Norprolac®).
В другом воплощении агонист дофамина, предполагаемый для лечения OHSS, исключает бромокриптин (Parlodel®) при использовании в качестве монотерапии.
По одному воплощению доза хинаголида (Norprolac®) для лечения OHSS представляет собой дозу от примерно 0,025 мг/сутки до примерно 0,6 мг/сутки, предпочтительно от примерно 0,05 до примерно 0,3 мг/сутки.
В другом воплощении доза каберголина (Dostinex®), применяемая для лечения OHSS, составляет примерно от 0,07 до 1,0 мг/сутки, предпочтительно примерно 0,5 мг/сутки.
В другом воплощении доза бромокриптина (Parlodel®) составляет примерно от 5,0 до 100 мг/сутки, предпочтительно примерно 75 мг/сутки при тяжелом OHSS.
В другом воплощении агонист дофамина вводят перед введением хорионического гонадотропного гормона человека.
В еще одном воплощении для лечения OHSS агонист дофамина вводят на протяжении периода от примерно 1 суток до примерно 28 суток, предпочтительно от примерно 7 до примерно 14 суток, или до ослабления или устранения симптомов. Начало лечения начинают, когда начинают проявляться симптомы или признаки OHSS.
Краткое описание графических материалов
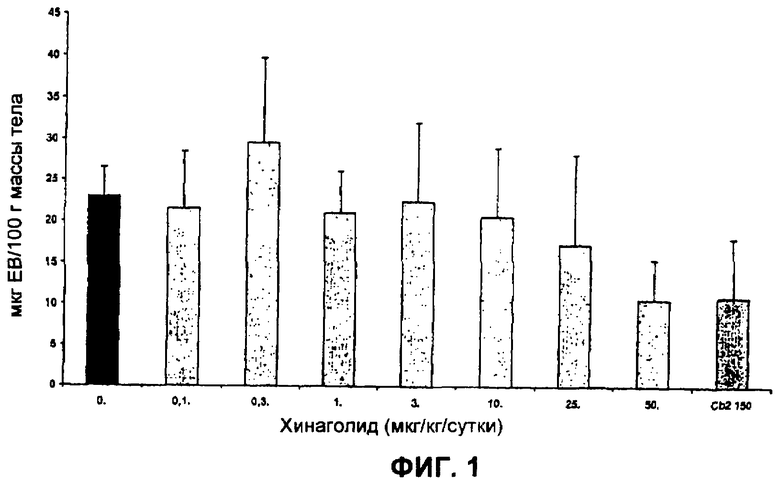
На Фиг.1 представлена диаграмма, изображающая результаты первого анализа эффекта хинаголида на сосудистую проницаемость (VP) у крыс с OHSS. Сосудистая проницаемость выражена как мкг экстравазированного красителя Evans Blue на 100 г массы тела у каждого животного.
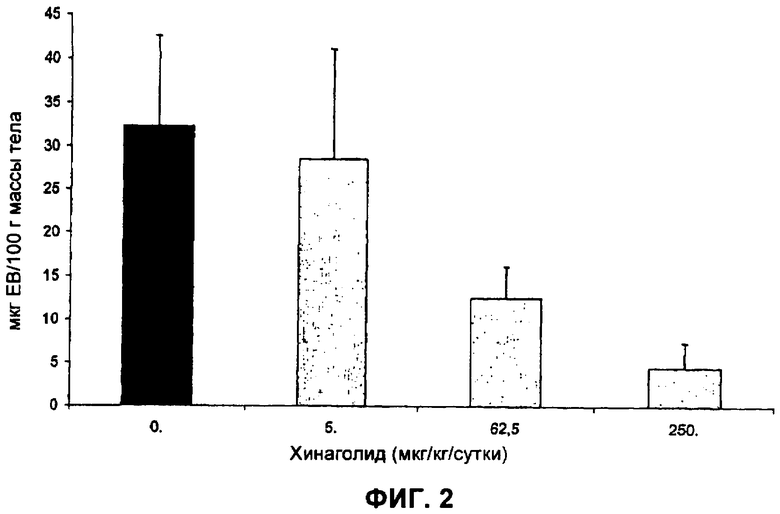
На Фиг.2 представлена диаграмма, изображающая результаты второго анализа эффекта хинаголида на VP у крыс с OHSS. Сосудистая проницаемость выражена как мкг экстравазированного красителя Evans Blue на 100 г массы тела у каждого животного.
Подробное описание
Настоящее изобретение частично основано на открытии того, что сосудистый эндотелиальный фактор роста (VEGF), проангиогенный цитокин, вовлечен в патогенез OHSS и что нейротрансмиттер дофамин может регулировать активность VEGF.
Сосудистый эндотелиальный фактор роста и OHSS
Главным признаком, связанным с увеличенной сосудистой проницаемостью, имеющей место при развитии OHSS, принято считать существование вазоактивной молекулы, высвобождаемой в ответ на hCG, и сосудистый эндотелиальный фактор роста (VEGF) является главным кандидатом в качестве медиатора hCG (Gomez et al., Endocrinology. 2002; 143. 4339-4348). Эксперименты на животных моделях продемонстрировали, что сосудистая проницаемость увеличивается от 2 до примерно 96 часов после введения hCG крысам, предварительно пролеченным индуцирующим овуляцию агентом (гонадотропином из сыворотки жеребой кобылы; PMSG) (Gomez et al., выше). В дополнение, увеличение накопления асцита в брюшинной полости у более чем 80% крыс из группы OHSS наблюдали на 48 и 96 часах после hCG. Увеличение сосудистой проницаемости было связано с сопутствующим увеличением экспрессии матричной рибонуклеиновой кислоты (мРНК) VEGF зернистыми и эндотелиальными клетками яичника. Овариальная экспрессия рецептора 2 типа VEGF (VEGF-R2) также возрастала после 48 часов и коррелировала с увеличенной экспрессией мRNA VEGF во время максимальной сосудистой проницаемости. Также было показано, что блокирование VEGF-R2 антителом (SU5416) вызывало реверсию сосудистой проницаемости к нормальным уровням.
В международных заявках согласно РСТ WO 2004/041164 и WO 2003/3092595, принадлежащих Merck & Co., описаны новые ингибиторы тирозинкиназ, которые могут быть применены для ингибирования фосфорилирования рецепторных тирозинкиназ, включая рецепторы VEGF. В этих заявках также раскрыто, что новые ингибиторы тирозинкиназ могут быть применены сами по себе или в комбинации со стимуляторами овуляции, такими как бромокриптин и гормоны беременности для лечения или профилактики OHSS.
Тем не менее, в исследованиях на онколитических моделях было показано, что антиангиогенные, то есть анти-VEGF, соединения, включая SU5416, не могут быть применены из-за серьезных токсических эффектов. Более того, экспрессия VEGF важна для роста и развития эндометрия на развивающихся стадиях менструального цикла. Экспрессия VEGF была специально соотнесена с имплантацией эмбриона (Welter et al., Exp Clin Endocrinol Diabetes, 2003; 111(1): 33-40). Эндометрий развивает новые капилляры из микрососудов, существующих до имплантации, и ненадлежащая васкуляризация эндометрия может вызвать нарушение имплантации и бесплодие. Соответственно, применение ингибиторов VEGF или VEGF-R2 для лечения или профилактики OHSS во время лечения бесплодия будет также иметь противопоказание предотвращения беременности.
Дофамин и рецепторы VEGF
Недавно было показано, что фармакологические дозы дофамина, воздействуя через дофаминовые рецепторы D2, могут ингибировать опосредованные VEGF микрососудистую проницаемость, пролиферацию и миграцию эндотелиальных клеток in vitro, вызывая эндоцитоз VEGF-R2 (Basu et al., Nat Med. 2001, May; 7(5): 569-74). Это было также продемонстрировано in vivo в моделях у мышей с истощенными запасами дофамина и нокаутных по D2-рецептору (Sarkar et al., Am J Physiol Heart Circ Physiol. 2004; 287: H 1554-60). В этих мышиных моделях вызванное VEGF фосфорилирование VEGF-R2, киназы фокальной адгезии и митоген-активируемой протеинкиназы (МАРK) в эндотелиальных клетках было значительно увеличено по сравнению с контролем. Это наводит на мысль, что эндогенный дофамин регулирует сигнальные каскады, необходимые для эндотелиальных функций VEGF in vivo.
Дофамин и гиперпролактинемия
В дополнение к вышеупомянутым эффектам на VEGF-R2, дофамин также контролирует секрецию пролактина. Пролактин представляет собой гормон, секретируемый гипофизом, секреция которого находится под тоническим ингибиторным контролем дофамина, который действует через рецепторы D2-типа, расположенные на лактотрофах гипофиза. Основной функцией пролактина является стимуляция пролиферации эпителиальных клеток грудных желез и индукция продукции молока. Избыточное образование пролактина, называемое гиперпролактинемия, является патологическим и связано со сниженной фертильностью, бесплодием, расстройствами менструации и утратой половой функции и продукции грудного молока.
Гиперпролактинемия может быть идиопатической, но также связана с расстройствами, такими как синдром поликистоза яичников (PCOS) и аденомы гипофиза. В одном исследовании у женщин с PCOS и гиперпролактинемией было показано, что введение агониста дофамина каберголина для снижения пролактина также снижало риск OHSS во время овариальной индукции агонистом гонадолиберина (GnRH), фолликулостимулирующим гормоном (FSH) и hCG (Papaleo et al., Human Reproduction, 2001; 16: 2263-2266). В двух других случаях представлены пациенты с аденомами гипофиза и OHSS (Murata et al., J. Clin. Endocrin. And Metabol. 2003; 88: 1988-93; Shimon et at., J. Clin. Endocrin. And Metabol. 2001; 86: 3635-40). В первом случае у пациентов были увеличенные поликистозные яичники и повышенные уровни эстрадиола сыворотки. Ежедневное введение 5 мг/сутки агониста дофамина бромокриптина нормализовало размер яичников и снижало уровни эстрадиола до нормальных пределов. Вскоре после этого пациента подвергали хирургическому вмешательству для удаления аденомы.
Во втором случае аденома гипофиза была связана с увеличенными яичниками, повышенными фолликулостимулирующим гормоном и пролактином, но не с повышенным эстрадиолом. Лечение агонистом дофамина каберголином, 0,5 мг дважды в неделю в течение трех недель, нормализовало уровни пролактина. Вскоре после этого этого пациента также подвергали хирургическому вмешательству для удаления аденомы.
В заключение, также было показано, что дофамин вызывает расширение сосудов почек и диурез. В одном исследовании докарпамин, пероральное пролекарство дофамина, вводили 27 пациентам с резистентным к лечению OHSS (Tsunoda et al., Gynecol Endocrinol. 2003; 17: 281-6). У некоторых женщин диурез был увеличен, и асцит был уменьшен.
Агонисты дофамина в профилактике и лечении OHSS
Согласно настоящему изобретению предложен способ лечения или профилактики OHSS у женщин, проходящих лечение от бесплодия гонадотропными гормонами, путем введения эффективного количества агониста дофамина. Агонисты дофамина могут быть безопасно введены в фазе лютеинизации и на ранних сроках беременности без отрицательных воздействий. Ожидают, что понижающая регуляция VEGF-R2 посредством эндоцитоза рецептора уменьшит патологически увеличенную сосудистую проницаемость, связанную с OHSS.
Агонисты дофамина применяют в первую очередь для лечения болезни Паркинсона из-за их нейропротективных эффектов на дофаминергические нейроны. Типичные агонисты дофамина, предполагаемые для применения по настоящему изобретению, включают, но не ограничены каберголином, бромокриптином, перголидом, талипексолом, ропиниролом и прамипексолом. Каберголин (Dostinex®) представляет собой длительно действующий агонист, производное спорыньи, с высоким сродством к D2-рецепторам. Бромокриптин (Parlodel®) представляет собой алкалоид спорыньи, агонист рецепторов дофамина. Он представляет собой сильный агонист D2-рецепторов и слабый антагонист D1-рецепторов. Он стимулирует как пресинаптические, так и постсинаптические рецепторы. Перголид (Permax®) представляет собой полусинтетическое производное спорыньи, агонист дофамина. В противоположность бромокриптину, он представляет собой сильный агонист D2-рецепторов и слабый агонист D1-рецепторов. Ропинирол (Requip®) представляет собой мощный неэрголиновый агонист дофамина. Прамипексол (Mirapex®) представляет собой синтетическое производное аминобензотиазола и D2/D3 агонист, не являющийся производным спорыньи.
Хинаголид (1-пропилбензо[g]хинолин-3-ил; Norprolac®; ранее CV 205-502) представляет собой другой, не являющийся производным спорыньи, неэрголиновый, бензохинолиновый дофаминергический агонист, блокирующий высвобождение пролактина. Он описан в заявке на европейский патент ЕР 0077754 и US 4565818 (Nordmann et al.). В настоящее время он показан для лечения гиперпролактинемии, особенно той, которая связана с опухолями гипофиза. Поддерживающая доза изменяется от пациента к пациенту. Хинаголид принимают один раз в день, вечером, обычно в дозе 50-150 микрограмм (0,05-0,15 миллиграмм) и редко до 300 микрограмм.
Определения
«Агонист дофамина» относится к любому соединению, конкурирующему с дофамином за связывание с D2-рецептором дофамина. Типичные агонисты дофамина включают, но не ограничены теми, которые раскрыты выше, то есть каберголином, бромокриптином, перголидом, талипексолом, ропиниролом и прамипексолом. В одном воплощении агонист дофамина вызывает рецепторный эндоцитоз VEGF-R2. В предпочтительном воплощении агонист дофамина представляет собой хинаголид.
Термин «агонист дофамина» также включает различные соли и изомеры (включая стереоизомеры и энантиомеры) агонистов дофамина. Термин «соли» может включать соли присоединения кислот или соли присоединения свободных оснований. Примеры кислот, которые могут быть применены для образования фармацевтически приемлемых солей присоединения кислот, включают неорганические кислоты, такие как соляная, серная или фосфорная кислоты, и органические кислоты, такие как уксусная, малеиновая, янтарная или лимонная кислоты и так далее. Все эти соли (или другие похожие соли) могут быть получены обычным способом. Природа соли не имеет решающего значения при условии, что она является нетоксичной и существенно не препятствует желаемой фармакологической активности.
«Бесплодие» относится к неспособности женщины к зачатию при незащищенном половом контакте на протяжении по меньшей мере одного года. Бесплодие включает, но не ограничено хронической ановуляцией, вызванной любым из следующего: гипоэстрогенным гипогонадизмом, гипергонадотропным гипогонадизмом, сниженным телесным жиром, повышенным стрессом или тревожностью, гипоталамической дисфункцией, гипотиреозом, гиперпролактинемией, андрогенизацией (синдромом поликистоза яичников), дефектами фазы лютеинизации, опухолями гипофиза или надпочечника, первичным угасанием функции яичников, синдромом резистентных яичников, аутоиммунным оофоритом и идиопатическим бесплодием. Эти расстройства описаны выше более подробно. Другие причины бесплодия включают чрезмерное употребление алкоголя или кофеина, курение или применение запрещенных лекарственных средств.
«Лечение бесплодия» включает, но не ограничено введением лекарственных средств от бесплодия для стимуляции яичников или введением лекарственных средств от бесплодия перед или во время экстракорпорального оплодотворения (IVF), переноса гамет в маточные трубы (GIFT), переноса зигот в маточные трубы (ZIFT) и внутриматочного осеменения.
«Лекарственные средства от бесплодия» включают, но не ограничены кломифеном (Clomid®), стимулирующим секрецию FSH и LH, прогестероном (Crinone®, Prometrium®), GnRH (Factrel®, Lutrepulse®), GnRH-агонистами (Lupron®, Sinarel®, Zoladex®) и ацетатом леупролида (Lupron®). Другие лекарственные средства от бесплодия включают рекомбинантные или очищенные hMG (комбинация LH и FSH; Pergonal®, Humegon®, Repronex®), hCG (Profasi®, Pregnyl®, Novarel®), FSH (урофоллитропин; Fertinex®, Follistim®, Gonal-F®, Metrodin®) и LH. hMG, hCG, LH и FSH называют «гонадотропными гормонами».
Фраза «фармацевтически приемлемый», как применено в связи с композициями агонистов дофамина, относится к молекулярным объектам и другим ингредиентам таких композиций, которые физиологически переносимы и обычно не вызывают нежелательных реакций (токсичности или побочных эффектов) при их введении млекопитающему (например, человеку). Предпочтительно, при использовании здесь термин «фармацевтически приемлемый» означает одобренный контрольным органом федерального правительства или правительства штата или зарегистрированный в фармакопее США или другой общепризнанной фармакопее для применения у млекопитающих, конкретнее у людей.
Термин «носитель», примененный к фармацевтическим композициям по изобретению, относится к разбавителю, эксципиенту или наполнителю, с которым вводят активное соединение (например, производное 1-аминоциклогексана). Такие фармацевтические носители могут представлять собой стерильные жидкости, такие как вода, солевые растворы, водные растворы D-глюкозы, водные растворы глицерина, и масла, включая минеральное, животное, растительное или из синтетического источника, такие как арахисовое масло, соевое масло, минеральное масло, кунжутное масло и так далее. Подходящие фармацевтические носители описаны в "Remington's Pharmaceutical Sciences", E.V. Martin, 18th Edition.
Термин «пациент» или «субъект, нуждающийся в этом», как применено здесь, относится к млекопитающему. В частности, термин относится к людям с риском развития OHSS или диагностированным OHSS. Диагноз OHSS поставлен квалифицированным врачом в рамках его компетенции с применением стандартных критериев, которые включают, но не ограничены повышенной сосудистой проницаемостью, увеличенным размером яичников, наличием асцита и повышенным эстрадиолом после введения hCG.
Термин «лечить» применен здесь в значении уменьшать или облегчать по меньшей мере один симптом заболевания у субъекта. Например, относительно OHSS термин «лечить» может обозначать улучшение, или уменьшение, или реверсирование, или снижение по меньшей мере одного из следующего: увеличенный размер яичников, внутрибрюшинный асцит, плевральные выпоты, гипотензия, олигоурия, жидкостные и электролитные расстройства, сниженный периферический кровоток и обездвиженность из-за вздутия живота и боли.
В пределах значения настоящего изобретения термин «лечить» также обозначает замедлить прогрессирование заболевания у пациентов с вышеупомянутыми симптомами или другими факторами риска, связанными с OHSS.
Термины «предотвратить или профилактика» обозначают профилактическое применение агониста дофамина для предотвращения явлений или симптомов, связанных с OHSS. В конкретном воплощении этот термин обозначает предотвращение повышения сосудистой проницаемости после введения гонадотрпопного гормона.
Термин «терапевтически эффективное количество» использован здесь для обозначения количества или дозы агониста дофамина для улучшения, замедления или предотвращения у субъекта симптома или явления, связанного с OHSS. Альтернативно, терапевтически эффективное количество представляет собой такое количество, которого достаточно, чтобы вызвать улучшение в клинически значимом состоянии или параметре (согласно лечащему врачу, применяющему один или более из вышеупомянутых наборов критериев), связанном с OHSS, у индивида, нуждающегося в этом.
«Отвечающий организм» представляет собой субъект, у которого предотвращают, замедляют, улучшают OHSS или, иначе, улучшают проводимое лечение агонистом дофамина согласно способу по настоящему изобретению. Например, отвечающий организм представляет собой субъект с OHSS, у которого при введении эффективного количества агониста дофамина снижается сосудистая проницаемость.
Термин «примерно» и «приблизительно» обычно обозначает приемлемую степень ошибки или вариации измеренной величины, если даны сущность и погрешность измерений. Обычно степень ошибки или вариации находится в пределах 20 процентов (%), предпочтительно в пределах 10% и более предпочтительно в пределах 5% данного значения или диапазона значений. Численные величины, данные здесь, представляют собой приблизительные, если не указано иначе, обозначающие, что термин «примерно» или «приблизительно» можно подразумевать, если точно не указано.
Композиция, доза и введение
Упомянутые ниже агонисты дофамина для перорального введения имеются в продаже как следующие.
Хинаголида гидрохлорид (Norprolac®) - введение таблеток от гиперпролактинемии в начальной дозе 0,025 мг ежедневно в течение 3 дней с увеличением затем с трехдневными интервалами с шагом 0,025 мг до достижения оптимального ответа, который обычно находится в пределах от 0,75 до 1,50 мг ежедневно. Если необходимы дозы более 3,0 мг ежедневно, увеличения могут быть сделаны с шагом от 0,75 до 1,50 мг ежедневно с интервалами не менее чем 4 недели. Для лечения и профилактики OHSS предполагаемая доза составляет примерно 0,025-0,6 мг/сутки, предпочтительно от примерно 0,05 до примерно 0,3 мг/сутки.
Бромокриптина мезилат (Parlodel®) - введение таблеток или капсул в начальной дозе обычно примерно 2,5 мг/сутки в течение 1 недели, увеличиваемой до примерно 2,5 мг два раза в сутки для следующей недели до 8 недель. Тем не менее, были определены пределы эффективных доз как 1,25-20,0 мг/сутки. Для лечения и профилактики OHSS предполагают, что примерно от 5,0 мг до 25 мг/сутки бромокриптина будет эффективно для профилактики, предпочтительно примерно 25 мг/сутки, и примерно 75-100 мг/сутки будет эффективно для лечения тяжелого OHSS, предпочтительно примерно 75 мг/сутки. Дозы могут быть понижены при легком и умеренном OHSS, например, от примерно 25 мг/сутки до 75 мг/сутки.
Перголида мезилат (Permax®) - введение таблеток представляет собой однократную суточную дозу 0,05 мг в течение первых двух дней, постепенно увеличиваемую на от 0,1 до 0,15 мг/сутки каждый третий день в течение последующих 12 дней терапии. Доза затем может быть увеличена на 0,25 мг/сутки каждый третий день до достижения оптимальной терапевтической дозы, то есть примерно 3,0 мг/сутки; ожидают, что доза для лечения или профилактики OHSS ниже и может быть без труда определена специалистом.
Каберголин (Dostinex®) - введение таблеток для начала лечения гиперпролактинемии представляет собой 0,25 мг два раза в неделю. Доза может быть увеличена на 0,25 мг дважды еженедельно до дозы 1,0 мг дважды в неделю в соответствии с уровнем пролактина в сыворотке пациента. Для профилактики или лечения OHSS предполагаемая эффективная доза составляет примерно от 0,05 до 1,0 мг/сутки (то есть суммарная доза, вводимая в течение примерно 8 дней, подобна суточной дозе, необходимой для подавления лактации, которая составляет примерно 0,5 мг в сутки).
Талипексола гидрохлорид - введение таблеток от паркинсонизма в дозах примерно от 1,2 до 3,6 мг ежедневно в разделенных дозах через рот; ожидают, что доза для лечения или профилактики OHSS ниже и может быть без труда определена специалистом.
Прамипексола дигидрохлорида моногидрат (Mirapex®) - введение таблеток от паркинсонизма представляет собой начальную дозу прамипексола гидрохлорида 0,125 мг, вводимую три раза ежедневно, увеличиваемую до 0,250 мг три раза ежедневно на второй неделе и затем до 0,5 мг три раза ежедневно на третьей неделе в соответствии с ответом. Ожидают, что доза для лечения или профилактики OHSS ниже и может быть без труда определена специалистом.
Ропинирола гидрохлорид (Requip®) - введение таблеток от паркинсонизма в начальной суточной дозе примерно 0,75 мг в сутки, увеличиваемой с недельными интервалами с шагом 0,75 мг до достижения оптимального ответа, который обычно находится в пределах от 3 до 9 мг ежедневно. Суточная доза не должна превышать 24 мг. Ожидают, что доза для лечения или профилактики OHSS ниже и может быть без труда определена специалистом.
Тем не менее, для любого агониста дофамина, применяемого в способе по изобретению, терапевтически эффективная доза может быть первоначально оценена на животных моделях для достижения области концентраций в циркулирующей плазме, включающей IC50 (например, концентрацию тестируемого соединения, при которой достигают половины максимальной секреции соответствующего гормона). Кривые доза-ответ, полученные на животных системах, затем применяют для определения пробных доз для первоначальных клинических исследований у людей. В исследованиях безопасности каждой композиции доза и кратность введения должны соответствовать или превосходить те, которые предполагают для применения в клиническом исследовании.
Другие факторы, которые следует учитывать, представляют собой процедуру определения доз, характеристики пациента или животного-субъекта, такие как возраст, масса тела, чувствительность, период дозирования, лекарственные средства, применяемые в комбинации, серьезность заболевания. Подходящая доза и время дозирования при конкретных условиях могут быть определены тестом, основанным на вышеописанных показателях, но могут быть уточнены и в конечном счете определены в соответствии с мнением практикующего врача и подробностями каждого пациента (возрастом, общим состоянием, тяжестью симптомов и так далее) по стандартным клиническим методикам.
Токсичность и терапевтическая эффективность композиций по изобретению могут быть определены стандартными фармацевтическими методиками у экспериментальных животных, например определением LD50 (дозы, летальной для 50% популяции) и ED50 (дозы, терапевтически эффективной у 50% популяции). Отношение доз между терапевтическими и токсическими эффектами представляет собой терапевтический индекс и может быть выражено как отношение ED50/LD50. Предпочтительны композиции, обнаруживающие большие терапевтические индексы.
Согласно настоящему изобретению фармацевтическая композиция по изобретению, например агонист дофамина, могут быть введены парентерально, через слизистые, перорально (per os), назально, или ректально, или трансдермально. Парентеральные способы включают внутривенное, внутриартериолярное, внутримышечное, внутрикожное, подкожное, внутрибрюшинное, внутрижелудочковое и внутричерепное введение.
Согласно настоящему изобретению лекарственная форма агониста дофамина может представлять собой твердую, полутвердую или жидкую композицию для перорального введения. Приготовление агониста дофамина в полутвердой или жидкой форме известно специалистам в данной области. Обычно активное вещество, например агонист дофамина, составляет от 0,1 до 99% по массе композиции, конкретнее от 0,5 до 20% по массе композиции, предназначенной для инъекции, и от 0,2 до 50% по массе композиции, подходящей для перорального введения.
Пероральные лекарственные формы хорошо известны в этой области техники и включают таблетки и капсулы, приготовленные обычным способом с фармацевтически приемлемыми эксципиентами, такими как связывающие агенты (например, пептизированный кукурузный крахмал, поливинилпирролидон или гидроксипропилметилцеллюлоза), наполнители (например, лактоза, микрокристаллическая целлюлоза или гидрофосфат кальция), смазывающие вещества (например, стеарат магния, тальк или диоксид кремния), разрыхляющие агенты (например, картофельный крахмал или крахмальный гликолят натрия) или смачивающие агенты (например, лаурилсульфат натрия). Таблетки могут быть покрыты способами, хорошо известными в этой области техники.
Жидкие препараты для перорального введения агониста дофамина могут иметь форму, например, растворов, сиропов или суспензий, или они могут быть представлены как сухой продукт для разведения водой или другим подходящим наполнителем перед применением. Такие жидкие препараты могут быть приготовлены обычным способом с фармацевтически приемлемыми добавками, такими как суспендирующие агенты (например, сорбитный сироп, производные целлюлозы или гидрогенизированные пищевые жиры), эмульгаторы (например, лецитин или аравийская камедь), неводные наполнители (например, миндальное масло, жирные сложные эфиры, этиловый спирт или фракционированные растительные масла) и консерванты (например, метил- или пропил-п-гидроксибензоаты или сорбиновая кислота). При необходимости препараты могут также содержать буферные соли, корригенты, красители и подсластители.
Препараты для перорального введения могут быть подходяще приготовлены для контролируемого высвобождения активного соединения.
Фармацевтические композиции агониста дофамина, подходящие для инъекционного применения, включают стерильные водные растворы (растворимые в воде), эмульсии в маслах (нерастворимые в воде) или дисперсии. Во всех случаях форма должна быть стерильной и должна быть текучей в той степени, при которой ее легко вводить с помощью шприца. Лекарственная форма должна быть стабильной в условиях производства и хранения и должна быть защищена от контаминирующего воздействия микроорганизмов, таких как бактерии и грибы. Носитель может представлять собой растворитель или дисперсную среду, содержащую, например, воду, этанол, полиол (например, глицерин, пропиленгликоль или полиэтиленгликоль, и тому подобное), их подходящие смеси и растительные масла. Надлежащая текучесть может быть поддержана, например, применением оболочки, такой как лецитин, поддержанием требуемого размера частиц в случае дисперсии и применением сурфактантов. Профилактика воздействия микроорганизмов может быть осуществлена различными антибактериальными и противогрибковыми агентами, например парабенами, хлорбутанолом, фенолом, сорбиновой кислотой и им подобными. Во многих случаях будет предпочтительно включить изотонические агенты, например сахара или хлорид натрия. Пролонгированное рассасывание инъекционных композиций может быть осуществлено применением в композициях агентов, замедляющих рассасывание, например моностеарата алюминия и желатина.
Стерильные инъекционные растворы приготавливают путем включения агониста дофамина в необходимое количество подходящего растворителя с различными из других ингредиентов, если требуется, с последующими фильтрацией и заключительной стерилизацией. В общем, дисперсии приготавливают включением различных стерилизованных активных ингредиентов в стерильный наполнитель, содержащий основную дисперсную среду и необходимые другие ингредиенты из тех, что перечислены выше. В случае стерильных порошков для приготовления стерильных инъекционных растворов предпочтительные способы приготовления представляют собой вакуумную сушку и методику лиофильной сушки, применяя которые, получают порошок активного ингредиента плюс любого желаемого дополнительного ингредиента из их растворов, стерильно профильтрованных ранее.
В дополнение к композициям, описанным выше, агонист дофамина может также быть приготовлен в виде депо-препарата. Такие длительно действующие композиции могут быть введены имплантацией (например, подкожно или внутримышечно) или внутримышечной инъекцией.
Для профилактики OHSS введение агониста дофамина может быть осуществлено по двум альтернативным схемам. В одном воплощении агонист дофамина вводят в течение контролируемой стимуляции яичников (гонадотропинами или другими агентами) и перед стимуляцией окончательного созревания/овуляции гонадотропным гормоном. В этом воплощении агонист дофамина вводят в течение от примерно 5 до примерно 48 суток, предпочтительно от примерно 7 до примерно 28 суток.
В альтернативном воплощении агонист дофамина вводят начиная со дня введения гонадотропного гормона и вводят в течение примерно от 6 до 8 суток.
Комбинированная терапия
Настоящее изобретение также предусматривает комбинации агонистов дофамина для лечения или профилактики OHSS. В одном воплощении комбинация предполагает подпороговые или субоптимальные дозы одного или обоих агонистов дофамина, вводимых в комбинации.
Термин «подпороговый», относящийся к количеству активного ингредиента, такого как агонист дофамина, обозначает количество. неадекватное для того, чтобы вызывать ответ, то есть количество, меньшее минимального эффективного количества. Термин «субоптимальный» в таком же контексте обозначает количество активного ингредиента, такого как агонист дофамина, которое вызывает ответ, но не в полной степени, которая была бы достигнута при использовании большего количества.
Указанная комбинация агонистов дофамина может быть также приготовлена как одиночная композиция или как две раздельные композиции, которые могут быть введены совместно.
Примеры
Настоящее изобретение описано далее посредством примеров, представленных ниже. Применение таких примеров является только иллюстративным и никоим образом не ограничивает объем и значение изобретения или какого-либо поясненного термина. Аналогично, изобретение не ограничено какими-либо конкретными предпочтительными воплощениями, описанными здесь. Безусловно, множество модификаций и вариаций изобретения будут очевидны специалистам при прочтении этого описания. Таким образом, изобретение следует ограничивать только по условиям приложенной формулы изобретения наряду с полным объемом эквивалентов, на которые дает право формула изобретения.
ПРИМЕР 1. Гены, позитивно и негативно регулируемые при OHSS, связанные с сосудистой проницаемостью, и применение бромокриптина для снижения сосудистой проницаемости, связанной с OHSS
С применением технологии микрочипа (Affymetrix, Inc. Santa Clara, CA), был изучена картина позитивной и негативной регуляции генов в яичниках контрольных гиперстимулированных крыс и крыс с OHSS.
Методы
Лекарственная терапия. Использовали неполовозрелых самок крыс Wistar. В группе OHSS (n=8) вводили 10 международных единиц (МЕ)/сутки гонадотропного гормона из сыворотки жеребой кобылы (PMSG) в течение 4 дней с последующим введением hCG (30 ME) на 5 день. В легкой группе (то есть в группе стимуляции яичников) (n=8) 10 ME PMSG вводили с последующим введением через 2 дня 10 ME hCG. В контрольной группе 1 ME PMSG вводили с последующим введением через 48 часов 1 ME hCG.
Измерение сосудистой проницаемости. Сосудистую проницаемость измеряли через 48 часов после введения hCG. 0,2 мл 5 мМ красителя Evans Blue инъецировали через бедренную вену. Через 30 минут полость брюшины промывали физиологическим раствором. В извлекаемой жидкости измеряли поглощение света при 595 нм и сосудистую проницаемость выражали как мкг Evans Blue/100 г массы тела.
Измерение экспрессии генов. Из яичников извлекали мРНК для применения в анализе экспрессии генов с применением микрочипа, содержащего примерно 14000 генов. Гены, которые были позитивно или негативно регулируемыми по меньшей мере трехкратно, рассматривали как значительно пораженные. Подтверждения экспрессии генов достигали количественной флуоресцентной полимеразной цепной реакцией (PCR) в термоциклере ABIPRISM 7700 для амплификации 3 позитивно регулируемых и 3 негативно регулируемых генов. Дополнительное подтверждение осуществляли, применяя иммунное окрашивание по обычным схемам и применяя групповой анализ. Последний осуществляли обратной транскрипцией РНК и переносом на нейлоновые фильтры в радиоактивных условиях. Группы 5×5 точечных сигналов анализировали, применяя программное обеспечение AIDA, и их экспрессию располагали парами с другими группами после фоновой субтракции сигнала.
Во второй серии экспериментов различные дозы бромокриптина вводили в группе крыс, у которых вызывали развитие OHSS 40 ME PMSG с последующим введением 30 ME hCG. 1,6, 4,0, 10,0 и 25,0 мг/кг бромокриптина вводили внутрибрюшинно в день введения hCG и через 24 часа. VP измеряли через 48 часов после введения hCG.
Результаты
Экспрессия генов. Экспрессия генов в трех группах в первых экспериментах показала 80 позитивно регулируемых и 7 негативно регулируемых генов при OHSS в сравнении с легкой и контрольной группами. Позитивно регулируемые гены были сгруппированы в пять семейств следующим образом: синтез холестерина, сигнальная трансдукция VEGF, синтез простагландинов, окислительный стресс и синтез пролактина. Тирозингидроксилаза (ТН), скорость-лимитирующий фермент, необходимый для продукции дофамина, представляла собой интересующий первично негативно регулируемый в яичниках ген при OHSS. Конкретно, ТН катализирует превращение L-тирозина в L-дофамин.
Лечение бромокриптином. Животные с OHSS из начального эксперимента демонстрировали увеличенную сосудистую проницаемость (30,7±5,8 мкг Evans Blue/100 г массы тела). Она была снижена при лечении 1,6 мг бромокриптина (15,3±3,3; р=0,04), 4 мг бромокриптина (14,2±2,2; р=0,04), 10 мг бромокриптина (10,1±2,6; р=0,009) и 25 мг бромокриптина (8,0±1,9; р=0,001).
Эти результаты, в особенности позитивная и негативная регуляция генов, вовлеченных в экспрессию VEGF, пролактина и дофамина, поддерживают применение бромокриптина для профилактики патологических увеличений сосудистой проницаемости и применение для профилактики/лечения OHSS. Ожидают, что у других агонистов дофамина будут похожие эффекты в отношении VEGF, и, таким образом, они также будут полезны для профилактики и лечения OHSS.
ПРИМЕР 2. Профилактика или лечение OHSS с применением хинаголида (Norprolac®)
Для профилактики OHSS у пациентов, проходящих лечение от бесплодия или IVF, включающие введение гонадотропных гормонов, ожидают, что введение агониста дофамина хинаголида предотвратит увеличение сосудистой проницаемости. Без ограничения конкретным механизмом ожидают, что это произойдет в результате связывания хинаголида с дофаминовыми рецепторами D2, приводящего к интернализации VEGF-R2, предотвращающего, таким образом, связывание VEGF-A с VEGF-R2 и фосфорилирование VEGF-R2.
Доза и введение. Хинаголид можно давать перорально в течение примерно 8-дневного курса начиная со дня введения hCG для лечения бесплодия или IVF. Доза должна составлять примерно 0,025-0,6 мг/сутки, предпочтительно от примерно 0,05 до примерно 0,3 мг/сутки (то есть доза, близкая к той, которая необходима для подавления лактации).
Альтернативно, для профилактики каберголин вводят во время контролируемой стимуляции яичников (гонадотропинами или другими агентами, стимулирующими яичники) перед стимуляцией окончательного созревания/овуляции, например, hCG. Предпочтительно, введение начинают в течение последней недели стимуляции. Введение продолжают в течение примерно от одной до трех недель после стимуляции hCG.
Лечение OHSS. Для лечения OHSS от легкого до тяжелого введение хинаголида начинают, как только у пациента диагностирован OHSS от легкого до тяжелого, и продолжают на протяжении примерно от 1 до 28 дней или до ослабления симптомов. Кроме того, хинаголид будут применять для уменьшения увеличенной сосудистой проницаемости и, таким образом, будут вводить до реверсирования или ослабления симптомов.
Доза и введение. Для лечения OHSS хинаголид вводят в дозе от примерно 0,025 мг/сутки до примерно 0,6 мг/сутки, предпочтительно от примерно 0,05 мг/сутки до примерно 0,3 мг/сутки. Продолжительность лечения составляет примерно от 1 до 28 дней, предпочтительно от 7 до 14 дней или до ослабления симптомов. Лечение обычно начинают при первом появлении признаков и симптомов OHSS.
ПРИМЕР 3. Профилактика или лечение OHSS с применением каберголина (Dostinex®)
Профилактика OHSS. Для профилактики OHSS у пациентов, проходящих лечение от бесплодия или IVF, включающие введение гонадотропных гормонов, ожидают, что введение агониста дофамина каберголина предотвратит увеличение сосудистой проницаемости. Без ограничения конкретным механизмом ожидают, что это произойдет в результате связывания каберголина с дофаминовыми рецепторами D2, приводящего к интернализации VEGF-R2, предотвращающего, таким образом, связывание VEGF-A с VEGF-R2 и фосфорилирование VEGF-R2.
Доза и введение. Для профилактики OHSS каберголин можно давать в течение примерно 8-дневного курса начиная со дня введения hCG для лечения бесплодия или IVF. Доза должна составлять примерно от 0,05 до 1,0 мг/сутки (то есть суммарная доза за примерно 8 дней близка к суточной дозе, необходимой для подавления лактации, которая составляет примерно 0,5 мг в сутки).
Альтернативно, для профилактики каберголин (Dostinex®) вводят во время контролируемой стимуляции яичников (гонадотропинами или другими агентами, стимулирующими яичники) перед стимуляцией окончательного созревания/овуляции, например, hCG. Предпочтительно, введение начинают в течение последней недели стимуляции. Введение продолжают в течение примерно от одной до трех недель после стимуляции hCG.
Лечение OHSS. Для лечения OHSS от легкого до тяжелого введение каберголина начинают, как только у пациента диагностирован OHSS от легкого или умеренного до тяжелого и, возможно, пациент госпитализирован. Кроме того, каберголин будут применять для уменьшения увеличенной сосудистой проницаемости.
Доза и введение. Для лечения OHSS введение каберголина начинают, как только у пациента диагностирован OHSS от умеренного до тяжелого. Каберголин будут вводить в дозе от примерно 0,05 до примерно 1,0 мг/сутки до реверсирования или ослабления симптомов. Продолжительность лечения составит от примерно 1 до примерно 28 дней, предпочтительно от примерно 7 до примерно 14 дней или до ослабления симптомов. Лечение начинают при первом появлении признаков и симптомов OHSS.
ПРИМЕРЫ 4 и 5. Измерение доза/ответ эффектов хинаголида (Norprolac®) на сосудистую проницаемость у крыс с OHSS
Общие методики
Индукция проявлений OHSS. Всего 96 неполовозрелых самок крыс Wistar (Harlan Iberica, Sant Feliu de Codina, Barcelona, SPAIN) с массой тела от 42-48 грамм в начале этих экспериментов (22 день) использовали для проведения исследований, раскрытых в примерах 4 и 5. Им инъецировали подкожно (s.c.) 10 ME гонадотропного гормона из сыворотки жеребой кобылы (PMSG) (Sigma) в течение 4 последовательных дней (22-25 дни) с последующим введением 30 ME hCG внутрибрюшинно (i.p.) на пятый день (26 день) с целью вызвать клинические проявления OHSS.
Измерение сосудистой проницаемости (VP). VP использовали как показатель для оценки и сравнения степени развития заболевания. VP измеряли у всех животных через 48-56 часов после введения hCG по методологии, описанной ранее (Gomez et al., выше). Кратко, 0,2 мл красителя Evans Blue, 0,05 М, инъецировали через бедренную вену. Через 30 минут полость брюшины промывали 5 мл физиологического раствора, pH 6, 22°С, и массировали в течение 30 секунд для извлечения экстравазированного красителя. Перитонеальную жидкость извлекали в 13 мл пробирки, содержащие 0,1 мл NaOH. Пробирки центрифугировали при 900×g в течение 12 минут во избежание белковой интерференции. Надосадочную жидкость фильтровали через 0,22 мкм фильтры с целью удаления асцитической белковой/фибриновой слизи, которая могла помешать дальнейшим измерениям. В заключение, измеряли оптическую плотность экстравазированного красителя при 595 нм с применением спектрофотометра. Вычисляли среднюю величину и средние отклонения в каждой группе (см. ниже). VP выражали в виде мкг экстравазированного красителя Evans Blue/100 г массы тела у каждого животного. Эти единицы представлены как оси «у» на диаграммах, представленных на Фиг.1 и 2.
Пример 4. Эксперименты доза-ответ, анализирующие эффект хинаголида на сосудистую проницаемость у крыс с OHSS
Всего 70 крыс были использованы в этом исследовании. Всем 70 крысам вводили PMSG/hCG, чтобы вызвать симптомы OHSS, как описано выше. Хинаголид (номер партии 1010003004; поставлен Ferring Labs) вводили 56 крысам. 56 крыс, получавших хинаголид, использовали как группу теста доза-ответ. Восемь крыс не получали хинаголид, и их использовали как группу носителя-контроля. Каберголин (Dostinex®) вводили 6 крысам как положительному контролю. Конкретные детали режима дозирования для каждой группы представляют собой следующие.
Группа носителя-контроля (хинаголид 0 мкг/кг) (n=8). Восьми крысам на 26 день, с 10:00 до 11:00, сразу после инъекции hCG (см. выше, Общие методики) имплантировали пролактиновые плацебо-пилюли с 5-дневным высвобождением. Через шесть часов после имплантации пилюль крысам в этой группе перорально вводили раствор носителя (1:6 смесь спирт в воде) (без хинаголида). Они получали другой пероральный носитель введением раствора носителя через 24 часа.
Экспериментальные группы (хинаголид 0,1, 0,3, 1, 3, 10, 25, 50 мкг/кг/сутки 7 тестируемым группам крыс) (n=8 в каждой тестируемой группе). Крысам в этих группах на 26 день, с 10:00 до 11:00, сразу после инъекции hCG (см. выше, Общие методики) имплантировали пролактиновые пилюли с 5-дневным высвобождением. Через шесть часов после имплантации пилюль (так чтобы было подходящее временное окно для высвобождения пролактина) крысы в этих семи тестируемых группах получали пероральное введение 0,008, 0,025, 0,08, 0,25, 0,8, 2, 4 мкг хинаголида соответственно, разведенных в 100 мкл раствора носителя. Таким образом, достигали желаемых для анализа доз в 0,1, 0,3, 1, 3, 10, 25, 50 мкг/кг. Через двадцать четыре часа крысам в этой группе вводили другую дозу таких же количеств хинаголида.
Группа положительного контроля (каберголин). Этим шести крысам на 26 день, с 10:00 до 11:00, сразу после инъекции hCG имплантировали пролактиновые пилюли с 5-дневным высвобождением. Через шесть часов после имплантации пилюль (так чтобы было подходящее временное окно для высвобождения пролактина) крысам в этой группе вводили 12 мкг каберголина, разведенного в 100 мкл носителя (достигая дозы 150 мкг/кг). Через двадцать четыре часа крысам в этой группе вводили другую дозу такого же количества каберголина. Эта доза каберголина (250 мкг/кг/сутки) была выбрана на основе предыдущих экспериментов, осуществленных на этой группе (повторенных несколько раз), демонстрирующих высокую корреляцию (p<0,05) между этой дозой каберголина и значительным снижением сосудистой проницаемости у крыс с OHSS.
Процесс разведения и разбавления для достижения подходящих доз хинаголида для перорального введения. Подходящие дозы приготавливали свежими непосредственно перед введением (на 26 день). Отдельную ампулу хинаголида, содержащую приблизительно 2,30-2,30 мг хинаголида, использовали для каждой отдельной группы животных. Для каждого раствора приблизительно 2,30-2,30 мг хинаголида разводили в растворе носителя (смесь спирт:вода 1:6) для достижения исходной концентрации 100 мкг хинаголида на мл раствора. 2 мл аликвоту исходного раствора хинаголида серийно разводили в одном и том же растворе носителя для получения семи растворов со следующими концентрациями: 0,08, 0,25, 0,8, 2,5, 8, 20 и 40 мкг хинаголида на мл раствора соответственно. Пероральное введение 100 мкл каждого раствора хинаголида давали подходящей группе крыс в тот же день, когда вводили hCG (26 день), как описано ниже. Оставшийся исходный раствор хранили при 4°С для использования таким же способом через 24 часа, как описано ниже. 100 мкл каждого серийно разведенного раствора содержали 0,008, 0,025, 0,08, 0,25, 0,8, 2 и 4 мкг хинаголида соответственно. Таким образом, при условии, что на 26 день (когда вводили хинаголид) масса тела крыс составляла в среднем 75-80 г, достигали желаемых доз 0,1, 0,3, 1, 3, 10, 25, 50 мкг/кг. Этот раствор носителя (смесь спирт:вода 1:6), без хинаголида, вводили, как описано, группе крыс положительного контроля.
Разведение и разбавление каберголина для достижения подходящей дозы для перорального введения. Половину (Dostinex®) пилюли, содержащую 125 мкг каберголина, механически измельчали в порошок, затем разводили в 1000 мкл раствора носителя (смесь спирт:вода 1:6) для достижения конечной концентрации 125 мкг каберголина на мл раствора. Пероральное введение 100 мкл этого раствора осуществляли в день введения hCG, как описано ниже. Оставшийся исходный раствор хранили при 4°С для использования таким же способом через 24 часа, как описано. 100 мкл этого раствора содержат 12,5 мкг каберголина. Таким образом, при условии, что на 26 день (когда вводили каберголин) масса тела крыс составляла в среднем 75-80 г, достигали желаемых доз 150 мкг/кг.
Сосудистую проницаемость (VP) измеряли у всех крыс с 48 по 56 часы после введения hCG, в 17:00 и 20:00, что соответствует времени ночного пика высвобождения пролактина. Ожидают, что эндогенное высвобождение пролактина будет полностью блокировано у крыс, пролеченных хинаголидом. Таким образом, время, в которое осуществляют измерения пролактина, не является решающим для крыс, пролеченных хинаголидом. Тем не менее, время, в которое осуществляют измерения пролактина у крыс с OHSS, не пролеченных хинаголидом, является решающим. Таким образом, сосудистую проницаемость измеряли у всех крыс на 48 и 56 часах после введения hCG с целью снизить вариабельность настолько, насколько возможно. В дополнение, вследствие того что измерение VP у более чем 4-6 животных в каждый час технически сложно и необходимо завершить эти измерения в пределах 3-часового интервала, тесты были распределены на четыре последовательных дня с использованием групп (обозначенных группы 1-4 в таблице 1, ниже) из 16-18 крыс каждый день.
Результаты
Данные о VP для приблизительно 25% крыс были утрачены из-за проблемы, связанной с фильтрами, использованными во избежание белковой интерференции. Считают, что в одной партии фильтров присутствовал загрязнитель. В результате краситель Evans Blue менял цвет на бледно-зеленый или желтый сразу после его прохождения через фильтр. Загрязненные фильтры были заменены, как только проблема была опознана. Тем не менее, большая часть экстравазированных перитонеальных жидкостей, полученных для группы 3, была утрачена (как указано в исходных данных, изложенных ниже в таблице 1).
Сосудистая проницаемость выражена как мкг экстравазированного красителя Evans Blue на 100 г массы тела у каждого животного. Исходные данные из таблицы 1 выше использовали для получения результатов, изображенных в графической форме на Фиг.1. Результаты, представленные на Фиг.1, отражают средние величины результатов для носителей-контролей (без хинаголида), положительных контролей (каберголин) и для каждого из вводимых количеств хинаголида (0,1, 0,3, 1, 3, 10, 25, 50 мкг/кг массы тела) у каждой крысы, тестированной таким образом.
Пример 5. Эксперименты доза ответ, анализирующие эффект хинаголида на сосудистую проницаемость у крыс с OHSS (повторная оценка)
Поскольку некоторые данные примера 4 были утрачены (см. таблицу 1), пример 5 был осуществлен для повторной оценки эффекта хинаголида на сосудистую проницаемость у крыс с OHSS.
Для примера 5 тестировали три дозы хинаголида: 5, 50, 250 мкг/кг/сутки. Дозу 250 мкг/кг/сутки тестировали с целью определения, был ли в примере 4 достигнут максимальный потенциальный ингибирующий эффект хинаголида.
Общие методики осуществляли, как изложено выше.
Всего 26 крыс использовали в этом исследовании. Всем 26 крысам вводили PMSG/hCG, чтобы вызвать симптомы OHSS, как описано выше. Хинаголид вводили 18 крысам, разделенным на три группы по шесть крыс на группу. 18 крыс, которые получали хинаголид, использовали как тестируемую группу доза-ответ. Восемь крыс не получали хинаголид, и их использовали как группу носителя-контроля. Группу положительного контроля не использовали для этого примера. Конкретные детали режима дозирования для каждой группы представляют собой следующие.
Группа носителя-контроля (хинаголид 0 мкг/кг) (n=8). Восьми крысам на 26 день, с 10:00 до 11:00, сразу после инъекции hCG (см. выше, Общие методики) имплантировали пролактиновые плацебо-пилюли с 5-дневным высвобождением. Через шесть часов после имплантации пролактиновых плацебо-пилюль крысам в этой группе перорально вводили раствор носителя (смесь спирт:вода 1:6) (без хинаголида). Они получали другое пероральное введение раствора носителя через 24 часа.
Экспериментальные группы (хинаголид 5, 62,5, 250 мкг/кг/сутки 3 тестируемым группам крыс) (n=6 в каждой тестируемой группе). Этим крысам на 26 день, с 10:00 до 11:00, сразу после инъекции hCG (см. выше, Общие методики) имплантировали пролактиновые пилюли с 5-дневным высвобождением. Через шесть часов после имплантации пролактиновых пилюль (так чтобы было подходящее временное окно для высвобождения пролактина) крысы в этих трех тестируемых группах (шесть крыс/группа) получали пероральное введение 0,4, 5, 0,08 и 20 мкг хинаголида соответственно, разведенных в 250 мкл раствора носителя. Таким образом, достигали желаемых для анализа доз в 5, 62,5 и 250 мкг/кг. Через двадцать четыре часа крысам в этой группе вводили другую дозу таких же количеств хинаголида.
Процесс разведения и разбавления для достижения подходящих доз хинаголида для перорального введения. Коммерческое лекарственное средство Norprolac® использовали как источник хинаголида для этого примера. Четыре пилюли Norprolac®, содержащие 150 мкг хинаголида каждая (всего 600 мкг хинаголида), разводили в 6250 мкл дистиллированной воды. Объем 1250 мкл спирта добавляли для получения раствора носителя (смесь спирт:вода 1:6), содержащего 80 мкг хинаголида на мл раствора. 1,5 мл аликвоту серийно разводили (1:4, 1:12,5) в одном и том же растворе носителя. Пероральное введение 250 мкл каждого раствора хинаголида давали подходящей крысе в каждой группе в тот же день, когда вводили hCG (26 день), как описано. Оставшийся исходный раствор хранили при 4°С для использования таким же способом через 24 часа, как описано. 250 мкл каждого серийно разведенного раствора содержали 0,4, 5 и 20 мкг хинаголида соответственно. Таким образом, при условии, что на 26 день (когда вводили хинаголид) масса тела крыс составляла в среднем 75-80 г, достигали желаемых доз 5, 50, 250 мкг/кг. Раствор носителя (смесь спирт:вода 1:6), без хинаголида, вводили, как описано, группе крыс положительного контроля.
Результаты
Исходные данные, полученные для примера 5, изложены ниже в таблице 2.
Сосудистая проницаемость выражена как мкг экстравазированного красителя Evans Blue на 100 г массы тела у каждого животного. Исходные данные из таблицы 2 выше использовали для получения результатов, изображенных в графической форме на Фиг.2. Результаты, представленные на Фиг.2, отражают средние величины результатов для носителей-контролей (без хинаголида), положительных контролей (каберголин) и для каждого из вводимых количеств хинаголида (5, 50 и 250 мкг/кг массы тела) у каждой крысы, тестированной таким образом.
ПРИМЕР 6. Агонист дофамина каберголин предотвращает умеренный-тяжелый ранний синдром гиперстимуляции яичников (OHSS) у пациентов с высоким риском, у которых используют вспомогательные репродуктивные технологии (ART)
OHSS с годами предотвращали и лечили эмпирически, поскольку его патофизиология оставалась неизвестной. С применением животных моделей было показано, что увеличенная сосудистая проницаемость (VP), отличительный признак OHSS, связана с увеличенной овариальной экспрессией сосудистого эндотелиального фактора роста (VEGF) и его рецептора 2 (VEGF-R2). Связывание VEGF и VEGF-R2 нарушает клеточные соединения и увеличивает VP. Более того, используя антитело, специфичное к VEGF-R2, реверсировали вызванную гонадотропинами VP. Однако у большей части антиангиогенных молекул, способных блокировать VEGF-R2, имеются тяжелые побочные эффекты. Дофамин и его агонисты также реверсируют увеличенную VP у гиперстимулированных животных путем ингибирования фосфорилирования VEGF-R2. На основе этих наблюдений пример 6 был осуществлен для определения, может ли введение агониста дофаминовых рецепторов 2 типа каберголина предотвратить OHSS у женщин с риском, проходящих стимуляцию яичников для ART.
Материалы и методы. Пример 5 представляет собой проспективное, рандомизированное и двойное слепое исследование 54 доноров ооцитов, у которых развивались 20-30 фолликулов более 12 мм и от которых получали более 20 ооцитов. Непосредственно после введения hCG пациентов разделяли на две группе на основе компьютерной рандомизации: 1) исследуемая группа (n=29) получала перорально 0,5 мг каберголина ежедневно в течение восьми дней; 2) контрольная группа (n=25) получала одну таблетку плацебо в течение тех же восьми дней. Пациентов наблюдали каждые 48 часов со дня введения hCG (0 день) до 8 дня. Присутствие асцита определяли как скопление перитонеальной жидкости более 9 см2 при вагинальном ультразвуковом обследовании пациента в положении для литотомии. Также регулярно записывали параметры крови и уровни пролактина (PRL) сыворотки.
Результаты. На 2, 4, 6 и 8 дни в исследуемой группе уровни PRL сыворотки были значительно ниже (p<0,0001) по сравнению с контролями. Как показано ниже в таблице 3, гемоконцентрация, присутствие и объем асцитической жидкости были значительно снижены в исследуемой группе.
Заключения. Каберголин снижает гемоконцентрацию и формирование асцита у женщин с риском развития умеренного-тяжелого раннего OHSS.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЛЕКАРСТВЕННОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ЭНДОМЕТРИОЗА | 2008 |
|
RU2423146C2 |
| ВЕТЕРИНАРНАЯ АНТИПРОЛАКТИНОВАЯ КОМПОЗИЦИЯ ДЛЯ ЖВАЧНЫХ | 2009 |
|
RU2528892C2 |
| Способы лечения бесплодия | 2016 |
|
RU2723098C2 |
| Композиция для лечения бесплодия | 2016 |
|
RU2704252C2 |
| УНИТАРНАЯ КОМБИНАЦИЯ FSH И hCG | 2004 |
|
RU2332228C2 |
| СПОСОБ ЛЕЧЕНИЯ БЕСПЛОДИЯ | 2000 |
|
RU2226395C2 |
| Применение каберголина в лечении патологических состояний, вызванных повышенными уровнями фактора роста эндотелия сосудов | 2016 |
|
RU2698728C1 |
| СПОСОБ ЛЕЧЕНИЯ БОЛЬНЫХ С ТЯЖЕЛЫМИ ФОРМАМИ СИНДРОМА ГИПЕРСТИМУЛЯЦИИ ЯИЧНИКОВ | 2015 |
|
RU2603319C1 |
| СПОСОБ ЛЕЧЕНИЯ НАРУЖНОГО ГЕНИТАЛЬНОГО ЭНДОМЕТРИОЗА | 2019 |
|
RU2732251C1 |
| Способ прогнозирования синдрома гиперстимуляции яичников в программе ЭКО на основании определения полиморфизмов генов VEGFA и TSHR | 2016 |
|
RU2621634C1 |
Изобретение относится к медицине, а именно к гинекологии, и может быть использовано для лечения синдрома гиперстимуляции яичников, а также для его профилактики у субъекта, который проходит лечение от бесплодия гонадотропным гормоном. Для этого пациенту вводят композицию, содержащую хинаголид в фармацевтически приемлемом носителе. Введение хинаголида, в отличие от других агонистов дофамина, обеспечивает высокую терапевтическую эффективность в значительно меньших дозах и быстро выводится из организма, что снижает риск токсичности для матери и плода. 3 н. и 13 з.п. ф-лы, 3 табл., 2 ил.
1. Применение фармацевтической композиции, содержащей хинаголид в фармацевтически приемлемом носителе для профилактики синдрома гиперстимуляции яичников у субъекта, который проходит лечение от бесплодия гонадотропным гормоном.
2. Применение по п.1, где лечение от бесплодия выбрано из группы, состоящей из экстракорпорального оплодотворения (IVF), внутрицитоплазматической инъекции сперматозоида (ICSI), переноса гамет в маточные трубы (GIFT), переноса зигот в маточные трубы (ZIFT) и внутриматочного осеменения во время контролируемой стимуляции яичников или индукции овуляции.
3. Применение по п.1, которое включает введение хинаголида в диапазоне доз от примерно 0,025 до примерно 0,6 мг/сут.
4. Применение по п.3, которое включает введение хинаголида в диапазоне доз от примерно 0,05 до примерно 0,3 мг/сут.
5. Применение по п.3 или 4, которое включает введение хинаголида, начиная со дня введения хорионического гонадотропного гормона человека (hCG).
6. Применение по п.5, которое включает введение хинаголида в течение по меньшей мере от примерно 6 до примерно 8 сут, и/или от примерно 5 до примерно 48 сут после введения хорионического гонадотропного гормона человека, например от примерно 7 до примерно 28 сут после введения хорионического гонадотропного гормона человека.
7. Применение по п.3 или 4, которое включает введение хинаголида перед стимуляцией окончательной овуляции путем введения хорионического гонадотропного гормона человека.
8. Применение по п.7, которое включает введение хинаголида в течение от примерно 5 до примерно 48 сут после начала введения гонадотропного гормона для стимуляции яичников, например от примерно 7 до примерно 28 сут после начала введения гонадотропного гормона для стимуляции яичников.
9. Применение фармацевтической композиции, содержащей хинаголид в фармацевтически приемлемом носителе для лечения синдрома гиперстимуляции яичников.
10. Применение по п.9, где синдром гиперстимуляции яичников связан с введением гонадотропного гормона, является идиопатическим и/или связан с беременностью.
11. Применение по п.9, где синдром гиперстимуляции яичников является синдромом гиперстимуляции яичников от легкого до тяжелого.
12. Применение по п.11, где синдром гиперстимуляции яичников является тяжелым, и субъект госпитализирован.
13. Применение по любому из пп.9-12, которое включает введение хинаголида в дозе от примерно 0,025 мг/сут до примерно 0,6 мг/сут.
14. Применение по любому из пп.9-12, которое включает введение хинаголида в дозе от примерно 0,05 мг/сут до примерно 0,3 мг/сут.
15. Применение по п.13, которое включает введение хинаголида в течение от примерно 1 сут до примерно 28 сут, например в течение от примерно 7 сут до примерно 14 сут.
16. Применение хинаголида в изготовлении лекарственного средства для лечения синдрома гиперстимуляции яичников или для профилактики синдрома гиперстимуляции яичников у субъекта, который проходит лечение от бесплодия гонадотропным гормоном.
| PAPALEO E | |||
| et al | |||
| Cabergoline influences ovarian stimulation in hyperprolactinaemic patients with polycystic ovary syndrome // Hum Reprod | |||
| Перекатываемый затвор для водоемов | 1922 |
|
SU2001A1 |
| RU 97108806 A, 10.05.1999 | |||
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| КАМИЛОВА Д.П | |||
| и др | |||
| Случай тяжелого течения синдрома гиперстимуляции яичников // Проблемы репродукции, 1999, №2, | |||
Авторы
Даты
2011-04-20—Публикация
2006-04-24—Подача