Настоящее изобретение относится к композициям и фармацевтическим продуктам для лечения бесплодия.
Методики вспомогательных репродуктивных технологий (ART), такие как оплодотворение in vitro (IVF), являются хорошо известными. Для данных методик ART обычно требуется стадия контролируемой стимуляции яичников (COS), в которой группу фолликулов стимулируют до полной зрелости. Стандартные схемы COS включают введение гонадотропинов, таких как фолликулостимулирующий гормон (FSH) - один или в комбинации с активностью лютеинизирующего гормона (LH), для стимуляции развития фолликулов, обычно с введением аналога GnRH до и/или во время стимуляции для предупреждения преждевременного всплеска LH. Фармацевтические композиции, обычно используемые для COS, включают рекомбинантный фолликулостимулирующий гормон (rFSH), FSH, полученный из мочи, препараты рекомбинантного FSH плюс LH, менотропин, полученный из мочи [человеческий менопаузный гонадотропин (hMG)], и высокоочищенный человеческий менопаузный гонадотропин (HP-hMG). IVF может быть ассоциировано с риском синдрома гиперстимуляции яичников (OHSS), который в тяжелых случаях может угрожать жизни.
Как указано выше, стандартные протоколы COS обычно включают введение FSH. Доза FSH обычно зависит от ряда факторов, включающих возраст, любой предыдущий ответ на стимуляцию FSH, базальный уровень FSH, число антральных фолликулов и, совсем недавно, антимюллеровский гормон (АМН). Клинический врач будет ожидать мультифолликулярное развитие в яичниках в ответ на данную дозу, наряду с увеличением уровня циркулирующего 17-β-эстрадиола.
Если ответ (мультифолликулярное развитие в яичниках, увеличение уровня циркулирующего 17-β-эстрадиола) на данную дозу является адекватным или таким, как ожидается, это указывает на нормальную функцию яичников, которая также именуется нормальным резервом яичников. Пациенты, которые не отвечают на стимуляцию FSH хорошо, продуцируют мало фолликулов, и, следовательно, их уровни 17-β-эстрадиола во время стимуляции увеличиваются медленно и достигают сравнительно низких уровней. Таких пациентов называют «слабыми респондерами», и можно сказать, что они имеют уменьшенный резерв яичников. Считается, что в слабом ответе участвуют несколько факторов, включающих больший возраст, тазовые спайки, заболевание яичников и иммунологические факторы.
Способность прогнозировать потенциал ответа женщин на контролируемую стимуляцию яичников (COS) может обеспечивать разработку индивидуализированных протоколов COS. Это могло бы, например, уменьшать риск OHSS у женщин, для которых прогнозируется наличие избыточного ответа на стимуляцию, улучшать результаты беременности у женщин, классифицируемых как плохие респондеры, и/или приводить к пониженной дозе (и подверженности влиянию) FSH, и, следовательно, меньшей стоимости терапии (и повышенной безопасности терапии) у конкретных пациентов.
Сывороточная концентрация антимюллеровского гормона (АМН) теперь установлена как надежный маркер резерва яичников. Уменьшение уровней АМН коррелирует с ослабленным ответом яичников на гонадотропины во время COS. Кроме того, высокие уровни АМН являются хорошим прогностическим параметром избыточного ответа яичников и индикатором риска OHSS.
В предварительном исследовании женщин младше 35 лет, подвергающихся ART, использовали алгоритм дозирования CONSORT (включающий базальный FSH, BMI (индекс массы тела), возраст и AFC (число антральных фолликулов)) для прогнозирования оптимальной исходной дозы FSH для COS у женщин, подвергающихся риску развития OHSS (Olivennes et. al., 2009). Индивидуализация дозы, в самом деле, приводила к адекватному выходу ооцитов и хорошей частоте беременности. Однако имели место высокие частоты отмен в группе с низкой дозой (75 IU (международные единицы) FSH) из-за неадекватного ответа, и OHSS действительно случался у значимой доли пациентов.
Как указано выше, стандартные протоколы COS могут включать ведение FSH. FSH секретируется в природных условиях передней долей гипофиза и функционирует для поддержки развития фолликулов и овуляции. FSH содержит альфа субъединицу из 92 аминокислот, также обычную для других гликопротеиновых гормонов - LH и CG (хорионический гонадотропин), и бета субъединицу из 111 аминокислот, уникальную для FSH, которая придает биологическую специфичность гормону (Pierce and Parsons, 1981). Каждая субъединица посттрансляционно модифицируется посредством добавления остатков сложных углеводов. Обе субъединицы несут 2 сайта присоединения N-связанных гликанов: альфа субъединица - на аминокислотах 52 и 78, и бета субъединица - на аминокислотных остатках 7 и 24 (Rathnam and Saxena, 1975, Saxena and Rathnam, 1976). FSH, таким образом, гликозилирован примерно на 30% по массе (Dias and Van Roey. 2001. Fox ef al. 2001).
FSH, очищенный из мочи постменопаузного человека, в течение многих лет использовали в лечении бесплодия; как для стимуляции овуляции при естественной репродукции, так и для предоставления ооцитов для вспомогательных репродуктивных технологий. Одобренные в настоящее время продукты на основе рекомбинантного FSH (rFSH) для стимуляции яичников, такие как фоллитропин альфа (GONAL-F, Merck Serono / EMD Serono) и фоллитропин бета (PUREGON / FOLLISTIM, MSD / Schering-Plough), получают из линии клеток яичников китайского хомяка (СНО). В настоящее время в продаже не доступны продукты на основе rFSH из человеческой линии клеток.
Существует значительная гетерогенность, ассоциированная с препаратами FSH, которая относится к различиям в количествах разных присутствующих изоформ. Индивидуальные изоформы FSH демонстрируют идентичные аминокислотные последовательности, но отличаются по степени, в которой они посттрансляционно модифицированы; конкретные изоформы характеризуются гетерогенностью структур углеводных ветвей и отличающимися количествами включения сиаловой кислоты (терминальный сахар), оба из которых, по-видимому, влияют на биоактивность специфических изоформ.
Гликозилирование природного FSH является очень сложным. Гликаны в гипофизарном FSH природного происхождения могут содержать широкий спектр структур, который может включать комбинации моно-, би-, три- и тетраантенных гликанов (Pierce and Parsons, 1981. Ryan et al., 1987. Baenziger and Green, 1988). Гликаны могут нести дополнительные модификации: фукозилирование ядра, разделяющие надвое глюкозамин, цепи, продленные ацетиллактозамином, частичное или полное сиалилирование, сиалилирование с α2,3 и α2,6 связями и галактоза, замененная сульфатированным галактозамином (Dalpathado et al., 2006). Кроме того, существуют различия между распределениями гликановых структур на индивидуальных сайтах гликозилирования. Сравнимый уровень сложности гликанов был обнаружен в FSH, полученном из сыворотки индивидов и из мочи постменопаузных женщин (Wide et al., 2007).
Гликозилирование продуктов на основе рекомбинантного FSH отражает спектр гликозилтрансфераз, присутствующих в линии клеток-хозяев. Имеющиеся в продаже продукты на основе rFSH имеют происхождение из генетически модифицированных клеток яичника китайского хомяка (клетки СНО). Спектр модификаций гликанов в rFSH, имеющем происхождение из клеток СНО, является более ограниченным, чем спектры, обнаруживаемые на природных продуктах. Примеры пониженной гетерогенности гликана, находящегося в rFSH, имеющем происхождение из клеток СНО, включают отсутствие делящего надвое глюкозамина и пониженное содержание фукозилирования ядра и ацетиллактозаминовых удлинений (Hard et al., 1990). Кроме того, клетки СНО способны добавлять сиаловую кислоту только с использованием α2,3-связи (Kagawa et al, 1988, Takeuchi et al, 1988, Svensson et al., 1990); rFSH, полученный из клетки СНО, включает только α2,3-связанную сиаловую кислоту и не включает α2,6-связанную сиаловую кислоту.
Таким образом, FSH, имеющий происхождение из клеток СНО, отличается от продуцируемого в природе FSH (например, человеческого гипофизарного/сывороточного FSH/FSH мочи), который содержит гликаны со смесью α2,3- и α2,6-связанной сиаловой кислоты, с преобладанием первой. Таким образом, рекомбинантные белки, экспрессируемые с использованием системы СНО, будет отличаться от их природных аналогов по их типу связей терминальной сиаловой кислоты. Это является важным фактором при производстве биологических агентов для фармацевтического применения, так как углеводные группировки могут вносить вклад в фармакологические характеристики молекулы.
Авторы настоящего изобретения разработали имеющий происхождение из человека рекомбинантный FSH, который является предметом международной патентной заявки № PCT/GB 2009/000978, опубликованной как WO 2009/127826 A. Рекомбинантный FSH со смесью как α2,3-, так и α2,6-связанной сиаловой кислоты получали посредством генетической модификации линии клеток человека для экспрессии как rFSH, так и α2,3-сиалилтрансферазы. Экспрессируемый продукт является сильно кислым и несет смесь и α2,3-, и α2,6-связанных сиаловых кислот; причем последние предоставляются активностью эндогенной сиалилтрансферазы. Обнаружили, что тип связи сиаловой кислоты, α2,3- или α2,6-, может иметь сильное влияние на биологический клиренс FSH. Рекомбинантный FSH со смесью как α2,3-, так и α2,6-связанных сиаловых кислот имеет два преимущества по отношению к rFSH, экспрессируемым в обычных клетках СНО: во-первых, данное вещество является более высокосиалилированным из-за объединенных активностей двух сиалилтрансфераз; и, во-вторых, данное вещество имеет большее сходство с природным FSH. Он, вероятно, является более подходящим биологически по сравнению с рекомбинантными продуктами, имеющими происхождение из клетки СНО, которые продуцируют только α2,3-связанную сиаловую кислоту (Kagawa et al, 1988, Takeuchi et al, 1988, Svensson et al., 1990) и имеют пониженное содержание сиаловой кислоты (Ulloa-Aguirre et al. 1995., Andersen et al. 2004).
Недавно было сделано предположение, что рецептор фолликулостимулирующего гормона или рецептор FSH (FSHR) может быть связан или может участвовать в уменьшенном резерве яичников. Рецептор FSH представляет собой трансмембранный рецептор, который взаимодействует с FSH. Рецептор FSH представляет собой 7-трансмембранный связанный с G-белком рецептор, связанный с аденилатциклазой, с большим N-концевым лигандсвязывающим доменом и С-концевым цитоплазматическим хвостом, обогащенным остатками серина и треонина, в качестве предположительных сайтов фосфорилирования. Его активация необходима для гормонального функционирования FSH. Постулировали, что мутации в рецепторе FSH могут приводить к уменьшенному резерву яичников. Также как и мутации, обнаруживаются варианты рецептора FSH (полиморфизмы рецептора FSH). Два таких полиморфизма располагаются в положении 307 (Ala/Thr) и положении 680 (Asn/Ser) в экзоне 10 рецептора FSH (Фиг. 4). Они представляют собой варианты Ala или Thr в положении 307 и Asn или Ser в положении 680. Данные полиморфизмы приводят к трем отличным генотипам рецептора FSH в отношении положения 680: Asn/Asn, Asn/Ser и Ser/Ser [см. Simoni et al, Journal of Clinical Endocrinology and Metabolism, Vol 84, No. 2, 751-755 (1999), Falconer et al, Acta Obstet Gynecol Scand 2005: 84: 806-811 (2005) и Loutradis et al, Journal of Assisted Reproduction and Genetics, Vol. 23, No. 4, (April 2006)].
Авторы настоящего изобретения обнаружили, что пациенты, идентифицированные как имеющие низкий уровень АМН [уровень АМН меньше 15 пмоль/л, которые обычно были бы ассоциированы со слабым ответом], а также имеющие вариант Ser/Ser в положении 680 рецептора FSH, имеют более длительную продолжительность лечения FSH по сравнению с пациентами с низким уровнем АМН и вариантом Asn/Asn или вариантом Asn/Ser в положении 680 рецептора FSH. Повышенная исходная доза FSH пациентам, имеющим низкий уровень АМН [уровень АМН меньше 15 пмоль/л (например, от 0,05 пмоль/л до 14,9 пмоль/л, например, от 5,0 пмоль/л до 14,9 пмоль/л)], а также имеющим вариант Ser/Ser в положении 680 рецептора FSH, может, следовательно, быть альтернативой для того, чтобы избежать большей продолжительности лечения FSH. Это обеспечивает приспособление дозы FSH у конкретных пациентов, идентифицированных как имеющие конкретный уровень АМН, а также конкретный полиморфизм FSHR.
Введение более высокой исходной дозы FSH пациентам, имеющим низкий уровень АМН [уровень АМН меньше 15 пмоль/л (например, от 0,05 пмоль/л до 14,9 пмоль/л, например от 5,0 пмоль/л до 14,9 пмоль/л)], а также имеющим вариант Ser/Ser в положении 680 рецептора FSH, является полезным, так как оно может обеспечивать повышенную вероятность успеха (в показателях беременности и/или живорождения) и лучшую прогнозируемость успеха. Успех более вероятен, если пациент имеет адекватный ответ (ожидаемое мультифолликулярное развитие в яичниках, увеличение уровня циркулирующего 17-β-эстрадиола), происходящий в пределах идеального терапевтического окна. Успех дополнительно усиливается, если ответ находится в пределах центра данного терапевтического окна; то есть, не слишком рано в окне и не слишком поздно. Уменьшение продолжительности лечения у пациентов, имеющих низкий уровень АМН и вариант Ser/Ser в положении 680 рецептора FSH (посредством увеличения дозы выше 12 мкг) может приводить ответ к центру терапевтического окна, с увеличенной вероятностью успеха.
Согласно настоящему изобретению в первом аспекте предложена композиция (например, фармацевтическая композиция) для применения в лечении бесплодия, содержащая от 9 до 24 мкг фолликулостимулирующего гормона (FSH), предназнченная для (например, ежесуточного) введения пациенту, идентифицированному как (например, выбранному как) имеющий вариант Ser/Ser в положении 680 рецептора FSH (до лечения). Композиция может быть предназнчена для (например, ежесуточного) введения пациенту, идентифицированному как (например, выбранному как) имеющий вариант Ser/Ser в положении 680 рецептора FSH и идентифицированному как (например, выбранному как) имеющий сывороточный уровень АМН меньше 15 пмоль/л (например, от 0,05 пмоль/л до 14,9 пмоль/л) (до лечения). Композиция может содержать от 9 до 24 мкг FSH, например от 10 до 18 мкг FSH, например от 12 до 16 мкг FSH, например от 12 до 15 мкг FSH. Композиция может содержать больше 12 мкг FSH, например от 12,3 до 24 мкг FSH, например от 12,33 до 24 мкг FSH, например от 12,67 до 24 мкг FSH, например от 13 до 24 мкг FSH, например от 13 до 16 мкг FSH, например от 13 до 15 мкг FSH.
Композиция (например, фармацевтическая композиция) может содержать суточную дозу, равную количествам rFSH человеческого происхождения, определенных здесь выше и в формуле изобретения или эквивалентную суточную дозу. Композиция (например, фармацевтическая композиция) может быть предназначена для (ежесуточного) введения FSH, начиная с суток один лечения и продолжая в течение от шести до шестнадцати суток, например от семи до шестнадцати суток, например от 8 до 16 суток, например от 8 до 13 суток. Лечение бесплодия может включать стадию идентификации (например, определения, например, измерения) варианта в положении 680 рецептора FSH пациента; и стадию введения дозы пациенту, (идентифицированному как) имеющему(ий) вариант Ser/Ser в положении 680 рецептора FSH. Лечение бесплодия может включать стадию идентификации (например, определения, например, измерения) сывороточного уровня АМН у пациента и введения дозы пациенту, (идентифицированному как) имеющему(ий) сывороточный уровень АМН меньше 15 пмоль/л (например, от 0,05 пмоль/л до 14,9 пмоль/л).
FSH может представлять собой рекомбинантный FSH. FSH может представлять собой рекомбинантный FSH, включающий α2,3- и α2,6-сиалилирование. FSH может представлять собой рекомбинантный FSH, включающий α2,3- и α2,6-сиалилирование, где от 1 до 99% общего сиалилирования представляет собой α2,6-сиалилирование, и от 99% до 1% общего сиалилирования представляет собой α2,3-сиалилирование. FSH может представлять собой рекомбинантный FSH, включающий α2,3- и α2,6-сиалилирование, где от 1 до 50% общего сиалилирования представляет собой α2,6-сиалилирование, и от 50% до 99% общего сиалилирования представляет собой α2,3-сиалилирование. FSH может представлять собой рекомбинантный FSH, включающий α2,3- и α2,6-сиалилирование, где от 5 до 40% общего сиалилирования представляет собой α2,6-сиалилирование, и от 60% до 95% общего сиалилирования представляет собой α2,3-сиалилирование. Предпочтительно FSH представляет собой рекомбинантный FSH, имеющий происхождение из человеческой линии клеток.
Согласно настоящему изобретению в другом аспекте предложена композиция (например, фармацевтическая композиция), содержащая фолликулостимулирующий гормон (FSH) для применения в лечении бесплодия у пациента, имеющего сывороточный уровень АМН меньше 15 пмоль/л (например, от 0,05 пмоль/л до 14,9 пмоль/л) и имеющему вариант Ser/Ser в положении 680 рецептора FSH, подлежащая введению в дозе или в эквиваленте от 9 до 24 мкг рекомбинантного FSH в сутки; и где лечение бесплодия включает стадию идентификации (например, определения) сывороточного уровня АМН пациента; стадию идентификации варианта в положении 680 рецептора FSH пациента; и стадию введения композиции пациенту, (идентифицированному как) имеющему(ий) сывороточный уровень АМН меньше 15 пмоль/л (например, от 0,05 пмоль/л до 14,9 пмоль/л) и вариант Ser/Ser в положении 680 рецептора FSH. Композиция может содержать от 9 до 24 мкг FSH, например от 10 до 18 мкг FSH, например от 12 до 16 мкг FSH, например от 12 до 15 мкг FSH. Композиция может содержать больше 12 мкг FSH, например от 12,3 до 24 мкг FSH, например от 12,33 до 24 мкг FSH, например от 12,67 до 24 мкг FSH, например от 13 до 24 мкг FSH, например от 13 до 16 мкг FSH, например от 13 до 15 мкг FSH.
Композиция (например, фармацевтическая композиция) может быть предназначена для применения в лечении бесплодия у пациента, имеющего сывороточный уровень АМН меньше 15 пмоль/л (например, от 0,05 пмоль/л до 14,9 пмоль/л) и имеющего вариант Ser/Ser в положении 680 рецептора FSH [где лечение бесплодия включает стадию идентификации (например, определения) сывороточного уровня АМН пациента; стадию идентификации варианта в положении 680 рецептора FSH пациента; и стадию введения дозы пациенту, (идентифицированному как) имеющему(ий) сывороточный уровень АМН меньше 15 пмоль/л (например, от 0,05 пмоль/л до 14,9 пмоль/л) и вариант Ser/Ser в положении 680 рецептора FSH].
FSH может представлять собой рекомбинантный FSH. FSH может представлять собой рекомбинантный FSH, включающий α2,3- и α2,6-сиалилирование. FSH может представлять собой рекомбинантный FSH, включающий α2,3- и α2,6-сиалилирование, где от 1 до 99% общего сиалилирования представляет собой α2,6-сиалилирование, и от 99% до 1% общего сиалилирования представляет собой α2,3-сиалилирование. FSH может представлять собой рекомбинантный FSH, включающий α2,3- и α2,6-сиалилирование, где от 1 до 50% общего сиалилирования представляет собой α2,6-сиалилирование, и от 50% до 99% общего сиалилирования представляет собой α2,3-сиалилирование. FSH может представлять собой рекомбинантный FSH, включающий α2,3- и α2,6-сиалилирование, где от 5 до 40% общего сиалилирования представляет собой α2,6-сиалилирование, и от 60% до 95% общего сиалилирования представляет собой α2,3-сиалилирование. Предпочтительно FSH представляет собой рекомбинантный FSH, имеющий происхождение из человеческой линии клеток.
Доза обеспечивает эффективный ответ при минимизации риска OHSS.
Большие дозы могут быть предназначены для лечения бесплодия в первом протоколе стимуляции пациента (субъекта). Будет понятно, что для дополнительных циклов стимуляции дозы могут быть скорректированы согласно реальному ответу яичников в первом цикле.
rFSH может присутствовать в виде одной изоформы или в виде смеси изоформ.
Авторы изобретения разработали «индивидуализированные» протоколы COS, в которых используются специфические дозы рекомбинантного FSH для лечения пациентов на основе их специфических уровней АМН и однонуклеотидного полиморфизма FSHR, посредством этого увеличивая вероятность адекватного ответа на стимуляцию (например, у пациентов, имеющих низкий потенциал ответа) и/или уменьшая риск OHSS или другого побочного эффекта.
Сывороточный уровень АМН может быть определен (например, измерен) любым способом, известным в данной области. В качестве примера, сывороточный уровень АМН измеряют с использованием набора для твердофазного иммуноферментного анализа Gen-II для АМН (Beckman Coulter, Inc., Webster, Техас). Данный анализ может выявлять концентрации АМН большие, чем 0,57 пмоль/л с минимальным порогом количественного измерения 1,1 пмоль/л. Можно использовать другие анализы. Сывороточные значения АМН здесь обычно изложены в показателях пмоль/л. Они могут быть конвертированы в нг/мл с использованием уравнения для конвертирования 1 нг/мл АМН = 7,1 пмоль/л АМН.
Таким образом, композиция может быть предназначена для (например, ежесуточного) введения пациенту, идентифицированному как (например, отобранному как) имеющий сывороточный уровень АМН меньше 15 пмоль/л (например, от 0,05 пмоль/л до 14,9 пмоль/л) при измерении с использованием твердофазного иммуноферментного анализа Gen-II от Beckman Coulter или сравнимый уровень АМН, измеренный другим способом.
Термины «пациент» и «субъект» здесь использованы взаимозаменяемо.
Композиция (например, фармацевтическая композиция) предпочтительно содержит суточную дозу, равную количествам rFSH человеческого происхождения, определенным здесь выше и в формуле изобретения, или эквивалентную суточную дозу. (Суточная) доза может представлять собой исходную дозу (т.е. она может быть снижена, повышена или поддерживаться на протяжении лечения).
Пациент, идентифицированный как имеющий вариант Ser/Ser в положении 680 рецептора FSH, может быть идентифицирован способами, хорошо известными в данной области, например посредством идентификации аллельного варианта в положении 680 рецептора FSH после экстракции геномной ДНК способами, хорошо известными в данной области [например, посредством набора для экстракции геномной ДНК из крови и последующего секвенирования ДНК, как описано, например, в Gromoll et al, Methods, 21, 83-97 (2000), Simoni et al, Journal of Clinical Endocrinology and Metabolism, Vol 84, No. 2, 751-755 (1999), Falconer et al, Acta Obstet Gynecol Scand 2005: 84: 806-811 (2005) и ссылках, процитированных в них, или экстракции ДНК с последующим определением одноцепочечного конформационного полиморфизма (SSCP, с последующим гель-электрофорезом и т.д.), или посредством способа PCR (полимеразная цепная реакция) и RFLP (полиморфизм длин рестрикционных фрагментов), такого как способ, изложенный в Loutradis et al, Journal of Assisted Reproduction and Genetics, Vol. 23, No. 4, April 2006)]. Таким образом, композиция может быть предназначена для (например, ежесуточного) введения пациенту, идентифицированному как (например, выбранному как) имеющий вариант Ser/Ser в положении 680 рецептора FSH при измерении посредством экстракции геномной ДНК (например, из крови) и последующего анализа способами PCR и RFLP, такими как способ, изложенный в Loutradis et al, Journal of Assisted Reproduction and Genetics, Vol. 23, No. 4, April 2006, или сравнимый способ.
Композиция (например, фармацевтическая композиция) может быть предназначена для (ежесуточного) введения FSH, начиная в сутки один лечения и продолжая в течение от шести до шестнадцати суток, например от семи до шестнадцати суток, например от 8 до 16 суток, например от 8 до 13 суток. Композиция (например, фармацевтическая композиция) может быть предназначена для введения от 12 до 16, например от 13 до 15, например 14 суток после введения (например, после инициации введения, например, после инициации ежесуточного введения) агониста GnRH (например, синарела, лупрона, декапептила). Композиция (например, фармацевтическая композиция) может быть предназначена для введения с агонистом GnRH. Композиция (например, фармацевтическая композиция) может быть предназначена для введения до введения антагониста GnRH (например, ганиреликса, цетрореликса), например для введения от пяти до шести суток до введения антагониста GnRH. Композиция (например, фармацевтическая композиция) может быть предназначена для введения с антагонистом GnRH. Композиция (например, фармацевтическая композиция) может быть предназначена для введения с антагонистом GnRH (например, с ганиреликсом, цетрореликсом), вводимым (например, ежесуточно) с суток шесть лечения. Предпочтительно композиция (например, фармацевтическая композиция) предназначена для введения до введения высокой (овуляторной) дозы hCG (например, от 4000 до 11000 IU hCG, например 5000 IU hCG, 10000 IU hCG и т.д.; или от 150 до 350 микрограммов рекомбинантного hCG, например 250 микрограммов рекомбинантного hCG) для индуцирования конечного созревания фолликулов.
Будет понятно, что композиция может быть предназначена для дозирования с частотами, большими (или меньшими), чем ежесуточные, причем в данном случае релевантные дозы будут эквивалентными определенным здесь (суточным) дозам.
Термин «лечение бесплодия» включает здесь лечение бесплодия посредством контролируемой стимуляции яичников (COS) или способами, которые включают этап или стадию контролируемой стимуляции яичников (COS), например внутриматочное осеменение (IUI), оплодотворение in vitro (IVF) или внутрицитоплазматическую инъекцию спермы (ICSI). Термин «лечение бесплодия» включает лечение бесплодия посредством индуцирования овуляции (OI) или посредством способов, включающих этап или стадию индуцирования овуляции (OI). Термин «лечение бесплодия» включает лечение бесплодия у субъекта, имеющего трубное или необъяснимое бесплодие, включая лечение бесплодия у субъекта, имеющего эндометриоз, например эндометриоз стадии I или стадии II, и/или у субъекта, имеющего ановуляторное бесплодие, например ановуляторное бесплодие типа II WHO (Всемирная организация здравоохранения, ВОЗ), и/или у субъекта с партнером с мужским фактором бесплодия. Данная композиция может быть предназначена для (применения в) лечении бесплодия (и/или для контролируемой стимуляции яичников) у субъекта, имеющего эндометриоз, например у субъекта, имеющего эндометриоз стадии I или стадии II, как определено системой классификации Американского общества репродуктивной медицины (ASRM) для разных стадий эндометриоза (стадия IV является самой тяжелой; стадия I является наименее тяжелой) [American Society for Reproductive Medicine. Revised American Society for Reproductive Medicine classification of endometriosis: 1996. Fertil Steril 1997; 67, 817 821].
Композиция может быть предназначена для (применения в) лечении бесплодия (и/или для контролируемой стимуляции яичников) у субъекта, имеющего нормальный сывороточный уровень FSH от 1 до 16 IU/л, например от 1 до 12 IU/л, на ранней фолликулярной фазе.
Композиция может быть предназначена для (применения в) лечении бесплодия (и/или для контролируемой стимуляции яичников) у субъекта, идентифицированного как находящийся в возрасте от 18 до 42 лет, например от 25 до 37 лет. Продукт может быть предназначен для (применения в) лечении бесплодия (и/или для контролируемой стимуляции яичников) у субъекта, идентифицированного как имеющий BMI больше 15 и BMI меньше 38 кг/м2, например субъекта, идентифицированного как имеющий BMI больше 18 и BMI меньше 25 кг/м2, например субъекта, имеющего BMI больше 20 и BMI меньше 25 кг/м2.
rFSH может иметь содержание сиаловой кислоты [выраженное в показателях отношения молей сиаловой кислоты к молям белка] 6 моль/моль или больше, например от 6 моль/моль до 15 моль/моль, например от 8 моль/моль до 14 моль/моль, например от 9 моль/моль до 14 моль/моль, например от 10 моль/моль до 14 моль/моль, например от 11 моль/моль до 14 моль/моль, например от 12 моль/моль до 14 моль/моль, например от 12 моль/моль до 13 моль/моль. rFSH может быть продуцирован или экспрессирован в человеческой линии клеток.
FSH (rFSH) для применения согласно изобретению может иметь от 1% до 99% общего сиалилирования, представляющего собой α2,3-сиалилирование. rFSH может иметь 10% или более общего сиалилирования, представляющего собой α2,3-сиалилирование. Например, 20, 30, 40, 50, 60, 70, 80 или 90% или более общего сиалилирования может представлять собой α2,3-сиалилирование. rFSH может предпочтительно включать α2,3-сиалилирование в количестве, которое составляет от 50 до 95% общего сиалилирования, например от 50 до 70% общего сиалилирования, например от 60 до 69% общего сиалилирования, например от 63 до 67%, например около 65% общего сиалилирования. FSH (rFSH) для применения согласно изобретению может иметь от 1% до 99% общего сиалилирования, представляющего собой α2,6-сиалилирование. rFSH (или препарат rFSH) по изобретению может иметь 5% или более, например от 5% до 99%, например от 5% до 50% общего сиалилирования, представляющего собой α2,6-сиалилирование. rFSH может иметь 50% или менее общего сиалилирования, представляющего собой α2,6 сиалилирование. rFSH может предпочтительно включать α2,6-сиалилирование в количестве, которое составляет от 5 до 50% общего сиалилирования, например от 10 до 50% общего сиалилирования, например от 31 до 38%, например около 35% общего сиалилирования. Под сиалилированием подразумевается количество остатков сиаловой кислоты, присутствующих на углеводных структурах FSH. α2,3-сиалилирование означает сиалилирование в положении 2,3 (как хорошо известно в данной области), и α2,6-сиалилирование находится в положении 2,6 (также хорошо известно в данной области). Таким образом, фраза «% общего сиалилирования может представлять собой сх2,3-сиалилирование» относится к % общего числа остатков сиаловой кислоты, присутствующих в FSH, которые сиалилированы в положении 2,3. Термин «% общего сиалилирования представляет собой α2,6-сиалилирование» относится к % общего числа остатков сиаловой кислоты, присутствующих в FSH, которые сиалилированы в положении 2,6.
rFSH может иметь содержание сиаловой кислоты (количество сиалилирования на молекулу FSH) (основанное на массе белка, а не на массе белка плюс углевода) 6% или больше (например от 6% до 15%, например от 7% до 13%, например от 8% до 12%, например от 11% до 15%, например от 12% до 14%) по массе.
rFSH может быть продуцирован или экспрессирован в человеческой линии клеток, например в линии клеток Per.С6, линии клеток НТ1080 и т.д. Это может упрощать (и делать более эффективным) способ продуцирования, так как манипулирование и контроль, например, ростовой среды клеток для сохранения сиалилирования могут быть менее критичными, чем в случае известных способов. Данный способ также может быть более эффективным, так как имеется мало основного продуцированного rFSH по сравнению с продукцией известных продуктов rFSH; продуцируется более кислотный rFSH и разделение/удаление основного FSH является менее проблематичным rFSH может продуцироваться или экспрессироваться в линии клеток PER.C6®, линии клеток, имеющией происхождение от PER.C6®, или модифицированной линии клеток PER.C6®. rFSH, который продуцируется или экспрессируется в человеческой линии клеток (например, линии клеток PER.C6®, линии клеток НТ1080 и т.д.), будет включать некоторое количество α2,6-связанных сиаловых кислот (α2,6 сиалилирование), предоставленных активностью эндогенной сиалилтрансферазы [линии клеток], и будет включать некоторое количество α2,3-связанных сиаловых кислот (α2,3 сиалилирование), предоставленных активностью эндогенной сиалилтрансферазы. Данная линия клеток может быть модифицирована с использованием α2,3-сиалилтрансферазы. Данная линия клеток может быть модифицирована с использованием α2,6-сиалилтрансферазы. Альтернативно или дополнительно, rFSH может включать α2,6-связанные сиаловые кислоты (α2,6 сиалилирование), предоставленные активностью эндогенной сиалилтрансферазы [линии клеток]. Здесь термин «рекомбинантный FSH человеческого происхождения» означает рекомбинантный FSH, который продуцируется или экспрессируется в человеческой линии клеток (например, рекомбинантный FSH, полученный посредством генетической модификации человеческой линии клеток).
rFSH может продуцироваться с использованием α2,3- и/или α2,6- сиалилтрансферазы. В одном примере rFSH продуцируется с использованием α2,3-сиалилтрансферазы. rFSH может включать α2,6-связанные сиаловые кислоты (α2,6-сиалилирование), предоставленные активностью эндогенной сиалилтрансферазы.
Композиция может представлять собой фармацевтическую композицию. Фармацевтическая композиция предназначена для лечения бесплодия. Лечение бесплодия может включать вспомогательные репродуктивные технологии (ART), индуцирование овуляции или внутриматочное осеменение (IUI). Данную фармацевтическую композицию можно использовать, например, при медицинских показаниях, где используют известные препараты FSH.
Продукт или композиция могут быть приготовлены в виде хорошо известных композиций для любого пути введения лекарственного средства, например перорального, ректального, парентерального, чрескожного (например, технология с использованием пластыря), внутривенного, внутримышечного, подкожного, надчревного, внутривагинального, внутрибрюшинного, местного (порошки, мази или капли) или в виде буккального или назального спрея. Типичная композиция содержит фармацевтически приемлемый носитель, такой как водный раствор, нетоксичные эксципиенты, включая соли и консерванты, буферы и тому подобное, как описано, среди прочих, в пятнадцатом издании Remington's Pharmaceutical Sciences (Matt Publishing Company, 1975) на страницах 1405-1412 и 1461-87 и в четырнадцатом XIV издании национального формуляра (American Pharmaceutical Association, 1975).
Примеры подходящих водных и неводных фармацевтических носителей, разбавителей, растворителей или наполнителей включают воду, этанол, полиолы (такие как глицерин, пропиленгликоль, полиэтиленгликоль и тому подобное), карбоксиметилцеллюлозу и их подходящие смеси, растительные масла (такие как оливковое масло) и инъецируемые органические сложные эфиры, такие как этилолеат. Композиции по настоящему изобретению также могут содержать добавки, такие как консерванты, увлажнители, эмульгаторы, поверхностно-активные вещества и диспергирующие агенты, но не ограничивающиеся ими. Для предупреждения роста микробов могут быть включены антибактериальные и противогрибковые агенты, и они включают, например, м-крезол, бензиловый спирт, парабен, хлорбутанол, фенол, сорбиновую кислоту и тому подобное. При включении консерванта предпочтительными являются бензиловый спирт, фенол и/или м-крезол; однако, консервант ни в коей мере не ограничивается данными примерами. Кроме того, может быть желательным включение изотонических агентов, таких как сахара, хлорид натрия и тому подобное. Продукт или композиция может дополнительно содержать соль, содержащую фармацевтически приемлемый катион щелочного металла, выбранную из группы, состоящей из солей Na+ или К+ или их комбинаций. Предпочтительно соль представляет собой соль Na+, например NaCl или Na2SO4.
Предпочтительно продукт или композиция содержит рекомбинантный FSH и один или более чем один из полисорбата 20, L-метионина, фенола динатрия сульфата и натрий-фосфатного буфера.
В некоторых случаях для эффекта пролонгированного действия желательным является замедление абсорбции FSH (и других активных ингредиентов при их наличии) из подкожной или внутримышечной инъекции. Это можно осуществлять посредством применения жидкой суспензии кристаллического или аморфного вещества с плохой растворимостью в воде. Скорость поглощения FSH тогда зависит от его скорости растворения, которая в свою очередь, может зависеть от размера кристалла и кристаллической формы. В качестве альтернативы, замедленную абсорбцию введенной парентерально комбинированной формы FSH осуществляют посредством растворения или суспендирования комбинации FSH в масляном носителе Инъецируемые формы депо можно получать посредством образования микроинкапсулирующих матриц FSH (и других агентов при их наличии) в биоразлагаемых полимерах, таких как полилактид-полигликолид. В зависимости от отношения FSH к полимеру и природы конкретного применяемого полимера, скорость высвобождения FSH можно контролировать Примеры других биоразлагаемых полимеров включают поливинилпирролидон, поли(ортоэфиры), поли(ангидриды) и т.д. Инъецируемые препараты в виде депо также получают посредством захвата FSH в липосомах или микроэмульсиях, которые являются совместимыми с тканями организма.
Инъецируемые композиции могут быть стерилизованы, например, посредством фильтрования через фильтр, задерживающий бактерии, или посредством включения стерилизующих агентов в форме стерильных твердых композиций, которые могут быть растворены или диспергированы в стерильной водной или другой стерильной инъецируемой среде непосредственно перед применением. Инъецируемые композиции могут быть поставлены в любом подходящем контейнере, например флаконе, предварительно заполненном шприце, инъекционных картриджах и тому подобном.
Продукт или композиция могут быть приготовлены для однократного применения или для многократного применения (множества доз) При приготовлении продукта или композиции для многократного применения предпочтительным является включение консерванта. При включении консерванта предпочтительными являются бензиловый спирт, фенол и/или м-крезол; однако, консервант ни в коей мере не ограничивается данными примерами. Приготовленный продукт или композиция для однократного или многократного применения может дополнительно содержать соль, содержащую фармацевтически приемлемый катион щелочного металла, выбранный из группы, состоящей из солей Na+ или К+ или их комбинации. Предпочтительно данная соль представляет собой соль Na+, например NaCl или Na2SO4.
Продукт или композиция могут быть включены в контейнер, такой как флакон, предварительно заполненный картридж (например, для однократного введения или многократного применения) или инъекционное устройство, такое как «шприц-ручка», например, для введения множества доз.
Продукт или композиция могут представлять собой композицию (например, инъецируемую композицию), включающую FSH (возможно с hCG, LH, активностью LH и т.д.). Активность LH, при ее наличии, может происходить от LH или человеческого хорионического гонадотропина - hCG. Если имеется более чем один активный ингредиент (т.е. FSH и, например, hCG или LH), они могут быть подходящими для введения раздельно или совместно. При раздельном введении введение может быть последовательным. Продукт может быть поставлен в любой подходящей упаковке. Например, продукт может включать ряд контейнеров (например, предварительно заполненных шприцев или флаконов), содержащих либо FSH, либо hCG, либо комбинацию (или комбинацию) и FSH, и hCG. hCG может быть рекомбинантным hCG или hCG мочи. Если продукт включает ряд контейнеров (например, предварительно заполненных шприцев или флаконов), содержащих FSH, например рекомбинантный FSH, каждый контейнер может включать одно и то же количество FSH. Один или более чем один контейнер может включать разные количества FSH. Шприцы или флаконы могут быть упакованы в блистерные упаковки или в другие приспособления для поддержания стерильности. Любой продукт возможно может содержать инструкции для применения композиций FSH (и, например, hCG при его наличии). рН и точную концентрацию разных компонентов фармацевтической композиции корректируют согласно традиционной практике в данной области. См. GOODMAN and GILMAN's THE PHARMACOLOGICAL BASIS FOR THERAPEUTICES, 7th ed В предпочтительном воплощении композиции по изобретению поставляют в виде композиций для парентерального введения. Общие способы получения парентеральных композиций известны в данной области и описаны в REMINGTON; THE SCIENCE AND PRACTICE OF PHARMACY, выше, на страницах 780-820 Парентеральные композиции могут быть поставлены в жидкой композиции или в виде твердого вещества, которое будет смешиваться со стерильной инъецируемой средой непосредственно перед введением. В особенно предпочтительном воплощении парентеральные композиции поставляют в стандартной лекарственной форме для облегчения введения и однородности дозировки.
Согласно настоящему изобретению в другом аспекте предложен способ лечения бесплодия [например, бесплодия у пациента, имеющего сывороточный уровень АМН меньше 15 пмоль/л (например, от 0,05 пмоль/л до 14,9 пмоль/л) и имеющего вариант Ser/Ser в положении 680 рецептора FSH], где лечение бесплодия включает (а) идентификацию (например, определение) сывороточного уровня АМН пациента; (б) идентификацию варианта в положении 680 рецептора FSH пациента; и (в) введение дозы 9-24 мкг рекомбинантного фолликулостимулирующего гормона (FSH) в сутки или эквивалентной дозы пациенту, (идентифицированному как) имеющему(ий) сывороточный уровень АМН меньше 15 пмоль/л (например, от 0,05 пмоль/л до 14,9 пмоль/л) и вариант Ser/Ser в положении 680 рецептора FSH. Композиция может содержать от 9 до 24 мкг FSH, например от 10 до 18 мкг FSH, например от 12 до 16 мкг FSH, например от 12 до 15 мкг FSH. Композиция может содержать больше 12 мкг FSH, например от 12,3 до 24 мкг FSH, например от 12,33 до 24 мкг FSH, например от 12,67 до 24 мкг FSH, например от 13 до 24 мкг FSH, например от 13 до 16 мкг FSH, например от 13 до 15 мкг FSH.
Введение FSH может начинаться в сутки один лечения и продолжаться в течение от шести до шестнадцати суток, например от семи до шестнадцати суток, например от 8 до 16 суток, например от 8 до 13 суток.
FSH может быть рекомбинантным FSH. FSH может быть рекомбинантным FSH, включающим α2,3- и α2,6-сиалилирование. FSH может быть рекомбинантным FSH, включающим α2,3- и α2,6-сиалилирование, где от 1 до 99% общего сиалилирования представляет собой α2,6-сиалилирование, и от 99% до 1% общего сиалилирования представляет собой α2,3-сиалилирование. FSH может быть рекомбинантным FSH, включающим «2,3- и α2,6-сиалилирование, где от 1 до 50% общего сиалилирования представляет собой α2,6-сиалилирование, и от 50% до 99% общего сиалилирования представляет собой α2,3-сиалилирование. FSH может быть рекомбинантным FSH, включающим α2,3- и α2,6-сиалилирование, где от 5 до 40% общего сиалилирования представляет собой α2,6-сиалилирование, и от 60% до 95% общего сиалилирования представляет собой α2,3-сиалилирование. Предпочтительно FSH представляет собой рекомбинантный FSH, имеющий происхождение из человеческой линии клеток.
Введение предпочтительно включает суточную дозу, равную количеству FSH, определенному выше и в формуле изобретения или суточную дозу, эквивалентную этому количеству. (Суточная) доза может представлять собой исходную дозу (она может быть снижена, увеличена или поддерживаться на протяжении лечения).
Способ может представлять собой способ лечения бесплодия в первом протоколе стимуляции пациента (субъекта). Будет понятно, что для дальнейших циклов стимуляции дозы могут быть скорректированы согласно реальному ответу яичников в первом цикле.
Согласно настоящему изобретению в другом аспекте предложена композиция (например, фармацевтическая композиция), содержащая FSH для применения в изготовлении лекарственного средства для лечения бесплодия, содержащая от 9 до 24 мкг фолликулостимулирующего гормона (FSH), где лекарственное средство предназначено для (например, ежесуточного) введения пациенту, идентифицированному как (например, выбранному как) имеющий вариант Ser/Ser в положении 680 рецептора FSH (до лечения) Лекарственное средство может быть предназначено для (например, ежесуточного) введения пациенту, идентифицированному как (например, выбранному как) имеющий вариант Ser/Ser в положении 680 рецептора FSH и идентифицированному как (например, выбранному как) имеющий сывороточный уровень АМН меньше 15 пмоль/л (например, от 0,05 пмоль/л до 14,9 пмоль/л) (до лечения). Композиция может содержать от 9 до 24 мкг FSH, например от 10 до 18 мкг FSH, например от 12 до 16 мкг FSH, например от 12 до 15 мкг FSH. Композиция может содержать больше 12 мкг FSH, например от 12,3 до 24 мкг FSH, например от 12,33 до 24 мкг FSH, например от 12,67 до 24 мкг FSH, например от 13 до 24 мкг FSH, например от 13 до 16 мкг FSH, например от 13 до 15 мкг FSH.
Авторы настоящего изобретения также обнаружили, что введение FSH пациентам, идентифицированным как имеющие низкий уровень АМН [уровень АМН меньше 15 пмоль/л (например, от 0,05 пмоль/л до 14,9 пмоль/л), который, в общем, был бы ассоциирован со слабым ответом], а также имеющие вариант Asn/Asn или вариант Asn/Ser в положении 680 рецептора FSH, обеспечивает хороший ответ в показателях развития фолликулов Это достигается при использовании пониженной дозировки FSH и/или пониженной продолжительности лечения по сравнению с лечением пациентов с низким уровнем АМН и вариантом Ser/Ser в положении 680 рецептора FSH. Это обеспечивает приспособление дозы FSH у конкретных пациентов, идентифицированных как имеющие специфический уровень АМН, а также данные специфические полиморфизмы FSHR. Как изложено ниже, ожидаемая продолжительность стимуляции для пациента, имеющего уровень АМН меньше 15 пмоль/л и вариант Asn/Asn, составляет на 1,5 суток меньше, чем продолжительность стимуляции, требующаяся для пациента, имеющего уровень АМН меньше 15 пмоль/л и вариант Ser/Ser (см Фиг 7) Соответственно, приспособление дозы для пациентов, идентифицированных, до лечения, как имеющие и уровень АМН меньше 15 пмоль/л, и вариант Asn/Asn (или как уровень АМН меньше 15 пмоль/л, так и вариант Asn/Ser), может обеспечивать значительную экономию в показателях фармацевтических затрат, а также уменьшение риска потенциальных побочных эффектов из-за введения более высокой общей дозы FSH, чем требующаяся у данных пациентов.
Согласно настоящему изобретению в дополнительном аспекте предложена композиция (например, фармацевтическая композиция) для применения в лечении бесплодия, содержащая от 10 до 12 мкг фолликулостимулирующего гормона (FSH), предназначенная для (например, ежесуточного) введения пациенту, идентифицированному (например, выбранному как) имеющий вариант Asn/Asn или вариант Asn/Ser в положении 680 рецептора FSH (до лечения). Данная композиция может быть предназначена для (например, ежесуточного) введения пациенту, идентифицированному как (например, выбранному как) имеющий вариант Asn/Asn или вариант Asn/Ser в положении 680 рецептора FSH и идентифицированному как (например, выбранному как) имеющий сывороточный уровень АМН меньше 15 пмоль/л (например, от 0,05 пмоль/л до 14,9 пмоль/л) (до лечения). Композиция может быть предназначена для введения пациенту, идентифицированному как (например, выбранному как) имеющий вариант Asn/Asn в положении 680 рецептора FSH и идентифицированному как (например, выбранному как) имеющий сывороточный уровень АМН меньше 15 пмоль/л (например, от 0,05 пмоль/л до 14,9 пмоль/л) (до лечения). Данная композиция может содержать от 10 до меньше чем 12 мкг FSH, например от 10 до 11,9 мкг FSH, например от 11 до 11,9 мкг FSH, например от 11,33 до 11,67 мкг FSH.
Композиция (например, фармацевтическая композиция) может содержать суточную дозу, равную количествам rFSH человеческого происхождения, определенным здесь выше и в формуле изобретения или суточную дозу, эквивалентную этим количествам. Композиция (например, фармацевтическая композиция) может быть предназначена для (ежесуточного) введения FSH, начиная с суток один лечения и продолжая в течение шести-шестнадцати суток, например от семи до шестнадцати суток, например от 8 до 16 суток, например от 8 до 13 суток.
Лечение бесплодия может включать стадию идентификации (например, определения, например, измерения) варианта в положении 680 рецептора FSH пациента; и стадию введения дозы пациенту, (идентифицированному как) имеющему(ий) вариант Asn/Asn или вариант Asn/Ser в положении 680 рецептора FSH. Лечение бесплодия может включать стадию идентификации (например, определения, например, измерения) сывороточного уровня АМН пациента и введение дозы пациенту, (идентифицированному как) имеющему(ий) сывороточный уровень АМН меньше 15 пмоль/л (например, от 0,05 пмоль/л до 14,9 пмоль/л).
Согласно настоящему изобретению в дополнительном аспекте предложена композиция (например, фармацевтическая композиция), содержащая фолликулостимулирующий гормон (FSH) для применения в лечении бесплодия у пациента, имеющего сывороточный уровень АМН меньше 15 пмоль/л (например, от 0,05 пмоль/л до 14,9 пмоль/л) и имеющего вариант Asn/Asn или вариант Asn/Ser в положении 680 рецептора FSH, подлежащая введению в дозе от 10 до 12 мкг рекомбинантного FSH в сутки или в эквивалентной дозе; и где лечение бесплодия включает стадию идентификации (например, определения) сывороточного уровня АМН пациента; стадию идентификации варианта в положении 680 рецептора FSH пациента; и стадию введения композиции пациенту, (идентифицированному как) имеющему(ий) сывороточный уровень АМН меньше 15 пмоль/л (например, от 0,05 пмоль/л до 14,9 пмоль/л) и вариант Asn/Asn или вариант Asn/Ser в положении 680 рецептора FSH. Композиция может содержать от 10 до меньше, чем 12 мкг FSH, например от 10 до 11,9 мкг FSH, например от 11 до 11,9 мкг FSH, например от 11,33 до 11,67 мкг FSH.
Композиция (например, фармацевтическая композиция) может служить для применения в лечении бесплодия у пациента, имеющего сывороточный уровень АМН меньше 15 пмоль/л (например, от 0,05 пмоль/л до 14,9 пмоль/л) и имеющего вариант Asn/Asn в положении 680 рецептора FSH [где лечение бесплодия включает стадию идентификации (например, определения) сывороточного уровня АМН пациента; стадию идентификации варианта в положении 680 рецептора FSH пациента; и стадию введения дозы пациенту (идентифицированному как) имеющему(ий) сывороточный уровень АМН меньше 15 пмоль/л (например, от 0,05 пмоль/л до 14,9 пмоль/л) и вариант Asn/Asn в положении 680 рецептора FSH].
Согласно настоящему изобретению в дополнительном аспекте предложен способ лечения бесплодия [например, бесплодия у пациента, имеющего сывороточный уровень АМН меньше 15 пмоль/л (например, от 0,05 пмоль/л до 14,9 пмоль/л) и имеющего вариант Asn/Asn или вариант Asn/Ser в положении 680 рецептора FSH], где лечение бесплодия включает: (а) идентификацию (например, определение) сывороточного уровня АМН пациента; (б) идентификацию варианта в положении 680 рецептора FSH пациента; и (в) введение дозы 10-12 мкг рекомбинантного фолликулостимулирующего гормона (FSH) в сутки или эквивалентной дозы пациенту, (идентифицированному как) имеющему(ий) сывороточный уровень АМН меньше 15 пмоль/л (например, от 0,05 пмоль/л до 14,9 пмоль/л) и вариант Asn/Asn или вариант Asn/Ser в положении 680 рецептора FSH. Композиция может содержать от 10 до меньше, чем 12 мкг FSH, например от 10 до 11,9 мкг FSH, например от 11 до 11,9 мкг FSH, например от 11,33 до 11,67 мкг FSH.
Введение FSH может начинаться в сутки один лечения и продолжаться в течение от шести до тринадцати суток, например, от семи до тринадцати суток, например, от 8 до 13 суток, например, от 8 до 11 суток.
Согласно настоящему изобретению в другом аспекте предложена композиция (например, фармацевтическая композиция), содержащая FSH для применения в изготовлении лекарственного средства для лечения бесплодия, содержащая от 10 до 12 мкг фолликулостимулирующего гормона (FSH), где данное лекарственное средство предназначено для (например, ежесуточного) введения пациенту, идентифицированному как (например, выбранному как) имеющий вариант Asn/Asn или вариант Asn/Ser в положении 680 рецептора FSH (до лечения). Лекарственное средство может быть предназначено для (например, ежесуточного) введения пациенту, идентифицированному как (например, выбранному как) имеющий вариант Asn/Asn или вариант Asn/Ser в положении 680 рецептора FSH и идентифицированному как (например, выбранному как) имеющий сывороточный уровень АМН меньше 15 пмоль/л (например, от 0,05 пмоль/л до 14,9 пмоль/л) (до лечения). Лекарственное средство может быть предназначено для введения пациенту, идентифицированному как (например, выбранному как) имеющий вариант Asn/Asn в положении 680 рецептора FSH и идентифицированному как (например, выбранному как) имеющий сывороточный уровень АМН меньше 15 пмоль/л (например, от 0,05 пмоль/л до 14,9 пмоль/л) (до лечения). Композиция может содержать от 10 до меньше, чем 12 мкг FSH, например от 10 до 11,9 мкг FSH, например от 11 до 11,9 мкг FSH, например от 11,33 до 11,67 мкг FSH.
Будет понятно, что FSH, идентификация сывороточного уровня АМН пациента и варианта в положении 680 рецептора FSH и т.д. для данных аспектов изобретения могут быть такими же, как и для других перечисленных здесь аспектов изобретения.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение теперь будет описано более подробно со ссылкой на приложенные чертежи, в которых:
на Фиг. 1 показана карта плазмиды экспрессионного вектора рFSНальфа/бета.;
на Фиг. 2 показан экспрессионный вектор α2,3-сиалилтрансферазы (ST3GAL4);
на Фиг. 3 показан экспрессионный вектор α2,6-сиалилтрансферазы (ST6GAL1);
Фиг. 4 представляет собой схематическую диаграмму рецептора FSH, показывающую положение полиморфизмов в аминокислотных положениях 307 и 680 экзона 10, и в положении 29 в промоторе;
на Фиг. 5 показано распределение гаплотипов SNP в гене рецептора FSH для 222 пациентов, которых лечили FSH в исследовании из Примера 8;
Фиг. 6 представляет собой таблицу результатов, показывающую, для полного набора анализа, наблюдаемую продолжительность лечения гонадотропином (FSH) (сутки) и общую доставленную дозу гонадотропина (FSH) (мкг) пациентам/субъектам, имеющим АМН меньше 15 пмоль/л, в каждом из трех отличных генотипов рецептора FSH в отношении положения 680: Asn/Asn, Asn/Ser и Ser/Ser; и
Фиг. 7 представляет собой таблицу результатов, показывающую, для полного набора анализа, ожидаемую продолжительность (сутки) лечения гонадотропином (FSH), доставленным пациентам/субъектам, имеющим АМН меньше 15 пмоль/л, в каждом из трех отличных генотипов рецептора FSH в отношении положения 680: Asn/Asn, Asn/Ser и Ser/Ser, с корректировкой на дозу.
Выбор последовательности
Человеческий FSH
Кодирующую область гена альфа полипептида FSH использовали согласно Fiddes and Goodman. (1981). Последовательность депонирована как АН007338, и во время конструирования не было других вариантов данной белковой последовательности. Данная последовательность именуется здесь SEQ ID NO: 1.
Кодирующую область гена бета полипептида FSH использовали согласно Keene et al (1989). Последовательность депонирована как NM 000510, и во время конструирования не было других вариантов данной белковой последовательности. Данная последовательность именуется здесь SEQ ID NO: 2.
Сиалилтрансфераза
α2,3-Сиалилтрансфераза - кодирующую область гена бета-галактозид-альфа-2,3-сиалилтрансферазы 4 (α2,3-сиалилтрансфераза, ST3GAL4) использовали согласно Kitagawa and Paulson (1994). Данная последовательность депонирована как L23767 и именуется здесь SEQ ID NO. 3.
α2,6-Сиалилтрансфераза - кодирующую область гена бета галактозамид-альфа-2,6-сиалилтрансферазы 1 (α2,6-сиалилтрансфераза, ST6GAL1) использовали согласно Grundmann et al. (1990). Последовательность депонирована как NM_003032 и именуется здесь SEQ ID NO: 4.
ПРИМЕРЫ
Пример 1. Конструирование экспрессионного вектора FSH
Кодирующую последовательность альфа полипептида FSH (АН007338, SEQ ID NO: 1) и бета полипептида FSH (NM_003032, SEQ ID NO: 2) амплифицировали посредством PCR с использованием комбинаций праймеров FSHa-fw и FSHa-rev и FSHb-fw и FSHb-rev соответственно.

Полученную в результате амплифицированную ДНК FSH бета расщепляли рестрикционными ферментами AscI и HpaI и вставляли в сайты AscI и HpaI на экспрессионном векторе млекопитающих, управляемом CMV (цитомегаловирус), несущем неомициновый селективный маркер. Аналогично ДНК FSH альфа расщепляли BamHI и NheI и вставляли в сайты SamHI и NheI на экспрессионном векторе, уже содержащем ДНК бета полипептида FSH.
Данную векторную ДНК использовали для трансформации штамма DH5α Е. coli. Колонии собирали для амплификации. Колонии, содержащие вектор, содержащие и FSH альфа, и бета, отбирали для секвенирования, и они все содержали правильные последовательности согласно SEQ ID NO: 1 и SEQ ID NO: 2. Плазмиду pFSH A+B#17 отбирали для трансфекции (Фиг. 1).
Пример 2. Конструирование экспрессионного вектора ST3
Кодирующую последовательность бета-галактозид-альфа-2,3-сиалилтрансферазы 4 (ST3, L23767, SEQ ID NO: 3) амплифицировали посредством PCR с использованием комбинации праймеров 2,3STfw и 2,3STrev.
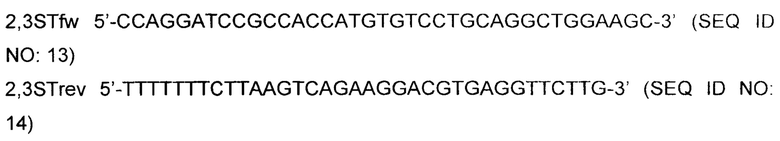
Полученную в результате амплифицированную ДНК ST3 расщепляли рестрикционными ферментами BamHI и Af/II и вставляли в сайты BamHI и Af/II на экспрессионном векторе млекопитающих, управляемом CMV, несущем гигромициновый маркер устойчивости. Вектор амплифицировали, как описано ранее, и секвенировали. Клон pST#1 (Фиг. 2) содержал правильную последовательность согласно SEQ ID NO: 3 и был выбран для трансфекции.
Пример 3. Конструирование экспрессионного вектора ST6
Кодирующую последовательность бета-галактозамид-альфа-2,6-сиалилтрансферазы 1 (ST6, NM_003032, SEQ ID NO: 4) амплифицировали посредством PCR с использованием комбинации праймеров 2,6STfw и 2,6STrev.

Полученную в результате амплифицированную ДНК ST6 расщепляли рестрикционными ферментами SamHI и Af/II и вставляли в сайты SamHI и Af/II на экспрессионном векторе млекопитающих, управляемом CMV, несущем гигромициновый маркер устойчивости. Вектор амплифицировали, как описано ранее, и секвенировали. Клон pST6#11 (Фиг. 3) содержал правильную последовательность согласно SEQ ID NO. 4 и был выбран для трансфекции
Пример 4. Стабильная экспрессия pFSH α+β в клетках PER.C6®. Трансфекция, выделение и скрининг клонов
Клоны PER.C6®, продуцирующие FSH, генерировали посредством экспрессирования обеих полипептидных цепей FSH из одной плазмиды (см. Пример 1).
Для получения стабильных клонов использовали трансфекционный агент на основе липосом с конструкцией pFSH α+β. Стабильные клоны подвергали селекции в VPRO, дополненной 10% FCS (фетальная телячья сыворотка) и содержащей G418. Через три недели после трансфекции вырастали клоны, устойчивые к G418. Клоны подвергали селекции для выделения. Выделенные клоны культивировали в селективной среде до 70-80%-ной конфлюентности. Супернатанты анализировали на предмет содержания белка FSH с использованием ELISA (твердофазный иммуноферментный анализ), селективного в отношении FSH, и на предмет фармакологической активности на рецепторе FSH в клонированной линии клеток с использованием анализа накопления сАМР (циклический аденозинмонофосфат). Клоны, экспрессирующие функциональный белок, продвигали для увеличения объема культуры в 24 лунки, 6 лунок и колбы Т80.
Исследования для определения продуктивности и качества материала из семи клонов инициировали в колбах Т80 с получением достаточного количества материала. Клетки культивировали в дополненных средах, как описано ранее, в течение 7 суток, и собирали супернатант. Продуктивность определяли с использованием ELISA, селективного в отношении FSH. Изоэлектрический профиль вещества определяли посредством изоэлектрофокусировки (IEF) способами, известными в данной области. Отбирали клоны с достаточной продуктивностью и качеством для конструирования сиалилтрансферазы.
Пример 5. Уровень сиалилирования увеличивается в клетках, которые сверхэкспрессируют α2,3-сиалилтрансферазу. Стабильная экспрессия pST3 в клетках PER.C6®, экспрессирующих FSH; трансфекция, выделение и скрининг клонов.
Клоны PER.C6®, продуцирующие высокосиалилированный FSH, получали посредством экспрессирования α2,3-сиалилтрансферазы из отдельных плазмид (Пример 2) в клетках PER.C6®, уже экспрессирующих обе полипептидные цепи FSH (из Примера 4). Клоны, продуцированные из клеток PER.C6®, как изложено в Примере 4, отбирали в отношении их характеристик, включающих продуктивность, хороший профиль роста, продукцию функционального белка и продуцированный FSH, который включал некоторое сиалилирование. Стабильные клоны получали, как описано ранее в Примере 4. Клоны выделяли, размножали и подвергали анализу. Клоны с α2,3-сиалилтрансферазой адаптировали к бессывороточным средам и условиям суспензии.
Как и ранее, клоны подвергали анализу с использованием ELISA, селективного в отношении FSH, функционального ответа в линии клеток с рецептором FSH, IEF, скорости метаболического клиренса и анализа Стилман-Поли (Sleelman-Pohley). Результаты сравнивали с имеющимся в продаже рекомбинантным FSH (Gonal-f, Serono) и родительскими линиями клеток PER.C6® с FSH. FSH, продуцированный большинством клонов, имеет значительно улучшенное сиалилирование (т.е. в среднем больше изоформ FSH с большим числом сиаловых кислот) по сравнению с FSH, экспрессированным без α2,3-сиалилтрансферазы. В заключение, экспрессия FSH совместно с сиалилтрансферазой в клетках PER.C6® приводила к повышенным уровням сиалилированного FSH по сравнению с клетками, экспрессирующими только FSH.
Пример 6. Обзор продуцирования и очистки
Разработали методику для продуцирования FSH в клетках PER С6®, которые культивировали в суспензии в бессывороточной среде. Методика описана ниже, и ее применяли к нескольким линиям клеток PER.C6®, продуцирующим FSH.
FSH из α2,3-клона (Пример 5) получали с использованием модификации способа, описанного Lowry et al. (1976).
Для продуцирования PER.C6®-FSH линии клеток адаптировали к бессывороточной среде, то есть Excell 525 (JRH Biosciences) Клетки сначала культивировали с образованием монослоя, конфлюентного на 70%-90%, в колбе для культивирования Т80. При пассировании клетки ресуспендировали в бессывороточной среде, Excell 525 плюс 4 мМ L-глутамин, до плотности клеток 0,3×106 клеток/мл. 25 мл суспензии клеток помещали в 250 мл встряхиваемую колбу и встряхивали при 100 об./мин при 37° при 5% CO2. После достижения плотности клеток больше 1×106 клеток/мл клетки субкультивировали до плотности клеток 0,2 или 0,3×106 клеток/мл и дополнительно культивировали во встряхиваемых колбах при 37°С, 5% CO2 и 100 об./мин.
Для продуцирования FSH клетки переносили в бессывороточную продукционную среду, т.е. VPRO (JRH Biosciences), которая поддерживает рост клеток PER.C6®, до очень высоких плотностей клеток (обычно больше 107 клеток/мл в периодической культуре). Клетки сначала культивировали до больше чем 1×106 клеток/мл в Excell 525, затем центрифугировали в течение 5 мин при 1000 об./мин и затем суспендировали в среде VPRO плюс 6 мМ L-глутамин до плотности 1×106 клеток/мл. Клетки затем культивировали во встряхиваемой колбе в течение 7-10 суток при 37°С, 5% CO2 и 100 об./мин. На протяжении этого периода клетки вырастали до плотности, большей чем 107 клеток/мл. Культуральную среду отбирали после того, как жизнеспособность клеток начинала снижаться. Клетки центрифугировали в течение 5 мин при 1000 об./мин, и супернатант использовали для количественного измерения и очистки FSH. Концентрацию FSH определяли с использованием ELISA (DRG EIA 1288).
Затем проводили очистку FSH с использованием модификации способа, описанного Lowry et al. (1976). Проводили очистку с использованием хроматографии, селективной в отношении заряда, для обогащения высокосиалилированных форм способами, хорошо известными в данной области.
На протяжении всех хроматографических процедур обогащение сиалилированных форм FSH, как здесь заявлено, подтверждали посредством RIA (радиоиммуноанализ) (DRG EIA 1288) и/или IEF.
Пример 7. Количественное измерение относительных количеств α2,3- и α2,6-сиаловой кислоты
Относительные процентные количества α2,3- и α2,6-сиаловой кислоты на очищенном rFSH (Пример 6) измеряли с использованием известных методик.
N-гликаны высвобождали из образцов с использованием ПНГазы F (пептид-N-гликозидаза F) при денатурирующих условиях и затем метили 2-аминобензамидом. Высвобожденные формы гликанов затем разделяли и анализировали посредством слабой анионообменной (WAX) колонки для определения распределения заряда. Меченые гликаны, обработанные 2,3,6,8-сиалидазой для определения общей сиаловой кислоты и 2,3-сиалидазой для определения 2,3-сиаловой кислоты далее анализировали посредством колонки WAX.
Относительные процентные содержания заряженных гликанов рассчитывали из структур, присутствующих в пулах нерасщепленного и расщепленного гликана, и они показаны на Фиг. 4 (для 8 образцов). Обнаружили, что они находятся в интервалах 50%-95% (например, от примерно 80% до 90%) для α2,3-сиалилирования и от 5% до 50%, обычно примерно от 10 до 20% (или примерно 31% или 35%) для α2,6-сиалилирования.
Пример 8 - многодозовое исследование, в котором изучают FE 999049 по сравнению с GONAL-F
В следующем описано рандомизированное контролируемое слепое для оценивающего многонациональное многоцентровое испытание с параллельными группами, оценивающее связь доза-ответ FE 999049 у пациентов, подвергающихся контролируемой стимуляции яичников для оплодотворения in vitro (IVF) / внутрицитоплазматической инъекции спермы (ICSI). Популяция пациентов представляла собой 265 IVF пациентов в возрасте от 18 до 37 лет с BMI от 18,5 до 32,0 кг/м2.
Данное испытание было разработано как испытание доза-ответ с числом извлеченных ооцитов в качестве первичного ожидаемого результата. В отношении вторичных ожидаемых результатов будут исследовать качественное и количественное влияние разных доз FE 999049 относительно эндокринного профиля, развития фолликулов, оплодотворения ооцитов, качества эмбрионов и эффективности лечения (т.е. общего потребления гонадотропина и продолжительности стимуляции). Данное испытание разрабатывается для оценки эффективности FE 999049 для установления беременности при использовании в контролируемой стимуляции яичников для циклов IVF/ICSI.
Субъектов оценивали в пределах 3 месяцев до рандомизации на предмет соблюдения схемы и режима лечения с критериями включения и исключения, включающими оценку антимюллеровского гормона (АМН) для увеличения гомогенности испытуемой популяции в отношении ответа яичников и для минимизации числа потенциальных слабых и гиперреспондеров в отношении доз FE 999049 и дозы GONAL-F, используемой в испытании. Оценку АМН осуществляли с использованием набора для твердофазного иммуноферментного анализа АМН Gen-II (Beckman Coulter, Inc., Webster, Техас). Данный анализ может выявлять концентрации АМН, большие чем 0,57 пмоль/л, с минимальной границей количественного измерения 1,1 пмоль/л.
В сутки 2-3 их менструального цикла субъектов рандомизировали способом 1:1:1:1:1:1 для лечения одним из следующих количеств FE 999049. 90 IU, 120 IU, 150 IU, 180 IU или 210 IU, или 150 IU GONAL-F, и инициировали стимуляцию яичников. Рандомизацию разделяли согласно уровню АМН в момент скрининга [5,0-14,9 пмоль/л (низкий уровень АМН) и от 15,0 до 44,9 пмоль/л (высокий уровень АМН)].
Заполнение Gonal-F осуществляют по массе (FbM), по требованию FDA (Управление США по контролю качества пищевых продуктов и лекарственных средств); следовательно, подходящей является ссылка на дозу в мкг На этикетке Gonal-F показано 600 IU/44 мкг, что показывает, что 150 IU составляет 11 мкг. Однако имеется некоторое варьирование, и сертификат партии для данного испытания указывал то, что 11,3 мкг Gonal-F были эквивалентными 150 IU. Дозы FE999049 представлены по содержанию белка (мкг), а не по биологической активности. Таким образом, дозы FE999049 составляли 5,2 мкг (90 IU), 6,9 мкг (120 IU), 8,6 мкг (150 IU), 10,3 мкг (180 IU) или 12,1 мкг (210 IU)
Субъект и распределение дозы излагают следующим образом (данные представляют собой число субъектов):
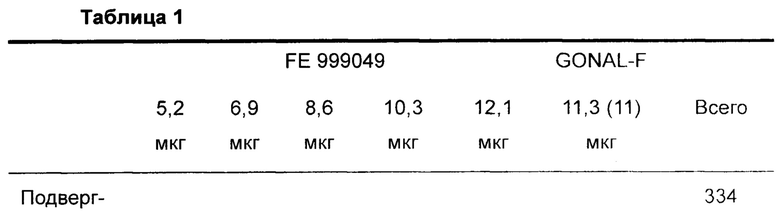
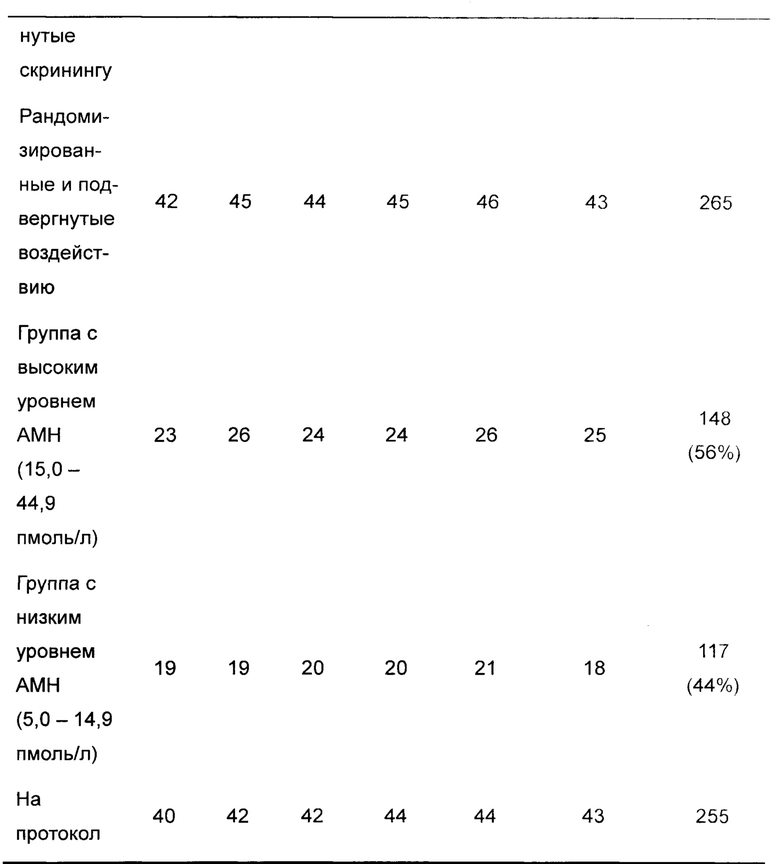
Уровень суточной дозы FE 999049 или GONAL-F фиксируют на протяжении всего периода стимуляции. Во время стимуляции субъектов отслеживают в сутки стимуляции 1, 4 и 6, и затем по меньшей мере в каждые вторые сутки. При наблюдении 3 фолликулов, больших чем или равных 15 мм, посещения осуществляют ежесуточно. Субъектов лечат FE 999049 или GONAL-F в течение максимум 16 суток.
Для предупреждения преждевременного всплеска LH можно инициировать введение антагониста GnRH (ганиреликса ацетат, ORGALUTRAN, MSD / Schering-Plough) в сутки стимуляции 6 при суточной дозе 0,25 мг и продолжать на протяжении всего периода стимуляции. Запуск конечного созревания фолликулов осуществляют в сутки, когда наблюдается 3 или более фолликулов с диаметром 17 мм или более. Если имеется меньше 25 фолликулов с диаметром 12 мм или более, вводят 250 мкг рекомбинантного hCG (хориогонадотропин альфа, OVITRELLE, Merck Serono / EMD Serono). Если имеется 25-35 фолликулов с диаметром 12 мм или более, вводят 0,2 мг агониста GnRH (трипторелина ацетат, DECAPEPTYL / GONAPEPTYL, Ferring Pharmaceuticals). В случае избыточного ответа яичников, определенного как больше 35 фолликулов с диаметром 12 мм или более, лечение отменяют. В случае слабого ответа яичников, определенного как меньше 3 фолликулов с диаметром 10 мм или более, наблюдаемых в сутки стимуляции 10, цикл мог быть отменен.
Извлечение ооцитов происходит через 36 ч (плюс/минус 2 ч) после запуска конечного созревания ооцитов, и ооциты осеменяют посредством IVF и/или ICSI. Оплодотворение и развитие эмбриона оценивают от извлечения ооцитов до суток переноса. Для субъектов, которые подвергаются запуску конечного созревания фолликулов с использованием hCG, одну бластоцисту наилучшего доступного качества переносят в сутки 5 после извлечения ооцитов, тогда как остальные бластоцисты замораживают. Для субъектов которые подвергаются запуску конечного созревания фолликулов с использованием агониста GnRH, не происходит переноса эмбриона в свежем цикле, и бластоцисты вместо этого замораживают в сутки 5. Предоставляют вагинальные 100 мг таблетки прогестерона (LUTINUS, Ferring Pharmaceuticals) 3 раза в сутки для поддержки лютеальной фазы с суток после извлечения ооцитов до суток посещения в связи с клинической беременностью. Анализ на (ihCG проводится через 13-15 суток после переноса эмбриона, и клиническая беременность будет подтверждена посредством трансвагинального ультразвукового исследования (TVU) через 5-6 недель после переноса эмбрионов.
Результаты
Число извлеченных ооцитов (первичный ожидаемый результат) показано в Таблице 2.
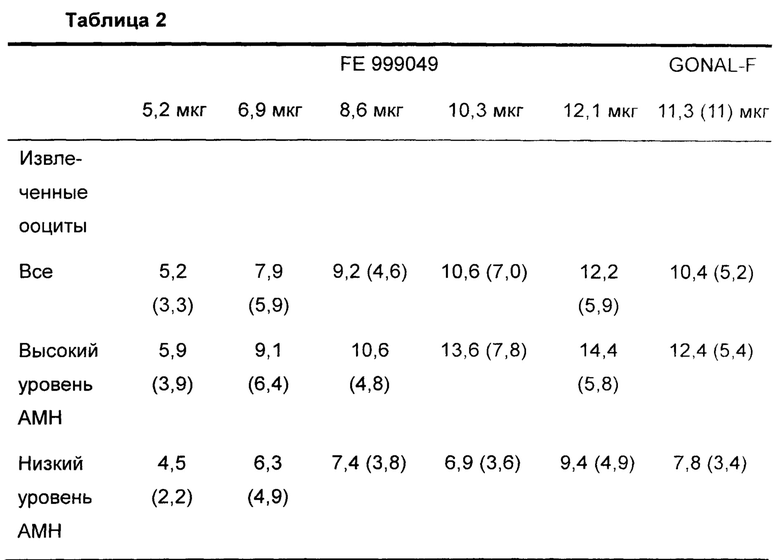
Данные представляют собой средние значения (SD - стандартное отклонение)
Первичная цель была удовлетворена: была установлена значимая связь доза-ответ для FE 999049 в отношении числа извлеченных ооцитов. Эти данные наблюдали не только для общей испытуемой популяции, но также и для каждой из двух групп АМН, используемых при рандомизации.
Значимая связь доза-ответ для FE 999049 была продемонстрирована для всех ключевых объективных фармакодинамических параметров, например эстрадиола, ингибина В и ингибина А. При аналогичном уровне дозы в микрограммах фармакодинамические ответы при использовании FE 999049 были больше, чем при использовании GONAL-F (эти результаты не показаны).
Сывороточные концентрации FSH после воздействия FE 999049 были значимо выше, чем для GONAL-F. Данные результаты подтверждают, что РК профиль FE 999049 отличается от профиля GONAL-F.
Частоты оплодотворения, развитие бластоцист и частоты беременности у пациентов с IVF/ICSI, которых лечили FE 999049, находились в пределах ожиданий.
При применении FE 999049 не было беспокойства относительно безопасности. Была документально подтверждена хорошая местная переносимость.
Дополнительный анализ
Авторы изобретения дополнительно проанализировали данные для идентификации доз(ы) FE 999049, которые удовлетворяют следующим критериям в отношении числа извлеченных ооцитов:
• ооциты, извлеченные в интервале 8-14
• минимизация доли пациентов с менее чем 8 ооцитами
• минимизация доли пациентов с менее чем 4 или 20 или более ооцитами
Группа с низким уровнем АМН
Как видно в Таблице 2, доза FE 999049, которая удовлетворяла первому критерию (ооциты, извлеченные в интервале 8-14), составляла 12,1 мкг (в среднем 9,4 извлеченных ооцитов). Распределение ооцитов показано в Таблице 3.
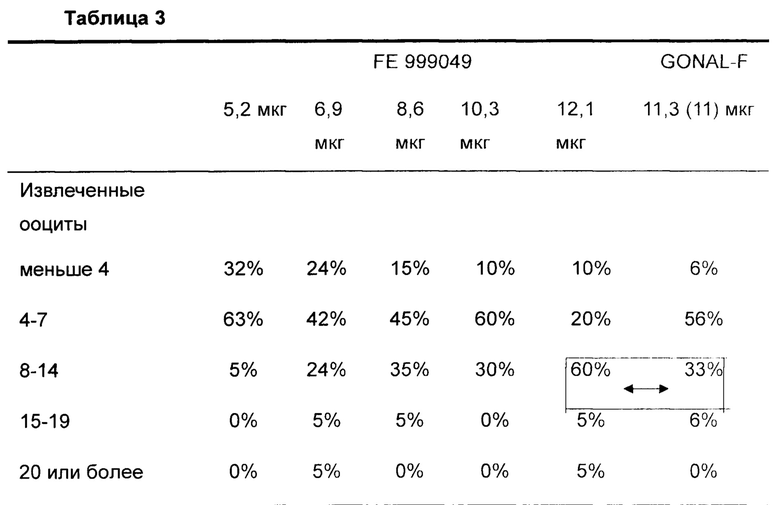
Данные представляют собой % субъектов
Как показано прямоугольником и стрелками, доза 12,1 мкг FE 999049 обеспечивает извлечение самого желательного числа ооцитов у 60% субъектов в группе с низким уровнем АМН. Это является заметным улучшением по сравнению с Gonal-F (самое желательное число ооцитов только у 33% субъектов). Отсутствовали указания раннего OHSS умеренной или тяжелой природы, и отсутствовали случаи требующихся предупредительных действий, нет беспокойства, связанного с дозой 12,1 мкг FE 999049 у пациента, имеющего низкий уровень АМН.
Таким образом, авторы изобретения обнаружили, что доза или доза, эквивалентная 6-24 мкг, например от 9 до 14 мкг, например 12 мкг рекомбинантного FSH человеческого происхождения, является подходящей для применения в лечении бесплодия у пациента, имеющего сывороточный уровень АМН меньше 15 пмоль/л, например 0,05-14,9 пмоль/л, например 5,0-14,9 пмоль/л. Данная доза обеспечивает эффективный ответ при минимизации риска OHSS.
Исследовательская оценка
В качестве исследовательской оценки авторы настоящего изобретения исследовали вклад полиморфизма рецептора FSH в ответ яичников и эффективность лечения после стимуляции FE 999049.
Геномную ДНК от всех пациентов в исследовании анализировали на предмет однонуклеотидного полиморфизма (SNP) в положениях 29, 307 и 680 FSH-R в University of Modena and Reggio Emilia, Италия Фиг. 4 представляет собой схематическую диаграмму рецептора FSH, показывающую положение полиморфизмов в аминокислотных положениях 307 и 680 экзона 10 и положении 29 в промоторе. Данное распределение комбинаций SNP FSH-R является следующим: АА 7%, AG 35% и GG 58% для положения 29; Thr/Thr 29%, Ala/Thr 54% и Ala/Ala 17% для положения 307; и Asn/Asn 30%, Asn/Ser 53% и Ser/Ser 17% для положения 680. На Фиг. 5 показано распределение гаплотипов SNP в гене рецептора FSH для 222 пациентов, которых лечили FSH в исследовании Примера 8. Распределение для каждого положения и общие комбинации не были значимо отличными между группами с низким уровнем АМН и высоким уровнем АМН.
Результаты данного клинического испытания дополнительно анализировали для оценки того, имел ли SNP какой-либо эффект на продолжительность лечения и общую требующуюся дозу. Это делали для группы с низким уровнем АМН и группы с высоким уровнем АМН.
Полиморфизм FSHR исследовали посредством PCR (полимеразная цепная реакция) и RFLP (полиморфизм длин рестрикционных фрагментов) способами, известными в данной области. Женщин классифицировали как генотипы Asn/Asn, Asn/Ser и Ser/Ser. Генетический анализ описан в следующем обзорном протоколе, и пациенты подписывали специальное информированное согласие. Образцы отбирали как часть других образцов крови в сутки стимуляции 1. Их измеряли в University of Modena and Reggio Emilia.
Обзор методик, используемых для анализа SNP в гене рецептора FSH
Общие методики:
1. Экстракция геномной ДНК (из крови с использованием набора для экстракции геномной ДНК Nucleon, GE HEALTHCARE).
2. Рабочие методики с использованием Nanodrop.
Методики HRM (плавления с высоким разрешением):
Генотипирование SNP посредством методологии плавления с высоким разрешением (HRM) (с использованием фермента трески SsoFast EvaGreen Supermix 172-5201, Bio-Rad; планшетов HSP-96, кат.№HSP9645, Bio-Rad; и термоциклера в реальном времени CFX96 Bio-Rad).
Методики секвенирования:
В случае сомнений относительно результатов HRM (после двух независимых HRM на тех же самых образцах) используют следующие методики секвенирования:
1. Реакция и амплификация PCR.
2. Очистка продукта PCR.
3. Количественное измерение очищенного продукта PCR.
4. Протокол реакции секвенирования.
5. Очистка продукта секвенирования.
6. Разделение посредством капиллярного электрофореза с использованием установки ABI PRISM 3130.
7. Оценка и подтверждение результатов, полученных посредством секвенирования на основе капиллярного электрофореза с использованием ABI PRISM 3130.
Результаты
Фиг. 7 представляет собой таблицу результатов, показывающую, для полного набора анализа, ожидаемую продолжительность (сутки) лечения гонадотропином (FSH), доставленного пациентам/субъектам, имеющим уровень АМН меньше 15 пмоль/л в каждом из трех отличных генотипов рецептора FSH в отношении положения 680: Asn/Asn, Asn/Ser и Ser/Ser, с корректировкой на дозу.
На Фиг. 7 показано, что ожидаемая средняя продолжительность лечения, требующегося для стимуляции пациента, имеющего уровень АМН меньше 15 пмоль/л и вариант Ser/Ser, составляет 9,59 суток, что примерно на 1,5 суток дольше, чем таковая для лечения, требующегося для стимуляции пациента, имеющего уровень АМН меньше 15 пмоль/л и вариант Asn/Asn (8,13 суток), и примерно на 1,3 суток дольше, чем таковая для лечения, требующегося для стимуляции пациента, имеющего уровень АМН меньше 15 пмоль/л и вариант Ser/Asn (8,26 суток).
Как показано выше, успех (в показателях беременности и/или живорождения) более вероятен, если пациент имеет адекватный ответ (ожидаемое мультифолликулярное развитие яичников, увеличение циркулирующего 17-β-эстрадиола), происходящий в пределах идеального терапевтического окна. Успех дополнительно усиливается, если ответ находится в пределах центра данного терапевтического окна; то есть, не слишком рано в окне и не слишком поздно. Уменьшение продолжительности лечения у пациентов, имеющих низкий уровень АМН и вариант Ser/Ser в положении 680 рецептора FSH (посредством увеличения дозы выше 12 мкг) может приводить ответ к центру терапевтического окна, с увеличенной вероятностью успеха.
Соответственно, может быть возможным приспособление дозы до лечения для пациентов, идентифицированных как имеющие уровень АМН меньше 15 пмоль/л и вариант Ser/Ser. Идентификация до лечения пациентов, имеющих Ser/Ser, может позволять увеличение исходной дозы у данных пациентов по сравнению с пациентами, имеющими Ser/Asn и Asn/Asn.
Как изложено выше, доза 12,1 мкг FE 999049 обеспечивает извлечение самого желательного числа ооцитов у 60% субъектов в группе с низким уровнем АМН (Таблица 3). Группа с низким уровнем АМН, показанная в Таблице 3, включала пациентов, имеющих вариант Ser/Ser, а также пациентов, имеющих Ser/Asn и Asn/Asn. Введение более высокой исходной дозы (например, от 9 до 24 мкг, например от более чем 12 до 24 мкг, например 12,33 мкг или 13 мкг рекомбинантного FSH человеческого происхождения) пациентам, имеющим низкий уровень АМН [уровень АМН меньше 15 пмоль/л, (например, от 0,05 пмоль/л до 14,9 пмоль/л, например от 5,0 пмоль/л до 14,9 пмоль/л)], а также имеющим вариант Ser/Ser в положении 680 рецептора FSH, может быть полезным, так как оно может обеспечивать повышенную вероятность успеха (в показателях беременности и/или живорождения) и лучшую прогнозируемость успеха.
На Фиг. 7 показано, что средняя продолжительность лечения, требующаяся для стимуляции пациента, имеющего уровень АМН меньше 15 пмоль/л и вариант Asn/Asn, составляет 8,13 суток, и средняя продолжительность лечения, требующаяся для стимуляции пациента, имеющего уровень АМН меньше 15 пмоль/л и вариант Ser/Asn, составляет 8,26 суток - примерно на 1,5-1,3 суток короче, чем продолжительность эквивалентного лечения пациента, имеющего уровень АМН меньше 15 пмоль/л и вариант Ser/Ser (9,59 суток). Таким образом, идентификация до лечения пациентов, имеющих уровень АМН меньше 15 пмоль/л и вариант Ser/Asn и Asn/Asn, может позволять уменьшение исходной дозы для этих пациентов до менее чем 12 мкг FE 999049, например от 10 до 12 мкг, или уменьшение продолжительности лечения, при одновременном обеспечении хорошего ответа в показателях развития фолликулов. Это может давать пользу в показателях стоимости фармацевтического средства и также в показателях уменьшения риска, ассоциированного с введением более высокой дозы, чем требующаяся для эффекта у данных пациентов.
Фиг. 6 представляет собой таблицу результатов, показывающую, для полного анализируемого набора, наблюдаемую продолжительность (сутки) лечения гонадотропином (FSH) и общую дозу (мкг) гонадотропина (FSH), доставленную пациентам/субъектам, имеющим уровень АМН меньше 15 пмоль/л, в каждом из трех отличных генотипов рецептора FSH в отношении положения 680: Asn/Asn, Asn/Ser и Ser/Ser. Это подтверждает эффекты, показанные на Фиг. 7.
Данные результаты не показывали этот эффект, связанный с SNP, в популяции с высоким уровнем АМН.
Это обеспечивает приспособление дозы FSH у конкретных пациентов, идентифицированных как имеющие специфический уровень АМН и специфический полиморфизм FSHR.
Пример 9 - индивидуализированный протокол COS (низкий уровень АМН)
Выбранные пациенты близки к тому, чтобы подвергнуться COS для оплодотворения in vitro (IVF) / внутрицитоплазматической инъекции спермы (ICSI) посредством способов, известных в данной области Протокол предобработки включает оценку/скрининг сывороточного уровня АМН пациента с использованием набора для твердофазного иммуноферментного анализа АМН Gen-II (Beckman Coulter, Inc., Webster, Техас). Данный анализ может выявлять концентрации АМН больше, чем 0,57 пмоль/л с минимальным порогом количественного измерения 1,1 пмоль/л. АМН может быть измерен с использованием других наборов для анализа (например, доступных от Roche) Протокол предобработки включает идентификацию аллельного варианта в положении 680 рецептора FSH, с последующей экстракцией геномной ДНК способами, хорошо известными в данной области (например, посредством набора для экстракции геномной ДНК из крови и последующего секвенирования ДНК, как описано, например, в Gromoll et al, Methods, 21, 83-97 (2000), Simoni et al, Journal of Clinical Endocrinology and Metabolism, Vol 84, No. 2, 751-755 (1999), Falconer et al, Acta Obstet Gynecol Scand 2005: 84: 806-811 (2005) и в ссылках в них, или посредством способа PCR и RFLP, такого как способ, изложенный в Loutradis et al, Journal of Assisted Reproduction and Genetics, Vol.23, No. 4, April 2006).
Протокол COS идет обычным способом, за исключением введения исходной дозы FE 999049 согласно уровню АМН в момент скрининга. Пациенту с уровнем АМН меньше 15 пмоль/л и вариантом Ser/Asn или Asn/Asn вводили бы исходную суточную дозу приблизительно 12 мкг FE 999049 - рекомбинантного продукта FSH человеческого происхождения, изготовленного согласно способу из Примера 6, или меньше 12 мкг FE 999049, например от 10 до 12 мкг, например 11,33 мкг или 11,67 мкг рекомбинантного FSH человеческого происхождения. Пациент с уровнем АМН меньше 15 пмоль/л и вариантом Ser/Ser получал бы более высокую исходную суточную дозу, большую, чем 12 мкг (например, от 12,33 до 24 мкг или 13-24 мкг рекомбинантного FSH человеческого происхождения).
Ссылки
Andersen CY, Westergaard LG, and van Wely M. (2004). FSH isoform composition of commercial gonadotrophin preparations: a neglected aspect? Reprod Biomed Online. 9(2), 231-236.
Arey BJ, Stevis PE, Deecher DC, Shen ES, Frail DE, Negro-Vilar A, and Lopez FJ. (1997) Induction of promiscuous G protein coupling of the follicle-stimulating hormone (FSH) receptor: a novel mechanism for transducing pleiotropic actions of FSH isoforms. Mol Endocrinol. 11(5), 517-526.
Baenziger JU and Green ED. (1988). Pituitary glycoprotein hormone oligosaccharides: structure, synthesis and function of the asparagine-linked oligosaccharides on lutropin, follitropin and thyrotropin. Biochim Biophys Acta 947(2), 287-306.
Bassett RM, and Driebergen R. (2005). Continued improvements in the quality and consistency of follitropin alfa, recombinant human FSH. Reprod Biomed Online. 10(2), 169-177.
 P, Zaga V, Maldonado A,
P, Zaga V, Maldonado A,  C, Timossi C, and Ulloa-Aguirre A. (1999). Oestrogens regulate pituitary alpha2,3-sialyltransferase messenger ribonucleic acid levels in the female rat. J Mol Endocrinol. 23(2), 153-165.
C, Timossi C, and Ulloa-Aguirre A. (1999). Oestrogens regulate pituitary alpha2,3-sialyltransferase messenger ribonucleic acid levels in the female rat. J Mol Endocrinol. 23(2), 153-165.  M., Borrelli F., Datola A., Bucci R., Mascia M., Polletta P., Piscitelli D, and Papoian R. (1999) Biological characterization of recombinant human follicle stimulating hormone isoforms. Human Reproduction 14, 1160-1167.
M., Borrelli F., Datola A., Bucci R., Mascia M., Polletta P., Piscitelli D, and Papoian R. (1999) Biological characterization of recombinant human follicle stimulating hormone isoforms. Human Reproduction 14, 1160-1167.
Dalpathado DS, Irungu J, Go EP, Butnev VY, Norton K, Bousfield GR, and Desaire H. (2006). Comparative glycomics of the glycoprotein follicle stimulating hormone: glycopeptide analysis of isolates from two mammalian species. Biochemistry 45(28), 8665-8673.
Dias JA, Van Roey P. (2001). Structural biology of human follitropin and its receptor. Arch Med Res. 32(6), 510-519.
Fiddes, J. C. and Goodman, H. M. (1979) Isolation, cloning and sequence analysis of the cDNA for the alpha-subunit of human chorionic gonadotropin Nature, 281, 351-356.
Flack, M.R., Bennet, A.P., Froehlich, J. Anasti, JN and Nisula, B. (1994). Increased biological activity due to basic isoforms in recombinant human follicle-stimulating hormone produced in a human cell line. J. Clin. Endocrinol. Metab., 79, 756-760.
Fox KM, Dias JA, and Van Roey P. (2001). Three-dimensional structure of human follicle-stimulating hormone. Mol Endocrinol. 15(3), 378-89.
Grabenhorst E, Hoffmann A, Nimtz M, Zettlmeissl G, and Conradt HS. (1995) Construction of stable BHK-21 cells coexpressing human secretory glycoproteins and human Gal(beta 1-4)GlcNAc-R alpha 2,6-sialyltransferase alpha 2,6-linked NeuAc is preferentially attached to the Gal(beta 1-4)GlcNAc(beta 1-2)Man(alpha 1-3)-branch of diantennary oligosaccharides from secreted recombinant beta-trace protein Eur J Biochem. 232(3), 718-25.
Green ED and Baenziger JU. (1988). Asparagine-linked oligosaccharides on lutropin, follitropin, and thyrotropin. II. Distributions of sulfated and sialylated oligosaccharides on bovine, ovine, and human pituitary glycoprotein hormones. J Biol Chem. 263(1), 36-44.
Grundmann, U., Nerlich, C, Rein, T. and Zettlmeissl, G. (1990). Complete cDNA sequence encoding human beta-galactoside alpha-2,6-sialyltransferase. G Nucleic Acids Res. 18 (3), 667.
Howies, CM. (1996). Genetic engineering of human FSH (Gonal-F). Hum Reprod Update, 2, 172-191.
Kagawa Y, Takasaki S, Utsumi J, Hosoi K, Shimizu H, Kochibe N, and Kobata A (1988). Comparative study of the asparagine-linked sugar chains of natural human interferon-beta 1 and recombinant human interferon-beta 1 produced by three different mammalian cells. J Biol Chem. 263(33), 17508-17515.
Keene, J.L., Matzuk, M.M., Otani, Т., Fauser, B,C,J,M., Galway, A.B., Hsueh, A.J.W. and Boime, I. (1989). Expression of Biologically active Human Follitropin in Chinese Hamster Ovary Cells. The Journal of Biological Chemistry, 264(9), 4769-4775.
Kitagawa.H. and Paulson,J.С (1994) Cloning of a novel alpha 2,3-sialyltransferase that sialylates glycoprotein and glycolipid carbohydrate groups J. Biol. Chem 269(2), 1394-1401.
Lee EU, Roth J, and Paulson JC (1989) Alteration of terminal glycosylation sequences on N-linked oligosaccharides of Chinese hamster ovary cells by expression of beta-galactoside alpha 2,6-sialyltransferase J Biol Chem. 264(23) 13848-13855.
de Leeuw, R., Mulders, J., Voortman, G. Rombout, F. Damm, J and Kloosterboer, L (1996) Structure-function relationship of recombinant follicle stimulating hormone (Puregon). Mol. Hum. Reprod., 2, 361-369.
Lowry OH, Rosebrough NJ, Farr AL, Randall RJ. (1951) Protein measurement with the Folin phenol reagent. J Biol Chem. 193(1), 265-75.
Lowry, PJ, McLean, C, Jones RL and Satgunasingam N. (1976) Purification of anterior pituitary and hypothalamic hormones Clin Pathol Suppl (Assoc Clin Pathol). 7, 16-21.
Olivennes F, Howies CM, Borini A, Germond M, Trew G, Wikland M, Zegers-Hochschild F, Saunders H (2009) Individualizing FSH dose for assisted reproduction using a novel algorithm: the CONSORT study Reprod Biomed Online. 2009 Feb; 18(2): 195-204.
Pierce JG, and Parsons TF (1981) Glycoprotein hormones: structure and function Annu Rev Biochem. 50, 465-495.
Pricer WE Jr, and Ashwell G. (1971). The binding of desialylated glycoproteins by plasma membranes of rat liver. J Biol Chem. 246(15), 4825-33.
Rathnam P, and Saxena BB. (1975). Primary amino acid sequence of follicle-stimulating hormone from human pituitary glands. I. alpha subunit. J Biol Chem.:250(17):6735-6746.
Regoeczi E, Debanne MT, Hatton MC, and Koj A. (1978) Elimination of asialofetuin and asialoorosomucoid by the intact rat. Quantitative aspects of the hepatic clearance mechanism. Biochim Biophys Acta. 541(3), 372-84.
Royle L, Radcliffe CM, Dwek RA and Rudd PM (2006) Methods in Molecular Biology, ed I Brockhausen-Schutzbach (Humana Press), 347: Glycobiology protocols, 125-144.
Ryan RJ, Keutmann HT, Charlesworth MC, McCormick DJ, Milius RP, Calvo FO and Vutyavanich T. (1987). Structure-function relationships of gonadotropins. Recent Prog Horm Res.; 43,:383-429.
Saxena BB and Rathnam P. (1976) Amino acid sequence of the beta subunit of follicle-stimulating hormone from human pituitary glands. J Biol Chem. 251(4), 993-1005.
Steelman SL, and Pohley FM. (1953) Assay of the follicle stimulating hormone based on the augmentation with human chorionic gonadotropin. Endocrinology. 53(6), 604-616.
Steer CJ, and Ashwell G. (1980) Studies on a mammalian hepatic binding protein specific for asialoglycoproteins. Evidence for receptor recycling in isolated rat hepatocytes. J Biol Chem. 255(7), 3008-13.
Svensson EC, Soreghan B, and Paulson JC. (1990) Organization of the beta-galactoside alpha 2,6-sialyltransferase gene. Evidence for the transcriptional regulation of terminal glycosylation. J Biol Chem. 265(34):20863-20868.
Takeuchi M, Takasaki S, Miyazaki H, Kato T, Hoshi S, Kochibe N, and Kobata A (1988). Comparative study of the asparagine-linked sugar chains of human erythropoietins purified from urine and the culture medium of recombinant Chinese hamster ovary cells. J Biol Chem. 263(8), 3657-3663.
Timossi CM, Barrios de Tomasi J, Zambrano E,  R, Ulloa-Aguirre A (1998). A naturally occurring basically charged human follicle-stimulating hormone (FSH) variant inhibits FSH-induced androgen aromatization and tissue-type plasminogen activator enzyme activity in vitro. Neuroendocrinology. 67(3), 153-163.
R, Ulloa-Aguirre A (1998). A naturally occurring basically charged human follicle-stimulating hormone (FSH) variant inhibits FSH-induced androgen aromatization and tissue-type plasminogen activator enzyme activity in vitro. Neuroendocrinology. 67(3), 153-163.
Timossi CM, Barrios-de-Tomasi J, Gonzalez-Suarez R, Arranz MC, Padmanabhan V, Conn PM, and Ulloa-Aguirre A. (2000). Differential effects of the charge variants of human follicle-stimulating hormone. J Endocrinol. 165(2), 193-205.
Ulloa-Aguirre, A., Espinoza, R., Damian-Matsumura, P. and Chappel, S С (1988) Immunological and biological potencies of the different molecular species of gonadotrophins. Hum. Reprod. 3, 491-501.
Ulloa-Aguirre, A., Cravioto, A.,  , P. Jimenez, M, Zambrano, E and Diaz-Sanchez, V. (1992) Biological characterization of the naturally occurring analogues of intrapituitary human follicle stimulating hormone. Hum Reprod 7, 23-30.
, P. Jimenez, M, Zambrano, E and Diaz-Sanchez, V. (1992) Biological characterization of the naturally occurring analogues of intrapituitary human follicle stimulating hormone. Hum Reprod 7, 23-30.
Ulloa-Aguirre A, Midgley AR Jr, Beitins IZ, and Padmanabhan V. (1995). Follicle-stimulating isohormones: characterization and physiological relevance. Endocr Rev.16(6), 765-787.
Ulloa-Aguirre A, Maldonado A, Damian-Matsumura P, and Timossi С (2001). Endocrine regulation of gonadotropin glycosylation. Arch Med Res. 32(6), 520-532.
Ulloa-Aguirre A, Timossi C, Barrios-de-Tomasi J, Maldonado A, and Nayudu P (2003). Impact of carbohydrate heterogeneity in function of follicle-stimulating hormone: studies derived from in vitro and in vivo models. Biol Reprod. 69(2), 379-389.
Van Lenten L, and Ashwell G. (1972) The binding of desialylated glycoproteins by plasma membranes of rat liver. Development of a quantitative inhibition assay. J Biol Chem. 247(14), 4633-40.
Wide, L. and Albertsson-Wikland, K. (1990) Change in electrophoretic mobility of human follicle-stimulating hormone in serum after administration of gonadotropin-releasing hormone. J. Clin. Endocrinol. Metab. 70, 271-276.
Wide, L. and Bakos, O. (1993). More basic forms of both human follicle-stimulating hormone and luteinizing hormone in serum at midcycle compared with the follicular or luteal phase. J. Clin. Endocrinol. Metab., 76, 885-889.
Wide L,  T, Sundstrom-Poromaa I, Eriksson K. (2007) Sulfonation and sialylation of gonadotropins in women during the menstrual cycle, after menopause, and with polycystic ovarian syndrome and in men. J Clin Endocrinol Metab.; 92(11), 4410-4417.
T, Sundstrom-Poromaa I, Eriksson K. (2007) Sulfonation and sialylation of gonadotropins in women during the menstrual cycle, after menopause, and with polycystic ovarian syndrome and in men. J Clin Endocrinol Metab.; 92(11), 4410-4417.
Zambrano E,  T, Olivares A, Barrios-de-Tomasi J, and Ulloa-Aguirre A. (1999). Receptor binding activity and in vitro biological activity of the human FSH charge isoforms as disclosed by heterologous and homologous assay systems: implications for the structure-function relationship of the FSH variants. Endocrine. 10(2), 113-121.
T, Olivares A, Barrios-de-Tomasi J, and Ulloa-Aguirre A. (1999). Receptor binding activity and in vitro biological activity of the human FSH charge isoforms as disclosed by heterologous and homologous assay systems: implications for the structure-function relationship of the FSH variants. Endocrine. 10(2), 113-121.
Zhang X, Lok SH, and Kon OL (1998) Stable expression of human alpha 2,6 sialyltransferase in Chinese hamster ovary cells: functional consequences for human erythropoietin expression and bioactivity. Biochim Biophys Acta. 1425(3), 441-452.
Фиг. 1, 2 и 3: карты плазмид экспрессионных векторов рР5Нальфа/бета, pST3 и pST6. CMV - промотор цитомегаловируса, BGHp(A) - последовательность полиаденилирования коровьего гормона роста, fl ori - репликатор fl, SV40 - промотор вируса обезьян 40, Neo - маркер устойчивости к неомицину, Hyg - маркер устойчивости к гигромицину, SV40 р(А) - последовательность полиаденилирования вируса обезьян 40, FSH А - полипептид альфа фолликулостимулирующего гормона, FSH В - полипептид бета фолликулостимулирующего гормона, ST3GAL4 - α2,3-сиалилтрансфераза, ST6GAL1 - α2,6-сиалилтрансфераза, ColEI - репликатор ColEI, Amp - маркер устойчивости к ампициллину.



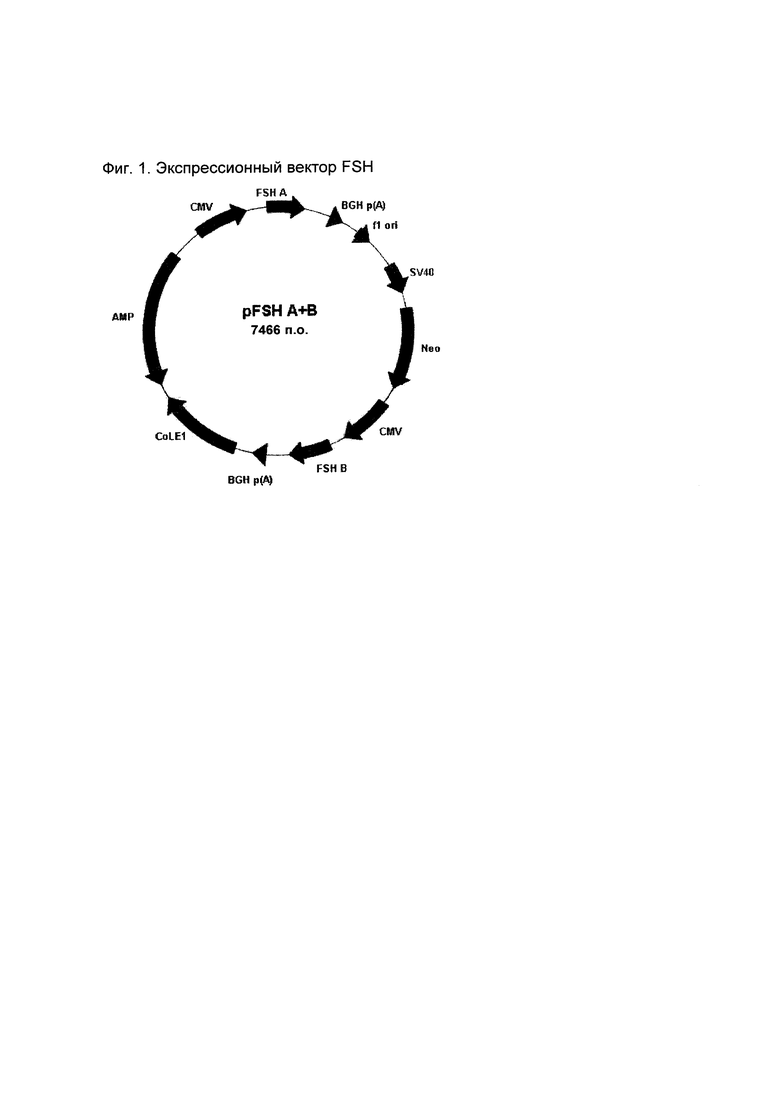


Группа изобретений относится к лечению бесплодия. Раскрыт способ лечения бесплодия у пациента, где лечение бесплодия включает: (а) идентификацию указанного пациента как имеющего сывороточный уровень антимюллеровского гормона (AMH) меньше 15 пмоль/л до лечения; (б) идентификацию указанного пациента как имеющего вариант Ser/Ser в положении 680 рецептора фолликулостимулирующего гормона (FSH) до лечения; и (в) введение дозы от более чем 12 до 24 мкг рекомбинантного фолликулостимулирующего гормона (FSH) в сутки или эквивалентной дозы указанному пациенту. Также раскрыт другой вариант лечения бесплодия. Группа изобретений обеспечивает более эффективное лечение бесплодия у определенных пациентов. 2 н.п. ф-лы, 7 ил., 3 табл., 9 пр.
1. Способ лечения бесплодия у пациента, где лечение бесплодия включает:
(а) идентификацию указанного пациента как имеющего сывороточный уровень антимюллеровского гормона (AMH) меньше 15 пмоль/л до лечения;
(б) идентификацию указанного пациента как имеющего вариант Ser/Ser в положении 680 рецептора фолликулостимулирующего гормона (FSH) до лечения; и
(в) введение дозы от более чем 12 до 24 мкг рекомбинантного фолликулостимулирующего гормона (FSH) в сутки или эквивалентной дозы указанному пациенту.
2. Способ лечения бесплодия у пациента, где лечение бесплодия включает:
(а) идентификацию указанного пациента как имеющего сывороточный уровень антимюллеровского гормона (AMH) меньше 15 пмоль/л до лечения;
(б) идентификацию указанного пациента как имеющего вариант Asn/Asn или вариант Asn/Ser в положении 680 рецептора фолликулостимулирующего гормона (FSH) до лечения; и
(в) введение дозы от 10 до 12 мкг рекомбинантного фолликулостимулирующего гормона (FSH) в сутки или эквивалентной дозы указанному пациенту.
| WO 2013020996 A1, 14.02.2013 | |||
| LOUTRADIS D ET AL | |||
| FSH RECEPTOR GENE POLYMORPHISMS HAVE A ROLE FOR DIFFERENT OVARIAN RESPONSE TO STIMULATION IN PATIENTS ENTERING IVF/ICSI-ET PROGRAMS/ Journal of Assisted Reproduction and Genetics, Vol | |||
| Прибор для равномерного смешения зерна и одновременного отбирания нескольких одинаковых по объему проб | 1921 |
|
SU23A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| СПОСОБ ЛЕЧЕНИЯ БЕСПЛОДИЯ | 2000 |
|
RU2226395C2 |
Авторы
Даты
2019-10-25—Публикация
2016-04-15—Подача