ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к улучшению видимых частей человека, способствующему внешнему виду прямо или косвенно, включая в качестве неограничивающих примеров кожу, волосы, подкожный жир, хрящ, мышцу, скелетную структуру, и к улучшению здоровья и повреждения клеток и тканей, предпочтительно, кожи, и более предпочтительно восстановлению состарившийся кожи до юношеского вида. В некоторых вариантах осуществления изобретение относится к композиции, включающей i) дифференцирующиеся клетки, ii) экстракты из клеток или зародыщей, или iii) их компоненты, которые могут индуцировать дифференциацию, и компоненты экстракта, очищенные или синтетические последовательности нуклеиновой кислоты, полипептиды, или природные вещества, содержащиеся в экстрактах. В некоторых вариантах осуществления клетки представляют собой дифференцирующиеся клетки, предпочтительно, стволовые клетки. В некоторых вариантах осуществления композиции используют в способе, который включает нанесение композиций на кожу и/или на раны после удаления внешних поверхностных слоев. В некоторых вариантах осуществления изобретение относится к способу дедифференциации клеток и/или дедифференциации с последующей редифференциацией. В некоторых вариантах осуществления изобретение относится к оказанию помощи, профилактике и лечению кожных заболеваний.
Изобретение также относится к применению композиций, включающих дифференцирующиеся клетки, клеточные экстракты зародышей или клеточные экстракты дифференцирующихся клеток для предотвращения деградации, поражения и нарушения функции клеток и тканей, и для активации, улучшения и усиления функции клетки для активации, улучшения и усиления вида, жизнеспособности и здоровья клеток и тканей.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Кожа представляет собой первый барьер против внешних воздействий и выполняет как физическую, так и химическую защиты. Витамин D производится в эпидермисе под воздействием солнечного излучения. Этот витамин необходим для поглощения кальция в кишечнике и затем фиксирован в костях, что делает возможным развитие и рост тела человека. Однако чрезмерное воздействие солнца приводит к повреждению кожи и, возможно, к раку. Кроме того, клетки кожи могут быть повреждены естественным путем, т.е. при ранении, или повреждены в результате возрастных изменений. Таким образом, существует необходимость идентифицировать композиции и способы для улучшения здоровья кожи, и профилактики, и лечения патологических состояний кожи и заболеваний, и для поддержания нормального внешнего вида кожи, и восстановления состарившейся кожи до юношеского внешнего вида.
При заживлении раны ее место занимает рубец. Простые ткани, такие как жировая, соединительная ткань, и эпителий регенерируются, но кожа, будучи сложным органом, развившимся из 2 зародышевых листков, заживает с образованием преимущественно фиброзной ткани. Если повреждение рассекает или разрушает сосочковый слой рогового слоя, то образуется рубец. Иногда этот рубец не привлекает внимания, в других случаях он может быть уродующим. Наиболее часто доставляют огорчения пациентам уродующие патологические шрамы. Однако некоторые пациенты испытывают другие симптомы, связанные с их патологическими шрамами, такие как боль, зуд и утрата активности движений. Такие симптомы могут быть показаниями для хирургической коррекции рубца. Таким образом, существует необходимость идентифицировать композицию и способы помощи, профилактики и лечения рубцов.
После повреждения, хирургического вмешательства или воздействия радиации на ткани или органы возникают рубцы или неполная регенерация ткани или органа. Это вызывает боль и дискомфорт, а также нарушение функции поврежденных тканей или органов. Как правило, у взрослых людей не происходит полное излечение и восстановление размера органов и тканей, в то время как, например, земноводные могут восстанавливать ткани, включая утраченные конечности. Таким образом, существует необходимость создать композицию и способы помощи и лечения при образовании рубцов во внутренних органах и тканях, увеличения пластичности ткани и стимулировать восстановление размеров поврежденных тканей и органов.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к улучшению видимых частей человека, способствующему внешнему виду прямо или косвенно, включая в качестве неограничивающих примеров кожу, волосы, подкожный жир, хрящ, мышцу, скелетную структуру, и к улучшению здоровья и повреждения клеток и тканей, предпочтительно, кожи, и, более предпочтительно, восстановлению состарившейся кожи до юношеского вида. В некоторых вариантах осуществления изобретение относится к композициям клеток, экстрактам клетки или зародышей и компонентам экстракта, которые могут индуцировать дедифференцирование, включая в качестве неограничивающих примеров очищенные или синтетические последовательности нуклеиновой кислоты, полипептиды или природные продукты, содержащиеся в экстрактах. В некоторых вариантах осуществления клетки представляют собой дифференцирующиеся клетки, предпочтительно, стволовые клетки. В некоторых вариантах осуществления композиции используют в способе, который включает нанесение композиций на кожу и/или раны после удаления внешних поверхностных слоев. В некоторых вариантах осуществления изобретение относится к способу дедифференцировки клеток и/или дедифференцировки с последующей редифференцировкой. В некоторых вариантах осуществления изобретение относится к оказанию помощи, профилактики и лечению кожных заболеваний. В некоторых вариантах осуществления изобретение относится к восстановлению или формированию de novo утраченных или поврежденных тканей, органов и конечностей.
В некоторых вариантах осуществления изобретение относится к композиции, содержащей i) клеточный компонент, включающий дифференцирующиеся клетки, клеточные экстракты дифференцирующейся клетки, клеточные экстракты зародыша или компоненты экстрактов дифференцирующейся клетки или клеточные экстракты зародыша или их сочетания, и ii) липиды. В еще одном варианте осуществления композиция дополнительно содержит очищенные или синтетические последовательности нуклеиновой кислоты, белки, эпигенетические ингибиторы или натуральные продукты, содержащиеся в экстрактах или их сочетания. В еще одном варианте осуществления дифференцирующиеся клетки представляют собой эмбриональные стволовые клетки, эмбриональные половые клетки или взрослые стволовые клетки. Настоящее изобретение не ограничивают использованием какого-либо конкретного клеточного экстракта или фракции. В действительности, возможно использование многообразных клеточных экстрактов и фракций, включая в качестве неограничивающих примеров, цитоплазматические экстракты и фракции, экстракты и фракции ядер, растворимые в воде экстракты и фракции, и экстракты и фракции, полученные из клеточных экстрактов аффинной хроматографией, центрифугированием в градиенте, ВЭЖХ, гель-фильтрацией и т.п.
В некоторых вариантах осуществления изобретение относится к способам и композициям, которые, как было обнаружено, можно использовать для профилактики деградации, повреждения и нарушения функции клеток и тканей, и для активации, улучшения и усовершенствования функции клетки для активации, улучшения и усовершенствования вида, жизнеспособности и здоровья клеток и тканей.
В некоторых вариантах осуществления изобретение относится к композиции для лечения кожи, включающей i) клеточный компонент, выбранный из группы, состоящей из дифференцирующихся клеток, клеточных экстрактов дифференцирующейся клетки и клеточных экстрактов зародыша или компонентов экстрактов дифференцирующихся клеток, или клеточных экстрактов зародыша, или их сочетаний, и ii) липидный компонент. В еще одном варианте осуществления синтетический белок представляет собой синтетический троянский белок. В еще одном варианте осуществления композиция дополнительно содержит натуральную первородную смазку, экстракты первородной смазки, первородную смазку, полученную из синтетических компонентов, и компоненты экстрактов первородной смазки. В еще одном варианте осуществления липидный компонент включает сквален, алифатические воски, сложные стероловые эфиры, сложные диоловые эфиры, триглицериды и свободный стерол. В еще одном варианте осуществления липидный компонент представляет собой полученный из зародыша из рыбы, креветки, морского ежа или лягушки и/или икры рыб. В еще одном варианте осуществления липидный компонент содержит холестерин, жирные кислоты и церамиды. В некоторых вариантах осуществления липидный компонент происходит из источника, отличного от клеточного компонента. В дополнительном варианте осуществления, композиция содержит кератин или флаггрин. В еще одном варианте осуществления композиция дополнительно содержит глутамин, противоинфекционные средства, антиоксиданты и/или никотинамид. В еще одном варианте осуществления антиоксидант представляет собой витамин E, A или C или их сочетания.
В некоторых вариантах осуществления изобретение относится к набору для улучшения внешнего вида рубца, содержащему две композиции, где первая композиция растворяет ткань рубца и включает растворяющие коллаген средства и вторая композиции улучшает заживление ран и включает клеточный компонент, выбранный из группы, состоящей из дифференцирующихся клеток, клеточных экстрактов дифференцирующейся клетки и зародышевый клеточный экстракт или их сочетания, липиды, белки и воду. В еще одном варианте осуществления дифференцирующиеся клетки представляют собой эмбриональные стволовые клетки, эмбриональные половые клетки или взрослые стволовые клетки. В еще одном варианте осуществления первая композиция дополнительно содержит антисептическое средство, антибактериальное, противовоспалительное, иммуномодулятор, протеазу или болеутоляющее средство или их сочетания. В еще одном варианте осуществления вторая композиция дополнительно содержит натуральную первородную смазку, экстракты первородной смазки, первородную смазку, полученную из синтетических компонентов, и компоненты экстрактов первородной смазки. В еще одном варианте осуществления липидный компонент включает сквален, алифатические воски, сложные стероловые эфиры, сложные диоловые эфиры, триглицериды, свободный стерол или их сочетания. В еще одном варианте осуществления липиды и/или белки представляют собой полученные из зародыша из рыбы, креветки, морского ежа или лягушки и/или икры рыб. В еще одном варианте осуществления липидная фракция содержит холестерин, жирные кислоты или церамиды или их сочетание. В некоторых вариантах осуществления липидный компонент происходит из источника, отличного от клеточного компонента. В еще одном варианте осуществления композиция дополнительно содержит глутамин, противоинфекционные средства, антиоксиданты и/или никотинамид.
В некоторых вариантах осуществления изобретение относится к способу улучшения внешнего вида кожи, включающему: i) удаление ткани кожи химическими препаратами, лазером или физической силой, и ii) наложение композиции, которая улучшает заживление ран, содержащей дифференцирующиеся клетки, клеточные экстракты дифференцирующихся клеток или зародыша, компоненты экстрактов дифференцирующихся клеток, липиды, белки и/или воду. В еще одном варианте осуществления улучшение внешнего вида кожи включает улучшение внешнего вида рубца или улучшение внешнего вида кожи с морщинами. В еще одном варианте осуществления дифференцирующиеся клетки представляют собой эмбриональные стволовые клетки, эмбриональные половые клетки или взрослые стволовые клетки. В еще одном варианте осуществления композиция дополнительно содержит натуральную первородную смазку, экстракты первородной смазки, первородную смазку, полученную из синтетических компонентов, и компоненты экстрактов первородной смазки.
В дополнительных варианты осуществления изобретение относится к способам для местного применения дифференцирующихся клеток, клеточных экстрактов зародыша или дифференцирующихся клеток, компонентов клеточных экстрактов, включающим: обеспечение композиции, включающей клеточный компонент, компонент, включающий дифференцирующиеся клетки, клеточные экстракты зародыша или дифференцирующейся клетки, компоненты клеточных экстрактов, и индивид, обладающий кожей, и наложение экстрактов на кожу индивида. В еще одном варианте осуществления, экстракты зародыша или дифференцируемых клеток или компоненты клеточных экстрактов являются эффективными в качестве питательного вещества для клетки кожи. В еще одном варианте осуществления композиция представляет собой водный гель. В еще одном варианте осуществления водный гель включает соединение, выбранное из группы, состоящей из гиалуроновой кислоты и хитозана. В еще одном варианте осуществления композиция представляет собой компонент в повязке на рану. В еще одном варианте осуществления композиция представляет собой компонент распыляемой композиции. В еще одном варианте осуществления распыляемая композиция представляет собой аэрозоль. В еще одном варианте осуществления распыляемая композиция сохнет на коже. В еще одном варианте осуществления распыляемая композиция содержит гелеобразующие компоненты. В некоторых вариантах осуществления композиция дополнительно содержит липидный компонент, как описано выше.
В некоторых вариантах осуществления изобретение относится к заживляющей повязке на рану, включающей композицию, содержащую дифференцирующиеся клетки, экстракты зародыша или дифференцирующихся клеток, и компоненты клеточных экстрактов.
В еще одном варианте осуществления, изобретение относится к способам местного нанесения дифференцирующихся клеток, клеточных экстрактов, компонентов клеточных экстрактов, включающим: i) наличие a) композиции, содержащей дифференцирующиеся клетки, клеточные экстракты дифференцирующейся клетки или зародыша, компоненты клеточных экстрактов, b) индивида, обладающего раной на коже, и c) повязки на рану, ii) наложение дифференцирующихся клеток, клеточных экстрактов, компонентов клеточных экстрактов на рану; и iii) закрывание раны повязкой на рану. В еще одном варианте осуществления повязка на рану является негерметичной. В еще одном варианте осуществления повязка на рану представляет собой гипс. В еще одном варианте осуществления повязка на рану включает: i) влагостойкий слой; ii) слой питающего геля, включающего дифференцирующиеся клетки, клеточные экстракты, и компоненты клеточных экстрактов. В еще одном варианте осуществления влагостойкий слой представляет собой пластичную мембрану, которая может быть приклеена на кожу. В еще одном варианте осуществления слой питающего геля включает противобактериальные вещества и модулирующие коллаген вещества. В еще одном варианте осуществления слой питающего геля улучшает скорость заживления ран.
В некоторых вариантах осуществления изобретение относится к способам местного нанесения дифференцирующихся клеток, экстрактов зародыша или дифференцирующихся клеток, или компонентов клеточных экстрактов, включающим: i) наличие a) индивида, обладающего 1) раной на коже, и 2) ткань, включающую специализированные клетки; b) повязку на рану; ii) сбор специализированных клеток из ткани; iii) выращивание специализированных клеток в условиях, при которых формируется композиция, содержащая выращенные специализированные дифференцируемые клетки, клеточные экстракты, или компоненты клеточных экстрактов; iii) наложение композиции на рану и iii) закрывание раны повязкой на рану. В еще одном варианте осуществления специализированные клетки выбраны из группы, состоящей из стволовой клетки волосяного фолликула из выпуклой части корневого влагалища, эмбриональной стволовой или зародышевой стволовой клетки. В еще одном варианте осуществления композиция представляет собой жидкую суспензию специализированных клеток. В еще одном варианте осуществления композиция является композицией гипса. В еще одном варианте осуществления композицию помещают на мембрану со слоем питающего геля перед нанесением композиции на рану. В еще одном варианте осуществления мембрана представляет собой пластичное вещество, функционирующее как герметичная повязка на рану при наложении на кожу. В еще одном варианте осуществления повязка на рану представляет собой коммерчески доступный лейкопластырь. В еще одном варианте осуществления перед нанесением композиции выполняют стадию прижигания кожи, замораживания кожи и/или шлифовки кожи. В еще одном варианте осуществления перед нанесением композиции в композицию вводят или наносят на кожу транспортное средство, которое проникает в неповрежденную кожу, включающее фосфолипиды, пальмитилмиристраты, ДМСО, полимерные или хитозановые суспензии или матрицу, липосомы и/или троянские пептиды, пептиды фаэтоны (nature biotech 2000), малые упругие везикулы (Van den Bergh et al., 1999), микросферы, наночастицы, предварительно нагруженные сферические бусины, одно- и/или многослойные везикулы, мономолекулярный слой ретинола, полиакрилонитрил, бета-глюкан (Redmond, Int Jorn Cosmetic Science 2005), пропиленгликоль, бутиленгликоль, полиэтиленгликоль, оливковое масло, диметилизосорбат, диметилформамид, метилсалицилат, олеиновые кислоты с длинной цепью.
В некоторых вариантах осуществления изобретение относится к композициям для стимуляции клеток, таких как фибробласты и кератиноциты, содержащим эффективное количество очищенной цитоплазматической фракции эмбриональной стволовой клетки, клетки-предшественника, соматической клетки или зародышей из животных, включая в качестве неограничивающих примеров зародыши приматов, грызунов, рыбы, креветок, морского ежа и/или лягушки. В еще одном варианте осуществления композиция дополнительно содержит жиры, белки и/или натуральные продукты. В еще одном варианте осуществления композиция дополнительно содержит растительные вещества. В еще одном варианте осуществления растительное вещество представляет собой алоэ вера. В еще одном варианте осуществления композиция дополнительно содержит экстракты семян. В еще одном варианте осуществления экстракты семян получают из пшеницы, кукурузы, риса или авокадо. В еще одном варианте осуществления композиция дополнительно содержит растительное масло. В еще одном варианте осуществления композиция дополнительно содержит вещество грибов. В еще одном варианте осуществления вещество грибов представляет собой непальские грибы. В еще одном варианте осуществления композиция дополнительно содержит экстракты рыбы, креветок, морского ежа, или лягушки, или компоненты этих экстрактов зародышей. В еще одном варианте осуществления компоненты экстрактов зародышей представляют собой компоненты, разрушающие гликозилированные продукты и ингибиторы гликозилирования. В еще одном варианте осуществления, компонентами экстракта зародыша, представляющими собой компоненты, разрушающие гликозилированные продукты и ингибиторы гликозилирования, являются аминогуанидин, карнозин и fex пиридоксамин.
В еще одном варианте осуществления, изобретение относится к способам заживления ран, включающим наличие индивида, имеющего рану, и композиции, содержащей дифференцирующиеся клетки, экстракты зародыша или дифференцирующихся клеток и компоненты клеточных экстрактов, и нанесение композиции на рану в условиях, при которых рана заживает. В еще одном варианте осуществления композиция дополнительно содержит растворяющее коллаген средство. В еще одном варианте осуществления растворяющее коллаген средство является кислотой. В еще одном варианте осуществления композиция дополнительно содержит фруктовую кислоту. В еще одном варианте осуществления композиция представляет собой крем. В еще одном варианте осуществления рана является открытой раной, и композицию наносят местно. В предпочтительных вариантах осуществления способ дополнительно включает наличие поддерживающей матрицы, включающей композицию. В еще одном варианте осуществления поддерживающая матрица представляет собой повязку на рану из ткани или пластического материала.
В некоторых вариантах осуществления изобретение относится к способу регенерации кожи, включающему наличие индивида, имеющего рану, и композицию, содержащую дифференцирующиеся клетки, экстракты зародыша или дифференцирующихся клеток, или компоненты клеточных экстрактов или экстрактов зародыша, и нанесение композиции на рану в условиях, при которых кожа регенерируется. В еще одном варианте осуществления композиция представляет собой крем. В еще одном варианте осуществления рана является открытой раной, и композицию наносят местно.
В еще одном варианте осуществления, изобретение относится к способу омолаживания кожи, включающему наличие индивида, имеющего неровную кожу, и композиции, содержащей дифференцирующиеся клетки, экстракты зародыша или дифференцирующиеся клетки, экстракты зародыша или компоненты клеточного экстракта, и нанесение композиции на неровную кожу в условиях, при которых кожа омолаживается. В некоторых вариантах осуществления компонент клеточного экстракта представляет собой последовательность нуклеиновой кислоты или компонент клеточного экстракта представляет собой пептид или их сочетания. В некоторых вариантах осуществления неровная кожа является следствием рубца или морщин. В еще одном варианте осуществления композиция представляет собой крем. В еще одном варианте осуществления крем дополнительно содержит средства, способствующие проницаемости. В еще одном варианте осуществления средства, способствующие проницаемости, представляют собой токсичные средства, ДМСО или хитозан, полимер хитозана или трипсин. В еще одном варианте осуществления средства, способствующие проницаемости, представляют собой липосомы или бусины альгината. В еще одном варианте осуществления липосомы или бусины альгината включают пептид, или последовательность нуклеиновой кислоты клеточного экстракта, или фактор роста, или их сочетание. В еще одном варианте осуществления липосомы включают последовательность нуклеиновых кислот клеточных экстрактов или экстрактов зародыша, полученные электропорацией. В еще одном варианте осуществления композиция содержит слитый троянский пептид, включающий пептид клеточного экстракта. В еще одном варианте осуществления применение композиции является местным. В еще одном варианте осуществления, способ дополнительно содержит стадию применения композиции, которую выполняют после применения химического препарата, лазера или физического действия к неровной коже при условиях, что внешний слой клеток неровной кожи удаляют. В еще одном варианте осуществления композиция дополнительно содержит антисептическое средство, антибактериальное, противовоспалительное, иммуномодулятор, протеазу или болеутоляющее средство или их сочетания
В некоторых вариантах осуществления изобретение относится к композиции, включающей: липид; композицию компонентов семян растений; антиоксидант; очищенный или синтетический белок, или очищенный или синтетический натуральный продукт, содержащийся в клеточном экстракте; стабилизирующий компонент; аутогенный жир, происходящий из жировой ткани индивида.
В еще одном варианте осуществления, изобретение относится к способам улучшения кожного лоскута, включающим пересадку кожи или заместителя кожи, и применению композиции, включающей: дифференцирующиеся клетки, клеточные экстракты дифференцирующихся клеток или зародышей, зародышевые экстракты; компоненты клеточных экстрактов или зародышевых экстрактов; очищенную или синтетическую последовательность нуклеиновой кислоты, очищенный или синтетический белок, или очищенный или синтетический натуральный продукт, содержащийся в клеточных экстрактах, зародышевых экстрактах; или их сочетания.
В некоторых вариантах осуществления изобретение относится к способам для оказания помощи, предотвращения и/или лечения образования рубца, нетипичных рубцов, патологического заживления ран, расширенного рубца, гипертрофированного рубца, келоида, келоидного рубца, осложнений заживления ран, листового рубца, гипертрофии рубца профилактическим или непрофилактическим способом введения, используя композиции, описываемые в настоящем документе. В еще одном варианте осуществления изобретение относится к способам первичного лечения, ушивания раны, вторичного лечения, эпителизации, реэпитализации, третичного ушивания раны, задерженного первичного срастания, санации раневой полости, шовному материалу, фазе воспаления, фазе пролиферации, фазе созревания, гемостазу, воспалению, коллагену, свертыванию, тромбоксану A2, простагландину 2а, простагландину 2-альфа, вазоконстриктору, кровотечению, вазодилятации, гистамину, тромбоциту, хемокину, эпидермальному фактору роста, фибронектину, фибриногену, гистамину, тромбоцитарному фактору роста, серотонину, фактору фон Виллебранда, формированию сгустка, дегрануляции тромбоцитов, системе комплимента, нейтрофилу, лейкоциту, макрофагу, моноциту, коллагеназе, интерлейкину, фактору некроза опухоли, фибробластам, трансформирующему фактору роста, кератиноциту, ангиогенезу, формированию грануляционной ткани, депонированию коллагена и инсулиноподобному фактору роста.
В некоторых вариантах осуществления изобретение относится к композициям, включающим дифференцирующиеся клетки, предпочтительно эмбриональные стволовые клетки или клетки-предшественники. В еще одном варианте осуществления композиции включают экстракты дифференцирующихся клеток, предпочтительно эмбриональных стволовых клеток или клеток-предшественников. В еще одном варианте осуществления, композиции содержат компоненты экстрактов из дифференцирующихся клеток, предпочтительно эмбриональных стволовых клеток или клеток-предшественников.
В некоторых вариантах осуществления изобретение относится к композициям, содержащим дифференцирующиеся клетки, предпочтительно эмбриональные стволовые клетки или клетки-предшественники, экстракты дифференцирующихся клеток, предпочтительно эмбриональных стволовых клеток или клеток-предшественников, компоненты экстрактов из дифференцирующихся клеток, и/или натуральную первородную смазку, и/или экстракты первородной смазки, и/или компоненты первородной смазки из экстрактов первородной смазки, которые частично или полностью синтетические.
В некоторых вариантах осуществления изобретение относится к способам для местного применения зародышевых клеточных экстрактов или клеточных экстрактов дифференцирующихся клеток, включающим: рассматриваемые композиции, включающие зародышевые клеточные экстракты или клеточные экстракты дифференцирующихся клеток, и индивида, обладающего кожей, и применение экстрактов на коже. Предпочтительно трофический сигнал в экстракте приходит и является эффективным как элемент питания для клеток кожи. Предпочтительно композиция находится в геле на водной основе, включающем гиалуроновую кислоту и/или хитозан. В другом предпочтительном варианте осуществления экстракт представляет собой распыляемый раствор, действующий как жидкий лейкопластырь или жидкость, которая высыхает на коже. В еще одном варианте осуществления жидкость содержит образующие гель компоненты, такие как коллаген и хитозан. В дополнительных предпочтительных вариантах осуществления, композиция представляет собой компонент пленки на носителе или крем.
Настоящее изобретение также относится к использованию вышеприведенных композиций для лечения кожи, для удаления морщин, для омолаживания кожи, для заживления ран, для улучшения внешнего вида кожи, предотвращения повреждения кожи, чтобы предотвратить деградацию кожи или предоставить коже питательные элементы и любого другого использования, описываемого в настоящем документе.
Настоящее изобретение дополнительно относится к способам получения композиции для местного применения на коже, включающей дифференцирующиеся клетки, или получения экстракта, или фракции дифференцирующихся клеток, или зародышей; и составления указанных дифференцирующихся клеток или указанных экстрактов с веществами для местного применения на коже, чтобы получить крем, гель, распыляемый раствор, эмульсию, твердый, пластичный материал или матрицу, мазь, порошок или лосьон, подходящие для местного применения. В еще одном варианте осуществления настоящее изобретение относится к композициям, полученным вышеупомянутыми способами.
ОПИСАНИЕ ФИГУР
Фиг.1 представляет собой график поколения от времени.
Фиг.2 представляет собой график минут/поколение от времени.
Фиг.3 представляет собой график кривой роста.
На фиг.4 представлены графики измерений ран и рубцов кожи мыши и процент заживления ран. Эти данные показывают, что экстракт для заживления ран влияет на заживление двух типов ран (иссеченные раны, левые панели, раны разреза, правые панели) на коже мыши. Измерения делали линейкой, и площади раны/рубца копировали на прозрачную пленку на 1, 5, 9 и 12 день. Площади иссеченных и длины разрезных ран (верхние панели) показали постепенное уменьшение в площади раны с 1 до 12 дни. Заживление начинается ранее и уменьшение раны является более быстрым у животных, которых лечили экстрактом, существенно на 5 и 9 день для иссеченных ран. Образованные рубцы измеряли с дня реэпителизации (средние панели). Тенденцию к уменьшению размеров ран можно наблюдать и для иссеченных, и разрезных ран. Показан день полного заживления, взятый как день отделения корок ран. Процент животных с полностью заживленными ранами (нижние панели) показывает более быстрое заживление у обработанных животных для разрезных ран.
ОПРЕДЕЛЕНИЯ
"Противоинфекционные средства" включают в качестве неограничивающих примеров бензилпенициллин, пенициллин, пенициллин G, 6-фенил ацетил пенициллин, пенициллин V, микромицин, клавуланат, оксациллин, деквалиниум, клоксациллин, сулбенициллин, ампициллин, циллерал, и принципен и их сочетания.
"Противовоспалительный" означает вещество, которое уменьшает воспаление. Многие болеутоляющие средства лечат боль уменьшением воспаления. Многие стероиды, в частности глюкокортикоиды, уменьшают воспаление связыванием с рецепторами кортизола. Нестероидные противовоспалительные лекарственные средства (НПВП) облегчают боль противодействием ферменту циклооксигеназе (ЦОГ). Сам фермент ЦОГ синтезирует простагландины, создавая воспаление. Многие растения обладают противовоспалительными качествами, включая в качестве неограничивающих примеров, иссоп и балберу (последний из которых содержит салициловую кислоту, активный ингредиент в аспирине), а также березу, лакричник, дикий ямс и женьшень.
"Антиоксиданты" означают любое из множества веществ, которые предотвращают или замедляют разрушение других веществ кислородом. Синтетические и натуральные антиоксиданты используют, чтобы замедлить деградацию бензина и резины, и такие антиоксиданты, как витамин C (аскорбиновая кислота), бутилированный гидрокситолуол (BHT) и бутилированный гидроксианизол (BHA), обычно добавляют к продуктам питания для предотвращения протухания или потери цвета. Обнаружено, что питательные вещества, такие как бета-каротин (предшественник витамина A), витамин C, витамин E, и селен, действуют как антиоксиданты. Они действуют путем удаления свободных радикалов, молекул с одним или несколькими неспаренными электронами, которые быстро реагируют с другими молекулами, начиная цепные реакции в процессе, названном окислением. Свободные радикалы представляют собой обычный продукт метаболизма; организм производит свои собственные антиоксиданты (например, фермент супероксидисмутаза) для поддержания в балансе. Однако стресс, старение и источники в окружающей среде, такие как загрязненный воздух и сигаретный дым, могут увеличивать число свободных радикалов в организме, создавая дисбаланс. Чрезвычайно реакционно-способные свободные радикалы могут повреждать здоровую ДНК и связаны с изменениями, которые сопровождают старение (такие как возрастная дегенерация желтого пятна, лидирующая причина слепоты у пожилых людей), и с патологическими процессами, которые ведут к раку, заболеванию сердца и инсульту.
"Антисептическое средство" представляет собой средство, которое убивает или предотвращает рост и размножение различных микроорганизмов, включая бактерии, грибы, простейшие и вирусы на внешних поверхностях тела. Цель антисептических средств представляет собой уменьшение возможности сепсиса, инфекции или гнилостного разложения микробами. Антибактериальные средства имеют ту же самую цель, но только действуют против бактерий. Антибиотики выполняют аналогичную функцию, предотвращая рост или размножение бактерий внутри организма. Антисептические средства включают в качестве неограничивающих примеров, спирт, йод, перекись водорода и борную кислоту. Существует огромный разброс в способности антисептических средств уничтожать микроорганизмы и в их воздействии на живые ткани. Например, хлорид ртути представляет собой мощное антисептическое средство, но он раздражает чувствительные ткани. Напротив, нитрат серебра убивает меньше микробов, но его можно использовать на чувствительных тканях глаз и горла. Также существует большое различие во времени, необходимом для действия для различных антисептических средств. Йод, одно из наиболее быстродействующих антисептических средств, убивает бактерии в пределах 30 сек. Другие антисептические средства имеют более медленное, более продолжительное действие. Так как существует такая большая вариабельность, разработаны системы для измерения действия антисептических средств по сравнению с определенными стандартами. Бактериостатическое действие антисептических средств, по сравнению с фенолом (при тех же условиях и против того же микроорганизма), известно как его фенольный коэффициент.
"Хитозан" представляет собой бета-1,4-связанный полимер глюкозамина, который, в отличие от хитина, содержит, если есть, несколько остатков N-ацетила. Его можно получить из хитина, полисахарида, обнаруженного в наружном скелете ракообразных, таких как креветка, лобстер и крабы. Панцири можно размолоть в мелкий порошок. Этот порошок затем деацетилируют, что позволяет хитозану абсорбировать липиды.
"Коллаген" означает любое из множества веществ, которые содержат альфа-цепи полипептида коллагена с последовательностью, как правило, соответствующей образцу Gly-X-Y, где Gly обозначает глицин, X обозначает пролин и Υ обозначает пролин или гидроксипролин. Белки коллагены также содержат значительное количество глицина и пролина. Гидроксипролин и гидроксилизин не вводятся непосредственно рибосомами. Они представляют собой производные пролина и лизина в ферментативном процессе посттрансляционной модификации, для которой требуется витамин C. Это связано с тем, что дефицит витамина C может вызвать цингу - болезнь, которая ведет к потере зубов и легкому травмированию, вызванному уменьшением прочности соединительной ткани, по причине недостатка коллагена или дефектного коллаген. Клетки, названные фибробластами, образуют различные волокна в соединительной ткани организма, включая коллаген. Белый коллаген, который образует матрикс большей части соединительной ткани у млекопитающих, состоит из переплетенных волокон белка коллагена. Волокна коллагена состоят из глобулярных единиц из субъединиц коллагена, тропоколлагена. Субъединицы тропоколлагена спонтанно упорядочиваются при физиологических условиях в структуры шахматного строения, стабилизированные множеством водородных и ковалентных связей. Субъединицы тропоколлагена представляют собой левосторонние тройные спирали, где каждый тяж сам по себе, в свою очередь, представляет собой правую спираль. Таким образом, тропоколлаген можно рассматривать как свернутый в спираль.
Несмотря на то что коллаген обуславливает эластичность кожи и его деградация приводит к морщинам, которые сопровождают старение, он образуется во многих других местах по всему телу, и в различных формах известен как типы: коллаген типа I - это наиболее распространенный коллаген тела человека, присутствующий в рубцовой ткани, конечный продукт, когда ткань залечивается при восстановлении; коллаген типа II - хрящ ушной раковины; коллаген типа III - это коллаген грануляционной ткани и быстро производится молодыми фибробластами перед синтезом плотного коллаген типа I; коллаген типа IV - базальная мембрана; коллаген типа V - большей частью интерстициальная ткань, связан с типом I; коллаген типа VI - большей частью интерстициальная ткань, связан с типом I; коллаген типа VII - эпителиальная ткань; коллаген типа VIII - некоторые эндотелиальные клетки; коллаген типа IX - хрящ, связан с типом II; коллаген типа X - гипертрофический и минерализующийся хрящ; коллаген типа XI - хрящ; коллаген типа XII - взаимодействует с типами I и III.
В контексте некоторых вариантов осуществления, "модулирующее коллаген вещество" обозначает многообразие веществ, способных содействовать формированию или разрушению единиц или любого типа коллагена.
"Гель" представляет собой полутвердый материал, образованный из коллоидного раствора. По весу гели большей частью представляют собой жидкости, тем не менее, они ведут себя подобно твердым телам. Пример представляет собой желатин.
"Кератин" представляет собой любой из множества образующих волокна молекул белков, которые служат как структурные единицы для различных живых тканей. Кератины представляют собой основные белковые компоненты волос, шерсти, ногтей, рога, копыт и стволов перьев. Эти белки, как правило, содержат большие количества серосодержащих аминокислот, в частности цистеин. Спиральные молекулы кератина оплетают друг друга, чтобы образовать удлиненные тяжи, названные промежуточными филаментами. Формирование дисульфидных связей между атомами серы на двух цистеинах на отдельных полипептидных цепях кератина предусматривает перекрестное сшивание этих цепей и приводит к образованию в известной степени жесткого соединения.
"Филаггрин" представляет собой любой из разнообразия связанных с филаментами белков, который взаимодействует с промежуточными филаментами кератина окончательно дифференцированного эпидермиса млекопитающих путем образования дисульфидных связей.
"Иммуномодулятор" обозначает любое из разнообразия веществ, которые влияют на иммунную систему. Примеры включают в качестве неограничивающих примеров, цитокины, интерлейкин-2, иммуностимулирующие средства и иммуносупрессоры.
Термин "природный продукт" обозначает любое из разнообразия органических химических веществ, чья молекулярная структура происходит из ферментативных преобразований в живом организме, исключая аминокислоты, белки, полипептиды, нуклеиновые кислоты и последовательности, и насыщенные жирные кислоты. Примеры включают в качестве неограничивающих примеров, липиды (т.е. которые представляют собой ненасыщенные жирные кислоты), углеводы/сахариды и полисахариды, стероиды и их производные, терпены и их производные, витамины, каротеноиды, и естественные лекарства, такие как таксол, и т.д. Термин "синтетические природные продукты" относится к природным продуктам, полученным не из их естественного источника.
Термин "ген", как применяют в настоящем документе, относится к последовательности ДНК, которая включает контролирующие и кодирующие последовательности, необходимые для получения предшественника полипептида или белка. Полипептид может быть кодирован кодирующей последовательностью полной длины или частью кодирующей последовательности при условии сохранения требуемой активности белка.
"Нуклеозид", как применяют в настоящем документе, относится к соединению, состоящему из основания пурин [гуанин (G) или аденин (A)] или пиримидин [тимин (T), уридин (U) или цитидин (C)], ковалентно связанного с пентозой, тогда как "нуклеотид" относится к нуклеозиду, фосфорилированному по одной из гидроксильных групп пентозы.
"Последовательность нуклеиновой кислоты", как применяют в настоящем документе, относится к олигонуклеотиду, нуклеотиду или полинуклеотиду, и его фрагментам или частям, и к геномным или синтетическим ДНК или РНК, источник которых может быть одно- или двухцепочечным и представляет смысловую или антисмысловая цепь.
"Аминокислотная последовательность", как применяют в настоящем документе, относится к последовательности пептида или белка.
"Пептидно-нуклеиновая кислота", как применяют в настоящем документе, относится к олигомерной молекуле, в которой нуклеозиды соединены пептидными, а не фосфодиэфирными связями. Эти низкомолекулярные соединения, также специализированное препятствующее транскрипции гена средство, останавливают элонгацию транскрипта связыванием с его комплементарной (кодирующей) цепью нуклеиновой кислоты (Nielsen et al. (1993) Anticancer Drug Des., 8:53-63).
"Вариант" в отношении аминокислотных последовательностей используют, чтобы обозначить аминокислотную последовательность, которая отличается одной или несколькими аминокислотами от другой, обычно родственной аминокислоты. Вариант может иметь "консервативные" замены, где замещенная аминокислота имела аналогичные структурные или химические свойства (например, замена лейцина изолейцином). Реже, вариант может иметь "неконсервативные" замены, например замену глицина триптофаном. Аналогично минорные вариации могут включать в себя аминокислотные делеции или вставки (т.е. дополнения), или и то и другое. Указание в определении, какие и сколько аминокислотных остатков могут быть замещены, вставлены или удалены без уничтожения биологической или иммунологической активности, можно найти, используя компьютерные программы, хорошо известные в данной области, например программное обеспечение DNAStar.
Как применяют в настоящем документе, термин "часть" в отношении аминокислотной последовательности или белка (как в случае "часть аминокислотной последовательности") относится к фрагментам белка. Фрагменты могут изменяться по размеру от четырех аминокислотных остатков до полной аминокислотной последовательности минус одна аминокислота.
Как применяют в настоящем документе, термин "очищенный" относится к молекулам, включая в качестве неограничивающих примеров нуклеиновые, рибонуклеиновые, липидные или аминокислотные последовательности, которые удалены из их естественной среды, изолированы или выделены. "Изолированная последовательность нуклеиновой кислоты", таким образом, представляет собой очищенную последовательность нуклеиновой кислоты. "В значительной степени очищенные" молекулы представляют собой, по меньшей мере, 60% свободных, предпочтительно, по меньшей мере, 75% свободных, и более предпочтительно, по меньшей мере, 90% свободных от других компонентов, с которыми они ассоциированы в естественных условиях.
"Рак" означает любое из различных клеточных заболеваний со злокачественными новообразованиями, характеризующимися быстрым размножением анапластических клеток. Не предполагается, что больные клетки должны действительно вторгаться в окружающую ткань и метастазировать в новые места организма. Рак может включать любую ткань организма и иметь много различных форм в каждой области организма. Большинство раковых заболеваний называют по типу клеток или органа, в которых они начались.
"Клетка" означает минимальную структурную единицу живого вещества, способную функционировать автономно, состоящую из одного или нескольких ядер, цитоплазмы и различных органелл, всех вместе окруженных полупроницаемой мембраной. Клетки включают все соматические клетки или происходящие из тела живого или больного животного на любой стадии развития, а также половые клетки, включая клетки спермы и зародыша (репродуктивный объект животного, состоящий из яйцеклетки или эмбриона вместе питательными и защитными оболочками). Включают обе основные категории клеток: прокариоты и эукариоты. Клетки, предусмотренные для использования в данном изобретении, включают все типы клеток из всех организмов всех царств: растения, животные, одноклеточные, грибы, археобактерии и эубактерии. Стволовые клетки представляют собой клетки, способные последовательными делениями производить специализированные клетки на многих различных уровнях. Например, гематопоэтические стволовые клетки продуцируют как красные клетки крови, так и белые клетки крови. От оплодотворения до смерти люди содержат стволовые клетки, но у взрослых их способность дифференцироваться уменьшена.
Как применяют в настоящем документе, термин "дифференцировка" по отношению к клеткам означает процесс, посредством которого клетки становятся структурно и функционально специализированными, который представляет собой возрастающее ограничение потенциала дифференцировки и увеличение специализации функций, которые имеют место во время развития эмбриона и приводят к образованию специализированных клеток, тканей и органов.
Термин "дедифференцировка" по отношению к клеткам обозначает процесс, обратный процессу дифференцировки, где клетки становятся менее структурно и функционально специализированными, где возрастает потенциал дифференцировки клетки.
"Дифференцирующиеся" обозначает способность клетки дифференцироваться в необходимый тип клеток. Как применяют в настоящем документе, термин "дифференцироваться" обозначает специализацию (дифференцировку) или возвращение к более первозданному типу клеток; дедифференция.
"Экстракт", как использовано в контексте, "клеточного экстракта" и "зародышевого экстракта" в данном изобретении обозначает продукт любого типа клеток, как определено выше, полученный химическим или механическим воздействием, как например, давлением, дистилляцией, испарением и т.д. Экстракты могут включать все или любой взятый в отдельности компонент или комбинацию компонентов клеток, включая концентрированные продукты активных компонентов. Такие компоненты экстрактов включают в качестве неограничивающих примеров РНК, ДНК, липиды, все структуры, основанные на аминокислотах, включая пептиды и белки, углеводы или их сочетания. Экстракты, предусмотренные настоящим изобретением, включают, но не ограничены, экстракты зародышей рыб, зародышей морского ежа, зародышей лягушки, взрослых стволовых клеток, семян растения и стволовых клеток растения.
"Среды для выращивания" представляют собой композиции, использованные, чтобы выращивать микроорганизмы или клетки в культуре. Существуют различные сорта сред для выращивания различных сортов клеток. Наибольшие различия между средами для выращивания имеются между средами, использованными для выращивания клеток в культуре (клеточные культуры используют определенные типы клеток, полученные из растений или животных), и средами, использованными для выращивания микроорганизмов (обычно бактерии или дрожжи). Эти различия возникают вследствие того факта, что клетки, происходящие из целых организмов и выросшие в культуре, часто неспособны расти без обеспечения определенных потребностей, таких как гормоны или факторы роста, которые обычно возникают in vivo. В случае клеток животного, эти потребности часто удовлетворяют добавлением к среде сыворотки крови. Эти среды часто красные или розовые по причине включения индикаторов pH. Среды для выращивания эмбриональных стволовых клеток предпочтительно содержат минимальную поддерживающую среду, т.е. среду Игла: аминокислоты, соли (нитрат железа нонагидрат, хлорид калия, сульфат магния, хлорид натрия, однозамещенный фосфат натрия), витамины (аскорбиновая кислота, фолиевая кислота, никотинамид, рибофлавин, B-12) или Среду Дульбекко: дополнительно железо, глюкозу; ненезаменимые аминокислоты, пируват натрия, β-меркаптоэтанол, L-глутамин, эмбриональную телячью сыворотку и фактор, ингибирующий лейкозы (LIF). В случае микроорганизмов, так как они часто представляют собой одноклеточные организмы, таких ограничений не существует. Еще одно основное различие состоит в том, что клетки животного в культуре часто растут на плоской поверхности, к которой они прикреплены, и среду поставляют в жидкой форме, которая покрывает клетки. Бактерии, такие как Escherichia coli (E. coli, самый часто употребительный микроорганизм в лабораториях), можно выращивать на твердой среде или в жидкой среде, жидкую питательную среду обычно называют питательный бульон. Предпочтительные среды для выращивания микроорганизмов представляют собой питательный бульон или среду Лурия-Бертани (среда L-B). Бактерии, выращенные в жидких культурах, часто формируют коллоидные суспензии. Когда к жидкой среде добавляют агар (вещество, которое застывает в гель), она может быть разлита в чашки Петри, где она будет застывать (их называют агаровые чашки) и создавать твердую среду, на которой можно культивировать микроорганизмы.
В рамках контекста некоторых вариантов осуществления, "приклеивать на кожу" означает прилеплять или приклеивать при помощи или без помощи клеящих веществ (адгезивов), таких как клей, паста или мазь на основе камеди.
"Липид" означает любое из группы органических соединений, включающей жиры, масла, воски, стеролы и триглицериды, которые нерастворимы в воде, но растворимы в неполярных органических растворителях, и являются маслянистыми на ощупь. Основные классы липидов включают жирные кислоты, липиды, производные глицерина (включая, жиры, масла и фосфолипиды), липиды производные сфингозина (включая церамиды, цереброзиды, ганглиозиды, и сфингомиелины), стероиды и их производные, терпены и их производные, некоторые ароматические соединения, и спирты и воски с длинной цепью. В живых организмах липиды служат как основа клеточных мембран и как форма хранения топлива. Часто липиды обнаруживают сопряженными с белками или углеводами, и итоговые вещества известны как липопротеины и липополисахариды. Жирорастворимые витамины могут быть отнесены к липидам. Липосомы представляют собой сферические пузырьки, образованные смешиванием липидов с водой или водными растворами. Они нашли применение в пероральном введении некоторых лекарственных средств (например, инсулина и некоторых лекарственные средства от рака), так как они сохраняют свою целостность до тех пор, пока они не разрушаются липазами в желудке и тонком кишечнике.
В контексте некоторых вариантов осуществления, "слой питающего геля" представляет собой гель, содержащий вещества, обычно содержащиеся в среде для выращивания.
В контексте некоторых вариантов осуществления, "специализированная клетка" индивида означает, что клетка имеет характерные идентифицируемые иммунными способами маркеры, так что дифференциация этих клеток и представление тканям индивидов могут быть выполнены в таких условиях, что иммунная система не образует антител к дифференцированным клеткам. Например, когда эритроциты, несущие один или оба A или Β антигена, представляют соответствующим антителам, они агглютинируют, то есть агрегируют. Люди обычно имеют антитела против тех эритроцитов, антигены которых они не имеют. Таким образом, специализированные эритроциты индивида будут эритроцитами его группы крови. Причина отторжения трансплантата представляет собой распознавание антигенов чужого Главного Комплекса Гистосовместимости Τ-клетками и активацию тех Τ-клеток в цитотоксичные клетки эффекторы или хелперные Τ-клетки. Активация Τ-клетки возникает в случае трансплантата на сосудистой ножке из ядросодержащих клеток, экспрессирующих MHC, соответствующий MHC Класса I (особенно HLA-B), и аллели Класса II HLA-DR являются важнее для успешной трансплантации, когда соответствуют другим антигенам MHC; и соответствие MHC является более важным, чем соответствие минорным антигенам гистосовместимости. Таким образом, специализированные клетки индивида, представляющие MHC, будут клетками, представляющими аллели, соответствующие MHC.
Термин "положительное влияние", когда используется в связи с болезнью или состоянием, относится к оказанию положительных воздействий на индивид, к которому применяют профилактическое или терапевтическое средство, которые не приводит к излечению от болезни. В определенных вариантах осуществления индивиду вводят одно или несколько профилактических или терапевтических средств для оказания помощи при болезни так, чтобы предотвратить прогрессирование или ухудшение болезни.
Как применяют в настоящем документе, термины "предотвращать" и "предотвращение" включают предотвращение рецидива, распространения или появления. Не имеется в виду, что изобретение ограничено полным предотвращением. В некоторых вариантах осуществления появление задерживают или уменьшают тяжесть заболевания.
Как применяют в настоящем документе, термины "лечить" и "лечение" не являются ограниченными случаем, когда индивид (например, пациент) вылечен и болезнь искоренена. Точнее, настоящее изобретение также предусматривает лечение, которое всего лишь уменьшает симптомы и/или задерживает прогрессирование заболевания.
В контексте некоторых вариантов осуществления, "водостойкий слой" обозначает материал или ткань, которые являются в значительной степени непроницаемыми для воды, или слой нанесенного герметизирующего вещества, предназначенного для того, чтобы предотвратить значительное проникновение воды.
Как применяют в настоящем документе, термин "транспортное средство" включает вещества, способные помогать проникновению в кожу, или клетки кожи, или другие соматические клетки. Термин "транспортное средство" используют как синоним с термином "средства, способствующие проникновению". Такие транспортные средства включают в качестве неограничивающих примеров: фосфолипиды, пальмитилмиристираты, ДМСО, суспензии полимера или хитозана или матрикс, липосомы, троянские пептиды, пептиды фаэтоны, малые эластичные везикулы, микросферы (наделенные функцией векторы, сделанные из материалов природного происхождения, таких как коллаген, гликозаминогликаны, хондроитинсульфат, хитозан или полисахариды), наночастицы (несут липофильные вещества и усиливают биодоступность заключенных в них материалов в коже), предварительно наполненные сферические бусины и губки, одно- и/или многослойные везикулы (стабилизируют содержание экстрактов в основе крема и помогают транспортировать на кожу), молекулярную жидкость пленки ретинола (тонкая однородная однослойная пленка, которая облегчает перенос активных веществ через роговой слой), полиакрилонитрил (полимеры, включающие систему контролируемого высвобождения, которая синхронизирует высвобождение активного ингредиента, наряду с ароматизирующим веществом, как ощущаемый маркер, который отражает эффективность продукта), бета-глюкан (волокно овса, которое способствует проницаемости кожи, Redmond, Int. Journ. Cosmetic science 2005), пропиленгликоль (как носитель лекарственного средства, лучше всего действует с основанным на минеральном масле креме/лосьоне и т.д.), бутиленгликоль, полиэтиленгликоль, оливковое масло, диметилизосорбид, диметилформамид, метилсалицилат (все они усиливают абсорбцию через кожу), олеиновые кислоты с длинной цепью (разрушают бислой внутри рогового слоя, жизненно важный для проникновения композиций в составах, основанных на пропиленгликоле), вещества, способные регулировать pH, гидратацию и местный метаболизм в коже. Средства, модифицирующие эти факторы, включают транспортные средства, содержащие активный гидрофобный реагент, деионизацию активных ингредиентов, увеличенную гидратацию кожи (содержание воды в растворе/креме/среде-носителе), молочную кислоту (изменяет pH).
Как применяют в настоящем документе, термин "NANOG" относится к содержащим гомеобокс генам. NANOG предполагают необходимой для неограниченного деления стволовых клеток, остающихся при этом способными производить много различных типов клеток. Ген представляет собой потенциальный основной ген, который помогает получить рост эмбриональных стволовых клеток в лаборатории, делая стволовые клетки способными к неограниченной пролиферации.
Как применяют в настоящем документе, термин "OCT4" относится к гену, неактивному в соматических клетках, включая взрослые стволовые клетки, но экспрессирующимуся в эмбриональных стволовых и половых клетках. OCT4 имеет существенное значение для поддержания способности эмбриональных стволовых клеток дифференцироваться в клетки различных типов.
Как применяют в настоящем документе, термин "SOX2" относится к гену из определяющего пол региона Y (SRY), кодирующему белок box 2. Не имеющий интронов ген кодирует члены семейства HMG-box (SOX), связанные с SRY-факторов транскрипции, включенных в регулирование эмбрионального развития и определения судьбы клетки.
Как применяют в настоящем документе, термин "GAPDH" относится к гену домашнего хозяйства глицеральдегид-3-фосфат дегидрогеназа. Этот ген участвует в основных функциях, необходимых для поддержания клетки. Гены домашнего хозяйства экспрессируются в обязательном порядке.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Изобретение относится к улучшению здоровья и повреждений клеток и тканей, предпочтительно кожи, и более предпочтительно восстановлению состарившейся или поврежденной кожи до молодого и здорового внешнего вида. В некоторых вариантах осуществления изобретение относится к композициям клеток, клеточным или зародышевым экстрактам, и компонентам экстракта, которые могут вызывать дифференциацию, включая, в качестве неограничивающих примеров, очищенные или синтетические последовательности нуклеиновой кислоты, полипептиды, или естественные продукты, содержащиеся в указанных экстрактах. В некоторых вариантах осуществления клетки представляют собой дифференцирующиеся клетки, предпочтительно стволовые клетки или клетки зародышей. В некоторых предпочтительных вариантах осуществления, экстракты представляют собой водные экстракты. В некоторых вариантах осуществления экстракты происходят из не имеющего отношения к птицам источника. В некоторых вариантах осуществления композиции используют в способе, который включает нанесение композиций на кожу и/или раны после удаления внешних поверхностных слоев. В некоторых вариантах осуществления изобретение относится к способу дедифференцировки клеток и/или дедифференцировки с последующей редифференцировкой. В некоторых вариантах осуществления изобретение относится к оказанию помощи, предотвращению и лечению заболеваний кожи.
Нанесение композиции на необходимую поверхность может быть профилактическим, так что композиция наносится на кожу или другую поверхность до возникновения воздействия средства.
Применение композиции может быть лечебным, например, для дальнейшей защиты нарушенной поверхности кожи или создания защитной поверхности во время естественного или опосредованного лечения подвергнувшейся воздействию поверхности кожи. Применение композиции может быть защитной, например, чтобы защитить поверхность кожи, которая должна подвергнуться воздействию.
Настоящее изобретение относится к использованию экстрактов или компонентов дифференцирующихся клеток для местного нанесения на поверхность тела. Таким образом, настоящее изобретение относится к способам и композициям для косметического и терапевтического использований. Настоящее изобретение не ограничено использование экстрактов или компонентов какого-либо конкретного типа дифференцирующийся клетки. В действительности предусматривается использованием разнообразных типов клеток и дифференцирующихся клеток из любого организма, включая, в качестве неограничивающих примеров, эмбриональные стволовые клетки млекопитающих, взрослые стволовые клетки млекопитающих, клетки пуповинной крови, зародышей и эмбрионов рыб, креветок или морского ежа, и зародышей и эмбрионов земноводных.
В некоторых вариантах осуществления изобретение относится к дедифференцировке существующих эпителиальных/эпидермальных клеток до примордиального состояния, в котором клетки обладают способностями стволовых клеток и могут преобразовывать подходящие и нужные клетки для регенерации целого слоя кожи (эпидермиса, дермы и подкожного). Несмотря на то что многие дифференцированные клетки обычно следуют своей судьбе, случаи дедифференцировки могут иметь место. Хвостатые земноводные и костистые рыбы могут восстанавливать утраченные части тела в результате процесса миграции, дедифференцировки, пролиферации и редифференцировки эпителиальных клеток в области раны. Функциональное перепрограммирование ядер дифференцированных клеток также проиллюстрировано происхождением полипотентных эмбриональных стволовых клеток (ESC) и рождением живых детенышей клонированных животных после трансплантации ядер в неоплодотворенные зародыши.
Термин пластичность, как использовано в настоящем документе, означает, что клетка из одной ткани способна порождать дифференцированные клетки других тканей. Зародыши Xenopus способны перепрограммировать соматические ядра млекопитающих, чтобы экспрессировать ген Oct4 гомеодоменсодержащего фактора транскрипции семейства POU, в процессе, требующем деметилирования ДНК. Деметилирование ДНК также возникает после слияния тимоцитов мыши с эмбриональными половыми клетками (EGC), но примечательно, что только клетки EG способны деметилировать импринтные гены. Слияние клеток-предшественников нейрона или клеток, происходящих из костного мозга, с ESC приводит к гибридам, которые экспрессируют маркеры полипотентности. Аналогичные результаты получены при слиянии фибробластов человека с ESC. Слияние клеток эмбриональной карциномы (ESC) с клетками T-лимфомы также активирует образование колоний экспрессирующих транскрипты полипотентных клеток из генома лимфомы. Компоненты полипотентных клеток EG, ES или EC способны вызывать случаи перепрограммирования в соматическом геноме.
Функция соматического ядра может быть изменена, используя ядерные и цитоплазматические экстракты, потому что экстракты предоставляют необходимые регулирующие компоненты. Экстракты регенерирующихся конечностей тритона вызывают повторение клеточного цикла и деактивацию миогенных маркеров в дифференцированных мышечных трубочках. Тератокарциномы представляют собой особый тип опухолей половых клеток, которые содержат недифференцированные стволовые клетки и дифференцированные производные, которые могут включать зародышевые листки эндодермы, мезодермы и эктодермы. Недифференцированные клетки карциномы можно культивировать для выращивания линий ECC. ECC образуют злокачественные тератокарциномы, когда пересажены в эктопические области; однако некоторые линии ECC также могут благоприятствовать тканям развивающегося зародыша, когда введены в бластоцисту.
Недифференцированные клетки тератокарциномы человека NCCIT-клетки могут быть получены из смешанных медиастинальных опухолей половых клеток. NCCIT находятся на промежуточной стадии между семиномой (предшественник опухолей половых клеток) и эмбриональной карциномой. NCCIT представляет собой клеточную линию с развивающейся полипотентностью, которая может дифференцироваться в производные всех трех типов зародышевых листков эмбриона и внеэмбриональные линии клеточной дифференцировки, экстракт недифференцированных соматических клеток может вызывать дедифференцирование в соматической клеточной линии. См. Taranger et al., "Induction of Dedifferentiation, Genome-wide Transcriptional Programming, and Epigenetic Reprogramming by Extracts of Carcinoma and Embryonic Stem Cells" Mol Biol Cell. (2005).
Стволовые клетки способны адаптироваться в поврежденной ткани. См. Menard et al., "Transplantation of cardiac-committed mouse embryonic stem cells to infarcted sheep myocardium: a preclinical study" Lancet, 366(9490): 1005-12 (2005); Goldman "Stem and progenitor cell-based therapy of the human central nervous system" Nat Biotechnol. 23(7): 862-71 (2005); Leri et al., "Repair of the damaged heart" Kidney Int. 68(5):1962 (2005); Levy et al., "Embryonic and adult stem cells as a source for cell therapy in Parkinson's disease" J Mol Neurosci. 24(3):353-86 (2004); Jack et al., "Processed lipoaspirate cells for tissue engineering of the lower urinary tract: implications for the treatment of stress urinary incontinence and bladder reconstruction" J Urol. 174(5):2041-5 (2005); Kitmaura et al., Establishment of renal stem/progenitor-like cell line from S3 segment of proximal tubules in adult rat kidney Kidney Int. 68(5): 1966 (2005).
В некоторых вариантах осуществления изобретение относится к экстрактам, которые способны стимулировать иммунную систему, чтобы способствовать излечению. Например, экстракты могут содержать фибриноген и белки теплового шока. Эти эндогенные клеточные компоненты представляют собой сигналы тревоги, обычно экспрессированные в больных или поврежденных клетках. Они связываются с Toll-подобными рецепторами (TLR) антигенпредставляющих клеток (APC) и приводят иммунную систему в боевую готовность в поврежденной области. См. Matzinger "The Danger Model: A Renewed Sense of Self Science 296:301-305 (2002).
В некоторых вариантах осуществления изобретение относится к стимулированию существующих стволовых клеток в коже, таких как стволовые клетки, обнаруженные внутри и вокруг волосяных фолликулов, к воспроизводству и/или дифференцированию в эпителиальные клетки или нейроны. Нестин, маркер нейтральных клеток-предшественников, экспрессируется в клетках выпуклой части волосяного мешочка и ведет себя как стволовые клетки, дифференцируясь для формирования большей части волосяного фолликула во время каждого цикла роста волоса. Волосяной фолликул представляет собой динамичный, находящийся в циклическом режиме между фазами роста (анаген), регрессии (катаген) и покоя (телоген) на всем протяжении жизни. Стволовые клетки, локализованные в области выпуклой части мешочка волосяного фолликула, вызывают рост структур фолликулов во время каждой фазы анагена. Стволовые клетки выпуклой части мешочка волосяного фолликула способны порождать все типы эпителиальных клеток внутри неизмененного фолликула и волоса в период нормального цикла волосяной фолликулы. Стволовые клетки выпуклой части мешочка волосяного фолликула дифференцируют в клетки матрикса волосяного фолликула, базальные клетки сальных желез и эпидермис. В ответ на нанесение раны, некоторые стволовые клетки выходят из выпуклой части мешочка фолликула, мигрируют и пролиферируют для того, чтобы вновь заселить воронку и эпидермис. Полипотентные взрослые стволовые клетки из слоя дермы кожи, названные кожными клетками-предшественниками (SKP), способны пролиферировать и дифференцироваться, чтобы произвести нейроны, нейроглию, гладкомышечные клетки и жировые клетки. Полипотентные стволовые клетки ганглионарной пластинки присутствуют в дермальных сосочках волосяных фолликулов взрослых млекопитающих. См. Amoh et al., "Multipotent nestin-positive, keratin-negative hair-follicle bulge stem cells can form neurons" Proc Natl Acad Sci USA. 12;102(15):5530-4(2005).
Костный мозг содержит три популяции стволовых клеток - гематопоэтические стволовые клетки, стромальные клетки и эндотелиальные клетки-предшественники. Стволовые клетки костного мозга, гематопоэтические стволовые клетки (HSC), являются ответственными за формирование всех типов клеток крови в организме. Полученные из костного мозга клетки иногда сортируют - используя панель поверхностных маркеров - на популяции гематопоэтических стволовых клеток или стромальных клеток костного мозга. HSC могут быть высокоочищенные или частично очищенные, в зависимости от использованных условий. Другой способ разделить популяции клеток костного мозга представляет собой фракционирование, чтобы получить клетки, которые прилипают к субстрату для роста (стромальные клетки) или не прилипают (гематопоэтические клетки). Мезенхимальные стволовые клетки костного мозга также порождают эти ткани и образуют ту же самую популяцию, как и стромальные клетки костного мозга. Клетки-предшественники, которые дифференцируют в эндотелиальные клетки, тип клеток, который выстилает кровеносные сосуды, может быть изолирован из циркулирующей крови. Перициты представляют собой стромальные клетки костного мозга.
Комбинации поверхностных маркеров используют, чтобы идентифицировать, изолировать и очистить HSC, происходящие из костного мозга и крови. Недифференцированные HSC и гематопоэтические клетки-предшественники экспрессируют c-kit, CD34 и H-2K. Эти клетки обычно утрачивают маркер происхождения Lin или экспрессируют его на очень низких уровнях (Lin-/low). Стромальные клетки костного мозга имеют несколько признаков, которые отличают их от HSC. Два типа клеток являются разделимыми in vitro. Когда костный мозг диссоциирован, смесь из клеток, которые он содержит, разводят до низкой плотности, стромальные клетки прилипают к поверхности чашки для культивирования и HSC нет. В определенных условиях in vitro, стромальные клетки костного мозга формируют колонии из единственной клетки, называемой колониеобразующей единицей-F (CFU-F). Эти колонии затем могут дифференцировать в жировые клетки или вспомогательную строму спинного мозга, анализ клонированием которой показывает природу стромальных клеток, подобную природе стволовой клетки. В отличие от HSC, которые не делятся in vitro (или пролифелируют только в ограниченной степени), стромальные клетки костного мозга в состоянии пролифелировать до 35 удвоений популяций in vitro. Эндотелиальные стволовые клетки являются CD34+ (маркер HSC), и они экспрессируют фактор транскрипции GATA-2, см. Kocher, et al., "Neovascularization of ischemic myocardium by human bone-marrow-derived angioblasts prevents cardiomyocyte apoptosis, reduces remodeling and improves cardiac function" Nat. Med. 7, 430-436 (2001).
Настоящее изобретение относится к применению любого типа клеток, включая стволовые клетки из любого многоклеточного организма из любого царства видов, как эукариотов, включая животных, растения, одноклеточные организмы, грибы, и прокариотов, включая царства ахеобактерии и эубактерии. Многоклеточные организмы содержат тотипотентные, мультипотентные, плюрипотентные и унипотентные стволовые клетки, способные к делению и пополнению тканей и клеток, которые составляют организм. Стволовые клетки хорошо документированы в млекопитающих животных, но присутствуют во всех животных, например насекомых. Взрослые плодовые мушки имеют такие же стволовые клетки, управляющие регуляцией клеток в их пищеварительном канале, как у людей. Пищеварительные системы позвоночных и беспозвоночных показывают большое сходство в их развитии, составе клеток и генетическом контроле. Средняя кишка Drosophila является типичной: энтероциты образуют большую часть интестинального эпителиального монослоя, но заполняется в промежутках продуцирующими гормоны энтероэндокринными клетками. Интестинальные клетки человека (и мыши) непрерывно пополняются стволовыми клетками, нарушение регуляции которых может лежать в основе общих нарушений пищеварения и рака. Напротив, стволовые клетки не описаны в кишечниках мух, и интестинальные клетки Drosophila признаны относительно стабильными. Линейным мечением было показано, что поздние клетки средней кишки Drosophila непрерывно пополняются отличающейся популяцией интестинальных стволовых клеток (ISC). (Benjamin Ohlstein and Allan Spradling, The adult Drosophila posterior midgut is maintained by pluripotent stem cells, Nature, online december 7 2005.)
В дополнение к стволовым клеткам животных, растения также содержат стволовые клетки. Стволовые клетки в меристемах побега и корня растения сохраняются на протяжении жизни и продуцируют дочерние соматические клетки, которые формируют тело растения. Стволовые клетки растения также могут быть получены из соматических клеток in vivo и in vitro. (Plants stem cells: divergent pathways and common themes in shoots and roots. Byrne ME, Kidner CA, Martienssen RA. Curr Opin Genet Dev. 2003 Oct; 13(5):551-7.) Клетки и организмы животных двигаются сопровождаемые делением клеток, которое служит для регенерации и поддержания тканей и циркулирующих клеточных популяций, растут согласованным повторяющимся образом, в эмбриогенезе содержат резервный набор зародышевых линий, обладают низкой толерантностью к генетическим нарушениям, производят сложные и неполные зародыши, и показывают по существу отсутствие неполового размножения, и не имеют клеточной стенки. Растения реагируют физиологической адаптацией, деление их клеток постоянно до старости содействует образованию органов de novo, рост растения является последовательным, периодическим и восстановительным, растения не имеют резервных зародышевых линий, являются более толерантными к генетическим нарушениям, их зародыши простые и полные, и растительные клетки являются тотипотентными. Растительные стволовые клетки и семена (гаметы растений) предусмотрены для использования по настоящему изобретению. В противоположность редкости тотипотентных клеток у животных, почти каждая сформированная грибами клетка может функционировать как "стволовая клетка". Многоклеточные плодовые тела базидиального гриба состоят из того же типа филаментозного гифа, который формирует фазу активного роста организма, или мицелия, и видимой клеточной дифференциации практически не существует (Money NP. Mushroom stem cells. Bioessays. 2002 Oct;24(10):949-52).
Описание организовано в следующих разделах: A. Экстракты эмбриональных стволовых клеток млекопитающих; B. Экстракты взрослых стволовых клеток; C. Экстракты клеток пуповинной крови; D. Экстракты клеток, зародышей и эмбрионов видов, не относящихся к млекопитающим; E. Способы получения экстрактов; F. Эпигенетические ингибиторы; G. Способы местного введения; H. Другие способы введения; I. Дополнительные компоненты для экстрактов; J. Параметры композиций; K. Местное применение; L. Терапевтические применения; M. Применения целых клеток; N. Терапия Ex vivo и in vivo.
A. Экстракты эмбриональных стволовых клеток млекопитающих
В некоторых вариантах осуществления настоящее изобретение относится к композициям, включающим эмбриональные стволовые клетки или экстракты, полученные из эмбриональных стволовых клеток. В некоторых преимущественных вариантах осуществления, клетки или экстракты представляют собой составленные для местного применения, как более детально описано ниже. Настоящее изобретение не ограничивают использованием какого-либо конкретного типа эмбриональной стволовой клетки. В действительности, предусматривают использование эмбриональных стволовых клеток из ряда видов животных, включая все виды царства животных, но не ограниченные беспозвоночными и позвоночными, включая виды таксономического тип хордовые, включая все классы, и, что важно, все отряды класса млекопитающие, включая в качестве неограничивающих примеров всех приматов, грызунов, плотоядных животных, зайцеобразных и парнокопытных. Способы для получения плюрипотентных клеток из видов этих отрядов животных, включая обезьян, мышей, крыс, свиней, крупный рогатый скот и овец, были ранее описаны. См., например, патенты США №№ 5453357; 5523226; 5589376; 5340740; и 5166065 (все из них особым образом включены в настоящий документ в качестве ссылки); а также, Evans, et al., Theriogenology 33(1): 125-128, 1990; Evans, et al., Theriogenology 33(1): 125-128, 1990; Notarianni, et al., J. Reprod. Fertil. 41(Suppl.):51-56, 1990; Giles, et al., Mol. Reprod. Dev. 36:130-138, 1993; Graves, et al., Mol. Reprod. Dev. 36:424-433, 1993; Sukoyan, et al., Mol. Reprod. Dev. 33:418-431, 1992; Sukoyan, et al., Mol. Reprod. Dev. 36:148-158,1993; Iannaccone, et al., Dev. Biol. 163:288-292, 1994; Evans & Kaufman, Nature 292:154-156, 1981; Martin, Proc Natl Acad Sci USA 78:7634-7638, 1981; Doetschmanet al. Dev Biol 127:224-227, 1988); Gileset al. Mol Reprod Dev 36:130-138, 1993; Graves & Moreadith, Mol Reprod Dev 36:424-433, 1993 и Bradley, et al., Nature 309:255-256, 1984.
Эмбриональные стволовые клетки приматов предпочтительно можно получать способами, раскрытыми в патентах США №№ 5843780 и 6200806, каждый включен в настоящий документ в качестве ссылки. Стволовые клетки приматов (включая человека) также можно получать из коммерческих источников, таких как WiCell, Madison, WI. Предпочтительная среда для выделения эмбриональных стволовых клеток представляет собой "среду ES." Среда ES состоит из 80% Модифицированной по способу Дульбекко среды Игла (DMEM; состав без пирувата с высоким содержанием глюкозы, Gibco BRL), с 20% эмбриональной телячьей сыворотки (FBS; Hyclone), 0,1 мМ β-меркаптоэтанола (Sigma), 1% исходного раствора ненезаменимых аминокислот (Gibco BRL). Предпочтительно, партии эмбриональной телячьей сыворотки сравнивают тестированием эффективностей путем покрытия колониями, кратковременными пассажами клеточной линии мышиных ESC (ESjt3), клеточная линия поддерживается только для целей этого теста. Партии FBS должны сравниваться, так как обнаружено, что партии существенно различаются по способности поддерживать рост эмбриональных клеток, но любой другой способ анализа соответствия партий FBS требованием для поддержания эмбриональных клеток будет работать как альтернатива.
ES клетки приматов выделяют на конфлюэнтном слое мышиных эмбриональных фибробластов в присутствии клеточной среды ES. Эмбриональные фибробласты представляют собой предпочтительно полученные от 12-дневных зародышей аутбредных мышей CF1 (SASCO), но другие штаммы можно использовать в качестве альтернативы. Чашки для культивирования тканей предпочтительно обрабатывают 0,1% желатином (тип I; Sigma). Было продемонстрировано получение эмбрионов макак-резусов, с выходом в среднем от 0,4 до 0,6 жизнеспособных эмбриона на макаку-резуса в месяц, Seshagiri et al. Am J Primatol 29:81-91, 1993. Embryo collection from marmoset monkey is also well documented (Thomson et al. "Non-surgical uterine stage preimplantation embryo collection from the common marmoset," J Med Primatol, 23:333-336 (1994)). Здесь, вителлиновый слой с бластоцистов удаляют кратковременным представлением воздействию проназы (Sigma). Для иммунохирургии бластоцисты подвергают воздействию разведения 1:50 кроличьей антисыворотки против клеток селезенки мартышки (для бластоцистов мартышки) или разведением 1:50 кроличьей против макаки-резуса (для бластоцистов макаки-резуса) в DMEM в течение 30 минут, затем промывали в течение 5 минут три раза в DMEM, затем подвергали воздействию разведенного 1:5 комплемента морской свинки (Gibco) в течение 3 минут.
После двух последующих промываний в DMEM, разрушенные клетки трофэктодермы удаляют из неповрежденной внутренней клеточной массы (ICM) аккуратными действиями пипеткой, и ICM наносят на инактивированные (3000 рад гамма-излучения) эмбриональный фибробласты. Через 7-21 дней полученные массы ICM удаляют из разрастаний эндодермы микропипеткой с прямым наблюдением под стереомикроскопом, обрабатывают добавлением 0,05% трипсин-ЭДТА (Gibco) с 1% куриной сывороткой в течение 3-5 минут и аккуратно разделяют аккуратным действием полированной в пламени микропипеткой.
Диссоциированные клетки наносят на эмбриональные фидерные слои в свежей среде ES и наблюдают за образованием колоний. Колонии, демонстрирующие ES-подобную морфологию, отбирают индивидуально и снова отделяют, как описано выше. ES-подобную морфологию определяют как компактные колонии, имеющие высокое отношение ядер к цитоплазме и рельефные ядра. Полученные в результате клетки ESC затем рутинным образом отделяют коротким трипсинолизом или воздействием фосфатно-солевым буфером Дульбекко (без кальция или магния и с 2 мМ ЭДТА) каждые 1-2 недели, когда культуры становятся плотными. Клетки ранних пассажей также замораживают и хранят в жидком азоте.
В некоторых вариантах осуществления экстракты получают из эмбриональных стволовых клеток млекопитающих. В некоторых вариантах осуществления клетки отмывают в фосфатно-солевом буфере (PBS) и буфере для лизиса клеток (100 мМ HEPES, pH 8,2, 50 мМ NaCl, 5 мМ MgCl2, 1 мМ дитиотреитол и ингибиторы протеаз), осаждают при 400 g, повторно растворяют в 1 объеме холодного буфера для лизиса клеток и инкубируют в течение 30-45 мин на льду для набухания. Клетки обрабатывают ультразвуком на льду в аликвотах по 200 мкл, используя импульсный ультрозвуковой аппарат Labsonic-M, оборудованный зондом диаметром 3 мм (B. Braun Biotech, Мельзунген, Германия), до лизиса всех клеток и ядер. Продукт лизиса осаждают при 15000 g в течение 15 мин при 4°C, чтобы осадить крупнозернистый материал. Супернатант разделяют на аликвоты, замораживают в жидком азоте и он может храниться до 9 месяцев при -80°C. Если необходимо, экстракты можно разводить H2O перед использованием, чтобы привести осмотическую концентрацию раствора до ~300 мОсм/л (т.е. изотоничность).
В некоторых вариантах осуществления экстракты стволовых клеток животных, включая, в качестве неограничивающих примеров, экстракты стволовых клеток млекопитающих, используют как они есть, тогда как в других вариантах осуществления экстракты составляют или в чистом виде, или с другими компонентами, как более подробно описано ниже.
B. Экстракты взрослых стволовых клеток
В некоторых вариантах осуществления настоящее изобретение относится к композициям, включающим взрослые стволовые клетки или экстракты, полученные из взрослых стволовых клеток. В некоторых предпочтительных вариантах осуществления, клетки или экстракты составляют для местного применения, как описано более подробно ниже. Взрослая стволовая клетка представляет собой недифференцированную (неспециализированную) клетку, которую обнаруживают в дифференцированной (специализированной) ткани; она может восстанавливать себя и становиться специализированной, чтобы создавать специализированные типы клеток той ткани, из которой она происходит. Эти клетки-предшественники существуют внутри дифференцированных тканей взрослых особей всех многоклеточных организмов в царствах животных, растений, одноклеточных организмов и грибов в качестве сообщества клеток, распределенных на всем протяжении ткани. Клетки-предшественники, полученные из взрослых особей, можно разделять на три категории, основываясь на их потенциале для дифференцирования. Эти три категории клеток-предшественников представляют собой эпибластподобные стволовые клетки, стволовые клетки, происходящие из зародышевого листка, и клетки-предшественники. Клетки-предшественники выделяют из широкого разнообразия тканей, включая, в качестве неограничивающих примеров, скелетной мышцы, дермы, жира, сердечной мышцы, грануляционной ткани, периоста, перихондрия, мозга, мягких мозговых оболочек, периневрия, связок, сухожилий, кровеносных сосудов, костного мозга, трахеи, легких, пищевода, желудка, печени, кишечника, селезенки, поджелудочной железы, почки, мочевого пузыря и мужской половой железы. Клетки-предшественники могут выделяться из участков соединительной ткани любой области организма механическим разрушением и/или ферментативным гидролизом и выделены из, в качестве неограничивающих примеров, новорожденных, пубертатных и старческого возраста мышей, крыс и людей, и взрослых кроликов, собак, козлов, овец и свиней.
Первая категория клеток-предшественников, эпибластподобные стволовые клетки (ELSC), состоит из стволовой клетки, которая сформирует клетки из всех трех зародышевых листков. Стволовые клетки из взрослых крыс и стволовые клетки из взрослых людей можно выделить из участков соединительной ткани любой области тела механическим разрушением и/или ферментативным гидролизом.
Стволовые клетки или от взрослых крыс, или от взрослых людей могут быть предпочтительно медленно заморожены и сохранены при -80°C±5°C, используя 7,5% сверхчистый диметилсульфоксид. Быстрое размораживание стволовых клеток из обоих видов из замороженного состояния до температуры окружающей среды дает степень восстановления, превышающую 98%. Эти клетки в недифференцированном состоянии экспрессируют ген Oct-3/4, который является характеристичным для эмбриональных стволовых клеток. ELSC спонтанно не дифференцируют в окружении без сыворотки, испытывающем недостаток веществ, вызывающих прогрессию, веществ вызывающих пролиферацию, веществ индуцирующих направление дифференцировки, и/или ингибирующих факторов, таких как рекомбинантный фактор человека ингибирования лейкемии (LIF), мышиный рекомбинантный фактор, ингибирующий лейкозу (ESGRO), или рекомбинантный фактор подавления дифференцировки человека (ADF). При таких условиях эмбриональные стволовые клетки дифференцируются спонтанно. В отличие от этого, клетки ELS, полученные от обоих видов, остаются в состоянии покоя до воздействия специфических пролиферативных и/или индуктивных агентов и/или окружающей среды.
Клетки ELS пролиферируют с образованием множества конфлюэнтных слоев клеток in vitro в присутствии, агентов пролиферации, таких как производимые тромбоцитами факторы роста, и реагируя на агенты, индуцирующие направление дифференцировки. ELSC реагируют на фактор роста гепатоцитов образованием клеток, принадлежащих эндодермальной линии дифференцировки. Клеточные линии обладают экспрессированными маркерами фенотипа многих несвязанных типов клеток эктодермального, мезодермального и эндодермального происхождения, когда подвержены воздействию общих и специфических агентов индукции.
Вторая категория клеток-предшественников состоит из трех особых стволовых клеток. Каждая из клеток образует клетки конкретного направления дифференцировки эмбрионального зародышевого листка (эктодермальные стволовые клетки, мезодермальные стволовые клетки и эндодермальные стволовые клетки). Под воздействием общих и специфических индукционных агентов стволовые клетки эктодермального направления дифференцировки зародышевого листика могут быть способны дифференцировать, например, в клетки-предшественники нейронов, нейроны, ганглии, олигодендроциты, астроциты, синаптические пузырьки, радиальные глиальные клетки и кератиноциты.
Третья категория клеток-предшественников представлена во взрослых тканях и состоит из множества мультипотентных, трипотентных, бипотентных и унипотентных-предшественников клеток. В твердых тканях эти клетки локализованы около соответствующих им типов дифференцированных клеток. Клетки-предшественники обычно не представляют фенотипических маркеров экспрессии для плюрипотентных ELSC, таких как стадийспецифичный эмбриональный антиген-1, стадийспецифичный эмбриональный антиген-1 или стадийспецифичный эмбриональный антиген-3, или карциноэмбриональный антиген молекулы адгезии клетки-1. Аналогично, клетки-предшественники обычно не представляют фенотипических маркеров экспрессии для стволовых клеток линии дифференцировки зародышевого листка, таких как нестин для клеток эктодермальной линии дифференцировки или фетопротеин для клеток эндодермальной линии дифференцировки.
Клетка-предшественник может быть мультипотентной, обладающей способностью образовывать много типов клеток. Клетка-предшественник эктодермального происхождения, постоянно находящаяся в передней доли гипофиза и обозначаемая как клетка-предшественник из аденогипофиза, представляет собой пример мультипотентной клетки-предшественника. Эти клетки сформируют гонадотропоциты, соматотрофные клетки, тиротрофы, кортикотрофы и маммотрофы. Клетки-предшественники для специфической клеточной линии обладают уникальными совокупностями параметров маркеров кластеров дифференцировки (CD) поверхности клетки и уникальными совокупностями параметров экспрессионных маркеров фенотипической дифференцировки. Клетки-предшественники не дифференцируются спонтанно в указанной среде без сыворотки в отсутствие агента дифференцировки, такого как LIF или ADF. Таким образом, в отличие от эмбриональных стволовых клеток, которые спонтанно дифференцируются при этих условиях, клетки-предшественники остаются в состоянии покоя до воздействия агентами пролиферации (такими как тромбоцитарный фактор роста) и/или агентами прогрессии (такими как инсулин, инсулиноподобный фактор роста-I или инсулиноподобный фактор роста-II).
Клетки-предшественники в состоянии регулировать свое поведение в соответствии с изменяющимися требованиями так, что после трансплантации они активируются из состояния покоя с тем, чтобы пролиферировать и производить как новые клетки-сателлиты, так и значительные количества новых дифференцированных клеток. Например, сократительные единицы мышцы представляют собой мышечные волокна, вытянутые синцитиальные клетки, каждая содержащая много сотен постмитотических ядер миоцитов. Клетки-сателлиты являются постоянно находящимися под базальной мембраной мышечных волокон и функционируют в качестве миогенного предшественника во время регенерации мышцы. В ответ на травму мышцы, клетки-сателлиты активируются, пролиферируют и дифференцируются, во время чего они объединяются воедино с тем, чтобы восстановить или заменить поврежденные мышечные волокна. Когда клетки-сателлиты извлекают из их мышечных волокон способом неферментативного физического титрования, они сохраняют свою способность пораждать значительные количества новой мышцы после трансплантации, чего невозможно добиться ферментативным гидролизом. Обычно применяемый способ ферментативной дезагрегации ослабляет миогенный потенциал. Collins и Partridge "Self-Renewal of the Adult Skeletal Muscle Satellite Cell" Cell Cycle 4:10, 1338-1341 (2005).
Таким образом, настоящее изобретение также предполагает использование неэмбриональных стволовых клеток, таких, как описанные выше. В некоторых вариантах осуществления мезенхимальные стволовые клетки (MSC) могут быть получены из костного мозга, периоста, дермы и других тканей мезодермального происхождения (см., например, патенты США № 5591625 и 5486359, каждый из которых включен в настоящий документ в качестве ссылки). MSC представляют собой образовательные предшествующие плюрипотентные клетки, которые дифференцируются в конкретные типы соединительных тканей (т.е. тканей тела, которые поддерживают специализированные элементы; в особенности жировую, ареолярную, костную, хрящевую, эластичную, стромы костного мозга, мышечные и волокнистые соединительные ткани) в зависимости от различных воздействий in vivo или in vitro окружающей среды. Несмотря на то что эти клетки представляют собой присутствующие в норме с очень низкой встречаемостью в костном мозге, были описаны различные способы для выделения, очистки и в значительной степени воспроизводства происходящих из костного мозга мезенхимальных стволовых клеток в культуре, т.е. in vitro (см. также патенты США № 5197985 и 5226914 и PCT Publication No. WO 92/22584, каждый из которых включен в настоящий документ в качестве ссылки).
Также были описаны различные способы для выделения гематопоэтических стволовых клеток (см., например, патенты США № 5061620; 5750397; 5716827, все из которых включены в настоящий документ в качестве ссылки). Предполагается, что способы по настоящему изобретению можно использовать для получения лимфоидных, миелоидных и эритроидных клеток из гематопоэтических стволовых клеток. Лимфоидные линии, включая B-клетки и T-клетки, предусмотрены для получения антител, регуляции клеточной иммунной системы, обнаружения чужеродных агентов в крови, обнаружения клеток, чуждых для хозяина, и т.п. Миелоидная линия, которая включает моноциты, гранулоциты, мегакариоциты, а также другие клетки, отслеживает присутствие чужеродных тел в кровотоке, обеспечивая защиту против неопластических клеток, утилизации чужеродных материалов в кровотоке, производства тромбоцитов, и т.п. Эритроидные линии предоставляют эритроциты, которые действуют как носители кислорода.
Таким образом, настоящее изобретение также предусматривает использование нейрональных стволовых клеток, которые, как правило, выделяют из развивающихся плодов. Выделение, культивирование и использование нейрональных стволовых клеток описано в патентах США № 5654183; 5672499; 5750376; 5849553; и 5968829, все из которых включены в настоящий документ в качестве ссылки. Предусматривается, что способы по настоящему изобретению могут использовать нейрональные стволовые клетки, чтобы получать нейроны, глии, меланоцит, хрящевую и соединительную ткани головы и шеи, строму различных секреторных желез и клетки пути оттока сердца.
В некоторых вариантах осуществления экстракты получают из эмбриональных стволовых клеток млекопитающих. В некоторых вариантах осуществления клетки промывают в фосфатно-солевом буфере (PBS) и в буфере для лизиса клеток (100 мМ HEPES, pH 8,2, 50 мМ NaCl, 5 мМ MgCl2, 1 мМ дитиотреитол и ингибиторы протеаз), осаждают при 400 g, ресуспендируют в 1 объеме холодного буфера для лизиса клеток и инкубируют в течение 30-45 мин на льду для набухания. Клетки обрабатывают ультразвуком на льду в аликвотах по 200 мкл, используя импульсный ультразвуковой прибор Labsonic-M, оборудованный зондом диаметром 3 мм (B. Braun Biotech, Мельзунген, Германия), до лизиса всех клеток и ядер. Лизат осаждают при 15000 g в течение 15 мин при 4°C, чтобы осадить крупнозернистый материал. Супернатант разделяют на аликвоты, замораживают в жидком азоте и он может храниться до 9 месяцев при -80°C. Если необходимо, экстракты можно разводить H2O перед использованием, чтобы привести осмотическую концентрацию раствора до ~300 мОсм/л (т.е. изотоничность).
В некоторых вариантах осуществления экстракты стволовых клеток животных используют как они есть, тогда как в других вариантах осуществления экстракты составляют или в чистом виде, или с другими компонентами, как более подробно описано ниже.
C. Экстракты клеток пуповинной крови
В некоторых вариантах осуществления настоящее изобретение относится к композициям, включающим клетки пуповинной крови или экстракты, полученные из клеток пуповинной крови. В некоторых предпочтительных вариантах осуществления, клетки или экстракты составляют для местного применения, как описано более подробно ниже. Трансплантация пуповинной крови была успешно выполнена для лечения индивидов с заболеваниями крови; в качестве доноров были использованы новорожденные родные братья или сестры, у которых HLA полностью соответствовали. Преимущества пуповинной крови в качестве источника гематопоэтических стволовых клеток для трансплантации очевидны. Во-первых, пролиферативный потенциал гематопоэтических стволовых клеток в пуповинной крови является высшим для клеток в костном мозге или крови от взрослых особей. Оттого что они пролиферируют быстро, стволовые клетки в одной единице пуповинной крови могут восстановить полную гематопоэтическую систему. Во-вторых, использование пуповинной крови уменьшает риск реакции "трансплантат против хозяина", главного препятствия успеху аллогенной трансплантации гематопоэтических стволовых клеток. Реакции "трансплантат против хозяина" вызывается реакцией Τ-клеток в трансплантате на HLA антигены реципиента; незрелость лимфоцитов в пуповинной крови гасит эту реакцию. Объединенные европейские исследования показали, что реципиенты пуповинной крови от HLA-идентичного родного брата или сестры имеют меньший риск острой или хронической реакции "трансплантат против хозяина", чем реципиенты костного мозга HLA-идентичных братьев или сестер. Дети с острым лейкозом, которые получили HLA-несоответствующую пуповинную кровь от неродственного донора, также имели меньший риск реакции "трансплантат против хозяина", чем реципиенты HLA-несоответствующего костного мозга от неродственного донора (Hematopoietic stem-cell transplants using umbilical-cord blood, New England Journal of Medicine, 2001, 3 44(24): 1860-1861, editorial).
Клетки пуповинной крови от родных братьев или сестер или детей с соответствующим HLA могли использоваться, чтобы получить экстракты или быть применены для использования в качестве, предусмотренном настоящим изобретением.
D. Экстракты клеток, зародышей и эмбрионов видов, не относящихся к млекопитающим
В некоторых вариантах осуществления композиции по настоящему изобретению используют клеточный, зародышевый и эмбриональный экстракты из позвоночных, включая в качестве неограничивающих примеров надкласс Gnathostomata (Челюстноротые), Euteleostomi (костистые позвоночные), Класс Actinopterygii (лучеперые рыбы), класс Sarcopterygii (лопастеперые рыбы и наземные позвоночные), Tetrapoda (тетраподы), Amniota (амниоты), Synapsida (синапсиды), класс Mammalia (млекопитающие), ранние Therapsida (ранние терапсиды), класс Reptilia (рептилии), анапсиды (морские и сухопутные черепахи), отряд Testudines (морские и сухопутные черепахи), Diapsida (птицы, крокодилы, ящерицы, змеи и близкие виды), Archosauria (птицы и крокодилы), отряд Crocodilia (кайманы, настоящие крокодилы и близкие), Lepidosauria (амфисбены, ящерицы, змеи и туатары), отряд Rhynchocephalia (туатары), отряд Squamata (амфисбены, ящерицы и змеи), класс Amphibia (амфибии), подкласс Dipnoi (двоякодышащие), Actinistia, отряд Coelacanthiformes (целаканты), класс Chondrichthyes (скаты, акулы и близкие), Placodermi (панцирные рыбы и пластинокожие), класс Cephalaspidomorphi, более предпочтительно зародыши или эмбрионы рыбы, креветки, морского ежа или амфибий. В некоторых вариантах осуществления используют неоплодотворенные, но активированные зародыши рыбы, креветки или морского ежа. Настоящее изобретение не ограничено использованием какого-либо конкретного типа зародышей. В действительности, предусматривается использование разнообразных зародышей, включая, в качестве неограничивающих примеров, зародыши из лягушки, креветки, морского ежа, лосося, форели или полосатого данио. В некоторых вариантах осуществления зародыши собирают от зрелых самок и спонтанно активируют контактом с водой. В еще одном варианте осуществления зародыши промывают в солевом растворе Рингера. В некоторых вариантах осуществления изобретения используют зародыши не из видов птиц.
E. Получение экстрактов и фракций
Экстракты по настоящему изобретению получают из любого источника, описанного в разделах A-D. В некоторых вариантах осуществления экстракты представляют собой клеточные экстракты. Клеточные экстракты по настоящему изобретению представляют собой композиции разрушенных клеток, такие как стволовые клетки или зародыши. Клетки могут быть разрушены разными способами, включая, в качестве неограничивающих примеров, механическое разрывание или введением добавок, разрушение ультразвуком или осмотический лизис. В некоторых вариантах осуществления клеточные экстракты представляют собой предпочтительно дополнительно переработанные для получения композиции, которая по существу свободна от липидов, естественным образом связанных с клетками, такими как компоненты клеточной мембраны. По существу свободные от липидов означает, что клеточный экстракт включает менее чем приблизительно 1%, предпочтительно менее чем приблизительно 0,5%, и более предпочтительно менее чем приблизительно 0,1% липидов, которые естественным образом связаны с клетками, использованными для получения клеточного экстракта. В некоторых вариантах осуществления экстракты включают менее чем приблизительно 1% и предпочтительно менее чем 0,1% холестерина или овальбумина. Таким образом, в некоторых вариантах осуществления клеточный экстракт включает углеводы, белки, гликозилированные или другим образом модифицированные белки, пептиды, аминокислоты, РНК (мРНК, сРНК, мкРНК, рРНК), ДНК, воду и т.д., и их сочетания. В некоторых вариантах осуществления, клеточные экстракты могут включать малые количества липидов, естественным образом связанных с клетками, а также компоненты ядер, такие как хромосомы, нуклеиновые кислоты и ядерные белки. В некоторых вариантах осуществления клеточный экстракт представляет собой предпочтительно цитоплазматический экстракт, полученный удалением ядерной, клеточной мембраны и других не растворимых в воде материалов, естественным образом связанных с клетками. В некоторых вариантах осуществления эти компоненты удаляют посредством центрифугирования или фракционирования разрушенных клеток. В некоторых вариантах осуществления клеточные экстракты представляют собой предпочтительно водные экстракты, включающие растворимые в воде компоненты клеток, такие как белки, мРНК, и углеводы.
Для получения экстрактов можно использовать различные способы. Например, в некоторых вариантах осуществления зародыши помещают "сухими" в стеклянную пробирку объемом 15 мл и разрушают центрифугированием при 15,000 g в течение 15 мин. Это производит три слоя: верхнюю липидную фракцию, которую собирают, делят на аликвоты и замораживают; среднюю клеточную фракцию, которую также собирают, делят на аликвоты и замораживают; и осадочную фракцию, которую отбрасывают. В некоторых вариантах осуществления клеточная фракция или экстракт прежде всего включает содержимое цитоплазмы. Клеточную фракцию используют как экстракт. В некоторых вариантах осуществления клеточную фракцию можно использовать в сочетании с липидной фракцией. Фракция цитоплазмы может быть в дальнейшем очищена осаждением при 50000, 100000 или 200000 g, чтобы получить в дальнейшем клеточный экстракт, который представляет собой прежде всего растворимую в воде фракцию экстракта. Вне зависимости от использованной фракции экстракт, если необходимо, может быть разведен до приблизительно 300 мОсм буфером для лизиса клеток (см. выше). Таким образом, в некоторых предпочтительных вариантах осуществления используют растворимый в воде экстракт из зародышей или эмбрионов.
В других вариантах осуществления зародыши суспендируют в 0,5 объема буфера для лизиса клеток и обрабатывают ультразвуком во льду до разрушения зародышей. Дисперсный материал осаждают при 15000 g в течение 15 мин при 4°C. Супернатант является экстрактом. Как указывалось выше, осмотическая концентрация, если необходимо, может быть доведена до 300 мОсм. Экстракт также может быть очищен, как указано выше.
В других дополнительных вариантах осуществления, зародыши суспендируют в буфере для лизиса клеток, как в способе 2. Зародыши лизируют гомогенизацией по Доунсу, используя стеклянную ступку и пестик (Kontes, тип A или B). Лизат осаждают и обрабатывают, как описано выше.
В некоторых вариантах осуществления экстракты из стволовых клеток, таких как эмбриональные стволовые клетки, получают подобным способом. В этих вариантах осуществления, стволовые клетки сначала разрушают и затем центрифугируют, как описано выше, для удаления нерастворимых остатков клеток. Стволовые клетки, как правило, содержат много меньше липидного материала, следовательно, начальное центрифугирование дает две основные фракции, осадок и клеточные фракции, которые содержат в себе, прежде всего, цитоплазматические компоненты. В некоторых вариантах осуществления клетки, чашка с клетками или клетки, собранные из колб или ферментеров, промывают в охлаждаемом на льду РBS. Когда используют чашку с клетками, клетки соскребают и переносят охлажденную на льду пробирку для цетрифугирования, такую как пробирку Эппендорфа. В некоторых вариантах осуществления затем клетки осаждают и супернатант удаляют. Затем клетки разрушают. В некоторых вариантах осуществления к клеткам добавляют гипотонический раствор в объеме приблизительно от 1,5:1 до 3,0:1 по отношению к клеточному осадку. Подходящий гипотонический раствор содержит 10 мМ HEPES pH 7,9, 1,5 мМ MgCl2, 10 мМ KCl 3,33, 0,5 мМ ДТТ, и 0,2 мМ PMSF. В некоторых вариантах осуществления затем добавляют 10% раствор Triton X (приблизительно 1/20 объема) к осадку и осадок ресуспендируют интенсивным встряхиванием. В некоторых вариантах осуществления затем клетки гомогенизируют, например гомогенизатором Доунса или обработкой ультразвуком, чтобы дополнительно разрушить клетки. В одном варианте осуществления, остатки клеток осаждают посредством центрифугирования, например 6000 об/мин при 4°C в течение 30 секунд. Затем супернатант собирают как клеточный экстракт.
В некоторых вариантах осуществления клеточные экстракты, описанные выше, и наиболее предпочтительно средние фракции дополнительно фракционируют. Можно использовать ряд методов, включая, в качестве неограничивающих примеров, градиенты плотности на основе фиколла, градиентное центрифугирование, осаждение белка, сублимационная сушка, хроматография на колонках, такая как гель-фильтрация и аффинная хроматография, разделение в геле, высокоэффективная жидкостная хроматография, http://www.multitran.ru/c/m.exe?t=4185292_2_1, и иммунопреципитация. Понятно, что эти этапы разделения на фракции дают соответствующие фракции, такие как сублимированные фракции, фракции аффинной хроматографии, фракции осаждения и т.д.
В некоторых вариантах осуществления затем фракции объединяют с или перерастворяют с компонентами, подходящими для получения композиций для местного применения, как более детально описано ниже.
F. Эпигенетические ингибиторы
В некоторых вариантах осуществления композиции по настоящему изобретению дополнительно содержат эпигенетические ингибиторы. В предпочтительных вариантах осуществления один или несколько эпигенетических ингибиторов объединяют с одним или несколькими клеточными экстрактами, описанными в разделах A-E. Настоящее изобретение не ограничивают использованием какого-либо конкретного эпигенетического ингибитора. В действительности, подразумевается использование ряда эпигенетических ингибиторов, включая, в качестве неограничивающих примеров, синтетические эпигенетические ингибиторы и эпигенетические ингибиторы, выделенные и полученные из природных источников. Примеры эпигенетических ингибиторов включают в качестве неограничивающих примеров ингибиторы гистондеацетилазы, ингибиторы ДНК метилтрансферазы и некоторые витамины.
В некоторых вариантах осуществления эпигенетические ингибиторы включают естественные экстракты, содержащие бутират или масляную кислоту, полученную из естественных продуктов питания, таких как масло из животных жиров или молоко (например, коровье молока или сыр), растительные масла (например, Heracleum giganteum (борщевик обыкновенный) и Pastinaca sativa (пастернак)), или чайный гриб (включает масляную кислоту, как результат ферментации содержащегося бутирата). Получение экстрактов может включать ферментацию, обеспечиваемую анаэробными бактериями (например, Clostridium butyricum, Clostridium kluyveri, Clostridium pasteurianum, Fusobacterium nucleatum, Butyrivibrio fibrisolvens, Eubacterium limosum). Эстракты продуктов животного жира или растительного малсла можно получить химическим или физическим способом, включающим высвобождение масляной кислоты из глицерида гидролизом. Экстракты также можно получать ферментацией сахара или крахмала в естественных продуктах, добавлением Bacillus subtilis, с карбонатом кальция, добавленным, чтобы нейтрализовать образованные кислоты.
В других вариантах осуществления эпигенетические ингибиторы включают натуральный экстракт красных сортов винограда, содержащих фитоалексин ресвератрол, включая экстракт из сока или ферментированного сока (вина) красных сортов винограда. Экстракты могут быть получены механическим разрушением винограда, отделением кожицы от мякоти и косточек, и либо экстрагированием фитоалексина химическими или физическими способами, либо могут быть получены из свежего или ферментированного виноградного сока химическими или физическими способами, включая вываривание, фракционирование, аффинную хроматографию, сублимационную сушку или разделение в геле.
В других вариантах осуществления эпигенетические ингибиторы включают естественный экстракт, содержащий цианокобаламин (витамин B-12), полученный из организмов, содержащих ферменты, необходимые для синтеза Β12, такие как бактерии и археи, или натуральные продукты, которые накапливают такие продуцирующие B12 бактерии, включая мясо (особенно печень, и моллюски, и ракообразные), яйца, и молочные продукты. Экстракты могут быть получены химическими или физическими способами, такими как гомогенизация с последующим фракционированием, аффинная хроматография, сублимационная сушка или разделение в геле.
В других вариантах осуществления эпигенетические ингибиторы включают природный экстракт, содержащий один или несколько вариантов витамина B, полученного из картофеля, бананов, чечевицы, чилийского перца, темпе, печени, индейки, тунца, пищевых дрожжей (или пекарских дрожжей), пива или мармита. Экстракты можно получать химическими или физическими способами, такими как гомогенизация с последующим, например, фракционированием, аффинной хроматографией, сублимационной сушкой или разделением в геле.
В других вариантах осуществления эпигенетические ингибиторы включают природный экстракт, содержащий ретиноиды или предшественники ретиноидов, полученные из или продуктов животного происхождения (например, молоко и яйца), которые содержат сложные эфиры ретинила, или из растений (например, морковь, шпинат), которые содержат каротеноиды провитамина A. Экстракт может быть модифицирован гидролизом (продукты животного происхождения) ретинилэфиров до получения ретинола, в то время как растительные экстракты, содержащие каротеноиды провитамины A, могут быть расщеплены для получения ретиналя (ретинальдегида), который может быть далее обратимо восстановлен до получения ретинола или может быть необратимо окислен до ретиноевой кислоты. Наилучшим образом описанные активные ретиноидные метаболиты представляют собой 11-цис-ретиналь и полностью транс- и 9-цис-изомеры ретиноевой кислоты, которые могут быть добавлены к этому экстракту.
Примеры других ингибиторов ДНК метилтрансферазы включают в качестве неограничивающих примеров 5-азацитидин, 5-аза-20-дезоксицитидин, арабинозил-5-азацитидин, 5-6-Дигидро-5-азацитидин, 5-Фтор-20-дезоксицитидин, EGX30P, эпигаллокатехина-3-галлат, полифенол зеленого чая, гидралазин, MG98, прокаинамид, прокаин, и зебуларин. Примеры других ингибиторов гистондеацетилазы включают в качестве неограничивающих примеров апицидин, бутираты, фенилбутират, бисгидроксамид м-Карбоксикоричной кислоты (CBHA), циклический пептид, содержащий гидроксамовую кислоту 1 (CHAP1), гибрид TSA-Трапоксин, депудецинэпоксид, депсипептид FR901228, бензамидин, LAQ824, оксамфлатин, MGCD0103, PXD101, пироксамид, субероилбисгидроксамовую кислоту (SBHA), субероиланилидгидроксамовую кислоту (SAHA), трикостатин A (TSA), трапоксин A, вальпроевую кислоту.
G. Способы местного введения
В некоторых вариантах осуществления описанные выше экстракты (или компоненты экстрактов) составляют для топического введения. Обычные составы для местного нанесения описаны в Remington's Pharmaceutical Sciences, 18th Edition, Mack Publishing, p. 1288-1300 [1990]. Таким образом, в некоторых вариантах осуществления экстракты составляют в виде геля или пасты на водной основе, мази, крема (безводного или водного), лосьона (безводного или водного), эмульсии, спрея, раствора, аэрозоля, карандаша (твердого крема), жидкого лейкопластыря, порошка, распыляемого раствора для ингаляции, назального спрея, капель для носа, щечных капель, подъязычных капель, глазных капель или спреев, ушных капель или спреев, и трансдермальных пластырей.
Η. Другие способы введения
В некоторых вариантах осуществления описанные выше экстракты (или компоненты экстрактов) составляют для введения рядом методов. В некоторых вариантах осуществления описанные выше экстракты составляют для нанесения на кожу, в желудочно-кишечный тракт, жировые отложения, хрящ, кость, соединительную ткань, мышцы или внутренние органы. В некоторых вариантах осуществления экстракты или их компоненты составляют для перорального введения с или без походящего носителя, такого как крахмал, сахароза или лактоза, в таблетках, пилюлях, драже, капсулах, растворах, жидкостях, пастообразных смесях, суспензиях и эмульсиях. В некоторых вариантах осуществления средство доставки для перорального введения включает энтеросолюбильное покрытие. В других вариантах осуществления экстракты или их компоненты составляют для ректального введения как капсулы, крем, суппозитории или жидкость. В некоторых вариантах осуществления экстракты или их компоненты инъецируют шприцом в полость брюшины или во внутренние органы или ткани. В некоторых вариантах осуществления, экстракты или их компоненты составляют для введения осмотической помпой.
В других дополнительных вариантах осуществления, экстракты или их компоненты водят микроинъекцией, предпочтительно путем бомбардировки частицами (т.е. генным ружьем). Метод введения гена посредством частиц представляет собой известный в данной области, коммерчески доступный, и включают, в качестве неограничивающих примеров, приводимый в действие газом инструмент для введения гена, описанный McCabe, патент США № 5584807, все содержание которого включено в настоящий документ в качестве ссылки. Этот способ включает нанесение последовательности нуклеиновой кислоты, представляющей интерес, на частицы металла с большим удельным весом и ускорение покрытых частиц под давлением сжатого газа для введения в намеченную ткань. Также доступны другие способы бомбардировки частицами. Как правило, эти способы включают нанесение экстракта или его компонентов на поверхность маленькой частицы с большой плотностью из материала, такого как золото, платина или вольфрам. Затем сами покрытые частицы наносят на жесткую поверхность, такую как металлическая пластина, или на лист носителя, сделанного из хрупкого материала, такого как майлар. Затем покрытый лист ускоряется по направлению к намеченной биологической ткани. Использование плоского листа создает однородное распределение ускоренных частиц, что делает максимальным число клеток, получающих частицы при однородных условиях, приводящих к введению образца нуклеиновой кислоты в намеченную ткань. Настоящее изобретение предусматривает описанное использование генного ружья для введения экстрактов или компонентов экстрактов, как определено выше.
В других дополнительных вариантах осуществления, эмбриональные экстракты стволовых клеток, взрослых стволовых клеток или зародышей или компоненты являются микрокапсулированными (например, с коллагеном или гликозаминогликанами), превращенными в наночастицы (например, лецитин, инкапсулированный в масляное ядро), липосомы, микроэмульсии, или наноэмульсии, основы масляных материалов, жидкие моелекулярные пленки ретинола, однослойные везикулы, многослойные везикулы, предварительно нагруженные сферические бусины или губки, эластичные везикулы, и т.д.
I. Параметры композиций
В некоторых вариантах осуществления композиция для местного и/или внутреннего применения представляет собой комбинацию экстрактов с липидами, и/или водой, и/или углеводами, и/или нуклеиновыми кислотами, и/или белками, и/или сигнальными веществами. В некоторых вариантах осуществления экстракт по этому документу состоит из целых клеток или комбинаций липидов, и/или углеводов, и/или нуклеиновых кислот, и/или белков, и/или сигнальных веществ клеток, из которых получен экстракт, или из синтетических, и/или природных вариантов липидов, и/или углеводов, и/или нуклеиновых кислот, и/или белков, и/или сигнальных соединений. Сигнальные структуры включают комбинации активных веществ, высвобожденных из клеток, которые содержатся в экстрактах клеток, и включают синтетические и/или природные варианты этих сигнальных веществ, добавленные к экстрактам. Сигнальные вещества по настоящему изобретению включают в качестве неограничивающих примеров факторы роста, эндорфины, гормоны, переносчики аминокислоты, иммунорегуляторные цитокины и другие факторы, связанные с иммунной системой.
Фактор роста-β1 управляет биологией облученной ткани в качестве элемента, воспринимающего окислительный стресс, и представляет собой неотъемлемую составляющую реакции на повреждение ДНК клетки. Трансформирующий фактор роста-β5 (TGF- β5), член этого семейства сигнальных факторов, найденный в амфибиях, экспрессирован в регенерирующих бластемах, образованных при регенерации конечностей (King et al., 2003), и все изоформы TGF-β млекопитающих высвобождаются местно из различных клеток в местах повреждения, и это является существенным при контроле образования волокнистой ткани и образования рубца при восстановлении ткани млекопитающего. Манипуляция конкретными изоформами TGF-β допускает получение заживления без рубца ран у мышей (Ferguson и O'Kane, 2004). TGF-β1 представляет собой мощный иммунорегуляторный цитокин, вовлеченный в подавление воспаления и регуляторной активности Τ-клеток, приводящие к иммунной толерантности (Chen и Wahl, 2003). Исследования по заживлению ран и подавлению иммунитета у млекопитающих показывают, что различная активность TGF-β в регенерирующих ампутированных конечностях амфибий может быть вовлечена в супрессию образования волокнистых тканей и установление условий, допускающих образование бластемы.
Трансформирующий фактор роста-альфа (TGF-альфа) и происходящий из мозга нейротрофический фактор (BDNF), выделяемый in vitro из плюрипотентных стволовых клеток человека, происходящих из эмбриональных половых клеток, названных эмбриодными клетками из тела (EBD), имеют способность восстанавливать неврологическую функцию у животных защитой нейронов хозяина от гибели и содействовать реафференциации тел клеток двигательных нейронов (Kerr DA, et al., Human embryonic germ cell derivatives facilitate motor recovery of rats with diffuse motor neuron injury. J Neurosci. 2003 Jun 15;23(12):5131-40).
Показано, что факторы роста фибробластов (FGF), такие как FGF-10, являются важными при повторном росте конечностей у лягушек (Christen и Slack, 1997; Yokoyama et al., 2000).
Про-опиомеланокортин (POMC) предшественник a-меланоцитстимулирующего гормона (α-MSH), эндорфины и некоторые другие пептидные гормоны экспрессированы в регенерирующих бластомах (King et al., 2003), в коже, а также в мозге, гипофизе и других органах. POMC имеет первоочередное значение в модулировании иммунной активности в коже, в первую очередь в силу активности α-MSH (Luger et al., 1999). Паракринное высвобождение пептидов α-MSH оказывает мощный иммуномодулирующий эффект на клетки иммунной системы. α-MSH ингибирует все формы воспалений, против которых его тестировали (Lipton et al., 1997), и локализованное продуцирование α-MSH помогает поддерживать оптимальный иммунный ответ в конкретных участках кожи (Paus et al., 2003). Экспрессия α-MSH клетками бластемы, как разумно ожидать, предоставит противовоспалительный эффект, потенциально важный для ингибирования роста волокнистой ткани и регенерации, необходимой для повторного роста конечности или ткани.
Тимозин-β4 представляет собой тимусный внешний фактор, который также, как было показано, активирует ангиогенез, миграцию кератиноцитов и заживление ран (Malinda et al., 1999). Тимозин-β4 проявляет сильную противовоспалительную активность и секретируется макрофагами и Τ-лимфоцитами кожи, кишечника и других органов в дополнение к тимусу (Young et al., 1999; Girardi et al., 2003). Тимозин-β4 активирован в псевдобластемах лягушки (King et al., 2003) и бластемах регенерации и активность тимозина-β4 в тканях ампутированных конечностей может включать иммуномодуляцию воспалительного ответа в дополнение к стимуляции эпителиальной миграции и других аспектов регенерации.
J. Дополнительные компоненты
В некоторых вариантах осуществления описанные выше экстракты или их компоненты комбинируют с дополнительными компонентами. В некоторых вариантах осуществления эти дополнительные компоненты увеличивают поглощение, биодоступность или проникание компонентов экстракта. В предпочтительных вариантах осуществления компоненты экстракта могут содержать природные компоненты или смесь синтетических компонентов. Компоненты могут быть частично или полностью синтетические. В некоторых вариантах осуществления клетка, или экстракт, или синтетические компоненты, полученные из веществ, идентифицированных в экстрактах, смешивают с композицией, включающей воду, жировые и эпидермальные липиды и клеточные экстракты, белки и их компоненты, предпочтительно содержат приблизительно 10% по весу липидной фракции, приблизительно 10% по весу белковой фракции, и приблизительно 80% по весу летучей фракции.
Vernix caseosa (первородная смазка) представляет собой встречающееся в природе защитное средство кожи. Первородная смазка представляет собой богатое липидами вещество, состоящее из кожного сала, эпидермальных липидов и лущившихся эпителиальных клеток, которое постепенно покрывает кожу развивающегося зародыша, полностью окруженного амниотической жидкостью, во время последнего триместра беременности. В одном варианте осуществления, изобретение относится к композициям, где липидная фракция предпочтительно включает компоненты в первородной смазке, т.е. лецитин и другие фосфолипиды, сквален, воск, эфиры воска, стероловые сложные эфиры, диоловые сложные эфиры, тирглицериды, свободные стеролы и четыре класса жирных кислот, расположенные по длине цепи от C12 до C26 (насыщенная неразветвленная цепь, ненасыщенная неразветвленная цепь, насыщенная разветвленная цепь и ненасыщенная разветвленная цепь). В предпочтительных вариантах осуществления липидные компоненты первородной смазки представляют собой следующие с указанным относительным процентным содержанием: сквален (9%), алифатические воски (12%), стероловые сложные эфиры (33%), диэфиры (7%), триглицериды (26%), свободные стеролы (9%), другие липиды (4%). В еще одном варианте осуществления, липидную композицию составляют из липидов зародыша и/или икры рыбы со способностью заживления ран 30%, которую представляют собой защитные липиды (протеолипидный матрикс); холестерин (1,1 %, 52,8% защиты), свободные жирные кислоты (0,6%, 27,7% защиты), фосфолипиды (0,4%), церамиды (0,7%, 20,1% защиты). В другом предпочтительном варианте осуществления белковая фракция содержит белковые компоненты первородной смазки, т.е. кератин, филагрин, регуляторные белки (например, EGF) и глутамин.
Жирные кислоты в составе алифатических восков могут быть разветвленные, и разветвленные жирные кислоты могут быть метилированные. Белковая фракция состоит из белков эпидермального происхождения, прежде всего кератина и флагилина. Белковая фракция также содержит незначительные количества в диапазоне от приблизительно микромолярной до миллимолярной концентрации регуляторных белков, таких как эпидермальный фактор роста (EGF), и незначительные количества от приблизительно наномолярной до микромолярной концентрации поверхностно-активных белков, таких как поверхностно-активное вещество A и поверхностно-активное вещество B. Летучая фракция представляет собой в первую очередь воду. Скорость испарения летучих компонентов относительно медленная, возможно благодаря увеличенным потребностям в энергии для диссоциации водородных связей и для диффузии из клеточного компонента через липидный компонент для перехода воды из жидкого в газовое состояние. В дополнительных предпочтительных вариантах осуществления, композиция содержит мРНК, содержащуюся в клеточных экстрактах, предпочтительно экстрактах стволовых клеток.
В некоторых вариантах осуществления экстракты или компоненты эмбриональных стволовых клеток, взрослых стволовых клеток или зародышей комбинируют с фосфолипидами или другими липофильными веществами, пальмитилмиристратами, диметилсульфоксидом (DMSO), хитозаном, органическими полимерами с длинной цепью, такими как полисахариды, неводные растворители, бета-глюкан, компоненты, регулирующие pH, агенты, ингибирующие метаболизм в коже, пропиленгликоль, бутиленгликоль, полиэтиленгликоль, оливковое масло или другие встречающейся в природе масла, диметилизосорбид, диметилформамид, метилсалицилат, олеиновые кислоты с длинной цепью, гликозаминогликаны, и другие агенты.
В некоторых вариантах осуществления дополнительные агенты включают, в качестве неограничивающих примеров, убиквитин, противомикробные вещества (aльфа-дефензины, LL37, бета-дефензины и т.д.), поверхностно-активные белки из семейства коллектинов (коллектин, связанные белки A и D), никотинамид и псориазин.
В некоторых вариантах осуществления дополнительные агенты включают, в качестве неограничивающих примеров, витамины, антиоксиданты, минералы, экстракты и химические соединения, такие как альфа-токоферол (витамин E), меланин, витамин C, провитамин A, пропионат ретинола, ретиноевую кислоту, витамин D3, никотинамид (витамин B), никотинамид (вит. B3, отшелушивает поверхностную кожу), d-пантенол (в коже содействует восстановлению повреждений), витамин A, гиалуроновую кислоту, церамиды, морские водоросли (algae), Минеральное масло (paraffinum liquidium), вазелин, глицерин, изогексадекан экстракт Cirrus aurantifolia (лайма) микрокристаллический воск (cera microcristallina), спирты ланолина, масло семян Seamum indicium (кунжута), масло листьев Eucalyptus globules (эвкалипта), сульфат магния, семена Sesamum indicum (кунжута), семена Medicago satvia (люцерны), семечки Helianthus annuus (подсолнуха), Prunus dulcis (молотый миндаль), натрий, калий, медь, кальций, магний, глюконат цинка, парафин, сукцинатную форму витамина Ε, ниацин, бета-каротин, Децилолеат, дистиарат алюминия, октилдодеканол, лимонную кислоту, цианкобаламин, стеарат магния, пантенол, лимонен, гераниол, линалоол, гидроксицитронеллаль, цитронеллаль, бензилсалицилат, цитраль, метилхлоризотиазолин, метилизотиазолин, спирт денатурированный, отдушку (parfum), бутиленгликоль, Byrospermum parkii (масло из семян дерева ши), экстракт хрящей рыбы (pisces), полиэтилен, гидрогенизированный полиизобутен, циклопентасилоксан, цетиловые сложные эфиры, цетиловый спирт, малахит, изостеарилнеопентаноат, полибутен, сахарозу, диоксид кремния, токотриенол, экстракт плода Cucumis satvius (огурец), экстракт Centella asiatica (тигровой травы), семена Seamum indicium (сезама), масло листьев Eucalyptus globules (эвкалипта), семена Medicago satvia (люцерны), семечки Helianthus annuus (подсолнуха), Prunus dulcis (молотый миндаль), калий, медь, кальций, магний, кофеин, гиалуронат натрия, линолевую кислоту, холестерил/бефенил/октилдодециллаурилглутамат, Метил glucose sesquisterate, холестерин, диметикон, Ocimum basilicum (базилик), Mentha arvensis (мята круглолистная), Акрилат/C 10-30 алкил акрилат кроссполимер, глицерилдистеарат, цетилариловый глюкозид, стеарет-10, карбомер, Аминометилпропанол, лимонен, линалоол, бензилсалицилат, динатрий ЭДТА, BHT, дигидроацетат натрия, феноксиэтанол, метилпарабен, диоксид титана (CI 77891), сложный эфир кислот C12-20 и PEG-8, гидрогенизированное растительное масло, вазелин, бутиленгликоль, глицерин, ацетилированный ланолин, гликопротеины, панакс, экстракт корня женьшеня, экстракт Equisetum Arvense (хвощ), карбомер натрия, пчелиный воск (cera alba), цетилфосфат, полиперфторметилизопропиловый простой эфир, бензиловый спирт, линалоол, гидроксицитронеллаль, альфаизометилионон, альфаамилкоричный альдегид, Гексил коричный альдегид, экстракт Verenia furfuracea (молочай), гераниол, бензилбензоат, бутилфенилметилпропиловый эфир, эвгенол, бензилсалицилат, хлорфенезин, феноксиэтанол и метилпарабен.
K. Местное применение
Предусматривается, что описанные выше композиции для местного применения находят полезными как для косметических, так и терапевтических целей. Терапевтические применения описаны более подробно в разделе J. В некоторых вариантах осуществления предусматривается, что описанные выше композиции наносят непосредственно на кожу или другую эпителиальную или эпидермальную поверхность тела. Композиции можно применять один, два, три или более раз ежедневно в соответствии с показаниями. Примененное количество, как правило, не является существенным, но, как правило, на конкретную поверхность тела может быть нанесена композиция, включающая приблизительно от 0,001 мкг до 10 грамм экстракта (или его компонентов). Как описано выше, композиция может включать другие компоненты, такие как вспомогательные вещества, носители, другие активные ингредиенты, и т.д.
В некоторых вариантах осуществления изобретение относится к композициям, которые включают консерванты и антиоксиданты (включая витамины), чтобы предотвратить деградацию продукта, предпочтительно тринатрий- и тетранатрийэдетат (ЭДТА) и токоферол (витамин E). В еще одном варианте осуществления композиция содержит противомикробные препараты для борьбы с бактериями, предпочтительно бутил, пропил, этил, и метил парабены, DMDM гидантоин, метилизотиазолин-феноксиэтанол (также компонент аромата простого эфира из розы), кватерниум-15. В еще одном варианте осуществления, композиция содержит загустители и воски, использованные в продуктах в виде твердого крема, таких как помады и румяна, предпочтительно канделильский, карнаубский и микрокристаллический воски, карбомер- и полиэтилен-загустители. В еще одном варианте осуществления композиция содержит растворители для разжижения, предпочтительно бутиленгликоль и пропиленгликоль, циклометикон (летучий силикон), этанол (спирт) и глицерин. В еще одном варианте осуществления композиция содержит эмульгаторы для диспергирования и очистки предпочтительно глицерилмоностеарат (также вещество с перламутровым эффектом), лаурамид DЕA (также пенообразователь) и полисорбаты. В некоторых вариантах осуществления композиция содержит цветные добавки - синтетические органические красители, полученные из угля и нефтяных источников, предпочтительно D&C Red No. 7 кальцийсодержащий пигмент (и другие красители, которые не растворяются в воде), оксиды железа, слюда (радужная), и аминофенолы. В еще одном варианте осуществления композиция содержит регулирующие pH компоненты для стабилизации или исправления кислот и оснований, предпочтительно гидроксид аммония - в отшелушивающих кожу и завивающих волосы и выпрямляющих, лимонная кислота - регулирует pH, и триэтаноламин - регулирующее pH средство, используемое чаще всего в прозрачном мыле. В еще одном варианте осуществления композиции содержат агенты, предпочтительно силикат магния, алюминия - абсорбент, средство против спекания, двуокись кремния (диоксид кремния) - абсорбент, средство против спекания, абразив, лаурилсульфат натрия - моющее средство, стеариновая кислота - очищающее, эмульгатор, тальк (порошкообразный силикат магния) - абсорбент, средство против спекания, и стеарат цинка использован в порошке для улучшения текстуры, смазки.
Композиции включают изложенные компоненты и их сочетания в общем количестве приблизительно от 0,5 до 50 грамм на литр, предпочтительно приблизительно от 3 до 10 грамм на литр, несмотря на то, что допускаются более высокие или низкие концентрации. Такие композиции находятся в форме эмульсии, крема, целебной мази или подобной, активных материалов, смешанных с водой, алкиленгликолями, различными натуральными и синтетическими маслами, вазелином, консервантами, красителями, отдушками, и подобными ингредиентами обычными в области косметики.
Композиции могут быть применены на лице, веках или других частях тела в индивидуально изменяющемся количестве. Определено, что полезны приблизительно от 0,01 до 1, преимущественно от 0,02 до 0,75 и предпочтительно приблизительно от 0,3 до 0,5, грамм на см2, но можно использовать больше или меньше. Применение может быть один раз в неделю или более частым, даже несколько раз в день.
В соответствии с композициями и способами по настоящему изобретению, экстракты зародышей, эмбрионов или стволовых клеток по настоящему изобретению можно вводить в форме фармацевтической композиции, дополнительно включающей фармацевтически приемлемый носитель. Специалисты в данной области поймут, что существуют подходящие способы введения композиций экстракта животному, такому как млекопитающее, и, несмотря на то что можно использовать более чем один способ введения конкретной композиции, конкретный способ и дозировка могут обеспечить более быструю и более эффективную реакцию, чем другие. Фармацевтически приемлемые носители также представляют собой хорошо известные специалистам в данной области. Выбор носителя будет определен, от части, как конкретной композицией, так и конкретным способом, использованным для введения композиции. Таким образом, существует широкий ряд подходящих составов фармацевтических композиций по настоящему изобретению.
В некоторых предпочтительных вариантах осуществления, составы по данному изобретению предназначены для местного применения. Типичные из таких составов представляют собой мази, кремы и гели.
Мази, как правило, получают, используя или (1) жировую основу, т.е. основу, состоящую из жирных масел или углеводородов, таких как медицинский вазелин или минеральное масло, или (2) абсорбирующую основу, т.е. основу, состоящую из безводного вещества или веществ, которые могут поглощать воду, например безводный ланолин. Обычно за формированием основы или жировой, или абсорбирующей добавляют активный ингредиент (например, экстракт зародышей лосося или стволовых клеток) в количестве, дающем требуемую концентрацию.
Кремы представляют собой масляно/водные эмульсии. Они состоят из жировой фазы (дисперсная фаза), включающей обычно жирные масла, углеводороды и т.п., такие как воски, вазелин, минеральное масло и т.п., и водной фазы (диспергирующая фаза), включающей воду и любые водорастворимые вещества, такие как добавленные соли. Две фазы стабилизируют, используя эмульгирующее вещество, например поверхностно-активное средство, такое как лаурилсульфат натрия; гидрофильные коллоиды, такие как коллоидные глины акации, вигум и т.п. После формирования эмульсии, активный ингредиент (например, экстракт зародышей лосося или стволовых клеток) обычно добавляют в количестве, достаточном для достижения требуемой концентрация.
Гели включают основу, выбранную из жировой основы, воды или основы эмульсия-суспензия, такие как вышеописанные. К основе добавляют гелеобразующее вещество, которое формирует в геле матрикс, увеличивая его вязкость. Примеры гелеобразующих веществ представляют собой гидроксипропилцеллюлозу, акриловую кислоту полимеры и т.п. Обычно активный ингредиент (IGF-II) добавляют к составу в требуемой концентрации в момент, предшествующий добавлению гелеобразующего вещества.
Количество экстракта, включенного в состав по данному изобретению, не является решающим; концентрация только должна находиться в диапазоне, достаточном, чтобы позволить приготовить аппликацию к области раны в количестве, которое доставит желаемое количество экстракта.
Обычное количество состава, которое будет применено, зависит от концентрации активного ингредиента в составе. В некоторых вариантах осуществления определено количество белка в экстракте. Затем определенное количество экстракта включают в фармацевтически приемлемый носитель, исходя из количества белка. Как правило, состав будет применен на рану в количестве, обеспечивающем приблизительно от 0,1 до приблизительно 500 мкг белка на см2 кожи. Предпочтительно, примененное количество белка будет изменяться от приблизительно 1 до приблизительно 300 мкг/см2, более предпочтительно, приблизительно от 5 до приблизительно 200 мкг/см2. В других вариантах осуществления конкретный объем экстракта добавляют к фармацевтически приемлемому носителю. Таким образом, в некоторых вариантах осуществления композиции по настоящему изобретению включают на основе объем/объем (объем экстракта и объем фармацевтически приемлемого носителя), например, приблизительно от 0,001 до 50% экстракта, приблизительно от 0,01 до 50% экстракта, приблизительно от 0,1 до 50% экстракта, приблизительно от 0,001 до 10% экстракта, приблизительно от 0,01 до 10% экстракта, приблизительно от 0,1 до 10% экстракта, приблизительно от 0,001 до 5% экстракта, приблизительно от 0,01 до 5% экстракта, приблизительно от 0,1 до 5% экстракта, приблизительно от 0,001 до 4% экстракта, приблизительно от 0,01 до 4% экстракта, приблизительно от 0,1 до 4% экстракта, приблизительно от 0,001 до 2% экстракта, приблизительно от 0,01 до 2% экстракта, приблизительно от 0,1 до 2% экстракта, приблизительно от 0,001 до 1% экстракта, приблизительно от 0,01 до 1% экстракта, или приблизительно от 0,1 до 1% экстракта.
Настоящее изобретение может быть составлено по мере необходимости с добавками, обычно используемыми в фармацевтических науках, такими как поверхностно-активные вещества, масла и жиры, многоатомные спирты, низшие спирты, загущающие компоненты, поглотители УФ-излучения, светорассеивающие средства, консерванты, антиоксиданты, антибиотики, хелаторы, регуляторы pH, ароматизаторы, красители и вода.
Примеры поверхностно-активных веществ включают полиоксиэтилен (здесь и далее сокращенный как POE - сложные эфиры разветвленных алкилов, такие как POE-октилдодециловый спирт и POE-2-децилтетрадециловый спирт, POE-алкильные простые эфиры, такие как простой эфир POE-олеилового спирта и простой эфир POE-цетилового спирта, сорбитановые сложные эфиры, такие как сорбитанмоноолеат, сорбитанмоностерарат и сорбитанмонолаурат, POE-сорбитановые сложные эфиры такие как POE-сорбитанмоноолеат, POE-сорбитанмоноизостерарат и POE-сорбитанмонолаурат, сложные эфиры жирных кислот и глицерина, такие как глицерилмоноолеат, глицерилмоностеарат и глицерилмономиристат, сложные эфиры POE-жирных кислот и глицерина, такие как POE-глицерилмоноолеат, POE-глицерилмоностеарат и POE-глицерилмономиристат, POE-дигидрохолистериновые сложные эфиры, POE-отверженное касторовое масло, сложные эфиры жирных кислот и POE-отверженного касторового масла, такие как изостеарат POE-отверженного касторового масла, POE-алкиларильные простые эфиры, такие как POE-октилфеноловый простой эфир, сложные эфиры глицерина, такие как глицеролмоноизостеарат и глицеролмономиристат, простые эфиры POE-глицерина, такие как POE-глицеролмоноизостеарат и POE-глицеролмономиристат, сложные эфиры полиглицериновых жирных кислот, такие как диглицерилмоностеарат, декаглицерилдекастеарат, декаглицерилдекаизостеарат и диглицерилдиизостеарат и другие неионные поверхностно-активные вещества; калийные соли, соли натрия, соли диэтаноламина, соли триэтаноламина, соли аминокислот и другие соли высших жирных кислот, таких как миристиновая кислота, стеариновая кислота, пальмитиновая кислота, бегеновая кислота, изостеариновая кислота и масляная кислота, приведенные выше соли щелочных металлов сложных эфиров карбоновых кислоты, соли N-ациламинокислот, N-ацилсалицилаты, высшие алкилсульфонаты и другие анионные поверхностно-активные вещества; соли алкиламинов, полиаминов, жирных кислот аминоспиртов, кремнийорганическая смола, четвертичные алифатические соли аммония; и другие катионные поверхностно-активные вещества; и лецитин, производные бетаина и другие амфотерные поверхностно-активные вещества.
Примеры масел и жиров включают растительные масла и жиры, такие как касторовое масло, оливковое масло, масло какао, масло камелии, кокосовое масло, древесный воск, масло жожоба, масло из виноградных косточек и масло авокадо; животные масла и жиры, такие как норковый жир и масло яичного желтка; воски, такие как пчелиный воск, воск жировых тканей кита, ланолин, карнаубский воск и канделильский воск; углеводороды, такие как вазелиновое масло, сквален, микрокристаллический воск, церезиновый воск, парафиновый воск и вазелин; природные или синтетические жирные кислоты, такие как лауриновая кислота, миристиновая кислота, стеариновая кислота, масляная кислота, изостеариновая кислота и бегеновая кислота; природные или высшие спирты, такие как пальметиловый, октадециловый спирт, гексилдеканол, октилдеканол и лауриловый спирт; и сложные эфиры, такие как изопропилмиристат, изопропилпальмитат, октилдодецилмиристат, октилдодецилолеат и холестеринолеат.
Примеры многоатомных спиртов включают этиленгликоль, полиэтиленгликоль, пропиленгликоль, 1,3-бутиренгликоль, 1,4- бутиренгликоль, дипропиленгликоль, глицерин, диглицерин, триглицерин, тетраглицерин и другие полиглицерины, глюкозу, мальтозу, мальтитозу, сахарозу, фруктозу, ксилитозу, сорбит, мальтотриозу, треит и эритрит.
Примеры загущающего компонента включают встречающиеся в природе высокомолекулярные вещества, такие как альгинат натрия, ксантановая камедь, силикат алюминия, экстракт семян айвы, трагакантовая камедь, крахмал, коллаген и гиалуронат натрия; полусинтетические высокомолекулярные вещества, такие как метилцеллюлоза, гидроксиэтилцеллюлоза, карбоксиметилцеллюлоза, растворимый крахмал и катионизированная целлюлоза; и синтетические высокомолекулярные вещества, такие как полимер карбоксивинила и поливиниловый спирт.
Примеры поглощающих УФ-веществ включают п-аминобензойную кислоту, 2-этоксиэтил-п-метоксициннамат, изопропил п-метоксициннамат, бутилметоксибензоилметан, глицерил-моно-2-этилгексаноил-ди-п-метоксибензофенон, дигалловый триолеат, 2,2'-дигидрокси-4-метоксибензофенон, этил-4-бисгидроксипропиламинобензоат, 2-этилгексил-2-циано-3,3'-дифенилакрилат, этилгексил-п-метоксициннамат, 2-этилгексил салицилат, глицерил-п-аминобензоат, гомометилсалицилат, метил-o-аминобензоат, 2-гидрокси-4-метоксибензофенон, амил-п-диметиламинобензоат, 2-фенилбензоимидазол-5-сульфоновую кислоту и 2-гидрокси-4-метоксибензофенон-5-сульфоновую кислоту.
Примеры консервирующих веществ включают бензоаты, салицилаты, сорбаты, дегидроацетаты, п-оксибензоаты, 2,4,4'-трихлор-2'-гидроксидифениловый простой эфир, 3,4,4'-трихлоркарбанилид, хлорид бензалкония, хинокитол, резорцин и этанол.
Примеры антиоксидантов включают токоферол, аскорбиновую кислоту, бутилгидроксианизол, дибутилгидрокситолуол, нордигидрогваяретовую кислоту и пропил галлат.
Примеры хелатирующих веществ включают эдетат натрия и цитрат натрия.
Примеры антибиотиков включают пенициллин, неомицин, цефалотин, перманганат калия, сульфид селения, эритромицин, бацитрацин, тетрациклин, хлорамфеникол, ванкомицин, нитрофурантоин, акризорцин, хлородонтион, и флуцитозин.
Некоторые из этих добавок действуют, увеличивая эффективность композиции, увеличивая стабильность или подкожную абсорбционную способность существенных компонентов по настоящему изобретению.
Кроме того, приемлема любая лекарственная форма или в растворе, эмульсии, порошковой дисперсии, или другие. Применимость является широкой, включая основные лекарственные формы, такие как лосьоны, эмульсии, кремы и гели.
В дополнение к вышеизложенным, подходящие среды для лекарства, носители и адъюванты включают воду, вазелин, жидкий парафин, минеральное масло, растительное масло, животное масло, органические и неорганические воски, полимеры, такие как ксантан, желатин, целлюлоза, коллаген, крахмал, каолин, каррагенан, аравийская камедь, синтетические полимеры, спирты, полиолы и т.п. Носитель также может включать носитель с замедленным высвобождением, такой как липосомы, микрогубки, микросферы или микрокапсулы, мази на водной основе, эмульсии вода-в-масле или масло-в-воде, гели или т.п.
Вводимая доза животному, в особенности человеку, в условиях по настоящему изобретению должна быть достаточной, чтобы получить терапевтический ответ в течение разумного интервала времени. Доза будет определяться силой конкретной используемой композиции и состоянием индивида. Размер дозы и частота применения также будет определятся существованием, природой и степенью неблагоприятных побочных эффектов, которые могут сопровождать введение конкретной композиции.
L. Терапевтические применения
В некоторых вариантах осуществления композиции клеток или экстрактов представляют собой полезную для гидратации (т.е. лечения интраваскулярной дегидратации и отека в ранах), обеспечения водонепроницаемости (т.е. компенсировать гиповолемию в ранах), защиты от инфекций (т.е. защиты раны от инфекций), защиты от окисления (т.е. предотвращения образования свободных радикалов кислорода во время воспалительных реакций ишемизированных тканей), заживления ран (т.е. увеличенный метаболизм для облегчения гипоксических состояний, особенно обожженных тканей или клеток в анаэробном метаболизме). В некоторых предпочтительных вариантах осуществления, композиции являются непахнущими (т.е. характеризуются отсутствием летучих углерод или азотсодержащих соединений).
В некоторых вариантах осуществления изобретение относится к способам использования конкретных композиций. В предпочтительных вариантах осуществления первый крем используют для ослабления и/или растворения рубцов растворяющими коллаген агентами или кислотами. Второй крем - с экстрактами или их компонентами, наряду с другими заживляющими рану веществами, как описано в настоящем изобретении. В предпочтительном варианте осуществления используют лазер, химический пилинг, бритву, кислоту, замораживание, отшелушивающие средства и/или абразив для удаления рубцов или морщин с последующим применением крема с экстрактами или их компонентами, а также другими заживляющими раны веществами, как описано в настоящем документе.
В некоторых вариантах осуществления изобретение относится к первой композиции, предпочтительно крему, который сдерживает заживление ран, уменьшает воспаление и/или уменьшает формирование рубца. Эту композицию используют в течение нескольких дней. В предпочтительных вариантах осуществления композиция содержит комбинацию одного или нескольких медленных противовоспалительных средств, антигистаминные средства, компонент или компоненты экстракта, способные ослаблять миграцию нейтрофилов и/или пролиферацию, компонент или компоненты экстракта, способные стимулировать макрофаги, фосфолипазы, арахидоновую кислоту. В еще одном варианте осуществления в композиции существует водное, липидное, белковое содержание, которое обеспечивает свойство первородной смазки. В еще одном варианте осуществления компоненты композиции уменьшают активность цитокинов фиброгенеза. Предпочтительно, первую композицию применяют в течение от приблизительно 1 до 3 дней.
В другом варианте осуществления изобретение относится ко второй композиции, предпочтительно крему, который залечивает раны стимулированием необходимых клеток. Предпочтительно эту композицию применяют к индивиду после применения первой композиции. Предпочтительно, вторую композицию применяют в течение от приблизительно 3 до 14 дней. Эта вторая композиция содержит компоненты клетки и клеточных экстрактов, которые регулируют коллагеназ, активируют плазминогеназ для лизиса сгустка, стимулируют эпителизацию (т.е. миграцию, пролиферацию, дедифференцировку, редифференцировку), активируют фибронектин и фактор роста фибробластов, стимулируют ангиогенез, уменьшают активность цитокинов фиброгенеза и регулируют гены, такие как TP53.
В другом варианте осуществления изобретение относится к третьей композиции, предпочтительно крему. Предпочтительно эту композицию применяют к индивиду после применения второй композиции. Функции этой третьей композиции - контролировать ремоделирование коллагена путем синтеза и разрушения коллагена, предпочтительно коллагеназами и металлопротеинами и предпочтительно коллагена I, и инактивировать фибронектин, гиалуроновую кислоту и гликозаминогликаны, и обезвоживание опухоли. Третью композицию предпочтительно применяют в течение от приблизительно одной до шести недель, следуя за применением первой и второй композиций. В некоторых вариантах осуществления изобретение относится к матриксу, такому как хитозановому матриксу, биоразлагаемому полимерному матриксу, коллагеновому матриксу или жидкому лейкопластырю.
В некоторых вариантах осуществления композицию клеток и/или экстракта, диспергированную в биосовместимой жидкости, нанесли на физиологически приемлемую поддерживающую структуру в жидком состоянии для формирования пленки. В настоящем документе пленка определяется как поверхность и/или разделяющая оболочка или в жидком, или твердом состоянии, с зависящими от температуры свойствами. Способы формирования пленок включают, в качестве неограничивающих примеров, распыление, формование выдавливанием, выдувание, полив, выпаривание, глазирование и окрашивание. Дисперсия представлена в качестве капель, которые сливаются, образуя пленку при встречи с подложкой.
В альтернативном варианте осуществления, предварительно сформированная пленка наносится на подложки. Физиологически приемлемые поддерживающие структуры представляет собой структуру, которая способна выдержать стерилизацию, предпочтительно стандартными способами стерилизации, известными специалисту в данной области, такими как воздействие гамма-излучением, автоклавирование, и т.д. Поддерживающая структура не ограничена конкретной композицией или конфигурацией и, в зависимости от использования, может быть или стерилизованной, или не стерилизованной и может принимать различные формы.
В другом варианте осуществления пленки используют для усиления клеточного роста кожи и могут наноситься на структуры, такие как фильтры, мембраны, бусины, частицы и т.д. Аналогично, поддерживающая структура не ограничена конкретным состоянием вещества и может быть твердой, полутвердой, гелем и т.д. В одном из вариантов осуществления подложка состоит из пронизанного нейлоновыми моноволокнами материала покрытия, такого как разделительные прокладки (Winfield Laboratories, Inc., Dallas Tex.), Biobrane II.RTM. (Sterling Drug Inc., New York, N.Y.) или круглые нейлоновые фильтры подходящей пористости (Micron Separations Inc., Westboro, Mass.). Однако для выполнения изобретения также можно использовать другие материалы подложки.
В другом варианте осуществления пленку используют для лечения или предотвращения повреждения из-за воздействия вещества или травмы и могут применять к различным материалам для внесения или прямым контактом, или непрямым контактом с подверженным воздействию участку кожи. Участок кожи может быть интактный (например, нормальная кожа) или может быть с нарушениями, определенный как кожа, которая повреждена или которая утратила по меньшей мере часть рогового слоя (например, кожа, поврежденная воздействием рассматриваемого агента, другого агента, наличием патологического состояния, такого как сыпь или контактный дерматит, физической травмой, такой как срез, рассечение или истирание, недоразвитая кожа, такая как возникает у недоношенного ребенка, условия, в которых воздействуют или на весь, или на часть эпидермиса, условия, в которых часть дермы удалили, такие как раны частичной толщины, встречающиеся при процедурах восстановления поверхности, таких как химический пилинг, абразивное удаление дефектов кожи, и восстановления поверхности лазером, и т.д.).
Поддерживающие структуры могут быть проницаемыми для физических и/или химических агентов, могут принимать многообразные формы, в зависимости от их целей и размера площади, требующей покрытия оболочкой или лечения. Пленка может распространяться на различные синтетические пленки, такие как термопластичные пленки, получаемые экструзией с раздувом пленки и воздухопроницаемые пленки, и различные природные и синтетические композиции материалов, такие как тканые, нетканые материалы, материалы фильерного производства, и сшитые ткани. Изобретение можно использовать в ряду продуктов, примеры которых включают повязки на раны и покрытия, такие как бинты, ленты, марля, клеящиеся продукты, применяемые на короткое или длительное время на коже, продукты для ухода за стромой, госпитальные прокладки, такие как прокладки для страдающих недержанием, гигроскопические прокладки, и смотровые прокладки, одноразовые и полотняные пеленки, и гигиенические продукты для женщин, такие как интралабиальные приспособления.
В некоторых вариантах осуществления изобретение относится к восстановлению функции кожи с требуемым внешним видом и предотвращению повреждения кожи. В еще одном варианте осуществления раннее формирование рубца предотвращают применением композиции для предотвращения рубца, когда образуется рана. В еще одном варианте осуществления стимулирование омоложения и регенерации перенесшей стресс и стареющей кожи предотвращает образование морщин. В еще одном варианте осуществления препарат применяют периодически, чтобы замедлить непрерывный процесс разрушения, который возникает, когда кожа стареет.
Кожа имеет два основных слоя - эпидермис и дерму. Ниже их имеется слой подкожный (под кожей жира). Внешняя поверхность кожи представляет собой эпидермис, который сам содержит несколько слоев - слой базальных клеток, шиповатый слой эпидермиса, слой гранулярных клеток и stratum corneum (роговой слой). Самый глубокий слой эпидермиса представляет собой слой базальных клеток. Здесь клетки непрерывно делятся, чтобы производить группы новых клеток кожи. Эти клетки перемещаются к поверхности кожи, вытолкнутые вверх делящимися под ними клетками. Кровеносные сосуды в дерме, которая ниже слоя базальных клеток, поставляют питательные вещества, чтобы поддержать этот активный рост новых клеток кожи. По мере того как базальные клетки двигаются вверх и дальше от питающей их крови, содержание и форма их клеток меняется. Клетки выше базального слоя становятся более нерегулярные по форме и образуют шиповатый слой эпидермиса. Над ним клетки двигаются в гранулярный слой. Будучи удаленными от кровоснабжения в дерме, клетки начинают умирать и накапливать вещество, названное кератином.
Stratum corneum ('роговой слой') представляет собой верхний слой эпидермиса - именно этот слой кожи мы видим снаружи. Здесь клетки являются плоскими и ламеллярными ('чешуевидный') по форме. Эти клетки представляют собой мертвые, содержат много кератина и расположены в перекрывающихся слоях, что придает поверхности кожи характерную твердость и водонепроницаемость. Отмершие клетки кожи постоянно отделяются от поверхности кожи. Это балансируется делением клеток в базальном слое клеток, таким образом, создавая состояние постоянного обновления. Также в слое базальных клеток существуют клетки, которые производят меланин. Меланин представляет собой пигмент, который абсорбируется в делящиеся клетки кожи, чтобы помочь защитить их от повреждения от солнечного света (ультрафиолетовый свет). Количество меланина в коже определяется наследуемым составом и воздействием на нее солнечного света. Чем больше присутствует пигмента меланин, тем темнее цвет кожи.
Ниже эпидермиса расположен слой, названный дермой. Верхний слой дермы - непосредственно под эпидермисом - имеет много выступов, названных бугорками. На отпечатках пальцев поверхность кожи следует этому узору выступов, создавая наши индивидуальные отпечатки пальцев. Дерма содержит переменное количество жира и, кроме того, волокна коллагена и эластина, что придает прочность и гибкость коже. У более пожилых людей фрагменты волокон эластина и значительная часть эластичного качества кожи утрачены. Это, наряду с потерей подкожного жира, приводит к морщинам. Кровеносные сосуды поставляют питательные вещества делящимся клеткам в базальном слое и удаляют любые продукты жизнедеятельности. Они также помогают поддерживать температуру тела расширением и переносом большего количества крови, когда тело нуждается в потере тепла со своей поверхности; они сужаются и несут меньше крови, когда тело нуждается в ограничении количества потери тепла с его поверхности. Кожа также содержит некоторое количество нервов и желез.
Общее качество кожи и внешний вид могут быть поражены рядом нарушений, включая изменение свойств в результате старения, старение кожи от воздействия ультрафиолетовых лучей, акне, расширенные поры и образование рубца. Подлинный процесс возрастного старения происходит в результате утончения эпидермиса и дермы и потери эластичности. Этот процесс влияет на все слои лица, включая подкожную ткань, мышечно-фасциальную систему, поверхностной мышечной апоневротической системы и кости лица. Результат представляет собой резорбцию кости, истощение подкожного жира, ослабление мышечно-фиброзной системы и нарушения поверхности кожи. Соединение дермы и эпидермиса выпрямляется, что приводит к потере сети гребней и более рыхлому внешнему виду эпидермы. Дерма также становится тонкой с уменьшением эластичных волокон, выработки коллагена, васкуляризации и основного вещества. Биохимические изменения в коллагене и эластине приводят к более слабой дерме, еще меньшей эластичности и упругости. В совокупности эти изменения приводят к появлению тонких морщин на коже и провисанию тканей, покрывающих лицевой череп.
В некоторых вариантах осуществления изобретение относится к композиции, включающей экстракты, которые способны стимулировать клетки кожи к спонтанной регенерации. В еще одном варианте осуществления, клетки с удлиненной теломеразой, полученные in situ из собственных клеток индивида, повторно вводят индивиду.
Много способов воздействия могут изменять поверхность кожи, чтобы улучшить качество кожи, уменьшить старческие пятна, смягчить мелкие и тонкие морщинки и лечить акне или другие шрамы. Способы воздействия включают традиционное абразивное удаление дефектов кожи, химических пилинг, лазерную шлифовку и микродермабразию. Этими способами делают попытку удалить внешние слои кожи с идеей, что стимулирование нового роста улучшит внешний вид. Исходную оценку состояния кожи обычно выполняют, используя шкалу Фитцпатрика типов кожи по фоточувствительности, которая обозначает реакцию пациентов на ультрафиолетовое излучение и существующую степень пигментации. Пациенты типа I всегда получают ожог и никогда не загорают. Пациенты типа II загорают только с трудом и обычно получают ожог. Пациенты типа III загорают, но иногда получают ожог. Пациенты типа IV редко получают ожог и легко загорают. Пациенты типа V очень легко загорают и очень редко получают ожог. Пациенты типа VI загорают очень легко и никогда не получают ожог.
Химический пилинг представляет собой химическое удаление слоев кожи, чтобы исправить дерматологические дефекты. Механизм действия вызывающих пилинг веществ относительно несложный. Обладающие большой активностью вещества, такие как фенол (с различными добавками, такими как кротоновое масло и глицерин) и трихлоруксусная кислота (TCA), вызывают химический некроз кожи на переменной глубине, зависящей от ряда контролируемых и неконтролируемых переменных. Обладающие более слабой активностью вещества изменяют pH в достаточной степени, чтобы вызвать неглубокий шок клеток и, в зависимости от многих переменных, повреждение или смерть клетки. При использовании с увлажняющим компонентом, кислота действует просто, вызывая клеточное и межклеточное набухание и вздутие, приводящее к временному увеличению размеров клетки и матрикса и уменьшению мелких складок и морщин. Последующая обработка приводит к отшелушиванию кожи и ее сглаживанию. Последующее раздражение может привести к эффектам, аналогичным лечению третионином или ретиноидами (т.е. утолщению дермы, увеличению потока крови к коже). Пилинг фенолом по "формуле Байкера" представляет собой фенол USP 88% 3 см3 49%; дистиллированная вода 2 см3 44%; 3 капли кротонового масла 2,1%; и 8 капель септисола 4,5%.
Способ микродермабразии стачивает кожу потоком кристаллов под высоким давлением. Микродермабразия представляет собой способ, наиболее эффективный в условиях небольшой глубины кожи потому, что он производит повреждения только на небольшой глубине. Условия небольшой глубины кожи включают начальные стадии старения кожи от воздействия ультрафиолетовых лучей, мелкие и тонкие морщинки и образование неглубоких рубцов. Микродермабразию завершают размещением кожи под напряжением так, что достигают эффективного вакуума. Обычно, растягивание обрабатываемой области недоминирующей рукой и использование доминирующей руки для управления насадкой представляет собой способ для достижения этого эффекта. При обработки шеи, шею помещают в удлинитель, чтобы содействовать натяжению кожи. Наконечник двигают над обрабатываемой областью одним разглаживающим проходом, который может быть повторен. Давление потока кристаллов контролируют ножной педалью. Толстая кожа, такая как кожа на лбу, подбородке и носу, может быть обработана более агрессивно (т.е. отрегулировать скорость движения насадки или число движений). При обработке тонкой кожи нижних век и верхних частей щек следует уменьшить давление. При обработке шеи все движения ориентируйте вертикально.
Восстановления поверхности кожи лазером (LSR) можно выполнить как отдельную процедуру или в качестве дополнения к таким процедурам, как неперфорирующая блефаропластика (TCB), косметическая операция на лице по удалению морщин, и эндоскопической операции по улучшению внешнего вида верхнего века. Лазер позволяет осуществлять точное управление глубиной иссечения, и он позволяет хирургу в соответствии с необходимостью изменять эту глубину. В дополнение к такой точности, LSR вызывает благоприятный нагрев дермы, который напрягает волокна коллагена и стимулирует секрецию фибробластами неоколлагена. Две длины волны лазера представляют собой предпочтительные для восстановления поверхности кожи лица: импульсные на углекислом газе и эрбий:алюминий-иттриевый гранат (Er:YAG). Каждый импульс Er:YAG удаляет только 25-30 микрометров ткани в сравнении с импульсным углекислотным, который удаляет 50-100 микрометров. Er:YAG производит меньше коллатеральной энергии в дерме, так как перенос тепла составляет приблизительно 5 микрометров; импульсного углеродного составляет 30-50 микрометров. Излучение Er:YAG лазера абсорбируется непосредственно коллагеном и белками дермы, тогда как углекислотный лазер испаряет межклеточную воду в дерме. Каждый проход Er:YAG порождает аналогичную величину абляции, тогда как импульсный углекислотный производит уменьшенную глубину испарения с каждым проходом.
Композиция по настоящему изобретению также находит применение при заживлении ран. Рана представляет собой повреждение в коже (наружный слой кожи называют эпидермисом). Раны обычно вызваны порезами или царапинами. Заживание представляет собой ответ на повреждение, который приводит в действие последовательность событий. За исключением кости, все ткани заживают с некоторым образованием рубца. Объектом соответствующей заботы является минимизация возможности инфекции и образования рубца.
Пролежневые язвы представляют собой хронические раны, вызванные непрерывным сдавливанием, которое приводит к повреждению ткани. Язвы делят на стадии от I до IV, согласно уровню наблюдаемого повреждения ткани. Пролежневая язва представляет собой наиболее обычную, среди госпитализированных пациентов, пациентов домов престарелых и пациентов с повреждениями позвоночник. Стандартный уход за пролежневыми язвами включает периодические смены одежды, снижение давления, перемещение, укрепляющие процедуры, дополнительное питание и контроль за инфекциями. Если рана становится серьезной, хирургические вмешательства включают санацию раневой полости и пластику полного кожного лоскута, мышечного лоскута или свободного пластического лоскута.
Настоящее изобретение также находит применение для лечения различных нарушений кожи. Неровности кожи, нарушение окраски и новообразования могут быть вызваны рядом факторов, включая генетические, воздействие солнца и/или использование лекарственных средств. Образование каллуса (мозоль) представляет собой утолщение кожи по причине перемежающегося давления и сил трения. Форма рук и ног является важной при образовании клавуса. В особенности, костные выступы пястнофалангового и плюснефалангового суставов часто имеют такую форму, которая вызывает трение лежащей сверху кожи. Подобно тому как происходит образование клавусов, трение с обувью способно увековечивать гиперкератоз. Деформация пальцев ног, включая контрактуры и шпоры, пальцы в форме молота и колотушки, могут участвовать в патогенезе. Шишки на ногах, т.е. келоиды над латеральной пятой плюсневой головкой, могут быть связаны с невротическими симптомами по причине сдавливания подлежащих латеральных пальцевых нервов. Кроме того, палец Мортона, где второй палец ноги больше, чем первый палец, случается у 25% популяции; это может быть одним из наиболее важных патогенных факторов в мозолях второй общей плюсневой головки, т.е. неустранимый плантарный кератоз.
Родинки (невусы) представляют собой совокупности меланоцитов, находящиеся в контакте друг с другом. Они обычно начинают формироваться в раннем детстве. Предполагают, что они образуются в ответ на воздействие солнца. Однако наследственный фактор несомненно участвует в невусах. Некоторые родственники эксперссируют аутосомальные доминантные признаки, в которых члены обладают большим числом больших невусов, иногда больше чем 150 невусов распределенных по покрову тела. Отмечено, что невусы быстро развиваются после событий, вызывающих появление волдырей, таких как термические поражения второй степени или солнечные ожоги; токсические эпидермальные некролизы; и у лиц с наследственными связанными с волдырями заболеваниями, такими как буллезный эпидермолиз. Предполагают, что факторы роста, такие как щелочной фактор роста фибробластов, высвобождают при пролиферации кератиноциты и стимулируют пролиферацию маланоцитов. Меланоцитные невусы представляют собой доброкачественные новообразования или гамартомы, состоящие чаще всего из меланоцитов, производящих пигмент клеток, которые колонизируют эпидермис. Меланоциты происходят из ганглионарной пластинка и мигрируют во время эмбриологического развития в выбранные эктодермальные участки (предпочтительно, кожа и ЦНС), но также в глаза и уши. Эктопические меланоциты идентифицировали при аутопсии в желудочно-кишечном и мочеполовом трактах. Присутствующие при рождении меланоцитарные невусы рассматривают представляющими патологию при эмбриогенезе и по существу должны быть рассмотрены как мальформация или гамартома. В отличие от этого, большинство приобретенных меланоцитарных невусов рассматривают как доброкачественные неопластические пролиферации.
Атипические родинки/диспластические невусы представляют собой приобретенные меланоцитарные поражения кожи, чьи клиническая и гистологическая характеристики все еще являются эволюционирующими. Атипические родинки отличаются от обычных приобретенных меланоцитарных невусов в нескольких отношениях, включая диаметр и отсутствие однородности пигментирования.
Родимые пятна (капиллярные гемангиомы) представляют собой одни из наиболее частых доброкачественных орбитальных опухолей в младенчестве. Они представляют собой доброкачественные эндотелиальные клеточные новообразования, которые обычно отсутствуют при рождении и характерным образом имеют быстрый рост в младенчестве со спонтанной инволюцией в дальнейшем в жизни. В отличие от других известных детских сосудистых патологий, эта патология подставляет собой врожденные сосудистые пороки. Сосудистые малформации, такие как лимфангиомы и артериовенозные малформации, присутствуют при рождении и характеризуются очень медленным ростом с сохраняем во взрослой жизни.
Стрии при растяжении кожи (растяжки) повреждают кожу, которая подверглась продолжительному и нарастающему растягиванию; увеличенная нагрузка пришлась на соединительную ткань по причине увеличенного размера различных частей тела. Это происходит на животе и груди беременных женщин, на плечах людей, занимающихся тяжелой атлетикой, подвергающихся скачку роста в юношеском возрасте, и у отдельных граждан с избыточным весом. Растяжение кожи приводит к излишней дегрануляция тучных клеток с последующим повреждение коллагена и эластина. Продолжительное использование пероральных или местных кортикостероидов или синдром Кушинга (увеличенная адренокортикальная активность) приводит к развитию борозд.
Проявление акне определяют как разрастание сальных желез волосяных луковиц. Пубертатный период вызывает эндокринное созревание придаточных элементов, приводящее к накоплению клеточных продуктов в подверженных влиянию системах. В дополнение к клеточным продуктам имеются сосуществующие микроорганизмы, обычно Propionibacterium acnes и Staphylococcus epidermidis.
Розацеа представляет собой обычное заболевание, характеризующееся симптомами стойкого покраснения лица и совокупностью клинических признаков, включающих эритему, телангиэктазию, шероховатость кожи, и воспалительным характеризующимся наличием папулопустул высыпанием походящим на акне. Розацеа определяют как стойкое покраснение кожи центральной части лица в течение по меньшей мере 3 месяцев. Подтверждающие критерии включают покраснение, уплотненные участки кожи, прыщи и телангиэктазии на выпуклых поверхностях. Вторичные характеристики представляют собой жжение и острую боль, отек, пятна сыпи, сухость, офтальмологические проявления и опухание. Периоральный дерматит (POD) представляет собой хронический, характеризующийся наличием папулопустул лицевой дерматит. Он чаще всего возникает у молодых женщин. Клинические и гистологические отличия повреждений подобны повреждениям при розацеа.
Бородавки представляют собой доброкачественные разрастания кожи и слизистых, вызванные вирусом папилломы человека (HPV). В настоящее время идентифицировано более чем 100 типов HPV. Некоторые типы HPV проявляют тенденцию к появлению в конкретных участках тела; однако бородавки каждого типа HPV могут возникать в любом месте. Первичное клиническое проявление инфекции HPV включает обычные бородавки, генитальные бородавки, плоские бородавки и глубокие ладонно-подошвенные бородавки (myrmecia). Менее обычные проявления инфекции HPV включают очаговую эпителиальную гиперплазию (болезнь Хека), верруциформную эпидермодисплазию и подошвенные пузыри. Бородавки передают прямым или непрямым контактом, и предрасполагающие факторы включают нарушения нормального эпителиального барьера. Лечение может быть затруднительным, с частыми неудачами и рецидивами.
Генитальные бородавки представляют собой результат инфекции папилломавирусом человека (HPV), приобретенный внедрением вируса в эпидермис через дефекты в эпителии (т.е. мацирации кожи). Аутоинокуляция вируса в противостоящие повреждения является обычной. Развертывание инфекции HPV происходит обычно непосредственно через ассоциированный с кожей вирус, а не путем переносимой кровью инфекции.
Бовеноидный папулез (BP) возникает на гениталиях обоих полов у сексуально активных людей. BP проявляется в виде папул, которые индуцированы путем вирусной инфекции папилломавирусом человека (HPV) и демонстрирует отличающуюся гистопатологию (бовеноидная дисплазия).
Псориаз характеризуется чрезвычайно быстрым обновлением кожи и появляется в качестве хронического, двусторонне симметричного, эритематозного, подобного сыпи повреждения с серебристым чешуйчатым покрытием. Повреждения классически локализованные на разгибательных поверхностях, включая локтевую область, колени, спину и кожу черепа. Также могут возникать конфлюэнтные генерализованные повреждения.
При болезни Фон Реклингхаузена на теле возникают множественные невральные опухоли. Проявляются множественные пигментные поражения кожи. Преобладают пятна классического цвета кофе с молоком. Дополнительно, обычными являются пигментированные гамартомы радужной оболочки (т.е. Lisch nodules). Могут быть идентифицированы костные и внутричерепные повреждения и повреждения и симптомы ЖКТ.
Necrobiosis lipoidica diabeticorum представляет собой подобные сыпи, вдавленные, атрофические желтые повреждения, обычно обнаруживаемые у пациентов с диабетом. Он сильно связан с диабетом и действительно может быть клиническим предвестником появления заболевания всего организма. Его редко находят в местах, отличных от нижних конечностей, и редко обнаруживают в отсутствие диабета. Повреждение имеет тенденцию прогрессировать от красной, подобной сыпи области до области с атрофией, которая изредка может образовывать язвы.
Себорейный дерматит представляет собой папулезно-чашуйчатое нарушение, создающее характерный узор на богатых жиром областях кожи головы, лица, и туловища. В дополнение к кожному салу, этот дерматит связан с Malassezia, иммунологическими нарушениями, и активацией комплимента.
Себорейный кератоз (также известный как себорейная бородавка, старческая бородавка, и базально-клеточная папиллома) представляет собой обычную доброкачественную опухоль у лиц средних лет и пожилого возраста. Это обычно индуцированное папулезное повреждение непостоянного цвета от светло до темно коричневого. Себорейный кератоз может быть гладкий или морщинистый с видимым образованием оспин. Обычные места включают лицо, тело и конечности. Повреждение также может иметь ножку или не иметь ножку. Вариант, известный как черный себорейный кератоз (DPN), встречается в районах лба и скул индивидуумов с черной кожей.
Акрохордоны (также известные, как мягкая бородавка, фиброэпителиальный полип, мягкая фиброма и фиброэпителиальная папиллома) иногда связывают с беременностью, сахарным диабетом и синдромами интестинального полипоза. Они имеют тенденцию локализоваться в опрелых областях подмышечной впадины, паха и передней и нижней областях груди, а также нижней шейной области вдоль линии воротника. Они представляют собой мягкие мясистые бугорки и обычно, хотя не обязательно, имеют ножку.
Актинический кератоз представляет собой наиболее распространенное связанное с солнцем новообразование. Актинические кератозы главным образом обнаруживают на подверженных воздействию солнца областях лица, ушей, предплечий и тыльной поверхности рук. Однако они могут возникать в любых областях, которые постоянно или многократно подвергались воздействию солнца, такие как спина, грудь и ноги. Они обычно возникают как множественные раздельные, плоские или возвышающиеся, напоминающие бородавку, кератозные бородавки. Повреждения обычно обладают эритематозной основой, покрытой чешуей (гиперкератоз). Они обычно имеют 3-10 мм в диаметре и постепенно увеличиваются в ширину в более широкие, более приподнятые повреждения. Со временем актинические кератозы могут развиваться в инвазивные роговые кератомы или раки кожи. Гистологические, эпидермальные изменения характеризуют акантоз, паракератоз и дискератоз. Присутствует клеточная атипия, и кератиноциты варьируются по размеру и форме. Фигуры митоза являются общепринятыми.
Болезнь Боуэна также известна как карцинома in situ и сквамозная интраэпителиальная неоплазия. Повреждения включают преимущественно кожу, не подверженную воздействию солнца (т.е. защищенную). Классически, Болезнь Боуэна включает гениталии. Зуд представляет собой обычную жалобу. При вовлеченности в процесс женских наружных половых органов, большие половые губы обладают тенденцией быть больше вовлеченными в процесс, чем малые половые губы. Повреждения представляют собой чешуйчатые, покрытые коркой, эритематозные пятна.
Псевдокарциноматозная гиперплазия представляет собой повреждения, вызванные восстановительным процессом характеризующимся языками сквамозного эпителия, растущего книзу в дерму.
Невус сальных желез Ядассона представляет собой гамартоматозное повреждение выделяющих элементов жировой и апокринной желез, нарушенные волосяные фолликулы, акантоз и папилломатоз. Именно присутствующие при рождении повреждения обычно присутствуют на коже головы и лице. Повреждения имеют тенденцию увеличиваться со временем.
Красная волчанка (LE) представляет собой заболевание разнородной соединительной ткани, связанное с активацией поликлональных B-клеток.
Аденома сальных желез представляет собой узловатое и дольчатое повреждение с периферическими производящими клетками и переменной жировой дифференцировкой при приближению к центру повреждения. Она образована не так как узоры гиперплазии сальных желез. Это повреждение является отличным от гамартоматозного разнообразия встречаемого на лицах пациентов с синдромом туберозного склероза.
Инвертированный фолликулярный кератоз, как полагают, является воспалительным вариантом себорейного кератоза. Его обычно обнаруживают на лице и подверженных действию солнца областях пожилых пациентов. Обычно, это повреждение локализовано на верхнем веке. Анатомически оно представляет обратный или эндофитный процесс в эпителии сальных волосяных фолликул. Повреждения имеют тенденцию быть единственными и присутствуют как папула или узелок.
Трихоэпителиома представляет собой редкое доброкачественное повреждение. Оно, как правило, бывает от розового до телесного цвета. Оно часто является множественным и не является язвенным. Эти повреждения имеют тенденцию рекапитулировать волосяные фолликулы. Первоначально они появляются во время пубертатного периода. Обычно области этого повреждения охватывают лицо и кожу головы, в меньшей степени тело и шею.
Атерома представляет собой доброкачественную опухоль с особенностями шаровидных богатых гликогеном клеток. Иногда, грубо идентифицируют кератинизацию в очаге.
Сальный моллюск представляет собой самоизлечивающуюся опухоль кожи. Повреждение представляет собой классический куполообразный бугор с центральной воронкой кератина.
Базально-клеточная карцинома представляет собой эпителиальную злокачественную опухоль, которая возникает как бессимптомно развивающиеся, безболезненные, неизлечимые язвы или узелки на подверженных воздействию солнца частях тела. Самая распространенная локализация на голове представляет собой нос, особенно кончик и крылья носа. Риск связан с типом кожи и степенью подверженности воздействию солнечного света, особенно УФ-B излучения. Опухоли наиболее часты у индивидов с белым цветом лица.
Большинство эпидермоидных раков появляются на подверженных действию солнца участках тела. Плоскоклеточная карцинома (SCC) возникает из злокачественной трансформации и пролиферации кератиноцитов в эпидермисе. SCC могут возникать из актинических кератозов, лейкоплакии, радиационных кератозов или дерматитов, рубцов, хронических язв, или хронических синуситов. Люди с актиническим кератозом имеют атипические сквамозные клетки в от трети до половины эпидермиса. Люди с болезнью Боуэна, или SCC in situ, имеют нетипичные кератиноциты во всем эпидермисе. Инвазивные SCC заключают эпидермис и вторгаются в дрему. Опухоли изначально возникают как бляшки на кожа, пятна и узелки, которые увеличиваются и развивают центральные участки воспаления, уплотнение, и, впоследствии, некроз и выделения. SCC метастазирует прямым, лимфатическим и гематогенным распространением.
Меланома представляет собой опухоль, которая развивается как результат злокачественной трансформации меланоцитов. Эти клетки происходят из нервного гребешка. Меланомы обычно встречаются на коже, но могут возникать в других местах, куда мигрируют клетки нервного гребешка, такие как желудочно-кишечный тракт или мозг.
Предусматривается, что композиции по настоящему изобретению находят применение в лечении всех вышеупомянутых патологических состояний и нарушений кожи.
Композиции по настоящему изобретению также находят применение в лечении ожогов. Солнечные ожоги представляют собой острые кожные воспалительные реакции, которые следуют за чрезмерным подверганием кожи ультрафиолетовой радиации (УФ). Воздействие солнечной радиации оказывает положительное воздействие на стимулирование синтеза витамина D в коже и обеспечения лучевого тепла. К сожалению, когда кожа подвергается чрезмерному облучению в ультрафиолетовом диапазоне (длина волны <400 нм), могут возникать вредные воздействия. Самый распространенный представляет собой острый солнечный ожег или солнечную эритему. Глаза, в особенности роговая оболочка (окошко прозрачной ткани в передней части глазного яблока), могут быть легко повреждены воздействием ультрафиолетового излучения от солнца и от других источников ультрафиолетового света, таких как дуга сварочного аппарата, прожектор заливающего света фотографа, лампа солнечного света, или даже настольная галогенная лампа.
Сильные ожоги приводят к разрушению кожного барьера, что может привести к потерям жидкости и электролита и к инфекции в коже, которая приводит к генерализованной инфекции. Ожоги делят по степени повреждения ткани. Ожоги первой степени включают повреждение верхнего слоя кожи (эпидермиса), и ожоги второй степени включают эпидермис и подлежащий слой кожи (дерма). Ожоги первой и второй степени также можно назвать ожогами частичного слоя. Ожоги третьей степени поражают эпидермис, дерму и гиподерму, вызывая обугливание кожи или прозрачного белого цвета, с коагулированными сосудами, видимыми сразу под поверхностью кожи. Их также называют ожогами полной толщины.
Лечение пациентов с сильными ожогами включает начальную очистку и удаление омертвевших частей раны, внутривенные (IV) жидкости, содержащие электролиты, общие антибиотики, местные антибиотики, дополнительное питание и лекарственные средства для контроля боли. Пересадка кожи, как правило, кожей, взятой с донорных участков у пациента, может потребоваться для достижения закрытия раневой поверхности. При больших ожогах аутогенный трансплантат кожи может быть недоступен в достаточных количествах для полного закрытия раны. В этом случае, растянутые аутогенные трансплантаты применяют к ране, и трупный аллотрансплантат используют в таком случае, чтобы закрыть рану полностью. Донорные участки трансплантации кожи представляют собой хирургически созданные раны, которые требуют того же уровня ухода, как и другие открытые раны.
Композиции по настоящему изобретению также нашли применение в лечении различных типов внутренних ран. Раны на внутренних тканях могут быть результатом хирургического повреждения, такого как повреждения, образованные удалением раковой ткани или коррекцией заячьей губы и/или неба. Раны могут сформироваться на мембранах рта, носа и пищеварительной системы.
Заячья губа или небо влияет на очевидные формы лица, как анатомическая уродливость, и имеет функциональные последствия, оказывающий влияние на способность ребенка есть, говорить, слышать и дышать. Особенно у детей, рожденных с двухсторонней трещиной, хирург изначально встречается с выступающей межчелюстной костью и трудностью достижения достаточной колюмеллярной длины и вертикальной высоты губ во время реконструкции. Несмотря на то что хирургия билатеральной заячьей губы претерпела много недавних улучшений, коррекция назального уродства, связанного с этим врожденным пороком, остается одним из самых больших вызовов в пластической хирургии. Хирургическая коррекция назальных дефектов, связанных с духсторонней заячьей губой, является затруднительной, потому что дефекты могут становиться явными по мере того, как нос подвергается дальнейшему росту и развитию.
Удаление раковой опухоли из челюстной кости часто создает брешь в кости, которая ранит окружающие ткани. Дистракционный остеогенез представляет собой способ, в котором кость может быть удлинена путем de novo формирования кости, как части нормального процесса заживления, который происходит между хирургически разделенными сегментами кости, которая подлежит управляемому вытягиванию.
Небно-глоточная (VP) дисфункция включает любое структурное и/или нервно-мышечное нарушение мягкого неба и/или фарингеальных стенок на уровне носоглотки, в которой возникает нарушение нормального сфинктерного закрытия. VP дисфункция может происходить из анатомического, нервно-мышечного, поведенческого или сочетания нарушений.
Многоформная эритема (EM) представляет собой острую реакцию кожно-слизистой гиперчувствительности переменной тяжести, характеризуемой симметрично расположенными высыпаниями на коже, с или без повреждения мукозной мембраны. Более распространенная мягкая форма, EM минор, состоит из кожных повреждений с включением не более чем одной слизистой поверхности. Симметрично расположенные, эритематозные, расширяющиеся пятна или узелки развиваются в классических ранах радужной оболочки или мишени, с ярко красными краями и центральным точечным кровоизлиянием, пузырями или гемморагической сыпью. Мажорная EM, или синдром Стивенса-Джонсона, представляет собой более тяжелую форму, включающую две или больше мембран слизистой оболочки с более разнородным поражением. Оно может включать внутренние органы и обычно связано с системными симптомами. Результаты обследования кожи могут быть аналогичны минорной EM, но часто являются более изменчивыми и тяжелыми. Типичны воспалительные везикулобуллезные поражения, часто с кровотечением и некрозом.
Ринит определен как воспаление оболочек носа и охарактеризован симптомокомплексом, состоящим из любой комбинации следующего: чихание, заложенность носа, зуд в носу и ринорея. Глаза, уши, пазухи и горло также могут быть поражены. Аллергический ринит представляет собой наиболее распространенную причину ринита.
Болезнь Крона представляет собой идиопатический, хронический, трансмуральный воспалительный процесс в пищеварительном тракте, который может поражать любую часть ЖКТ ото рта до ануса. Состояние, как полагают, является результатом дисбаланса между провоспалительными и противовоспалительными медиаторами. Большинство случаев включает тонкую кишку, в частности границу подвздошной кишки. Характерные проявления болезни Крона представляют собой боль в животе и диарею, которые могут быть осложнены свищами в ЖКТ, обтурацией, или и тем и другими. Первичное поражение начинается в качестве очага воспаленного инфильтрата около полостей, с последующим образованием язвы поверхностной слизистой оболочки. Позже, клетки воспалительного инфильтрата вторгаются в глубокие слои и в этом процессе начинают организовываться в неказиозные гранулемы. Гранулемы распространяются через все слои кишечной стенки и в мезентерий и региональные лимфатические узлы. Хотя образование гранулем является характерным для болезни Крона, отсутствие не исключат диагноза. Первичное расстройство представляет собой гиперемию и отек пораженной слизистой оболочки. Далее, образуются отдельные поверхностные язвы, которые становятся глубокими серпигинозными язвами, расположенными поперек и вдоль через воспаленную слизистую оболочки, придавая слизистой оболочке вид булыжника. Поражения часто являются сегментальными, будучи разделенными здоровыми областями. Мальабсорбция возникает как результат потери функциональной слизистой абсорбирующей поверхности. Это явление может приводить к белково-калорийной недостаточности, обезвоживанию и белково-энергетической недостаточности. Поражение границы подвздошной кишки может приводить к мальабсорбции желчных кислот, которая приводит к стеатореи, дефициту жирорастворимых витаминов и образованию желчного камня. Нарушенная захватом кальция абсорбции жира может приводить к увеличенному выделению оксалата (в норме образующего комплекс с кальцием), вызывая образование почечного камня.
Гастрит включает бесчисленные нарушения, которые предусматривают воспалительные изменения в слизистой желудка, включая язвенный гастрит, вызванный токсическим раздражением, рефлюксный гастрит из-за воздействия желчи и поджелудочной жидкости, геморрагический гастрит, инфекционный гастрит, и атрофию слизистой желудка. Язвенная болезнь (PUD) относится к отдельным дефектам слизистой части желудочно-кишечного тракта (желудочной или дуоденальной), подверженной действию выделяемых кислот и пепсина. Язвенный гастрит обычно является связанным с тяжелой болезнью или с разнообразными лекарственными средствами. Стресс, этанол, избыток желчи и нестероидные противовоспалительные лекарственные средства (НПВП) разрушают слизистый барьер желудка, делая его уязвимым для обычных желудочных секреций. Инфекция Helicobacter pylori, короткой, спиралеобразной, микроаэрофильной грамотрицательной палочковидной бактерией, представляет собой основную причину PUD и связана практически со всеми язвами, индуцированными не НПВП.
Герпес в области рта представляет собой инфекцию, вызванную вирусом простого герпеса. Вирус вызывает болезненные открытые поражения кожи на ваших губах, деснах, языке, небе вашего рта и внутри ваших щек. Он также может вызывать симптомы, такие как лихорадка и мышечные боли.
Композиции по настоящему изобретению дополнительно полезны в усилении различных фаз заживления. Существуют различные фазы заживления. Фаза воспаления начинается с повреждения как такового. Фазу воспаления характеризуют гемостаз и воспаление. Здесь у вас есть кровотечение, непосредственное сужение кровеносных сосудов, формирование сгустка и высвобождение различных химических веществ в рану, которая начнет заживление. Специализированные клетки очищают рану от инородных остатков в течение нескольких дней болезни. Коллаген, подвергнутый воздействию при образовании раны, приводит в действие каскад коагуляции (оба, внутренний и внешний пути), инициируя фазу воспаления. После того как произошло причинение вреда ткани, клеточные мембраны, поврежденные при образовании раны, высвобождают тромбоксан A2 и простагландин 2-альфа, мощные вазоконстрикторы. Этот начальный ответ помогает ограничить кровотечение. После короткого периода происходит капиллярная вазодилатация, вторичная по отношению к локальному выбросу гистамина, и клетки воспаления являются способными мигрировать на поверхность раны.
Тромбоциты, клетки первого ответа, высвобождают множественные хемокины, включая эпидермальный фактор роста (EGF), фибронектин, фибриноген, гистамин, фактор роста тромбоцитарного происхождения (PDGF), серотонин, и фактор фон Виллебранда. Эти факторы помогают стабилизировать рану путем формирования сгустка. Эти медиаторы действуют, чтобы управлять кровотечением и ограничивать размер раны. Дегрануляция тромбоцитов также активирует каскад комплемента, конкретно C5a, который представляет собой мощный хемоаттрактант для нейтрофилов. Воспалительная фаза продолжается, и дополнительное количество клеток иммунного ответа мигрирует к ране. Вторая клетка ответа для миграции в рану, нейтрофил, является ответственной за удаление инородных веществ, опосредованную комплиментом опсонизацию бактерий, разрушение бактерий посредством механизма окислительного взрыва (т.е. образование супероксида и перекиси водорода). Нейтрофилы убивают бактерии и обеззараживают рану от инородных частиц. Следующие клетки, присутствующие в ране представляют собой лейкоциты и макрофаги (моноциты). Макрофаг, обозначаемый как организатор, является необходимым для заживления ран. Многочисленные ферменты и цитокины секретируются макрофагом. Они включают коллагеназы, которые удаляют омертвевшие части раны; интерлейкины и фактор некроза опухоли (TNF), которые стимулируют фибробласты (продуцируют коллаген) и активируют ангиогенез; и трансформирующий фактор роста (TGF), который стимулирует кератиноциты. Этот шаг отмечает переход в процесс реконструкции ткани, т.е. пролиферативную фазу.
В пролиферативной фазе формируется матрикс или решетчатая конструкция клеток. На этом матриксе будут формироваться новые клетки кожи и кровеносные сосуды. Именно новые малые кровеносные сосуды (известные как капилляры) дают заживающей ране ее розовый или пурпурно-красный внешний вид. Эти новые кровеносные сосуды будут снабжать восстанавливаемые клетки кислородом и питательными веществами для поддержания роста новых клеток и поддержания продуцирования белков (в первую очередь коллагена). Коллаген действует как остов, на котором строятся новые ткани. Коллаген представляет собой главное вещество в конечном рубце.
Эпителизацию, ангиогенез, формирование грануляционной ткани и накопление коллаген включают в анаболическую часть пролиферативной фазы заживления ран. Эпителизация возникает в начале восстановления раны. Если базальная мембрана остается неповрежденной, эпителиальные клетки мигрируют вверх обычным образом. Это эквивалент ожога кожи первой степени. Эпителиальные клетки-предшественники ниже раны остаются неповрежденными, и обычные слои эпидермиса восстанавливают в 2-3 дня. Если базальная мембрана была разрушена, аналогично ожогу второй или третьей степени, тогда рана реэпитализируется из нормальных клеток на периферии и, если неповрежденные, из дополнений кожи (т.е. волосяных фолликулов, потовых желез).
Ангиогенез, стимулированный TNF-альфа, характерен эндотелиальной клеточной миграцией и капиллярным формированием. Новые капилляры доставляют питательные вещества ране и помогают поддерживать поверхность грануляционной ткани. Миграция капилляров в поверхность раны является решающей для должного заживления ран. Грануляционная фаза и накопление ткани требуют питательных веществ, поставляемых капиллярами, и в случае провала приводят к хронически незаживающей ране. Способы модификации ангиогенеза изучаются и имеют значительный потенциал для улучшения процесса заживления.
Во время формирования грануляционной ткани фибробласты дифференцируются и производят основное вещество и затем коллаген. Основное вещество накапливают на поверхности раны; затем накапливается коллаген по мере того, как рана претерпевает финальную фазу восстановления. Множество различных цитокинов включено в пролиферационную фазу восстановления раны. Этапы и точный механизм контроля как следует не изучены. Некоторые из цитокинов включают PDGF, инсулинподобный фактор роста (IGF) и EGF.
Во время стадии ремоделирования, несущая конструкция (коллаген) становится более упорядоченной, делая ткань более прочной. Плотность кровеносных сосудов становится меньше, и рана начинает терять розовый цвет. В течение 6 месяцев болезни, область увеличивает прочность, в конечном счете достигая 70% прочности неповрежденной кожи. В фазе развития, рана испытывает сжатие, в конечном итоге приводя к меньшему количеству видимой ткани рубца. Весь процесс является активным и непрерывным с перекрыванием каждой фазы и непрерывным ремоделированием. Рана достигает максимальной прочности в течение одного года, с прочностью при растяжении, которая составляет 30% от нормальной кожи. Накопление коллагена продолжается в течение длительного периода, но результирующее увеличение накопления коллагена стабилизируется через 21 день.
Эпителизация представляет собой процесс укладывания новых кожных, или эпителиальных, клеток. Кожа образует защитный барьер между окружающей средой и телом. Ее первичное назначение состоит в защите от чрезмерной потери воды и от бактерий. Восстановление этого слоя начинается в пределах нескольких часов от повреждения и завершается в пределах 24-48 часов в чистой, зашитой (прикрытой) ране. Открытые раны могут потребовать 7-10 дней, потому что воспалительный процесс является продолжительным, что благоприятствует образованию рубца. Образование рубца происходит, когда повреждение простирается за пределы глубинного слоя кожи (в дермис).
3 категории закрытия раны представляют собой первичную, вторичную, и третичную. Первичное лечение включает закрытие раны в течение часов от ее образования. Вторичное лечение не включает формального закрытия раны, рана закрывается спонтанно стягиванием и реэпителизацией. Третичное закрытие раны также известно как отложенное первичное закрытие и включает начальную санацию полости раны в течение продолженного периода и затем формальное закрытие с накладыванием швов или другим способом.
Композиция по настоящему изобретению дополнительно нашла применение для лечения рубцов, отдельно или в сочетании с известными способами лечения рубца. Открытые раны могут приводить к ряду осложнений, включая заражение раны и уродующие рубцы, включая келоиды, увеличенные рубцы и гипертрофированные рубцы. И келоиды, и гипертрофированные рубцы представляют собой раны, которые заживают чрезмерно выше поверхности кожи. Различие между келоидом и гипертрофированным рубцом состоит в том, что келоид продолжает увеличиваться за пределы исходного размера и формы раны, тогда как гипертрофированный рубец увеличивается в пределах границ исходной раны. Хотя оба могут быть красными и возвышающимися, келоиды продолжают расти и гипертрофированные рубцы имеют тенденцию к регрессии с течением времени. Оба могут рецидивировать после хирургического удаления, однако рецидив келоидного рубца является более обычным. Расширенные рубцы представляют собой раны, которые отделились во время процесса заживления, обычно в ответ на напряжение, перпендикулярное краям раны. Гипертрофированные рубцы являются более обычными, чем келоиды. Гипертрофированные рубцы могут возникать у лиц любого возраста или в любом месте, и они имеют тенденцию спонтанно регрессировать. В основном, гипертрофированные рубцы являются более отзывчивыми на лечение. Тогда как келоиды возникают часто у лиц с черной кожей, они могут возникать у лиц любой расы с доказанной тенденцией к формированию келоида. Келоиды более распространены у лиц в возрасте 10-30 лет, тогда как гипертрофированные рубцы встречаются у лиц любого возраста.
Какие факторы инициируют образование келоида или гипертрофированного рубца не является изученным достаточным образом. Несколько генетических и относящихся к окружающей среде причин подразумеваются в этиологии келоида и гипертрофированных рубцов. В формировании и келоида, и гипертрофированного рубца чрезмерное накопление коллагена происходит из возросшего синтеза коллагена или уменьшенной деградации коллагена. Предложенные причины формирования патологического рубца включают реакцию на чужеродное тело и бактериальные инфекции. Многие патологические рубцы связаны с татуировками, ожогами, инъекциями, укусами, вакцинациями, травмами, хирургическими операциями или инфекциями. Натяжение кожи часто является вовлеченным в формирование гипертрофированного рубца. Заживление ненормального рубца обычно включает области высокого напряжения кожи, такие как передняя часть грудной клетки, плечи и верхняя часть спины. Другие факторы предполагаемые в этиологии формирования ненормального рубца включают раневую инфекцию или гипоксию, продленный воспалительный ответ, и ориентацию раны, отличную от линий напряжения расслабленной кожи. Формирование келоида имеет генетическую основу, как показано предрасположенностью к нему для лиц некоторых рас и некоторых семей. Так как келоиды имеют тенденцию демонстрировать ускорение роста во время полового созревания или беременности и тенденцию рассасываться с менопаузой, гормоны (оба и андроген, и эстроген) были вовлечены в формирование келоида. Другие гормоны, связанные с формированием келоида, включают изменение тиреоидного гормона и меланоцитостимулирующих гормонов. Иммунологические изменения замешаны в ненормальных рубцах. Конкретно, иррегулярный иммуноглобулин и уровни комплемента, возросший трансформирующий фактор роста-бета и тучные клетки обнаружены в ненормальных рубцах. Дополнительно, пониженные уровни фактора некроза опухоли и интерлейкина 1 обнаружены в этих ненормальных рубцах. Расширенные рубцы являются результатом излишнего напряжения, перпендикулярного краям раны во время заживления. Расширение рубца обычно происходит в течение первых 6 месяцев от повреждения.
Хотя множественные факторы вовлечены в формирование ненормального рубца, исследования показывают, что келоидные и гипертрофированные рубцы происходят из увеличенного производства коллагена и пониженной деградации коллагена. Уровни коллагенсвязанного фермента пролилгидроксилазы являются повышенными в поврежденной келоидом коже по сравнению с нормальной кожей. Пролилгидроксилаза требуется для гидроксилирования пролина во время синтеза коллагена, предполагая, что перепроизводство коллагена происходит при келоидах.
Производство коллагена является повышенным в образцах биопсии келоида и в культурированных фибробластах, происходящих из келоидов. Увеличенное производство коллагена культурированными фибробластами, происходящими из келоидов, сохраняется на всем протяжении промежутка их жизни in vitro; они не возвращались к норме после переноса повреждения к культуре. Когда келоидную дерму сравнивали с нормальной дермой, значительных различий в содержании ДНК или насыщенности клетками найдено не было. Это предполагает, что каждый фибробласт производит больше коллагена, а не происходит увеличение числа фибробластов, продуцирующих нормальное количество коллагена. В формировании келоида чрезмерное производство коллагена фибробластами происходит из-за окружающей среды раны.
Формирование расширенного рубца, как полагают, происходит из отделения края раны с напряжением, перпендикулярным ране залечиваемой кожи. Состояние напряжения естественным образом существует в коже; раненная кожа широко раскрывается и становится эллиптической вместо того, чтобы быть круглой. Когда рана закрывается против линий напряжения, вероятность формирования расширенного рубца повышена.
На основании клинического исследования, келоидные и гипертрофированные рубцы подняты над уровнем кожи. Гипертрофированные рубцы самоограниченные; они гипертрофированы в пределах, ограниченных раной. Первоначально, гипертрофированные рубцы могут быть приподнятыми, красными, зудящими и даже болезненными; однако с течением времени они становятся белесыми и плоскими. Гипертрофированные рубцы появляются в худшем случает через от 2 недель до 2 месяцев. Келоидные рубцы можно отличать от гипертрофированных рубцов по их распространению за пределы исходной раны. Келоидные рубцы имеют тенденцию оставаться красными, зудящими и причиняющими боль в течение от многих месяцев до лет до менопаузы. Пациенты обычно имеют личную или семейную историю келоидного формирования. Отличные от гипертрофированных и келоидных рубцов расширенные рубцы являются плоскими и иногда вдавленными. При адекватном развитии раны, эти раны блекнут до пигментации окружающей неповрежденной кожи. Расширенные рубцы обычно не являются красными или зудящими.
Линии напряжения расслабленной кожи следуют по бороздам, образующимся, когда кожа расслабленна. В отличие от морщин, они представляют собой невидимые черты кожи. Они легко получаются из полос, созданных щипанием кожи. Эти борозды получают предпочтительно щипанием перпендикулярно линиям. Когда кожа сдавлена под углом к линиям напряжения расслабленной кожи, образуется S-образный узор. Меньше при этом более высоких борозд создают, если кожу щипают параллельно линиям. Закрытие рассечений против линий напряжения расслабленной кожи может увеличить риск формирования расширенных или гипертрофированных рубцов.
Потенциальное относительное противопоказание хирургической коррекции рубца, когда рубец представляет собой келоид, существует из-за риска ухудшения рубца. Иногда, когда келоиды рецидивируют, они становятся больше, чем исходные. Расширенные рубцы можно легко отличить от гипертрофических и келоидных рубцов на основе результатов соматических исследований. Расширенные рубцы являются плоскими и иногда даже вдавленными. Гипертрофические рубцы и келоиды являются неразличимыми под световым микроскопом. Однако существует ряд различий при наблюдении под электронным микроскопом и при иммунохимических сравнениях. Келоиды содержат толстые волокна коллагена с увеличенным эпидермальным гиалуроновым содержимым, тогда как гипертрофические рубцы проявляют узловатые структуры с тонкими волокнами коллагена и возросшими уровнями гладкомышечного альфа-актина. Коллаген и в келоидах, и в гипертрофических рубцах организован в обособленные узелки, часто облитерирующие сосочкообразные выросты в папиллярном слое дермы очагов повреждений. Тогда как коллаген в нормальной дерме расположен в обособленных пучках, разделенных значительным промежуточным пространством, узелки коллагена в келоидах и в гипертрофических рубцах являются безсосудистыми и однонаправленными и расположены в сильно напряженной конфигурации.
Различные нехирургические способы лечат патологические рубцы. Давление, как думают, уменьшает метаболизм в ткани и увеличивает распад коллагена в пределах раны. Различные способы оказания давления включают использование эластичных повязок (эластичный бинт), чулки при тромбоэмболической болезни, или изотонные перчатки на конечностях. Альтернативно, можно использовать специально подогнанные компрессионные предметы одежды, чтобы оказывать давление в более трудных областях, включая шею и торс. Так как эти приспособления являются неудобными, изменяется соблюдение пациентом схемы лечения. К сожалению, для оптимальных результатов, эти приспособления должны использоваться в течение 6-12 месяцев во время старения раны.
Чтобы лечить ненормальные рубцы можно использовать силиконовый гель. Силиконовый гель показал значительное уменьшение объема рубца в течение времени использования, в частности, для формирования гипертрофического рубца. Действие силиконового геля на рубец, как полагают, происходит благодаря гидратации раны. Силиконовый гель применяют к ране в течение по меньшей мере 12 ч/д. Пациенты находят более привлекательным применять силикон к их ранам ночью. Силиконовый гель получает популярность потому, что его можно применять к меньшим областям в течение 12 ч/д, обычно ночью. Однако повреждения кожи, сыпь и трудности с плотным прилеганием к ране могут привести к отказу от использования.
Инъекции стероидов стали обычным нехирургическим вариантом в лечении проблемных рубцов. Стероид, использованный для инъекций внутрь пораженных тканей, представляет собой триамцинолон (Кеналог).
Инъекции триамцинолона были стандартным лечением, чтобы стимулировать выравнивание, выцветание и уменьшенную совокупность симптомов гипертрофического рубца. Эти инъекции могут быть введены, как только идентифицирована проблема рубца. Доза инъекции может меняться от 10 до 120 мг, в зависимости от размера рубца.
Можно использовать инъекцию триамцинолона для тонких и широких гипертрофических рубцов и силикон для очень широких гипертрофических рубцов. Некоторые пациенты предпочитают инъекции триамцинолона, чтобы избежать применения и ношения силикона каждый день в течение 6-9 месяцев, особенно на участках тела, где сцепление недостаточно. Неблагоприятные воздействия инъекций триамцинолона включают гипопигментацию и подкожную атрофию. Другие нехирургические варианты включают кортикостероиды, вводимые внутрь пораженных тканей кортикостероидные инъекции, терапия витамином Ε, терапия оксидом цинка, средства против новообразований, и иммунотерапия.
Если консервативные меры являются недостаточными в лечении патологического шрама, можно рассмотреть оперативное вмешательство. Является важным такое закрытие раны, чтобы ориентировать рану вдоль линий напряжения расслабленной кожи. Стандартная практика, часто используемая скорее подсознательно после иссечения повреждения, включает оценку направления наименьшего напряжения, основанную на конфигурации краев раны или зажиманием раны.
Процедура первой линии, используемая для исправления шрама, представляет собой веретенообразное иссечение. В основном, веретенообразное иссечение не требует растяжения рубца. Во избежание собачьих ушей обеспечьте, чтобы рана имела отношение длины к ширине, как 4:1. Веретенообразное иссечение представляет собой предпочтительное для коротких ран, ориентированных вдоль линий напряжения расслабленной кожи. Способ лоскута Милларда является аналогичным веретенообразному иссечению, но он включает сохранение рубца и его соединения с подлежащим жиром. Кожу рассекают веретенообразным образом вокруг рубца до подкожного слоя. Затем рубец деэпителизируют, и края кожи сводят вместе над деэпителизированным рубцом. Способ лоскута Милларда представляет собой предпочтительный для расширенных, вдавленных рубцов.
Рубцы, не ориентированные вдоль линий напряжения расслабленной кожи, могут быть модифицированы способом Z-пластики. Для Z-пластики создают детали равной длины. Угол Z обуславливает длину распределения напряжения рубца и удлинение (т.е. 30° для 25%, 45° для 50%, 60° для 75%, 75° для 100%, 90° для 120%). Способ W-пластики для исправления рубца аналогичен Ζ-пластике из-за результата разбивания прямолинейного шрама в структуру, которая менее заметна. Аналогично веретенообразному иссечению, W-пластика включает удаление кожи; следовательно, избегайте этого способа, если по краям раны присутствует значительное напряжение. W-пластическая коррекция рубца является предпочтительной для рубцов вдоль линий напряжения расслабленной кожи; рубцов, сведенных в линию; коротких, вдавленных рубцов; и рубцов на лице.
Растяжение ткани и последовательное иссечение можно рассматривать для коррекций больших рубцов, когда прогнозируется излишнее напряжение раны. Если ожидается более чем 2 последовательных иссечения, растяжение ткани является предпочтительным. В конечном счете, другие описанные способы для лечения рубцов включают абразивное удаление дефектов кожи, криохирургию и лазерную терапию. Расширенные рубцы можно лечить иначе, чем гипертрофические рубцы. Расширенные рубцы могут быть плоскими или даже впалыми. Следовательно, введение внутрь пораженных тканей стероидов не является предпочтительным; эти реагенты могут усугубить впадину. Расширенные рубцы лечат предпочтительно 2-лоскутным способом Милларда над деэпителизованном рубцом. Этот способ обеспечивает наполнение мягких тканей под сведенными краями раны. Кроме того, если расширенный рубец рецидивирует, риск следующего рецидива может быть минимизирован переориентацией напряжения раны вдоль линий напряжения расслабленной кожи. Другие дополнительные детали, описанные в лечении расширенных рубцов, включают введение лоскута жира или других заместителей тканей. Когда направление близко к линиям напряженности расслабленной кожи, гипертрофированные рубцы могут быть иссечены веретенообразным способом. Если гипертрофированный рубец развился по причине чрезмерного напряжения между краями раны в качестве результата неблагоприятной ориентации раны, Ζ-пластика иногда может помочь переориентировать рану для распределения напряжения в другом направлении, чтобы минимизировать риск рецидива.
Послеоперационно, для уменьшения риска рецидива в течение 4-6 месяцев являются предпочтительными предметы компрессионной одежды и силиконовый гель. Пациентам предлагают воздержаться от тяжелой физической активности в течение по меньшей мере 6 недель до времени, в которое рана достигает приблизительно 80% исходной прочности раны при растяжении. Пациентов послеоперационно контролируют в течение 6 месяцев, чтобы обнаружить и потенциально своевременно избежать рецидивов. Послеоперационно пациенты испытывают риск рецидива гипертрофированного рубца и расширенного рубца. Другие риски включают инфекцию, гематому, скопления сыворотки крови в тканях и образование болезненного или непривлекательного рубца. Риск рецидива является значительным как для гипертрофического, так и расширенного рубцов, и возрастает с повтором операций. Заживление ран требует приблизительно 1 года, в течение которого хирург и пациент должны соблюдать и ожидать улучшения. Раз рубец имел возможность созреть, можно рассмотреть возможность коррекции рубца.
В некоторых вариантах осуществления настоящего изобретения, композиции, включающие клеточный экстракт, используют для улучшения любой видимой площади индивида, участвуя в косметическом внешнем виде индивида, включая в качестве неограничивающих примеров кожу, волосы, ногти, зубы, подкожный жир, хрящ, мышечные и костные структуры. Описанные генное ружье и способ микроинъекционной доставки предусмотрен для того, чтобы вводить экстракты или компоненты экстрактов в структуры ниже поверхности кожи индивида.
Данное изобретение относится к предотвращению деградации, повреждения и нарушения функции клеток и тканей, и к тому, чтобы активировать, улучшить и превзойти клеточную функцию для того, чтобы активировать, улучшить и превзойти внешний вид, жизнеспособность и здоровье лечением клеток и тканей дифференцирующимися клетками, клеточными или зародышевыми экстрактами, или компонентами названных экстрактов, включая сигнальные молекулы, пептиды, углеводы, липиды или нуклеиновые кислоты.
Настоящее изобретение предусматривает установление потребностей индивида в лечении, регенерации или восстановлении повреждения несколькими способами, включая в качестве неограничивающих примеров анализ и измерения видимых поверхностей, pH кожи, толщины, структуры и эластичности слоев кожи, анализ образцов крови или ткани с помощью микропроцессорного, ОТ-ПЦР, масс-спектрометрии, высокоэффективной жидкостной хроматографии, твердофазного ИФВ, анализа РНК, анализа накопления повреждений ДНК или дефектных генов секвенированием ДНК, оценка здоровья внутренних органов и тканей, формированием рентгеновских изображений, ультразвуковой визуализации, компьютерной томографии (КТ), магниторезонансной томографии (МРТ), позитронно-эмиссионной томографии(PET).
Подкожный жир способствует косметическому внешнему виду человека и перераспределяется во время старения, в результате курения и ряда болезней, включая ВИЧ и диабет, а также жертв ожогов. Липодистрофический синдром при инфекции вируса иммунодефицита человека (ВИЧ) связывают с перераспределением жира и метаболическими нарушениями, включая резистентность к инсулину. Увеличенная концентрация липидов внутри мышечных волокон (IMCL), как предполагают, способствует резистентности к инсулину, будучи связанной с переменными метаболизма и состава тела. Среди инфицированных ВИЧ индивидов уменьшены площадь подкожного жира голени и жир конечностей. Жир конечностей существенно связан с IMCL ВИЧ инфицированных пациентов, контролированием жира внутренних органов брюшины, подкожного жира брюшины, и антиретровирусных медикаментов в модели регрессии. Повышенные IMCL у ВИЧ инфицированных женщин со смешанной структурой липодистрофии наиболее значительно связаны с пониженным жиром конечностей (Torriani Μ et al., J Appl Physiol. 2006 Feb;100(2):609-14. Epub 2005 Oct 13). Насыщение хранилища подкожного жира представляет собой основное событие патофизиологии резистентности к инсулину у большинства пациентов и постулирует, что это основополагающее событие может привести к развитию гипертензии, гипертриглицеридемии и пониженным уровням ЛВП (т.е. метаболический синдром). Не существует действующих на данный момент эффективных способов перераспределения подкожного жира у таких лиц, современное лечение включает (1) потерю веса с различными наблюдаемыми ответами по отношению к резистентности к инсулину в зависимости от размера запаса жира; (2) агонисты гамма-рецептора, активированные пролифератором пероксисом, таким как тиазолединедионы, которые расширяют хранилища подкожного жира, (3) расширение альтернативных участков хранения для триглицеридов рядом способов, таких как резистивная индуцированная физической тренировкой мышечная гипертрофия, также может улучшить резистентность к инсулину; (4) лекарственные средства, такие как агонисты бета 3 адренергического рецептора, которые активируют липолиз, могут увеличить резистентность к инсулину высвобождением свободных жирных кислот в кровообращение. Ингибиторы бета-окисления свободных жирных кислот (например, ингибиторы карнитин-пальмитоилтрансферазы) могут обуславливать резистентность к инсулину удерживанием жира и (5) липосакция, уменьшение размеров депозитов подкожного жира может ухудшить резистентность к инсулину, таким образом увеличивая риск сахарного диабета типа 2 (Cherian MA, Santoro TJ, Med Hypotheses. 2005 Dec 14; [Epub ahead of print]).
Изменения состояния подкожного жира и кожи по причине изменений в гормонах, которое происходит при старении и болезни, также представляют собой области, предусмотренные по данному изобретению. Влияние стероидов яичника и других на всем протяжении жизни является важным для метаболизма кожи и волос, изменения в составе тела и изменения распределения подкожного жира. Так называемая эстетическая эндокринология, доступ, дефицит или избыток стероидов яичника ведет к различным проблемам кожи и волос и другим неполовым, т.е. ожирению и целлюлиту. Половые стероиды представляют собой низкомолекулярные соединения, которые транспортируют в кожу местным применением при надлежащем составлении и предполагаются добавленными к представленным в данном изобретении экстрактам, чтобы достичь локальных эффектов, но избежать системных реакций. Эстрогены, введенные перорально или местно, могут противодействовать старению кожи особенно после менопаузы. Эстроген сам по себе недостаточен для воссоздания юношеской кожи, но может замедлять процесс старения кожи. До настоящего времени единственное успешное лечение утраты волос у женщин представляет собой применение негормонального соединения миноксидила, и композиции, предусмотренные данным изобретением, могут служить другим способом лечения утраты волос. В действительности, предусмотренные композиции могут стимулировать фолликулы волосяных мешочков к повторному росту или увеличению скорости и качества волос, а также ногтей. Эстрогены также способствуют гирсутизму (избыточному росту толстых темных волос в областях, где у женщин обычно рост волос минимален или отсутствует), акне и изменениям в конституции тела (Gruber CJ, et al., Current concepts in aesthetic endocrinology. Gynecol Endocrinol. 2002 Dec; 16(6):431-41). Композиции в настоящем изобретении дополнительно предусматривают для использования при потере волос и облысении у мужчин, которые могут быть вызваны гормонами, диетой, раком, хроническим заболеванием или стрессом.
Предусмотрено, что настоящее изобретение можно использовать для регулирования роста волос стимулированием или модулированием клеток волосяных фолликулов, или для уменьшения, или усиления, или для восстановления роста волос в требуемых областях местными или подкожными применениями.
Изобретение также полезно при лечении целлюлита. Целлюлит представляет собой общий термин, использованный для описания специфических очагов отложенного жира, которые вызывают неровную, с характерными углублениями, или с "апельсиновой коркой" кожу. Он проявляется у 90% половозрелых женщин и редко наблюдают у мужчин. Обычные, но не исключительные области, где находят целлюлит, представляют собой бедра, ягодицы и живот. Вопреки поверью целлюлит не связан с ожирением, так как он встречается у женщин с повышенной массой тела, нормальных и худых. Целлюлит может быть облегчен механизированными приспособлениями с моторизованными роликами и регулируемым разрежением. Этот нехирургический и неинвазивный аппарат создает симметричный изгиб кожи, который позволяет произойти глубокой мобилизации ткани, которая приводит к уменьшению целлюлита и потери дюймов. Настоящее изобретение предусматривает применение экстрактов местно или подкожно, чтобы регулировать распределение отложений подкожного жира и улучшать косметический вид областей, пораженных целлюлитом.
Предполагается, что настоящее изобретение может быть полезным для восстановления, или омолаживания, или формирования de novo поврежденных тканей, органов и клеток под кожей, включая все внутренние органы и ткани, включая в качестве неограничивающих примеров мышцы, жир, хрящ, кость, соединительную ткань, селезенку, печень, поджелудочную железу, легкие и нервную ткань. Повреждение внутренней ткани или органов может быть вызвано травмами, болезнями, лекарственной терапией, раком, радиацией и хирургией.
Когда тело подвергают высоким дозам радиации, инициируют сложный биологический отклик, который может привести к полиорганной недостаточности (MOF). MOF начинается с того, что энергия накапливается в клеточных мишенях, и распространяется, и усиливается ответом ткани на повреждение клетки. Биология заживления ран находится в основе MOF, следующей за хирургической травмой, воспаление представляет собой основу MOF при сепсисе, и биология облученной ткани вызывает радиогенный MOF. Ответ ткани на радиационное повреждение, как предполагают, должен быть инициирован и координирован подачей внеклеточных сигналов. Показано, что трансформирующий фактор роста-β1 организует биологические процессы в облученной ткани в качестве детектора уровня ткани окислительного стресса и является неотделимой частью ответа на разрушение клеточной ДНК.
(Barcellos-Hoff MH.How tissues respond to damage at the cellular level: orchestration by transforming growth factor-β (TGF-β) British Journal of Radiology (2005) Supplement_27, 123-127.)
M. Применение целых клеток
В некоторых вариантах осуществления настоящего изобретения, композиции, содержащие неизмененные стволовые клетки (эмбриональные или взрослые) или стволовые клетки пуповинной крови, используют для косметических или терапевтических целей. В некоторых вариантах осуществления в кожу вводят суспензии клеток в жидкой форме. В некоторых вариантах осуществления суспензии клеток в жидкой форме вводят в открытую рану и затем закрывают раневой повязкой, которая может осуществлять газообмен (неокклюзивная). В некоторых вариантах осуществления используют окклюзивные повязки на рану. В некоторых вариантах осуществления используют один или несколько слоев, например водонепроницаемая пластиковая мембрана, которая может быть приклеена на кожу, слой питающего геля, который может питать клетки и ускорять заживление ран (содержащий антибактериальные средства, модулирующие коллаген вещества и другие вещества); и слой стволовых клеток кожи, погруженный в/помещенный на питающий слой, который вводят в прямой контакт с раной. В некоторых вариантах осуществления клетки культивируют в лаборатории из собственной кожи индивидуума, жира или стволовых клеток. В некоторых предпочтительных вариантах осуществления затем клетки собирают и вводят в суспензию или чтобы использовать в качестве жидкости, или поместить на пластиковую мембрану с питающим слоем геля, чтобы использовать на коже в качестве окклюзионной повязки/пластыря/лейкопластыря на рану.
N. Терапия еx vivo и in vivo
В некоторых вариантах осуществления экстракты используют для обработки ex vivo клеток, происходящих из пациента. В кратком изложении, клетки извлекают из пациента, развивают, изменяют проницаемость, инкубируют с экстрактом, закрывают и затем используют для лечения пациента. В этом способе, ряд свойств клеток можно изменить или усилить, включая в качестве неограничивающих примеров наращивание теломеров - концевые хромосомы, защищающие центральную ДНК, содержащуюся в хромосоме, которые укорачиваются с каждым делением клетки, таким образом обрабатывают возобновление и удлинение срока жизни клетки. Предпочтительные способы описаны в Примере 3.
В некоторых вариантах осуществления экстракты используют in vivo на внутренних органах и/или тканях или клетках пациента. В кратком изложении, экстракт или его компоненты можно ввести во внутрибрюшинную полость, таким образом, омывая поверхность органов брюшной полости, включая в качестве неограничивающих примеров кишечник, печень, селезенку, поджелудочную железу, желудок и полость, таким образом, вызывая заживление ран в этих органах и тканях или способствуя в регенерации клеток, из которых состоят органы и/или ткани.
Также предусмотрено вводить клетки или экстракты или их компоненты во внутренние органы и/или ткани, включая в качестве неограничивающих примеров мышцы, мозг, жир, соединительную ткань, хрящ, поджелудочную железу, печень, селезенку, сердце и легкие, чтобы индуцировать de novo формирование клеток тканей и органов и/или омоложения клеток, из которых ткани/органы состоят. Образование клеток de novo происходит спонтанно в организмах, включая людей. Формирование локальной лимфоидной ткани de novo дендритными клетками, которые представляют собой наиболее мощные специализированные антигенпредставляющие клетки (Ludewig Β et al.,1998 J Exp Med).
Жизнь проявляется в росте. В растениях рост может быть двух типов, гетеротрофный и аутотрофный. Аутотрофный рост использует для питания неорганические материалы. Гетеротрофный рост является зависимым от органических материалов для питания. Во время проращивания сеянцы обычно растут гетеротрофно, но как только растение становится фотосинтетическим, оно может расти аутотрофно - используя минералы из почвы и атмосферы, и солнечный свет для энергии. Таким образом, большую часть из жизни растения являются аутотрофными. Однако существуют некоторые паразитические растения, которые растут гетеротрофно, получая неорганические материалы из их хозяев. В растениях рост является периодическим, повторяющимся и формообразующим, и деление клетки способствует формированию органов de novo до самого старения. У животных деление клетки предназначено для регенерации и поддержания ткани и популяций циркулирующих клеток, и рост является согласованным повторяющимся и зависимым от длины теломеров, которые укорачивают при каждом делении клетки.
Настоящее изобретение предусматривает использование как органических материалов, так и неорганических материалов, содержащихся или добавляемых к экстрактам для того, чтобы питать, стимулировать и регулировать клеточный рост, функцию и образование de novo во всех органах и тканях. Семена растений содержат минералы для гетеротрофного роста и предназначены для использования в экстрактах, чтобы способствовать клеточному росту у людей.
Некоторые животные обладают способностью регенерировать части своих тел после утраты или повреждения. Для того, чтобы действительно вырастить заново утраченный орган или другую структуру, а не просто заполнить пустое пространство рубцовой тканью, включают процессы в диапазоне от ответа на повреждения и заживления ран, и до роста, формирования структуры и дифференцировки новой ткани, аналогично тому, что происходит во время эмбрионального развития. С новым подтверждением присутствие стволовых клеток в большинстве, если не во всех взрослых органах, и их способности участвовать в восстановлении ткани, поле регенеративной биологии приобрело много более масштабное медицинское значение (Stocum, 1995, 2004). Если посмотреть на филогенетическое распределение регенеративной способности в различных системах органов, видно, что эта способность постепенно терялась в ходе эволюции животных (Thouveny and Tassava, 1998; Sanchez Alvarado, 2000). Регенерация ампутированных конечностей у амфибий представляет собой одну из наиболее изученных систем и полезный пример для понимания многих деталей регенерации органов позвоночных. В качестве примера "эпиморфной" регенерации, эта система включает клеточную дедифференцировку в поврежденных тканях обрубка конечности и пролиферации этих клеток для образования дистальной бластемы, которая подлежит структурированию и росту для того, чтобы восстановить утраченные структуры конечности. Вопросу, почему конечности филогенетически развитых позвоночных не способны регенерировать, посвящены исследования с конечностями бесхвостых амфибий. Регенерация является замечательной на ранних стадиях развития конечностей у бесхвостых земноводных (лягушек и жаб), но постепенно уменьшается, по мере того как личинка приближается к метаморфозам (Dent, 1962). Конечности взрослых бесхвостых земноводных являются неспособными к полной регенерации.
Однако хвостатые земноводные (тритоны и саламандры) обычно регенерируют конечности и часто другие органы, такие как хвосты, челюсти и части глаза, на всем протяжении их времени жизни. Такие регенеративные явления представляют собой очень редкие среди рептилий, птиц и млекопитающих, таких как взрослые, предполагая, что утрата регенеративной способности может быть адаптивной частью эволюционного перехода к более развитым тетраподам, несколько исследователей предполагают, что клетки дифференцированной мышечной и других тканей в конечности бесхвостых земноводных утратили способность возвращаться в пролиферативное состояние и участвовать в повторном росте конечности. В соответствии с этим взглядом, регенерация и морфогенез были найдены более глубокими в конечностях взрослых лягушек, когда диссоциация ткани и дедифференциация клеток были усилены у обрубка дополнительной травмой (Polezhaev, 1972). Пластичность дифференцированного состояния в способных к регенерации конечностях и возможность многоядерных мышечных волокон дифференцировать и повторно входить в цикл клетки в настоящее время представляют собой активные области исследования в поле регенерации конечностей (Brockes et al., 2001; Brockes and Kumar, 2002).
Регенерация требует эпителиально-мезенхимальных взаимодействий в дистальной культе конечности, подобно тому, которое движет развитие эмбриональных конечностей, и изменение природы закрытия раны после ампутации лягушачьих конечностей во время перехода от личинки до взрослых также были исследованы. Закрытие культей конечностей у млекопитающих включает стягивание кожи полной толщины, и у взрослых лягушек включает быстрое формирование соединительной ткани под эпидермисом апикальной раны, которых изначально закрывал поверхность среза (Carlson, 1974). Tassava и Olsen (1982) предположили, что неспособность высших позвоночных формировать функциональный эпителий раны объясняет потерю возможности для регенерации. Препятствие формированию дистального рубца в ампутированных конечностях млекопитающих или взрослых лягушек для того, чтобы вызвать регенерацию, имели в лучшем случае, были минимально успешны (см. обзор Stocum, 1996), но важность установления правильных условий для обоюдных взаимодействий между апикальным эпителием и подлежащими мезодермальными клетками, если конечность должна регенерировать. В эмбриональных конечностях передача сигналов происходит между апикальной эктодермой и прилегающими мезодермальными клетками фактора роста фибробластов (FGF) и их рецепторами. Galis et al. (2003) предположили, что причина для неудачи конечностей высших позвоночных восстановить функциональные взаимодействия происходит потому, что регенерация конечности единственно возможна, когда конечность развивается в качестве полуавтономного модуля, не зависящего от взаимодействий с промежуточными структурами, такими как сомиты.
Развитие конечностей рептилий, птиц и млекопитающих начинается на ранних стадиях развития эмбриона и включает взаимодействие с помощью передачи сигналов с различными временно соседствующими структурами, в то время как у амфибий развитие конечностей происходит много позже в развитии и не связано с взаимодействием с промежуточными структурами. Факторы и клетки иммунной системы также могут оказывать воздействие на регенеративную способность (Harty et al., 2003). Развитие приобретенного иммунитета, который дополняет более общие и примитивные, врожденные иммунные механизмы, и позволяет организму получать высокоспецифичные защитные механизмы против проникающих микроорганизмов, может давать иммунные клетки и цитокины, чья активность в травмированной ткани является недружелюбной для клеточной дедифференциации или передачи сигналов, необходимых, чтобы вызвать регенерацию конечностей так, что реакция на повреждение в присутствие такого иммунитета представляет собой доминирующую в части восстановления ткани и фиброза, а не регенерации (Mescher и Neff, 2005).
Появление в ходе эволюции приобретенного иммунитета ведет к ограничению регенеративной способности в соответствии с нашим знанием иммунной филогенетики (Flajnik et al., 2003). Беспозвоночные, которые обычно имеют хорошо развитые способности к регенерации, совершенно не имеют приобретенного иммунитета. Вместо этого они зависят от совокупности систем защиты, которые образуют чрезвычайно эффективную врожденную иммунную систему. Механизмы, лежащие в основе приобретенного или адаптивного иммунитета, впервые появились у челюстноротых позвоночных, становясь более эффективными в различных отрядах рыб и амфибий и высокоразвитым у теплокровных (Flajnik et al., 2003).
Настоящее изобретение предусматривает увеличить пластичность и изменить потенциал роста клеток и тканей, увеличивая клеточную дедифференциацию и диссоциацию тканей, таким образом, делая возможным формирование клеток, тканей, и органов de novo. Также предусмотрено изменение иммунного ответа активными веществами в экстрактах.
ПРИМЕРЫ
Пример 1
Клетки и Клеточные экстракты
Клетки NCCIT, Jurkat (клон E6-1) и 293T (Американская коллекция типовых культур, Bethesda, MD) культивируют в RPMI 1640 (Sigma, St. Louis, MO) с 10% эмбриональной телячьей сыворотки (FCS), 2 мМ L-глутамина, 1 мМ пирувата натрия и не незаменимых аминокислот (полная RPMI). Фибробласты NIH3T3 Swiss-Albino (Американская коллекция типовых культур) культивируют в Модифицированной по способу Дульбекко среде Игла (DMEM; Sigma) с 10% FCS, L-глутамином и 0,1 мМ β-меркаптоэтанолом. Мышиные ESC изолируют из внутренней клеточной массы линии бластоцисты sv129 и наносят на фидерные слои γ-облученных мышиных фибробластов в среде ESC (DMEM, 15% FCS, 0,1 мМ β-меркаптоэтанол, не незаменимые аминокислоты, 1% пенициллин/стрептомицин), дополненную 1000 ед./мл (10 нг/мл) рекомбинантного фактора ингибирования лейкоза (LIF; Sigma) на покрытых желатином чашках. Перед сбором клеток для получения экстракта, ESC пересаживают и культивируют в условиях без питающего слоя в RPMI, содержащей 10 нг/мл LIF.
Для получения экстрактов NCCIT, клетки промывают в фосфатно солевом буфере (PBS) и в буфере для лизиса клеток (100 мМ HEPES, pH 8,2, 50 мМ NaCl, 5 мМ MgCl2, 1 мМ дитиотреитол и ингибиторы протеаз), осаждают при 400 g, ресуспендируют в 1 объеме холодного буфера для лизиса клеток и выдерживают в течение 30-45 мин на льду. Клетки обрабатывают ультразвуком на льду в аликвотах по 200 мкл, используя импульсный генератор ультразвука Labsonic-M, оборудованный зондом диаметром 3 мм (B. Braun Biotech, Мельзунген, Германия) до лизиса всех клеток и ядер, что определяется микроскопией. Продукт лизиса осаждают при 15000 g в течение 15 мин при 4°C, чтобы гранулировать крупнозернистый материал. Супернатант разделяют на аликвоты, замораживают в жидком азоте и хранят. Лизат 95583±10966 клеток NCCIT используют для получения экстракта. Экстракты ESC (25-30 мг/мл белка) аналогично получают из адаптированных с использованием LIF культур ESC. Экстракты 293T, Jurkat и NIH3T3 также получают, как описано выше. В случае необходимости, перед использованием экстракты разводят с H2O, чтобы довести осмотическую концентрацию раствора до ~300 мОсм.
Пример 2
Стволовые клетки выпуклой части волосяного фолликула
Чтобы выделить фолликулы вибрисс, верхнюю губу, содержащую подушечку, вибриссы индивида срезают и ее внутреннюю поверхность обнажают. У индивидуумов человека можно использовать волосы вместо вибрисс, например, волосы кожного покрова головы или других покрытых волосами частей тела. Фолликулы вибрисс или волос иссекают под бинокулярным микроскопом. Вибриссы выдергивают из подушки, вытягивая их из подушки за шею аккуратно остроконечным пинцетом. Выделенные вибриссы промывали с DMEM-F12 (GIBCO/BRL), содержащей B-27 (GIBCO/BRL) и 1% пенициллин/стрептомицин (GIBCO/BRL). Все хирургические процедуры провели в стерильной среде. Область выпуклой части фолликула вибриссы содержала клетки, экспрессирующие нестин. Клетки изолировали воздействием флуоресцентных антител против нестина под флуоресцентной микроскопией. Выделенные клетки суспендировали в 1 мл DMEM-F12, содержащей B-27 с 1% метилцеллюлозой (Sigma-Aldrich), и 20 нг·мл-1 основного FGF (bFGF) (Chemicon). Клетки культивировали в 24-луночных тканевых планшетах (Corning) в инкубаторе для выращивания тканей при 37°C в 5% CO2/95% воздуха. Через 4 недели клетки выпуклой части волосяного фолликула формируют колонии.
Пример 3
Терапия Ex vivo
Клетки, которые должны быть перепрограммированы ex vivo промывают в холодном PBS и в холодном солевом растворе Хенка без Ca2+ и Mg2+ (HBSS; Invitrogen, Гайтерсбург, Мэриленд). Клетки повторно суспендировали в аликвоты по 100000 клеток/100 мкл HBSS, или их кратные количества, помещали в пробирки по 1,5 мл и центрифугировали при 120 g в течение 5 мин при 4°C в поворотно-откидном роторе. Осажденные клетки суспендировали в 97,7 мл холодного HBSS, пробирки помещали в ванну H2O при 37°C в течение 2 мин и 2,3 мл SLO (Sigma; 100 мг/мл концентрированный раствор разведенный 1:10 в холодном HBSS) добавляли до конечной концентрации SLO 230 нг/мл. Образцы инкубировали горизонтально в ванне H2O в течение 50 мин при 37°C с периодическим перемешиванием и оставляли на льду. Образцы разводят с 200 мл холодного HBSS и клетки осаждают при 120 g в течение 5 мин при 4°C. Нарушение проницаемости мембран оценивают по наблюдению проникновения декстрана, конъюгированного с техасским красным с молекулярной массой 70000 (Molecular Probes, Юджин, Орегон; 50 мкг/мл) в отдельном образце, спустя 24 ч после повторного уплотнения и пересаживания клеток. Эффективность нарушения проницаемости при этих условиях составляет ~80%.
После изменения проницаемости клетки, которые должны быть перепрограммированы ex vivo, суспендируют до 1000 клеток/мкл в 100 мл экстракта (или их кратные количества), содержащего АТФ-регенерирующую систему (1 мМ АТФ, 10 мМ креатинфосфат, 25 мг/мл креатинкиназа; Sigma), 100 мкΜ GTP (Sigma) и 1 мМ трифосфата каждого нуклеотида (NTP; Roche Diagnostics, Мангейм, Германия). Пробирки, содержащие клетки, инкубируют горизонтально в течение 1 ч при 37°C в ванне H2O с периодическим перемешиванием. Чтобы повторно уплотнить плазматические мембраны, экстракт разводят с полной RPMI, содержащей 2 мМ CaCl2 и антибиотики, и клетки высевают по 100000 клеток на лунку 48-луночного планшета. Через 2 ч плавающие клетки удаляют, и высеянные клетки культивируют в полной RPMI. Перепрограммированные клетки можно трансплантировать назад в пациента.
Пример 4
Основа крема для использования с клеточными экстрактами
Вода - 78%;
Белки - 10%;
например, кератин, филагрин, и/или факторы роста в незначительных количествах (в количествах мкΜ - мМ EGF, IGF, IGFII, Инсулин, вещества P, дефензины, NGF);
Липиды - 10%;
Сквалан 9%, алифатические воски 12%, сложные эфиры стерола 33%, диоловые сложные эфиры 7%, триглицериды 26%, свободные стеролы 9%, другие липиды 4%.
Клеточные экстракты или экстракты зародышей или компоненты экстрактов - 2%.
Основа для крема, полученная из любой комбинации липидов и/или белков и/или воды, содержащей клеточные экстракты.
Пример 5
Получение экстрактов икринок
Свежие, неоплодотворенные зародыши лосося (Salmo salar) собирали из самок в репродуктивной фазе (конец осени), хранили на льду, и экстракты предпочтительно делали немедленно. Допустимо сублимационно высушивать зародыши в криопротекторе (например, 1,5 Μ 1,2-пропандиол и 0,2 Μ сахароза) без разрушения мембраны зародыша. Замораживание должно быть постепенным от (-1°C/мин) до - 80°C. Зародыши следует оттаивать и держать на льду на всем протяжении процедуры получения экстракта.
Зародыши промывают дважды в HBSS или морской воде с ингибиторами протеазы (10 мкг/мл). Раствор для промывания удаляют и икру лизируют и гомогенизируют в предварительно охлажденном в полностью стеклянном гомогенизаторе Даунса. Лизат переносят в полиалломерные пробирки для центрифугирования Beckman Ultra Clear (5 мл), избегая переноса оболочек икры, и центрифугируют в течение 15 мин при 15000 g при 4°C в ультрацентрифуге Beckman, используя ротор SW55T1. Таким образом получают три фракции: верхнюю липидную фракцию, среднюю цитоплазматическую фракцию и нижнюю фракцию, содержащую оболочки икринок и обломки ядер. Средняя цитоплазматическая фракция представляет собой полученный экстракт. Этот экстракт, как ожидают, будет содержать большинство цитозольных органелл, включая митохондрии, лизосомы и пероксисомы, должен быть чистым и вязким и имел оранжевый оттенок. Добавляют ингибиторы протеаз (10 мкг/мл исходный раствор) и экстракты хранят при -80°C.
Дополнительно возможно фракционирование цитоплазматического экстракта. Центрифугирование при 100000 g при 4°C в течение 60 минут дает 2-3 фракции, где верхняя/средняя цитоплазматическая фракция содержит цитозоль с эдоплазматическим ретикулумом, СВ и микросомы. pH экстракта измеряют лакмусовой бумагой, концентрацию белка измеряют по Брэдфорду, и осмотическую концентрацию раствора измеряют осмометром.
Эмбрионы полосатого данио в стадии средней бластулы собирают, удаляют жидкость и замораживают при -20°C. Чтобы получить экстракт, эмбрионы размораживают на льду, лизируют и гомогенизируют полностью стеклянным гомогенизатором Доунса в небольшом количестве или HBSS, или морской воды (предпочтительно менее чем 50% жидкости об./об.). Лизат фильтруют через стерильную льняную ткань и центрифугируют при 5000 g при 4°C в течение 20 мин в роторе SX4250, используя центрифугу Beckman X-22R. Цитоплазматический экстракт (супернатант) собирают и добавляют ингибиторы протеаз (10 мкг/мл). Экстракт можно фильтровать через Millipore (0,22 мкм MilliQ стерильный фильтр). Экстракты хранят при -80°C. pH экстракта измеряют лакмусовой бумагой, концентрацию белка измеряют по Брэдфорду, и осмотическую концентрацию раствора измеряют осмометром.
Этот общий способ является полезным для получения экстрактов из морского ежа, креветки, зародышей икры рыбы или зародышей лягушки. В кратком изложении, икру, собирают из несущих икру самок рыб вскоре после того как они высвободят своих зародышей по программе нереста (hCG гормон инъецируют (1 мл/кг) за 6-8 часов перед высвобождением зародышей, обычно на рассвете (2-4 часа утра), или из икряной лягушки. Икру/зародыши высушивают сублимацией или замораживают при -20°C или используют свежими. Икру собирают из различных сортов рыб. В случае морского ежа, 0,5 Μ KCl впрыскивают вокруг рта, чтобы вызвать взметывание зародышей. Экстракт получают из зародышей/икры измельчением (дробилкой клеток или гомогенизацией по Доунсу) или центрифугированием при различных скоростях, чтобы разделить цитоплазму со всем содержимым, с/без оболочек зародышей (блестящая оболочка), с/без ядер/цитозоля, с/без органелл, с/без липидов. Дополнительное фракционирование может быть проведено, чтобы выделить одну или несколько мРНК, белки, легкие пептиды, углеводы и липиды. Преобладающие компоненты жирных кислот в икре представляют собой олиеловую кислоту, линелевою кислоту и омега-3-жирные кислоты.
По заявлению вышеприведенного протокола для экстрактов зародышей лосося, экстракты зародышей лосося имели поразительно высокую концентрацию белка, меняющуюся от 100 до 380 мг/мл, pH между 6,4-6,8 и осмотическую концентрацию раствора приблизительно 350 мОсм. Экстракты были чистые и вязкие и не поддающиеся фильтрованию (с помощью 0,45 мкм фильтра MilliQ). Белок в экстракте легко выпадал в осадок при добавлении воды или водных растворов с низкой буферной емкостью по причине высокой концентрации белка и низкого pH. Экстракты могли быть нейтрализованы до pH 7,0 добавлением щелочи (1-3 мкл 1M NaOH/мл экстракта), после чего растворение в воде и водных растворах было возможным. Экстракты полосатых данио имели концентрацию белка, меняющуюся от 23 до 26 мг/мл, pH между 6,4-6,8 и осмотическую концентрацию раствора между 80 и 150 мОсм. Экстракты были чистые и невязкие, поддающиеся фильтрованию и легко разводились в воде при всех разведениях.
Пример 6
Токсикологическое тестирование экстрактов
Экстракты с низким pH и которые содержат некоторые вещества могут быть токсичными для клеток. Токсичность каждой партии должна тестироваться на каждом типе клеток, которой должен быть перепрограммирован. Клетки собирали и дважды промывали в HBSS. Приблизительно 100000 клеток осаждали и ресуспендировали в 100 мкл экстракта и инкубировали в водяной бане при 37°C в течение 1 часа. Разведения экстрактов можно тестировать, чтобы определить выживаемость клеток в экстрактах варьирующихся концентраций белка, pH и осмотической концентрации. Оптимально, концентрация белка должна быть более чем 25 мг/мл, pH должен быть близок к 7,2, и осмотическая концентрация раствора близка к 280 мОсм/л. Клетки и экстракты инкубировали в лунках с нормальной средой (в качестве подходящей выбранному типу клеток) в течение 24 часов, и морфология клеток контролируется с помощью микроскопии. Клетки собирают, красят и считают жизнеспособные клетки. Если более чем 50% клеток нежизнеспособны после посева, экстракт считают токсичным.
По применению вышеприведенного протокола, клетки 293T были жизнеспособными в течение по меньшей мере 3 недель после инкубирования с экстрактами зародышей лосося и эмбрионов полосатого данио с концентрацией белка, меняющейся от 24 до 380 мг/мл, при осмотической концентрации раствора между 140 и 350 и pH 6,9-7,7. При осмотической концентрации раствора ниже 140 мОсм/л клетки погибали.
Клеточная морфология у клеток, перепрограммированных с использованием экстрактов зародышей лосося или экстрактов эмбрионов полосатого данио, менялась приблизительно через 3 дня. Клетки 293T становятся округлыми, и некоторые популяции клеток начинают расти в сферах, подобных бластоме. Эти изменения являются устойчивыми и могут наблюдаться до 21 дня (эксперимент завершился), несмотря на то, что при некоторых условиях эти изменения, по-видимому, возвращаются к нормальной морфологии 293T через 2 недели. На культуре нормальных клеток 293T с экстрактом, добавленным к нормальным средам (RPMI-1640 с 10%FCS и 0,2% экстракта), можно наблюдать изменения морфологии, аналогичные тем, которые наблюдали для перепрограммированных клеток, культивированных в нормальных средах. Кроме того, клетки, культивируемые с экстрактами зародышей лосося в особенности, имели увеличенную скорость роста по сравнению с нормальными клетками. При голодании клеток (RPMI-1640 с 0,5% FCS) скорость роста значительно уменьшается для не обработанных экстрактами клеток, и морфология клеток слегка изменяется. Для роста голодных клеток с экстрактами (0,2% экстракта в минимальной среде) изменения являются более явными. В этом случае, большинство популяций клеток растет в сферах, подобных бластомерам, и сферы отделяются от сосуда для культивирования и плавают в средах, где они продолжают расти. Примечательно, что замедление скорости роста обратимо в клетках культивируемых с экстрактом, добавленным к минимальной среде.
Пример 7
Экспрессия генов экстрактов
Чтобы проверить экспрессию генов, которые нужно исследовать в перепрограммированных клетках, ОТ-ПЦР можно провести на РНК, выделенной из экстрактов. РНК можно изолировать из экстрактов способом по выбору, например, используя набор Qiagen RNeasy Plus (Qiagen). РНК количественно измеряют спектрофотометром, хранят при -80°C. 1 мкг РНК используют для синтеза кДНК. Синтез кДНК можно провести например, используя набор iScript cDNA Synthesis Kit (Bio-Rad), с последующей ПЦР, проведенной с праймерами по выбору. Положительные контроли включают для каждого тестируемого набора праймеров. Продукты ПЦР разделяют в 1% агарозном геле с бромистым этидием и полосы визуализируют УФ-лампой.
При применении вышеприведенного протокола, продукты ПЦР экстрактов, полученные с помощью специфичных праймеров для представляющих интерес генов человека, в качестве наблюдаемых в агарозном геле сравнили с полосами, полученными из линий клеток человека для положительного контроля, для которых ранее было показано, что они эксперссируют исследуемые здесь гены (например, OCT4, NANOG, SOX2, UFT1, GAPDH, REX1 (известный также как ZFP42), LMN-A, LMN-B1, OXT2, ACI33, APL и STELLA). Клетки положительного контроля NCCIT показывали единственную полосу ожидаемого размера для каждого исследуемого гена, тогда как продукты ПЦР ни из экстрактов зародышей лосося, ни из экстрактов эмбрионов полосатого данио не давали полос в геле. Эти результаты показывают, что экстракты не экспрессируют вариантов генов человека, обнаруживаемых с использованными праймерами.
Пример 8
Перепрограммирование клеток с экстрактами зародышей или эмбрионов рыб
Клетки выбранного типа (например, клетки человека 293T и стволовые клетки жировой ткани (ASC, подтвержденные)) собирают, хранят на льду и промывают дважды в охлажденном на льду HBSS. Приблизительно от 100000 до 500000 клеток осаждают посредством центрифугирования (300 g, 4°C в течение 10 минут). Клетки могут иметь проницаемость, нарушенную с помощью стрептолизина-O (SLO), инкубацией в течение 50 минут в водяной бане при 37°C перед перепрограммированием, однако это не является необходимым для эффектов перепрограммирования экстрактов зародышей или эмбрионов рыб. После инкубирования с SLO, клетки промывают в охлажденном на льду HBSS, центрифугируют и излишек удаляют из осадка. Клетки ресуспендируют в 100 мкл экстракта на 100000 клеток и инкубируют в течение 1 часа при 37°C в водяной бане. Приблизительно 100000 клеток высевают в лунки с полной средой по выбору. Если нарушение проницаемости с SLO было проведено, клетки культивируют в средах с 2 мМ CaCl2 в течение 2 часов после перепрограммирования, чтобы повторно уплотнить клеточные мембраны. Среды должны быть заменены спустя 2-12 часов после перепрограммирования. Чтобы определить степень изменения проницаемости посредством SLO, используют эпифлуоресцентную микроскопию клеток, выдержанных в течение 50 мин в растворе SLO 0 или 100 нг/мл с 50 мкг/мл декстрана, конъюгированного с красным Алексия (молекулярная масса декстрана 10000 или 70000), чтобы подтвердить изменение проницаемости и повторное уплотнение.
Клетки культивируют в лунках до пролиферации, позволяющей разведение в большие сосуды. Разводить клетки в зависимости от типа клеток, но не позволяя им становиться конфлюэнтными. Осадки для генного анализа следует собирать еженедельно и оценивать морфологию микроскопией фазового контраста при каждом пересеве. Клетки можно культивировать так долго, как необходимо, но чтобы оценить сохраняющиеся эффекты перепрограммирования, 40 дней составляют предполагаемый минимум.
Дополнительно, клетки можно перепрограммировать выдерживанием в средах, усовершенствованных экстрактами зародышей или эмбрионов рыб. Клетки перепрограммируют добавлением 0,4% экстракта к нормальной полной среде (10% FCS) или минимальной среде (0,5% FCS). Выбранные клетки выращивают до 50% конфлюэнтности, и нормальную среду заменяют полной средой или минимальной средой содержащей 0,4% экстракта. Разводить клетки в зависимости от необходимости средами, содержащими экстракт. Свежая среда с экстрактами должна быть добавлена к клеткам по меньшей мере дважды в неделю при разбавлении клеток менее чем два раза в неделю. Осадки для генного анализа следует собирать еженедельно и оценивать морфологию микроскопией фазового контраста при каждом пересеве. Клетки можно культивировать так долго, как необходимо, но чтобы оценить сохраняющиеся эффекты перепрограммирования, 40 дней составляют предполагаемый минимум.
При следовании приведенным выше протоколам, клетки, перепрограммированные с экстрактами зародышей рыб или эмбриональными экстрактами полосатого данио, или выращенные на средах с добавлением экстрактов, собирали и выделяли РНК. Перепрограммированные или нормальные клетки 293T инкубировали в полных средах (RPMI-1640 с 10% FCS) c/без экстрактов (0,2%), или в минимальных средах (RPMI-1640 с 0,5% FCS) с/без экстрактов. Для изучения активации и понижающей регуляции генов маркеров дифференцировки была выполнена ОТ-ПЦР в реальном времени. Спустя 7 дней наблюдали четко выраженную активацию гена OCT 4 в обработанных экстрактом клетках, и изменения все еще наблюдают спустя 17 дней. Экспрессию гена рассчитывали с конститутивным геном GAPDH в качестве стандарта экспрессии гена и ее можно увидеть в Таблицах 1 и 2. Значения представляют возрастание экспрессии гена в обработанных клетках относительно необработанных клеток, выращенных в нормальной среде. Приведенные значения даны для клеток обрабатываемых в течение 17 дней, 17 дней после перепрограммирования.
Результаты показывают активировацию (от 18 до 100 раз) гена OCT-4 во всех клетках, обработанных экстрактами по сравнению с необработанными клетками. Изменения в экспрессии гена NANOG более умеренные, с активацией, варьирующейся от никакой до 5 раз. Для экспрессии гена SOX2, наблюдаемая активация варьируется от 2 до 8 раз по отношению к базисной.
В клетках, выращиваемых с недостаточным питанием без экстрактов, все гены OCT4, NANOG и SOX2 были с отрицательной регуляцией (0,2-0,6 раз от нормальных клеток 293Τ, выращенных в нормальной среде). Добавление 0,2% экстракта к минимальным средам восстанавливает параметры экспрессии гена и активирует экспрессию гена OCT4 от 5 до 13 раз по отношению к экспрессии нормальных клеток 293Τ - и активации приблизительно в 100 раз от необработанных, выращиваемых с недостаточным питанием клеток 293T. Аналогичного не наблюдают для экспрессии гена NANOG, где не освобождаются от эффекта отрицательной регуляции от недостаточного питания. Для экспрессии гена SOX2 восстановление аналогично тому, что наблюдают в OCT4, хотя не такой заметный (до 4-кратной активации). В этих экспериментах экстракты зародышей лосося по-видимому обеспечивали наибольшее восстановление и активацию генов, связанных с дифференциацией.
Повторение этих экспериментов по перепрограммированию в трех параллелях давало результаты, подтверждающие, что экстракты зародышей лосося активируют гены, связанные с дифференцировкой, указывая на увеличенную "стволовитость" клеток 293T.
Перепрограммирование проводили тремя различными способами:
1. Перепрограммирование, как описано в способах, за которыми следует нормальная клеточная культура;
2. Перепрограммирование, как описано, с последующей культурой в средах, дополненных 0,4% экстрактом зародышей лосося (аналогичным использованному в перепрограммировании); и
3. Нормальные клетки не перепрограммированы, культивированы в среде, дополненной 0,4% экстрактом зародышей лосося (аналогичным использованному в перепрограммировании).
Все эти способы приводили к изменениям в морфологии и экспрессии генов в клетках, но на разных уровнях и возникающих в различные периоды. Изменения в экспрессии гена наблюдают в то же время, в которое наблюдаются и морфологические изменения, различающиеся от 5 дня после перепрограммирования до 28 дня после перепрограммирования. По-видимому, это зависит от использованного способа: перепрограммирование (способы 1 и 2) может давать более быстрые изменения, чем неперепрограммирование и культивирование в дополненных средах (способ 2).
Перепрограммированные клетки с морфологическими изменениями и изменениями экспрессии генов, как показано ниже, дополнительно метили антителами к OCT4 и NANOG и визуализировали с помощью флуоресценции вторичных антител в конфокальном микроскопе, чтобы подтвердить возросшую экспрессию этих генов.
Результаты примеров показаны ниже в таблицах 3 и 4, где цифры представляют кратность активации или отрицательного регулирования связанных с дедифференцировкой генов OCT4, NANOG и SOX2 по сравнению с нормальными клетками 293T. Цифры ниже единицы означают понижающую регуляцию, и цифры, превышающие единицу, означают активацию. Большие эффекты активации отмечают в таблице голубым. Активация происходит в день ASC, обозначает стволовые клетки жировой ткани, только несущественные изменения в экспрессии генов могут быть выявлены. Это согласуется с экспериментами, проведенными с различными экстрактами (неопубликованные наблюдения, Taranger et al., 2006).
Представленные в настоящем документе исследования предоставляют надлежащие протоколы для получения экстрактов зародышей рыб, определение характеристик и тесты на токсичность таких экстрактов, протоколы для перепрограммирования клеток с экстрактами, а также результаты изменений, вызванных экстрактами в клетках. Результаты включают морфологические изменения, представленные как микроскопические изображения, а также изменения в экспрессии генов в обработанных клетках, представленные в виде данных анализа ПЦР в реальном времени.
Перепрограммирование клеток 293T провели 17 раз независимо, с изменениями в морфологии, обнаруженными в 12 из 17 перепрограммирований. Изменения в экспрессии генов были обнаружены в 8 из 12 изученных (анализ экспрессии генов для перепрограммирований все еще в работе). Изменения в морфологии коррелировали с изменениями в экспрессии генов, т.е. изменения в морфологии происходят в то же время, что и изменения в экспрессии генов в клетках, и это подтверждено иммунофлуоресцентным мечением различающихся генов в перепрограммированных клетках. Перепрограммирование стволовых клеток жировой ткани провели 6 раз и морфологические изменения наблюдали только в 1 из них. Только незначительные изменения в изменениях экспрессии генов в этих перепрограммированных клетках можно обнаружить.
Пример 9
Морфологические изменения в клетках, подвергнутых действию экстрактов
Морфология клеток, перепрограммированных с экстрактами зародышей лосося или экстрактами эмбрионов полосатого данио, изменяется спустя приблизительно 3 дня. Клетки 293T становятся округлыми, и некоторые популяции клеток начинают расти в сферах, подобных бластеме. Эти изменения являются устойчивыми и могут наблюдаться до 21 дня (эксперимент завершился), несмотря на то, что при некоторых условиях эти изменения, по-видимому, возвращаются к нормальной морфологии 293T через 2 недели. На культуре нормальных клеток 293T с экстрактом, добавленным к нормальным средам (RPMI-1640 с 10%FCS и 0,2% экстракта), можно наблюдать изменения морфологии, аналогичные тем, которые наблюдали для перепрограммированных клеток, культивированных в нормальных средах. Кроме того, клетки, культивируемые с экстрактами зародышей лосося в особенности, имели увеличенную скорость роста по сравнению с нормальными клетками. При голодании клеток (RPMI-1640 с 0,5% FCS) скорость роста значительно уменьшается для не обработанных экстрактами клеток (не показано), и морфология клеток слегка изменяется. Для роста голодных клеток с экстрактами (0,2% экстракта в минимальной среде) изменения являются более явными. В этом случае, большинство популяций клеток растет в сферах подобных бластомерам, и сферы отделяются от сосуда для культивирования и плавают в средах, где они продолжают расти. Примечательно, что замедление скорости роста обратимо в клетках культивируемых с экстрактом, добавленным к минимальной среде.
Успешные перепрограммированные клетки обычно растут в больших скоплениях (диаметр > 2 мм), видимых в сосудах для клеток невооруженным глазом.
Пример 10
Изменения в параметрах роста в клетках, культивированных с экстрактами
500000 клеток 293T засеивали в чашки для культивирования среднего размера и инкубировали в нормальных средах, или средах с добавлением экстракта, или минимальных сред. Клетки собирали через 24, 41 и 68 часов, считали и вычисляли скорости роста. Результаты представлены в таблицах 5 и 6.
Изменения скорости роста обнаружены в случаях клеток, ограничиваемых в питании, рост много медленнее, чем у клеток в нормальных средах на всем протяжении исследования. Этот эффект снимается добавлением сред зародышей лосося спустя 48 часов культивирования. Клетки, выращенные в нормальных средах с эмбриональным экстрактом полосатого данио и экстрактом зародышей лосося, растут быстрее всех клеток во время первых 24 часов. См. фигуры 1-3.
Пример 11
Улучшенное заживление ран с экстрактами зародышей лосося
Цель исследования: Исследовать действия полученного экстракта зародышей лосося на заживление ран на коже мышей.
Способы:
Краткое изложение: На спинной коже мышей создавали раны двух типов. Отрезные раны диаметром 1 см создали на левой стороне спины каждой мыши (n=12, повторенные 3x), и разрезные раны длинной 2 см создавали на правой стороне спины параллельно позвоночнику. Половину мышей (выбраны случайным образом) обрабатывали с использованием 30 мкл экстракта зародышей лосося после создания раны и каждые 3 дня в течение 12 дней. Контрольная группа не получала лечения. На раны всех мышей (обработанные и контроли) распыляли жидкий лейкопластырь в 1 день в одном из трех повторов, но это не оказывало воздействия на различия, обнаруженные между контролем и обработанными мышами, как наблюдали во всех трех экспериментах (с/без распыляемой повязки).
В каждом эксперименте мышей разделяли на 3 клетки, каждая с 2 контролями и 2 обработанными животными. Процесс заживления ран наблюдали в течение 12 дней с проведением измерений, включая площади ран, дни до полного заживления (реэпителизация и отпадание корки) и размера результирующего рубца. Биопсии брали в день 1 и день 12 для дальнейшего анализа, и раны регулярно фотографировали для документирования процесса заживления.
Материалы:
Мыши: самцы альбиносы A/J или NMRI.
Этанол для стерилизации кожи перед созданием ран.
Малые хирургические ножницы и микроножницы, лезвия скальпелей и щипцы.
Зародышевый экстракт лосося, партия LE4, полученная, как описано выше.
Изофлурановый газ: FORENE Isofluran Vnr 506949, lot 22397VA, exp 2009-10 (Abbott, Сольна, Швеция).
Испаритель: Datex-Ohmeda Isotec 5
Жидкий азот для образцов биопсии.
4% PFA (в PBS) для образцов биопсии.
Цифровая камера для получения изображений ран и кожи во время излечения.
Круглый шаблон диаметром 1 см для маркировки размера ран у животных.
Схема исследования:
Животные. Здоровых инбредных самцов мышей NMR1 или A/J (раздельные исследования), весом между 25 г и 35 г получали из вивария Национального института Здравоохранение, Осло, Норвегия. Мышей акклиматизировали в течение недели перед экспериментами, и содержали в полипропиленовых клетках на нормальной еде и воде в неограниченном количестве, и метили на ушах (1-4 в каждой клетке) за одну неделю до начала экспериментов. Животных периодически взвешивали перед и после экспериментов. Мышей анестезировали до причинения экспериментальных ран. Хирургические вмешательства выполняли при стерильных условиях, используя изофлурановый газ (кислород + изофлуран, смешанные в испарителе). Животных тщательно осматривали на предмет любых инфекций; тех, которые показывали признаки инфекций, отделяли и исключали из исследования. Исследования на острую токсичность для экстрактов проводили, как описано в других местах в этом патенте. Исследование было одобрено Комитетом по Этике Норвегии.
Активность по заживлению ран. Модели иссеченных и разрезных ран использовали для оценки ранозаживляющей активности экстрактов зародышей лосося. Каждое животное получило иссеченную рану на правой стороне спины, и разрезную рану на левой стороне спины. Раны создавали в день 1 и исследование заканчивали в день 12.
Иссеченные и разрезные раны. Каждой мыши причиняли одну иссеченную рану (Morton JJP, Malone MH. Evaluation of vulnerary activity by an open wound procedure in rats. Arch Int Pharmacodyn. 1972; 196:117-126) и одну разрезную рану (Ehrlich HP, Hunt TK. Effect of cortisone и vitamin A on wound healing. Ann Surg. 1968; 167:324-328). Мышей анестезировали перед созданием ран изофлурановым газом (маской, детали системы ниже). Спинной мех животных сбривали электрической машинкой для стрижки волос и очерчивали площадь иссеченной раны на левой стороне спины животных с помощью водостойкого, долговечного маркера. Иссеченная рана шириной в 1 см (площадь круга = 0,785 см2) полной толщины кожи (прибл. 1 мм) создавали вдоль маркировки, используя зубчатый пинцет, лезвие для скальпеля и указанные ножницы, всю рану оставляли открытой. На правой стороне хребта делали продольный паравертебральный разрез длинной 2 см через кожу и подкожные ткани спины. Группы экспериментальных животных обрабатывали водными экстрактами зародышей лосося (30 мкл), местно применяя к ране на каждый третий день. Раны контрольной группы оставляли необработанными.
Исследованные параметры представляли собой закрытые раны, размер раны, размер рубца, время эпителизации, и гистология (морфологические параметры кожи). Измерения площадей ран модели иссеченной раны проводили на 1-й, 5-й, 9-й и 12-й день, следуя за изначальной раной, используя прозрачную бумагу и устойчивый маркер. Раны каждой мыши фотографировали ежедневно цифровой камерой (см. детали ниже). Период эпителизации рассчитывали, как число дней, необходимых для того, чтобы раны освободились от корки.
Биопсии. В день 1, кожу, вырезанную при создании иссеченной раны, сохраняли как биопсию нормальной кожи, давая возможность каждому животному быть своим собственным контролем в дальнейшем анализе биопсии. Половину биопсии фиксировали в 4% PFA, другую быстро замораживали в жидком азоте. В модели иссеченных и разрезных ран, грануляционную ткань, образованную на ране, вырезали на 12-й послеоперационный день, после умерщвления животного смещением шейных позвонков или газом CO2. Иссеченные и резаные раны хирургически удаляли вместе с маркировкой изначального создания ран. Половину биопсии фиксировали в 4% PFA, другую быстро замораживали в жидком азоте для дальнейшего анализа.
Гистопатологический анализ биопсий. Половина зажившей ткани, полученной на 12-й день от всех животных в модели иссеченных и резаных ран, фиксировали в параформальдегиде (4% фосфатно-солевом буфере) в течение 2 часов при комнатной температуре и хранили при 4 градусах Цельсия, сделав срезы в криостате антипараллельно поверхности кожи. Срезы окрашивали H&E и параметры рубца, включая толщину грануляционной ткани, измеряли в микроскопе.
Была проведена стандартная процедура окрашивания H&E. В кратком изложении, срезы в криостате биопсии кожи мыши толщиной 10 мкм (на предметных стеклах SuperFrost Plus) регидратировали (от абсолютного через 96% и 70% этанол) перед окрашиванием гематоксилином (7 мин) (Sigma 51275 ГЕМАТОКСИЛИН РАСТВОР ACC. TO MAYER), промывали в проточной воде (5 мин), окрашивали эозином (1 мин) (Sigma HT110116 ЭОЗИН Υ СПИРТОВОЙ РАСТВОР), быстро промывали в воде и дегидратировали (из 70% через 96% в абсолютный этанол с последующими 2×5 мин в ксилол). Срезы монтировали прямо из ксилола с помощью Eukitt (Sigma 03989-100ML EUKITT(R) QUICK-HARDENING MOUNTING ME-DI).
Окрашенные H&E срезы биопсии кожи мыши, взятые на 1 день (по времени создания раны) и 12 день (после заживления) от репрезентативных обработанных и контрольных животных, исследовали в световом микроскопе, были сделаны цифровые снимки с 4x, 10x, 20x и 40x объективами и по цифровым изображениям измерены толщина кожи и параметры рубца.
Иммунное мечение криостатных срезов биопсий кожи мыши. Срезы биопсий иссеченных ран, взятых в день 1 и день 12 у репрезентативных обработанных и необработанных контролей, были дважды иммунно мечены, как описано ранее (Boulland et al. Expression of the vesicular glutamate transporters during development indicates the widespread corelease of multiple neurotransmitters. J Comp Neurol. 2004 Dec 13;480(3):264-80), антителами против или NANOG (поликлональные кроличьи, Abсam) и кальбиндином (мышиным, Abсam), или OCT3/4 (поликлональные кроличьи, Santa Cruz) и калретинином (козла, Chemicon), чтобы найти увеличенную экспрессию стволовых клеток (как показано присутствием NANOG и OCT3/4) в заживленных ранах.
РЕЗУЛЬТАТЫ
Скорости заживления ран, обработанных экстрактом зародышей лосося, сравниваемые с необработанными контролями.
Внешний вид обработанных и необработанных ран кожи. Результаты показывают более быстрое заживление ран у обработанных экстрактом животных (изображения не показаны), со значительными различиями на дни 9 и 12. Кроме того, размеры ран уменьшались более быстро у леченых экстрактом животных, со значительными различиями на дни 5 и 9. См. фиг.4.
Окрашенные гематоксилином-эозином биопсии кожи для гистологического исследования (погруженные в парафин или криостатные срезы). Были получены криостатные срезы биопсий, взятых из кожи, удаленной для формирования иссеченной раны, в день один и сравнительные биопсии той же области, взятые в день 12 от 6 животных, окрашены H&E, получены и проанализированы изображения через микроскоп. Морфологически, срезы биопсий нормальной кожи из дня 1 групп контрольных и обработанных животных были аналогичны, с равными измеренными параметрами кожи. В день 12, ткань рубца, в частности организация коллагена, представлялась более дезорганизованной у контрольных животных в сравнении с обработанными экстрактом животными.
Измерения (среднее из 3 независимых измерений на срезах) были получены следующим образом: Толщину эпидермиса измеряли от зародышевого слоя (безальных кератиноцитов) до рогового слоя. Толщину дермы измеряли от ниже зародышевого слоя до субкутиса (жировой ткани ниже дермы). Общую толщину кожи измеряли как объединенную толщину эпидермиса и дермы. Диаметр рубца в день 12 измеряли между выступами заживления ран на каждой стороне ткани рубца, и сравнивали с диаметром иссеченной раны в день 1 (1 см). Расстояние между волосяными мешочками измеряли между центрами волосяных бугорков прилегающих волос (близкими к рубцу в день 12).
Измерения показывают, что существует незначительный разброс в толщине рубца, диаметре, толщине эпидермиса и дермы в леченых животных в сравнении с необработанными контролями. Животные, обработанные экстрактом, показывали более нормальную толщину эпидермиса (ближе к толщине эпидермиса, измеренной у тех же животных в день 1), и расстояние между вновь образованными волосяными мешочками, ближайшими к рубцу, были более равномерно распределены (в большей степени аналогично распределению волосяных мешочков в нормальной коже в день 1), тогда как волосяные мешочки излеченной кожи у контрольных животных были в большей степени не организованы и распределены с меньшим расстоянием между волосяными мешочками в сравнении с нормальной кожей.
Таким образом, данные показывают, что животные, обработанные экстрактом, имеют на 41% более тонкий рубец (общая толщина кожи в центре рубца) по сравнению с необработанными контролями, и вновь сформировавшийся эпителий в здоровой коже является на 148% тоньше, и новый дермис на 7% тоньше у обработанных животных в сравнении с необработанными контролями. Дополнительно расстояние между волосяными мешочками волос составляет на 16% ближе к дооперационному расстоянию у обработанных животных по сравнению с необработанными контролями.
Иммунное мечение криостатных срезов биопсий мышиной кожи. Срезы биопсий иссеченных ран, взятых в день 1 и день 12 у репрезентативных обработанных экстрактом и необработанных контролей, были дважды иммунно мечены, как описано ранее (Boulland et al.), антителами против или NANOG (поликлональные кроличьи, Abсam) и кальбиндином (мышиным, Abсam), или OCT3/4 (поликлональные кроличьи, Santa Cruz) и калретинином (козла, Chemicon), чтобы найти увеличенную экспрессию стволовых клеток (как показано присутствием NANOG и OCT3/4) в заживленных ранах.
OCT3/4 представляет собой маркер эмбриональных и других стволовых клеток, находится преимущественно в ядрах. Окрашивание OCT4 (зеленый) было обнаружено в базальном слое эпидермиса (пролиферирующие кератиноциты) (новое открытие). Интерфолликулярные кератиноциты в культуре были предварительно трансфецированы OCT-4, что привело к возросшей экспрессии Sox-2, Nanog, Uft1 и Rex-1.
Экспрессия NANOG часто следует за экспрессией OCT4 в стволовых клетках. Мечение NANOG было обнаружено в основаниях волосяных мешочков (волосяные стволовые клетки), а также в мигрирующих клетках вдоль гребня заживления ран в день 12 (новое открытие).
КАЛЬРЕТИНИН представляет собой кальций-связывающий белок, как показано, присутствует в слое клеток спутников волосяного фолликула человека. Окрашивание кальретинина обнаружено, как предполагалось, вдоль волосяного стержня.
КАЛБИНДИН обнаруживают в ядрах и цитоплазме эпидермальных кератиноцитов (больше в ядрах, чем в цитоплазме). При ранении уровни калбиндина в ядрах падают в течение приблизительно 10 дней после ранения. Окрашивание калбиндина обнаруживали в кератиноцитах (эпидермис и слои вокруг волосяного стержня).
При анализе с использованием Z-stack и трансформации Фурье c конфокальным микроскопом можно увидеть различие между обработанными ранами и необработанными контролями.
Пример 12
Перепрограммирование фибробластов кожи человека и клеток HEK
Субкультура клеток hsF (фибробласты кожи человека).
Полная среда для hsF
500 мл DMEM F-12 (+ Glutamax)
50 мл (10%) FCS (эмбриональная телячья сыворотка - инактивированием нагреванием)
5 мл (1%) ПенСтреп
Минимальная среда для hsF:
500 мл DMEM F-12 (+ Glutamax)
5 мл (1%) ПенСтреп
Культивировали клетки в больших колбах (162 см2) - до 1 миллиона клеток на большой сосуд при конфлюэнтности, или в покровных стеклах в лунках для перепрограммирования (использованные клетки hsF получены из ACCT).
Субкультивирование hsF:
1. Промывали слой клеток дважды 10-15 мл PBS для удаления всех остатков сыворотки.
2. Добавили 2 мл раствора трипсин-ЭДТА до диспергирования слоя клеток (5 - 7 минут).
3. Добавили минимум 4 мл среды и отсосали клетки аккуратными действиями пипеткой.
4. Отношение пересева 1:2 - 1:4; добавили 2-3 мл клеточной суспензии в сосуд и свежих сред до общего объема 25 мл. Пересаживали клетки 1:2 до 1:4 каждые 2 -3 дня, например 1:4 дважды в неделю.
Замораживание клеточного осадка:
1. Приготовили свежую среду для замораживания:
a. Нормальные среды с 20% FCS и 10% DMSO
2. Следовали вышеприведенному протоколу (субкультивирование) до пункта 3; затем
3. Перенести клетки в пробирку Nunc 50 мл и крутили при 300 g (1500 об/мин), 10 мин, 4°C.
4. Ресуспендировали клетки до 1 миллиона на 1 мл среды для замораживания и разделит на аликвоты по 1 мл в криопробирки Nunc.
5. Заморозили клетки в Mr. Frosty-box с изопропанолом при -80°C в течение ночи (- 1°C/мин).
6. Перенесли в емкость с азотом.
Приготовление клеточного осадка для выделения РНК:
Следовали протоколу для субкультивирования до пункта 3; затем
1. Перенесли клетки в пробирку Nunc 50 мл и крутить при 300 g (1500 об/мин), 10 мин, 4°C.
2. Промыть клетки в одном мл охлажденного на льду PBS на миллион клеток и крутить (300 g, 10 мин 4°C).
3. Ресуспендировали осадок в том же количестве PBS и добавить 1 мл в пробирку Эппендорфа для осадков для РНК.
4. Крутили при 300 × g 10, при 4°C.
5. Аспирировали PBS.
6. Держали клеточный осадок на льду и быстро заморозили в жидком N2.
7. Переносили в морозильник -80°C.
Перепрограммирование hsF на покровных стеклах, включая SLO
Цель: перепрограммировали клетки с безъядерным экстрактом, чтобы изменить экспрессию генов, морфологию и элементы роста и изучили изменения в состоянии дифференцировки.
Материалы: клетки hsF, выращенные в 24-луночном планшете на покровных стеклах (приблизительно 100000 клеток засевают на лунку в минимальной среде прибл. 5 днями ранее и приблизительно 50000 клеток на лунку в нормальных средах приблизительно 3 днями ранее); Экстракт (лососевый зародышевый экстракт); инкубирование в средах для контроля; 1xPBS; Сбалансированный солевой раствор Хенка (HBSS) без Ca2+ при 4°C; TE для снятия клеток из колбы; исходный раствор SLO 100 мкг/мл, разведенный 1:100 в HBSS; АТФ (200 мМ исходный раствор в воде); GTP (10 мМ исходный раствор в воде); креатинфосфат (2M исходный раствор в воде); креатинкиназа (5 мг/мл исходный раствор в воде); автоклавированная вода MQ; водяная баня на 37°C; CaCl2 (2 мМ) обогащенная среда: 100 мM CaCl2 исходный раствор приготовленных смешиванием 1,67 г CaCl2 с 15 мл дистиллированной воды и стерильной фильтрацией. 2 мМ концентрацию CaCl2 получают, например смешиванием 50 мкл 100 мМ CaCl2 с 2450 мкл среды для перепрограммирования.
Способ: промывали клетки дважды в охлажденном на льду 1xPBS (1 мл). Клетки промывали дважды в охлажденном на льду HBSS (1 мл). Предварительно нагревали образцы в инкубаторе, 37°C, 2-3 мин и удалить HBSS. Добавить 110 мкл HBSS и 90 мкл SLO (до конечной концентрации SLO 450 нг/мл) и смешали. Добавляли 200 мкл HBSS к контрольным лункам без SLO. Инкубировали в инкубаторе 30 мин, наклоняли планшет каждые 10 мин. Удаляли SLO (сохранить одну параллель, где SLO остается в лунке). Приготовили экстракт для программирования: Одна реакция перепрограммирования содержит 250 мкл экстракта (до 50-100 тысяч клеток). Приготовили систему генерирования АТФ, хранили на льду: смешали АТФ, GTP, креатинкиназу, креатинфосфат в соотношении 1:1:1:1, хранили на льду. Добавили 12,5 мкл системы генерирующей АТФ на реакцию к экстракту. Добавили 250 мкл лососевого зародышевого экстракта (с системой генерирования АТФ). Убедились, что экстракт закрывает клетки на покровном стекле. Смешали наклонами планшета. Инкубировали в инкубаторе 60 мин, наклоняли планшет каждые 10 мин. Аспирировали экстракт (200 мкл) и добавили обогащенную Ca среду в каждую лунку (приблизительно 1500 мкл). Ингибировали в течение 2 ч. Проверили в микроскопе, что клетки прикреплены к покровным стеклам. Если ток, удаляли содержащую Ca среду и добавляли полную среду (прибл 500 мкл). Инкубировали 37°C, 5% CO2. Определить клетки в 24 часовой культуре.
Микроскопия фазового контраста. Разводили клетки перед достижением конфлюэнтности. Покровные стекла переносили в новые лунки через один день после перепрограммирования, и некоторые покровные стекла обрабатывали трипсином, чтобы переместить в малые бутылки. Так как клетки не отделялись, в бутылки перемещали целые покровные стекла.
Результаты - перепрограммирование hsF
Эксперименты по перепрограммированию RPE (минимальные среды) и RPF (нормальные среды).
Изменения в экспрессии генов:
Морфологические изменения клеток
После перепрограммирования, клеточные культуры оценивали микроскопией фазового контраста и сравнивали с нормальными клетками.
Через одни день после перепрограммирования, популяция выживших клеток была сходна с нормальными клетками hSF, тогда как часть популяции клеток показывала измененную морфологию. Эти клетки оказывались длиннее/более растянутые, чем нормальные клетки и некоторые (особенно такие клетки из минимальных сред) продемонстрировали округлые везикулы/тела в цитоплазме. Из минимальных сред выжило больше клеток, чем из нормальных сред.
С 12 по 22 день после перепрограммирования (эксперимент завершили на 22 день) клетки, которые все еще были прикреплены к покровному стеклу, показывали необычное морфологическое строение с большими и более отчетливыми ядрами, обладающими тонкими "ответвлениям"/"отростками", и клетки, имеющие отличную от нормальных клеток форму. Часть популяции клеток (в основном клеток, выросших в условиях недостаточного питания) все еще имела округлые визикулы/тела внутри цитоплазмы. Так как полное перепрограммирование всех клеток в каждом эксперименте не ожидалось (Taranger et al., 2005), части популяций клеток, показывающие измененное морфологическое строение, возможно представляли перепрограммированные клетки, которые представляли собой ответственные за изменения в экспрессии генов, обнаруженное ПЦП реального времени.
Иммунофлуоресценция
Клетки были фиксированы на покровных стеклах на 7 день после перепрограммирования. Иммунофлуоресцентное мечение проводили в основном, как описано ранее, для срезов тканей (Boulland et al., 2004). В кратком изложении, клетки, выросшие на покровных стеклах, фиксировали 4% PFA (30 мин при комнатной температуре), промывали в PBS, блокировали 1M этаноламином, промывали в 3×PBS, преинкубировали в растворе для блокирования (1 ч, комнатная температура), инкубировали с первичными антителами против OCT 3/4 (Santa Cruz) (1:200) в растворе для инкубирования (3 ч, комнатная температура), промывали в 3×PBS и инкубировали с флуоресцентно меченными вторичными антителами Alexa 488 (1:2000) (Molecular Probes) (1 ч, комнатная температура) и окончательно промывали в 3xPBS. Для окрашивания ядер, DAPI (1:1000) добавляли ко второму последнему промыванию. Покровные стекла монтировали с использованием реагента, препятствующего затуханию флуоресценции ProLong Gold (Molecular Probes), и изображения регистрировали с помощью флуоресцентного микроскопа (Olympus) или конфокального микроскопа (Zeiss).
Окрашивание OCT4 наблюдали в цитоплазме большинства клеток, более сильное мечение наблюдали в перепрограммированных клетках по сравнению с нормальным контролем, который показал очень слабое окрашивание. Окрашивание красителями Hoechst наблюдали в ядрах нормальных клеток, дополнительно перекрывающееся с окрашиванием OCT4 в цитоплазме перепрограммированных клеток. Клетки определяли на инфекции, чтобы убедиться, что цитоплазматическое окрашивание Hoechst не вызвано микоплазмой вместо реальной экспрессии перепрограммирования.
Субкультура клеток HEKa (взрослые эпидермальные кератиноциты человека)
Системы культуры кератиноцитов из Cascade Biologics
СИСТЕМЫ УВЕЛИЧЕНИЯ ПРОДОЛЖИТЕЛЬНОСТИ ЖИЗНИ
После репрограммирования: 1 мл гентамицин/амфотерицин (GA). Культивировали клетки в 75 см2 культуральных колбах - приблизительно 10 миллионов клеток при конфлюэнтности.
Субкультивирование клеток HEKa
1. Быстро промывали клетки 3 мл Трипсин/ЭДТА.
2. Добавили 1 мл свежего Трипсин/ЭДТА и инкубировали до диспергирования клеток (8-10 минут).
3. Добавили 3 мл раствора нейтрализатора трипсина и перенесли клетки в стерильные пробирки 15 мл. Повторили с дополнительными 3 мл дополнительного нейтрализатора трипсина.
4. Центрифугировали при 180 × g в течение 7 минут.
5. Ресуспендировали клеточный осадок и засеяли новый культуральный сосуд с 2,5×103 клеток/см2.
6. Сменили среды на клетках через 48 часов.
7. Сменяли среду через день до достижения культурой приблизительно 50% конфлюэнтности.
8. Сменять среду каждый день до достижения культурой приблизительно 80% конфлюэнтности.
Замораживание клеточного осадка:
7. Приготовили свежую среду для замораживания:
a. Нормальные среды с 10% PCS и 10% DMSO.
8. Следовали вышеприведенному протоколу (субкультивирование) до пункта 3; затем
9. Промыли клетки PBS (180×g, 7 мин).
10. Ресуспендировали клетки до 1 миллиона на 1 мл среды для замораживания и разделили на аликвоты по 1 мл в криопробирки Nunc.
11. Заморозили клетки в Mr. Frosty-box с изопропанолом при -80°C в течение ночи (-1°C/мин).
12. Перенесли в емкость с азотом.
Приготовление клеточного осадка для выделения РНК
Следовали протоколу для субкультивирования до пункта 4; затем
8 Ресуспендировали клетки до 1 миллиона на 1 мл PBS и добавить 1 мл в пробирки Эппендорфа для осадков для РНК.
9. Крутить при 300 × g 10, при 4°C.
10. Аспирировали PBS, держали клеточный осадок на льду и быстро заморозили в жидком N2.
11. Перенесли в морозильник -80°C.
Перепрограммирование клеток HEKa (без SLO)
Цель: Перепрограммировали клетки безъядерным экстрактом, чтобы изменить экспрессию генов, морфологическое строение и элементы роста и исследовали изменения в состоянии дифференцировки.
Клетки HEKa, использованные для эксперимента, выращивали в их нормальных средах (EpiLife с HGKS и альтернативно 1% GA [после перепрограммирования]). Репрограммирование "Mock" было проведено, как контроль (клетки подвергли процедуре перепрограммирования в нормальной среде без добавленного экстракта), и нормальные клетки HEKa культивировали параллельно, как негативный контроль.
293T перепрограммировали в том же эксперименте, также включая одно перепрограммирование mock и 1 колбу нормальных 293T в качестве контроля. 293T растили в их нормальных средах (RPMI с 1% PS).
Материалы: 1 колбу клеток HEK; 1 колбу 293T; экстракт (лососевый зародышевый экстракт); инкубация в средах для контроля; среда RPMI (293T); среда EpiLife (HEK); 1xPBS; балансированный раствор солей Ханка (HBSS) без Ca2+ при 4°C; TE для отделения клеток HEK от колбы; TN (нейтрализующий трипсин) раствор; АТФ (200 мМ исходный раствор в воде); GTP (10 мМ исходный раствор в воде); креатинфосфат (2M исходный раствор в воде); креатинкиназа (5 мг/мл исходный раствор в воде); NTP (25 мМ исходный раствор); автоклавированная вода MQ; колбы 75 см2; пробирки для центрифугирования 15 мл, 1,5 мл охлажденные до 4°C; поворотно-откидной ковшеобразный ротор для пробирок 1,5 мл, и для пробирок 15 мл; водяная баня на 37°C.
Способ:
1. Собрали клетки HEK - промыли с 1 мл TE, аспирировали и инкубировали с 3 мл TE в течение 5-10 мин Перенести клетки в пробирки 15 мл и крутили при 200 × g 10 мин, 4°C (собрали клетки 293T - промыли PBS, добавили 10 мл сред RPMI, сняли клетки и перенести в 50 мл пробирки).
a. Промыли однократно в 30 мл охлажденного на льду PBS и однократно в 10 мл охлажденного на льду HBSS
b. ресуспендировали клетки в концентрации 500000 на 1 мл HBSS
2. Добавили 500000 клеток в каждую пробирку для перепрограммирования
a. центрифугировали 1200 об/мин, 5 мин 4°C в роторе SW
b. Удалили HBSS
3. Приготовили экстракт для перепрограммирования
a. Приготовили систему, генерирующую АТФ, держали на льду: смешали АТФ, ГТФ, креатинкиназу, креатинфосфат в пропорции 1:1:1:1, держать на льду. + 0,5 мМ NTP на реакцию.
b. Добавили 30 мкл системы генерации АТФ на реакцию
4. Добавили экстракт (с АТФ-генерирующей системой), 500 мкл к 500000 клеток в пробирке.
a. Закрыли пробирки парафильмом и инкубировали в течение 60 мин в водяной бане при 37°C. Во время инкубации дважды встряхнуть клетки.
5. Добавили одну пробирку для перепрограммироваиня в колбу со средой.
6. Инкубировали при 37°C, 5% CO2.
Оценили клетки в 24 часовой культуре. Микроскопия фазового контраста. Разводили клетки до достижения конфлюэнтности.
Результат: перепрограммирование HEKa
Эксперимент перепрограммирования RPH
Изменения в экспрессии генов:
Морфологические изменения клеток
После перепрограммирования, клеточные культуры оценивали микроскопией фазового контраста и сравнивали с нормальными клетками.
Меньше клеток, инкубированных с экстрактом, пережило перепрограммирование, чем клеток mock контроля. Некоторые перепрограммированные клетки показывали округлые везикулы/тела внутри цитоплазмы и возможно большие и менее выраженные ядра. Некоторые из клеток показали нетипичную морфологию с маленькими "шипами", похожими на подоциты, выступающие из плазматической мембраны и имеющие отличающуюся общую форму от нормальных клеток.
Иммунофлуоресценция
Клетки были фиксированы на покровных стеклах на 9 день после перепрограммирования. Иммунофлуоресцентное мечение проводили в основном, как описано для клеток hSF.
Клетки HEK метили иммунными метками для OCT4 (те же способы и антитело как для клеток hSF) и ядер, идентифицированных окрашиванием Hoechst через флуоресцентный микроскоп. Нормальные клетки НЕК демонстрировали очень слабое окрашивание ОСТ4 в ядрах, тогда как ядра группы в популяции клеток НЕК, перепрограммированных лососевым зародышевым экстрактом, были очевидно более сильно окрашены ОСТ4, в соответствии с результатами ПЦР в реальном времени, показывающими активацию ОСТ4 в клетках из некоторых перепрограммирований. Окрашивание Hoechst было перекрывающимся с окрашиванием ОСТ4 в ядрах большинства клеток, и окрашивание ОСТ4 было особенно сильным в ядрах перепрограммированных клеток. Отрицательные контроли (в первую очередь пропущенное антитело) показали отсутствие окрашивания ОСТ4, когда ядра были нормально окрашены Hoechst. При наблюдении клеток использовали идентичные параметры для микроскопа и цифровой регистрации изображений. Проведенный компанией Regenics анализ и интерпретация результатов клинического тестирования primo 2010 кремов в Китае, выполненного под контролем компаний l'Onvie и Aqua Skin Science.
Пример 13
В исследовании приняли участие 4 группы по 22 женщины в каждой. Исследование длилось 56 дней, измерения проводились до проведения исследования, а затем на 7, 14, 28 и 56 день. Разработанная компанией l'Onvie сыворотка использовалась ежедневно. Были протестированы четыре различных варианта сыворотки, по одному варианту в каждой группе, со следующим добавленным активным компонентом: группа 1: 5% цитоплазматической фракции икры рыб (LEX); группа 2: 1% LEX; группа 3: активные вещества, разработанные компанией l'Onvie; группа 4: контрольная группа.
ИЗУЧЕННЫЕ ПАРАМЕТРЫ И РЕЗУЛЬТАТЫ:
1. Фотодокументация/визуальное исследование
Согласно протоколу исследований в обязательном порядке была проведена оценка цифровых фотографий, сделанных в анфас, по 4-балльной шкале слепым методом. У некоторых женщин визуально имелось уменьшение морщин вокруг рта, а также сглаживание лба. Результаты для группы, в которой использовали 5% LEX, были впечатляющие. Шероховатость кожи значительно уменьшилась по сравнению с контрольной группой. В соответствии с кривой зависимости доза-ответ (не приведена) с увеличением времени наблюдалось усиление эффекта. Это соответствует исследованиям, демонстрирующим необходимость проведения профилактических мероприятий по меньшей мере в течение 14 дней, но значимый эффект наблюдался уже через 7 дней. По-видимому, эффект связан с усилением продукции коллагена в коже и, вероятно, увеличением количества фибробластов. Кривая доза-ответ согласуется с результатами исследований in vitro, проведенными на клетках фибробластов в культуре, в которых с увеличением времени усиливалась секреция коллагена, которая зависела от концентрации. Таким образом, для получения эффекта на необработанной коже, аналогичного эффекту, полученному на культивируемых клетках, необходима концентрация 2-5%. По предварительной оценке концентрация должна превышать концентрацию, используемую непосредственно для клеток (причем минимальная концентрация для получения эффекта составляет 0,5%), по меньшей мере в 4 раза. Это связано с тем, что не все вещества полностью проникают в кожу из-за более длительной диффузии и ферментативной активности кожи, которая ограничивает доступ активных веществ.
Таким образом, через 56 дней было отмечено 20% уменьшение мелких морщин. При сравнении с препаратами, содержащими ретиноин, не у всех добровольцев наблюдался эффект даже через 56 дней. Изучив необработанные данные по использованию 5% LEX, оказалось, что у 40% наблюдался очень хороший эффект, у 30% - умеренный эффект, а у 30% эффект отсутствовал. Примерно у 45% женщин, использующих крема на основе ретиноина, наблюдается улучшение через 1 год. Поэтому результаты с заявленным препаратом действительно уникальны. Нет другого продукта, протестированного аналогичным образом, который бы обеспечивал такое сильное и значимое улучшение уже через 28 дней, какое наблюдается в случае использования 5% LEX (см. фиг.5).
При использовании 5% LEX уменьшается количество тонких морщин в среднем на 20% через 56 дней. Этот эффект со временем увеличивается по сравнению с 1% LEX в терминах доза-ответ. Средний эффект среди испытуемых в группе, использовавшей 5% LEX, сильно превышает эффект, полученный во всех других группах на всех временных точках. Эффект является значимым по сравнению с контрольной группой на 7, 14 и 28 день. На 56 день отмечается еще более значимый эффект, но при этом в группе наблюдается большее отличие. В некоторых временных точках 5% LEX также значимо лучше активных веществ, разработанных компанией I'Onvie.
Такое различие следует ожидать в том случае, когда испытуемые реагируют аналогично случаю использования ретиноида, только 40% женщин получили хороший эффект после профилактики.
Что касается ретиноида, причина такого результата не ясна, но, вероятно, это связано с тем, что восприимчивость фибробластов является индивидуальной, и, как предполагают, такая восприимчивость может иметь генетическую составляющую. Были отмечены различные эффекты LEX на клеточных линиях, полученных от различных людей, к тому же у некоторых из них наблюдалась более сильная реакция по сравнению с другими испытуемыми. Этот также может быть компонентом, зависящим от возраста.
2. Измерение индекса меланина (MI) проводили с помощью мексаметра: принцип измерения меланина и регистрации эритемы основан на использовании источника света с тремя определенными длинами волн, излучение которых поглощается кожей и диффузно отражается. Фотодетектор анализирует диффузное отражение от кожи. Это дает информацию о микроциркуляции в коже и величине пигментации. Статистические данные показывают, что 5% LEX значимо уменьшает уровень пигментации по сравнению с группой 4 (контрольной) во всех временных точках, и по сравнению с группой 3 на 28 и 56 дни. Группа 2 (1% LEX) имеет значимый эффект по сравнению с контрольной группой на 7, 14 и 56 дни.
Кроме того, имеется дополнительное значимое увеличение эффекта между временными точками в группе 1, которое наблюдается, начиная с 14 дня, по сравнению с 0 днем, и в дальнейшем усиливается. На 56 день эффект является значимым по сравнению с 0 и 7 днями.
3. Индекс эритемы (EI) измеряли с помощью мексаметра, как и для MI. Краснота кожи, показатель микроциркуляции.
Для 5% LEX только в одной группе был отмечен значимый эффект. Значимое улучшение (уменьшение красноты кожи) наблюдалось на 56 день по сравнению с 0, 7 и 14 днями.
Из необработанных данных и графиков можно видеть, что сыворотка (контрольная группа 7) сама может оказывать благоприятное влияние на EI, что усложняет интерпретацию данных, к тому же во всех группах наблюдается некоторое улучшение, хотя сравнение с контролем не проводилось. Даже если это так, LEX имеет значимое положительное влияние на EI в течение времени.
4. L*a*b значения измеряли с помощью спектрофотометра. Это позволяет измерить бледность и прозрачность кожи. Измерение проводилось только на 0, 7 и 14 дни.
Только LEX дал значимое улучшение. По сравнению со всеми другими группами 5% LEX значимо влияет на бледность кожи на 14 день. 1% LEX также дает значимое улучшение на 7 день.
Содержания воды в коже измеряли с помощью корнеометра и себуметра. 5% LEX увеличивает содержание воды в коже значительно лучше по сравнению с 3-мя другими группами во всех временных точках. 1% LEX дает значимые результаты по сравнению с 3-й группой на 28 день.
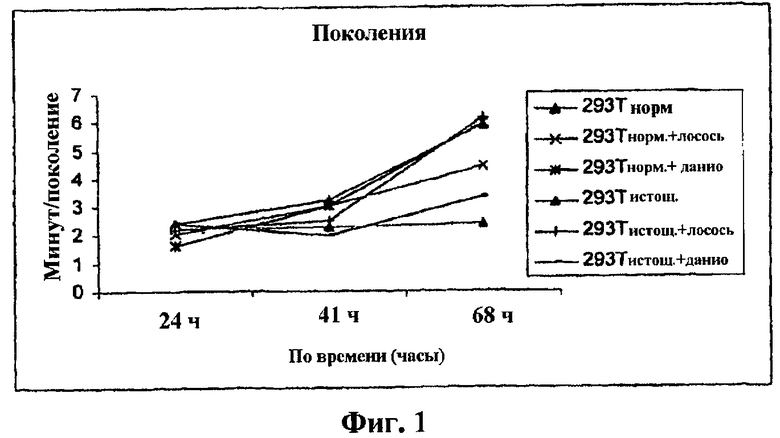
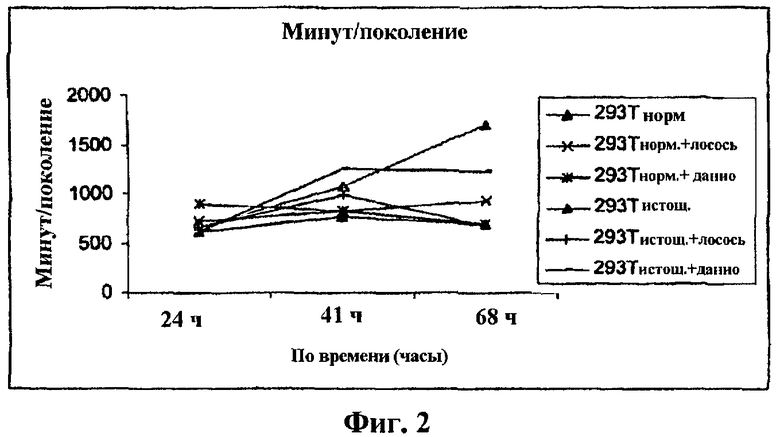
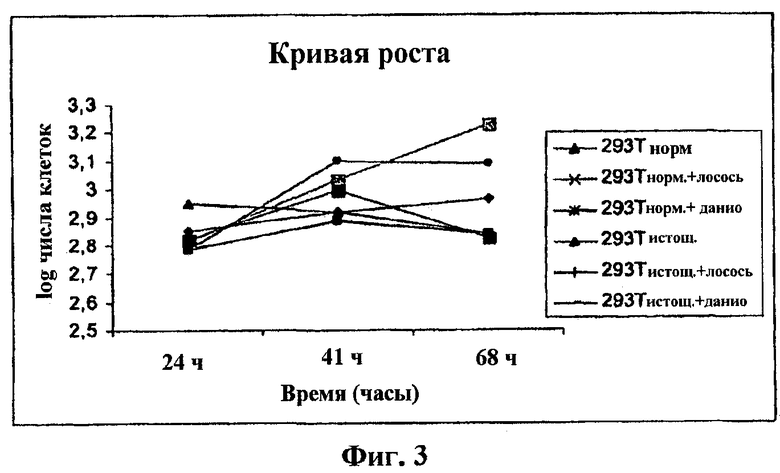
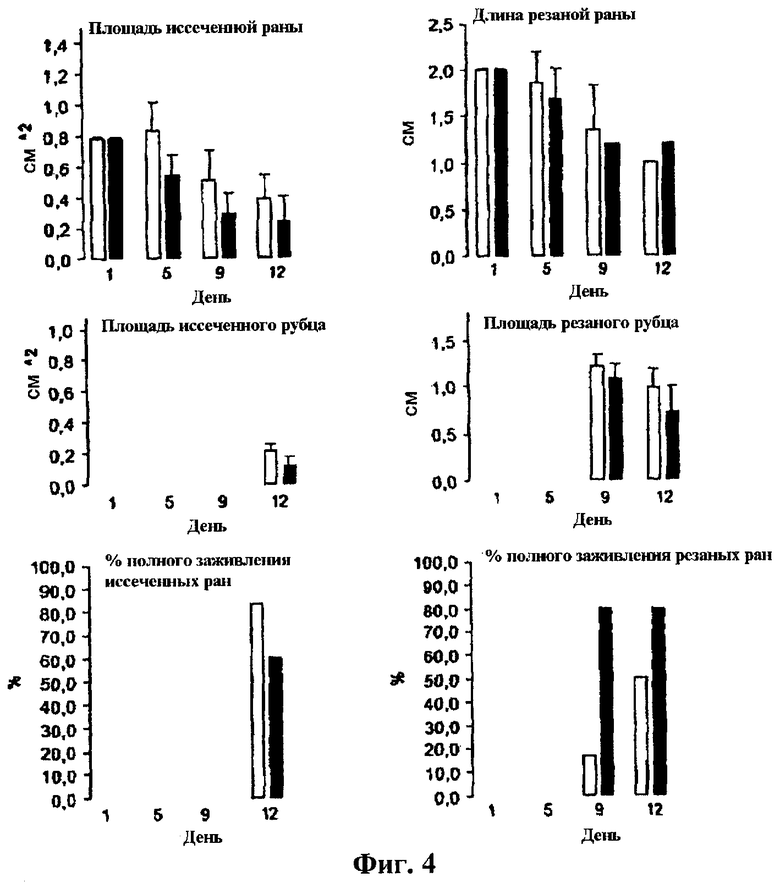
Изобретение относится к косметологии и дерматологии и представляет собой композицию для улучшения здоровья клеток и ткани кожи, содержащую i) выделенную, растворимую в воде фракцию икры рыбы, характеризующуюся содержанием матричной рибонуклеиновой кислоты и белка в количестве 100-380 мг/мл; и ii) липидный компонент из источника, отличного от источника указанной икры рыбы. Изобретение обеспечивает улучшение здоровья клеток и ткани кожи. 8 н. и 17 з.п. ф-лы, 9 табл., 4 ил.
1. Композиция для улучшения здоровья клеток и ткани кожи, содержащая
1) выделенную, растворимую в воде фракцию икры рыбы, характеризующуюся содержанием матричной рибонуклеиновой кислоты и белка в количестве 100-380 мг/мл; и ii) липидного компонента из источника, отличного от источника указанной икры рыбы.
2. Композиция по п.1, дополнительно содержащая эпигенетический ингибитор.
3. Композиция по п.1, где указанная композиция находится в креме, геле, эмульсии, мазе, распыляемом растворе, порошке или лосьоне.
4. Композиция для улучшения здоровья клеток и ткани кожи, содержащая выделенную, растворимую в воде фракцию икры рыбы, характеризующуюся содержанием матричной рибонуклеиновой кислоты и белка в количестве 100-380 мг/мл в креме, геле, распыляемом растворе, эмульсии, твердом веществе, пластичном или матрице, мази, порошке или лосьоне, подходящем для местного применения.
5. Композиция по п.4, где указанная композиция дополнительно содержит эпигенетический ингибитор.
6. Композиция по п.4, где указанная композиция дополнительно содержит липидную или белковую фракцию из источника, отличного от источника указанной икры рыбы.
7. Композиция по п.6, где липидная фракции включает сквален, алифатический воск, стироловый сложный эфир, диоловый сложный эфир, триглицерид, или стиролы, или их сочетания.
8. Композиция по п.6, где указанная липидная или белковая фракция происходит из зародышей рыб, креветок, морского ежа, лягушки, или икры рыбы, или и того и другого.
9. Композиция по п.4, где указанная композиция дополнительно содержит кератин или филагрин.
10. Композиция по п.4, где указанная композиция дополнительно содержит глутамин, противоинфекционные средства, противовоспалительные средства, антиоксиданты и/или никотинамид.
11. Композиция по п.10, где указанный антиоксидант представляет собой витамин А, С, D, или, Е или их сочетания.
12. Композиция по п.4, где указанный гель содержит соединение, выбранное из группы, состоящей из гиалуроновой кислоты и хитозана.
13. Композиция по п.4, где указанный распыляемый раствор представляет собой аэрозоль.
14. Композиция по п.4, где указанный распыляемый раствор высыхает на коже.
15. Композиция по п.4, где указанная композиция распыляемого раствора содержит образующие гель компоненты.
16. Способ лечения кожи индивида, включающий: нанесение композиции по п.1 или 4 на кожу указанного индивида.
17. Способ по п.16, дополнительно включающий этап удаления ткани кожи химическими веществами, лазером или физической силой перед указанным этапом применения.
18. Способ по п.16, где указанную композицию наносят при условиях таким образом, что внешний вид кожи улучшается, где улучшение внешнего вида кожи выбрано из группы, состоящей из улучшения внешнего вида рубца, улучшения внешнего вида кожи с морщинами или повреждением от солнечных лучей и улучшения внешнего вида кожи, поврежденного нарушениями кожи.
19. Способ по п.16, где указанный индивид имеет неровную или поврежденную кожу и указанную композицию наносят на указанную неровную или поврежденную кожу таким образом, что кожа омолаживается.
20. Способ для местного применения композиции по п.1 или 4, включающий:
a) наличие композиции по п.1 или 4; и
b) нанесение указанной композиции на указанную кожу.
21. Способ по п.20, где указанный компонент наносят на рану указанной кожи.
22. Способ для местного применения композиции по п.1 или 4, включающий:
i) наличие
a) композиции по п.1 или 4,
b) индивида, имеющего рану на коже, и
c) раневой повязки;
ii) нанесение указанной композиции на указанную рану; и
iii) закрытие указанной раны указанной раневой повязкой.
23. Способ по п.21, где указанная раневая повязка включает:
i) водостойкий слой;
ii) слой питающего геля, содержащий выделенную, растворимую в воде фракцию икры рыбы, характеризующуюся содержанием матричной рибонуклеиновой кислоты и белка в количестве 100-380 мг/мл.
24. Композиция для стимуляции роста клеток, содержащая выделенную, растворимую в воде фракцию икры рыбы, характеризующуюся содержанием матричной рибонуклеиновой кислоты и белка в количестве 100-380 мг/мл.
25. Применение композиций по п.1 или 4 для лечения кожи, для удаления морщин, для омоложения кожи, для заживления ран, для улучшения внешнего вида кожи, для предотвращения повреждения кожи, деградации кожи или для питания кожи.
| КОСМЕТИЧЕСКОЕ СРЕДСТВО НА ОСНОВЕ АКВАГОМОГЕНАТА ИКРЫ ОСЕТРОВЫХ РЫБ ИЛИ НА ОСНОВЕ АКВАГОМОГЕНАТА ИКРЫ ЛОСОСЕВЫХ РЫБ, ИЛИ НА ОСНОВЕ КОМПЛЕКСА АКВАГОМОГЕНАТА ИКРЫ ОСЕТРОВЫХ И ЛОСОСЕВЫХ РЫБ (ВАРИАНТЫ) | 2003 |
|
RU2232587C1 |
| КОСМЕТИЧЕСКИЙ КРЕМ | 1993 |
|
RU2032398C1 |
| КОСМЕТИЧЕСКИЙ МАРИКРЕМ ДЛЯ УХОДА ЗА КОЖЕЙ | 1996 |
|
RU2110984C1 |
| WO 2004084828 A2, 07.10.2004 | |||
| Классификация заболеваний кожи по синдромально-патогенетическому признаку», Архив клинической и экспериментальной медицины, Том 12, №1, 2003. | |||
Авторы
Даты
2011-06-20—Публикация
2007-05-11—Подача