УРОВЕНЬ ТЕХНИКИ
Настоящее изобретение относится к способам хемоселективного пегилирования цистеинового остатка, обладающего неокисленной сульфгидрильной боковой цепью и свободной α-аминогруппой, в белках, пептидах и других молекулах.
Если низкомолекулярные лекарственные средства обычно вводят пероральным путем, то белковые и пептидные терапевтические агенты, как правило, вводят инъекционно вследствие их крайне низкой пероральной биодоступности. После инъекции большинство белков и пептидов быстро расщепляется ферментами и выводится из организма, что приводит к краткому сроку циркуляции (периоду полураспада) in vivo. Малое время циркуляции (период полураспада) приводит к более низкой эффективности, более частому введению, худшему соблюдению больным режима и схемы лечения и более высокой стоимости белковых и пептидных лекарственных препаратов. Поэтому существует острая необходимость в развитии способов продления времени действия белковых и пептидных лекарственных средств.
Доказано, что ковалентное присоединение белков и пептидов к полиэтиленгликолю (PEG) представляет собой эффективный способ увеличения времени циркуляции (периода полураспада) белков и пептидов в организме (Abuchowski, A. et al., Cancer Biochem. Biophys., 1984, 7:175-186; Hershfield, M.S. et al., N. Engl. J. Medicine 316:589-596; и Meyers, F. J. et al., Clin. Pharmacol. Ther., 1991, 49:307-313). Ковалентное присоединение PEG к белкам и пептидам не только защищает молекулы от ферментативного расщепления, но и снижает скорость их выведения из организма. Размер PEG, присоединенного к белку, имеет существенное влияние на время циркуляции (период полураспада) белка. Как правило, больший PEG приводит in vivo к более длительному периоду полураспада присоединенного белка. Коммерчески доступны молекулы PEG нескольких размеров (Nektar Advanced PEGylation Catalog 2005-2006; и NOF DDS Catalogue Ver 7.1), которые подходят для получения белков и пептидов с намеченными сроками циркуляции (периодами полураспада). Фрагмент PEG также повышает растворимость в воде и снижает иммуногенность белков, пептидов и других молекул (Katre, N.V. et al., Proc. Natl. Aced. Sci. USA, 1998, 84:1487-1491; и Katre, N.V. et al., J. Immunology, 1990, 144:209-213).
В литературе сообщалось о нескольких способах пегилирования белков. Например, для пегилирования свободных аминогрупп лизиновых остатков и N-концов белков использовали N-гидроксисукцинимид (NНS)-PEG. Поскольку белки обычно содержат большое число лизиновых остатков и концевую аминогруппу, с использованием данного способа пегилируется большое число сайтов белка. Такое неселективное пегилирование приводит к снижению эффективности пегилированных белков, поскольку большое число фрагментов PEG обычно препятствует взаимодействию между белками и их биологическими молекулами-мишенями (Teh, L.-C. and Chapman, G.E., Biochem. Biophys. Res. Comm., 1988, 150:391-398; и Clark, R. et al., J. Biol. Chem. 1996, 271:21969-21977). Неселективное, повторенное на большом числе сайтов пегилирование, кроме того, создает гетерогенные смеси конечных продуктов. Многие из этих гетерогенных пегилированных белков не подходят для применения в лечебных целях из-за низкоспецифических активностей. Гетерогенные пегилированные белки трудно поддаются очистке и характеристике. Как правило, высоко разнообразие содержания различных партий продукта гетерогенных пегилированных белков и контроль качества этих смесей затруднителен.
Несмотря на то что для пегилирования аминоконцов белков были использованы молекулы PEG, несущие альдегидные группы, при наличии восстановителя, такой способ не создает исключительно N-концевых пегилированных белков, и лизиновые остатки белков также пегилируются. Таким образом, полученные белки также представляют собой гетерогенные смеси (Kinstler O.B. et al., заявка США №09/817725). Недостатком этого способа также является использование жестких условий реакции восстановления. Восстановители, такие как цианоборогидрид, могут повреждать белки и приводить к меньшему выходу реакции.
Для селективного пегилирования свободных тиоловых групп цистеиновых остатков в белках использовали молекулы PEG с малеимидными функциональными группами. Для такого способа часто необходима точковая мутация, приводящая к появлению нового цистеина. Поскольку большинство белков содержит один или несколько цистеиновых остатков для того, чтобы избирательно помешать тиоловой группе нового, «неприродного», цистеинового остатка образовать дисульфидный мостик с другими цистеиновыми остатками, и затем для избирательного пегилирования исключительно этого нового цистеина требуются очень сложные условия проведения реакции (патент США №6753165, выданный 22 июня 2004, и патент США №6608183, выданный 19 августа 2003). Даже в контролируемых условиях проведения реакции могут пегилироваться другие цистеиновые остатки, и получаются гетерогенные продукты.
Сообщалось о сайт-специфическом пегилировании ацетил-фенилаланинового остатка аналогов гормона роста. Для такого способа необходима точковая мутация с образованием неприродной аминокислоты ацетил-фенилаланина (заявка США №11/046432, поданная 28 января 2005). Одним из недостатков этого способа является то, что пегилирование белков, обладающих неприродными аминокислотами, такими как ацетил-фенилаланин, можно осуществить лишь в бактериальных клетках, но не в клетках млекопитающих.
Для пегилирования белка были использованы свободные тиоловые и аминогруппы, полученные в реакции аминотиолактона со свободной аминогруппой интерлейкина-2. Тем не менее, в данном способе использованный аминотиолактон взаимодействует с любыми функциональными аминогруппами лизиновых остатков и N-концов в белках, и способ не является сайт-селективным (патент США №6310180, выданный 30 октября 2001).
Поэтому несмотря на ранее предпринятые различными коллективами усилия до сих пор существует острая необходимость в разработке легких и удобных в использовании способов сайт-специфического пегилирования белков, пептидов и других молекул.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
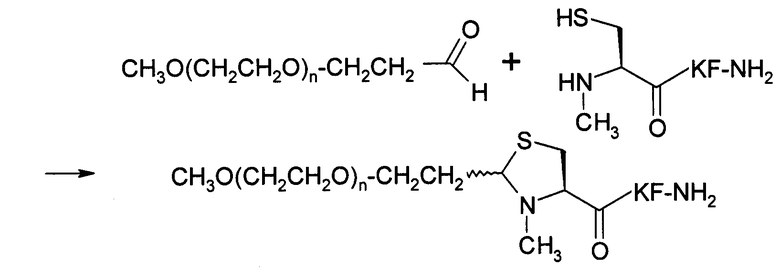
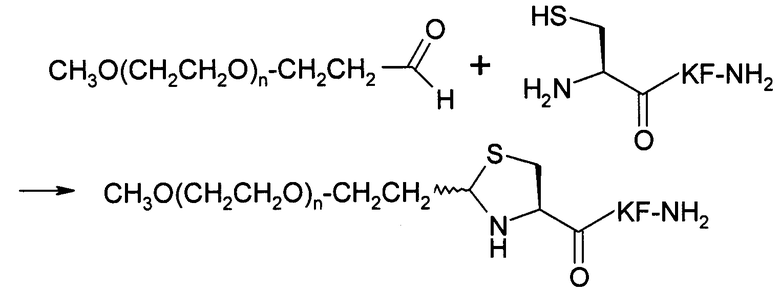
Настоящее изобретение в целом относится к новым способам сайт-специфического пегилирования белков, пептидов и других молекул. Было обнаружено, что PEG, содержащий альдегидную функциональную группу (PEG-альдегид), самопроизвольно взаимодействует, в водном растворе в широком диапазоне значений рН с цистеином, обладающим неокисленной сульфгидрильной боковой цепью и свободной α-аминогруппой, с образованием тиазолидина, благодаря чему PEG-альдегид вследствие гидрофильной природы и большого размера PEG (например, 30 кДа) взаимодействует с пептидным фрагментом, содержащим большое число функциональных групп, который не был точно определен. Авторы изобретения также обнаружили, что с PEG-альдегидом взаимодействует лишь цистеиновый остаток, имеющий боковую цепь с неокисленным сульфгидрилом и свободную α-аминогруппу. Другие функциональные группы в других остатках (например, тиоловая группа цистеина, не имеющего свободной α-аминогруппы, гуанидиниловая группа Arg, аминогруппа Lys, карбоксильная группа боковой цепи Asp, карбоксильная группа боковой цепи Glu, гидроксильная группа Tyr и гидроксильная группа Ser) не взаимодействуют с PEG-альдегидом.
Используя настоящие способы, пегилируются лишь цистеиновые остатки, имеющие боковую цепь с неокисленным сульфгидрилом и свободную α-аминогруппу, но не какие-либо другие аминокислоты в белках, пептидах и других молекулах. Таким образом, настоящие способы являются высоко сайт-селективными. Свойство настоящих способов пегилирования быть сайт-специфичными приводит к получению более гомогенных продуктов, которые легко поддаются характеристике, очистке и их легко получить и у них меньше различий между разными партиями. У PEG, присоединенного к конкретному сайту (т.е. N-концевому цистеину) белков и пептидов, должен быть меньше риск взаимодействия с биологическими мишенями, и поэтому должны получаться более эффективные терапевтические агенты.
В настоящем изобретении альдегидная функциональная группа PEG самопроизвольно взаимодействует с амино- и тиоловыми функциональными группами цистеинового остатка на N-конце белка или пептида в водном растворе в диапазоне значений рН (например, рН 2-8) и при различных температурах (например, при комнатной температуре). Вновь полученная функциональная группа между PEG и белком или пептидом представляет собой 1,3-тиазолидин. В таких условиях пегилирования карбоксильные группы остатков глутаминовой и аспарагиновой кислот и С-концевая карбоксильная группа, аминогруппы лизиновых остатков, гуанидиниловые группы аргининовых остатков, тиоловые группы внутренних цистеиновых остатков и гидроксильные группы сериновых, треониновых и тирозиновых остатков не взаимодействуют с альдегидной функциональной группой PEG. Таким образом, настоящее изобретение относится к сайт-специфическому пегилированию N-концевого цистеинового остатка. Для предотвращения образования в процессе пегилирования дисульфидного мостика можно использовать восстановители, такие как трис(карбоксиэтил) фосфин (ТСЕР), и реакции можно проводить в атмосфере азота и аргона. Можно использовать PEG-альдегид в количестве 1-4 эквивалентов. Реакции обычно завершают через 2-72 часа в зависимости от значения рН раствора и количества эквивалентов использованного PEG-альдегида. Если при пегилировании встречаются несвернутые белки, после пегилирования белковые продукты могут вновь свернуться. При проведении пегилирования на правильно свернутых белках стадия повторного сворачивания не совершается.
Молекулы PEG, использованные в настоящем изобретении, могут иметь различную молекулярную массу (например, 2-40 кДа), иметь линейную, разветвленную и сильноразветвленную структуру и содержать одну или несколько альдегидных функциональных групп. При использовании PEG, содержащего две альдегидных функциональных группы, конечный продукт будет представлять собой белковый или пептидный димер, и PEG будет в нем линкером. PEG с большим числом альдегидных функциональных групп будет создавать мультимер пегилированных белков или пептидов.
Для контроля значения рН реакционного раствора можно использовать системы забуференных растворов, такие как PBS. Для содействия проведению реакций реакционные растворы также могут содержать другие агенты, такие как EDTA.
Конечные пегилированные белки и пептиды можно очистить c помощью различных способов очистки, таких как обратнофазовая высокоэффективная жидкостная хроматография (RP-HPLC), гель-хроматография и ионообменная хроматография, и охарактеризовать с помощью MALDI-MS, хроматографических способов, электрофореза, аминокислотного анализа и методик секвенирования белков и пептидов.
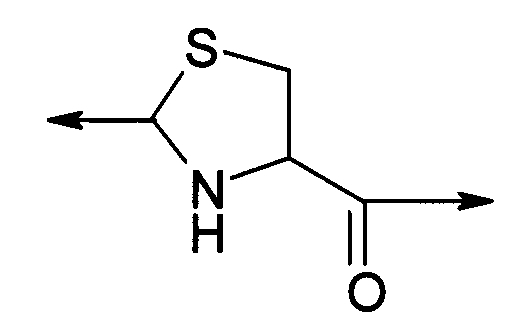
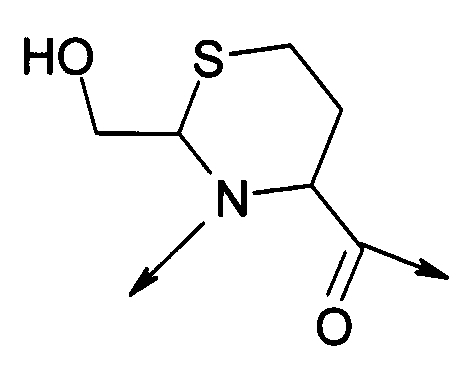
В первом варианте осуществления изобретение относится к способу химического конъюгирования PEG, содержащего свободную альдегидную группу, с боковой цепью, содержащей неокисленный сульфгидрил, и свободной α-аминогруппой цистеинового остатка молекулы, указанный способ содержит взаимодействие свободной альдегидной группы указанного PEG с неокисленной сульфгидрильной боковой цепью и свободной α-аминогруппой указанного цистеинового остатка с образованием в продукте 1,3-тиазолидиновой группы, где указанный продукт имеет структуру
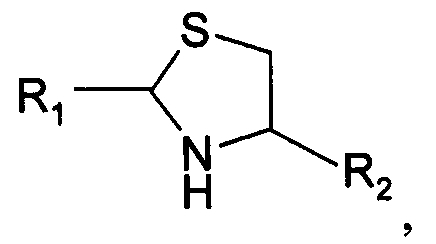
где R1 представляет собой указанный PEG, и R2 представляет собой указанную молекулу.
Во втором варианте осуществления изобретение относится к способу химического конъюгирования PEG, содержащего свободную альдегидную группу, с неокисленной сульфгидрильной боковой цепью и свободной α-аминогруппой цистеинового остатка молекулы, включающему взаимодействие в реакционном растворе свободной альдегидной группы указанного PEG с неокисленной сульфгидрильной боковой цепью и свободной α-аминогруппой указанного цистеинового остатка с образованием в промежуточном продукте 1,3-тиазолидиновой группы, и доведение рН реакционного раствора до значения приблизительно 7, при котором, указанный промежуточный продукт перегруппируется с образованием конечного продукта, где указанный промежуточный продукт имеет структуру
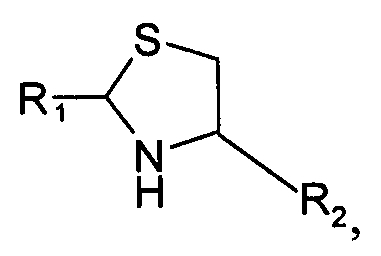
и указанный конечный продукт имеет структуру
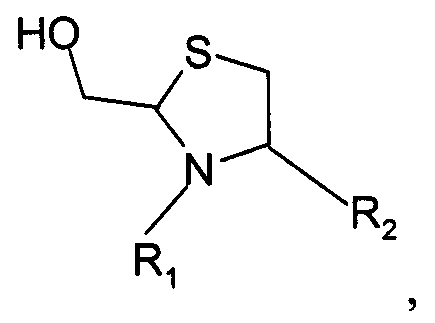
где R1 представляет собой указанный PEG, и R2 представляет собой указанную молекулу. В данном документе под термином «приблизительно» понимают ±10%.
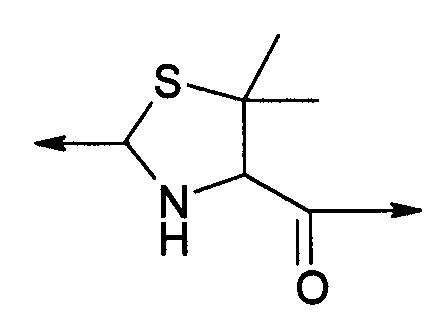
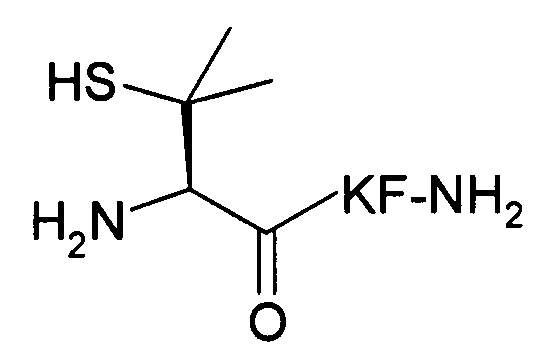
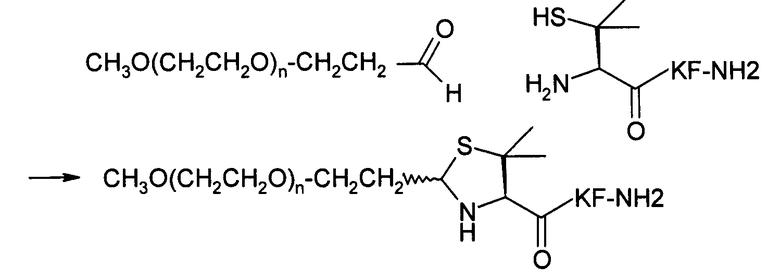
В третьем варианте осуществления изобретение относится к способу химического конъюгирования PEG, содержащего свободную альдегидную группу, с неокисленной сульфгидрильной боковой цепью и свободной α-аминогруппой пеницилламинового остатка молекулы, включающему взаимодействие свободной альдегидной группы указанного PEG с неокисленной сульфгидрильной боковой цепью и свободной α-аминогруппой указанного пеницилламинового остатка с образованием в продукте 5,5-диметил-1,3-тиазолидиновой группы, где указанный продукт имеет структуру
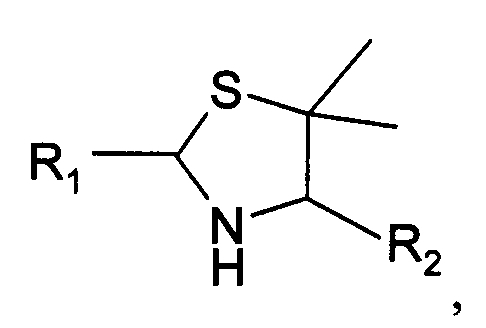
где R1 представляет собой указанный PEG, и R2 представляет собой указанную молекулу.
В четвертом варианте осуществления изобретение относится к способу химического конъюгирования PEG, содержащего свободную альдегидную группу, с неокисленной сульфгидрильной боковой цепью и свободной α-аминогруппой пеницилламинового остатка молекулы, включающему взаимодействие в реакционном растворе свободной альдегидной группы указанного PEG с неокисленной сульфигидрильной боковой цепью и свободной α-аминогруппой указанного пеницилламинового остатка с образованием в промежуточном продукте 5,5-диметил-1,3-тиазолидиновой группы, и доведение рН реакционного раствора до значения приблизительно 7, при котором указанный промежуточный продукт перегруппируется с образованием конечного продукта, где указанный промежуточный продукт имеет структуру
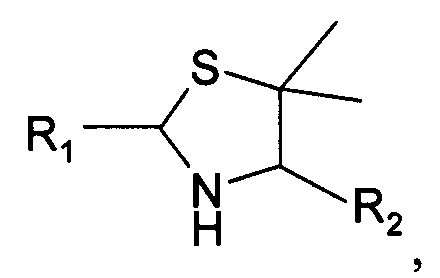
и указанный конечный продукт имеет структуру
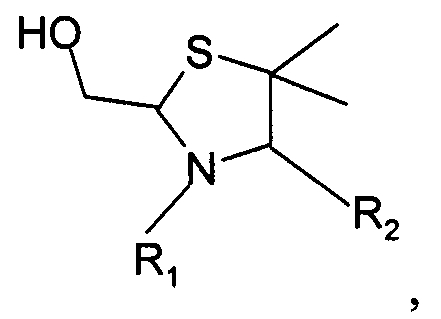
где R1 представляет собой указанный PEG, и R2 представляет собой указанную молекулу. В данном документе под термином «приблизительно» понимают ±10%.
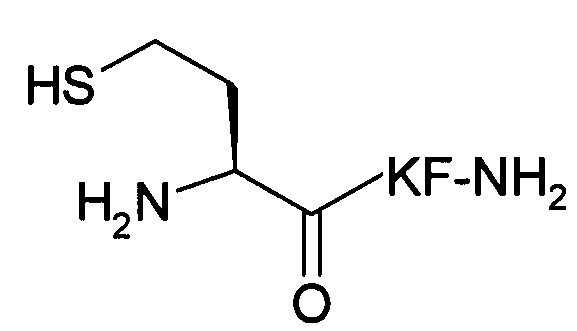
В пятом варианте осуществления изобретение относится к способу химического конъюгирования PEG, содержащего свободную альдегидную группу, с неокисленной сульфгидрильной боковой цепью и свободной α-аминогруппой гомоцистеинового остатка молекулы, включающему взаимодействие свободной альдегидной группы указанного PEG с неокисленной сульфгидрильной боковой цепью и свободной α-аминогруппой указанного гомоцистеинового остатка с образованием в продукте 6-членной кольцевой системы, где указанный продукт имеет структуру
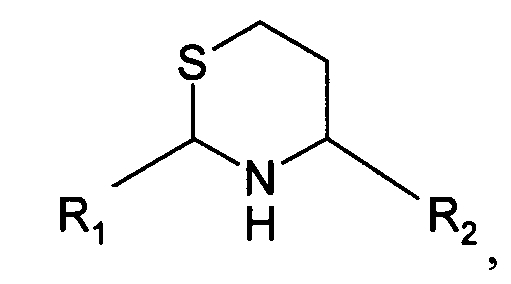
где R1 представляет собой указанный PEG, и R2 представляет собой указанную молекулу.
В шестом варианте осуществления изобретение относится к способу химического конъюгирования PEG, содержащего свободную альдегидную группу, с неокисленной сульфгидрильной боковой цепью и свободной α-аминогруппой гомоцистеинового остатка молекулы, включающему взаимодействие в реакционном растворе свободной альдегидной группы указанного PEG с неокисленной сульфгидрильной боковой цепью и свободной α-аминогруппой указанного гомоцистеинового остатка с образованием в промежуточном продукте 6-членной кольцевой системы, и доведение рН реакционного раствора до значения приблизительно 7, таким образом, указанный промежуточный продукт перегруппируется с образованием конечного продукта, где указанный промежуточный продукт имеет структуру
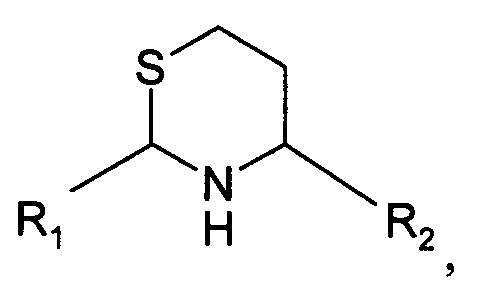
и указанный конечный продукт имеет структуру
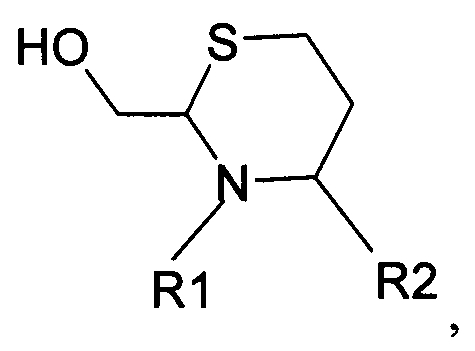
где R1 представляет собой указанный PEG, и R2 представляет собой указанную молекулу. В данном документе под термином «приблизительно» понимают ±10%.
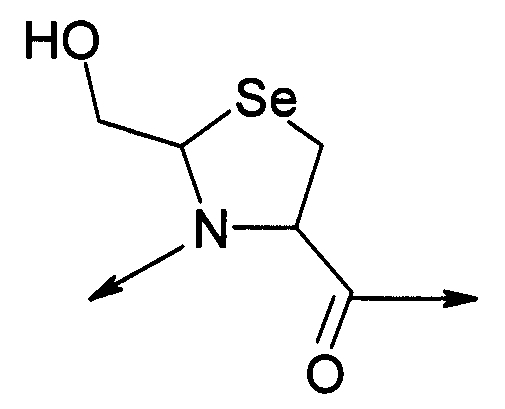
В седьмом варианте осуществления изобретение относится к способу химического конъюгирования PEG, содержащего свободную альдегидную группу, с неокисленной свободной селеногруппой и свободной α-аминогруппой селенцистеинового остатка молекулы, включающему взаимодействие свободной альдегидной группы указанного PEG с неокисленной свободной селеногруппой и свободной α-аминогруппой указанного селенцистеинового остатка с образованием в продукте 5-членной кольцевой системы, где указанный продукт имеет структуру
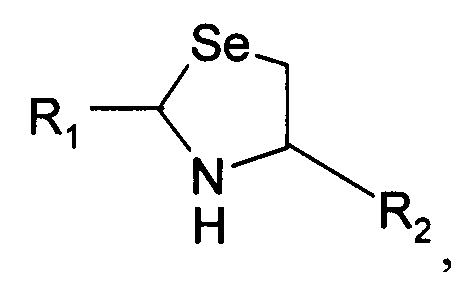
где R1 представляет собой указанный PEG, и R2 представляет собой указанную молекулу.
В восьмом варианте осуществления изобретение относится к способу химического конъюгирования PEG, содержащего свободную альдегидную группу, с неокисленной свободной селеногруппой и свободной α-аминогруппой селенцистеинового остатка молекулы, включающему взаимодействие в реакционном растворе свободной альдегидной группы указанного PEG с неокисленной свободной селеногруппой и свободной α-аминогруппой указанного селенцистеинового остатка с образованием в промежуточном продукте 5-членной кольцевой системы, и доведение рН реакционного раствора до значения приблизительно 7, при котором, указанный промежуточный продукт перегруппируется с образованием конечного продукта, где указанный промежуточный продукт имеет структуру
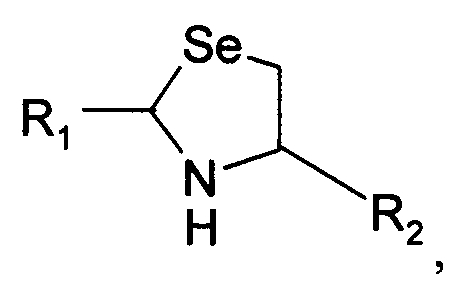
и указанный конечный продукт имеет структуру
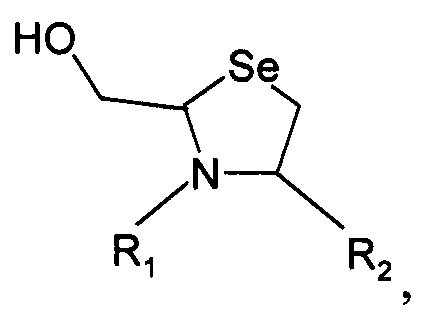
где R1 представляет собой указанный PEG, и R2 представляет собой указанную молекулу. В данном документе под термином «приблизительно» понимают ±10%.
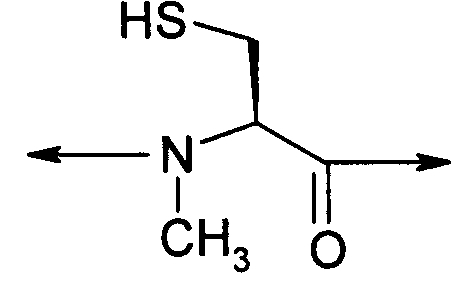
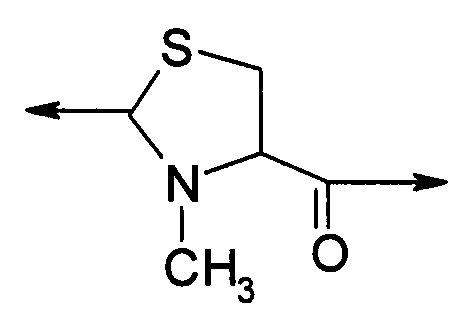
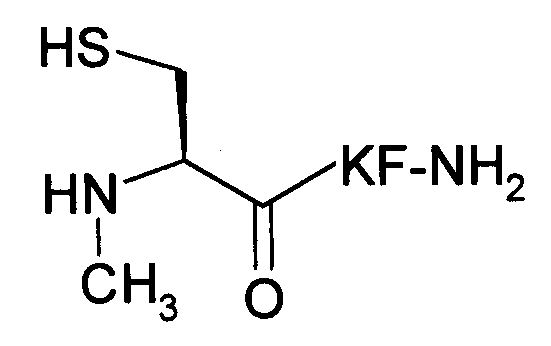
В девятом варианте осуществления изобретение относится к способу химического конъюгирования PEG, содержащего свободную альдегидную группу, с неокисленной сульфгидрильной боковой цепью и свободной α-метиламиногруппой N-метилцистеинового остатка молекулы, включающему взаимодействие свободной альдегидной группы указанного PEG с неокисленной сульфгидрильной боковой цепью и свободной α-метиламиногруппой указанного N-метилцистеинового остатка с образованием в продукте 3-метил-1,3-тиазолидиновой группы, где указанный продукт имеет структуру
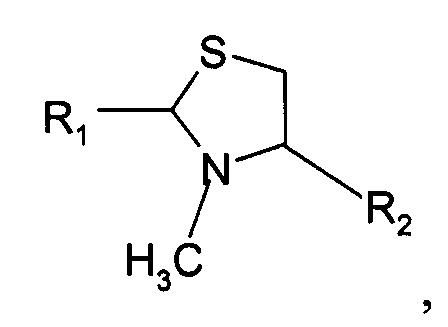
где R1 представляет собой указанный PEG, и R2 представляет собой указанную молекулу.
В каждом из вышеуказанных вариантов осуществления изобретения - т.е. с пятого по девятый варианты осуществления изобретения - свободная альдегидная группа присоединяется к указанному PEG посредством линкера, который может содержать в качестве функциональной группы амид, сложный эфир, сульфонамид, сульфонил, тиол, окси, алкил, алкенил, алкинил, арил, малеимид или амин или любое их сочетание.
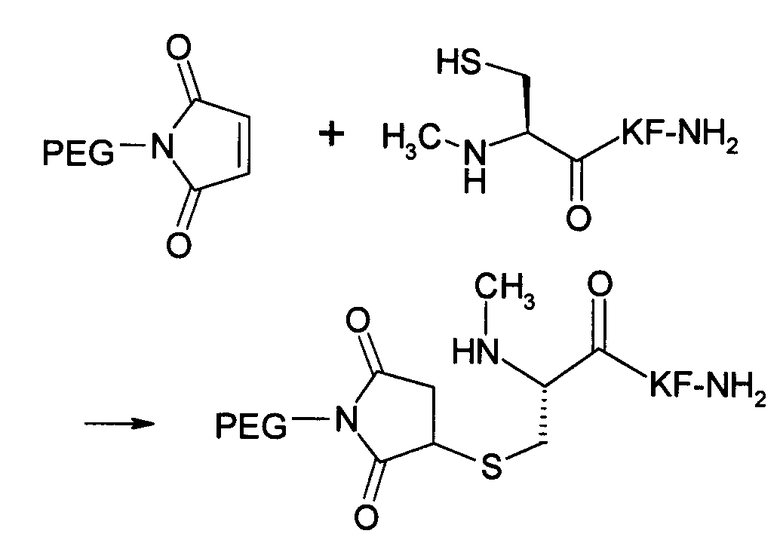
В десятом варианте осуществления изобретение относится к способу химического конъюгирования PEG, содержащего свободную малеимидную группу, с неокисленной сульфгидрильной боковой цепью N-метилцистеинового остатка молекулы, включающему взаимодействие свободной малеимидной группы указанного PEG с неокисленной сульфгидрильной боковой цепью указанного N-метилцистеина с образованием конъюгированного продукта, где указанный конъюгированный продукт имеет структуру

где R1 представляет собой указанный PEG, и R2 представляет собой указанную молекулу.
В одиннадцатом варианте осуществления изобретение относится к способу химического конъюгирования PEG, содержащего свободную малеимидную группу, с неокисленной сульфгидрильной боковой цепью пеницилламинного остатка молекулы, включающему взаимодействие свободной малеимидной группы указанного PEG с неокисленной сульфгидрильной боковой цепью указанного пеницилламинного остатка с образованием конъюгированного продукта, где указанный конъюгированный продукт имеет структуру
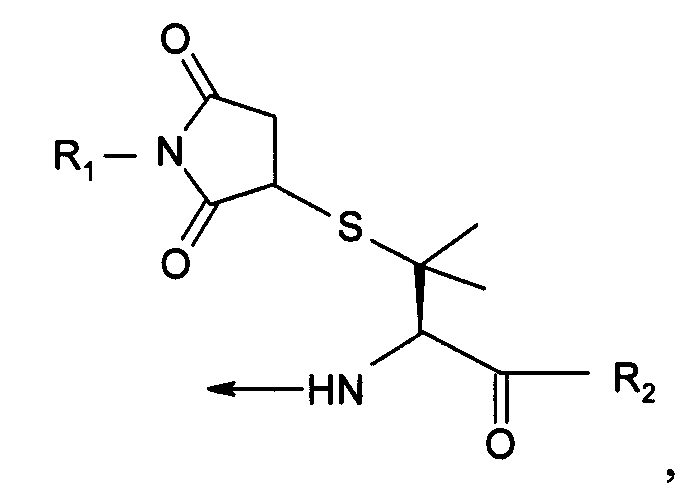
где R1 представляет собой указанный PEG, и R2 представляет собой указанную молекулу.
В двенадцатом варианте осуществления изобретение относится к способу химического конъюгирования PEG, содержащего свободную малеимидную группу, с неокисленной сульфгидрильной боковой цепью гомоцистеинового остатка молекулы, включающему взаимодействие свободной малеимидной группы указанного PEG с неокисленной сульфгидрильной боковой цепью указанного гомоцистеинового остатка с образованием конъюгированного продукта, где указанный конъюгированный продукт имеет структуру
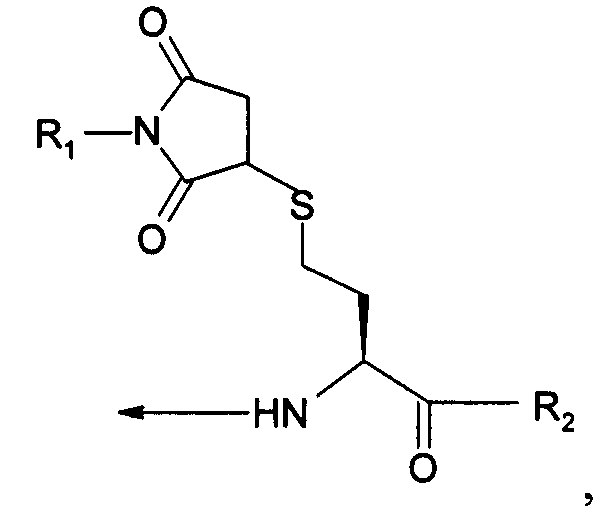
где R1 представляет собой указанный PEG, и R2 представляет собой указанную молекулу.
В тринадцатом варианте осуществления изобретение относится к способу химического конъюгирования PEG, содержащего свободную малеимидную группу, с неокисленной селенсодержащей боковой цепью селенцистеинового остатка молекулы, включающему взаимодействие свободной малеимидной группы указанного PEG с неокисленной селенсодержащей боковой цепью указанного селенцистеинового остатка с образованием конъюгированного продукта, где указанный продукт имеет структуру
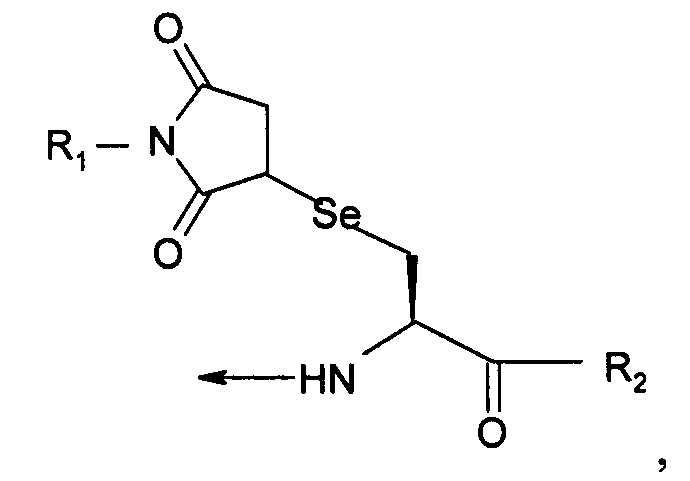
где R1 представляет собой указанный PEG, и R2 представляет собой указанную молекулу.
В каждом из вышеуказанных вариантов осуществления изобретения - т.е. с десятого по тринадцатый варианты осуществления изобретения - свободная малеимидная группа присоединяется к указанному PEG посредством линкера, который может содержать в качестве функциональной группы амид, сложный эфир, сульфонамид, сульфонил, тиол, окси, алкил, алкенил, алкинил, арил, малеимид или амин или любое их сочетание.
Во всех вышеуказанных вариантах осуществления изобретения PEG может иметь линейную структуру, разветвленную структуру или сильноразветвленную структуру.
Во всех вышеуказанных вариантах осуществления изобретения PEG имеет среднюю молекулярную массу от примерно 100 Да до примерно 500 000 Да, а более предпочтительно от примерно 1 000 Да до примерно 50 000 Да.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Авторы изобретения полагают, что специалист в данной области на основании описания данного документа может использовать настоящее изобретение в полном объеме. Следующие конкретные варианты осуществления поэтому должны пониматься всего лишь в качестве иллюстративных, но не в качестве ограничивающих последующее описание каким бы то ни было образом.
Если не указано иначе, все технические и научные термины, использованные в данном документе, имеют то же значение, которое обычно понимается специалистом в данной области, для которого это изобретение предназначено. Кроме того, все публикации, патентные заявки, патенты и другие ссылки, упоминаемые в данном документе, приводятся в качестве ссылки в полном объеме.
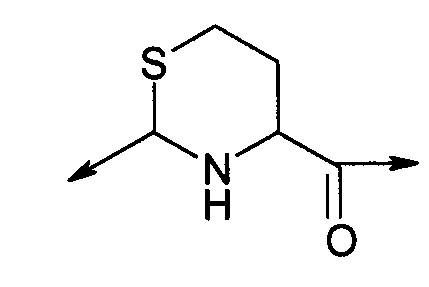
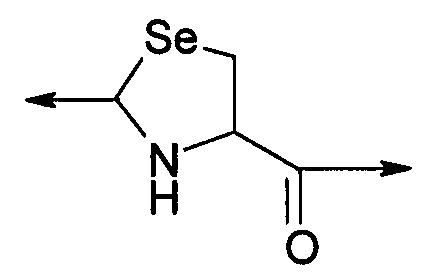
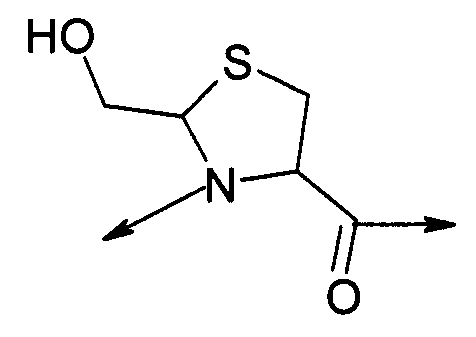
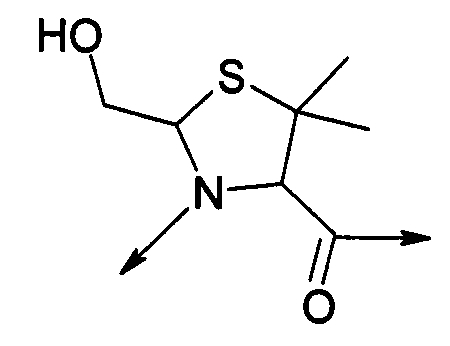
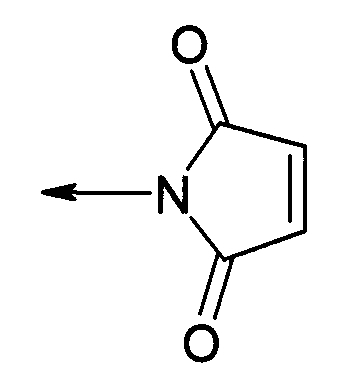
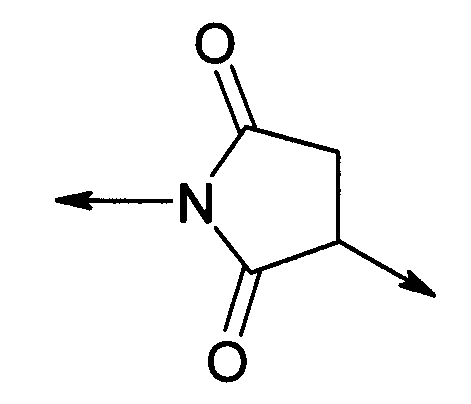
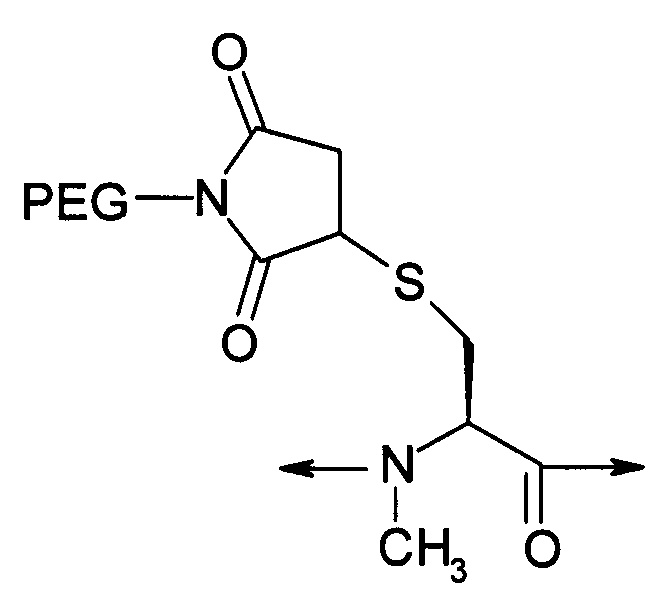
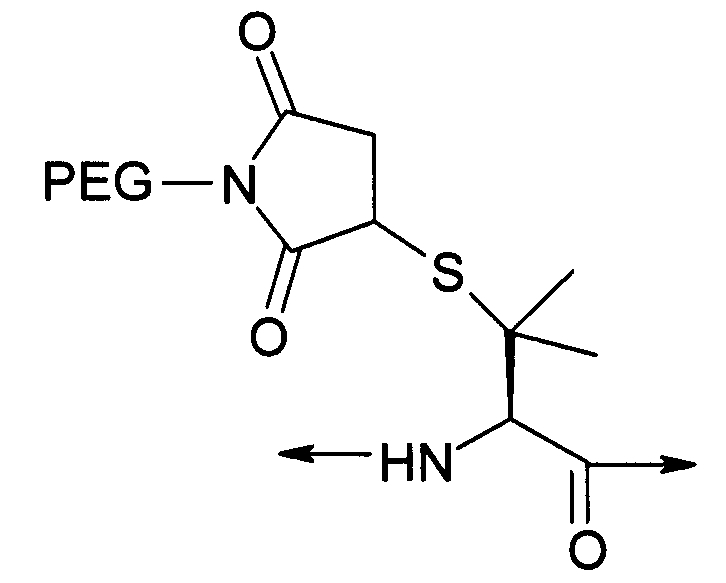
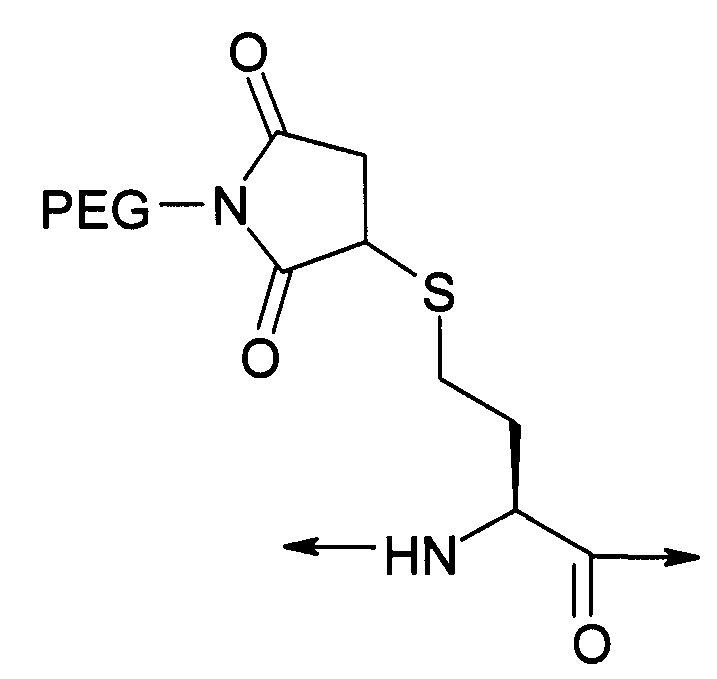
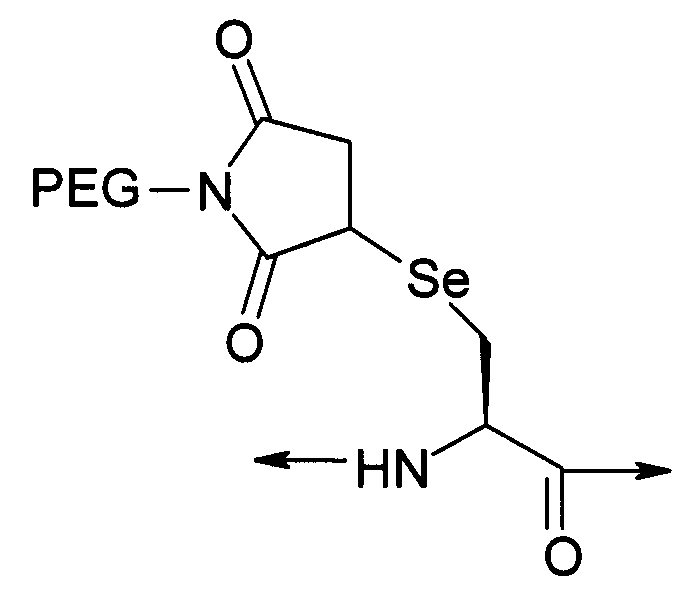
PEG представляет собой хорошо известный водорастворимый полимер, который коммерчески доступен или может быть получен полимеризацией этиленгликоля с раскрытием кольца согласно способам, известным в данной области (Sandler and Karo, Polymer Synthesis, Academic Press, New York, VO13, pages 138-161). Термин «PEG» широко используют в отношении любых молекул полиэтиленгликоля вне зависимости от размера или модификации на конце молекулы PEG. PEG могут иметь линейную, разветвленную или сильноразветвленную структуру.
ПРИМЕРЫ
Пример 1) Получение H-NMeCys-Lys-Phe-NH 2 (SEQ ID NO:1)
Амидной смоле Ринка МВНА (211 мг, 0,152 ммоль) (Novabiochem, San Diego, Calif.) давали набухнуть в дихлорметане (DCM) и промывали диметилформамидом (DMF). Смолу деблокировали обработкой 25%-ным раствором пиперидин/ DMF (10 мл) 2 раза по 10 мин. Смолу трижды промывали DMF (10 мл). Первую аминокислоту присоединяли к смоле обработкой раствором, содержащим Fmoc-Phe-OH (Novabiochem, San Diego, Calif.) (235 мг, 0,606 ммоль), 1-гидроксибензтриазол (HOBt) (92,3 мг, 0,606 ммоль) и диизопропилкарбодиимид (DIC) (77 мг, 0,606 ммоль) в N-метилпирролидоне (NMP) (2 мл), в течение одного часа. Смолу фильтровали и промывали с помощью DMF (10 мл) трижды.
Защитную группу Fmoc удаляли обработкой 25%-ным раствором пиперидин/DMF (10 мл) 2 раза по 10 мин, и смолу трижды промывали DMF (10 мл). В течение одного часа к полученной смоле, содержащей свободный амин, присоединяли Fmoc-Lys(Boc)-OH (Novabiochem, San Diego, Calif.) (285 мг, 0,606 ммоль) при наличии HOBt (0,606 ммоль) и DIC (0,606 ммоль) в NMP (2 мл).
Процедуры деблокирования и промывки повторяли аналогично описанному выше. Используя HOBt (51 мг, 0,33 ммоль) и DIC (83,8 мг, 0,66 ммоль) в NMP (2 мл), к полученной смоле с пептидом в течение 12 часов присоединяли Fmoc-N-Me-Cys(Trt)-OH (Timen Chemicals, Lodz, Poland.) (100 мг, 0,167 ммоль). Используя тетраметилфторформамидинийпентафторфосфат (TFFH) (20 мг, 0,075 ммоль) и диизопропилэтиламин (DIEA) (19,4 мг, 0,150 ммоль) в NMP (2 мл), в течение одного часа воспроизводили присоединение Fmoc-N-Me-Cys(Trt)-OH (45 мг, 0,075 ммоль). Процедуры деблокирования и промывки повторяли аналогично описанному выше. Смолу трижды промывали DСМ, после чего трижды промывали метанолом. Смолу высушивали в вакууме.
Пептид отщепляли от смолы путем встряхивания смолы с 8% триспропилсилан/трифторуксусной кислотой (ТFА) (2 мл) в течение двух часов. Смолу фильтровали и промывали с помощью DCМ (2 мл). Фильтраты объединяли и концентрировали до 1 мл. Для осаждения пептида добавляли диэтиловый эфир (35 мл). После центрифугирования собирали осажденный пептид. Осадок растворяли в воде и ацетонитриле и затем лиофилизировали.
Полученный сырой продукт очищали с помощью системы обратнофазовой HPLC (колонка Luna 5 микрон С8(2) размером 100х20 мм), элюировали в течение 30 минут, начиная со 100% буфера А (0,1% ТFА в воде) и 0% буфера В (0,1% ТFА в ацетонитриле) и заканчивая 80% буфером А и 20% буфером В, осуществляя мониторинг при 235 нм. После лиофилизации получали 51,2 мг конечного продукта. С помощью масс-спектроскопии ESI определяли, что ион М+1 имеет массу 410,3 Да, что согласуется с рассчитанной молекулярной массой 409,6 Да.
Пример 2) Получение mPEG-Tmc-Lys-Phe-NH 2 (SEQ ID NO:2)
В данном документе mPEG имеет структуру СН3О(СН2СН2О)n-(СН2)2-, где n представляет собой положительное целое число.
Пептидный продукт, полученный в примере 1 (0,5 мг, 1,22 микромоль), растворяли в 1,0 мл буфера со значением рН 4 (20 ммоль NaOAc, 150 ммоль NaCl и 1 ммоль EDTA). К полученному раствору добавляли mPEG-альдегид (в количестве 1,5 эквивалента, средняя молекулярная масса 31378 Да, NOF Corp., Tokyo, Japan). По данным анализа, проведенного с использованием системы обратнофазовой аналитической HPLC (колонка для разделения пептидов/белков Vydac C18 5µ, 4,6×250 мм), реакция была завершена примерно на 90% через 27 часов при комнатной температуре. Реакционную смесь наносили на спин-колонку для обессоливания ZebaТМ объемом 5 мл (Pierce Biotechnology, Rockford, IL). После лиофилизации получали вспененное белое вещество (36,7 мг).
Пример 3) Получение H-NMeCys (Prd-PEG)-Lys-Phe-NH 2 (SEQ ID NO:3)
Пептидный продукт, полученный в примере 1 (0,5 мг, 1,22 микромоль), растворяли в 1,0 мл буфера со значением рН 7 (20 ммоль NaOAc). К полученному раствору добавляли α-(3-(3-малеимид-1-оксопропил)амино) пропил-ω-метоксиполиоксиэтилен (в количестве 1,5 эквивалентов, средняя молекулярная масса 11962 Да, NOF Corp., Tokyo, Japan) и гидрохлорид трис(2-карбоксиэтил) фосфина (ТСЕР) в количестве 2 эквивалентов. Через час при комнатной температуре реакцию завершали, основываясь на анализе, проведенном с использованием системы обратнофазовой аналитической HPLC (колонка для разделения пептидов/белков Vydac C18 5µ, 4,6×250 мм). Реакционную смесь наносили на спин-колонку для обессоливания ZebaТМ объемом 5 мл (Pierce Biotechnology, Rockford, IL). После лиофилизации получали вспененное белое вещество (15,1 мг). Продукт дополнительно очищали на катион-обменной колонке High TrapTM SPXL (GE Healthcare, Piscataway, NJ). Используя масс-спектроскопию MALDI-TOF, определяли распределение молекулярной массы очищенного продукта. Полученный экспериментально результат оказался сопоставим с рассчитанным распределением молекулярной массы.
Пример 4) Получение H-Cys-Lys-Phe-NH 2 (SEQ ID NO:4)
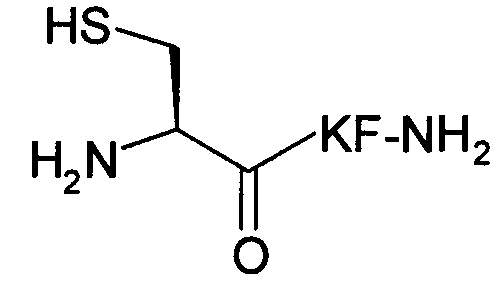
Названный пептид синтезировали на микроволновом пептидном синтезаторе модели LibertyTM (CEM Corp., Matthews, NC), используя амидную смолу Ринка МВНА (347 мг, 0,25 ммоль) (Novabiochem, San Diego, Calif.). Аминокислоты Fmoc-Phe-OH, Fmoc-Lys(BOC)-OH и Fmoc-Cys(Trt)-OH (Novabiochem, San Diego, CA) использовали с четырехкратным избытком, применяя активацию HBTU, и каждое присоединение повторяли.
Пептид отщепляли от смолы путем встряхивания смолы с 8% триспропилсилан/трифторуксусной кислотой (TFA) с добавлением 1% дитиотреитола (10 мл) в течение трех часов. Смолу фильтровали и промывали с помощью DCM (5 мл). Фильтраты объединяли и концентрировали до 3 мл. Для осаждения пептида добавляли диэтиловый эфир (35 мл). После центрифугирования осажденный пептид собирали. Осадок растворяли в воде и ацетонитриле и затем лиофилизировали.
Полученный сырой продукт очищали с помощью системы обратнофазовой HPLC (колонка Luna 5 микрон С8(2) размером 100×20 мм), элюировали в течение 35 минут, начиная со 100% буфера А (0,1% ТFА в воде) и 0% буфера В (0,1% ТFА в ацетонитриле) и заканчивая 70% буфером А и 30% буфером В, мониторируя при 235 нм. После лиофилизации получали 89,1 мг конечного продукта. С помощью масс-спектроскопии ESI определяли, что ион М+1 имеет массу 396,5 Да, что согласуется с рассчитанной молекулярной массой 395,5 Да.
Пример 5) Получение mPEG-Tha-Lys-Phe-NH 2 (SEQ ID NO:5)
В данном документе mPEG имеет структуру СН3О(СН2СН2О)n-(СН2)2-, где n представляет собой положительное целое число.
Пептидный продукт, полученный в примере 4 (0,5 мг, 1,26 микромоль), растворяли в 1,0 мл буфера со значением рН 4 (20 ммоль NaOAc). К полученному раствору добавляли mPEG-альдегид (в количестве 1,5 эквивалентов, средняя молекулярная масса равняется 20644 Да, NOF Corp., Tokyo, Japan) и ТСЕР (в количестве 2,0 эквивалентов). По данным анализа, проведенного с использованием системы обратнофазовой аналитической HPLC (колонка для разделения пептидов/белков Vydac C18 5µ, 4,6×250 мм), реакция была завершена примерно на 85% через три часа при комнатной температуре. Реакционную смесь наносили на спин-колонку для обессоливания ZebaТМ объемом 10 мл (Pierce Biotechnology, Rockford, IL). После лиофилизации получали вспененное белое вещество.
Пример 6) Получение H-hCys-Lys-Phe-NH 2 (SEQ ID NO:4)
Указанный пептид синтезировали на микроволновом пептидном синтезаторе модели LibertyTM (CEM Corp., Matthews, NC), используя амидную смолу Ринка МВНА (347 мг, 0,25 ммоль) (Novabiochem, San Diego, Calif.). Аминокислоты Fmoc-Phe-OH, Fmoc-Lys(BOC)-OH и Fmoc-hCys(Trt)-OH (Novabiochem, San Diego, CA) использовали в четырехкратном избытке, применяя активацию HBTU, и каждое присоединение повторяли.
Пептид отщепляли от смолы путем встряхивания смолы с 8% триспропилсилан/ трифторуксусной кислотой (TFA) с добавлением 1% дитиотреитола (10 мл) в течение трех часов. Смолу фильтровали и промывали с помощью DCM (5 мл). Фильтраты объединяли и концентрировали до 3 мл. Для осаждения пептида добавляли диэтиловый эфир (35 мл). После центрифугирования собирали осажденный пептид. Осадок растворяли в воде и ацетонитриле и затем лиофилизировали.
Полученный сырой продукт очищали с помощью системы обратнофазовой HPLC (колонка Luna 5 микрон С8(2) размером 100×20 мм), элюировали в течение 35 минут, начиная со 100% буфера А (0,1% ТFА в воде) и 0% буфера В (0,1% ТFА в ацетонитриле) и заканчивая 75% буфером А и 25% буфером В, осуществляя мониторинг при 235 нм. После лиофилизации получали 85,7 мг конечного продукта. С помощью масс-спектроскопии ESI определяли, что ион М+1 имеет массу 410,5 Да, что согласуется с рассчитанной молекулярной массой 409,6 Да.
Пример 7) Получение H-Реn-Lys-Phe-NH 2 (SEQ ID NO:6)
Указанный пептид синтезировали на микроволновом пептидном синтезаторе модели LibertyTM (CEM Corp., Matthews, NC), используя амидную смолу Ринка МВНА (347 мг, 0,25 ммоль) (Novabiochem, San Diego, Calif.). Аминокислоты Fmoc-Phe-OH, Fmoc-Lys(BOC)-OH и Fmoc-Pen(Trt)-OH (Novabiochem, San Diego, CA) использовали с четырехкратным избытком, применяя активацию HBTU, и каждое присоединение повторяли.
Пептид отщепляли от смолы путем встряхивания смолы с 8% триспропилсилан/трифторуксусной кислотой (TFA) с добавлением 1% дитиотреитола (10 мл) в течение трех часов. Смолу фильтровали и промывали с помощью DCM (5 мл). Фильтраты объединяли и концентрировали до 3 мл. Для преципитации пептида добавляли диэтиловый эфир (35 мл). После центрифугирования собирали осажденный пептид. Осадок растворяли в воде и ацетонитриле и затем лиофилизировали.
Полученный сырой продукт очищали с помощью системы обратнофазовой HPLC (колонка Luna 5 микрон С8(2) размером 100×20 мм), элюировали в течение 35 минут, начиная со 100% буфера А (0,1% ТFА в воде) и 0% буфера В (0,1% ТFА в ацетонитриле) и заканчивая 80% буфером А и 20% буфером В, мониторируя при 235 нм. После лиофилизации получали 83,9 мг конечного продукта. С помощью масс-спектроскопии ESI определяли, что ион М+1 имеет массу 424,5 Да, что согласуется с рассчитанной молекулярной массой 423,6 Да.
Пример 8) Получение mPEG-Dma-Lys-Phe-NH 2 (SEQ ID NO:7)
В данном документе mPEG имеет структуру СН3О(СН2СН2О)n-(СН2)2-, где n представляет собой положительное целое число.
Пептидный продукт, полученный в примере 7 (0,5 мг, 1,18 микромоль), растворяли в 1,0 мл буфера со значением рН 4 (20 ммоль NaOAc). К полученному раствору добавляли mPEG-альдегид (в количестве 1,5 эквивалентов, средняя молекулярная масса равняется 20644 Да, NOF Corp., Tokyo, Japan) и ТСЕР (в количестве 2,0 эквивалентов). По данным анализа, проведенного с использованием системы обратнофазовой аналитической HPLC (колонка для разделения пептидов/белков Vydac C18 5µ, 4,6Ч250 мм), реакция была завершена примерно на 80% через три часа при комнатной температуре. Реакционную смесь наносили на спин-колонку для обессоливания ZebaТМ объемом 10 мл (Pierce Biotechnology, Rockford, IL). После лиофилизации получали вспененное белое вещество.
Пример 9) Получение mPEG-Thc-Lys-Phe-NH 2 (SEQ ID NO:8)
В данном документе mPEG имеет структуру СН3О(СН2СН2О)n-(СН2)2-, где n представляет собой положительное целое число.
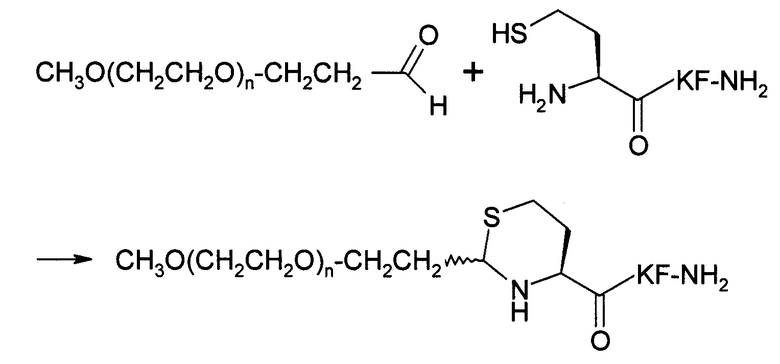
Пептидный продукт, полученный в примере 6 (0,5 мг, 1,22 микромоль), растворяли в 1,0 мл буфера со значением рН 4 (20 ммоль NaOAc). К полученному раствору добавляли mPEG-альдегид (в количестве 1,5 эквивалентов, средняя молекулярная масса равняется 20644 Да, NOF Corp., Tokyo, Japan) и ТСЕР (в количестве 2,0 эквивалентов). По данным анализа, проведенного с использованием системы обратнофазовой аналитической HPLC (колонка для разделения пептидов/белков Vydac C18 5µ, 4,6×250 мм), реакция была завершена примерно на 90% через три часа при комнатной температуре. Реакционную смесь наносили на спин-колонку для обессоливания ZebaТМ объемом 10 мл (Pierce Biotechnology, Rockford, IL). После лиофилизации получали вспененное белое вещество.
Пример 10) Получение селенCys-Lys-Phe-NH 2 (SEQ ID NO:9)
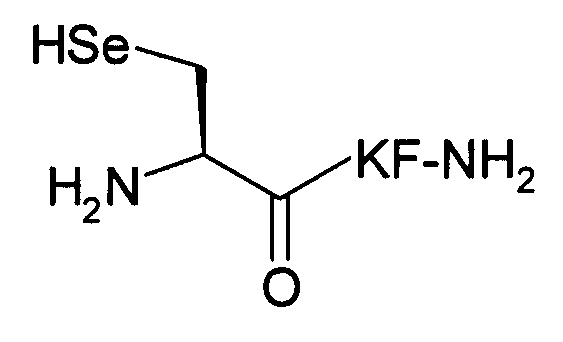
Указанный пептид синтезировали по существу согласно процедуре, описанной в примере 1. Для встраивания селенцистеинового остатка на N-конце использовали Fmoc-селенCys (4-MeOBzl)-OH (Novabiochem, San Diego, СА).
Пример 11) Получение mPEG-Sez-Lys-Phe-NH 2 (SEQ ID NO:10)
В данном докумете mPEG имеет структуру СН3О(СН2СН2О)n-(СН2)2-, где n представляет собой положительное целое число.
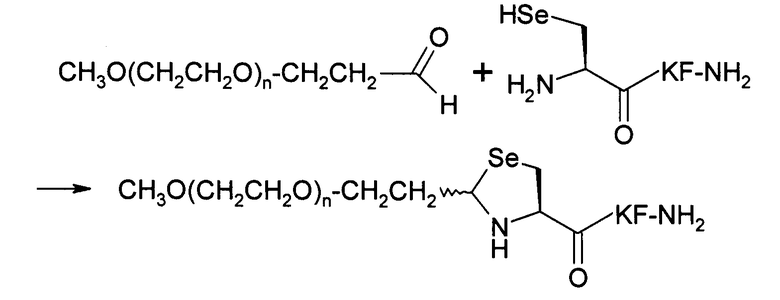
Указанный пептид синтезировали по существу согласно процедуре, описанной в примере 2. Продукт, полученный в примере 10, является исходным пептидным материалом.
Пример 12) Получение
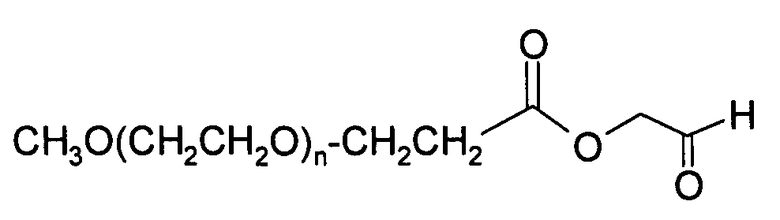
В данном документе mPEG имеет структуру СН3О(СН2СН2О)n-(СН2)2-, где n представляет собой положительное целое число.
Цезиевая соль mPEG-С(О)ОН взаимодействует с диметилацеталем бромацетальдегида в DMF при проведении реакции в течение 2 дней при 60°С. После удаления растворителя продукт обрабатывают с помощью 40% TFA в DCM в присутствии небольшого количества воды при 0°С в течение около 30 минут.
Пример 13) Получение mPEG-Hth-Lys-Phe-NH 2 (SEQ ID NO:11)
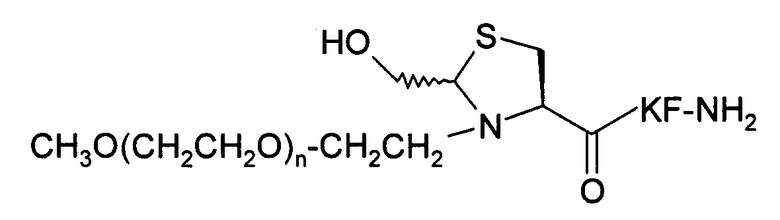
В данном документе mPEG имеет структуру СН3О(СН2СН2О)n-(СН2)2-, где n представляет собой положительное целое число.
Указанный пептид синтезируют по существу согласно процедуре, описанной в примере 2. Исходный пептидный материал представляет собой продукт, полученный в примере 4. Исходный материал PEG-альдегида представляет собой продукт, полученный в примере 12. Перед очисткой проводится дополнительная стадия доведения рН буферного раствора: выдержав при комнатной температуре в течение 2 часов при значении рН4, рН реакционного раствора доводят до значения 7 и выдерживают при комнатной температуре в течение 3 дней.
Пример 14) Получение mPEG-Hdm-Lys-Phe-NH 2 (SEQ ID NO:12)
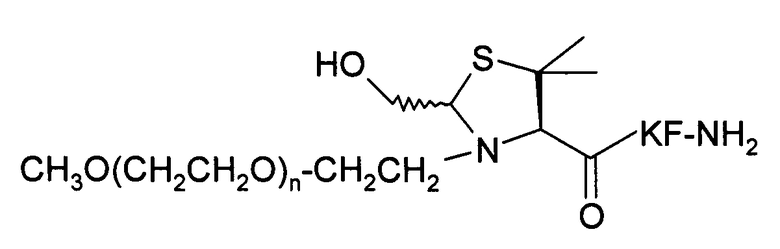
В данном документе mPEG имеет структуру СН3О(СН2СН2О)n-(СН2)2-, где n представляет собой положительное целое число.
Указанный пептид синтезируют по существу согласно процедуре, описанной в примере 8. Исходный пептидный материал представляет собой продукт, полученный в примере 7. Исходный материал PEG-альдегида представляет собой продукт, полученный в примере 12. Перед очисткой проводится дополнительная стадия доведения рН буферного раствора: выдержав при комнатной температуре в течение ночи, рН реакционного раствора доводят до значения 7 и выдерживают раствор при комнатной температуре в течение 3 дней.
Пример 15) Получение mPEG-Haz-Lys-Phe-NH 2 (SEQ ID NO:13)
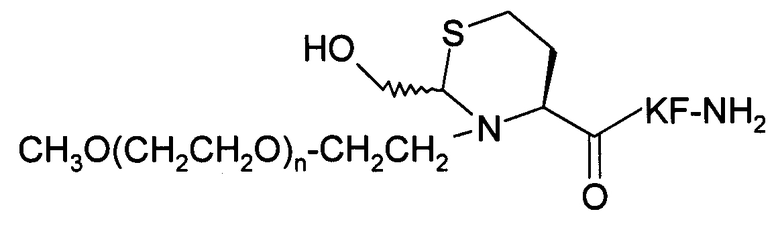
В данном документе mPEG имеет структуру СН3О(СН2СН2О)n-(СН2)2-, где n представляет собой положительное целое число.
Указанный пептид синтезируют по существу согласно процедуре, описанной в примере 9. Исходный пептидный материал представляет собой продукт, полученный в примере 6. Исходный материал PEG-альдегида представляет собой продукт, полученный в примере 12. Перед очисткой проводится дополнительная стадия доведения рН буферного раствора: выдержав при комнатной температуре в течение ночи при значении рН 4, рН реакционного раствора доводят до значения 7 и выдерживают раствор при комнатной температуре в течение 3 дней.
Пример 16) Получение mPEG-Hsz-Lys-Phe-NH 2 (SEQ ID NO:14)
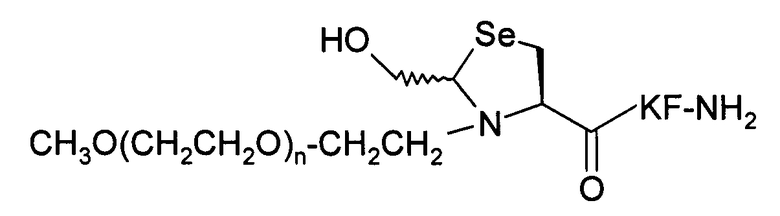
В данном документе mPEG имеет структуру СН3О(СН2СН2О)n-(СН2)2-, где n представляет собой положительное целое число.
Указанный пептид синтезируют по существу согласно процедуре, описанной в примере 11. Исходный пептидный материал представляет собой продукт, полученный в примере 10. Исходный материал PEG-альдегида представляет собой продукт, полученный в примере 12. Перед очисткой проводится дополнительная стадия доведения рН буферного раствора: выдержав при комнатной температуре в течение 2 часов при значении рН 4, рН реакционного раствора доводят до значения 7 и выдерживают раствор при комнатной температуре в течение 3 дней.
Пример 17) Получение H-Pen(Prd-PEG)-Lys-Phe-NH 2 (SEQ ID NO:15)
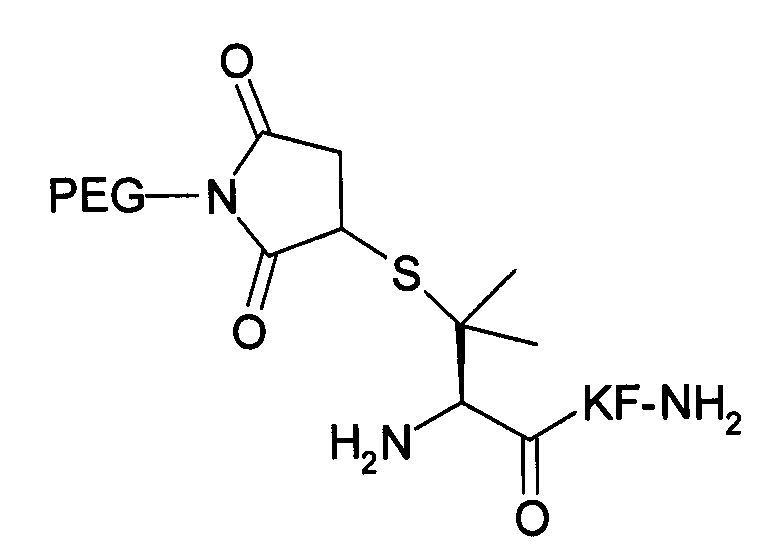
Указанный пептид синтезируют по существу согласно процедуре, описанной в примере 3. Исходный пептидный материал представляет собой продукт, полученный в примере 7.
Пример 18) Получение H-hCys(Prd-PEG)-Lys-Phe-NH 2 (SEQ ID NO:16)
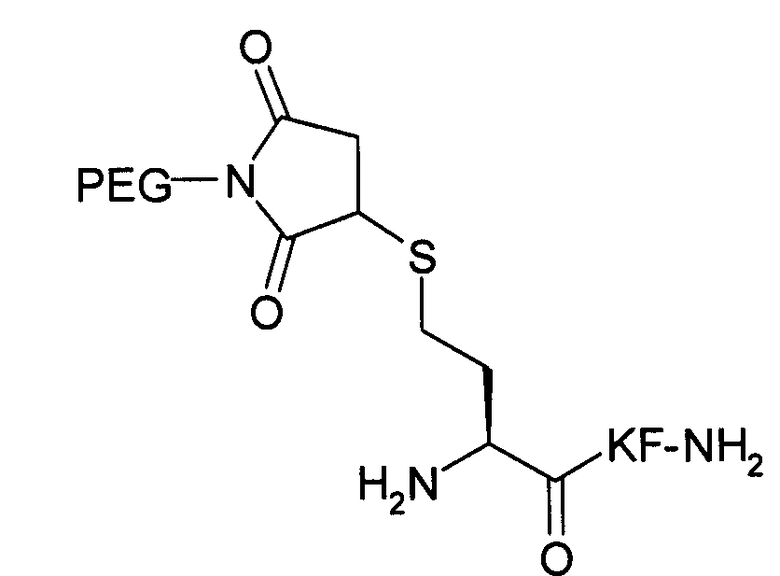
Пептидный продукт, полученный в примере 6 (1,0 мг, 2,44 микромоль), растворяли в 1,0 мл буфера со значением рН 7 (20 ммоль NaOAc). К полученному раствору добавляли α-(3-(3-малеимид-1-оксопропил)амино) пропил-ω-метоксиполиоксиэтилен (в количестве 1,5 эквивалентов, средняя молекулярная масса 11962 Да, NOF Corp., Tokyo, Japan) и гидрохлорид трис(2-карбоксиэтил) фосфина (ТСЕР) в количестве 2 эквивалентов. По данным анализа, проведенного с использованием системы обратнофазовой аналитической HPLC (колонка для разделения пептидов/белков Vydac C18 5µ, 4,6×250 мм), реакция была завершена через один час при комнатной температуре. Реакционную смесь наносили на спин-колонку для обессоливания ZebaТМ объемом 10 мл (Pierce Biotechnology, Rockford, IL). После лиофилизации получали вспененное белое вещество.
Пример 19) Получение H-селенCys(Prd-PEG)-Lys-Phe-NH 2 (SEQ ID NO:17)
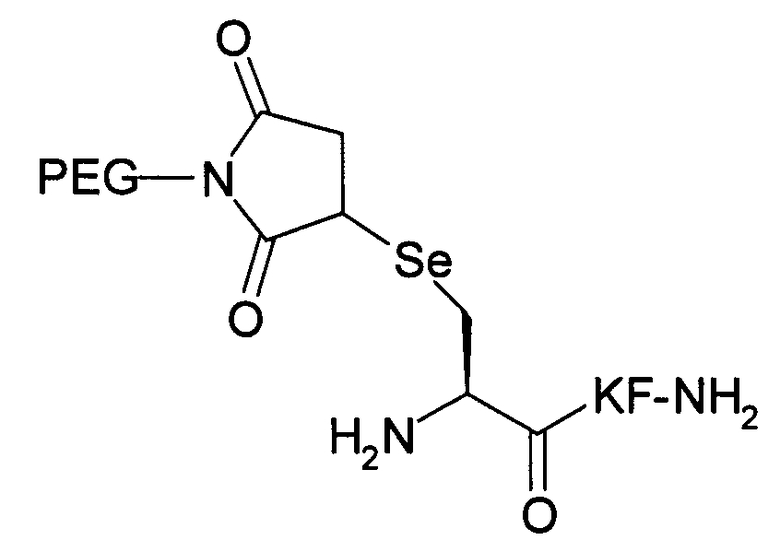
Указанный пептид синтезируют по существу согласно процедуре, описанной в примере 3. Исходный пептидный материал представляет собой продукт, полученный в примере 10.
| название | год | авторы | номер документа |
|---|---|---|---|
| Сайт-специфически монопегилированные аналоги эксендина и способ их получения | 2012 |
|
RU2625015C2 |
| Линкерные звенья и содержащие их молекулярные конструкции | 2018 |
|
RU2752671C2 |
| ПЕПТИДЫ ГЛЮКАГОНОВОГО СУПЕРСЕМЕЙСТВА, ОБЛАДАЮЩИЕ АКТИВНОСТЬЮ ОТНОСИТЕЛЬНО ЯДЕРНЫХ ГОРМОНАЛЬНЫХ РЕЦЕПТОРОВ | 2011 |
|
RU2604067C2 |
| АНАЛОГИ ГЛЮКАГОНА, ОБЛАДАЮЩИЕ ПОВЫШЕННОЙ РАСТВОРИМОСТЬЮ И СТАБИЛЬНОСТЬЮ В БУФЕРАХ С ФИЗИОЛОГИЧЕСКИМИ ЗНАЧЕНИЯМИ Ph | 2009 |
|
RU2560254C2 |
| КОНЪЮГАТЫ ИНСУЛИН-ИНКРЕТИН | 2014 |
|
RU2678134C2 |
| ПЕПТИДНЫЕ ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ С ПОВЫШЕННОЙ ЭФФЕКТИВНОСТЬЮ ПРОТИВ ИНСУЛИНОРЕЗИСТЕНТНОСТИ | 2012 |
|
RU2602801C2 |
| АНАЛОГИ ОКСИНТОМОДУЛИНА | 2009 |
|
RU2542362C2 |
| ПЕПТИДНЫЕ СОЕДИНЕНИЯ | 2005 |
|
RU2393167C2 |
| Улучшенный способ получения конъюгата физиологически активного полипептида | 2013 |
|
RU2639256C2 |
| ЦИКЛИЧЕСКИЕ ПЕПТИДЫ С АНТИНЕОПЛАСТИЧЕСКОЙ И АНТИАНГИОНЕННОЙ АКТИВНОСТЬЮ | 2012 |
|
RU2603286C2 |







Настоящее изобретение относится к способам хемоселективного пегилирования цистеинового остатка, обладающего неокисленной сульфгидрильной боковой цепью и свободной α-аминогруппой в пептидах. Предлагаются аналогичные способы хемоселективного пегилирования гомоцистеинового, селенцистеинового, пеницилламинового и N-метилцистеинового остатков. 9 н. и 4 з.п. ф-лы.
1. Способ химического конъюгирования PEG, содержащего одну или несколько свободных альдегидных групп, с неокисленной сульфгидрильной боковой цепью и свободной α-аминогруппой D- или L-цистеинового остатка пептида, включающий взаимодействие свободной альдегидной группы указанного PEG с неокисленной сульфгидрильной боковой цепью и свободной α-аминогруппой указанного цистеинового остатка в присутствии восстановителя с образованием в продукте 1,3-тиазолидиновой группы, где указанный продукт имеет структуру
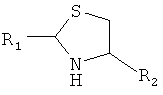 ,
,
где R1 представляет собой указанный PEG, и R2 представляет собой указанный пептид.
2. Способ химического конъюгирования PEG, содержащего одну или несколько свободных альдегидных групп, с неокисленной сульфгидрильной боковой цепью и свободной α-аминогруппой D- или L-цистеинового остатка пептида, где указанный способ включает взаимодействие в реакционном растворе свободной альдегидной группы указанного PEG с неокисленной сульфгидрильной боковой цепью и свободной α-аминогруппой указанного цистеинового остатка в присутствии восстановителя с образованием в промежуточном продукте 1,3-тиазолидиновой группы; и
доведение рН реакционного раствора до значения приблизительно 7, при котором указанный промежуточный продукт перегруппируется с образованием конечного продукта, где указанный промежуточный продукт имеет структуру
 ,
,
и указанный конечный продукт имеет структуру
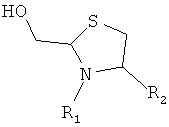 ,
,
где R1 представляет собой указанный PEG, и R2 представляет собой указанный пептид.
3. Способ химического конъюгирования PEG, содержащего одну или несколько свободных альдегидных групп, с неокисленной сульфгидрильной боковой цепью и свободной α-аминогруппой D- или L-пеницилламинового остатка пептида, включающий взаимодействие свободной альдегидной группы указанного PEG с неокисленной сульфгидрильной боковой цепью и свободной α-аминогруппой указанного пеницилламинового остатка в присутствии восстановителя с образованием в продукте 5,5-диметил-1,3-тиазолидиновой группы, где указанный продукт имеет структуру
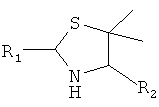 ,
,
где R1 представляет собой указанный PEG, и R2 представляет собой указанный пептид.
4. Способ химического конъюгирования PEG, содержащего одну или несколько свободных альдегидных групп, с неокисленной сульфгидрильной боковой цепью и свободной α-аминогруппой D- или L-пеницилламинового остатка пептида, где указанный способ включает взаимодействие в реакционном растворе свободной альдегидной группы указанного PEG с неокисленной сульфгидрильной боковой цепью и свободной α-аминогруппой указанного пеницилламинового остатка в присутствии восстановителя с образованием в промежуточном продукте 5,5-диметил-1,3-тиазолидиновой группы; и доведение рН реакционного раствора до значения приблизительно 7, при котором указанный промежуточный продукт перегруппируется с образованием конечного продукта, где указанный промежуточный продукт имеет структуру
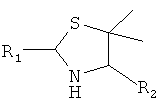 ,
,
и указанный конечный продукт имеет структуру
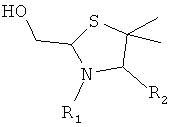 ,
,
где R1 представляет собой указанный PEG, и R2 представляет собой указанный пептид.
5. Способ химического конъюгирования PEG, содержащего одну или несколько свободных альдегидных групп, с неокисленной сульфгидрильной боковой цепью и свободной α-аминогруппой D- или L-гомоцистеинового остатка пептида, включающий взаимодействие свободной альдегидной группы указанного PEG с неокисленной сульфгидрильной боковой цепью и свободной α-аминогруппой указанного гомоцистеинового остатка в присутствии восстановителя с образованием в продукте шестичленной кольцевой системы, где указанный продукт имеет структуру
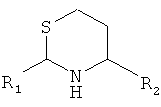 ,
,
где R1 представляет собой указанный PEG, и R2 представляет собой указанный пептид.
6. Способ химического конъюгирования PEG, содержащего одну или несколько свободных альдегидных групп, с неокисленной сульфгидрильной боковой цепью и свободной α-аминогруппой D- или L-гомоцистеинового остатка пептида, где указанный способ включает взаимодействие в реакционном растворе свободной альдегидной группы указанного PEG с неокисленной сульфгидрильной боковой цепью и свободной α-аминогруппой указанного гомоцистеинового остатка в присутствии восстановителя с образованием в промежуточном продукте шестичленной кольцевой системы; и
доведение рН реакционного раствора до значения приблизительно 7, при котором указанный промежуточный продукт перегруппируется с образованием конечного продукта, где указанный промежуточный продукт имеет структуру
 ,
,
и указанный конечный продукт имеет структуру
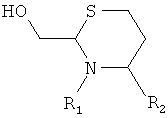
где R1 представляет собой указанный PEG, и R2 представляет собой указанный пептид.
7. Способ химического конъюгирования PEG, содержащего одну или несколько свободных альдегидных групп, с неокисленной свободной селеногруппой и свободной α-аминогруппой D- или L-селенцистеинового остатка пептида, включающий взаимодействие свободной альдегидной группы указанного PEG с неокисленной свободной селеногруппой и свободной α-аминогруппой указанного селенцистеинового остатка в присутствии восстановителя с образованием в продукте пятичленной кольцевой системы, где указанный продукт имеет структуру
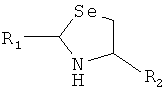 ,
,
где R1 представляет собой указанный PEG, и R2 представляет собой указанный пептид.
8. Способ химического конъюгирования PEG, содержащего одну или несколько свободных альдегидных групп, с неокисленной свободной селеногруппой и свободной α-аминогруппой D- или L-селенцистеинового остатка пептида, где указанный способ включает
взаимодействие в реакционном растворе свободной альдегидной группы указанного PEG с неокисленной свободной селеногруппой и свободной α-аминогруппой указанного селенцистеинового остатка в присутствии восстановителя с образованием в промежуточном продукте пятичленной кольцевой системы; и
доведение рН реакционного раствора до значения приблизительно 7, при котором указанный промежуточный продукт перегруппируется с образованием конечного продукта, где указанный промежуточный продукт имеет структуру
 ,
,
и указанный конечный продукт имеет структуру
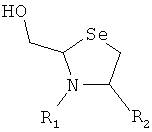 ,
,
где R1 представляет собой указанный PEG, и R2 представляет собой указанный пептид.
9. Способ химического конъюгирования PEG, содержащего одну или несколько свободных альдегидных групп, с неокисленной сульфгидрильной боковой цепью и свободной α-метил-аминогруппой D- или L-N-метилцистеинового остатка пептида, включающий взаимодействие свободной альдегидной группы указанного PEG с неокисленной сульфгидрильной боковой цепью и свободной α-метиламиногруппой указанного N-метилцистеинового остатка в присутствии восстановителя с образованием в продукте 3-метил-1,3-тиазолидиновой группы, где указанный продукт имеет структуру
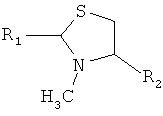 ,
,
где R1 представляет собой указанный PEG, и R2 представляет собой указанный пептид.
10. Способ по любому из пп.1-9, в котором свободная альдегидная группа присоединяется к указанному PEG посредством линкера, который может содержать в качестве функциональной группы амид, сложный эфир, сульфонамид, сульфонил, тиол, окси, алкил, алкенил, алкинил, арил, малеимид или амин или любое их сочетание.
11. Способ по п.10, в котором указанный PEG имеет линейную, разветвленную или сильноразветвленную структуру.
12. Способ по п.11, в котором указанный PEG имеет среднюю молекулярную массу от примерно 100 Да до примерно 500000 Да, предпочтительно от примерно 1000 Да до примерно 50000 Да.
13. Способ по любому из пп.1-9, в котором указанный восстановитель выбирают из группы, состоящей из ТСЕР, соединений, содержащих неокисленную сульфгидрильную группу, и соединений, содержащих неокисленную свободную селеногруппу.
| WO 2004085386 А2, 07.10.2004 | |||
| RU 2005134471 A, 10.03.2006 | |||
| NATARAJAN A | |||
| ET AL.: «CHARACTERIZATION OF SITE-SPECIFIC SCFV PEGYLATION FOR TUMOR-TARGETING PHARMACEUTICALS» BIOCONJUGATE CHEM | |||
| Устройство для электрической сигнализации | 1918 |
|
SU16A1 |
| US 20040037802 A1, 26.02.2004 | |||
| US 5589356 A, 31.12.1996. | |||
Авторы
Даты
2011-07-20—Публикация
2007-05-25—Подача