Изобретение относится к медицинской технике, а именно к оптическим способам исследования свойств клеток крови путем измерения светопропускания. Из достигнутого уровня техники известен способ анализа агрегации тромбоцитов, согласно которому с использованием одного источника света и двух фотоприемников одновременно измеряют светопропускание пробы крови при непрерывном ее перемешивании и образца сравнения, обедненного тромбоцитами, а по величине разности сигналов судят о степени агрегации (US 4135818, Kent, et al., 23.01.1979).
Основной недостаток способа - невозможность определения размера агрегатов, поскольку оптическая плотность крови неоднозначно связана с размером образующихся агрегатов. Так, возможны случаи, когда две пробы различаются количеством вошедших в агрегаты тромбоцитов и размером образовавшихся агрегатов, но обладают одинаковой величиной оптической плотности. Кроме того, на оптическую плотность существенное влияние оказывает форма тромбоцитов. Переход тромбоцитов от плоских дисков к округлой форме приводит к изменению оптической плотности на 30-40%.
Известен также способ оптического анализа агрегации тромбоцитов, согласно которому через оптическую кювету, заполненную пробой крови до заданного уровня, пропускают коллимированный узкий пучок света и фотоприемником регистрируют прошедший сигнал, при этом одновременно проводят перемешивание образца. Из сигнала фотоприемника выделяют постоянную и переменную составляющие, определяют среднюю интенсивность Ic света, прошедшего через пробу, и его среднее квадратическое отклонение σ. Размер агрегатов определяют исходя из величины квадрата отношения σ/Ic (патент US 5071247, Markosian et al., 12.10.1991 - прототип).
Недостаток прототипа заключается в его недостаточной информативности, поскольку не дает возможности определить степень агрегации тробоцитов, то есть долю числа тромбоцитов, вошедших в агрегаты.
Настоящее изобретение направлено на решение технической задачи по повышению информативности анализа при одновременном повышении точности измерений.
Способ анализа агрегации тромбоцитов включает формирование в кювете с пробой крови при ее перемешивании основного измерительного канала с помощью коллимированного узкого пучка света, регистрацию фотопреобразователем интенсивности света, прошедшего основной измерительный канал с последующим выделением постоянной и переменной составляющих электрического сигнала и оценку среднего размера агрегатов тромбоцитов,
Способ характеризуется, в отличие от прототипа, тем, что непосредственно перед окончанием перемешивания пробы определяют среднюю интенсивность Iск света, прошедшего через основной измерительный канал, сформированный в кювете в нижней части пробы. По завершении перемешивания формируют в верхней части пробы, вблизи ее уровня, аналогичный основному дополнительный измерительный канал, в котором регистрируют установившееся во времени значение Iу интенсивности света, а о степени агрегации судят по величине логарифма отношения Iу/Iск.
Способ может характеризоваться и тем, что дополнительный измерительный канал размещают на расстоянии h от уровня пробы, удовлетворяющем условию: 0,5d≤h≤2,6 мм, где d - поперечный размер оптических измерительных каналов в вертикальном направлении, мм.
Способ может характеризоваться также тем, что средний размер агрегатов тромбоцитов оценивают по величине отношения (σ/Iс)2, где Iс - средняя интенсивность света, прошедшего через основной оптический измерительный канал; σ - среднее квадратическое отклонение интенсивности света относительно Iс.
Технический результат состоит в возможности измерений в одной и той же пробе как среднего размера агрегатов, так и степени агрегации тромбоцитов, а также повышения точности определения этих характеристик.
В основе достижения технического результата лежат следующие соображения и предпосылки. Обеспечение равномерного перемешивания пробы по всему ее объему при одновременном измерении светопропускания является крайне сложной технической задачей. Следствием неравномерного перемешивания является неравномерное распределение агрегатов по высоте пробы. В случае образования агрегатов различного размера степень неравномерности распределения их по высоте увеличивается вследствие седиментации более крупных в донную часть кюветы. Поэтому патентуемое расположение основного измерительного канала обеспечивает повышение вероятности пересечения этого канала агрегатами, размер которых изменяется в диапазоне, практически соответствующем реальному распределению их по размерам. С окончанием процесса перемешивания пробы оседание агрегатов интенсифицируется. В результате, как показали собственные исследования, через интервал времени 10-15 сек с момента окончания перемешивания в верхней части пробы отсутствуют агрегаты тромбоцитов, при этом под верхней частью пробы подразумевается область, лежащая от уровня пробы на расстоянии h, удовлетворяющем условию: 0,5d≤h≤2,6 мм, где d - поперечный размер оптических измерительных каналов в вертикальном направлении.
Следовательно, установившееся во времени значение интенсивности Iу света, прошедшего через дополнительный измерительный канал, будет зависеть только от концентрации тромбоцитов, не вошедших в агрегаты за время перемешивания. Поскольку величина средней интенсивности Iск света, прошедшего через измерительный канал, перед окончанием перемешивания, будет зависеть не только от концентрации тромбоцитов в пробе, но и от концентрации образовавшихся за то же время агрегатов, логарифм отношения Iу/Iск будет соответствовать концентрации агрегатов в пробе. Что касается нижнего предела величины h, то реализация соотношения h<0,5d (при d≤1 мм) приводит к неоправданным трудозатратам при осуществлении способа. При h≥0,5d точной юстировки оптических элементов относительно пробы крови не требуется.
В дальнейшем сущность изобретения поясняется конкретным примером, который, однако, не является единственно возможным, но наглядно демонстрирует возможность достижения указанных выше технических результатов патентуемой совокупностью существенных признаков.
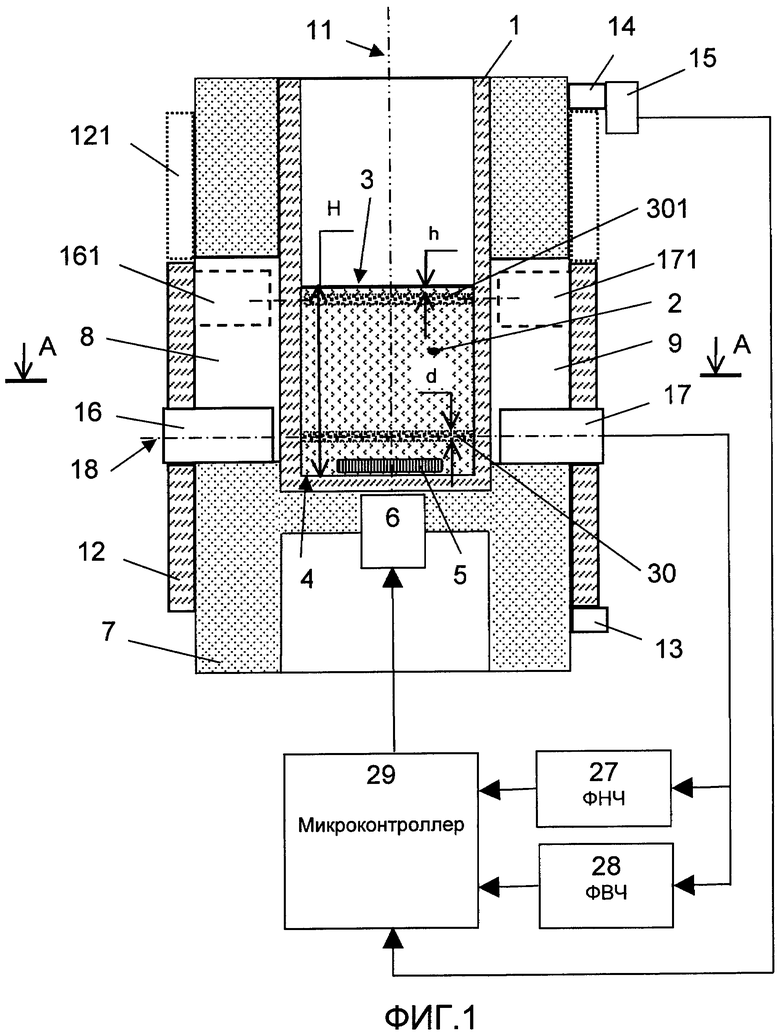
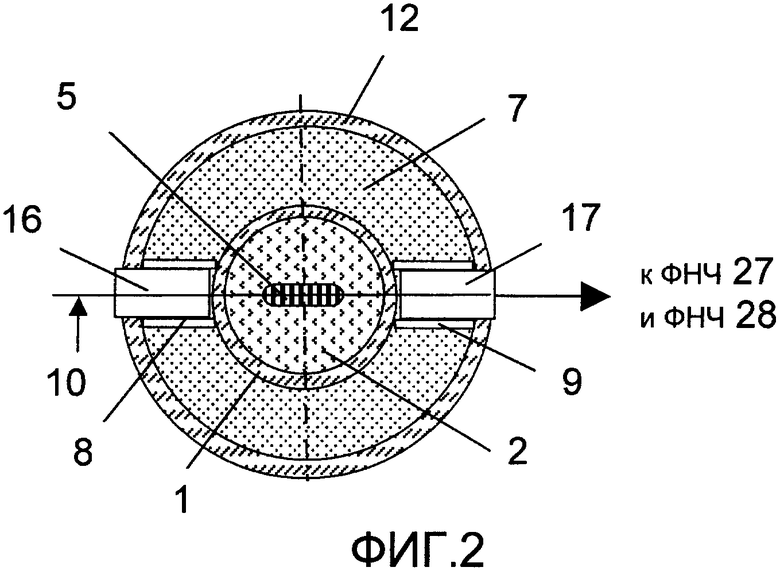
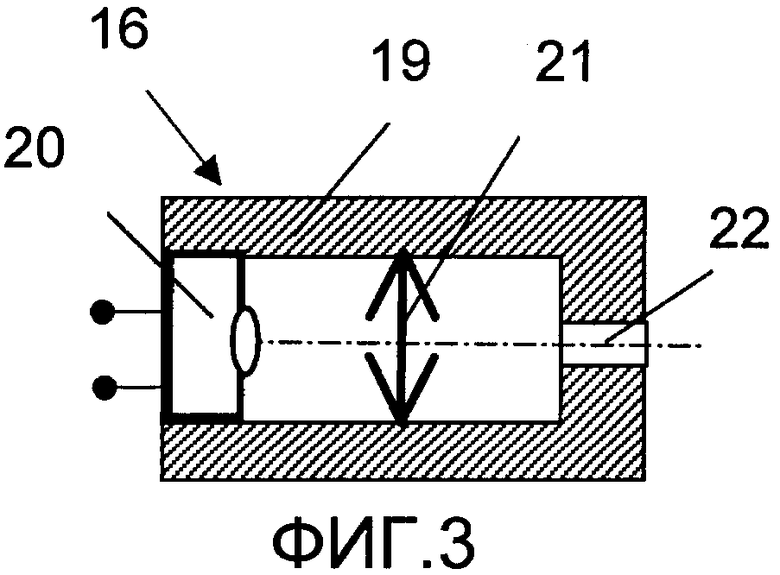
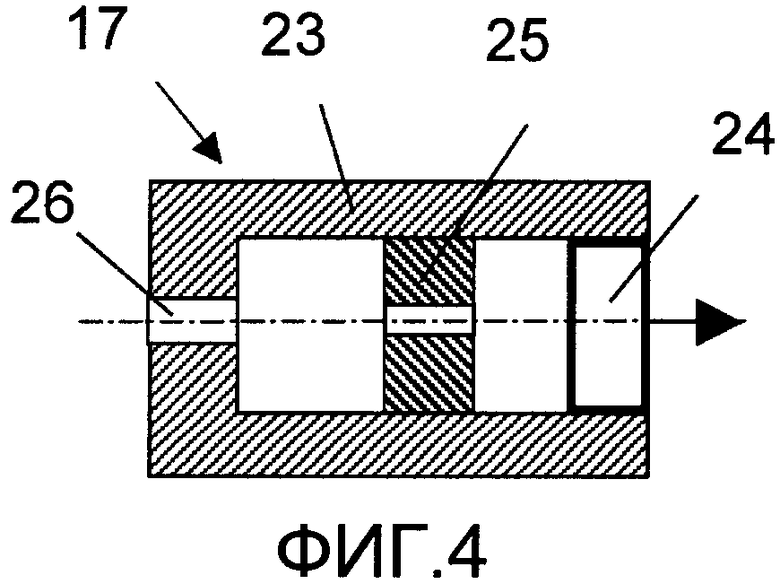
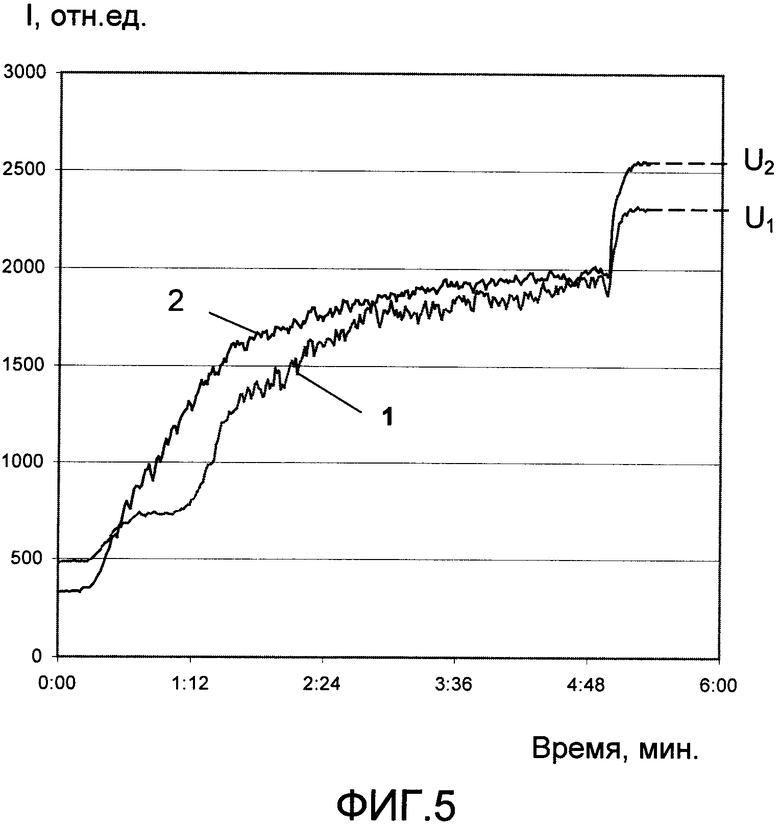
На фиг.1 изображена принципиальная схема оптического анализатора для осуществления патентуемого способа; на фиг.2 - разрез по A-A фиг.1; на фиг.3 и 4 - соответственно конструкция светоизлучающего и фотоприемного модулей, продольный разрез (увеличено); на фиг.5 - временная зависимость сигнала с выхода фотопреобразователя.
Оптический анализатор (фиг.1, 2) содержит оптическую кювету 1 для размещения в ней исследуемой пробы 2 крови (объемом 0,5-1,5 мл), которая заполняет ее до уровня 3, расположенного на расстоянии Н от ее дна 4. На дне 4 размещен якорь 5 магнитной мешалки, которая приводится в действие с помощью бесконтактного привода 6. Кювета 1 помещена в термостат 7, в котором образованы два паза 8, 9, расположенные напротив друг друга и симметрично относительно плоскости 10, проходящей через ось 11 кюветы. Анализатор содержит кольцевой держатель 12, выполненный с возможностью продольного перемещения (вручную или с помощью привода (не показан)) и фиксации упорами 13 и 14 с электроконтактным датчиком 15 положения.
Светоизлучающий 16 и фотоприемный 17 модули соосно закреплены на держателе 12 и размещены в соответствующих пазах 8, 9 с возможностью перемещения при переводе держателя 12 из одного крайнего положения в другое.
Модуль 16 (фиг.3) выполнен в виде цилиндрической оправы 19, в которой соосно размещены источник света 20 (светодиод, лазерный диод), коллимирующая линза 21, диафрагма 22, выполненная предпочтительно за одно целое с оправой 19.
Модуль 17 (фиг.4) выполнен также в виде цилиндрической оправы 23, в которой соосно размещены фотопреобразователь 24 и две входные диафрагмы 25, 26.
Держатель 12 выполнен из теплоизоляционного материала с высотой, превышающей длину пазов 8, 9 по крайней мере на величину его максимального перемещения относительно термостата 7.
Электронная часть анализатора включает блоки предварительной обработки сигнала, а именно фильтр 27 низких частот (ФНЧ), фильтр 28 высоких частот (ФВЧ), а также микроконтроллер 29. Выход фотоприемного модуля 17 соединен с входами блоков 27, 28, а их выходы - с микроконтроллером 29 для цифровой обработки сигналов, анализа и управления.
На фиг.1 поз.30 и 301 обозначены основной и дополнительный измерительные каналы, функционирующие соответственно во время перемешивания пробы 2 и по окончании перемешивания. В крайнем верхнем положении держатель 12 обозначен поз.121, а модули 16 и 17 - соответственно поз.161 и 171.
Способ осуществляют следующим образом.
В исходном состоянии держатель 12 размещен в крайнем нижнем положении, как это показано на фиг.1. Кювету 1 заполняют подготовленной пробой 2 до уровня 3, соответствующего расстоянию Н от дна 4. С помощью привода 6 магнитной мешалки по сигналу от блока 29 осуществляется перемешивание пробы.
Основной измерительный канал 30 посредством модулей 16, 17 формируют в нижней части кюветы параллельно уровню пробы, а именно выше якоря 5 и на расстоянии, превышающем величину H/2 относительно уровня 3. Поперечный размер коллимированного пучка света как дополнительного 301, так и основного 30 измерительных каналов в вертикальном направлении составляет d=0,3-1,0 мм. Свет, прошедший через пробу 2, через входные диафрагмы 25 и 26 модуля 17 поступает на фотоприемник 24.
Из сигнала с фотопреобразователя 24 выделяют с помощью ФНЧ 27 постоянную составляющую, которая соответствует средней интенсивности Ic; а помощью ФВЧ 28 - переменную составляющую, используемую для вычисления в микроконтроллере 29 (по тому же алгоритму, что и в прототипе) среднего квадратического отклонения о интенсивности света относительно Iс. Суждение о среднем размере агрегатов тромбоцитов, образующихся в процессе перемешивания, выносят по величине (σ/Ic)2. Исследования показали, что рекомендованное ограничение на размещение основного канала 30 по высоте обеспечивает повышение точности определения среднего размера агрегатов тромбоцитов, поскольку именно в этом диапазоне размер агрегатов практически соответствует распределению агрегатов по размерам в пробе.
После отключения привода 6 перемешивание прекращается и происходит естественная седиментация агрегатов. На этом этапе в верхней части пробы вблизи уровня 3 формируют аналогичный основному 30 дополнительный измерительный канал 301. Этот канал размещают на расстоянии h от уровня 3 пробы, удовлетворяющем условию: 0,5d≤h≤2,6 мм, где d - поперечный размер измерительного канала в вертикальном направлении, мм. Для этого держатель 12 переводят в крайнее верхнее положение - поз.121, срабатывает электроконтактный датчик 15. В результате на соответствующий вход микроконтроллера 29 подается сигнал, обеспечивающий запуск другой программы обработки сигнала с выхода фотопреобразователя 24. Через ФНЧ 27, выполняющий в данном случае функции сглаживающего фильтра, сигнал, соответствующий временной зависимости, поступает в микроконтроллер 29.
По мере седиментации интенсивность света на фотопреобразователе 24 возрастает и примерно через 10 сек достигает установившегося во времени значения Iу, которое определяется концентрацией тромбоцитов в пробе, не вошедших в агрегаты.
На основании полученных величин оценивают степень агрегации концентрации тромбоцитов по величине логарифма отношения Iу/Iск, где Iск - среднее значение интенсивности света, прошедшего через основной измерительный канал 30 непосредственно перед окончанием перемешивания пробы.
Таким образом, при указанном ограничении на положение канала 301 обеспечивается повышение точности определения степени агрегации тромбоцитов, поскольку позволяет максимально уменьшить (до 10-15 сек) интервал времени между моментами регистрации величин Iск и Iу.
Установлено, что при увеличении величины h от 0,5d до 2,6 мм величина Δt изменяется незначительно (не более чем на 10%), однако при дальнейшем увеличении h величина Δt сначала быстро увеличивается, а затем ее рост замедляется.
На фиг.5 представлена временная зависимость сигнала с выхода фотопреобразователя 24 для двух проб (кривая 1 - соответствует добавке в пробу индуктора АДФ в количестве 1 мкМ, кривая 2 - 2 мкМ). Видно, что с увеличением концентрации индуктора степень агрегации тромбоцитов возрастает. На графиках обозначены уровни сигналов U1 и U2, соответствующие установившимся интенсивностям света соответственно для первого и второго образцов.
Промышленная применимость патентуемого способа подтверждается возможностью его реализации по представленному описанию с использованием широко известных в данной области технических средств.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОПТИЧЕСКОГО АНАЛИЗА АГРЕГАЦИИ ТРОМБОЦИТОВ | 2009 |
|
RU2426990C1 |
| ОПТИЧЕСКИЙ СПОСОБ РЕГИСТРАЦИИ КИНЕТИКИ АГРЕГАЦИИ ЧАСТИЦ В МУТНЫХ СУСПЕНЗИЯХ | 2012 |
|
RU2516193C2 |
| СПОСОБ ИССЛЕДОВАНИЯ АГРЕГАЦИОННОЙ СПОСОБНОСТИ ЧАСТИЦ КОЛЛОИДНОЙ СИСТЕМЫ | 2009 |
|
RU2405133C1 |
| УСТРОЙСТВО ДЛЯ ОПРЕДЕЛЕНИЯ АГРЕГАЦИОННОЙ СПОСОБНОСТИ ТРОМБОЦИТОВ И СВЕРТЫВАЕМОСТИ КРОВИ | 2007 |
|
RU2343456C1 |
| СПОСОБ ИССЛЕДОВАНИЯ НАЧАЛЬНОЙ АГРЕГАЦИИ ТРОМБОЦИТОВ (ВАРИАНТЫ) И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ (ВАРИАНТЫ) | 1994 |
|
RU2067764C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АГРЕГАЦИИ ТРОМБОЦИТОВ В ПЛАЗМЕ КРОВИ И ВРЕМЕНИ ЕЕ КОАГУЛЯЦИИ | 2006 |
|
RU2336525C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АГРЕГАЦИОННОЙ АКТИВНОСТИ ТРОМБОЦИТОВ И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2008 |
|
RU2391665C1 |
| СПОСОБ ОЦЕНКИ РИСКА ПОВТОРНЫХ ТРОМБОТИЧЕСКИХ СОБЫТИЙ У БОЛЬНЫХ ОСТРЫМ КОРОНАРНЫМ СИНДРОМОМ | 2010 |
|
RU2419800C1 |
| УСТРОЙСТВО ДЛЯ АНАЛИЗА БИОЛОГИЧЕСКОЙ ЖИДКОСТИ | 2012 |
|
RU2500999C2 |
| Способ определения индивидуальной чувствительности к нифедипину у больных сердечно-сосудистыми заболеваниями | 1991 |
|
SU1786437A1 |
Изобретение относится к медицине, а именно к лабораторной диагностике, и может быть использовано для анализа агрегации тромбоцитов. Для этого в кювете с пробой крови при ее перемешивании формируют основной измерительный канал с помощью коллимированного узкого пучка света. Затем фотопреобразователем регистрируют интенсивность света, прошедшего основной измерительный канал, с последующим выделением постоянной и переменной составляющих электрического сигнала и определяют средний размер агрегатов тромбоцитов. Непосредственно перед окончанием перемешивания пробы определяют среднюю интенсивность Icк света, прошедшего через основной измерительный канал, сформированный в кювете в нижней части пробы. По завершении перемешивания формируют в верхней части пробы, вблизи ее уровня, аналогичный основному дополнительный измерительный канал, в котором регистрируют установившееся во времени значение Iу интенсивности света. По величине логарифма отношения Iу/Iск судят о степени агрегации. Изобретение обеспечивает возможность измерения в одной и той же пробе как среднего размера агрегатов, так и степени агрегации тромбоцитов, а также повышение точности определения этих характеристик. 2 з.п. ф-лы, 5 ил.
1. Способ анализа агрегации тромбоцитов, включающий
формирование в кювете с пробой крови при ее перемешивании основного измерительного канала с помощью коллимированного узкого пучка света, регистрацию фотопреобразователем интенсивности света, прошедшего основной измерительный канал с последующим выделением постоянной и переменной составляющих электрического сигнала и оценку среднего размера агрегатов тромбоцитов, отличающийся тем, что непосредственно перед окончанием перемешивания пробы определяют среднюю интенсивность Iск света, прошедшего через основной измерительный канал, сформированный в кювете в нижней части пробы, по завершении перемешивания формируют в верхней части пробы вблизи ее уровня аналогичный основному дополнительный измерительный канал, в котором регистрируют установившееся во времени значение Iу интенсивности света, а о степени агрегации судят по величине логарифма отношения Iу/Iск.
2. Способ по п.1, отличающийся тем, что дополнительный измерительный канал размещают на расстоянии h от уровня пробы, удовлетворяющем условию:
0,5d≤h≤2,6 мм, где d - поперечный размер оптических измерительных каналов в вертикальном направлении, мм.
3. Способ по п.1, отличающийся тем, что средний размер агрегатов тромбоцитов оценивают по величине отношения (σ/Iс)2, где Ic - средняя интенсивность света, прошедшего через основной оптический измерительный канал; σ - среднее квадратическое отклонение интенсивности света относительно Iс.
| US 5071247 А, 10.12.1991 | |||
| СПОСОБ ИССЛЕДОВАНИЯ НАЧАЛЬНОЙ АГРЕГАЦИИ ТРОМБОЦИТОВ (ВАРИАНТЫ) И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ (ВАРИАНТЫ) | 1994 |
|
RU2067764C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АГРЕГАЦИИ ТРОМБОЦИТОВ В ПЛАЗМЕ КРОВИ И ВРЕМЕНИ ЕЕ КОАГУЛЯЦИИ | 2006 |
|
RU2336525C2 |
| US 4135818 A, 23.01.1979 | |||
| US 6043871 A, 28.03.2000 | |||
| ЛИХАЧЕВ С.А | |||
| и др | |||
| Ишемический инсульт: современные методы лабораторного мониторинга антитромботической терапии | |||
| Учебно-методическое пособие | |||
| - Минск, 2008, с.41-46. | |||
Авторы
Даты
2011-08-27—Публикация
2009-12-25—Подача