Изобретение относится к медицинской технике, а именно к оптическим способам исследования свойств клеток крови путем измерения светопропускания.
Из достигнутого уровня техники известны различные способы анализа агрегации тромбоцитов (см., например, Смоляницкий А.Я. Методы исследования системы гемостаза // Лабораторные методы исследования в клинике: Справочник / Под ред. В.В.Меньшикова. - М.: Медицина, 1987, с.152-154). Эти способы основаны на прямом подсчете числа тромбоцитов и определении распределения их агрегатов по размерам, вследствие чего характеризуются значительной трудоемкостью.
Известен способ оптического анализа агрегации тромбоцитов, согласно которому проводят прокачку пробы крови по замкнутому контуру, формируют измерительный оптический канал путем освещения участка контура, выделяют две компоненты рассеянного излучения в двух угловых интервалах, а о размерах агрегатов судят по соотношению величины измеренных сигналов (см. патент US 6043871, Solen et al., 28.03.2000). Однако результат измерений зависит не только от размеров агрегатов, но и их формы, которая априори неизвестна.
Известен оптический способ анализа агрегации тромбоцитов, при котором одновременно измеряют светопропускание исследуемой пробы и пробы сравнения, содержащей обедненную тромбоцитами плазму, и по величине разности измеренных сигналов судят о степени агрегации (US 3989382, Kent et al., 02.11.1976). Основной недостаток способа - невозможность определения размера агрегатов, поскольку оптическая плотность крови неоднозначно связана с размером образующихся агрегатов. Так, возможны случаи, когда две пробы различаются количеством вошедших в агрегаты тромбоцитов и размером образовавшихся агрегатов, но обладают одинаковой величиной оптической плотности. Кроме того, на оптическую плотность существенное влияние оказывает форма тромбоцитов. Переход тромбоцитов от плоских дисков к округлой форме приводит к изменению оптической плотности на 30-40%.
Известен также способ оптического анализа агрегации тромбоцитов, согласно которому через оптическую кювету с пробой крови пропускают узкий пучок света, и фотоприемником регистрируют прошедший сигнал, при этом одновременно посредством магнитной мешалки проводят перемешивание образца. Из сигнала фотоприемника выделяют постоянную и переменную составляющие, определяют среднюю интенсивность света, прошедшего через пробу, и его среднее квадратическое отклонение. Размер агрегатов определяют исходя из величины квадрата отношения среднего квадратического отклонения интенсивности света к его средней интенсивности (патент US 5071247, Markosian et al., 12.10.1991, - прототип). Однако прототип имеет следующие недостатки:
а) невысокую достоверность определения параметров агрегации, поскольку мешалка не обеспечивает равномерного перемешивания по всему объему пробы, а это приводит к неравномерному распределению агрегатов по высоте кюветы. При этом степень неравномерности увеличивается за счет оседания более крупных частиц в донную часть кюветы. Результаты измерений будут зависеть как от положения пучка света оптического канала, так и соотношения между геометрическими размерами канала и кюветы, а следовательно, не адекватны реальному процессу;
б) недостаточно высокую точность измерений из-за изменений интенсивности пучка света, обусловленных нестабильностью источника во времени, его старения, а также вследствие замены;
в) значительный объем образца - не менее 0,5 мл.
Настоящее изобретение направлено на решение технической задачи по повышению достоверности определения параметров агрегации тромбоцитов при одновременном повышении точности измерений и возможности использования проб объемом от 50 до 100 мкл.
Поставленная цель достигается тем, что способ анализа агрегации тромбоцитов, включает преобразование фотоприемником интенсивности пучка света, прошедшего измерительный оптический канал, в электрический сигнал в условиях перемешивания пробы крови в сосуде и вычисление параметров агрегации.
Отличие способа состоит в том, что перемешивание осуществляют посредством периодического всасывания части пробы из сосуда в капилляр с последующим ее вытеснением обратно в сосуд. Преобразуют интенсивность пучка света, прошедшего через участок капилляра, являющийся измерительным каналом и соответствующий двукратному пересечению упомянутого участка мениском пробы в каждый период ее всасывания и вытеснения, в электрический сигнал, из которого выделяют импульсы, каждый из которых образован в результате пересечения пробой светового пучка в соответствующий каждому импульсу период всасывания и вытеснения пробы. Измеряют среднее значение амплитуды Uc каждого импульса относительно уровня составляющей электрического сигнала, предшествующей его переднему фронту, вычисляют ее среднее квадратическое отклонение σ, а о среднем размере агрегатов тромбоцитов судят по величине квадрата отношения σ/Uc.
Способ может характеризоваться тем, что периодическое всасывание и вытеснение пробы осуществляют посредством замкнутой камеры переменного объема.
Способ может характеризоваться и тем, что максимальный объем V1 пробы крови, находящейся в капилляре в процессе измерений, составляет V1=(0,96-0,98)V0, где V0 - объем пробы.
Способ может характеризоваться также тем, что периодическому всасыванию и вытеснению подвергают часть пробы, составляющую не менее 0,9V1 от ее объема.
Технический результат состоит в повышении равномерности перемешивания малого объема образцов (от 50 до 100 мкл) и исключении влияния на результаты измерений светопропускания стенок капилляра и нестабильности интенсивности пучка света.
Преимущество патентуемого способа перед прототипом состоит в том, что принудительное периодическое всасывание и вытеснение части пробы из капилляра в сосуд обеспечивает перемешивание образца. На этапе вытеснения обеспечивается струйное затопленное истечение из капилляра в сосуд, сопровождающееся турбулентным перемешиванием всего исследуемого образца крови, который к тому же в 5-10 раз меньше, чем в прототипе. Этот же эффект (хотя и в меньшей степени) будет иметь место и при перемещении образца в самом капилляре при неустановившемся режиме течения.
Другое преимущество состоит в том, что за счет периодического перемещения части пробы по капилляру обеспечивается двукратное сканирование значительной части пробы световым пучком. Вследствие этого достигается повышение достоверности определения параметров агрегации тромбоцитов.
Благодаря тому что световой пучок проходит через участок капилляра, соответствующий двукратному пересечению мениском пробы в каждый период ее всасывания и вытеснения, электрический сигнал на выходе фотопреобразователя содержит предшествующую переднему фронту каждого импульса составляющую, относительно уровня которой среднее значение амплитуды импульса не зависит ни от интенсивности пучка света, направленного на капилляр, ни от светопропускания его стенок, а зависит только от оптических параметров образца. Следствием этого является повышение точности измерений патентуемым способом. Достаточность малого объема образцов от 50 до 100 мкл расширяет возможности метода.
Сущность изобретения поясняется конкретными примерами, которые, однако, не являются единственно возможными, но наглядно демонстрируют возможность достижения указанных выше технических результатов патентуемой совокупностью признаков.
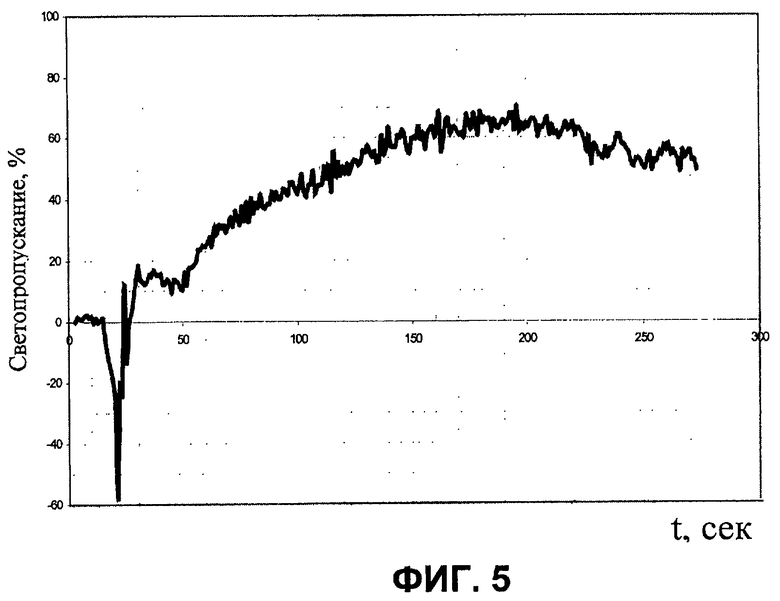
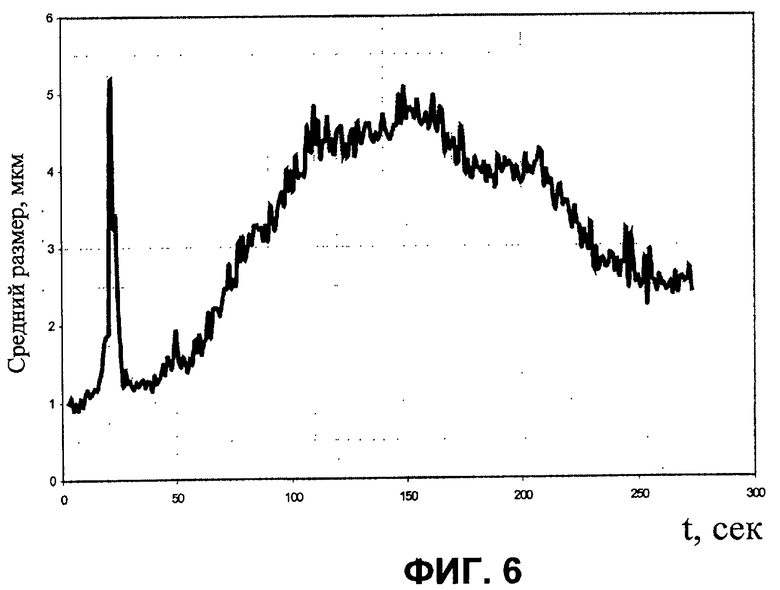
На фиг.1 изображена принципиальная схема оптического анализатора для осуществления патентуемого способа; на фиг.2 - то же, но другой пример выполнения сосуда для пробы крови; на фиг.3 - временная зависимость объема замкнутой камеры переменного объема; на фиг.4 - временная зависимость электрического сигнала (для наглядности инвертированного) на выходе фотопреобразователя; на фиг.5, 6 - экспериментально полученные временные зависимости соответственно светопропускания и среднего размера агрегатов.
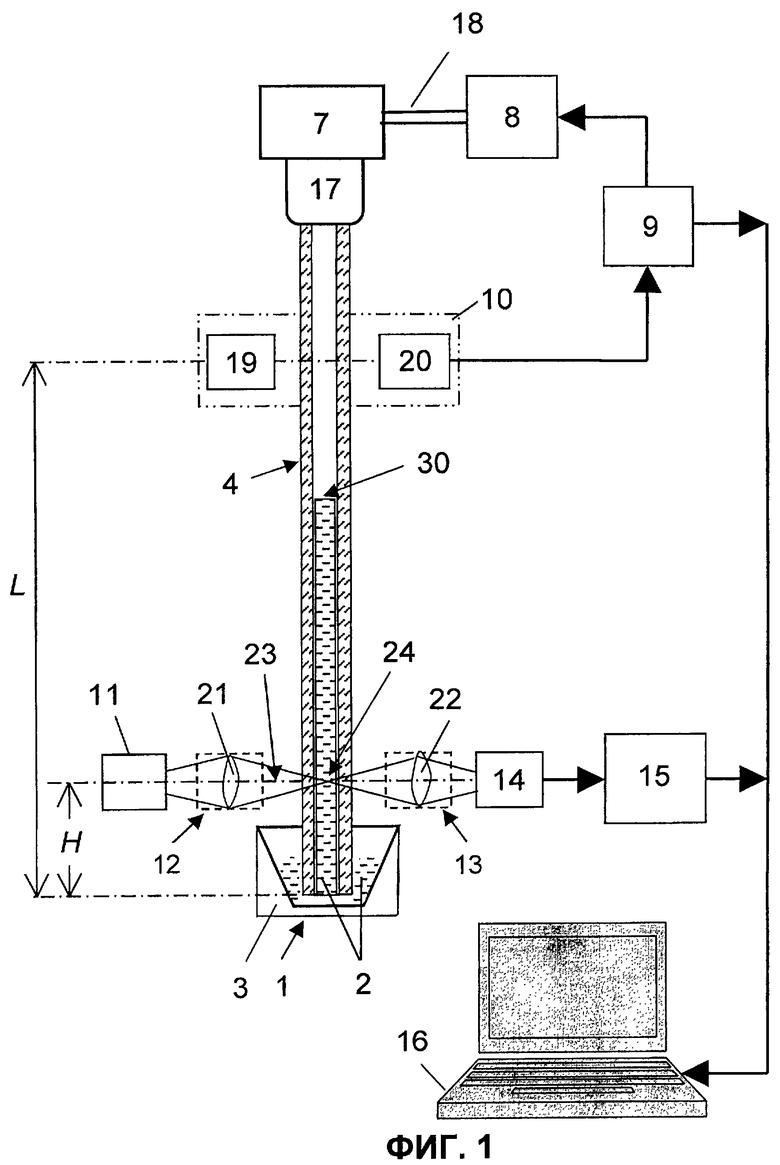
Оптический анализатор (фиг.1) для осуществления патентуемого способа содержит сосуд 1 для размещения в нем пробы 2 крови, термостат 3, капилляр 4, выполненный в виде трубки из оптически прозрачного материала (стекла, кварца) с узким каналом, диаметр которого 0,2-1 мм, замкнутую камеру 7 переменного объема, привод 8 возвратно-поступательного перемещения, блок 9 управления приводом 8, датчик 10 уровня, источник 11 света, формирующие оптические системы 12, 13, фотопреобразователь 14, аналого-цифровой преобразователь (АЦП) 15 и компьютер 16.
Сосуд 1 помещен в термостат 3, а первый конец капилляра 4 размещен в полости сосуда 1 с обеспечением его контакта с пробой 2. Капилляр 4 сообщается с полостью замкнутой камеры 7 посредством трубки 17, надетой на его второй конец. В простейшем случае одна из стенок замкнутой камеры 7 выполнена в виде поршня, шток 18 которого соединен с приводом 8 возвратно-поступательного перемещения. Вместо поршня может быть использована мембрана (диафрагма), которая жестко закреплена по всему своему периметру, аналогично тому, как это реализовано в мембранных (диафрагменных) насосах. Первый выход блока 9 соединен с управляющим входом привода 8 возвратно-поступательного перемещения. Датчик 10 уровня, предпочтительно, выполнен в виде оптоэлектронной пары, а именно светодиода 19 и фотоприемника 20, которые расположены напротив друг друга и по обе стороны капилляра 4. В принципе, в качестве датчика 10 уровня могут быть использованы и другие известные из уровня техники, предпочтительно бесконтактные, датчики уровня. Датчик 10 уровня установлен на расстоянии L от торца первого конца капилляра 4, которое определяется из соотношения: L=V1/S, где V1 - максимальный объем пробы 2, которая в процессе измерений находится в капилляре 4, S - площадь поперечного сечения канала капилляра. Выход датчика 10 уровня соединен с управляющим входом блока 9, второй выход которого связан для синхронизации работы анализатора с компьютером.
Источник 11 света (светодиод, полупроводниковый лазер и т.п.), формирующая оптическая система 12 (в простейшем случае линза 21), капилляр 4, приемная оптическая система 13 (в простейшем случае линза 22) и фотопреобразователь 14 расположены последовательно вдоль общей оптической оси 23, пересекающей ось капилляра 4 на расстоянии Н от торца его первого конца. Свет от источника 11 света с помощью формирующей оптической системы 12 преобразуется в пучок света, распространяющийся в направлении к капилляру 4 и имеющий параметры, обеспечивающие образование в капилляре 4 (в его канале) измерительного оптического канала 24. В представленном на фиг.1 случае пучок света является сходящимся на ось капилляра 4. В принципе, в качестве формирующей оптической системы 12 может быть использован коллиматор, обеспечивающий формирование узкого параллельного пучка света. Прошедший через капилляр 4 свет собирается с помощью приемной оптической системы 13 и направляется на фотопреобразователь 14, выход которого через АЦП 15 соединен с компьютером 16.
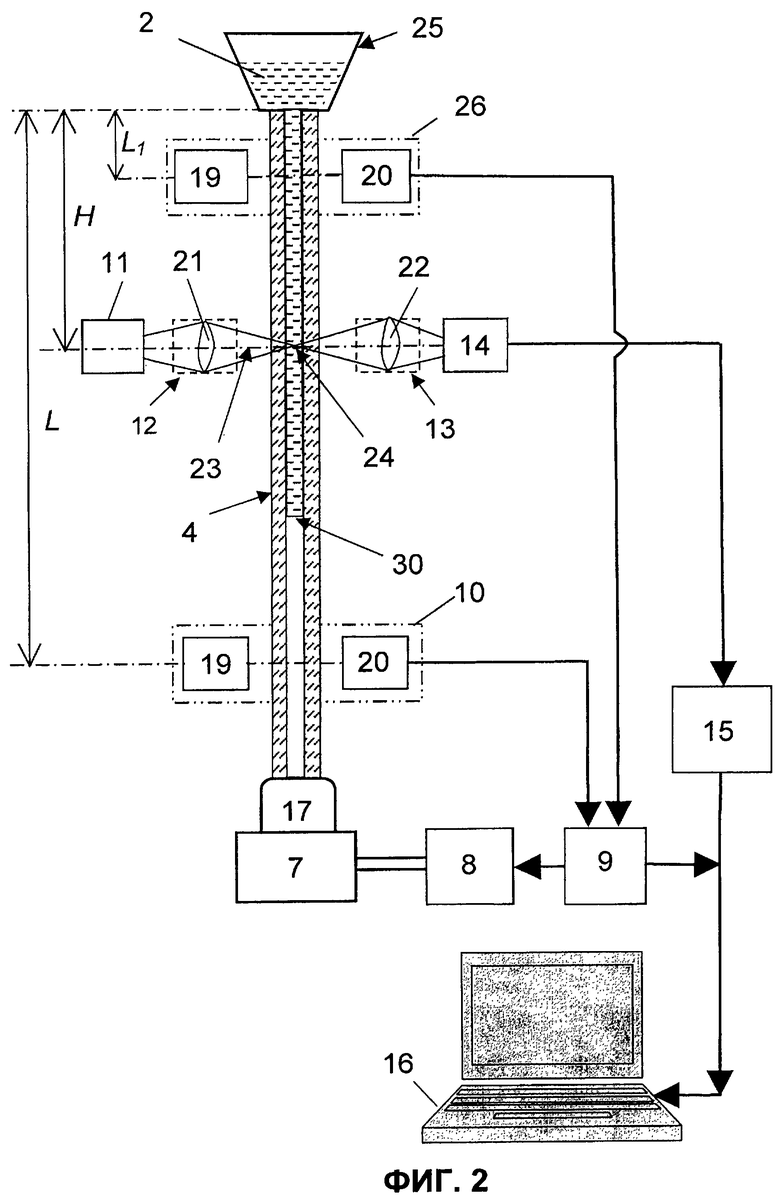
Оптический анализатор (фиг.2) содержит сосуд 25 для размещения пробы 2 крови, при этом сосуд 25 выполнен сужающимся книзу (предпочтительно в виде воронки) с отверстием в дне. Первый конец капилляра 4 герметично закреплен в отверстии дна сосуда 25. Аналогично тому, как описано выше для варианта фиг.1, капилляр 4 сообщается с полостью замкнутой камеры 7 посредством трубки 17, надетой на второй его конец, одна из стенок замкнутой камеры 7 выполнена в виде поршня, шток которого соединен с приводом 8 возвратно-поступательного перемещения. Датчик 10 уровня установлен также на расстоянии L от торца первого конца капилляра 4, а его выход соединен с управляющим входом блока 9. Кроме того, образующие передающий тракт источник 11 света и формирующая оптическая система 12, а также образующие приемный тракт приемная оптическая система 13 и фотопреобразователь 14 расположены на оптической оси 23, пересекающей ось капилляра 4 на расстоянии Н от торца его первого конца. Выход фотопреобразователя 14, так же как и в варианте на фиг.1, соединен через АЦП 15 с компьютером 16, первый выход блока 9 соединен с управляющим входом привода 8, а второй выход связан с компьютером 16.
Представленный на фиг.2 оптический анализатор содержит также дополнительный датчик 26 уровня, выход которого соединен с дополнительным управляющим входом блока 9. Дополнительный датчик 26 уровня выполнен аналогично датчику 10 и установлен на расстоянии L1=(V1-V2)/S от торца первого конца капилляра 4, где V2 - объем пробы 2, которая вытесняется из капилляра 4 обратно в сосуд 25. Время на фиг.3, 4 обозначено буквой t.
При использовании оптического анализатора, представленного на фиг.1, способ оптического анализа агрегации тромбоцитов осуществляется следующим образом.
Подготовленную для исследования пробу 2 крови объемом V0 помещают в сосуд 1, предпочтительно выполненный сужающимся книзу. Первый конец капилляра 4 погружают в пробу 2 с обеспечением минимально возможного зазора между торцом его первого конца и дном сосуда 1. В результате обеспечивается контакт между находящейся в сосуде 1 исследуемой пробой 2 и первым концом капилляра 4. Со стороны второго конца капилляр 4 посредством трубки 17 сообщается с полостью замкнутой камеры 7 переменного объема. Капилляр 4 предпочтительно размещают вертикально, поскольку при его наклонном или горизонтальном положениях под действием силы тяжести возможно оседание тромбоцитов и/или их агрегатов на стенки канала, что соответственно приведет к погрешности в измерениях.
Далее, в соответствии с выбранным максимальным количеством пробы 2, которая в процессе измерения находится в капилляре 4, устанавливают датчик 10 уровня на расстоянии L от торца первого конца капилляра 4, которое определяется из соотношения: L=V1/S, где V1=(0,9-1,0)V0 - максимальный объем пробы 2 крови, находящейся в капилляре 4 в процессе измерений.
При выборе соотношения между V1 и V0 необходимо иметь в виду следующее. При V1=V0 возможно образование пузырьков воздуха при истечении пробы 2 из капилляра 4 в сосуд 1. При V1<0,9V0 существенно уменьшается исследуемый на светопропускание объем (V1-H·S) пробы 2, что приводит к снижению достоверности результатов измерений. Проведенные исследования показали, что оптимальным является соотношение V1=(0,96-0,98)V0, обеспечивающее, с одной стороны, несущественное уменьшение исследуемой на светопропускание части пробы 2, а с другой стороны, гарантированно безпузырьковое истечение пробы 2 из капилляра 4 обратно в сосуд 1.
После этого осуществляют настройку блока 9 таким образом, чтобы на этапе, соответствующем уменьшению объема замкнутой камеры 7, происходило неполное вытеснение из капилляра 4 обратно в сосуд 1 исследуемой пробы 2, а именно V2=(0,9-0,995)V1. Благодаря этому не происходит образования пузырьков воздуха в самом капилляре 4. Здесь необходимо отметить, что при образовании в капилляре 4 пузырьков воздуха осуществление патентуемого способа становится невозможным. Что касается приведенного выше соотношения между V1 и V2, то при V2<0,9V1 существенно уменьшается исследуемая на светопропускание часть пробы 2, поскольку с увеличением разности между V1 и V2 увеличивается и значение Н. Это приводит к снижению достоверности результатов измерений. Реализация же условия V2>0,995V1 представляет собой трудновыполнимую техническую задачу.
Затем формируют измерительный оптический канал 24 путем пропускания сформированного, например сфокусированного (конического), пучка света через участок капилляра 4, расположенный на расстоянии Н от торца его первого конца, при этом Н должно быть больше значения (V1-V2)/S. Иными словами, расстояние между торцом первого конца капилляра 4 и мениском исследуемой пробы 2 крови в нем на момент окончания этапа, соответствующего уменьшению объема замкнутой камеры 7, должно быть меньше Н. Прошедший через капилляр 4 свет собирают с помощью приемной оптической системы 13, а затем направляют его на фотопреобразователь 14, преобразующий прошедший через капилляр 4 свет в электрический сигнал.
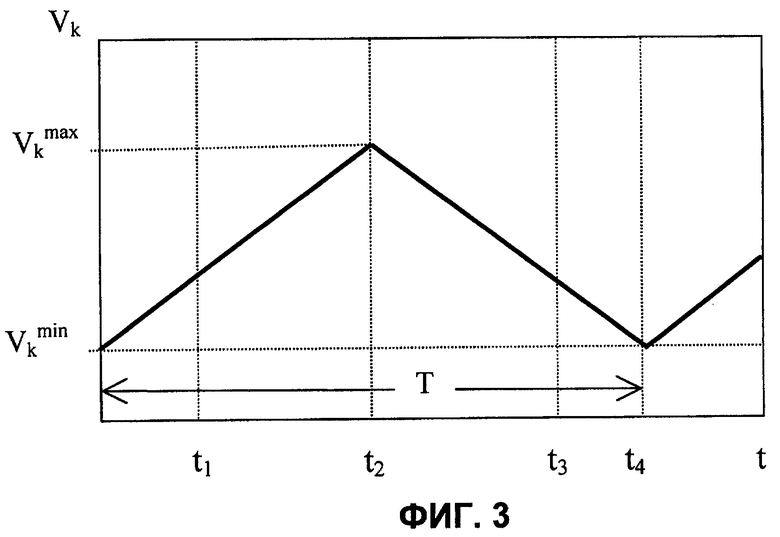
При оптическом анализе агрегации тромбоцитов в пробе 2 (т.е. при определении степени агрегации тромбоцитов в ходе спонтанной агрегации или после воздействия индукторов) периодически изменяют объем Vk камеры 7 (фиг.3), например, по линейному закону. Одновременно с помощью фотопреобразователя 14 преобразуют прошедший через капилляр 4 свет в электрический сигнал U(t). На момент, соответствующий минимальному объему Vk min камеры 7, сигнал на выходе датчика 10 отсутствует. Уровень сигнала на выходе фотопреобразователя 14 определяется интенсивностью пучка света, направленного на капилляр 4, а также светопропусканием его стенок, поскольку в рассматриваемый момент времени мениск исследуемого образца 2 расположен ближе к торцу первого конца капилляра, чем измерительный канал 24. Рассмотренный выше момент времени относится к началу этапа увеличения объема камеры 7. Далее, по мере увеличения объема камеры 7 происходит всасывание пробы 2 из сосуда в капилляр 4, а следовательно, увеличение расстояния между торцом капилляра 4 и мениском 30 пробы в нем.
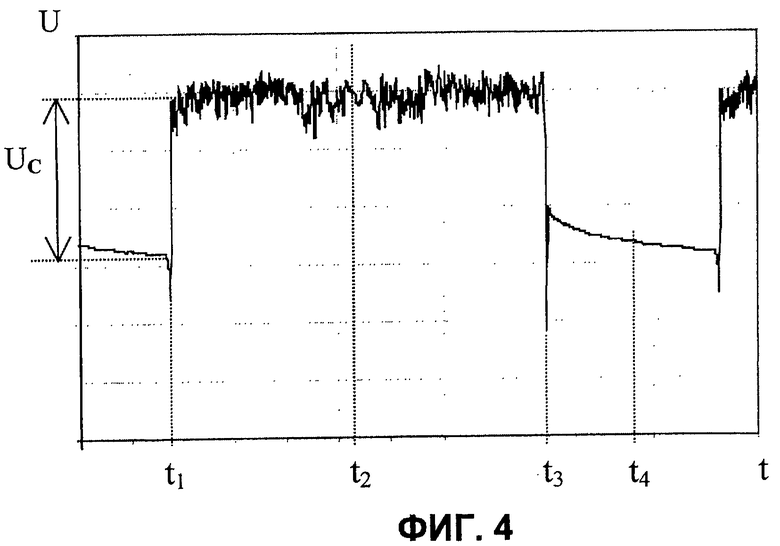
После прохождения мениском 30 канала 24 (при t1>t2, фиг.3, 4) величина сигнала будет определяться не только интенсивностью пучка света, направленного на капилляр 4, и светопропусканием его стенок, но и светопропусканием той дозы крови, которая в соответствующий момент времени находится в пределах границ канала 24. Таким образом, начиная с момента времени t1 за счет увеличения объема камеры 7 осуществляется непрерывное пропускание пробы через канал 24. В момент времени t2 (соответствующий окончанию этапа увеличения объема камеры до Vk max, фиг.3) мениск 30 пробы находится на уровне, соответствующем, с одной стороны, расстоянию L от торца капилляра 4, а с другой, максимальному объему V1 пробы в процессе осуществления измерений. Таким образом, на этапе увеличения объема камеры 7 за интервал времени (t2-t1) через измерительный оптический канал пропускается объем (V1-H·S) пробы 2.
В момент времени t2, соответствующий окончанию этапа увеличения объема камеры 7, срабатывает датчик 10 уровня, и соответствующий сигнал с его выхода подается на управляющий вход блока 9. В блоке 9 формируется сигнал, обеспечивающий реверс привода 8, т.е. переход к этапу, соответствующему уменьшению объема камеры 7. Происходит вытеснение пробы 2 в сосуд 1, а следовательно, уменьшение расстояния между мениском 30 и торцом капилляра 4. Таким образом, начиная с момента времени t2 происходит вытеснение той же порции, величиной (V1-H·S), через измерительный канал 24, но в обратном направлении. В момент времени t3 (см. фиг.3, 4) мениск 30 достигнет канала 24. После прохождения мениском 30 канала 24 уровень сигнала на выходе фотопреобразователя 14 вновь будет определяться только интенсивностью пучка света, направленного на капилляр 4, и светопропусканием его стенок вплоть до момента времени t4, соответствующего достижению объемом замкнутой камеры 7 вновь минимального объема Vk min. Таким образом, за период Т измерения объема формируется импульс с вершиной, имеющей вид реализации случайного процесса длительностью (t3-t1). Вид вершины импульса обусловлен флуктуациями числа частиц (тромбоцитов и/или их агрегатов) в измерительном канале 24 при протекании через него пробы 2. Далее описанный выше цикл повторяется в каждом периоде Т, и на выходе фотопреобразователя 14 имеет место периодическая последовательность импульсов. Безусловное преимущество перед прототипом состоит в том, что электрический сигнал содержит предшествующую переднему фронту каждого импульса составляющую, относительно уровня которой среднее значение амплитуды Uc соответствующего ей импульса не зависит ни от интенсивности пучка света, направленного на капилляр, ни от светопропускания стенок капилляра 4. Сигнал с выхода фотопреобразователя 14 подается на АЦП 15, с выхода которого оцифрованный сигнал поступает в компьютер 16. Последний обеспечивает вычисление среднего значения амплитуды Uc каждого импульса относительно уровня составляющей электрического сигнала, предшествующей переднему фронту этого импульса, а также среднее квадратическое отклонение σ относительно среднего значения амплитуды импульса. Далее, аналогично тому, как это имеет место в прототипе, вычисляется величина квадрата отношения σ/Uc, но для каждого импульса в отдельности. На основании величины (σ/Uc)2 выносят суждение о среднем размере тромбоцитов и/или их агрегатов в соответствующем каждому импульсу интервале времени. В предпочтительном воплощении способа перед измерением Uc каждого импульса дополнительно выделяют его часть, которая расположена симметрично относительно его переднего и заднего фронтов. При этом исключаемые при обработке сигналов интервалы времени, один из которых непосредственно следует за передним фронтом, а другой, равный ему, предшествует заднему фронту каждого выделенного импульса, соответствуют времени, которое необходимо для пересечения измерительного оптического канала долей (V1-V2) пробы, постоянно находящейся в капилляре. Это обеспечивает дополнительное повышение достоверности результатов измерений в случае, когда невозможно обеспечить малую величину (V1-V2).
В анализаторе (фиг.2) используется сосуд 25, первый конец капилляра герметично закрепляют в отверстии дна сосуда, при этом капилляр 4 со стороны его второго конца сообщается с полостью замкнутой камеры 7. Аналогично ранее описанному варианту устанавливают датчик 10 на расстоянии L от торца капилляра 4, которое определяется из соотношения L=V1/S. После этого на расстоянии (V1-V2)/S устанавливают дополнительный датчик 26 уровня, благодаря чему по сравнению с вариантом фиг.1 отпадает необходимость в настройке блока 9 таким образом, чтобы на этапе уменьшения объема камеры 7 происходило вытеснение из капилляра 4 количества исследуемого образца крови объемом V2=(0,9-0,995)V1. В данном варианте реверс привода 8 в момент времени t4 (фиг.3) будет осуществляться автоматически, а именно по сигналу с выхода дополнительного датчика 26 уровня, который подается на дополнительный управляющий вход блока 9. В остальном оптический анализ агрегации тромбоцитов осуществляется аналогично тому, как описано в предыдущем варианте.
В таблице приведены данные, подтверждающие повышение достоверности измерений среднего размера агрегатов тромбоцитов патентуемым способом по сравнению с прототипом и прямой микроскопией. Использовались пробы из одного и того же образца.
На фиг.5 и 6 для наглядности приведен вид типичных экспериментальных зависимостей светопропускания и среднего размера агрегатов от времени в пробе крови.
При необходимости полученные параметры Uc и σ могут быть использованы для определения концентрации тромбоцитов. Для этого необходимо провести измерения на дополнительном образце, в котором отсутствуют тромбоциты. В этом случае величина М, пропорциональная концентрации тромбоцитов, определяется из выражения:
M=[(lnUc1-lnUc)·Uc/σ]2,
где Uc1 - среднее значение амплитуды импульсов при измерении дополнительного образца крови.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОПТИЧЕСКОГО АНАЛИЗА АГРЕГАЦИИ ТРОМБОЦИТОВ | 2009 |
|
RU2427839C1 |
| СПОСОБ ИССЛЕДОВАНИЯ АГРЕГАЦИОННОЙ СПОСОБНОСТИ ЧАСТИЦ КОЛЛОИДНОЙ СИСТЕМЫ | 2009 |
|
RU2405133C1 |
| УСТРОЙСТВО ДЛЯ ОПРЕДЕЛЕНИЯ АГРЕГАЦИОННОЙ СПОСОБНОСТИ ТРОМБОЦИТОВ И СВЕРТЫВАЕМОСТИ КРОВИ | 2007 |
|
RU2343456C1 |
| Способ определения индивидуальной чувствительности к нифедипину у больных сердечно-сосудистыми заболеваниями | 1991 |
|
SU1786437A1 |
| СПОСОБ ИССЛЕДОВАНИЯ ВНУТРИСОСУДИСТОЙ АГРЕГАЦИИ ТРОМБОЦИТОВ IN VITRO | 1996 |
|
RU2102754C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ГЕМОГЛОБИНА, КОЛИЧЕСТВА ЭРИТРОЦИТОВ, ЛЕЙКОЦИТОВ, ТРОМБОЦИТОВ, ГЕМАТОКРИТА И СКОРОСТИ ОСЕДАНИЯ ЭРИТРОЦИТОВ В ЦЕЛЬНОЙ КРОВИ | 2005 |
|
RU2289133C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АГРЕГАЦИИ ТРОМБОЦИТОВ В ПЛАЗМЕ КРОВИ И ВРЕМЕНИ ЕЕ КОАГУЛЯЦИИ | 2006 |
|
RU2336525C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ СТЕПЕНИ АГРЕГАЦИИ КЛЕТОК КРОВИ | 2012 |
|
RU2484465C1 |
| СПОСОБ ЭКСПРЕСС-ОЦЕНКИ ФУНКЦИОНАЛЬНОГО СОСТОЯНИЯ СИСТЕМЫ ГЕМОСТАЗА | 2009 |
|
RU2413954C2 |
| СПОСОБ ДИАГНОСТИКИ НАРУШЕНИЙ АГРЕГАЦИИ ТРОМБОЦИТОВ ПРИ МУКОВИСЦИДОЗЕ У ДЕТЕЙ | 2013 |
|
RU2533287C1 |
Изобретение относится к медицине, а именно к лабораторной диагностике, и может быть использовано для анализа агрегации тромбоцитов. Для этого перемешивание пробы крови осуществляют посредством периодического всасывания части пробы из сосуда в капилляр с последующим ее вытеснением обратно в сосуд. Преобразуют в электрический сигнал интенсивность пучка света, прошедшего через участок капилляра, находящегося в измерительном канале и соответствующего двукратному пересечению упомянутого участка мениском в каждый период всасывания и вытеснения. Выделяют импульсы, образованные в результате пересечения пробой светового пучка в каждый период всасывания и вытеснения пробы. Измеряют среднее значение амплитуды Uc каждого импульса относительно уровня составляющей электрического сигнала, предшествующей его переднему фронту, вычисляют ее среднее квадратическое отклонение σ, а о среднем размере агрегатов тромбоцитов судят по величине квадрата отношения σ/Uc. Изобретение обеспечивает повышение равномерности перемешивания малого объема проб крови (от 50 до 100 мкл) и исключение влияния на результаты измерений светопропускания стенок капилляра и нестабильности пучка света. 3 з.п. ф-лы, 6 ил., 1 табл.
1. Способ анализа агрегации тромбоцитов, включающий преобразование фотоприемником интенсивности пучка света, прошедшего измерительный оптический канал, в электрический сигнал в условиях перемешивания пробы крови в сосуде и вычисление параметров агрегации,
отличающийся тем, что
перемешивание осуществляют посредством периодического всасывания части пробы из сосуда в капилляр с последующим ее вытеснением обратно в сосуд,
преобразуют интенсивность пучка света, прошедшего через участок капилляра, находящийся в измерительном канале и соответствующий двукратному пересечению упомянутого участка мениском пробы в каждый период ее всасывания и вытеснения, в электрический сигнал, из которого выделяют импульсы, образованные в результате пересечения пробой светового пучка в каждый период всасывания и вытеснения пробы,
измеряют среднее значение амплитуды Uc каждого импульса относительно уровня составляющей электрического сигнала, предшествующей его переднему фронту, вычисляют ее среднее квадратическое отклонение σ, а о среднем размере агрегатов тромбоцитов судят по величине квадрата отношения σ/Uc.
2. Способ по п.1, отличающийся тем, что периодическое всасывание и вытеснение пробы осуществляют посредством замкнутой камеры переменного объема.
3. Способ по п.1, отличающийся тем, что максимальный объем V1 пробы крови, находящейся в капилляре в процессе измерений, составляет V1=(0,96-0,98)V0, где V0 - объем пробы.
4. Способ по п.1, отличающийся тем, что периодическому всасыванию и вытеснению подвергают часть пробы, составляющую не менее 0,9 V1 ее объема.
| US 5071247 А, 10.12.1991 | |||
| СПОСОБ ИССЛЕДОВАНИЯ НАЧАЛЬНОЙ АГРЕГАЦИИ ТРОМБОЦИТОВ (ВАРИАНТЫ) И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ (ВАРИАНТЫ) | 1994 |
|
RU2067764C1 |
| СПОСОБ ИССЛЕДОВАНИЯ АКТИВАЦИИ И АГРЕГАЦИИ ТРОМБОЦИТОВ | 1996 |
|
RU2108579C1 |
| УСТРОЙСТВО ДЛЯ ОПРЕДЕЛЕНИЯ АГРЕГАЦИОННОЙ СПОСОБНОСТИ ТРОМБОЦИТОВ И СВЕРТЫВАЕМОСТИ КРОВИ | 2007 |
|
RU2343456C1 |
| УСТРОЙСТВО ДЛЯ ИЗМЕРЕНИЯ ПАРАМЕТРОВ КРОВИ | 1996 |
|
RU2149403C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АГРЕГАЦИИ ТРОМБОЦИТОВ В ПЛАЗМЕ КРОВИ И ВРЕМЕНИ ЕЕ КОАГУЛЯЦИИ | 2006 |
|
RU2336525C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АГРЕГАЦИОННОЙ АКТИВНОСТИ ТРОМБОЦИТОВ И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2008 |
|
RU2391665C1 |
| JP 10267827 A, 09.10.1998 | |||
| Автомобильное ведущее колесо | 1927 |
|
SU10526A1 |
| ГАББАСОВ З.А | |||
| Новый высокочувствительный метод анализа агрегации тромбоцитов | |||
| // Лабораторное дело | |||
| Механизм для сообщения поршню рабочего цилиндра возвратно-поступательного движения | 1918 |
|
SU1989A1 |
Авторы
Даты
2011-08-20—Публикация
2009-11-19—Подача