Уровень техники, к которой относится изобретение
Изобретение относится к новым противоопухолевым соединениям, содержащим их фармацевтическим композициям и их применению в качестве противоопухолевых агентов.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Было показано, что некоторые асимметричные димерные макролиды обладают противоопухолевыми, противовирусными и/или противогрибковыми свойствами. В частности, Kitagawa и др. (Chem. Pharm. Bull., 1994, 42(1), 19-26) выделили несколько асимметричных димерных макролидов из окинавской морской губки Theonella swinhoei:
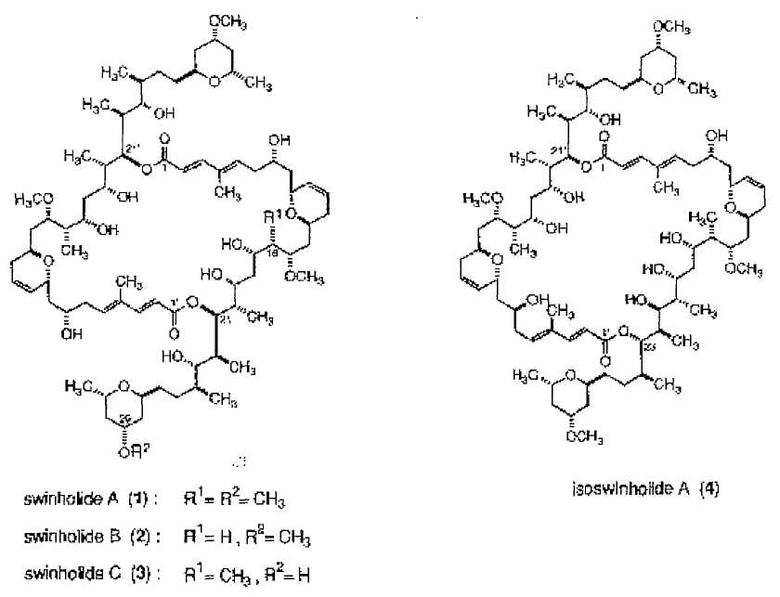
Показано, что Swinholide А (1), В (2) и С (3) проявляют цитотоксическую активность против L1210 и КВ клеток со значением IC50 0,03, 0,30 и 0,14 мкг/мл (для L1210) и 0,04, 0,04 и 0,05 мкг/мл (для КВ), соответственно. Однако наблюдалось, что isoswinhokide A (4) показывал меньшую цитотоксичность [IC50 1,35 мкг/мл (L1210) и 1,1 мкг/мл (КВ)] по сравнению с другими, ранее указанными аналогами.
Kitagawa и др. также проверили цитотоксичность некоторых димеров, полученных из Swinholide А (1):
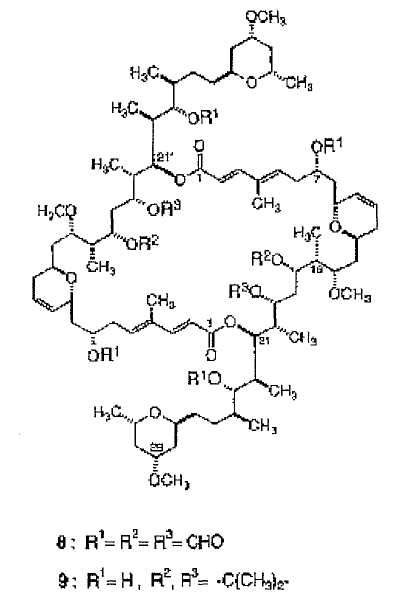
наблюдая, что оба димера (8 и 9) показывают слабую способность ингибирования роста КВ клеток (51,1% ингибирования при 50 мкг/мл и 19,3% ингибирования при 10 мкг/мл, соответственно).
Другие димерные макролиды, которые были получены из Swinholide А (1), были следующими:
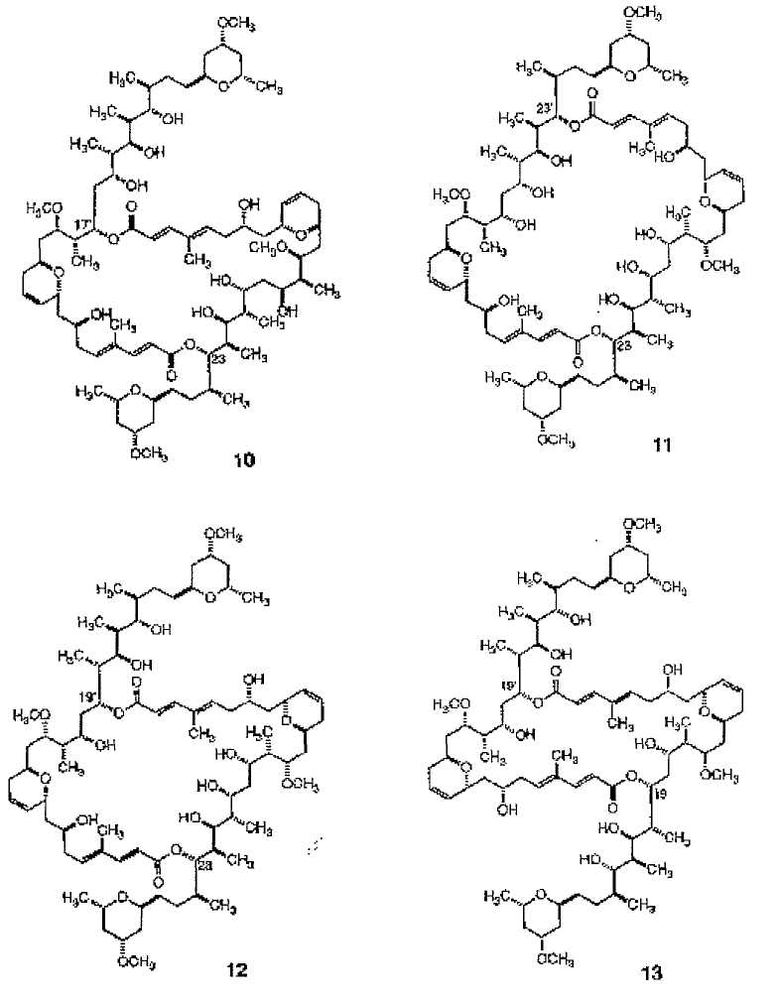
Цитотоксичность данных соединений (10-13) против L1210 и КВ клеток является меньшей, чем цитотоксичность, показанная Swinholide A (1).
Помимо этого, Kitagawa и др. проверили противоопухолевый эффект Swinholide A (1) и его изомеров против Р388 лейкемии у CDF1 мыши. Неожиданно было обнаружено, что Swinholide А (1), isoswinholide А (4) и изомер 11 были токсичны и не показали многообещающей противоопухолевой активности.
Кроме этого, заявка на патент WO 88/00195 описывает следующие соединения (Misakinolide А (15) и производные (15)), которые были выделены из морской губки рода Theonella:
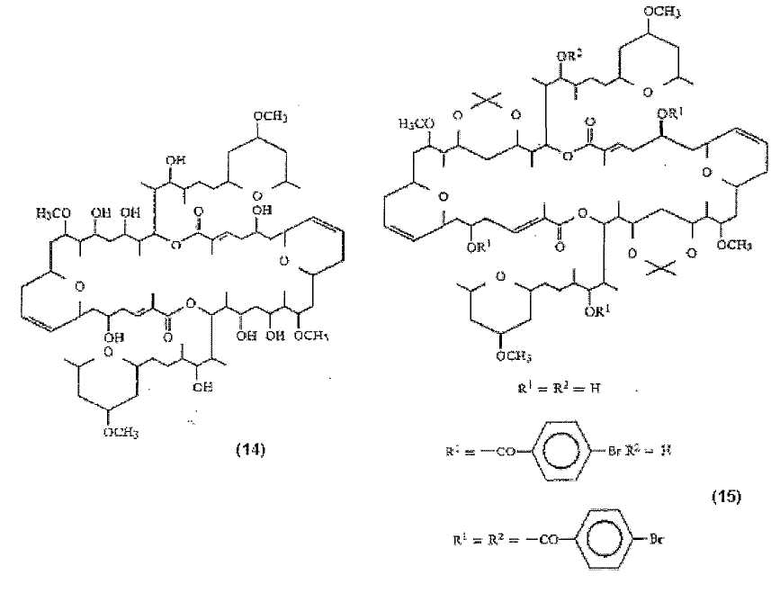
В указанной заявке на патент описывается противоопухолевая активность Misakinolide А (14) in vitro против Р388, НСТ-8, А549 и MDA-MB-231 раковых клеток. Также было описано, что кроме ярко выраженной цитотоксичности [IC50 0,035 мкг/мл (L1210)], Misakinolide А также обладает противоопухолевой активностью [T/C 140% при дозе 0,1 мг/кг (мыши), против Р388 лейкемии] (Chem. Pharm. Bull., 1994, 42(1), 19-26).
Рак продолжает быть одной из главных причин смерти среди видов животных и человека. Были предприняты и продолжают предприниматься огромные усилия, направленные на поиск средств предохранения и новых эффективных противоопухолевых агентов, которые внесут вклад в увеличение терапевтического арсенала, необходимого для эффективного лечения пациентов с этим заболеванием. В этом смысле настоящее изобретение направлено на решение данной проблемы, предоставляя новые соединения, эффективные при лечении рака.
Сущность изобретения
Настоящее изобретение направлено на асимметрические димерные макролиды с общей формулой I, а также на их соответствующие фармацевтически приемлемые соли, производные, пролекарства и стереоизомеры,
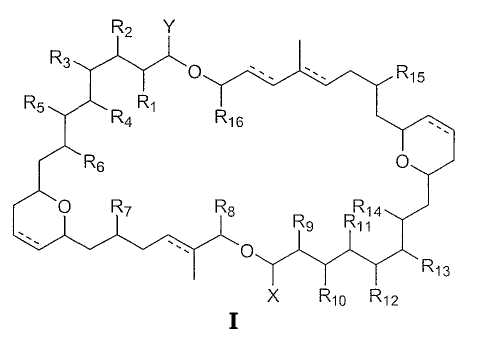
где R1-16 являются группами, независимо выбранными из водорода, защищенного или незащищенного гидроксила, замещенного или незамещенного С1-С24 алкила, замещенного или незамещенного С2-С24 алкенила, замещенного или незамещенного С2-С24 алкинила, =О, ORa, OCORa, NRaRb, NRaCORb, CONRaRb, CORa, COORa и галогена.
X и Y являются группами, независимо выбранными из замещенного или незамещенного С1-С24 алкила, замещенного или незамещенного С2-С24 алкенила, замещенного или незамещенного С2-С24 алкинила, =О, ORa, OCORa, NRaRb, NRaCORb, CONRaRb, CORa, COORa и галогена;
Ra и Rb являются группами, независимо выбранными из водорода, галогена, замещенного или незамещенного С1-С12 алкила, замещенного или незамещенного С2-С12 алкенила, замещенного или незамещенного С2-С12 алкинила, замещенного или незамещенного арила и замещенного или незамещенного гетероцикла; и пунктирная линия показывает необязательное присутствие двойной связи.
Изобретение также относится к выделению соединений формулы I из губок семейства Theonellidae, рода Theonella и вида swinhoei, и к образованию производных выделенных соединений.
Кроме этого, настоящее изобретение также относится к соединению общей формулы I или его фармацевтически приемлемой соли, производному, пролекарству или стереоизомеру, для его применения в качестве лекарственного средства.
Изобретение также направлено на применение соединения формулы I или его фармацевтически приемлемой соли, производного, пролекарства или стереоизомера для получения лекарственного средства для лечения рака.
Также настоящее изобретение относится к фармацевтическим композициям, содержащим соединение формулы I или его соответствующие фармацевтически приемлемые соли, производные, пролекарства или стереоизомеры в смеси с фармацевтически приемлемым эксципиентом или разбавителем.
Подробное описание изобретения
Соединения, являющиеся целью изобретения, относятся к асимметрическим димерным макролидам общей формулы I

где R1-16 являются группами, независимо выбранными из водорода, защищенного или незащищенного гидроксила, замещенного или незамещенного С1-С24 алкила, замещенного или незамещенного С2-С24 алкенила, замещенного или незамещенного С2-С24 алкинила, =О, ORa, OCORa, NRaRb, NRaCORb, CONRaRb, CORa, COORa и галогена.
X и Y являются группами, независимо выбранными из замещенного или незамещенного С1-С24 алкила, замещенного или незамещенного С2-С24 алкенила, замещенного или незамещенного С2-С24 алкинила, =О, ORa, OCORa, NRaRb, NRaCORb, CONRaRb, CORa, COORa и галогена;
Ra и Rb являются группами, независимо выбранными из водорода, галогена, замещенного или незамещенного С1-С24 алкила, замещенного или незамещенного С2-С24 алкенила, замещенного или незамещенного С2-С24 алкинила, замещенного или незамещенного арила и замещенного или незамещенного гетероцикла; и пунктирная линия показывает необязательное присутствие двойной связи.
Группы или заместители в данных соединениях могут быть выбраны согласно следующим условиям.
Термин алкил обозначает линейную или разветвленную углеродную цепь, имеющую от 1 до 24 атомов углерода. Предпочтительными являются алкильные группы от 1 до 6 атомов углерода, и особенно предпочтительны те, которые состоят из 1, 2, 3 и 4 атомов углерода. В соединениях настоящего изобретения особенно предпочтительными алкильными группами являются метильная, этильная, пропильная, изопропильная, бутильная, втор-бутильная и трет-бутильная группы. Также термин алкил, используемый в настоящем изобретении, относится как к циклической, так и нециклической группе, принимая во внимание, что циклические группы будут содержать, по крайней мере, три атома углерода в кольце. Другими предпочтительными алкильными группами являются такие, которые имеют от 5 до 12 атомов углерода, причем особенно предпочтительны такие, которые состоят из 6, 7, 8, 9 и 10 атомов углерода. В соединениях настоящего изобретения особенно предпочтительными алкильными группами являются гексильная, гептильная, 1,3-диметилпентильная, октильная, 1,3-диметилгексильная и нонильная группы.
Термины алкенил и алкинил обозначают линейную или разветвленную ненасыщенную алкильную цепь, содержащую от 2 до 24 атомов углерода, и включающую одно или несколько ненасыщенных положений. Предпочтительными являются алкенильные, алкинильные группы, имеющие от 2 до 6 атомов углерода, и особенно предпочтительны те, которые состоят из 2, 3 и 4 атомов углерода. Также термины алкенил и алкинил, используемые в настоящем изобретении, относятся как к циклическим, так и нециклическим группам, принимая во внимание, что циклические группы будут содержать, по крайней мере, три атома углерода в кольце. Другими предпочтительными алкенильными и алкинильными группами являются такие, которые имеют от 5 до 12 атомов углерода. В число арильных групп, которые могут присутствовать в соединениях изобретения, включены такие, которые содержат одно или несколько колец, включая множественные кольца с разделенными или конденсированными арильными или гетероарильными группами. Обычно арильные группы содержат от 1 до 3 колец и от 4 до 18 атом углерода в кольце(ах). Предпочтительными арильными группами являются фенил, нафтил, бифенил, фенантрил и антрацил, причем все они замещены или незамещены.
В число гетероциклических групп, которые могут присутствовать в соединениях изобретения, включены как гетероароматические, так и гетероалициклические группы. Гетероароматические группы содержат один, два или три гетероатома, выбранных из N, O и S, например, включая группы, такие как кумаринил, предпочтительно 8-кумаринил, хинолинил, предпочтительно 8-хинолинил, пиридил, пиразинил, пиримидил, фурил, пирролил, тиенил, тиазолил, оксазолил, имидазолил, индолил, бензофуранил и бензотиазолил. Гетероалициклические группы содержат один, два или три гетероатома, выбранных из N, O и, S, и, например, включая группы, такие как тетрагидрофуранил, тетрагидропиранил, пиперидинил, морфолин и пирролидинил. Гетероциклические группы могут быть как замещенными, так и незамещенными.
Ранее упомянутые группы, возможно, могут быть замещены по их одному или нескольким доступным положениям, независимо одним или несколькими подходящими заместителями, такими как OR`, =О, SR`, SOR`, SO2R`, NO2, NHR`, N(R`)2, =N-R`, NHCOR`, N(COR`)2, NHSO2R`, NR`C(=NR`)NHR`, CN, галоген, С(=O)R`, COOR`, OC(=O)R`, CONHR`, CON(R`)2, замещенный или незамещенный С1-С24 алкил, замещенный или незамещенный С2-С24 алкенил, замещенный или незамещенный С2-С24 алкинил, замещенный или незамещенный арил и замещенный или незамещенный гетероцикл, где каждая группа R` независимо выбрана из Н, ОН, NO2, NH2, SH, CN, галогена, =О, С(=O)Н, С(=O)алкила, СООН, замещенного или незамещенного С1-С12 алкила, замещенного или незамещенного С2-С12 алкенила, замещенного или незамещенного С2-С12 алкинила, замещенного или незамещенного арила и замещенного или незамещенного гетероцикла. В число галогеновых заместителей, которые могут присутствовать в соединениях настоящего изобретения, включены F, Cl, Br и I. В случае таких групп, которые в свою очередь замещены, соответствующие заместители могут быть выбраны из указанного здесь списка заместителей.
Гидроксильная группа, возможно, может быть защищена. Существует огромное число гидроксильных защитных групп, и они хорошо известны специалисту в данной области техники. Для справки см. Protecting groups, Kocienski, 2004, 3-е изд.
Термин «фармацевтически приемлемые соли, производные, пролекарства» относится к любой фармацевтически приемлемой соли, сложному эфиру, сольвату, гидрату или какому-либо другому соединению, которое после его введения пациенту способно (напрямую или опосредованно) дать соединение формулы I. Однако следует принимать во внимание, что не фармацевтически приемлемые соли также находятся в рамках изобретения, так как они могут быть пригодными при получении фармацевтически приемлемых солей. Получение солей, пролекарств и производных может быть осуществлено с помощью способов, известных в области техники.
Например, фармацевтически приемлемые соли соединений настоящего изобретения получаются из соответствующих соединений, имеющих кислотные или основные части, с помощью традиционных химических методов. В основном указанные соли образуются, например, посредством реакции соответствующей основной или свободнокислотной формы указанного соединения со стехиометрическим количеством подходящего основания или кислоты в воде, органическом растворителе или в их смеси. Обычно предпочтительными неводными средами являются эфир, этилацетат, этанол, изопропанол или ацетонитрил. В число солей, полученных добавлением кислоты, входят соли, полученные добавлением минеральных кислот, такие как гидрохлорид, гидробромид, гидроиодид, сульфат, нитрат и фосфат, и соли, полученные добавлением органических кислот, такие как ацетат, трифторацетат, малеат, фумарат, цитрат, оксалат, сукцинат, тартрат, соль яблочной кислоты, соль миндальной кислоты, метансульфанат и паратолуолсульфанат. В число солей, полученных добавлением основания, входят неорганические соли, такие как натриевые, калиевые, кальциевые и аммонийные соли, и органические соли, такие как соли этилендиамина, этаноламина, N,N-диалкиленэтаноламина, триэтаноламина и основные соли аминокислот.
Соединения настоящего изобретения могут быть в кристаллической форме как в виде свободных соединений, так и сольватов (например, гидратов), причем обе формы включены в объем настоящего изобретения. Способы сольватации в основном хорошо известны в области техники.
Любое соединение, которое является пролекарством соединения общей формулы I, включено в объем настоящего изобретения. Термин «пролекарство» используется в широком смысле и включает все производные, которые могут быть превращены in vivo в любые соединения изобретения. Специалист в области техники знает, какие это производные могут быть, и они включают, например, соединения, в которых свободная гидроксильная группа превращена в сложноэфирное производное, или сложный эфир модифицирован посредством переэтерификации или образования подходящего амида.
Соединения настоящего изобретения, представленные общей формулой I, имеют более чем один стереогенный центр, так что изобретение в равной степени относится к каждому и любому из возможных энантиомеров и диастериомеров, которые могут быть получены, а также к возможным Z и Е стереоизомерам, которые могут быть образованы при наличии в молекуле двойной связи. В рамках настоящего изобретения находятся как чистые изомеры, так и смеси изомеров указанных соединений.
Предпочтительными соединениями настоящего изобретения являются такие, у которых R1-16 являются группами, независимо выбранными из водорода, защищенного или незащищенного гидроксила, ORa, OCORa, =О, NRaRb, NRaCORb, галогена и замещенного или незамещенного С1-С24 алкила, где Rа определен выше. Особенно предпочтительными являются такие соединения, в которых R1-7 и R9-15 являются группами, независимо выбранными из водорода, гидроксила, С1-С6 алкила и ORа; и среди них предпочтительными являются водород, гидроксил, метил и метокси. Также особенно предпочтительно, чтобы R8 и R16 группы были =О.
Предпочтительно Х и Y являются группами, независимо выбранными из замещенного или незамещенного С5-С12 алкила и замещенного или незамещенного С5-С12 алкенила. Особенно предпочтительно, чтобы они были независимо замещены одним или несколькими подходящими заместителями, и, в частности, замещены одним или несколькими следующими заместителями: ОН, OR`, NHCOR` и замещенным или незамещенным гетероциклом, где R` определен ранее. Более предпочтительно, чтобы X и Y были С5-С12 алкильными группами, замещенными одной или несколькими гидроксильными группами и/или замещенными гетероциклами. Особенно предпочтительно, когда X и Y являются
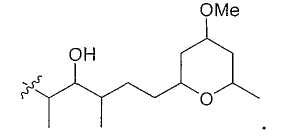
В данных участках структуры предпочтительно наличие двойных связей, показанных пунктирной линией в общей формуле I.
Следующие соединения являются особенно предпочтительными соединениями настоящего изобретения:
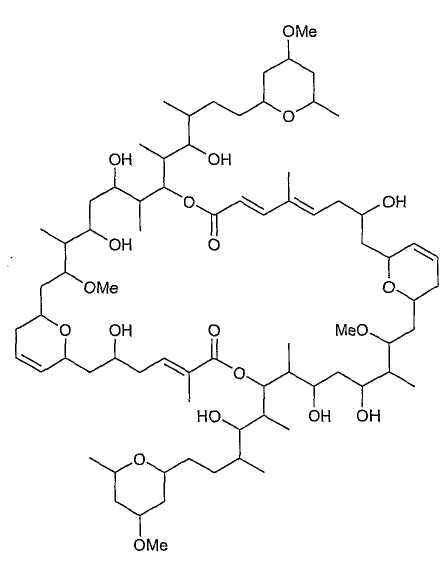
Соединение А
Соединение А является природным продуктом, выделенным из морской губки, а именно из губки вида Theonella swinhoei (Класс: Demosponhiae, Подкласс: Tetractinomorpha, Отряд: Lithistida, Подотряд: Triaenosina, Семейство: Theonellidae). Указанный организм был собран на Островах Глорьез (северо-запад Мадагаскара).
Данные виды губок обычны для запада Тихого Оокеана, в Индийском Океане и в Красном Море, причем располагаются по побережью на глубине до 48 метров. Образцы были найдены:
- Кения, Момбаса, Shelly Beach, на внешнем откосе рифа, на глубине 12-16 метров.
- North Kenya Banks (02° 25,`ю.ш. - 40° 42,5` в.д., на глубине 48 метров)
- Tulear, область Ifaty (Мадагаскар)
- Острова Albadra (северо-запад Мадагаскара)
- Ternate, Celebes, Ambon, Manila, Formosa (Филиппины), Тайвань.
Кроме этого, аналоги указанных соединений могут быть синтезированы специалистом в данной области техники с помощью, например, кислотного или основного гидролиза, окисления, этерификации, альдолльной конденсации, озонолиза, реакции Виттига, реакции Хорнера-Эммонса, эпоксидирования по Шарплессу или реакции Пиктеда-Спенглера. Соединение А и его аналоги могут быть синтезированы, например, посредством описанных синтезов подходящим образом защищенных мономерных единиц Swinholide A и Misakinolide A, последующего проведения реакций макролактонизации, которые позволяют получить Соединение А и его аналоги (см. K-S. Yeung и I. Paterson. Angew. Chem. Int. Ed. 2002, 41, 4632-4653).
Важным аспектом соединений настоящего изобретения является их биологическая активность и, в частности, их цитотоксическая активность. Следовательно, настоящее изобретение обеспечивает новые фармацевтические композиции соединений общей формулы I, имеющих цитотоксический эффект, а также их применение в качестве противоопухолевых агентов. Кроме этого, настоящее изобретение также обеспечивает фармацевтические композиции, содержащие соединение настоящего изобретения или фармацевтически приемлемую соль, производное, пролекарство или стереоизомер в смеси с фармацевтически приемлемым наполнителем или разбавителем.
Фармацевтические композиции, включенные в качестве примеров, являются любыми твердыми (таблетки, пилюли, капсулы, гранулы и т.п.) или жидкими (растворы, суспензии или эмульсии) композициями для орального, топического или парентерального введения. Фармацевтические композиции, содержащие соединения настоящего изобретения, также могут быть получены в форме липосом или наносфер, составов замедленного высвобождения или любых других традиционных систем высвобождения.
Введение соединений или композиций настоящего изобретения может быть осуществлено с помощью любых обычных способов, таких как внутривенное вливание, составы для орального введения и/или внутрибрюшинного и внутривенного введения. Предпочтительно, чтобы используемые времена вливания не превышали 24 часа, предпочтительно были от 1 до 12 часов и еще более предпочтительно от 1 до 6 часов. Короткие времена вливания особенно желаемы, так как это позволяет проводить лечение без необходимости проводить ночь в госпитале. Однако времена вливания от 12 до 24 часов и включая большие, при необходимости могут быть использованы. Вливание может быть проведено с подходящими интервалами, такими как от 1 до 4 недель.
Правильная доза соединений меняется в зависимости от типа используемого состава, формы применения и местоположения, хозяина и опухоли, которую необходимо лечить. Также должны приниматься во внимание другие факторы, такие как возраст, вес тела, пол, режим питания, время введения, скорость выведения, состояние здоровья хозяина, комбинация активных ингредиентов, чувствительность с точки зрения реакций и серьезности заболевания. Введение может быть проведено непрерывно или периодически с максимально переносимой дозой.
Соединения и композиции настоящего изобретения могут быть использованы вместе с другими активными ингредиентами в комбинированной терапии. Другие активные ингредиенты могут быть частью той же композиции или могут быть введены посредством другой композиции, причем одновременно или в различное время.
ПРИМЕРЫ
ПРИМЕР 1: ОПИСАНИЕ ОРГАНИЗМА И МЕСТО СБОРА
Несколько образцов губки Theonella swinhoei были собраны при погружении на Островах Глорьез (северо-запад Мадагаскара, запад Индийского Океана) на глубине 18 метров в ноябре 2003 г. Координаты места сбора образцов являются следующими: широта 11° 34` 995`` с.ш. и долгота 47° 16` 829`` в.д. Дно моря было скалистым и песчаным, и подложка образцов была скалистой.
Описание организма: массивная губка. Верхняя поверхность покрыта несколькими округлыми отверстиями (поры). Поверхность является гладкой и консистенция твердая, однако выдержанные образцы являются хрупкими. Цвет живой губки коричневый и ее внутренность светло-бежевого цвета. Дермальная мембрана равномерно пористая. Данные образцы легко характеризуются посредством скелетных элементов. Скелет образован неправильными узлами стронгилидов, направленных по касательным к поверхности, и помощью малоразветвленных спикул (кремнистая спикула губок неправильной формы). Внутренний скелет состоит из тетразоновых спикул, которые могут быть гладко или слабо покрыты бугорками.
ПРИМЕР 2: ВЫДЕЛЕНИЕ СОЕДИНЕНИЯ А
Замороженный образец (604 г) губки Примера 1 нарезают на кусочки и экстрагируют Н2О (3×500 мл) и затем смесью МеОН:CH2Cl2 (50:50, 3×500 мл). Объединенные органические экстракты концентрируют, получая остаток (7,48 г), который разделяют вакуумной жидкостной хроматографией на Lichroprep RP-18 с градиентом от Н2О:МеОН до CH2Cl2. Соединение А (5,8 мг) выделяют из фракции, элюированной с МеОН, которую очищают с помощью полупрепаративной ВЭЖХ (SymmetryPrep C-18, 7 мкм, 7,8 мм×150 мм, градиент Н2О:CH3CN, УФ-детектирование), получая фракцию, содержащую Соединение А, и которую снова очищают с помощью полупрепаративной ВЭЖХ (SymmetryPrep C-18, 7 мкм, 19 мм×150 мм, градиент Н2О:CH3CN, УФ-детектирование).
Соединение А: MS (ESI)=1362 (M+). MS (APCI)=1345(M+1-H2O)+. 1Н и 13С ЯМР см. Таблицу 1.

Соединение А
Данные 1Н и 13С ЯМР (CD3OD) соединения А
ПРИМЕР 3: БИОЛОГИЧЕСКИЙ АНАЛИЗ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТИ
Анализ противоопухолевой активности позволяет обнаруживать выделения или соединения с цитотоксической активностью (клеточной гибелью) или цитостатической активностью (ингибирование роста) в in vitro культурах опухолевых клеток человеческого происхождения.
ЛИНИИ КЛЕТОК
ИССЛЕДОВАНИЯ ИНГИБИРОВАНИЯ КЛЕТОЧНОГО РОСТА С ПОМОЩЬЮ КОЛОРИМЕТРИЧЕСКОГО АНАЛИЗА
Измерение клеточного роста in vitro проводилось с помощью колориметрического анализа с сульфородомином В (SRB) (следуя адаптации, ранее описанного способа Philip Skehan и др. 1990, J. Natl. Cancer Inst., 82:1107-1112).
В данном типе анализа используется 96-луночные микроплашки культур (Mosmann, 1983, Faircloth, 1988). Большинство использованных линий клеток получено из Американской коллекции типовых культур (АТСС) и от различных типов человеческих опухолей.
Культуры клеток поддерживались в культурной среде DMEM (с добавлением 10% эмбриональной бычий сыворотки (FBS), 1% пенициллин/стрептомицин 1% глутамин) при 37°С, 5% СО2 и 98% влажности.
Для анализов, клетки трипсинизируются и высеваются в 96-луночные микроплашки при различной концентрации в зависимости от линии клеток и инкубируются в течение 24 часов в активной среде без ингредиента с целью их стабилизации. Затем культуры обрабатываются (конечная концентрация изменяется в зависимости от типа анализа) носителем (DMSO:DMEM, 1:1) или активным ингредиентом. После 48 часов экспонирования активному ингредиенту противоопухолевый эффект измеряют посредством указанного ранее SRB способа, который по существу состоит из: фиксации клеток 1% раствором глутарового альдегида (30 минут, комнатная температура), промывки фиксированных клеток фосфатно-буферным солевым раствором (3 промывки, комнатная температура), окрашивания культур 0,4% раствором SRB (30 минут, комнатная температура), промывки красящего агента в 1% уксусной кислоте (3 промывки, комнатная температура), сушки планшетов на воздухе и окончательной экстракции красящего агента Трис-буфером. Количественное измерение анализа проводят с помощью показаний оптической плотности планшетов в спектрофотометрическом планшет-ридере при одной длине волны 490 нм.
Для определения клеточного роста из полученных значений оптической плотности применялся алгоритм (эквивалентный алгоритму, применяемому в программе противоопухолевого скрининга NCI), который позволяет рассчитывать проценты роста по отношению к нулевому времени (начало эксперимента) как в отсутствии, так и в присутствии активного ингредиента в исследовании. Рассчитанные параметры клеточного ответа по отношению к активному ингридиенту являются следующими: GI50=концентрация, вызывающая 50% ингибирования роста, TGI=концентрация, вызывающая полное ингибирование роста (цитостатический эффект) и LC50=концентрация, вызывающая 50% клеточной гибели (цитотоксический эффект).
В Таблице 2 представлены данные биологической активности Соединения А.
Данные противоопухолевой активности (Молярные)
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОТИВОРАКОВЫЕ СТЕРОИДНЫЕЛАКТОНЫ, НЕНАСЫЩЕННЫЕ В ПОЛОЖЕНИИ 7(8) | 2011 |
|
RU2572595C2 |
| ПРОТИВООПУХОЛЕВЫЕ СОЕДИНЕНИЯ | 2008 |
|
RU2528393C9 |
| ПРОТИВООПУХОЛЕВЫЕ СОЕДИНЕНИЯ | 2008 |
|
RU2489429C2 |
| CПОСОБ ПРОФИЛАКТИКИ ПЕРЕДАЮЩИХСЯ ПОЛОВЫМ ПУТЕМ ВИРУСНЫХ ЗАБОЛЕВАНИЙ, ЛЕКАРСТВЕННОЕ СРЕДСТВО, СПОСОБ ПОЛУЧЕНИЯ ЛЕКАРСТВЕННОГО СРЕДСТВА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ МЕСТНОГО ПРИМЕНЕНИЯ И ПРЕЗЕРВАТИВ | 2010 |
|
RU2560879C2 |
| ИНГИБИТОРЫ ЛЕЙКОТРИЕН А4-ГИДРОЛАЗЫ | 2014 |
|
RU2690489C2 |
| ПРОТИВООПУХОЛЕВЫЕ СОЕДИНЕНИЯ | 2008 |
|
RU2493147C2 |
| ИНГИБИТОРЫ ЛЕЙКОТРИЕН А4-ГИДРОЛАЗЫ | 2014 |
|
RU2696559C2 |
| ПРОТИВООПУХОЛЕВЫЕ СОЕДИНЕНИЯ ДИГИДРОПИРАН-2-ОНА | 2007 |
|
RU2444519C2 |
| ПРОИЗВОДНЫЕ 2-ФЕНИЛАМИНО-3-ЦИАНОПИРАЗОЛО[1,5-А]ПИРИМИДИНА, ПОЛЕЗНЫЕ В КАЧЕСТВЕ ИНГИБИТОРА ЛЕЙКОТРИЕН-A-ГИДРОЛАЗЫ | 2014 |
|
RU2678196C2 |
| ЗАМЕЩЕННОЕ АРОМАТИЧЕСКОЕ ПРОИЗВОДНОЕ С КОНДЕНСИРОВАННЫМИ КОЛЬЦАМИ И КОМПОЗИЦИЯ, ВКЛЮЧАЮЩАЯ ЕГО, И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2811484C1 |
Изобретение касается новых противоопухолевых соединений общей формулы I

где R1-16 являются группами, независимо выбранными из водорода, защищенного или незащищенного гидроксила, C1-C24 алкила, C2-C24 алкенила, =O и ORa, OCORa; X и Y являются C5-C12 алкильными группами, которые замещены одной или несколькими C1-С6 алкильными группами, гидроксильными группами и/или тетрагидропираном, который необязательно может быть замещен алкилом и/или группой ORa; Ra независимо выбирают из водорода и C1-С12 алкила; и пунктирная линия показывает присутствие двойной связи. А также способа их получения, фармацевтической композиции, на основе данных соединений, обладающей противоопухолевой активностью, и применения соединений формулы I для получения лекарственного средства, направленного на лечение рака. Технический результат: получены и описаны новые соединения, которые обладают цитотоксической активностью и могут быть использованы для лечения рака. 4 н. и 11 з.п. ф-лы, 2 табл.
1. Соединение общей формулы I или его фармацевтически приемлемая соль или стереоизомер,
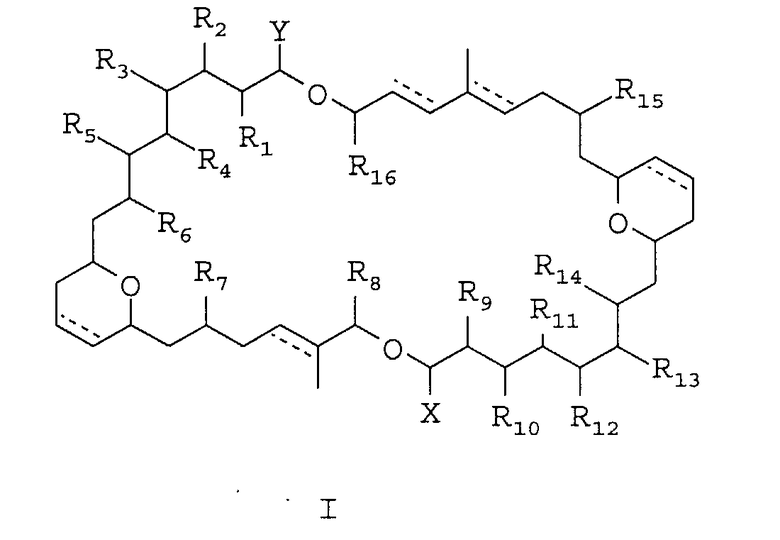
где R1-16 являются группами, независимо выбранными из водорода, защищенного или незащищенного гидроксила, C1-C24 алкила, С2-С24 алкенила, =O и ORa, OCORa;
X и Y являются C5-C12 алкильными группами, которые замещены одной или несколькими C1-С6 алкильными группами, гидроксильными группами и/или тетрагидропираном, который необязательно может быть замещен алкилом и/или группой ORa;
Ra независимо выбирают из водорода и C1-C12 алкила; и
пунктирная линия показывает присутствие двойной связи.
2. Соединение по п.1, где R1-7 и R9-15 являются группами, независимо выбранными из водорода, гидроксила, C1-С6 алкила и ORa.
3. Соединение по п.2, где R1-7 и R9-15 являются группами, независимо выбранными из водорода, гидроксила, метила и метокси.
4. Соединение по п.3, где R1, R5, R9 и R13 являются метилом.
5. Соединение по п.3, где R2, R4, R7, R10; R12 и R15 являются гидроксилом.
6. Соединение по п.3, где R3 и R11 являются водородом.
7. Соединение по п.3, где R6 и R14 являются метокси.
8. Соединение по любому из пп.1-7, где R8 и R16 являются =O.
9. Соединение по любому из пп.1-7, где Х и Y являются
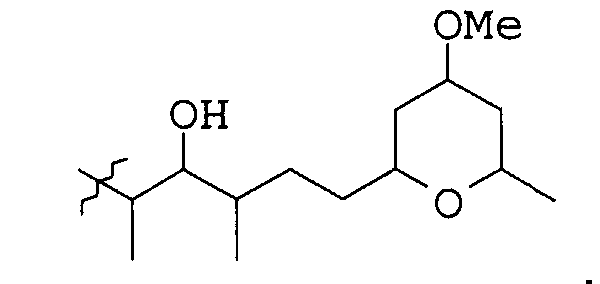
10. Соединение по п.8, где Х и Y являются
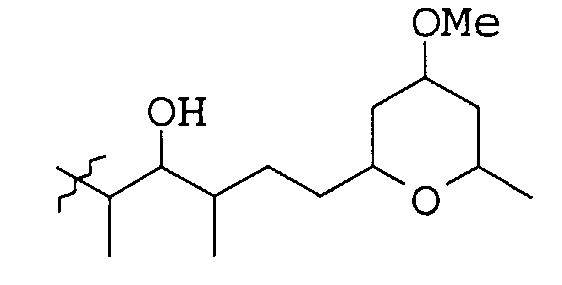
11. Соединение по п.1, имеющее следующую формулу:
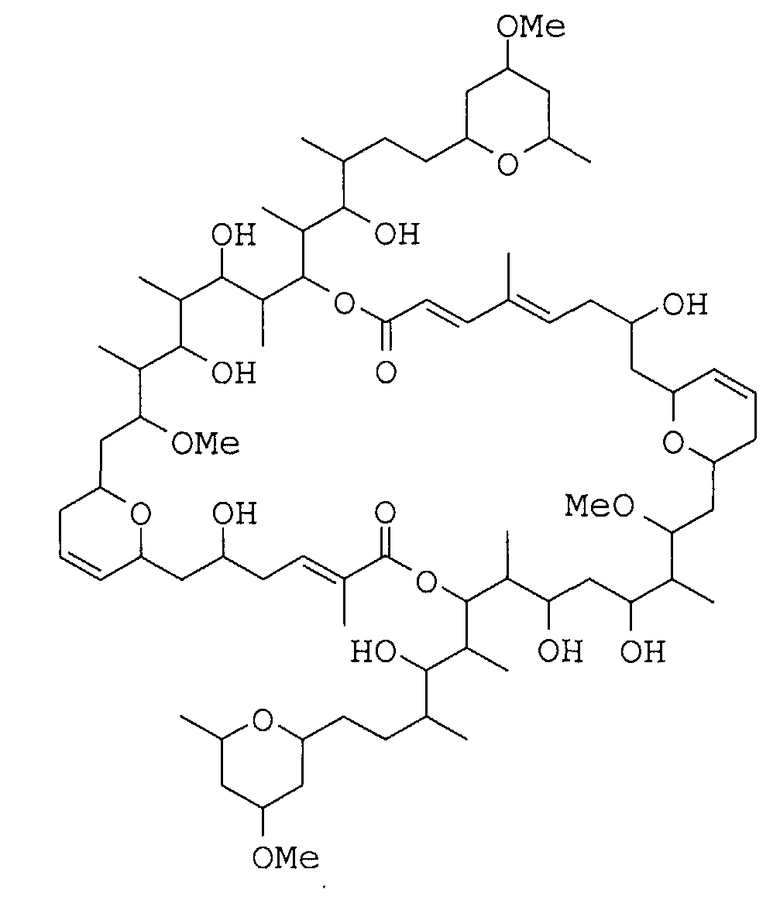
12. Способ получения соединения, определенного по любому из предшествующих пунктов, включающий его экстракцию и выделение из организма вида Theonella swinhoei.
13. Фармацевтическая композиция, обладающая противоопухолевой активностью, содержащая соединение по любому из пп.1-11 или его фармацевтически приемлемую соль или стереоизомер, в смеси с фармацевтически приемлемым эксципиентом или разбавителем.
14. Соединение по п.1 или его фармацевтически приемлемая соль или стереоизомер для применения в качестве лекарственного средства, обладающего противоопухолевой активностью.
15. Применение соединения по любому из пп.1-11 или его фармацевтически приемлемой соли или стереоизомера для получения лекарственного средства, направленного на лечение рака.
| CARMELY, S | |||
| & KASHMAN, Y | |||
| "Structure of Swinholide-A, a new Macrolide from the Marine Sponge Theonella swinhoei", Tetrahedron Letters, 1985, vol.26, n.4, p:511-514 | |||
| Механическая топочная решетка с наклонными частью подвижными, частью неподвижными колосниковыми элементами | 1917 |
|
SU1988A1 |
| НОВЫЕ ЦИТОТОКСИЧЕСКИЕ МАКРОЛИДЫ, СОДЕРЖАЩИЕ ТРИС(ОКСАЗОЛ), СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБЫ ЛЕЧЕНИЯ | 1999 |
|
RU2217433C2 |
Авторы
Даты
2011-09-10—Публикация
2006-12-14—Подача