Область техники, к которой относится изобретение
Настоящее изобретение относится к новым противоопухолевым соединениям, фармацевтическим композициям, их содержащим, и к их применению в качестве противоопухолевых агентов.
Предпосылки создания изобретения
В 1990 году, Gunasekera и др. описали выделение нового полигидроксилированного лактона, (+)-дискодермолида, из глубоководной губки Карибского моря, Discodermia dissoluta (Gunasekera SP et. al., J. Org. Chem., 1990, 55, 4912-4915, и J. Org. Chem., 1991, 56, 1346).
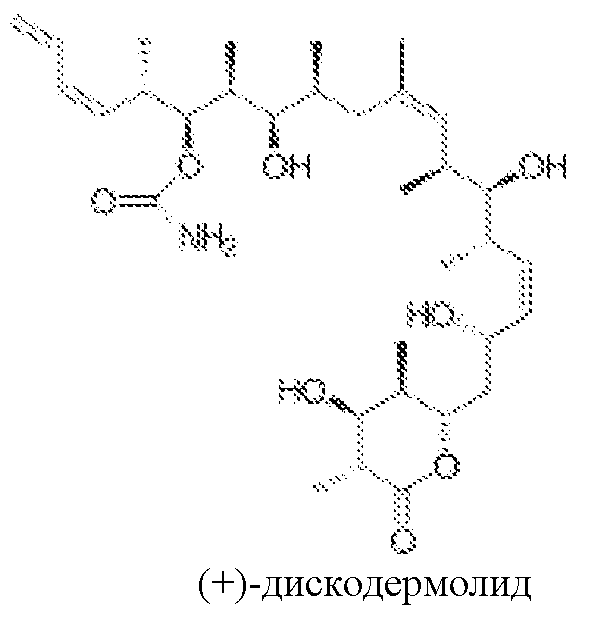
Показано, что это соединение является эффективным антимитотическим агентом (Hung DT et. al., Chem. Biol., 1996, 3, 287-293 и ter Haar E. et. al., Biochemistry, 1996, 35, 243-250), обладающим способом действия, подобным таковому клинически доказанного противоракового агента паклитаксела (Schiff PB et. al., Nature, 1979, 277, 665-667). Оба природных продукта подавляют клеточный цикл в М-фазе, способствуют образованию микроканальцев и обладают похожими ингибирующими эффектами против рака молочной железы (IC50 составляет 2,4 нМ и 2,1 нМ, соответственно).
С другой стороны, некоторые исключительные линейные дипептиды, содержащие N-ациленамидную функциональность, выделены из миксобактерий, принадлежащих к роду Chondromyces (Kunze B. et. al., J. Antibiot., 1994, 47, 881-886, и Jansen R. et. al., J. Org. Chem., 1999, 1085-1089). В особенности эти соединения являются крокацинами А, В, С и D и представляют собой группу ингибиторов транспорта электронов.
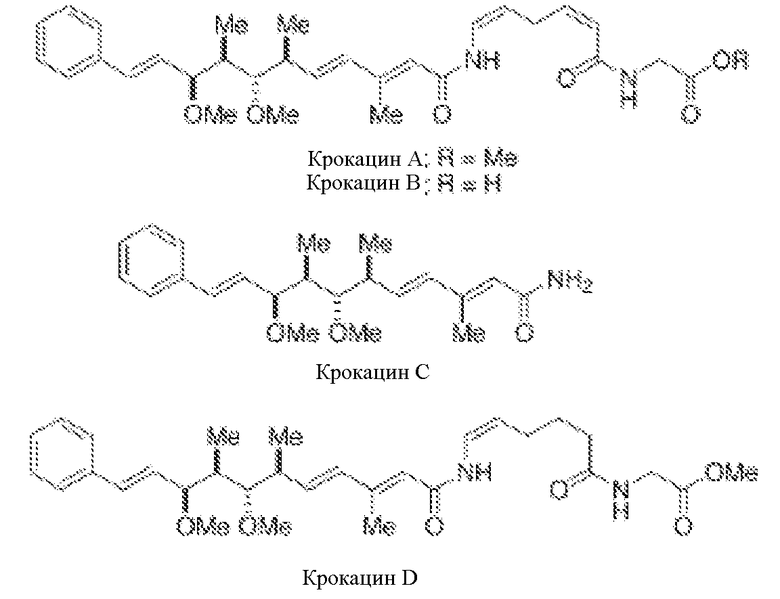
Крокацины А-D умеренно ингибируют рост некоторых грамположительных бактерий и являются эффективными ингибиторами клеточных культур животных и некоторых дрожжей и грибов. Наибольшую активность проявляет крокацин D, который показывает минимальную ингибирующую концентрацию (MIC), равную 1,4 нг/мл, против грибов Saccharomyces cerevisiae и сильную токсичность (IC50 составляет 0,06 мг/л) по отношению к культуре мышиных фибробластов L929.
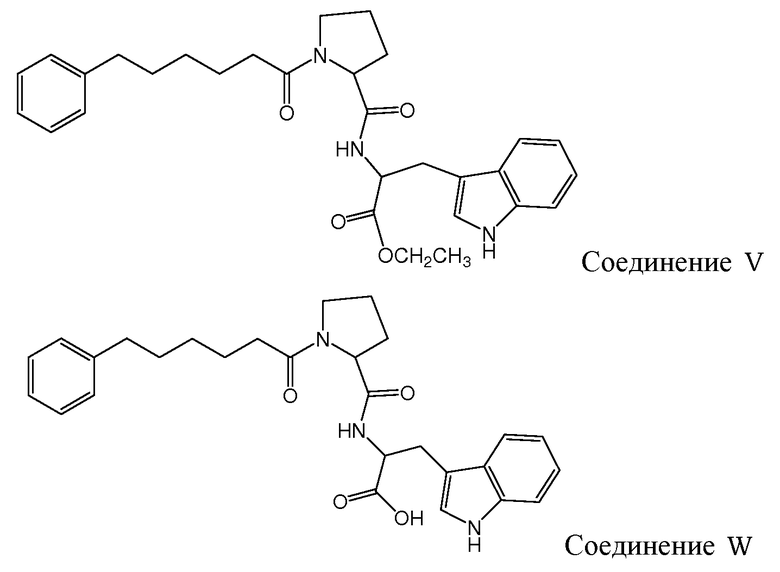
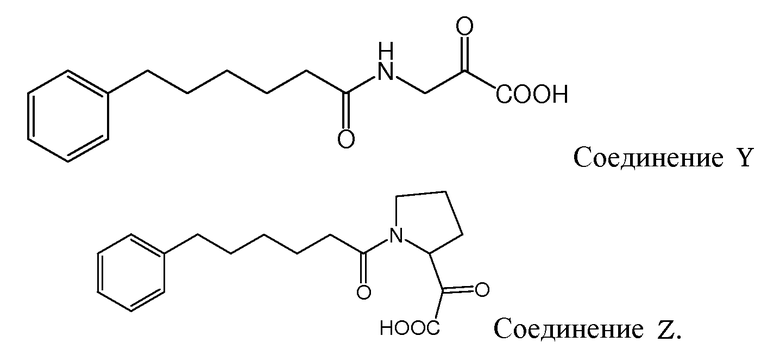
Gudasheva и др. (Russian Journal of Bioorganic Chemistry, 2007, 44(4), 413-420, и Pharmaceutical Chemistry Journal, 2006, 40(7), 367-372) описали дизайн дипептидных соединений, базирующийся на структуре эндогенного тетрапептида холецистокинина-4 (ССК-4). В этом отношении раскрыто, что производные L-триптофана проявляют анксиолитические свойства и производные D-триптофана - анксиогенные свойства. Два этих дипептидных соединения описаны Gudasheva и др. следующим образом:

и следующие соединения описаны в виде промежуточных продуктов при синтезе соединений R и U:
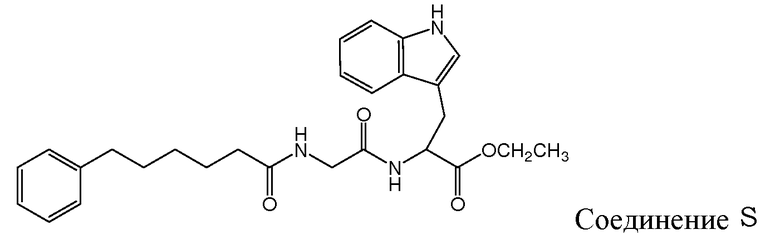
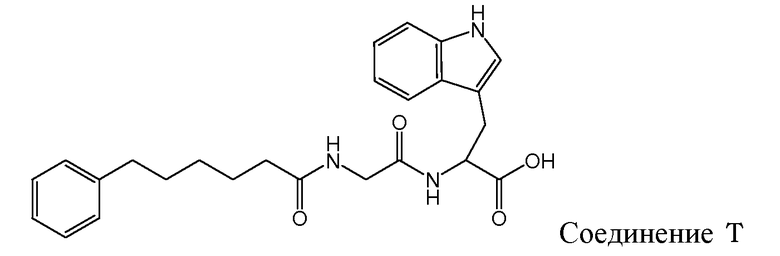
Рак является основной причиной смерти животных и людей. Предпринимались и по-прежнему предпринимаются огромные усилия в целях получения противоопухолевого агента, активного и безопасного в отношении введения его пациентам, страдающим от ракового заболевания. Проблемой, решаемой согласно настоящему изобретению, является получение соединений, которые пригодны для лечения ракового заболевания.
Краткое изложение сущности изобретения
В одном аспекте настоящее изобретение относится к соединениям общей формулы I или к их фармацевтически приемлемым солям, таутомерам, пролекарствам или стереоизомерам:
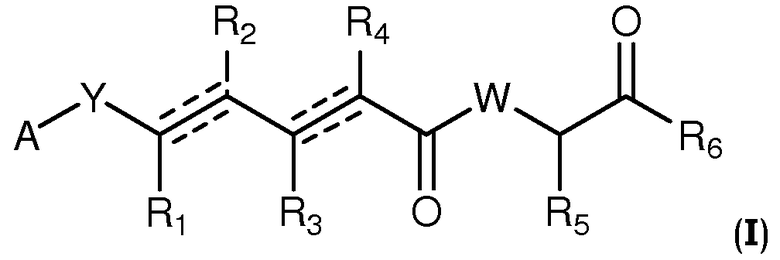
где Y выбирают из группы, состоящей из -CHRay-, -CHRay-CHRby-, -CRay=CRby-, -C≡C-, -CHRay-CHRby-CHRcy-, -CHRay-CRby=CRcy- и -CHRay-С≡С-;
каждый Ray, Rby и Rcy независимо выбирают из группы, состоящей из водорода, замещенного или незамещенного С1-С12-алкила, замещенного или незамещенного С2-С12-алкенила и замещенного или незамещенного С2-С12-алкинила;
каждый R1, R2, R3, R4 и R5 независимо выбирают из группы, состоящей из водорода, замещенного или незамещенного С1-С12-алкила, замещенного или незамещенного С2-С12-алкенила и замещенного или незамещенного С2-С12-алкинила;
R6 выбирают из NR8R9 и OR10;
А выбирают из:
W выбирают из О и NR7;
R7 выбирают из группы, состоящей из водорода, CORa, COORa, замещенного или незамещенного С1-С12-алкила, замещенного или незамещенного С2-С12-алкенила и замещенного или незамещенного С2-С12-алкинила, или R7 и R5, вместе с соответствующим атомом азота и атомом углерода, к которым они присоединены, могут образовывать замещенную или незамещенную гетероциклическую группу;
R8 выбирают из группы, состоящей из водорода, CORa, COORa, замещенного или незамещенного С1-С12-алкила, замещенного или незамещенного С2-С12-алкенила, замещенного или незамещенного С2-С12-алкинила и замещенного или незамещенного С4-С12-алкенинила;
R10 выбирают из группы, состоящей из водорода, замещенного или незамещенного С1-С12-алкила, замещенного или незамещенного С2-С12-алкенила и замещенного или незамещенного С2-С12-алкинила;
каждая пунктирная линия означает необязательную дополнительную связь, но если существует тройная связь между атомами углерода, к которым присоединены R1 и R2, то R1 и R2 отсутствуют, и если существует тройная связь между атомами углерода, к которым присоединены R3 и R4, то R3 и R4 отсутствуют; и,
когда А означает:
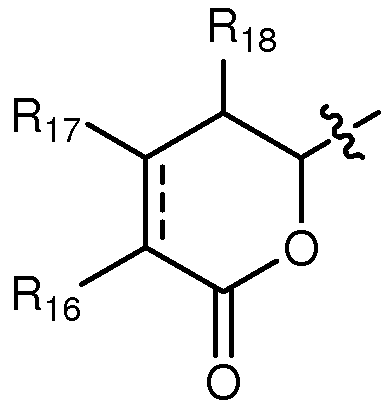
тогда R9 выбирают из группы, состоящей из водорода, CORa, COORa, замещенного или незамещенного С1-С12-алкила, замещенного или незамещенного С2-С12-алкенила, замещенного или незамещенного С2-С12-алкинила и замещенного или незамещенного С4-С12-алкенинила, при условии, что, когда Y означает -CHRay-CHRby-CHRcy- или -CHRay-CRby=CRcy- и существует одинарная или двойная связь между атомами углерода, к которым присоединены R3 и R4, тогда R9 означает замещенный или незамещенный С4-С12-алкенинил; и,
когда А означает:
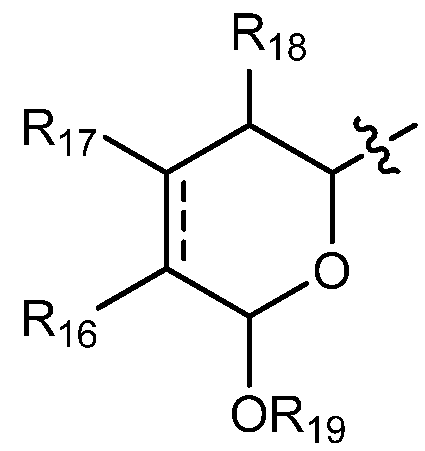
тогда R9 выбирают из группы, состоящей из водорода, CORa, COORa, замещенного или незамещенного С1-С12-алкила, замещенного или незамещенного С2-С12-алкенила, замещенного или незамещенного С2-С12-алкинила и замещенного или незамещенного С4-С12-алкенинила;
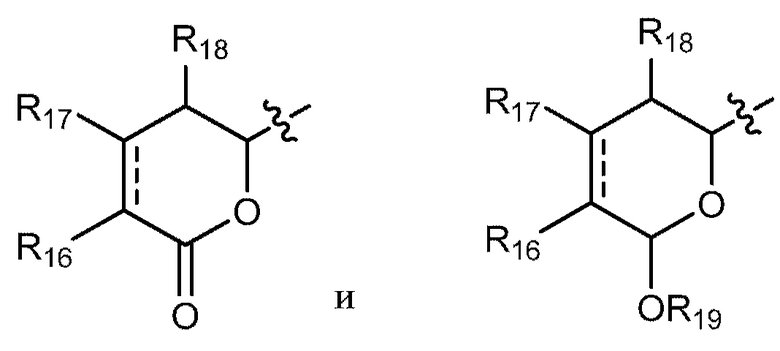
каждый R16, R17 и R18 независимо выбирают из группы, состоящей из водорода, ORa, OCORa, OCOORa, NRaRb, NRaCORb NRaC(=NRa)NRaRb, замещенного или незамещенного С1-С12-алкила, замещенного или незамещенного С2-С12-алкенила и замещенного или незамещенного С2-С12-алкинила;
R19 выбирают из группы, состоящей из водорода, CORa, COORa, CONRaRb, S(O)Ra, SO2Ra, P(O)(Ra)ORb, SiRaRbRc, замещенного или незамещенного С1-С12-алкила, замещенного или незамещенного С2-С12-алкенила и замещенного или незамещенного С2-С12-алкинила;
и каждый Ra, Rb и Rc независимо выбирают из группы, состоящей из водорода, замещенного или незамещенного С1-С12-алкила, замещенного или незамещенного С2-С12-алкенила, замещенного или незамещенного С2-С12-алкинила, замещенного или незамещенного арила и замещенной или незамещенной гетероциклической группы.
В другом аспекте настоящее изобретение также относится к соединению формулы I или к его фармацевтически приемлемой соли, таутомеру, пролекарству или стереоизомеру для применения в качестве лекарственного средства.
В другом аспекте настоящее изобретение также относится к соединению формулы I или к его фармацевтически приемлемой соли, таутомеру, пролекарству или стереоизомеру для применения в качестве лекарственного средства для лечения ракового заболевания.
В дальнейшем аспекте настоящее изобретение также относится к применению соединений формулы I, или их фармацевтически приемлемых солей, таутомеров, пролекарств или стереоизомеров для лечения ракового заболевания или для получения лекарственного средства в целях лечения ракового заболевания. Другие аспекты данного изобретения представляют собой способы лечения и соединения для использования в этих способах. Следовательно, настоящее изобретение, далее, относится к способу лечения любого млекопитающего, в особенности, человека, пораженного раковым заболеванием, который включает введение пораженному индивидууму терапевтически эффективного количества соединения формулы I или его фармацевтически приемлемой соли, таутомера, пролекарства или стереоизомера.
Еще в дальнейшем аспекте настоящее изобретение также относится к соединению формулы I или к его фармацевтически приемлемой соли, таутомеру, пролекарству или стереоизомеру для применения в качестве противоракового агента.
В другом аспекте настоящее изобретение относится к фармацевтическим композициям, содержащим соединение формулы I или его фармацевтически приемлемую соль, таутомер, пролекарство или стереоизомер, вместе с фармацевтически приемлемым носителем или разбавителем.
Подробное описание предпочтительных воплощений
Настоящее изобретение относится к соединениям общей формулы I, как описано выше.
В этих соединениях группы можно выбирать в соответствии со следующим руководством.
Алкильные группы могут быть разветвленными или неразветвленными, и, предпочтительно, могут иметь от 1 до примерно 12 атомов углерода. Один более предпочтительный класс алкильных групп имеет от 1 до примерно 6 атомов углерода. Еще более предпочтительными являются алкильные группы, имеющие 1, 2, 3 или 4 атома углерода. Метил, этил, пропил, изопропил и бутил, включая трет-бутил, втор-бутил и изобутил, являются особенно предпочтительными алкильными группами в соединениях согласно настоящему изобретению. Другой предпочтительный класс алкильных групп имеет от 6 до примерно 10 атомов углерода и даже более предпочтительно 7, 8 или 9 атомов углерода. Гептил, октил и нонил являются наиболее предпочтительными алкильными группами в этом классе.
Предпочтительные алкенильные и алкинильные группы в соединениях согласно настоящему изобретению могут быть разветвленными или неразветвленными, могут иметь одну или более ненасыщенных связей и от 2 до примерно 12 атомов углерода. Один более предпочтительный класс алкенильных и алкинильных групп имеет от 2 до примерно 6 атомов углерода. Даже более предпочтительными являются алкенильные и алкинильные группы, имеющие 2, 3 или 4 атома углерода. Другой предпочтительный класс алкенильных и алкинильных групп имеет от 4 до примерно 10 атомов углерода, еще более предпочтительно от 6 до примерно 10 атомов углерода и даже более предпочтительно 7, 8 или 9 атомов углерода.
Авторы настоящего изобретения определяют алкенинильную группу как алкильную группу, содержащую одну или более двойных связей и одну или более тройных связей, и предпочтительными алкенинильными группами являются таковые, имеющие от 4 до примерно 12 атомов углерода. Один более предпочтительный класс алкенинильных групп имеет от 6 до примерно 10 атомов углерода.
Подходящие арильные группы в соединениях согласно настоящему изобретению включают моно- и полициклические соединения, включая полициклические соединения, которые содержат изолированные и/или конденсированные арильные группы. Типичные арильные группы содержат 1-3 изолированных или конденсированных циклов и от 6 до примерно 18 атомов углерода в цикле. Предпочтительные арильные группы содержат от 6 до примерно 10 атомов углерода в цикле. Особенно предпочтительные арильные группы включают замещенный или незамещенный фенил, замещенный или незамещенный нафтил, замещенный или незамещенный бифенил, замещенный или незамещенный фенантрил и замещенный или незамещенный антрил.
Подходящие гетероциклические группы включают гетероароматические и гетероалициклические группы, содержащие 1-3 изолированных или конденсированных цикла и от 5 до примерно 18 атомов углерода в цикле. Предпочтительно, гетероароматические и гетероалициклические группы содержат от 5 до примерно 10 атомов углерода в цикле, наиболее предпочтительно 5, 6 или 7 атомов углерода в цикле. Подходящие гетероароматические группы в соединениях согласно настоящему изобретению содержат один, два или три гетероатома, выбираемые из атомов N, O или S, и включают, например, кумаринил, включая 8-кумаринил, хинолил, включая 8-хинолил, изохинолил, пиридил, пиразинил, пиразолил, пиримидинил, фурил, пирролил, тиенил, тиазолил, изотиазолил, триазолил, тетразолил, изоксазолил, оксазолил, имидазолил, индолил, изоиндолил, индазолил, индолизинил, фталазинил, птеридинил, пуринил, оксадиазолил, тиадиазолил, фуразанил, пиридазинил, триазинил, циннолинил, бензимидазолил, бензофуранил, бензофуразанил, бензотиофенил, бензотиазолил, бензоксазолил, хиназолинил, хиноксалинил, нафтиридинил и фуропиридил. Подходящие гетероалициклические группы в соединениях согласно настоящему изобретению содержат один, два или три гетероатома, выбираемые из атомов N, O или S, и включают, например, пирролидинил, тетрагидрофуранил, дигидрофуранил, тетрагидротиенил, тетрагидротиопиранил, пиперидил, морфолинил, тиоморфолинил, тиоксанил, пиперазинил, азетидинил, оксетанил, тиетанил, гомопиперидил, оксепанил, тиепанил, оксазепинил, диазепинил, тиазепинил, 1,2,3,6-тетрагидропиридил, 2-пирролинил, 3-пирролинил, индолинил, 2Н-пиранил, 4Н-пиранил, диоксанил, 1,3-диоксоланил, пиразолинил, дитианил, дитиоланил, дигидропиранил, дигидротиенил, дигидрофуранил, пиразолидинил, имидазолинил, имидазолидинил, 3-азабицикло[3.1.0]гексил, 3-азабицикло[4.1.0]гептил, 3Н-индолил и хинолизинил.
Группы, указанные выше, могут быть замещены в одном или более доступных положениях одной или более подходящими группами, такими, как OR', =O, SR', SOR', SO2R', NO2, NHR', NR'R', =N-R', NHCOR', N(COR')2, NHSO2R', NR'C(=NR')NR'R', CN, галоген, COR', COOR', OCOR', OCONHR', OCONR'R', CONHR', CONR'R', защищенный ОН, замещенный или незамещенный С1-С12-алкил, замещенный или незамещенный С2-С12-алкенил, замещенный или незамещенный С2-С12-алкинил, замещенный или незамещенный арил и замещенная или незамещенная гетероциклическая группа, где каждую из R'-групп независимо выбирают из группы, состоящей из водорода, ОН, NO2, NH2, SH, CN, галогена, COH, CO-алкила, СО2Н, замещенного или незамещенного С1-С12-алкила, замещенного или незамещенного С2-С12-алкенила, замещенного или незамещенного С2-С12-алкинила, замещенного или незамещенного арила и замещенной или незамещенной гетероциклической группы. В случаях, где такие группы сами являются замещенными, заместители могут быть выбраны из вышеприведенного перечня.
Подходящие галоген-заместители в соединениях согласно настоящему изобретению включают F, Cl, Br и I.
Подходящие защитные группы для ОН хорошо известны квалифицированному специалисту в данной области. Общий обзор в отношении защитных групп в органической химии представлен Wuts P.G.M. и Greene T.W. в руководстве «Protecting Groups in Organic Synthesis», 4-ое изд., Wiley-Interscience, и Kocienski PJ в руководстве «Protecting Groups», 3-е изд., Georg Thieme Verlag. Эти ссылки относятся к разделам в отношении защитных групп для ОН. Все эти ссылки включены путем ссылки во всей их полноте. Примеры таких защищенных ОН включают простые эфиры, простые силильные эфиры, сложные эфиры, сульфонаты, сульфенаты и сульфинаты, карбонаты и карбаматы. В случае простых эфиров защитную группу для ОН можно выбирать из группы, состоящей из метила, метоксиметила, метилтиометила, (фенилдиметилсилил)-метоксиметила, бензилоксиметила, п-метоксибензилоксиметила, [(3,4-диметоксибензил)окси]метила, п-нитробензилоксиметила, о-нитробензилоксиметила, [(R)-1-(2-нитрофенил)этокси]метила, (4-метоксифенокси)метила, гваяколметила, [(п-фенилфенил)окси]-метила, трет-бутоксиметила, 4-пентенилоксиметила, силоксиметила, 2-метоксиэтоксиметила, 2-цианоэтоксиметила, бис(2-хлорэтокси)метила, 2,2,2-трихлорэтоксиметила, 2-(триметилсилил)-этоксиметила, ментоксиметила, о-бис(2-ацетоксиэтокси)метила, тетрагидропиранила, фтортетрагидропиранила, 3-бромтетрагидро-пиранила, тетрагидротиопиранила, 1-метоксициклогексила, 4-метокситетрагидропиранила, 4-метокситетрагидротиопиранила, 4-метокситетрагидротиопиранил-S,S-диоксида, 1-[(2-хлор-4-метил)фенил]-4-метоксипиперидин-4-ила, 1-(2-фторфенил)-4-метоксипиперидин-4-ила, 1-(4-хлорфенил)-4-метоксипиперидин-4-ила, 1,4-диоксан-2-ила, тетрагидрофуранила, тетрагидротиофуранила, 2,3,3а,4,5,6,7,7а-октагидро-7,8,8-триметил-4,7-метанобензофуран-2-ила, 1-этоксиэтила, 1-(2-хлорэтокси)этила, 2-гидроксиэтила, 2-бромэтила, 1-[2-(триметилсилил)этокси]этила, 1-метил-1-метоксиэтила, 1-метил-1-бензилоксиэтила, 1-метил-1-бензилокси-2-фторэтила, 1-метил-1-феноксиэтила, 2,2,2-трихлорэтила, 1,1-дианизил-2,2,2-трихлорэтила, 1,1,1,3,3,3-гексафтор-2-фенилизопропила, 1-(2-цианоэтокси)этила, 2-триметилсилилэтила, 2-(бензилтио)этила, 2-(фенилселенил)этила, трет-бутила, циклогексила, 1-метил-1'-циклопропилметила, аллила, пренила, циннамила, 2-феналлила, пропаргила, п-хлорфенила, п-метоксифенила, п-нитрофенила, 2,4-динитрофенила, 2,3,5,6-тетрафтор-4-(трифторметил)фенила, бензила, п-метоксибензила, 3,4-диметоксибензила, 2,6-диметоксибензила, о-нитробензила, п-нитробензила, пентадиенилнитробензила, пентадиенилнитропиперонила, галогенбензила, 2,6-дихлорбензила, 2,4-дихлорбензила, 2,6-дифторбензила, п-цианобензила, фторбензила, 4-фторалкоксибензила, триметилсилилксилила, п-фенилбензила, 2-фенил-2-пропила, п-ациламинобензила, п-азидобензила, 4-азидо-3-хлорбензила, 2-трифторметилбензила, 4-трифторметилбензила, п-(метилсульфинил)бензила, п-силэтанилбензила, 4-ацетоксибензила, 4-(2-триметилсилил)этоксиметоксибензила, 2-нафтилметила, 2-пиколила, 4-пиколила, N-оксидо-3-метил-2-пиколила, 2-хинолинилметила, 6-метокси-2-(4-метилфенил)-4-хинолинметила, 1-пиренилметила, дифенилметила, 4-метоксидифенилметила, 4-фенилдифенилметила, п,п'-динитробензгидрила, 5-дибензосуберила, трифенилметила, трис(4-трет-бутилфенил)метила, α-нафтилдифенилметила, п-метоксифенилдифенилметила, ди(п-метоксифенил)фенилметила, три(п-метоксифенил)метила, 4-(4'-бромфенацилокси)фенилдифенилметила, 4,4',4”-трис(4,5-дихлорфталимидофенил)метила, 4,4',4”-трис(левулиноилоксифенил)-метила, 4,4',4”-трис(бензоилоксифенил)метила, 4,4'-диметокси-3”-[N-(имидазолилметил)]тритила, 4,4'-диметокси-3”-[N-(имидазолилэтил)карбамоил]тритила, бис(4-метоксифенил)-1'-пиренилметила, 4-(17-тетрабензо[a,c,g,i]флуоренилметил)-4,4”-диметокситритила, 9-антрила, 9-(9-фенил)ксантенила, 9-фенилтиоксантила, 9-(9-фенил-10-оксо)антрила, 1,3-бензодитиолан-2-ила и 4,5-бис(этоксикарбонил)-[1,3]диоксолан-2-ила, S,S-диоксидобензизотиазолила. В случае простых силильных эфиров защитную группу для ОН можно выбирать из группы, состоящей из триметилсилила, триэтилсилила, триизопропилсилила, диметилизопропилсилила, диэтилизопропилсилила, диметилгексил-силила, 2-норборнилдиметилсилила, трет-бутилдиметилсилила, трет-бутилдифенилсилила, трибензилсилила, три-п-ксилилсилила, трифенилсилила, дифенилметилсилила, ди-трет-бутилметилсилила, бис(трет-бутил)-1-пиренилметоксисилила, трис(триметилсилил)-силила, (2-гидроксистирил)диметилсилила, (2-гидроксистирил)-диизопропилсилила, трет-бутилметоксифенилсилила, трет-бутоксидифенилсилила, 1,1,3,3-тетраизопропил-3-[2-(трифенилметокси)этокси]дисилоксан-1-ила и фторсилила. В случае сложных эфиров защитную группу для ОН можно выбирать из группы, состоящей из формиата, бензоилформиата, ацетата, хлорацетата, дихлорацетата, трихлорацетата, трихлорацетамидата, трифторацетата, метоксиацетата, трифенилметоксиацетата, феноксиацетата, п-хлорфеноксиацетата, фенилацетата, дифенилацетата, 3-фенилпропионата, бисфторированной цепи типа пропаноила, 4-пентеноата, 4-оксопентаноата, 4,4-(этилендитио)пентаноата, 5-[3-бис(4-метоксифенил)-гидроксиметилфенокси]левулината, пивалоата, 1-адамантоата, кротоната, 4-метоксикротоната, бензоата, п-фенилбензоата, 2,4,6-триметилбензоата, 4-бромбензоата, 2,5-дифторбензоата, п-нитробензоата, пиколината, никотината, 2-(азидометил)бензоата, 4-азидобутирата, (2-азидометил)фенилацетата, 2-{[(тритилтио)окси]метил}бензоата, 2-{[(4-метокситритилтио)окси]-метил}бензоата, 2-{[метил(тритилтио)амино]метил}бензоата, 2-{{[(4-метокситритил)тио]метиламино}метил}бензоата, 2-(аллилокси)фенилацетата, 2-(пренилоксиметил)бензоата, 6-(левулинилоксиметил)-3-метокси-2-нитробензоата, 6-(левулинилоксиметил)-3-метокси-4-нитробензоата, 4-бензилокси-бутирата, 4-триалкилсилилоксибутирата, 4-ацетокси-2,2-диметилбутирата, 2,2-диметил-4-пентеноата, 2-иодбензоата, 4-нитро-4-метилпентаноата, о-(дибромметил)бензоата, 2-формилбензолсульфоната, 4-(метилтиометокси)бутирата, 2-(метилтиометоксиметил)бензоата, 2-(хлорацетоксиметил)бензоата, 2-[(2-хлорацетокси)этил]бензоата, 2-[2-(бензилокси)этил]-бензоата, 2-[2-(4-метоксибензилокси)этил]бензоата, 2,6-дихлор-4-метилфеноксиацетата, 2,6-дихлор-4-(1,1,3,3-тетраметилбутил)-феноксиацетата, 2,4-бис(1,1-диметилпропил)феноксиацетата, хлордифенилацетата, изобутирата, моносукциноата, (Е)-2-метил-2-бутеноата, о-(метоксикарбонил)бензоата, α-нафтоата, нитрата, алкил-N,N,N',N'-тетраметилфосфородиамидата и 2-хлорбензоата. В случае сульфонатов, сульфенатов и сульфинатов, защитную группу для ОН можно выбирать из группы, состоящей из сульфата, аллилсульфоната, метансульфоната, бензилсульфоната, тозилата, 2-[(4-нитрофенил)этил]сульфоната, 2-трифторметилбензолсульфоната, 4-монометокситритилсульфената, алкил-2,4-динитрофенилсульфената, 2,2,5,5-тетраметилпирролидин-3-он-1-сульфината, бората и диметилфосфинотиолила. В случае карбонатов, защитную группу для ОН можно выбирать из группы, состоящей из метилкарбоната, метоксиметилкарбоната, 9-флуоренилметилкарбоната, этилкарбоната, бромэтилкарбоната, 2-(метилтиометокси)этилкарбоната, 2,2,2-трихлорэтилкарбоната, 1,1-диметил-2,2,2-трихлорэтилкарбоната, 2-(триметилсилил)этилкарбоната, 2-[диметил(2-нафтилметил)силил]-этилкарбоната, 2-(фенилсульфонил)этилкарбоната, 2-(трифенилфосфонио)этилкарбоната, цис[4-[[(метокситритил)-сульфенил]окси]тетрагидрофуран-3-ил]оксикарбоната, изобутил-карбоната, трет-бутилкарбоната, винилкарбоната, аллилкарбоната, циннамилкарбоната, пропаргилкарбоната, п-хлорфенилкарбоната, п-нитрофенилкарбоната, 4-этокси-1-нафтилкарбоната, 6-бром-7-гидроксикумарин-4-илметилкарбоната, бензилкарбоната, о-нитробензилкарбоната, п-нитробензилкарбоната, п-метоксибензилкарбоната, 3,4-диметоксибензилкарбоната, антрахинон-2-илметилкарбоната, 2-дансилэтилкарбоната, 2-(4-нитрофенил)этилкарбоната, 2-(2,4-динитрофенил)этилкарбоната, 2-(2-нитрофенил)пропилкарбоната, алкил-2-(3,4-метилендиокси-6-нитрофенил)пропилкарбоната, 2-циано-1-фенилэтилкарбоната, 2-(2-пиридил)амино-1-фенилэтилкарбоната, 2-[N-метил-N-(2-пиридил)]амино-1-фенилэтилкарбоната, фенацилкарбоната, 3',5'-диметоксибензоинкарбоната, метилдитиокарбоната и S-бензилтиокарбоната. И, в случае карбаматов, защитную группу для ОН можно выбирать из группы, состоящей из диметилтиокарбамата, N-фенилкарбамата, N-метил-N-(о-нитрофенил)карбамата. Упоминание этих групп не должно быть интерпретировано как ограничение объема охраны данного изобретения, так как эти группы упомянуты в качестве всего лишь иллюстрации защитных групп для ОН, однако другие группы, обладающие вышеуказанной функцией, могут быть известны квалифицированному специалисту в данной области и подразумевают, что они также входят в рамки настоящего изобретения.
Термин «фармацевтически приемлемые соли, пролекарства» относится к любой фармацевтически приемлемой соли, сложному эфиру, сольвату, гидрату или любому другому соединению, которое, после введения пациенту, способно давать (прямо или непрямо) соединение, как описанное в данном контексте.
Однако нужно принимать во внимание, что фармацевтически неприемлемые соли также входят в рамки данного изобретения, так как они могут быть пригодны при получении фармацевтически приемлемых солей. Получение солей и пролекарств можно осуществлять способами, известными в данной области.
Например, фармацевтически приемлемые соли соединений, представленные в данном контексте, синтезируют из исходного соединения, которое содержит щелочной или кислотный остаток, при использовании стандартных химических способов. Как правило, такие соли, например, получают путем введения во взаимодействие свободных кислотных или основных форм этих соединений со стехиометрическим количеством соответствующего основания или кислоты, в воде или в органическом растворителе или в смеси обоих. Как правило, предпочтительны неводные среды, подобные диэтиловому эфиру, этилацетату, этанолу, изопропанолу или ацетонитрилу. Примеры аддитивных солей кислот включают аддитивные соли неорганических кислот, такие как, например, гидрохлорид, гидробромид, гидроиодид, сульфат, нитрат, фосфат, и аддитивные соли органических кислот, такие как, например, ацетат, трифторацетат, малеат, фумарат, цитрат, оксалат, сукцинат, тартрат, малат, манделат, метансульфонат и п-толуолсульфонат. Примеры аддитивных солей оснований включают неорганические соли, такие как, например, соли натрия, калия, кальция и аммония, и соли органических оснований, таких как, например, этилендиамин, этаноламин, N,N-диалкиленэтаноламин, триэтаноламин и соли основных аминокислот.
Соединения согласно данному изобретению могут быть в кристаллической форме, или в виде свободных соединений, или в виде сольватов (например, гидратов), и подразумевают, что обе формы входят в рамки настоящего изобретения. Способы сольватации обычно известны в данной области.
Любое соединение, которое является пролекарством соединения формулы I, входит в объем и сущность данного изобретения. Термин «пролекарство», как используется в данной заявке, определен в данном контексте как означающий химическое соединение, подвергающееся химической дериватизации, такой, как замещение или введение другой химической группы для изменения (для фармацевтического применения) любого из его физико-химических свойств, таких, как растворимость или биодоступность, например, сложноэфирные и простые эфирные производные активного соединения, которые дают активное соединение, по существу, после введения субъекту. Примеры хорошо известных способов получения пролекарства данного активного соединения известны квалифицированному специалисту в данной области и могут быть найдены, например, в руководстве Krogsgaard-Larsen и др. «Textbook of Drugdesign and Discovery», Taylor & Francis (апрель 2002 года).
Подразумевают, что любое соединение, упомянутое в данном контексте, представляет собой такое конкретное соединение, а также некоторые вариации или формы. В особенности соединения, упомянутые в данном контексте, могут иметь асимметрические центры и, следовательно, существовать в различных энантиомерных формах. Все оптические изомеры и стереоизомеры соединений, упомянутых в данном контексте, и их смеси, рассматриваются в рамках настоящего изобретения. Таким образом, подразумевают, что любое данное соединение, упомянутое в настоящем контексте, представляет собой любое одно из рацемата, одной или более энантиомерных форм, одной или более диастереомерных форм, одной или более атропоизомерных форм, и их смесей. В особенности, соединения согласно настоящему изобретению, представленные вышеописанной формулой I, могут включать энантиомеры, в зависимости от их асимметрии, или диастереоизомеры. Стереоизомерия по двойной связи также возможна, следовательно, в некоторых случаях, молекула может существовать в виде (Е)-изомера или (Z)-изомера. Если молекула содержит несколько двойных связей, то каждая двойная связь имеет свою стереоизомерию, которая может быть такой же или другой, чем стереоизомерия других двойных связей в молекуле. Отдельные изомеры и смеси изомеров входят в рамки настоящего изобретения.
Кроме того, соединения, упомянутые в данном контексте, могут существовать в виде геометрических изомеров (т.е. цис- и транс-изомеров), в виде таутомеров или в виде атропоизомеров. В особенности, термин «таутомер» относится к одному из двух или более структурных изомеров соединения, которые существуют в равновесии и без труда превращаются из одной изомерной формы в другую. Общеизвестными таутомерными парами являются амин-имин, амид-имид, кето-енол, лактам-лактим и т.д. Кроме того, подразумевают, что любое соединение, упомянутое в данном контексте, представляет собой гидраты, сольваты и полиморфы и их смеси, когда такие формы существуют в среде. В дополнение, соединения, упомянутые в данном контексте, могут существовать в меченых изотопами формах. Все геометрические изомеры, таутомеры, атропоизомеры, гидраты, сольваты, полиморфы и меченные изотопами формы соединений, упомянутые в данном контексте, и их смеси входят в рамки настоящего изобретения.
Для обеспечения более краткого описания, некоторые из количественных выражений, представленных в данном контексте, не квалифицированы термином «примерно». Понятно, что, используют ли термин «примерно» определенно или нет, подразумевают, что каждое количество, указанное в данном контексте, относится к реальной данной величине, и также подразумевают, что оно относится к приближению к такой данной величине, которая должна быть разумно обоснована заключением квалифицированного специалиста в данной области, включая эквиваленты и приближения, обусловленные экспериментальными условиями и/или условиями измерения в случае такой данной величины.
В соединениях общей формулы I особенно предпочтительно Y означает -CHRay-, -CRay=CRby- и -CHRay-CRby=CRcy-, где Ray, Rby и Rcy имеют значения, как описано выше.
Особенно предпочтительно Ray, Rby и Rcy означают водород и замещенный или незамещенный С1-С12-алкил. Более предпочтительно Ray, Rby и Rcy означают водород и замещенный или незамещенный С1-С6-алкил и еще более предпочтительно означают водород, замещенный или незамещенный метил, замещенный или незамещенный этил, замещенный или незамещенный пропил, замещенный или незамещенный изопропил и замещенный или незамещенный бутил, включая замещенный или незамещенный трет-бутил, замещенный или незамещенный изобутил и замещенный или незамещенный втор-бутил. Предпочтительными заместителями вышеуказанных групп являются OR', =O, SR', SOR', SO2R', NO2, NHR', NR'R', =N-R', NHCOR', N(COR')2, NHSO2R', NR'C(=NR')NR'R', CN, галоген, COR', COOR', OCOR', OCONHR', OCONR'R', CONHR', CONR'R', защищенный ОН, замещенный или незамещенный С1-С12-алкил, замещенный или незамещенный С2-С12-алкенил, замещенный или незамещенный С2-С12-алкинил, замещенный или незамещенный арил и замещенная или незамещенная гетероциклическая группа, где каждую из R'-групп независимо выбирают из группы, состоящей из водорода, ОН, NO2, NH2, SH, CN, галогена, COH, CO-алкила, СООН, замещенного или незамещенного С1-С12-алкила, замещенного или незамещенного С2-С12-алкенила, замещенного или незамещенного С2-С12-алкинила, замещенного или незамещенного арила и замещенной или незамещенной гетероциклической группы. В случаях, где такие группы сами замещены, заместители можно выбирать из вышеприведенного перечня. Еще более предпочтительными заместителями вышеуказанных групп являются ОН, SCH3, SH, NH2, NHC(=NH)NH2, CONH2, COOH, фенил, п-, м- или о-гидроксифенил, индолил, включая 1-, 2- и 3-индолил, и имидазолил, включая 4- и 5-имидазолил. Водород и метил являются наиболее предпочтительными для групп Ray, Rby и Rcy. Особенно, когда Y означает -CHRay-, тогда особенно предпочтительно Ray означает метил, когда Y означает -CRay=CRby-, тогда особенно предпочтительно Ray означает водород и особенно предпочтительно Rby означает метил и, когда Y означает -CHRay-CRby=CRcy-, тогда особенно предпочтительно Ray означает водород или метил, особенно предпочтительно Rby означает водород и особенно предпочтительно Rcy означает метил.
Особенно предпочтительно, R1, R2, R3, R4 и R5 означают водород и замещенный или незамещенный С1-С12-алкил. Более предпочтительно, R1, R2, R3, R4 и R5 означают водород и замещенный или незамещенный С1-С6-алкил и даже более предпочтительно означают водород, замещенный или незамещенный метил, замещенный или незамещенный этил, замещенный или незамещенный пропил, замещенный или незамещенный изопропил и замещенный или незамещенный бутил, включая замещенный или незамещенный трет-бутил, замещенный или незамещенный изобутил и замещенный или незамещенный втор-бутил. Предпочтительными заместителями вышеуказанных групп являются OR', =O, SR', SOR', SO2R', NO2, NHR', NR'R', =N-R', NHCOR', N(COR')2, NHSO2R', NR'C(=NR')NR'R', CN, галоген, COR', COOR', OCOR', OCONHR', OCONR'R', CONHR', CONR'R', защищенный ОН, замещенный или незамещенный С1-С12-алкил, замещенный или незамещенный С2-С12-алкенил, замещенный или незамещенный С2-С12-алкинил, замещенный или незамещенный арил и замещенная или незамещенная гетероциклическая группа, где каждую из R'-групп независимо выбирают из группы, состоящей из водорода, ОН, NO2, NH2, SH, CN, галогена, COH, CO-алкила, СООН, замещенного или незамещенного С1-С12-алкила, замещенного или незамещенного С2-С12-алкенила, замещенного или незамещенного С2-С12-алкинила, замещенного или незамещенного арила и замещенной или незамещенной гетероциклической группы. В случаях, где такие группы сами замещены, заместители можно выбирать из вышеприведенного перечня. Даже более предпочтительными заместителями вышеуказанных групп являются ОН, SCH3, SH, NH2, NHC(=NH)NH2, CONH2, COOH, фенил, п-, м- или о-гидроксифенил, индолил, включая 1-, 2- и 3-индолил, и имидазолил, включая 4- и 5-имидазолил. Водород, метил, изопропил, трет-бутил и бензил являются наиболее предпочтительными группами R1, R2, R3, R4 и R5. Конкретно, особенно предпочтительно R1, R2, R3 и R4 означают водород. И особенно предпочтительно R5 означает метил, изопропил и трет-бутил.
Особенно предпочтительным W является NR7, где R7 имеет значение, как описано выше.
Особенно предпочтительным R6 является NR8R9 и OR10, где R8, R9 и R10 имеют значения, как описано выше и даже более предпочтительно R6 означает NR8R9.
Особенно предпочтительно R7 и R8 означают водород и замещенный или незамещенный С1-С12-алкил. Более предпочтительно R7 и R8 означают водород и замещенный или незамещенный С1-С6-алкил и даже более предпочтительно означают водород, метил, этил, пропил, изопропил и бутил, включая трет-бутил. Водород является наиболее предпочтительным.
В другом воплощении особенно предпочтительно что R7 и R5, вместе с соответствующим атомом азота и атомом углерода, к которым они присоединены, образуют замещенную или незамещенную гетероциклическую группу. В этом отношении предпочтительной гетероциклической группой является гетероалициклическая группа, содержащая один, два или три гетероатома, выбираемые из атомов N, O или S, наиболее предпочтительно один атом азота, и имеющая от 5 до примерно 10 атомов в цикле, наиболее предпочтительно 5, 6 или 7 атомов в цикле. Пирролидиновая группа является наиболее предпочтительной.
Особенно предпочтительным является наличие одной или более дополнительных связей в местах, обозначенных пунктирной линией. Более предпочтительным является наличие одной дополнительной связи между атомами углерода, к которым присоединены R1 и R2, и наличие одной или двух дополнительных связей между атомами углерода, к которым присоединены R3 и R4. В дополнение, стереохимия каждой двойной связи может существовать в виде (Е) или (Z). Отдельные изомеры и смеси этих изомеров входят в рамки настоящего изобретения.
В соединениях, где А означает:
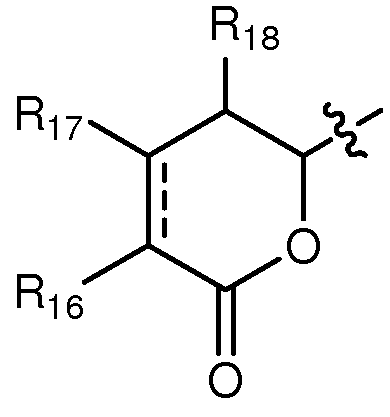
когда Y означает: а) -CHRay-, -CHRay-CHRby-, -CRay=CRby-, -C≡C- или -CHRay-С≡С-; или b) -CHRay-CHRby-CHRcy- или -CHRay-CRby=CRcy-, и тройная связь существует между атомами углерода, к которым присоединены R3 и R4, тогда особенно предпочтительно R9 означает водород, замещенный или незамещенный С1-С12-алкил, замещенный или незамещенный С2-С12-алкенил, замещенный или незамещенный С2-С12-алкинил и замещенный или незамещенный С4-С12-алкенинил. Более предпочтительно R9 означает водород, замещенный или незамещенный С2-С12-алкенил, замещенный или незамещенный С2-С12-алкинил и замещенный или незамещенный С4-С12-алкенинил. Предпочтительно замещенный алкил, замещенный алкенил, замещенный алкинил и замещенный алкенинил могут присутствовать не только в виде одного, но и двух или более заместителей. Более предпочтительными алкильными группами являются таковые, имеющие от 6 до примерно 10 атомов углерода и даже более предпочтительно 7, 8 или 9 атомов углерода. Гептил, октил и нонил являются наиболее предпочтительными алкильными группами. С другой стороны, более предпочтительными алкенильными группами являются таковые, имеющие от 6 до примерно 10 атомов углерода и даже более предпочтительно 7, 8 или 9 атомов углерода. Окта-1,6-диенил, окта-1,5-диенил, окта-1,4-диенил, окта-1,3-диенил, нона-1,7-диенил, нона-1,6-диенил, нона-1,5-диенил, нона-1,4-диенил, нона-1,3-диенил, гепта-1,5-диенил, гепта-1,4-диенил, гепта-1,3-диенил являются наиболее предпочтительными алкенильными группами. С другой стороны, более предпочтительными алкинильными группами являются таковые, имеющие от 6 до примерно 10 атомов углерода; и, даже более предпочтительно, 7, 8 или 9 атомов углерода. Окт-7-инил, окт-6-инил, окт-5-инил, окт-4-инил, окт-3-инил, окт-2-инил, окт-1-инил, нон-8-инил, нон-7-инил, нон-6-инил, нон-5-инил, нон-4-инил, нон-3-инил, нон-2-инил, нон-1-инил, гепт-6-инил, гепт-5-инил, гепт-4-инил, гепт-3-инил, гепт-2-инил и гепт-1-инил являются наиболее предпочтительными алкинильными группами. С другой стороны, более предпочтительными алкенинильными группами являются таковые, имеющие от 6 до примерно 10 атомов углерода и даже более предпочтительно 7, 8 или 9 атомов углерода. Окт-1-ен-7-инил, окт-1-ен-6-инил, окт-1-ен-5-инил, окт-1-ен-4-инил, окт-1-ен-3-инил, нон-1-ен-8-инил, нон-1-ен-7-инил, нон-1-ен-6-инил, нон-1-ен-5-инил, нон-1-ен-4-инил, нон-1-ен-3-инил, гепт-1-ен-6-инил, гепт-1-ен-5-инил, гепт-1-ен-4-инил и гепт-1-ен-3-инил являются наиболее предпочтительными алкенинильными группами. Предпочтительными заместителями для вышеуказанных алкильных, алкенильных, алкинильных и алкенинильных групп являются OR', =O, SR', SOR', SO2R', NO2, NHR', NR'R', =N-R', NHCOR', N(COR')2, NHSO2R', NR'C(=NR')NR'R', CN, галоген, COR', COOR', OCOR', OCONHR', OCONR'R', CONHR', CONR'R', защищенный ОН, замещенный или незамещенный С1-С12-алкил, замещенный или незамещенный С2-С12-алкенил, замещенный или незамещенный С2-С12-алкинил, замещенный или незамещенный арил и замещенная или незамещенная гетероциклическая группа, где каждую из R'-групп независимо выбирают из группы, состоящей из водорода, ОН, NO2, NH2, SH, CN, галогена, COH, CO-алкила, СООН, замещенного или незамещенного С1-С12-алкила, замещенного или незамещенного С2-С12-алкенила, замещенного или незамещенного С2-С12-алкинила, замещенного или незамещенного арила и замещенной или незамещенной гетероциклической группы. В случаях, где такие группы сами замещены, заместители можно выбирать из вышеприведенного перечня. Более предпочтительными заместителями для вышеуказанных алкенильных, алкинильных и алкенинильных групп являются галоген, OR', =O, OCOR', OCONHR', OCONR'R', CONHR', CONR'R' и защищенный ОН, где каждую из R'-групп предпочтительно выбирают из группы, состоящей из водорода, замещенного или незамещенного С1-С12-алкила, замещенного или незамещенного С2-С12-алкенила, замещенного или незамещенного С2-С12-алкинила и замещенного или незамещенного арила. Даже более предпочтительными заместителями для этих алкильных, алкенильных, алкинильных и алкенинильных групп являются галоген, OR', =O, OCONHR', OCONR'R', CONHR', CONR'R' и защищенный ОН, где защитную группу для ОН предпочтительно выбирают из группы, состоящей из триметилсилила, триэтилсилила, триизопропилсилила, диметилизопропилсилила, диэтилизопропилсилила, диметилгексилсилила, 2-норборнилдиметилсилила, трет-бутилдиметилсилила, трет-бутилдифенилсилила, трибензилсилила, три-п-ксилилсилила, трифенилсилила, дифенилметилсилила, ди-трет-бутилметилсилила, бис(трет-бутил)-1-пуренилметоксисилила, трис(триметилсилил)-силила, (2-гидроксистирил)диметилсилила, (2-гидроксистирил)-диизопропилсилила, трет-бутилметоксифенилсилила, трет-бутоксидифенилсилила, 1,1,3,3-тетраизопропил-3-[2-(трифенилметокси)этокси]дисилоксан-1-ила и фторсилила, и где каждую из R'-групп более предпочтительно выбирают из группы, состоящей из водорода, незамещенного С1-С6-алкила и замещенного или незамещенного арила, Cl, OH, =O, OCONH2, OCONH-фенила и защищенного ОН, где защитную группу для ОН предпочтительно выбирают из группы, состоящей из триметилсилила, триэтилсилила, триизопропилсилила, диметилизопропилсилила, диэтилизопропил-силила, диметилгексилсилила, 2-норборнилдиметилсилила, трет-бутилдиметилсилила, трет-бутилдифенилсилила, трибензилсилила, три-п-ксилилсилила, трифенилсилила, дифенилметилсилила, ди-трет-бутилметилсилила, бис(трет-бутил)-1-пуренилметоксисилила, трис(триметилсилил)силила, (2-гидроксистирил)диметилсилила, (2-гидроксистирил)диизопропилсилила, трет-бутилметоксифенилсилила, трет-бутоксидифенилсилила, 1,1,3,3-тетраизопропил-3-[2-(трифенилметокси)этокси]дисилоксан-1-ила и фторсилила, которые являются наиболее предпочтительными заместителями для этих алкильных, алкенильных, алкинильных и алкенинильных групп.
Когда Y означает -CHRay-CHRby-CHRcy- или -CHRay-CRby=CRcy- и одинарная или двойная связь существует между атомами углерода, к которым присоединены R3 и R4, тогда R9 означает замещенный или незамещенный С4-С12-алкенинил. Предпочтительный замещенный алкенинил может присутствовать не только в виде одного, но и двух или более заместителей. Более предпочтительные алкенинильные группы представляют собой таковые, имеющие от 6 до примерно 10 атомов углерода и даже более предпочтительно 7, 8 или 9 атомов углерода. Окт-1-ен-7-инил, окт-1-ен-6-инил, окт-1-ен-5-инил, окт-1-ен-4-инил, окт-1-ен-3-инил, нон-1-ен-8-инил, нон-1-ен-7-инил, нон-1-ен-6-инил, нон-1-ен-5-инил, нон-1-ен-4-инил, нон-1-ен-3-инил, гепт-1-ен-6-инил, гепт-1-ен-5-инил, гепт-1-ен-4-инил и гепт-1-ен-3-инил являются наиболее предпочтительными алкенинильными группами. Предпочтительными заместителями для вышеуказанных алкенинильных групп являются OR', =O, SR', SOR', SO2R', NO2, NHR', NR'R', =N-R', NHCOR', N(COR')2, NHSO2R', NR'C(=NR')NR'R', CN, галоген, COR', COOR', OCOR', OCONHR', OCONR'R', CONHR', CONR'R', защищенный ОН, замещенный или незамещенный С1-С12-алкил, замещенный или незамещенный С2-С12-алкенил, замещенный или незамещенный С2-С12-алкинил, замещенный или незамещенный арил и замещенная или незамещенная гетероциклическая группа, где каждую из R'-групп независимо выбирают из группы, состоящей из водорода, ОН, NO2, NH2, SH, CN, галогена, COH, CO-алкила, СООН, замещенного или незамещенного С1-С12-алкила, замещенного или незамещенного С2-С12-алкенила, замещенного или незамещенного С2-С12-алкинила, замещенного или незамещенного арила и замещенной или незамещенной гетероциклической группы. В случаях, где такие группы сами замещены, заместители можно выбирать из вышеприведенного перечня. Более предпочтительными заместителями для вышеуказанных алкенинильных групп являются галоген, OR', =O, OCOR', OCONHR', OCONR'R', CONHR', CONR'R' и защищенный ОН, где каждую из R'-групп предпочтительно выбирают из группы, состоящей из водорода, замещенного или незамещенного С1-С12-алкила, замещенного или незамещенного С2-С12-алкенила, замещенного или незамещенного С2-С12-алкинила и замещенного или незамещенного арила. Даже более предпочтительными заместителями для этих алкенинильных групп являются галоген, OR', =O, OCONHR', OCONR'R', CONHR', CONR'R' и защищенный ОН, где защитную группу для ОН предпочтительно выбирают из группы, состоящей из триметилсилила, триэтилсилила, триизопропилсилила, диметилизопропилсилила, диэтилизопропилсилила, диметилгексилсилила, 2-норборнилдиметилсилила, трет-бутилдиметилсилила, трет-бутилдифенилсилила, трибензилсилила, три-п-ксилилсилила, трифенилсилила, дифенилметилсилила, ди-трет-бутилметилсилила, бис(трет-бутил)-1-пуренилметоксисилила, трис(триметилсилил)силила, (2-гидроксистирил)диметилсилила, (2-гидроксистирил)диизопропилсилила, трет-бутилметоксифенилсилила, трет-бутоксидифенилсилила, 1,1,3,3-тетраизопропил-3-[2-(трифенилметокси)этокси]дисилоксан-1-ила и фторсодержащего силила, и где каждую из R'-групп более предпочтительно выбирают из группы, состоящей из водорода, незамещенного С1-С6-алкила и замещенного или незамещенного арила, Cl, OH, =O, OCONH2, OCONH-фенила и защищенного ОН, где защитную группу для ОН предпочтительно выбирают из группы, состоящей из триметилсилила, триэтилсилила, триизопропилсилила, диметилизопропилсилила, диэтилизопропилсилила, диметилгексилсилила, 2-норборнил-диметилсилила, трет-бутилдиметилсилила, трет-бутилдифенилсилила, трибензилсилила, три-п-ксилилсилила, трифенилсилила, дифенилметилсилила, ди-трет-бутилметилсилила, бис(трет-бутил)-1-пуренилметоксисилила, трис(триметилсилил)силила, (2-гидроксистирил)диметилсилила, (2-гидроксистирил)диизопропил-силила, трет-бутилметоксифенилсилила, трет-бутоксидифенилсилила, 1,1,3,3-тетраизопропил-3-[2-(трифенилметокси)этокси]дисилоксан-1-ила и фторсилила, которые являются наиболее предпочтительными заместителями для этих алкенинильных групп.
Особенно предпочтительно R16 означает водород, ORa и OCORa, где Ra выбирают из водорода и замещенного или незамещенного С1-С12-алкила. Особенно предпочтительно, Ra означает водород и замещенный или незамещенный С1-С6-алкил; и, даже более предпочтительно, означает водород, метил, этил, пропил, изопропил и бутил, включая трет-бутил. Водород, ОН и метокси являются наиболее предпочтительными группами R16.
Особенно предпочтительно R17 и R18 означают водород и замещенный или незамещенный С1-С12-алкил. Более предпочтительно R17 и R18 означают водород и замещенный или незамещенный С1-С6-алкил и даже более предпочтительно означают водород.
С другой стороны, в соединениях, где А означает:
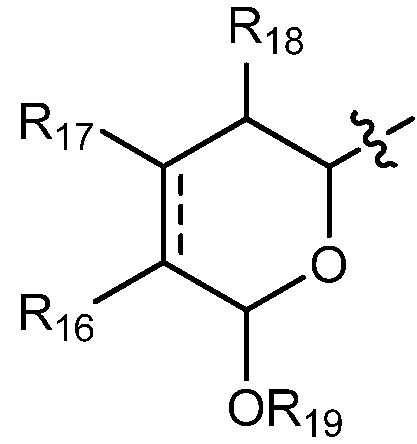
особенно предпочтительно R9 означает водород, замещенный или незамещенный С1-С12-алкил, замещенный или незамещенный С2-С12-алкенил, замещенный или незамещенный С2-С12-алкинил и замещенный или незамещенный С4-С12-алкенинил и более предпочтительно означает водород, замещенный или незамещенный С2-С12-алкенил, замещенный или незамещенный С2-С12-алкинил и замещенный или незамещенный С4-С12-алкенинил. Предпочтительные замещенные алкилы, замещенные алкенилы, замещенные алкинилы и замещенные алкенинилы могут присутствовать не только в виде одного, но и двух или более заместителей. Более предпочтительными алкильными группами являются таковые, имеющие от 6 до примерно 10 атомов углерода и даже более предпочтительно 7, 8 или 9 атомов углерода. Гептил, октил и нонил являются наиболее предпочтительными алкильными группами. С другой стороны, более предпочтительными алкенильными группами являются таковые, имеющие от 6 до примерно 10 атомов углерода и даже более предпочтительно 7, 8 или 9 атомов углерода. Окта-1,6-диенил, окта-1,5-диенил, окта-1,4-диенил, окта-1,3-диенил, нона-1,7-диенил, нона-1,6-диенил, нона-1,5-диенил, нона-1,4-диенил, нона-1,3-диенил, гепта-1,5-диенил, гепта-1,4-диенил, гепта-1,3-диенил являются наиболее предпочтительными алкенильными группами. С другой стороны, более предпочтительными алкинильными группами являются таковые, имеющие от 6 до примерно 10 атомов углерода и даже более предпочтительно 7, 8 или 9 атомов углерода. Окт-7-инил, окт-6-инил, окт-5-инил, окт-4-инил, окт-3-инил, окт-2-инил, окт-1-инил, нон-8-инил, нон-7-инил, нон-6-инил, нон-5-инил, нон-4-инил, нон-3-инил, нон-2-инил, нон-1-инил, гепт-6-инил, гепт-5-инил, гепт-4-инил, гепт-3-инил, гепт-2-инил и гепт-1-инил являются наиболее предпочтительными алкинильными группами. С другой стороны, более предпочтительными алкенинильными группами являются таковые, имеющие от 6 до примерно 10 атомов углерода и даже более предпочтительно 7, 8 или 9 атомов углерода. Окт-1-ен-7-инил, окт-1-ен-6-инил, окт-1-ен-5-инил, окт-1-ен-4-инил, окт-1-ен-3-инил, нон-1-ен-8-инил, нон-1-ен-7-инил, нон-1-ен-6-инил, нон-1-ен-5-инил, нон-1-ен-4-инил, нон-1-ен-3-инил, гепт-1-ен-6-инил, гепт-1-ен-5-инил, гепт-1-ен-4-инил и гепт-1-ен-3-инил являются наиболее предпочтительными алкенинильными группами. Предпочтительными заместителями для вышеуказанных алкильных, алкенильных, алкинильных и алкенинильных групп являются OR', =O, SR', SOR', SO2R', NO2, NHR', NR'R', =N-R', NHCOR', N(COR')2, NHSO2R', NR'C(=NR')NR'R', CN, галоген, COR', COOR', OCOR', OCONHR', OCONR'R', CONHR', CONR'R', защищенный ОН, замещенный или незамещенный С1-С12-алкил, замещенный или незамещенный С2-С12-алкенил, замещенный или незамещенный С2-С12-алкинил, замещенный или незамещенный арил и замещенная или незамещенная гетероциклическая группа, где каждую из R'-групп независимо выбирают из группы, состоящей из водорода, ОН, NO2, NH2, SH, CN, галогена, COH, CO-алкила, СООН, замещенного или незамещенного С1-С12-алкила, замещенного или незамещенного С2-С12-алкенила, замещенного или незамещенного С2-С12-алкинила, замещенного или незамещенного арила и замещенной или незамещенной гетероциклической группы. В случаях, где такие группы сами замещены, заместители можно выбирать из вышеприведенного перечня. Более предпочтительными заместителями для вышеуказанных алкенильных, алкинильных и алкенинильных групп являются галоген, OR', =O, OCOR', OCONHR', OCONR'R', CONHR', CONR'R' и защищенный ОН, где каждую из R'-групп предпочтительно выбирают из группы, состоящей из водорода, замещенного или незамещенного С1-С12-алкила, замещенного или незамещенного С2-С12-алкенила, замещенного или незамещенного С2-С12-алкинила и замещенного или незамещенного арила. Даже более предпочтительными заместителями для этих алкильных, алкенильных, алкинильных и алкенинильных групп являются галоген, OR', =O, OCONHR', OCONR'R', CONHR', CONR'R' и защищенный ОН, где защитную группу для ОН предпочтительно выбирают из группы, состоящей из триметилсилила, триэтилсилила, триизопропилсилила, диметилизопропилсилила, диэтилизопропилсилила, диметилгексилсилила, 2-норборнил-диметилсилила, трет-бутилдиметилсилила, трет-бутилдифенилсилила, трибензилсилила, три-п-ксилилсилила, трифенилсилила, дифенилметилсилила, ди-трет-бутилметилсилила, бис(трет-бутил)-1-пуренилметоксисилила, трис(триметилсилил)силила, (2-гидроксистирил)диметилсилила, (2-гидроксистирил)диизопропил-силила, трет-бутилметоксифенилсилила, трет-бутоксидифенилсилила, 1,1,3,3-тетраизопропил-3-[2-(трифенилметокси)этокси]дисилоксан-1-ила и фторсилила, и где каждую из R'-групп более предпочтительно выбирают из группы, состоящей из водорода, незамещенного С1-С6-алкила и замещенного или незамещенного арила, Cl, OH, =O, OCONH2, OCONH-фенила и защищенного ОН, где защитную группу для ОН предпочтительно выбирают из группы, состоящей из триметилсилила, триэтилсилила, триизопропилсилила, диметилизопропилсилила, диэтилизопропилсилила, диметилгексил-силила, 2-норборнилдиметилсилила, трет-бутилдиметилсилила, трет-бутилдифенилсилила, трибензилсилила, три-п-ксилилсилила, трифенилсилила, дифенилметилсилила, ди-трет-бутилметилсилила, бис(трет-бутил)-1-пуренилметоксисилила, трис(триметилсилил)-силила, (2-гидроксистирил)диметилсилила, (2-гидроксистирил)-диизопропилсилила, трет-бутилметоксифенилсилила, трет-бутоксидифенилсилила, 1,1,3,3-тетраизопропил-3-[2-(трифенилметокси)этокси]дисилоксан-1-ила и фторсилила, которые являются наиболее предпочтительными заместителями для этих алкильных, алкенильных, алкинильных и алкенинильных групп.
Особенно предпочтительно R16 означает водород, ORa и OCORa, где Ra выбирают из водорода и замещенного или незамещенного С1-С12-алкила. Особенно предпочтительно Ra означает водород и замещенный или незамещенный С1-С6-алкил и даже более предпочтительно означает водород, метил, этил, пропил, изопропил и бутил, включая трет-бутил. Водород, ОН и метокси являются наиболее предпочтительными группами R16.
Особенно предпочтительно R17 и R18 означают водород и замещенный или незамещенный С1-С12-алкил и особенно предпочтительно R19 означает водород, замещенный или незамещенный С1-С12-алкил и CORa, где Ra означает замещенный или незамещенный С1-С12-алкил. Более предпочтительно, R17 и R18 означают водород и замещенный или незамещенный С1-С6-алкил, и, более предпочтительно, R19 означает водород, замещенный или незамещенный С1-С6-алкил и CORa, где Ra означает замещенный или незамещенный С1-С6-алкил. Особенно предпочтительно, Ra означает метил, этил, пропил, изопропил и бутил, включая трет-бутил. Даже более предпочтительно, R17, R18 и R19 означают водород.
Особенно предпочтительным является наличие одной или более дополнительных связей в местах, обозначенных пунктирной линией. Более предпочтительным является наличие одной дополнительной связи между атомами углерода, к которым присоединены R1 и R2, и наличие одной или двух дополнительных связей между атомами углерода, к которым присоединены R3 и R4. В дополнение, стереохимия каждой двойной связи может существовать в виде (Е) или (Z). Отдельные изомеры и смеси этих изомеров входят в рамки настоящего изобретения.
Более конкретно, предпочтительными соединениями общей формулы I являются таковые, также имеющие общую формулу IA, или их фармацевтически приемлемые соли, таутомеры, пролекарства или стереоизомеры:
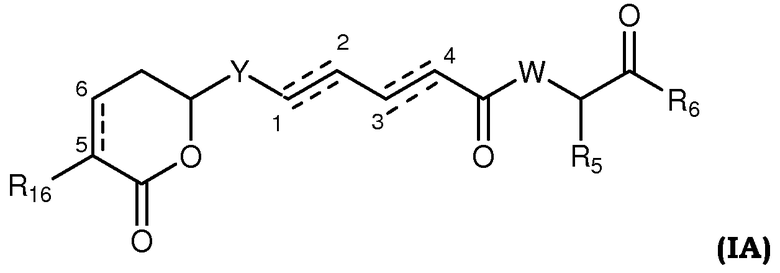
где Y выбирают из группы, состоящей из -CHRay-, -CHRay-CHRby-, -CRay=CRby-, -C≡C-, -CHRay-CHRby-CHRcy-, -CHRay-CRby=CRcy- и -CHRay-С≡С-;
каждый Ray, Rby и Rcy независимо выбирают из группы, состоящей из водорода, замещенного или незамещенного С1-С12-алкила, замещенного или незамещенного С2-С12-алкенила и замещенного или незамещенного С2-С12-алкинила;
R5 выбирают из группы, состоящей из водорода, замещенного или незамещенного С1-С12-алкила, замещенного или незамещенного С2-С12-алкенила и замещенного или незамещенного С2-С12-алкинила;
R6 выбирают из NR8R9 и OR10;
W выбирают из О и NR7;
R7 выбирают из группы, состоящей из водорода, CORa, COORa, замещенного или незамещенного С1-С12-алкила, замещенного или незамещенного С2-С12-алкенила и замещенного или незамещенного С2-С12-алкинила, или R7 и R5, вместе с соответствующим атомом азота и атомом углерода, к которым они присоединены, могут образовывать замещенную или незамещенную гетероциклическую группу;
каждый R8 и R9 независимо выбирают из группы, состоящей из водорода, CORa, COORa, замещенного или незамещенного С1-С12-алкила, замещенного или незамещенного С2-С12-алкенила, замещенного или незамещенного С2-С12-алкинила и замещенного или незамещенного С4-С12-алкенинила; при условии, что, когда Y означает -CHRay-CHRby-CHRcy- или -CHRay-CRby=CRcy- и одинарная или двойная связь существует между С3 и С4, тогда R9 означает замещенный или незамещенный С4-С12-алкенинил;
R10 выбирают из группы, состоящей из водорода, замещенного или незамещенного С1-С12-алкила, замещенного или незамещенного С2-С12-алкенила и замещенного или незамещенного С2-С12-алкинила;
R16 выбирают из группы, состоящей из водорода, ORa, OCORa, OCOORa, NRaRb, NRaCORb и NRaC(=NRa)NRaRb, замещенного или незамещенного С1-С12-алкила, замещенного или незамещенного С2-С12-алкенила и замещенного или незамещенного С2-С12-алкинила; и
каждый Ra и Rb независимо выбирают из группы, состоящей из водорода, замещенного или незамещенного С1-С12-алкила, замещенного или незамещенного С2-С12-алкенила, замещенного или незамещенного С2-С12-алкинила, замещенного или незамещенного арила и замещенной или незамещенной гетероциклической группы; и
каждая пунктирная линия представляет собой необязательную дополнительную связь.
В соединениях общей формулы IA, особенно предпочтительно Y означает -CHRay-, -CRay=CRby- и -CHRay-CRby=CRcy-, где Ray, Rby и Rcy имеют значения, как описано выше.
Особенно предпочтительно Ray, Rby и Rcy означают водород и замещенный или незамещенный С1-С12-алкил. Более предпочтительно, Ray, Rby и Rcy означают водород и замещенный или незамещенный С1-С6-алкил и даже более предпочтительно означают водород, замещенный или незамещенный метил, замещенный или незамещенный этил, замещенный или незамещенный пропил, замещенный или незамещенный изопропил и замещенный или незамещенный бутил, включая замещенный или незамещенный трет-бутил, замещенный или незамещенный изобутил и замещенный или незамещенный втор-бутил. Предпочтительными заместителями вышеуказанных групп являются OR', =O, SR', SOR', SO2R', NO2, NHR', NR'R', =N-R', NHCOR', N(COR')2, NHSO2R', NR'C(=NR')NR'R', CN, галоген, COR', COOR', OCOR', OCONHR', OCONR'R', CONHR', CONR'R', защищенный ОН, замещенный или незамещенный С1-С12-алкил, замещенный или незамещенный С2-С12-алкенил, замещенный или незамещенный С2-С12-алкинил, замещенный или незамещенный арил и замещенная или незамещенная гетероциклическая группа, где каждую из R'-групп независимо выбирают из группы, состоящей из водорода, ОН, NO2, NH2, SH, CN, галогена, COH, CO-алкила, СООН, замещенного или незамещенного С1-С12-алкила, замещенного или незамещенного С2-С12-алкенила, замещенного или незамещенного С2-С12-алкинила, замещенного или незамещенного арила и замещенной или незамещенной гетероциклической группы. В случаях, где такие группы сами замещены, заместители можно выбирать из вышеприведенного перечня. Даже более предпочтительными заместителями вышеуказанных групп являются ОН, SCH3, SH, NH2, NHC(=NH)NH2, CONH2, COOH, фенил, п-, м- или о-гидроксифенил, индолил, включая 1-, 2- и 3-индолил, и имидазолил, включая 4- и 5-имидазолил. Водород и метил являются наиболее предпочтительными группами Ray, Rby и Rcy. Особенно, когда Y означает -CHRay-, тогда особенно предпочтительно Ray означает метил, когда Y означает -CRay=CRby-, тогда особенно предпочтительно Ray означает водород и особенно предпочтительно Rby означает метил, и, когда Y означает -CHRay-CRby=CRcy-, тогда особенно предпочтительно Ray означает водород или метил, особенно предпочтительно Rby означает водород и особенно предпочтительно Rcy означает метил.
Особенно предпочтительно R5 означает водород и замещенный или незамещенный С1-С12-алкил. Более предпочтительно R5 означает водород и замещенный или незамещенный С1-С6-алкил и даже более предпочтительно означает водород, замещенный или незамещенный метил, замещенный или незамещенный этил, замещенный или незамещенный пропил, замещенный или незамещенный изопропил и замещенный или незамещенный бутил, включая замещенный или незамещенный трет-бутил, замещенный или незамещенный изобутил и замещенный или незамещенный втор-бутил. Предпочтительными заместителями вышеуказанных групп являются OR', =O, SR', SOR', SO2R', NO2, NHR', NR'R', =N-R', NHCOR', N(COR')2, NHSO2R', NR'C(=NR')NR'R', CN, галоген, COR', COOR', OCOR', OCONHR', OCONR'R', CONHR', CONR'R', защищенный ОН, замещенный или незамещенный С1-С12-алкил, замещенный или незамещенный С2-С12-алкенил, замещенный или незамещенный С2-С12-алкинил, замещенный или незамещенный арил и замещенная или незамещенная гетероциклическая группа, где каждую из R'-групп независимо выбирают из группы, состоящей из водорода, ОН, NO2, NH2, SH, CN, галогена, COH, CO-алкила, СООН, замещенного или незамещенного С1-С12-алкила, замещенного или незамещенного С2-С12-алкенила, замещенного или незамещенного С2-С12-алкинила, замещенного или незамещенного арила и замещенной или незамещенной гетероциклической группы. В случаях, где такие группы сами замещены, заместители можно выбирать из вышеприведенного перечня. Даже более предпочтительными заместителями вышеуказанных групп являются ОН, SCH3, SH, NH2, NHC(=NH)NH2, CONH2, COOH, фенил, п-, м- или о-гидроксифенил, индолил, включая 1-, 2- и 3-индолил, и имидазолил, включая 4- и 5-имидазолил. Водород, метил, изопропил, трет-бутил и бензил являются наиболее предпочтительными группами R5 и, даже наиболее предпочтительными, являются метил, изопропил и трет-бутил.
Особенно предпочтительно, W означает NR7, где R7 имеет значение, как описано выше.
Особенно предпочтительно R6 означает NR8R9, где R8 и R9 имеют значения, как описано выше.
Особенно предпочтительно R7 и R8 означают водород и замещенный или незамещенный С1-С12-алкил. Более предпочтительно R7 и R8 означают водород и замещенный или незамещенный С1-С6-алкил; и, даже более предпочтительно, означают водород, метил, этил, пропил, изопропил и бутил, включая трет-бутил. Водород является наиболее предпочтительным.
В другом воплощении особенно предпочтительно, что R7 и R5, вместе с соответствующим атомом азота и атомом углерода, к которым они присоединены, образуют замещенную или незамещенную гетероциклическую группу. В этом отношении предпочтительной гетероциклической группой является гетероалициклическая группа, содержащая один, два или три гетероатома, выбираемые из атомов N, O или S, наиболее предпочтительно один атом азота и имеющая от 5 до примерно 10 атомов в цикле, наиболее предпочтительно, 5, 6 или 7 атомов в цикле. Пирролидиновая группа является наиболее предпочтительной.
Когда Y означает: а) -CHRay-, -CHRay-CHRby-, -CRay=CRby-, -C≡C- или -CHRay-С≡С-; или b) -CHRay-CHRby-CHRcy- или -CHRay-CRby=CRcy-, и тройная связь существует между С3 и С4, тогда, особенно предпочтительно, R9 означает водород, замещенный или незамещенный С1-С12-алкил, замещенный или незамещенный С2-С12-алкенил, замещенный или незамещенный С2-С12-алкинил и замещенный или незамещенный С4-С12-алкенинил. Более предпочтительно означает водород, замещенный или незамещенный С2-С12-алкенил, замещенный или незамещенный С2-С12-алкинил и замещенный или незамещенный С4-С12-алкенинил. Предпочтительно замещенный алкил, замещенный алкенил, замещенный алкинил и замещенный алкенинил могут присутствовать не только в виде одного, но и двух или более заместителей. Более предпочтительными алкильными группами являются таковые, имеющие от 6 до примерно 10 атомов углерода и, даже более предпочтительно, 7, 8 или 9 атомов углерода. Гептил, октил и нонил являются наиболее предпочтительными алкильными группами. С другой стороны, более предпочтительными алкенильными группами являются таковые, имеющие от 6 до примерно 10 атомов углерода и даже более предпочтительно 7, 8 или 9 атомов углерода. Окта-1,6-диенил, окта-1,5-диенил, окта-1,4-диенил, окта-1,3-диенил, нона-1,7-диенил, нона-1,6-диенил, нона-1,5-диенил, нона-1,4-диенил, нона-1,3-диенил, гепта-1,5-диенил, гепта-1,4-диенил, гепта-1,3-диенил являются наиболее предпочтительными алкенильными группами. С другой стороны, более предпочтительными алкинильными группами являются таковые, имеющие от 6 до примерно 10 атомов углерода и даже более предпочтительно 7, 8 или 9 атомов углерода. Окт-7-инил, окт-6-инил, окт-5-инил, окт-4-инил, окт-3-инил, окт-2-инил, окт-1-инил, нон-8-инил, нон-7-инил, нон-6-инил, нон-5-инил, нон-4-инил, нон-3-инил, нон-2-инил, нон-1-инил, гепт-6-инил, гепт-5-инил, гепт-4-инил, гепт-3-инил, гепт-2-инил и гепт-1-инил являются наиболее предпочтительными алкинильными группами. С другой стороны, более предпочтительными алкенинильными группами являются таковые, имеющие от 6 до примерно 10 атомов углерода и даже более предпочтительно 7, 8 или 9 атомов углерода. Окт-1-ен-7-инил, окт-1-ен-6-инил, окт-1-ен-5-инил, окт-1-ен-4-инил, окт-1-ен-3-инил, нон-1-ен-8-инил, нон-1-ен-7-инил, нон-1-ен-6-инил, нон-1-ен-5-инил, нон-1-ен-4-инил, нон-1-ен-3-инил, гепт-1-ен-6-инил, гепт-1-ен-5-инил, гепт-1-ен-4-инил и гепт-1-ен-3-инил являются наиболее предпочтительными алкенинильными группами. Предпочтительными заместителями для вышеуказанных алкильных, алкенильных, алкинильных и алкенинильных групп являются OR', =O, SR', SOR', SO2R', NO2, NHR', NR'R', =N-R', NHCOR', N(COR')2, NHSO2R', NR'C(=NR')NR'R', CN, галоген, COR', COOR', OCOR', OCONHR', OCONR'R', CONHR', CONR'R', защищенный ОН, замещенный или незамещенный С1-С12-алкил, замещенный или незамещенный С2-С12-алкенил, замещенный или незамещенный С2-С12-алкинил, замещенный или незамещенный арил и замещенная или незамещенная гетероциклическая группа, где каждую из R'-групп независимо выбирают из группы, состоящей из водорода, ОН, NO2, NH2, SH, CN, галогена, COH, CO-алкила, СООН, замещенного или незамещенного С1-С12-алкила, замещенного или незамещенного С2-С12-алкенила, замещенного или незамещенного С2-С12-алкинила, замещенного или незамещенного арила и замещенной или незамещенной гетероциклической группы. В случаях, где такие группы сами замещены, заместители можно выбирать из вышеприведенного перечня. Более предпочтительными заместителями для вышеуказанных алкенильных, алкинильных и алкенинильных групп являются галоген, OR', =O, OCOR', OCONHR', OCONR'R', CONHR', CONR'R' и защищенный ОН, где каждую из R'-групп предпочтительно выбирают из группы, состоящей из водорода, замещенного или незамещенного С1-С12-алкила, замещенного или незамещенного С2-С12-алкенила, замещенного или незамещенного С2-С12-алкинила и замещенного или незамещенного арила. Даже более предпочтительными заместителями для этих алкильных, алкенильных, алкинильных и алкенинильных групп являются галоген, OR', =O, OCONHR', OCONR'R', CONHR', CONR'R' и защищенный ОН, где защитную группу для ОН предпочтительно выбирают из группы, состоящей из триметилсилила, триэтилсилила, триизопропилсилила, диметилизопропилсилила, диэтилизопропилсилила, диметилгексилсилила, 2-норборнил-диметилсилила, трет-бутилдиметилсилила, трет-бутилдифенилсилила, трибензилсилила, три-п-ксилилсилила, трифенилсилила, дифенилметилсилила, ди-трет-бутилметилсилила, бис(трет-бутил)-1-пуренилметоксисилила, трис(триметилсилил)силила, (2-гидроксистирил)диметилсилила, (2-гидроксистирил)диизопропил-силила, трет-бутилметоксифенилсилила, трет-бутоксидифенилсилила, 1,1,3,3-тетраизопропил-3-[2-(трифенилметокси)этокси]дисилоксан-1-ила и фторсилила, и где каждую из R'-групп более предпочтительно выбирают из группы, состоящей из водорода, незамещенного С1-С6-алкила и замещенного или незамещенного арила, Cl, OH, =O, OCONH2, OCONH-фенила и защищенного ОН, где защитную группу для ОН предпочтительно выбирают из группы, состоящей из триметилсилила, триэтилсилила, триизопропилсилила, диметилизопропилсилила, диэтилизопропилсилила, диметилгексил-силила, 2-норборнилдиметилсилила, трет-бутилдиметилсилила, трет-бутилдифенилсилила, трибензилсилила, три-п-ксилилсилила, трифенилсилила, дифенилметилсилила, ди-трет-бутилметилсилила, бис(трет-бутил)-1-пуренилметоксисилила, трис(триметилсилил)-силила, (2-гидроксистирил)диметилсилила, (2-гидроксистирил)-диизопропилсилила, трет-бутилметоксифенилсилила, трет-бутоксидифенилсилила, 1,1,3,3-тетраизопропил-3-[2-(трифенилметокси)этокси]дисилоксан-1-ила и фторсилила, которые являются наиболее предпочтительными заместителями для этих алкильных, алкенильных, алкинильных и алкенинильных групп.
Когда Y означает -CHRay-CHRby-CHRcy- или -CHRay-CRby=CRcy- и одинарная или двойная связь существует между С3 и С4, тогда R9 означает замещенный или незамещенный С4-С12-алкенинил. Предпочтительный замещенный алкенинил может присутствовать не только в виде одного, но и двух или более заместителей. Более предпочтительные алкенинильные группы представляют собой таковые, имеющие от 6 до примерно 10 атомов углерода; и, даже более предпочтительно, 7, 8 или 9 атомов углерода. Окт-1-ен-7-инил, окт-1-ен-6-инил, окт-1-ен-5-инил, окт-1-ен-4-инил, окт-1-ен-3-инил, нон-1-ен-8-инил, нон-1-ен-7-инил, нон-1-ен-6-инил, нон-1-ен-5-инил, нон-1-ен-4-инил, нон-1-ен-3-инил, гепт-1-ен-6-инил, гепт-1-ен-5-инил, гепт-1-ен-4-инил и гепт-1-ен-3-инил являются наиболее предпочтительными алкенинильными группами. Предпочтительными заместителями для вышеуказанных алкенинильных групп являются OR', =O, SR', SOR', SO2R', NO2, NHR', NR'R', =N-R', NHCOR', N(COR')2, NHSO2R', NR'C(=NR')NR'R', CN, галоген, COR', COOR', OCOR', OCONHR', OCONR'R', CONHR', CONR'R', защищенный ОН, замещенный или незамещенный С1-С12-алкил, замещенный или незамещенный С2-С12-алкенил, замещенный или незамещенный С2-С12-алкинил, замещенный или незамещенный арил и замещенная или незамещенная гетероциклическая группа, где каждую из R'-групп независимо выбирают из группы, состоящей из водорода, ОН, NO2, NH2, SH, CN, галогена, COH, CO-алкила, СООН, замещенного или незамещенного С1-С12-алкила, замещенного или незамещенного С2-С12-алкенила, замещенного или незамещенного С2-С12-алкинила, замещенного или незамещенного арила и замещенной или незамещенной гетероциклической группы. В случаях, где такие группы сами замещены, заместители можно выбирать из вышеприведенного перечня. Более предпочтительными заместителями для вышеуказанных алкенинильных групп являются галоген, OR', =O, OCOR', OCONHR', OCONR'R', CONHR', CONR'R' и защищенный ОН, где каждую из R'-групп предпочтительно выбирают из группы, состоящей из водорода, замещенного или незамещенного С1-С12-алкила, замещенного или незамещенного С2-С12-алкенила, замещенного или незамещенного С2-С12-алкинила и замещенного или незамещенного арила. Даже более предпочтительными заместителями для этих алкенинильных групп являются галоген, OR', =O, OCONHR', OCONR'R', CONHR', CONR'R' и защищенный ОН, где защитную группу для ОН предпочтительно выбирают из группы, состоящей из триметилсилила, триэтилсилила, триизопропилсилила, диметилизопропилсилила, диэтилизопропилсилила, диметилгексил-силила, 2-норборнилдиметилсилила, трет-бутилдиметилсилила, трет-бутилдифенилсилила, трибензилсилила, три-п-ксилилсилила, трифенилсилила, дифенилметилсилила, ди-трет-бутилметилсилила, бис(трет-бутил)-1-пуренилметоксисилила, трис(триметилсилил)-силила, (2-гидроксистирил)диметилсилила, (2-гидроксистирил)-диизопропилсилила, трет-бутилметоксифенилсилила, трет-бутоксидифенилсилила, 1,1,3,3-тетраизопропил-3-[2-(трифенилметокси)этокси]дисилоксан-1-ила и фторсилила, и где каждую из R'-групп более предпочтительно выбирают из группы, состоящей из водорода, незамещенного С1-С6-алкила и замещенного или незамещенного арила, Cl, OH, =O, OCONH2, OCONH-фенила и защищенного ОН, где защитную группу для ОН предпочтительно выбирают из группы, состоящей из триметилсилила, триэтилсилила, триизопропилсилила, диметилизопропилсилила, диэтилизопропил-силила, диметилгексилсилила, 2-норборнилдиметилсилила, трет-бутилдиметилсилила, трет-бутилдифенилсилила, трибензилсилила, три-п-ксилилсилила, трифенилсилила, дифенилметилсилила, ди-трет-бутилметилсилила, бис(трет-бутил)-1-пуренилметоксисилила, трис(триметилсилил)силила, (2-гидроксистирил)диметилсилила, (2-гидроксистирил)диизопропилсилила, трет-бутилметоксифенилсилила, трет-бутоксидифенилсилила, 1,1,3,3-тетраизопропил-3-[2-(трифенилметокси)этокси]дисилоксан-1-ила и фторсилила, которые являются наиболее предпочтительными заместителями для этих алкенинильных групп.
Особенно предпочтительно R16 означает водород, ORa и OCORa, где Ra выбирают из водорода и замещенного или незамещенного С1-С12-алкила. Особенно предпочтительно Ra означает водород и замещенный или незамещенный С1-С6-алкил и даже более предпочтительно означает водород, метил, этил, пропил, изопропил и бутил, включая трет-бутил. Водород, ОН и метокси являются наиболее предпочтительными группами R16.
Особенно предпочтительным является наличие одной или более дополнительных связей в местах, обозначенных пунктирной линией. Более предпочтительным является наличие одной дополнительной связи между С1 и С2, и/или наличие одной или двух дополнительных связей между С3 и С4, и/или наличие одной дополнительной связи между С5 и С6. В дополнение, стереохимия каждой двойной связи может существовать в виде (Е) или (Z). Отдельные изомеры и смеси этих изомеров входят в рамки настоящего изобретения.
Другими, особенно предпочтительными соединениями общей формулы I являются таковые, имеющие общую формулу IB, или их фармацевтически приемлемые соли, таутомеры, пролекарства или стереоизомеры:
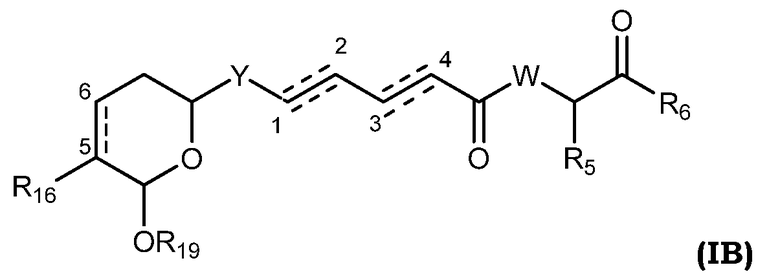
где Y выбирают из группы, состоящей из -CHRay-, -CHRay-CHRby-, -CRay=CRby-, -C≡C-, -CHRay-CHRby-CHRcy-, -CHRay-CRby=CRcy- и -CHRay-С≡С-;
каждый Ray, Rby и Rcy независимо выбирают из группы, состоящей из водорода, замещенного или незамещенного С1-С12-алкила, замещенного или незамещенного С2-С12-алкенила и замещенного или незамещенного С2-С12-алкинила;
R5 выбирают из группы, состоящей из водорода, замещенного или незамещенного С1-С12-алкила, замещенного или незамещенного С2-С12-алкенила и замещенного или незамещенного С2-С12-алкинила;
R6 выбирают из NR8R9 и OR10;
W выбирают из О и NR7;
R7 выбирают из группы, состоящей из водорода, CORa, COORa, замещенного или незамещенного С1-С12-алкила, замещенного или незамещенного С2-С12-алкенила и замещенного или незамещенного С2-С12-алкинила, или R7 и R5, вместе с соответствующим атомом азота и атомом углерода, к которым они присоединены, могут образовывать замещенную или незамещенную гетероциклическую группу;
каждый R8 и R9 независимо выбирают из группы, состоящей из водорода, CORa, COORa, замещенного или незамещенного С1-С12-алкила, замещенного или незамещенного С2-С12-алкенила, замещенного или незамещенного С2-С12-алкинила и замещенного или незамещенного С4-С12-алкенинила;
R10 выбирают из группы, состоящей из водорода, замещенного или незамещенного С1-С12-алкила, замещенного или незамещенного С2-С12-алкенила и замещенного или незамещенного С2-С12-алкинила;
R16 выбирают из группы, состоящей из водорода, ORa, OCORa, OCOORa, NRaRb, NRaCORb и NRaC(=NRa)NRaRb, замещенного или незамещенного С1-С12-алкила, замещенного или незамещенного С2-С12-алкенила и замещенного или незамещенного С2-С12-алкинила;
R19 выбирают из группы, состоящей из водорода, CORa, COORa, CONRaRb, S(O)Ra, SO2Ra, P(O)(Ra)ORb, SiRaRbRc, замещенного или незамещенного С1-С12-алкила, замещенного или незамещенного С2-С12-алкенила и замещенного или незамещенного С2-С12-алкинила; и
каждый Ra, Rb и Rc независимо выбирают из группы, состоящей из водорода, замещенного или незамещенного С1-С12-алкила, замещенного или незамещенного С2-С12-алкенила, замещенного или незамещенного С2-С12-алкинила, замещенного или незамещенного арила и замещенной или незамещенной гетероциклической группы; и
каждая пунктирная линия представляет собой необязательную дополнительную связь.
В соединениях общей формулы IB, особенно предпочтительно, Y означает -CHRay-, -CRay=CRby- и -CHRay-CRby=CRcy-, где Ray, Rby и Rcy имеют значения, как описано выше.
Особенно предпочтительно Ray, Rby и Rcy означают водород и замещенный или незамещенный С1-С12-алкил. Более предпочтительно, Ray, Rby и Rcy означают водород и замещенный или незамещенный С1-С6-алкил, и, даже более предпочтительно, означают водород, замещенный или незамещенный метил, замещенный или незамещенный этил, замещенный или незамещенный пропил, замещенный или незамещенный изопропил и замещенный или незамещенный бутил, включая замещенный или незамещенный трет-бутил, замещенный или незамещенный изобутил и замещенный или незамещенный втор-бутил. Предпочтительными заместителями вышеуказанных групп являются OR', =O, SR', SOR', SO2R', NO2, NHR', NR'R', =N-R', NHCOR', N(COR')2, NHSO2R', NR'C(=NR')NR'R', CN, галоген, COR', COOR', OCOR', OCONHR', OCONR'R', CONHR', CONR'R', защищенный ОН, замещенный или незамещенный С1-С12-алкил, замещенный или незамещенный С2-С12-алкенил, замещенный или незамещенный С2-С12-алкинил, замещенный или незамещенный арил и замещенная или незамещенная гетероциклическая группа, где каждую из R'-групп независимо выбирают из группы, состоящей из водорода, ОН, NO2, NH2, SH, CN, галогена, COH, CO-алкила, СООН, замещенного или незамещенного С1-С12-алкила, замещенного или незамещенного С2-С12-алкенила, замещенного или незамещенного С2-С12-алкинила, замещенного или незамещенного арила и замещенной или незамещенной гетероциклической группы. В случаях, где такие группы сами замещены, заместители можно выбирать из вышеприведенного перечня. Даже более предпочтительными заместителями для вышеуказанных групп являются ОН, SCH3, SH, NH2, NHC(=NH)NH2, CONH2, COOH, фенил, п-, м- или о-гидроксифенил, индолил, включая 1-, 2- и 3-индолил, и имидазолил, включая 4- и 5-имидазолил. Водород и метил являются наиболее предпочтительными группами Ray, Rby и Rcy. Особенно, когда Y означает -CHRay-, тогда особенно предпочтительно Ray означает метил, когда Y означает -CRay=CRby-, тогда особенно предпочтительно Ray означает водород и, особенно предпочтительно, Rby означает метил, и, когда Y означает -CHRay-CRby=CRcy-, тогда особенно предпочтительно Ray означает водород или метил, особенно предпочтительно, Rby означает водород и особенно предпочтительно Rcy означает метил.
Особенно предпочтительно, R5 означает водород и замещенный или незамещенный С1-С12-алкил. Более предпочтительно, R5 означает водород и замещенный или незамещенный С1-С6-алкил, и, даже более предпочтительно, означает водород, замещенный или незамещенный метил, замещенный или незамещенный этил, замещенный или незамещенный пропил, замещенный или незамещенный изопропил и замещенный или незамещенный бутил, включая замещенный или незамещенный трет-бутил, замещенный или незамещенный изобутил и замещенный или незамещенный втор-бутил. Предпочтительными заместителями вышеуказанных групп являются OR', =O, SR', SOR', SO2R', NO2, NHR', NR'R', =N-R', NHCOR', N(COR')2, NHSO2R', NR'C(=NR')NR'R', CN, галоген, COR', COOR', OCOR', OCONHR', OCONR'R', CONHR', CONR'R', защищенный ОН, замещенный или незамещенный С1-С12-алкил, замещенный или незамещенный С2-С12-алкенил, замещенный или незамещенный С2-С12-алкинил, замещенный или незамещенный арил и замещенная или незамещенная гетероциклическая группа, где каждую из R'-групп независимо выбирают из группы, состоящей из водорода, ОН, NO2, NH2, SH, CN, галогена, COH, CO-алкила, СООН, замещенного или незамещенного С1-С12-алкила, замещенного или незамещенного С2-С12-алкенила, замещенного или незамещенного С2-С12-алкинила, замещенного или незамещенного арила и замещенной или незамещенной гетероциклической группы. В случаях, где такие группы сами замещены, заместители можно выбирать из вышеприведенного перечня. Даже более предпочтительными заместителями вышеуказанных групп являются ОН, SCH3, SH, NH2, NHC(=NH)NH2, CONH2, COOH, фенил, п-, м- или о-гидроксифенил, индолил, включая 1-, 2- и 3-индолил, и имидазолил, включая 4- и 5-имидазолил. Водород, метил, изопропил, трет-бутил и бензил являются наиболее предпочтительными группами R5, и, даже наиболее предпочтительными являются метил, изопропил и трет-бутил.
Особенно предпочтительно W означает NR7, где R7 имеет значение, как описано выше.
Особенно предпочтительно R6 означает NR8R9, где R8 и R9 имеют значения, как описано выше.
Особенно предпочтительно R7 и R8 означают водород и замещенный или незамещенный С1-С12-алкил. Более предпочтительно R7 и R8 означают водород и замещенный или незамещенный С1-С6-алкил и еще более предпочтительно означают водород, метил, этил, пропил, изопропил и бутил, включая трет-бутил. Водород является наиболее предпочтительным.
В другом воплощении, особенно предпочтительно, что R7 и R5, вместе с соответствующим атомом азота и атомом углерода, к которым они присоединены, образуют замещенную или незамещенную гетероциклическую группу. В этом отношении, предпочтительной гетероциклической группой является гетероалициклическая группа, содержащая один, два или три гетероатома, выбираемые из атомов N, O или S, наиболее предпочтительно один атом азота и имеющая от 5 до примерно 10 атомов в цикле, наиболее предпочтительно 5, 6 или 7 атомов в цикле. Пирролидиновая группа является наиболее предпочтительной.
Особенно предпочтительно, R9 означает водород, замещенный или незамещенный С1-С12-алкил, замещенный или незамещенный С2-С12-алкенил, замещенный или незамещенный С2-С12-алкинил и замещенный или незамещенный С4-С12-алкенинил и, более предпочтительно, означает водород, замещенный или незамещенный С2-С12-алкенил, замещенный или незамещенный С2-С12-алкинил и замещенный или незамещенный С4-С12-алкенинил. Предпочтительно, замещенный алкил, замещенный алкенил, замещенный алкинил и замещенный алкенинил могут присутствовать не только в виде одного, но и двух или более заместителей. Более предпочтительными алкильными группами являются таковые, имеющие от 6 до примерно 10 атомов углерода и даже более предпочтительно 7, 8 или 9 атомов углерода. Гептил, октил и нонил являются наиболее предпочтительными алкильными группами. С другой стороны, более предпочтительными алкенильными группами являются таковые, имеющие от 6 до примерно 10 атомов углерода и даже более предпочтительно 7, 8 или 9 атомов углерода. Окта-1,6-диенил, окта-1,5-диенил, окта-1,4-диенил, окта-1,3-диенил, нона-1,7-диенил, нона-1,6-диенил, нона-1,5-диенил, нона-1,4-диенил, нона-1,3-диенил, гепта-1,5-диенил, гепта-1,4-диенил, гепта-1,3-диенил являются наиболее предпочтительными алкенильными группами. С другой стороны, более предпочтительными алкинильными группами являются таковые, имеющие от 6 до примерно 10 атомов углерода и даже более предпочтительно 7, 8 или 9 атомов углерода. Окт-7-инил, окт-6-инил, окт-5-инил, окт-4-инил, окт-3-инил, окт-2-инил, окт-1-инил, нон-8-инил, нон-7-инил, нон-6-инил, нон-5-инил, нон-4-инил, нон-3-инил, нон-2-инил, нон-1-инил, гепт-6-инил, гепт-5-инил, гепт-4-инил, гепт-3-инил, гепт-2-инил и гепт-1-инил являются наиболее предпочтительными алкинильными группами. С другой стороны, более предпочтительными алкенинильными группами являются таковые, имеющие от 6 до примерно 10 атомов углерода и даже более предпочтительно 7, 8 или 9 атомов углерода. Окт-1-ен-7-инил, окт-1-ен-6-инил, окт-1-ен-5-инил, окт-1-ен-4-инил, окт-1-ен-3-инил, нон-1-ен-8-инил, нон-1-ен-7-инил, нон-1-ен-6-инил, нон-1-ен-5-инил, нон-1-ен-4-инил, нон-1-ен-3-инил, гепт-1-ен-6-инил, гепт-1-ен-5-инил, гепт-1-ен-4-инил и гепт-1-ен-3-инил являются наиболее предпочтительными алкенинильными группами. Предпочтительными заместителями для вышеуказанных алкильных, алкенильных, алкинильных и алкенинильных групп являются OR', =O, SR', SOR', SO2R', NO2, NHR', NR'R', =N-R', NHCOR', N(COR')2, NHSO2R', NR'C(=NR')NR'R', CN, галоген, COR', COOR', OCOR', OCONHR', OCONR'R', CONHR', CONR'R', защищенный ОН, замещенный или незамещенный С1-С12-алкил, замещенный или незамещенный С2-С12-алкенил, замещенный или незамещенный С2-С12-алкинил, замещенный или незамещенный арил и замещенная или незамещенная гетероциклическая группа, где каждую из R'-групп независимо выбирают из группы, состоящей из водорода, ОН, NO2, NH2, SH, CN, галогена, COH, CO-алкила, СООН, замещенного или незамещенного С1-С12-алкила, замещенного или незамещенного С2-С12-алкенила, замещенного или незамещенного С2-С12-алкинила, замещенного или незамещенного арила и замещенной или незамещенной гетероциклической группы. В случаях, где такие группы сами замещены, заместители можно выбирать из вышеприведенного перечня. Более предпочтительными заместителями для вышеуказанных алкенильных, алкинильных и алкенинильных групп являются галоген, OR', =O, OCOR', OCONHR', OCONR'R', CONHR', CONR'R' и защищенный ОН, где каждую из R'-групп предпочтительно выбирают из группы, состоящей из водорода, замещенного или незамещенного С1-С12-алкила, замещенного или незамещенного С2-С12-алкенила, замещенного или незамещенного С2-С12-алкинила и замещенного или незамещенного арила. Даже более предпочтительными заместителями для этих алкильных, алкенильных, алкинильных и алкенинильных групп являются галоген, OR', =O, OCONHR', OCONR'R', CONHR', CONR'R' и защищенный ОН, где защитную группу для ОН предпочтительно выбирают из группы, состоящей из триметилсилила, триэтилсилила, триизопропилсилила, диметилизопропилсилила, диэтилизопропилсилила, диметилгексилсилила, 2-норборнилдиметил-силила, трет-бутилдиметилсилила, трет-бутилдифенилсилила, трибензилсилила, три-п-ксилилсилила, трифенилсилила, дифенилметилсилила, ди-трет-бутилметилсилила, бис(трет-бутил)-1-пуренилметоксисилила, трис(триметилсилил)силила, (2-гидроксистирил)диметилсилила, (2-гидроксистирил)диизопропил-силила, трет-бутилметоксифенилсилила, трет-бутоксидифенилсилила, 1,1,3,3-тетраизопропил-3-[2-(трифенилметокси)этокси]дисилоксан-1-ила и фторсилила, и где каждую из R'-групп более предпочтительно выбирают из группы, состоящей из водорода, незамещенного С1-С6-алкила и замещенного или незамещенного арила, Cl, OH, =O, OCONH2, OCONH-фенила и защищенного ОН, где защитную группу для ОН предпочтительно выбирают из группы, состоящей из триметилсилила, триэтилсилила, триизопропилсилила, диметилизопропилсилила, диэтилизопропилсилила, диметилгексил-силила, 2-норборнилдиметилсилила, трет-бутилдиметилсилила, трет-бутилдифенилсилила, трибензилсилила, три-п-ксилилсилила, трифенилсилила, дифенилметилсилила, ди-трет-бутилметилсилила, бис(трет-бутил)-1-пиренилметоксисилила, трис(триметилсилил)-силила, (2-гидроксистирил)диметилсилила, (2-гидроксистирил)-диизопропилсилила, трет-бутилметоксифенилсилила, трет-бутоксидифенилсилила, 1,1,3,3-тетраизопропил-3-[2-(трифенилметокси)этокси]дисилоксан-1-ила и фторсилила, которые являются наиболее предпочтительными заместителями для этих алкильных, алкенильных, алкинильных и алкенинильных групп.
Особенно предпочтительно R16 означает водород, ORa и OCORa, где Ra выбирают из водорода и замещенного или незамещенного С1-С12-алкила. Особенно предпочтительно Ra означает водород и замещенный или незамещенный С1-С6-алкил и даже более предпочтительно означает водород, метил, этил, пропил, изопропил и бутил, включая трет-бутил. Водород, ОН и метокси являются наиболее предпочтительными группами R16.
Особенно предпочтительно R19 означает водород, замещенный или незамещенный С1-С12-алкил и CORa, где Ra означает замещенный или незамещенный С1-С12-алкил. Более предпочтительно R19 означает водород, замещенный или незамещенный С1-С6-алкил и CORa, где Ra означает замещенный или незамещенный С1-С6-алкил. Особенно предпочтительно Ra означает метил, этил, пропил, изопропил и бутил, включая трет-бутил. Еще более предпочтительно R19 означает водород.
Особенно предпочтительным является наличие одной или более дополнительных связей в местах, обозначенных пунктирной линией. Более предпочтительным является наличие одной дополнительной связи между С1 и С2, и/или наличие одной или двух дополнительных связей между С3 и С4, и/или наличие одной дополнительной связи между С5 и С6. В дополнение, стереохимия каждой двойной связи может существовать в виде (Е) или (Z). Отдельные изомеры и смеси этих изомеров входят в рамки настоящего изобретения.
Соединения согласно данному изобретению можно получать синтетически путем присоединения различных фрагментов, как показано на схеме А.
где R1, R2, R3, R4, R5, R6, А, Y и W означают желательные группы или подходящую защитную группу, как необходимо, и J, K, L и M означают подходящие реакционноспособные или удаляемые группы.
Соединения согласно данному изобретению можно получать путем любой из следующих стратегий:
1) Фрагменты А и В можно связывать, следуя стандартным методикам в органической химии (т.е. Bodanszky M. and Bodanszky A., The Practice of Peptide Synthesis, Springer-Verlag, 1993).
2) Фрагменты С и D можно связывать, следуя стандартным методикам металлорганической химии (т.е. R.B. Crabtree, “The Organometallic Chemistry of the Transition Metals”, 2-е изд., Wiley, Nueva York, 1994).
Фрагменты А, В, С и D можно независимо получать, следуя стандартным методикам в органическом синтезе.
Снятия защиты в отношении защитных групп можно достигать в соответствии с известными методиками в органическом синтезе (Greene and Wuts, Protective Groups in Organic Synthesis, 3-е изд., Wiley-Interscience; Burke and Danheiser, Handbook of Reagents for Organic Synthesis: Oxidizing and Reducing Agents, Wiley; Pla D. et. al., J. Org. Chem., 2005, 70, 8231).
Когда необходимо, подходящие защитные группы можно использовать в качестве заместителей для обеспечения того, чтобы не были затронуты реакционноспособные группы. Синтез можно осуществлять при использовании предшественников заместителей, которые могут превращаться, на подходящей стадии, в желательный заместитель. Насыщенность или ненасыщенность в циклической структуре можно вводить или удалять, как часть синтеза. Исходные вещества и реагенты можно модифицировать, как желательно, для обеспечения осуществления синтеза нужного соединения. В дополнение, аналоги также можно синтезировать из полученных соединений по обычным методикам в синтетической органической химии, которые известны квалифицированному специалисту в данной области.
Вышеуказанные пути синтеза можно модифицировать, как желательно, для получения стереоспецифических соединений, а также смесей стереоизомеров. Конкретные стереоизомеры или конкретные смеси можно синтезировать различными способами, включая использование стереоспецифических реагентов или путем введения хиральных центров в соединения во время синтеза. Можно вводить один или более стереоцентров во время синтеза и также инвертировать существующие стереоцентры. Кроме того, можно разделять стереоизомеры, если соединение уже синтезировано, стандартными способами разделения, известными квалифицированному специалисту в данной области.
Важным свойством вышеописанных соединений формулы I является их биоактивность и, в особенности, их цитотоксическая активность.
Согласно настоящему изобретению, авторами предлагаются новые фармацевтические композиции, включающие соединения общей формулы I, которые обладают цитотоксической активностью, и их применение в качестве противоопухолевых агентов. Таким образом, настоящее изобретение, далее, относится к фармацевтическим композициям, содержащим соединение согласно данному изобретению, его фармацевтически приемлемую соль, таутомер, пролекарство или стереоизомер, с фармацевтически приемлемым носителем.
Термин «носитель» относится к растворителю, адъюванту, эксципиенту или разбавителю, с которым вводят активный ингредиент. Пригодные фармацевтические носители описаны в руководстве «Remington's Pharmaceutical Sciences», E.W. Martin, 1995.
Примеры фармацевтических композиций включают любые твердые (таблетки, пилюли, капсулы, гранулы и т.д.) или жидкие (растворы, суспензии или эмульсии) композиции для перорального, местного или парентерального введения.
Введение соединений или композиций согласно настоящему изобретению можно осуществлять любым подходящим способом, таким как внутривенная инфузия, пероральные лекарственные формы и интраперитонеальное и внутривенное введение. Предпочтительно, чтобы времена инфузии составляли вплоть до 24 часов, более предпочтительно 1-12 часов, наиболее предпочтительно 1-6 часов. Особенно желательны короткие времена инфузии, которые позволяют осуществлять лечение без пребывания в течение ночи в стационаре. Однако инфузия может длиться от 12 до 24 часов или даже дольше, если необходимо. Инфузию можно осуществлять в подходящие интервалы, составляющие от 1 до 4 недель. Фармацевтические композиции, содержащие соединения согласно данному изобретению, могут быть доставлены посредством липосомной или наносферной инкапсуляции, при использовании готовых лекарственных форм с пролонгированным высвобождением или с помощью других стандартных способов доставки.
Точная доза соединений варьируется в соответствии с конкретной готовой лекарственной формой, способом применения и конкретным участком, «хозяином» и опухолью, которую подвергают лечению. Нужно принимать во внимание другие факторы, подобные возрасту, массе тела, полу, режиму питания, времени введения, скорости экскреции, состоянию «хозяина», лекарственным комбинациям, чувствительностям в отношении реакции и тяжести заболевания. Введение можно осуществлять непрерывно или периодически, в пределах максимально допустимых доз.
Соединения и композиции согласно данному изобретению можно применять с другими лекарственными средствами для осуществления комбинированной терапии. Другие лекарственные средства могут образовывать часть той же самой композиции или могут быть предусмотрены в виде отдельной композиции для введения в одно и то же время или в другое время.
Противоопухолевые активностьи этих соединений включают, но не ограничиваясь этим, активность по отношению к раку легкого, раку ободочной кишки и раку молочной железы.
ПРИМЕРЫ
Пример 1
Синтез фрагмента 9
На схеме 1 представлен пример синтеза фрагмента 9.
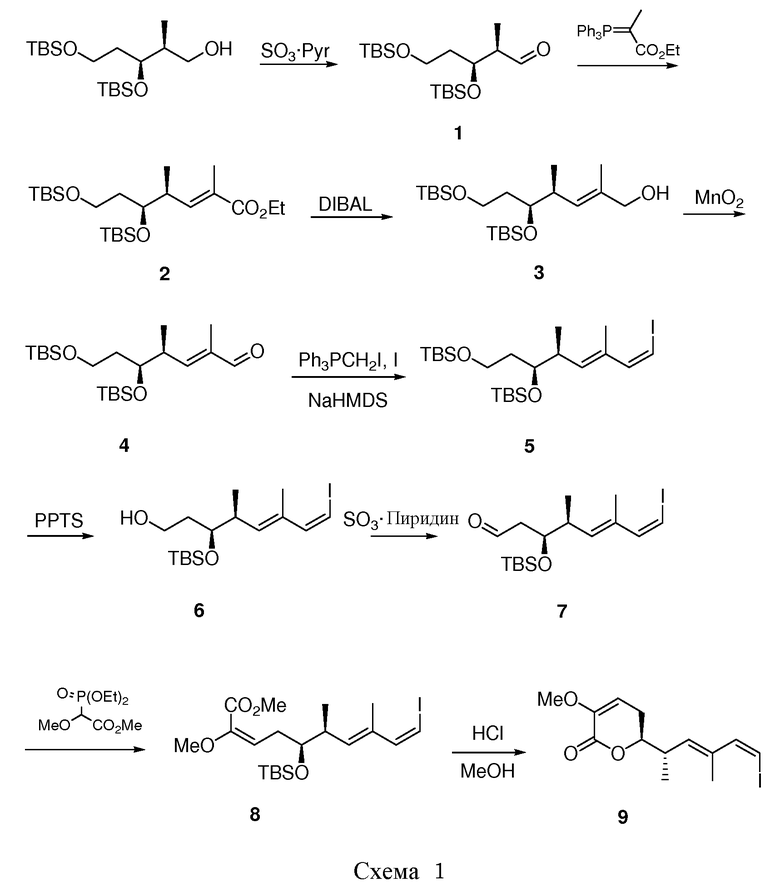
Синтез промежуточного продукта 1
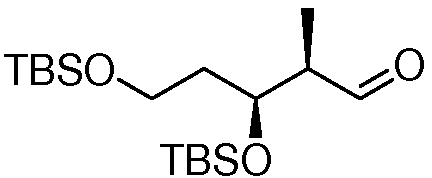
К охлажденному до температуры 0°С раствору (2S,3S)-3,5-бис{[(трет-бутил)диметилсилил]окси}-2-метилпентан-1-ола (P. Phukan, S. Sasmal and M.E. Maier, Eur. J. Org. Chem., 2003, 1733-1740) (50 г, 0,14 моль), в смеси дихлорметан/ДМСО (331 мл/149 мл), через капельную воронку добавляют Et3N (96,1 мл, 0,69 моль). Спустя 10 минут по частям добавляют SO3·Pyr (54,8 г, 0,34 моль) и раствор перемешивают в течение еще 2 часов, при температуре 0°С. Затем его разбавляют дихлорметаном (800 мл) и гасят с помощью HCl (0,5 н раствор, 800 мл). Органический слой декантируют, сушат над MgSO4 и концентрируют в вакууме. Очищают с помощью колоночной хроматографии (гексан/EtOAc = от 100:0 до 10:1), получая 45 г (выход: 90%) альдегида 1.
1Н ЯМР (CDC13, 300 МГц) δ: 9,79 (с, 1H), 4,30 (м, 1H), 3,65 (м, 2H), 2,51 (м, 1H), 1,69 (м, 2H), 1,04 (д, 3H, J=6,9 Гц), 0,85-0,88 (м, 18H), 0,03-0,07 (м, 12H).
13С-ЯМР (CDCl3, 75 МГц) δ: 205,4, 69,4, 59,6, 51,7, 37,5, 26,1, 26,0, 18,4, 18,2, 8,0, -4,3, -4,5, -5,2.
Синтез промежуточного продукта 2
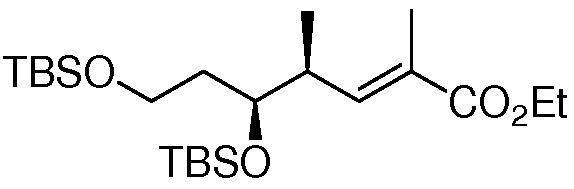
К раствору альдегида 1 (45 г, 0,12 моль), в толуоле (625 мл), добавляют карбоэтоксиэтилидентрифенилфосфоран (113 г, 0,31 моль) и смесь нагревают при температуре 60°С в течение 17 часов. Затем растворитель удаляют при пониженном давлении и полученное масло очищают с помощью колоночной хроматографии (гексан/EtOAc = от 100:0 до 10:1), получая 53,3 г (выход: 96%) сложного эфира, соединения 2.
1H ЯМР (CDCl3, 300 МГц) δ: 6,71 (дд, 1H, J=1,5, 10,2 Гц), 4,19 (м, 2H), 3,77 (м, 1H), 3,66 (м, 2H), 2,61 (м, 1H), 1,85 (д, 3H, J=1,5 Гц), 1,68 (м, 2H), 1,30 (т, 3H, J=7,2 Гц), 0,98 (д, 3H, 6,9 Гц), 0,90 (м, 18H), 0,05 (м, 12H).
13С-ЯМР (CDCl3, 75 МГц) δ: 168,3, 145,4, 126,7, 72,2, 60,4, 59,7, 38,4, 38,0, 25,9, 18,2, 18,1, 14,3, 14,3, 12,6, -4,4, -4,6, -5,4.
Синтез промежуточного продукта 3
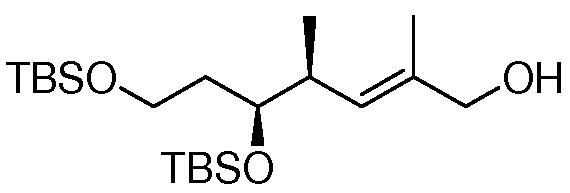
К раствору сложного эфира 2, охлажденному до температуры -78°С (46,7 г, 0,105 моль), в безводном ТГФ (525 мл), в атмосфере аргона, добавляют 1 М раствор диизобутилалюминий-гидрида (DIBAL) в толуоле (231 мл, 0,231 моль) в течение периода времени 10 минут и смесь перемешивают при температуре -78°С. Спустя 4 часа реакционную смесь гасят с помощью МеОН (10 мл), добавляют насыщенный раствор тартрата натрия-калия (800 мл) и разбавляют этилацетатом (EtOAc) (1000 мл). Эту смесь перемешивают в течение 2 часов и затем органический слой декантируют. Водный остаток экстрагируют дополнительным количеством EtOAc (2 раза по 400 мл) и объединенные органические слои сушат над безводным Na2SO4 и растворитель выпаривают. Полученное масло очищают с помощью колоночной хроматографии (гексан/EtOAc = от 20:1 до 10:1), получая 32,5 г (выход: 77%) спирта 3.
1H ЯМР (CDCl3, 300 МГц) δ: 5,31 (д, 1H, J=9,6 Гц), 3,98 (м, 2H), 3,66 (м, 3H), 2,49 (м, 1H), 1,67 (с, 3H), 1,70-1,62 (м, 2H), 0,91 (д, 3H, J=6,9 Гц), 0,88 (м, 18H), 0,03 (м, 12H).
13С-ЯМР (CDCl3, 75 МГц) δ: 133,9, 129,8, 73,1, 69,1, 59,9, 37,8, 37,5, 25,9, 18,3, 18,1, 15,9, 13,9, -4,4, -4,4, -5,3.
Синтез промежуточного продукта 4
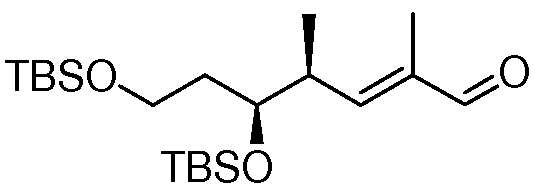
К раствору спирта 3 (31,2 г, 77,5 ммоль) в этиловом эфире (387 мл), в атмосфере аргона, добавляют MnO2 (101 г, 1,16 моль) и смесь перемешивают при комнатной температуре в течение 2 часов. Эту смесь фильтруют через колонку с силикагелем, элюируя с помощью EtOAc (3 л), и полученный раствор сушат при пониженном давлении, получая 29,1 г (выход: 94%) альдегида 4.
1H ЯМР (CDCl3, 300 МГц) δ: 9,37 (с, 1H), 6,44 (д, 1H, J=9,6 Гц), 3,82 (дд, 1H, J=6,3, 10,8 Гц), 3,65 (м, 2H), 2,82 (м, 1H), 1,74 (с, 3H), 1,67 (м, 2H), 1,02 (д, 3H, J=6,9 Гц), 0,86 (с, 18H), 0,04-0,01 (м, 12H).
13С-ЯМР (CDCl3, 75 МГц) δ: 195,4, 157,8, 138,3, 72,0, 59,5, 38,7, 37,5, 25,8, 18,2, 18,0, 14,3, 9,4, -4,4, -4,5, -5,4.
Синтез промежуточного продукта 5
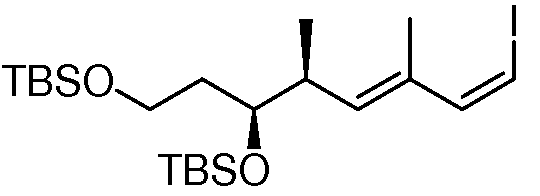
К суспензии иодметилтрифенилфосфонийиодида (Gilbert Stork KZ., Tetrahedron letters, 1989, 30(17), 2173) (96,3 г, 181,7 ммоль) в безводном ТГФ (727 мл), при температуре 0°С, через капельную воронку медленно добавляют 1 М раствор натрийгексаметилдисилазана (NaHMDS) (181,7 мл, 181,7 ммоль) в течение 10 минут. После перемешивания в течение дополнительных 5 минут раствор охлаждают до температуры -78°С и затем через канюлю добавляют 1,3-диметил-3,4,5,6-тетрагидро-2(1Н)-пиримидинон (DMPU) (43,9 мл, 363,4 ммоль), после чего добавляют альдегид 4 (29,1 г, 72,7 ммоль), растворенный в безводном ТГФ (727 мл). Поддерживают температуру -78°С во время перемешивания реакционной смеси в течение 2 часов. Добавляют гексан (1 л) и полученную суспензию отфильтровывают через целит и промывают с помощью дополнительного количества гексана (3 л). Фильтрат выпаривают при пониженном давлении и полученное масло очищают с помощью колоночной хроматографии (гексан/EtOAc = от 100:0 до 20:1), получая 32 г (выход: 84%) иодида 5.
1Н ЯМР (CDCl3, 300 МГц) δ: 6,73 (д, 1H, J=8,4 Гц), 6,09 (дд, 1H, J=8,4, 1,2 Гц), 5,57 (дд, 1H, J=9,6, 1,2 Гц), 3,63-3,71 (м, 3H), 2,58 (м, 1H), 1,90 (с, 3H), 1,70 (м, 2H), 0,96 (дд, 3H, J=6,6, 1,2 Гц), 0,88 (с, 18H), 0,04 (м, 12H).
13С-ЯМР (CDCl3, 75 МГц) δ: 142,3, 138,1, 131,8, 74,6, 72,9, 59,8, 38,1, 37,9, 26,0, 18,3, 18,2, 15,7, 15,7, -4,4, -5,2, -5,2.
Синтез промежуточного продукта 6
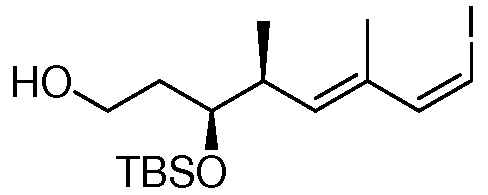
К раствору иодида 5 (12 г, 22,9 ммоль) в EtOH (114 мл) добавляют пиридиний-п-толуолсульфонат (PPTS) (2,01 г, 8,0 ммоль) и реакционную смесь перемешивают при комнатной температуре в течение 25 часов. Затем растворитель удаляют при пониженном давлении и полученное масло очищают с помощью колоночной хроматографии (гексан/EtOAc = 10:1), получая 8,7 г (выход: 93%) спирта 6.
1Н ЯМР (CDCl3, 300 МГц) δ: 6,69 (д, 1H, J=8,4 Гц), 6,12 (д, 1H, J=8,4 Гц), 5,47 (д, 1H, J=9,9 Гц), 3,67-3,87 (м, 4H), 2,71 (м, 1H), 1,89 (с, 3H), 1,73-1,86 (м, 2H), 1,01 (д, 3H, J=6,9 Гц), 0,91 (с, 9H), 0,087-0,115 (м, 6H).
13С-ЯМР (CDCl3, 75 МГц) δ: 142,4, 136,4, 132,6, 75,8, 75,2, 60,0, 38,1, 36,4, 26,1, 18,2, 17,1, 16,0, -4,1, -4,2.
Синтез промежуточного продукта 7
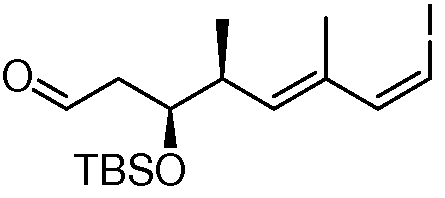
К охлажденному до температуры 0°С раствору спирта 6 (8,7 г, 21,2 ммоль), в смеси дихлорметан/ДМСО (50,9 мл/22,9 мл), через капельную воронку добавляют Et3N (14,8 мл, 106 ммоль). Спустя 10 минут по частям добавляют SO3·Pyr (8,43 г, 53,0 моль) и раствор перемешивают в течение еще 2 часов при температуре 0°С. Затем его разбавляют дихлорметаном (800 мл) и гасят с помощью HCl (0,5 н раствор, 50 мл). Органический слой декантируют, сушат над MgSO4 и концентрируют в вакууме. Очищают с помощью колоночной хроматографии (гексан/EtOAc = 10:1), получая 6,9 г (выход: 80%) альдегида 7.
1H ЯМР (CDCl3, 300 МГц) δ: 9,89 (т, 1H, J=1,5 Гц), 6,67 (д, 1H, J=8,4 Гц), 6,13 (д, 1H, J=8,4 Гц), 5,43 (д, 1H, J=10,2 Гц), 3,98 (м, 1H), 2,59-2,69 (м, 3H), 1,85 (с, 3H), 1,01 (д, 3H, J=6,6 Гц), 0,86 (с, 9H), 0,06 (с, 3H), 0,03 (с, 3H).
13С-ЯМР (CDCl3, 75 МГц) δ: 201,8, 141,9, 135,2, 133,3, 76,3, 71,9, 49,3, 39,3, 25,8, 18,0, 16,7, 15,9, -4,4, -4,5.
Синтез промежуточного продукта 8
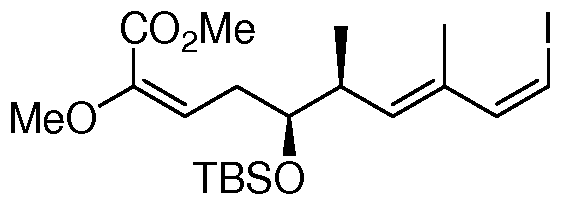
К раствору диэтил(метокси[метоксикарбонил]метил)фосфоната (5,51 г, 14,45 ммоль) и 18-краун-6 (11,5 г, 43,34 ммоль), в безводном ТГФ (390 мл), перемешиваемому в атмосфере аргона, при температуре -78°С, по каплям добавляют 0,5 М раствор бис(триметилсилил)амида калия (KHMDS) (43,34 мл, 21,67 ммоль). Спустя 15 минут по каплям добавляют альдегид 7 (5,9 г, 14,45 ммоль) в безводном ТГФ в течение 30 минут и перемешивают при температуре -78°С в течение 90 минут. Затем реакционную смесь гасят с помощью насыщенного раствора NH4Cl (200 мл), нагревают до комнатной температуры и разбавляют дихлорметаном (1000 мл). Органическую фазу сушат над безводным Na2SO4 и выпаривают при пониженном давлении. Очищают с помощью колоночной хроматографии (гексан/Et2O = 20:1), получая 4,2 г (выход: 59%) чистого (Е)-8.
1H ЯМР (CDCl3, 300 МГц) δ: 6,70 (д, 1H, J=8,4 Гц), 6,08 (д, 1H, J=8,4 Гц), 5,47 (д, 1H, J=9,9 Гц), 5,37 (т, 1H, J=7,2 Гц), 3,78 (с, 3H), 3,60 (с, 3H), 3,60 (м, 1H), 2,79 (м, 1H), 2,52-2,67 (м, 2H), 1,83 (с, 3H), 0,99 (д, 3H, J=6,6 Гц), 0,89 (с, 9H), 0,05 (с, 3H), 0,04 (с, 3H).
13С-ЯМР (CDCl3, 75 МГц) δ: 163,7, 145,9, 142,1, 137,3, 132,1, 110,4, 75,4, 74,8, 55,4, 51,9, 38,1, 32,3, 25,9, 18,1, 16,5, 15,7, -4,3, -4,5.
Синтез промежуточного продукта 9
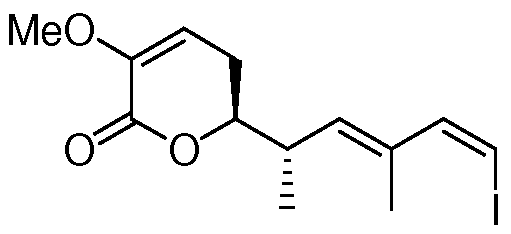
К раствору сложного эфира 8 (4,15 г, 8,39 ммоль) в МеОН (125 мл), при комнатной температуре, добавляют 37%-ный раствор HCl (1,04 мл) и реакционную смесь перемешивают в течение 6 часов. Затем смесь нейтрализуют с помощью насыщенного водного раствора NaHCO3 (рН=7-8) и органический растворитель выпаривают при пониженном давлении. Полученную суспензию экстрагируют дихлорметаном (3 раза по 200 мл), сушат и выпаривают. Фильтруют с помощью колоночной хроматографии (гексан/EtOAc = от 10:1 до 2:1), получая 2,76 г (выход: 94%) лактона 9.
1Н ЯМР (500 МГц, CDCl3) δ: 6,68 (д, 1H, J=9,0 Гц), 6,20 (д, 1H, J=8,5 Гц), 5,63 (дд, 1H, J=2,5, 6,5 Гц), 5,43 (д, 1H, J=10,0 Гц), 4,19 (м, 1H), 3,65 (с, 3H), 2,84 (м, 1H), 2,55 (м, 1H), 2,43 (дc, 1H, J=3,0, 12,0, 15,0, 18,0 Гц), 1,87 (с, 3H), 1,16 (д, 3H, J=6,5 Гц).
13С-ЯМР (125 МГц, CDCl3) δ: 161,6, 145,2, 141,8, 134,4, 132,7, 108,3, 81,7, 77,4, 55,4, 37,1, 26,6, 16,5, 16,1.
Пример 2
Синтез фрагментов 21 и 22
На схеме 2 представлен пример синтеза фрагментов 21 и 22.
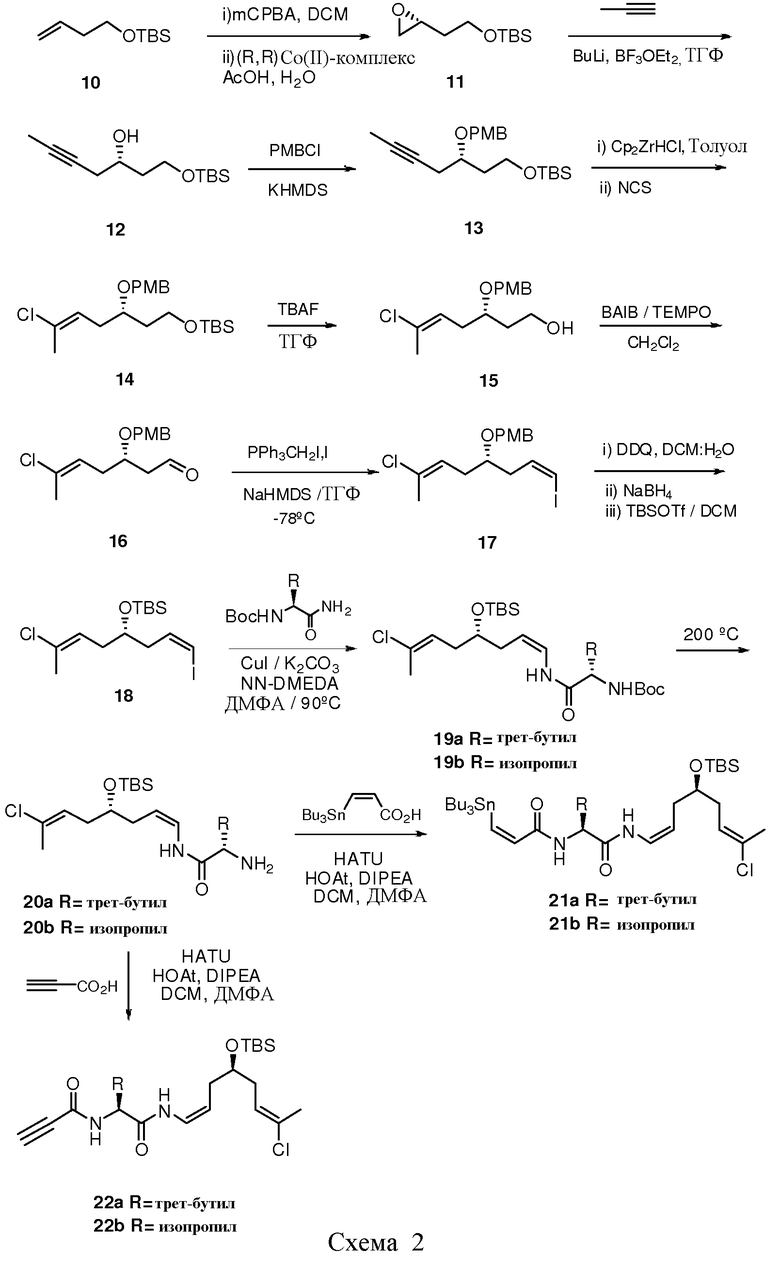
Синтез промежуточного продукта 11
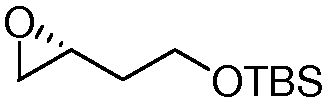
К раствору промежуточного продукта 10 (72,3 г, 0,39 моль) в безводном дихлорметане (DCM) (918 мл) при комнатной температуре по частям добавляют 3-хлорнадбензойную кислоту (m-CPBA) (100 г, 0,58 моль) и смесь перемешивают при комнатной температуре в течение 18 часов. Осадок белого цвета гасят с помощью насыщенного водного раствора NaHCO3, экстрагируют дихлорметаном (DCM) (3 раза по 250 мл) и снова промывают с помощью насыщенного водного раствора NaHCO3 (3 раза по 250 мл). Органические слои объединяют, сушат над безводным Na2SO4 и концентрируют в вакууме. Полученное масло очищают на силикагеле (гексан-EtOAc = 15:1), получая эпоксид в виде бесцветного масла (64,5 г, выход 82%). К раствору рацемического эпоксида (30 г, 0,15 моль) в безводном ТГФ (7,5 мл) добавляют (R,R)-(-)-N,N'-бис(3,5-ди-трет-бутилсалицилиден)-1,2-циклогександиамино-кобальт-(II) [(R,R)Co(II)-комплекс] (448 мг, 0,74 ммоль), затем АсОН (0,14 мл). Раствор охлаждают до температуры 0°С и по каплям добавляют воду (1,2 мл). Реакционную смесь оставляют нагреваться до комнатной температуры и перемешивают в течение 18 часов. По истечении данного времени, летучие вещества выпаривают в вакууме и сырой продукт немедленно загружают в колонку с силикагелем. Осуществляют флэш-хроматографию, используя смесь гексан/EtOAc (от 15:1 до 12:1) в качестве элюента, получая хиральный эпоксид (+)-11 (13,6 г, выход: 46%) в виде бесцветного масла.
[α]D=+14,1 (с=1, CHCl3).
1H ЯМР (CDCl3, 300 МГц) δ: 3,74 (т, 2H, J=6,3 Гц), 3,01 (м, 1H), 2,74 (т, 1H, J=4,6 Гц), 2,48 (дд, 1H, J=5,1, 3,1 Гц), 1,70 (м, 2H), 0,87 (с, 9H), 0,04 (с, 6H).
13С-ЯМР (CDCl3, 75 МГц) δ: 60,2, 50,2, 47,3, 36,1, 26,1, 18,4, -5,2.
Синтез промежуточного продукта 12

Пропин (10 мл, 0,176 моль) конденсируют при температуре -78°С и растворяют в безводном ТГФ (165 мл). По каплям добавляют н-бутиллитий (75,1 мл, 0,188 моль), в атмосфере азота, в течение 30 минут и полученную суспензию белого цвета перемешивают в течение еще 30 минут при температуре -78°С. Затем, по каплям, добавляют раствор (+)-(R)-2-[2-(трет-бутилдиметилсилилокси)-этил]оксирана 11 (23,7 г, 0,117 моль) в безводном ТГФ (125 мл), с последующим добавлением BF3.OEt2 (22,1 мл, 0,176 моль). Смесь перемешивают в течение 1 часа при температуре -78°С и еще в течение часа - при температуре 0°С. Реакционную смесь гасят с помощью насыщенного водного раствора NH4Cl (150 мл) и экстрагируют Et2O (3 раза по 150 мл). Объединенные органические слои сушат над Na2SO4, отфильтровывают и концентрируют. Осуществляют флэш-хроматографию (гексан/EtOAc = от 10:1 до 1:1), получая спирт 12 (22,7 г, выход: 80%) в виде бесцветного масла.
[α]D = +5,6 (с = 0,1, CHCl3).
1H ЯМР (500 МГц, CDCl3) δ: 3,75-3,90 (м, 3H), 3,47 (д, 1H, J=2,7 Гц, OH), 2,34 (м, 2H), 1,79, (т, 3H, J=2,4 Гц), 1,75 (м, 2H), 0,89 (с, 9H), 0,07 (с, 6H).
13С-ЯМР (125 МГц, CDCl3) δ: 77,8, 75,8, 70,7, 62,4, 37,6, 27,6, 26,1, 18,3, 3,7, -5,3, -5,4.
MS (ES), m/z: 243,2 [М+Н]+, 265,2 [М+Na]+.
Синтез промежуточного продукта 13
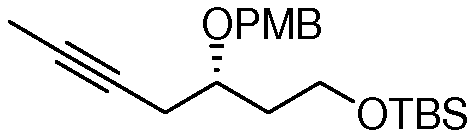
К раствору продукта 12 (41,8 г, 0,173 моль) и 18-краун-6-эфиру (50,27 г, 0,190 моль) в безводном ТГФ (1190 мл) при температуре -78°С в атмосфере азота, через капельную воронку добавляют 0,5 н раствор KHMDS в толуоле (380 мл, 0,190 моль), в течение 30 минут. Смесь перемешивают при этой же температуре в течение 45 минут, затем добавляют раствор 4-метоксибензилхлорида (PMBCl) (23,89 г, 0,176 моль) в безводном ТГФ (100 мл). После выдерживания в течение 2 часов при температуре -78°С, смесь гасят с помощью насыщенного водного раствора NH4Cl (600 мл). Органический слой отделяют и водную фазу исчерпывающе экстрагируют EtOAc (3 раза по 500 мл). Объединенные органические слои промывают с помощью насыщенного водного раствора NaCl, сушат над безводным Na2SO4, отфильтровывают и концентрируют, получая продукт 13 в виде масла желтого цвета, которое используют на следующих стадиях без дальнейшей очистки (61,3 г, выход: 99%).
1H ЯМР (CDCl3, 300 МГц) δ: 7,25 (д, 2H, J=8,7 Гц), 6,90 (д, 2H, J=8,7 Гц), 4,45 (м, 2H), 3,80 (с, 3H), 3,65 (м, 3H), 2,40 (м, 2H), 1,82 (м, 2H), 1,79 (т, 3H, J=2,4 Гц), 0,92 (с, 9H), 0,05 (с, 6H).
Синтез промежуточного продукта 14
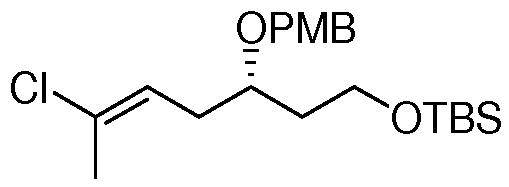
К раствору продукта 13 (61,3 г, 0,169 моль) в безводном толуоле (2,1 л), в атмосфере азота и при температуре 0°С, добавляют реагент Шварца, (бис(циклопентадиенил)цирконий(IV)-хлоридгидрид, Cp2ZrHCl) (130,3 г, 0,507 моль) и реакционную смесь перемешивают в течение 5 минут при комнатной температуре. Реакционную температуру повышают до 50°С, в течение 20 минут и перемешивают при температуре 50°С в течение 2,5 часов. В течение этого времени реакционный раствор становится оранжевого цвета. Реакционный раствор охлаждают до температуры 0°С и добавляют N-хлорсукцинимид (58,45 г, 0,440 моль) в виде одной порции. Продолжают перемешивать в течение 30 минут при комнатной температуре и реакционную смесь разбавляют смесью гексан/EtOAc (95:5; 500 мл). Удаляют твердое вещество путем фильтрации и выпаривают летучие вещества, получая продукт 14 в виде масла желтого цвета, которое используют без дальнейшей очистки (15,1 г, выход: 86%).
[α]D=+20,5 (с=1, CHCl3).
1H ЯМР (CDCl3, 300 МГц) δ: 7,25 (д, 2H, J=8,7 Гц), 6,87 (д, 2H, J=8,7 Гц), 5,64 (тд, 1H, J=7,8, 0,9 Гц), 4,45 (кв, 2H, J=11,1 Гц), 3,80 (с, 3H), 3,70 (м, 2H), 3,62 (м, 1H), 2,27 (т, 2H, J=6,9 Гц), 2,03 (с, 3H), 1,70 (м, 2H), 0,89 (с, 9H), 0,05 (с, 6H).
13С-ЯМР (CDCl3, 75 МГц) δ: 159,4, 130,9, 130,7, 129,6, 124,2, 114,0, 75,2, 71,4, 59,8, 55,5, 37,7, 33,8, 26,1, 21,2, 18,5, -5,1.
Синтез промежуточного продукта 15
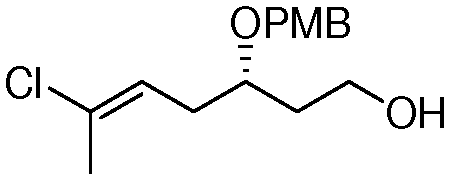
К раствору продукта 14 (23 г, 0,058 моль) в безводном ТГФ (288 мл), в атмосфере азота и при температуре 0°С, по каплям добавляют раствор тетрабутиламмонийфторида (TBAF) (115,3 мл, 0,115 моль) в течение 20 минут (раствор становится красного цвета). Реакционную смесь перемешивают при комнатной температуре в течение 2 часов и затем гасят с помощью насыщенного водного раствора NH4Cl (200 мл). Слои разделяют и водную фазу исчерпывающе экстрагируют EtOAc (3 раза по 150 мл). Объединенные органические слои сушат над Na2SO4, отфильтровывают и концентрируют. Осуществляют флэш-хроматографию (гексан/EtOAc = от 4:1 до 1:1), получая продукт 15 в виде бесцветного масла (11,9 г, выход: 73%).
1Н ЯМР (CDCl3, 300 МГц) δ: 7,25 (д, 2H, J=8,7 Гц), 6,86 (д, 2H, J=8,7 Гц), 5,62 (т, 1H, J=7,8 Гц), 4,45 (м, 2H), 3,80 (с, 3H), 3,70 (м, 3H), 2,35 (м, 2H), 2,03 (с, 3H), 1,75 (м, 2H).
Синтез промежуточного продукта 16
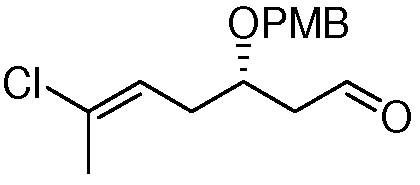
(Диацетоксииод)бензол (BAIB) (11,5 г, 35,7 ммоль) добавляют к раствору спирта 15 (9,2 г, 32,4 ммоль) и 2,2,6,6-тетраметилпиперидин-1-оксила (ТЕМРО) (515 мг, 3,3 ммоль) в безводном дихлорметане (92 мл). Реакционную смесь перемешивают при комнатной температуре в течение 20 часов до тех пор, пока спирт больше не будет обнаруживаться (ТСХ), и затем эту смесь гасят с помощью насыщенного водного раствора NH4Cl и экстрагируют DCM (3 раза по 100 мл). Объединенные органические фазы сушат над безводным Na2SO4, отфильтровывают и концентрируют. Остаток очищают с помощью флэш-хроматографии (гексан/EtOAc = от 4:1 до 1:1), получая продукт 16 в виде бесцветного масла (6,3 г, выход: 69%).
1Н ЯМР (CDCl3, 300 МГц) δ: 9,78 (с, 1H), 7,25 (д, 2H, J=8,7 Гц), 6,85 (д, 2H, J=8,7 Гц), 5,64 (т, 1H, J=7,8 Гц), 4,45 (кв, 2H, J=11,1 Гц), 4,02 (м, 1H), 3,80 (с, 3H), 2,60 (м, 2H), 2,35 (м, 2H), 2,03 (с, 3H).
13С-ЯМР (CDCl3, 75 МГц) δ: 201, 159,6, 132,1, 130,1, 129,7, 122,8, 114,1, 73,3, 71,5, 55,5, 48,3, 33,5, 21,3.
Синтез промежуточного продукта 17
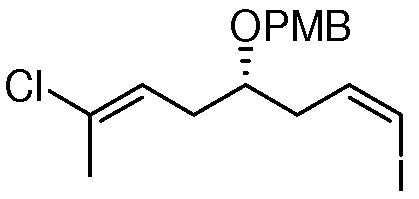
К суспензии иодметилтрифенилфосфонийиодида (16,6 г, 31 ммоль) в безводном ТГФ (126 мл), при комнатной температуре, медленно добавляют 1 М раствор NaHMDS в безводном ТГФ (31,27 мл, 31,27 моль). После перемешивания в течение 2 минут смесь желтого цвета охлаждают до температуры -78°С и затем добавляют раствор продукта 16 (6,3 г, 22 ммоль) в безводном ТГФ (82 мл). Реакционную смесь перемешивают при температуре -78°С в течение 2 часов и при комнатной температуре в течение 5 минут, разбавляют гексаном и отфильтровывают через слой целита (Celite®). Слой целита промывают гексаном, объединенные фильтраты выпаривают при пониженном давлении и полученное масло очищают с помощью колоночной хроматографии (гексан/EtOAc = от 12:1 до 8:1), получая продукт 17 в виде масла желтого цвета (5,6 г, выход: 62%).
1Н ЯМР (CDC13, 300 МГц) δ: 7,25 (д, 2H, J=8,7 Гц), 6,85 (д, 2H, J=8,7 Гц), 6,25 (м, 2H) 5,64 (т, 1H, J=7,8 Гц), 4,42 (м, 2H), 3,80 (с, 3H), 3,55(м, 1H), 2,40 (м, 2H), 2,25 (м, 2H), 2,03 (с, 3H).
Синтез промежуточного продукта 18
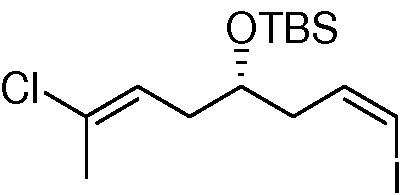
2,3-Дихлор-5,6-дициано-п-бензохинон (DDQ) (3,6 г, 16 ммоль) добавляют к раствору продукта 17 (5 г, 12 ммоль) в смеси DCM-H2O (20:1, 98 мл), в атмосфере азота, при комнатной температуре. Спустя 1,5 часа (гексан/EtOAc = 4:1, ТСХ показывает отсутствие исходного вещества), реакционную смесь гасят путем выливания в Et2O (200 мл) и промывки с помощью 1 М раствора NaOH (3 раза по 50 мл) и насыщенного солевого раствора (50 мл). Органическую фазу сушат над безводным Na2SO4, отфильтровывают и концентрируют. Хроматографическое отделение п-метоксибензальдегида облегчается восстановлением до п-метоксибензилового спирта. По окончании этого раствор полученного остатка в МеОН (98 мл) с NaBH4 (0,60 г, 16 ммоль), в атмосфере азота, выдерживают при комнатной температуре в течение 1 часа. Реакционную смесь затем гасят путем выливания в Et2O (100 мл) и промывки с помощью 1 М раствора HCl (40 мл) и насыщенного солевого раствора (40 мл). Органическую фазу сушат над безводным Na2SO4, отфильтровывают и концентрируют. Полученное масло очищают на силикагеле (гексан/EtOAc = от 10:1 до 4:1), получая вторичный спирт в виде бесцветного масла (2,8 г, выход: 80%).
К раствору вторичного спирта (2,8 г, 10 ммоль) в безводном DCM (38 мл), в атмосфере азота и при температуре 0°С, по каплям добавляют 2,6-лутидин (2,28 мл, 20 ммоль), затем трет-бутилдиметилсилилтрифторметансульфонат (TBSOTf) (2,33 мл, 12 ммоль). Реакционную смесь перемешивают в течение 2 часов. В этот момент сырую смесь гасят с помощью 0,5 М раствора HCl (25 мл) и экстрагируют DCM (2 раза по 25 мл). Объединенные органические слои промывают с помощью насыщенного водного раствора NaHCO3 и насыщенного солевого раствора. Органическую фазу сушат над Na2SO4, отфильтровывают и концентрируют. Осуществляют флэш-хроматографию (гексан/EtOAc = от 100:1 до 20:1), получая продукт 18 в виде бесцветного масла (3,14 г, выход: 80%).
1H ЯМР (CDCl3, 300 МГц) δ: 6,25 (м, 2H) 5,64 (т, 1H, J=7,8 Гц), 3,82 (м, 1H), 2,38 (т, 2H, J=6,0 Гц), 2,20 (т, 2H, J=6,3 Гц), 2,03 (с, 3H), 0,86 (с, 9H), 0,05 (с, 6H).
13С-ЯМР (CDCl3, 75 МГц) δ: 137,7, 130,9, 124,3, 84,6, 70,6, 42,5, 36,6, 25,9, 21,3, 18,2, -4,4.
Синтез промежуточного продукта 19а
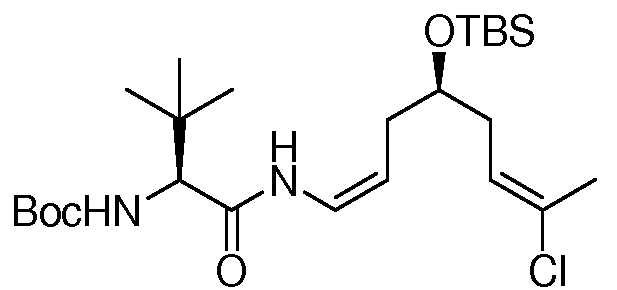
В герметично закрываемую пробирку Шленка вводят иодид меди-(I) (148 мг, 0,78 ммоль), карбонат калия (1,076 г, 7,78 ммоль) и Вос-трет-LeuCONH2 (полученный по методике, описанной Pozdnev V.F., Tetrahedron Letters, 1995, 36, 7115-7118) (0,96 г, 4,15 ммоль), создают вакуум и заполняют азотом. Добавляют N,N'-диметилэтилендиамин (DMEDA) (0,166 мл, 1,55 ммоль), винилиодид 18 (1,04 г, 2,59 ммоль) и безводный ДМФА (15 мл), в атмосфере азота. Пробирку Шленка герметично закрывают, нагревают при температуре 90°С в течение 18 часов и охлаждают до комнатной температуры. Полученную смесь разбавляют EtOAc и гасят водой. Органический слой промывают водой и сушат над безводным Na2SO4. Растворитель удаляют при пониженном давлении и остаток очищают с помощью флэш-хроматографии на силикагеле (гексан/EtOAc = от 20:1 до 15:1). Промежуточный продукт 19а (670 мг, выход: 53%) получают в виде масла.
1Н ЯМР (CDC13, 300 МГц) δ: 7,72 (д, 1H, J=9,9 Гц), 6,70 (т, 1H, J=9,6 Гц), 5,54 (т, 1H, J=7,8 Гц), 5,35 (д, 1H, J=9,0 Гц), 4,76 (кв, 1H, J=7,8 Гц), 3,89 (д, 1H, J=9,0 Гц), 3,73-3,68 (м, 1H), 2,12 (м, 4H), 1,98 (с, 3H), 1,40 (с, 9H), 0,97 (с, 9H), 0,84 (с, 9H), 0,02 (с, 3H), 0,01 (с, 3H).
13С-ЯМР (CDCl3, 75 МГц) δ: 168,9, 156,0, 131,1, 123,9, 122,6, 108,2, 79,9, 71,6, 62,5, 36,5, 34,8, 33,8, 28,1, 26,7, 25,9, 21,2, 18,3, -4,3, -4,4.
Синтез промежуточного продукта 19b
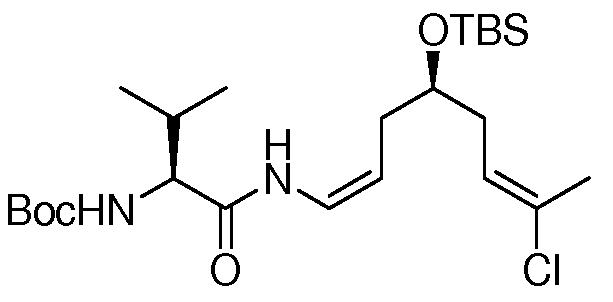
В герметично закрываемую пробирку Шленка вводят иодид меди-(I) (40,4 мг, 0,213 ммоль), карбонат калия (294 мг, 2,13 ммоль) и Вос-Val-CONH2 (полученный по методике, описанной Pozdnev V.F., Tetrahedron Letters, 1995, 36, 7115-7118) (230 мг, 1,06 ммоль), создают вакуум и заполняют азотом. Добавляют N,N'-диметилэтилендиамин (45 мкл, 0,426 ммоль), винилиодид 18 (283 мг, 0,71 ммоль) и безводный ДМФА (35 мл), в атмосфере азота. Пробирку Шленка герметично закрывают, нагревают при температуре 90°С в течение 18 часов и охлаждают до комнатной температуры. Полученную смесь разбавляют EtOAc и гасят водой. Органический слой промывают водой и сушат над безводным Na2SO4. Растворитель удаляют при пониженном давлении и остаток очищают с помощью флэш-хроматографии на силикагеле (гексан/EtOAc = от 7:1 до 3:1). Промежуточный продукт 19b (270 г, выход: 77%) получают в виде масла.
1Н ЯМР (CDC13, 300 МГц) δ: 7,80 (д, 1H, J=9,3 Гц), 6,79-6,73 (м, 1H), 5,58 (т, 1H, J=7,5 Гц), 5,02 (уш.с, 1H), 4,85-4,76 (м, 1H), 3,93 (дд, 1H, J=8,4, 6,0 Гц), 3,80-3,73 (м, 1H), 2,12-2,22 (м, 5H), 2,02 (с, 3H), 1,45 (с, 9H), 0,98 (д, 3H, J=6,9 Гц), 0,93 (д, 3H, J=6,9 Гц), 0,89 (с, 9H), 0,07 (с, 3H), 0,06 (с, 3H).
Синтез промежуточного продукта 20а
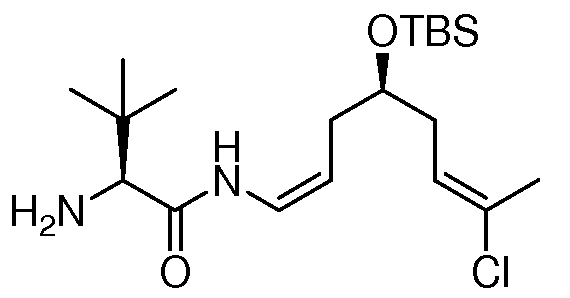
Раствор защищенного аминопроизводного 19а (670 мг, 1,33 ммоль) в этиленгликоле (30 мл) нагревают при температуре 200°С в течение 15 минут. Реакционную смесь затем охлаждают до комнатной температуры, разбавляют DCM, гасят с помощью насыщенного солевого раствора и выливают в воду. Добавляют несколько капель 3 М раствора NaOH до тех пор, пока рН раствора не достигнет 14, и затем тщательно экстрагируют DCM. Объединенные органические фазы сушат над безводным Na2SO4, отфильтровывают и концентрируют в вакууме, получая первичный амин 20а (510 мг, выход: 95%) в виде масла желтого цвета, которое используют без дальнейшей очистки.
1Н ЯМР (CDCl3, 300 МГц) δ: 8,77 (д, 1H, J=9,9 Гц), 6,71 (т, 1H, J=9,6 Гц), 5,56 (т, 1H, J=7,8 Гц), 4,71 (м, 1H), 3,72 (м, 1H), 3,14 (с, 1H), 2,14 (м, 4H), 1,97 (с, 3H), 0,97 (с, 9H), 0,84 (с, 9H), 0,02 (с, 6H).
13С-ЯМР (CDCl3, 75 МГц) δ: 171,2, 131,0, 124,1, 122,5, 107,1, 71,5, 64,3, 36,2, 34,5, 33,8, 26,5, 26,0, 21,2, 18,2, -4,4, -4,5.
Синтез промежуточного продукта 20b
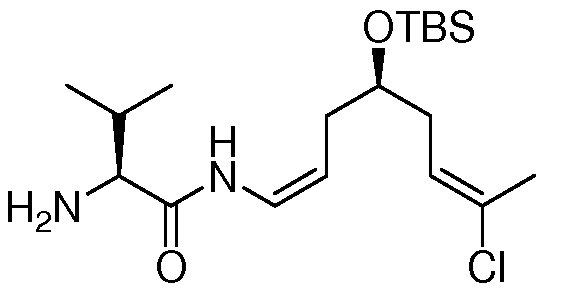
Раствор защищенного аминопроизводного 19b (255 мг, 0,52 ммоль) в этиленгликоле (15 мл) нагревают при температуре 200°С в течение 15 минут. Реакционную смесь затем охлаждают до комнатной температуры, разбавляют DCM, гасят с помощью насыщенного солевого раствора и выливают в воду. Добавляют несколько капель 3 М раствора NaOH до тех пор, пока рН раствора не достигнет 14, и затем тщательно экстрагируют DCM. Объединенные органические фазы сушат над безводным Na2SO4, отфильтровывают и концентрируют в вакууме, получая первичный амин 20b (170 мг, выход: 85%) в виде масла желтого цвета, которое используют без дальнейшей очистки.
1Н ЯМР (CDCl3, 300 МГц) δ: 9,27 (д, 1H, J=10,2 Гц), 6,76 (дд, 1H, J=11,1, 9,6 Гц), 5,61 (т, 1H, J=7,8 Гц), 4,80-4,72 (м, 1H), 3,81-3,73 (м, 1H), 3,31 (д, 1H, J=3,6 Гц) 2,44-2,33 (м, 1H), 2,20-2,16 (м, 4H), 2,03 (с, 3H), 1,59 (уш.с, 2H), 1,00 (д, 3H, J=6,9 Гц), 0,89 (с, 9H), 0,82 (д, 3H, J=6,9 Гц), 0,05 (с, 6H).
13С-ЯМР (CDCl3, 75 МГц) δ: 172,1, 131,1, 124,1, 122,5, 107,4, 71,5, 60,2, 36,2, 33,7, 30,8, 26,0, 21,3, 20,0, 18,3, 16,1, -4,3, -4,4.
Синтез промежуточного продукта 21а

К раствору амина 20а (918 мг, 2,27 ммоль) в безводной смеси DCM/ДМФА (10:1, 39,6 мл) добавляют раствор (Z)-3-трибутилстаннилакриловой кислоты (1028 мг, 2,84 ммоль) в безводном DCM, в атмосфере азота, и затем охлаждают до температуры 0°С. К раствору добавляют диизопропилэтиламин (DIPEA) (0,6 мл, 3,4 ммоль), 1-гидрокси-7-азабензотриазол (HOAt) (310 мг, 2,27 ммоль) и N,N,N'N'-тетраметил-О-(7-азабензотриазол-1-ил)уронийгексафторфосфат (HATU) (860 мг, 2,27 ммоль) и спустя 30 минут охлаждающую баню отставляют. Реакционную смесь перемешивают при комнатной температуре в течение 2 часов, гасят с помощью насыщенного водного раствора NH4Cl, выливают в воду и экстрагируют DCM. Объединенные органические фазы сушат над безводным Na2SO4, отфильтровывают и концентрируют. Остаток очищают с помощью флэш-хроматографии (гексан/EtOAc = от 20:1 до 15:1), получая амид 21а (1,11 г, выход: 66%) в виде масла.
1H ЯМР (CDCl3, 300 МГц) δ: 7,63 (д, 1H, J=10,5 Гц), 6,97 (д, 1H, J=12,3 Гц), 6,75 (д, 1H, J=12,3 Гц), 6,72 (т, 1H, J=9,5 Гц), 6,50 (д, 1H, J=9,0 Гц), 5,56 (т, 1H, J=6,6 Гц), 4,83 (кв, 1H, J=9,0 Гц), 4,41 (д, 1H, J=9,6 Гц) 3,76 (м, 1H), 2,17 (м, 4H), 2,01 (с, 3H), 1,45 (м, 6H), 1,25 (м, 8H), 1,0 (с, 9H), 0,88 (с, 9H), 0,84 (м, 13H), 0,06 (с, 6H).
Синтез промежуточного продукта 21b
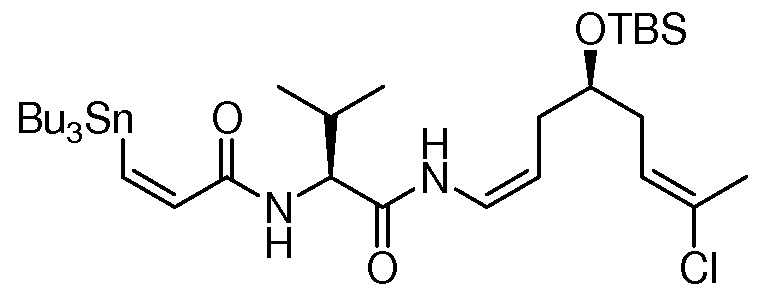
К раствору амина 20b (170 мг, 0,437 ммоль) в безводной смеси DCM/ДМФА (10:1, 7,7 мл) добавляют раствор (Z)-3-трибутилстаннилакриловой кислоты (197,2 мг, 0,546 ммоль) в безводном DCM, в атмосфере азота, и затем охлаждают до температуры 0°С. К раствору добавляют DIPEA (0,11 мл, 0,655 ммоль), HOAt (59,4 мг, 0,437 ммоль) и HATU (166 мг, 0,437 ммоль) и спустя 30 минут охлаждающую баню отставляют. Реакционную смесь перемешивают при комнатной температуре в течение 2 часов, гасят с помощью насыщенного водного раствора NH4Cl, выливают в воду и экстрагируют DCM. Объединенные органические фазы сушат над безводным Na2SO4, отфильтровывают и концентрируют. Остаток очищают с помощью флэш-хроматографии (гексан/EtOAc = от 20:1 до 15:1), получая амид 21b (250 мг, выход: 78%) в виде пены белого цвета.
1Н ЯМР (CDC13, 300 МГц) δ: 7,94 (д, 1H, J=10,8 Гц), 7,00 (д, 1H, J=5 12,3 Гц), 6,75 (д, 1H, J=12,3 Гц), 6,72 (т, 1H, J=9,5 Гц), 6,50 (д, 1H, J=9,0 Гц), 5,56 (т, J=6,6 Гц, 1H), 4,83 (кв, 1H, J=9,0 Гц), 4,41 (т, 1H, J=9,0 Гц), 3,76 (м, 1H), 2,17 (м, 4H), 2,01 (с, 3H), 1,45 (м, 7H), 1,25 (м, 8H), 0,88 (с, 9H), 0,84 (м, 19H), 0,06 (с, 6H).
13С-ЯМР (CDCl3, 75 МГц) δ: 169,2, 166,8, 153,8, 136,2, 131,1, 123,9, 122,6, 108,7, 71,6, 59,2, 36,5, 33,7, 31,4, 29,5, 27,6, 26,1, 21,3, 19,5, 18,5, 14,0, 11,8, -4,3, -4,4.
Синтез промежуточного продукта 22а
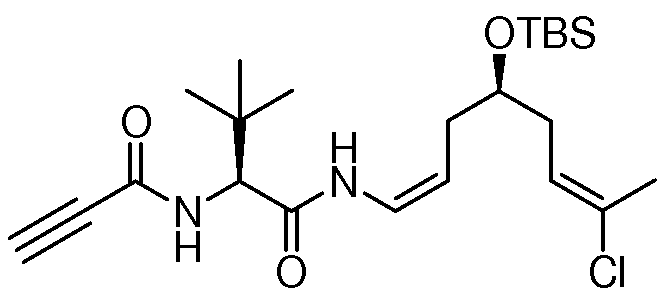
К раствору продукта 20а (120 мг, 0,30 ммоль) и пропиоловой кислоты (23 мкл, 0,37 ммоль) в безводной смеси DCM/ДМФА (10:1, 4,2 мл), при температуре 0°С, добавляют HATU (113 мг, 0,30 ммоль), HOAt (40 мг, 0,30 ммоль) и DIPEA (0,78 мкл, 0,44 ммоль). Реакционную смесь перемешивают при температуре 0°С в течение 30 минут и в течение 2 часов - при комнатной температуре. Затем сырую смесь обрабатывают с помощью насыщенного водного раствора NH4Cl и экстрагируют CH2Cl2. Объединенные фильтраты промывают водой. После сушки и выпаривания растворителя при пониженном давлении, сырой продукт очищают с помощью колоночной хроматографии (смесь этилацетат/гексаны), получая чистое соединение 22а (50 мг, выход: 40%).
1H ЯМР (CDCl3, 300 МГц) δ: 8,20 (д, 1H, J=10,2 Гц), 6,83 (д, 1H, J=Гц), 6,72 (т, 1H, J=9,3 Гц), 5,55 (т, 1H, J=6,9 Гц), 4,88 (кв, 1H, J=Гц), 4,58 (д, 1H, J=9,6 Гц), 3,75 (м, 1H), 2,90 (с, 1H), 2,17 (м, 4H), 2,00 (с, 3H), 1,02 (с, 9H), 0,87 (с, 9H), 0,05 (с, 3H), 0,04 (с, 3H).
13С-ЯМР (CDCl3, 75 МГц) δ: 167,5, 152,1, 131,0, 124,1, 122,3, 109,4, 77,1, 74,8, 71,7, 60,9, 36,5, 35,7, 33,8, 26,7, 26,1, 21,2, 18,3, -4,3, -4,4.
Синтез промежуточного продукта 22b
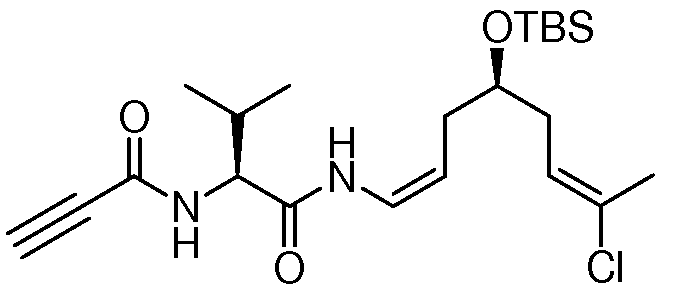
К раствору продукта 20b (200 мг, 0,51 ммоль) и пропиоловой кислоты (39 мкл, 0,64 ммоль) в безводной смеси DCM/ДМФА (10:1, 8 мл), при температуре 0°С, добавляют HATU (194 мг, 0,51 ммоль), HOAt (69 мг, 0,51 ммоль) и DIPEA (133 мкл, 0,76 ммоль). Реакционную смесь перемешивают при температуре 0°С в течение 30 минут и в течение 2 часов - при комнатной температуре. Затем сырую смесь обрабатывают с помощью насыщенного водного раствора NH4Cl и экстрагируют CH2Cl2. Объединенные фильтраты промывают водой. После сушки и выпаривания растворителя при пониженном давлении сырой продукт очищают с помощью колоночной хроматографии (смесь этилацетат/гексаны), получая чистое соединение 22b (150 мг, выход: 67%).
1H ЯМР (CDCl3, 300 МГц) δ: 7,02 (д, 1H, J=11A Гц), 6,75 (дд, 1H, J=20 10,8, 9,0 Гц), 6,53 (д, 1H, J=10,2 Гц), 5,58 (дд, 1H, J=9,0, 7,8 Гц), 4,87 (кв, 1H, J=7,8 Гц), 4,33 (дд, 1H, J=8,7, 6,3 Гц), 3,84-3,76 (м, 1H), 2,83 (с, 1H), 2,23-2,11 (м, 5H), 2,05-2,03 (м, 3H), 0,99 (д, 6H, J=6,9 Гц), 0,89 (с, 9H), 0,08 (с, 3H), 0,06 (с, 3H).
Пример 3
Синтез фрагмента 27
На схеме 3 представлен пример синтеза фрагмента 27.
Синтез промежуточного продукта 23
К суспензии иодметилтрифенилфосфонийиодида (Gilbert Stork KZ., Tetrahedron letters, 1989, 30(17), 2173) (6,6 г, 12,47 ммоль) в безводном ТГФ (50 мл), при температуре 0°С, через капельную воронку медленно добавляют 1 М раствор натрийгексаметилдисилазана (NaHMDS) (12,5 мл, 12,47 ммоль) в течение 10 минут. После перемешивания в течение дополнительных 5 минут раствор охлаждают до температуры -78°С и затем через канюлю добавляют 1,3-диметил-3,4,5,6-тетрагидро-2(1Н)-пиримидинон (DMPU) (3,02 мл, 24,95 ммоль), затем альдегид 1 (1,80 г, 4,99 ммоль), растворенный в безводном ТГФ (50 мл). Поддерживают температуру -78°С, пока перемешивают реакционную смесь в течение 2 часов. Добавляют гексан (200 мл), и полученную суспензию отфильтровывают через целит (Celite®) и промывают с помощью дополнительного количества гексана (200 мл). Фильтрат выпаривают при пониженном давлении и полученное масло очищают с помощью колоночной хроматографии (гексан/EtOAc = от 100:0 до 20:1), получая 1,64 г (выход: 68%) иодида 23.
1H ЯМР (CDCl3, 300 МГц) δ: 6,18-6,09 (м, 2H), 3,79 (м, 1H), 3,67 (м, 2H), 2,57 (м, 1H), 1,75-1,63 (м, 2H), 0,96 (д, 3H, J=6,9 Гц), 0,89 (м, 18H), 0,04 (м, 12H).
Синтез промежуточного продукта 24
К раствору иодида 23 (520 мг, 1,07 ммоль) в этаноле (5,3 мл) добавляют пиридиний-п-толуолсульфонат (PPTS) (94,4 мг, 0,38 ммоль) и реакционную смесь перемешивают при комнатной температуре в течение 25 часов. Затем растворитель удаляют при пониженном давлении и полученное масло очищают с помощью колоночной хроматографии (гексан/EtOAc = 4:1), получая 380 мг (выход: 87%) спирта 24.
1H ЯМР (CDCl3, 300 МГц) δ: 6,20 (д, 1H, J=7,5 Гц), 6,08 (м, 1H), 3,87-3,72 (м, 3H), 2,69 (м, 1H), 1,85-1,80 (м, 1H), 1,71-1,65 (м, 1H), 0,99 (д, 3H, J=6,6 Гц), 0,90 (м, 9H), 0,09 (м, 6H).
Синтез промежуточного продукта 25
К охлажденному до температуры 0°С раствору спирта 24 (380 мг, 1,03 ммоль) в безводном DCM (10,3 мл) добавляют периодинан Десс-Мартина (870 мг, 2,05 ммоль). Спустя 1 час, добавляют насыщенный водный раствор NaHCO3 (50 мл) и органический слой отфильтровывают, сушат над безводным MgSO4 и концентрируют в вакууме. Очищают с помощью колоночной хроматографии (гексан/EtOAc = 1:1), получая 350 мг (выход: 93%) альдегида 25.
1H ЯМР (CDCl3, 300 МГц) δ: 9,82 (т, 1H, J=2,1 Гц), 6,26 (дд, 1H, J=0,6, 7,5 Гц), 6,05 (дд, 1H, J=1,5, 9,0 Гц), 4,14 (м, 1H), 2,68 (м, 1H), 2,58 (м, 2H), 1,01 (д, 3H, J=6,6 Гц), 0,87 (м, 9H), 0,07 (с, 3H), 0,03 (с, 3H).
Синтез промежуточного продукта 26
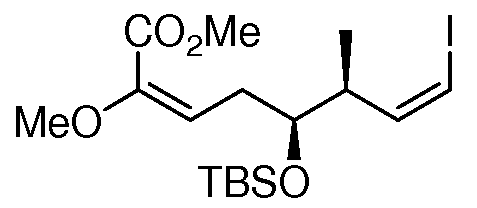
К раствору диэтил(метокси[метоксикарбонил]метил)фосфоната (362 мг, 1,42 ммоль) и 18-краун-6 (754 мг, 2,85 ммоль) в безводном ТГФ (27 мл), перемешиваемому в атмосфере аргона, при температуре -78°С, по каплям добавляют 0,5 М раствор бис(триметилсилил)амида калия (KHMDS) (2,85 мл, 1,42 ммоль). Спустя 15 минут по каплям добавляют альдегид 25 (350 мг, 0,95 ммоль) в безводном ТГФ (14 мл) в течение 30 минут и перемешивают при температуре -78°С в течение 90 минут. Затем реакционную смесь гасят с помощью насыщенного раствора NH4Cl (20 мл), нагревают до комнатной температуры и разбавляют дихлорметаном (50 мл). Органическую фазу сушат (безводный Na2SO4) и выпаривают при пониженном давлении. Очищают с помощью колоночной хроматографии (гексан/Et2O = 20:1), получая 370 мг (выход: 86%) чистого (Е)-26.
1H ЯМР (CDCl3, 300 МГц) δ: 6,12 (д, 1Н, J=7,2 Гц), 6,03 (м, 1Н), 5,32 (т, 1Н, J=7,5 Гц), 3,78 (с, 3H), 3,77-3,70 (м, 1Н), 3,63 (с, 3H), 2,69 (м, 2H), 2,58 (м, 1Н), 0,97 (д, 3H, J=6,6 Гц), 0,88 (с, 9H), 0,04 (с, 6H).
Синтез промежуточного продукта 27
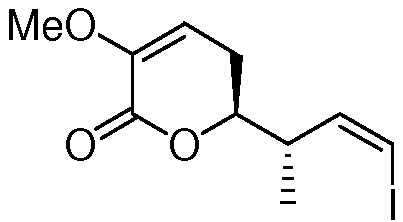
К раствору сложного эфира 26 (95 мг, 0,21 ммоль) в МеОН (3,15 мл), при комнатной температуре, добавляют 37% раствор HCl (26 мкл) и реакционную смесь перемешивают в течение 6 часов. Затем смесь нейтрализуют с помощью насыщенного водного раствора NaHCO3 (рН=7-8) и органический растворитель выпаривают при пониженном давлении. Полученную суспензию экстрагируют дихлорметаном (4 раза по 20 мл), сушат и выпаривают. Осуществляют фильтрацию с помощью колоночной хроматографии (гексан/EtOAc = от 10:1 до 2:1), получая 210 мг (выход: 84%) лактона 27.
1H ЯМР (CDCl3, 300 МГц) δ: 6,32 (дд, 1H, J=0,6, 7,5 Гц), 6,08 (дд, 1H, J=1,5, 9,3 Гц), 5,62 (дд, 1Н, J=3,0, 6,3 Гц), 4,28 (м, 1Н), 3,63 (с, 3H), 2,84 (м, 1Н), 2,54 (м, 1Н), 2,34 (м, 1Н), 1,13 (д, 3H, J=6,6 Гц).
Пример 4
Синтез фрагмента 30
На схеме 4 представлен пример синтеза фрагмента 30.
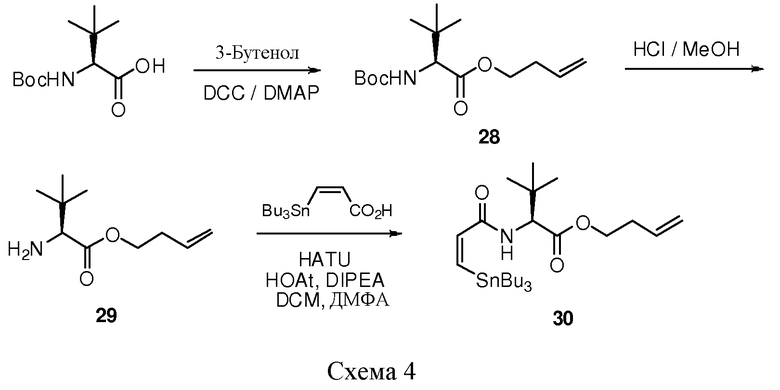
Синтез промежуточного продукта 28
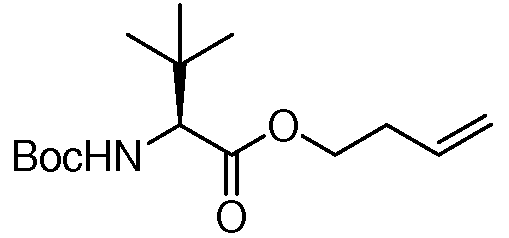
К смеси L-Boc-трет-лейцина (300 мг, 1,3 ммоль) в безводном DCM (13 мл) и дициклогексилкарбодиимида (DCC) (295 мг, 1,43 ммоль), при температуре 0°С, в атмосфере азота, добавляют 3-бутенол (0,3 мл, 3,9 ммоль) и диметиламинопиридин (DMAP) (15,9 мг, 0,13 ммоль). Реакционную смесь перемешивают в течение 5 минут при температуре 0°С и в течение 4 часов - при комнатной температуре. Органический растворитель выпаривают при пониженном давлении и полученное твердое вещество очищают с помощью колоночной хроматографии (гексан/EtOAc = 10:1), получая сложный эфир 28 (300 мг, выход: 81%).
1H ЯМР (CDCl3, 300 МГц) δ: 5,82-5,71 (м, 1H), 5,14-5,06 (м, 2H), 4,24-4,12 (м, 2H), 4,08 (д, 1H, J=9,8 Гц), 2,41 (кв, 2H, J=6,7 Гц), 1,43 (с, 9H), 0,96 (с, 9H).
Синтез промежуточного продукта 29
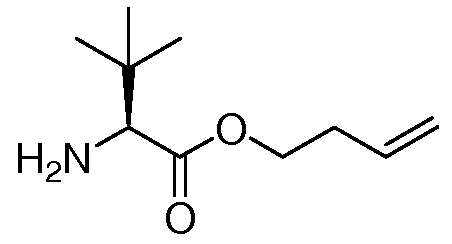
Раствор сложного эфира 28 (180 мг, 0,63 ммоль) в 1 М растворе HCl·в метаноле (3,6 мл) перемешивают при комнатной температуре в течение 24 часов. Органический растворитель выпаривают при пониженном давлении и полученное твердое вещество растворяют в DCM и промывают водой, полученную органическую фазу сушат над безводным Na2SO4, отфильтровывают и растворитель выпаривают, получая 116 мг (выход: 100%) продукта 29.
1H ЯМР (CDC13, 300 МГц) δ: 5,85-5,72 (м, 1H), 5,15-5,06 (м, 2H), 4,16 (т, 2H, J=6,7 Гц), 3,15 (с, 1H), 4,44-4,37 (м, 2H), 0,96 (с, 9H).
Синтез промежуточного продукта 30
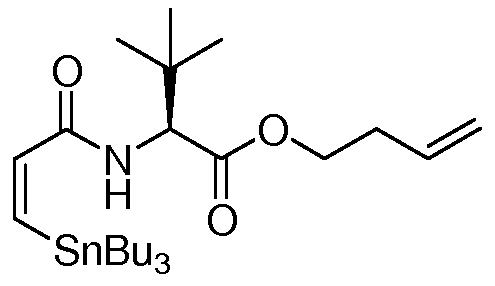
DIPEA (0,24 мл, 1,4 ммоль), HOAt (123,3 мг, 0,9 ммоль) и HATU (345 мг, 0,9 ммоль) добавляют к раствору продукта 29 (168 мг, 0,9 ммоль) и (Z)-3-трибутилстаннилакриловой кислоты (393 мг, 1,2 ммоль) в безводной смеси DCM/ДМФА (10:1, 14 мл), при температуре 0°С, в атмосфере аргона. Спустя 2 часа, охлаждающую баню отставляют и реакционную смесь перемешивают при комнатной температуре в течение 1 часа, гасят с помощью насыщенного водного раствора NH4Cl, выливают в воду и экстрагируют DCM. Объединенные органические фазы сушат над безводным Na2SO4, отфильтровывают и концентрируют. Остаток очищают с помощью флэш-хроматографии (гексан/EtOAc = от 15:1 до 10:1), получая продукт 30 (340 мг, выход: 72%).
1H ЯМР (CDCl3, 300 МГц) δ: 7,01 (д, 1H, J=12,3 Гц), 6,75 (д, 1H, J=12,3 Гц), 6,03 (д, 1H, J=9,73 Гц), 5,84-5,69 (м, 1H), 5,14-5,05 (м, 2H), 4,60 (д, 1H, J=9,76 Гц), 4,19-4,14 (м, 2H), 2,40 (кв, 2H, J=6,70 Гц), 1,48-1,40 (м, 6H), 1,31-1,19 (м, 6H), 0,96 (с, 9H), 0,93-0,83 (м, 15H).
Пример 5
Синтез фрагмента 37
На схеме 5 представлен синтез фрагмента 37.
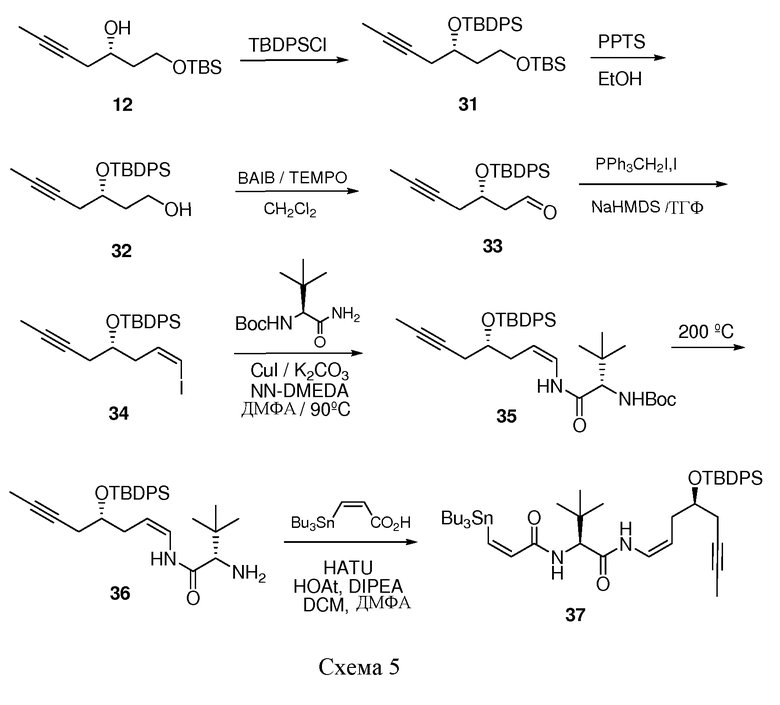
Синтез промежуточного продукта 31
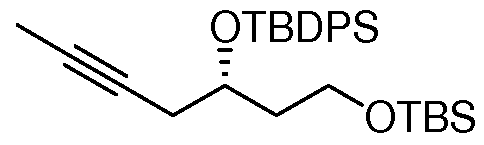
Раствор спирта 12 (2,88 г, 11,9 ммоль), трет-бутилдифенилсилилхлорида (4,39 мл, 16,89 ммоль) и 4-(диметиламино)пиридина (43,6 мг) в ДМФА (14 мл) перемешивают в течение ночи при комнатной температуре. Смесь разбавляют водой и экстрагируют Et2O, и органическую фазу промывают с помощью насыщенного солевого раствора, сушат над безводным Na2SO4, отфильтровывают и концентрируют. Осуществляют флэш-хроматографию (гексан/EtOAc = 95:1), получая силильный эфир 31 (5,3 г, выход: 93%) в виде бесцветной жидкости.
1Н ЯМР (300 МГц, CDCl3) δ: 7,70-7,66 (м, 4H), 7,40-7,34 (м, 6H), 3,99-3,95 (м, 1Н),3,70-3,62 (м, 2H), 2,23-2,22 (м, 2H), 1,84-1,81 (м, 2H), 1,69 (т, 3H, J=2,7 Гц), 1,05 (с, 9H), 0,84 (с, 9H), 0,01 (с, 6H).
13С-ЯМР (CDCl3, 75 МГц) δ: 136,1, 134,6, 129,7, 127,8, 77,8, 76,2, 69,9, 60,1, 39,6, 27,5, 27,2, 26,2, 19,6, 18,5, 3,7, -5,1.
Синтез промежуточного продукта 32
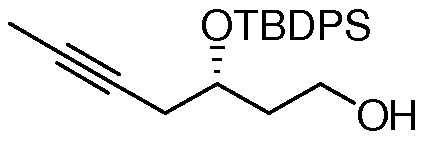
PPTS (837,7 мг, 3,33 ммоль) добавляют, в виде одной порции, к раствору продукта 31 (4 г, 8,33 ммоль) в этаноле (80 мл). Реакционную смесь перемешивают при комнатной температуре в течение 7 часов и затем концентрируют. Остаток разбавляют DCM и промывают с помощью насыщенного водного раствора NaHCO3. Органический слой экстрагируют, сушат над безводным Na2SO4, отфильтровывают и концентрируют. Осуществляют флэш-хроматографию (гексан/EtOAc = 95:1), получая силильный эфир 32 (2,12 г, выход: 69%), в виде бесцветного масла.
1Н ЯМР (500 МГц, CDCl3) δ: 7,71-7,63 (м, 4H), 7,45-7,26 (м, 6H), 4,14-4,01 (м, 2H), 3,80-3,71 (м, 1H), 2,31-2,28 (м, 2H), 1,94-1,80 (м, 2H), 1,79 (т, 3H, J=2,4 Гц), 1,07 (с, 9H).
Синтез промежуточного продукта 33
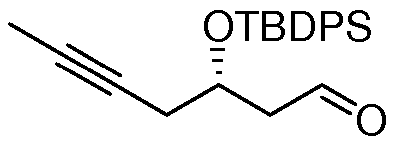
(Диацетоксииод)бензол (BAIB) (1,93 г, 6,00 ммоль) добавляют к раствору спирта 32 (2,0 г, 5,46 ммоль) и 2,2,6,6-тетраметилпиперидин-1-оксила (ТЕМРО) (85 мг, 0,55 ммоль) в безводном дихлорметане (27 мл). Реакционную смесь перемешивают при комнатной температуре в течение 18 часов до тех пор, пока спирт больше не будет обнаруживаться (ТСХ), и затем ее гасят с помощью насыщенного водного раствора NH4Cl и экстрагируют DCM (3 раза по 500 мл). Объединенные органические фазы сушат над безводным Na2SO4, отфильтровывают и концентрируют. Остаток очищают с помощью флэш-хроматографии (гексан/EtOAc = от 20:1 до 10:1), получая продукт 33 в виде бесцветного масла (1,64 г, выход: 82%).
1H ЯМР (CDCl3, 300 МГц) δ: 9,72 (с, 1H), 7,71-7,63 (м, 4H), 7,45-7,26 (м, 6H), 4,29 (м, 1H), 2,65 (м, 2H), 2,33 (м, 2H), 1,70 (с, 3H), 1,04 (с, 9H).
Синтез промежуточного продукта 34
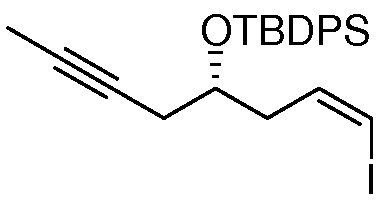
К суспензии иодметилтрифенилфосфонийиодида (3,14 г, 6,04 ммоль) в безводном ТГФ (60 мл), при комнатной температуре, медленно добавляют 1 М раствор NaHMDS в ТГФ (6,0 мл). После перемешивания в течение 2 минут смесь желтого цвета охлаждают до температуры -78°С и затем добавляют раствор продукта 33 (1,57 г, 4,31 ммоль) в безводном ТГФ (35 мл). Реакционную смесь перемешивают при температуре -78°С в течение 2 часов и при комнатной температуре - в течение 5 минут, разбавляют гексаном и отфильтровывают через слой целита (Celite®). Слой целита промывают гексаном и объединенные фильтраты выпаривают при пониженном давлении и полученное масло очищают с помощью колоночной хроматографии (гексан/EtOAc = 50:1), получая продукт 34 в виде масла желтого цвета (1,31 г, выход: 62%).
1Н ЯМР (500 МГц, CDCl3) δ: 7,70-7,66 (м, 4H), 7,44-7,34 (м, 6H), 6,27-6,24 (м, 2H), 3,99-3,95 (м, 1H), 2,47-2,41 (м, 2H), 2,27-2,23 (м, 2H), 1,71 (т, 3H, J=2,7 Гц), 1,07 (с, 9H).
Синтез промежуточного продукта 35
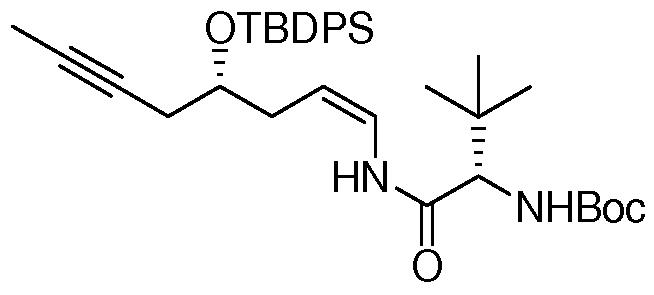
В герметично закрываемую пробирку Шленка вводят иодид меди-(I) (85,1 мг, 0,447 ммоль), карбонат калия (0,618 г, 4,47 ммоль) и Вос-трет-LeuCONH2 (полученный по методике, описанной Pozdnev V.F., Tetrahedron Letters, 1995, 36, 7115-7118) (0,514 г, 2,23 ммоль), создают вакуум и заполняют аргоном. Добавляют N,N'-диметилэтилендиамин (DMEDA) (0,095 мл, 0,89 ммоль), винилиодид 34 (0,727 г, 1,49 ммоль) и безводный ДМФА (11 мл), в атмосфере аргона. Пробирку Шленка герметично закрывают, нагревают при температуре 90°С в течение 18 часов и охлаждают до комнатной температуры. Полученную смесь разбавляют EtOAc и гасят водой. Органический слой промывают водой и сушат над безводным Na2SO4. Растворитель удаляют при пониженном давлении и остаток очищают с помощью флэш-хроматографии на силикагеле (гексан/EtOAc = от 20:1 до 15:1). Промежуточный продукт 35 (388 мг, выход: 44%) получают в виде масла.
1H ЯМР (300 МГц, CDCl3) δ: 7,70-7,66 (м, 4H), 7,53 (д, 1H, J=10,5 Гц), 7,43-7,26 (м, 6H), 6,73 (т, 1H, J=9,6 Гц), 5,29 (м, 1H), 4,79 (м, 1H), 3,85-3,81 (м, 2H), 2,39-2,30 (м, 1H), 2,27-2,21 (м, 3H), 1,88 (с, 3H), 1,43 (с, 9H), 1,06 (с, 9H), 0,97 (с, 9H).
Синтез промежуточного продукта 36
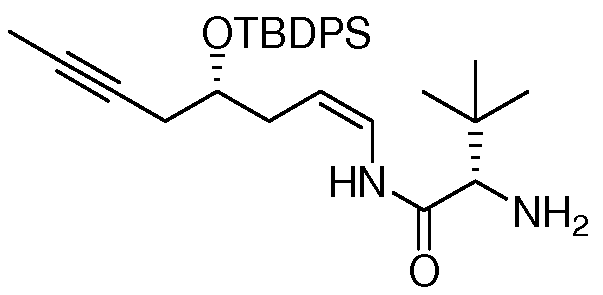
Раствор защищенного аминопроизводного 35 (288 мг, 0,487 ммоль) в этиленгликоле (17 мл) нагревают при температуре 200°С в течение 15 минут. Реакционную смесь затем охлаждают до комнатной температуры, разбавляют DCM, гасят с помощью насыщенного солевого раствора и выливают в воду. Добавляют несколько капель 3 М раствора NaOH до тех пор, пока рН раствора не достигнет 14, и затем тщательно экстрагируют DCM. Объединенные органические фазы сушат над безводным Na2SO4, отфильтровывают и концентрируют в вакууме, получая первичный амин 36 (165 мг, выход: 69%) в виде масла желтого цвета, которое используют без дальнейшей очистки.
1Н ЯМР (CDCl3, 300 МГц) δ: 8,46 (д, 1H, J=11,1 Гц), 7,71-7,63 (м, 4H), 7,45-7,26 (м, 6H), 6,76 (т, 1H, J=10,2 Гц), 4,77 (кв, 1H, J=10,2 Гц), 3,89 (м, 1H), 3,06 (с, 1H), 2,30 (м, 2H), 2,24 (м, 2H), 1,70 (с, 3H), 1,05 (с, 9H), 0,98 (с, 9H).
Синтез промежуточного продукта 37
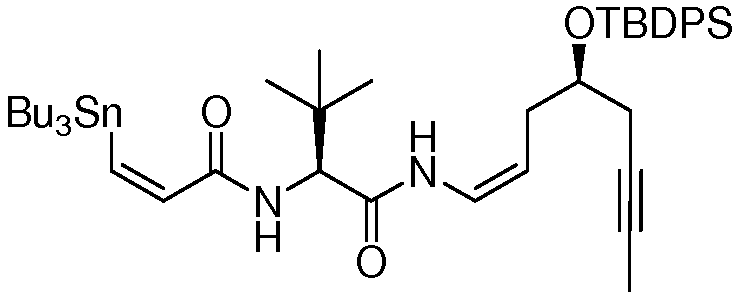
К раствору амина 36 (221 мг, 0,450 ммоль) в безводной смеси DCM/ДМФА (4:1, 5 мл) добавляют раствор (Z)-3-трибутилстаннилакриловой кислоты (195 мг, 0,54 ммоль) в безводном DCM, в атмосфере аргона, и затем охлаждают до температуры 0°С. К раствору добавляют DIPEA (0,094 мл, 0,54 ммоль), HOAt (73,5 мг, 0,54 ммоль) и HATU (205 мг, 0,54 ммоль) и спустя 30 минут охлаждающую баню отставляют. Реакционную смесь перемешивают при комнатной температуре в течение 2 часов, гасят с помощью насыщенного водного раствора NH4Cl, выливают в воду и экстрагируют DCM. Объединенные органические фазы сушат над безводным Na2SO4, отфильтровывают и концентрируют. Остаток очищают с помощью флэш-хроматографии (гексан/EtOAc = от 20:1 до 15:1), получая амид 37 (288 мг, выход: 77%) в виде масла.
1H ЯМР (300 МГц, CDCl3) δ: 7,70-7,66 (м, 4H), 7,61 (д, 1H, J=10,2 Гц), 7,42-7,38 (м, 6H), 7,02 (д, 1H, J=12,0 Гц), 6,77-6-70 (м, 2H), 6,28 (д, 1H, J=9,6 Гц), 4,82 (кв, 1H, J=8,4 Гц), 4,36 (д, 1H, J=9,6 Гц), 3,89-3-86 (м, 1H), 2,39-2,24 (м, 4H), 1,94 (с, 3H), 1,50-1,41 (м, 6H), 1,30-1-23 (м, 6H), 1,07 (с, 9H), 0,92 (с, 9H), 0,92-0,84 (м, 15H).
Пример 6
Синтез фрагмента 40
На схеме 6 представлен синтез фрагмента 40.
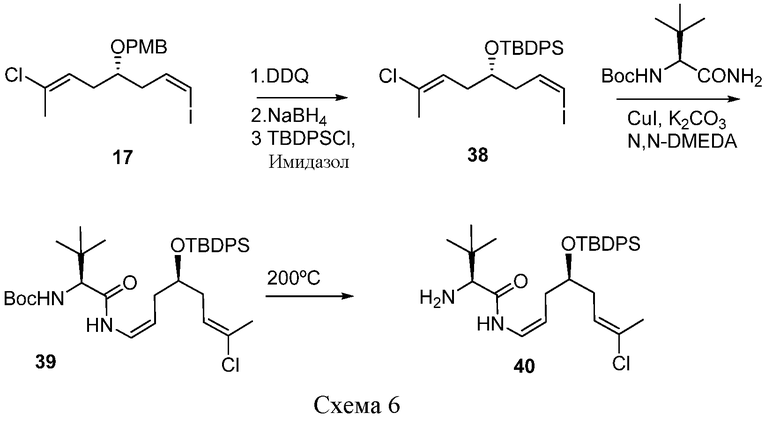
Синтез промежуточного продукта 38
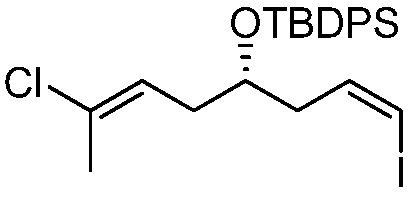
2,3-Дихлор-5,6-дициано-п-бензохинон (DDQ) (8,70 г, 38 ммоль) добавляют к раствору продукта 17 (12 г, 30 ммоль) в смеси дихлорметан-H2O (20:1, 236 мл), в атмосфере аргона, при комнатной температуре. Спустя 1,5 часа (гексан/EtOac = 4:1, ТСХ показывает отсутствие исходного вещества) реакционную смесь гасят путем выливания в Et2O (400 мл) и промывки с помощью 1 М водного раствора NaOH (3 раза по 200 мл) и насыщенного солевого раствора (200 мл). Органическую фазу сушат над безводным Na2SO4, отфильтровывают и концентрируют. Хроматографическое отделение п-метоксибензальдегида облегчается восстановлением до п-метоксибензилового спирта. По окончании этого раствор полученного остатка в МеОН (236 мл) с NaBH4 (1,5 г, 38 ммоль), в атмосфере аргона, выдерживают при комнатной температуре в течение 1 часа. Реакционную смесь затем гасят путем выливания в Et2O (400 мл) и промывки с помощью 1 М водного раствора HCl (200 мл) и насыщенного солевого раствора (200 мл). Органическую фазу сушат над безводным Na2SO4, отфильтровывают и концентрируют. Полученное масло очищают на силикагеле (гексан/EtOAc = от 10:1 до 4:1), получая вторичный спирт в виде бесцветного масла (6 г, выход: 73%).
К раствору вторичного спирта (6 г, 21 ммоль) в безводном ДМФА (25 мл), в атмосфере аргона и при комнатной температуре, по частям добавляют имидазол (3,3 г, 48,6 ммоль), затем трет-бутилдифенилсилилхлорид (TBDPSCl) (7,6 мл, 29,3 ммоль) и DMAP (77 мг, 0,63 ммоль). Смесь перемешивают в течение ночи и в этот момент времени сырой продукт гасят водой (30 мл) и экстрагируют Et2O (3 раза по 30 мл). Объединенные органические слои тщательно промывают с помощью воды и насыщенного солевого раствора. Органическую фазу сушат над безводным Na2SO4, отфильтровывают и концентрируют. Осуществляют флэш-хроматографию (гексан/EtOAc = от 100:1 до 30:1), получая продукт 38 (9,6 г, выход: 92%) в виде бесцветного масла.
1H ЯМР (CDCl3, 300 МГц) δ: 7,67 (м, 4H), 7,45-7,37 (м, 6H), 6,25 (м, 2H), 5,51 (т, 1H, J=7,8 Гц), 3,89 (м, 1H), 2,30 (т, 2H, J=5,5 Гц), 2,14 (т, 2H, J=6,4 Гц), 1,85 (с, 3H), 1,07 (с, 9H).
Синтез промежуточного продукта 39
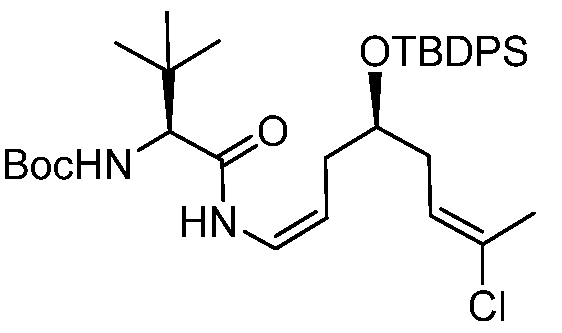
В герметично закрываемую пробирку Шленка вводят иодид меди-(I) (1,05 г, 5,54 ммоль), карбонат калия (7,65 г, 55,4 ммоль) и Вос-трет-LeuCONH2 (полученный по методике, описанной Pozdnev V.F., Tetrahedron Letters, 1995, 36, 7115-7118) (6,8 г, 29,6 ммоль), создают вакуум и заполняют аргоном. Добавляют N,N'-диметилэтилендиамин (DMEDA) (1,18 мл, 11,1 ммоль), винилиодид 38 (9,7 г, 18,5 ммоль) и безводный ДМФА (92 мл), в атмосфере аргона. Пробирку Шленка герметично закрывают, нагревают при температуре 90°С в течение 18 часов и охлаждают до комнатной температуры. Полученную смесь разбавляют EtOAc и гасят водой. Органический слой промывают водой и сушат над безводным Na2SO4. Растворитель удаляют при пониженном давлении и остаток очищают с помощью флэш-хроматографии на силикагеле (гексан/EtOAc = от 20:1 до 15:1), получая соединение 39 (5,8 г, выход: 51%) в виде твердого вещества белого цвета.
1Н ЯМР (CDCl3, 300 МГц) δ: 7,67 (м, 4H), 7,47-7,37 (м, 6H), 7,02 (д, 1H, J=10,2 Гц), 6,67 (т, 1H, J=9,4 Гц), 5,51 (т, 1H, J=7,3 Гц), 5,23 (д, 1H, J=8,4 Гц), 4,72 (кв, 1H, J=8,1 Гц), 3,81 (м, 2H), 2,18-2,04 (м, 4H), 1,86 (с, 3H), 1,42 (с, 9H), 1,05 (с, 9H), 0,97 (с, 9H).
Синтез соединения 40
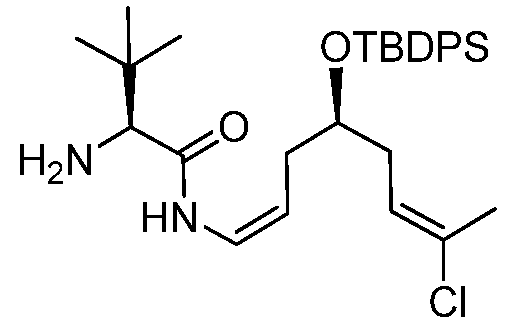
Раствор защищенного аминопроизводного 39 (4,75 г, 7,6 ммоль) в этиленгликоле (140 мл) нагревают при температуре 200°С в течение 15 минут. Реакционную смесь затем охлаждают до комнатной температуры, разбавляют дихлорметаном, гасят с помощью насыщенного солевого раствора и выливают в воду. Добавляют несколько капель 3 М раствора NaOH до тех пор, пока рН раствора не достигнет 14, и затем тщательно экстрагируют дихлорметаном. Объединенные органические фазы промывают водой, сушат над безводным Na2SO4, отфильтровывают и концентрируют при пониженном давлении, получая первичный амин 40 (3,8 г, выход: 95%) в виде масла желтого цвета, которое используют без дальнейшей очистки.
1H ЯМР (CDCl3, 300 МГц) δ: 8,66 (д, 1H, J=10,5 Гц), 7,66 (м, 4H), 7,47-7,33 (м, 6H), 6,71 (т, 1H, J=9,3 Гц), 5,53 (т, 1H, J=8,3 Гц), 4,72 (кв, 1H, J=8,4 Гц), 3,83 (м, 1H), 3,19 (с, 1H), 2,22-2,05 (м, 4H), 1,83 (с, 3H), 1,05 (с, 9H), 0,99 (с, 9H).
Пример 7
Синтез фрагмента 45
На схеме 7 представлен пример синтеза фрагмента 45.
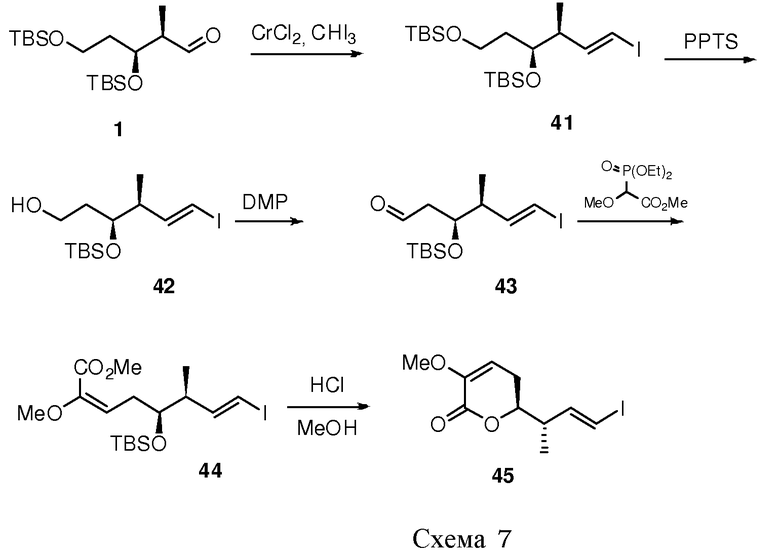
Синтез промежуточного продукта 41
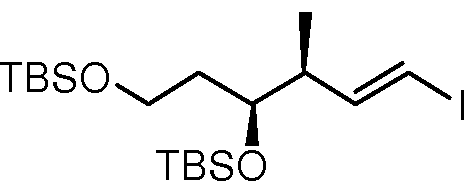
К раствору безводного CrCl2 (2,03 г, 16,55 ммоль) в безводном ТГФ (30 мл), при температуре 0°С, добавляют раствор альдегида 1 (0,995 г, 2,76 ммоль) и иодоформа (2,17 г, 5,52 ммоль) в безводном ТГФ (10 мл). После 4 часов перемешивания при температуре 23°С, смесь разбавляют Et2O и отфильтровывают через целит (Celite®). Фильтрат концентрируют, получая остаток, который очищают с помощью флэш-хроматографии на силикагеле (гексан/дихлорметан = от 50:1 до 5:1), получая винилиодид 41 (0,79 г, выход: 57%) в виде масла слегка желтого цвета.
1H ЯМР (CDCl3, 300 МГц) δ: 6,58 (дд, 1H, J=14,5, 6,7 Гц), 5,98 (дд, 1H, J=14,5, 1,3 Гц ), 3,76-3,70 (м, 1Н), 3,67-3,59 (м, 2H), 2,37-2,32 (м, 1Н), 1,62-1,53 (м, 2H), 0,96 (д, 3H, J=7,2 Гц), 0,89 (м, 18H), 0,04 (м, 12H).
Синтез промежуточного продукта 42
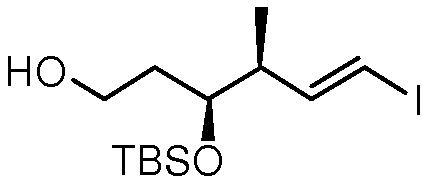
К раствору иодида 41 (786 мг, 1,58 ммоль) в EtOH (15 мл) добавляют пиридиний-п-толуолсульфонат (PPTS) (139 мг, 0,55 ммоль) и реакционную смесь перемешивают при комнатной температуре в течение 25 часов. Затем растворитель удаляют при пониженном давлении и полученное масло очищают с помощью колоночной хроматографии (гексан/EtOAc = 4:1), получая 379,7 мг (выход: 63%) спирта 42 в виде бесцветного масла.
1H ЯМР (CDCl3, 300 М Гц) δ: 6,56 (дд, 1H, J=14,5, 6,7 Гц), 6,01 (дд, 1H, J=14,5, 1,3 Гц ), 3,78-3,3,69 (м, 3H), 2,45-2,39 (м, 1H), 1,87-1,83 (м, 1H), 1,71-1,59 (м, 2H), 1,00 (д, 3H, J=6,6 Гц), 0,90 (с, 9H), 0,09 (с, 3H), 0,07 (с, 3H).
Синтез промежуточного продукта 43
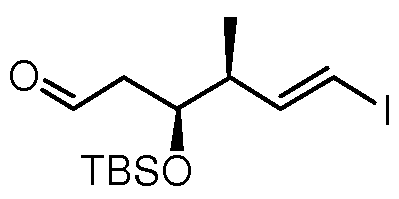
При температуре 0°С, к раствору спирта 42 (389 мг, 1,01 ммоль) в безводном DCM (10 мл) добавляют периодинан Десс-Мартина (644 мг, 1,52 ммоль). После 1 часа перемешивания при температуре 0°С и 30 минут - при температуре 23°С реакционную смесь гасят с помощью насыщенного водного раствора NaHCO3. Органический слой отфильтровывают, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Очищают с помощью колоночной хроматографии (гексан/EtOAc = от 20:1 до 2:1), получая 349,3 мг (выход: 90%) альдегида 43 в виде бесцветного масла.
1H ЯМР (CDCl3, 300 МГц) δ: 9,77 (т, 1H, J=2,1 Гц), 6,52 (дд, 1H, J=14,7, 7,5 Гц), 6,05 (дд, 1Н, J=14,7, 1,2 Гц), 4,12-4,07 (м, 1Н), 2,52-2,47 (м, 2H), 2,43-2,36 (м, 1Н), 0,98 (д, 3H, J=7,2 Гц), 0,87 (с, 9H), 0,07 (с, 3H), 0,03 (с, 3H).
Синтез промежуточного продукта 44
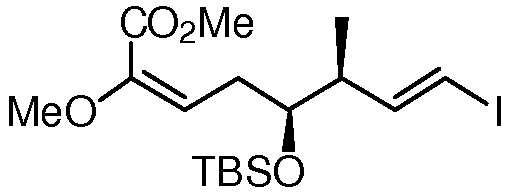
К раствору диэтил(метокси[метоксикарбонил]метил)фосфоната (348,4 мг, 1,37 ммоль) и 18-краун-6 (722,3 мг, 2,73 ммоль) в безводном ТГФ (13 мл), перемешиваемому в атмосфере аргона, при температуре -78°С, по каплям добавляют 0,5 М раствор бис(триметилсилил)амида калия (KHMDS) в толуоле (2,74 мл, 1,37 ммоль). Спустя 15 минут по каплям добавляют альдегид 43 (349,4 мг, 0,91 ммоль) в безводном ТГФ (9 мл) в течение 30 минут и перемешивают при температуре -78°С в течение 90 минут. Затем реакционную смесь гасят с помощью насыщенного водного раствора NH4Cl (20 мл), нагревают до комнатной температуры и разбавляют дихлорметаном (50 мл). Органическую фазу сушат (безводный Na2SO4) и выпаривают при пониженном давлении. Очищают с помощью колоночной хроматографии (гексан/EtOAc = от 30:1 до 5:1), получая 410 мг (выход: 99%) продукта 44 в виде смеси Е/Z-изомеров (региоселективность > 5:1, определенная с помощью 1Н-ЯМР).
1H ЯМР (CDCl3, 300 МГц) для (2Е,7Е)-44 δ: 6,51 (дд, 1Н, J=14,4, 7,8 Гц), 5,97 (дд, 1Н, J=14,4, 1,2 Гц), 5,29 (т, 1Н, J=7,7 Гц), 3,82 (с, 3H), 3,77-3,70 (м, 1Н), 3,60 (с, 3H), 2,65-2,61 (м, 2H), 2,39-2,21 (м, 1Н), 1,00 (д, 3H, J=6,9 Гц), 0,89 (с, 9H), 0,04 (с, 6H).
Синтез промежуточного продукта 45
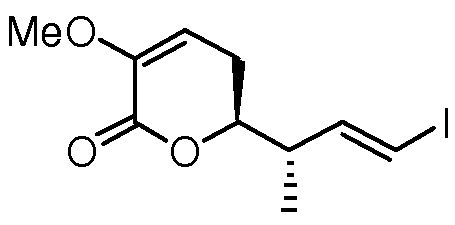
К раствору сложного эфира 44 (410,9 мг, 0,90 ммоль) в МеОН (13,5 мл), при комнатной температуре, добавляют 37%-ный водный раствор HCl (160 мкл) и реакционную смесь перемешивают в течение 6 часов. Затем смесь нейтрализуют с помощью насыщенного водного раствора NaHCO3 (рН=7-8) и органический растворитель выпаривают при пониженном давлении. Полученную суспензию экстрагируют с помощью дихлорметана (4 раза по 20 мл), сушат и выпаривают. Сырой продукт очищают с помощью колоночной хроматографии (гексан/EtOAc = от 10:1 до 2:1), получая 192 мг (выход: 69%) лактона 45 в виде твердого вещества белого цвета.
1H ЯМР (CDCl3, 300 МГц) δ: 6,32 (дд, 1H, J=14,7, 8,4 Гц), 6,21 (дд, 1H, J=14,7, 1,2 Гц), 5,62 (дд, 1H, J=6,6, 2,7 Гц), 4,27-4,19 (м, 1H), 3,64 (с, 3H), 2,61-2,54 (м, 1H), 2,43-2,34 (м, 2H), 1,14 (д, 3H, J=6,9 Гц).
MS (ES) [m/z] = 331,1 [М+Na]+.
Пример 8
Синтез фрагмента 51
На схеме 8 представлен пример синтеза фрагмента 51.
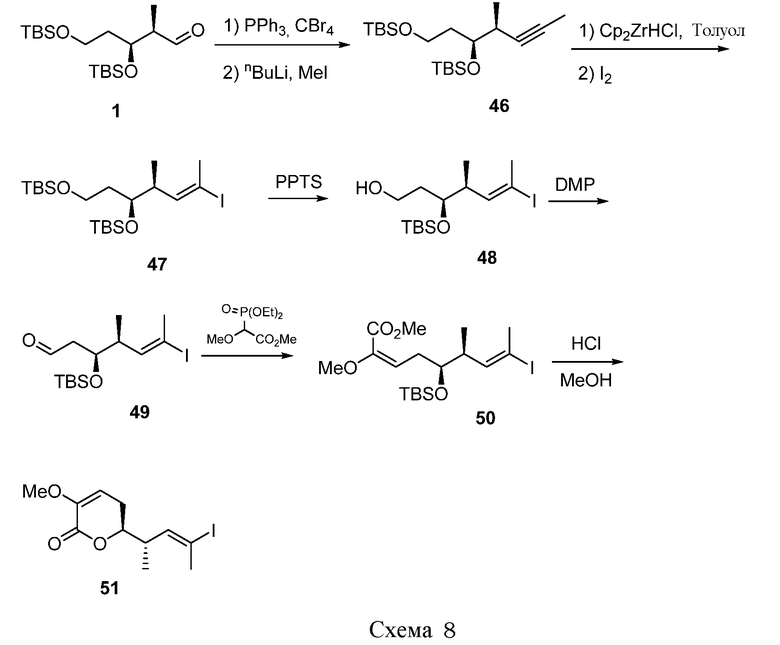
Синтез промежуточного продукта 46
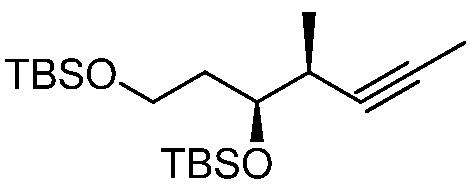
К раствору тетрабромида углерода (8,74 г, 26,35 ммоль) в безводном дихлорметане (26 мл) добавляют по каплям раствор трифенилфосфина (1,38 г, 52,69 ммоль) в безводном DCM (50 мл), при температуре 0°С. Раствор темно-желтого цвета охлаждают до температуры -78°С и быстро добавляют альдегид 1 (4,75 г, 13,2 ммоль) в безводном DCM (13 мл). Полученную смесь перемешивают при температуре -78°С (30 минут) и при температуре 0°С (10 минут). Реакционную смесь разбавляют Et2O и затем промывают с помощью насыщенного солевого раствора. Водный слой экстрагируют Et2O и органические слои объединяют, сушат, отфильтровывают и выпаривают при пониженном давлении. Очищают с помощью флэш-хроматографии (гексан/дихлорметан = 10:1), получая 4,37 г (выход: 66%) винилдибромида в виде бесцветного масла. К раствору дибромолефина в безводном ТГФ (80 мл) добавляют по каплям 2,5 М раствор н-бутиллития в гексане (7,03 мл), при температуре -78°С. Реакционную смесь нагревают до температуры -25°С и перемешивают в течение 1 часа. Реакционную смесь опять охлаждают до температуры -78°С и по каплям добавляют метилиодид (0,55 мл, 8,79 ммоль) в безводном ТГФ (9 мл). Полученную смесь оставляют нагреваться до комнатной температуры и перемешивают еще в течение 1 часа. Реакционную смесь гасят с помощью насыщенного водного раствора NH4Cl, затем разбавляют Et2O. Органический слой сушат, отфильтровывают и выпаривают при пониженном давлении. Очищают с помощью флэш-хроматографии (гексан/дихлорметан = от 50:1 до 5:1), получая 2,77 мг (выход: 89%) алкина 46 в виде бесцветного масла.
1H ЯМР (CDCl3, 300 МГц) δ: 3,74-3,66 (м, 3H), 2,49-2,46 (м, 1H), 1,83-1,72 (м, 2H), 1,78 (с, 3H), 1,08 (д, 3H, J=7,2 Гц), 0,89 (м, 18H), 0,07 (с, 3H), 0,06 (с, 3H), 0,05 (с, 6H).
Синтез промежуточного продукта 47
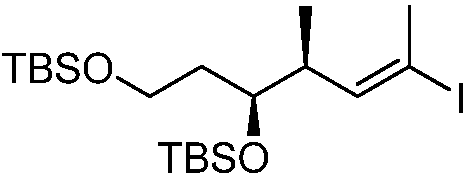
К раствору продукта 46 (200 мг, 0,56 ммоль) в безводном толуоле (7 мл), в атмосфере аргона и при температуре 23°С, добавляют бис(циклопентадиенил)цирконий(IV)-хлоридгидрид (432,3 мг, 1,68 ммоль) и реакционную смесь перемешивают при температуре 50°С в течение 1 часа. По истечении этого времени реакционный раствор становится оранжевого цвета. Реакционную смесь охлаждают до температуры 23°С и в виде одной порции добавляют иод (284,3 мг, 1,12 ммоль). Продолжают перемешивать в течение 30 минут при комнатной температуре и реакционную смесь разбавляют гексаном и отфильтровывают через целит (Celite®). Фильтрат концентрируют, получая остаток, который очищают с помощью флэш-хроматографии, элюируя смесью гексан/дихлорметан (от 10:1 до 1:2), получая винилиодид 47 (140,4 мг, выход: 49%) в виде масла бледно-желтого цвета.
1H ЯМР (CDCl3, 300 МГц) δ: 6,07 (дд, 1H, J=9,9, 1,5 Гц), 3,72-3,67 (м, 1H), 3,65-3,61 (т, 2H, J=6,6 Гц), 2,53-2,47 (м, 1H), 2,37 (с, 3H), 1,68-1,61 (м, 2H), 0,92 (д, 3H, J=6,6 Гц), 0,89 (м, 18H), 0,05 (м, 12H).
Синтез промежуточного продукта 48
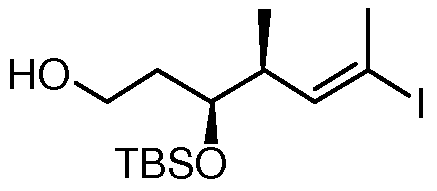
К раствору иодида 47 (140,4 мг, 0,27 ммоль) в EtOH (2 мл) добавляют пиридиний-п-толуолсульфонат (PPTS) (24 мг, 0,09 ммоль) и реакционную смесь перемешивают при комнатной температуре в течение 25 часов. Затем растворитель удаляют при пониженном давлении и полученное масло очищают с помощью колоночной хроматографии (гексан/EtOAc = 4:1), получая 90,3 мг (выход: 83%) спирта 48 в виде бесцветного масла.
1Н ЯМР (CDCl3, 300 МГц) δ: 6,01 (дд, 1H, J=9,9, 1,5 Гц), 3,78-3,67 (м, 3H), 2,62-2,55 (м, 1H), 2,39 (с, 3H), 2,00-1,98 (м, 1H), 1,80-1,62 (м, 2H), 0,96 (д, 3H, J=6,6 Гц), 0,89 (с, 9H), 0,09 (с, 3H), 0,08 (с, 3H).
Синтез промежуточного продукта 49
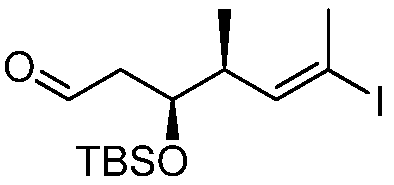
К охлажденному до температуры 0°С раствору спирта 48 (87 мг, 0,22 ммоль) в безводном DCM (2 мл) добавляют периодинан Десс-Мартина (140 мг, 0,33 ммоль). После перемешивания в течение 1 часа при температуре 0°С и в течение 30 минут - при температуре 23°С, реакционную смесь гасят с помощью насыщенного водного раствора NaHCO3. Органический слой отфильтровывают, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Очищают с помощью колоночной хроматографии (гексан/EtOAc = от 20:1 до 2:1), получая 76,6 мг (выход: 86%) альдегида 49 в виде бесцветного масла.
1H ЯМР (CDCl3, 300 МГц) δ: 9,79 (т, 1H, J=2,4 Гц), 5,98 (дд, 1H, J=9,9, 1,5 Гц), 4,02-3,97 (м, 1H), 2,57-2,51 (м, 3H), 2,38 (с, 3H), 0,97 (д, 3H, J=6,6 Гц), 0,87 (с, 9H), 0,08 (с, 3H), 0,04 (с, 3H).
13С-ЯМР (CDCl3, 75 МГц) δ: 201,5, 143,5, 95,1, 71,3, 49,3, 41,9, 28,3, 26,0, 18,2, 15,8, -4,2, -4,4.
Синтез промежуточного продукта 50
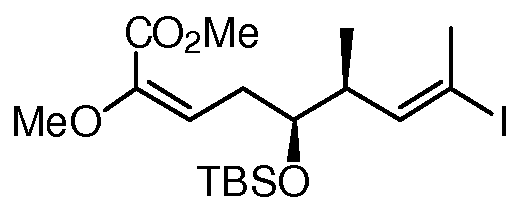
К раствору диэтил(метокси[метоксикарбонил]метил)фосфоната (73,7 мг, 0,29 ммоль) и 18-краун-6 (153,4 мг, 0,58 ммоль) в безводном ТГФ (3 мл), перемешиваемому в атмосфере аргона, при температуре -78°С, по каплям добавляют 0,5 М раствор бис(триметилсилил)амида калия (KHMDS) в толуоле (0,58 мл, 0,29 ммоль). Спустя 15 минут по каплям добавляют альдегид 49 (76,6 мг, 0,19 ммоль) в безводном ТГФ (2 мл), в течение 10 минут и перемешивают при температуре -78°С в течение 90 минут. Затем реакционную смесь гасят с помощью насыщенного водного раствора NH4Cl, нагревают до комнатной температуры и разбавляют дихлорметаном. Органическую фазу сушат (безводный Na2SO4) и выпаривают при пониженном давлении. Очищают с помощью колоночной хроматографии (гексан/EtOAc = от 30:1 до 5:1), получая 89,0 мг (выход: 100%) продукта 50 в виде смеси Е/Z-изомеров (региоселективность >2,5:1, определенная с помощью 1Н-ЯМР), в виде бесцветной маслянистой смеси.
1H ЯМР (CDCl3, 300 МГц) для (2E,7E)-50 δ: 6,28 (д, 1H, J=9,0 Гц), 5,33 (т, 1H, J=9,0 Гц), 3,84 (с, 3H), 3,61-3,57 (м, 1H), 3,61 (с, 3H), 2,77-2,70 (м, 1H), 2,64-2,55 (м, 1H), 2,49-2,37 (м, 1H), 2,30 (с, 3H), 0,96 (д, 3H, J=6,6 Гц), 0,89 (с, 9H), 0,06 (с, 3H), 0,05 (с, 3H).
Синтез промежуточного продукта 51
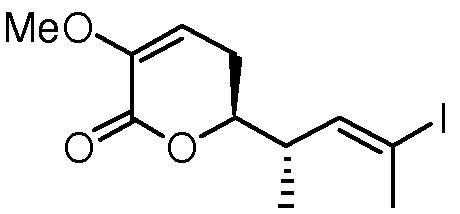
К раствору сложного эфира 50 (90,8 мг, 0,19 ммоль) в МеОН (3 мл), при комнатной температуре, добавляют 37%-ный водный раствор HCl (34 мкл) и реакционную смесь перемешивают в течение 6 часов. Затем смесь нейтрализуют с помощью насыщенного водного раствора NaHCO3 (рН=7-8) и органический растворитель выпаривают при пониженном давлении. Полученную суспензию экстрагируют дихлорметаном, сушат и выпаривают. Сырой продукт очищают с помощью колоночной хроматографии (гексан/EtOAc = 10:1 до 2:1), получая 34 мг (выход: 50%) лактона 51 в виде твердого вещества белого цвета.
1Н ЯМР (CDCl3, 300 МГц) δ: 5,99 (дд, 1H, J=9,9, 1,2 Гц), 5,62 (дд, 1H, J=5,1, 4,2 Гц), 4,19-4,11 (м, 1H), 3,64 (с, 3H), 2,78-2,70 (м, 1H), 2,41 (с, 3H), 2,42-2,37 (м, 2H), 1,11 (д, 3H, J=6,6 Гц).
Пример 9
Синтез фрагмента 56
На схеме 9 представлен пример синтеза фрагмента 56.
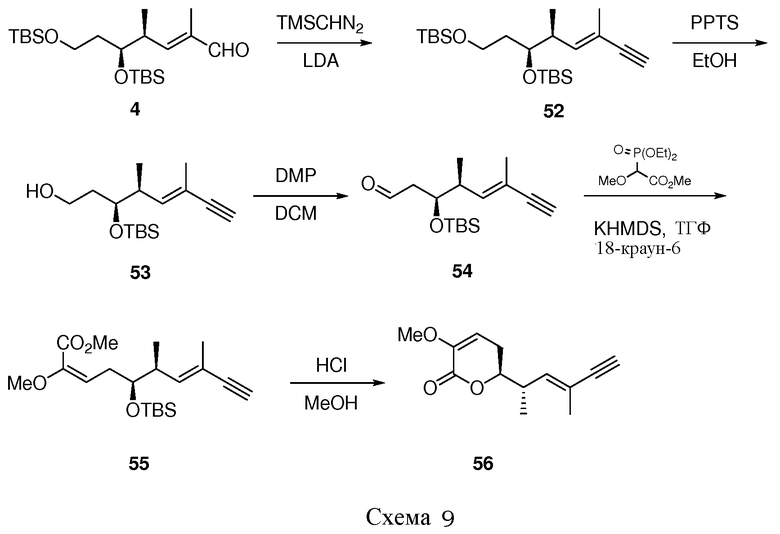
Синтез промежуточного продукта 52
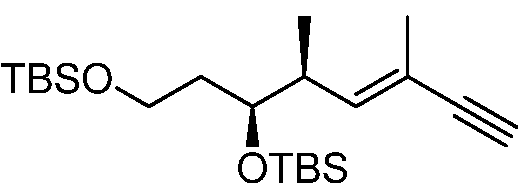
1,8 М Раствор литийдиизопропиламида в смеси гептан/ТГФ/этилбензол (8,96 мл, 16,13 ммоль) разбавляют с помощью 88 мл безводного ТГФ. После охлаждения до температуры -78°С добавляют триметилсилилдиазометан (8,06 мл, 2 М раствор в ТГФ, 16,13 ммоль) и полученную смесь перемешивают в течение 30 минут. Добавляют раствор продукта 4 (4,377 г, 10,75 ммоль) в безводном ТГФ (35 мл) и оставляют перемешиваться в течение 1 часа при температуре -78°С и в течение 2 часов - при температуре 23°С. Реакционную смесь добавляют к смеси воды со льдом и экстрагируют Et2O. Объединенные органические слои сушат (безводный Na2SO4) и растворитель удаляют. Остаток очищают с помощью флэш-хроматографии, получая 2,38 г (выход: 55%) продукта 52 в виде масла желтого цвета.
1H ЯМР (CDCl3, 300 МГц) δ: 5,86 (д, 1H, J=9,9 Гц), 3,73-3,63 (м, 3H), 2,74 (с, 1Н), 2,58-2,50 (м, 1Н), 1,80 (с, 3H), 1,70-1,63 (м, 2H), 0,93 (д, 3H, J=6,6 Гц), 0,88 (м, 18H), 0,04 (м, 12H).
13С-ЯМР (CDCl3, 75 МГц) δ: 143,3, 116,3, 87,1, 73,7, 72,8, 60,0, 38,6, 38,0, 26,1, 26,1, 18,5, 18,3, 17,4, 15,3, -4,2, -5,1.
Синтез промежуточного продукта 53
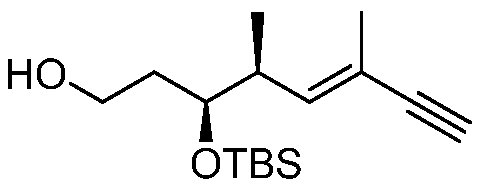
К раствору продукта 52 (2,05 г, 5,17 ммоль) в EtOH (50 мл) добавляют пиридиний-п-толуолсульфонат (PPTS) (511,7 мг, 2,04 ммоль) и реакционную смесь перемешивают при комнатной температуре в течение 25 часов. Затем растворитель удаляют при пониженном давлении и полученное масло очищают с помощью колоночной хроматографии (гексан/EtOAc = 4:1), получая 1,055 г (выход: 72%) спирта 53 в виде бесцветного масла.
1H ЯМР (CDCl3, 300 МГц) δ: 5,76 (д, 1Н, J=9,9 Гц), 3,73-3,63 (м, 3H), 2,79 (с, 1Н), 2,64-2,59 (м, 1Н), 2,24 (уш.с, 1Н), 1,80 (с, 3H), 1,70-1,60 (м, 2H), 0,95 (д, 3H, J=6,9 Гц), 0,88 (с, 9H), 0,08 (с, 3H), 0,06 (с, 3H).
Синтез промежуточного продукта 54
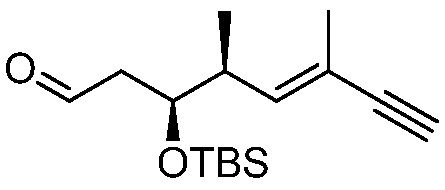
К охлажденному до температуры 0°С раствору спирта 53 (140 мг, 0,48 ммоль) в безводном DCM (5 мл) добавляют периодинан Десс-Мартина (308,5 мг, 0,73 ммоль). После перемешивания в течение 30 минут при температуре 0°С и в течение 60 минут - при температуре 23°С реакционную смесь гасят с помощью насыщенного водного раствора NaHCO3. Органический слой отфильтровывают, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Очищают с помощью колоночной хроматографии (гексан/дихлорметан = от 5:1 до 1:1), получая 100 мг (выход: 73%) альдегида 54 в виде бесцветного масла.
1H ЯМР (CDCl3, 300 МГц) δ: 9,79 (т, 1H, J=2,4 Гц), 5,72 (д, 1H, J=10,2 Гц), 4,02-3,96 (м, 1H), 2,77 (с, 1H), 2,64-2,53 (м, 3H), 1,80 (с, 3H), 0,98 (д, 3H, J=6,9 Гц), 0,87 (с, 9H), 0,08 (с, 3H), 0,04 (с, 3H).
13С-ЯМР (CDCl3, 75 МГц) δ: 201,7, 141,2, 117,9, 86,6, 74,5, 71,8, 49,4, 39,7, 26,0, 18,2, 17,6, 16,2, -4,3, -4,4.
Синтез промежуточного продукта 55
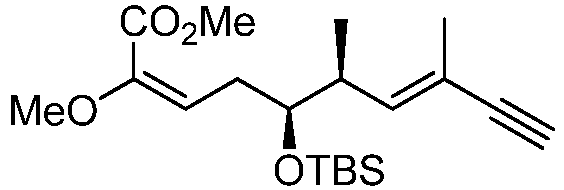
К раствору диэтил(метокси[метоксикарбонил]метил)фосфоната (768,6 мг, 3,02 ммоль) и 18-краун-6 (1,60 г, 6,06 ммоль) в безводном ТГФ (30 мл), перемешиваемому в атмосфере аргона, при температуре -78°С, по каплям добавляют 0,5 М раствор бис(триметилсилил)амида калия (KHMDS) в толуоле (6,1 мл, 3,05 ммоль). Спустя 15 минут по каплям добавляют альдегид 54 (578 мг, 2,02 ммоль) в безводном ТГФ (20 мл) в течение 10 минут и перемешивают при температуре -78°С в течение 90 минут. Затем реакционную смесь гасят с помощью насыщенного водного раствора NH4Cl, нагревают до комнатной температуры и разбавляют дихлорметаном. Органическую фазу сушат (безводный Na2SO4) и выпаривают при пониженном давлении. Очищают с помощью колоночной хроматографии (гексан/EtOAc = от 30:1 до 5:1), получая 839,4 мг (выход: >100%) продукта 55 в виде бесцветной маслянистой смеси Е/Z-изомеров (региоселективность >4:1, определенная с помощью 1Н-ЯМР).
1H ЯМР (CDCl3, 300 МГц) для (2Е,7Е)-55 δ: 5,73 (д, 1H, J=9,9 Гц), 5,33 (дд, 1Н, J=7,8, 6,9 Гц), 3,80 (с, 3H), 3,61-3,57 (м, 1Н), 3,59 (с, 3H), 2,77-2,68 (м, 1Н), 2,73 (уш.с, 1Н), 2,58-2,44 (м, 2H), 1,72 (уш.с, 3H), 0,95 (д, 3H, J=6,6 Гц), 0,85 (с, 9H), 0,05 (с, 3H), 0,04 (с, 3H).
Синтез промежуточного продукта 56
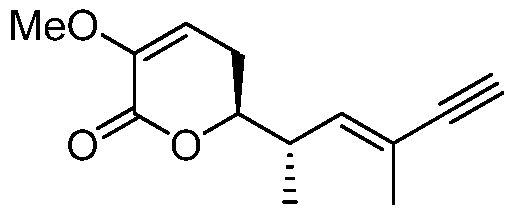
К раствору сложного эфира 55 (839,4 мг, 2,29 ммоль) в МеОН (30 мл), при комнатной температуре, добавляют 37%-ный водный раствор HCl (766 мкл, 9,16 ммоль) и реакционную смесь перемешивают в течение 4 часов. Затем смесь нейтрализуют с помощью насыщенного водного раствора NaHCO3 (рН=7-8) и органический растворитель выпаривают при пониженном давлении. Полученную суспензию экстрагируют с помощью дихлорметана, сушат и выпаривают. Сырой продукт очищают с помощью колоночной хроматографии (гексан/EtOAc = от 10:1 до 1:3), получая 312,7 мг (выход: 62%) лактона 56 в виде твердого вещества белого цвета.
1Н ЯМР (CDCl3, 300 МГц) δ: 5,72 (дд, 1Н, J=10,2, 1,8 Гц), 5,60 (дд, 1Н, J=5,1, 4,2 Гц), 4,20-4,10 (м, 1Н), 3,64 (с, 3H), 2,85-2,2,77 (м, 1Н), 2,81 (с, 1Н), 2,41-2,36 (м, 2H), 1,84 (с, 3H), 1,13 (д, 3H, J=6,9 Гц).
13С-ЯМР (CDCl3, 125 МГц) δ: 161,3, 145,1, 138,6, 118,9, 108,0, 85,9, 81,3, 74,8, 55,4, 37,2, 26,2, 17,5, 16,2.
MS (ES) [m/z] = 243,2 [М+Na]+.
Пример 10
Синтез фрагмента 62
На схеме 10 представлен пример синтеза фрагмента 62.
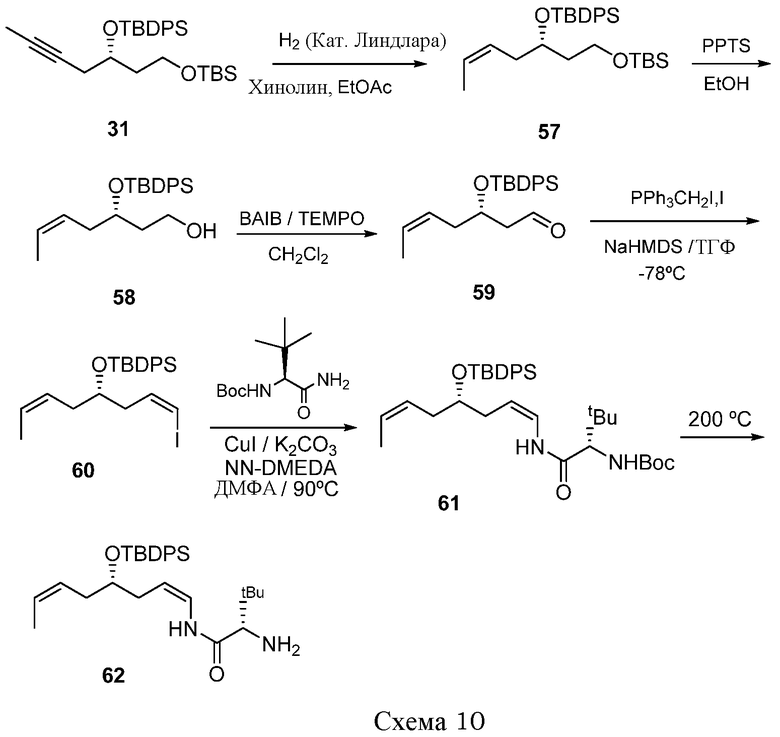
Синтез промежуточного продукта 57
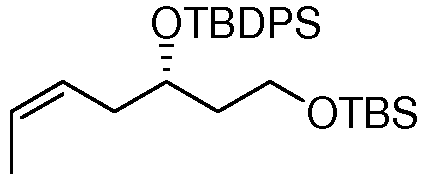
В колбе, содержащей смесь 31 (4,73 г, 9,85 ммоль), хинолин (0,582 мл, 4,92 ммоль) и катализатор Линдлара (2,18 г), в этилацетате, создают вакуум и заполняют водородом. Реакционную смесь перемешивают при комнатной температуре в атмосфере водорода (1 атм) в течение 2 часов и затем отфильтровывают через слой целита. Слой целита промывают с помощью этилацетата и объединенные фильтраты промывают с помощью 0,1%-ного раствора HCl. Органический слой сушат над безводным Na2SO4, отфильтровывают и концентрируют, получая промежуточный продукт 57 (4,27 г, выход: 90%) в виде бесцветного масла, которое используют без дальнейшей очистки.
1H ЯМР (CDCl3, 300 МГц) δ: 7,70-7,67 (м, 4H), 7,44-7,36 (м, 6H), 5,48 (м, 1H), 5,36-5,27 (м, 1H), 3,95-3,87 (м, 1H), 3,71-3,55 (м, 2H), 2,16 (дд, 2H, J=6,9, 6,3 Гц), 1,73-1,66 (м, 2H), 1,41 (дд, 3H, J=6,6, 1,2 Гц), 1,05 (с, 9H), 0,84 (с, 9H), -0,02 (с, 6H).
13С-ЯМР (CDCl3, 75 МГц) δ: 136,2, 134,8, 129,8, 127,8, 126,4, 125,8, 70,9, 60,4, 39,6, 34,8, 27,3, 26,2, 19,7, 18,5, 13,1, -5,1.
Синтез промежуточного продукта 58
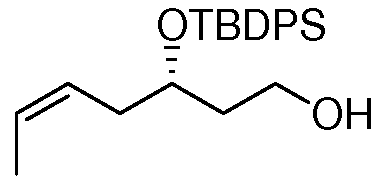
PPTS (837,7 мг, 3,33 ммоль) добавляют, в виде одной порции, к раствору продукта 57 (4 г, 8,33 ммоль) в этаноле (80 мл). Реакционную смесь перемешивают при комнатной температуре в течение 7 часов и затем концентрируют. Остаток разбавляют DCM и промывают с помощью насыщенного раствора NaHCO3. Органический слой извлекают, сушат над безводным Na2SO4, отфильтровывают и концентрируют. Осуществляют флэш-хроматографию (гексан/EtOAc = 95:1), получая силильный эфир 58 (2,12 г, выход: 69%) в виде бесцветного масла.
1H ЯМР (CDCl3, 300 МГц) δ: 7,73-7,69 (м, 4H), 7,44-7,36 (м, 6H), 5,44-5,38 (м, 1H), 5,21-5,17 (м, 1H), 4,01-3,94 (м, 1H), 3,84-3,76 (м, 1H), 3,69-3,64 (м, 1H), 2,32-2,14 (м, 2H), 1,89-1,78 (м, 1H), 1,70-1,60 (м, 1H), 1,37 (д, 3H, J=6,9 Гц), 1,07 (с, 9H).
13С-ЯМР (CDCl3, 75 МГц) δ: 136,2, 134,1, 130,0, 127,8, 126,3, 125,9, 72,3, 60,1, 37,7, 34,3, 27,2, 19,5, 13,0.
Синтез промежуточного продукта 59
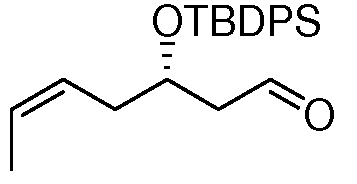
BAIB (1,97 г, 6,11 ммоль) добавляют к раствору спирта 58 (2,05 г, 5,56 ммоль) и ТЕМРО (86,87 мг, 0,56 ммоль) в 25 мл DCM. Реакционную смесь перемешивают при комнатной температуре в течение 16-18 часов, пока спирт больше не будет обнаруживаться (ТСХ), и затем ее гасят с помощью насыщенного водного раствора NH4Cl и экстрагируют DCM. Объединенные органические фазы сушат над безводным Na2SO4, отфильтровывают и концентрируют. Остаток очищают с помощью флэш-хроматографии (гексан/DCM = от 5:1 до 1:2), получая продукт 59 (1,733 мг, выход: 79%) в виде бесцветного масла.
1H ЯМР (CDCl3, 300 МГц) δ: 9,72 (т, 1H, J=2,7 Гц), 7,74-7,67 (м, 4H), 7,48-7,37 (м, 6H), 5,56-5,45 (м, 1H), 5,32-5,23 (м, 1H), 4,29-4,20 (м, 1H), 2,51-2,48 (м, 2H), 2,31-2,27 (м, 2H), 1,43 (дд, 3H, J=6,9, 1,5 Гц), 1,06 (с, 9H).
13С-ЯМР (CDCl3, 75 МГц) δ: 202,3, 136,1, 134,0, 130,1, 127,9, 127,4, 125,1, 69,4, 50,1, 35,1, 27,2, 19,5, 13,1.
Синтез промежуточного продукта 60
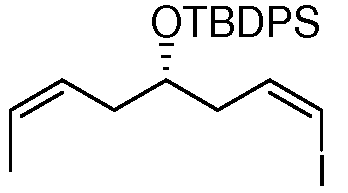
К суспензии иодметилтрифенилфосфорана (3,32 г, 6,38 ммоль) в безводном ТГФ (60 мл), при комнатной температуре, медленно добавляют 6,83 мл 1 М раствора NaHMDS (6,38 ммоль) в ТГФ. После перемешивания в течение 2 минут, смесь желтого цвета охлаждают до температуры -78°С и затем добавляют раствор продукта 59 (1,67 г, 4,56 ммоль) в безводном ТГФ (40 мл). Реакционную смесь перемешивают при температуре -78°С в течение 90 минут, затем при комнатной температуре - в течение 5 минут, разбавляют гексаном и отфильтровывают через слой целит/SiO2. Слой целит/SiO2 промывают с помощью смеси гексан/EtOAc (от 10:1 до 5:1), получая соединение 60 (2 г, выход: 89%) в виде бесцветного масла, которое используют без дальнейшей очистки.
1H ЯМР (CDCl3, 300 МГц) δ: 7,70-7,66 (м, 4H), 7,45-7,34 (м, 6H), 6,21-6,31 (м, 2H), 5,49-5,43 (м, 1H), 5,35-5,27 (м, 1H), 3,94-3,75 (м, 1H), 2,30-2,27 (м, 2H), 2,24-2,04 (м, 2H), 1,43 (д, 3H, J=6,6 Гц), 1,06 (с, 9H).
13С-ЯМР (CDCl3, 75 МГц) δ: 138,2, 136,2, 134,3, 129,9, 127,8, 126,4, 126,0, 84,1, 71,9, 41,6, 34,5, 27,2, 19,6, 13,2.
Синтез промежуточного продукта 61
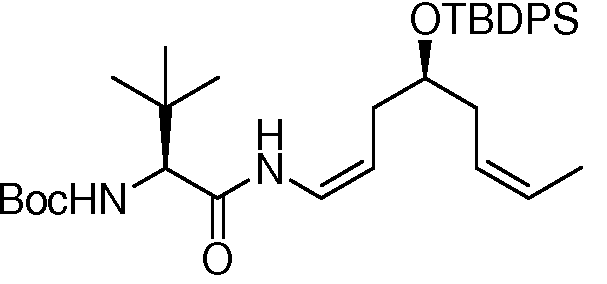
В герметично закрываемую пробирку Шленка вводят иодид меди-(I) (232,4 мг, 1,22 ммоль), карбонат калия (1,688 г, 12,23 ммоль) и Вос-трет-LeuCONH2 (2,474 г, 6,12 ммоль), создают вакуум и заполняют аргоном. Добавляют N,N'-диметилэтилендиамин (0,26 мл, 2,45 ммоль), винилиодид 60 (2 г, 4,08 ммоль) и безводный ДМФА (35 мл), в атмосфере аргона. Пробирку Шленка герметично закрывают, нагревают при температуре 90°С в течение 18 часов и охлаждают до комнатной температуры. Полученную смесь разбавляют EtOAc и гасят водой. Органический слой промывают водой и сушат над безводным Na2SO4. Растворитель удаляют при пониженном давлении и остаток очищают с помощью флэш-хроматографии на силикагеле (гексан/EtOAc = от 20:1 до 15:1). Промежуточный продукт 61 (1,06 г, выход: 44%) получают в виде масла.
1Н ЯМР (CDCl3, 300 МГц) δ: 7,70-7,67 (м, 4H), 7,43-7,35 (м, 6H), 7,13 (д, 1H, J=10,5 Гц), 6,67 (дд, 1H, J=10,2, 9,6 Гц), 5,56-5,45 (м, 1H), 5,36-5,28 (м, 2H), 4,86-4,78 (м, 2H), 3,88-3,77 (м, 1H), 2,26-2,04 (м, 4H), 1,44 (д, 3H, J=6,9 Гц), 1,43 (с, 9H), 1,06 (с, 9H), 0,96 (с, 9H).
Синтез промежуточного продукта 62
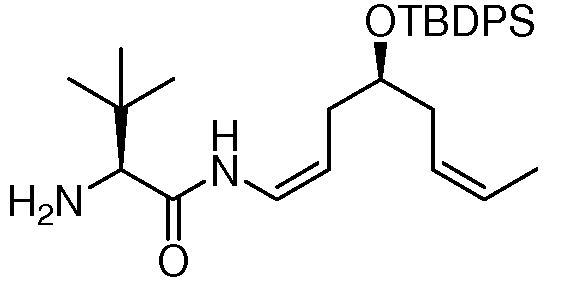
Раствор защищенного аминопроизводного 61 (847 мг, 1,43 ммоль) в этиленгликоле (50 мл) нагревают при температуре 200°С в течение 10-20 минут. Реакционную смесь затем охлаждают до комнатной температуры, разбавляют DCM, гасят с помощью насыщенного солевого раствора и выливают в воду. Добавляют несколько капель 3 М раствора NaOH до тех пор, пока рН раствора не достигнет 14, и затем тщательно экстрагируют DCM. Объединенные органические фазы сушат над безводным Na2SO4, отфильтровывают и концентрируют в вакууме, получая первичный амин 62 (435 мг, выход: 62%) в виде пены белого цвета, после очистки с помощью флэш-хроматографии (гексан/EtOAc = от 10:1 до 1:2).
1H ЯМР (CDCl3, 300 МГц) δ: 8,50 (д, 1H, J=10,8 Гц), 7,70-7,66 (м, 4H), 7,45-7,33 (м, 6H), 6,67 (дд, 1H, J=11,1, 9,3 Гц), 5,48-5,40 (м, 1H), 5,36-5,28 (м, 1H), 4,79 (дд, 1H, J=16,2, 7,5 Гц), 3,87-3,79 (м, 1H), 3,08 (с, 1H), 2,22-2,14 (м, 4H), 1,43 (д, 3H, J=6,9 Гц), 1,05 (с, 9H), 0,97 (с, 9H).
13С-ЯМР (CDCl3, 75 МГц) δ: 171,0, 136,1, 134,5, 129,8, 127,8, 126,3, 126,2, 122,1, 107,6, 72,6, 64,4, 34,0, 34,4, 32,8, 27,2, 26,9, 19,6, 13,2.
Пример 11
Синтез фрагмента 63
На схеме 11 представлен пример синтеза фрагмента 63.
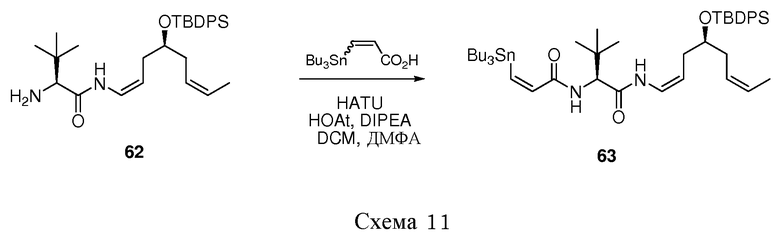
Синтез промежуточного продукта 63
К раствору амина 62 (575 мг, 1,17 ммоль) в безводной смеси DCM/ДМФА (4:1, 12,5 мл) добавляют раствор (Z)-3-трибутилстаннилакриловой кислоты (505,6 мг, 1,4 ммоль) в безводном DCM, в атмосфере аргона, и затем охлаждают до температуры 0°С. К раствору добавляют DIPEA (0,243 мл, 1,76 моль), 7-гидроксибензотриазол (HOBt) (189,2 мг, 1,4 ммоль) и HATU (532,28 мг, 1,4 ммоль), и, спустя 30 минут, охлаждающую баню отставляют. Реакционную смесь перемешивают при комнатной температуре в течение 2 часов, гасят с помощью насыщенного водного раствора NH4Cl, выливают в воду и экстрагируют DCM. Объединенные органические фазы сушат над безводным Na2SO4, отфильтровывают и концентрируют. Остаток очищают с помощью флэш-хроматографии (гексан/EtOAc = от 20:1 до 15:1), получая амид 63 (780,4 мг, выход: 77%) в виде пены белого цвета.
1Н ЯМР (CDCl3, 300 МГц) δ: 7,70-7,68 (м, 4H), 7,43-7,36 (м, 6H), 7,02 (д, 1H, J=12,3 Гц), 7,00 (д, 1H, J=10,8 Гц), 6,75 (д, 1H, J=12,3 Гц), 6,66 (т, 1H, J=9,3 Гц), 6,26 (д, 1H, J=9,6 Гц), 5,57-5,34 (м, 1H), 5,38-5,28 (м, 1H), 4,83 (дд, 1H, J=16,5, 7,8 Гц), 4,31 (д, 1H, J=9,6 Гц), 3,89-3,82 (м, 1H), 2,26-2,02 (м, 4H), 1,50-1,42 (м, 6H), 1,43 (д, 3H, J=6,9 Гц), 1,33-1,20 (м, 6H), 1,06 (с, 9H), 0,96 (с, 9H), 0,95-0,83 (м, 15H).
13С-ЯМР (CDCl3, 75 МГц) δ: 168,0, 166,2, 153,8, 136,3, 136,1, 134,3, 130,0, 127,8, 126,7, 126,0, 121,6, 109,0, 72,6, 60,7, 35,7, 34,0, 32,7, 29,5, 27,7, 27,2, 26,7, 19,5, 14,0, 13,2, 11,8.
Пример 12
На схеме 12 представлен синтез некоторых соединений согласно данному изобретению.
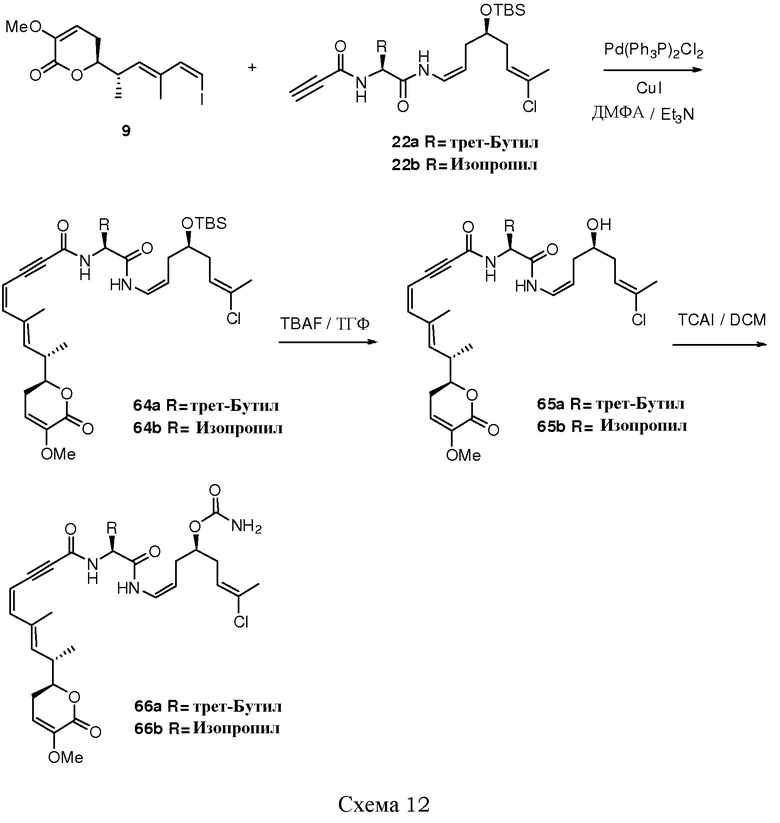
Синтез промежуточного продукта 64а
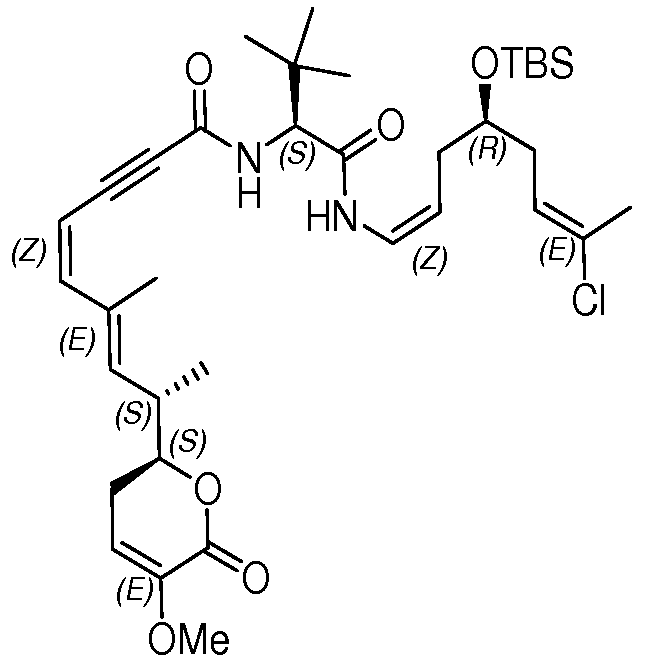
К раствору иодистого соединения 9 (11 мг, 0,033 ммоль) в смеси ДМФА/Et3N (0,25 мл и 0,05 мл), в атмосфере азота, при температуре -20°С, добавляют Pd(Ph3P)2Cl2 (2,3 мг, 0,0033 ммоль) и CuI (1,9 мг, 0,01 ммоль). Затем добавляют соединение 22а (15 мг, 0,03 ммоль в 0,1 мл ДМФА) и реакционную смесь перемешивают при температуре от -20°С до комнатной температуры в течение 3 часов. Сырой продукт гасят водой и экстрагируют с помощью этилацетата. Органическую фазу сушат (безводный Na2SO4) и выпаривают при пониженном давлении. Очищают с помощью колоночной хроматографии (смесь этилацетат/гексаны), получая чистое соединение 64а (10 мг, выход: 46%).
1H ЯМР (CDCl3, 300 МГц) δ: 7,75 (д, 1H, J=10,5 Гц), 6,70 (т, 1H, J=10,2 Гц), 6,50 (д, 1H J=9,3 Гц), 6,38 (д, 1H, J=12,3 Гц), 5,60 (м, 3H), 5,45 (д, 1H, J=12,0 Гц), 4,87 (кв, 1H, J=8,1 Гц), 4,37 (д, 1H, J=9,3 Гц), 4,21 (м, 1H), 3,77 (м, 1H), 3,64 (с, 3H), 2,87 (м, 1H), 2,40 (м, 2H), 2,20 (м, 4H), 2,09 (с, 3H), 2,01 (с, 3H), 1,15 (д, 3H, J=6,6 Гц), 1,02 (с, 9H), 0,89 (с, 9H), 0,07 (с, 3H), 0,05 (с, 3H).
Синтез промежуточного продукта 64b
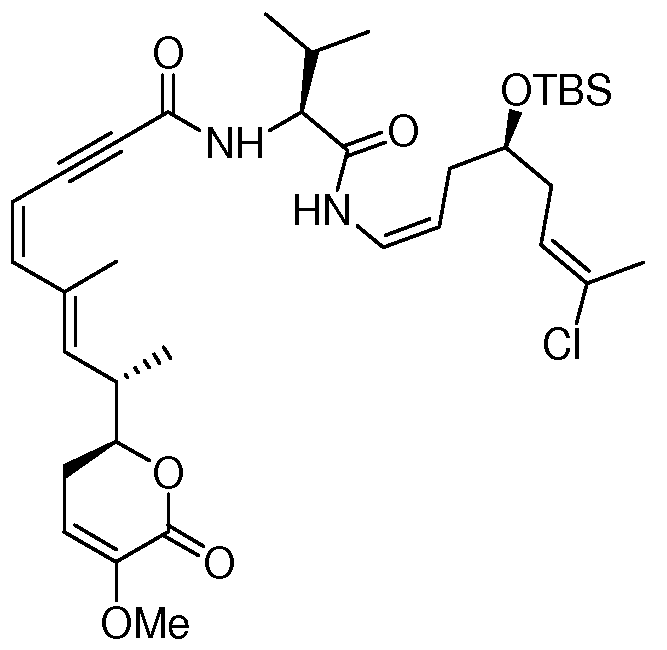
К раствору соединения 9 (40 мг, 0,113 ммоль) в смеси ДМФА/Et3N (1 мл и 0,19 мл), при температуре -20°С, добавляют Pd(Ph3P)2Cl2 (7,9 мг, 0,113 ммоль) и CuI (6,5 мг, 0,034 ммоль). Затем добавляют соединение 22b (50 мг, 0,113 ммоль в 0,4 мл ДМФА) и реакционную смесь перемешивают при температуре от -20°С до комнатной температуры, в течение 3 часов. Сырую смесь гасят водой и экстрагируют с помощью этилацетата. Органическую фазу сушат (безводный Na2SO4) и выпаривают при пониженном давлении. Очищают с помощью колоночной хроматографии (смесь этилацетат/гексаны), получая чистый продукт 64b (40 мг, выход: 54%).
1Н ЯМР (CDCl3, 300 МГц) δ: 7,77 (д, 1H, J=11,4 Гц), 6,75 (т, 1H, J=10,2 Гц), 6,41-6,36 (м, 2H), 5,64-5,56 (м, 3H), 5,46 (д, 1H, J=11,7 Гц), 4,86 (кв, 1H, J=8,1 Гц), 4,31 (дд, 1H, J=8,4; 6,6 Гц), 4,25-4,16 (м, 1H), 3,84-3,76 (м, 1H), 3,65 (с, 3H), 2,92-2,81 (м, 1H), 2,44-2,39 (м, 2H), 2,22-2,12 (м, 5H), 2,10 (с, 3H), 2,03 (с, 3H), 1,16 (д, 3H, J=6,6 Гц), 0,99 (дд, 6H, J=9,3; 6,9 Гц), 0,89 (с, 9H), 0,0080 (с, 3H), 0,0064 (с, 3H).
Синтез соединения 65а
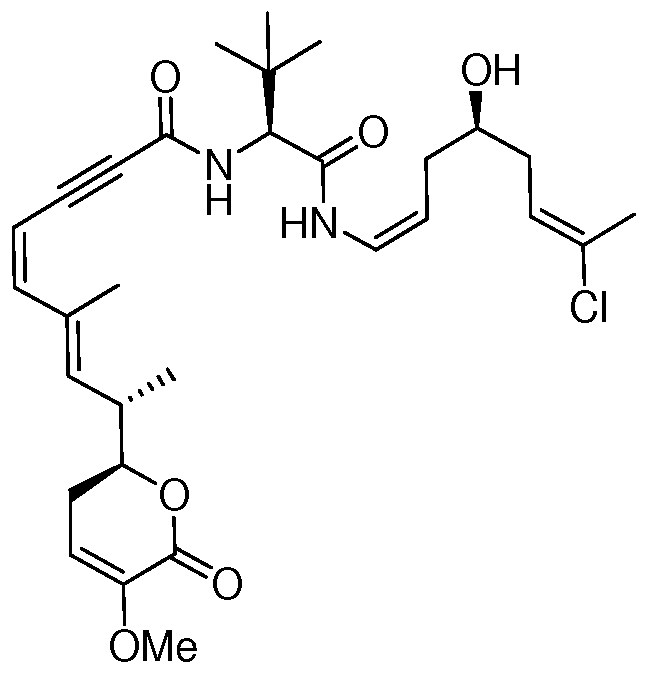
К раствору продукта 64а (15 мг, 0,022 ммоль) в безводном ТГФ (0,5 мл), в атмосфере азота и при комнатной температуре, добавляют 1 М раствор TBAF в ТГФ (0,044 мл, 0,044 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 18 часов и затем гасят с помощью насыщенного водного раствора NH4Cl и экстрагируют EtOAc. Объединенные органические фазы сушат над безводным Na2SO4, отфильтровывают и концентрируют. Остаток очищают с помощью флэш-хроматографии (гексан/EtOAc = от 3:1 до 1:2), получая спирт 65а (5 мг, выход: 42%).
1H ЯМР (CDCl3, 300 МГц) δ: 8,78 (д, 1H, J=9,6 Гц), 6,77 (т, 1H, J=9,0 Гц), 6,57 (д, 1Н J=9,0 Гц), 6,38 (д, 1Н, J=12,3 Гц), 5,60 (м, 3H), 5,45 (д, 1Н, J=12,0 Гц), 4,90 (кв, 1Н, J=8,7 Гц), 4,29 (д, 1Н, J=9,6 Гц), 4,23 (м, 1Н), 3,80 (м, 1Н), 3,65 (с, 3H), 2,86 (м, 1Н), 2,66 (уш.с, 1Н), 2,40 (м, 2H), 2,21 (м, 4H), 2,07 (с, 3H), 2,04 (с, 3H), 1,15 (д, 3H, J=6,6 Гц), 1,02 (с, 9H).
Синтез соединения 65b
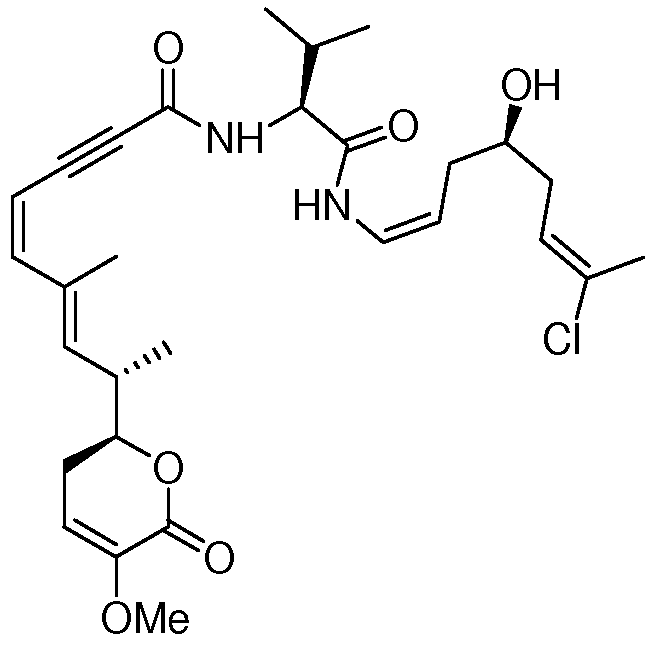
К раствору продукта 64b (40 мг, 0,06 ммоль) в безводном ТГФ (0,9 мл), в атмосфере азота и при комнатной температуре, добавляют 1 М раствор TBAF в ТГФ (0,12 мл, 0,067 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 16 часов, затем гасят с помощью NH4Cl и экстрагируют CH2Cl2. Органическую фазу сушат (безводный Na2SO4) и выпаривают при пониженном давлении. Очищают с помощью колоночной хроматографии (смесь этилацетат/гексаны), получая чистое соединение 65b (15 мг, выход: 45%).
1H ЯМР (CDCl3, 300 МГц) δ: 8,95 (д, 1H, J=10,2 Гц), 6,77 (т, 1H, J=9,3 Гц), 6,60 (д, 1H, J=9,0 Гц), 6,38 (д, 1H, J=12,6 Гц), 5,64-5,60 (м, 3H), 5,45 (д, 1H, J=12,0 Гц), 4,88 (кв, 1H, J=8,4 Гц), 4,34 (дд, 1H, J=8,7; 7,2 Гц), 4,27-4,20 (м, 1H), 3,82-3,74 (м, 1H), 3,65 (с, 3H), 2,92-2,82 (м, 1H), 2,45-2,38 (м, 2H), 2,11-2,04 (м, 5H), 1,57-1,45 (м, 6H), 1,28-1,23 (м, 3H), 1,15 (д, 6H, J=6,6 Гц).
Синтез соединения 66а
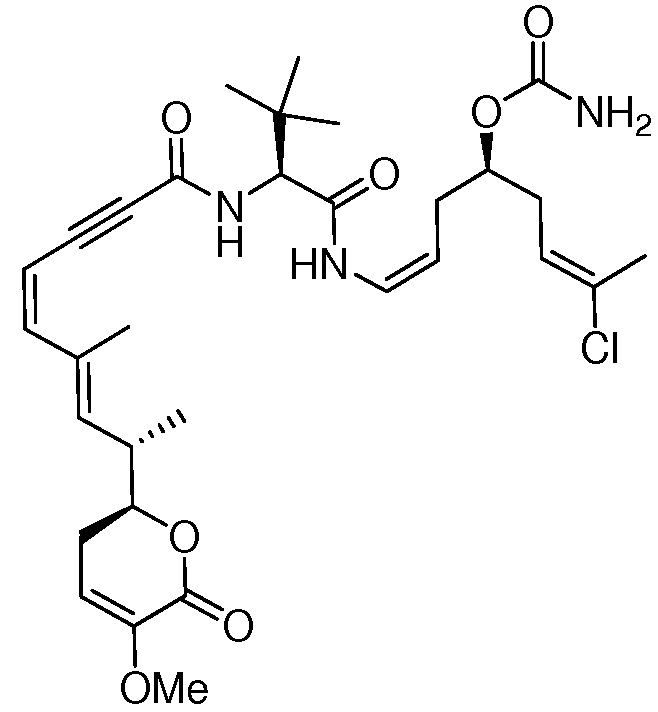
К раствору соединения 65а (3,5 мг, 0,0062 ммоль) в безводном DCM (0,45 мл), при комнатной температуре, добавляют трихлорацетилизоцианат (TCAI) (1 мкл, 0,0075 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 30 минут и затем добавляют нейтральный оксид алюминия (100 мг). Смесь перемешивают в течение 30 минут и затем наносят, при пропитке, на слой оксида алюминия. Продукт вымывают, используя смесь DCM/МеОН = 50:1. Фильтрат выпаривают в вакууме, получая сырой продукт, который очищают с помощью колоночной хроматографии (гексан/EtOAc = от 2:1 до 1:2), получая соединение 66а (2,5 мг, выход: 70%).
1H ЯМР (CDCl3, 500 МГц) δ: 8,72 (д, 1H, J=10,5 Гц), 6,84 (т, 1H, J=9,0 Гц), 6,66 (д, 1H, J=10,0 Гц), 6,38 (д, 1H, J=12,0 Гц), 5,60 (м, 3H), 5,46 (д, 1H, J=12,0 Гц), 4,82 (кв, 1H, J=8,0 Гц), 4,42 (м, 2H), 4,22 (м, 1H), 3,65 (с, 3H), 2,88 (м, 1H), 2,44-2,32 (м, 6H), 2,10 (с, 3H), 2,06 (с, 3H), 1,15 (д, 3H, J=7,0 Гц), 1,05 (с, 9H).
MS (ES) (m/z): 604,2 [М+1]+, 626,2 (М+Na+).
Синтез соединения 66b
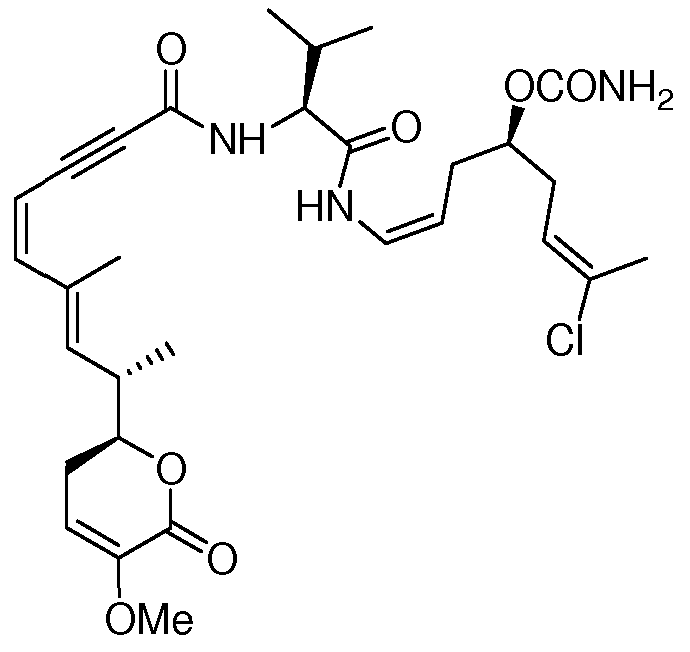
К раствору соединения 65b (32 мг, 0,06 ммоль) в CH2Cl2 (4,2 мл), при комнатной температуре, добавляют трихлорацетилизоцианат (TCAI) (8,5 мкл, 0,072 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 30 минут и затем добавляют нейтральный оксид алюминия (450 мг) при перемешивании в течение дополнительных 30 минут. Реакционную смесь отфильтровывают через оксид алюминия, используя смесь CH2Cl2/МеОН (1:1) и после выпаривания фильтрата при пониженном давлении продукт очищают с помощью колоночной хроматографии (смесь гексан/EtOAc), получая чистое соединение 66b (12 мг, выход: 35%).
1H ЯМР (CDCl3, 300 МГц) δ: 8,90 (д, 1H, J=10,8 Гц), 6,84 (т, 1H, J=9,0 Гц), 6,74 (д, 1Н, J=8,7 Гц), 6,38 (д, 1Н, J=12,0 Гц), 5,64-5,58 (м, 3H), 5,45 (д, 1Н, J=12,0 Гц), 5,38 (уш.с, 2H), 4,86-4,78 (м, 1Н), 4,44-4,39 (м, 2H), 4,27-4,19 (м, 1Н), 3,65 (с, 3H), 2,96-2,84 (м, 1Н), 2,51-2,39 (м, 2H), 2,37-2,30 (м, 5H), 2,18-2,04 (м, 6H), 1,15 (д, 3H, J=6,6 Гц), 1,00-0,96 (м, 6H).
Пример 13
На схеме 13 представлен синтез некоторых соединений согласно данному изобретению.
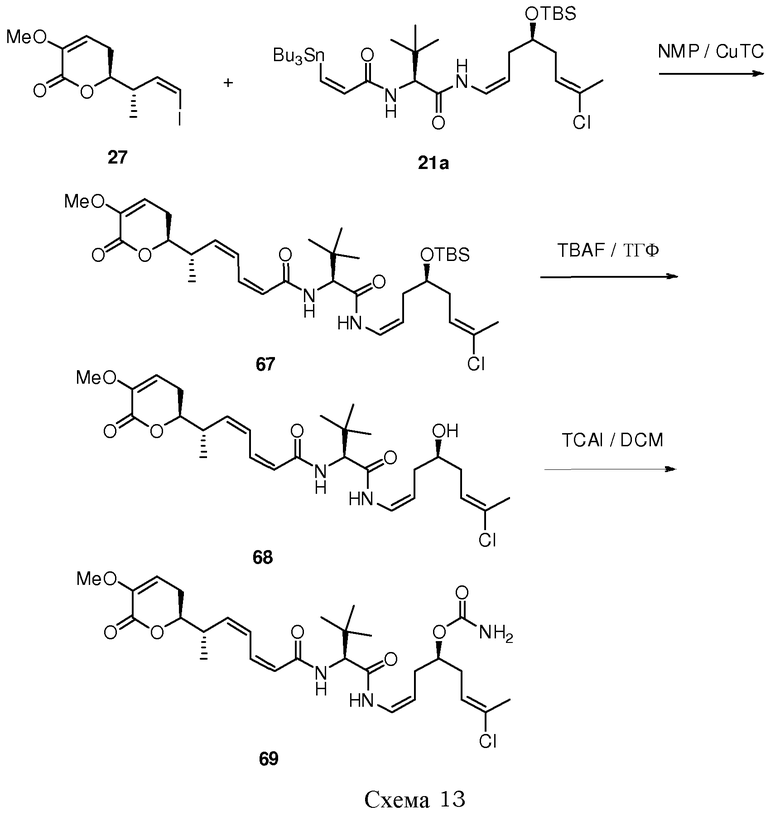
Синтез соединения 67
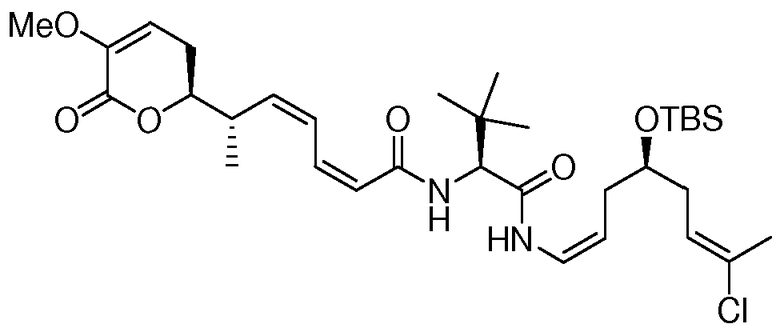
К раствору алкенилстаннана 21а (50 мг, 0,07 ммоль) и иодида 27 (24,8 мг, 0,08 ммоль) в 1-метил-2-пирролидиноне (NMP) (1 мл), при температуре 0°С, добавляют тиофенкарбоксилат меди (CuTC) (19,2 мг, 0,1 ммоль). Реакционную смесь перемешивают при температуре 0°С в течение 45 минут и в течение 20 минут - при комнатной температуре. Затем сырую смесь отфильтровывают через слой нейтрального оксида алюминия, промывают с помощью смеси EtOAc/диэтиловый эфир (50:50) и объединенные фильтраты промывают с помощью 0,5н раствора HCl (3 раза по 5 мл). Органический раствор сушат и выпаривают, получая сырой продукт, который очищают с помощью колоночной хроматографии (гексан/EtOAc = от 10:1 до 6:1), получая триен 67 (19 мг, выход: 44%) в виде масла.
1H ЯМР (CDC13, 300 МГц) δ: 7,73 (д, 1H, J=10,5 Гц), 7,41 (дд, 1H, J=11,7, 11,1 Гц), 6,77-6,68 (м, 2H), 6,37 (д, 1Н, J=9,3 Гц), 5,74 (д, 1Н, J=11,4 Гц), 5,61-5,52 (м, 3H), 4,87-4,79 (м, 1Н), 4,37 (д, 1Н, J=9,3 Гц), 4,21-4,14 (м, 1Н), 3,79-3,72(м, 1Н), 3,64 (с, 3H), 3,09-2,99 (м, 1Н), 2,39-2,35 (м, 2H), 2,20-2,10 (м, 4H), 2,01 (с, 3H), 1,16 (д, 3H, J=6,6 Гц), 1,03 (с, 9H), 0,88 (с, 9H), 0,07 (с, 3H), 0,05 (с, 3H).
Синтез соединения 68
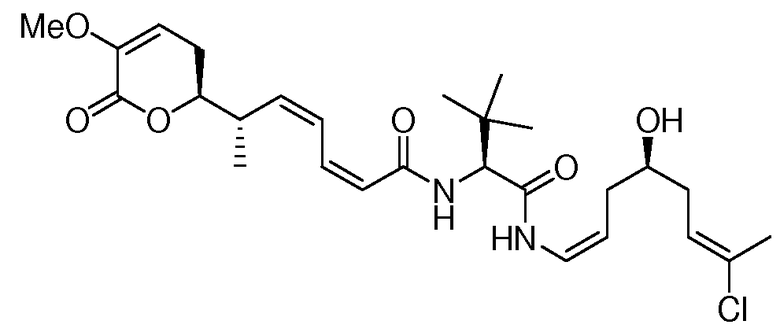
К раствору соединения 67 (18 мг, 0,03 ммоль) в безводном ТГФ (0,42 мл), в атмосфере азота и при комнатной температуре, добавляют 1 М раствор TBAF в ТГФ (0,05 мл, 0,05 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 18 часов и затем гасят с помощью насыщенного водного раствора NH4Cl и экстрагируют EtOAc. Объединенные органические фазы сушат над безводным Na2SO4, отфильтровывают и концентрируют. Остаток очищают с помощью флэш-хроматографии (гексан/EtOAc = от 3:1 до 1:2), получая спирт 68 (16 мг, выход: 80%) в виде масла.
1Н ЯМР (CDCl3, 300 МГц) δ: 8,90 (д, 1H, J=10,5 Гц), 7,42 (дд, 1H, J=11,7, 11,1 Гц), 6,78-6,69 (м, 2H), 6,59 (д, 1H, J=9,3 Гц), 5,75 (д, 1H, J=11,4 Гц), 5,64-5,53 (м, 3H), 4,88-4,80 (м, 1H), 4,37 (д, 1H, J=9,3 Гц), 4,22-4,15 (м, 1H), 3,77-3,69 (м, 1H), 3,64 (с, 3H), 3,11-3,01 (м, 1H), 2,39-2,35 (м, 2H), 2,24-2,14 (м, 4H), 2,03 (с, 3H), 1,16 (д, 3H, J=6,6 Гц), 1,03 (с, 9H).
Синтез соединения 69
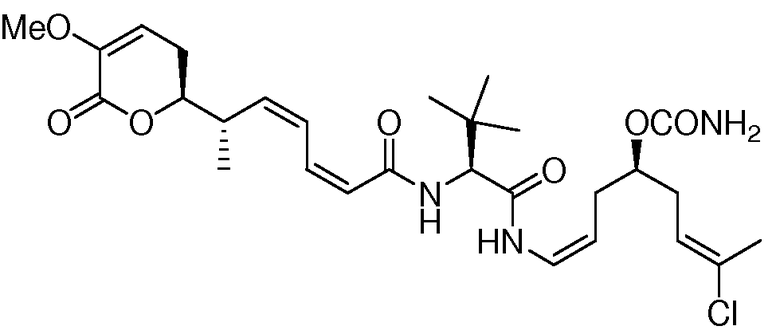
К раствору соединения 68 (15 мг, 0,02 ммоль) в безводном DCM (0,3 мл), при комнатной температуре, добавляют трихлорацетилизоцианат (TCAI) (4,1 мкл, 0,64 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 30 минут и затем добавляют нейтральный оксид алюминия (450 мг). Эту смесь перемешивают в течение 30 минут и затем наносят, при пропитке, на слой оксида алюминия. Продукт вымывают, используя смесь DCM/МеОН (50:1). Фильтрат выпаривают в вакууме, получая сырой продукт, который очищают с помощью колоночной хроматографии (гексан/EtOAc = от 3:1 до 2:1), получая соединение 69 (14 мг, выход: 86%).
1H ЯМР (CDCl3, 300 МГц) δ: 8,89 (д, 1H, J=10,5 Гц), 7,45 (м, 1H), 6,87-6-71 (м, 2H), 6,53 (д, 1Н, J=9,6 Гц), 5,75 (м, 2H), 5,60-5,57 (м, 2H), 4,81 (м, 1Н), 4,40-4,37 (м, 2H), 4,19 (дд, 1Н, J=9,3, 9,5 Гц), 3,66 (с, 3H), 3,06 (м, 1Н), 2,40-2,30 (м, 5H), 2,15-2,08 (м, 1Н), 2,07 (с, 3H), 1,17 (д, 3H, J=4,2 Гц), 1,04 (с, 9H).
13С-ЯМР (CDCl3, 75,5 МГц) δ: 168,1, 165,9, 161,4, 157,7, 145,2, 138,3, 135,2, 132,0, 125,9, 124,5, 122,3, 121,8, 108,1, 105,2, 81,4, 75,1, 60,7, 55,4, 36,1, 35,0, 32,9, 30,8, 26,7, 26,3, 21,0, 17,0.
Пример 14
На схеме 14 представлен синтез некоторых соединений согласно данному изобретению.
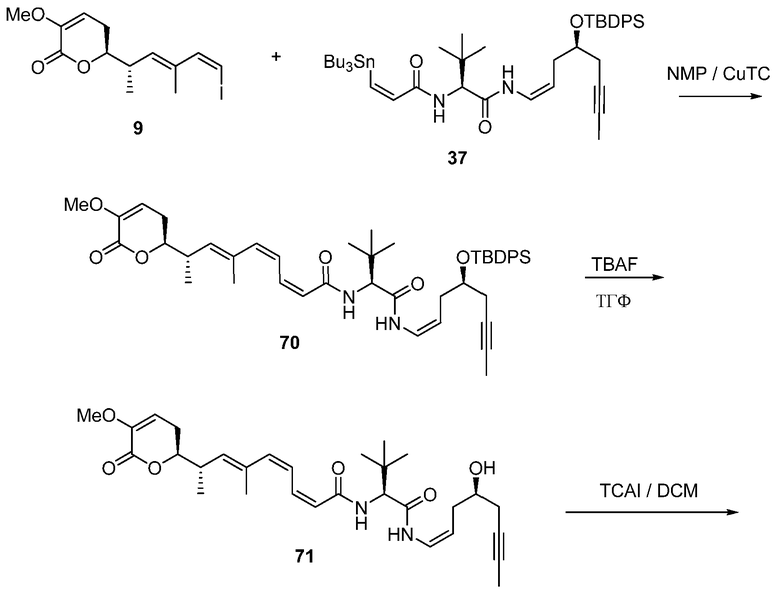
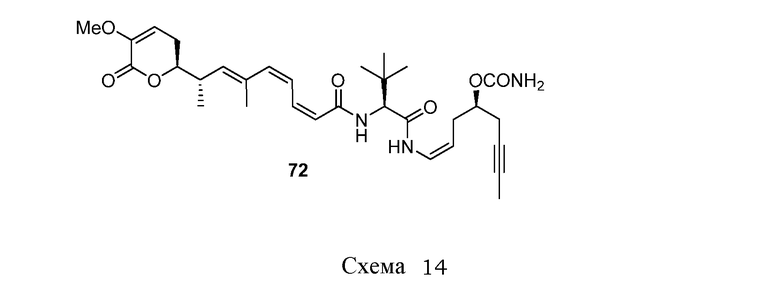
Синтез соединения 70
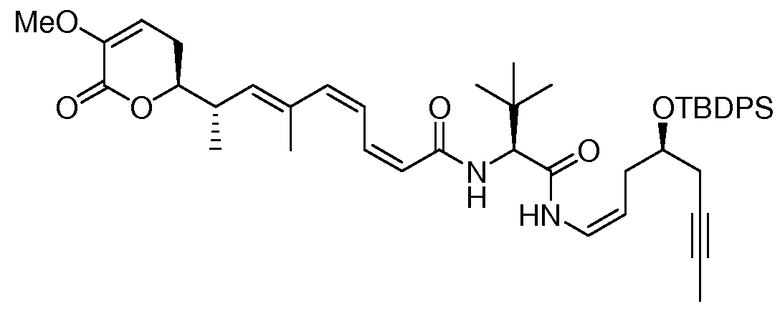
К раствору алкенилстаннана 37 (94 мг, 0,112 ммоль) и продукта 9 (47 мг, 0,135 ммоль) в 1-метил-2-пирролидиноне (NMP) (1,1 мл), при температуре 0°С, добавляют тиофенкарбоксилат меди (CuTC) (32,2 мг, 0,168 ммоль). Реакционную смесь перемешивают при температуре 0°С в течение 45 минут и в течение 20 минут - при комнатной температуре. Затем сырую смесь отфильтровывают через слой нейтрального оксида алюминия, промывают с помощью смеси EtOAc/диэтиловый эфир (50:50) и объединенные фильтраты промывают с помощью 0,5 н раствора HCl (3 раза по 15 мл). Органический раствор сушат и выпаривают, получая сырой продукт, который очищают с помощью колоночной хроматографии (гексан/EtOAc = от 2:1 до 1:1), получая триен 70 (81,4 мг, выход: 79%) в виде масла.
1H ЯМР (CDC13, 300 МГц) δ: 7,74 (д, 1H, J=10,5 Гц), 7,66-7,64 (м, 4H), 7,44-7,38 (м, 6H), 7,22 (дд, 1Н, J=12,3, 11,4 Гц), 6,86 (дд, 1Н, J=11,7, 11,4 Гц), 6,70 (дд, 1Н, J=9,9, 9,3 Гц), 6,40 (д, 1Н, J=9,3 Гц), 6,17 (д, 1Н, J=11,4 Гц), 5,66 (д, 1Н, J=11,4 Гц), 5,60 (дд, 1Н, J=5,4, 3,9 Гц), 5,26 (д, 1Н, J=10,2 Гц), 4,84-4,76 (м, 1Н), 4,3 (д, 1Н, J=9,3 Гц), 4,20-4,16 (м, 1Н), 3,88-3,80 (м, 1Н), 3,64 (с, 3H), 2,89-2,77 (м, 1Н), 2,41-2,33 (м, 3H), 2,28-2,20 (м, 3H), 1,91 (с, 3H), 1,82 (с, 3H), 1,13 (д, 3H, J=6,9 Гц), 1,02 (с, 9H), 0,86 (с, 9H).
Синтез соединения 71
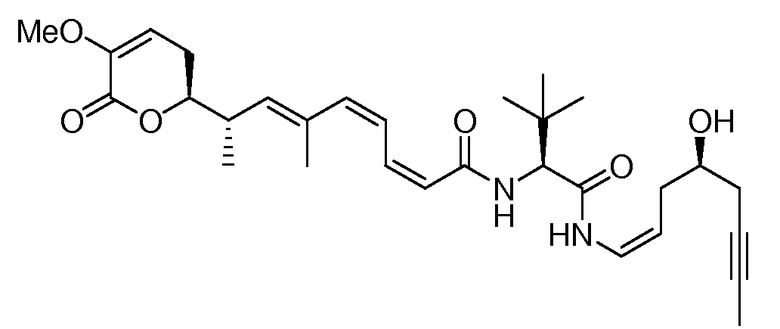
К раствору соединения 70 (77,2 мг, 0,106 ммоль) в безводном ТГФ (7,5 мл), в атмосфере азота и при комнатной температуре, добавляют 1 М раствор TBAF в ТГФ (0,2 мл, 0,2 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 18 часов и затем гасят с помощью насыщенного водного раствора NH4Cl и экстрагируют EtOAc. Объединенные органические фазы сушат над безводным Na2SO4, отфильтровывают и концентрируют. Остаток очищают с помощью флэш-хроматографии (гексан/EtOAc = 1:2), получая спирт 71 (25 мг, выход: 44%) в виде масла.
1Н ЯМР (CDCl3, 300 МГц) δ: 8,79 (д, 1H, J=9,6 Гц), 7,28-7,22 (м, 1H), 6,85 (т, 1H, J=11,7 Гц), 6,73 (т, 1H, J=9,6 Гц), 6,58 (д, 1H, J=8,7 Гц), 6,12 (д, 1H, J=11,4 Гц), 5,68-5,61 (м, 2H), 5,26 (д, 1H, J=9,9 Гц), 4,86 (кв, 1H, J=8,1 Гц), 4,38 (д, 1H, J=9,3 Гц), 4,20-4,18 (м, 1H), 3,78-3,76 (м, 1H), 3,64 (с, 3H), 3,10 (уш.с, 1H), 2,86-2,79 (м, 1H), 2,41-2,14 (м, 6H), 1,82 (с, 6H), 1,14 (д, 3H, J=6,6 Гц), 1,02 (с, 9H).
Синтез соединения 72
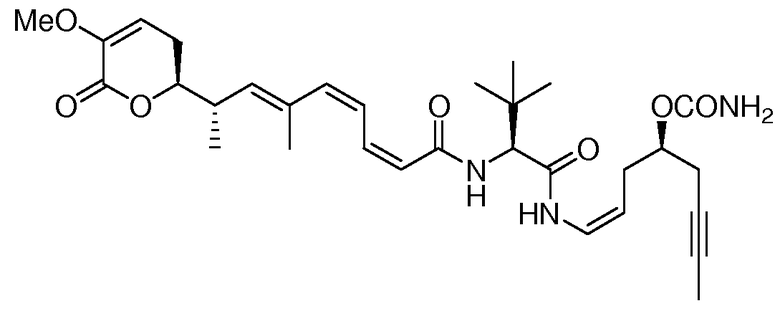
К раствору соединения 71 (21,6 мг, 0,0443 ммоль) в безводном DCM (3,1 мл), при температуре 0°С, добавляют трихлорацетилизоцианат (TCAI) (6,4 мкл, 0,053 ммоль). Реакционную смесь перемешивают при температуре 0°С в течение 30 минут и затем добавляют нейтральный оксид алюминия. Эту смесь перемешивают в течение 5-30 минут и затем наносят, при пропитке, на слой оксида алюминия. Продукт вымывают, используя смесь DCM/МеОН (50:1). Фильтрат выпаривают в вакууме, получая сырой продукт, который очищают с помощью колоночной хроматографии (гексан/EtOAc = 1:2). Соединение 72 (19,1 мг, выход: 76%) получают в виде твердого вещества белого цвета.
1H ЯМР (CDCl3, 500 МГц) δ: 8,61 (д, 1H, J=11,1 Гц), 7,27 (т, 1H, J=11,4 Гц), 6,92-6,78 (м, 2H), 6,52 (д, 1H, J=9,3 Гц), 6,15 (д, 1H, J=11,4 Гц), 5,69 (д, 1H, J=11,4 Гц), 5,62-5,61 (м, 1H), 5,45 (уш.с, 2H), 5,28 (д, 1H, J=9,6 Гц), 4,87-4,78 (м, 1H), 4,53-4,45 (м, 1H), 4,42 (д, 1H, J=9,6 Гц), 4,25-4,20 (м, 1H), 3,64 (с, 3H), 2,87-2,80 (м, 1H), 2,44-2,17 (м, 6H), 1,81 (с, 6H), 1,16 (д, 3H, J=6,5 Гц), 1,04 (с, 9H).
Пример 15
На схеме 15 представлен синтез соединения 73.
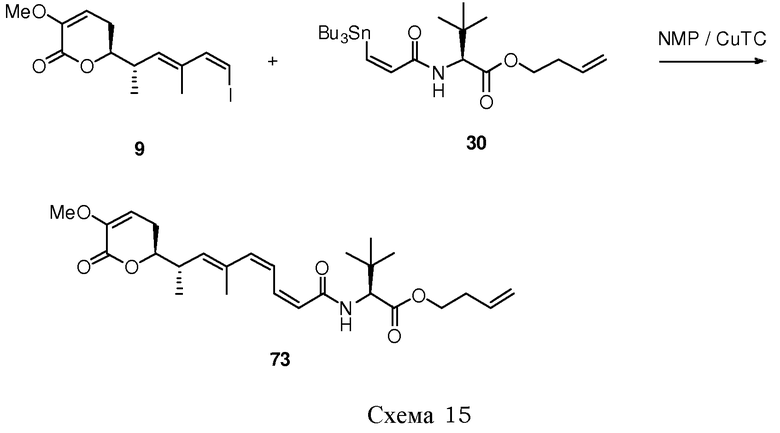
Синтез соединения 73
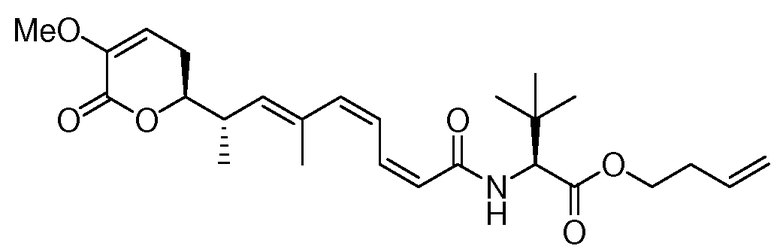
К раствору продукта 30 (40 мг, 0,076 ммоль) и продукта 9 (31 мг, 0,09 ммоль) в NMP (0,8 мл), при температуре 0°С, добавляют тиофенкарбоксилат меди (CuTC) (22 мг, 0,11 ммоль). Реакционную смесь перемешивают при температуре 0°С в течение 45 минут и в течение часа - при комнатной температуре. Затем сырую смесь отфильтровывают через слой нейтрального оксида алюминия, промывают с помощью смеси EtOAc/диэтиловый эфир (50:50, 20 мл) и объединенные фильтраты промывают с помощью 0,5 н раствора HCl (3 раза по 10 мл). После сушки и выпаривания растворителя при пониженном давлении, сырой продукт очищают с помощью колоночной хроматографии (этилацетат/гексаны = от 5:1 до 2:1), получая чистое соединение 73 (6 мг, выход: 17%).
1H ЯМР (CDCl3, 300 МГц) δ: 7,27 (т, 1H, J=11,46 Гц), 6,90 (т, 1H, J=11,52 Гц), 6,16 (д, 1Н, J=11,7), 6,03 (д, 1Н, J=9,55 Гц), 5,84-5,70 (м, 1Н), 5,67-5,60 (м, 2H), 5,28 (д, 1Н, J=10,66 Гц), 5,14-5,06 (м, 2H), 4,53 (д, 1Н, J=9,41 Гц), 4,22-4,10 (м, 3H), 3,65 (с, 3H), 2,91-2,81 (м, 1Н), 2,47-2,34 (м, 4H), 1,84 (с, 3H), 1,16 (д, 3H, J=6,65 Гц), 0,99 (с, 9H).
Пример 16
На схеме 16 представлен синтез некоторых соединений согласно данному изобретению.
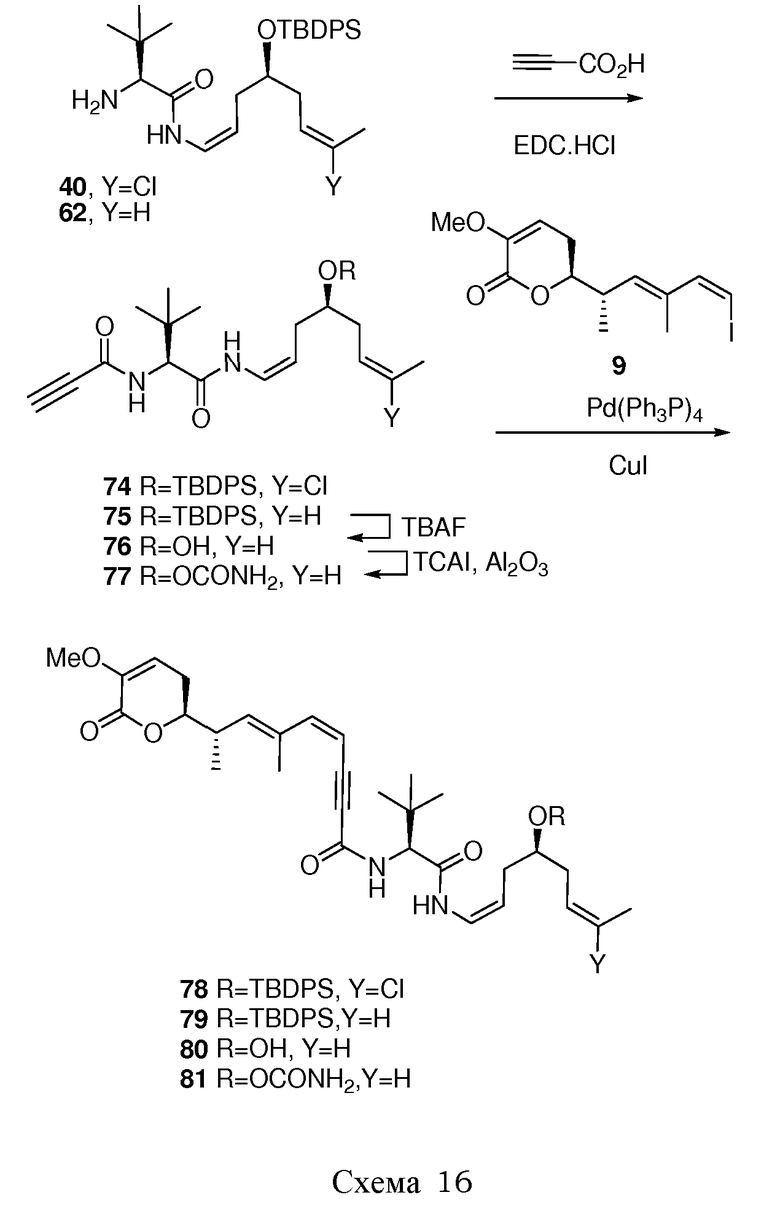
Синтез соединения 74
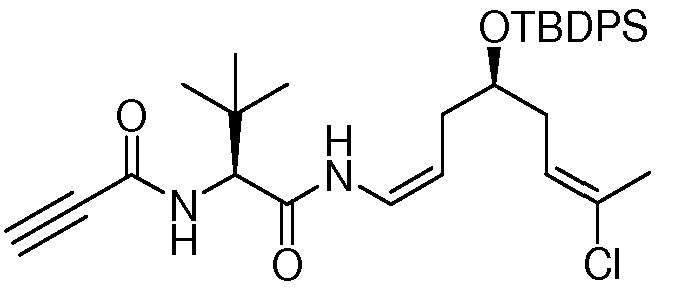
К раствору продукта 40 (2,7 г, 5,12 ммоль) и пропиоловой кислоты (0,41 мл, 6,66 ммоль) в безводном DCM (51 мл), при температуре 0°С, добавляют N-(3-диметиламинопропил)-N'-этилкарбодиимидгидрохлорид (EDC) (1,23 г, 6,4 ммоль). Реакционную смесь перемешивают при температуре 0°С в течение 30 минут и в течение 2 часов - при комнатной температуре. Затем сырую смесь гасят водой и экстрагируют дихлорметаном. Объединенные фильтраты промывают водой. После сушки и выпаривания растворителя при пониженном давлении сырой продукт очищают с помощью колоночной хроматографии (смесь EtOAc/гексаны), получая чистое соединение 74 (2,25 г, выход: 85%) в виде твердого вещества белого цвета.
1H ЯМР (CDCl3, 300 МГц) δ: 7,66 (м, 4H), 7,47-7,36 (м, 6H), 6,96 (д, 1H, J=10,5 Гц), 6,66 (д, 1H, J=9,2 Гц), 6,62 (т, 1H, J=8,9 Гц), 5,52 (т, 1H, J=7,4 Гц), 4,79 (кв, 1H, J=8,6 Гц), 4,27 (д, 1H, J=9,4 Гц), 3,83 (м, 1H), 2,82 (с, 1H), 2,19-2,04 (м, 4H), 1,87 (с, 3H), 1,05 (с, 9H), 0,99 (с, 9H).
Синтез промежуточного продукта 75
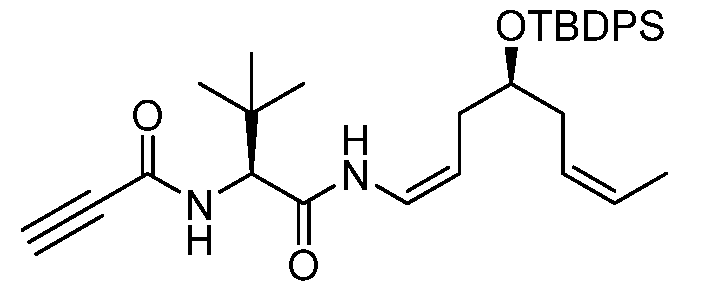
Раствор пропиоловой кислоты (45 мкл, 0,726 ммоль), амина 62 (275 мг, 0,56 ммоль), в безводном DCM (5,6 мл), охлаждают до температуры 0°С, в атмосфере аргона, и добавляют N-(3-диметиламинопропил)-N'-этилкарбодиимидгидрохлорид (EDC) (134 мг, 0,7 ммоль). Реакционную смесь перемешивают при температуре 0°С в течение 10 минут и затем при температуре 23°С - в течение 3 часов, гасят водой и экстрагируют дихлорметаном. Объединенные органические слои сушат (безводный Na2SO4), отфильтровывают и концентрируют. Остаток очищают с помощью флэш-хроматографии (EtOAc/гексан = от 1:10 до 3:1), получая продукт 75 (260 мг, выход: 85%) в виде бесцветной твердой пены.
1H ЯМР (CDCl3, 300 МГц) δ: 7,69-7,67 (м, 4H), 7,44-7,36 (м, 6H), 7,08 (д, 1H, J=10,2 Гц), 6,67-6,61 (м, 2H), 5,53-5,45 (м, 1H), 5,35-5,26 (м, 1H), 4,92-4,84 (м, 1H), 4,26 (д, 1H, J=9,6 Гц), 3,89-3,82 (м, 1H), 2,80 (с, 1H), 2,26-2,05 (м, 4H), 1,44 (д, 3H, J=7,8 Гц), 1,05 (с, 9H), 0,97 (с, 9H).
Синтез промежуточного продукта 76
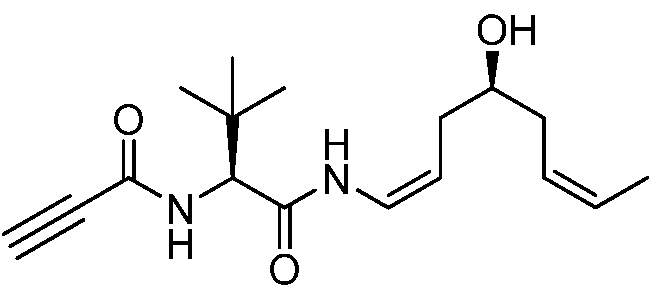
К раствору продукта 75 (244,3 мг, 0,45 ммоль) в безводном ТГФ (5 мл), в атмосфере азота и при температуре 0°С, добавляют 1 М раствор TBAF в ТГФ (0,54 мл, 0,54 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 3 часов и затем гасят с помощью насыщенного водного раствора NH4Cl и экстрагируют EtOAc. Объединенные органические фазы сушат над безводным Na2SO4, отфильтровывают и концентрируют. Остаток очищают с помощью флэш-хроматографии (гексан/EtOAc = от 4:1 до 1:2), получая спирт 76 (94,1 мг, выход: 69%) в виде масла бледно-желтого цвета.
1Н ЯМР (CDCl3, 300 МГц) δ: 9,02 (д, 1H, J=9,9 Гц), 7,09 (д, 1H, J=9,3 Гц), 6,74 (т, 1H, J=9,9 Гц), 5,65-5,57 (м, 1H), 5,43-5,35 (м, 1H), 4,93-4,85 (м, 1H), 4,44 (д, 1H, J=9,3 Гц), 3,78-3,70 (м, 1H), 2,87 (с, 1H), 2,32-2,12 (м, 4H), 1,61 (д, 3H, J=6,6 Гц), 1,02 (с, 9H).
13С-ЯМР (CDCl3, 75 МГц) δ: 167,7, 152,4, 127,7, 126,0, 123,5, 109,4, 77,3, 74,9, 72,1, 61,3, 35,4, 34,7, 33,2, 26,8, 13,3.
Синтез промежуточного продукта 77
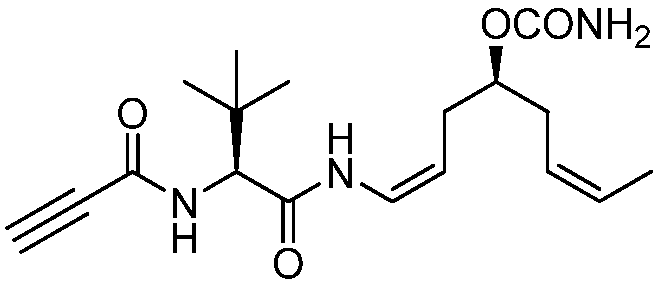
К раствору продукта 76 (48,6 мг, 0,159 ммоль) в безводном DCM (1,6 мл), при комнатной температуре, добавляют трихлорацетилизоцианат (TCAI) (23,0 мкл, 0,19 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 30 минут и затем добавляют нейтральный оксид алюминия (250 мг). Эту смесь перемешивают в течение 60 минут и затем наносят, при пропитке, на слой оксида алюминия. Продукт вымывают, используя смесь дихлорметан/МеОН (50:1). Фильтрат выпаривают при пониженном давлении, получая сырой продукт, который очищают с помощью колоночной хроматографии (гексан/EtOAc = от 3:1 до 1:100), получая соединение 77 (43 мг, выход: 77%) в виде твердого вещества белого цвета.
1H ЯМР (CDCl3, 300 МГц) δ: 9,02 (д, 1H, J=10,5 Гц), 7,12 (уш.с, 1H), 7,04 (д, 1Н, J=9,6 Гц), 6,98 (уш.с, 1Н), 6,80 (т, 1Н, J=9,7 Гц), 5,63-5,53 (м, 1Н), 5,42-5,33 (м, 1Н), 4,86 (кв, 1Н, J=8,3 Гц), 4,48-4,30 (м, 1Н), 4,39 (д, 1Н, J=9,6 Гц), 2,87 (с, 1Н), 2,46-2,43 (м, 1Н), 2,35-2,30 (м, 2H), 2,18-2,11 (м, 1Н), 1,61 (д, 3H, J=6,0 Гц), 1,00 (с, 9H).
Синтез соединения 78
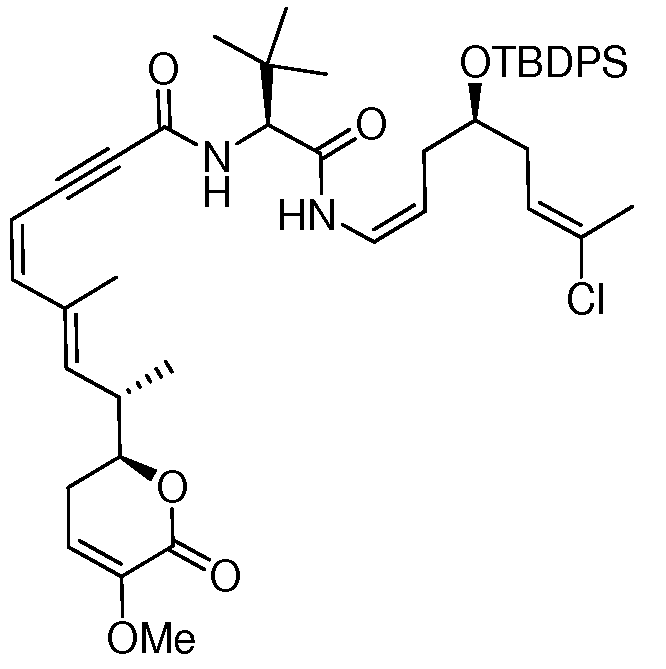
К раствору иодистого соединения 9 (300 мг, 0,86 ммоль) в диизопропиламине (4,3 мл), в атмосфере азота и при комнатной температуре, добавляют Pd(Ph3P)4 (20 мг, 0,017 ммоль) и CuI (6,4 мг, 0,034 ммоль). Затем, по частям, добавляют соединение 74 (500 мг, 0,86 ммоль) и реакционную смесь перемешивают при комнатной температуре в течение 2 часов. Сырой продукт гасят водой и экстрагируют EtOAc. Органическую фазу сушат (безводный Na2SO4) и выпаривают при пониженном давлении. Очищают с помощью колоночной хроматографии (гексан/EtOAc = от 3:1 до 1:1), получая чистое соединение 78 (580 мг, выход: 85%) в виде твердого вещества желтого цвета.
1H ЯМР (CDCl3, 300 МГц) δ: 7,67 (м, 4H), 7,48-7,37 (м, 6H), 7,75 (д, 1H, J=10,5 Гц), 6,65 (т, 1H, J=10,1 Гц), 6,46 (д, 1H J=9,2 Гц), 6,38 (д, 1H, J=12,0 Гц), 5,64-5,48 (м, 3H), 5,43 (д, 1H, J=12,1 Гц), 4,78 (кв, 1H, J=7,7 Гц), 4,28 (д, 1H, J=9,3 Гц), 4,20 (м, 1H), 3,82 (м, 1H), 3,65 (с, 3H), 2,86 (м, 1H), 2,40 (м, 2H), 2,14 (м, 4H), 2,09 (с, 3H), 1,86 (с, 3H), 1,15 (д, 3H, J=6,6 Гц), 1,05 (с, 9H), 0,99 (с, 9H).
Синтез соединения 79
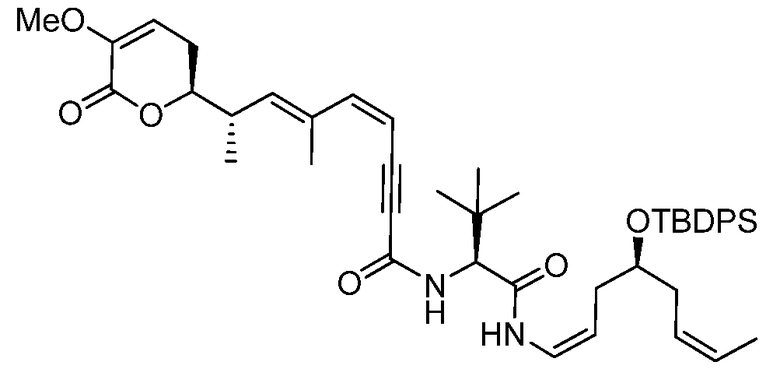
К раствору продукта 9 (113 мг, 0,325 ммоль) в DIPA (1,6 мл), при температуре 23°С, добавляют Pd(Ph3P)4 (7 мг, 0,006 ммоль) и CuI (2,5 мг, 0,013 ммоль). Затем добавляют соединение 75 (195 мг, 0,358 ммоль) и реакционную смесь перемешивают при температуре 23°С в течение 3 часов. Сырую смесь гасят водой и экстрагируют EtOAc. Органическую фазу сушат (безводный Na2SO4) и выпаривают при пониженном давлении. Остаток очищают с помощью флэш-хроматографии (EtOAc/гексан = от 1:3 до 1:1), получая чистое соединение 79 (180 мг, выход: 70%) в виде бесцветной твердой пены.
1H ЯМР (CDCl3, 300 МГц) δ: 7,67-7,64 (м, 4H), 7,60 (д, 1H, J=10,8 Гц), 7,46-7,35 (м, 6H), 6,66 (т, 1H, J=9,6 Гц), 6,59 (дд, 1H, J=9,9 Гц), 6,31 (д, 1H, J=12,6 Гц), 5,62-5,54 (м, 2H), 5,42-5,37 (м, 1H), 5,32 (д, 1H, J=12,0 Гц), 5,30-5,23 (м, 1H), 4,92-4,84 (м, 1H), 4,42 (д, 1H, J=9,6 Гц), 4,23-4,15 (м, 1H), 3,86-3,78 (м, 1H), 3,63 (с, 3H), 2,88-2,80 (м, 1H), 2,41-2,36 (м, 2H), 2,22-2,11 (м, 4H), 2,06 (с, 3H), 1,39 (д, 3H, J=6,9 Гц), 1,13 (д, 3H, J=6,6 Гц), 1,03 (с, 9H), 0,96 (с, 9H).
13С-ЯМР (CDCl3, 75 МГц) δ: 167,5, 161,7, 153,3, 148,2, 145,4, 138,2, 136,1, 135,7, 134,4, 129,9, 127,8, 127,8, 126,5, 126,1, 121,6, 109,5, 108,5, 103,1, 88,2, 85,1, 81,7, 72,6, 60,8, 55,6, 37,2, 35,6, 34,1, 32,6, 27,2, 26,7, 26,6, 19,5, 16,4, 15,5, 13,1. (один сигнал Csp2 не обнаружен).
Синтез соединения 80
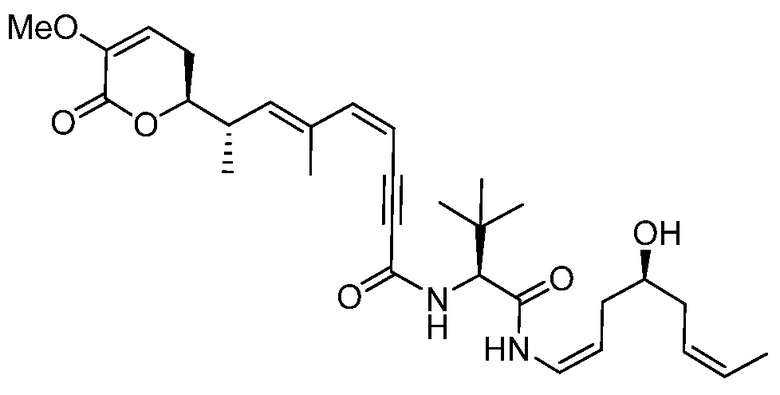
К раствору продукта 9 (52 мг, 0,15 ммоль) в DIPA (0,6 мл), при температуре 23°С, добавляют Pd(Ph3P)4 (3,5 мг, 0,003 ммоль) и CuI (1,14 мг, 0,006 ммоль). Затем добавляют соединение 76 (45,5 мг, 0,15 ммоль) в 0,4 мл DIPA и реакционную смесь перемешивают при температуре 23°С в течение 120 минут. Сырую смесь гасят водой и экстрагируют EtOAc. Органическую фазу сушат (безводный Na2SO4) и выпаривают при пониженном давлении. Остаток очищают с помощью флэш-хроматографии (дихлорметан/МеОН = от 100:1 до 20:1), получая чистое соединение 80 (59,5 мг, выход: 75%) в виде бесцветного масла.
1H ЯМР (CDCl3, 300 МГц) δ: 8,94 (д, 1H, J=9,9 Гц), 6,75 (т, 1H, J=9,3 Гц), 6,69 (д, 1H, J=9,0 Гц), 6,37 (д, 1H, J=12,0 Гц), 5,68-5,57 (м, 3H), 5,44 (д, 1H, J=12,0 Гц), 5,43-5,35 (м, 1H), 4,95-4,87 (м, 1H), 4,34 (д, 1H, J=9,3 Гц), 4,24-4,17 (м, 1H), 3,76 (м, 1H), 3,64 (с, 3H), 2,91-2,78 (м, 1H), 2,63 (уш.с, 1H), 2,43-2,38 (м, 2H), 2,32-2,11 (м, 4H), 2,07 (с, 3H), 1,62 (д, 3H, J=6,6 Гц), 1,14 (д, 3H, J=6,6 Гц), 1,01 (с, 9H).
13С-ЯМР (CDCl3, 125 МГц) δ: 167,5, 161,5, 153,2, 147,9, 145,1, 137,8, 135,4, 127,8, 125,5, 123,6, 109,0, 108,3, 103,0, 88,0, 84,7, 81,4, 72,0, 61,1, 55,4, 37,0, 35,2, 34,5, 32,8, 26,6, 26,4, 16,2, 15,3, 13,0.
MS (ES) [m/z]: 549,2 [М+Na]+.
Синтез соединения 81
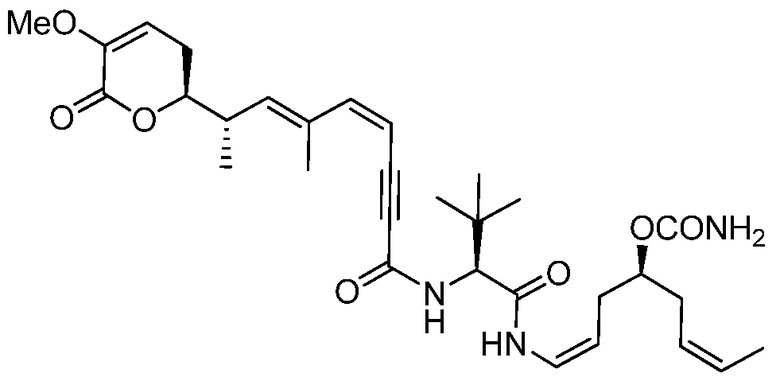
К раствору продукта 9 (43 мг, 0,123 ммоль) в DIPA (0,6 мл), при температуре 23°С, добавляют Pd(Ph3P)4 (2,8 мг, 0,0025 ммоль) и CuI (1,0 мг, 0,005 ммоль). Затем добавляют соединение 77 (43 мг, 0,123 ммоль) в 0,4 мл DIPA и реакционную смесь перемешивают при температуре 23°С в течение 120 минут. Сырую смесь гасят водой и экстрагируют EtOAc. Органическую фазу сушат (безводный Na2SO4) и выпаривают при пониженном давлении. Остаток очищают с помощью флэш-хроматографии (дихлорметан/МеОН = от 100:1 до 20:1), получая чистое соединение 81 (38 мг, выход: 54%) в виде бесцветного масла.
1H ЯМР (CDCl3, 300 МГц) δ: 9,00 (д, 1H, J=10,8 Гц), 6,81 (т, 1H, J=9,6 Гц), 6,73 (д, 1H, J=9,6 Гц), 6,38 (д, 1H, J=12,0 Гц), 5,63-5,56 (м, 5H), 5,45 (д, 1H, J=11,7 Гц), 5,43-5,36 (м, 1H), 4,90-4,81 (м, 1H), 4,40 (д, 1H, J=9,3 Гц), 4,40-4,33 (м, 1H), 4,24-4,17 (м, 1H), 3,64 (с, 3H), 2,90-2,82 (м, 1H), 2,42-2,31 (м, 5H), 2,18-2,09 (м, 1H), 2,09 (с, 3H), 1,62 (д, 3H, J=6,6 Гц), 1,15 (д, 3H, J=6,6 Гц), 1,01 (с, 9H).
Пример 17
На схеме 17 представлен синтез некоторых соединений согласно данному изобретению.
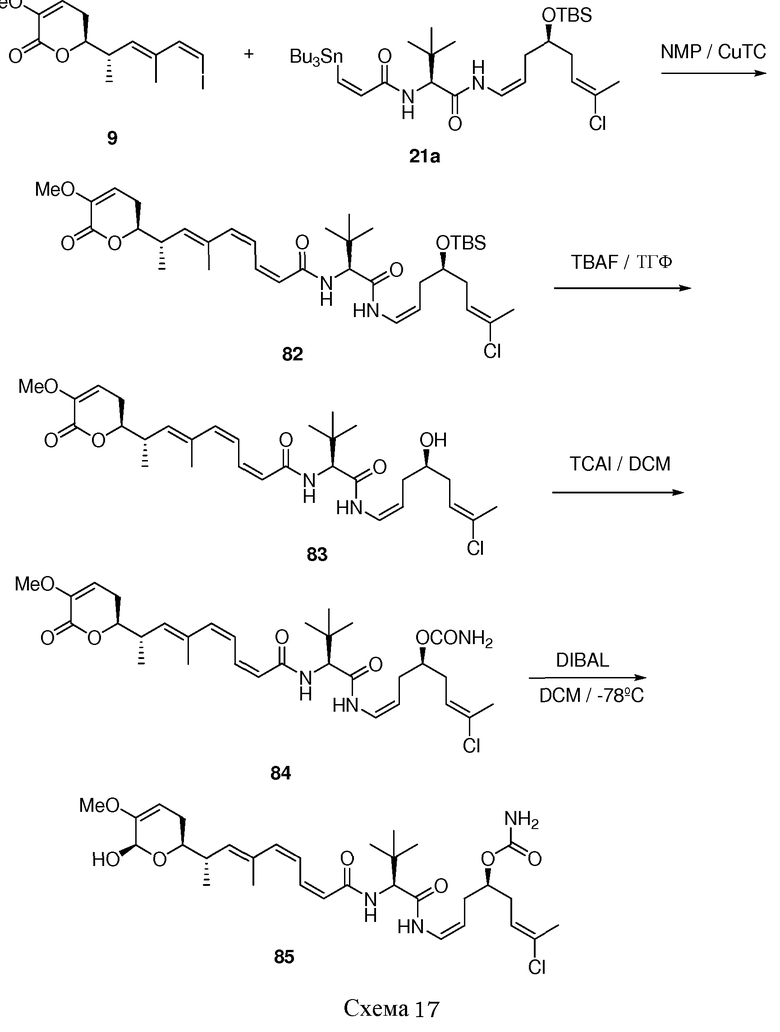
Синтез соединения 82
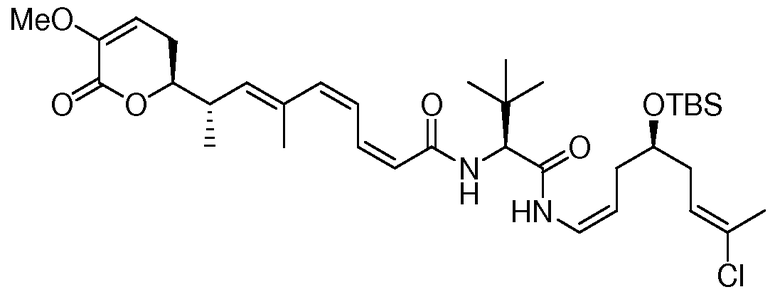
К раствору алкенилстаннана 21а (1,1 г, 1,47 ммоль) и соединения 9 (0,62 г, 1,77 ммоль) в 1-метил-2-пирролидиноне (NMP) (14,7 мл), при температуре 0°С, добавляют тиофенкарбоксилат меди (CuTC) (422 мг, 2,2 ммоль). Реакционную смесь перемешивают при температуре 0°С в течение 45 минут и в течение 20 минут - при комнатной температуре. Затем сырую смесь отфильтровывают через слой нейтрального оксида алюминия, промывают с помощью смеси EtOAc/диэтиловый эфир (50:50) и объединенные фильтраты промывают с помощью 0,5 н раствора HCl (3 раза по 15 мл). Органический раствор сушат и выпаривают, получая сырой продукт, который очищают с помощью колоночной хроматографии (гексан/EtOAc = от 5:1 до 1:1), получая триен 82 (0,66 г, выход: 66%) в виде масла.
1H ЯМР (CDCl3, 300 МГц) δ: 7,89 (д, 1H, J=10,8 Гц), 7,22 (дд, 1H, J=12,3, 11,4 Гц), 6,86 (дд, 1H, J=11,7, 11,4 Гц), 6,70 (дд, 1H, J=9,9, 9,3 Гц), 6,35 (д, 1H, J=9,3 Гц), 6,13 (д, 1H, J=11,4 Гц), 5,66 (д, 1H, J=11,4 Гц), 5,60 (дд, 1H, J=5,4, 3,9 Гц), 5,55 (уш.т, 1H, J=7,8 Гц), 5,26 (д, 1H, J=10,2 Гц), 4,84-4,76 (м, 1H), 4,3 (д, 1H, J=9,3 Гц), 4,20-4,16 (м, 1H), 3,77-3,69 (м, 1H), 3,63 (с, 3H), 2,89-2,77 (м, 1H), 2,41-2,33 (м, 2H), 2,19-2,13 (м, 4H), 2,00 (с, 3H), 1,82 (с, 3H), 1,13 (д, 3H, J=6,9 Гц), 1,02 (с, 9H), 0,86 (с, 9H), 0,4 (с, 3H), 0,03 (с, 3H).
13С-ЯМР (CDCl3, 75 МГц) δ: 168,5, 166,4, 161,8, 145,4, 140,3, 137,3, 134,4, 134,3, 131,0, 124,3, 124,1, 122,4, 121,2, 108,7, 108,4, 82,0, 71,6, 60,6, 55,6, 37,5, 36,5, 35,1, 33,8, 26,5, 26,0, 21,3, 18,3, 17,4, 16,9, -4,3, -4,4.
Синтез соединения 83
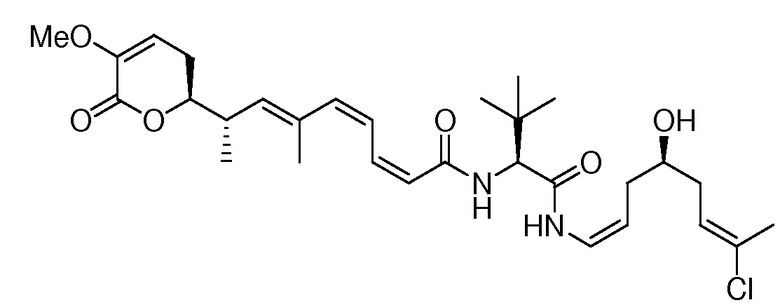
К раствору соединения 82 (275 мг, 0,41 ммоль) в безводном ТГФ (6 мл), в атмосфере азота и при комнатной температуре, добавляют 1 М раствор TBAF в ТГФ (0,82 мл, 0,82 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 18 часов и затем гасят с помощью насыщенного водного раствора NH4Cl и экстрагируют EtOAc. Объединенные органические фазы сушат над безводным Na2SO4, отфильтровывают и концентрируют. Остаток очищают с помощью флэш-хроматографии (гексан/EtOAc = от 3:1 до 1:2), получая спирт 83 (175 мг, выход: 76%) в виде твердого вещества белого цвета.
1H ЯМР (CDCl3, 300 МГц) δ: 9,00 (д, 1H, J=10,2 Гц), 7,25 (дд, 1H, J=12,0, 11,4 Гц), 6,86 (дд, 1Н, J=11,7, 11,4 Гц), 6,72 (дд, 1Н, J=9,6, 8,7 Гц), 6,68 (д, 1Н, J=8,7 Гц), 6,13 (д, 1Н, J=11,7 Гц), 5,68 (д, 1Н, J=11,4 Гц), 5,63-5,58 (м, 2H), 5,27 (д, 1Н, J=10,2 Гц), 4,85-4,76 (м, 1Н), 4,42 (д, 1Н, J=9,3 Гц), 4,25-4,17 (м, 1Н), 3,70-3,69 (м, 1Н), 3,63 (с, 3H), 3,48 (уш.с, 1Н), 2,89-2,75 (м, 1Н), 2,42-2,36 (м, 2H), 2,22-2,11 (м, 4H), 2,04 (с, 3H), 1,82 (с, 3H), 1,14 (д, 3H, J=6,6 Гц), 1,03 (с, 9H).
Синтез соединения 84
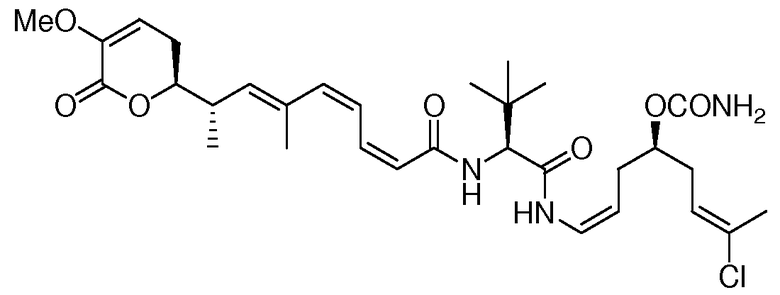
К раствору соединения 83 (300 мг, 0,53 ммоль) в безводном DCM (7,5 мл), при температуре 0°С, добавляют трихлорацетилизоцианат (TCAI) (76 мкл, 0,64 ммоль). Реакционную смесь перемешивают при температуре 0°С в течение 30 минут и затем добавляют нейтральный оксид алюминия. Смесь перемешивают в течение 5-30 минут и затем наносят, при пропитке, на слой оксида алюминия. Продукт вымывают, используя смесь DCM/МеОН = 50:1. Фильтрат выпаривают в вакууме, получая сырой продукт, который очищают с помощью колоночной хроматографии (гексан/EtOAc = от 2:1 до 1:2), получая соединение 84 (0,26 г, выход: 81%) в виде твердого вещества белого цвета.
1H ЯМР (CDCl3, 300 МГц) δ: 8,78 (д, 1H, J=10,8 Гц), 7,30 (дд, 1H, J=11,6, 11,6 Гц), 6,91 (дд, 1H, J=11,6, 11,6 Гц), 6,84 (уш.дд, 1H, J=10,8, 9,7 Гц), 6,51 (д, 1H, J=9,5 Гц), 6,17 (д, 1H, J=11,6 Гц), 5,70 (д, 1H, J=11,6 Гц), 5,63 (дд, 1H, J=6,5, 2,6 Гц), 5,61 (уш.т, 1H, J=6,8 Гц), 5,29 (д, 1H, J=9,8 Гц), 4,80 (м, 1H), 4,41 (м, 1H), 4,41 (д, 1H, J=9,5 Гц), 4,24 (ддд, 1H, J=11,5, 7,1, 4,1 Гц), 3,66 (с, 3H), 2,85 (ддкв, 1H, J=9,8, 7,1, 6,7 Гц), 2,46 (м, 1H), 2,45 (ддд, 1H, J=17,3, 11,5, 2,6 Гц), 2,37 (ддд, 1H, J=17,3, 6,5, 4,1 Гц), 2,33 (м, 2H), 2,09 (ддд, 1H, J=14,1, 8,4, 8,1 Гц), 2,06 (с, 3H), 1,82 (с, 3H), 1,15 (д, 3H, J=6,7 Гц), 1,04 (с, 9H).
13С-ЯМР (CDCl3, 75 МГц) δ: 168,2, 166,3, 161,6, 157,2, 145,2, 140,2, 137,6, 134,1, 133,7, 132,0, 124,6, 124,5, 122,4, 120,7, 108,2, 105,0, 81,9, 74,9, 60,8, 55,4, 37,1, 34,7, 33,0, 30,7, 26,7, 26,1, 21,0, 17,1, 16,3.
Синтез соединения 85
К охлажденному до температуры -78°С раствору соединения 84 (10 мг, 0,016 ммоль) в безводном дихлорметане (0,3 мл), в атмосфере аргона, добавляют 1 М раствор диизобутилалюминийгидрида (DIBAL) в толуоле (0,02 мл, 0,02 моль) и смесь перемешивают при температуре -78°С. Спустя 2 часа, реакционную смесь гасят с помощью насыщенного водного раствора NH4Cl и разбавляют дихлорметаном (2 мл). Смесь перемешивают в течение 0,5 часов при комнатной температуре и затем органический слой декантируют. Водный остаток экстрагируют дополнительным количеством дихлорметана (2 раза по 4 мл), объединенные органические слои сушат (безводный Na2SO4) и растворитель выпаривают. Сырой продукт очищают с помощью колоночной хроматографии (гексан/EtOAc = от 2:1 до 1:2), получая соединение 85 (5 мг, выход: 50%) в виде бесцветного масла.
1H ЯМР (CDCl3, 300 МГц) δ: 8,57 (д, 1H, J=10,9 Гц), 7,19 (т, 1H, J=11,3 Гц), 6,92 (т, 1H, J=11,4 Гц), 6,82 (т, 1H, J=9,3 Гц), 6,38 (д, 1H, J=9,5 Гц), 6,18 (д, 1H, J=11,5 Гц), 5,64 (д, 1H, J=11,2 Гц), 5,60 (м, 1H), 5,35 (д, 1H, J=10,0 Гц), 5,27 (д, 1H, J=3,1 Гц), 4,81 (м, 2H), 4,46 (м, 1H), 4,40 (д, 1H, J=9,5 Гц), 3,85 (м, 1H), 3,57 (с, 3H), 3,21 (д, 1H, J=3,1 Гц), 2,61 (м, 1H), 2,46-2,29 (м, 3H), 2,14-2,08 (м, 3H), 2,06 (с, 3H), 1,81 (с, 3H), 1,08 (д, 3H, J=6,7 Гц), 1,05 (с, 9H).
Пример 18
На схеме 18 представлен синтез некоторых соединений согласно данному изобретению.
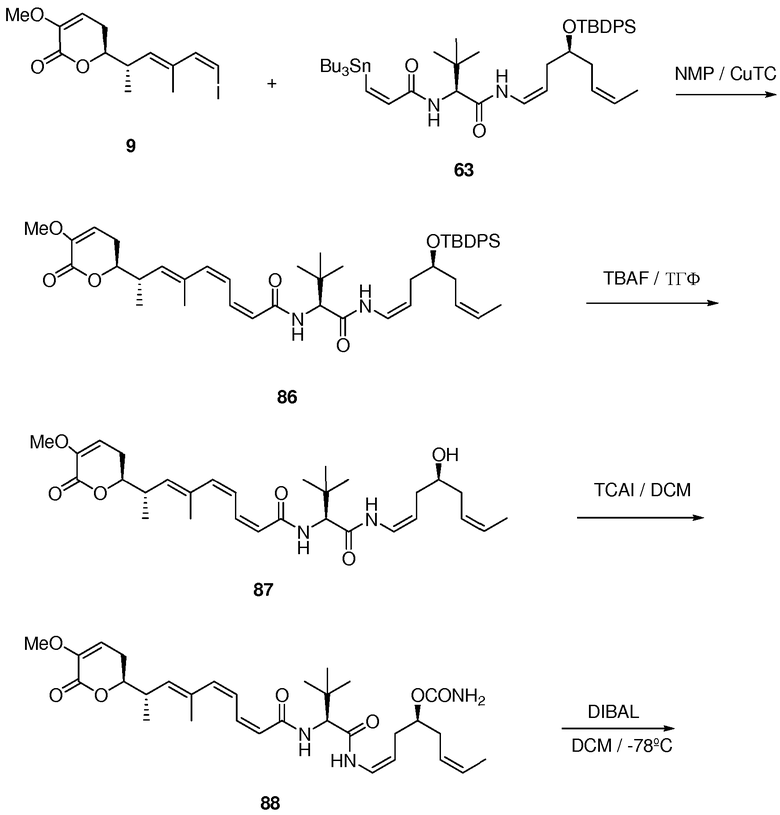

Синтез соединения 86
К раствору алкенилстаннана 63 (780,4 мг, 0,904 ммоль) и продукта 9 (377,4 мг, 1,085 ммоль) в NMP (9 мл), при температуре 0°С, добавляют тиофенкарбоксилат меди (258,5 мг, 1,36 ммоль). Реакционную смесь перемешивают при температуре 0°С в течение 45 минут и в течение 20 минут - при комнатной температуре. Затем сырую смесь отфильтровывают через слой нейтрального оксида алюминия, промывают с помощью смеси EtOAc/диэтиловый эфир (50:50) и объединенные фильтраты промывают с помощью 0,5 н раствора HCl (3 раза по 10 мл). Органический раствор сушат и выпаривают, получая сырой продукт, который очищают с помощью колоночной хроматографии (гексан/EtOAc = от 5:1 до 1:1), получая триен 86 (459,7 мг, выход: 66%) в виде масла.
1H ЯМР (CDCl3, 300 МГц) δ: 7,66-7,64 (м, 4H), 7,43-7,32 (м, 7H), 7,23 (т, 1H, J=11,7 Гц), 6,85 (т, 1H, J=11,7 Гц), 6,62 (дд, 1H, J=10,5, 9,3 Гц), 6,41 (д, 1H, J=9,3 Гц), 6,11 (д, 1H, J=11,7 Гц), 5,66 (д, 1H, J=11,4 Гц), 5,60 (дд, 1H, J=5,7, 5,1 Гц), 5,49-5,41 (м, 1H), 5,32-5,27 (м, 1H), 5,25 (д, 1H, J=9,9 Гц), 4,83-4,75 (м, 1H), 4,32 (д, 1H, J=9,3 Гц), 4,22-4,15 (м, 1H), 3,83-3,78 (м, 1H), 3,62 (с, 3H), 2,86-2,78 (м, 1H), 2,40-2,35 (м, 2H), 2,20-2,04 (м, 4H), 1,81 (с, 3H), 1,40 (д, 3H, J=6,9 Гц), 1,13 (д, 3H, J=6,9 Гц), 1,03 (с, 9H), 0,97 (с, 9H).
13С-ЯМР (CDCl3, 75 МГц) δ: 168,3, 166,3, 161,8, 145,4, 140,2, 137,3, 136,1, 134,8, 134,4, 134,3, 129,9, 127,8, 126,4, 126,1, 124,4, 121,7, 121,2, 108,4, 109,1, 82,0, 72,6, 60,6, 55,6, 37,5, 35,2, 32,7, 31,1, 27,2, 26,8, 26,5, 19,5, 17,4, 16,9, 13,1.
Синтез соединения 87
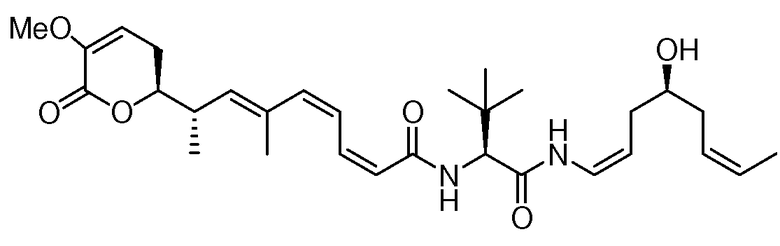
К раствору соединения 86 (586 мг, 0,76 ммоль) в безводном ТГФ (7,5 мл), в атмосфере азота и при комнатной температуре, добавляют 1 М раствор TBAF в ТГФ (1,53 мл, 2 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 18 часов и затем гасят с помощью насыщенного водного раствора NH4Cl и экстрагируют EtOAc. Объединенные органические фазы сушат над безводным Na2SO4, отфильтровывают и концентрируют. Остаток очищают с помощью флэш-хроматографии (гексан/EtOAc = от 3:1 до 1:2), получая спирт 87 (320 мг, выход: 80%) в виде твердого вещества белого цвета.
1H ЯМР (CDCl3, 300 МГц) δ: 8,95 (д, 1H, J=10,2 Гц), 7,25 (т, 1H, J=12,0 Гц), 6,85 (т, 1H, J=11,7 Гц), 6,73 (т, 1H, J=9,6 Гц), 6,57 (д, 1H, J=8,7 Гц), 6,12 (д, 1H, J=11A Гц), 5,67 (д, 1H, J=11A Гц), 5,61 (дд, 1H, J=5,4, 3,9 Гц), 5,63-5,58 (м, 1H), 5,44-5,35 (м, 1H), 5,26 (д, 1H, J=9,9 Гц), 4,86 (кв, 1H, J=8,1 Гц), 4,38 (д, 1H, J=9,3 Гц), 4,24-4,16 (м, 1H), 3,81-3,71 (м, 1H), 3,64 (с, 3H), 2,96-2,92 (м, 1H), 2,86-2,79 (м, 1H), 2,41-2,37 (м, 2H), 2,28-2,14 (м, 4H), 1,82 (с, 3H), 1,61 (д, 3H, J=6,6 Гц), 1,14 (д, 3H, J=6,6 Гц), 1,02 (с, 9H).
13С-ЯМР (CDCl3, 75 МГц) δ: 168,7, 166,6, 161,8, 145,4, 140,3, 137,5, 134,4, 134,3, 127,7, 126,0, 124,4, 123,7, 121,1, 108,9, 108,4, 82,0, 72,1, 60,9, 55,7, 37,6, 35,0, 34,8, 33,2, 26,9, 26,5, 17,4, 16,9, 13,3.
Синтез соединения 88
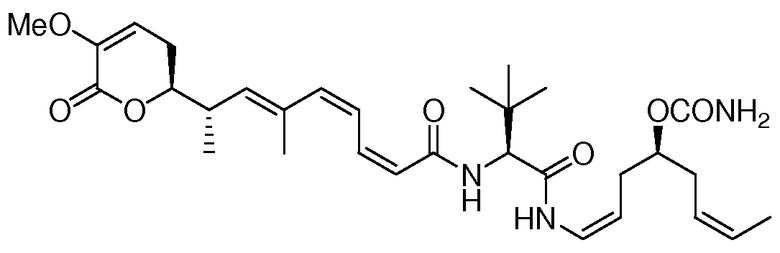
К раствору продукта 87 (56 мг, 0,105 ммоль) в безводном DCM (1 мл), при температуре 0°С, добавляют трихлорацетилизоцианат (15 мкл, 0,126 ммоль). Реакционную смесь перемешивают при температуре 0°С в течение 30 минут и затем добавляют нейтральный оксид алюминия. Эту смесь перемешивают в течение 5-30 минут и затем наносят, при пропитке, на слой оксида алюминия. Продукт вымывают, используя смесь DCM/МеОН (50:1). Фильтрат выпаривают в вакууме, получая сырой продукт, который очищают с помощью колоночной хроматографии (гексан/EtOAc = от 3:1 до 1:2), получая соединение 88 (57,6 мг, выход: 96%) в виде пены белого цвета.
1H ЯМР (CDCl3, 300 МГц) δ: 8,69 (д, 1H, J=10,4 Гц), 7,31 (дд, 1H, J=11,6, 11,6 Гц), 6,90 (дд, 1H, J=11,6, 11,6 Гц), 6,82 (ддд, 1H, J=10,4, 9,1, 0,9 Гц), 6,53 (д, 1H, J=9,6 Гц), 6,15 (д, 1H, J=11,6 Гц), 5,72 (уш.д, 1H, J=11,6 Гц), 5,63 (дд, 1H, J=6,6, 2,7 Гц), 5,60 (м, 1H), 5,40 (м, 1H), 5,29 (д, 1H, J=9,9 Гц), 4,82 (м, 1H), 4,45 (м, 1H), 4,44 (д, 1H, J=9,6 Гц), 4,25 (ддд, 1H, J=11,3, 7,0, 4,0 Гц), 3,66 (с, 3H), 2,85 (ддкв, 1H, J=9,9, 7,0, 6,7 Гц), 2,46 (м, 1H), 2,44 (м, 1H), 2,39 (м, 1H), 2,35 (м, 2H), 2,12 (ддд, 1H, J=14,1, 8,0, 8,0 Гц), 1,82 (с, 3H), 1,63 (дд, 3H, J=6,8, 1,0 Гц), 1,15 (д, 3H, J=6,7 Гц), 1,04 (с, 9H).
13С-ЯМР (CDCl3, 75 МГц) δ: 168,2, 166,3, 161,6, 157,6, 145,2, 140,2, 137,5, 134,1, 133,8, 127,1, 124,9, 124,4, 124,2, 120,8, 108,2, 105,8, 81,9, 75,6, 60,7, 55,4, 37,1, 34,8, 31,4, 30,9, 26,7, 26,1, 17,1, 16,4, 13,0.
Синтез соединения 89
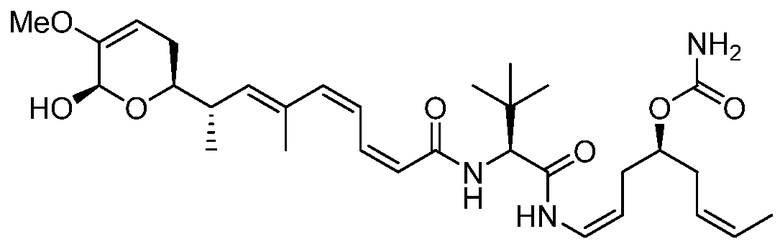
К охлажденному до температуры -78°С раствору соединения 88 (15 мг, 0,0262 ммоль) в безводном дихлорметане (0,5 мл), в атмосфере аргона, добавляют 1 М раствор диизобутилалюминийгидрида (DIBAL), в толуоле (0,03 мл, 0,034 моль), и смесь перемешивают при температуре -78°С. Спустя 2 часа, реакционную смесь гасят с помощью насыщенного водного раствора NH4Cl и разбавляют дихлорметаном (2 мл). Смесь перемешивают в течение 0,5 часов при комнатной температуре и затем органический слой декантируют. Водный остаток экстрагируют дополнительным количеством дихлорметана (2 раза по 4 мл), объединенные органические слои сушат (безводный Na2SO4) и растворитель выпаривают, получая соединение 89 (12 мг, выход: 80%), без дальнейшей очистки.
1H ЯМР (CDCl3, 500 МГц) δ: 8,67 (д, 1H, J=10,7 Гц), 7,17 (м, 1H), 6,92 (т, 1H, J=11,4 Гц), 6,81 (т, 1H, J=9,6 Гц), 6,44 (д, 1H, J=9,5 Гц), 6,18 (д, 1H, J=11,5 Гц), 5,65 (д, 1H, J=11,4 Гц), 5,59 (м, 1H), 5,40 (м, 1H), 5,35 (д, 1H, J=10,0 Гц), 5,27 (с, 1H), 4,83 (кв, 1H, J=8,3 Гц), 4,80 (м, 1H), 4,46 (м, 1H), 4,40 (д, 1H, J=9,6 Гц), 3,85 (м, 1H), 3,57 (с, 3H), 3,27 (с, 1H), 2,61 (м, 1H), 2,42 (м, 2H), 2,15-1,99 (м, 4H), 1,83 (с, 3H), 1,63 (д, 3H, J=6,7 Гц), 1,08 (д, 3H, J=6,6 Гц), 1,04 (с, 9H).
Пример 19
На схеме 19 представлен синтез некоторых соединений согласно данному изобретению.
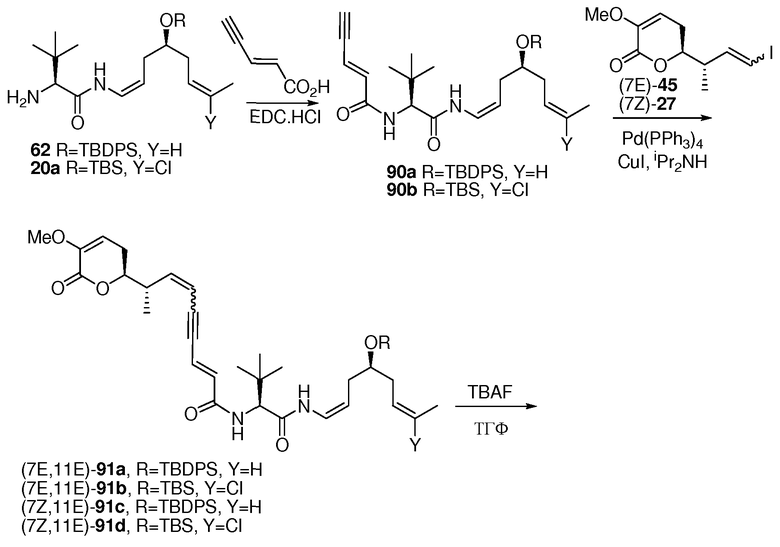
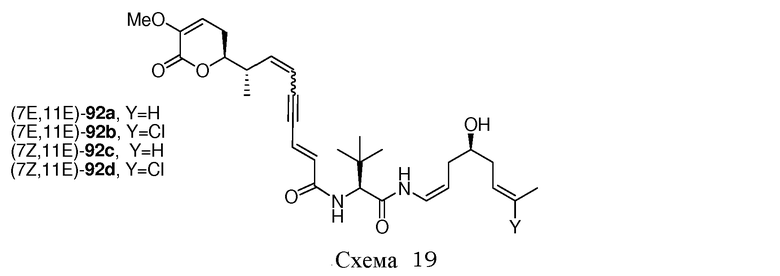
Синтез промежуточного продукта 90а

Раствор (Е)-пент-2-ен-4-овой кислоты (52 мг, 0,54 ммоль), амина 62 (232 мг, 0,47 ммоль) в безводном DCM (5 мл) охлаждают до температуры 0°С, в атмосфере аргона, и добавляют N-(3-диметиламинопропил)-N'-этилкарбодиимидгидрохлорид (EDC) (100 мг, 0,52 ммоль). Реакционную смесь перемешивают при температуре 0°С в течение 10 минут и затем при температуре 23°С - в течение 90 минут, гасят с помощью насыщенного водного раствора NH4Cl и экстрагируют дихлорметаном. Объединенные органические слои сушат (безводный Na2SO4), отфильтровывают и концентрируют, получая продукт 90а (223 мг, выход: 83%) в виде бесцветного пенообразного твердого вещества, которое используют без дальнейшей очистки.
1H ЯМР (CDCl3, 300 МГц) δ: 7,69-7,67 (м, 4H), 7,44-7,36 (м, 6H), 7,11 (д, 1H, J=10,8 Гц), 6,72-6,60 (м, 2H), 6,42 (д, 1H J=8,1 Гц), 6,41 (д, 1H J=15,6 Гц), 5,54-5,45 (м, 1H), 5,36-5,27 (м, 1H), 4,89-4,81 (м, 1H), 4,30 (д, 1H, J=9,3 Гц), 3,89-3,79 (м, 1H), 3,25 (уш.с, 1H), 2,25-2,02 (м, 4H), 1,45 (д, 3H, J=6,3 Гц), 1,05 (с, 9H), 0,97 (с, 9H).
MS (ES) [m/z] = 593,3 [М+Na]+.
13С-ЯМР (CDCl3, 125 МГц) δ: 167,7, 164,1, 135,8, 134,4, 134,1, 129,7, 129,7, 127,6, 127,6, 126,4, 125,8, 121,4, 121,1, 109,2, 84,6, 80,5, 72,3, 60,7, 35,3, 33,8, 32,4, 29,7, 27,0, 26,5, 19,3, 12,9.
Синтез промежуточного продукта 90b
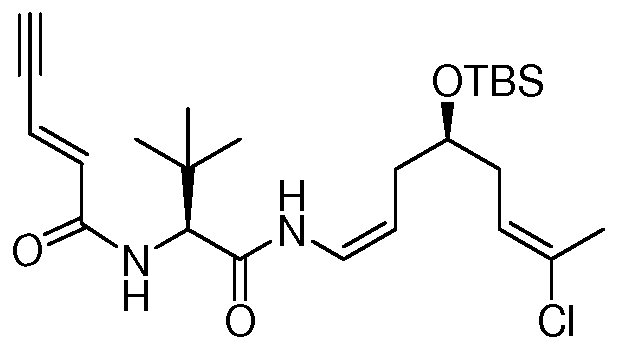
К раствору амина 20а (96,04 мг, 0,24 ммоль) и (Е)-пент-2-ен-4-овой кислоты (27,4 мг, 0,28 ммоль) в безводной смеси дихлорметан/ДМФА (10:1, 3,3 мл), в атмосфере аргона и при температуре 0°С, добавляют DIPEA (0,049 мл, 0,28 ммоль), HOAt (38,11 мг, 0,28 ммоль) и HATU (106,4 мг, 0,28 ммоль) и спустя 30 минут ледяную баню отставляют. Реакционную смесь перемешивают при комнатной температуре в течение 2 часов, гасят с помощью насыщенного водного раствора NH4Cl, выливают в воду и экстрагируют дихлорметаном. Объединенные органические фазы сушат над безводным Na2SO4, отфильтровывают и концентрируют. Остаток очищают с помощью флэш-хроматографии (гексан/EtOAc = от 20:1 до 10:1), получая амид 90b (81,9 мг, выход: 71%) в виде пены белого цвета.
1H ЯМР (CDCl3, 300 МГц) δ: 7,91 (д, 1H, J=10,2 Гц), 6,74-6,63 (м, 3H), 6,48 (д, 1H, J=15,6 Гц), 5,58-5,53 (м, 1H), 4,89-4,81 (м, 1H), 4,48 (д, 1H, J=9,3 Гц), 3,77-3,73 (м, 1H), 3,25 (д, 1H, J=9,3 Гц), 2,18-2,09 (м, 4H), 2,01 (с, 3H), 1,02 (с, 9H), 0,87 (с, 9H), 0,06 (с, 3H), 0,04 (с, 3H).
13С-ЯМР (CDCl3, 75 МГц) δ: 168,3, 164,4, 134,7, 131,7, 133,9, 122,5, 121,3, 109,1, 84,8, 80,8, 71,6, 61,0, 36,5, 35,4, 33,8, 26,8, 26,0, 21,2, 18,3, -4,3, -4,4.
Синтез соединения 91а
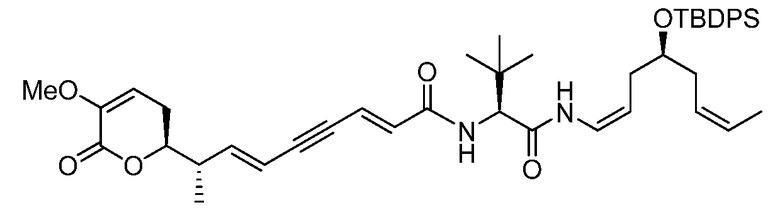
К раствору продукта 45 (56,2 мг, 0,182 ммоль) в DIPA (1,6 мл), при температуре 23°С, добавляют Pd(Ph3P)4 (15,7 мг, 0,014 ммоль) и CuI (5,2 мг, 0,028 ммоль). Затем добавляют соединение 90а (114,6 мг, 0,200 ммоль), в 0,4 мл DIPA, и реакционную смесь перемешивают при температуре 23°С в течение 90 минут. Сырую смесь гасят водой и экстрагируют EtOAc. Органическую фазу сушат (безводный Na2SO4) и выпаривают при пониженном давлении. Остаток очищают с помощью флэш-хроматографии (EtOAc/гексаны = от 1:4 до 6:1), получая чистое соединение 91а (96 мг, выход: 70%) в виде бесцветного масла.
1H ЯМР (CDCl3, 300 МГц) δ: 7,68-7,66 (м, 4H), 7,46-7,35 (м, 6H), 7,11 (д, 1H, J=10,8 Гц), 6,81 (дд, 1H, J=15,3, 2,1 Гц), 6,30 (дд, 1H, J=10,2, 9,3 Гц), 6,32 (д, 1H, J=9,3 Гц), 6,25 (д, 1H, J=15,3 Гц), 6,15 6,32 (дд, 1H, J=15,9, 8,4 Гц), 5,74 (д, 1H, J=15,9 Гц), 5,62 (дд, 1H, J=6,3, 3,0 Гц), 5,54-5,46 (м, 1H), 5,30-5,27 (м, 1H), 4,84-4,82 (м, 1H), 4,30 (д, 1H, J=9,3 Гц), 4,28-4,21 (м, 1H), 3,86-3,82 (м, 1H), 3,65 (с, 3H), 2,68-2,62 (м, 1H), 2,43-2,36 (м, 2H), 2,22-2,04 (м, 4H), 1,43 (д, 3H, J=6,6 Гц), 1,18 (д, 3H, J=6,9 Гц), 1,04 (с, 9H), 0,96 (с, 9H).
13С-ЯМР (CDCl3, 125 МГц) δ: 167,7, 164,3, 161,3, 145,5, 145,2, 135,2, 134,1, 131,8, 129,8, 129,7, 127,6, 127,6, 126,4, 125,8, 122,2, 121,4, 111,3, 109,1, 108,0, 95,1, 86,7, 80,8, 72,3, 60,7, 55,4, 41,5, 35,2, 33,8, 32,4, 29,7, 27,0, 26,5, 25,9, 19,3, 15,5, 12,9.
Синтез соединения 91b
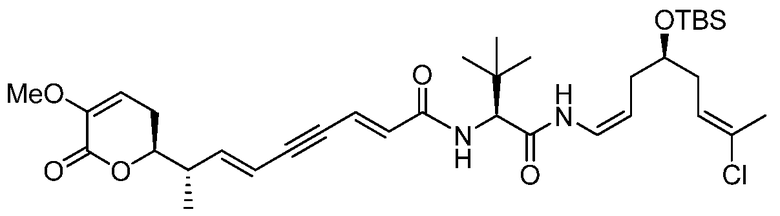
К раствору продукта 45 (30,2 мг, 0,098 ммоль) в DIPA (0,5 мл), при температуре 23°С, добавляют Pd(Ph3P)4 (8 мг, 0,007 ммоль) и CuI (3 мг, 0,014 ммоль). Затем добавляют соединение 90b (47,6 мг, 0,098 ммоль) в 0,5 мл DIPA и реакционную смесь перемешивают при температуре 23°С в течение 90 минут. Сырую смесь гасят водой и экстрагируют EtOAc. Органическую фазу сушат (безводный Na2SO4) и выпаривают при пониженном давлении. Остаток очищают с помощью флэш-хроматографии (EtOAc/гексаны = от 1:4 до 1:1), получая чистое соединение 91b (41,2 мг, выход: 64%) в виде бесцветного масла.
1H ЯМР (CDCl3, 300 МГц) δ: 7,70 (д, 1H, J=10,2 Гц), 6,82 (дд, 1H, J=15,3, 2,4 Гц), 6,72 (т, 1H, J=9,5 Гц), 6,28 (д, 1H, J=9,0 Гц), 6,25 (д, 1H, J=15,3 Гц), 6,15 (дд, 1H, J=15,9, 8,1 Гц), 5,74 (д, 1H, J=15,9 Гц), 5,63 (дд, 1H, J=6,3, 3,0 Гц), 5,62-5,55 (м, 1H), 4,89-4,81 (м, 1H), 4,38 (д, 1H, J=9,6 Гц), 4,30-4,23 (м, 1H), 3,79-3,75 (м, 1H), 3,65 (с, 3H), 2,69-2,61 (м, 1H), 2,44-2,32 (м, 2H), 2,20-2,14 (м, 4H), 2,02 (с, 3H), 1,18 (д, 3H, J=6,6 Гц), 1,02 (с, 9H), 0,87 (с, 9H), 0,07 (с, 3H), 0,05 (с, 3H).
13С-ЯМР (CDCl3, 75 МГц) δ: 168,1, 164,6, 161,5, 145,7, 145,4, 132,1, 131,2, 123,9, 122,4, 111,5, 108,9, 108,2, 95,4, 86,9, 81,0, 71,7, 61,0, 55,7, 41,7, 36,5, 35,4, 33,8, 29,9, 26,8, 26,2, 26,1, 21,3, 18,3, 15,7, -4,3, -4,4.
Синтез соединения 91с
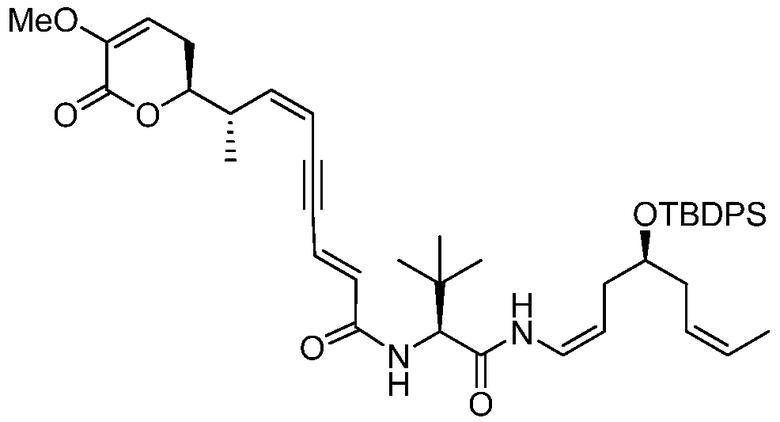
К раствору продукта 27 (58 мг, 0,188 ммоль) в DIPA (1,6 мл), при температуре 23°С, добавляют Pd(Ph3P)4 (16,3 мг, 0,014 ммоль) и CuI (5,3 мг, 0,028 ммоль). Затем добавляют соединение 90а (118,2 мг, 0,207 ммоль), в 0,4 мл DIPA, и реакционную смесь перемешивают при температуре 23°С в течение 90 минут. Сырую смесь гасят водой и экстрагируют EtOAc. Органическую фазу сушат (безводный Na2SO4) и выпаривают при пониженном давлении. Остаток очищают с помощью флэш-хроматографии (EtOAc/гексаны = от 1:4 до 6:1), получая чистое соединение 91с (92 мг, выход: 65%) в виде бесцветного масла.
1H ЯМР (CDCl3, 300 МГц) δ: 7,68-7,66 (м, 4H), 7,46-7,35(м, 6H), 7,15 (д, 1H, J=10,5 Гц), 6,85 (дд, 1H, J=15,3, 2,1 Гц), 6,64 (дд, 1H, J=10,5, 9,3 Гц), 6,39 (д, 1H, J=9,0 Гц), 6,30 (д, 1H, J=15,3 Гц), 5,88 (т, 1H, J=10,5 Гц), 5,71 (дд, 1H, J=10,5, 2,1 Гц), 5,69-5,61 (м, 1H), 5,53-5,47 (м, 1H), 5,35-5,30 (м, 1H), 4,88-4,80 (м, 1H), 4,31 (д, 1H, J=9,6 Гц), 4,28-4,19 (м, 1H), 3,87-3,82 (м, 1H), 3,65 (с, 3H), 3,14-3,06 (м, 1H), 2,58-2,47 (м, 1H), 2,41-2,32 (м, 1H), 2,23-2,04 (м, 4H), 1,43 (д, 3H, J=6,6 Гц), 1,18 (д, 3H, J=6,9 Гц), 1,05 (с, 9H), 0,98 (с, 9H).
13С-ЯМР (CDCl3, 300 МГц) δ: 167,9, 164,5, 161,7, 145,5, 145,4, 136,1, 134,3, 132,4, 130,0, 129,9, 127,9, 127,8, 126,7, 126,1, 122,2, 121,6, 110,7, 109,4, 108,4, 93,2, 91,8, 81,0, 72,6, 61,0, 55,6, 39,6, 35,4, 34,0, 32,7, 29,8, 27,2, 26,8, 23,5, 19,5, 15,8, 13,2.
Синтез соединения 91d
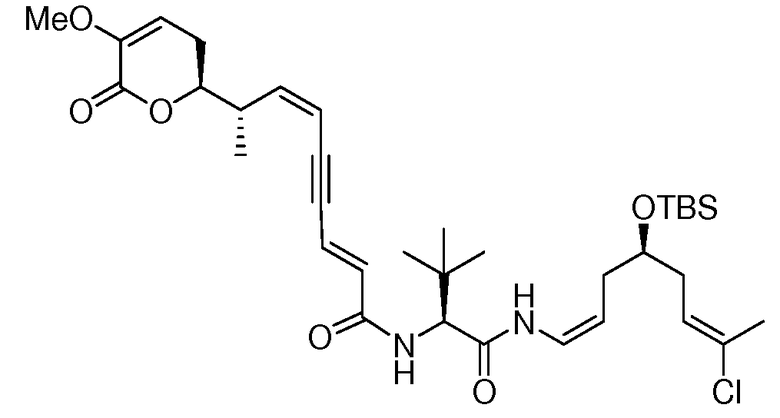
К раствору продукта 27 (26,2 мг, 0,085 ммоль) в DIPEA (4 мл), при температуре -20°С, добавляют Pd(Ph3P)2Cl2 (6 мг, 0,0085 ммоль) и CuI (5 мг, 0,025 ммоль). Затем добавляют соединение 90b (45 мг, 0,094 ммоль) и реакционную смесь перемешивают при температуре 23°С в течение 90 минут. Сырую смесь гасят водой и экстрагируют EtOAc. Органическую фазу сушат (безводный Na2SO4) и выпаривают при пониженном давлении. Очищают с помощью колоночной хроматографии (EtOAc/гексаны = от 1:10 до 2:1), получая соединение 91d (44,5 мг, выход: 79%) в виде бесцветного масла.
1H ЯМР (CDCl3, 300 МГц) δ: 7,75 (д, 1H, J=11,1 Гц), 6,81 (дд, 1H, J=15,6, 2,4 Гц), 6,68 (т, 1H, J=9,3 Гц), 6,37 (д, 1H, J=9,3 Гц), 6,34 (д, 1H, J=11,7 Гц), 5,87 (т, 1H, J=10,8 Гц), 5,70 (дд, 1H, J=10,8, 2,4 Гц), 5,62-5,57 (м, 2H), 4,85 (кв, 1H, J=8,1 Гц), 4,41 (д, 1H, J=9,3 Гц), 4,28-4,18 (м, 1H), 3,81-3,72 (м, 1H), 3,64 (с, 3H), 3,16-3,06 (м, 1H), 2,56-2,46 (м, 1H), 2,40-2,32 (м, 1H), 2,26-2,13 (м, 4H), 2,04 (с, 3H), 1,17 (д, 3H, J=6,6 Гц), 1,03 (с, 9H), 0,87 (с, 9H), 0,07 (с, 3H), 0,05 (с, 3H).
Синтез соединения 92а
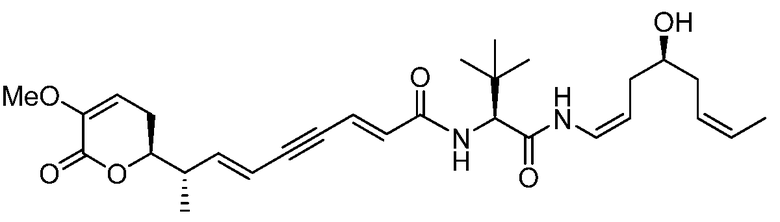
К раствору продукта 91а (78,2 мг, 0,104 ммоль) в безводном ТГФ (2 мл), в атмосфере азота и при температуре 0°С, добавляют 1 М раствор TBAF в ТГФ (0,2 мл, 0,208 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 3 часов и затем гасят с помощью насыщенного водного раствора NH4Cl и экстрагируют EtOAc. Объединенные органические фазы сушат над безводным Na2SO4, отфильтровывают и концентрируют. Остаток очищают с помощью флэш-хроматографии (гексан/EtOAc = от 4:1 до 1:2), получая спирт 92а (17,9 мг, выход: 34%) в виде масла бледно-желтого цвета.
1H ЯМР (CDCl3, 500 МГц) δ: 8,89 (д, 1H, J=10,0 Гц), 6,80 (дд, 1H, J=15,0, 2,0 Гц), 6,75 (дд, 1Н, J=10,0, 9,0 Гц), 6,50 (д, 1Н, J=9,5 Гц), 6,28 (д, 1Н, J=15,5 Гц), 6,14 (дд, 1Н, J=15,5, 8,0 Гц), 5,74 (дд, 1Н, J=16,0, 2,5 Гц), 5,68-65 (м, 1Н), 5,63 (дд, 1Н, J=6,5, 2,5 Гц), 5,42-5,39 (м, 1Н), 4,92-4,90 (м, 1Н), 4,37 (д, 1Н, J=9,0 Гц), 4,28-4,23 (м, 1Н), 3,79-3,73 (м, 1Н), 3,65 (с, 3H), 2,67-2,62 (м, 1Н), 2,47-2,37 (м, 2H), 2,34-2,15 (м, 4H), 1,64 (д, 3H, J=7,0 Гц), 1,18 (д, 3H, J=6,5 Гц), 1,01 (с, 9H).
Синтез соединения 92b
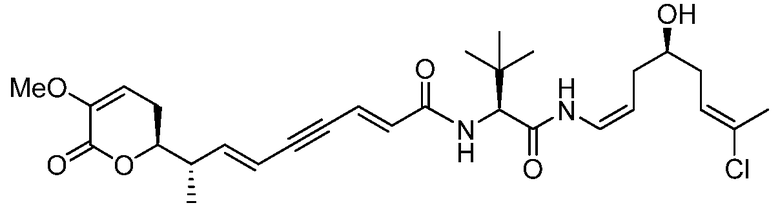
К раствору продукта 91b (41,2 мг, 0,061 ммоль) в безводном ТГФ (1 мл), в атмосфере азота и при температуре 0°С, добавляют 1 М раствор TBAF в ТГФ (0,12 мл, 0,122 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 18 часов и затем гасят с помощью насыщенного водного раствора NH4Cl и экстрагируют EtOAc. Объединенные органические фазы сушат над безводным Na2SO4, отфильтровывают и концентрируют. Остаток очищают с помощью флэш-хроматографии (гексан/EtOAc = от 4:1 до 1:2), получая спирт 92b (14,7 мг, выход: 65%) в виде масла бледно-желтого цвета.
1H ЯМР (CDCl3, 500 МГц) δ: 8,85 (д, 1H, J=10,2 Гц), 6,84-6,73 (м, 2H), 6,61 (д, 1H, J=9,3 Гц), 6,27 (д, 1H, J=15,6 Гц), 6,15 (дд, 1H, J=15,9, 8,4 Гц), 5,75 (д, 1H, J=15,9 Гц), 5,63-5,60 (м, 2H), 4,92-4,84 (м, 1H), 4,41 (д, 1H, J=9,3 Гц), 4,29-4,23 (м, 1H), 3,79-3,76 (м, 1H), 3,65 (с, 3H), 3,10 (уш.с, 1H), 2,69-2,61 (м, 1H), 2,46-2,37 (м, 2H), 2,20-2,14 (м, 4H), 2,04 (с, 3H), 1,18 (д, 3H, J=6,9 Гц), 1,02 (с, 9H).
Синтез соединения 92с
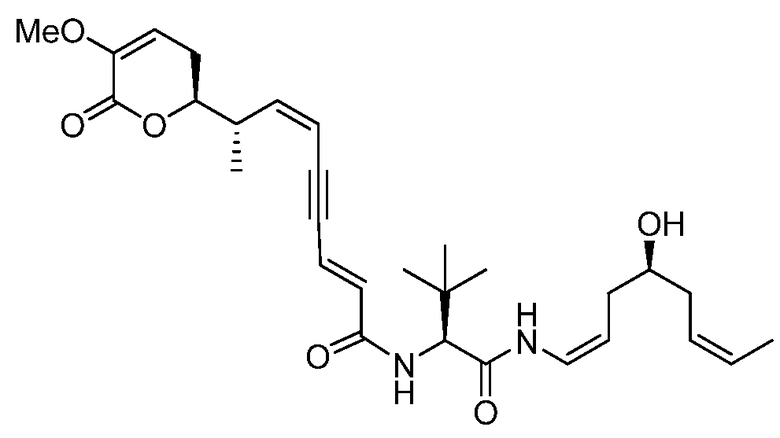
К раствору продукта 91с (71,5 мг, 0,095 ммоль) в безводном ТГФ (2 мл), в атмосфере азота и при температуре 0°С, добавляют 1 М раствор TBAF в ТГФ (0,19 мл, 0,19 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 4 часов и затем гасят с помощью насыщенного водного раствора NH4Cl и экстрагируют EtOAc. Объединенные органические фазы сушат над безводным Na2SO4, отфильтровывают и концентрируют. Остаток очищают с помощью флэш-хроматографии (гексан/EtOAc = от 4:1 до 1:2), получая спирт 92с (18,1 мг, выход: 37%) в виде масла бледно-желтого цвета.
1H ЯМР (CDCl3, 300 МГц) δ: 8,94 (д, 1H, J=9,6 Гц), 6,83 (дд, 1H, J=15,3, 2,1 Гц), 6,75 (т, 1H J=9,6 Гц), 6,57 (д, 1H, J=9,6 Гц), 6,32 (д, 1H, J=15,3 Гц), 5,88 (д, 1H, J=10,2 Гц), 5,74-5,70 (м, 1H), 5,67-5,62 (м, 2H), 5,44-5,36 (м, 1H), 4,95-4,86 (м, 1H), 4,38 (д, 1H, J=9,3 Гц), 4,28-4,23 (м, 1H), 3,77-3,73 (м, 1H), 3,65 (с, 3H), 3,14-3,06 (м, 1H), 2,59-2,11 (м, 6H), 1,63 (д, 3H, J=6,9 Гц), 1,19 (д, 3H, J=6,6 Гц), 1,02 (с, 9H).
Синтез соединения 92d
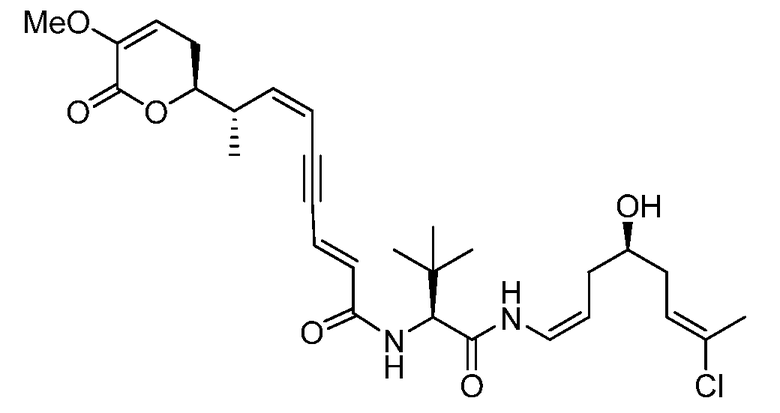
К раствору продукта 91d (40 мг, 0,06 ммоль) в безводном ТГФ (0,6 мл), в атмосфере азота и при комнатной температуре, добавляют 1 М раствор TBAF в ТГФ (0,12 мл, 0,12 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 18 часов, затем гасят с помощью насыщенного водного раствора NH4Cl и экстрагируют EtOAc. Объединенные органические фазы сушат над безводным Na2SO4, отфильтровывают и концентрируют. Остаток очищают с помощью флэш-хроматографии (гексан/EtOAc = от 4:1 до 1:2), получая спирт 92d (20 мг, выход: 61%) в виде бесцветного масла.
1H ЯМР (CDCl3, 300 МГц) δ: 8,90 (д, 1Н, J=9,9 Гц), 6,82 (дд, 1Н, J=15,6, 2,4 Гц), 6,74 (т, 1Н, J=9,6 Гц), 6,66 (д, 1Н, J=9,3 Гц), 6,33 (д, 1Н, J=9,3 Гц), 5,88 (т, 1Н, J=10,5 Гц), 5,71 (дд, 1Н, J=10,8, 2,4 Гц), 5,64-5,59 (м, 2H), 4,84 (кв, 1Н, J=7,8 Гц), 4,40 (д, 1Н, J=9,3 Гц), 4,28-4,20 (м, 1Н), 3,72 (м, 1Н), 3,64 (с, 3H), 3,13-3,06 (м, 2H), 2,58-2,47 (м, 1Н), 2,41-2,33 (м, 1Н), 2,31-2,15 (м, 4H), 2,05 (с, 3H), 1,18 (д, 3H, J=6,9 Гц), 1,02 (с, 9H).
Пример 20
На схеме 20 представлен синтез следующего соединения согласно данному изобретению.
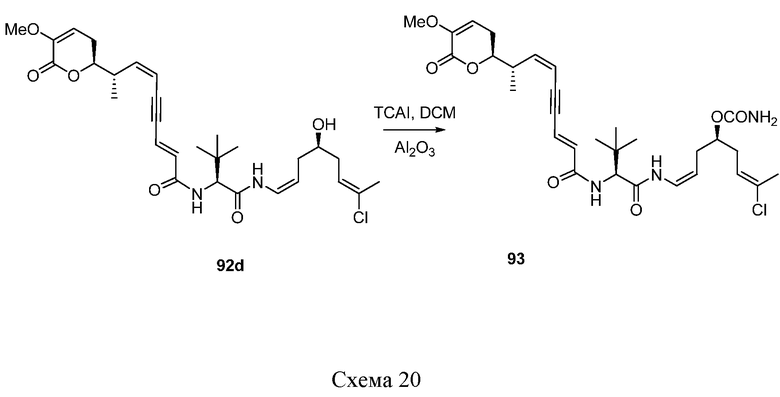
Синтез соединения 93
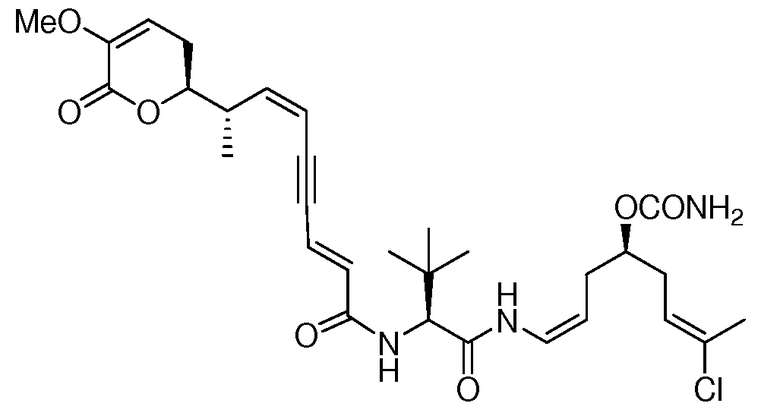
К раствору соединения 92d (6,5 мг, 0,012 ммоль) в безводном DCM (0,2 мл), при температуре 23°С, добавляют трихлорацетилизоцианат (TCAI) (1,7 мкл, 0,014 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 30 минут и затем добавляют нейтральный оксид алюминия (120 мг). Эту смесь перемешивают в течение 30 минут и затем наносят, при пропитке, на слой оксида алюминия. Продукт вымывают, используя смесь дихлорметан/МеОН = 50:1. Фильтрат выпаривают при пониженном давлении, получая сырой продукт, который очищают с помощью колоночной хроматографии (дихлорметан/МеОН = от 100:1 до 40:1), получая соединение 93 (3 мг, выход: 42%) в виде твердого вещества белого цвета.
1H ЯМР (CDC13, 300 МГц) δ: 8,83 (д, 1H, J=10,5 Гц), 6,89-6,81 (м, 2H), 6,62 (д, 1H, J=9,9 Гц), 6,32 (д, 1H, J=15,3 Гц), 5,87 (т, 1H, J=9,0 Гц), 5,73 (дд, 1H, J=10,5, 2,4 Гц), 5,65-5,57 (м, 2H), 5,38 (уш.с, 2H), 4,84-4,76 (м, 1H), 4,48 (д, 1H, J=9,3 Гц), 4,40-4,33 (м, 1H), 4,28-4,21 (м, 1H), 3,66 (с, 3H), 3,19-3,10 (м, 1H), 2,58-2,42 (м, 3H), 2,35-2,30 (м, 2H), 2,14-2,06 (м, 1H), 2,08 (с, 3H), 1,20 (д, 3H, J=6,6 Гц), 1,03 (с, 9H).
13С-ЯМР (CDCl3, 125 МГц) δ: 167,9, 164,3, 161,4, 157,6, 145,1, 145,0, 132,3, 132,0, 124,5, 122,3, 121,9, 110,6, 108,3, 104,9, 92,9, 91,7, 80,8, 75,1, 61,2, 55,5, 39,3, 35,0, 32,9, 30,9, 26,7, 26,4, 21,0, 15,9.
MS (ES) [m/z]: 590,2 [М+Н]+.
Пример 21
На схеме 21 представлен синтез некоторых соединений согласно данному изобретению.
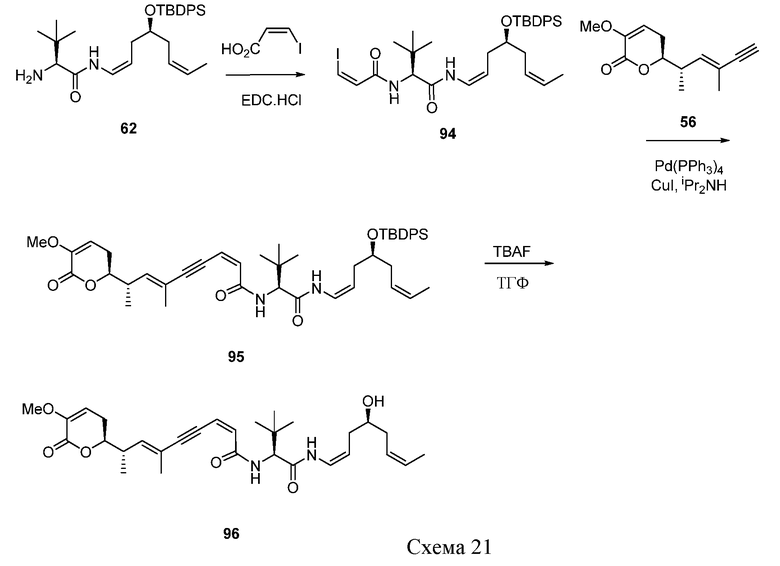
Синтез промежуточного продукта 94
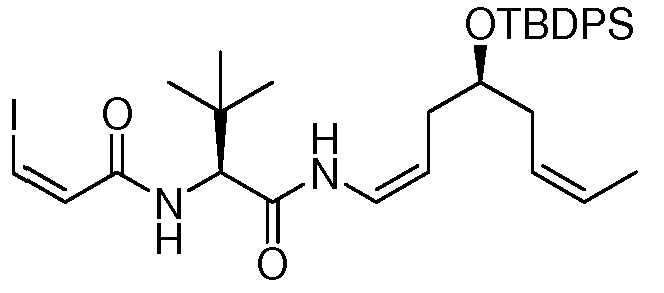
Раствор (Z)-иодакриловой кислоты (365 мг, 1,84 ммоль) (полученной, как описано Takeuchi R., Tanabe K., Tanaka S., J. Org. Chem., 2000, 65, 1558-1561), амина 62 (700 мг, 1,42 ммоль) в безводном DCM (12 мл) охлаждают до температуры 0°С, в атмосфере аргона, и добавляют N-(3-диметиламинопропил)-N'-этилкарбодиимидгидрохлорид (EDC) (340,8 мг, 1,78 ммоль). Реакционную смесь перемешивают при температуре 0°С в течение 10 минут и затем при температуре 23°С - в течение 3 часов, гасят с помощью насыщенного водного раствора NaCl и экстрагируют дихлорметаном. Объединенные органические слои сушат (безводный Na2SO4), отфильтровывают и концентрируют. Остаток очищают с помощью флэш-хроматографии (EtOAc/гексан = от 1:10 до 1:1), получая продукт 94 (675 мг, выход: 71%) в виде бесцветного пенообразного твердого вещества.
1H ЯМР (CDCl3, 300 МГц) δ: 7,69-7,66 (м, 4H), 7,44-7,36 (м, 6H), 7,24 (д, 1H, J=9,6 Гц), 7,06 (д, 1H, J=9,3 Гц), 6,90 (д, 1H J=9,0 Гц), 6,68-6,61 (м, 2H), 5,55-5,43 (м, 1H), 5,35-5,26 (м, 1H), 4,89-4,81 (м, 1H), 4,38 (д, 1H, J=9,3 Гц), 3,88-3,80 (м, 1H), 2,23-2,06 (м, 4H), 1,43 (д, 3H, J=6,9 Гц), 1,05 (с, 9H), 1,01 (с, 9H).
13С-ЯМР (CDCl3, 125 МГц) δ: 167,4, 164,3, 135,8, 134,1, 133,0, 129,7, 129,6, 127,6, 127,5, 126,4, 125,8, 121,4, 109,1, 88,3, 72,3, 60,4, 35,1, 33,8, 32,5, 27,0, 26,7, 19,3, 12,9.
MS (ES) [m/z]: 695,2 [М+Na]+.
Синтез соединения 95
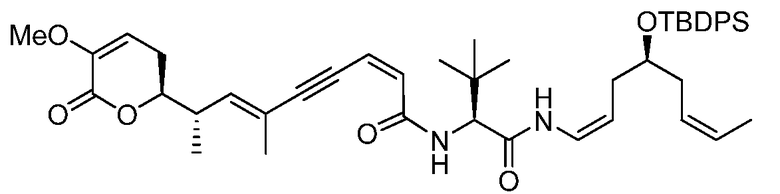
К раствору продукта 94 (304,4 мг, 0,45 ммоль) в DIPA (5,5 мл), при температуре 23°С, добавляют Pd(Ph3P)4 (39,3 мг, 0,034 ммоль) и CuI (12,9 мг, 0,068 ммоль). Затем добавляют соединение 56 (100 мг, 0,45 ммоль) и реакционную смесь перемешивают при температуре 23°С в течение 45 минут. Сырую смесь гасят водой и экстрагируют EtOAc. Органическую фазу сушат (безводный Na2SO4) и выпаривают при пониженном давлении. Остаток очищают с помощью флэш-хроматографии (EtOAc/гексан = от 1:4 до 3:1), получая чистое соединение 95 (300 мг, выход: 87%) в виде бесцветного пенообразного твердого вещества.
1H ЯМР (CDCl3, 300 МГц) δ: 7,82 (д, 1H, J=9,3 Гц), 7,68-7,65 (м, 4H), 7,46-7,29 (м, 7H), 6,62 (дд, 1H, J=10,2, 9,3 Гц), 6,14 (д, 1H, J=12,3 Гц), 6,08 (дд, 1H, J=10,5, 9,3 Гц), 6,05 (д, 1H, J=12,3 Гц), 5,60 (дд, 1H, J=6,3, 3,0 Гц), 5,52-5,43 (м, 1H), 5,33-5,25 (м, 1H), 4,85-4,77 (м, 1H), 4,44 (д, 1H, J=9,3 Гц), 4,24-4,23 (м, 1H), 3,88-3,80 (м, 1H), 3,64 (с, 3H), 2,91-2,79 (м, 1H), 2,54-2,34 (м, 2H), 2,23-2,04 (м, 4H), 1,92 (с, 3H), 1,42 (д, 3H, J=6,9 Гц), 1,13 (д, 3H, J=6,6 Гц), 1,04 (с, 9H), 0,99 (с, 9H).
13С-ЯМР (CDCl3, 125 МГц) δ: 167,9, 164,6, 161,7, 145,5, 136,1, 134,3, 132,5, 129,9, 127,8, 126,7, 126,1, 121,7, 118,9, 116,4, 108,9, 108,4, 104,5, 98,8, 82,8, 81,6, 72,6, 60,9, 55,7, 38,0, 35,5, 34,0, 32,7, 27,2, 26,9, 26,5, 19,5, 17,3, 16,5, 13,1.
Синтез соединения 96
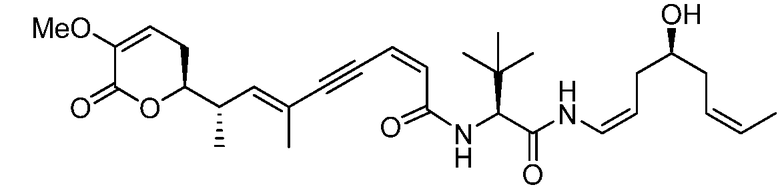
К раствору продукта 95 (250 мг, 0,326 ммоль) в ТГФ (3,3 мл), в атмосфере азота и при температуре 0°С, добавляют 1 М раствор TBAF в ТГФ (0,65 мл, 0,65 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 3 часов, затем гасят с помощью насыщенного водного раствора NH4Cl и экстрагируют EtOAc. Объединенные органические фазы сушат над безводным Na2SO4, отфильтровывают и концентрируют. Остаток очищают с помощью флэш-хроматографии (гексан/EtOAc = от 4:1 до 1:3), получая спирт 96 (150 мг, выход: 87%) в виде бесцветного масла.
1H ЯМР (CDC13, 300 МГц) δ: 8,76 (д, 1H, J=9,9 Гц), 7,83 (д, 1H, J=9,0 Гц), 6,74 (т, 1H, J=9,3 Гц), 6,17 (д, 1H, J=12,0 Гц), 6,15-6,09 (м, 1H), 6,07 (д, 1H, J=12,0 Гц), 5,74-5,60 (м, 1H), 5,61 (дд, 1H, J=6,3, 3,0 Гц), 5,44-5,37 (м, 1H), 4,94-4,85 (м, 1H), 4,41 (д, 1H, J=9,3 Гц), 4,25-4,17 (м, 1H), 3,76 (м, 1H), 3,65 (с, 3H), 2,92-2,80 (м, 1H), 2,55-2,11 (м, 6H), 1,93 (с, 3H), 1,62 (д, 3H, J=6,6 Гц), 1,14 (д, 3H, J=6,6 Гц), 1,01 (с, 9H).
Пример 22
На схеме 22 представлен синтез некоторых соединений согласно данному изобретению.
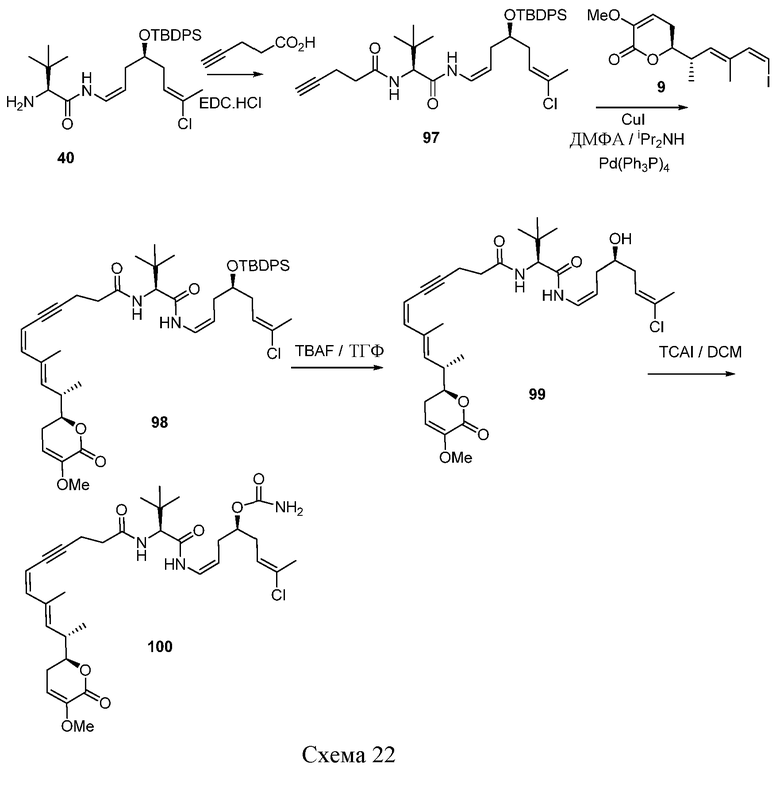
Синтез промежуточного продукта 97
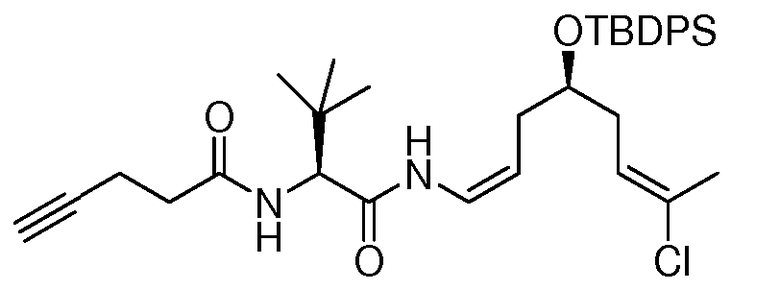
К раствору продукта 40 (200 мг, 0,38 ммоль) и 4-этилпропиоловой кислоты (48 мг, 0,49 ммоль) в безводном DCM (3,8 мл), при температуре 0°С, добавляют EDC (91 мг, 0,47 ммоль). Реакционную смесь перемешивают при температуре 0°С в течение 30 минут и затем в течение 2 часов - при комнатной температуре. После этого сырую смесь гидролизуют водой и экстрагируют дихлорметаном (3 раза по 5 мл). После сушки и выпаривания растворителя при пониженном давлении, сырой продукт очищают с помощью колоночной хроматографии (гексан/EtOAc = 6:1), получая чистое соединение 97 (105 мг, выход: 47%) в виде бесцветного масла.
1H ЯМР (CDCl3, 300 МГц) δ: 7,66 (м, 4H), 7,43 (м, 6H), 7,14 (д, 1H, J=10,6 Гц), 6,65 (т, 1H, J=9,3 Гц), 6,40 (д, 1H, J=9,1 Гц), 5,52 (т, 1H, J=7,2 Гц), 4,75 (кв, 1H, J=7,6 Гц), 4,29 (д, 1H, J=9,2 Гц), 3,81 (м, 1H), 2,63-2,40 (м, 4H), 2,19-2,03 (м, 5H), 1,86 (с, 3H), 1,05 (с, 9H), 0,98 (с, 9H).
Синтез соединения 98
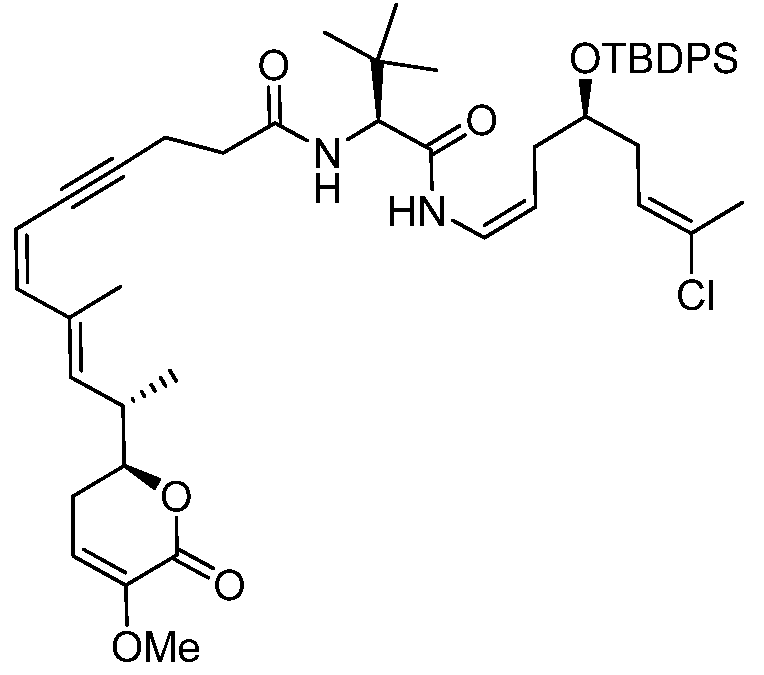
К раствору иодистого соединения 9 (52 мг, 0,148 ммоль) в диизопропиламине (0,75 мл), в атмосфере азота и при комнатной температуре, добавляют Pd(Ph3P)4 (2,3 мг, 0,002 ммоль) и CuI (1,0 мг, 0,005 ммоль). Затем, по частям, добавляют соединение 97 (90 мг, 0,148 ммоль) и реакционную смесь перемешивают при комнатной температуре в течение 2 часов. Сырой продукт гасят водой и экстрагируют EtOAc. Органическую фазу сушат (безводный Na2SO4) и выпаривают при пониженном давлении. Очищают с помощью колоночной хроматографии (гексан/EtOAc = от 3:1 до 1:2), получая чистое соединение 98 (105 мг, выход: 86%) в виде твердого вещества белого цвета.
1H ЯМР (CDCl3, 300 МГц) δ: 7,66 (м, 4H), 7,41 (м, 6H), 7,26 (д, 1H, J=10,6 Гц), 6,64 (т, 1H, J=10,1 Гц), 6,42 (д, 1H J=9,3 Гц), 6,06 (д, 1H, J=12,0 Гц), 5,61 (м, 1H), 5,48 (м, 2H), 5,35 (д, 1H, J=11,8 Гц), 4,74 (кв, 1H, J=8,3 Гц), 4,28 (д, 1H, J=9,2 Гц), 4,16 (м, 1H), 3,81 (м, 1H), 3,64 (с, 3H), 2,81 (м, 1H), 2,66 (м, 2H), 2,47-2,36 (м, 4H), 2,18-2,06 (м, 4H), 2,04 (с, 3H), 1,85 (с, 3H), 1,12 (д, 3H, J=6,6 Гц), 1,04 (с, 9H), 0,98 (с, 9H).
Синтез соединения 99
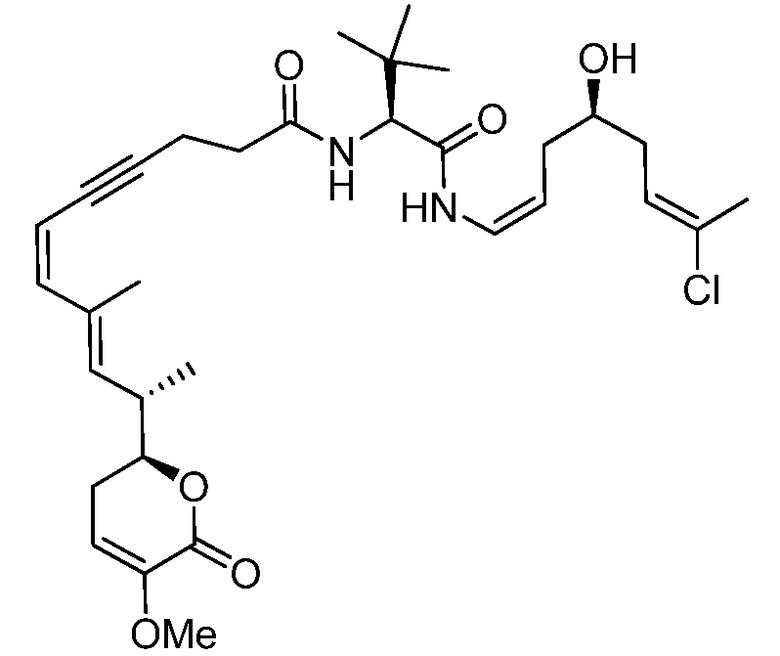
К раствору соединения 98 (75 мг, 0,09 ммоль) в безводном ТГФ (1,5 мл), в атмосфере азота и при комнатной температуре, добавляют 1 М раствор TBAF в ТГФ (0,18 мл, 0,18 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 4 часов, затем гасят с помощью насыщенного водного раствора NH4Cl и экстрагируют EtOAc. Объединенные органические фазы сушат над безводным Na2SO4, отфильтровывают и концентрируют. Остаток очищают с помощью флэш-хроматографии (гексан/EtOAc = от 3:1 до 1:3), получая спирт 99 (35 мг, выход: 67%) в виде твердого вещества белого цвета.
1H ЯМР (CDCl3, 300 МГц) δ: 8,92 (д, 1H, J=10,1 Гц), 6,74 (т, 1H, J=9,5 Гц), 6,67 (д, 1H, J=9,1 Гц), 6,06 (д, 1H, J=12,0 Гц), 5,62 (м, 2H), 5,47 (д, 1H, J=9,8 Гц), 5,34 (д, 1H, J=11,9 Гц), 4,84 (кв, 1H, J=8,5 Гц), 4,32 (д, 1H, J=9,1 Гц), 4,18 (м, 1H), 3,73 (м, 1H), 3,64 (с, 3H), 3,20 (д, 1H, J=4,0 Гц), 2,82 (м, 1H), 2,66 (м, 2H), 2,49-2,36 (м, 4H), 2,24-2,14 (м, 4H), 2,05 (с, 3H), 2,02 (с, 3H), 1,12 (д, 3H, J=6,6 Гц), 1,00 (с, 9H).
13С-ЯМР (CDCl3, 75 МГц) δ: 171,3, 168,4, 161,7, 145,1, 142,1, 135,5, 134,4, 131,7, 123,6, 123,4, 108,4, 108,2, 106,1, 94,3, 81,8, 80,2, 71,4, 60,9, 36,7, 36,1, 35,3, 34,5, 33,0, 29,6, 26,5, 26,3, 21,0, 16,4, 16,1, 15,5.
Синтез соединения 100
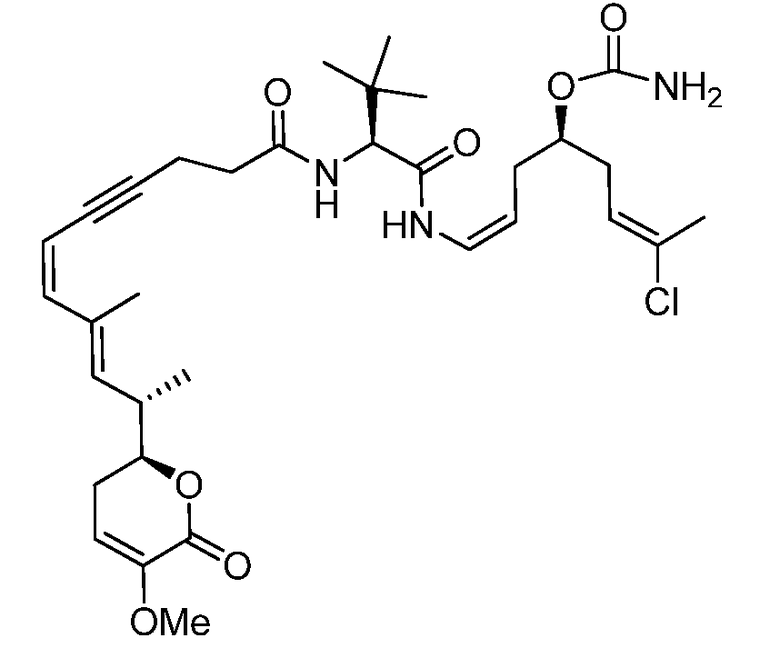
К раствору соединения 99 (30 мг, 0,05 ммоль) в безводном DCM (3,15 мл), при комнатной температуре, добавляют трихлорацетилизоцианат (TCAI) (6 мкл, 0,06 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 30 минут и затем добавляют нейтральный оксид алюминия (375 мг). Смесь перемешивают в течение 1 часа и затем наносят, при пропитке, на слой на оксида алюминия. Продукт вымывают, используя смесь дихлорметан/МеОН = 50:1. Фильтрат выпаривают при пониженном давлении, получая сырой продукт, который очищают с помощью колоночной хроматографии (гексан/EtOAc), получая соединение 100 (26 мг, выход: 82%) в виде твердого вещества белого цвета.
1Н ЯМР (CDCl3, 300 МГц) δ: 8,87 (д, 1H, J=10,7 Гц), 6,81 (т, 1H, J=9,8 Гц), 6,62 (д, 1H, J=9,5 Гц), 6,06 (д, 1H, J=12,0 Гц), 5,75 (уш.с, 2H), 5,61 (м, 2H), 5,45 (д, 1H, J=10,1 Гц), 5,35 (д, 1H, J=11,9 Гц), 4,80 (кв, 1H, J=8,4 Гц), 4,37 (м, 1H), 4,33 (д, 1H, J=9,3 Гц), 4,18 (м, 1H), 3,64 (с, 3H), 2,83 (м, 1H), 2,66 (м, 2H), 2,50-2,27 (м, 8H), 2,05 (с, 3H), 2,03 (с, 3H), 1,12 (д, 3H, J=6,6 Гц), 0,99 (с, 9H).
Пример 23
На схеме 23 представлен синтез некоторых соединений согласно данному изобретению.
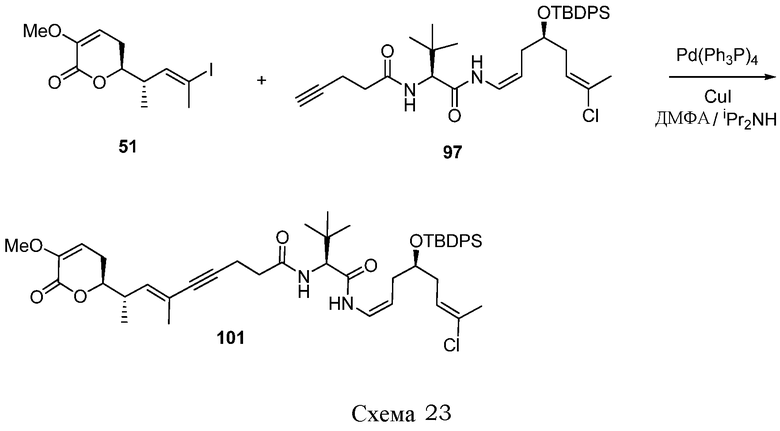
Синтез соединения 101
К раствору иодистого соединения 51 (70 мг, 0,217 ммоль) в диизопропиламине (1,1 мл), в атмосфере азота и при комнатной температуре, добавляют Pd(Ph3P)4 (5 мг, 0,004 ммоль) и CuI (1,7 мг, 0,008 ммоль). Затем, по частям, добавляют соединение 97 (132 мг, 0,217 ммоль) и реакционную смесь перемешивают при комнатной температуре в течение 2 часов. Сырой продукт гасят водой и экстрагируют EtOAc. Органическую фазу сушат (безводный Na2SO4) и выпаривают при пониженном давлении. Очищают с помощью колоночной хроматографии (гексан/EtOAc = от 3:1 до 1:2), получая чистое соединение 101 (80 мг, выход: 50%) в виде твердого вещества белого цвета.
1Н ЯМР (CDCl3, 300 МГц) δ: 7,66 (м, 4H), 7,41 (м, 6H), 7,25 (д, 1H, J=10,6 Гц), 6,65 (т, 1H, J=10,1 Гц), 6,44 (д, 1H J=9,3 Гц), 5,63-5,48 (м, 3H), 4,78 (кв, 1H, J=8,3 Гц), 4,32 (д, 1H, J=9,2 Гц), 4,14 (м, 1H), 3,81 (м, 1H), 3,64 (с, 3H), 2,81 (м, 1H), 2,62 (м, 2H), 2,46-2,33 (м, 4H), 2,18-2,05 (м, 4H), 2,02 (с, ЗН), 1,85 (с, ЗН), 1,12 (д, 3H, J=6,6 Гц), 1,04 (с, 9H), 0,98 (с, 9H).
Пример 24
Биоанализ для определения противоопухолевой активности
Целью этого анализа является оценка in vitro цитостатической активности (способность замедлять или останавливать рост опухолевой клетки) или цитотоксической активности (способность уничтожать опухолевые клетки) тестируемых образцов.
Клеточные линии
Оценка цитотоксической активности с использованием колориметрического анализа с SBR
Для количественного определения роста и жизнеспособности клеток был адаптирован колориметрический тип анализа с использованием реакции сульфородамина B (SRB) (следуя методике, описанной Skehan P. и др., J. Natl. Cancer Inst., 1990, 82, 1107-1112).
В случае этого вида анализа используют SBS-стандартные 96-луночные микропланшеты для клеточной культуры (Faircloth et. al., Methods in cell science, 1988, 11(4), 201-205; Mosmann et. al., Journal of Immunological. Methods, 1983, 65(1-2), 55-63). Используемые при этом исследовании все клеточные линии, производимые от различных типов рака человека, получали из Американской коллекции типовых культур (АТСС).
Клетки выдерживали в модифицированной по способу Дульбекко среде Игла (DMEM), дополненной 10% фетальной телячьей сыворотки (FBS), 2 мМ L-глутамина, 100 мкг/мл пенициллина и 100 мкг/мл стрептомицина, при температуре 37°С, в присутствии 5% СО2 и при 98%-ной влажности. Для экспериментов клетки собирали из субконфлюэнтных культур, используя трипсинизацию, и ресуспендировали в свежей среде перед подсчетом и посевом.
Клетки высевали на 96-луночные титрационные микропланшеты по 5×103 клеток на лунку, в аликвотах по 150 мкл, и выдерживали для прикрепления к поверхности планшета в течение 18 часов в не содержащей лекарственного средства среде. Один контрольный (необработанный) планшет в случае каждой клеточной линии фиксировали (как описано ниже) и использовали для справочной оценки во время ноль. После этого тестируемые образцы добавляли к культурам в 10 последовательных разведениях, в аликвотах по 50 мкл, изменяющихся от 10 мкг/мл до 0,00262 мкг/мл. После выдерживания в течение 48 часов, оценивали противоопухолевый эффект по SRB-методу: вкратце, клетки дважды промывали с помощью PBS, фиксировали в течение 15 минут в 1%-ном растворе глутарового альдегида, дважды промывали с помощью PBS и окрашивали при использовании 0,4%-ного раствора SRB в течение 30 минут при комнатной температуре. Затем клетки несколько раз промывали с помощью 1%-ного раствора уксусной кислоты и высушивали на воздухе. После этого SRB экстрагировали с помощью 10 мМ раствора Trizma-основания и оптическую плотность измеряли с помощью автоматизированного спектрофотометрического планшет-ридера при длине волны 490 нм. Выживаемость клеток выражали в процентах от роста контрольных клеток. Конечный эффект тестируемого образца оценивали путем использования NCI-алгоритма (Boyd MR. and Paull KD., Drug Dev. Res., 1995, 34, 91-104).
Используя среднее ±SD (стандартное отклонение) из культур в трех повторениях, кривую «доза-ответ» строили автоматически, используя нелинейный регрессионный анализ. Рассчитывали три базовых параметра (NCI-алгоритм) путем автоматической интерполяции: GI50 = концентрация, которая вызывает ингибирование роста на 50 %; TGI = полное ингибирование роста (цитостатический эффект) и LC50 = концентрация, которая вызывает уничтожение 50% клеток (цитотоксический эффект).
Таблица 1 иллюстрирует данные по биологической активности соединений согласно настоящему изобретению.
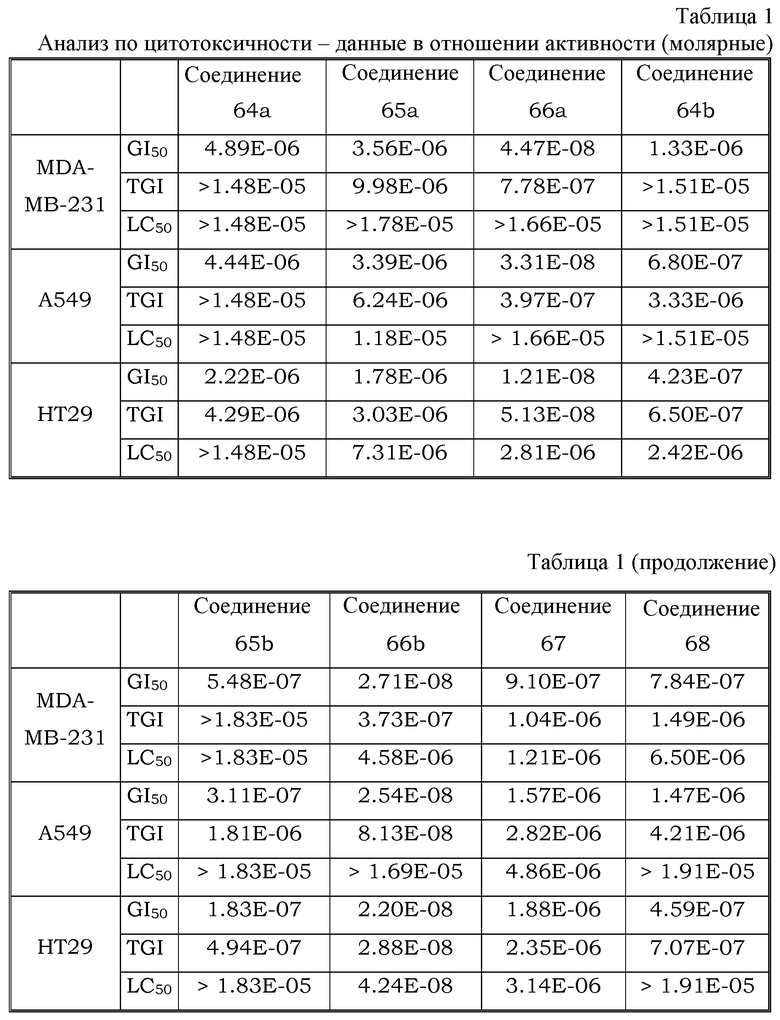
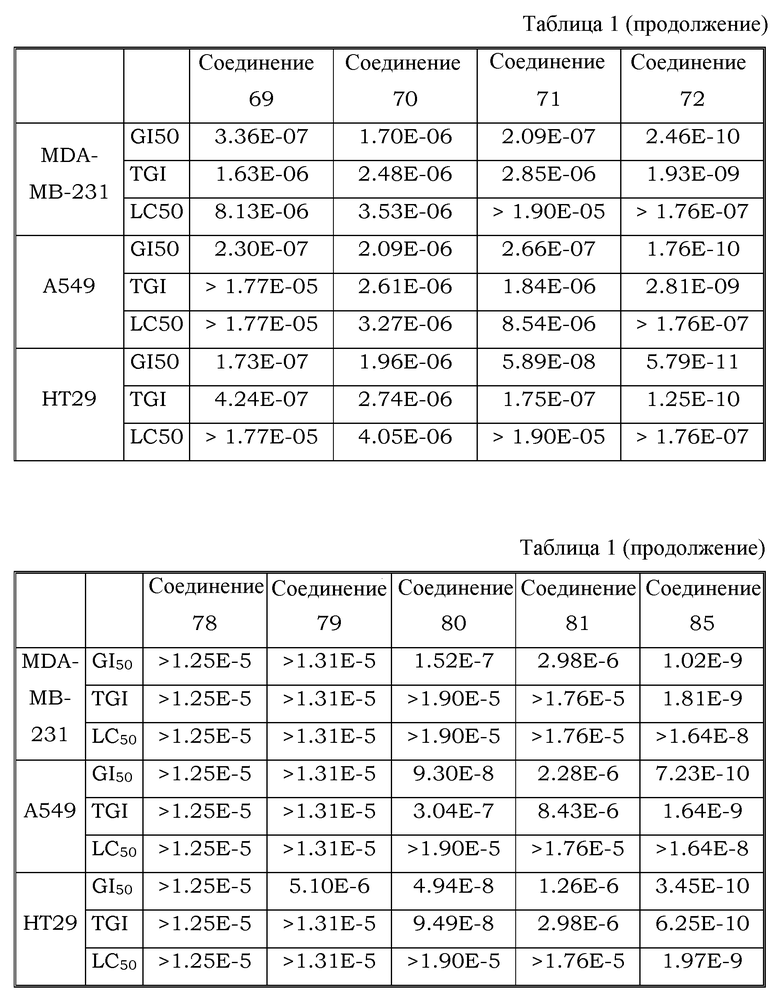
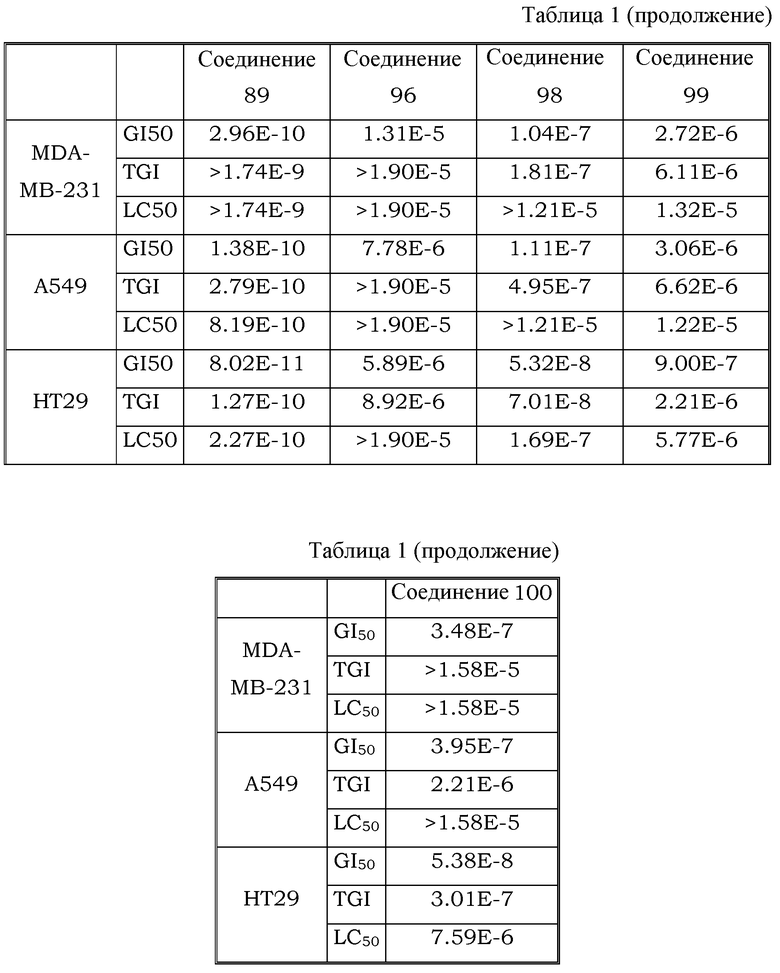
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОТИВООПУХОЛЕВЫЕ СОЕДИНЕНИЯ | 2008 |
|
RU2528393C9 |
| ПРОТИВООПУХОЛЕВЫЕ СОЕДИНЕНИЯ | 2008 |
|
RU2493147C2 |
| ПРОТИВООПУХОЛЕВЫЕ СОЕДИНЕНИЯ ДИГИДРОПИРАН-2-ОНА | 2007 |
|
RU2444519C2 |
| ПРОТИВООПУХОЛЕВЫЕ АНАЛОГИ ЛАМЕЛЛАРИНА | 2003 |
|
RU2328500C2 |
| ОБЩИЙ СИНТЕЗ МИРИАПОРОНОВ | 2003 |
|
RU2328492C2 |
| НЕЙРОАКТИВНЫЕ СТЕРОИДЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2830163C2 |
| ПРОИЗВОДНЫЕ ТАКСАНА, ФУНКЦИОНАЛИЗИРОВАННЫЕ ПО 14-ПОЛОЖЕНИЮ, И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2003 |
|
RU2320652C2 |
| ПРОИЗВОДНЫЕ ЭКТЕИНАСЦИДИНОВ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И ПРИМЕНЕНИЕ | 2003 |
|
RU2306316C9 |
| ПРОИЗВОДНЫЕ ВАРИОЛИНА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ПРОТИВООПУХОЛЕВЫХ СРЕДСТВ | 2002 |
|
RU2302419C2 |
| НОВЫЕ СОЕДИНЕНИЯ, ИХ ИЗОМЕР ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ В КАЧЕСТВЕ АНТАГОНИСТА ВАНИЛОИДНОГО РЕЦЕПТОРА И СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2007 |
|
RU2448108C2 |
Изобретение относится к соединениям общей формулы I, обладающим цитостатической или цитотоксической активностью, его фармацевтически приемлемым солям, таутомерам или стереоизомерам, фармацевтической композиции на их основе, их применению, способам получения и способам лечения с их использованием. Соединения могут быть использованы для лечения раковых заболеваний. В общей формуле I

Y выбирают из группы, состоящей из -CHRay- и -CHRay-CRby-CRcy-; каждый Ray, Rby и Rcy независимо выбирают из водорода и незамещенного C1-C12-алкила; каждый R1, R2, R3, R4 и R5 независимо выбирают из водорода и незамещенного С1-С12-алкила; R6 выбирают из NR8R9 и OR10; А означает 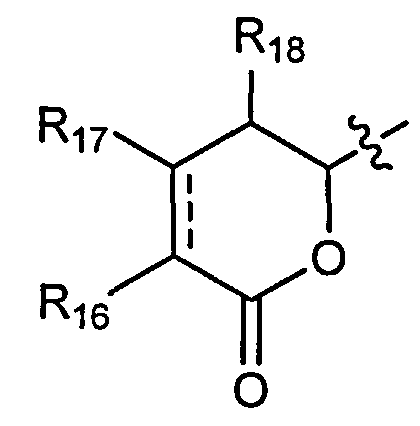
W означает NR7; R7 означает водород; R8 означает водород; R10 означает незамещенный С2-С12-алкенил; каждая пунктирная линия означает необязательную дополнительную связь, но когда существует тройная связь между атомами углерода, к которым присоединены R1 и R2, то R1 и R2 отсутствуют, и когда существует тройная связь между атомами углерода, к которым присоединены R3 и R4, то R3 и R4 отсутствуют; R9 выбирают из замещенного С2-С12-алкенила и замещенного C4-C12-алкенинила, где заместителей выбирают из группы, состоящей из: галогена, OR', OCONHR' и ОН, защищенного простым силильным эфиром где R' означает водород; при условии, что когда Y означает -CHRay-CRby=CRcy- и существует одинарная или двойная связь между атомами углерода, к которым присоединены R3 и R4, тогда R9 означает замещенный C4-C12-алкенинил; и каждый R16, R17 и R18 независимо выбирают из водорода и ORa; каждый Ra выбирают из водорода или незамещенного C1-C12-алкила. 4 н. и 27 з.п. Ф-лы.
1. Соединение общей формулы I

где Y выбирают из группы, состоящей из -CHRay- и -CHRay-CRby=CRcy-;
каждый Ray, Rby и Rcy независимо выбирают из водорода и незамещенного C1-C12-алкила;
каждый R1, R2, R3, R4 и R5 независимо выбирают из водорода и незамещенного С1-С12-алкила;
R6 выбирают из NR8R9 и OR10;
А означает

W означает NR7;
R7 означает водород;
R8 означает водород;
R10 означает незамещенный С2-С12-алкенил;
каждая пунктирная линия означает необязательную дополнительную связь, но, когда существует тройная связь между атомами углерода, к которым присоединены R1 и R2, то R1 и R2 отсутствуют, и когда существует тройная связь между атомами углерода, к которым присоединены R3 и R4, то R3 и R4 отсутствуют;
R9 выбирают из замещенного С2-С12-алкенила и замещенного С4-С12-алкенинила, где заместителей выбирают из группы, состоящей из галогена, OR', OCONHR' и ОН, защищенного простым силильным эфиром, где R' означает водород; при условии, что, когда Y означает -CHRay-CRby=CRcy- и существует одинарная или двойная связь между атомами углерода, к которым присоединены R3 и R4, тогда R9 означает замещенный С4-С12-алкенинил; и,
каждый R16, R17 и R18 независимо выбирают из водорода и ORa;
каждый Ra выбирают из водорода или незамещенного C1-C12-алкила; или
его фармацевтически приемлемая соль, таутомер или стереоизомер.
2. Соединение по п.1, где R16 выбирают из водорода и ORa, где Ra выбирают из водорода и незамещенного C1-C6-алкила.
3. Соединение по п.2, где R16 выбирают из водорода, ОН и метокси.
4. Соединение по любому из пп.1-3, где одна дополнительная связь присутствует между атомами углерода, к которым присоединены R16 и R17.
5. Соединение по любому одному из пп.1-3, где R17 и R18 означают водород.
6. Соединение по любому одному из пп.1-3, где R1, R2, R3 и R4 независимо выбирают из водорода и незамещенного C1-C6-алкила.
7. Соединение по п.6, где R1, R2, R3 и R4 означают водород.
8. Соединение по любому одному из пп.1-3, где Y выбирают из-CHRay- и -CHRay-CRby=CRcy-, где Ray, Rby и Rcy независимо выбирают из водорода и незамещенного C1-C6-алкила.
9. Соединение по п.8, где Ray, Rby и Rcy независимо выбирают из водорода и метила.
10. Соединение по любому одному из пп.1-3, где R5 выбирают из водорода и незамещенного C1-C6-алкила.
11. Соединение по п.10, где R5 выбирают из метила, изопропила и третбутила.
12. Соединение по любому одному из пп.1-3, где R6 означает NR8R9, и где R8 означает водород, а R9 выбирают из замещенного C2-С12-алкенила и замещенного С4-С12-алкенинила, который замещен в одном или нескольких положениях галогеном, OR', OCONHR' и ОН, защищенным простым силильным эфиром, где R' означает водород.
13. Соединение по любому одному из пп.1-3, где одна дополнительная связь присутствует между атомами углерода, к которым присоединены R1 и R2, и одна или две дополнительные связи присутствуют между атомами углерода, к которым присоединены R3 и R4.
14. Соединение по п.1, имеющее следующую формулу
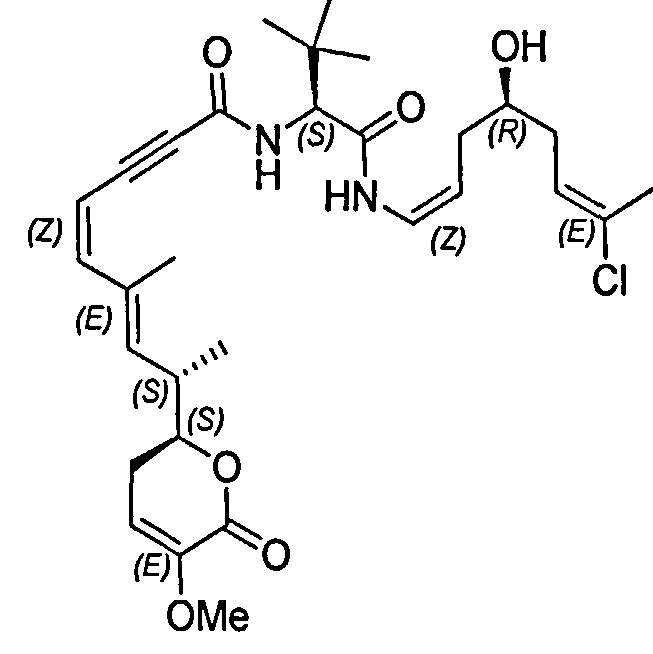
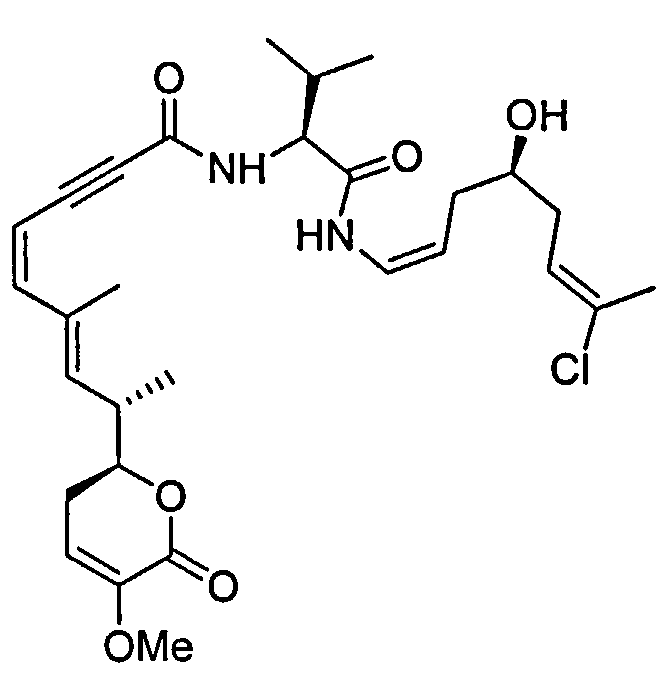
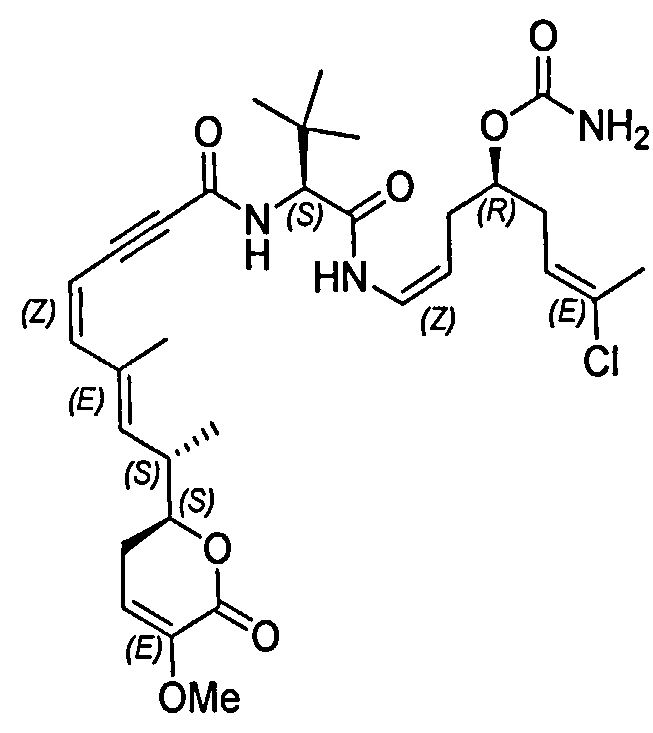
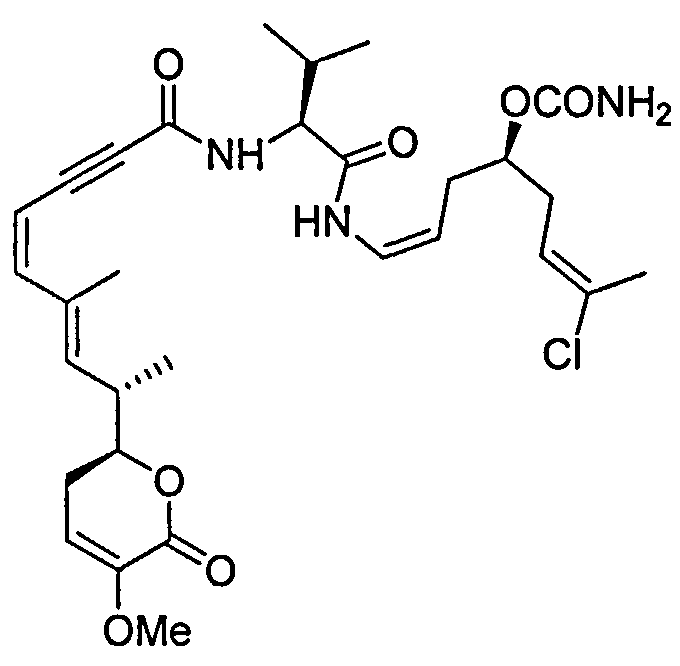
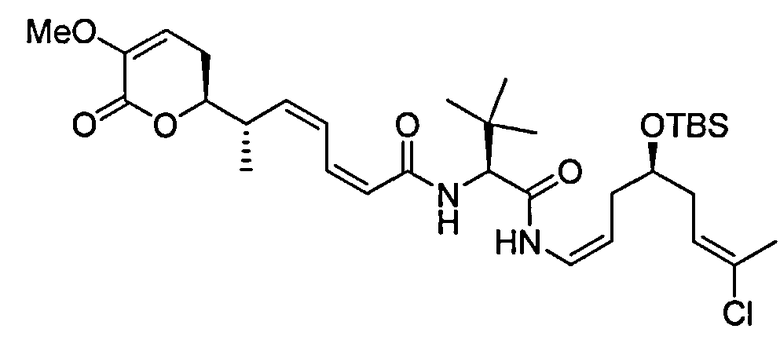
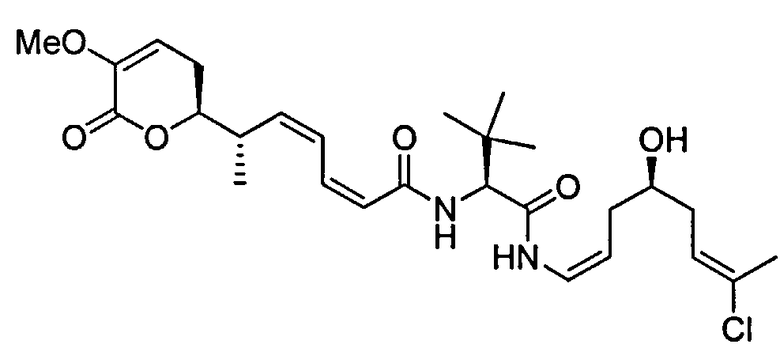
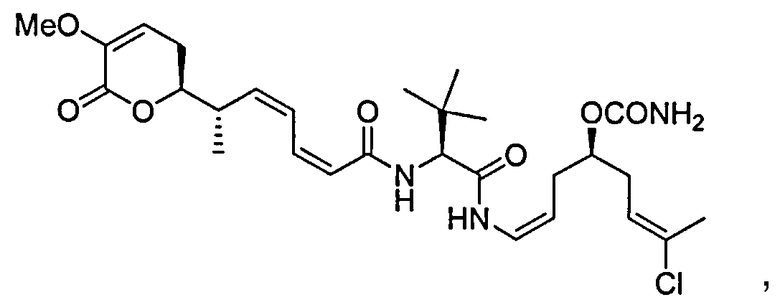
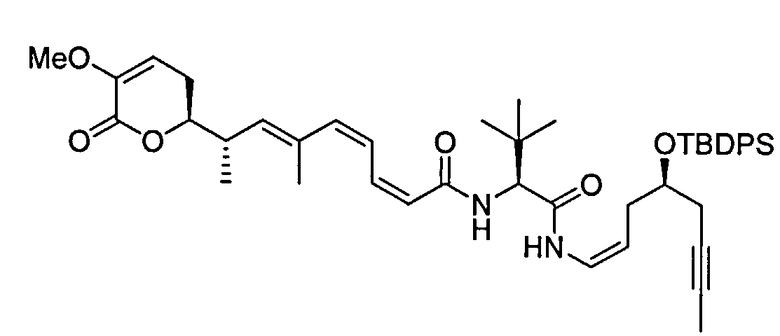
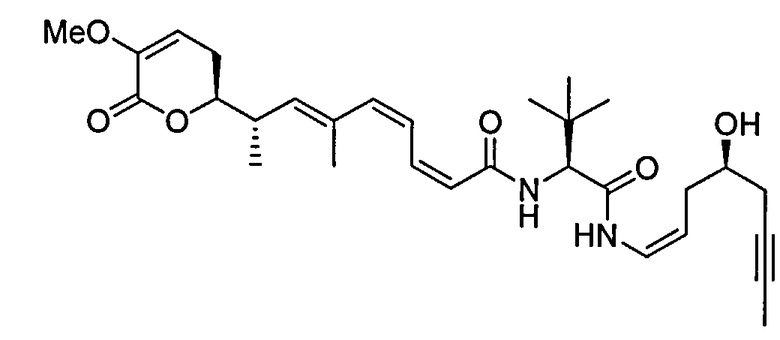
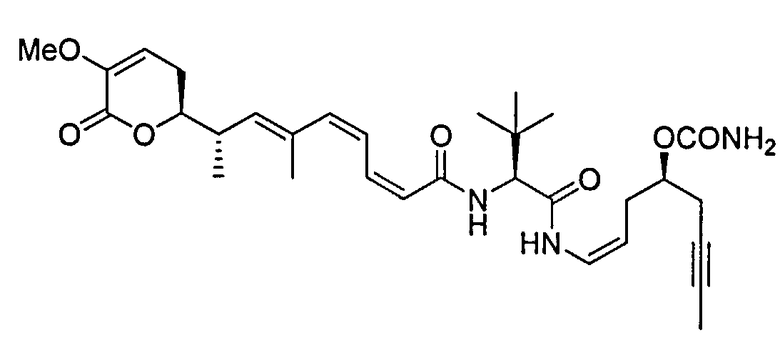
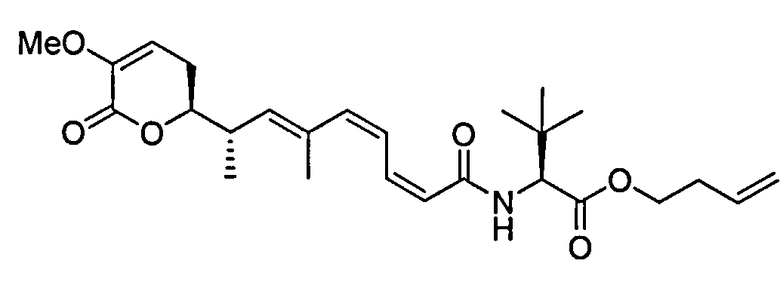
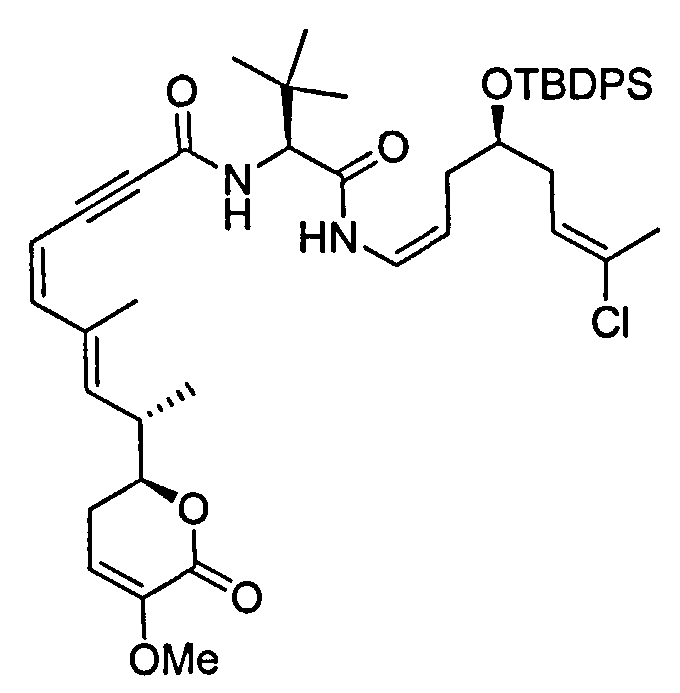
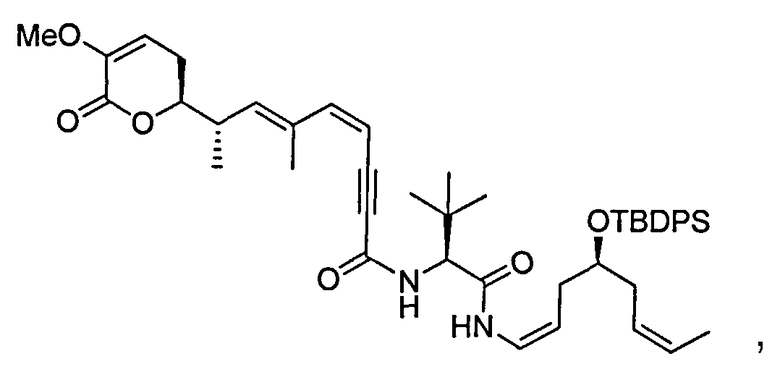
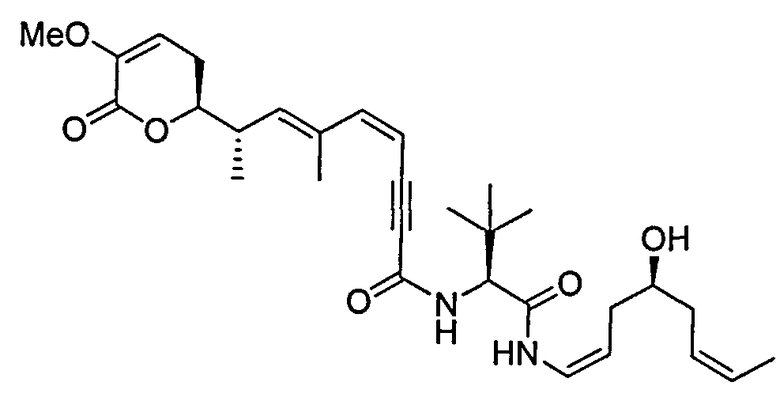
или
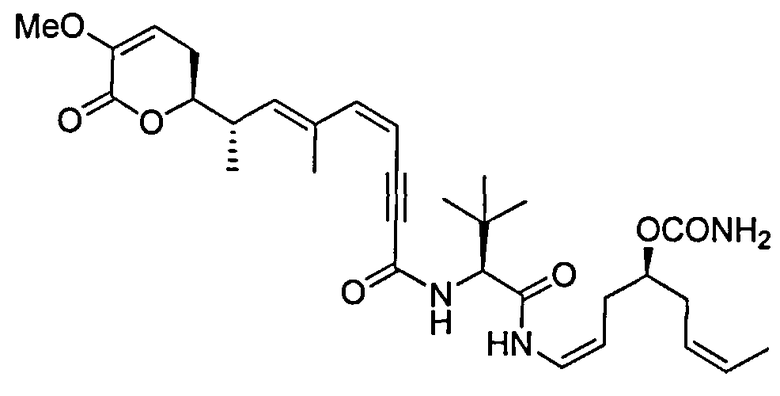
или его фармацевтически приемлемая соль, таутомер или стереоизомер.
15. Фармацевтическая композиция, обладающая цитостатической или цитотоксической активностью, содержащая соединение по любому из предшествующих пунктов, или его фармацевтически приемлемую соль, таутомер или стереоизомер, и фармацевтически приемлемый растворитель или носитель.
16. Соединение по любому одному из пп.1, 2, 3, 7, 9 или 14, или его фармацевтически приемлемая соль, таутомер или стереоизомер, для применения в качестве лекарственного средства для лечения ракового заболевания.
17. Соединение по п.15 для применения в качестве лекарственного средства для лечения ракового заболевания.
18. Применение соединения по любому из пп.1-14, или его фармацевтически приемлемых солей, таутомеров или стереоизомеров, в целях получения лекарственного средства для лечения ракового заболевания.
19. Способ лечения любого млекопитающего, особенно человека, пораженного раковым заболеванием, который включает введение пораженному индивидууму терапевтически эффективного количества соединения, обладающего цитостатической или цитотоксической активностью, по любому из пп.1-14, или его фармацевтически приемлемой соли, таутомера или стереоизомера.
20. Способ лечения любого млекопитающего, особенно человека, пораженного раковым заболеванием, который включает введение пораженному индивидууму терапевтически эффективного количества композиции по п.15.
21. Способ получения соединений, имеющих формулу I
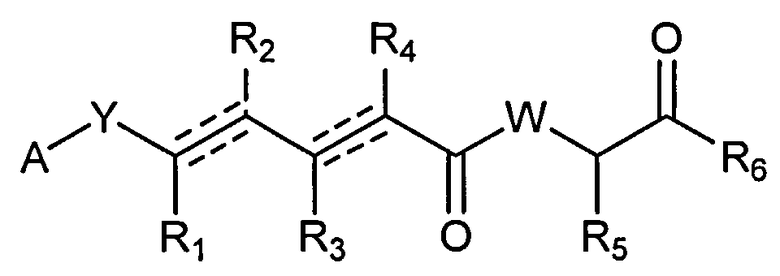 ,
,
по любому из пп.1-14, где A, Y, W, R1, R2, R3, R4, R5 и R6 являются такими, как они определены в любом из пп.1-14, содержащий присоединение Фрагментов С и D
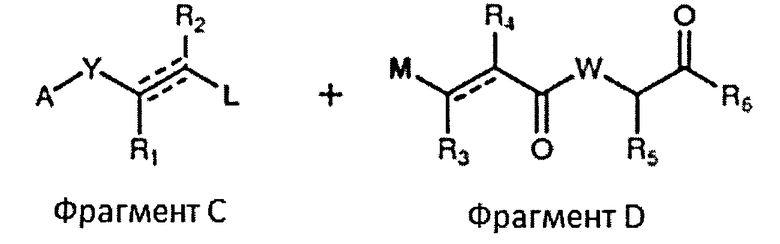 ,
,
где R1, R2, R3, R4, R5, R6, A, Y и W означают желательные группы, определенные в соединении формулы I, или подходящую защитную группу, как необходимо, и L и М означают подходящие реакционноспособные или удаляемые группы.
22. Способ по п.21, где соединение формулы I является любым соединением по п.14.
23. Способ по любому из пп.21-22, где удаляемая группа L является йодом.
24. Способ по любому из пп.21-22, где реакционноспособная группа М означает трибутил олова.
25. Способ по любому из пп.21-22, где Фрагмент D означает
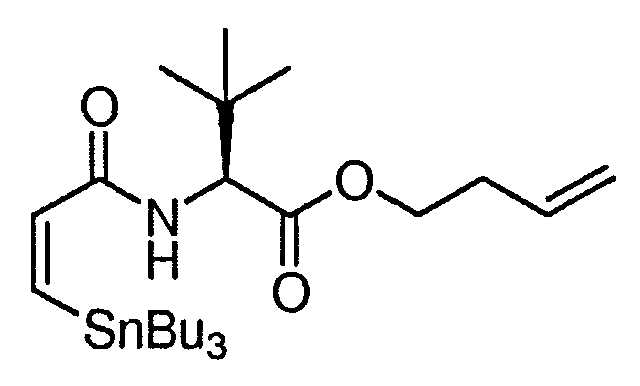
26. Способ по любому из пп.21-22, где Фрагмент D означает

27. Соединение согласно определению Фрагмента D по п.21, которое представляет собой
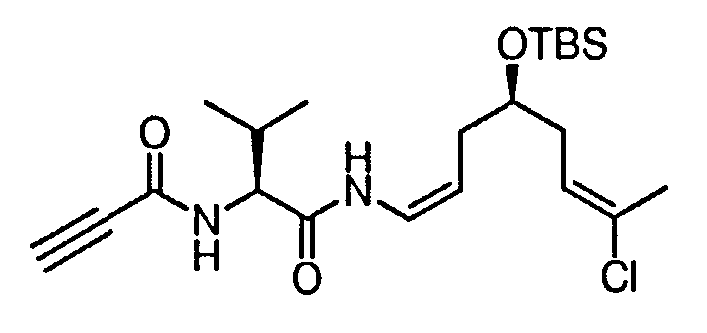
28. Соединение согласно определению Фрагмента D по п.21, которое представляет собой
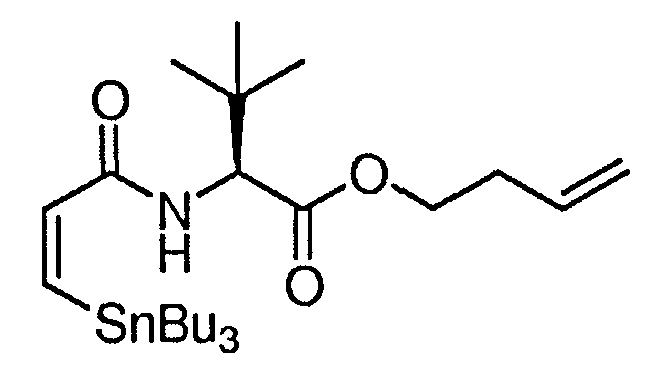
29. Соединение согласно определению Фрагмента D по п.21, которое представляет собой
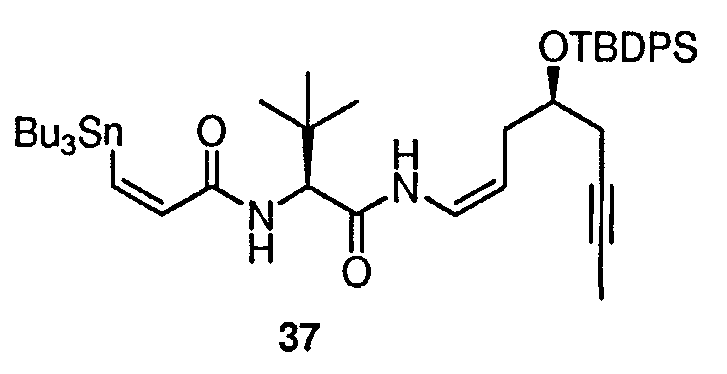
30. Способ получения соединений формулы I
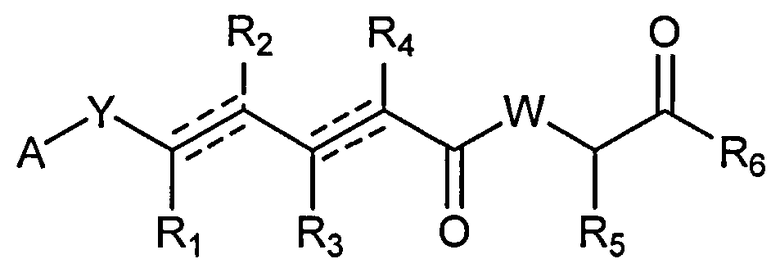
по любому из пп.1-14, где A, Y, W, R1, R2, R3, R4, R5 и R6 являются такими, как они определены в любом из пп.1-14, содержащий присоединение Фрагментов А и В
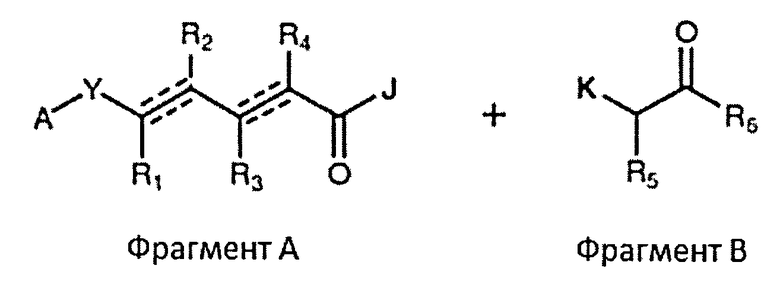
где R1, R2, R3, R4, R5, R6, А и Y означают желательные группы или подходящую защитную группу, как необходимо, и J и К означают подходящие реакционноспособные или удаляемые группы.
31. Способ по п.30, где соединение формулы I является любым соединением по п.14.
| WO 2005117894 A1, 15.12.2005 | |||
| WO 2001074355 A1, 11.10.2001 | |||
| RU 2006142690 A, 10.06.2008. |
Авторы
Даты
2013-08-10—Публикация
2008-12-19—Подача