Изобретение относится к ветеринарной медицине, в частности к методам изготовления вакцин, и может быть использовано для профилактики смешанных кишечных инфекций у молодняка животных.
Разработка средств специфической профилактики инфекционных болезней животных была и остается одним из актуальных направлений ветеринарной медицины. Установлено, что в последние годы в нозологическом профиле инфекционной патологии телят и поросят, сопровождающихся диарейным синдромом, доминируют колибактериоз, стрептококкоз и энтерококковая инфекция (Субботин В.В., Сидоров М.А. Профилактика желудочно-кишечных болезней новорожденных животных с симптомокомплексом диареи. / Ветеринария, 2001. - №4. - С.3-4; Шахов А. и др. Профилактика желудочно-кишечных болезней поросят бактериальной этиологии. / Свиноводство, 2008. - №1. - С.23-25; Терехов В.И. и др. Видовой состав и антигенная структура микроорганизмов, обуславливающих смешанные кишечные инфекции у новорожденных телят. / Труды Кубанского государственного аграрного университета. Серия: Ветеринарные науки, 2009. - №1 (ч.1). - С.98-99). Данные заболевания чаще всего протекают в виде ассоциированных инфекций, поэтому применение ассоциированных вакцин, включающих антигены разных возбудителей, является более предпочтительным, чем моновакцины, поскольку они позволяют создать у животных напряженный иммунитет в сжатые сроки, а кроме того, снизить стрессовые ситуации у прививаемых животных и уменьшить трудозатраты. В связи с вариабельностью возбудителей кишечных инфекций состав средств специфической профилактики должен включать антигены, аналогичные антигенному составу бактерий, выделенных от больных и павших животных в эпизоотическом очаге.
Известна вакцина, ассоциированная против анаэробной энтеротоксемии и эшерихиоза поросят (патент РФ на изобретение №2129441 от 10.12.97). Данная вакцина содержит клостридиозный компонент, представленный штаммом Clostridium perfingens, активно продуцирующий токсин типа С. Она также содержит сложный эшерихиозный компонент, включающий набор полисахаридных О, К антигенов, адгезивных антигенов, ТЛ- и ТС-анатоксинов в соотношении 1:1. Однако данная вакцина обеспечивает спектр иммуногенности против возбудителей анаэробной энтеротоксемии и эшерихиоза у поросят и, естественно, не создает иммунитета против стрептококкоза и энтерококковой инфекции у животных.
Известна вакцина, ассоциированная против диареи телят (патент РФ на изобретение №2035916 от 27.05.1995), которая содержит 3 штамма E.coli, Salmonella typhimurium, S.dublin, S.enteritidis, 2 штамма Klebsiella pneumoniae, Proteus vulgaris и P.mirabilis. Эта вакцина предназначена для профилактики колибактериоза, сальмонеллеза, клебсиеллеза и протейной инфекции у телят, но она также не защищает животных от стрептококковой и энтерококковой инфекции.
Известен способ изготовления вакцины, ассоциированной против колибактериоза, сальмонеллеза, стрептококкоза и энтерококковой инфекции нутрий (патент РФ на изобретение №2316345 от 19.07.2006 - прототип). Способ заключается в том, что осуществляют отбор пораженных органов от павших нутрий из местного эпизоотического очага. Готовят суспензию из патологического материала и делают посев на дифференциально-диагностические среды. Выделяют чистые культуры Escherichia coli, Salmonella typhimurium. Streptococcus pneumoniae и Streptococcus fecalis. Раздельно выращивают выделенные культуры в мясопептонной питательной среде с добавлением 0,2% глюкозы до достижения концентрации микробных клеток - 4-5 млрд в 1 см3. Инактивируют формалином до 0,4-0,6%-ной конечной концентрации. Выдерживают при температуре 37°С в течение 72-96 часов. Смешивают культуры в равных соотношениях. Вносят 3%-ный раствор гидроокиси алюминия в количестве 20% к объему культуры и тщательно смешивают. После чего полученную вакцину фасуют и укупоривают. Способ прост в исполнении, позволяет повысить специфичность и иммуногенность полученной вакцины. Однако данный способ позволяет получать вакцину против колибактериоза, сальмонеллеза, стрептококкоза и энтерококковой инфекции только для нутрий и не предусматривает использования для телят и поросят, поскольку возбудители, вызывающие у них болезни, существенно отличаются по своим антигенным свойствам от возбудителей болезней нутрий.
Техническим результатом изобретения является повышение эффективности специфической профилактики колибактериоза, стрептококкоза и энтерококковой инфекции у телят и поросят путем введения в вакцинный препарат культур возбудителей болезней специфичных для крупного рогатого скота и свиней.
Решение задачи достигается тем, что в способе изготовления вакцины, ассоциированной против колибактериоза, стрептококкоза и энтерококковой инфекции телят и поросят, включающем получение антигенов и инактивацию формалином, проводят выделение из пораженных органов телят и поросят эпизоотических штаммов Escherichia coli, продуцирующих термолабильный, термостабильный и шигаподобный токсины, гемолитических штаммов Streptococcus bovis и Enterococcus fecalis раздельно их выращивают на питательном бульоне при температуре 37°С, при этом культуры Escherichia coli в течение 7 дней, а культуры Streptococcus bovis и Enterococcus fecalis в течении 24 ч до концентрации 5-6 млрд микробных тел в 1 мл, раздельно инактивируют формалином до концентрации 0,3-0,4% в течение 14 суток, смешивают культуры в равных объемах, фасуют и укупоривают.
Новизна заявляемого предложения заключается в том, что в качестве антигена используют эпизоотические штаммы Escherichia coli, продуцирующие термолабильный, термостабильный и шигаподобный токсины, гемолитические штаммы Streptococcus bovis и Enterococcus fecalis, которые получают путем отбора пораженных органов от павших телят и поросят из местного эпизоотического очага с последующим выделением из них чистых культур возбудителей колибактериоза, стрептококкоза и энтерококковой инфекции животных и обработкой их при определенных режимах. Способ обеспечивает получение безвредной, иммуногенной и специфичной вакцины для защиты телят и поросят от поражения колибактериозом, стрептококкозом и энтерококковой инфекции.
В патентной и научно-технической литературе не обнаружена аналогичная заявляемой совокупность признаков, что позволяет судить об изобретательском уровне и новизне заявляемого предложения.
Пример конкретного осуществления способа изготовления вакцины, ассоциированной против колибактериоза, стрептококкоза и энтерококковой инфекции телят и поросят.
Для изготовления вакцины ассоциированной против колибактериоза, стрептококкоза и энтерококковой инфекции первоначально проводят отбор пораженных органов от павших животных в период их заболевания колибактериозом, стрептококкозом и энтерококковой инфекцией из местного эпизоотического очага, осуществляют бактериологический посев с целью выделения чистых культур возбудителей.
Для определения культуральных свойств возбудителя колибактериоза делали посевы выделенной культуры из патологического материала в МПБ, на среду Эндо, МПА и инкубировали в термостате при 37°С в течение 18-24 ч. На чашках Петри с МПА росли влажные колонии с ровными краями и гладкой поверхностью серого цвета. В пробирках с МПБ наблюдали равномерное помутнение питательной среды с образованием на поверхности пленки и небольшим придонным осадком, разбивающимся при встряхивании. На среде Эндо наблюдали рост колоний малиново-красного цвета с бронзовым отливом, характерный для E.coli. При микроскопии препаратов, окрашенных по Граму, под иммерсионной системой микроскопа наблюдали толстые палочки с закругленными концами красного цвета, расположенные одиночно, характерные для E.coli.
Для подтверждения видовой принадлежности выделенных изолятов устанавливали их биохимические свойства с использованием микротест-систем «ENTEROtest» фирмы PLIVA-Lachema Diagnostika (Чехия). При подтверждении принадлежности чистых культур к Escherichia coli определяли способность их к токсинообразованию с помощью биотеста на инфузориях-стилонихиях по пат. РФ 2262529. При наличии в культуральной среде экзотоксинов количество погибших инфузорий должно быть не менее 70-80%, в то время как количество погибших инфузорий в контрольной пробе, не содержащей токсин, не должно превышать 5%. Токсинпродуцирующие изоляты отбирали для получения вакцины.
Для определения культуральных свойств возбудителей стрептококкоза и энтерококковой инфекции делали посевы выделенных культур из патматериала в чашки Петри с мясопептонным агаром (МПА) с добавлением глюкозы до 1%-ной конечной концентрации и 5% дефибринированной крови барана. Через 18-20 ч инкубирования в термостате при температуре 37°С наблюдали в чашках Петри с кровяным МПА рост мелких, мутноватых с ровными краями колоний, окруженных зеленоватой зоной гемолиза. При микроскопии препаратов, окрашенных по Грамму, под иммерсионной системой микроскопа наблюдали диплококки или кокки в виде коротких цепочек, окрашенные в фиолетовый цвет, характерные для рода Streptococcus и Enterococcus.
Принадлежность выделенных изолятов к Streptococcus bovis и Enterococcus fecalis подтверждали исследованиями биохимических свойств и активности пирролидонилариламидазы с использованием «PYRAtest», «STREPTOtest» и «EN-COCCUStest» фирмы PLIVA-Lachema Diagnostika (Чехия).
Выделенные таким образом чистые культуры возбудителей колибактериоза (Escherichia coli), стрептококкоза (Streptococcus bovis) и энтерококковой инфекции (Enterococcus fecalis) используют для получения баксырья. Для этого из культур каждого изолята, выросших на чашках Петри, отбирают по 2-3 изолированные колонии и засевают по отдельности в пробирки с 10 мл питательного бульона, приготовленного по пат. РФ №2342425, после культивируют при 37°С в течение 6-8 ч до появления легкой мути, свидетельствующей о росте микроорганизмов. Далее проводят микроскопию мазков, окрашенных по Граму, для подтверждения чистоты выросших культур и засевают каждый штамм во флаконы с 200-300 мл питательного бульона, приготовленного по пат. РФ №2342425, и культивируют при 37°С: культуры возбудителя колибактериоза в течение 7 суток, а культуры возбудителей стрептококкоза и энтерококковой инфекции - 24 ч. Концентрацию микробных клеток в бактериальной массе определяли по стандарту мутности и разводили стерильным физиологическим раствором до концентрации 5-6 млрд в 1 см3. Инактивацию полученного баксырья проводили внесением формалина до конечной концентрации 0,3-0,4%, выдерживали при температуре 37°С в течение 14 суток при периодическом перемешивании. Затем равные объемы инактивированных баккультур объединяют и тщательно перемешивают. После чего полученную вакцину фасуют по стерильным флаконам, укупоривают и проверяют на стерильность и безвредность.
При контрольных высевах на МПА, МПБ, среды Китт-Тароцци, Сабуро, Эндо рост бактериальной и грибной флоры отсутствовал, что свидетельствовало о стерильности вакцины.
При внутрибрюшинном введении вакцины в дозе 0,3 мл белым мышам массой 20-22 г, состояние угнетения и гибели их в течение 10 дней не отмечали, что является показателем безвредности данной изготовленной вакцины.
Иммуногенные свойства вакцины проверяли на 5 кроликах массой 2,5-3 кг, при этом оценивали накопление в сыворотке крови животных антитоксических антител и антител к стрептококку и энтерококку в реакции преципитации в агаровом геле. Кроликов иммунизировали дважды с интервалом 7 дней в дозе 1,0+1,0 мл. Перед второй иммунизацией и спустя 7 дней после второй иммунизации у животных отбирали кровь и исследовали на наличие специфических антител. Результаты представлены в таблице 1, из данных которой видно, что после введения вакцины у кроликов появляются специфические антитела к токсинам кишечной палочки и антигенам Streptococcus bovis и Enterococcus fecalis. После повторного введения вакцины уровень специфических антител к вакцинным антигенам увеличился в 4-8 раз, что свидетельствует о выраженных иммуногенных свойствах препарата.
Защитные свойства ассоциированной вакцины против колибактериоза, стрептококкоза и энтерококковой инфекции проверяли на модели острой инфекции при внутрибрюшинном заражении белых мышей суточными бульонными культурами соответствующих возбудителей (токсигенный изолят Escherichia coli, Streptococcus bovis, Enterococcus fecalis). Для этого было сформировано 6 групп по 10 мышей в каждой. Мышей 1-3 групп дважды с интервалом 7 дней иммунизировали вакциной ассоциированной против колибактериоза, стрептококкоза и энтерококковой инфекции телят и поросят в дозе 0,1 мл, а мышей 4-6 групп иммунизировали в той же дозе и по такой же схеме вакциной ассоциированой колибактериоза, сальмонеллеза, стрептококкоза и энтерококковой инфекции нутрий. Через 14 дней после последней вакцинации всех животных заражали суточными бульонными культурами в дозе 2ЛД50 и в течение 10 дней вели наблюдение, учитывая при этом количество павших мышей. Результаты опыта представлены в таблицах 2-4. Из материалов данных таблиц видно, что вакцина, изготовленная по предлагаемому способу, обеспечивает защиту 80-100% животных при их экспериментальном заражении. 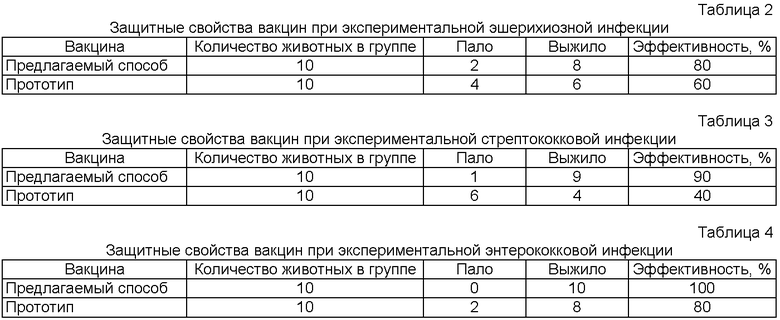 Она более специфична и эффективна чем прототип, поэтому может быть предложена для использования в ветеринарии в качестве биопрепарата для профилактики колибактериоза, стрептококкоза и энтерококковой инфекции у телят и поросят.
Она более специфична и эффективна чем прототип, поэтому может быть предложена для использования в ветеринарии в качестве биопрепарата для профилактики колибактериоза, стрептококкоза и энтерококковой инфекции у телят и поросят.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения вакцины ассоциированной против колибактериоза, стрептококкоза и энтерококковой инфекции телят и поросят | 2017 |
|
RU2650628C1 |
| Способ профилактики острых кишечных заболеваний у поросят | 2017 |
|
RU2649831C1 |
| Способ профилактики острых кишечных заболеваний у телят | 2017 |
|
RU2650604C1 |
| ВАКЦИНА АССОЦИИРОВАННАЯ ПРОТИВ КОЛИБАКТЕРИОЗА, САЛЬМОНЕЛЛЕЗА, СТРЕПТОКОККОЗА И ЭНТЕРОКОККОВОЙ ИНФЕКЦИИ НУТРИЙ | 2006 |
|
RU2316344C1 |
| ВАКЦИНА АССОЦИИРОВАННАЯ ПРОТИВ КОЛИБАКТЕРИОЗА, САЛЬМОНЕЛЛЕЗА И ЭНТЕРОКОККОВОЙ ИНФЕКЦИИ НУТРИЙ | 2006 |
|
RU2301078C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ВАКЦИНЫ АССОЦИИРОВАННОЙ ПРОТИВ КОЛИБАКТЕРИОЗА, САЛЬМОНЕЛЛЕЗА, СТРЕПТОКОККОЗА И ЭНТЕРОКОККОВОЙ ИНФЕКЦИИ НУТРИЙ | 2006 |
|
RU2316345C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ВАКЦИНЫ АССОЦИИРОВАННОЙ ПРОТИВ КОЛИБАКТЕРИОЗА, САЛЬМОНЕЛЛЕЗА И ЭНТЕРОКОККОВОЙ ИНФЕКЦИИ НУТРИЙ | 2006 |
|
RU2338554C2 |
| ВАКЦИНА АССОЦИИРОВАННАЯ ПРОТИВ СТРЕПТОКОККОЗА, ПСЕВДОМОНОЗА И ЭНТЕРОКОККОВОЙ ИНФЕКЦИИ НУТРИЙ | 2009 |
|
RU2406531C1 |
| ВАКЦИНА АССОЦИИРОВАННАЯ ПРОТИВ КОЛИБАКТЕРИОЗА, САЛЬМОНЕЛЛЕЗА И СТРЕПТОКОККОЗА НУТРИЙ | 2006 |
|
RU2301681C1 |
| ВАКЦИНА АССОЦИИРОВАННАЯ ПРОТИВ СТРЕПТОКОККОЗА И ЭНТЕРОКОККОВОЙ ИНФЕКЦИИ НУТРИЙ | 2006 |
|
RU2301680C1 |
Изобретение относится к области ветеринарной медицины. Способ заключается в том, что проводят выделение из пораженных органов телят и поросят эпизоотических штаммов Escherichia coli, продуцирующих термолабильный, термостабильный и шигаподобный токсины, а также гемолитических штаммов Streptococcus bovis и Enterococcus faecalis. Раздельно выращивают культуры Escherichia coli, Streptococcus bovis и Enterococcus faecalis на питательном бульоне при температуре 37°С. При этом культуры Escherichia coli выращивают в течение 7 дней, а культуры Streptococcus bovis и Enterococcus faecalis в течение 24 ч до концентрации 5-6 млрд микробных тел в 1 мл. Затем раздельно инактивируют выращенные культуры формалином до концентрации 0,3-0,4% в течение 14 суток. После чего смешивают культуры в равных объемах, фасуют и укупоривают. Полученная вакцина обладает высокой иммуногенностью и специфичностью, безвредна. 4 табл.
Способ изготовления вакцины, ассоциированной против колибактериоза, стрептококкоза и энтерококковой инфекции телят и поросят, включающий получение антигенов и инактивацию их формалином, отличающийся тем, что проводят выделение из пораженных органов телят и поросят эпизоотических штаммов Escherichia coli, продуцирующих термолабильный, термостабильный и шигаподобный токсины, гемолитических штаммов Streptococcus bovis и Enterococcus faecalis, раздельно их выращивают на питательном бульоне при температуре 37°С, при этом культуры Escherichia coli в течение 7 дней, а культуры Streptococcus bovis и Enterococcus faecalis в течение 24 ч до концентрации 5-6 млрд микробных тел в 1 мл, раздельно инактивируют формалином до концентрации 0,3-0,4% в течение 14 суток, после чего смешивают культуры в равных объемах, фасуют и укупоривают.
| СПОСОБ ИЗГОТОВЛЕНИЯ ВАКЦИНЫ АССОЦИИРОВАННОЙ ПРОТИВ КОЛИБАКТЕРИОЗА, САЛЬМОНЕЛЛЕЗА, СТРЕПТОКОККОЗА И ЭНТЕРОКОККОВОЙ ИНФЕКЦИИ НУТРИЙ | 2006 |
|
RU2316345C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ВАКЦИНЫ АССОЦИИРОВАННОЙ ПРОТИВ КОЛИБАКТЕРИОЗА, САЛЬМОНЕЛЛЕЗА И ЭНТЕРОКОККОВОЙ ИНФЕКЦИИ НУТРИЙ | 2006 |
|
RU2338554C2 |
| ВАКЦИНА, АССОЦИИРОВАННАЯ ПРОТИВ ДИАРЕИ ТЕЛЯТ | 1993 |
|
RU2035916C1 |
| Ветряный винтовой двигатель с трубчатым поворотным кожухом | 1927 |
|
SU18331A1 |
| JP 7010774 A, 13.01.1995. | |||
Авторы
Даты
2011-09-20—Публикация
2010-07-27—Подача