Предпосылки создания изобретения
В целом изобретение относится к способам лечения опухолей, которые экспрессируют мутантные формы рецептора эпидермального фактора роста (EGFR).
Рак по-прежнему представляет собой в значительной мере нерешенную проблему. При многих типах рака, в особенности в случае солидных опухолей, EGFR аберрантно экспрессируется и участвует в патогенезе рака.
Ген EGFR является клеточным гомологом онкогена erb В, первоначально идентифицированного в вирусах эритробластоза птиц. EGFRvIII представляет собой вариантом EGFR, который присутствует во многих типах рака. EGFRvIII является конститутивно активной формой рецептора, образующегося в результате делеции аминокислотной последовательности из 267 аминокислот во внеклеточном домене.
Для лечения опухолей, "запускаемых" EGFR, применяют две стратегии: моноклональные антитела и родственные белки, которые связываются с внеклеточным доменом, и малые молекулы, которые связываются с внутриклеточным киназным доменом EGFR. Эффективность моноклональных антител частично вызвана ингибированием передачи сигнала рецептора, а частично - иммунологическим действием антител на опухоль, таким как антителозависимая клеточно-опосредованная цитотоксичность (ADCC). Кроме того, терапевтические моноклональные антитела могут также влиять на интернализацию и стабильность рецептора. Очевидно, ингибирование передачи сигнала важно для противоопухолевого эффекта лекарства на основе антител, в то время как антитела, которые обычно узнают опухолеспецифические антигены, обычно неэффективны.
Хотя некоторые антитела против EGFR испытаны и применяются в качестве противораковых лекарств, в настоящее время отсутствует четкая корреляция между реакцией пациента на конкретное антитело против EGFR и экспрессией конкретного мутантного или дикого типа EGFR. Таким образом, необходимы противораковые лекарства, которые могут специфически ингибировать передачу сигнала EGFRvIII и родственных мутантных форм EGFR в раковых клетках, экспрессирующих EGFRvIII.
Сущность изобретения
В целом изобретение относится к открытию, что антитела, распознающие определенные эпитопы в EGFR, применимы для ингибирования сигнальной трансдукции при использовании как интактного EGFR, так и вариантов EGFR, конкретно, делеционных вариантов EGFR, таких как EGFRvIII.
Авторы изобретения нашли эпитоп антитела против EGFR EMD72000. Этот эпитоп включает аминокислоты Ser460/Gly461 и соседние аминокислоты на поверхности EGFR. Также обнаружено, что связывание с этим эпитопом в EGFRvIII с помощью EMD72000 и других антител, распознающих тот же самый эпитоп, блокирует димеризацию EGFRvIII со второй молекулой EGFR, такой как интактный EGFR или вторая молекула EGFRvIII. В этом состоит их отличие от антител, таких как 13А9 и других, которые связываются с EGFRvIII способом, который пространственно не запрещает EGFRvIII принимать конформацию, способную (компетентную) к димеризации. Установлено также, что EMD72000 может ингибировать передачу рецепторного сигнала как EGFRvIII, так и EGFR.
Таким образом, предлагается EMD72000 и другие антитела, которые связываются с эпитопом Ser460/Gly461 или которые способны блокировать передачу рецепторного сигнала как EGFR, так и EGFRvIII, применять для лечения раковых заболеваний, при которых экспрессируется EGFRvIII, или вероятность его экспрессии высока.
В целом изобретение включает методы лечения раковых заболеваний, при которых могут экспрессироваться EGFR варианты с делецией во внеклеточном домене. Методы обычно включают стадии первой оценки вероятности того, что данный тип рака у субъекта экспрессирует делегированный EGFR вариант, а затем лечение субъекта антителом по изобретению. Лечение таким антителом, предпочтительно, осуществляют тогда, когда считают вероятность экспрессии делегированного варианта EGFR при рассматриваемом раковом заболевании высоким.
В первом аспекте изобретение включает способ лечения, предупреждения или стабилизации ракового заболевания у нуждающегося в этом субъекта, этот способ включает стадии (а) определение, действительно эта раковая опухоль экспрессирует EGFRvIII, и (б) введение субъекту с диагностированным раковым заболеванием, при котором экспрессируется EGFRvIII, антитела, которое узнает эпитоп Ser460/Gly461 человеческого EGFR, причем антитело вводят в течение такого времени и в таком количестве, которые достаточны для лечения, предупреждения или стабилизации ракового заболевания у субъекта.
В предпочтительных вариантах данного аспекта изобретения антитело включает аминокислотную последовательность вариабельной области тяжелой цепи, по меньшей мере, на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичную аминокислотной последовательности SEQ ID NO:9, или аминокислотную последовательность вариабельной области легкой цепи, по меньшей мере, на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичную аминокислотной последовательности SEQ ID NO:3. Желательно, антитело включает аминокислотную последовательность вариабельной области, по меньшей мере, на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичную SEQ ID NO:3 и 9. Или же, или помимо этого, можно использовать антитело, которое распознает эпитоп, содержащий аминокислоты 452, 454, 457, 462 или 463, или аминокислоты, находящиеся внутри последовательностей, примерно, от 406 до 413 или, примерно, от 314 до 337 EGFR. Неограничивающие примеры антител, применимых в данном аспекте изобретения, включают EMD72000, mAb528, h- R3, mAb 425 и антигенсвязывающие фрагменты любого из вышеперечисленных антител. Включают также гуманизированные, DeImmunized™ (деиммунизированные), модифицированные (например, для повышения стабильности или для снижения иммуногенности у людей, когда это целесообразно) или химерные производные любого из вышеуказанных антител. V-области антител по изобретению можно также использовать по отношению к слитым белкам, одноцепочечным Fv фрагментам, Fab фрагментам и другим конструкциям, полученным методом генетической инженерии.
В дополнительных предпочтительных вариантах изобретения антитело снижает или предупреждает передачу сигнала (например, превращение в активную конформацию, интернализация рецептора, димеризация рецептора, аутофосфорилирование рецептора и фосфорилирование субстрата) интактным EGFR или EGFRvIII. Желательно, передача сигнала ослабляется, по меньшей мере, на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или более.
В другом аспекте изобретение включает способ лечения, предупреждения или стабилизации рака у нуждающегося в этом субъекта, который включает стадии (а) определение, действительно эта раковая опухоль экспрессирует EGFRvIII, и (б) введение субъекту с диагностированным раковым заболеванием, при котором экспрессируется EGFRvIII, антитела, которое связывает EGFRvIII и снижает или ингибирует передачу сигнала от рецептора EGFRvIII, причем антитело вводят в течение такого времени и в таком количестве, которые достаточны для лечения, предупреждения или стабилизации ракового заболевания у субъекта. Желательно, чтобы антитело связывалось с эпитопом, содержащим аминокислоты 452, 454, 457, 462 или 463, аминокислоты Ser460/Gly461 человеческого EGFR, аминокислоты 406-413 человеческого EGFR, аминокислоты 314-337 человеческого EGFR, или связываться с сайтом на домене 3 EGFR, который предотвращает переход домена 2 в конформацию, обеспечивающую передачу сигнала.
В предпочтительных вариантах данного аспекта изобретения антитело включает аминокислотную последовательность вариабельной области тяжелой цепи, по меньшей мере, на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичную аминокислотной последовательности SEQ ID NO:9, или аминокислотную последовательность вариабельной области легкой цепи, по меньшей мере, на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичную аминокислотной последовательности SEQ ID NO:3. Желательно, антитело включает аминокислотную последовательность вариабельной области, по меньшей мере, на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичную SEQ ID NO:3 и 9. Неограничивающие примеры антител, применимых в данном аспекте изобретения, включают EMD72000, mAb528, h- R3, mAb 425 и антигенсвязывающие фрагменты, гуманизированные или химерные производные любого из любого из вышеперечисленных антител. Включают также гуманизированные, DeImmunized™ (деиммунизированные), модифицированные (например, для повышения стабильности или для снижения иммуногенности у людей, когда это целесообразно) или химерные производные любого из вышеуказанных антител. V-области антител по изобретению можно также использовать по отношению к слитым белкам, одноцепочечным Fv фрагментам, Fab фрагментам и другим конструкциям, полученным методом генетической инженерии.
Передача сигнала от рецептора (рецепторного сигнала) EGFR включает превращение (переход) в активную конформацию, интернализацию рецептора, димеризацию рецептора, аутофосфорилирование рецептора и фосфорилирование субстрата. Желательно, передача сигнала ослабляется, по меньшей мере, на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или более.
Неограничивающие примеры раковых заболеваний, которые можно лечить или предупреждать, используя способы по изобретению, включают раковые заболевания по данному описанию и, в частности, глиобластому, медуллобластому, рак молочной железы, рак яичника и карциному простаты. В одном примере субъектом является субъект с предраковым поражением, которое, по определению, экспрессирует EGFRvIII, и способ применяется для предупреждения рака у субъекта.
Определение, действительно ли раковая опухоль экспрессирует EGFRvIII, можно проводить различными методами. В одном примере тип рака у субъекта сопоставляют с известным коэффициентом (в процентах) экспрессии EGFRvIII для этого типа рака в популяции для определения коэффициента (в процентах) правдоподобия экспрессии EGFRvIII раковой опухолью. Раковое заболевание с процентом правдоподобия, по меньшей мере, 57%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или более является предпочтительным для способов по изобретению.
В другом примере от субъекта получают биологический образец и используют для определения присутствия EGFRvIII полипептида. Если в биологическом образце обнаруживают EGFRvIII, считают, что раковая опухоль экспрессирует EGFRvIII. Предпочтительно, для обнаружения EGFRvIII полипептида применяют EGFRvIII-связывающий полипептид (например, антитело) или антисыворотку, которая специфически распознает новую пептидную связь с EGFRvIII. Например, можно использовать антитело MR1-1.
Еще в одном примере от субъекта получают биологический образец и используют для определения присутствия EGFRvIII нуклеиновой кислоты. Если в биологическом образце детектируют EGFRvIII нуклеиновую кислоту, считают, что раковая опухоль экспрессирует EGFRvIII. В уровне техники известны различные способы обнаружения нуклеиновых кислот в биологическом образце, некоторые из них включены в данное описание. Например, нуклеиновую кислоту, которая гибридизуется с новой пептидной связью мРНК EGFRvIII, или ее соответствующей кДНК, можно использовать в качестве зонда для обнаружения EGFRvIII нуклеиновой кислоты методами Саузерн-блоттинга, Нозерн-блоттинга или на основе защиты РНК-азы. Нуклеиновую кислоту, которая гибридизуется с EGFRvIII, можно также использовать в качестве праймера для обнаружения мРНК EGFRvIII или соответствующей ей кДНК в анализах на основе амплификации, таких как ПЦР, OT(RT)-ПЦР, или количественная полимеразная цепная реакция в реальном времени. Помимо этого, нуклеиновые кислоты, которые гибридизуются с EGFR, можно также применять в качестве зондов или праймеров и можно детектировать исходя из разницы в размерах между детектируемой ДНК или мРНК EGFR и ДНК или мРНК EGFRvIII, причем на присутствие EGFRvIII указывает более короткая или быстрее мигрирующая полоса.
В изобретении также раскрываются белковые комплексы, которые включают V области антитела и участки EGFR. Одним из предпочтительных вариантов изобретения является комплекс между EMD72000 и EGFRvIII. Такой комплекс EMD72000/EGFRvIII может находиться на поверхности культивированной клетки или на поверхности клеток больного раком.
Под "EGFR" или "интактным EGFR" понимают любой зрелый полноразмерный рецептор эпидермального фактора роста млекопитающего, включая человеческие и нечеловеческие формы. Включающий 1186 аминокислот человеческий EGFR описан в Ullrich et al., Nature 309:418-425 (1984)) и GenBank Регистрационный No. AAH94761.
Под "EGFRvIII" понимают вариант EGFR, в котором делегированы экзоны 2-7, в результате получают делецию 267 аминокислот в рамке считывания во внеклеточном домене EGFR. EGFRvIII известен как мутант типа III, дельта-EGFR, EGFRde2-7 и AEGFR и описан в патентах США No. 6455498, 6127126, 5981725, 5814317, 5710010, 5401828 и 5212290. Обычно белок EGFRvIII начинается со следующей аминокислотной последовательности: Leu Glu Glu Lys Lys Gly Asn Tyr Val Val Thr Asp His (SEQ ID NO:18), а далее идет остаток зрелого EGFR. Конкретно, присутствуют первые пять аминокислот зрелого EGFR (Leu Glu Glu Lys Lys (SEQ ID NO:19)), затем идет остаток глицина из гибридного кодона вследствие альтернативного сплайсинга, а затем идет последовательность зрелого EGFR, начиная с нуклеотида 274. Экспрессия EGFRvIII может являться результатом хромосомной делеции, а также аберрантного альтернативного сплайсинга. См. Sugawa et al., Proc. Natl. Acad. Set 87:8602-8606 (1990).
Под "EGFRvIII новым пептидным связыванием (связью, сочленением)" понимают следующую аминокислотную последовательность Leu Glu Glu Lys Lys Gly Asn Tyr Val Val Thr Asp His (SEQ ID NO:18), которую продолжает остаток зрелого EGFR, где последовательность Leu Glu Glu Lys Lys (SEQ ID NO:19) образуется из экзона 1 EGFR, Gly представляет собой новую аминокислоту, получающуюся из нового кодона, образованного на границе сплайсинга между экзоном 1 и экзоном 8, а Asn-Туг-Val-Val-Thr-Asp-His (SEQ ID NO:20) и соответствующие аминокислоты взяты из экзона 8 EGFR.
Под "делегированным EGFR вариантом (вариантом с делецией)" понимают делегированный вариант EGFR, в котором отсутствует (пропущен) участок внеклеточного домена, так что EGFR передача сигнала становится, по меньшей мере, частично независимой от лиганда.
Под "антителом" понимают иммуноглобулиновый белок (или белки, как в случае поликлонального антитела), или его производное, натуральный или синтетический, способный связываться с антигеном. Термин также включает моноклональные антитела, поликлональные антитела, полиспецифические антитела (например, биспецифические антитела), образованные, по меньшей мере, из двух интактных антител, фрагменты антител и гетероантитела, которые состоят из двух или более антител, или из фрагментов с различной специфичностью связывания, которые связаны друг с другом. Производные, подпадающие под этот термин, включают антитела, имеющие модифицированную последовательность, но сохраняющие способность специфически связываться с антигеном, включая интерспецифические (межвидовые гибридные), биспецифические, химерные, гуманизированные антитела, и иммуноконъюгаты, полученные в результате конъюгации антитела с дополнительной молекулой (например, цитотоксической молекулой), примеры которых даны в опубликованной заявке РСТ No. WO 2004/032960. Антитело может быть моноклональным или поликлональным и может находиться в различных средах, включая, но без ограничения, сыворотку или супернатант, или в чистом виде. По данному описанию антитела можно получать любым известным методом, включая сбор с культуры клеток нативных В лимфоцитов, гибридомы, системы рекомбинантной экспрессии, фаговый дисплей и т.п. Методы получения моноклональных антител известны в уровне техники и включают метод гибридом, описанный Kohler and Milstein (Nature 256, 495 (1975)) и в "Monoclonal Antibody Technology, The Production and Characterization of Rodent and Human Hybridomas" (Burdon et al., Eds, Laboratory Techniques in Biochemistry and Molecular Biology, Volume 13, Elsevier Science Publishers, Amsterdam (1985)), или их можно получать хорошо известными методами рекомбинантной ДНК (см., например, патент США 4816567). Моноклональные антитела можно также выделять с помощью фаг-дисплейных библиотек методами, описанными, например, в Clackson et al., Nature, 352:624-628 (1991) и Marks et al., J. Mol Biol, 222:58, 1-597 (1991). Методы получения поликлональных антител известны специалистам в данной области техники. Например, поликлональные антитела можно получать, иммунизируя кроликов или других животных инъекцией антигена с последующими бустер-инъекциями через соответствующие интервалы. У животных берут кровь и анализируют сыворотку в сравнении с очищенным белком, обычно методом ELISA или с помощью биоанализа, основанного на способности блокировать действие соответствующего гена. При использовании птиц различных видов, например кур, индюшек и т.п., антитело можно выделять из яичного желтка. Методы получения химерных и гуманизированных антител также известны в уровне техники. Например, методы получения химерных антител включают методы, представленные в данном описании. Гуманизированные моноклональные антитела можно получать методами, описанными в Международной патентной заявке WO 87/02671; Европейских патентах ЕР 184187; ЕР 171496; ЕР 173494; Международной патентной заявке WO 86/01533; Патентах США No. 4816567, 4816397, 5585089, 5225539, 6331415; Европейском патенте ЕР 125023; Better et al., Science 240:1041-1043 (1988); Liu et al., Proc Natl Acad Sci. U.S.A. 84:3439-3443 (1987); Liu et al., J Immunol 139:3521-3526 (1987); Sun et al., Proc Natl Acad Sci. U.S.A. 84:214-218 (1987); Nishimura et al., Cancer Res. 47:999-1005 (1987); Wood. et al., Nature 314:446-449 (1985); Shaw et al., J Natl Cancer Inst. 80:1553-1559 (1988); Morrison Science 229:1202-1207 (1985); Oi et al., Biotechniques 4:214 (1986); Jones et al., Nature 321:552-525 (1986); Verhoeyan et al., Science 239:1534 (1988); Beidler et al., J Immunol. 141:4053-4060 (1988); Jones et al., Nature 321:522-525 (1986); Riechmann et al., Nature 332:323-327 (1988); и Verhoeyen et al., Science 239:1534-1536 (1988).
Под "антисывороткой" понимают сыворотку крови человека или животных, содержащую иммуноглобулины, специфические к одному или более антигенов. Примеры антисыворотки EGFRvIII известны в уровне техники, например, описаны в Kallio et al., Br. J. Cancer 89:1266-1269 (2003).
"Фрагмент антитела" или "фрагмент белка антитела" относится к участку антитела (например, Fv), способному связываться с антигеном. Фрагменты, подпадающие по этот термин по данному описанию, включают фрагменты, образующиеся при расщеплении (гидролизе) различными пептидазами, такие как Fab, Fab' и F(ab)'2 фрагменты, фрагменты, образующиеся при химической диссоциации, химическом расщеплении и методами рекомбинантной ДНК. Типические рекомбинантные фрагменты, полученные, например, методом фагового дисплея, включают одноцепочечные фрагменты Fab и scFv ("одноцепочечную вариабельную область"). Производные, охватываемые данным термином, включают производные с модифицированной последовательностью, включая межвидовые гибридные, химерные и гуманизированные антитела, но сохраняющие способность связывать антиген.
Под "вариабельной областью" или "вариабельным доменом" понимают участок тяжелой или легкой цепи антитела, имеющий аминокислотную последовательность, значительно отличающуюся среди антител и использующуюся при связывании и для специфичности каждого конкретного антитела к его конкрентному антигену. Вариабельность сосредоточена в "гипервариабельных областях" или "области, определяющие комплементарность" (CDR), в вариабельных доменах как легкой, так и тяжелой цепи. Области между CDR являются более высококонсервативными и называются каркасными областями (FR). Вариабельные области каждой нативной тяжелой и легкой цепи содержат четыре FR (FR1-FR4), принимающие, в основном, конфигурацию β-складки, связанные гипервариабельными областями, которые образуют петли, связывающие, а в некоторых случаях образующие часть β-складчатой структуры. Гипервариабельные области в каждой цепи удерживаются вместе в непосредственной близости FR участками и вместе с гипервариабельными областями другой цепи участвуют в образовании антигенсвязывающего сайта антител (см. Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991)). Константные домены непосредственно не участвуют в связывании антитела с антигеном, но проявляют различные эффекторные функции, такие как участие антитела в антителозависимой клеточной цитотоксичности (ADCC). Термин "гипервариабельная область" или "CDR" по данному описанию относится к аминокислотным остаткам антитела, отвечающим за связывание с антигеном. Желательно, чтобы антитела, применимые в способах изобретения, были практически идентичны, по меньшей мере, части вариабельного домена (тяжелой цепи, легкой цепи или обеих) EMD72000.
Под "практически (в значительной степени) идентичной" понимают нуклеотидную, белковую или аминокислотную последовательность, которая, по меньшей мере, на 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична другой нуклеотидной, белковой или аминокислотной последовательности. Выражение "практическая (в значительной степени) идентичность" может применяться в отношении последовательностей различных типов и различной протяженности (длины), таких как полноразмерная последовательность, последовательности эпитопов или иммуногенных пептидов, функциональных доменов, вариабельных областей антител, кодирующие и/или регуляторные последовательности, экзоны, интроны, промоторы и геномные последовательности. Уровень идентичности (в процентах) двух полипептидных или нуклеотидных последовательностей определяют различными способами, известными специалисту в данной области техники, например, применяя общедоступную компьютерную программу, такую как алгоритм (выравнивание) Смита-Ватермана (Smith and Waterman J. Mol. Biol 147:195-7, 1981); программу "BestFit" (Smith and Waterman, Advances in Applied Mathematics, 482-489, 1981), включенную в GeneMatcher Plus™, Schwarz and Dayhof "Atlas of Protein Sequence and Structure," Dayhof, M.O., Ed pp 353-358, 1979; программу BLAST (Basic Local Alignment Search Tool; (Altschul, S. F., W. Gish, et al., J. Mol. Biol. 215:403-410, 1990). BLAST-2, BLAST-P, BLAST-N, BLAST-X, WU-BLAST-2, ALIGN, ALIGN-2, CLUSTAL, или программу Megalign (DNASTAR). Кроме того, специалисты в данной области техники могут определить соответствующие параметры для определения выравнивания, включая любые алгоритмы, необходимые для достижения максимального выравнивания по длине сравниваемых последовательностей. Обычно для белков длина сравниваемых последовательностей составляет, по меньшей мере, 10 аминокислот, предпочтительно, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 175, 200, 210, 220, 230, 240, 250 аминокислот или более, вплоть до полной длины белка. Для нуклеиновых кислот длина сравниваемых последовательностей составляет, по меньшей мере, 25, 50, 100, 125, 150, 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700, 750 нуклеотидов или более, вплоть до полной длины нуклеотидной молекулы. Понятно, что при определении идентичности с эпитопом протяженность белка, применяемого для сравнения, будет намного короче, например, 5, 7, 10, 12, 15 или 20 или более аминокислот, вплоть до полной длины эпитопа. Понятно, что для определения идентичности последовательностей путем сравнения последовательности ДНК с последовательностью РНК нуклеотид тимин эквивалентен нуклеотиду урацилу. Консервативные замены обычно включают замены внутри следующих групп: глицин, аланин; валин, изолейцин, лейцин; аспарагиновая кислота, глутаминовая кислота, аспарагин, глутамин; серин, треонин; лизин, аргинин; и фенилаланин, тирозин.
Под "эпитопом" понимают область на макромолекуле, которая распознается (узнается) антителом. Обычно эпитоп находится в короткой области первичной последовательности белка и имеет длину около 5-12 аминокислот, но он также может представлять собой область вторичной структуры. Предпочтительные эпитопы по изобретению включают Ser460/Gly461 эпитоп человеческого EGFR; аминокислоты 406-413 человеческого EGFR; аминокислоты 314-337 человеческого EGFR; и любой эпитоп в домене 3, который находится на поверхности взаимодействия домена 3' с аминокислотами 274-310. Включается также эпитоп на не-человеческом EGFR, эквивалентный любому из вышеуказанных эпитопов, и этот эпитоп можно определить выравниванием не-человеческого EGFR с человеческим EGFR для определения эквивалентных остатков в не-человеческом EGFR. Антитела, которые связываются с предпочтительными эпитопами, можно определить известными в уровне техники методами анализа. В одном примере связывание возможного (подходящего, кандидата) антитела с интактным EGFR с серином и глицином в положениях 460 и 461 соответственно можно сравнивать со связыванием возможного (подходящего, кандидата) антитела с мутантным EGFR, у которого аминокислоты в этих положениях заменены на другие аминокислоты, например, на аминокислоты с аминокислотной цепью большего размера. Предполагаемое антитело (кандидат), которое связывает EGFR дикого типа, но не мутантный EGFR, в данном анализе идентифицируется как антитело, которое связывает эпитоп Ser460/Gly461.
Под "Ser460/Gly461 эпитопом" понимают область на поверхности EGFR, которая включает аминокислоты Ser460 и Gly461 и, необязательно, включает соседние аминокислоты в пределах 10-15 ангстрем от Ser460 и Gly461. Говорят, что антитело связывается с Ser460/Gly461 эпитопом, если связывание антитела разрывается при введении в положения 460 и/или 461 мутаций, которые обычно не нарушают (не разрывают) структуру EGFR. Например, если антитело связывается с человеческим EGFR, но не связывается с человеческим EGFR, в котором в "человеческой" последовательности в положениях 460 и 461 имеются замены на аминокислоты мышиной последовательности пролин и аспарагин, то говорят, что антитело связывается с Ser460/Gly461 эпитопом. Аналогично, если антитело связывается с человеческим EGFR, но не связывается с человеческим EGFR, в котором в "человеческой" последовательности Ser460 заменен на аминокислоту, такую как аланин, фенилаланин, пролин, треонин, тирозин или аспарагиновая кислота, или в которой Gly461 заменен, например, на лейцин, то говорят, что антитело связывается с Ser460/Gly461 эпитопом.
Под термином "рак", "раковое заболевание" понимают доброкачественное или злокачественное новообразование или доброкачественную или злокачественную опухоль, вызванное(ую) аномальным и неконтролируемым делением клеток. Примеры раковых заболеваний включают, но без ограничения, лейкозы (например, острый лейкоз, острый лимфоцитарный лейкоз, острый миелоцитарный лейкоз, острый миелобластный лейкоз, острый промиелоцитарный лейкоз, острый миеломоноцитарный лейкоз, острый моноцитарный лейкоз, острый эритролейкоз, хронический лейкоз, хронический миелоцитарный лейкоз, хронический лимфоцитарный лейкоз), истинную полицитемию, лимфому (болезнь Ходжкина, неходжкинскую лимфому), макроглобулинемию Вальденстрома, болезнь тяжелых цепей и солидные опухоли, такие как саркомы и карциномы (например, фибросаркома, миксосаркома, липосаркома, хондросаркома, остеогенная саркома, хордома, ангиосаркома, эндотелиосаркома, лимфангиосаркома, лимфангиоэндотелиосаркома, синовиома, мезотелиома, опухоль Юинга, лейомиосаркома, рабдомиосаркома, карцинома толстой кишки, рак поджелудочной железы, рак молочной железы, рак яичников, рак простаты, плоскоклеточный рак, базальноклеточный рак, аденокарцинома, рак потовых желез, рак сальных желез, папиллярная карцинома (папиллярный рак), папиллярные аденокарциномы, цистаденокарциномы, медуллярная карцинома, бронхогенную карциному, почечно-клеточный рак (гипернефрома), гепатому, карциному желчного протока, опухоль Вильмса, рак шейки матки, рак матки, рак яичка, рак легкого, мелкоклеточный рак легкого, рак мочевого пузыря, эпителиальный рак, глиома, астроцитома, медуллобластома, краниофарингиома, эпендимома, пинеалома, гемангиобластома, невринома слухового нерва, олигодендроглиома, шваннома, менингиома, меланома, нейробластома и ретинобластома). Желательно, чтобы способы по изобретению применялись для лечения рака, который характеризуется экспрессией EGFRvIII.
Под "предраковым поражением" понимают морфологически идентифицируемое поражение, из которого, как предполагают, в значительном числе случаев развивается злокачественная опухоль.
Под "противораковой терапией" ("противораковым лечением)" понимают любую терапию (лечение), направленную на предупреждение, замедление, прекращение или инверсию развития (роста) предракового поражения, рака или метастазов рака. Обычно противораковая терапия уменьшает (ослабляет) или обращает (инвертирует) любой из признаков, который определяет раковую клетку (см. Hanahan et al., Cell 100:57-60, 2000). Наиболее часто лечение рака нацелено на раковые клетки, замедляя, прекращая, обращая или снижая инвазивную способность или снижая способность раковой клетки выживать. Противораковая терапия включает, без ограничения, хирургическую операцию, лучевую терапию (радиотерапию), биотерапию, иммунотерапию, химиотерапию или комбинацию этих видов лечения.
Под "лечением, стабилизацией или предупреждением рака" понимают действия, приводящие к снижению размера опухоли, замедлению или предупреждению увеличения размеров опухоли, увеличению периода безрецидивной выживаемости между исчезновением опухоли и ее повторным появлением, предупреждение первичного или последующего появления опухоли или уменьшение побочного симптома, обусловленного опухолью. В одном предпочтительном варианте изобретения число раковых клеток после лечения, по меньшей мере, на 20, 40, 60, 80 или 100% ниже, чем начальное число раковых клеток, определяемое любым стандартным методом анализа. Предпочтительно, уменьшение числа раковых клеток в результате лечения (введения лекарственного препарата) по изобретению, по меньшей мере, в 2, 5, 10, 20 или 50 раз больше, чем уменьшение числа нераковых клеток. Еще в одном предпочтительном варианте изобретения число раковых клеток после проведения терапии, по меньшей мере, в 2, 5, 10, 20 или 50 раз меньше числа раковых клеток после введения плацебо или контрольного носителя. Предпочтительно, способы по настоящему изобретению уменьшают размер опухоли, определяемый стандартными методами, на 20, 40, 60, 80 или на 100%. Предпочтительно, по меньшей мере, у 20, 40, 60, 80, 90 или 95% пролеченных субъектов наблюдается полная ремиссия, при которой исчезают все признаки рака. Предпочтительно, рак не появляется снова или появляется снова, по меньшей мере, через 5, 10, 15 или 20 лет. В другом предпочтительном варианте изобретения продолжительность жизни после обнаружения рака и проведения терапии по изобретению, по меньшей мере, на 20, 40, 60, 80, 100, 200 или даже 500% больше, чем (i) средняя продолжительность дальнейшей жизни (существования) непролеченного пациента или (ii) средняя продолжительность дальнейшей жизни пациента, пролеченного другим лекарством.
Под "образцом" понимают жидкость из организма (например, мочу, кровь. сыворотку, плазму или цереброспинальную жидкость), ткань (например, биоптат ткани) или клетку, в которой обычно обнаруживается EGFR.
Под "субъектом" понимают млекопитающее, включая, но без ограничения, человека или отличного от человека млекопитающего, такого как крупный рогатый скот, лошади, собаки, овцы и козы или кошки.
Под "коэффициентом правдоподобия (в процентах)" понимают процент вероятности. В настоящем изобретении коэффициент правдоподобия того, что раковые клетки экспрессируют EGFRvIII, можно определить, сравнивая тип рака у субъекта с клиническими исследованиями или опубликованными сообщениями, в которых указывается коэффициент правдоподобия того, что обнаруженный тип раковых клеток экспрессирует EGFRvIII. Для методов по изобретению предпочтительно, чтобы коэффициент правдоподобия (в процентах) того, что раковые клетки экспрессируют EGFRvIII, был равен 57%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или более.
Под "передачей сигнала рецептора" понимают любую из биологических активностей, ассоциированных с EGFR или его мутантами или производными (например, EGFRvIII), которые приводят к активации клеточных событий или путей клеток. Примеры биологических активностей включают переход (конверсию) в активную конформацию, димеризацию рецептора (гомодимер или гетеродимер), аутофосфорилирование рецептора (например, по остаткам Tyr 992, 1068, 1086, 1148 или 1173 человеческого EGFR), фосфорилирование субстрата и связывание субстрата. Субстраты EGFR известны в уровне техники и включают Gab1, Shc, EPS8, EPS15 и любые полипептиды, которые включают аминокислотную последовательность EEEEYFELV (SEQ ID NO:17). Такие активности можно измерять (определять) аналитическими методами, известными в уровне техники или представленными в данном описании, эти методы включают киназные анализы, иммуноанализы связывания рецептора с субстратом, анализ конформации рецептора на основании структуры и анализы интернализации рецепторов.
Под "снижением (понижением, уменьшением, ослаблением)" понимают способность вызывать общее снижение, предпочтительно, на 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или более. Например, в одном варианте изобретения антитела по изобретению, применимые в методах лечения, вызывают уменьшение (ослабление) передачи сигнала рецептора EGFRvIII или как EGFRvIII, так и EGFR, по меньшей мере, на 20%.
Другие признаки и преимущества изобретения будут понятны из нижеприведенного описания его предпочтительных вариантов и из п.п. формулы изобретения.
Краткое описание Фигур
На ФИГУРЕ 1 схематически показано взаимопревращение интактного EGF рецептора в его не передающее сигнал мономерное состояние и передающее сигнал димерное состояние, в котором он связывается с лигандом, таким как EGF. В верхней части Фигуры показаны внеклеточные EGFR домены, тогда как в нижней части Фигуры показаны внеклеточные домены, включая киназный домен (горизонтальные полосы) и прилегающую C-концевую область, которая фосфорилизуются при димеризации. На левой половине Фигуры показан свободный эпидермальный фактор роста (EGF; косые полосы) и не связанный с лигандом EGFR. Характеристикой не связанного с лигандом EGFR является то, что удлиняющий сегмент (расширение) Домена 2 взаимодействует с C-концом, проксимальной (ближайшей) к мембране областью Домена 4, так что димеризационные поверхности как в Домене 2, так и в Домене 4 спрятаны, углублены. Справа на Фигуре показан EGFR в димерном, связанном с лигандом состоянии. В этой конфигурации лиганд, такой как EGF или TGFα, взаимодействует с Доменом 1 и Доменом 3 EGFR, тогда как Домен 2 и Домен 4 осуществляют димеризационные контакты. Взаимопревращение активного и неактивного состояний EGFR включает "масштабное" вращение вокруг места соединения Доменов 2 и 3. В результате димеризации внутриклеточные киназные домены сближаются друг с другом и сближаются сайтами фосфорилирования тирозина субстрата.
На ФИГУРЕ 2 показано выравнивание вариабельных областей легких цепей (SEQ ID NO:1-6) и тяжелых цепей (SEQ ID NO:7-12) антитела против EGFR. 425 (SEQ ID NO:2 и 8, для легкой цепи и тяжелой цепи соответственно) представляет собой оригинальное (исходное) мышиное моноклональное антитело, из которого образовано антитело EMD72000. EMD72000 (SEQ ID NO:3 и 9, для легкой цепи и тяжелой цепи соответственно) содержит мутации в каркасе вариабельных областей 425 для повышения сходства с человеческими вариабельными областями. H-R3 (SEQ ID NO:1 и 7, для легкой цепи и тяжелой цепи соответственно) представляет собой независимо выделенное антитело, которое связывается с EGFR и описано в патенте США No. 6506883. 225 (SEQ ID NO:4 и 10, для легкой цепи и тяжелой цепи соответственно) представляет собой мышиное моноклональное антитело, которое связывается с эпитопом, отличным от эпитопа 425/EMD72000. Cur6 (SEQ ID NO:5 и 11, для легкой цепи и тяжелой цепи соответственно) и Cur63 (SEQ ID NO:6 и 12, для легкой цепи и тяжелой цепи соответственно) представляют собой дополнительные антитела против EGFR и описаны в опубликованной патентной заявке США No. 20050100546.
На ФИГУРЕ 3 показаны результаты FACS анализов в процессе выделения мутантных EGFR, с которыми не связывается EMD72000, при использовании клеток дрожжей. На левом чертеже показана популяция клеток дрожжей, экспрессирующих мутагенизированный EGFR и эпитопную метку, к которым добавлены меченный флуоресцентной меткой EMD72000 и меченное другой флуоресцентной меткой распознающее эпитопную метку антитело. На этом чертеже показаны клетки, прошедшие четыре цикла селекции на утрату связывания EMD72000. На оси Y представлено связывание EMD72000, тогда как на оси Х показано связывание антитела, распознающего эпитопную метку. Скопление пятен внизу слева изображает клетки, которые утратили плазмиду, экспрессирующую EGFR. Скопление (кластер) пятен ближе к центру рисунка представляет собой клетки, с которыми как EMD72000, так и антитело, узнающее эпитопную метку, связаны примерно в равном соотношении. Пятна, заключенные в трапецию, представляют собой клетки, которые, по-видимому, сохраняют связывание антитела, узнающего эпитопную метку, но утратили связывание с EMD72000.
На чертеже справа показан FACS анализ дрожжевых клеток из популяции, взятой из трапеции на левом чертеже. На этом правом чертеже показаны клетки дрожжей, к которым добавлены флуоресцентно меченное антитело 225 и узнающее эпитопную метку антитело, меченное иной флуоресцентной меткой. На этом правом рисунке показана популяция, прошедшая два цикла селекции на сохранение связывания антитела 225. На оси Y представлено связывание 225, тогда как на оси Х показано связывание антитела, распознающего эпитопную метку. Скопление пятен внизу слева опять же изображает клетки, которые утратили плазмиду, экспрессирующую EGFR. Скопление (кластер) пятен ближе к центру чертежа представляет собой клетки, с которыми как антитело 225, так и антитело, узнающее эпитопную метку, связаны примерно в равном соотношении. Пятна, заключенные в трапецию, представляют собой клетки, которые, по-видимому, сохраняют связывание антитела, узнающего эпитопную метку, и 225, но утратили связывание с EMD72000 вследствие их предыдущей селекции.
На ФИГУРЕ 4 иллюстрируется протокол, используемый для определения скорости интернализации белка, меченного радиоактивной меткой, который связывается с EGFR, в клетку.
На ФИГУРЕ 5 схематически показана математическая модель для расчета скорости интернализации меченного радиоактивной меткой белка в клетку.
На ФИГУРЕ 6 представлена диаграмма (столбцевая), показывающая скорость интернализации (ke) меченного радиоактивной меткой EGF, EMD72000 и MR1-1 в иммортализованных нетрансформированных человеческих эпителиальных клеток молочной железы (НМЕС). Незакрашенные столбцы изображают скорости интернализации в родительские НМЕС, экспрессирующие около 2×105 EGFR на клетку, но не EGFRvIII. Столбцы, заштрихованные тонкими черными линиями, столбцы, заштрихованные жирными черными линиями, столбцы, закрашенные черным, изображают скорости интернализации в трансфецированных НМЕС, экспрессирующих 5×104 EGFRvIII, 5×104 EGFRvIII, 5×104 EGFRvIII соответственно, помимо экспрессии 2×105 EGFR на клетку.
На ФИГУРЕ 7 изображены структурные модели интактного гетеродимера EGFR/EGFRvIII (верхний чертеж) и гомодимера EGFRvIII/EGFRvIII (нижний чертеж). Чтобы упростить изображение, боковые цепи скрыты, а показана только связанная альфа-углеродная цепь.
На ФИГУРЕ 8 изображена структурная модель Fab (серый цвет), расположенного над Ser460/Gly461 эпитопом в модели доменов 2 и 3 EGFRvIII в активной конформации. На верхней модели показана только альфа-углеродная цепь полипептидных скелетов. Fab расположен в левом верхнем углу (изображен серым цветом). Домен 3 EGFR расположен внизу фигуры, а остаток Домена 2 в EGFRvIII расположен справа и заключен в эллипс. Нижняя модель представляет собой тот же комплекс в такой же ориентации, но теперь показаны все атомы каркаса и боковых цепей, кроме водорода. Для простоты N-связанные олигосахариды не показаны.
На ФИГУРЕ 9 показана структурная модель Fab (серым цветом), позиционированного над Ser460/Gly461 эпитопом в модели доменов 2 и 3 EGFRvIII в неактивной конформации. На верхней модели показана только альфа-углеродная цепь полипептидных скелетов. Fab расположен в левом верхнем углу (изображен серым цветом). Домен 3 EGFR расположен внизу фигуры, а остаток Домена 2 в EGFRvIII расположен справа и заключен в эллипс. Нижняя модель представляет собой тот же комплекс в такой же ориентации, но теперь показаны все атомы каркаса и боковых цепей, кроме водорода. Для простоты N-связанные олигосахариды не показаны.
Подробное описание изобретения
Основанием для изобретения служат следующие открытия и неожиданные озарения. Во-первых, мы открыли, что антитело EMD72000 против EGFR, видоизмененное производное моноклонального антитела 425, созданного как обладающее пониженной иммуногенностью, связывается с эпитопом, который включает аминокислоты Ser460 и Gly461 и, возможно, другие соседние аминокислоты на поверхности EGFR. Эти результаты показывают, что EMD72000 связывает эпитоп на EGFR, отличный от эпитопов 13А9, 225 и 806 (Chao et al., J. Mot Biol. 342:539-50 (2004); опубликованная заявка РСТ No. WO 2004/032960).
Во-вторых, мы открыли, что связывание с этим эпитопом в EGFRvIII с помощью EMD72000 и других антител, узнающих тот же самый эпитоп, блокирует димеризацию EGFRvIII со второй молекулой EGFR, такой как молекула дикого типа EGFR или второй молекулой EGFRvIII. Мы также нашли, что EMD72000 может ингибировать передачу рецепторного сигнала как EGFRvIII, так и EGFR. Свидетельством того, что EMD72000 и другие антитела, узнающие эпитоп Ser460/Gly461, могут блокировать димеризацию EGFRvIII, являются экспериментальными данными, представленными в данном описании, структурные представления, основанные на известной трехмерной структуре внеклеточных доменов EGFR, и структурные модели EGFR, EGFRvIII и комплексов EGFR/антитело, представленные в данном описании.
Настоящее изобретение включает применение EMD72000 и других антител, которые связываются с эпитопом Ser460/Gly461 или которые способны блокировать передачу сигнала рецепторами как EGFR, так и EGFRvIII, для лечения раковых опухолей, которые экспрессируют или величина правдоподобия экспрессии ими EGFRvIII повышена.
Нижеприведенное описание изобретения представлено на примере специфического антитела, EMD72000, но предполагается, что оно является иллюстративным, а не ограничивающим. EMD72000 представляет собой гуманизированный вариант мышиного антитела 425 (патент США No. 5558864). Помимо EMD72000, другие антитела, применимые в способах по изобретению, включают моноклональное антитело 528, h-R3, mAb425. Кроме того, на основании открытия эпитопа для EMD72000 и способности EMD72000 блокировать активную конформацию, необходимую для передачи сигнала рецепторами как EGFR, так и EGFRvIII, специалисты в области молекулярного моделирования белковых структур поймут, что описываемыми ниже способами можно идентифицировать дополнительные антитела, применимые в способах по изобретению. Такие дополнительные антитела включены для применения в способах по изобретению.
Получение антител, применимых в способах по изобретению
Антитела против внеклеточного домена EGFR можно получать и идентифицировать любым методом, таким как обычный метод гибридом, фаговый дисплей и другие методы, известные в уровне техники. Антитела по изобретению могут быть моноклональными, поликлональными, антигенсвязывающими фрагментами, химерными антителами, гуманизированными антителами и любым производным, которое сохраняет способность специфически связываться с антигеном.
После того, как антитело, которое распознает EGFR, идентифицировано, можно тестировать его способность специфически связываться с эпитопами по данному описанию или способность специфически ингибировать передачу сигналов EGFR, EGFRvIII или обоих, используя, например, способы по данному описанию.
Например, в патенте США No. 5558864 описано, как приготовить антитела, применимые в способах по изобретению.
После того, как антитела получены и/или очищены, можно провести их скрининг на способность связываться со специфическими эпитопами на EGFRvIII или ингибировать передачу сигнала интактными EGFR, EGFRvIII или обоими, используя стандартные методы, известные в уровне техники, примеры которых представлены в данном описании.
Идентификация антител, применимых в изобретении, на основе эпитопов
В одном из разделов изобретения был идентифицирован связывающий эпитоп для EMD72000, и было найдено, что он включает аминокислоты Ser460/Gly461 человеческого EGFR. Следовательно, предпочтительные антитела по изобретению могут связываться с эпитопом, включающим эти аминокислоты и/или соседние аминокислоты. Следует отметить, что аминокислоты можно рассматривать как "соседние" ("окружающие") исходя из первичной последовательности или вторичной структуры. Кроме того, изобретение включает интуитивное понимание, догадку, что аминокислоты 406-413 или аминокислоты 314-337 также являются различными эпитопами для связывания других антител, помимо EMD72000, применимых в способах по изобретению. В качестве альтернативы или помимо этого эпитоп может включать аминокислоты 452, 454, 457, 462 или 463. Соответственно любой метод, пригодный для скрининга антител на их способность связывать любой из этих эпитопов, можно использовать для идентификации антител, применимых в способах по изобретению.
В одном примере связывание возможного (кандидата) антитела с EGFR дикого типа с серином и глицином в положениях 460 и 461 соответственно, можно сравнивать со связыванием возможного антитела с мутантным EGFR, в котором аминокислоты в этих положениях заменены на другие аминокислоты, например, аминокислоты с боковой цепью аминокислоты большего размера. Предполагаемое антитело (антитело-кандидат), которое связывает дикого типа EGFR, но не мутантный EGFR, в данном анализе идентифицируют как антитело, которое связывает Ser460/Gly461 эпитоп.
В другом примере используют метод идентификации эпитопов методом дисплея в дрожжевых клетках, описанным Cochran et al. (J. Immunol. Methods. 287:147-58 (2004)) и Chao et al. (J. Mol Biol 342:539-50 (2004)). В соответствии с этим методом целевой белок (белок-мишень), с которым связывается антитело, экспрессируют в виде слитого белка с эндогенным белком клеточной поверхности Aga2. Присутствие целевого белка на поверхности клетки дрожжей можно детектировать с помощью флуоресцентно-меченного антитела, и можно идентифицировать мутанты, в которых связывание антитела утрачено. Затем мутанты отделяют, проводят клональное выращивание, а затем мутацию(и) в целевом белке идентифицируют секвенированием ДНК. Полагают, что эти мутации определяют эпитоп для тестируемого антитела.
Конструируют слитый белок, содержащий стандартные эпитопные метки на N-конце и С-конце целевого белка. В данном случае применимы, например, эпитопы так называемые "Мус tag" и "FLAG tag". Эпитопные метки применимы для определения степени (величины) экспрессии слитого белка и степени протеолитического отщепления целевого белка. В частности, популяция клеток дрожжей, экспрессирующих слитую конструкцию целевого белка, имеет абсолютные уровни слитого белка EGFR-Aga2, которые меняются от клетки к клетке, но отношение антител, связывающихся с целевым белком, к антителам, связывающимся с дистальной (удаленной) эпитопной меткой, должно быть 1:1. На практике два антитела метят различными флуоресцентными красителями, а сортинг клеток дрожжей проводят с помощью FACS системы. Клетки, несущие белок-мишень дикого типа, при детектировании с помощью прибора FACS и отсортированным по двум красителям распределяются вдоль прямой линии, проходящей через начало.
Клетки дрожжей, экспрессирующие слитый белок (эпитопная метка 1)-EGFR-(эпитопная метка 2)-Aga2, затем мутагенизируют и сортируют.Клетки, в которых антитело против EGFR, как очевидно, не связывается, отбирают, выращивают, повторно сортируют и снова отбирают, и процесс продолжают до тех пор, пока клетки дрожжей, в которых антитела против EGFR, как очевидно, не связываются, не составят большинство клеток. Такие клетки затем засевают для получения отдельных клонов, а затем тестируют далее и секвенируют.
Когда вышеприведенную методику, более подробно описанную в Cochran et al., supra и Chao et al., supra, осуществляют с применением антитела по изобретению, такого как EMD72000, выделяют клетки дрожжей, которые экспрессируют формы EGFR с мутациями в сайтах, таких как Asn452, Lys454, Phe457, Ser460, Gly461, Gln462, и/или Lys463 (см. также Пример 1).
Другой метод идентификации антител по изобретению включает, во-первых, создание панели антител против EGFR стандартными методами, такими как метод гибридом или метод фагового дисплея, а затем скрининг выделенных при этом антител на способность конкурировать с EMD72000 в стандартных конкурентных анализах. Такие методы общеизвестны в инженерии антител.
Идентификация антител по изобретению на основании последовательности вариабельной области
На основании нашей идентификации Ser460/Gly461 как части эпитопа для EMD72000 антитела, которые имеют вариабельную область, практически идентичную вариабельной области EMD72000, также рассматриваются как антитела, применимые в способах по изобретению. Последовательности вариабельных областей предполагаемого антитела (антитела-кандидата) против EGFR с неизвестным эпитопом выравнивают с последовательностями вариабельных областей антител против EGFR с известными эпитопами, таких как С225, EMD72000, MR1 и 806. Это выравнивание может включать вариабельную область тяжелой цепи, вариабельную область легкой цепи, целую вариабельную область и CDR тяжелой цепи или легкой цепи или обеих. На Фиг.2 показано выравнивание некоторых последовательностей вариабельных областей антител против EGFR с известной и неизвестной специфичностью. На основании выравнивания предсказано, что антитело h-R3 связывается с эпитопом Ser460/Gly461, и, следовательно, оно считается применимым в изобретении.
Идентификация антител по изобретению на основании функции
Способ лечения по изобретению включает введение пациенту антитела, которое блокирует передачу сигнала рецепторами EGFR и EGFRvIII и аналогичными рецепторами, в которых имеется делеция во внеклеточном домене EGFR. Поэтому способы идентификации антител, применимых по изобретению, включают также применение любого анализа, позволяющего определить (измерить) EGFR или EGFRvIII передачу сигнала в клеточной линии млекопитающего. Примеры таких клеточных линий включают любые человеческие эпителиальные клетки молочной железы (НМЕС), клетки А431, клетки U87, клетки НТ29 или другие клетки, которые были экспрессированы при использовании конструкции экспрессии EGFRvIII. Можно также использовать клетки млекопитающих, которые не экспрессируют EGFR и которые были экспрессированы при использовании конструкции экспрессии EGFRvIII. Передачу сигнала рецептором EGFRvIII можно измерять (определять) различными способами, например, такими, которые описаны ниже.
Определение передачи сигнала рецептором путем установления активной конформации
Способность антитела по изобретению блокировать передачу сигнала рецептором EGFRvIII можно определить его способностью предупреждать переход EGFRvIII в конформацию, которая способствует олигомеризации. Полагают, что внеклеточный домен EGFR существует в двух возможных конформациях: активной, передающей сигнал конформации, соответствующей димерной структуре, наблюдаемой методом рентгеноструктурного анализа, и неактивной, не передающей сигнал конформации, соответствующей мономерной структуре, фиксируемой методом рентгеноструктурного анализа (Garrett et al., Cell 110:763- 773 (2002); Ferguson et al., Molecular Cell 11:507-517 (2003)). Схематическое изображение этих двух конформаций показано на Фиг.1. Внеклеточная область EGFR состоит из четырех доменов: домены 1 и 3 представляют собой спиральные бета-нитевые структуры, тогда как домены 2 и 4 являются удлиненными и богатыми цистеиновыми остатками, которые образуют дисульфидные связи. Аминокислотные последовательности доменов можно выравнивать, а трехмерные структуры сходны. Взаимопревращение активной и неактивной форм протекает главным образом путем вращения вокруг аргинина 310.
В качестве альтернативного метода идентификации антител по изобретению можно использовать структурные модели EGFRvIII в активной конформации для определения областей, которые, будучи связаны с антителом, приводят к пространственному запрещению перехода аминокислот, примерно, от 274 до 310 в активную конформацию относительно доменов 3 и 4. Например, антитела, узнающие аминокислоты, примерно, от 406 до 413 или узнающие аминокислоты, примерно, от 314 до 337, применимы в способах по изобретению.
Антитела, специфические к таким областям, можно получать, например, как описано далее. В соответствии со стандартными методами, когда такие сегменты обычно связываются за счет цистеиновых остатков, которые образуют дисульфидные связи, можно использовать связанную дисульфидной связью (образованную за счет дисульфидной связи) петлю, необязательно конъюгированную с носителем, в качестве антигена. Например, образованная за счет дисульфидной связи петля с последовательностью Cys-Asn-Gly-Ile-Gly-Ile-Gly-Glu-Phe-Lys-Asp-Ser-Leu-Ser-De-Asn-Ala-Thr-Asn-Ile-Lys-His-Phe-Lys-Asn-Cys (SEQ ID NO:21), которая соответствует аминокислотам 313 -338, может быть использована в качестве антигена для создания антитела по изобретению.
Измерение передачи сигнала рецептором путем определения скорости интернал изации рецептора
Димеризацию и передачу сигнала рецептором EGFRvIII можно оценивать, определяя скорости интернализации комплексов антитело- EGFR методами, известными в уровне техники для определения скоростей интернализации рецепторов.
EGFRvIII передает сигнал постоянно (конститутивно), а в трансфецированных человеческих эпителиальных клетках молочной железы скорость интернализации мутантного рецептора EGFRvIII высока в результате эндоцитоза, который стимулируется передачей сигнала. Антитела, которые связываются с EGFRvIII таким образом, который ингибирует передачу сигнала, также ингибируют стимулированную интернализацию, так что интернализация происходит на уровне фона, соответствующем величине мембранного метаболизма, которая составляет около 10% скорости интернализации, стимулированной передачей сигнала. Напротив, интернализация антител, которые связываются с EGFRvIII и не ингибируют передачу им сигнала, происходит с высокой скоростью. Степень снижения или ингибирования интернализации рецептора может составлять 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, до 90% или более в зависимости от типа используемых клеток. Этот анализ можно использовать также для изучения воздействия этих эффектов на передачу сигнала интактного EGFR, применяя линии клеток, которые экспрессируют только EGFR.
В одном примере для измерения скоростей интернализации применяют метод Worthylake (Уортилейка) (Worthylake et al., J. Biol. Chem. 274:8865-8874 (1999)) для измерения уровня интернализации. Коротко говоря, меченные радиоактивной меткой антитела против EGFR добавляют в культивируемые клетки млекопитающих, экспрессирующие EGFRvIII, и, необязательно, примерно равные количества EGFR. В различные временные точки после прибавления антитела отбирают аликвоты клеток и процессируют любым из двух способов: кислотой отделяют связанное с поверхностью антитело, которое можно посчитать; и щелочным гидролизом высвобождают интернализованное антитело, которое также можно посчитать (см. также Фиг.4 и 5).
Как более подробно описано в Примерах, моноклональные антитела EMD72000 и MR 1-1 действительно ингибируют передачу сигнала рецептором EGFRvIII. EMD72000 также ингибирует интернализацию, стимулированную передачей сигнала интактным EGFR. В других опытах не-нейтрализующее антитело 13А9 не ингибирует интернализацию, стимулированную передачей сигнала интактным EGFR или EGFRvIII. MR 1-1 не связывается с интактным EGFR и, следовательно, его нельзя проверить в данной аналитической системе.
Измерение передачи сигнала рецептором путем определения киназной активности рецептора
Передачу сигнала рецептором EGFRvIII, а также интактным EGFR можно определять вестерн-блоттингом, используя моноклональные антитела, специфические к фосфорилированным тирозиновым остаткам в положениях 1069 или 1173 (Upstate Biotechnology, Lake Placid, New York, no. по каталогу 07-715 и 05-483 соответственно) EGFR. Когда клетки, экспрессирующие EGFRvIII, такие как перечисленные выше, обрабатывают антителом, распознающим эпитоп Ser460/Gly461, фосфорилирование тирозина в положениях 1069 или 1173 обычно ингибируется.
Степень снижения или ингибирования киназной активности рецептора может составлять, по меньшей мере, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или более в зависимости от типа используемых клеток. В некоторых типах клеток значительная часть EGFRvIII находится внутри клетки (внутриклеточная локализация), например, в эндоплазматическом ретикулуме или в аппарате Гольджи и поэтому устойчива к любому воздействию антитела.
Применение антител по изобретению для лечения ракового заболевания
Антитела по изобретению применяются для лечения больных раком, при котором, по определению, экспрессируется EGFRvIII. В одном варианте изобретения рак можно оценивать по правдоподобию экспрессии EGFRvIII на основании клинических исследований или опубликованных сообщений, показывающих процент для конкретного типа опухоли, которая экспрессирует полипептидные или нуклеотидные молекулы EGFRvIII в данном исследовании. Например, врач может отметить тип опухоли и оценить процент правдоподобия экспрессии EGFRvIII опухолью пациента на основании научной литературы или клинических данных.
Например, найдено, что в случае глиальных опухолей, рака молочной железы, рака яичника, немелкоклеточного рака легкого и карциномы простаты часто экспрессируется EGFRvIII (см., например, Wikstrand et al., Cancer Res. 57:4130-4140 (1997)). Moscatello et al. (Cancer Res. 55:5536-5539 (1995)) сообщали, что EGFRvIII присутствует в 57% (26 из 46) случаев высокозлокачественных и в 86% (6 из 7) случаев низкозлокачественных глиальных опухолей. EGFRvIII не экспрессируется в нормальной ткани головного мозга. EGFRvIII обнаружен также в 66% (4 из 6) случаев глиом у детей, в 86% (6 из 7) случаев медуллобластом, в 78% (21 из 27) случаев карциномы молочной железы и в 73% (24 из 32) случаев рака яичника.
Garcia de Palazzo et al. (Cancer Res. 53:3217-3220 (1993)) применили иммуногистохимию для определения экспрессии EGFRvIII на 32 замороженных срезах первичных опухолях немелкоклеточного рака легкого. Мутацию обнаружили в 16% образцов. В случае карцином простаты 68% (26 из 38) образцов имели положительное окрашивание на EGFRvIII (Olapade-Olaopa et al., Brit. J. Cancer 82:186-194 (2000)).
Ниже, в Таблице 1, показан процент правдоподобия экспрессии EGFRvIII для различных типов рака.
Если субъект изобретения болен раком, экспрессия EGFRvIII при котором, по определению с помощью клинического исследования или опубликованного сообщения, составляет, по меньшей мере, 57%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или более, в способах изобретения считается, что эта раковая опухоль экспрессирует EGFRvIII.
Или же, или помимо этого, субъектов предварительно проверяют на экспрессию EGFRvIII полипептидов или нуклеиновых кислот, или сходных внеклеточных делеционных вариантов, в из опухоли (опухолях). Диагноз можно установить, получая образцы опухоли и проводя тесты на EGFRvIII методами на основе белка, РНК или ДНК.
Методы на основе белка, такие как иммуноанализы или иммуногистохимия, можно использовать для того, чтобы проверить, действительно ли образец опухоли экспрессирует EGFRvIII. Для таких анализов можно использовать любой белок, связывающий EGFRvIII, но предпочтительно использовать антитело, которое узнает новую последовательность пептидного связывания, которая включает следующую аминокислотную последовательность: Leu-Glu-Glu-Lys-Lys-Gly-Asn-Tyr-Val-Val-Thr-Asp-His (SEQ ID NO:18), где последовательность Leu-Glu-Glu-Lys-Lys (SEQ ID NO:19) образуется из экзона 1 EGFR, глициновый остаток образуется на границе сплайсинга между экзоном 1 и экзоном 8, a Asn-Tyr-Val-Val-Thr-Asp-His (SEQ ID NO:20) и любые соответствующие аминокислоты взяты из экзона 8 EGFR. Следует отметить, что новая последовательность пептидного связывания может также включать аминокислоты, которые обнаружены в EGFR как на аминоконце, так и на карбокси-конце последовательности SEQ ID NO:18. Таким образом, можно использовать антитело, которое специфически узнает соединительную последовательность Lys-Gly-Asn и/или соседние последовательности при условии, что их неспецифическое связывание достаточно низкое.
В одном примере получают образец опухоли, например, биопсией или хирургическим путем. В соответствии со стандартной методикой образец опухоли затем окрашивают методами иммуногистохимического окрашивания. Антитело, которое специфически узнает EGFRvIII, используют в качестве первичного антитела. Например, вариабельные области MR1-1 связываются с константными областями иммуноглобулина, например, мыши, кролика или другого животного, для которого промышленностью выпускаются вторичные антитела. Такие полноразмерные антитела конструируют методами, аналогичными методам, описанным в Примере 2. Предпочтительно, однако, не использовать константные области, так как опухолевая ткань может содержать человеческие антитела, которые могут перекрестно реагировать со вторичным антителом.
Или же поликлональные антисыворотки, которые узнают новое пептидное соединение (участок соединения в результате сплайсинга) EGFRvIII, получают стандартными методами, а затем используют для иммуногистохимии. Например, синтетический пептид, такой как Leu-Glu-Glu-Lys-Lys-Gly-Asn-Tyr-Val-Val-Thr-Asp-His-Gly-Cys (SEQ ID NO:24), продукт пептидного синтеза, получают от промышленной компании. С-концевой цистеиновый остаток используют для конъюгации пептида с носителем, таким как гемоцианин лимфы улитки (гемоцианин фисурелла, соединение по типу ключ-замок), а затем кроликов иммунизируют и делают бустер-инъекции с конъюгатом и подходящим адъювантом. После необязательной очистки антител против пептидов методом аффинной хроматографии полученную антисыворотку используют для иммуноанализов, таких как иммуногистохимия, в соответствии со стандартными методами, известными в уровне техники.
Или же экспрессию EGFRvIII можно проверять, используя тест на основе РНК. Например, образец опухоли можно тестировать, используя полимеразную цепную реакцию с обратной транскриптазой (ОТ-ПЦР, RT-PCR), нозерн-блоттинг, методы защиты РНК-азы или количественную ПЦР в реальном времени, все эти методы являются стандартными. Метод ОТ-ПЦР можно осуществлять либо на очищенном образце РНК, либо методами in situ, такими как окрашивание методами in situ гибридизации или in situ полимеразной цепной реакцией с обратной транскриптазой (ОТ/ПЦР).
Например, олигонуклеотид, примерно, из 20-30 оснований, который охватывает границу новой кодирующей последовательности EGFRvIII, можно использовать в качестве гибридизационного зонда для обнаружения мРНК EGFRvIII. Зонд создан таким образом, чтобы в центре было новое пептидное сочленение EGFRvIII, a гибридизацию осуществляют в таких условиях, чтобы зонд гибридизовался только с мРНК EGFRvIII, но не интактного EGFR. В некоторых случаях применимо сначала провести стадию обращенная транскриптаза/полимеразная цепная реакция для амплификации области связывания EGFRvIII. Помимо простой амплификации сигнала, эту стадию можно осуществлять в условиях быстрого цикла, в результате чего получают предпочтительную амплификацию коротких ДНК сегментов, так что предпочтительно амплифицируются ДНК-сегменты, соответствующие EGFRvIII, по сравнению с ДНК сегментами, соответствующими интактному EGFR. Гибридизация с охватывающим контакты (границы) (в результате альтернативного сплайсинга) олигонуклеотидным зондом проводят затем на амплифицированном материале.
В одном варианте способа один из ПЦР праймеров соответствует новому пептидному соединению (в результате сплайсинга) в EGFRvIII. Нижеприведенные праймеры 5' и 3' являются примерами праймеров, которые можно применять в данном способе.
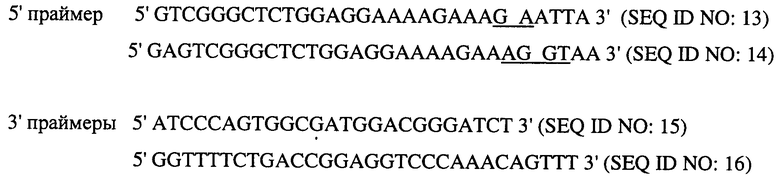
Подчеркнутая последовательность представляет собой кодон, который соответствует глицину, образующемуся при использовании гибридного кодона вследствие альтернативного сплайсинга.
Для детектирования EGFRvIII можно также использовать анализ на основе ДНК. Этот анализ показывает присутствие геномной ДНК, которая претерпела делецию с удалением экзонов 2-7 и прилегающего интронного материала. Этот подход обычно включает метод на основе ПЦР с применением олигонуклеотидных праймеров, соответствующих областям в экзоне 1 и экзоне 8. Обычно этот метод является несколько менее предпочтительным, так как в некоторых случаях может быть так, что экспрессия EGFRvIII возникает в результате альтернативного сплайсинга, а не геномной делеции. Более того, даже если экспрессия EGFRvIII является результатом геномной делеции, конечные результаты делеции в интронах варьируются от пациента к пациенту, что приводит к изменению интенсивности сигнала и размера продукта ПЦР. Саузерн-блоттинг также можно использовать для идентификации геномных делеций, которые приводят к экспрессии EGFRvIII, хотя соседняя нормальная ткань и присутствие хромосомы, кодирующей дикого типа EGFR, обычно вызывают трудности при обнаружении делегированной ДНК.
После того как раковую опухоль идентифицируют как экспрессирующую EGFRvIII, субъекту вводят одно или более антител по изобретению для лечения, стабилизации или предупреждения рака. Антитело можно вводить в дозе, достаточной для того, чтобы вызвать снижение размеров опухоли, замедлить или предупредить увеличения размеров опухоли, предупредить первичное или последующее возникновение опухоли, увеличить период безрецидивной выживаемости между исчезновением опухоли и ее повторным появлением или уменьшить побочный симптом, обусловленный опухолью.
Антитела по изобретению можно также применять для лечения предракового поражения или предупреждения развития опухоли у субъекта, у которого обнаружено предраковое поражение или найдено, что его биоптат экспрессирует EGFRvIII. Такому субъекту можно назначить профилактическую схему, чтобы снизить величину правдоподобия образования злокачественной опухоли.
Точная доза антител по изобретению для лечения или предупреждения рака варьируется в соответствии с факторами, оцениваемыми обычным врачом. Эти факторы включают (но без ограничения) габариты, возраст, общее состояние здоровья, распространенность ракового заболевания и другие средства, применяемые для лечения пациента. При разработке точной схемы лечения необходима оптимизация с помощью обычных медицинских методов, общеизвестных специалистам-медикам.
Предпочтительным способом введения антитела по изобретению является внутривенный, хотя могут также применяться внутриопухолевая, интраперитонеальная (внутрибрюшинная), подкожная, внутримышечная и интрадермальная инъекции, а также другие методы, такие как ингаляция. Особенно предпочтительным методом введения является внутривенная инфузия, например, в течение часа.
Фармацевтические композиции можно приготовить в соответствии с обычной фармацевтической практикой (см., например. Remington: The Science and Practice of Pharmacy (20th ed.), ed. A.R.Gennaro, Lippincott Williams & Wilkins, 2000 и Encyclopedia of Pharmaceutical Technology, eds. J.Swarbrick and J.C.Boylan, 1988-1999, Marcel Dekker, New York).
Жидкие препараты антитела по изобретению могут включать агенты, которые стабилизируют белки в растворе, такие как сахара, аргинин или другие аминокислоты, цитрат, Твин или человеческий сывороточный альбумин. Для жидкого препарата можно использовать забуференный фосфатом солевой физиологический раствор.
Нежидкие препараты могут также включать фармацевтически приемлемые эксципиенты, например, инертные разбавители или наполнители (например, сахарозу, сорбит, сахар, маннит, микрокристаллическую целлюлозу, крахмал, включая картофельный крахмал, карбонат кальция, хлорид натрия, лактозу, фосфат кальция, сульфат кальция или фосфат натрия); гранулирующие агенты и агенты, способствующие расщеплению (например, производные целлюлозы, включая микрокристаллическую целлюлозу, крахмал, включая картофельный крахмал, натрий кроскармелозу, альгинаты или альгиновую кислоту); связующие (например, сахароза, глюкоза, сорбит, камедь, альгиновую кислоту, альгинат натрия, желатин, крахмал, прежелатинизированный крахмал, микрокристаллическую целлюлозу, силикат магния алюминия, натрий кабоксиметилцеллтолозу, метилцеллюлозу, гидроксипропилметилцеллюлозу, этилцеллюлозу, поливинилпирролидон или полиэтиленликоль); и смазки, вещества, способствующие проглатыванию, и антиадгезионные вещества (например, стеарат магния, стеарат цинка, стеариновую кислоту, диоксид кремния, гидрогенизированные растительные масла или тальк). Другими фармацевтически приемлемыми эксципиентами могут являться красители, вещества, придающие вкус и запах, пластификаторы, смачивающие вещества, буферизующие агенты и т.п.
Предпочтительная частота приема доз составляет, примерно, один раз каждые 1-8 недель, и более предпочтительно, примерно, один раз каждые 1, 2 или 3 недели. Предпочтительная доза составляет около 20-2000 миллиграмм взрослому, весящему 70 кг, более предпочтительно, около 400-1200 миллиграмм, и наиболее предпочтительно, около 800 миллиграмм взрослому, весящему 70 кг. В одном примере пациенту, весящему 70 килограмм, вливают около 800 миллиграмм EMD72000, примерно, один раз каждые три - шесть недель в виде, примерно, 3-6 циклов. Признаки заболевания у (состояние) пациента контролируют, например, радиологическими методами, и лечение продолжают, если находят, что первая серия циклов является успешной, Дополнительная информация представлена в Vanhoefer et al., J. Clin. Oncol. 22: 175-184 (2004), Tabernero et al., Proc. Am. Soc. Clin. Oncol 22: 192 (2003), и Salazar et al., Proc. Am. Soc. Clin. Oncol. 23: 127 (2004).
Примеры
Пример 1. Идентификация эпитопа EMD72000.
Эпитоп EMD72000 на EGFR идентифицируют в основном методом 'дисплея в дрожжах (на дрожжевых клетках)', описанным Kieke et al. (патент США No.6300065), Cochran et al., supra, и Chao et al., supra, со следующими специфическими изменениями. Chao et al. нашли, что весь внеклеточный домен EGFR слабо экспрессируется при слиянии с белком Aga2 и экспрессируется на поверхности дрожжей Saccharomyces cerevisiae, так что они связывают (сливают) аминокислоты 273-621 EGFR с Aga2 для идентификации эпитопов для моноклональных антител 13А9, С225 и 806.
Найдено, что EMD72000 слабо связывается со слитым белком EGFR (273-621)-Aga2 на поверхности дрожжей, поэтому было выбрано мутантное производное полноразмерного внеклеточного домена EGFR, которое эффективно экспрессируется на поверхности дрожжей в виде слитого белка с Aga2. Это мутантное производное содержит аминокислотные замены Ala62Thr, Leu69His, Phe380Ser и Ser418Gly.
Далее по методике Chao et al. идентифицируют мутации в EGFR, которые нарушают связывание EMD72000, со следующими модификациями. Коротко говоря, популяцию плазмид экспрессии, кодирующую слитый белок EGFR-Aga2, мутагенизируют и стандартными методами трансформируют в Saccharomyces cerevisiae. Проводят четыре цикла селекции трансформированных клеток дрожжей на EGFR мутанты, которые утратили связывание с EMD72000. Предполагают, что полученная в результате популяция включает мутанты EGFR, которые влияют на сайты специфических контактов, а также мутанты EGFR, которые дестабилизируют складчатую структуру, так что антитело полностью теряет способность правильно связываться. Для высвобождения мутантов, влияющих на глобальную структуру одного или более доменов EGFR, проводят два дополнительных сортинга, отбирая клетки дрожжей, в которых антитело 225 все еще связывается с EGFR на клеточной поверхности (Фиг.3). Антитело 225 выбирают потому, что ранее было установлено, что антитела 225 и 425 (из которого образовано EMD72000) связываются с различными эпитопами на EGFR (Kreysch, опубликованная Международная патентная заявка РСТ No. WO 2004/032960).
После такого обогащения клетками дрожжей, несущими мутантные EGFR, определяют последовательности EGFR 17 независимых клонов дрожжевых клеток. Во всех последовательностях имеются мутации, соответствующие аминокислотным заменам аминокислот 452-463 EGFR. В Таблице 2 представлены репрезентативные специфические замены. В некоторых случаях идентифицируют множественные мутации, но во всех таких случаях имеется мутация в положении 452, 454, 457, 460, 461, 462 или 463.
Пример 2. Конструкция полноразмерного антитела, распознающего EGFRvIII
MR1-1 относится к ряду вариабельных областей, которые распознают (узнают) новую пептидную связь в EGFRvIII. Beers et al. (din Cancer Res. 6:2835-43 (2000)), описывают оптимизацию этих вариабельных областей из родительских вариабельных областей, названных MR1. Landry et al. (J Mol Biol. 308:883-93 (2001)), описывают разрешенную структуру вариабельных областей MR1 с пептидом, соответствующим соединительному пептиду в EGFRvIII.
В нижеприведенном примере для исследования интернализации вариабельные области MR1-1 помещают в контекст интактного антитела с тяжелой цепью человеческого IgG1 и каппа легкой цепью с целью сравнения с EMD72000.
Для экспрессии MR1-1 используют следующие стандартные методы. Последовательности ДНК, кодирующие белковые последовательности V-областей тяжелой и легкой цепи MR1-1, встраивают в вектор экспрессии антитела pDHL10, который является производным от pDHL2 (Gillies et al., J. Immunol. Methods 125:191-202 (1989)).
Для кодирования V-области тяжелой цепи MR1-1 используют следующую последовательность ДНК:
CAGGTGAAGCTGCAGCAGTCTGGAGGAGGCTTGGTGAAGCCTGGAG
CTTCACTCAAACTCTCTTGTGTGACTTCTGGATTCACTTTTCGCAAAT
TCGGAATGTCTTGGGTCCGCCAGACTTCTGACAAGTGTCTTGAGTGG
GTTGCTAGTATTAGTACAGGTGGTTACAACACCTACTATAGTGACAA
TGTGAAGGGGCGATTCACCATCTCCAGAGAGAATGCCAAGAACACC
CTGTACCTGCAAATGAGCAGTCTGAAATCTGAGGACACGGCCCTGT
ATTACTGTACGAGGGGGTATTCACCCTACTCATACGCTATGGACTAC
TGGGGTCAAGGAACCACCGTCACCGTCTCTGGGATCGAGGGCCGCG.
(SEQ ID NO:22)
Для кодирования V-области легкой цепи MR1-1 используют следующую последовательность ДНК:
GACATTGAGGCTACACAGTCTCCTGCTTCCTTATCTGTAGCTACCGG
TGAGAAAGTTACTATCAGATGCATGACTAGCACTGACATTGATGAT
GATATGAACTGGTATCAACAGAAACCCGGTGAGCCACCCAAATTCC
TCATCTCCGAGGGAAACACTCTCAGGCCTGGGGTTCCGTCCCGCTTT
AGTAGTAGTGGGACTGGGACAGACTTCGTTTTCACCATCGAGAACA
CTCTCTCCGAGGACGTGGGGGATTACTACTGCTTGCAGTCCTGGAAC
GTCCCATTAACATTCGGCTGCGGGACAAAGTTGGAAATAAAAC.
(SEQ ID NO:23)
Для введения ДНК, кодирующей описанное выше интактное антитело MR1-1, в линию клеток мышиной миеломы NS/0 применяют электропорацию. Для осуществления электропорации клетки выращивают в модифицированной по способу Дульбекко среде Игла, дополненной 10% термоинактивированной фетальной бычьей сывороткой, 2 мМ глутамина и пенициллина/стрептомицина. Примерно, 5×106 клеток отмывают однократно с помощью PBS и ресуспендируют в 0.5 мл PBS. Затем 10 мкг линеаризованной плазмидной ДНК, кодирующей антитело с V-областями MR 1-1 и константными областями человеческого IgG1, инкубируют с клетками в Gene Pulser Cuvette (кювете генного пульсатора (межэлектродное расстояние 0.4 см, BioRad) на льду в течение, примерно, 10 минут. Электропорацию проводят, используя генный пульсатор (Gene Pulser, BioRad, Hercules, CA) с установочными параметрами 0.25 В и 500 мкФ. Клетки оставляют регенерироваться в течение, примерно, 10 минут на льду, после чего их ресуспендируют в питательной среде и помещают на 2 96-луночных планшета.
Стабильно трансфецированные клоны отдирают в зависимости от их роста в присутствии 100 нМ метотрексата (МТХ), который добавляют в питательную среду через два дня после трансфекции. Подпитку клеток проводят еще два-три раза через два дня на третий, а устойчивые к МТХ клоны появляются через 2-3 недели. Супернатанты клонов анализируют с помощью анти-Fc ELISA с целью определения клонов, которые продуцируют большие количества антитела против GD2. Высокопродуктивные клоны выделяют и размножают в питательной среде, содержащей 100 нМ МТХ. Обычно используют бессывороточную питательную среду, такую как среда Н-SFM или CD (Life Technologies).
Пример 3. Ингибирование передачи сигнала EGFRvIII с помощью антитела, связывающегося с эпитопом Ser460/Gly461.
Способность различных антител ингибировать передачу сигнала рецепторами EGFR и EGFRvIII проверяют, используя четыре линии клеток, полученных из человеческих эпителиальных клеток молочной железы (НМЕС), свойства которых описаны ниже, в Таблице 3. Родительские НМЕС получают из Американской коллекции типовых культур (Manassas, VA USA). Клетки, экспрессирующие EGFRvIII, получают из родительской НМЕС линии вирусной трансдукцией с помощью экспрессирующего EGFRvIII вируса, конструированного стандартными методами (см., например, Nishikawa et al., Proc. Natl. Acad. Sci. 91:7727-7731 (1994). После осуществления протокола вирусной трансдукции, выделения и некоторого роста проводят сортинг успешно инфицированных клеток с помощью FACS системы в популяции, экспрессирующие высокие, средние и низкие уровни EGFRvIII.
Основания для применения НМЕС следующие. EGFR играет важную роль в нормальном развитии молочной железы и экспрессируется в этих клетках на высоком уровне. Кроме того, в этих клетках наблюдается высокий уровень действия механизмов опосредованного рецептором эндоцитоза, рециклинга и деградации.
Для того чтобы определить воздействие связывания данного антитела с EGFR или EGFRvIII на передачу сигнала рецепторами EGFR и EGFRvIII, к культурам НМЕС, описанным в вышеприведенной таблице, добавляют меченные радиоактивной меткой антитела. Предпосылки, основание и дизайн этого эксперимента следующие. Обычно, когда молекула EGFR передает сигнал, интенсивно происходит процесс эндоцитоза в результате активации внутриклеточных путей передачи сигнала. Этот эндоцитоз происходит за время порядка нескольких минут, при скорости интернализации до 15% в минуту или более. В отсутствие EGFR сигнальной трансдукции EGFR интернализуется медленно, в соответствии с величиной мембранного метаболизма, при скорости интернализации около 2% в минуту. Когда не-нейтрализующее меченное радиоактивной меткой антитело связывается с EGFR на клетке млекопитающего, антитело интернализуется с высокой скоростью, если присутствует лиганд или если EGFR конститутивно (постоянно) передает сигнал по какой-либо другой причине. Когда нейтрализующее меченное радиоактивной меткой антитело связывается с EGFR, передача сигнала прекращается и стимулируемый передачей сигнала эндоцитоз также прекращается. В результате меченное радиоактивной меткой нейтрализующее антитело, связанное с EGFR, интернализуется медленно, со скоростью около 2% в минуту.
Для измерения скоростей интернализации используют метод Worthylake et al., supra, схематически изображенный на фиг.4. Коротко говоря, меченные радиоактивной меткой антитела добавляют в культуру родительских НМЕС и НМЕС, экспрессирующих EGFRvIII. Через 0, 1, 2, 3, 5 и 10 минут образцы клеток отбирают, отмывают, а затем очищают кислотой для того, чтобы удалить и измерить связанное с поверхностью меченное радиоактивной меткой антитело. Затем клетки лизируют, а оставшуюся радиоактивную метку измеряют для определения уровней интернализованного антитела. Скорость интернализации рассчитывают по формулам, представленным на Фигуре 5.
Данные, показанные на фиг.6, получают с меченным радиоактивной меткой EGF, EMD72000 и MR1-1. В отдельных экспериментах данные получают при использовании не-нейтрализующего антитела 13А9. Эти данные показывают, что меченный радиоактивной меткой EGF, будучи связан с поверхностью клетки любой из четырех клеточных линий, быстро интернализуется со скоростью ke, примерно, 0.14/минута; т.е. мгновенная скорость интернализации EGF составляет около 14% в минуту.
Когда меченное радиоактивной меткой антитело 13А9 добавляют к родительской НМЕС линии, скорость его интернализации находится в пределах 0.025/минута, низкой скорости исчезновения с мембраны и интернализации. Напротив, когда присутствует также EGF, меченное радиоактивной меткой 13А9 интернализуется с высокой скоростью, сходной со скоростью интернализации меченного радиоактивной меткой EGF. Эти наблюдения согласуются с характеристикой 13А9 как не-нейтрализующего антитела в отношении связывания EGF с EGFR.
Также в отличие от поведения в присутствии родительской НМЕС, в линиях НМЕС, экспрессирующих EGFRvIII, меченное радиоактивной меткой антитело 13А9 интернализуется с высокой скоростью в присутствии и в отсутствие EGF. Эти наблюдения согласуются с концепцией, что EGFRvIII способен передавать сигнал и интернализоваться таким способом, который является конститутивным и независимым от лиганда.
Если меченное радиоактивной меткой антитело EMD72000 связано с родительскими НМЕС, экспрессирующими только EGFR в присутствии EGF, скорость интернализации низкая, это показывает, что EMD72000 ингибирует сигнальную трансдукцию при использовании интактного EGFR. Кроме того, если меченное радиоактивной меткой EMD72000 связано с НМЕС, экспрессирующими EGFRvIII, a также интактный EGFR, скорость интернализации низкая, это показывает, что EMD72000 ингибирует передачу сигнала как EGFRvIII, так и интактного EGFR.
Антитело MR1-1 связывается с новым соединительным пептидом в EGFRvIII. Конкретно, MR1-1 узнает последовательность Lys-Lys-Gly-Asn-Tyr-Val-Val-Thr-Asp- His (SEQ ID NO:25), которая экспрессируется при соединении (сочленении, контакте) экзона 1 и экзона 8 EGFR. MR1-1 не связывается с интактным EGFR, экспрессирующимся на поверхности клеток. Меченное радиоактивной меткой антитело MR1-1 медленно интернализуется клетками НМЕС, экспрессирующими как EGFRvIII, так и интактный EGFR. Не связывая себя теорией, полагают, что, по-видимому, когда клетки, экспрессирующие интактный EGFR и EGFRvIII, обрабатывают меченным радиоактивной меткой MR1-1, этот белок связывается только с EGFRvIII и ингибирует передачу сигнала через те рецепторы, с которыми он связан, но не связывается с интактным EGFR, поэтому передача сигнала через гомодимеры EGFR не ингибируется.
Пример 4. Предсказание ингибирования антителом передачи сигнала EGFR и EGFRvIII на основании структуры.
Для того чтобы понять возможные структурные предпосылки ингибирования передачи сигнала EGFRvIII антителом EMD72000, и для более полной иллюстрации методов получения антител, которые ингибируют передачу сигнала как EGFRvIII, так и интактного EGFR, конструируют следующие структурные модели:
Модель 1. Гетеродимеры интактный EGFR/EGFRvIII в конформации, способствующей передаче сигнала.
Модель 2. Гомодимеры EGFRvIII в конформации, способствующей передаче сигнала.
Модель 3. Fab, фиксированный в области Ser460/Gly461 эпитопа на модели EGFRvIII в активной конформации.
Модель 4. Fab, фиксированный в области Ser460/Gly461 эпитопа на модели EGFRvIII в неактивной конформации.
Изображения этих моделей показаны на фиг.7-9. Специалисты в области моделирования белков понимают, для того чтобы подробнее проанализировать такие структурные модели, лучше всего изучать такие модели с помощью программ визуализации, таких как RasMol (Sayle RA and Milner-White Ш, Trends Biochem. Sci. 20:374 (1995)) или SwissPDBViewer (Kaplan et al. Brief Bioinform. 2:195-7 (2001)) или других аналогичных программ, которые позволяют вьюверу вращать, перемещать и изменять размеры просматриваемой модели. Кроме того, пользователь может окрашивать и/или метить особые признаки модели, такие как важные аминокислоты и полипептидные цепи, чтобы выделить представляющие интерес признаки.
Модели создают с помощью программы SwissPDBViewer следующим образом. Для конструирования Модели 1 гетеродимера интактный EGFR/EGFRvIII делегируют (исключают) аминокислоты 1-273 из одной копии EGFR в структурном файле IMOX (Garrett TP, et al., Cell 110:763-73 (2002)). Для построения Модели 2 гомодимера EGFRvIII/EGFRvIII исключают аминокислоты 1-273 из обеих копий EGFR в структурном файле IМОХ. Не делается никаких попыток моделировать аминокислоты 1-7 как слитые с аминокислотой 274, так как было выдвинуто предположение, что аминокислоты 1-7 либо разупорядочены в EGFRvIII, либо расщепляются по последовательности Lys/Lys.
Если исходить из Моделей 1 и 2 (фиг.7), становится очевидным, что остаток домена 2 в EGFRvIII, который включает аминокислоты, примерно от 274 до примерно 310, осуществляет значительные контакты димера и, наиболее вероятно, вносит полезный вклад в образование гетеродимеров EGFRTEGFRvIII и гомодимеров EGFRvIII/EGFRvIII. Наиболее вероятно, что такой полезный энгергетический вклад возможен только в том случае, если домен 2, оставшийся в EGFRvIII, находится в корректной конформации, которая согласно теоретическому обоснованию изобретения соответствует такой же конформации, которую имеют аминокислоты 274-310 в активном димере интактного EGFR. Модель 3 (фиг.8) конструируют, исходя из Модели 1, путем добавления фрагмента Fab, который входит, ориентировочно, в выступ Ser460 и Gly461 в EGFRvIII. В результате этого действия по построению модели видно, что позиционирование Fab фрагмента над эпигоном Ser460/Gly461 показывает что Fab сталкивается в пространстве (стерически сближается) с аминокислотами 274-310 EGFR в активной, передающей сигнал конформации. Однако такой Fab стерически не сближается с аминокислотами 274-310 EGFR в неактивной, не способствующей передаче сигнала конформации, которая наблюдается, например, в структуре Модели 4. Модель 4 конструируют, помещая фрагмент Fab, позиционированный в Модели 3, в структуру, которую имеет EGFR в неактивной конформации.
Без связи с какой-либо теорией можно сказать, что, по-видимому, эти результаты объясняют данные, полученные в Примере 2, а именно что связывание EMD72000 с EGFRvIII ингибирует передачу сигнала EGFRvIII.
Кроме того, эти наблюдения иллюстрируют способ по изобретению, в котором антитела по изобретению идентифицируют, сравнивая модели трехмерных структур EGFRvIII в активном и неактивном состоянии, находя поверхности, которые являются незаметными, замаскированными в активном состоянии, и экспонируются в неактивном состоянии, а затем идентифицируя антитела, которые связываются на таких поверхностях или рядом с ними. Модели EGFRvIII в активном и неактивном состоянии обычно получают, удаляя аминокислоты 1-273 из моделей разрешенных структур EGFR в активном и в неактивном состоянии. Антитела, которые связываются с заданными поверхностями, идентифицируют, например, сначала идентифицируя антитела против EGFR с отдельными эпитопами, а затем идентифицируя эпитопы различных антител, например, дисплеем в дрожжевых клетках.
Другие варианты изобретения
Из представленного выше описания становится ясно, что в изобретение по данному описанию можно ввести варианты и модификации, чтобы принять различные применения и условия. Такие варианты также входят в объем следующих вариантов изобретения.
Все публикации, патентные заявки и патенты, указанные в данной характеристике, включая предварительную заявку США No.60/788426, поданную 31 марта 2006 года, вводятся в данное описание, как если бы независимая публикация, патент или патентная заявка специфически и индивидуально вводилась в качестве ссылки.











| название | год | авторы | номер документа |
|---|---|---|---|
| САЙТЫ АНТИТЕЛ, СПЕЦИФИЧНО СВЯЗЫВАЮЩИЕ EGFRvIII | 2014 |
|
RU2696892C2 |
| КОМПОЗИЦИИ РЕКОМБИНАНТНЫХ АНТИТЕЛ ПРОТИВ РЕЦЕПТОРА ЭПИДЕРМАЛЬНОГО ФАКТОРА РОСТА | 2008 |
|
RU2488596C2 |
| КОМПОЗИЦИИ РЕКОМБИНАНТНЫХ АНТИТЕЛ ПРОТИВ РЕЦЕПТОРА ЭПИДЕРМАЛЬНОГО ФАКТОРА РОСТА | 2009 |
|
RU2540146C2 |
| БЕЛКИ СПЕЦИФИЧЕСКОГО СВЯЗЫВАНИЯ И ИХ ПРИМЕНЕНИЯ | 2010 |
|
RU2549678C2 |
| БЕЛКИ СПЕЦИФИЧЕСКОГО СВЯЗЫВАНИЯ И ИХ ПРИМЕНЕНИЯ | 2010 |
|
RU2673724C2 |
| ЛЕЧЕНИЕ РАКА С ИСПОЛЬЗОВАНИЕМ ХИМЕРНОГО АНТИГЕНСПЕЦИФИЧЕСКОГО РЕЦЕПТОРА НА ОСНОВЕ ГУМАНИЗИРОВАННОГО АНТИТЕЛА ПРОТИВ EGFRvIII | 2014 |
|
RU2708032C2 |
| ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ С MND-ПРОМОТОРОМ | 2015 |
|
RU2708311C2 |
| БЛОКАДА CD73 | 2015 |
|
RU2746804C2 |
| СПОСОБЫ ИДЕНТИФИКАЦИИ ОПУХОЛЕЙ, ВОСПРИИМЧИВЫХ К ЛЕЧЕНИЮ АНТИТЕЛАМИ ПРОТИВ ErbB2 | 2003 |
|
RU2338751C2 |
| АНТИТЕЛО К ПРОТИВООПУХОЛЕВОМУ АНТИГЕНУ И СПОСОБЫ ПРИМЕНЕНИЯ | 2011 |
|
RU2598711C2 |

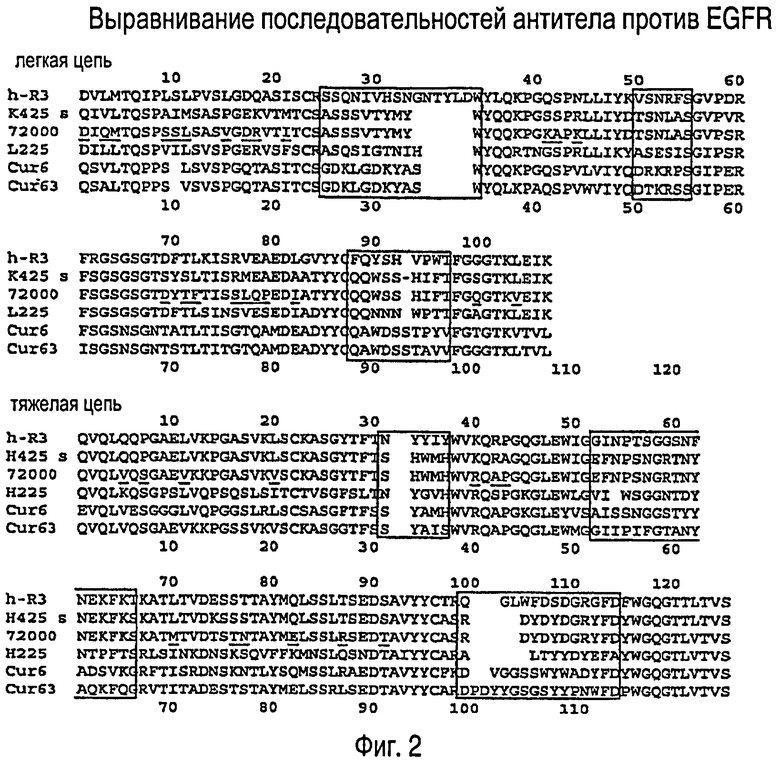
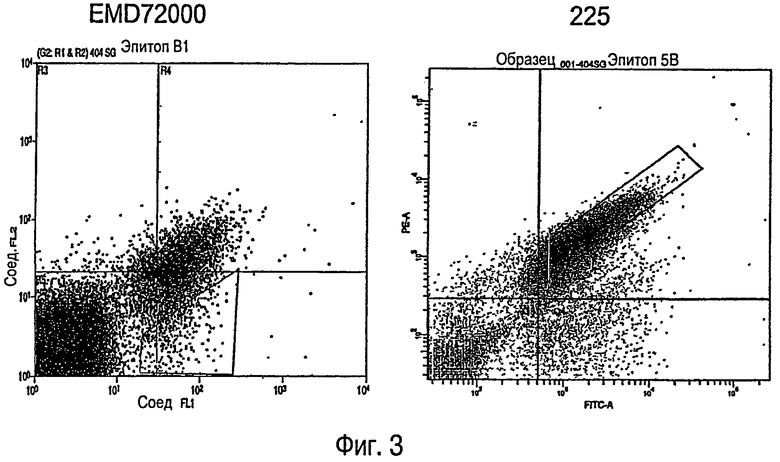

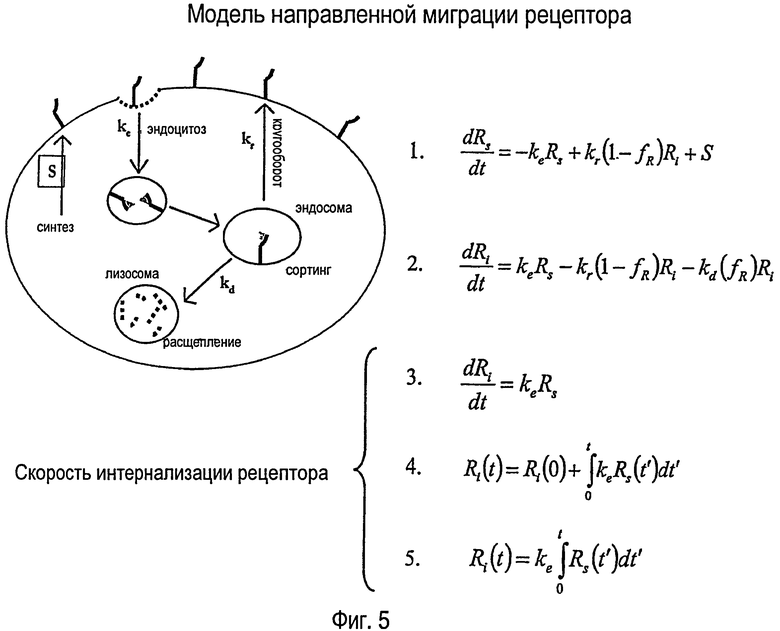
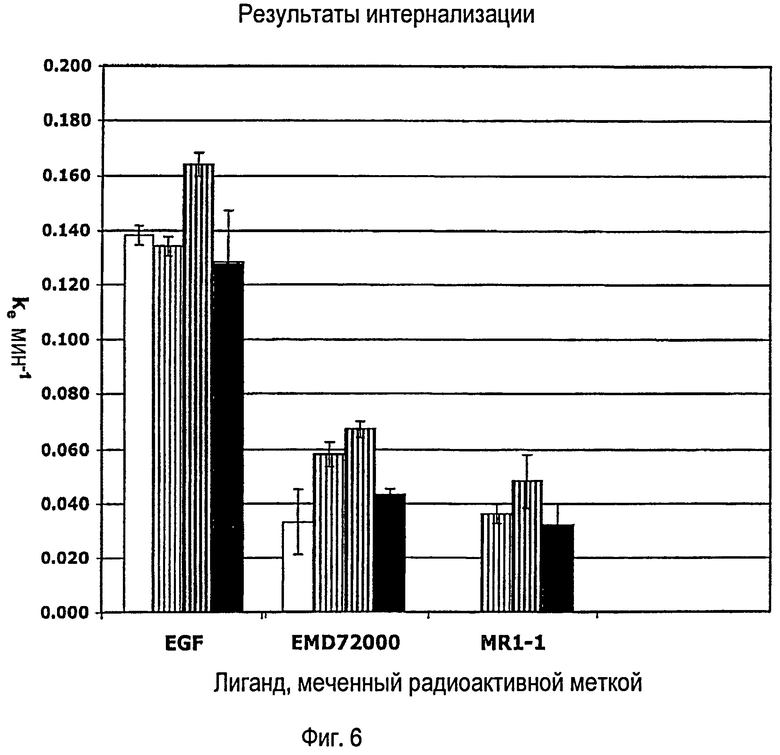
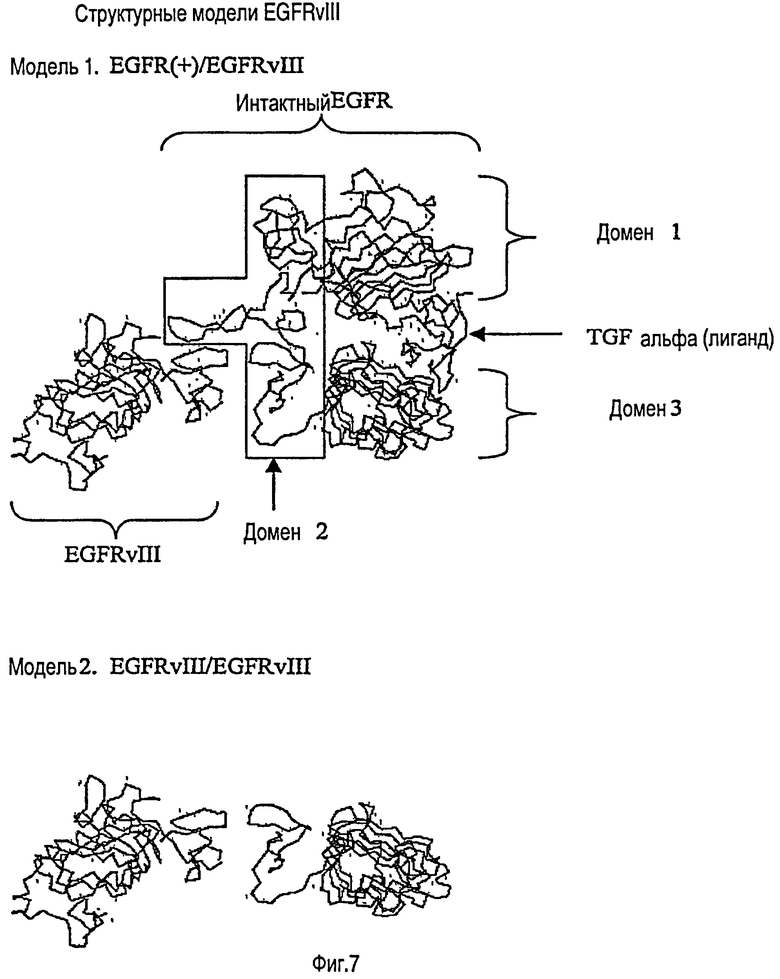
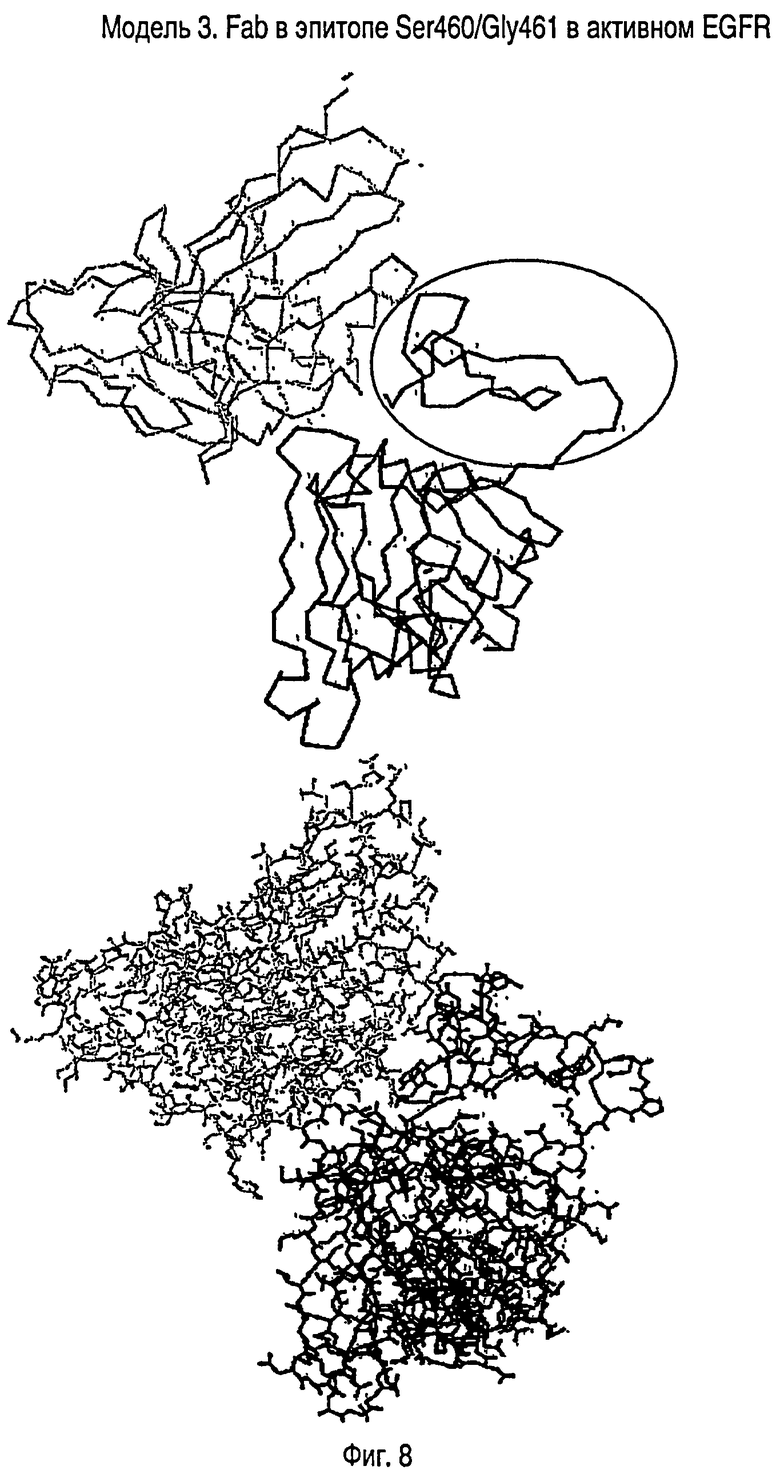
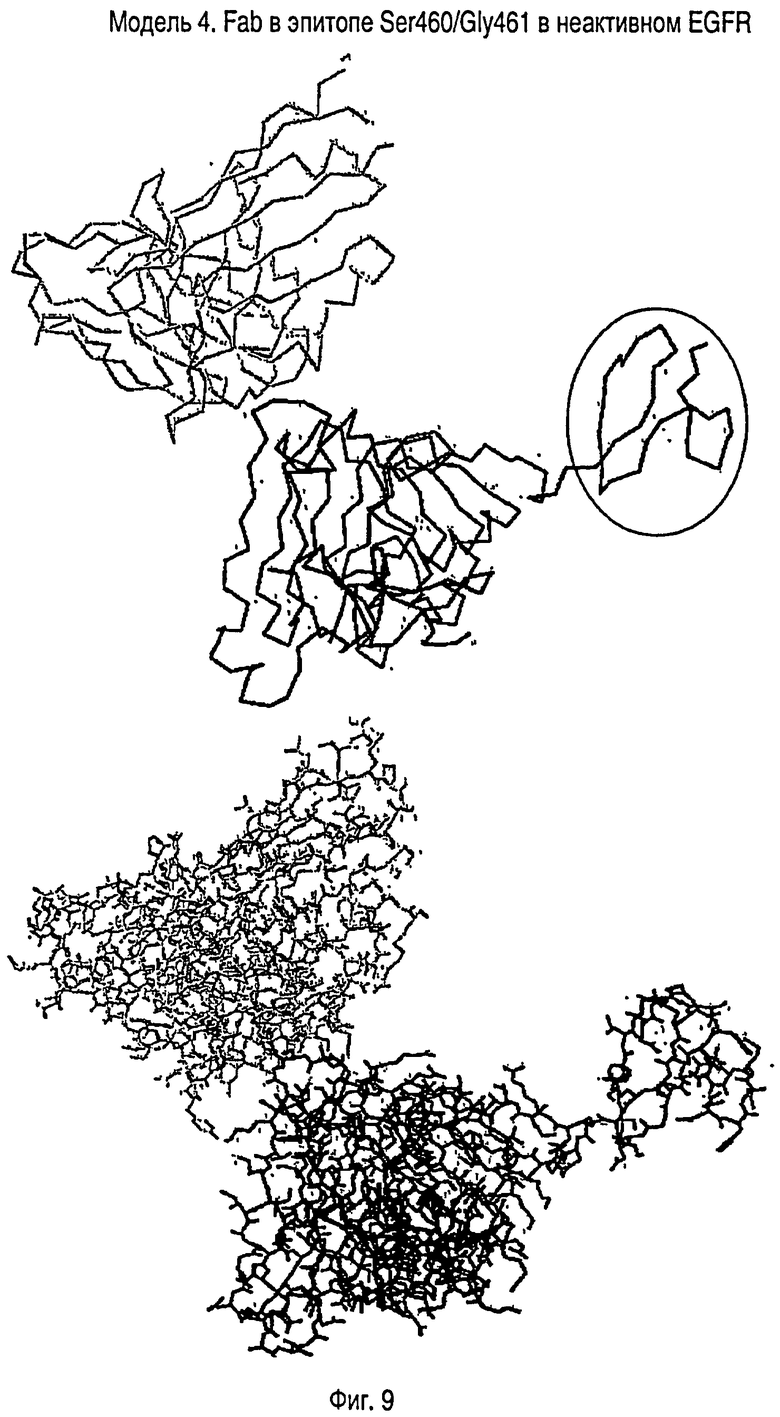
Группа изобретений относится к медицине, а именно к онкологии, и может быть использована для определения антител к рецептору эпидермального фактора роста (EGFR), снижающих или предупреждающих передачу сигнала интактными EGFR или EGFRvIII. Способы по изобретению включают (а) контактирование кандидата антитела с белком EGFR или его фрагментом, имеющим EGFR дикого типа, (b) контактирование кандидата антитела с белком EGFR или его фрагментом, имеющим мутантный EGFR сравнение связывания кандидата антитела с белком EGFR или его фрагментом, на стадии (а) со связыванием кандидата антитела с белком EGFR или его фрагментом на стадии (b), причем антитело, связывающееся с EGFR на стадии (а), а не на стадии (b), идентифицируется как антитело анти-EGFR, которое снижает или предупреждает передачу сигнала интактными EGFR или EGFRvIII. Использование изобретений позволяет идентифицировать антитела, ингибирующие сигнальную трансдукцию интактным EGFR. 3 н. и 16 з.п. ф-лы, 9 ил., 3 табл.
1. Способ идентификации антитела рецептора эпидермального фактора роста (EGFR), снижающего или предупреждающего передачу сигнала интактными EGFR или EGFRvIII, включающий
(a) контактирование кандидата антитела с белком EGFR или его фрагментом, имеющим EGFR дикого типа с серином и глицином в положениях 460 и 461;
(b) контактирование кандидата антитела с белком EGFR или его фрагментом, имеющим мутантный EGFR в положениях 460 и 461;
(c) сравнение связывания кандидата антитела с белком EGFR или его фрагментом, на стадии (а) со связыванием кандидата антитела с белком EGFR или его фрагментом на стадии (b), причем антитело, связывающееся с EGFR на стадии (а), а не на стадии (b), идентифицируется как антитело анти-EGFR, которое снижает или предупреждает передачу сигнала интактными EGFR или EGFRvIII.
2. Способ по п.1, отличающийся тем, что мутация при аминокислоте в положении 460 представляет собой мутацию серина в аланин, фенилаланин, пролин, треонин, тирозин или аспарагиновую кислоту.
3. Способ по п.1, отличающийся тем, что мутация при аминокислоте в положении 461 представляет собой мутацию глицина в лейцин.
4. Способ по п.1, отличающийся тем, что передача сигнала интактными EGFR или EGFRvIII включает переход в активную конформацию, интернализацию рецептора, димеризацию рецептора, аутофосфорилирование рецептора и фосфорилирование субстрата.
5. Способ по п.4, отличающийся тем, что передача сигнала интактными EGFR или EGFRvIII представляет собой димеризацию рецептора.
6. Способ по п.1, отличающийся тем, что фрагмент EGFR представляет собой внеклеточный домен EGFR.
7. Способ по п.6, отличающийся тем, что фрагмент EGFR состоит из внеклеточного домена EGFR.
8. Способ по п.1, отличающийся тем, что фрагмент EGFR содержит аминокислоты 273-621 EGFR.
9. Способ по п.8, отличающийся тем, что фрагмент EGFR дополнительно содержит одну или более замены аминокислот, выбранные из группы, состоящей от аланина до треонина при аминокислоте 62, от лейцина до гистидина при аминокислоте 69, от фенилаланина до серина при аминокислоте 380, и от серина до глицина при аминокислоте 418.
10. Способ по п.1, отличающийся тем, что эпитоп дополнительно содержит по меньшей мере одну или более замены аминокислот, выбранных из группы, состоящей из аминокислот 452, 454, 457, 462 и 463 EGFR, причем белок EGFR или его фрагмент стадии (а) дополнительно содержит аминокислоту дикого типа в положениях 452, 454, 457, 462 и 463 EGFR, а белок EGFR или его фрагмент стадии (b) дополнительно содержит мутацию одной или более аминокислот в положениях 452, 454, 457, 462 и 463, причем антитело, которое связывается с EGFR стадии (а), а не стадии (b), идентифицируется как антитело анти-EGFR, которое связывается с эпитопом, включающим Ser460 и Gly461 и по меньшей мере одну дополнительную аминокислоту, выбранную из группы, состоящей из аминокислот 452, 454, 457, 462 и 463 EGFR.
11. Способ по п.10, отличающийся тем, что передача сигнала интактными EGFR или EGFRvIII включает переход в активную конформацию, интернализацию рецептора, димеризацию рецептора, аутофосфорилирование рецептора и фосфорилирование субстрата.
12. Способ по п.10, отличающийся тем, что фрагмент EGFR представляет собой фрагмент, который включает внеклеточный домен EGFR или EGFRvIII.
13. Способ по п.12, отличающийся тем, что фрагмент EGFR состоит из внеклеточного домена EGFR или EGFRvIII.
14. Способ идентификации антитела анти-EGFR, снижающего или предупреждающего передачу сигнала интактными EGFR или EGFRvIII, включающий (а) контактирование полипептида EGFR или EGFRvIII или его фрагмента с EMD72000; (b) измерение связывания EMD72000 с полипептидом EGFR или EGFRvIII или его фрагментом; (с) контактирование полипептида EGFR или EGFRvIII или его фрагмента, и EMD72000 стадии (а) с кандидатом антитела; (d) измерение связывания EMD72000 с полипептидом EGFR или EGFRvIII или его фрагментом, причем уменьшение связывания EMD72000 с полипептидом EGFR или EGFRvIII по сравнению со связыванием, измеряемым в стадии (b), идентифицирует данного кандидата антитела как антитело, которое снижает или предупреждает передачу сигнала интактными EGFR или EGFRvIII.
15. Способ по п.14, отличающийся тем, что передача сигнала интактными EGFR или EGFRvIII включает переход в активную конформацию, интернализацию рецептора, димеризацию рецептора, аутофосфорилирование рецептора и фосфорилирование субстрата.
16. Способ по п.14, отличающийся тем, что передача сигнала интактными EGFR или EGFRvIII представляет собой димеризацию рецептора.
17. Способ идентификации антитела анти-EGFR, снижающего или предупреждающего передачу сигнала интактными EGFR или EGFRvIII, включающий (а) контактирование кандидата антитела с фрагментом EGFR, включающим аминокислоты 314-337 или 406-413 белка EGFR; (b) определение связывания кандидата антитела с фрагментом EGFR, причем антитело, которое связывается с фрагментом EGFR стадии (а), идентифицируется как антитело анти -EGFR, которое снижает или предупреждает передачу сигнала интактными EGFR или EGFRvIII.
18. Способ по п.17, отличающийся тем, что передача сигнала интактными EGFR или EGFRvIII включает переход в активную конформацию, интернализацию рецептора, димеризацию рецептора, аутофосфорилирование рецептора и фосфорилирование субстрата.
19. Способ по п.17, отличающийся тем, что фрагмент EGFR включает последовательность SEQ ID NO: 21.
| Дорожная спиртовая кухня | 1918 |
|
SU98A1 |
| ПРОТИВООПУХОЛЕВАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ПРОИЗВОДНЫЕ ТАКСАНА | 1993 |
|
RU2131250C1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| НОСОВ Д.А | |||
| Механизмы регуляции внутриклеточной передачи сигнала и апоптоза: успехи и неудачи целенаправленной терапии | |||
| VIII Российский онкологический конгресс | |||
| - Москва, 22-24 ноября 2004 г | |||
| он лайн [найдено в Интернете на | |||
Авторы
Даты
2011-09-20—Публикация
2007-03-29—Подача