Изобретение относится к медицине, а именно к материалам и средствам для замещения дефектов костной ткани, и предназначено для использования в травматологии и ортопедии, челюстно-лицевой хирургии и стоматологии, в том числе в качестве носителя биологически активных веществ и лекарственных средств.
В настоящее время для реконструкции костных дефектов (сложных переломов, артрозов, очагов остеопороза и остеонекроза, остеомиелитических и опухолевых секвестров, после удаления кист, хондром и т.п.) наиболее распространенными материалами с четко выраженной опорной функцией являются искусственные и натуральные кальций-фосфатные материалы (аморфный фосфат кальция, гидроксиапатит, ди- и трифосфат кальция, пирофосфат и др.). Известен биодеградируемый костнозамещающий материал, содержащий фосфат кальция и натрия, и ренанит [патент США №7074730]. Известен остеозамещающий материал, получаемый при обработке фосфатного камня алюмосиликатом или карбонатом натрия с образованием ренанита [патент США №4436546]. Известен керамический биодеградируемый материал на основе фосфатов кальция и натрия, представляющий собой фазы трикальций фосфата и ренанита [патент РФ №2372891]. Известна композиция стоматологического пломбировочного материала, получаемого гидратацией порошковообразного кальций фосфатного материала с образованием апатита [патент РФ №2332201]. Известен остеозамещающий медицинский композитный материал, содержащий хлорапатит, гидрат фосфата кальция и железа, фосфат кальция, гидрофосфат кальция и карбонат кальция [патент РФ №2320353], и композиция, содержащая гидроксиапатит, трикальций фосфат, фосфат магния и кальция [патент РФ №2292866].
Недостатком остеозамещающих материалов такого типа является то, что кальций фосфат, характеризующийся остеокондуктивной (поддерживающей) способностью, самостоятельно не обладает остеоиндуцирующими свойствами [Urist M.R., Leitze A., Davidson E. B-tricalcium phosphate delivery system for bone morphogenetic protein. Clin Ortop. 1984; 187: 277-279. Damien C.J., Parsons J.R. Bone graft and bone graft substitutes: review of current technology and applications. J. Appl. Biomater. 1991; 2: 187-208. John K.R., Zardiackas L.D., Terry R.C. Histological and electron microscopic analysis of tissue-response to synthetic composite bone graft in the canine. J. Appl. Biomater. 1995; 6: 89-97].
Известны композиционные материалы, содержащие одновременно коллаген и кальций фосфатные вещества, разработанные для челюстно-лицевой хирургии и хирургической стоматологии. Зарубежные материалы - типа "Alveloform" и "Bigraft" (США), содержащие очищенный фибриллярный кожный коллаген и частицы гидроксиапатита, пригодные для восстановления дефектов костной ткани при хирургическом лечении больных с парадонтитами, а также «Bio-OSS Collagen» (Швейцария), «Biobon» (Германия). Серия гибридных материалов на основе кальций фосфатов и коллагена создана в России, это «Гидроксиапол», КоллапАн®, «Росдент», «Полистом», «Остеопласт», «Индост» [патенты РФ №2317088, №2297249].
К недостаткам этих материалов относятся: первое - коллаген и кальций фосфаты самостоятельно не обладают остеоиндукцией, второе - их невысокие физико-механические характеристики (показатели прочности порядка 6,5 МПа и модуль Юнга около 2 ГПа), ограничивают применение материалов такого типа для заполнения крупных костных дефектов [Suchanek W, Yashima M, Kakihana M, Yoshimura M. Hydroxyapatite ceramics with selected sintering additives. Biomaterials. 1997; 18: 923-933].
Среди подходов, направленных на улучшение механических свойств остеозамещающих материалов на основе керамик (уменьшение жесткости, повышение эластичности) в последние годы сформировалось направление исследований, ориентированное на получение композитов гидроксиапатита с синтетическими полимерами (полиэтиленом, полисульфоном).
Недостаток этих материалов связан с тем, что наполнение гидроксиапатита такими полимерами значительно снижает его биосовместимость [Vacanti С.A, Vacanti J.P. The science of tissue engineering. Orthop Clin North Am. 2000; 31: 351-356].
Известены остеопластические материалы, содержащие смеси гидроксиапатита и полиакриламида [Григорьян А.С., Воинов А.В., Воложин А.И. Динамика заживления экспериментальных костных дефектов, заполненных различными композициями на основе полиакриламидного геля Стоматология. - 1999. - 8. - С.9-15] и сложная полимерная композиция для хирургического костного цемента, содержащая диметиметакрилат, жидкий компонент из акрилового олигомера, монометакриловый эфир этиленгликолы и антибиотики [патент РФ №2195320].
Недостаток этих материалов - отсутствие свойства остеоиндукции, а также цитотоксичность полиакриламида и токсичность продуктов его распада.
Новое решение проблемы - это создание композиционных материалов на основе керамик и биосовместимых полимеров, способных к биодеградации [Mistry A.S., Mikos A.G., Jansen J.A. Degradation and biocompatibility of a poly(propylene fumarate)-baseo/alumoxane nanocomposite for bone tissue engineering. J Biomed Mater Res. 2007; 83: 940-953]. Среди таковых известны применяемые с недавних пор в практике лечения остеомиелита композиции на основе керамик и лактидов или Са-желатиновые системы [Link D.P., van den Dolder J., van den Beucken J.J., Cuijpers V.M, Wolke J.G., Mikos A.G., Jansen J.A. Evaluation of the biocompatibility of calcium phosphate cement/PLGA microparticle composites. J Biomed Mater Res. 2008; [Epub ahead of print]].
Недостаток этих композитных материалов - быстрая ликвация антибиотиков вследствие быстрого гидролиза и биодеструкции этих полимеров in vivo, поэтому такие материалы неэффективны для лечения длительно текущих костных инфекций.
Известны другие биосовместимые полимеры, скорости разрушения которых в биологических средах намного более длительны по сравнению с полилактидами, коллагеном и т.п., например - полимеры из семейства полигидроксиалканоатов (ПГА), синтезируемые микроорганизмами. ПГА - это класс линейных термопластичных и биоразрушаемых полимеров, характеризующихся высокой биологической совместимостью, длительными и управляемыми скоростями разрушения в биологических средах, перерабатываемостью в специализированные изделия различными методами. ПГА представляют большой интерес для ортопедии в связи с их механической прочностью, высокой биосовместимостью и медленной биодеградацией [Волова Т.Г., Севастьянов В.И., Шишацкая Е.И. Полиоксиалканоаты - биоразрушаемые полимеры для медицины / Под ред. академика В.И.Шумакова. - Новосибирск: Изд-во Сибирского отделения РАН, 2003. - 350 с. Штильман М.И. Полимеры медико-биологического назначения // М: ИКЦ «Академкнига» - 2006].
Известен композитный материал, содержащий сополимер 3-гидроксимасляной и 3-гидроксивалериановой кислот (3-ПГБ/3-ПГВ) с включением гидроксивалерата 11 мол.% или сополимеры 3-гидроксибутирата/4-гидроксибутирата (3-ПГБ/4-ПГБ) с включением 4-гидроксибутирата 7 мол.% и антибиотик (типа Sulperasone® и Duocid®) [Gürsel I., Korkusuz F., Turesin F., Alaeddinoglu N.G., Hasirci V. In vivo application of biodegradablr controlled antibiotic release systems for the treatment of implant-related osteomyelitis // Biomaterials. - 2001. - V.22. - P.73-80].
Недостаток композиции - отсутствие в ней кальций фосфатных веществ усиливающих остеоинтегративные и прочностные свойства ПГА.
Наиболее близким к заявляемому изобретению является материал для регенерации костной ткани (варианты), который применяется для возмещения дефектов плоских и трубчатых костей, доставкой его в область дефекта закрытым способом [патент РФ №2360663, МПК А61К 6/033, опубл. 10.07.2009 г. (прототип)]. Материал в виде геля содержит биоразрушаемый и биосовместимый полиэтиленгликоль, дистиллированную воду и композицию ортофосфатов кальция, а по другим вариантам дополнительно может содержать неколлагеновые белки, противовоспалительные препараты и оксид цинка.
Недостаток данного геля заключается в том, что водорастворимый полиэтиленгликоль быстро вымывается из материала in vivo, поэтому данный материал неэффективен для длительно текущих регенераций больших дефектов в опорных костях и материал непригоден для заполнения крупных костных дефектов открытым способом.
Техническим результатом изобретения является получение биоразрушаемого и высокопрочного хирургического материала для реконструкции дефектов костной ткани различной этиологии, обладающего высокими остеоиндукционными и антимикробными свойствами и высокой биосовместимостью, а также способностью медленно биорезорбироваться in vivo адекватно скорости формирования полноценной новообразованной костной ткани без образования токсичных продуктов и негативных реакций со стороны тканей в процессе использования.
Технический результат достигается тем, что в хирургическом материале для реконструкции дефектов костной ткани, включающем биоразрушаемый и биосовместимый полимер и кальций фосфатные вещества, новым является то, что в качестве биоразрушаемого и биосовместимого полимера он содержит сополимер 3-гидроксибутирата и 3-гидроксивалериата, при следующем соотношении компонентов, мас.%:
А также тем, что кальций фосфатные вещества содержат трикальций фосфат и/или гидроксиапатит.
А также тем, что сополимер растворен, по меньшей мере, в одном растворителе.
А также тем, что растворитель представляет собой дихлорметан или хлороформ.
А также тем, что дополнительно содержит порообразующие вещества.
А также тем, что в качестве порообразующих веществ используют хлорид натрия или кристаллическую сахарозу с размером кристаллов от 400 до 600 мкм.
А также тем, что дополнительно содержит ультратонкое волокно из сополимера 3-ПГБ/3-ПГВ.
А также тем, что дополнительно содержит костные морфогенетические белки.
А также тем, что выполнен в виде порошка или гранул.
А также тем, что выполнен в виде объемной плотной или объемной пористой керамики.
А также тем, что выполнен в виде пленки или пластины.
Технический результат достигается также тем, что в хирургическом материале для реконструкции дефектов костной ткани, включающем биоразрушаемый и биосовместимый полимер, кальций фосфатные вещества и антибиотик, новым является то, что в качестве биоразрушаемого и биосовместимого полимера содержит сополимер 3-гидроксибутирата и 3-гидроксивалериата, а антибиотик выбран из группы, состоящей из тиенама, гентамицина, сульперазона и рубомицина, при следующем соотношении компонентов, мас.%:
А также тем, что кальций фосфатные вещества содержат трикальций фосфат и/или гидроксиапатит.
А также тем, что сополимер растворен, по меньшей мере, в одном растворителе.
А также тем, что растворитель представляет собой дихлорметан или хлороформ.
А также тем, что дополнительно содержит порообразующие вещества.
А также тем, что в качестве порообразующих веществ используют хлорид натрия или кристаллическую сахарозу с размером кристаллов от 400 до 600 мкм.
А также тем, что дополнительно содержит ультратонкое волокно из 3-ПГБ/3-ПГВ.
А также тем, что выполнен в виде порошка.
А также тем, что выполнен в виде объемной плотной или объемной пористой керамики.
А также тем, что выполнен в виде пленки или пластины.
Заявляемая группа изобретений соответствует требованию единства изобретения, поскольку группа однобъектных изобретений образует единый изобретательский замысел, причем заявка относится к объектам изобретения одного вида, одинакового назначения, обеспечивающим получение одного и того же технического результата.
Сопоставительный анализ с прототипом позволил выявить совокупность существенных по отношению к техническому результату отличительных признаков для каждого из заявляемых объектов группы, изложенных в формулах. Следовательно, каждый из объектов группы изобретений соответствует критерию «новизна».
Признаки, отличающие заявляемые технические решения от прототипа, не выявлены в других технических решениях при изучении данных и смежных областей техники и, следовательно, обеспечивают заявляемым решениям соответствие критерию «изобретательский уровень».
Сущность изобретения поясняется чертежами.
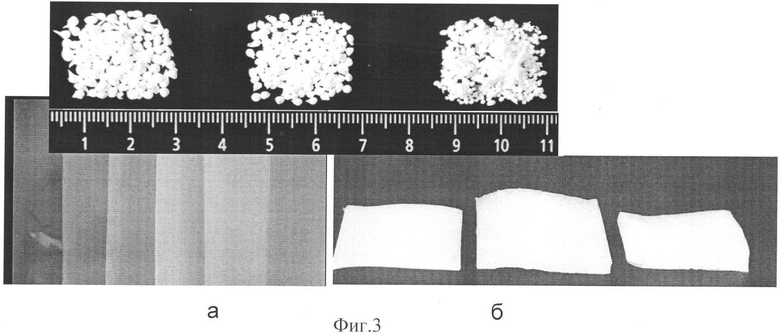
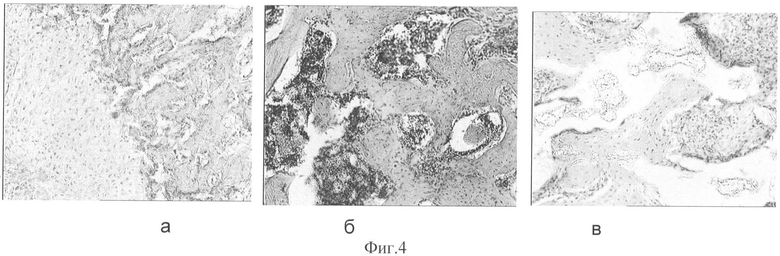
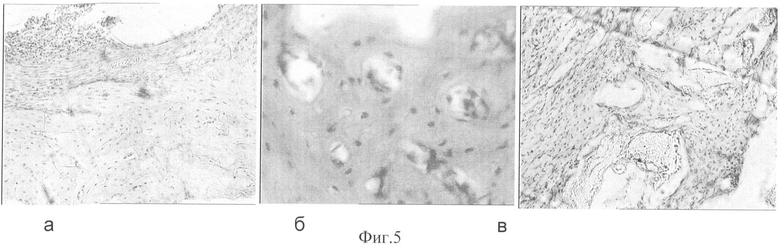
На фиг.1 представлен внешний вид хирургического материала на основе сополимера и кальций фосфатных веществ (3-ПГБ/3-ПГВ+КФВ) в виде гранул. На фиг.2 представлен объемный плотный (а) и пористый (б) хирургический материал, полученный прямым холодным прессованием сополимера и кальций фосфатных веществ (3-ПГБ/3-ПГВ+КФВ). На фиг.3 представлен хирургический материал, полученный экструзией из расплава сополимера 3-ПГБ/3-ПГВ в виде пленок и пластин. На фиг.4 представлены костные регенераты в модельном дефекте при имплантации материала, содержащего (на 100 г): 65 г сополимера 3-ПГБ/3-ПГВ, 20 г ГА и 15 г ТКФ: через 14 суток (а), 1 месяц (б), 3 месяца (в). Окраска гематоксилин-эозин. Увеличение ×100. На фиг.5 представлены костные регенераты в модельном дефекте при имплантации материала, содержащего (на 100 г): 75 г сополимера 3-ПГБ/3-ПГВ и 24.99 г ГА, в который перед имплантацией был введен костный морфогенетический белок КМБ-2 в количестве 0.01 г через 14 суток (а), 1 месяц (б), 3 месяца (в). Окраска гематоксилин-эозин. Увеличение: (а) и (в) × 100; (б) × 400.
ВАРИАНТ 1.
Для получения хирургического материала для реконструкции дефектов костной ткани используют сополимер, полученный микробиологическим способом согласно Техническим условиям на сополимер (ТУ №2200-001-03533441-2004 per. 14.12.2005 №068/003058) на опытном производстве Института биофизики СО РАН (Гигиенический сертификат соответствия Главной санитарной службы РФ соответствия условий производству материалов для медицины №24.49.05.000.М.007682.01.05 от 24.01.2005 г.). Полимер синтезирован природным штаммом бактерий Ralstonia eutropha В 5786 [патент РФ №2053292] на ацетате натрия с добавками валериата калия в культуру [патент РФ №2051968]. Сополимер содержит соотношение мономеров 3-ПГБ/3-ПГВ в широких пределах, от 90:10 до 10:90 (мол.%). Выделение и очистку полимера из бактериальной биомассы осуществляют дихлорметаном или хлороформом. Полимер выделяют из полученного экстракта после его концентрирования на роторном испарителе Rotavapor R-210 (Швейцария). Для получения высокоочищенных образцов полимеров проводят процедуру многократного растворения полимера в хлороформе и осаждение изопропанолом (или гексаном). Полученный полимер высушивают в боксе-ламинаре. Химический состав сополимера определяют на хроматомасс-спектрометре Agilent 5975Inert, фирмы Agilent (США) после предварительного метанолиза проб полимера. Температуру плавления сополимера определяют на дериватографе СТА - STA 449 Jupiter фирмы NETZSCH (Германия). Определение степени кристалличности сополимера осуществляют на рентгеноспектрометре D8 ADVANCE фирмы «Bruker» (Германия) (графитовый монохроматор на отраженном пучке). Молекулярную массу исходного сополимера и после его переработки в хирургический материал регистрируют системой гель-проникающей хроматографии «Waters Alliance GPC 2000 Series» фирмы «Waters» (США) с набором полистериновых стандартов (Sigma).
Значение средневесовой молекулярной массы используемых сополимеров 3-ПГБ/3-ПГВ варьирует и составляет в зависимости от величины фракции 3-ГВ от 900 до 1600 кДа, степень кристалличности от 40 до 60%, температура плавления (Тпл), соответственно, от 150 до 162°С, с разрывом температуры плавления и температуры термической деградации (Тдегр) не менее 90°С.
Базовую композицию заявляемого хирургического материала получают смешивая мелкодисперсный порошок сополимера 3-ПГБ/3-ПГВ и мелкодисперсный порошок кальций фосфатных веществ (КФВ), при следующем соотношении компонентов в мас.%: сополимер от 65 до 90, кальций фосфатные вещества, суммарно от 10 до 35. При этом кальций фосфатные вещества содержат гидроксиапатит (ГА) и трикальций фосфат (ТКФ), доля ГА в материале составляет от 10 до 25%, ТКФ - от 0 до 15%.
Для получения пористого хирургического материала к базовой композиции добавляют кристаллическую сахарозу или хлорид натрия (размеры кристаллов 400-600 мкм) в количестве от 10 до 20% мас., которые потом удаляют из сформованного изделия промыванием его в воде (техника выщелачивания). Заданный диаметр пор сопоставим с диаметром остеонов, т.к. известно, что при несоответствии размеров пор матрикса и остеогенных клеток ингибируется остеоиндукция [Gauthier О., Bouler J.-M., Aguado E. et al. Macroporous biphasic calcium phosphate ceramics: influence macropore diameter and macroporosity percentage on bone ingrowth // Biomaterials. - 1998. - Vol.19. - N 1-3. - Р.133-139]. После вымывания кристаллов соли в материале образуются поры, размер которых соответствует размеру кристаллов используемых солей (фиг.2б). В зависимости от величины добавки солей пористость материала может варьироваться от 20 до 80%.
Для повышения прочностных характеристик заявляемого хирургического материала перед прессованием к базовой композиции добавляют ультратонкие волокна диаметром 1-3 мкм (полученные из 3-ПГБ/3-ПГВ того же состава, что и материал, методом электростатического формования (ЭСФ), в количестве 10-15 мас.%.
Для усиления остеоиндуктивных свойств хирургического материала в стерильных условиях в базовую композицию вводят раствор костного морфогенетического белка, например КМБ-2, из расчета 0.01-0.02 мас.% от массы имплантируемого хирургического материала и затаривают с использованием термоупаковочной машины NS 1000 фирмы «Howo Gmby».
Заявляемый хирургический материал по варианту 1 может быть получен разными способами (прямым холодным прессованием, формованием из расплава, экструзией) и представлен в различном виде (порошка, гранул, гибких пленок, пластин, объемных матриксов).
Для получения хирургического материала в виде порошка, базовую композицию заявляемого материала растирают в агатовой ступке в среде жидкого азота и обрабатывают в вибромельнице с корундовыми шарами в течение 5-10 минут. Для усиления взаимодействия частиц компонентов порошок подвергают температурной обработке при 130°С в течение 45-50 минут и стерилизуют в системе Sterrad NX фирмы «Johnson& Johnson» (США) в течение 45 мин. Стерильность сохраняется в течение 1 года. Порошок используют для заполнения костных полостей.
Для получения заявляемого материала в виде гранул, в базовую композицию добавляют растворитель дихлорметан или хлороформ, смесь перемешивают с использованием верхнеприводной трехлопастной мешалкой «Heipolph RZR1» (Германия) в течение 5 мин при скорости перемешивания 300 об/мин. Стеклянную емкость с полученной смесью помещают на магнитную мешалку ММ-3 для обеспечения постоянного перемешивания смеси. С помощью насоса-дозатора через систему силиконовых шлангов и иглы размером 10-20 G смесь подают в осадительную ванну с изопропанолом (высота слоя осадителя 200 мм). Капли смеси при прохождении через слой осадителя формируются в гранулы. Полученные гранулы собирают фильтрованием и высушивают при комнатной температуре в боксе-ламинаре. В зависимости от размера иглы и скорости подачи композиции в осадитель получают гранулы диаметром от 1,4 до 2,8 мм (фиг.1). Сухие гранулы затаривают и стерилизуют. Полученный таким способом хирургический материал используют для заполнения костных полостей, в том числе после удаления опухолей.
Для получения хирургического материала в виде объемной плотной керамики базовую композицию хирургического материала после тщательного перемешивания прессуют при комнатной температуре на автоматическом прессе AutoPellet 3887/4387 "Carver" (США) при давлении 120 кгс/м2 и далее проводят формование при комнатной температуре под давлением (120 кгс/см2). Применение механических методов обработки заявляемого материала позволяет получать хирургический материал в виде объемной плотной керамики, что дает возможность формировать в ней отверстия, резьбу, бороздки и т.п. (фиг.2а).
Хирургический материал в виде пленок и пластин получают экструзией из расплава базовой композиции при температуре плавления сополимера. Предварительно полимер гранулируют с использованием гранулятора фирмы BRABENDER (Германия), гранулят имеет размер 2,5-3,0×3,0 мм. Полученный гранулят смешивают с кальций фосфатными веществами и на лабораторном автономном мини-экструдере Е 19/25 D фирмы Brabender® (Германия), оборудованном винтом 19/25 D, 1-й зоной нагрева и 2-мя зонами нагрева/охлаждения при подаче воздуха 200 л/мин при давлении 0.5 бар, с резьбовым кольцом 2 3/4, 8 N, диаметром вала 19 мм, длиной вала 25 дюймов, щелевидной экструзионной головкой размером щели 0.1 до 10.0 мм, выполняют плавление гранулята и последующее экструдирование с получением гибких пленок и пластин (фиг.3). Пластины пригодны для получения из них различных форм, в том числе крепежных элементов, применяемых в травматологии (скобок, шпилек, штифтов, пластинок, заклепок и т.п.). Пленки используют в рамках метода направленной тканевой регенерации и в случае артрозированных суставов.
Состав хирургического материала по варианту 1 и его свойства приведены в таблице 1.
ВАРИАНТ 2.
Для придания хирургическому материалу для реконструкции дефектов костной ткани антимикробной активности к базовой композиции, содержащей мелкодисперсный порошок сополимера 3-ПГБ/3-ПГВ и мелкодисперсный порошок кальций фосфатных веществ (КФВ), при следующем соотношении компонентов в мас.%: сополимер от 65 до 89, кальций фосфатные вещества, суммарно от 10 до 30, в стерильных условиях добавляют антибиотик выбранный из группы, состоящей из тиенама, гентамицина, сульперазона и рубомицина, в количестве от 1 до 5 мас.%. При этом кальций фосфатные вещества содержат гидроксиапатит (ГА) и трикальций фосфат (ТКФ), доля ГА в материале составляет от 10 до 25%, ТКФ - от 0 до 15%.
Заявляемый хирургический материал по варианту 2 получают также разными способами (описанными выше в варианте 1) и представлен он в различном виде (порошка, объемных матриксов, гибких пленок и пластин).
Физико-механические характеристики заявляемого хирургического материала регистрируют на универсальной электромеханической испытательной машине Инстрон 5565,5 KN (Великобритания). Зарегистрированные показатели прочности для материала различного вида составляют 40-70 МПа, и краевой угол смачивания водой (КУС) от 28 до 60°.
Состав хирургического материала по варианту 2 и его свойства приведены в таблице 2.
Из заявляемого хирургического материала получают плотные и пористые объемные матриксы, конструкции и эндопротезы различной геометрии и размеров (прямоугольные, округлые, квадратные, в виде шпилек, лопаточек, шурупов и винтов) с использованием пресс-форм различных типов и с применением технологии механической обработки изделий (фиг.1). Хирургический материал предназначен для заполнения дефектов костной ткани и ускорения процессов репаративного остеогенеза после различных травм, больших костных секвестров, в том числе после удаления опухолей.
Для определения антимикробной активности хирургического материала, содержащего антибиотик, в качестве тест-организмов используют культуру стафилококка (Staphylococcus citreus), которую засевают в чашки Петри на плотную агаризованную среду. На поверхности среды после засева микроорганизмов размещают диски (d=1 см) из заявляемого хирургического материала, содержащего антибиотические вещества. Антимикробная активность материала оценивается по величине зоны отсутствия роста тест-организмов на плотной среде (таблица 2).
Медико-биологические исследования:
Для оценки остеогенного потенциала разработанного хирургического материала проведен эксперимент на половозрелых крысах-самках линии «Вистар» с исходной массой 250-270 г. Животных содержали в виварии на стандартном рационе, руководствуясь инструкцией «Использование животных в космической биологии и медицине» и «Правилами проведения работ с экспериментальными животными». Использовано 90 животных, которые были разделены на 3 группы (по 30 животных в каждой группе): в первой группе использован материал, содержащий (на 100 г): 65 г сополимера 3-ПГБ/3-ПГВ, 20 г ГА и 15 г ТКФ; во второй экспериментальной группе использован материал, содержащий (на 100 г): 75 г сополимера 3-ПГБ/3-ПГВ, 24.99 г ГА, и перед имплантацией в материал введен раствор рекомбинантного костного морфогенетического белка МГБ-2 в количестве 0.01 г (фирмы «ProSpec-Tany TechnoGene Ltd», Израиль). Третья группа - контроль (регенерация дефекта без материала, под кровяным сгустком).
Область для формирования дефекта выбрана с учетом известных данных о том, что наиболее оптимальной моделью у крыс, позволяющей корректно оценить эффективность влияния на репаративный остеогенез имплантатов из различных материалов, является дефект метаэпифизарной зоны большеберцовой кости диаметром от 1,5 до 3,0 мм и глубиной от 1,0 до 3,5 мм [Uemura Т., Dong Y., Wang Y., Kojima H. Et al. Transplantation of cultured bone calls using combinations of scaffolds and culture techniques. Biomaterials. 2003; 24: 2277-2286]. Для формирования дефекта костной ткани у животных под ингаляционным наркозом в области эпифиза большеберцовой кости в верхней трети правой голени с помощью остеотома диаметром 2,5 мм при постоянном охлаждении физиологическим раствором создавали дефекты диаметром 3,0 мм и глубиной 2-2,5 мм. После этого проводили послойное ушивание послеоперационной раны. В ходе эксперимента анализировали общее состояние животных, опороспособность оперированной конечности, состояние тканей в месте операции. На сроках 14, 30 и 90 сутки после операции животных выводили из опыта летальной дозой наркоза. Выделяли бедренную кость, визуально оценивали область костного дефекта. Морфологические исследования выполнены общепринятыми методами, участок костной ткани с исследуемыми имплантатами фиксировали в 10%-ом растворе нейтрального формалина. После декальцинации препаратов раствором «Трилона-Б» готовили гистологические срезы (толщиной 5-10 мкм), которые окрашивали гематоксилин-эозином. Морфологические исследования проводили с применением поляризационного микроскопа в проходящем свете Axioskop 40 Pol. (Karl Zeiss) с цифровой фотокамерой AxioCam MRc-5. С использованием Image Analysis System «Carl Zeis» (Германия) проводили анализ изображений и морфометрические исследования срезов для морфометрических исследований структуры костной ткани в месте дефекта, оценки состояния и динамики резорбции материала имплантатов. Состояние новообразованной костной ткани в местах экспериментальных дефектов оценивали по результатам замеров плотности костной ткани с использованием компьютерной рентгенографии (установка «Kodak Trophy IRIX-70»), обработку результатов проводили с помощью сервисной программы «Trophy 4», удельную плотность костной ткани выражали в относительных единицах Trophy - tr). Рассчитывали удельную плотность костной ткани и темп изменения плотности в двух зонах дефекта: зона №1 - область центра имплантированного материала, зона №2 - краевая зона (в пределах 0,5-1 мм от границы «имплантат-кость» со стороны имплантата). Определение остаточного содержания материала имплантатов в месте дефекта проводили модифицированным морфометрическим методом В.П.Яценко [Яценко В.П., Кабак К.С., Терещенко Т.Л., Коломийцев А.К. // В кн. Морфологические и биохимические аспекты биодеструкции полимеров. Киев: Наукова думка. - 1986. - С.73-89].
Все животные во всех группах через 7-8 дней могли нагружать оперированную конечность в полном объеме. На всех сроках наблюдения имплантированный хирургический материал находился в месте костного дефекта. Заживление костных дефектов у животных протекало по общим закономерностям, включая фазы посттравматических изменений тканевых элементов, регенерации и адаптивной ремодуляции. В зависимости от состава материала выявлены некоторые отличия в течение репаративного остеогенеза.
При использовании для заполнения костного дефекта хирургического материала, содержащего (на 100 г): 65 г сополимера 3-ПГБ/3-ПГВ, 20 г ГА и 15 г ТКФ, через 14 дней эксперимента отмечены выраженные признаки окостенения с образованием костных пластинок, покрытых пролиферирующими остеогенными клетками и остеобластами, характеризующие интенсивный остеогенез (фиг.4а). Спустя 30 суток в месте имплантации материала отмечено активное образование костных пластинок с перестройкой в кортикальную кость (фиг.4б). В целом, гистологическая картина свидетельствовала о завершающемся остеогенезе и характеризовалась образованием компактной кости с четкими гаверсовыми системами, а также выраженной пролиферацией остеогенных клеток и остеобластов. К концу эксперимента (через 3 месяца) отмечена практически полностью сформированная компактная кость с гаверсовыми системами в месте дефекта, а также остаточные количества материалов имплантата, что свидетельствует о длительности процесса биоразрушения разработанного материала на основе сополимера 3-ПГБ/3-ПГВ.
Регенерация кости в присутствии в материале имплантата морфогенетического белка кости происходила активнее. Так, уже на 14 сутки в месте имплантации материала, содержащего (на 100 г): 75 г сополимера 3-ПГБ/3-ПГВ и 24.990 г ГА, в который перед имплантацией было введено 0.01 г костного морфогенетического белка (ПГА/МГБ-2), зафиксирована перихондральная оссификация, наряду с признаками энхондрального окостенения, характеризующегося образованием остеоида в области дезорганизации хрящевой ткани (фиг.5а), а также интрамембранозной оссификацией, которая нарастала в ходе эксперимента. Через 1 месяц в зоне дефекта в месте введения материала отмечено активное формирование компактной кости, что подтверждалось наличием остеонов с четкими линиями цементации (фиг.5б). В отдельных участках исследуемых препаратов наблюдали разрастание остеогенной ткани вокруг материала с пролиферацией остеобластов и образованием остеоида. Гистологическая картина в месте имплантации через 3 месяца свидетельствовала о завершенности остеогенеза, реконструкции и перестройки костной ткани с образованием зрелой компактной кости (фиг.5в). В препарате также присутствовали включения неразрушенного имплантата.
Для сравнительной оценки эффективности остеогенеза в местах дефекта костной ткани с использованием разработанного хирургического материала проведена компьютерная рентгенография препаратов (таблица 3), из данных которой видно, что регенерация костного дефекта с образованием более плотной костной ткани через 3 месяца была выше, после применения заявляемого хирургического материала, по сравнению с процессом репаративного остеогенеза, протекающего под сгустком крови без материала (контроль). Эти отличия оказались сходными как для зоны, расположенной в центре дефекта, так и для зоны на границе «имплантат-кость». Темп прироста плотности новообразованной костной ткани при имплантации в зону экспериментальных дефектов материала на основе сополимера 3-ПГБ/3-ПГВ и кальций фосфатных веществ был достоверно выше в обеих зонах наблюдения по сравнению с реконструкцией дефекта без материала (под кровяным сгустком), даже без применения стимулятора остеогенеза в виде костного морфогенетического белка. Перечисленное выше подтверждает, что заявляемый хирургический материал обладает выраженными остеопластическими свойствами и обеспечивает оптимальное течение репаративного остеогенеза.
Заявляемый хирургический материал предназначен для реконструкции поврежденных твердых тканей, для направленной регенерации тканей, в качестве:
- остеозамещающих имплантатов и устройств,
- в качестве ортопедических приспособлений,
- костных цементов,
- а также матрикса для депонирования и доставки лекарственных средств.

| название | год | авторы | номер документа |
|---|---|---|---|
| ХИРУРГИЧЕСКОЕ ВОЛОКНО, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ИЗДЕЛИЯ ИЗ НЕГО | 2010 |
|
RU2436595C1 |
| БИОЛОГИЧЕСКИ АКТИВНАЯ ПОЛИМЕРНАЯ МЕДИЦИНСКАЯ КОМПОЗИЦИЯ (ВАРИАНТЫ) | 2010 |
|
RU2447902C2 |
| ШТАММ БАКТЕРИЙ Cupriavidus eutrophus ВКПМ В-10646 - ПРОДУЦЕНТ ПОЛИГИДРОКСИАЛКАНОАТОВ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2010 |
|
RU2439143C1 |
| ПОКРЫТИЕ СТЕНТА | 2008 |
|
RU2380059C1 |
| ГЕРБИЦИДНОЕ СРЕДСТВО ДЛИТЕЛЬНОГО ДЕЙСТВИЯ ДЛЯ ГРУНТОВОГО ПРИМЕНЕНИЯ | 2012 |
|
RU2494621C1 |
| СПОСОБ ПОЛУЧЕНИЯ СОПОЛИМЕРА 3-ГИДРОКСИБУТИРАТА, 3-ГИДРОКСИВАЛЕРАТА И 4-ГИДРОКСИБУТИРАТА | 2014 |
|
RU2565815C1 |
| КОСТНОЗАМЕЩАЮЩИЙ МАТЕРИАЛ | 2012 |
|
RU2518753C1 |
| СПОСОБ ПОЛУЧЕНИЯ СОПОЛИМЕРА 3-ГИДРОКСИБУТИРАТА И 3-ГИДРОКСИГЕКСАНОАТА | 2014 |
|
RU2565819C1 |
| СПОСОБ ПОЛУЧЕНИЯ СОПОЛИМЕРОВ МИКРОБНОГО ПРОИСХОЖДЕНИЯ, ОБРАЗОВАННЫХ МОНОМЕРАМИ 3-ГИДРОКСИМАСЛЯНОЙ И 4-ГИДРОКСИМАСЛЯНОЙ КИСЛОТ | 2015 |
|
RU2582255C1 |
| Способ получения гибридной двухфазной системы доставки малорастворимых и нерастворимых в воде биологически активных веществ с контролируемой кинетикой выделения | 2015 |
|
RU2607598C1 |


Изобретение относится к медицине, конкретно к хирургическому материалу и средствам для замещения дефектов костной ткани. Хирургический материал содержит биоразрушаемый и биосовместимый сополимер 3-гидроксибутирата и 3-гидроксивалериата (3-ПГБ/3-ПГВ) и кальций фосфатные вещества, при следующем соотношении компонентов, мас.%: сополимер 65-90 и кальций фосфатные вещества 10-35. По второму варианту хирургический материал содержит биоразрушаемый и биосовместимый сополимер, кальций фосфатные вещества и антибиотик, выбранный из группы, состоящей из тиенама, гентамицина, сульперазона и рубомицина, при следующем соотношении компонентов, мас.%: сополимер 65-89; кальций фосфатные вещества 10-35; антибиотик 1-5. Техническим результатом изобретения является получение биоразрушаемого и высокопрочного хирургического материала для реконструкции дефектов костной ткани различной этиологии, обладающего высокими остеиндукционными и антимикробными свойствами. 2 н. и 19 з.п. ф-лы, 5 ил., 3 табл.
1. Хирургический материал для реконструкции дефектов костной ткани, включающий биоразрушаемый и биосовместимый полимер и кальций фосфатные вещества, отличающийся тем, что в качестве биоразрушаемого и биосовместимого полимера содержит сополимер 3-гидроксибутирата и 3-гидроксивалериата, при следующем соотношении компонентов, мас.%:
2. Хирургический материал по п.1, отличающийся тем, что кальций фосфатные вещества содержат трикальций фосфат и/или гидроксиаппатит.
3. Хирургический материал по п.1, отличающийся тем, что сополимер растворен, по меньшей мере, в одном растворителе.
4. Хирургический материал по п.3, отличающийся тем, что растворитель представляет собой дихлорметан или хлороформ.
5. Хирургический материал по п.1, отличающийся тем, что дополнительно содержит порообразующие вещества.
6. Хирургический материал по п.5, отличающийся тем, что в качестве порообразующих веществ используют хлорид натрия или кристаллическую сахарозу с размером кристаллов от 400 до 600 мкм.
7. Хирургический материал по п.1, отличающийся тем, что дополнительно содержит ультратонкое волокно из 3-ПГБ/3-ПГВ.
8. Хирургический материал по п.1, отличающийся тем, что дополнительно содержит костные морфогенетические белки.
9. Хирургический материал по п.1, отличающийся тем, что выполнен в виде порошка или гранул.
10. Хирургический материал по п.1, отличающийся тем, что выполнен в виде объемной плотной или объемной пористой керамики.
11. Хирургический материал по п.1, отличающийся тем, что выполнен в виде пленки или пластины.
12. Хирургический материал для реконструкции дефектов костной ткани, включающий биоразрушаемый и биосовместимый полимер, кальций фосфатные вещества и антибиотик, отличающийся тем, что в качестве биоразрушаемого и биосовместимого полимера содержит сополимер 3-гидроксибутирата и 3-гидроксивалериата, а антибиотик выбран из группы, состоящей из тиенама, гентамицина, сульперазона и рубомицина при следующем соотношении компонентов, мас.%:
13. Хирургический материал по п.12, отличающийся тем, что кальций фосфатные вещества содержат трикальций фосфат и/или гидроксиапатит.
14. Хирургический материал по п.12, отличающийся тем, что сополимер растворен, по меньшей мере, в одном растворителе.
15. Хирургический материал по п.14, отличающийся тем, что растворитель представляет собой дихлорметан или хлороформ.
16. Хирургический материал по п.12, отличающийся тем, что дополнительно содержит порообразующие вещества.
17. Хирургический материал по п.16, отличающийся тем, что в качестве порообразующих веществ используют хлорид натрия или кристаллическую сахарозу с размером кристаллов от 400 до 600 мкм.
18. Хирургический материал по п.12, отличающийся тем, что дополнительно содержит ультратонкое волокно из 3-ПГБ/3-ПГВ.
19. Хирургический материал по п.12, отличающийся тем, что выполнен в виде порошка.
20. Хирургический материал по п.12, отличающийся тем, что выполнен в виде объемной плотной керамики или объемной пористой керамики.
21. Хирургический материал по п.12, отличающийся тем, что выполнен в виде пленки или пластины.
| ГЕЛЬ ДЛЯ РЕГЕНЕРАЦИИ КОСТНОЙ ТКАНИ | 2008 |
|
RU2360663C1 |
| КОМПОЗИЦИЯ ДЛЯ ПОКРЫТИЯ ИМПЛАНТИРУЕМОГО МЕДИЦИНСКОГО УСТРОЙСТВА И СПОСОБ НАНЕСЕНИЯ ПОКРЫТИЯ НА ТАКОЕ УСТРОЙСТВО | 2003 |
|
RU2308295C2 |
| GÜRSEL I, ET AL | |||
| In vivo application of biodegradable controlled antibiotic release systems for the treatment of implant-related osteomyelitis, Biomaterials | |||
| Перекатываемый затвор для водоемов | 1922 |
|
SU2001A1 |
Авторы
Даты
2011-11-20—Публикация
2010-07-21—Подача