Изобретение относится к области медицины, конкретно к материалу для закрытия костных дефектов при реконструктивно-пластических операциях, изготовления костных имплантатов, замещения дефектов при различных костных патологиях.
В настоящее время на мировом рынке имплантационных материалов для закрытия костных дефектов используются следующие материалы:
1) синтетические пластмассы (протакрил, палакос) [1],
2) аутоматериалы (аутокость) [2, 3],
3) керамические имплантанты (корундовая керамика),
4) металлы (титан и сплавы) [4, 5].
Одним из факторов, существенно влияющих на выбор материала, является биосовместимость. Ряд авторов считают, что для коррекции костных дефектов наиболее целесообразно применение аутопластических материалов, в частности - аутокости. Существует мнение, что при отсутствии собственной кости, предпочтительным материалом является аллокость, которая якобы стимулирует процессы костеобразования со стороны тканей реципиента и служит источником новообразования костного регенерата.
В плане биосовместимости материалов имеются указания на то, что полиметилметакрилат и другие полимеры метакриловой кислоты не обладают достаточной биосовместимостью и токсичны для окружающих тканей, приводят к недопустимо большому количеству осложнений. Процесс полимеризации протакрила составляет более 1,5 часов, в течение которых наблюдается достаточно сильный разогрев и выброс токсичных газов.
Корундовая керамика в 5% случаев дает трофические нарушения мягких тканей и требует удаления.
Аутопластические материалы тоже не безобидны, так как могут вызывать осложнения воспалительного характера или подвергаться рассасыванию.
Сообщения, касающиеся применения титана и его сплавов, указывают на его достаточную биосовместимость и минимальное количество осложнений.
Однако биосовместимость - не единственная проблема, с которой сталкивается хирург при закрытии костного дефекта. Существует проблема восстановления естественного рельефа последнего, особенно если дефект занимает сложные по конфигурации анатомические зоны. Смоделировать из титановой сетки сложную конфигурацию дефекта довольно проблематично.
Таким образом, проблема создания материалов для закрытия костных дефектов, не имеющего перечисленных недостатков, является крайне актуальной.
Известен материал для закрытия костных дефектов при реконструктивно-пластических операциях, изготовления костных имплантатов, замещения дефектов при различных костных патологиях, защищенный патентом РФ №2333010, кл. A61L 27/5, A61L 27/12, опубл. 10.09.2008 г. Материал изготовлен на основе фосфатов кальция, представляет собой частицы карбонатзамещенного гидроксиапатита общей формулы Ca10(PO4)х(ОН)y(CO3)z, где 5<х<6, 0<y<2, 0<z<1, содержит от 0,6 до 6,0 мас.% групп CO3 2- с регулируемым атомным соотношением кальций/фосфор от 1,5 до 2,1. Материал выполнен в форме пористых сферических гранул диаметром от 100 до 1000 мкм, имеющих шероховатый микрорельеф внешней поверхности, с размерами пор от 0,5 до 15,0 мкм при общей открытой пористости от 50 до 80% и удельной поверхностью от 0,3 до 0,6 м2/г
Однако невысокие физико-механические характеристики ограничивают применение материалов такого типа для заполнения крупных костных дефектов, и невозможно производить склеивание переломов костей.
Известен композиционный материал, защищенный патентом РФ №2429885, кл. A61L 27/02, A61L 27/12, B82B 1/00, опубл. 27.09.2011 г. на основе гидроксиапатита и карбоната кальция, содержащий от 20 до 80 мас.% карбоната кальция, спекающийся до плотного состояния (открытая пористость менее 2-4%) при температурах до 720°С. Композиционный материал отличается высокой биорезорбируемостью, за счет содержания резорбируемых фаз карбонатгидроксиапатита и карбоната кальция. Использование добавки на основе карбоната калия и карбоната натрия в количестве до 10% сверх 100% по отношению к основным компонентам (гидроксиапатиту и карбонатгидроксиапатиту и карбонату кальция) препятствует термическому разложению керамического материала при обжиге и позволяет получить мелкокристаллическую структуру с размером кристаллов менее 500 нм и высокую прочность при сжатии от 100 до 330 МПа.
Однако, поскольку материал уже твердый, то невозможно моделировать сложные дефекты и производить склеивание.
Наиболее близким к предлагаемому по технической сущности и достигаемому результату, выбранным в качестве прототипа, является хирургический материал, защищенный патентом РФ №2433836, кл. A61L 27/12, A61L 27/14, A61F 2/02, опубл. 20.11.2011 г. Материал содержит биоразрушаемый и биосовместимый сополимер 3-гидроксибутирата и 3-гидроксивалериата (3-ПГБ/3-ПГВ) и кальций-фосфатные вещества, при следующем соотношении компонентов, мас.%: сополимер 65-90 и кальций-фосфатные вещества 10-35. По второму варианту хирургический материал содержит биоразрушаемый и биосовместимый сополимер, кальций-фосфатные вещества и антибиотик, выбранный из группы, состоящей из тиенама, гентамицина, сульперазона и рубомицина, при следующем соотношении компонентов, мас.%: сополимер 65-89; кальций-фосфатные вещества 10-35; антибиотик 1-5.
Недостаток у известного материала тот же, что и у вышеописанных. Поскольку он выпускается в виде порошка, твердых гранул или объемной пористой керамики, то невозможно моделирование сложных поверхностей, склеивание костей друг с другом и с титановыми конструкциями.
Задачей, решаемой изобретением, является создание костнозамещающего материала, обладающего биосовместимостью, остеокондуктивностью и возможностью моделирования.
Технический результат от использования изобретения заключается в возможности моделирования сложных поверхностей за счет пластичности материала и склеивания костных фрагментов за счет высоких адгезионных свойств материала к металлу и костной ткани.
Указанный результат достигается тем, что костнозамещающий материал, содержащий биоразрушаемый и биосовместимый полимер, в качестве остеокондуктивного и биосовместимого полимера содержит полимер полиуретанового ряда, полученный из полиоксипропиленгликоля со средней молекулярной массой 1000, 4,4'-диизоцианатодифенилметана и глицерина.
Основной способ синтеза полиуретанов, используемый в промышленности - взаимодействие соединений, содержащих изоцианатные группы, с би- и полифункциональными гидроксилсодержащими производными [6, 7]
nOCN-R-NCO+nHO-R'-OH→[-R-NHC(O)OR'-]n
R - алкилен, арилен; R' - алкилен, остаток гликолей, полиэфиров.
Предлагаемое изобретение иллюстрируется 4 фиг.
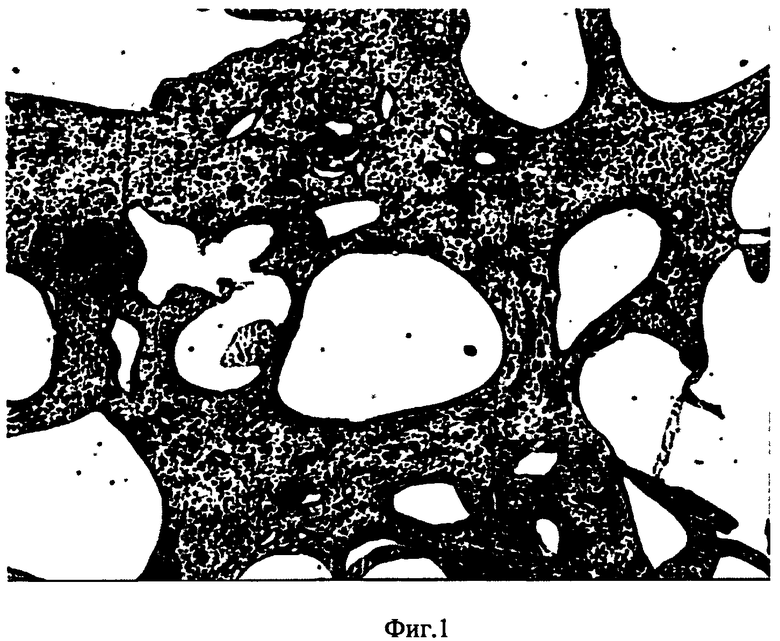
На фиг.1 изображена структура костнозамещающего материала (увеличение ×100), размер пор (50-400 мкм);
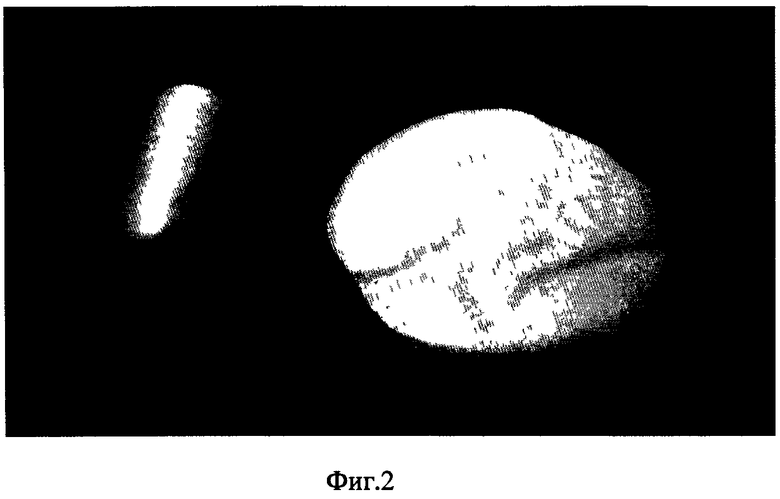
на фиг.2 изображен костнозамещающий материал до моделирования;
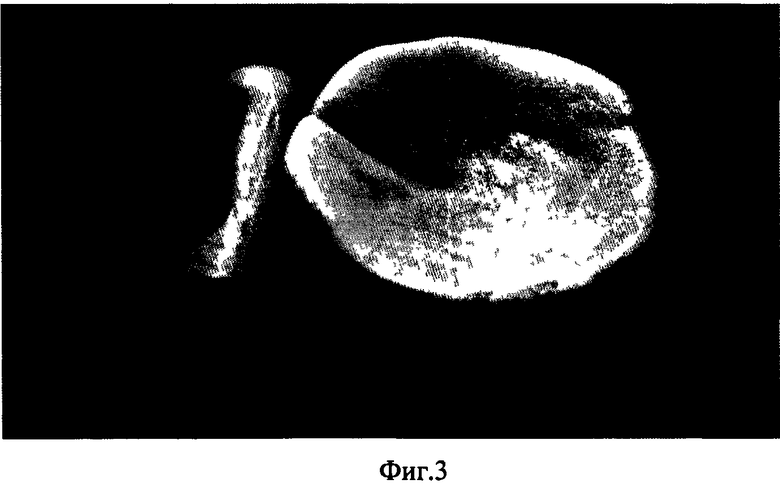
на фиг.3 изображен костнозамещающий материал после моделирования;
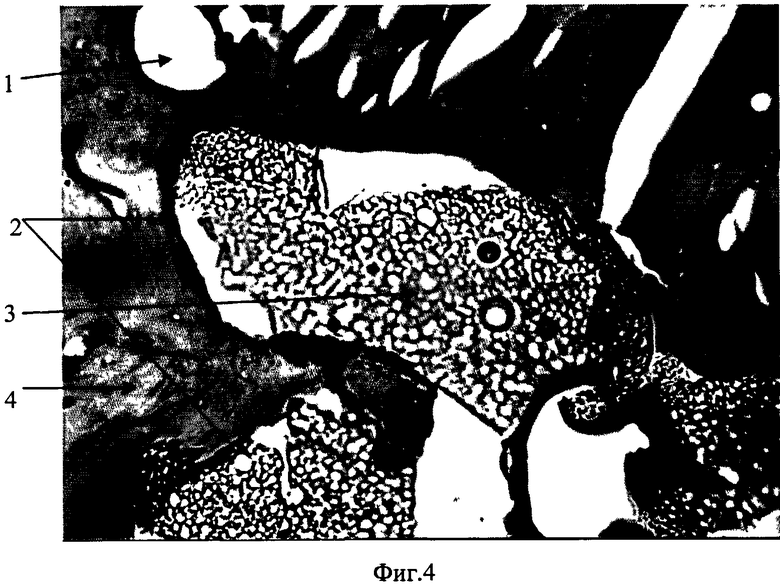
на фиг.4 изображена микрофотография гистологического препарата (бедренная кость кролика).
1 - кровеносный сосуд, 2 - граница раздела костная ткань - костнозамещающий материал (отсутствие фиброзной капсулы), 3 - костнозамещающий материал, 4 - костная ткань.
Способ получения костнозамещающего материала осуществляют следующим образом.
Получение костнозамещающего материала осуществляли в две стадии. На первой стадии синтезировали форполимер из полиоксипропиленгликоля со средней молекулярной массой 1000 и 4,4'-диизоцианатодифенилметана в присутствии катализаторов (третичные амины, оловоорганические соединения), при нагревании в токе сухого аргона или азота, контролируя содержание свободных NCO-групп по ТУ 6-03-22-60-78. Оптимальное содержание NCO-групп в форполимере составляет 11-13% по массе. Избыточное количество NCO-групп в форполимере (более 13%) приводит к снижению его стабильности при хранении. При содержании NCO-групп менее 10-11%, костнозамещающий материал становится не достаточно жестким.
На второй стадии отверждали полученный форполимер глицерином с растворенным в нем катализатором, таким как третичные амины, оловоорганические соединения.
Пример 1. На первой стадии в круглодонную колбу с мешалкой помещали 200 г.4,4'-диизоцианатодифенилметана, 172 г. полиоксипропиленгликоля, 0,005 г катализатора (дибутилоловодилауринат) и нагревали при 50-55°С в течение 4-6 часов в слабом токе аргона. Затем реакционную смесь охлаждали до комнатной температуры и проводили анализ на содержание свободных NCO-групп по ТУ 6-03-22-60-78.
На второй стадии получения костнозамещающего материала к 10 вес.ч. полученного форполимера добавляли 1,2 вес.ч. глицерина с растворенным в нем катализатором. При этом начинается процесс затвердевания смеси, сопровождающийся слабым разогревом. Варьируя количество катализатора отверждения (дибутилоловодилауринат) от 0 до 0,05% вес., можно изменять время полимеризации от 15 минут до одного часа. Изменяя количество воды в глицерине (0,1 - 0,5% вес.), можно регулировать пористость полученного материала.
Полученный костнозамещающий материал имеет размер пор 50-400 мкм (фиг.1). Прочность на сжатие составляет 50-60 МПа, адгезия к металлу и кости 60-65 кг/см2. Физико-механические испытания проводились на оборудовании Zwick/Roell Z100 производства Германии.
До момента полного затвердевания материал обладает пластичностью и позволяет выполнять моделирование и склеивание. Данный костнозамещающий материал может быть сформован в виде пластин, цилиндров и др., которые при температуре 60-70°С также можно моделировать (фиг.2).
Изобретение иллюстрируется следующими примерами доклинических испытаний.
Пример 2. В ФГБУ «ННИИТО» МЗ РФ проводились доклинические испытания по ИСО ГОСТ 10993 костнозамещающего материала. Проведено 2 эксперимента по изучению воздействия образцов материала на процессы адгезии, процессы пролиферации и синтез фибронектина дермальными фибробластами человека в системе in vitro. Для этого в стерильном боксе в чашке Петри готовили костнозамещающий материал способом, описанным в примере 1: к 10 г форполимера добавляли 1,2 г глицерина с растворенным в нем катализатором. Затем, до момента полного затвердевания костнозамещающего материала, в специальные ячейки (площадью 1 см2) помещали маленькие пробы материала (площадью 0,1 см2) и вносили на них культуру фибробластов человека с разным промежутком времени.
По результатам обоих экспериментов показано, что испытуемые образцы костнозамещающего материала не нарушают процессы адгезии, не влияют на процессы пролиферации и не меняют синтез фибронектина клетками соединительной ткани в культуре. Таким образом, у образцов отсутствует цитоксичность в системе in vitro.
В таблице 1 представлено изменение плотности клеток на единицу площади культурального сосуда в процессе роста культуры в присутствие костнозамещающего материала. Исходная посевная концентрация 20·103 клеток/мл. Эксперименты проведены на трех штаммах дермальных фибробластов человека с двумя сериями костнозамещающего материала.
В таблице 2 представлено изменение процента погибших клеток в процессе роста культуры в присутствие костнозамещающего материала. Исходная посевная концентрация 20·103 клеток/мл. Жизнеспособность клеток определялась с помощью окраски витальным красителем трипановым синим.
В таблице 3 представлено изменение содержания фибронектина (нг/мл) в культуральной среде в процессе роста культуры в присутствие костнозамещающего материала. Исходная посевная концентрация 20·103 клеток/мл.
Результаты экспериментов на культуре фибробластов человека свидетельствуют, что материал является биосовместимым.
Проведены испытания на 12-ти животных (кролики, чистая линия). Выполнена имплантация исследуемого материала в бедренную кость, по три имплантата каждому, размерами 3×5 мм. Состояние животных нормализовалось через 12-24 часа. Температура нормальная, животные активны. Местных воспалительных реакций нет.
Через 12 недель после имплантации выведено из эксперимента 7 животных.
На представленных микрофотографиях гистологических препаратов (фиг.3) очевидно:
1) имплантированный материал не подвергся инкапсуляции и отторжению - нет образования фиброзной капсулы,
2) по границе контакта кость-материал появились новые остеобласты.
Таким образом, у представленных образцов костнозамещающего материала отсутствуют патологические реакции при оссальной (внутрикостной) имплантации, что подтверждает его биосовместимость и доказывает остеокондуктивность материала.
Предлагаемым костнозамещающим материалом возможно моделировать сложные поверхности за счет пластичности материала и склеивать костные фрагменты за счет высоких адгезионных свойств материала к металлу и костной ткани.
Список литературы
1. Педаченко Е.Г., Кущаев С.В. Современные костные цементы для пункциональной вертебропластики. Украинский нейрохирургический журнал, N4, 2001.
2. Гинзбург Е.Р., Старых Е.С. Применение консервированных брефотрансплантатов в хирургии дефектов костей свода черепа. Материалы V съезда нейрохирургов России, Уфа, 2009. С.383.
3. Бельченко В.А., Притыко А.Г. и др. Костные аутотрансплантаты со свода черепа в хирургии врожденных и приобретенных деформаций черепно-лицевой области. Материалы V съезда нейрохирургов России, Уфа, 2009. С.381.
4. Леонов С., Кузнецов Д., Евсеев М. Опыт использования перфорированной титановой сетки "ротормед" при пластике дефектов черепа. Материалы V съезда нейрохирургов России, Уфа, 2009. С.391.
5. Геворков А.В., Давыдов Е.А. Аутокраниопластика с применением демпферных фиксаторов из никелида титана с термомеханической памятью формы. Материалы V съезда нейрохирургов России, Уфа, 2009. С.382.
6. Липатов Ю.С., Керча Ю.Ю., Сергеев Л.М. Структура и свойства полиуретанов, К., 1970.
7. Дж.М.Бюист. Композиционные материалы на основе полиуретанов, М., 1982.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОСТНЫЙ ЦЕМЕНТ | 2023 |
|
RU2822874C1 |
| ХИРУРГИЧЕСКИЙ МАТЕРИАЛ (ВАРИАНТЫ) | 2010 |
|
RU2433836C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИМЕРНОГО МАТЕРИАЛА ДЛЯ ЗАМЕЩЕНИЯ ДЕФЕКТОВ КОСТИ | 2020 |
|
RU2758863C1 |
| БИОСОВМЕСТИМЫЙ КОСТНОЗАМЕЩАЮЩИЙ МАТЕРИАЛ И СПОСОБ ПОЛУЧЕНИЯ ЕГО | 2012 |
|
RU2494721C1 |
| ТРЕХМЕРНЫЙ ПОРИСТЫЙ КОМПОЗИТНЫЙ МАТЕРИАЛ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2019 |
|
RU2714671C1 |
| НАНОБИОКОМПОЗИЦИЯ ДЛЯ ЗАПОЛНЕНИЯ КОСТНЫХ ДЕФЕКТОВ И СТИМУЛЯЦИИ РЕГЕНЕРАЦИИ | 2023 |
|
RU2818675C1 |
| КОМБИНИРОВАННЫЙ КОСТНЫЙ АЛЛОТРАНСПЛАНТАТ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2013 |
|
RU2524618C1 |
| ОСТЕОГЕННЫЙ БИОРЕЗОРБИРУЕМЫЙ МАТЕРИАЛ ДЛЯ ЗАМЕЩЕНИЯ КОСТНЫХ ДЕФЕКТОВ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2012 |
|
RU2504405C1 |
| СПОСОБ ЗАМЕЩЕНИЯ КОСТНОЙ ТКАНИ | 2014 |
|
RU2553368C1 |
| Способ наращивания объема костной ткани гребня альвеолярного отростка челюсти | 2016 |
|
RU2645963C2 |
Изобретение относится к области медицины, конкретно к материалу для закрытия костных дефектов при реконструктивно-пластических операциях, изготовления костных имплантатов, замещения дефектов при различных костных патологиях. Костнозамещающий материал, содержащий биоразрушаемый и биосовместимый полимер, в качестве остеокондуктивного и биосовместимого полимера содержит полимер полиуретанового ряда, полученный из полиоксипропиленгликоля со средней молекулярной массой 1000, 4,4'-диизоцианатодифенилметана и глицерина. Технический результат от использования изобретения заключается в возможности моделирования сложных поверхностей за счет пластичности материала и склеивания костных фрагментов за счет высоких адгезионных свойств материала к металлу и костной ткани. 3 табл., 4 ил., 2 пр.
Костнозамещающий материал, содержащий биоразрушаемый и биосовместимый полимер, отличающийся тем, что в качестве остеокондуктивного и биосовместимого полимера он содержит полимер полиуретанового ряда с размером пор 50-400 мкм, прочностью на сжатие 50-60 МПа, адгезией к металлу и кости 60-65 кг/см2, полученный в две стадии, при этом на первой стадии получают форполимер из полиоксипропиленгликоля со средней молекулярной массой 1000 и 4,4'-диизоцианатодифенилметана в присутствии катализаторов, таких как третичные амины, оловоорганические соединения, при нагревании в токе сухого аргона или азота и содержании свободных изоцианатных NCO-групп в форполимере 11-13% по массе, на второй стадии отверждают полученный форполимер глицерином с растворенным в нем катализатором отверждения, таким как дибутилоловодилауринат, при этом количество воды в глицерине составляет 0,1-0,5% вес.
| 2003 |
|
RU2235539C1 | |
| ТЕКСТИЛЬНЫЙ МАТЕРИАЛ ДЛЯ ОСТАНОВКИ КРОВОТЕЧЕНИЙ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2007 |
|
RU2380117C2 |
| Устройство трансляции кодовых сигналов в автоблокировке переменного тока | 1977 |
|
SU659440A1 |
Авторы
Даты
2014-06-10—Публикация
2012-12-04—Подача