Изобретение относится к медицине, точнее к гематологии, и может быть использовано при лечении наследственной анемии, связанной с нарушением синтеза порфиринов.
Биосинтез порфиринов - сложный процесс, в случае биосинтеза гема состоящий из девяти последовательных ферментативных реакций. Первым специфическим полупродуктом на пути биосинтеза гема является 5-аминолевулиновая (5-амино-4-оксопентановая) кислота (АЛК), которая образуется из глицина и сукцинил-СоА под действием фермента АЛК-синтетазы. Для поддержания нормального уровня гемоглобина крови здоровый человек вырабатывает ежедневно в среднем около 0,2 г АЛК. Особенность регуляции биосинтеза гема состоит в том, что его недостаток ведет к активации АЛК-синтетазы, увеличение активности которой ведет к росту биосинтеза АЛК и, в конечном счете, к росту биосинтеза гема.
Генетический дефект АЛК-синтетазы обусловливает недостаток АЛК в организме, что ведет к неэффективному эритропоэзу, развитию анемии, приводит к запусканию механизмов повышенного всасывания и метаболизма железа, патологическому повышению содержания железа.
В организме человека существует две различных формы фермента АЛК-синтетазы - печеночная и эритроцитарная. Печеночная форма выражена преимущественно в печени и производит АЛК для синтеза гема, который затем используется в гемсодержащих белках печени - различных цитохромах. Эритроцитарная соответственно, выражена в клетках эритроидного ряда и вырабатывает АЛК для синтеза гемоглобина, что составляет более 80% АЛК, вырабатываемого организмом. Ферменты различаются по способам их регулирования в организме и имеют различные кодирующие их гены.
Эритроцитарная АЛК-синтетаза кодируется геном, расположенным на Х-хромосоме. Известно более 25 различных мутаций гена, кодирующего АЛК-синтетазу, что дает большое разнообразие в характере повреждения фермента и, следовательно, в клинической картине заболевания. Болезнь поражает преимущественно мужчин. Больные либо погибают в молодом возрасте от анемии либо, если анемия выражена несильно, страдают от болезней, связанных с избытком железа, таких как сахарный диабет, цирроз печени, гормональная и сердечная недостаточность.
В мировой практике для лечения таких наследственных анемий используют препараты витаминов группы В6, поскольку пиридоксаль-5'-фосфат является коферментом АЛК-синтетазы (Alcindor Т, Bridges KR.Sideroblastic anaemias. Br J Haematol. 2002, 116(4), 733-743). Однако не всегда лечение оказывается эффективным, поскольку оно зависит от характера повреждения функции фермента АЛК-синтетазы. Так, при некоторых мутациях гена АЛК-синтетазы анемия может быть устойчива к терапии витаминами группы В6. В этом случае возможна лишь поддерживающая терапия, направленная на выведение из организма патологически избыточного железа. Для этой цели используют инъекции десферала (железосвязывающего препарата) длительными курсами по 3-6 раз в год. Это очень тяжелый и дорогой метод лечения, к тому же направленный лишь на временное устранение последствий основной патологии.
Задачей изобретения является лечение наследственной анемии, связанной с нарушением синтеза порфиринов. Поставленная задача решается применением для лечения препарата АЛК или ее гексилового эфира путем их перорального введения в организм.
Применение интервенций АЛК или ее эфиров для решения поставленной задачи не является очевидным решением. Так, при недостатке одного из следующих за АЛК-синтетазой ферментов биосинтеза гема также образуется порочный патологический круг: недостаток гемина вызывает лавинообразное перепроизводство АЛК и в зависимости от вида недостающего фермента других продуктов порфиринового обмена, которые обладают высокой степенью токсичности. В результате возникают заболевания, носящие групповое название «порфирии». Порфирии являются преимущественно наследственными заболеваниями. В их основе лежит мутация тех или иных генов, ответственных за активность катализирующих синтез гема ферментов. Генетика порфирии хорошо изучена, для каждой формы заболевания установлен вызывающий ее тот или иной биохимический или ферментативный дефект. Чаще других встречается острая перемежающаяся порфирия (аутосомно-доминирующий тип наследования), вызванная дефицитом порфобилиноген дезаминазы - третьего фермента в цепи биосинтеза. Высокое содержание АЛК в крови и вследствие этого в моче является одним из главных диагностических критериев заболевания.
Более того, на фототоксичности метаболитов АЛК и эфиров АЛК основано их применение в медицине в качестве просенсибилизаторов для флуоресцентной диагностики и фотодинамической терапии ряда онкологических заболеваний [J Eur Acad Dermatol Venereol., 2007, 21(3), 293-302; патент РФ №2191010]. Это применение основано на том, что в большинстве опухолевых клеток возрастает активность порфобилиноген дезаминазы и снижается активность феррохелатазы, что в свою очередь приводит к повышенному содержанию флуоресцирующего протопорфирина IX (ПП-IX), особенно выраженному при дополнительном введении АЛК. Однократное пероральное введение большой дозы АЛК вызывает накопление ПП-IX в опухоли в течение нескольких часов, его высокий уровень удерживается до 1-2 часов, в то время как в нормальных клетках ПП-IX быстро утилизируется путем его превращения в гем. Результатом этого является высокий флуоресцентный контраст опухоли и окружающей ткани, достигающей 10-15-кратной величины для различных опухолей, что является важным фактором визуализации новообразований при проведении фотодиагностики и обусловливает локальный терапевтический эффект без повреждения окружающей опухоль ткани при облучении светом в ходе фотодинамической терапии.
Таким образом, высокое содержание АЛК в организме как следствие патологического нарушения биосинтеза гема или как результат введения АЛК извне может приводить к специфическому фототоксическому поражению организма. Однако нами показано, что АЛК и ее гексиловый эфир могут быть использованы для терапии гематологических заболеваний, а именно для лечения наследственной анемии, связанной с нарушением синтеза порфиринов.
Токсичность АЛК и гексилового эфиров АЛК при однократном пероральном применении исследована на мышах-гибридах F1, самцах и неинбредных крысах самцах. Показано, что однократное пероральное введение препаратов в дозах от 10 до 1500 мг/кг не приводило к гибели мышей в течение всего срока наблюдения (14 дней), в дозах 10 и 100 мг/кг клинических признаков интоксикации отмечено не было в течение всего срока наблюдения. При дозах 500 и 1500 мг/кг в течение 3-х дней после введения препаратов у животных наблюдали внешние признаки проявления токсичности.
На основании этих данных по изучению «острой» токсичности на мышах АЛК и гексиловые эфиры АЛК классифицированы как малотоксичные фармакологические вещества.
При морфологических исследованиях клеток крови и внутренних органов установлено, что при однократном пероральном применении в дозах 1250, 625 мг/кг и ниже препараты не оказывали токсического действия на периферическую кровь, печень, почки, органы ЖКТ и ЦНС (по анализу поведенческих реакций) у крыс.
При семикратном пероральном применении в суммарных дозах 1500 и 3000 мг/кг препараты не оказывали токсического действия на периферическую кровь, печень и почки. Отсутствовали также нейротоксичность (изменения в поведенческих реакциях) и гастроинтестинальная токсичность.
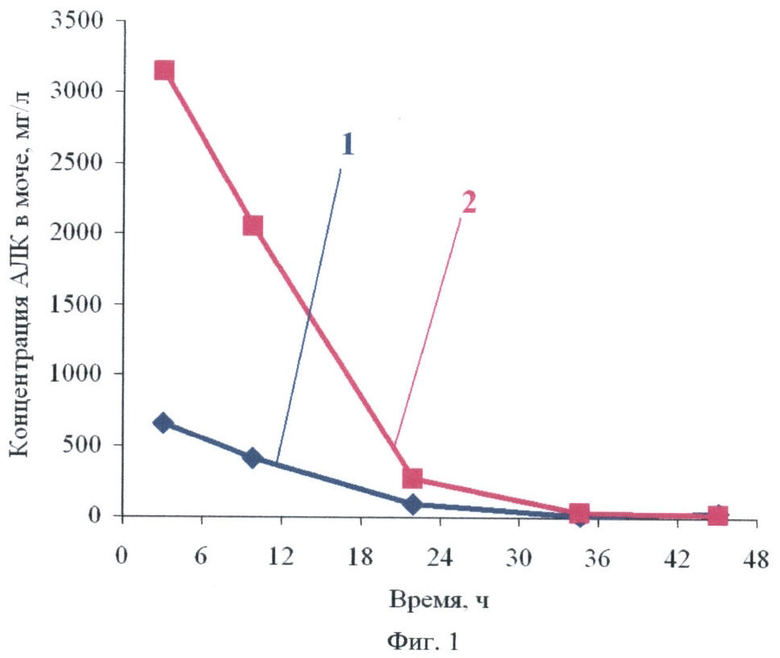
Для обеспечения регулярности введения препарат может вводиться с пищей, несколько раз в день, как в нижеприведенных примерах. При однократном разовом введении, как видно из Фиг.1, у крыс через 10 часов содержание АЛК в организме еще достаточно высоко. Через 24 часа оно значительно снижается. Учитывая более высокую скорость метаболизма у грызунов по отношению к человеку, для человека регулярное введение будет один раз в сутки или даже реже.
Зная среднее содержание крови в организме человека (7% от массы тела), среднее содержание гемоглобина в крови - 160 г/л, среднее время жизни эритроцита в крови - 120 дней, и молекулярные массы гемоглобина и АЛК, учитывая, что на синтез одной молекулы гема расходуется 4 молекулы АЛК и с учетом неэффективного эритропоэза в 10% можно рассчитать, что для восполнения гемоглобина крови в организме человека ежесуточно образуется 3,3 мг АЛК на кг массы тела.
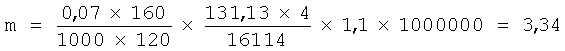
У мышей среднее время жизни эритроцита составляет 30 дней (А.А.Кудрявцев, Л.А.Кудрявцева. Клиническая гематология животных, М.: Колос (1974), сс.374-389), и соответственно величина ежесуточного образования АЛК составит 13,4 мг/кг, т.е. в четыре раза выше.
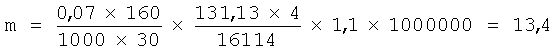
Ожидаемо, что эффективные суточные дозы для человека также будут меньше в четыре раза.
Дозы, вызывающие положительный эффект у мышей в наших примерах, в 5-50 раз превышают расчетные количества собственного биосинтеза. Использование суточных доз, меньших, чем расчетное количество нормально синтезированной АЛК, будет очевидно неэффективно. Использование доз, больших, чем доказано в примерах, неоправданно и потенциально опасно.
На человеке мы ожидаем эффективности АЛК в дозах от 3 до 150 мг/кг АЛК.
В наших примерах дозы, обеспечивающие покрытие недостаточного биосинтеза АЛК организмом, превышают расчетное количество АЛК, необходимое для поддержания его нормального уровня. Введение эндогенной АЛК для лечения заболевания может быть сопряжено с риском отравления продуктами порфиринового обмена по типу порфирии. Поэтому при проведении лечения целесообразно контролировать концентрацию АЛК в организме с целью подбора индивидуальной дозы.
Лечебная эффективность АЛК и гексилового эфира АЛК показана на модели замещения синтеза АЛК хлорамфениколом на фоне гиперплазии клеток эритроидного ряда, вызванной фенилгидразином. Данная биологическая модель отражает острое развитие анемии, вызванное недостатком фермента эритроцитарной АЛК-синтетазы.
Внутрибрюшинное введение фенилгидразина животным вызывает внутрисосудистый гемолиз эритроцитов. Длительное введение фенилгидразина в небольших дозах приводит к развитию хронической гемолитической анемии, что, в свою очередь, ведет к возникновению компенсаторной эритроидной гиперплазии (ретикулоцитоз в периферической крови до 30-40%) и обеспечивает ситуацию, при которой в костном мозге присутствуют преимущественно клетки эритроидного ряда (Firkin FC. Mitochondrial lesions in reversible erythropoietic depression due to chloramphenicol. J Clin Invest. 1972, 51(8), 2085-2092). Такой компенсаторный механизм на фоне хронической гемолитической анемии обеспечивает некоторый постоянный уровень гемоглобина крови и тем самым жизнь животных.
Введение на этом фоне хлорамфеникола вызывает резкое снижение активности фермента АЛК-синтетазы в ретикулоцитах (Rosenberg A, Marcus О. Effect of chloramphenicol on reticulocyte delta-aminolaevulinic acid synthetase in rabbits. Br J Haematol. 1974, 26(1), 79-83). Ретикулоцитоз не развивается. Вследствие супрессии эритропоэза не происходит компенсация гемолитической анемии, уровень гемоглобина равномерно падает, вплоть до гибели животного.
В то же время регулярное введение АЛК или эфиров АЛК животным, у которых была вызвана анемия, приводило к их выживаемости и росту уровня гемоглобина в крови.
Настоящее изобретение иллюстрируется следующими чертежами.
Фиг.1 - изменение концентрации АЛК в моче крыс, получивших внутрижелудочно однократную дозу АЛК:
кривая 1-210 мг/кг,
кривая 2-370 мг/кг.
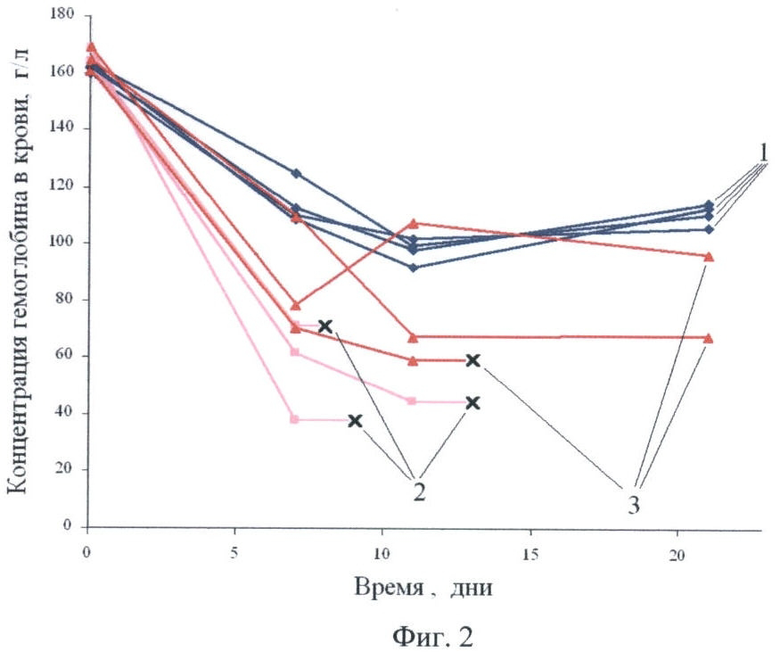
Фиг.2 - изменение концентрации гемоглобина в крови мышей:
кривые 1 - контрольная группа: фенилгидразин внутрибрюшинно;
кривые 2 - группа 2а: фенилгидразин внутрибрюшинно, хлорамфеникол с кормом;
кривые 3 - группа 2б: фенилгидразин внутрибрюшинно, хлорамфеникол с кормом, через 7 дней - АЛК перорально.
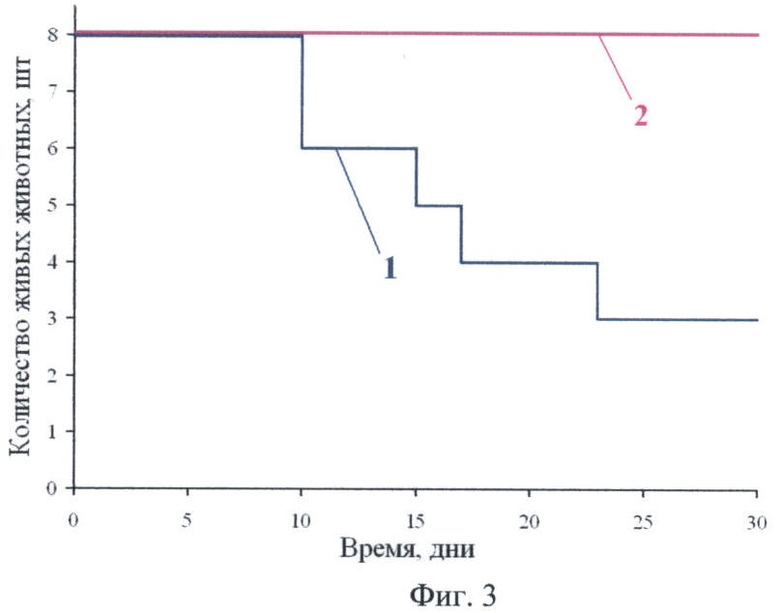
Фиг.3 - кривые выживаемости мышей:
кривая 1 - контрольная группа,
кривая 2 - опытная группа, получавшая АЛК (4 г/кг корма).
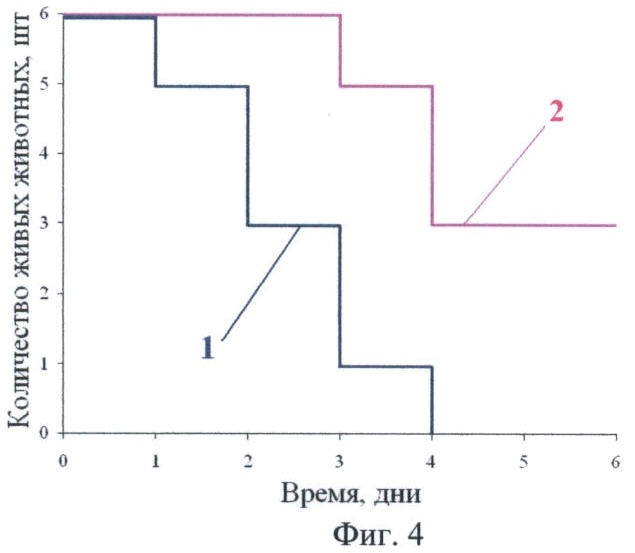
Фиг.4 - кривые выживаемости мышей:
кривая 1 - контрольная группа,
кривая 2 - опытная группа, получавшая гексиловый эфир АЛК (0,72 г/кг корма).
Настоящее изобретение иллюстрируется следующими примерами.
Пример 1
Две группы мышей - контрольная (4 мыши) и опытная (6 мышей) - со средней массой 33 г получали полноценную синтетическую диету, содержащую хлорамфеникол (ХФ) в концентрациях 0 (контроль) и 5 г/кг сухого корма. Начиная с третьего дня все животные начали получать внутрибрюшинные инъекции фенилгидразина по 48 мг/кг массы тела с частотой три раза в неделю.
На восьмой день вторую (опытную) группу разделили на две подгруппы. Второй подгруппе (26) начали вводить перорально раствор АЛК в дозе 700 мг/кг ежедневно. Всем группам животных снизили нагрузку фенилгидразина - вводили 3 раза в неделю по 24 мг/кг веса.
Результаты измерений гемоглобина приведены на фиг.2; полученная картина аналогична результатам работы (Firkin FC. Mitochondrial lesions in reversible erythropoietic depression due to chloramphenicol. J Clin Invest. 1972; 51(8), 2085-2092), где были использованы кролики, а хлорамфенисол вводился внутрибрюшинно. Регулярное введение фенилгидразина вызывает падение уровня гемоглобина во всех группах. Однако, если в контрольной группе гемоглобин стабилизируется на определенном уровне, при котором хроническая гемолитическая анемия компенсируется эритроидной гиперплазией (группа 1, кривые 1), у мышей, получающих с диетой хлорамфеникол (группа 2а, кривые 2), компенсация не наступает.Уровень гемоглобина в их крови падает, и не позже 13-го дня наступает гибель всех животных. Введение АЛК снижает смертность мышей, получающих с диетой хлорамфеникол (группа 2б, кривые 3): на 21-й день остались живы двое из трех животных, у них отмечено увеличение уровня гемоглобина.
Пример 2
Две группы мышей, опытная и контрольная, по 8 животных со средней массой 23 г, получали стандартный корм, содержащий 5 г/кг хлорамфеникола. Корм опытной группы содержал дополнительно 4 г/кг АЛК; таким образом, ежедневная доза животных из опытной группы составляла ~400 мг/кг АЛК. Три раза в неделю все животные получали внутрибрюшинные инъекции раствора фенилгидразина в дозе 60 мг/кг массы тела. Продолжительность опыта составила 30 дней.
Результаты выживаемости приведены на фиг.3. С 10-го по 30-й день наблюдения пали 5 из 8 животных контрольной группы (кривая 1). В то же время все животные опытной группы остались живы (кривая 2). Сравнительный статистический анализ кривых выживаемости проведен по логранк-тесту. Полученные различия в выживаемости достоверны (р=0,025).
Пример 3
В представленном опыте предварительно у животных и контрольной и опытной группы вызывали гемолитическую анемию небольшими дозами фенилгидразина с развитием компенсаторного механизма на фоне введения хлорамфеникола. Затем начинали проведение опыта, опытной группе с диетой дополнительно вводили гексиловый эфир АЛК, одновременно значительно увеличивая дозы фенилгидразина.
Две группы мышей, опытная и контрольная, по 6 животных со средней массой 49 г, получали стандартный корм, содержащий 5 г/кг хлорамфеникола. Три раза в неделю все животные получали внутрибрюшинные инъекции раствора фенилгидразина в дозе 40 мг/кг массы тела. После такой подготовки, которая длилась 20 дней, был начат эксперимент: в корм опытной группы был добавлен ГЭ АЛК в количестве 0,72 г/кг сухого корма, и, таким образом, ежедневная доза животных из опытной группы составляла ~72 мг/кг; нагрузка фенилгидразина была увеличена до 33 мг/кг ежедневно. Результаты выживаемости приведены на фиг.4. В контрольной группе (кривая 1) все животные погибли за первые четыре дня опыта. В опытной группе (кривая 2) к шестому дню выжили 3 мыши из 6.
Сравнительный статистический анализ кривых выживаемости проведен по логранк-тесту. Полученные различия в выживаемости достоверны (р=0,025).
Таким образом 5-АЛК и ее гексиловый эфир обеспечивают выживаемость животных с анемией, связанной с нарушением синтеза порфиринов.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРЕПАРАТ ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ АЛИМЕНТАРНОЙ АНЕМИИ У ПОРОСЯТ | 2013 |
|
RU2540506C2 |
| Фармакологическая композиция на основе водорастворимых полиметаллокомплексов полигалактуроновой кислоты, стимулирующая процесс кроветворения | 2019 |
|
RU2704033C1 |
| СПОСОБ ЭКСПЕРИМЕНТАЛЬНОГО МОДЕЛИРОВАНИЯ ЖЕЛЕЗОДЕФИЦИТНОЙ АНЕМИИ У ЛАБОРАТОРНЫХ ЖИВОТНЫХ | 2021 |
|
RU2782797C1 |
| Лечебно-профилактический хелатный железосодержащий препарат для сельскохозяйственных животных | 2016 |
|
RU2623071C1 |
| СПОСОБ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ АЛИМЕНТАРНОЙ АНЕМИИ И ПРОФИЛАКТИКИ ГИПОПЛАСТИЧЕСКОЙ АНЕМИИ У ПОРОСЯТ | 2010 |
|
RU2429863C1 |
| ТЕТРАКИС-(L-ГИСТИДИНАТО)-μ-ПЕРОКСИДИКОБАЛЬТА (III) ГЕПТАГИДРАТ, ПРОЯВЛЯЮЩИЙ АНТИАНЕМИЧЕСКУЮ, РАДИОПРОТЕКТОРНУЮ И АНТИАРИТМИЧЕСКУЮ АКТИВНОСТЬ | 1999 |
|
RU2151773C1 |
| ПРЕПАРАТ ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ЖЕЛЕЗОДЕФИЦИТНЫХ СОСТОЯНИЙ У ЖИВОТНЫХ | 2010 |
|
RU2455999C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПРЕДНАЗНАЧЕННАЯ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ ЦЕНТРАЛЬНОЙ И ПЕРИФЕРИЧЕСКОЙ НЕРВНОЙ СИСТЕМЫ СОСУДИСТОГО, ТРАВМАТИЧЕСКОГО, ТОКСИЧЕСКОГО, ГИПОКСИЧЕСКОГО И АУТОИММУННОГО ГЕНЕЗА | 2010 |
|
RU2445106C1 |
| БИОЛОГИЧЕСКИ АКТИВНАЯ КОМПОЗИЦИЯ АДАПТОГЕННОГО ДЕЙСТВИЯ | 2015 |
|
RU2620562C2 |
| СРЕДСТВО ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ И КОРРЕКЦИИ ПАТОЛОГИЧЕСКИХ СОСТОЯНИЙ ЖИВОГО ОРГАНИЗМА | 1998 |
|
RU2177788C2 |
Изобретение относится к медицине, точнее к гематологии, и может быть использовано при лечении наследственных анемий, связанных с нарушением синтеза порфиринов. Для этого перорально вводят 5-аминолевулиновую кислоту или ее гексиловый эфир в дозах, обеспечивающих восполнение недостаточного биосинтеза 5-аминолевулиновой кислоты организмом. Способ обеспечивает быстрое и эффективное повышение уровня гемоглобина при лечении указанной патологии в эксперименте. 4 ил.
Применение 5-аминолевулиновой кислоты или ее гексилового эфира для лечения наследственной анемии, связанной с нарушением синтеза порфиринов, путем их перорального введения в организм.
| СРЕДСТВО ДЛЯ ВОССТАНОВЛЕНИЯ КРОВЕТВОРНОЙ ФУНКЦИИ ПРИ ТОКСИЧЕСКОЙ ГЕМОЛИТИЧЕСКОЙ АНЕМИИ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2008 |
|
RU2376024C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ НАРУШЕНИЙ ПОРФИРИНОВОГО ОБМЕНА | 1992 |
|
RU2034297C1 |
| CN 101670017 А, 17.03.2010 | |||
| Полный справочник эндокринолога | |||
| - М.: Эксмо, 2007, стр.718-7280 | |||
| Воробьев А.И | |||
| Руководство по гематологии | |||
| - М.: Медицина, 1985, т.2, стр.27-30 | |||
| ALCINOR Т et al | |||
| "Sideroblastic anaemias" | |||
| Br J Haematol | |||
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
Авторы
Даты
2011-12-10—Публикация
2010-04-09—Подача