Изобретение относится к средствам для профилактики, лечения и ликвидации последствий вирусных, бактериальных, онкологических заболеваний, заболеваний печени, желудочно-кишечного тракта, мочеполовой системы, иммунной системы, ран, ожогов, стрессов, применяемым в медицине и ветеринарии.
Известно противовирусное средство, в виде монофосфата полипренола общей формулы Н-[-СН2-С(СН3)= СН-СН2-] а-Х (полипренилфосфат), где а - количество изопреновых звеньев, Х - анион фосфорной кислоты (RU, патент 2005475, А 61 К 31/21, 1991). Использование известного противовирусного средства недостаточно эффективно для борьбы с вирусами.
Технический результат от использования предлагаемого биологически активного вещества заключается в повышении эффективности его противовирусного действия.
Указанный технический результат достигается применением пирофосфата полипренола [1, 2] общей формулы Н-[-СН2-С(СН3)= СН-СН2-] а-Х, где Х - анион пирофосфорной кислоты, а - не менее 7, в качестве средства для профилактики и лечения инфекционных заболеваний и коррекции патологических состояний живого организма.
Предлагаемое биологически активное вещество обладает полифункциональной активностью как на клеточном уровне, так и на уровне организма в целом.
На клеточном уровне оно встраивается в клеточные мембраны, усиливая их проводимость, нормализует и активизирует процессы биосинтеза гликопротеинов клеточной поверхности, нормализует воспроизводство клеток, межклеточные и, как следствие, межтканевые взаимодействия.
В организме в целом - нормализует функционирование иммунной системы, способствует регенерации тканей, улучшает функционирование отдельных органов, усиливает кроветворную функцию.
Описанные свойства предлагаемого биологически активного вещества позволяют использовать его для профилактики, лечения и ликвидации последствий вирусных, бактериальных, онкологических заболеваний, заболеваний печени, желудочно-кишечного тракта, мочеполовой системы, иммунной системы, ран, ожогов, стрессов.
Действие средства можно проиллюстрировать на следующих примерах.
Пример 1. Противовирусная активность пирофосфата полипренола.
Опыты проводились на мышах линии С57В16, зараженных интраназально вирусом гриппа типа A (H1N1) штамм WSN в дозе 5 LD50.
Одновременно с вирусом однократно вводили монофосфат полипренола или пирофосфат полипренола (раствор 0,4% в дозе 5 мкг на мышь).
Средняя продолжительность жизни животных, которым вводили монофосфат полипренола, составила 6,6 суток, животных, которым вводили пирофосфат полипренола - 8,1 суток.
Приведенный пример свидетельствует о более эффективном действии пирофосфата полипренола по сравнению с монофосфатом полипренола.
Пример 2. Профилактическое защитное действие пирофосфата полипренола у мышей, обработанных эндотоксином грамотрицательных бактерий.
В опыте использованы белые мыши весом 20 г. Животным за 1 сутки до инъекции эндотоксина вводят внутрибрюшинно пирофосфат полипренола из расчета 100 мг на 1 кг веса. Затем животным инъецируют внутрибрюшинно 7 мг гликолипида хемотипа Re, полученного из бактерий Salmonella Minnesota R595 путем экстракции хлороформом и метанолом. Гибель животных учитывают в течение 3 суток. В каждой группе - не менее 20 животных. Без обработки пирофосфатом полипренола погибают все мыши. Предобработка пирофосфатом полипренола защищает от гибели 6 из 20 животных. Различия между группами достоверны при р<0,01.
Пример 3. Использование пирофосфата полипренола для коррекции иммунного статуса у добровольцев с дисбактериозом.
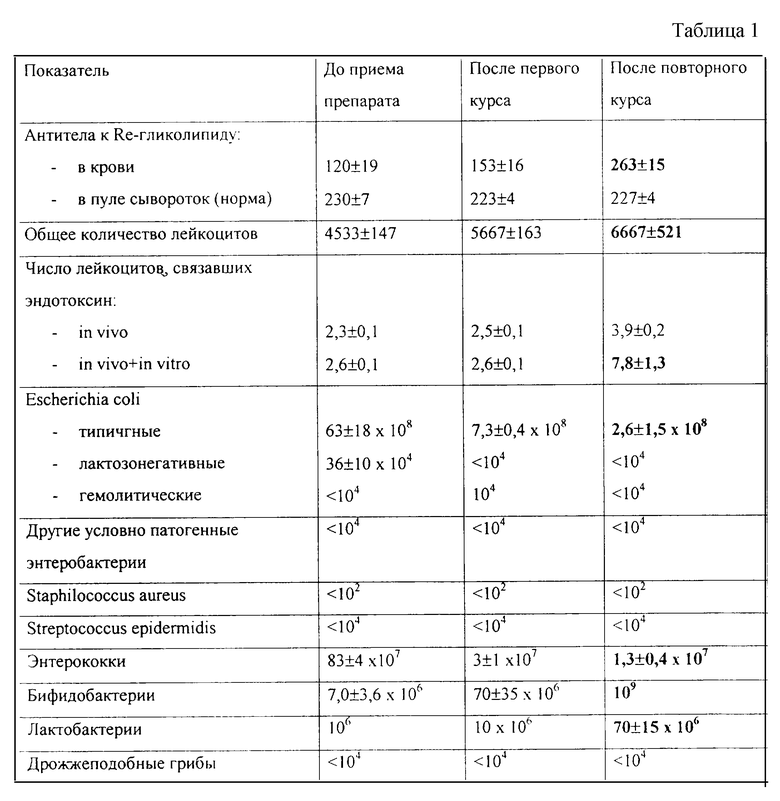
Испытания проведены на 3 добровольцах с дисбактериозом. Добровольцы принимали перорально по 3 мл 0,4% раствора пирофосфата полипренола утром и вечером в течение 3 дней и 1 раз на четвертый лень. Перед первым приемом и через 6 ч после последнего приема проведен анализ крови и кала. В крови определяют содержание IgG-антител к эндотоксину грамотрицательных бактерий (к гликолипиду хемотипа Re), общее количество лейкоцитов и количество лейкоцитов, связывыающих эндотоксин в кровотоке или способных связывать эндотоксин in vitro (в мазках крови). Содержание антител определяют с помощью иммуноферментного анализа (ИФА) с использованием белка А, меченного пероксидазой хрена. В качестве показателя нормы использован пул сывороток крови 40 здоровых добровольцев. Лейкоциты, связавшие эндотоксин in vivo, выявляли с помощью ИФА в мазках крови с использованием антител к Re-гликолипиду, меченному пероксидазой хрена. Для выявления лейкоцитов, способных связывать эндотоксин in vitro, мазки сначала обрабатывали Re-гликолипидом, а затем конъюгатом антител к гликолипиду. Содержание бактерий различных видов в кале определяли общепринятым способом путем высевов на различные питательные среды. Результаты исследования отражены в таблице 1.
После поваторного приема препарата наблюдается восстановление всех изученных показателей до нормы.
Пример 4. Коррекция патологических состояний. Коррекция стрессиндуцированного иммунодефицита
Для индукции стресса, экспериментальных мышей содержали в условиях ограничения движений (мышечной депривации). В течение 10 суток мышей помещали по одной в пластмассовые камеры размером 8,5•4,0•2,0 см на 7 ч ежедневно. Контрольных мышей содержали в стандартных клетках по 10 особей (размер стандартной клетки 42•14•11 см). На 10-е сутки стрессорного воздействия экспериментальным (и контрольным) животным вводили тест-антиген - эритроциты барана, после чего животных содержали в обычных условиях [2] . Для определения уровня стресса использовали метод локального гемолиза в геле [1] . Мышам вводили внутрибрюшинно эритроциты барана (ЭБ) по 5•108 в объеме 0,5 мл. На 5-е сутки после иммунизации у мышей брали селезенки и получали суспензии эритроцитов. Тестируемые клетки (106 в 0,1 мл) вносили в расплавленную агарозу (0,7%), со свежеотмытыми 20%-ными эритроцитами барана, после чего полученную смесь наслаивали на поверхность пластмассовых чашек Петри диаметром 50 мм. После застывания смеси чашки инкубировали при 37oС. Через 1 ч в чашки заливали по 1 мл комплемента морских свинок и инкубировали дополнительно в течение 1 ч при 37oС, после чего комплемент сливали и проводили подсчет зон гемолиза. Расчет числа антителообразующих клеток (АТОК) производили на 1 млн. жизнеспособных спленоцитов.
Исследовали следующие группы мышей (по 10 животных в группе):
1. Контрольные - получавшие ЭБ (5%) внутрибрюшинно по 0,5 мл.
2. Подвергнутые стрессу - получавшие ЭБ на 7-е сутки стрессорного воздействия.
3. Мыши, которым в 1-й день стрессорного воздействия вводили пирофосфат полипренола, а на 7-е сутки - ЭБ.
Результаты, представленные в таблице 2, показывают, что стресс, вызванный гипокинезией, индуцирует у мышей значительное подавление первичного иммунного ответа на ЭБ (с 204 до 70 АТОК на 1 млн. спленоцитов). Однократное введение препарата способствует увеличению численности АТОК, до нормы, полностью предотвращая развитие стрессиндуцированного иммунодефицита.
Пример 5. Коррекция патологических состояний. Изучение продукции интерферона.
Опыты проводились на мышах линии С57В16, выживших после заражения вирусом гриппа типа A (H1N1) штамм WSN.
Мышам линии С57В16 (масса мышей - 12-14 г) вводят внутрибрюшинно пирофосфат полипренола. Через 24 ч у опытных и контрольных мышей отбирают кровь и проводят определение интерферонового статуса по следующим параметрам: 1. Уровень синтеза интерферона в сыворотке крови. 2. Уровень синтеза интерферона, индуцированного вирусом ньюкаслской болезни (вирус-индуцированный интерферон, ВБН, 108TЦД50/02 мл). 3. Уровень синтеза интерферона, индуцированного стафилококковым энтеротоксином А (митоген-индуцированный интерферон, СЭА, 1 мкг/мл). Титрование интерферона проводят в культуре клеток L-929. В качестве тест-вируса используют 100 ТЦД50 вируса энцефаломиокардита мышей. За единицу интерферона принимают последнее разведение пробы, обеспечивающее 50%-ную защиту клеток при полной деструкции монослоя в контроле.
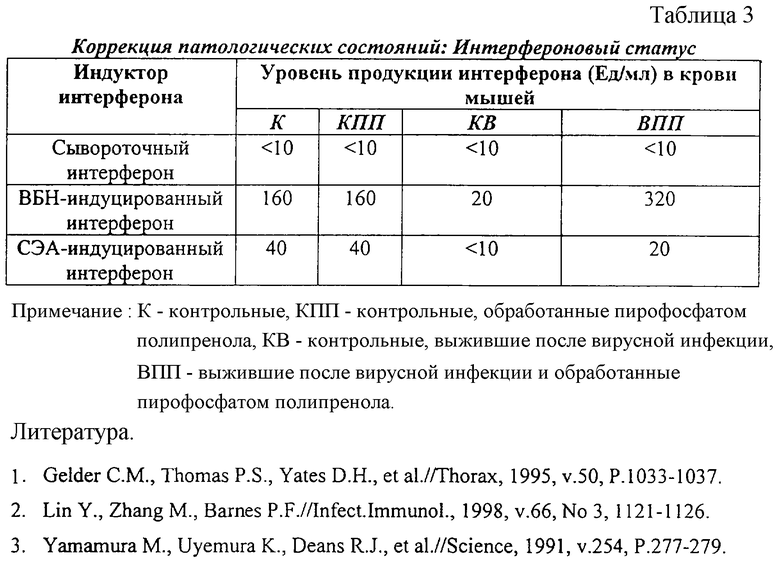
В эксперименте использовали следующие группы мышей: 1) контрольные (К), 2) контрольные, обработанные пирофосфатом полипренола (КПП), 3) контрольные, выжившие после вирусной инфекции (KB), 4) выжившие после вирусной инфекции и обработанные пирофосфатом полипренола (ВПП).
Установлено (табл. 3), что пирофосфат полипренола восстанавливает показатели интерферонового статуса мышей, выживших после вирусной инфекции, при этом не влияя на интерфероновый статус мышей без интерферонового дефицита.
Пример 6. Коррекция патологических состояний. Профиль цитокиновых мРНК.
Использовали линию клеток MG-63 (остеогенная саркома человека). Клетки выращивали в среде Игла MEM с 2 мМ глютамина и 10% сыворотки эмбриона крупного рогатого скота (КРС). При достижении клетками сплошного монослоя ростовую среду меняли на поддерживающую и опытные культуры обрабатывали пирофосфатом полипренола. Через 2, 24 и 48 ч клетки снимали раствором трипсина и версена, отмывали физиологическим раствором и проводили выделение общей РНК (использовали наборы для выделения РНК - Rneasy Total RNA System - Qiagen, Santa Clarita, CA) с последующим синтезом кДНК с использованием oligo dT праймеров и AMV-обратной транскриптазы (New England Biolabs, Bedford, MA). кДНК использовалась как темплата в реакции RT-PCR с парами праймеров для следующих цитокинов - IFN-α, IFN-γ, IL-lb, IL-2, IL-4, IL-6, IL-10, TNF-α (Yamamura et al. , 1991; Gelder et al. , 1995; Lin et al. , 1998). Условия реакции - 94oС 2 мин; 35 циклов при 94oС 1 мин - 55oС 2 мин - 72oС 2 мин; 72oС 5 мин --> SHUT-OFF. Продукт реакции выявляли с помощью электрофореза в 3% агарозном геле.
Было показано, что в клетках MG-63 пирофосфат полипренола индуцировал биосинтез мРНК для ИЛ-1 и ИЛ-2. Индукция отчетливо отмечалась через 24 ч после обработки; продукт реакции не обнаруживался через 2 ч после обработки; следовые количества PCR-продукта обнаруживались через 48 ч после обработки. Следует отметить, что в клетках MG-63 конститутивно были представлены мРНК для ИФН-α и ФНО-α.
Пример 7. Коррекция патологических состояний. Влияние на 2'-5'-олигоаденилатсинтетазу.
Фермент 2'-5'-олигоаденилатсинтетаза (2-5А синтетаза), находясь в комплексе с дсРНК, полимеризует АТР в олигоаденилаты, которые активируют рибонуклеазу, Рназу L. Активация системы ферментов 2-5А-синтетаза/Рназа L приводит к усилению распада мРНК в клетке и, как следствие, к снижению скорости клеточного размножения, подавлению вирусной инфекции и др. Использовали перевиваемую линию человеческих клеток J-96, полученную из крови мужчины, больного подострой моноцитарной лейкемией, и перевиваемую линию мышиных фибробластов L-929. Клетки культивировали в среде 199 с 10% сыворотки эмбриона КРС. На 2-й день культивирования при достижении клетками неполного монослоя ростовую среду заменяли на поддерживающую (с 2% сыворотки эмбриона КРС) и обрабатывали пирофосфатом полипренола. Через 24 ч клетки снимали со стекла раствором Версена, осаждали центрифугированием при 2000g в течение 5 мин, суспендировали в буфере и замораживали при -70oС. После размораживания клеток проводили соответствующие обработки и определение активности 2-5А синтетазы согласно А. Н. Наровлянского и соавт. (1988). Активность 2-5А-синтетазы выражали в молях АМР, включенного в димер 2-5А за 14 ч инкубации в расчете на 1 мг белка клеточного лизата. Как видно из таблицы 4, при обработке клеток J-96 и L-929 пирофосфатом полипренола происходила индукция 2-5А синтетазы. Активность 2-5А синтетазы возрастала до уровня, превышающего его исходный в 5,7 раза для культуры клеток J-96 и в 2,9 раза для культуры клеток L-929.
Пример 8. Коррекция патологических состояний. Влияние на сАМР-зависимую протеинкиназу.
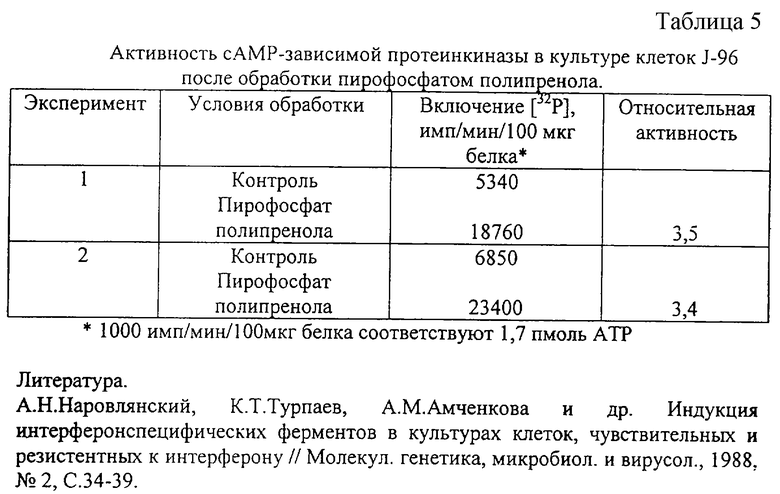
Использовали перевиваемую линию человеческих клеток J-96, полученную из крови мужчины, больного подострой моноцитарной лейкемией. Клетки культивировали в среде 199 с 10% сыворотки эмбриона КРС. На 2-й день культивирования при достижении клетками неполного монослоя ростовую среду заменяли на поддерживающую (с 2% сыворотки эмбриона КРС) и обрабатывали пирофосфатом полипренола. Через 24 ч клетки снимали со стекла раствором Версена, осаждали центрифугированием при 2000g в течение 5 мин, суспендировали в буфере и замораживали при -70oС. После размораживания клеток проводили соответствующие обработки и определение активности сАМР-зависимой протеинкиназы согласно А. Н. Наровлянского и соавт. (1988). Активность протеинкиназы выражали в импульсах в 1 мин в расчете на 1 мг белка клеточного лизата.
Представленные в таблице 5 данные позволяют сопоставить активность этого фермента в культуре клеток J-96 без и с обработкой пирофосфатом полипренола. Показано, что активность сАМР-зависимой протеинкиназы примерно в 3,5 раза выше в культуре клеток, обработанной пирофосфатом полипренола.
Литература
1. Rip J. W. et al. , Distribution, metabolism and function of dolichol and polyprenols. //Prog. Lipid Res. - 1985. - v. 24. - 6. -p. 269-309.
2. Shibaev V. N. , Danilov L. L. New developments in the synthesis of phosphopolyprenols and their glycosyl esters. // Biochem. Cell. Biol. - 1992. - v, 70. - 6. - р. 429-437.
| название | год | авторы | номер документа |
|---|---|---|---|
| СРЕДСТВО ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ И КОРРЕКЦИИ ПАТОЛОГИЧЕСКИХ СОСТОЯНИЙ ЖИВОГО ОРГАНИЗМА | 1998 |
|
RU2129867C1 |
| ИММУНОМОДУЛЯТОР - МЕТАБОЛИК - ДЕТОКСИКАНТ - АДАПТОГЕН - РАДИОПРОТЕКТОР | 2000 |
|
RU2194502C2 |
| КОМПЛЕКС 1:2 ГЕРМАНИЯ И 2,6-ПИРИДИНДИКАРБОНОВОЙ КИСЛОТЫ, СПОСОБ ЕГО ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1997 |
|
RU2171259C2 |
| СРЕДСТВО ДЛЯ СНИЖЕНИЯ РЕПРОДУКЦИИ ВИРУСА ГЕПАТИТА С | 2013 |
|
RU2526179C1 |
| СПОСОБ СНИЖЕНИЯ ЧАСТОТЫ РЕЦИДИВОВ И ВЫРАЖЕННОСТИ СИМПТОМОВ ГЕНИТАЛЬНОГО ГЕРПЕСА | 2014 |
|
RU2577718C1 |
| ПРОТИВОВИРУСНОЕ СРЕДСТВО | 2014 |
|
RU2564919C1 |
| СПОСОБ ПОВЫШЕНИЯ ПРОДУКТИВНОСТИ ПЛОТОЯДНЫХ ЖИВОТНЫХ | 2005 |
|
RU2297776C2 |
| СПОСОБ ПОВЫШЕНИЯ РЕЗИСТЕНТНОСТИ, ИММУНИТЕТА И МЯСНОЙ ПРОДУКТИВНОСТИ СВИНЕЙ | 2005 |
|
RU2306699C1 |
| БИОЛОГИЧЕСКИ АКТИВНАЯ ДОБАВКА И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2010 |
|
RU2427284C1 |
| ПРОТИВОВИРУСНОЕ СРЕДСТВО | 1991 |
|
RU2005475C1 |


Изобретение относится к медицине. Средство для профилактики, лечения и ликвидации последствий вирусных, бактериальных, онкологических заболеваний, заболеваний печени, желудочно-кишечного тракта, мочеполовой системы, иммунной системы, ран, ожогов, стрессов, применяемое в медицине и ветеринарии, содержит пирофосфат полипренола общей формулы: Н-[-СH2-C(CH3)= CH-CH2-] a-X, где Х - анион пирофосфорной кислоты, а - не менее 7. Предлагаемое средство более активно, так как обладает полифункциональной активностью на клеточном уровне. 5 табл.
Применение пирофосфата полипренола общей формулы
Н-[-СH2-C(CH3)= CH-CH2-] a-X,
где Х - анион пирофосфорной кислоты,
a - не менее 7,
в качестве средства для профилактики и лечения инфекционных заболеваний и коррекции патологических состояний организма.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| СПОСОБ ПОЛУЧЕНИЯ АНТОЦИАНОВОГО КРАСИТЕЛЯ | 1992 |
|
RU2025475C1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| СОСТАВ МАТЕРИАЛА ДЛЯ ПОКРЫТИЙ ПОЛОВ | 0 |
|
SU350801A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| WO 9614847 A1, 23.05.1996 | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| ДАНИЛОВ Л.Л | |||
| и др | |||
| Фосфорилирование полипренолов тетра-н-бутиламмоний фосфатом в присутствии трихлорацетонитрила | |||
| - Биоорганическая химия, т.14, № 9, 1988, с | |||
| Водоподъемный аппарат | 1924 |
|
SU1287A1 |
Авторы
Даты
2002-01-10—Публикация
1998-06-10—Подача