ОБЛАСТЬ ТЕХНИКИ
[0001] В настоящем изобретении предложена композиция для дозирующего ингалятора под давлением, содержащая фармацевтические вещества, и способ ее получения, где указанный дозирующего ингалятор под давлением представляет собой лекарственное средство, используемое для лечения респираторных заболеваний, таких как астма и хроническая обструктивная болезнь легких.
УРОВЕНЬ ТЕХНИКИ
[0002] Дозирующий ингалятор под давлением (pressurized metered dose inhaler, pMDI) позволяет обеспечить местное и быстрое действие ингалируемого лекарственного средства и обладает сниженным системным побочным действием по сравнению с пероральными лекарственными средствами. pMDI и ингалятор сухого порошка (dry powder inhaler, DPI) являются наиболее распространенными медицинскими средствами при астме или хронической обструктивной болезни легких (ХОБЛ), которые используют для введения композиции, выбранной из группы, состоящей из кортикостероидного лекарственного средства, бета-2-агониста, антихолинергических средств и их комбинации.
[0003] В 1995 г. компания 3М разработала продукт pMDI, содержащий хлорфторуглероды (CFC) в качестве пропеллента, и данный продукт стал наиболее популярным средством для лечения астмы или ХОБЛ. По сравнению с пероральным лекарственным средством pMDI может обеспечивать более быстрое проявление активности и меньшее системное побочное действие лекарственного средства. Типичные компоненты для лечения таких заболеваний включают кортикостероидное лекарственное средство, бета-2-агонист, антихолинергические средства или фармацевтическую композицию, представленную в виде дозирующего ингалятора и состоящую из указанных лекарственных средств.
[0004] В 1970-х было обнаружено, что пропеллент CFC может приводить к проблемам в сфере защиты окружающей среды, заключающимся в разрушении озонового слоя, и, таким образом, CFC находится под угрозой глобального запрета. В конце 1980-х был разработан продукт-заменитель DPI, однако указанный продукт-заменитель так и не смог полностью вытеснить pMDI с CFC-пропеллентом, поскольку на указанный продукт негативно воздействует влага и для эффективного введения пациенту требуется достаточная скорость ингаляции при использовании продукта. До настоящего времени компания Riker 3М прежде всего разрабатывает заменитель пропеллента для замены CFC-пропеллента, т.е. гидрофторалканового (HFA) пропеллента, который включает 1,1,1,2-тетрафторэтан (HFA 134а, HFC 134а) или 1,1,1,2,3,3,3-гептафтор-н-пропан (HFC 227еа, HFC 227, HFA227). Однако ввиду ряда проблем, требующих решения, в частности касающихся технологии получения и безопасности лекарственного средства, первый продукт на основе состава HFA MDI не выходил на рынок до 1996 г. и быстро набрал популярность в 2004 г., что привело к полному запрету производства CFC MDI после 2010 г.
[0005] В патентах США №5225183, 5439670, 5695743, 5766573, 5836299 и 6352684, принадлежащих компании Riker/3М, был описан запатентованный состав, содержащий HFA 134. Указанный состав содержит компоненты β-2-адренергических агонистов, включая, например, сальбутамол, кортикостероиды, такие как беклометазона дипропионат, адренергические компоненты, холин и антигистамин или противовоспалительные лекарственные средства, и содержит от 1 до 50% соединения этанола в качестве солюбилизатора и поверхностно-активное вещество, которое может представлять собой производное, такое как олеиновая кислота, полиэтиленгликоль 400(ПЭГ 400) или Span, и добавляется в массовом отношении менее 5%. В патенте США №6743413 HFA 134а и микронизированные лекарственные средства используют в качестве основных компонентов без других вспомогательных веществ. В патенте США №5776432 описано, что HFA 134а, HFA 227 или их комбинации используют в качестве пропеллентов, и 2%-12% этанола используют в качестве солюбилизатора основного лекарственного компонента, беклометазона 17, 21-дипропионата без использования какого-либо поверхностно-активного вещества.
[0006] В патенте США №5474759, принадлежащем компании Schering, описано, что HFA 227 используют в качестве пропеллента и диэфир пропиленгликоля с длинной цепью используют в качестве поверхностно-активного вещества, причем основные компоненты включают такие соединения, как альбутерол, альбутерола сульфат, беклометазона дипропионат или мометазона фуроат.
[0007] В патентах США №5653962, 5658549 и 5744123, принадлежащих компании GSK, описан запатентованный состав, содержащий HFA. Указанный состав включает основные компоненты, такие как сальметерол, сальбутамол и флутиказона пропионат, но не содержит сорастворителя и содержит поверхностно-активное вещество в количестве менее 0,001%. Их последующие патенты относятся к модификации равномерности доставки лекарственного средства. Патенты США №6315173 и 6510969 относятся к улучшению распыляющего сопла. В патенте США №6479035 описано использование флутиказона и 7-20% спирта в качестве солюбилизатора и использование 0,5-3% глицерина или ПЭГ в качестве поверхностно-активного вещества. В патентах США №5736124, 5817293, 5916540, 5922306, 6333023, 6200549 и 6222339 описан основной компонент формотерол с добавлением 0,01-5% этанола. В патентах США №6303103 и 6238647 указано, что в состав включены сальметерол и антихолинергические агенты и количество вспомогательного вещества составляет менее 0,0001%. Патент США №6013245 относится к беклометазону и сальбутамолу, указано на использование HFA 227 и отсутствие поверхностно-активного вещества. В патенте США №5833950 описан беклометазон и указано на использование HFA и вспомогательного вещества менее 0,0001%.
[0008] Компания Aeropharm описала запатентованный состав, содержащий HFA. В патенте США №5891419 описан флунизолид с добавлением только 0,5%-2% этанола. В патенте США №5891420 описан ацетонид триамцинолона с добавлением 1%-3% этанола. Патент США №6458338 относится к дозируемому составу, содержащему аминокислоту в качестве стабилизатора. В патентах США №6447750, 6540982, 6540983, 6548049 и 6645468 описан дозируемый состав основного компонента лекарственного средства для лечения диабета. В патенте США №6464959 описан дозируемый состав основного компонента лекарственного средства для лечения диабета, в который вводят аминокислоту в качестве стабилизатора.
[0009] В патенте США №6004537, принадлежащем компании Baker Norton (в настоящее время TEVA), описано, что HFA используют в качестве пропеллента, и указано на использование 10%-40% (масс./масс.) этанола в качестве солюбилизатора для растворения основных компонентов Будесонида и Формотерола.
[0010] В патенте США №6123924, принадлежащем Fisons, описаны основные компоненты, такие как агонист рецептора β2: гидробромид фенотерола, гидрохлорид прокатерола, сальбутамола сульфат, тербуталина сульфат, анаболические стероиды или стероидные компоненты; беклометазона дипропионат, флутиказона пропионат, типредан, антигистамин, противовоспалительное средство или ацетил-β-метилхолин бромид; холинергические компоненты: пентамидин изетионат, типреданен (tipredanene), докромил натрия, кромогликат натрия, клемастин, будесонид и т.д., которые распределены в HFA, и описано применение поливинилпирролидона (PVP) в количестве 0,00001~10% масс./масс., в качестве суспендирующиего агента и ПЭГ 400-3000 в качестве смазывающего агента.
[0011] В заявке на патент Тайваня №200303767, принадлежащей компании Chiesi, описан состав сверхизмельченного формотерола, содержащий 0,003-0,192% масс./об. фумарата (КД)-(±)-формотерола, при этом при комбинировании дозируемого состава под давлением используют и 10~20% этанола и HCl используют для регулирования значения рН. Особое внимание уделено соотношению частиц, равному или меньшему чем 1,1 микрометра, в количестве, большем или равном 30%. В патенте США №7223381 состав состоит из будесонида, HFA пропеллента и сорастворителей из 13% этанола и 0,2-2% глицерина.
[0012] Патент США №6638495, принадлежащий компании Nektar, относится к способу получения состава, в котором фосфолипид используют в качестве вспомогательного вещества для получения микроструктуры, и вещества, обладающие биологическими активностями, распределяют в дозирующем ингаляторе под давлением.
[0013] Патент США №6932962, принадлежащий компании AstraZeneca, относится к распыляемой дозе HFA, содержащей жирную кислоту или ее соль, соли желчных кислот, фосфолипид или алкилгликозиды в качестве поверхностно-активного вещества, при этом количество используемого этанола может составлять 5-20%.
[0014] Патент США №7481995, принадлежащий University College Cardiff Consultants Limited, относится к способу получения состава HFA MDI, в котором используют аминокислоту в качестве суспендирующего вспомогательного вещества.
[0015] Принимая во внимание указанные документы уровня техники, основанные на составах для дозирующего ингалятора под давлением, помимо лекарственного средства и HFA газа способы могут быть разделены в соответствии с условиями использования этанола следующим образом.
[0016] 1) Без каких-либо добавок, как представлено кампанией GSK, которая предложила лекарственное средство, полностью содержащееся в суспендирующем растворе, однако такое лекарственное средство имеет недостаток в виде более сложного осуществления однородного введения.
[0017] 2) Без использования этанола и простое использование наполнителя, например PVP или бисхлорацетата пропандиола.
[0018] 3) Большое количество этанола (более 10%), который будет полностью растворять лекарственное средство, и могут быть добавлены или не добавлены другие наполнители. В этом случае преимуществом является хорошая равномерность введения и возможным недостатком является худшая стабильность лекарственного средства и особое действие спирта, который плохо воспринимается пациентами.
[0019] 4) Средненизкое количество этанола (примерно от 1% до 10%), соотнесенное с другими наполнителями, в которых лекарственное средство частично растворено и частично не растворено. На стабильность состава сильно влияет то, что диаметр частиц лекарственного средства изменяется с течением времени хранения.
[0020] 5) Экстремально низкое количество этанола (примерно 0,2% до 2%), например, в составе компании Valois. В этом случае преимуществом является лучшая стабильность лекарственного средства, поскольку оно находится в суспендирующем растворе в нерастворенном состоянии, а недостатком является плохая равномерность введения, и, таким образом, могут потребоваться другие вспомогательные вещества. Кроме того, процесс производства может быть более сложным.
[0021] Несмотря на это Valois SAS опубликовала состав будесонида HFA MDI, содержащий 0,1-5% ПЭГ 300 и 0,2-2% этанола (согласно Indian Journal of Pharmaceutical Science, Vol. 69, No. 5, P. 722-724, Sep-Oct 2007). Однако для снижения абсорбции в емкости с указанным лекарственным средством и повышения равномерности введения в указанном составе необходимо использовать специальную поверхностно-анодированную емкость, такую как стандартная анодированная алюминиевая емкость для наполнения составом. При использовании в крупномасштабном производстве или в обычной емкости, такой как алюминиевая емкость, могут возникнуть некоторые проблемы, связанные с качеством. Соответственно, при непосредственном массовом производстве указанного состава в фармацевтической промышленности, даже когда компоненты состава одинаковы, может возникать разница в качестве вследствие разницы в порядке смешивания компонентов и различных способов или оборудования для наполнения. Примерами разницы в качестве являются недостаточное количество основного компонента, слипание частиц лекарственного средства, неудовлетворительная однородность и т.д. В частности, указанные состояния будут возникать легче, когда продукт содержит два вида основных компонентов, поскольку существует разница в физических и химических характеристиках, а также соотношении содержания двух указанных основных компонентов. Следовательно, изменение способа получения в отношении комбинирования вспомогательного вещества с содержимым состава, особенно порядка смешивания или способов гомогенизации основных компонентов с пропеллентом и другими вспомогательными веществами, может привести к получению дозирующего ингалятора под давлением со стабильными, безопасными и более эффективными характеристиками.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0022] Легкое является нежной тканью, и, таким образом, при осуществлении ингаляционного введения необходимо убедиться, что причиняемый вред является минимальным. Хотя поверхностные клетки легкого имеют двигательные волокна, способные выводить ингалируемое чужеродное тело, функция выведения ограничена. Следовательно, при разработке состава для дозы ингалятора следует использовать настолько низкое количество вспомогательных веществ, насколько это возможно, или вещества с более низкой токсичностью. Хотя использование большого количества солюбилизатора может привести к лучшей однородности продукта, его стабильность будет соответственно снижена. Следовательно, задачей состава HFA MDI, исследуемого в настоящем изобретении, которое предназначено для получения безопасной и эффективной дозы суспендирующего раствора с наименьшим количеством вспомогательного вещества или солюбилизатора, является достижение хорошей равномерности введения и долговременной стабильности продуктов и обеспечение пациентов эффективной дозой (<5 микрометров), способной входить в легкие. Однако снижение количеств вспомогательного вещества и солюбилизатора в патентованном составе HFA скорее приведет к снижению стабильности и однородности получаемых лекарственных средств, особенно когда продукт содержит два основных компонента, таких как бета-2-агонисты и кортикостероиды. Кроме того, значительная разница в дозах и различные физические и химические характеристики двух основных компонентов скорее приведут к ухудшению однородности и стабильности основных компонентов в дозе. Кроме того, поскольку основные компоненты не могут быть равномерно смешаны со вспомогательным веществом в ходе процесса получения дозы суспендирующего раствора, частицы лекарственного средства могут снова легко слипаться, что приводит к эффекту значительного снижения эффективности ингалируемой дозы (тонкодисперсной дозы).
[0023] В настоящем изобретении предложен способ получения и композиции для дозирующего ингалятора, включающий стадии:
a) смешивание 0,05%-10% (масс./масс.%) спирта с поверхностно-активным веществом с получением первой смеси;
b) диспергирование бета-2-агониста в первой смеси с получением второй смеси;
c) добавление гидрофторалканового (HFA) пропеллента во вторую смесь с получением третьей смеси;
d) диспергирование кортикостероида в третьей смеси; и
e) проведение стадии наполнения.
[0024] Согласно указанному концепту в настоящем изобретении стабильную и хорошо смешанную дозу суспендирующего раствора получают с использованием ингалируемого лекарственного средства с помощью подходящего способа получения. Указанное лекарственное средство включает бета-2-агонист, такой как прокатерол, сальбутамол, формотерол и сальметерол, кортикостероид, такой как будесонид, флутиказон, циклесонид и беклометазон, или их комбинации. Указанный гидрофторалкановый (HFA) пропеллент включает один из 1,1,1,2-тетрафторэтана (HFA 134а, HFC 134а) или 1,1,1,2,3,3,3-гептафтор-н-пропана (HFC 227еа, HFC 227, HFA227), и при необходимости указанные два HFA пропеллента могут быть смешаны. Указанное поверхностно-активное вещество включает полиэтиленгликолевое (ПЭГ) вспомогательное вещество для стабилизации состава или смазывания дозирующего клапана контейнера для предотвращения закупоривания, и добавляемое количество составляет от 0,01% до 2,50% (масс./масс.%), предпочтительно 0,05%-1,50% (масс./масс.%). В целом, ПЭГ в указанной концентрации не будет влиять на растворимость основных компонентов, которая приводит к снижению стабильности. ПЭГ предпочтительно имеет молекулярную массу от 100 до 6000, и в дополнение к функции облегчения суспендирования ПЭГ может рассматриваться в качестве корректора диаметра частиц, поскольку изменение его добавляемого количества может привести к изменению распределения диаметров частиц. Добавляют абсолютный этанол, и количество добавляемого этанола составляет от 0,05% до 10,0% (масс./масс.%), предпочтительно 0,25%-2% (масс./масс.%). В указанной концентрации абсолютный этанол может не только способствовать растворению ПЭГ, но также улучшает процесс агрегации частиц основного компонента в результате испарения HFA из распыляющего сопла распыляемой дозы в момент распыления. Кроме того, указанное поверхностно-активное вещество, т.е. ПЭГ с молекулярной массой 100-6000, используемое в настоящем изобретении, является коммерчески доступным продуктом, и требуемая вязкость может быть отрегулирована путем добавления количества этанола.
[0025] Согласно указанному концепту в настоящем изобретении предложен конкретный способ получения композиции для дозирующего ингалятора, включающий стадии:
a) применение 0,05%-10% (масс./масс.%) спирта в качестве спиртового растворителя для смешивания с поверхностно-активным веществом с получением раствора смеси;
b) диспергирование бета-2-агониста в указанном растворе смеси с получением однородного раствора;
c) добавление HFA в указанный однородный раствор;
d) диспергирование кортикостероида в указанном однородном растворе; и
e) осуществление стадии холодного наполнения или стадии наполнения под давлением.
[0026] В способе получения распыляемой дозы, предложенном в настоящем изобретении, стадия однородного диспергирования ПЭГ в HFA является важной стадией, необходимой для регулирования однородности частиц основного компонента. Сначала небольшое количество спирта равномерно смешивают с ПЭГ. Поскольку частицы лекарственного средства ингалируемого типа являются очень маленькими, указанные частицы склонны к агрегации. Для однородного диспергирования частиц с помощью ПЭГ необходимо осуществить стадию смешивания с помощью ультразвуковой вибрации для получения концентрированного раствора. Вязкость и объем раствора смеси спирта и ПЭГ могут быть изменены в зависимости от количества и свойств основного компонента, при этом его количество не должно превышать 2% (масс./масс.%) от общего количества состава. Однако если количество основного компонента лекарственного средства больше и полученный объем больше, чем объем раствора смеси спирта и ПЭГ, то нет необходимости смешивать спирт и ПЭГ заранее. Далее, указанный концентрированный раствор или раствор смеси спирта и ПЭГ должен быть гомогенно перемешан с HFA для получения гомогенизированного раствора, и затем основной компонент в большом количестве медленно добавляют и перемешивают с указанным гомогенизированным раствором. В указанном выше способе порядок добавления вспомогательного вещества и способ смешивания играют значительную роль. В частности, при расширении производства обеспечиваются определенные улучшения степени однородности диспергирования частиц лекарственного средства и количества основного компонента лекарственного средства, оставшегося в смесительной емкости. В конце осуществляют стадии холодного наполнения или наполнения под давлением.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ РЕАЛИЗАЦИИ ИЗОБРЕТЕНИЯ
[0027] Оценка однородности доставляемой дозы
[0028] На эффективность и безопасность лекарственного средства распыляемой дозы влияет однородность доставляемой дозы, которая включает:
1. однородное и быстрое диспергирование суспендирующего раствора при встряхивании бутылки;
2. однородное суспендированное состояние поддерживается по меньшей мере 5 секунд после встряхивания; и
3. доверительный интервал распыляющей головки спрея (Управление по продовольствию и лекарствам США требует, чтобы в соответствующий диапазон, представляющий собой среднее для группы распыляющих сопел, составлял целевое значение ±10% и для отдельного распыляющего сопла целевое значение ±15%).
[0029] Для обеспечения достоверного теста на однородность устройство для отбора образцов единичных доз (DUSA) согласно требованиям Фармакопеи США (USP) используют со стеклянным волокнистым фильтром (1 мкм). После осуществления отбора образцов путем распыления при требуемой скорости потока высвобождаемого воздуха (28,3 л/мин), количества лекарственных средств в исполнительном механизме (или насадке) и устройстве для отбора образцов/сбора лекарственного средства измеряют соответственно с помощью высокоэффективной хроматографии. Три изначальных распыления, четыре промежуточных распыления и три указанные конечные распыления бутыли соответственно исследуют в отношении единичной дозы. Описание требует, чтобы основные компоненты в одиночном распылении составляли менее 25% от указанной дозы согласно требованиям Фармакопеи, и среднее количество основных компонентов из всех десяти распылений должно составлять менее 15% от указанной дозы. Кроме того, однородность доставляемой дозы оценивают в условиях 40°C, относительной влажности 75% и выдерживания в течение шестимесячного периода хранения для обеспечения стабильности.
[0030] Оценка распределения размеров частиц
[0031] Для определения состояния распределения размеров частиц указанных лекарственных средств отбор образцов путем распыления осуществляли при скорости потока высвобождаемого воздуха (30,0 л/мин) согласно USP и анализ размеров частиц указанных лекарственных средств в указанных распыляемых образцах осуществляли с использованием каскадного импактора Next Generation Cascade Impactor. Распределение и меняющиеся характеристики частиц на каждом уровне при использовании каскадного импактора Next Generation Cascade Impactor наблюдали в условиях 40°C, относительной влажности 75% и выдерживания в течение шестимесячного периода хранения для обеспечения стабильности для оценки стабильности частиц лекарственного средства, суспендированных в растворе состава.
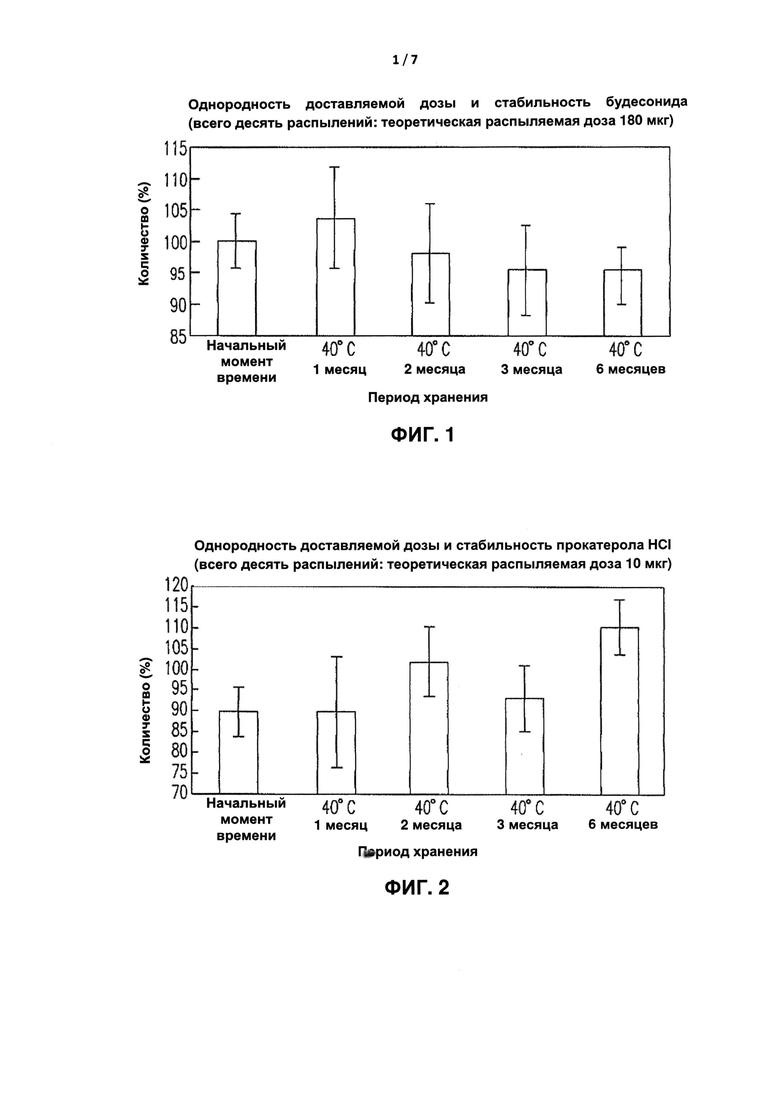
[0032] Однородность доставляемой дозы анализировали для спрея согласно составу Примера I способа для распыляемой дозы, предложенного в настоящем изобретении. Как показано на Фиг.1, где Будесонид при первом распылении имел указанную дозировку в 180 мкг после шестимесячного теста на обеспечение стабильности (40°C и относительная влажность 75%), каждая бутылка спреев, включающая всего десять распылений доставляемых доз, соответствовала требованию, согласно которому основной компонент в одиночном распылении должен составлять менее 25% от указанной дозы и среднее значение должно быть менее 15% от указанной дозы согласно Фармакопее. Как показано на Фиг.2, где Прокатерол-HCl при первом распылении имел указанную дозировку в 10 мкг после шестимесячного теста на обеспечение стабильности (40°C и относительная влажность 75%), каждая бутылка спреев, включающая всего десять распылений доставляемых доз, соответствовала требованию, согласно которому основной компонент в одиночном распылении должен составлять менее 25% от указанной дозы и среднее значение должно быть менее 15% от указанной дозы согласно Фармакопее.
[0033] Как показано на Фиг. 3, иллюстрирующей анализ распределения размеров частиц после шестимесячного теста на обеспечение стабильности (40°C и относительная влажность 75%), Будесонид анализировали с использованием каскадного импактора Next Generation Cascade Impactor на каждом уровне, который содержит исполнительный механизм, L-горлышко, ступень 1, ступень 2, ступень 3, ступень 4, ступень 5, ступень 6, ступень 7 и коллектор с микроотверстием (МОС). Значительная разница в количестве Будесонида (тест ANOVA, р>0,05) отсутствовала по сравнению с точкой отсчета с другими продуктами на каждом уровне.
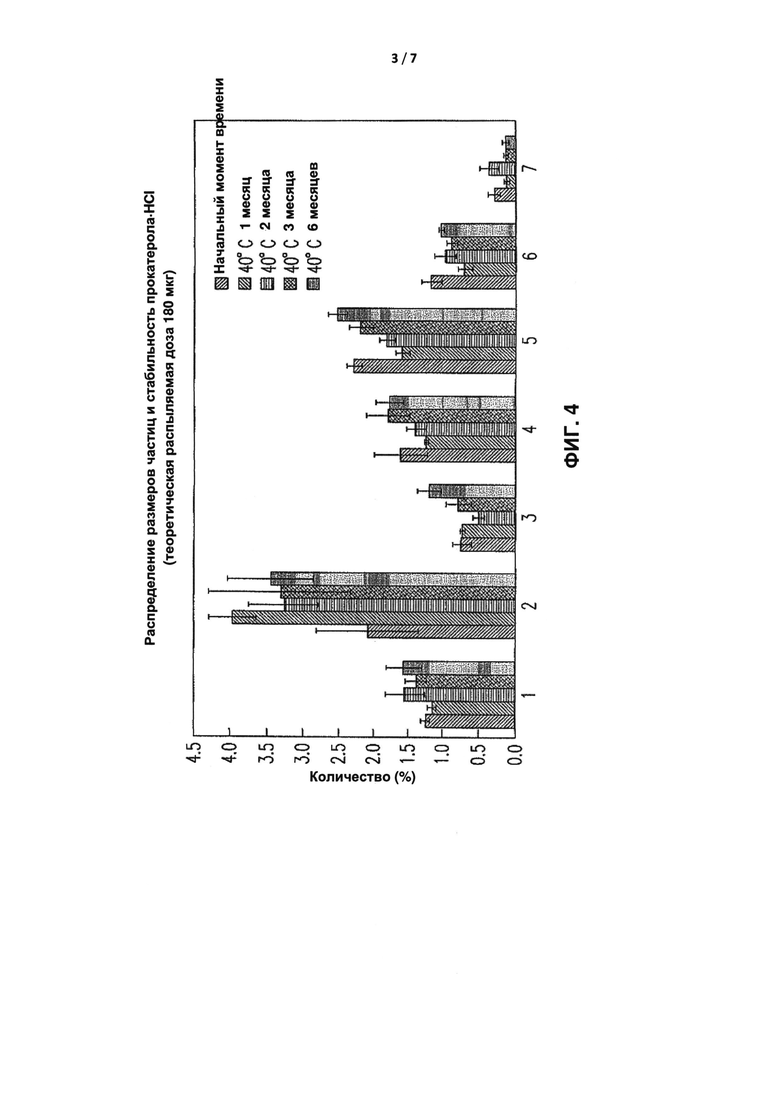
[0034] Как показано на Фиг. 4, иллюстрирующей анализ распределения размеров частиц после шестимесячного теста на обеспечение стабильности (40°C и относительная влажность 75%), Прокатерол-HCl анализировали с использованием каскадного импактора Next Generation Cascade Impactor на каждом уровне, и значительная разница в количестве Прокатерола-HCl (тест ANOVA, р>0,05) отсутствовала по сравнению с точкой отсчета с другими продуктами на каждом уровне.
[0035] Фиг. 5 иллюстрирует анализ однородности доставляемой дозы Флутиказона в спрее состава Примера VII, где Флутиказон при первом распылении имел указанную дозировку в 250 мкг. После шестимесячного теста на обеспечение стабильности (40°C и относительная влажность 75%) каждая бутылка спреев, включающая всего десять распылений доставляемых доз, соответствовала требованию, согласно которому основной компонент в одиночном распылении должен составлять менее 25% от указанной дозы и среднее значение должно быть менее 15% от указанной дозы согласно Фармакопее.
[0036] Фиг. 6 иллюстрирует анализ распределения размеров частиц Флутиказона в спрее состава Примера VII. После шестимесячного теста на обеспечение стабильности (40°C и относительная влажность 75%) его анализировали с использованием каскадного импактора Next Generation Cascade Impactor на каждом уровне, и значительная разница в количестве Флутиказона (тест ANOVA, р>0,05) отсутствовала по сравнению с точкой отсчета с другими продуктами на каждом уровне.
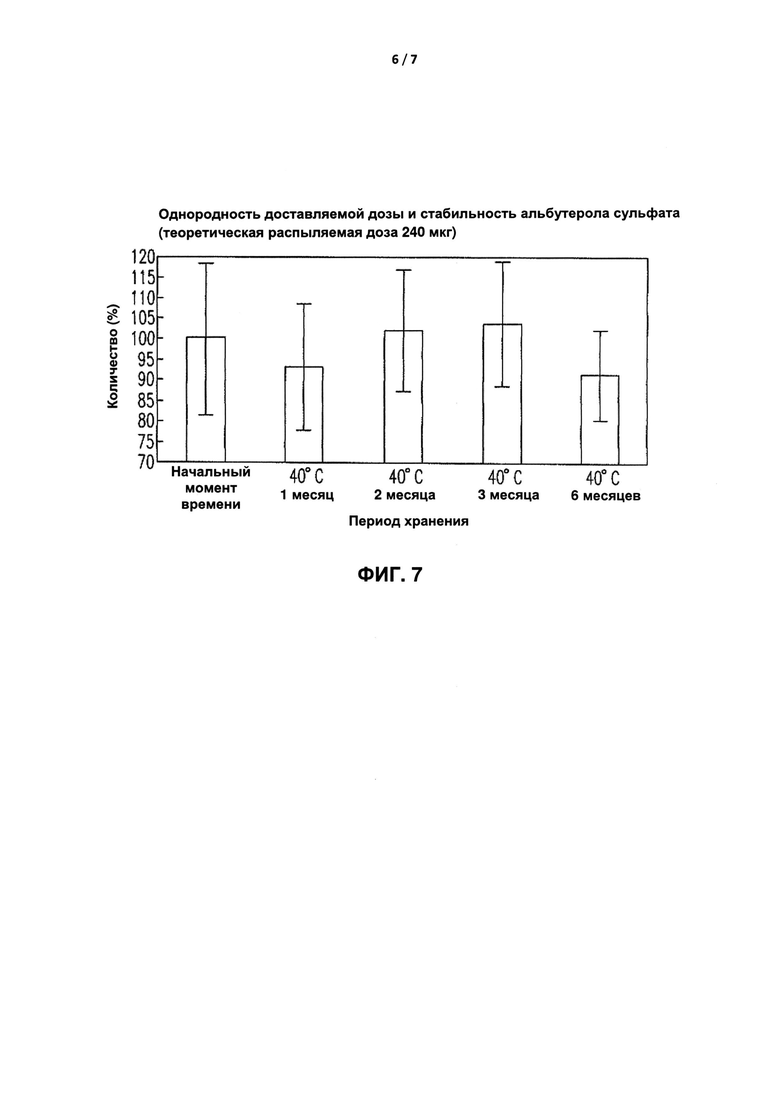
[0037] Фиг. 7 иллюстрирует анализ однородности доставляемой дозы Альбутерола сульфата в спрее состава Примера ГХ, где Альбутерола сульфат при первом распылении имел указанную дозировку 250 мкг. После шестимесячного теста на обеспечение стабильности (40°C и относительная влажность 75%) каждая бутылка спреев, включающая всего десять распылений доставляемых доз, соответствовала требованию, согласно которому основной компонент в одиночном распылении должен составлять менее 25% от указанной дозы и среднее значение должно быть менее 15% от указанной дозы согласно Фармакопее.
[0038] Фиг. 8 иллюстрирует анализ распределения размеров частиц Альбутерола сульфата. После шестимесячного теста на обеспечение стабильности (40°C и относительная влажность 75%) его анализировали с использованием каскадного импактора Next Generation Cascade Impactor на каждом уровне, и значительная разница в количестве Альбутерола сульфата (тест ANOVA, р>0,05) отсутствовала по сравнению с точкой отсчета с другими продуктами на каждом уровне.
[0039] Задачей настоящего изобретения является улучшение стабильности количеств, однородности доставляемой дозы и стабильность качества при получении дозируемой распыляемой дозы под давлением при масштабном производстве. Состав, применяемый в способе получения, будет иметь производственную ценность, особенно когда два основных компонента, имеющие значительные различия в относительных физических и химических свойствах, комбинируют в продукт. Соответственно, настоящее изобретение должно быть защищено по закону. Способ получения дозирующего ингалятора для лечения респираторных заболеваний, предложенный в настоящем изобретении, будет лучше понятен специалисту в данной области техники после прочтения следующих примеров. Однако следует понимать, что настоящее изобретение не ограничивается описанными вариантами реализации. Специалист в данной области техники сможет обеспечить различные варианты реализации в соответствии с сущностью описанных вариантов реализации, которые все находятся в рамках приложенной формулы изобретения в настоящем изобретении.
[0040] Пример способа I:

[0041] Описание способа
[0042] ПЭГ 6000 полностью растворяли в абсолютном этаноле с получением раствора смеси и затем Прокатерол·HCl выливали в указанный раствор смеси и растворяли с помощью ультразвуковой вибрации с получением гомогенизированного раствора. После гомогенного смешивания HFA 227 и гомогенизированного раствора в него медленно добавляли Будесонид. В конце осуществляли холодное наполнение или наполнение под давлением.
[0043] Пример способа II:

[0044] Описание способа
[0045] ПЭГ 400 полностью растворяли в абсолютном этаноле с получением раствора смеси. После гомогенного смешивания HFA 134а и раствора смеси в него медленно добавляли Флутиказон. В конце осуществляли холодное наполнение или наполнение под давлением.
[0046] Пример способа III:

[0047] Описание способа
[0048] ПЭГ 100 полностью растворяли в абсолютном этаноле с получением раствора смеси и затем альбутерола сульфат выливали в указанный раствор смеси и растворяли с помощью ультразвуковой вибрации с получением гомогенизированного раствора. После гомогенного смешивания HFA 227 и гомогенизированного раствора в него медленно добавляли Флутиказон. В конце осуществляли холодное наполнение или наполнение под давлением.
[0049] Пример способа IV:

[0050] Описание способа
[0051] ПЭГ 2000 полностью растворяли в абсолютном этаноле с получением раствора смеси и затем Прокатерол·HCl выливали в указанный раствор смеси и растворяли с помощью ультразвуковой вибрации с получением гомогенизированного раствора. HFA 227 гомогенно смешивали с гомогенизированным раствором. В конце осуществляли холодное наполнение или наполнение под давлением.
[0052] Пример состава I:

[0053] Пример состава II:

[0054] Пример состава III:

[0055] Пример состава IV:

[0056] Пример состава V:

[0057] Пример состава VI:

[0058] Пример состава VII:

[0059] Пример состава VIII:

[0060] Пример состава IX:

[0061] Пример состава X:

[0062] Пример состава XI:

[0063] Варианты реализации
[0064] 1. Способ получения композиции для дозирующего ингалятора,
включающий стадии:
a) смешивание 0,05%-10% (масс./масс.%) спирта с поверхностно-активным веществом с получением первой смеси;
b) диспергирование бета-2-агониста в первой смеси с получением второй смеси;
c) добавление гидрофторалканового (HFA) пропеллента во вторую смесь с получением третьей смеси;
d) диспергирование кортикостероида в третьей смеси; и
e) проведение стадии наполнения.
[0065] 2. Способ получения композиции для дозирующего ингалятора, включающий стадии:
a) смешивание 0,05%-10% (масс./масс.%) спирта с поверхностно-активным веществом с получением первой смеси;
b) диспергирование бета-2-агониста в первой смеси с получением второй смеси;
c) добавление HFA во вторую смесь с получением третьей смеси; и
d) диспергирование кортикостероида в третьей смеси.
[0066] 3. Способ получения композиции для дозирующего ингалятора, включающий стадии:
а) смешивание 0,05%-0,25% (масс./масс.%) спирта с поверхностно-активным веществом с получением первой смеси;
b) диспергирование бета-2-агониста в первой смеси с получением второй смеси; и
c) добавление HFA во вторую смесь с получением третьей смеси.
[0067] 4. Способ согласно варианту реализации 1, в котором указанный кортикостероид включает кортикостероид, выбранный из группы, состоящей из будесонида, флутиказона, беклометазона, циклесонида, флутиказона пропионата, беклометазона дипропионата и их комбинации.
[0068] 5. Способ согласно варианту реализации 1, в котором указанный бета-2-агонист включает агонист, выбранный из группы, состоящей из альбутерола, прокатерола, формотерола, альбутерола сульфата, прокатерола гидрохлорида, формотерола фумарата и их комбинации.
[0069] 6. Способ согласно варианту реализации 1, в котором указанный спиртовой растворитель представляет собой абсолютный этанол.
[0070] 7. Способ согласно варианту реализации 1, в котором стадию смешивания осуществляют с помощью ультразвуковой фильтрации.
[0071] 8. Способ согласно варианту реализации 5, в котором доля добавляемого спиртового растворителя предпочтительно составляет от 0,25% до 2% (масс./масс.%).
[0072] 9. Способ согласно варианту реализации 1, в котором указанное поверхностно-активное вещество включает полиэтиленгликоль (ПЭГ), имеющий молекулярную массу, составляющую от 100 до 6000.
[0073] 10. Способ согласно варианту реализации 9, в котором доля добавленного поверхностно-активного вещества предпочтительно составляет от 0,01% до 2,5%.
[0074] 11. Способ согласно варианту реализации 9, в котором доля добавленного поверхностно-активного вещества предпочтительно составляет от 0,05%-1,5% (масс./масс.%).
[0075] 12. Способ согласно варианту реализации 1, в котором указанный HFA пропеллент включает по меньшей мере один из HFA 134а и HFA 227.
[0076] 13. Способ согласно варианту реализации 12, в котором указанный HFA пропеллент может включать комбинацию HFA 134а и HFA 227.
[0077] 14. Композиция для дозирующего ингалятора, полученная по способу согласно варианту реализации 1, в которой указанную композицию применяют в качестве одного из неотложного лекарственного средства для субъекта, страдающего от приступа астмы, и лекарственного средства в ходе эксцентрической терапии субъекта, причем указанный субъект имеет заболевание, выбранное из астмы и хронической обструктивной болезни легких, и указанное лекарственное средство в ходе эксцентрической терапии вводят указанному субъекту, когда указанный субъект находится в состоянии до или после сна.
[0078] Несмотря на то, что настоящее изобретение было описано с учетом наиболее практичных и предпочтительных в настоящее время вариантов реализации, следует понимать, что настоящее изобретение не ограничивается описанными вариантами реализации. Напротив, оно должно охватывать различные модификации и аналогичные способы в рамках сущности и объема прилагаемой формулы изобретения, которая должна интерпретироваться наиболее широко с целью охватить все такие модификации и аналогичные структуры.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0079] Фиг. 1 представляет собой диаграмму, иллюстрирующую анализ однородности доставляемой дозы Будесонида согласно Примеру состава I.
[0080] Фиг. 2 представляет собой диаграмму, иллюстрирующую анализ однородности доставляемой дозы Прокатерола-HCl согласно Примеру состава I.
[0081] Фиг. 3 представляет собой диаграмму, иллюстрирующую анализ распределения размеров частиц Будесонида согласно Примеру состава I.
1: исполнительный механизм
2: L-горлышко
3: Ступень 1 + Ступень 2
4: Ступень 3
5: Ступень 4
6: Ступень 5
7: Ступень 6 + Ступень 7 + коллектор с микроотверстием (МОС)
[0082] Фиг. 4 представляет собой диаграмму, иллюстрирующую анализ распределения размеров частиц Прокатерола·HCl согласно Примеру состава I.
1: исполнительный механизм
2: L-горлышко
3: Ступень 1 + Ступень 2
4: Ступень 3
5: Ступень 4
6: Ступень 5
7: Ступень 6 + Ступень 7 + коллектор с микроотверстием (МОС)
[0083] Фиг. 5 представляет собой диаграмму, иллюстрирующую анализ однородности доставляемой дозы Флутиказона согласно Примеру состава VII.
[0084] Фиг. 6 представляет собой диаграмму, иллюстрирующую анализ распределения размеров частиц Флутиказона согласно Примеру состава VII.
1: исполнительный механизм
2: L-горлышко
3: Ступень 1
4: Ступень 2
5: Ступень 3
6: Ступень 4
7: Ступень 5
8: Ступень 6
9: Ступень 7
10: коллектор с микроотверстием (МОС)
[0085] Фиг. 7 представляет собой диаграмму, иллюстрирующую анализ однородности доставляемой дозы альбутерола сульфата согласно Примеру состава IX.
[0086] Фиг. 8 представляет собой диаграмму, иллюстрирующую анализ распределения размеров частиц альбутерола сульфата согласно Примеру состава IX.
1: исполнительный механизм
2: L-горлышко
3: Ступень 1
4: Ступень 2
5: Ступень 3
6: Ступень 4
7: Ступень 5
8: Ступень 6
9: Ступень 7
10: коллектор с микроотверстием (МОС)




Настоящее изобретение относится к стабильным составам для дозирующей ингаляции и способу их получения. Активный фармацевтический ингредиент может представлять собой бета-2-агонисты, кортикостероиды или их комбинации. Указанные составы для ингаляции представляют собой гомогенизированные суспензии гидрофторалканового (HFA) пропеллента, этанола в количестве от 0,05 до 10,0% (масс./масс.%) и полиэтиленгликоля (ПЭГ) в качестве суспендирующих агентов и агентов, модифицирующих размер частиц. 4 н. и 16 з.п. ф-лы, 11 пр., 8 ил.
1. Способ получения композиции для дозирующего ингалятора, включающий стадии:
a) смешивание этанола с поверхностно-активным веществом с получением первой смеси, причем содержание этанола составляет от 0,05% до 10,0% (масс./масс. %) от общей массы получаемой композиции для дозирующего ингалятора;
b) добавление бета-2-агониста к первой смеси и диспергирование бета-2-агониста в первой смеси с получением второй смеси;
c) добавление гидрофторалканового (HFA) пропеллента во вторую смесь с получением третьей смеси;
d) добавление кортикостероида к третьей смеси и диспергирование кортикостероида в третьей смеси; и
e) заполнение третьей смеси под давлением в емкость.
2. Способ по п. 1, отличающийся тем, что указанный кортикостероид включает кортикостероид, выбранный из группы, состоящей из будесонида, флутиказона, беклометазона, циклесонида, флутиказона пропионата, беклометазона дипропионата и их комбинации.
3. Способ по п. 1, отличающийся тем, что указанный бета-2-агонист включает агонист, выбранный из группы, состоящей из альбутерола, прокатерола, формотерола, альбутерола сульфата, прокатерола гидрохлорида, формотерола фумарата и их комбинации.
4. Способ по п. 1, отличающийся тем, что содержание этанола составляет от 0,25% до 2,0% (масс./масс. %) от общей массы получаемой композиции для дозирующего ингалятора.
5. Способ по п. 1, отличающийся тем, что указанное поверхностно-активное вещество включает полиэтиленгликоль (ПЭГ), имеющий молекулярную массу, составляющую от 100 до 6000.
6. Способ по п. 1, отличающийся тем, что содержание поверхностно-активного вещества составляет от 0,01% до 2,50% (масс./масс. %) от общей массы получаемой композиции для дозирующего ингалятора.
7. Способ по п. 1, отличающийся тем, что указанный HFA пропеллент включает по меньшей мере один из HFA 134а и HFA 227.
8. Композиция для дозирующего ингалятора, полученная по способу по п. 1, характеризующаяся тем, что указанную композицию применяют в качестве одного из неотложного лекарственного средства для субъекта, страдающего от приступа астмы, и лекарственного средства, применяемого в ходе эксцентрической терапии субъекта, причем указанный субъект имеет заболевание, выбранное из астмы и хронической обструктивной болезни легких, и указанное лекарственное средство, применяемое в ходе эксцентрической терапии, вводят указанному субъекту в момент времени, выбранный из момента времени непосредственно перед тем, когда субъект ложится спать, и момента времени сразу после пробуждения субъекта ото сна.
9. Способ получения композиции для дозирующего ингалятора, включающий стадии:
a) смешивание этанола с поверхностно-активным веществом с получением первой смеси, причем содержание этанола составляет от 0,05% до 10,0% (масс./масс. %) от общей массы получаемой композиции для дозирующего ингалятора;
b) добавление бета-2-агониста, диспергируемого в первой смеси, с получением второй смеси;
c) добавление гидрофторалканового пропеллента ко второй смеси с получением третьей смеси; и
d) добавление кортикостероида, диспергируемого в третьей смеси, с получением композиции для дозирующего ингалятора.
10. Способ по п. 9, дополнительно включающий стадию:
е) ввода третьей смеси под давлением в емкость.
11. Способ по п. 9, отличающийся тем, что указанный кортикостероид включает кортикостероид, выбранный из группы, состоящей из будесонида, флутиказона, беклометазона, циклесонида, флутиказона пропионата, беклометазона дипропионата и их комбинации.
12. Способ по п. 9, отличающийся тем, что указанный бета-2-агонист включает агонист, выбранный из группы, состоящей из альбутерола, прокатерола, формотерола, альбутерола сульфата, прокатерола гидрохлорида, формотерола фумарата и их комбинации.
13. Способ по п. 9, отличающийся тем, что содержание этанола составляет от 0,25% до 2,0% (масс./масс. %) от общей массы получаемой композиции для дозирующего ингалятора.
14. Способ по п. 9, отличающийся тем, что указанное поверхностно-активное вещество включает полиэтиленгликоль (ПЭГ) с молекулярной массой, составляющей от 100 до 6000.
15. Способ по п. 9, отличающийся тем, что содержание поверхностно-активного вещества составляет от 0,01% до 2,50% (масс./масс. %) от общей массы получаемой композиции для дозирующего ингалятора.
16. Способ по п. 9, отличающийся тем, что указанный HFA пропеллент включает по меньшей мере один из HFA 134а и HFA 227.
17. Композиция для дозирующего ингалятора, содержащая:
этанол в количестве 0,05%-1,5% (масс./масс. %) от общей массы композиции для дозирующего ингалятора;
бета-2-агонист в количестве 0%-0,2% (масс./масс. %) от общей массы композиции для дозирующего ингалятора;
гидрофторалкановый (HFA) пропеллент;
кортикостероид в количестве 0%-0,42% (масс./масс. %) от общей массы композиции для дозирующего ингалятора; и
поверхностно-активное вещество в количестве 0,01%-1,5% (масс./масс. %) от общей массы композиции для дозирующего ингалятора, причем указанная композиция для дозирующего ингалятора включает по меньшей мере один бета-2-агонист и кортикостероид.
18. Композиция по п. 17, отличающаяся тем, что указанный кортикостероид включает кортикостероид, выбранный из группы, состоящей из будесонида, флутиказона, беклометазона, циклесонида, флутиказона пропионата, беклометазона дипропионата и их комбинации.
19. Композиция по п. 17, отличающаяся тем, что указанный бета-2-агонист включает агонист, выбранный из группы, состоящей из альбутерола, прокатерола, формотерола, альбутерола сульфата, прокатерола гидрохлорида, формотерола фумарата и их комбинации.
20. Композиция по п. 17, отличающаяся тем, что указанный HFA пропеллент включает по меньшей мере один из HFA 134а и HFA 227.
| 2-Карбометокси-2-фенацилбензтиазолин-1,3,проявляющийпротивовоспалительную активность,и способ егополучения | 1977 |
|
SU625392A1 |
| US 20030032632 A1, 13.02.2003 | |||
| US 2007028381 A, 13.12.2007. | |||
Авторы
Даты
2016-04-20—Публикация
2012-02-14—Подача