Настоящее изобретение относится к новым изохинолоновым и изохинолиновым производным, описанным в формуле изобретения, их получению и применению для лечения и/или профилактики заболеваний, которые связаны с ингибированием Rho-киназы и/или опосредованного Rho-киназой фосфорилирования фосфатазы легкой цепи миозина.
Активация малой RhoA GTPазы при стимуляции агонистом приводит к конверсии RhoA из неактивной GDP-связанной формы в активную GTP-связанную форму с последующим связыванием с и активацией Rho-киназы. Известны две изоформы, Rho-киназа 1 и Rho-киназа 2. Rho-киназа 2 экспрессируется в клетках гладких мышц сосудов и эндотелиальных клетках. Активация Rho-киназы 2 активной GTP-связанной RhoA приводит к сенсибилизации кальция в клетках гладких мышц через опосредованное фосфорилированием ингибирование активности фосфатазы легкой цепи миозина и, посредством этого приводит к повышенной регуляции активности регуляторной легкой цепи миозина (Uehata et al., Nature 1997, 389, 990-994).
Известно, что Rho-киназа вовлечена в сужение кровеносных сосудов, включая развитие миогенного тонуса и чрезмерную сократительную способность гладких мышц (Gokina et al. J. Appl. Physiol. 2005, 98, 1940-8), сокращение гладкой мускулатуры бронхов (Yoshii et al. Am. J. Resp. Cell моль. Biol. 20, 1190-1200), астму (Setoguchi et al. Br J Pharmacol. 2001, 132, 111-8; Nakahara, et al. Eur J 2000, 389, 103) и хроническое обструктивное легочное заболевание (COPD, Maruoka, Nippon Rinsho, 1999, 57, 1982-7), гипертензию, легочную гипертензию (Fukumoto et al. Heart, 91, 391-2, 2005, Mukai et al. Nature 1997, 389, 990-4) и повышенное глазное давление и регуляцию внутриглазного давления (Honjo et al. Invest. Ophthalmol. Visual Sci. 2001, 42, 137-144), эндотелиальную дисфункцию (Steioff et al. Eur. J. Pharmacol. 2005, 512, 247-249), стенокардию (Masumoto et al. Circ 2002, 105, 1545-47, Shimokawa et al. JCP, 2002, 40, 751-761), нефропатию, включая индуцированную гипертензией, не индуцированную гипертензией и диабетическую нефропатию, почечную недостаточность и окклюзивное заболевание периферических артерий (PAOD) (Wakino et al. Drug News Perspect. 2005, 18, 639-43), инфаркт миокарда (Demiryurek et al. Eur J Pharmacol. 2005, 527, 129-40, Hattori et al. Circulation, 2004, 109, 2234-9), сердечную гипертрофию и недостаточность (Yamakawa, et al. Hypertension 2000, 35, 313-318, Liao et al. Am J Physiol Cell Physiol. 2006, 290, C661-8, Kishi et al. Circ 2005, 111, 2741-2747), коронарное заболевание сердца, артериосклероз, рестеноз (Pacaud et al. Arch. Mal. Coeur 2005, 98, 249-254, Retzer, et al. FEBS Lett 2000, 466, 70, Negoro, et al. Biochem Biophys Res Commun 1999, 262, 211), диабет, диабетические осложнения, утилизацию глюкозы и метаболический синдром (Sandu, et al. Diabetes 2000, 49, 2178, Maeda et al. Cell Metab. 2005, 2, 119-29), сексуальную дисфункцию, например, эректильную дисфункцию полового члена (Chitaley et al. Nature Medicine 2001, 7, 119-122), ретинопатию, воспаление, иммунные заболевания, СПИД, остеопороз, эндокринные дисфункции, например гиперальдостеронизм, расстройства центральной нервной системы, такие как дегенерация нервных клеток и повреждение спинного мозга (Hara, et al. JNeurosurg 2000, 93, 94), церебральную ишемию (Uehata, et al. Nature 1997, 389, 990; Satoh et al. Life Sci. 2001, 69, 1441-53; Hitomi, et al. Life Sci 2000, 67, 1929; Yamamoto, et al. J Cardiovasc Pharmacol. 2000, 35, 203-11), церебральный вазоспазм (Sato, et al. Circ Res 2000, 87, 195; Kim, et al. Neurosurgery 2000, 46, 440), боль, например, невропатическую боль (Tatsumi, et al. Neuroscience 2005, 131, 491, Inoue, et al. Nature medicine 2004, 10, 712), бактериальную инфекцию пищеварительного тракта (WO 98/06433), развитие и прогрессирование раковых заболеваний, неоплазию, где было показано, что ингибирование Rho-киназы ингибирует рост раковых клеток и метастазы (Itoh, et al. Nature Medicine 1999, 5, 221; Somlyo, et al. Res Commun 2000, 269, 652), ангиогенез (Uchida, et al. Biochem Biophys Res 2000, 269, 633-40; Gingras, et al. Biochem J 2000, 348, 273), пролиферацию и сократительную способность гладких мышц сосудов (Tammy et al. Circ. Res. 1999, 84, 1186-1193; Tangkijvanich et al. Atherosclerosis 2001, 155, 321-327), эндотелиальную пролиферацию, подвижность и сократительную способность эндотелиальных клеток (Oikawa et al. Biochem. Biophys. Res. Commun. 2000, 269, 633-640), образование стрессовых волокон (Kimura et al. Science 1997, 275, 1308-1311; Yamashiro et al. J. Cell Biol. 2000, 150, 797-806), тромботические заболевания (Kikkawa, et al. FEBS Lett. 2000, 466, 70-74; Bauer et al. Blood 1999, 94, 1665-1672, Klages, et al. J Cell Biol 1999, 144, 745; Retzer, et al. Cell Signal 2000, 12, 645) и агрегацию лейкоцитов (Kawaguchi, et al. Eur J Pharmacol. 2000, 403:203-8; Sanchez-Madrid, et al. J Immunol. 2003, 171:1023-34, Sanchez-Madrid, et al. J Immunol. 2002, 168:400-10), и резорбцию кости (Chellaiah, et al. J Biol Chem. 2003, 278:29086-97), активацию транспортной системы обмена Na/H (Kawaguchi, et al. Eur J Pharmacol. 2000, 403:203-8), болезнь Альцгеймера (Zhou et al. Science 2003, 302, 1215-1217), активацию аддуцина (Fukata et al. J. Biol. Chem., 1998, 273, 5542-5548) и передачу сигнала SREB (связывающий элемент стерольного ответа) и его действие на липидный метаболизм (Lin et al. Circ. Res., 92, 1296-304, 2003).
Поэтому соединение, обладающее эффектом ингибирования
Rho-киназы и/или опосредованного Rho-киназой фосфорилирования фосфатазы легкой цепи миозина, является полезным для лечения и/или профилактики сердечно-сосудистых и не-сердечно-сосудистых заболеваний с вовлечением Rho-киназы как основной и вторичной причины заболевания, например гипертензии, легочной гипертензии, глазной гипертензии, ретинопатии и глаукомы, нарушения периферического кровообращения, окклюзивного заболевания периферических артерий (PAOD), коронарной болезни сердца, стенокардии, гипертрофии сердца, сердечной недостаточности, ишемических заболеваний, ишемической органной недостаточности органа (приводящей в результате к повреждению органа), фиброидного легкого, фиброидной печени, печеночной недостаточности, нефропатии, включая индуцированную гипертензией, не индуцированную гипертензией и диабетическую нефропатию, почечной недостаточности, фиброидной почки, почечного гломерулосклероза, гипертрофии органов, астмы, хронического обструктивного легочного заболевания (COPD), респираторного дистресс-синдрома взрослых, тромботических заболеваний, удара, церебрального вазоспазма, церебральной ишемии, боли, например невропатической боли, дегенерации нервных клеток, повреждения спинного мозга, болезни Альцгеймера, преждевременных родов, эректильной дисфункции, эндокринных дисфункций, артериосклероза, гипертрофии простаты, диабета и осложнений диабета, метаболического синдрома, рестеноза кровеносных сосудов, атеросклероза, воспаления; аутоиммунных заболеваний; СПИДа, остеопатии, такой как остеопороз, нарушения функций мозга, бактериальных инфекций пищеварительного тракта, сепсиса, развитие и прогрессирование рака, например рака молочной железы, толстой кишки, предстательной железы, яичников, головного мозга и легкого и их метастазов.
WO 01/64238 описывает производные изохинолин-5-сульфонамида, необязательно замещенные -(CH2)1-6-O-(CH2)0-6-, -(CH2)0-6-S-(CH2)0-6- или -(CH2)0-6-связанной гетероциклической группой, полезные в качестве нейрозащитных средств.
WO 2004/106325 (Schering AG) описывает пролекарства ингибитора Rho-киназы fasudil, содержащие группу простого или сложного эфира в 1-положении изохинолинового кольца.
WO 2001/039726 в общем виде описывает -O-(C0-C10)алкил-гетероарил-замещенные циклогексильные производные, полезные для лечения бактериальных инфекций.
JP 10087629 A описывает производные изохинолина, полезные для лечения инфекций, вызванных Heliobacter pylori, таких как, например, гастрит, рак или язва; производные изохинолина могут быть замещены группой ОН в 1-положении, и предпочтительно являются 5-замещенными группой X-[(C1-C6)алкилен)]0-1-Y, где X может представлять собой кислород, а Y может представлять собой арил или гетероциклическую группу.
Yoshida et al. (Bioorg. Med. Chem. 1999, 7, 2647-2666) раскрывает 6-бензилоксиизохинолин для лечения инфекций, вызванных Heliobacter pylori.
US 5480883 в общем виде раскрывает в качестве ингибиторов рецептора EGF и/или PDGF соединения, полезные для ингибирования клеточной пролиферации, имеющие формулу “Ar I-X-Ar II”, где X может представлять собой (CHR1)m-Z-(CHR1)n, например, Z-CH2, где Z может представлять собой O, R1 представляет собой водород или алкил, и Ar I может, среди прочего, представлять собой необязательно замещенный изохинолон, и Ar II может, среди прочего, представлять собой необязательно замещенный циклогексил.
WO 2005/030791 (Merck & Co.) в общем виде описывает в качестве ингибиторов калиевого канала для лечения сердечной аритмии, удара, застойной сердечной недостаточности и т.д. изохинолоновые производные, которые, необязательно, являются замещенными в 6-положении группой (CReRf)pOR43, где p может иметь значение 0 и R43, например, представляет собой (C3-C10)циклоалкильный остаток, необязательно замещенный группой NR51R52, где R51 и R52 могут представлять собой водород, (C1-C6)алкил и т.д.; или R43 представляет собой группу R81, определенную как 4-6-членное ненасыщенное или насыщенное моноциклическое гетероциклическое кольцо, содержащее 1, 2, 3 или 4 гетероатома; и замещены непосредственно связанным необязательно замещенным арильным или гетероарильным кольцом в 4-положении.
WO 2005/030130 (Merck & Co.) в общем виде описывает в качестве ингибиторов калиевого канала для лечения сердечной аритмии, удара, застойной сердечной недостаточности и т.д. изохинолоновые производные, которые могут быть замещены гидроксилом в 1-положении и необязательно замещены в 6-положении группой (CReRf)pOR43, где p может иметь значение 0, и R43, например, представляет собой (C3-C10)циклоалкильный остаток, необязательно замещенный группой NR51R52, где R51 и R52 могут представлять собой водород, (C1-C6)алкил и т.д.; или R43 представляет собой группу R81, определенную как 4-6-членное ненасыщенное или насыщенное моноциклическое гетероциклическое кольцо, содержащее 1, 2, 3 или 4 гетероатома; и замещены непосредственно связанным необязательно замещенным арильным или гетероарильным кольцом в 4-положении.
WO 03/053330 (Ube) описывает производные изохинолона формулы

в качестве ингибиторов Rho-киназы.
Один вариант воплощения настоящего изобретения представляет соединение формулы (I)
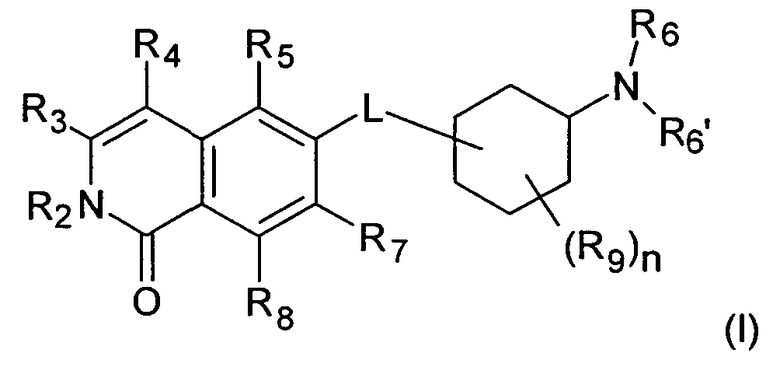
где
R2 представляет собой Н, (C1-C6)алкил, [(C1-C6)алкилен]0-1-R', [(C1-C6)алкилен]0-1-O-(C1-C6)алкил, [(C1-C6)алкилен]0-1-O-R', [(C1-C6)алкилен]0-1-NH2, [(C1-C6)алкилен]0-1-NH(C1-C6)алкил, [(C1-C6)алкилен]0-1-N[(C1-C6)алкил]2, [(C1-C6)алкилен]0-1-CH[R']2, [(C1-C6)алкилен]0-1-C(O)-R', [(C1-C6)алкилен]0-1-C(O)NH2, [(C1-C6)алкилен]0-1-C(O)NH-R', или [(C1-C6)алкилен]0-1-C(O)N[R']2;
R3 представляет собой Н, галоген, CN, (C1-C6)алкил, (C1-C6)алкилен-R', OH, O-R'', NH2, NHR'', NR''R'' или NH-C(O)-R'',
R4 представляет собой Н, галоген, гидрокси, CN, (C1-C6)алкил, (C3-C8)циклоалкил, (C1-C6)алкилен-R';
R5 представляет собой Н, галоген, CN, NO2, (C1-C6)алкил, (C2-C6)алкенил, R', (C1-C6)алкилен-(C6-C10)арил, (C2-C6)алкенилен-(C6-C10)арил, (C1-C6)алкилен-(C5-C10)гетероциклил, NH2, NH-R', NH-SO2H, NH-SO2-(C1-C6)алкил, NH-SO2-R', NH-C(O)-(C1-C6)алкил, NH-C(O)-R', C(O)N[(C1-C6)алкил]2, C(O)OH или C(O)O-(C1-C6)алкил;
R6 и R6', независимо друг от друга, представляют собой H, R', (C1-C8)алкил, (C1-C6)алкилен-R', (C1-C6)алкилен-O-(C1-C6)алкил, (C1-C6)алкилен-O-R', (C1-C6)алкилен-CH[R']2, (C1-C6)алкилен-C(O)-R', (C1-C6)алкилен-C(O)NH2, (C1-C6)алкилен-C(O)NH-R' или (C1-C6)алкилен-C(O)N[R']2;
R7 и R8, независимо друг от друга, представляют собой H, галоген, CN, NO2, (C1-C6)алкил, O-(C1-C6)алкил, O-[(C1-C6)алкилен]0-1-R', (C2-C6)алкенил, R', (C2-C6)алкенилен-(C6-C10)арил, (C1-C6)алкилен-R', NH2, NH-R', NH-SO2H, NH-SO2-(C1-C6)алкил, NH-SO2-R', SO2-NH2, SO2-NHR', NH-C(O)-(C1-C6)алкил, NH-C(O)-R', C(O)N[(C1-C6)алкил]2, C(O)OH или C(O)O-(C1-C6)алкил;
R9 представляет собой галоген или (C1-C6)алкил;
n имеет значение 0, 1, 2, 3 или 4; и
L представляет собой О или O-(C1-C6)алкилен;
где R' представляет собой (C3-C8)циклоалкил, (C5-C10)гетероциклил или (C6-C10)арил; и
R'' представляет собой (C3-C8)циклоалкил, (C5-C10)гетероциклил, (C6-C10)арил, (C1-C6)алкил, (C1-C6)алкилен-R', (C1-C6)алкилен-O-(C1-C6)алкил, (C1-C6)алкилен-O-R', или (C1-C6)алкилен-NRxRy; и
где Rx и Ry, независимо друг от друга, представляют собой (C1-C6)алкил, (C5-C10)гетероциклил, (C6-C10)арил, (C1-C4)алкилен-(C5-C10)гетероциклил, (C1-C4)алкилен-(C6-C10)арил, (C1-C4)алкилен-NH(C1-C6)алкил, (C1-C4)алкилен-N[(C1-C6)алкил]2, (C1-C4)алкилен-N[(C6-C10)арил]2, или (C1-C4)алкилен-N[(C5-C10)гетероциклил]2; и
где в остатках R4, R5, R7 и R8 один атом водорода алкила или алкилена необязательно может быть замещен группой OH, OCH3, COOH, COOCH3, NH2, NHCH3, N(CH3)2, CONH2, CONHCH3 или CON(CH3)2, или алкил или алкилен может быть замещен галогеном один или несколько раз;
или их фармацевтически приемлемые соли и/или стереоизомерные формы и/или физиологически функциональные производные.
В другом варианте воплощения соединения формулы (I) в остатках R4, R5, R7 и R8 один атом водорода алкила или алкилена необязательно может быть замещен группой OH, F, OCH3, COOH, COOCH3, NH2, NHCH3, N(CH3)2, CONH2, CONHCH3 или CON(CH3)2.
Стереоизомерные формы изохинолоновых производных формулы (I) включают соответствующие таутомерные 1-гидрокси-замещенные изохинолиновые производные формулы (I')
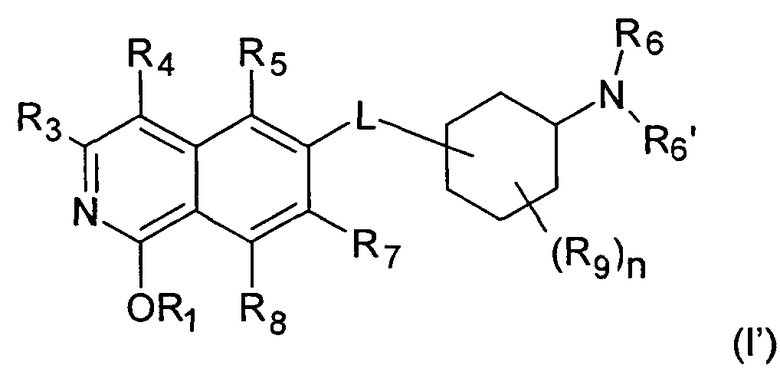
где R1 представляет собой Н, (C1-C6)алкил, (C2-C6)алкенил, (C2-C6)алкинил, [(C1-C6)алкилен]0-1-(C3-C8)циклоалкил, [(C1-C6)алкилен]0-1-(C5-C10)гетероциклил, (C1-C6)алкилен]0-1-(C6-C10)арил, C(O)-(C1-C6)алкил, C(O)(C2-C6)алкенил, C(O)-(C2-C6)алкинил, C(O)-[(C1-C6)алкилен]0-1-(C3-C8)циклоалкил, C(O)-[(C1-C6)алкилен]0-1-(C5-C10)гетероциклил, или C(O)-[(C1-C6)алкилен]0-1-(C6-C10)арил, и
где R3, R4, R5, R6, R6', R7, R8, R9, n и L определены выше.
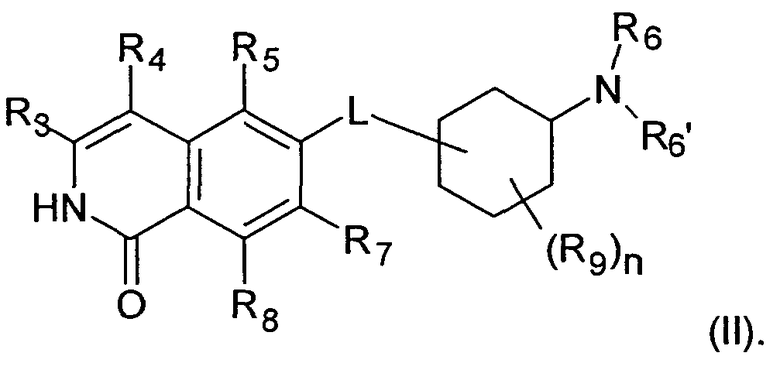
В предпочтительном варианте воплощения, R2 в соединении формулы (I) представляет собой Н, таким образом, соединение охарактеризовано как соединение формулы (II)
В следующем предпочтительном варианте воплощения, R1 в соединении формулы (I') представляет собой Н, таким образом, соединение охарактеризовано как соединение формулы (II')
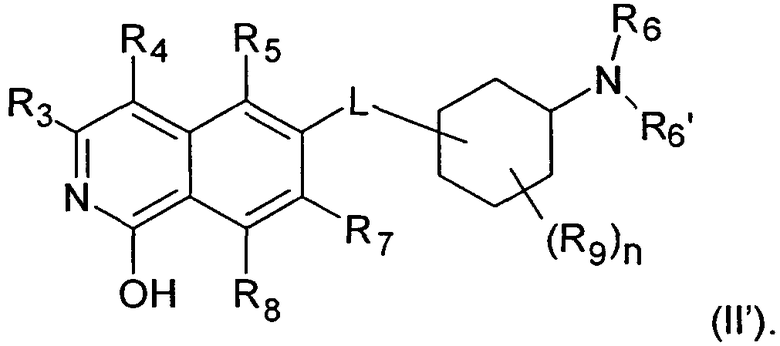
Соединения (II) и (II') представляют собой таутомерные формы друг друга.
Например, соединение, имеющее формулу
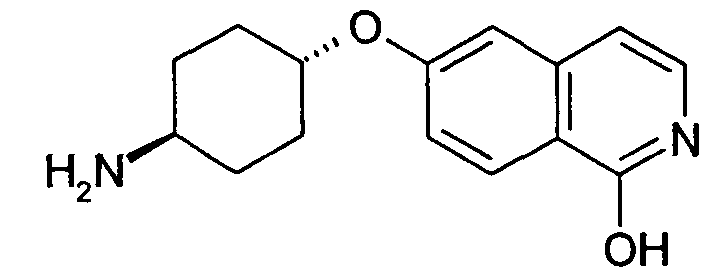
представляет собой таутомерную форму соединения формулы
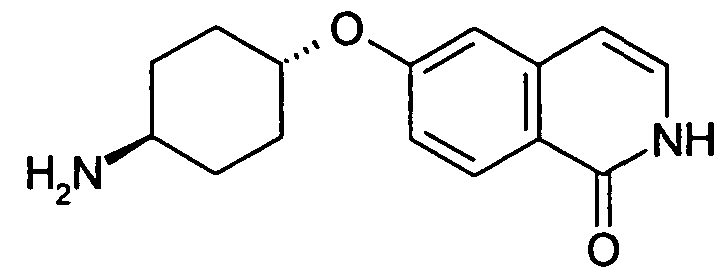
Следующие предпочтительные варианты воплощения относятся к соединениям формулы (I), (I'), (II) и (II'):
R3, предпочтительно, представляет собой H, галоген, (C1-C6)алкил, (C1-C4)алкилен-R', O-R'' или NHR''. Более предпочтительно, R3 представляет собой Н, (C1-C6)алкил или NHR''. Наиболее предпочтительно, R3 представляет собой Н, (C1-C4)алкил, NH-(C5-C6)гетероциклил или NH-фенил, особенно предпочтительно, когда R3 представляет собой Н, (C1-C4)алкил, NH-(C5-C6)гетероарил, содержащий один или несколько N атомов или NH-фенил. В самом предпочтительном варианте, R3 представляет собой H.
Предпочтительно, R4 представляет собой Н, галоген, CN, (C1-C6)алкил, NH-(C6-C10)арил или (C1-C6)алкилен-R'. Более предпочтительно, R4 представляет собой Н, галоген, (C1-C6)алкил, NH-(C6-C10)арил или (C1-C6)алкилен-R'. В более предпочтительном варианте воплощения, R4 представляет собой Н, галоген, (C1-C6)алкил, NH-(C6-C10)арил или (C1-C2)алкилен-(C6-C10)арил. Наиболее предпочтительно, когда R4 представляет собой Н, галоген, или (C1-C6)алкил. Особенно предпочтительно, когда R4 представляет собой Н, галоген или (C1-C6)алкил. Еще более предпочтительно, когда R4 представляет собой H или (C1-C6)алкил. В самом предпочтительном варианте, R4 представляет собой H.
Предпочтительно, R5 представляет собой Н, галоген, CN, (C1-C6)алкил, R', NH-(C6-C10)арил или (C1-C6)алкилен-R'. Более предпочтительно, R5 представляет собой Н, галоген, (C1-C6)алкил, R', NH-(C6-C10)арил или (C1-C6)алкилен-R', в более предпочтительном варианте воплощения, R5 представляет собой Н, галоген, (C6-C10)арил, NH-(C6-C10)арил, (C1-C2)алкилен-(C6-C10)арил, (C1-C6)алкил или (C5-C10)гетероарил. Наиболее предпочтительно, когда R5 представляет собой Н, галоген, фенил, (C1-C6)алкил или (C5-C6)гетероарил. Особенно предпочтительно, когда R5 представляет собой Н, галоген или (C1-C6)алкил. Еще более предпочтительно, когда R5 представляет собой H или галоген. В самом предпочтительном варианте, R5 представляет собой H.
Предпочтительно, R6 и R6', независимо друг от друга, представляют собой H, (C1-C6)алкил, R', (C1-C4)алкилен-(C3-C8)циклоалкил, (C1-C4)алкилен-(C5-C10)гетероциклил, (C1-C4)алкилен-C(O)-(C5-C10)гетероциклил, (C1-C4)алкилен-C(O)-(C6-C10)арил или (C1-C6)алкилен-(C6-C10)арил. В более предпочтительном варианте воплощения, R6 и R6', независимо друг от друга, представляют собой H, (C1-C6)алкил, (C5-C10)гетероциклил, (C3-C8)циклоалкил, (C1-C4)алкилен-(C3-C8)циклоалкил, (C1-C4)алкилен-(C5-C10)гетероциклил или (C1-C6)алкилен-(C6-C10)арил. В еще более предпочтительном варианте воплощения, R6 представляет собой Н, (C1-C6)алкил, (C3-C6)циклоалкил или (C1-C4)алкилен-(C3-C6)циклоалкил, и R6' представляет собой Н, (C1-C6)алкил, (C3-C8)циклоалкил, (C1-C4)алкилен-(C3-C8)циклоалкил, (C5-C10)гетероциклил, (C1-C4)алкилен-(C5-C10)гетероциклил или (C1-C6)алкилен-(C6-C10)арил. В еще более предпочтительном варианте воплощения, R6 представляет собой Н, (C1-C6)алкил и R6' представляет собой Н, (C1-C6)алкил, (C3-C8)циклоалкил, (C1-C4)алкилен-(C3-C8)циклоалкил, (C5-C10)гетероциклил, (C1-C4)алкилен-(C5-C10)гетероциклил или (C1-C6)алкилен-(C6-C10)арил. В еще более предпочтительном варианте воплощения, R6 представляет собой Н, (C1-C6)алкил и R6' представляет собой Н, (C1-C6)алкил, (C3-C8)циклоалкил, (C1-C4)алкилен-(C3-C8)циклоалкил, (C1-C4)алкилен-(C5-C10)гетероциклил, где гетероциклил является незамещенным или замещен (C1-C4)алкилом или галогеном, или представляет собой (C1-C6)алкилен-(C6-C10)арил, где арил является незамещенным или замещен галогеном, (C1-C4)алкил, в частности, CH3 или CF3, O-(C1-C4)алкил, в частности, O-CH3, или SO2-(C1-C4)алкил, в частности, SO2-CH3 или SO2-CF3. В наиболее предпочтительном варианте воплощения, R6 представляет собой Н, (C1-C6)алкил и R6' представляет собой Н, (C1-C6)алкил, (C3-C8)циклоалкил, в еще более предпочтительном варианте воплощения, R6 представляет собой H и R6' представляет собой Н, (C1-C6)алкил, (C3-C8)циклоалкил. Особенно предпочтительно, когда R6 и R6' представляют собой Н. В качестве примеров для этих вариантов воплощения, R6 или R6', независимо друг от друга, представляют собой водород, метил, этил, пропил, изопропил, 3-метилбутил, 2-метилпропил, бутил, пентил, 3,3,3-трифторпропил, 4,4,4-трифторбутил или заместитель, выбранный из группы, включающей
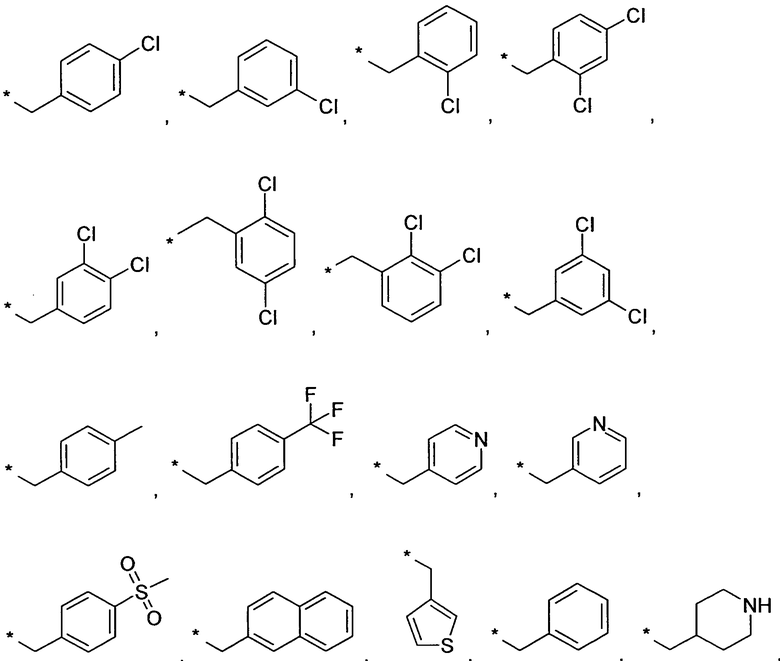
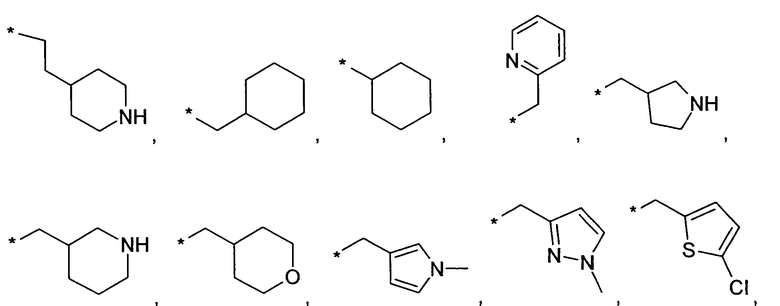
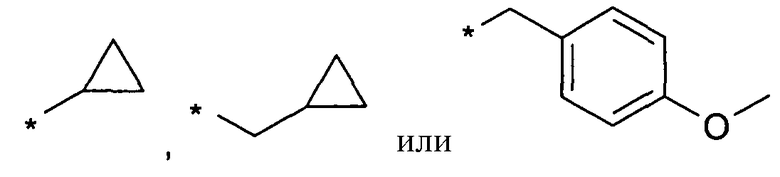
Предпочтительно, R7 и R8, независимо друг от друга, представляют собой H, галоген, CN, (C1-C6)алкил, O-(C1-C6)алкил, (C2-C6)алкенил, R' или (C1-C6)алкилен-(C3-C8)циклоалкил. Более предпочтительно, R7 и R8, независимо друг от друга, представляют собой H, галоген, CN, (C1-C4)алкил, O-(C1-C4)алкил, (C2-C4)алкенил, фенил, (C3-C6)циклоалкил, (C1-C4)алкилен-(C3-C6)циклоалкил или (C5-C6)гетероарил. Еще более предпочтительно, R7 и R8, независимо друг от друга, представляют собой H, галоген, (C1-C4)алкил, O-(C1-C4)алкил или (C3-C6)циклоалкил. Наиболее предпочтительно, R7 представляет собой Н, галоген, (C1-C4)алкил или (C3-C6)циклоалкил и R8 представляет собой Н. Особенно предпочтительно, R7 и R8 представляют собой H.
R9, предпочтительно, представляет собой галоген или (C1-C4)алкил. Более предпочтительно, R9 представляет собой Cl, F, метил или этил.
Предпочтительно, n имеет значение 0, 1, 2 или 3. Более предпочтительно, n имеет значение 0 или 1. Наиболее предпочтительно, n имеет значение 0.
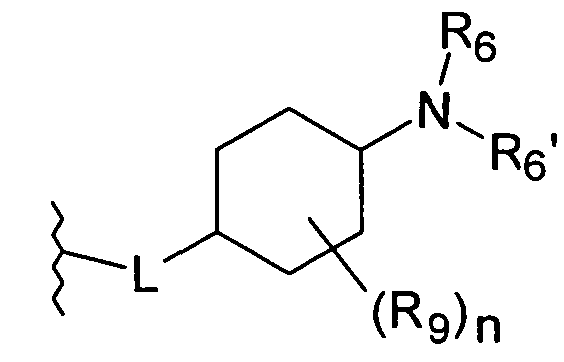
Линкерная группа L может быть связана с циклогексильным кольцом в любом положении через атом углерода циклогексильного кольца и, таким образом, может образовывать цис- или транс-стереоизомер соединения по настоящему изобретению.
В предпочтительном варианте воплощения, L присоединен в 4-положении циклогексильного кольца
 или
или
L присоединен в 3-положении циклогексильного кольца
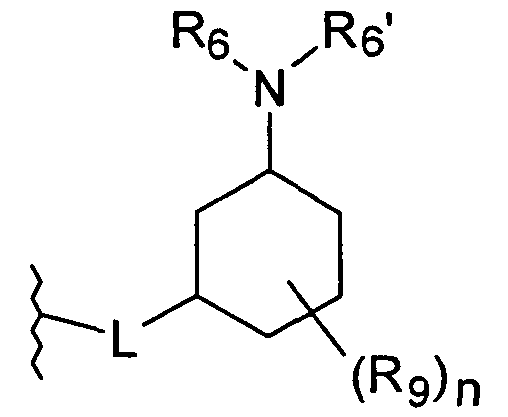
во всех их стереоизомерных формах.
В особенно предпочтительном варианте воплощения, L присоединен в 4-положении циклогексильного кольца.
Предпочтительно, L представляет собой О-метилен, O-этилен или O. Более предпочтительно, L представляет собой О-метилен, O-этилен или, наиболее предпочтительно, O присоединен в 4-положении циклогексильного кольца.
Наиболее предпочтительно, L представляет собой О.
В предпочтительных вариантах воплощения настоящего изобретения одна или несколько или все группы, содержащиеся в соединениях формул (I) или (I'), могут независимо друг от друга иметь любое из предпочтительных, более предпочтительных или наиболее предпочтительных определений групп, указанных выше, или любое одно или несколько из конкретных значений, которые включены в определения групп и указаны выше, при этом все комбинации предпочтительных определений, более предпочтительных или наиболее предпочтительных и/или конкретных определений, являются объектом настоящего изобретения. Также, относительно всех предпочтительных вариантов воплощения, настоящее изобретение включает соединения формул (I) или (I') во всех стереоизомерных формах и смеси стереоизомерных форм, в любых соотношениях, и/или их физиологически приемлемые соли.
Предпочтительный вариант воплощения настоящего изобретения представляет соединение формул (I), (I'), (II) или (II'), где
R3 представляет собой Н, галоген, CN, (C1-C6)алкил, (C1-C6)алкилен-R', OH, O-R'', NH2, или NHR'';
R4 представляет собой Н, галоген, гидрокси, CN, (C1-C6)алкил, (C3-C8)циклоалкил, (C1-C6)алкилен-R';
R5 представляет собой Н, галоген, CN, NO2, (C1-C6)алкил, (C2-C6)алкенил, R', (C1-C6)алкилен-(C6-C10)арил, (C2-C6)алкенилен-(C6-C10)арил, (C1-C6)алкилен-(C5-C10)гетероциклил, NH2, NH-R', NH-SO2H, NH-SO2-(C1-C6)алкил, NH-SO2-R', NH-C(O)-(C1-C6)алкил, NH-C(O)-R', C(O)N[(C1-C6)алкил]2, C(O)OH или C(O)O-(C1-C6)алкил;
R6 и R6', независимо друг от друга, представляют собой H, (C3-C8)циклоалкил, (C1-C8)алкил, (C1-C6)алкилен-R', (C1-C6)алкилен-O-(C1-C6)алкил, (C1-C6)алкилен-O-R', (C1-C6)алкилен-CH[R']2, (C1-C6)алкилен-C(O)NH2, (C1-C6)алкилен-C(O)NH-R' или (C1-C6)алкилен-C(O)N[R']2;
R7 и R8, независимо друг от друга, представляют собой H, галоген, CN, NO2, (C1-C6)алкил, (C2-C6)алкенил, R', (C2-C6)алкенилен-(C6-C10)арил, (C1-C6)алкилен-R', NH2, NH-R', NH-SO2-(C1-C6)алкил, NH-SO2-R', SO2-NH2, SO2-NHR', NH-C(O)-(C1-C6)алкил, NH-C(O)-R', C(O)N[(C1-C6)алкил]2, C(O)OH или C(O)O-(C1-C6)алкил;
R9 представляет собой галоген или (C1-C6)алкил;
n имеет значение 0, 1, 2; и
L представляет собой О или O-(C1-C3)алкилен;
где R1, R2, R', R'', Rx и Ry определены выше;
или их фармацевтически приемлемые соли и/или стереоизомерные формы и/или физиологически функциональные производные.
Следующий предпочтительный вариант воплощения настоящего изобретения представляет соединение формул (I), (I'), (II) или (II'), где
R3 представляет собой Н, галоген, CN, (C1-C6)алкил, (C1-C2)алкилен-R' или NHR'';
R4 представляет собой Н, галоген, CN, (C1-C6)алкил, (C3-C8)циклоалкил, (C1-C2)алкилен-R';
R5 представляет собой Н, галоген, CN, NO2, (C1-C6)алкил, (C2-C6)алкенил, R', (C1-C6)алкилен-(C6-C10)арил, (C2-C6)алкенилен-(C6-C10)арил, (C1-C6)алкилен-(C5-C10)гетероциклил, NH2, NH-R', NH-C(O)-(C1-C6)алкил, или C(O)N[(C1-C6)алкил]2;
R6 и R6', независимо друг от друга, представляют собой H, (C3-C8)циклоалкил, (C1-C8)алкил, или (C1-C3)алкилен-R';
R7 и R8, независимо друг от друга, представляют собой H, галоген, CN, NO2, (C1-C6)алкил, (C2-C6)алкенил, R', (C2-C3)алкенилен-(C6-C10)арил, (C1-C3)алкилен-R', NH-R', NH-SO2-(C1-C6)алкил, или SO2-NH2;
R9 представляет собой галоген или (C1-C6)алкил;
n имеет значение 0 или 1; и
L представляет собой О или O-метилен;
где R1, R2, R', R'', Rx и Ry определены выше;
или их фармацевтически приемлемые соли и/или стереоизомерные формы и/или физиологически функциональные производные.
Наиболее предпочтительный вариант воплощения настоящего изобретения представляет соединение формул (I), (I'), (II) или (II'), где
R3 представляет собой Н, галоген, CN, (C1-C6)алкил, (C1-C2)алкилен-R' или NHR'';
R4 представляет собой Н, галоген, CN, (C1-C4)алкил, (C3-C6)циклоалкил, (C1-C2)алкилен-R';
R5 представляет собой Н, галоген, CN, NO2, (C1-C6)алкил, (C2-C6)алкенил, R', (C1-C6)алкилен-(C6-C10)арил, (C2-C6)алкенилен-(C6-C10)арил, (C1-C6)алкилен-(C5-C10)гетероциклил, NH-R';
R6 представляет собой Н, (C3-C6)циклоалкил или (C1-C4)алкил;
R6' представляет собой Н, (C3-C8)циклоалкил, (C1-C8)алкил, или (C1-C3)алкилен-R';
R7 и R8, независимо друг от друга, представляют собой H, галоген, CN, NO2, (C1-C6)алкил, (C2-C6)алкенил, R', (C2-C3)алкенилен-(C6-C10)арил, (C1-C3)алкилен-R', NH-SO2-(C1-C6)алкил или SO2-NH2;
R9 представляет собой галоген или (C1-C4)алкил;
n имеет значение 0 ; и
L представляет собой О;
где R1, R2, R', R'', Rx и Ry определены выше;
или их фармацевтически приемлемые соли и/или стереоизомерные формы и/или физиологически функциональные производные.
В другом наиболее предпочтительном варианте воплощения настоящее изобретения представляет соединение формул (I), (I'), (II) или (II'), где
R3 представляет собой Н, галоген, (C1-C6)алкил;
R4 представляет собой Н, галоген, (C1-C4)алкил;
R5 представляет собой Н, галоген, (C1-C6)алкил;
R6 представляет собой Н, (C3-C8)циклоалкил, или (C1-C8)алкил;
R6' представляет собой Н, (C3-C8)циклоалкил, (C1-C8)алкил, или (C1-C3)алкилен-R';
R7 и R8, независимо друг от друга, представляют собой H, галоген, CN, (C1-C6)алкил или SO2-NH2;
R9 представляет собой галоген или (C1-C4)алкил;
n имеет значение 0 ; и
L представляет собой О;
где R1, R2, и R' определены выше;
или их фармацевтически приемлемые соли и/или стереоизомерные формы и/или физиологически функциональные производные.
Как в любом варианте воплощения изобретения, в описанных выше вариантах воплощения, которые содержат предпочтительные, более предпочтительные, наиболее предпочтительные или приведенные в качестве примера определения соединений по настоящему изобретению, одна или несколько или все группы могут иметь любое из их предпочтительных, более предпочтительных или наиболее предпочтительных определений, указанных выше, или любое одно или несколько конкретных значений, которые включены в определения групп и указаны выше.
Физиологически приемлемые соли соединений формулы (I) или (I') представляют собой как их органические, так и неорганические соли, как описано в Remington's Pharmaceutical Sciences (17th edition, page 1418 (1985)). Из-за физической и химической стабильности и растворимости, предпочтительными являются кислотные группы, среди прочего, для солей натрия, калия, кальция и аммония; предпочтительными являются оснόвные группы, среди прочего, для солей малеиновой кислоты, фумаровой кислоты, янтарной кислоты, яблочной кислоты, винной кислоты, метилсульфоновой кислоты, хлористоводородной кислоты, серной кислоты, фосфорной кислоты или карбоновых кислот или сульфоновых кислот, например, таких как гидрохлориды, гидробромиды, фосфаты, сульфаты, метансульфонаты, ацетаты, лактаты, малеаты, фумараты, малаты, глюконаты и соли аминокислот, природных оснований или карбоновых кислот. Получение физиологически приемлемых солей из соединений формулы (I) и (I'), которые являются способными к образованию соли, включая их стереоизомерные формы, осуществляют способом, известным per se. Соединения формулы (I) образуют стабильные соли со щелочными металлами, щелочноземельными металлами или необязательно замещенные аммониевые соли с оснόвными реагентами, такими как гидроксиды, карбонаты, бикарбонаты, алкоголяты и аммониевые или органические основания, например триметил- или триэтиламин, этаноламин, диэтаноламин или триэтаноламин, трометамол, а также оснόвные аминокислоты, например лизин, орнитин или аргинин. Когда соединения формул (I)или (I') имеют оснόвные группы, также могут быть получены устойчивые кислотно-аддитивные соли с сильными кислотами. Подходящие фармацевтически приемлемые кислотно-аддитивные соли соединений по настоящему изобретению представляют собой соли неорганических кислот, таких как хлористоводородная кислота, бромистоводородная, фосфорная, метафосфорная, азотная и серная кислота, и органических кислот, таких как, например, уксусная кислота, бензолсульфоновая, бензойная, лимонная, этансульфоновая, фумаровая, глюконовая, гликолевая, изетионовая, молочная, лактобионовая, малеиновая, яблочная, метансульфоновая, янтарная, п-толуолсульфоновая и винная кислота.
Соли с физиологически неприемлемым анионом, таким как, например, трифторацетат, также являются подходящим в рамках данного изобретения в качестве полезных промежуточных соединений для получения или очистки фармацевтически приемлемых солей и/или для использования в нетерапевтических применениях, например in vitro.
Термин “физиологически функциональное производное”, используемый в данном описании, относится к любому физиологически приемлемому производному соединения формул (I) или (I') по настоящему изобретению, например N-оксиду, которое при введении млекопитающему, такому как, например, человек, может образовывать (прямо или опосредованно) соединение формулы (I) или (I') или его активный метаболит.
Физиологически функциональные производные включают пролекарства соединений по настоящему изобретению, такие как описанные, например, в H. Okada et al., Chem. Pharm. Bull. 1994, 42, 57-61. Такие пролекарства могут быть метаболизированы in vivo в соединение настоящего изобретения. Эти пролекарства могут быть активными как таковые или неактивными.
Изобретение относится к соединениям формул (I) или (I') в форме их рацематов, рацемических смесей и чистых энантиомеров и к их диастереомерам и их смесям.
Если радикалы или заместители встречаются более одного раза в соединениях формулы (I) или (I'), то все они могут, независимо один от другого, иметь указанное значение и быть одинаковыми или отличными друг от друга.
Соединения настоящего изобретения также могут существовать в различных полиморфных формах, например, таких как аморфные и кристаллические полиморфные формы. Все полиморфные формы соединений настоящего изобретения являются подходящими в рамках настоящего изобретения и представляют собой еще один аспект настоящего изобретения.
Все ссылки на “соединение(соединения) формулы (I)” или на “соединение(соединения) формулы (I')”, приведенные далее, относятся к соединению(ям) формулы (I) или (I'), как описано выше, и их физиологически приемлемым солям, сольватам и физиологически функциональным производным, как описано в настоящей заявке.
Должно быть понятно, что термин алкил, и соответствующие алкиленовые заместители означают углеводородный остаток, который может быть линейным, т.е. с прямой цепью, или разветвленным и содержит 1, 2, 3, 4, 5 или 6 атомов углерода, соответственно, как это является подходящим. Это также применимо, когда алкильная группа присутствует в качестве заместителя в другой группе, например, в группе алкокси (O-алкил), S-алкил или -O(C1-C6)алкилен-O-, алкоксикарбонильной группе или арилалкильной группе. Примерами алкильных групп являются метил, этил, пропил, бутил, пентил или гексил, н-изомеры всех этих групп, изопропил, изобутил, 1-метилбутил, изопентил, неопентил, 2,2-диметилбутил, 2-метилпентил, 3-метилпентил, изогексил, втор-бутил, трет-бутил или трет-пентил. Алкильные группы могут, если не указано иное, быть галогенированными один или более раз, т.е. алкильные группы могут быть фторированы, например, перфторированы. Примерами галогенированных алкильных групп являются CF3 и CH2CF3, OCF3, SCF3 или -O-(CF2)2-O-.
Алкенил представляет собой, например, винил, 1-пропенил, 2-пропенил (= аллил), 2-бутенил, 3-бутенил, 2-метил-2-бутенил, 3-метил-2-бутенил, 5-гексенил или 1,3-пентадиенил.
Алкинил представляет собой, например, этинил, 1-пропинил, 2-пропинил (= пропаргил) или 2-бутинил.
Галоген означает фтор, хлор, бром или йод.
(C3-C8)циклоалкильные группы представляют собой циклические алкильные группы, содержащие 3, 4, 5, 6, 7 или 8 атомов углерода в кольце, такие как циклопропил, циклобутил, циклопентил, циклогексил или циклооктил, которые также могут быть замещенными и/или содержать 1 или 2 двойные связи (ненасыщенные циклоалкильные группы), например, циклопентенил или циклогексенил могут быть связаны через любой углеродный атом.
(C6-C10)арильная группа означает ароматическое кольцо или кольцевую систему, которая содержит два ароматических кольца, которые являются конденсированными или связанными иным образом, например, фенильная, нафтильная, бифенильная, тетрагидронафтильная, альфа- или бета-тетралон-, индалин- или индан-1-он-ильная группа. Предпочтительной (C6-C10)арильной группой является фенил.
(C5-C10)гетероциклильная группа означает моно- или бициклическую кольцевую систему, которая включает в себя, помимо углерода, один или несколько гетероатомов, таких как, например, 1, 2 или 3 атома азота, 1 или 2 атома кислорода, 1 или 2 атома серы, или комбинации различных гетероатомов. Гетероциклильные остатки могут быть связаны в любых положениях, например в 1-положении, 2-положении, 3-положении, 4-положении, 5-положении, 6-положении, 7-положении или 8-положении. (C5-C10)гетероциклильные группы могут быть (1) ароматическими [= гетероарильные группы] или (2) насыщенными или (3) смешанными ароматическими/насыщенными.
Подходящие (C5-C10)гетероциклильные группы включают акридинил, азоцинил, бензимидазолил, бензофурил, бензоморфолинил, бензотиенил, бензотиофенил, бензоксазолил, бензтиазолил, бензтриазолил, бензтетразолил, бензизоксазолил, бензизотиазолил, карбазолил, 4aH-карбазолил, карболинил, фуранил, хиназолинил, хинолинил, 4H-хинолизинил, хиноксалинил, хинуклидинил, хроманил, хроменил, хромен-2-онил, циннолинил, декагидрохинолинил, 2H,6H-1,5,2-дитиазинил, дигидрофуро[2,3-b]-тетрагидрофуран, фурил, фуразанил, гомоморфолинил, гомопиперазинил, имидазолидинил, имидазолинил, имидазолил, 1H-индазолил, индолинил, индолизинил, индолил, 3H-индолил, изобензофуранил, изохроманил, изоиндазолил, изоиндолинил, изоиндолил, изохинолинил (бензимидазолил), изотиазолил, изоксазолил, морфолинил, нафтиридинил, октагидроизохинолинил, оксадиазолил, 1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил, 1,3,4-оксадиазолил, оксазолидинил, оксазолил, оксазолидинил, пиримидинил, фенантридинил, фенантролинил, феназинил, фенотиазинил, феноксатиинил, феноксазинил, фталазинил, пиперазинил, пиперидинил, пролинил, птеридинил, пуринил, пиранил, пиразинил, пироазолидинил, пиразолинил, пиразолил, пиридазинил, пиридонил, пиридооксазолы, пиридоимидазолы, пиридотиазолы, пиридинил, пиридил, пиримидинил, пирролидинил, пирролинил, 2H-пирролил, пирролил, тетрагидрофуранил, тетрагидроизохинолинил, тетрагидрохинолинил, 6H-1,2,5-тиадазинил, тиазолил, 1,2,3-тиадиазолил, 1,2,4-тиадиазолил, 1,2,5-тиадиазолил, 1,3,4-тиадиазолил, тиенил, триазолил, тетразолил и ксантенил. Пиридил означает как 2-, 3-, так и 4-пиридил. Тиенил означает как 2-, так и 3-тиенил. Фурил означает как 2-, так и 3-фурил. Также включены соответствующие N-оксиды этих соединений, например, 1-окси-2-, 3- или 4-пиридил.
Замещения в (C5-C10)гетероциклильных остатках могут иметь место по свободным атомам углерода или по атомам азота.
Предпочтительными примерами (C5-C10)гетероциклильных остатков являются пиразинил, пиридил, пиримидинил, пиразолил, морфолинил, пирролидинил, пиперазинил, пиперидинил, тиенил, бензофурил, хинолинил, тетразолил и триазолил.
(C6-C10)арильные и (C5-C10)гетероциклильные группы являются незамещенными или, если не укзано иное, замещены один или несколько раз подходящими группами, независимо выбранными из галогена, CF3, NO2, N3, CN, C(O)-(C1-C6)алкила, C(O)-(C1-C6)арила, COOH, COO(C1-C6)алкила, CONH2, CONH(C1-C6)алкила, CON[(C1-C6)алкил]2, (C3-C8)циклоалкила, (C1-C6)алкила, (C1-C6)алкилен-OH, (C1-C6)алкилен-NH2, (C1-C6)алкилен-NH(C1-C6)алкила, (C1-C6)алкилен-N[(C1-C6)алкил]2, (C2-C6)алкенила, (C2-C6)алкинила, O-(C1-C6)алкила, O-C(O)-(C1-C6)алкила, O-C(O)-(C6-C10)арила, O-C(O)-(C5-C10)гетероциклила, PO3H2, SO3H, SO2-NH2, SO2NH(C1-C6)алкила, SO2N[(C1-C6)алкил]2, S-(C1-C6)алкила; S-(C1-C6)алкилен-(C6-C10)арила, S-(C1-C6)алкилен-(C5-C10)гетероциклила, SO-(C1-C6)алкила, SO-(C1-C6)алкилен-(C6-C10)арила, SO-(C1-C6)алкилен-(C5-C10)гетероциклила, SO2-(C1-C6)алкила, SO2-(C1-C6)алкилен-(C6-C10)арила, SO2-(C1-C6)алкилен-(C5-C10)гетероциклила, (SO2-NH(C1-C6)алкилен-(C6-C10)арила, SO2-NH(C1-C6)алкилен-(C5-C10)гетероциклила, SO2-N[(C1-C6)алкил][(C1-C6)алкилен-(C6-C10)арил], SO2-N[(C1-C6)алкил][(C1-C6)алкилен-(C5-C10)гетероциклил], SO2-N[(C1-C6)алкилен-(C6-C10)арил]2, SO2-N[(C1-C6)алкилен-(C5-C10)гетероциклил]2, C(NH)(NH2), NH2, NH-(C1-C6)алкила, N[(C1-C6)алкил]2, NH-C(O)-(C1-C6)алкила, NH-C(O)O-(C1-C6)алкила, NH-C(O)-(C6-C10)арила, NH-C(O)-(C5-C10)гетероциклила, NH-C(O)O-(C6-C10)арила, NH-C(O)O-(C5-C10)гетероциклила, NH-C(O)-NH-(C1-C6)алкила, NH-C(O)-NH-(C6-C10)арила, NH-C(O)-NH-(C5-C10)гетероциклила, NH-SO2-(C1-C6)алкила, NH-SO2-(C6-C10)арила, NH-SO2-(C5-C10)гетероциклила, N(C1-C6)алкил-C(O)-(C1-C6)алкила, N(C1-C6)алкил-C(O)O-(C1-C6)алкила, N(C1-C6)алкил-C(O)-(C6-C10)арила, N(C1-C6)алкил-C(O)-гетероциклила, N(C1-C6)алкил-C(O)O-(C6-C10)арила, N(C1-C6)алкил-C(O)O-(C5-C10)гетероциклила, N(C1-C6)алкил-C(O)-NH-(C1-C6)алкил], N(C1-C6)алкил-C(O)-NH-(C6-C10)арила, N(C1-C6)алкил-C(O)-NH-(C5-C10)гетероциклила, N[(C1-C6)алкил]-C(O)-N[(C1-C6)алкил]2, N[(C1-C6)алкил]-C(O)-N[(C1-C6)алкил]-(C6-C10)арила, N[(C1-C6)алкил]-C(O)-N[(C1-C6)алкил]-(C5-C10)гетероциклила, N[(C1-C6)алкил]-C(O)-N[(C6-C10)арил]2, N[(C1-C6)алкил]-C(O)-N[(C5-C10)гетероциклил]2, N[(C6-C10)арил]-C(O)-(C1-C6)алкила, N[(C5-C10)гетероциклил]-C(O)-(C1-C6)алкила, N[(C6-C10)арил]-C(O)O-(C1-C6)алкила, N[(C5-C10)гетероциклил]-C(O)O-(C1-C6)алкила, N(арил)-C(O)-(C6-C10)арила, N[(C5-C10)гетероциклил]-C(O)-(C6-C10)арила, N[(C6-C10)арил]-C(O)O-(C6-C10)арила, N[(C5-C10)гетероциклил]-C(O)O-(C6-C10)арила, N[(C6-C10)арил]-C(O)-NH-(C1-C6)алкила, N[(C5-C10)гетероциклил]-C(O)-NH-(C1-C6)алкила, N(арил)-C(O)-NH-(C6-C10)арила, N[(C5-C10)гетероциклил]-C(O)-NH-(C6-C10)арила, N[(C6-C10)арил]-C(O)-N[(C1-C6)алкил]2, N[(C5-C10)гетероциклил]-C(O)-N[(C1-C6)алкил]2, N[(C6-C10)арил]-C(O)-N[(C1-C6)алкил]-(C6-C10)арила, N[(C5-C10)гетероциклил]-C(O)-N[(C1-C6)алкил]-(C6-C10)арила, N[(C6-C10)арил]-C(O)-N[(C6-C10)арил]2, N[(C5-C10)гетероциклил]-C(O)-N[(C6-C10)арил]2, (C6-C10)арила, (C1-C6)алкилен-(C6-C10)арила, O-(C1-C6)алкилен-(C6-C10)арила, (C5-C10)гетероциклила, (C1-C6)алкилен-(C5-C10)гетероциклила, O-(C1-C6)алкилен-(C5-C10)гетероциклила, где (C6-C10)арил или (C5-C10)гетероциклил могут быть замещены 1-3 раза галогеном, OH, NO2, CN, O-(C1-C6)алкилом, (C1-C6)алкилом, NH2, NH(C1-C6)алкилом, N[(C1-C6)алкил]2, SO2CH3, COOH, C(O)O-(C1-C6)алкилом, CONH2, (C1-C6)алкилен-O-(C1-C6)алкилом, (C1-C6)алкилен-O-(C6-C10)арилом, O-(C1-C6)алкилен-(C6-C10)арилом; или где (C6-C10)арил является вицинально замещенным группой O-(C1-C4)алкилен-O, с образованием, таким образом, 5-8-членного кольца вместе с атомами углерода, с которыми связаны атомы кислорода. Арильные или гетероциклильные заместители в (C6-C10)арильных и (C5-C10)гетероциклильных группах могут не быть дополнительно замещенными арил- или гетероциклил-содержащей группой.
В случае замещения, предпочтительными заместителями для (C6-C10)арильных групп являются (C1-C4)алкил, O-(C1-C4)алкил, O-фенил, C(O)O-(C1-C6)алкил, C(O)OH, C(O)-(C1-C4)алкил, галоген, NO2, SO2NH2, CN, SO2-(C1-C4)алкил, NH-SO2-(C1-C4)алкил, NH2, NH-C(O)-(C1-C4)алкил, (C3-C8)циклоалкил, (C1-C4)алкил-OH, C(O)N[(C1-C4)алкил]2, C(O)NH2, N[(C1-C4)алкил]2, (C1-C4)алкенилен-(C6-C10)арил, где (C6-C10)арил может быть дополнительно замещен (C1-C4)алкилом, (C1-C4)алкилен-O-(C1-C6)алкилом, O-(C1-C6)алкил-(C6-C10)арилом, или может быть вицинально замещенным группой O-(C1-C4)алкилен-O, с образованием, таким образом, 5-8-членного кольца вместе с атомами углерода, с которыми связаны атомы кислорода. Более предпочтительными заместителями для (C1-C6)алкилен-(C6-C10)арила являются галоген, (C1-C4)алкил, в частности, CH3 или CF3, O-(C1-C4)алкил, в частности, O-CH3, или SO2-(C1-C4)алкил, в частности, SO2-CH3 или SO2-CF3.
В монозамещенных фенильных группах заместитель может находиться в 2-положении, 3-положении или 4-положении, где 3-положение и 4-положение являются предпочтительными. Если фенильная группа содержит два заместителя, они могут находиться в 2,3-положении, 2,4-положении, 2,5-положении, 2,6-положении, 3,4-положении или 3,5-положении. В фенильных группах, содержащих три заместителя, эти заместители могут находиться в 2,3,4-положении, 2,3,5-положении, 2,3,6-положении, 2,4,5-положении, 2,4,6-положении или 3,4,5-положении.
Приведенные выше указания, относящиеся к фенильным группам, соответственно применимы к двухвалентным группам, являющимся производными фенильных групп, т.е. к фенилену, который может представлять собой незамещенный или замещенный 1,2-фенилен, 1,3-фенилен или 1,4-фенилен. Приведенные выше указания также соответственно применимы к арильной подгруппе в арилалкиленовых группах. Примерами арилалкиленовых групп, которые также могут быть незамещенными или замещенными как в арильной подгруппе, так и в алкиленовой подгруппе, являются бензил, 1-фенилэтилен, 2-фенилэтилен, 3-фенилпропилен, 4-фенилбутилен, 1-метил-3-фенилпропилен.
В случае замещения, предпочтительными заместителями для (C5-C10)гетероциклильных групп являются (C1-C4)алкил, O-(C1-C4)алкил, (C1-C4)алкиленфенил, галоген, (C1-C4)алкилен-O-(C1-C4)алкил, (C5-C10)гетероциклил, (C1-C4)алкилен-N[(C1-C4)алкил]2, или (C6-C10)арил, где (C6-C10)арил может быть дополнительно замещен (C1-C4)алкилом, (C1-C4)алкилен-O-(C1-C6)алкилом, O-(C1-C6)алкил-(C6-C10)арилом, или может быть вицинально замещенным группой O-(C1-C4)алкилен-O, с образованием, таким образом, 5-8-членного кольца вместе с атомами углерода, с которыми связаны атомы кислорода. Более предпочтительными заместителями для (C5-C10)гетероциклильных групп являются (C1-C4)алкил или галоген.
Основные и предпочтительные заместители (C6-C10)арильных и (C5-C10)гетероциклильных групп можно объединить с общими и предпочтительными определениями R1, R2, R3, R4, R5, R6, R6', R7, R8, R9, n и L, как описано выше.
Настоящее изобретение, следовательно, также относится к соединениям формулы (I) или (I') и/или их физиологически приемлемым солям и/или стереоизомерным формам для применения в качестве фармацевтических средств (или лекарственных средств), к применению соединений формулы (I) или (I') и/или их физиологически приемлемых солей и/или их стереоизомерных форм для получения фармацевтических средств для лечения и/или профилактики заболеваний, связанных с Rho-киназой и/или опосредованным Rho-киназой фосфорилированием фосфатазы легкой цепи миозина, т.е. для лечения и/или профилактики гипертензии, легочной гипертензии, глазной гипертензии, ретинопатии и глаукомы, нарушения периферического кровообращения, окклюзивного заболевания периферических артерий (PAOD), коронарной болезни сердца, стенокардии, гипертрофии сердца, сердечной недостаточности, ишемических заболеваний, ишемической недостаточности органа (приводящей в результате к повреждению органа), фиброидного легкого, фиброидной печени, печеночной недостаточности, нефропатии, включая индуцированную гипертензией, не индуцированную гипертензией и диабетическую нефропатию, почечной недостаточности, фиброидной почки, почечного гломерулосклероза, гипертрофии органов, астмы, хронического обструктивного легочного заболевания (COPD), респираторного дистресс-синдрома взрослых, тромботических заболеваний, удара, церебрального вазоспазма, церебральной ишемии, боли, например невропатической боли, дегенерации нервных клеток, повреждения спинного мозга, болезни Альцгеймера, преждевременных родов, эректильной дисфункции, эндокринных дисфункций, артериосклероза, гипертрофии простаты, диабета и осложнений диабета, метаболического синдрома, рестеноза кровеносных сосудов, атеросклероза, воспаления; аутоиммунных заболеваний; СПИДа, остеопатии, такой как остеопороз, нарушения функций мозга, бактериальных инфекций пищеварительного тракта, сепсиса, развитие и прогрессирование рака, например рака молочной железы, толстой кишки, предстательной железы, яичников, головного мозга и легкого и их метастазов.
Лечение и/или профилактика заболеваний человека представляют собой предпочтительный вариант воплощения изобретения, но соединениями по настоящему изобретению можно лечить также и теплокровных животных, таких как кошки, собаки, кролики, лошади и т.д.
Настоящее изобретение, кроме того, относится к фармацевтическим препаратам (или фармацевтическим композициям), которые содержат эффективное количество, по меньшей мере, одного соединения формулы (I) или (I') и/или его физиологически приемлемых солей и/или стереоизомерных форм и фармацевтически приемлемый носитель, т.е. один или несколько фармацевтически приемлемых материалов носителя (или растворителей) и/или добавки (или эксципиенты).
Необязательно, физиологически функциональные производные, включая пролекарства, соединения формулы (I) или (I') могут быть использованы в указанных выше применениях и фармацевтических препаратах.
Фармацевтические средства можно вводить орально, например в форме пилюль, таблеток, таблеток с глянцевым покрытием, покрытых оболочкой таблеток, гранул, твердых и мягких желатиновых капсул, растворов, сиропов, эмульсий, суспензий или аэрозольных смесей. Однако введение также может быть ректальным, например, в форме суппозиториев или парентеральным, например, внутривенным, внутримышечным или подкожным, в форме инъекционных растворов или инфузионных растворов, микрокапсул, имплантатов или штифтов, или подкожным или местным, например, в форме мазей, растворов или настоек, или другими способами, например в форме аэрозолей или назальных спреев.
Фармацевтические препараты, согласно настоящему изобретению, получают способом, известным per se и известным специалистам в данной области техники, с использованием фармацевтически приемлемых инертных неорганических и/или органических веществ-носителей и/или добавок в дополнение к соединению(ям) формулы (I) или (I') и/или его (их) физиологически приемлемым солям и/или его (их) пролекарствам. Для получения пилюль, таблеток, таблеток с глянцевым покрытием, покрытых оболочкой таблеток, гранул, твердых и мягких желатиновых капсул можно использовать, например, лактозу, кукурузный крахмал или их производные, тальк, стеариновую кислоту или ее соли, и т.п. Вещества-носители для мягких желатиновых капсул и суппозиториев представляют собой, например, жиры, воски, полутвердые и жидкие полиолы, натуральные или отвержденные масла и т.п. Подходящие вещества-носители для получения растворов, например инъекционных растворов или эмульсии или сиропов, например, представляют собой воду, насыщенный солевой раствор, спирты, глицерин, полиолы, сахарозу, обратимые сахара, глюкозу, растительные масла и т.п. Подходящие вещества-носители для микрокапсул, имплантов или штифтов представляют собой, например, сополимеры гликолевой кислоты и молочной кислоты. Фармацевтические препараты обычно содержат от около 0,5 до около 90% мас. соединения формулы (I) или (I') и/или их физиологически приемлемых солей и/или их стереоизомерных форм. Количество активного ингредиента формулы (I) или (I') и/или его физиологически приемлемых солей и/или его стереоизомерных форм в фармацевтических препаратах обычно составляет от около 0,5 до около 1000 мг, предпочтительно от около 1 до около 500 мг.
В дополнение к активным ингредиентам формулы (I) или (I') и/или их физиологически приемлемым солям и/или стереоизомерным формам и к веществам-носителям, фармацевтические препараты могут содержать одну или более добавок, таких как, например, наполнители, дезинтегранты, связующие вещества, лубриканты, увлажняющие вещества, стабилизаторы, эмульгаторы, консерванты, подсластители, красители, отдушки, ароматизаторы, загустители, разбавители, буферные вещества, растворители, солюбилизаторы, агенты для достижения эффекта депо, соли для изменения осмотического давления, агенты покрытия или антиоксиданты. Они также могут содержать два или более соединений формулы (I) или (I') и/или их физиологически приемлемых солей и/или их пролекарств. В случае, если фармацевтический препарат содержит два или более соединений формулы (I) или (I'), выбор конкретных соединений может осуществляться с целью получения специфического общего фармакологического профиля фармацевтического препарата. Например, высокоактивное соединение с более короткой продолжительностью действия можно сочетать с соединением продолжительного действия с более низкой активностью. Допускаемая гибкость в отношении выбора заместителей в соединениях формулы (I) или (I') обеспечивает возможность более лучшего контроля биологических и физико-химических свойств соединений и, таким образом, обеспечивает возможность выбора таких желаемых соединений. Более того, в дополнение к, по меньшей мере, одному соединению формулы (I) или (I') и/или его физиологически приемлемым солям и/или его стереоизомерным формам, фармацевтические препараты также могут содержать один или несколько других терапевтически или профилактически активных ингредиентов.
При использовании соединений формулы (I) или (I') доза может варьировать в широком диапазоне, и обычно, как это известно лечащим врачам, должна быть подходящей для конкретных условий в каждом конкретном случае. Это зависит, например, от конкретного применяемого соединения, от природы и тяжести заболевания, которое лечат, от способа и схемы введения, или от того, является ли заболевание острым или хроническим, или от того, проводилась ли профилактика. Подходящую дозу можно определить с использованием клинических подходов, хорошо известных в области медицины. Как правило, суточная доза для достижения желаемых результатов для взрослых с массой тела около 75 кг составляет от около 0,01 до около 100 мг/кг, предпочтительно от около 0,1 до около 50 мг/кг, в частности от около 0,1 до около 10 мг/кг (в каждом случае в мг на кг массы тела). Суточную дозу можно разделить, в частности, в случае введения относительно больших количеств, на несколько, например, 2, 3 или 4, дробных введения. Как правило, в зависимости от индивидуальной реакции, может быть необходимым отклонение от указанной суточной дозы в большую или меньшую сторону.
Кроме того, соединения формулы (I) или (I') можно использовать в качестве промежуточных соединений синтеза для получения других соединений, в частности, других фармацевтически активных ингредиентов, которые можно получить из соединений формулы I, например, путем введения заместителей или модификации функциональных групп.
Должно быть понятно, что модификации, которые не оказывают существенного влияния на активность различных вариантов воплощения настоящего изобретения, включены в изобретение, раскрываемое в настоящей заявке.
Соединения формулы (I) или (I') можно получить в соответствии со следующими примерами соединений, не ограничивая объема притязаний.
Как правило, защитные группы, которые все еще могут присутствовать в продуктах, полученных в реакции сочетания, затем можно удалить, используя стандартные процедуры. Например, защитные трет-бутильные группы, в частности, трет-бутоксикарбонильную группу, которая представляет собой защищенную форму аминогруппы, можно удалить, т.е. преобразовать в аминогруппу, путем обработки трифторуксусной кислотой. Как объяснялось выше, после реакции сочетания могут также образовываться функциональные группы из подходящих групп-предшественников. Кроме того, затем можно осуществить преобразование в физиологически приемлемую соль или пролекарство соединения формулы (I) или (I') известыми способами.
Как правило, реакционную смесь, содержащую конечное соединение формулы (I) или (I') или промежуточное соединение, подвергают обработке и, если это желательно, продукт затем очищают традиционными способами, известными специалистам в данной области. Например, синтезированное соединение можно очистить, используя хорошо известные способы, такие как кристаллизация, хроматография или обращенно-фазовая высокоэффективная жидкостная хроматография (ОФ-ВЭЖХ), или другими способами разделения, основанными, например на размере, заряде или гидрофобности соединения. Аналогичным образом, можно использовать хорошо известные способы, такие как анализ аминокислотной последовательности, ЯМР, ИК и масс-спектрометрия (МС), для идентификации соединения по настоящему изобретению.
Изохинолиноны можно синтезировать различными способами. Представленные ниже общие схемы иллюстрируют некоторые возможные пути для получения изохинолонов, но этим не ограничивают настоящее изобретение.
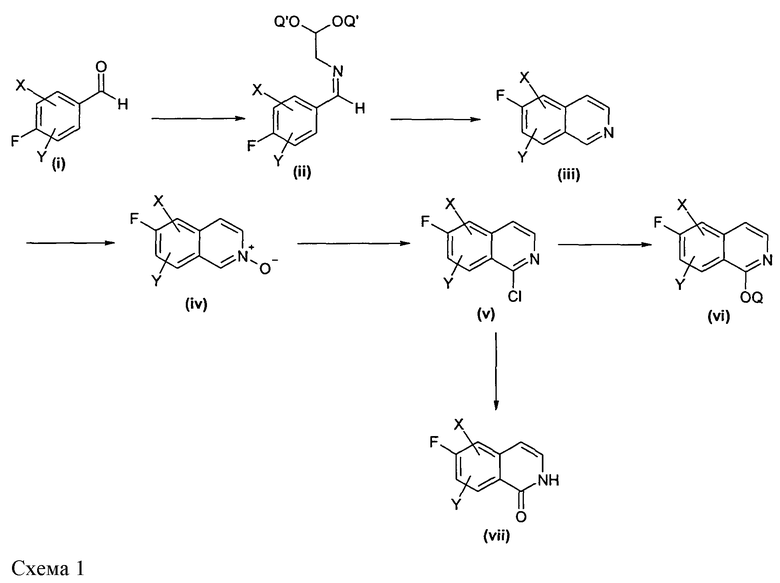
Подходяще замещенный альдегид, например, замещенный группой X или Y, которые независимо друг от друга представляют собой водород, алкил, алкокси или галогенид, присоединенный в подходящем положении, можно подвергнуть взаимодействию с подходящим соединением, таким как, например, ацеталь аминоацетальдегида, например, в растворителе, таком как ТГФ, хлороформ или толуол, в условиях кислотного катализа с использованием толуолсульфоновой кислоты или другой подходящей кислоты с получением имина (ii), где Q' может представлять собой, например, метил или этил, который, в свою очередь, может быть циклизован различными способами до изохинолина (iii). Например, это можно осуществить при помощи катализа кислотой Льюиса, используя подходящие кислоты Льюиса, такие как тетрахлорид титана, галогениды железа, галогениды алюминия и т.д. при температуре в пределах от температуры окружающей среды до 100°C, или путем восстановления имина до соответствующего амина при воздействии подходящего восстановителя, такого как боргидрид натрия, преобразования амина в амид или сульфонамид путем взаимодействия с подходящим хлорангидридом кислоты и последующей циклизации до изохинолина при воздействии подходящей кислоты Льюиса. Изохинолин (iii), в свою очередь, затем может быть преобразован в соответствующий N-оксид (iv) при воздействии подходящего окислителя, такого как перекись водорода, м-хлорпербензойная кислота или другие, при комнатной температуре или повышенной температуре. N-оксид (iv) затем может быть преобразован в 1-хлоризохинолиновое производное (v) путем взаимодействия с реагентом, таким как оксихлорид фосфора, в присутствии пентахлорида фосфора или без него. Производное (v) затем может быть преобразовано в подходящие 1-алкокси-производные путем взаимодействия с различными спиртами Q-OH, такими как метанол, этанол или бензиловый спирт, в присутствии подходящего основания, такого как гидрид натрия, и в подходящем растворителе, таком как диметилформамид, диметилацетамид или другие растворители. Альтернативно, соединение (v) может быть непосредственно преобразовано в изохинолиноновое производное (vii) путем взаимодействия с реагентом, таким как ацетат аммония.
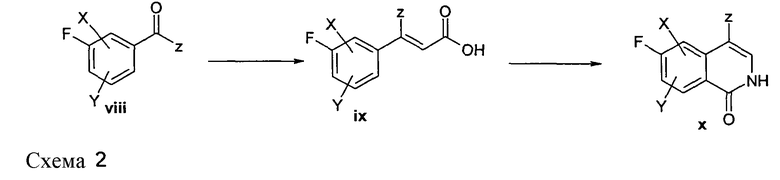
Альтернативно, изохинолины можно получить путем взаимодействия подходящих 3-формилированных или ацилированных фторбензолов (viii), где z, например, представляет собой H или алкил, такой как метил или этил, с реагентом, таким как триэтилфосфоноацетат, в присутствии подходящего основания, такого как гидрид натрия, с получением соответствующего эфира коричной кислоты, который затем отщепляют при воздействии подходящего основания, такого как гидроксид калия, гидроксид натрия или гидроксид лития, в подходящем растворителе с получением кислоты (ix). Кислота (ix) затем может быть преобразована в соответствующий хлорангидрид кислоты при помощи хорошо известных способов, который может быть преобразован в азид кислоты путем взаимодействия с азидом натрия в подходящем растворителе, таком как простой эфир, хлороформ или ацетон, в присутствии воды или без нее. Соответствующий азид затем может быть преобразован в изохинолинон (x) путем его взаимодействия в подходящем растворителе, таком как дифенилметан или дифениловый эфир, при подходящей температуре.
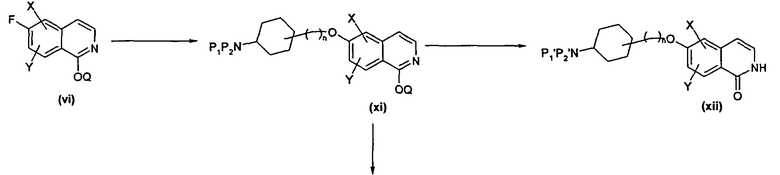
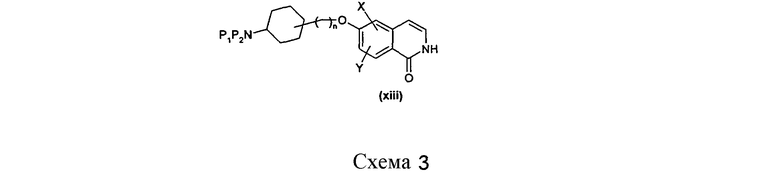
Полученные, как указано выше, 6-фторизохинолоны, например (vi), можно подвергнуть взаимодействию с подходящими P1/P2 замещенными аминоспиртами, где P1/P2 независимо друг от друга представляют собой, например, водород, алкил или защитную группу, например, такую как Boc или фталоил, в присутствии основания, такого как DBU, карбонат цезия или гидрид натрия, с получением соответствующих алкокси-замещенных производных (xi). В некоторых случаях, это преобразование можно осуществить даже на более ранних стадиях синтеза (например, путем взаимодействия подходящего промежуточного соединения). Должно быть понятно, что может потребоваться, в случае незащищенных изохинолонов, защита по азоту или кислороду изохинолоновой группы подходящими способами, такими как взаимодействие с подходяще замещенными алкил- или бензилгалогенидами в присутствии основания.
Продукты, такие как (xi), полученные таким способом, затем можно либо выделить, либо, в случае присутствия подходящей функциональной аминогруппы, подвергнуть взаимодействию с подходящими альдегидами или кетонами в присутствии восстановителя, такого как триацетоксиборгидрид натрия, боргидрид натрия или цианоборгидрид натрия, в подходящем растворителе и в присутствии воды, агента, способствующего извлечению продукта, такого как молекулярные сита, или подходящего орто-эфира. Может потребоваться высвобождение этой аминогруппы на начальной стадии, например, такой как удаление Boc-групп при помощи кислоты.
В случае использования защищенных изохинолонов, отщепление используемых защитных групп необходимо для выделения желаемого изохинолона (xii). Однако это выделение можно осуществить до или после стадии восстановительного аминирования, в зависимости от природы используемого альдегида/кетона и используемой защитной группы.
Изохинолоновые производные, такие как (xii), могут быть получены в форме свободных оснований или различных солей, таких как, например, гидрохлориды, гидробромиды, фосфаты, трифторацетаты, сульфаты или фумараты. Полученные соли можно преобразовать в соответствующее свободное основание, либо подвергая их ионообменной хроматографии, либо, например, при помощи обработки водным раствором щелочи с последующим экстрагированием подходящими органическими растворителями, такими как, например, метил трет-бутиловый эфир, хлороформ, этилацетат или смеси изопропанол/дихлорметан с последующим упариванием досуха.
Общие способы получения изохинолоновых производных, описанные выше, можно легко адаптировать для получения соединений формулы (I) или (I'). В представленных ниже примерах более подробно описано получение соединений по настоящему изобретению.
Следовательно, представленные ниже примеры являются частью настоящего изобретения и предназначены для его иллюстрации, а не для ограничения.
(2,2-Диметоксиэтил)-(4-фторбензил)амин (1)
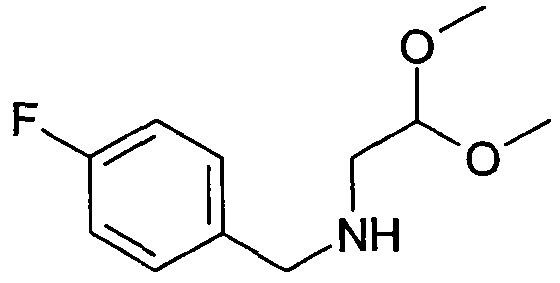
12,4 г 4-фторбензальдегида растворяли в 100 мл толуола и подвергали взаимодействию с 10,5 г диметилацеталя 2-аминоацетальдегида и 1,90 моногидрата п-толуолсульфоновой кислоты в течение двух часов в аппарате Дина-Старка. Раствору давали охладиться, экстрагировали насыщенным раствором бикарбоната натрия, водой и насыщенным солевым раствором, сушили над сульфатом магния и упаривали досуха. Неочищенный продукт растворяли в 100 мл этанола. Добавляли порциями 1,89 г боргидрида натрия. Перемешивание продолжали в течение ночи. Для дальнейшей обработки добавляли уксусную кислоту до тех пор, пока выделение газа уже не наблюдалось. Затем раствор упаривали досуха, осуществляли его поглощение в дихлорметан и промывали два раза водой. Органический слой экстрагировали насыщенным солевым раствором, сушили над сульфатом магния и упаривали досуха. Полученный неочищенный продукт (20 г) использовали для следующих реакций без очистки. Rt=0,86 мин (Способ B). Определенная масса: 182,1 (M-OMe-), 214,2 (M+H+).
N-(2,2-Диметоксиэтил)-N-(4-фторбензил)-4-метилбензолсульфонамид (2)
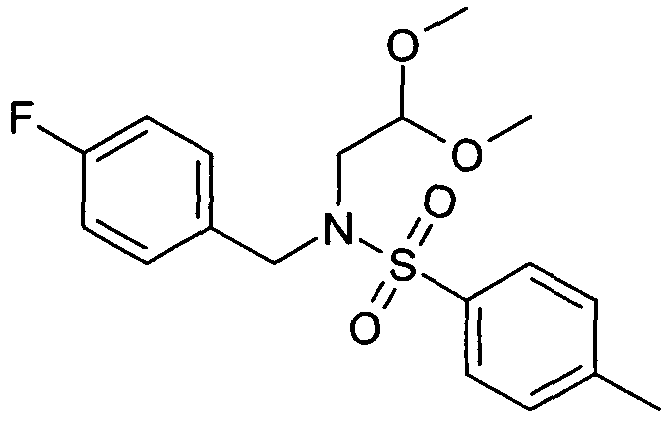
20 г (2,2-диметоксиэтил)-(4-фторбензил)амин (1) растворяли в 120 мл дихлорметана. Добавляли 20 мл пиридина. При 0°C добавляли по каплям раствор 23,8 г хлорангидрида п-толуолсульфоновой кислоты в дихлорметане. Реакционной смеси давали нагреться до комнатной температуры и перемешивание продолжали до завершения конверсии. Для дальнейшей обработки реакционную смесь экстрагировали два раза 2M хлористоводородной кислоты, два раза бикарбонатом натрия и один раз насыщенным солевым раствором. Органический слой сушили над сульфатом магния, упаривали досуха и полученный неочищенный продукт очищали хроматографией на силикагеле с получением 22,95 г соединения 2 в виде оранжевого масла. Rt=1,71 мин (Способ C). Определенная масса: 336,1 (M-OMe-).
6-Фторизохинолин (3)
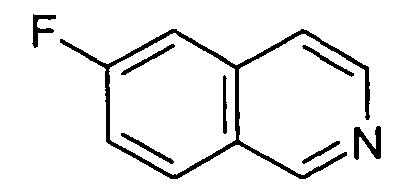
41,6 г AlCl3 суспендировали в 400 мл дихлорметана. При комнатной температуре добавляли раствор 22,95 г N-(2,2-диметоксиэтил)-N-(4-фторбензил)-4-метилбензолсульфонамида (2) в 150 мл дихлорметана. Перемешивание продолжали при комнатной температуре в течение ночи, раствор выливали на лед, органический слой отделяли, водную фазу экстрагировали два раза дихлорметаном и объединенные органические слои затем экстрагировали два раза бикарбонатом натрия. Органический слой сушили над сульфатом магния, упаривали досуха и полученный неочищенный продукт (8,75 г) очищали хроматографией на силикагеле с получением 2,74 г соединения (23). Rt=0,30 мин (Способ C). Определенная масса: 148,1 (M+H+).
7-Хлор-6-фторизохинолин (4)
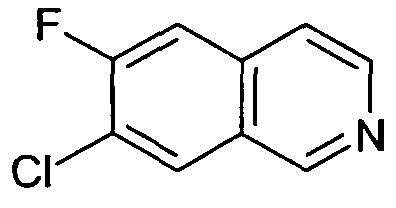
Исходя из 3-хлор-4-фторбензальдегида, указанное в заголовке соединение получали с использованием такой же последовательности реакций, как для синтеза 6-фторизохинолина (3). Rt=0,77 мин (Способ A). Определенная масса: 182,1/184,1 (M+H+).
7-Бром-6-фторизохинолин (92)
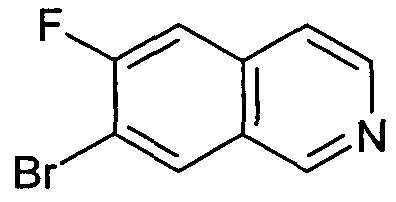
Исходя из 3-бром-4-фторбензальдегида, указанное в заголовке соединение получали с использованием такой же последовательности реакций, как для синтеза 6-фторизохинолина (3). Rt=0,91 мин (Способ B). Определенная масса: 226,0/228,0 (M+H+).
7-Хлор-6-фторизохинолин 2-оксид (5)
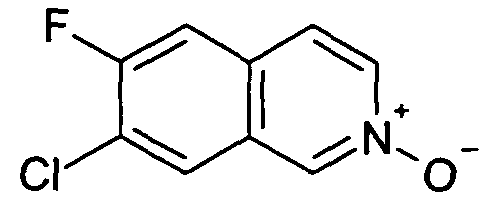
25 г (137,7 ммоль) 7-хлор-6-фторизохинолина (4) растворяли в 500 мл дихлорметана. При комнатной температуре добавляли 50,9 г (206,5 ммоль) м-хлорпербензойной кислоты (70%) и смесь перемешивали при комнатной температуре до завершения конверсии. Для дальнейшей обработки осадок отфильтровывали и промывали дихлорметаном. Фильтрат промывали два раза раствором бикарбоната натрия. Слои разделяли и водную фазу экстрагировали два раза дихлорметаном. Органические фазы сушили при помощи сульфата магния и упаривали. Полученное, таким образом, твердое вещество (18,4 г) использовали без дополнительной очистки. Rt=0,87 мин (Способ C). Определенная масса: 198,1/200,1 (M+H+).
1,7-Дихлор-6-фторизохинолин (6)
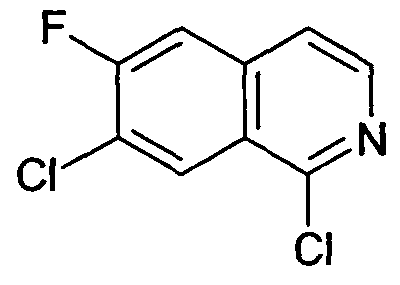
2,6 г (12,0 ммоль) 7-хлор-6-фторизохинолин 2-оксида (5) нагревали в 40 мл POCl3 при температуре кипения с обратным холодильником в течение 4 часов. После охлаждения смеси до комнатной температуры ее выливали на лед. Водный раствор экстрагировали три раза дихлорметаном. Объединенные органические слои сушили при помощи сульфата магния и упаривали с получением 2,91 г указанного в заголовке соединения, которое использовали без дополнительной очистки. Rt=2,34 мин (Способ A). Определенная масса: 216,0/218,0 (M+H+).
5-Хлор-6-фторизохинолин (7)
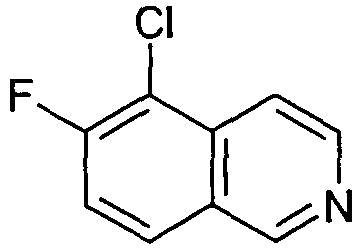
7,0 г (38,1 ммоль) 6-фторизохинолина (3) растворяли в 60 мл концентрированной серной кислоты. При 0°C добавляли 10,18 г N-хлорсукцинимида. Через 1 час добавляли еще 5,2 г N-хлорсукцинимида и раствор нагревали до 50°C. Последовательно добавляли еще две порции по 5,2 г N-хлорсукцинимида и перемешивание продолжали при 50°C до завершения реакции. Реакционную смесь охлаждали до комнатной температуры, выливали на лед и доводили до рН 10 добавлением гидроксида натрия. Осадок отфильтровывали, растворяли в дихлорметане и промывали водным раствором гидроксида натрия. Органический слой сушили над сульфатом магния, упаривали и неочищенный продукт очищали препаративной ВЭЖХ с получением 4,04 г 5-хлор-6-фторизохинолина (7) в виде трифторацетата. Rt=0,97 мин (Способ A). Определенная масса: 182,0/184,0 (M+H+).
5-Хлор-6-фторизохинолин 2-оксид (8)
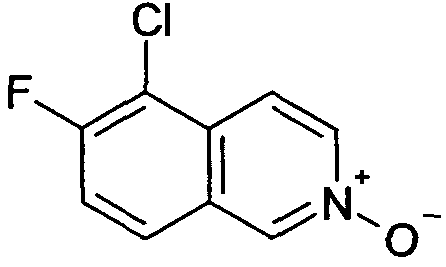
Исходя из 5-хлор-6-фторизохинолина трифторацетата (7), указанное в заголовке соединение получали, следуя способу, описанному для 7-хлор-6-фторизохинолина 2-оксида (5). Rt=0,90 мин (Способ C). Определенная масса: 198,1/200,1 (M+H+).
1,5-Дихлор-6-фторизохинолин (9)
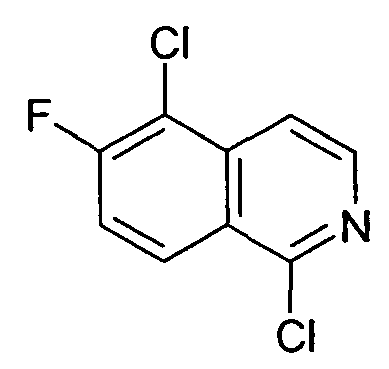
5-Хлор-6-фторизохинолин 2-оксид (8) преобразовывали в указанное в заголовке соединение, следуя протоколу, описанному для синтеза 1,7-дихлор-6-фторизохинолина (6). Неочищенный продукт очищали хроматографией на силикагеле (гептан/этилацетат 4:1). Rt=1,70 мин (Способ C). Определенная масса: 216,0/218,0 (M+H+).
6-(цис-4-Аминоциклогексилокси)-7-хлор-2H-изохинолин-1-он (10)
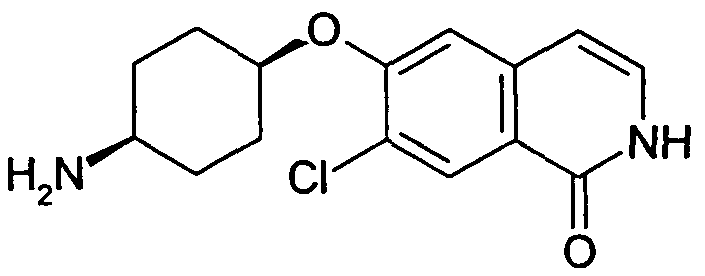
2,19 г (10,2 ммоль) трет-бутилового эфира цис-(4-гидроксициклогексил)карбаминовой кислоты растворяли в 20 мл диметилацетамида. В атмосфере аргона добавляли 814 мг (20,4 ммоль) гидрида натрия (60%) и смесь перемешивали при комнатной температуре. Через 30 минут добавляли раствор 2,0 г (9,26 ммоль) 1,7-дихлор-6-фторизохинолина (6) в 5 мл диметилацетамида и перемешивание продолжали при комнатной температуре. Через 1 час добавляли 2,0 г (18,5 ммоль) бензилового спирта и 740 мг (18,5 ммоль) гидрида натрия (60%). Реакционную смесь перемешивали в течение 2 часов при комнатной температуре и 30 минут при 80°C для достижения полной конверсии. Растворитель удаляли в вакууме, осуществляли поглощение остатка в дихлорметан и промывали два раза водой. После сушки над сульфатом магния органический слой упаривали, с получением 4,44 г неочищенного промежуточного соединения трет-бутилового эфира цис-[4-(1-бензилокси-7-хлоризохинолин-6-илокси)циклогексил]карбаминовой кислоты. Промежуточное соединение растворяли в метаноле и обрабатывали 2 н. раствором HCl при комнатной температуре. После перемешивания в течение 2 дней реакционную смесь доводили до щелочного pH добавлением гидроксида натрия. Растворитель удаляли в вакууме и остаток перемешивали в этаноле. Фильтрация и упаривание фильтрата давали твердое вещество, которое очищали препаративной ВЭЖХ. Полученный трифторацетат растворяли в 2 н. растворе HCl. Конечная лиофилизация давала 433 мг указанного в заголовке соединения в виде гидрохлорида. Rt=0,89 мин (Способ B). Определенная масса: 293,2/295,2 (M+H+).
6-(цис-4-Аминоциклогексилокси)-5-хлор-2H-изохинолин-1-он (11)
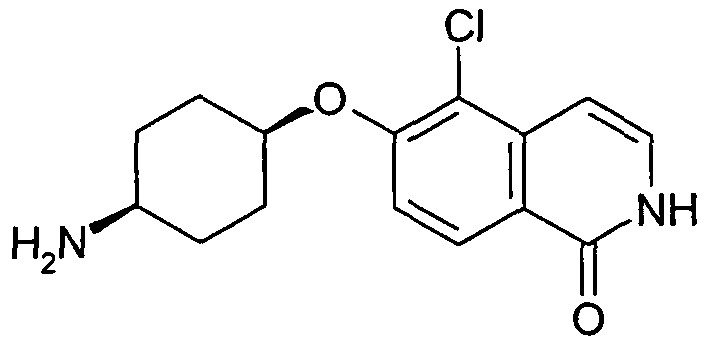
Исходя из трет-бутилового эфира цис-(4-гидроксициклогексил)карбаминовой кислоты и 1,5-дихлор-6-фторизохинолина (9), получали указанное в заголовке соединение в виде гидрохлорида, следуя способу, описанному для гидрохлорида 6-(цис-4-аминоциклогексилокси)-7-хлоризохинолин-1-ола (10). Rt=1,04 мин (Способ B). Определенная масса: 293,1/295,1 (M+H+).
7-Хлор-6-(цис-4-циклопропиламиноциклогексилокси)-2H-изохинолин-1-он (12)
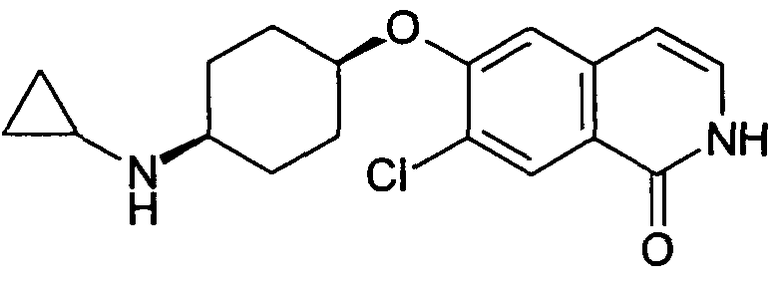
7-Хлор-6-(цис-4-дициклопропиламиноциклогексилокси)-2H-изохинолин-1-он (13)
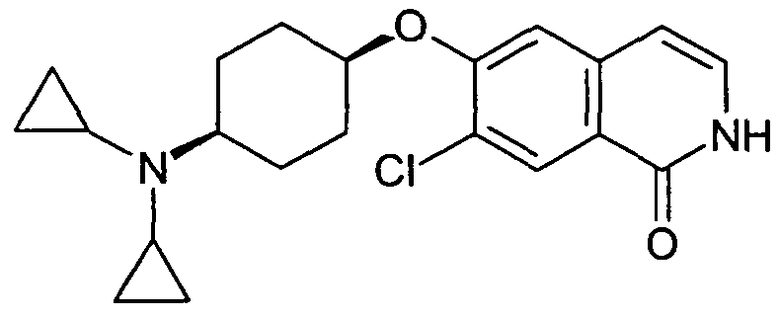
100 мг (0,3 ммоль) гидрохлорида 6-(цис-4-аминоциклогексилокси)-7-хлор-2H-изохинолин-1-она (10) растворяли в 10 мл метанола. Добавляли 54,5 мг (0,54 ммоль) триэтиламина и смесь перемешивали при комнатной температуре в течение 10 минут. Добавляли свежевысушенные молекулярные сита, 159,3 мг (2,66 ммоль) уксусной кислоты, 104,6 мг (0,6 ммоль) (1-этоксициклопропокси)триметилсилана и 56,5 мг (0,9 ммоль) цианоборгидрида натрия и реакционную смесь кипятили с обратным холодильником в течение 3 часов. Добавляли 5 эквивалентов (1-этоксициклопропокси)триметилсилана, с последующим добавлением 2 эквивалентов цианоборгидрида натрия. Смеси давали выстояться при комнатной температуре в течение ночи. Смесь фильтровали и фильтрат упаривали. Остаток растворяли в дихлорметане, промывали два раза 2 н. раствором NaOH и водой и сушили над сульфатом магния. После выпаривания растворителя и очистки при помощи препаративной ВЭЖХ получали 4,5 мг 7-хлор-6-(цис-4-циклопропиламиноциклогексилокси)изохинолин-1-ола (12) в виде трифторацетата и 16 мг 7-хлор-6-(цис-4-дициклопропиламиноциклогексилокси)изохинолин-1-ола (13) в виде трифторацетата. Rt (12)=1,05 мин (Способ A). Определенная масса: 333,2/335,2 (M+H+). Rt (13)=1,15 мин (Способ B). Определенная масса: 373,1/375,1 (M+H+).
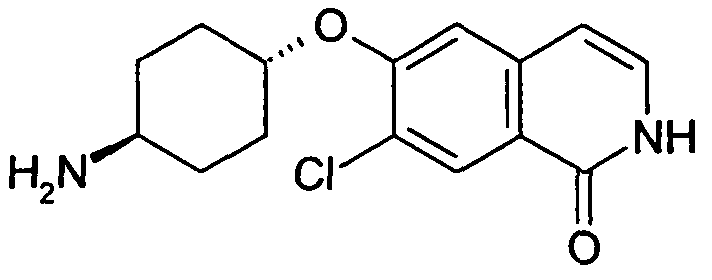
6-(транс-4-Аминоциклогексилокси)-7-хлоризохинолин-1-ол (14)
Исходя из трет-бутилового эфира транс-(4-гидроксициклогексил)карбаминовой кислоты и 1,7-дихлор-6-фторизохинолина (6), получали указанное в заголовке соединение в виде гидрохлорида, следуя способу, описанному для гидрохлорида 6-(цис-4-аминоциклогексилокси)-7-хлоризохинолин-1-ола (10). Rt=1,08 мин (Способ B). Определенная масса: 293,2/295,2 (M+H+).
транс-4-(Изохинолин-6-илокси)циклогексиламин (15)
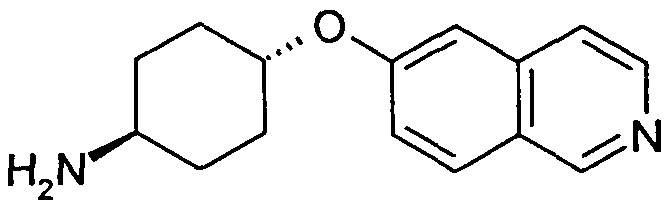
6,1 г (53 ммоль) 4-аминоциклогексанола растворяли в 50 мл диметилацетамида и добавляли при комнатной температуре 4,24 г (106 ммоль) гидрида натрия (60%). После перемешивания реакционной смеси в течение 30 минут в атмосфере аргона добавляли раствор 6,49 г (35,3 ммоль) гидрохлорида 6-фторизохинолина и смесь перемешивали при комнатной температуре в течение ночи. Для дальнейшей обработки растворитель удаляли в вакууме и остаток растворяли в дихлорметане и промывали два раза водой. Органический слой отделяли, сушили при помощи сульфата магния и упаривали с получением 8,64 г неочищенного продукта, который использовали без дополнительной очистки. Rt=0,77 мин (Способ B). Определенная масса: 243,1 (M+H+).
транс-N-[4-(Изохинолин-6-илокси)циклогексил]ацетамид (16)
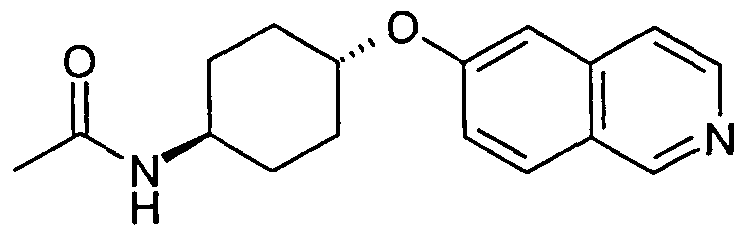
8,4 г (34,7 ммоль) 4-(изохинолин-6-илокси)циклогексиламина (15) растворяли в 100 мл дихлорметана/пиридина (4:1). При 0°C добавляли раствор 3,27 г (41,6 ммоль) ацетилхлорида в 10 мл дихлорметана и реакционную смесь перемешивали при комнатной температуре. Через 2 часа раствор разбавляли дихлорметаном и промывали два раза насыщенным раствором бикарбоната натрия. После промывки два раза 2 н. раствором HCl продукт переносили в водную фазу. HCl-слои доводили до щелочного pH добавлением твердого NaOH и экстрагировали три раза дихлорметаном. Сушка органических слоев при помощи сульфата магния и выпаривание растворителя давали 7,69 г неочищенного продукта. После хроматографии на силикагеле выделяли 4,48 г указанного в заголовке соединения. Rt=0,87 мин (Способ A). Определенная масса: 285,2 (M+H+).
транс-N-[4-(2-Оксиизохинолин-6-илокси)циклогексил]ацетамид (17)
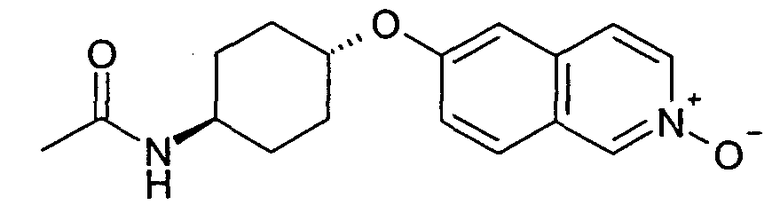
Исходя из N-[4-(изохинолин-6-илокси)циклогексил]ацетамида (16), указанное в заголовке соединение получали, следуя способу, описанному для 7-хлор-6-фторизохинолин 2-оксида (5). Rt=1,01 мин (Способ A). Определенная масса: 301,2 (M+H+).
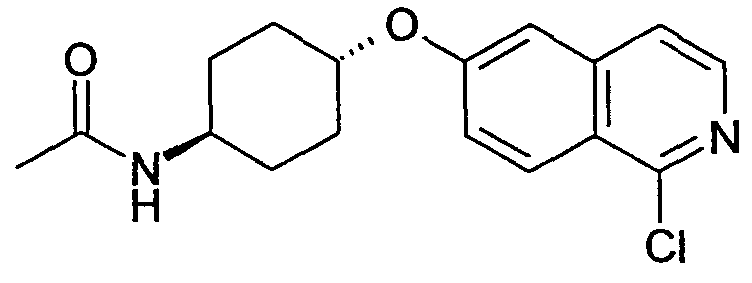
транс-N-[4-(1-Хлоризохинолин-6-илокси)циклогексил]ацетамид (18)
N-[4-(2-Оксиизохинолин-6-илокси)циклогексил]ацетамид (17) преобразовывали в указанное в заголовке соединение, следуя протоколу, описанному для 1,7-дихлор-6-фторизохинолина (6). Неочищенный продукт очищали препаративной ВЭЖХ. Rt=1,49 мин (Способ B). Определенная масса: 319,1/321,1 (M+H+).
транс-N-[4-(1-Бензилоксиизохинолин-6-илокси)циклогексил]ацетамид (19)
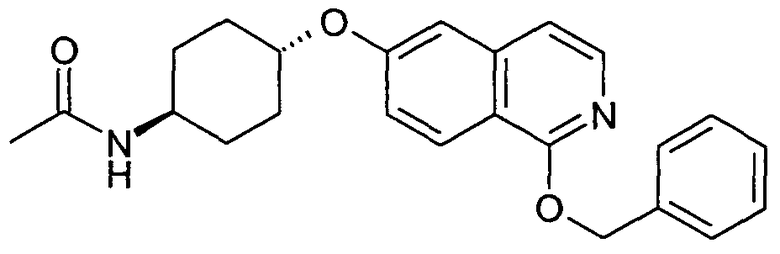
975 мг (3,06 ммоль) N-[4-(1-хлоризохинолин-6-илокси)циклогексил]ацетамида (18) растворяли в 20 мл диметилацетамида и добавляли 992 мг (9,17 ммоль) бензилового спирта. После добавления 367 мг (9,17 ммоль) гидрида натрия (60%) реакционную смесь перемешивали в течение 3 часов при комнатной температуре и в течение 1 часа при 80°C. Затем растворитель удаляли в вакууме, остаток растворяли в дихлорметане и промывали три раза водой. Органический слой сушили при помощи сульфата магния и упаривали. Конечная очистка препаративной ВЭЖХ давала 680 мг указанного в заголовке соединения. Rt=1,75 мин (Способ B). Определенная масса: 391,2 (M+H+).
транс-6-(4-Аминоциклогексилокси)-2H-изохинолин-1-он (20)
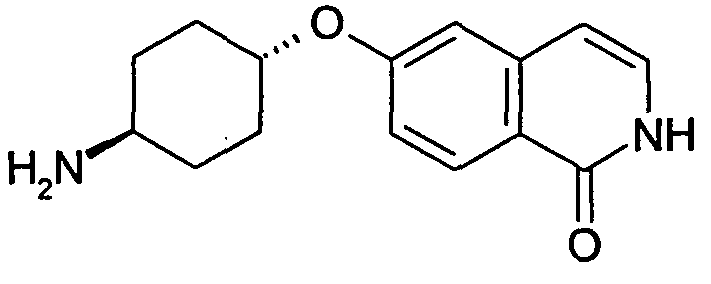
680 мг (1,74 ммоль) N-[4-(1-бензилоксиизохинолин-6-илокси)циклогексил]ацетамида (19) нагревали в 2 н. растворе HCl в автоклаве при 120°C до достижения полной конверсии. Растворитель удаляли в вакууме и остаток очищали препаративной ВЭЖХ. Фракции, содержащие продукт, упаривали и растворяли в 2 н. растворе HCl. После лиофилизации получали 182 мг указанного в заголовке соединения в виде гидрохлорида. Rt=0,97 мин (Способ B). Определенная масса: 259,2 (M+H+).
цис-4-(Изохинолин-6-илокси)циклогексиламин (21)
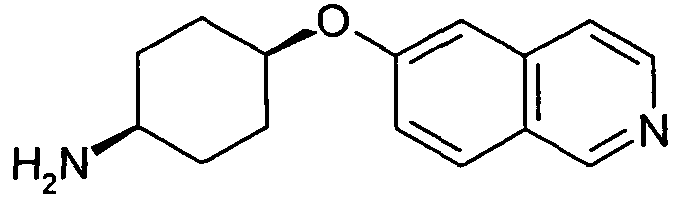
Исходя из гидрохлорида 6-фторизохинолина и цис-4-аминоциклогексанола, получали указанное в заголовке соединение, следуя протоколу, описанному для соединения (15). Rt=0,64 мин (Способ B). Определенная масса: 243,2 (M+H+).
цис-N-[4-(Изохинолин-6-илокси)циклогексил]ацетамид (22)
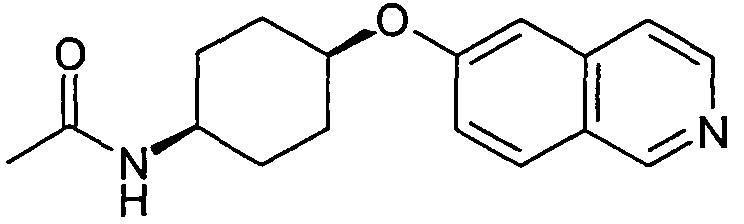
Исходя из цис-4-(изохинолин-6-илокси)циклогексиламина (21), получали указанное в заголовке соединение, следуя протоколу, описанному для соединения (16). Rt=0,90 мин (Способ B). Определенная масса: 285,1 (M+H+).
цис-N-[4-(2-Оксиизохинолин-6-илокси)циклогексил]ацетамид (23)
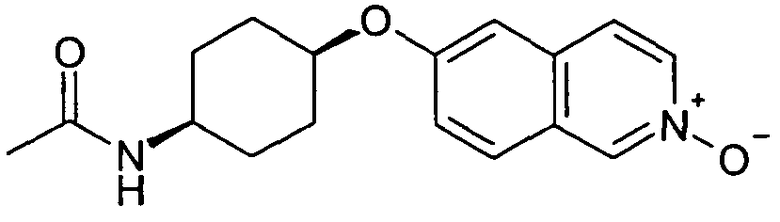
Исходя из цис-N-[4-(изохинолин-6-илокси)циклогексил]ацетамида (22), получали указанное в заголовке соединение, следуя способу, описанному для 7-хлор-6-фторизохинолин 2-оксида (5). Rt=0,80 мин (Способ C). Определенная масса: 301,2 (M+H+).
цис-4-(2-Оксиизохинолин-6-илокси)циклогексиламин (24)
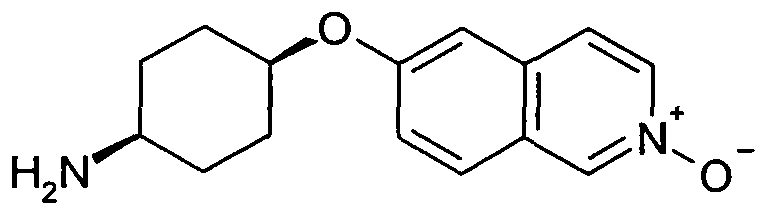
2,43 г (8,1 ммоль) цис-N-[4-(2-оксиизохинолин-6-илокси)циклогексил]ацетамида (23) кипятили с обратным холодильником в 50 мл 2 н. раствора HCl в течение 16 часов. Выпаривание растворителя давало 2,46 г указанного в заголовке соединения (неочищенный продукт) в виде HCl-соли. Rt=0,59 мин (Способ C). Определенная масса: 517,3; 259,2; 130,2 [(2M+H+), (M+H+), 1/2(M+H+)].
цис-4-(1-Хлоризохинолин-6-илокси)циклогексиламин (25)
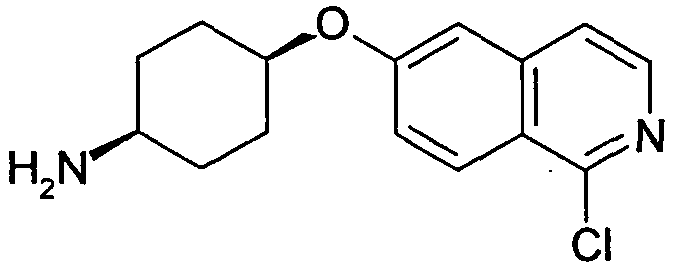
2,46 г цис-4-(2-оксиизохинолин-6-илокси)циклогексиламина (24, неочищенный продукт) нагревали до 100°C в 20 мл POCl3. Через 1 час смесь охлаждали до комнатной температуры и выливали на лед. Водный раствор доводили до щелочного pH добавлением гидроксида натрия и экстрагировали три раза дихлорметаном. Объединенные органические слои сушили при помощи сульфата магния и растворитель удаляли при пониженном давлении с получением 1,14 г указанного в заголовке соединения в виде неочищенного продукта, который использовали без дополнительной очистки. Rt=0,90 мин (Способ C). Определенная масса: 277,1/279,2 (M+H+).
трет-бутиловый эфир цис-[4-(1-Хлоризохинолин-6-илокси)циклогексил]карбаминовой кислоты (26)
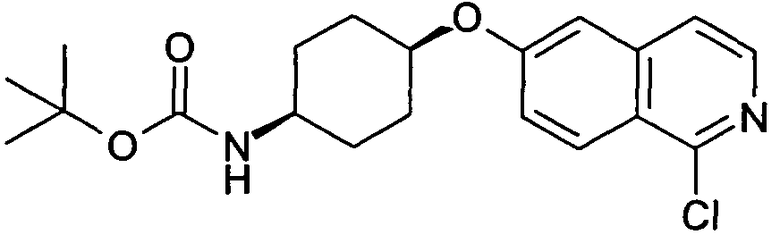
1,14 г цис-4-(1-хлоризохинолин-6-илокси)циклогексиламин (25, неочищенный продукт) растворяли в 20 мл дихлорметана. При 0°C добавляли раствор 1,17 г (5,35 ммоль) ди-трет-бутилдикарбоната в 5 мл дихлорметана и раствор перемешивали при комнатной температуре. Через 1 час раствор промывали водой, сушили и упаривали с получением 1,65 г указанного в заголовке соединения, которое использовали без дополнительной очистки. Rt=1,77 мин (Способ C). Определенная масса: 377,1/379,1 (M+H+).
трет-бутиловый эфир цис-[4-(1-бензилоксиизохинолин-6-илокси)циклогексил]карбаминовой кислоты (27)
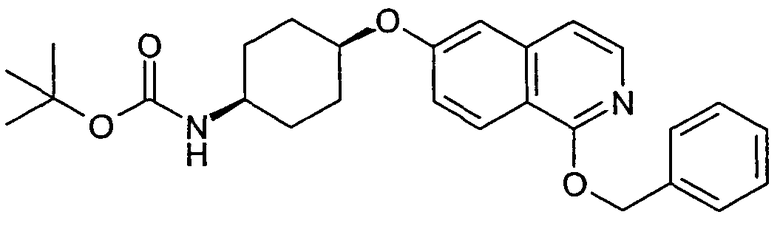
Исходя из трет-бутилового эфира цис-[4-(1-хлоризохинолин-6-илокси)циклогексил]карбаминовой кислоты (26, неочищенный продукт), получали указанное в заголовке соединение, следуя протоколу, описанному для транс-N-[4-(1-бензилоксиизохинолин-6-илокси)циклогексил]ацетамида (19). Конечная хроматография методом препаративной ВЭЖХ давала смесь желаемого продукта и производного с частично удаленной защитой, содержащего свободную аминогруппу. Rt=2,01 мин (Способ C). Определенная масса: 449,2 (M+H+).
цис-6-(4-Аминоциклогексилокси)-2H-изохинолин-1-он (28)
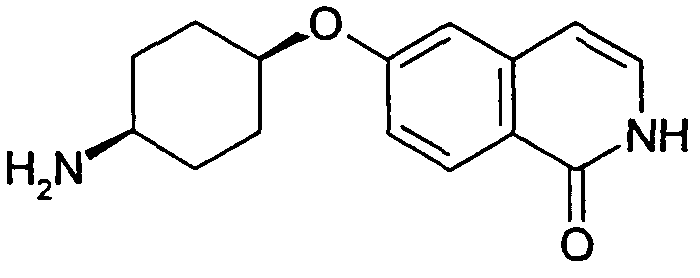
Указанное в заголовке соединение получали путем перемешивания трет-бутилового эфира цис-[4-(1-хлоризохинолин-6-илокси)циклогексил]карбаминовой кислоты (27) при комнатной температуре в растворе метанол/2 н. HCl (1:1). По достижении полной конверсии растворитель удаляли при пониженном давлении и остаток очищали препаративной ВЭЖХ. Полученный трифторацетат преобразовывали в соответствующий гидрохлорид путем растворения соединения в 2 н. растворе HCl и выпаривания растворителя. После растворения остатка в воде и лиофилизации выделяли желаемый продукт (HCl-соль) в виде бесцветного твердого вещества. Rt=0,75 мин (Способ B). Определенная масса: 259,2 (M+H+).
Общая процедура А для реакции восстановительного аминирования:
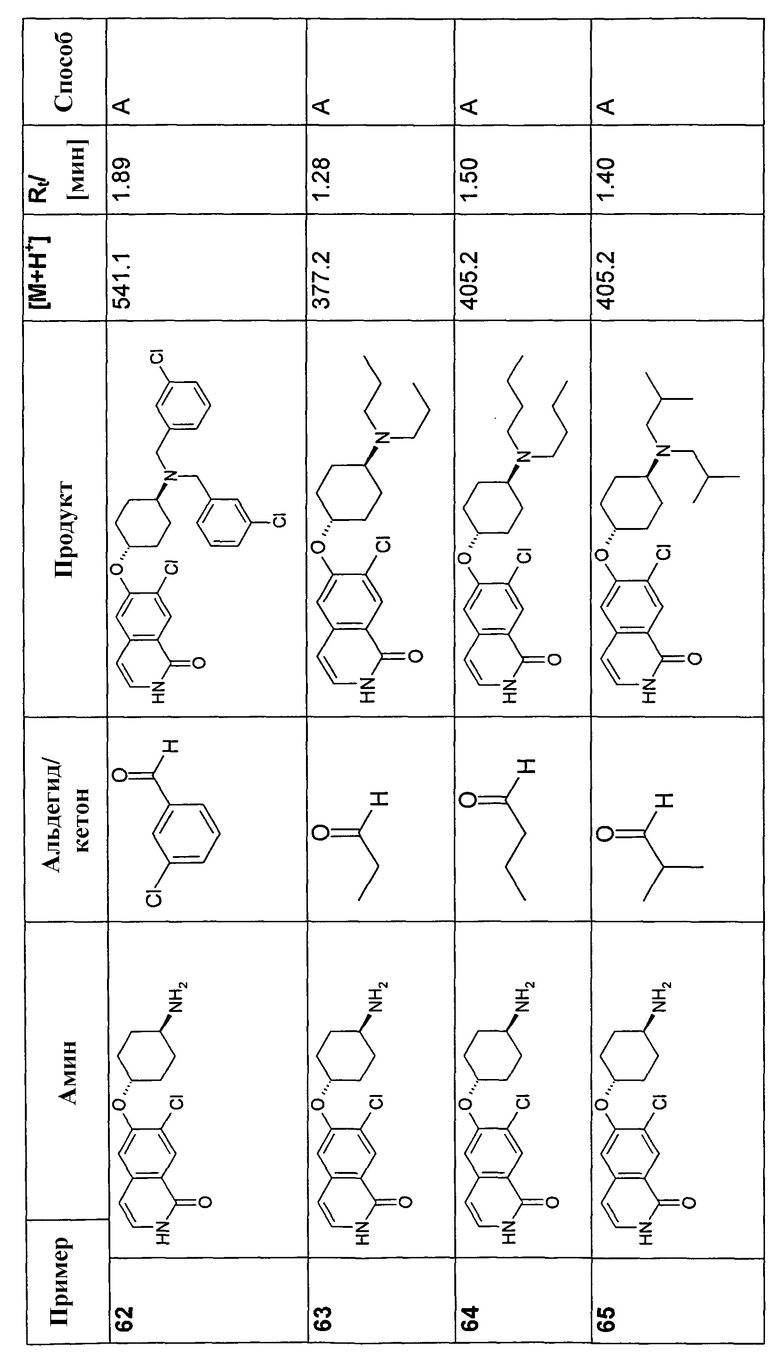
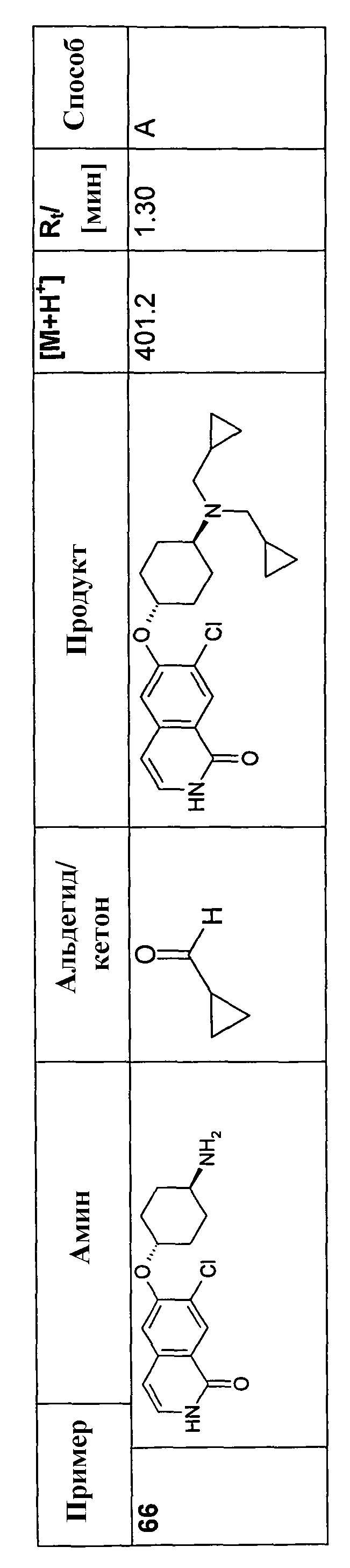
0,243 ммоль аминового соединения (гидрохлорид), 0,243 ммоль альдегида и 0,365 ммоль триэтиламина перемешивали в 3 мл HC(OMe)3 в течение 1 часа при комнатной температуре. Смесь охлаждали до -10°C, добавляли 1,75 мл свежеприготовленного раствора ДМФА, содержащего 1,215 ммоль NaHB(OAc)3 и 1,215 ммоль HOAc. Перемешивание продолжали при -10°C в течение 30 минут, смеси затем давали нагреться до комнатной температуры и оставляли при комнатной температуре в течение ночи. Добавляли 0,5 мл воды и смесь упаривали, растворяли в ДМФА и моно- и бис-алкилированные продукты, если таковые получали, очищали препаративной ВЭЖХ. Очищенные продукты растворяли в 1 мл HCl в изопропаноле (5-6M) и оставляли в течение ночи при комнатной температуре (у некоторых продуктов отщепляли BOC/tBu эфирные группы). Добавляли 2 мл воды и раствор сушили вымораживанием с получением продуктов в форме гидрохлоридов.
В соответствии с описанной процедурой, получали следующие продукты в виде гидрохлоридов из указанных аминового и карбонильного компонента (таблица 1)
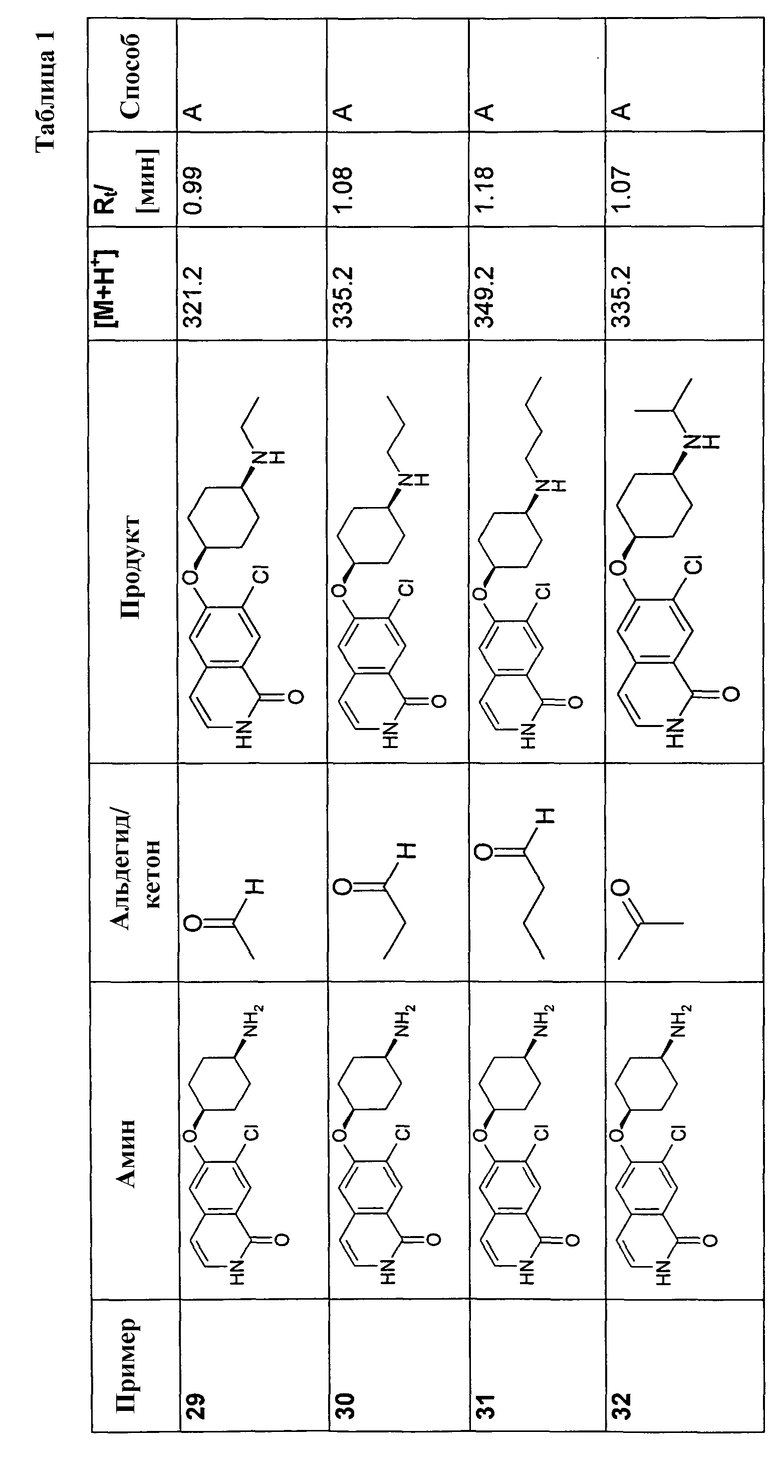
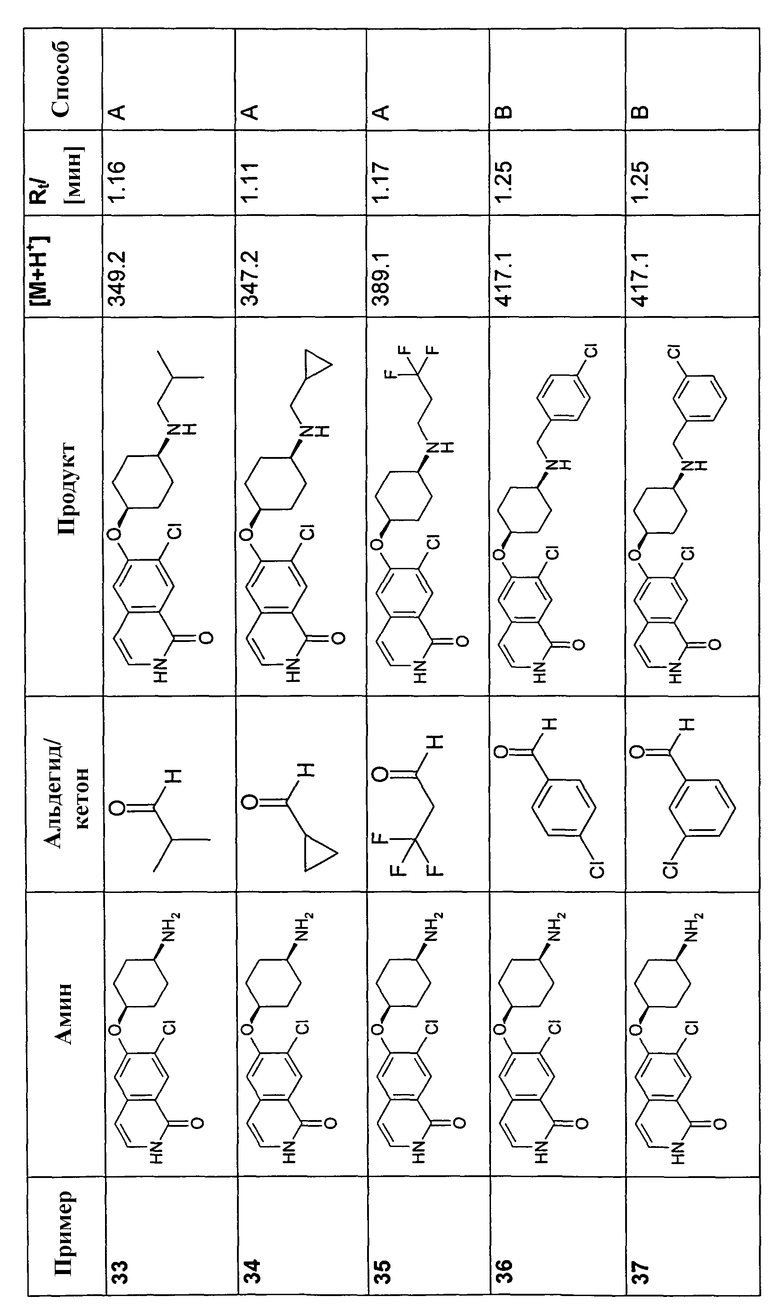
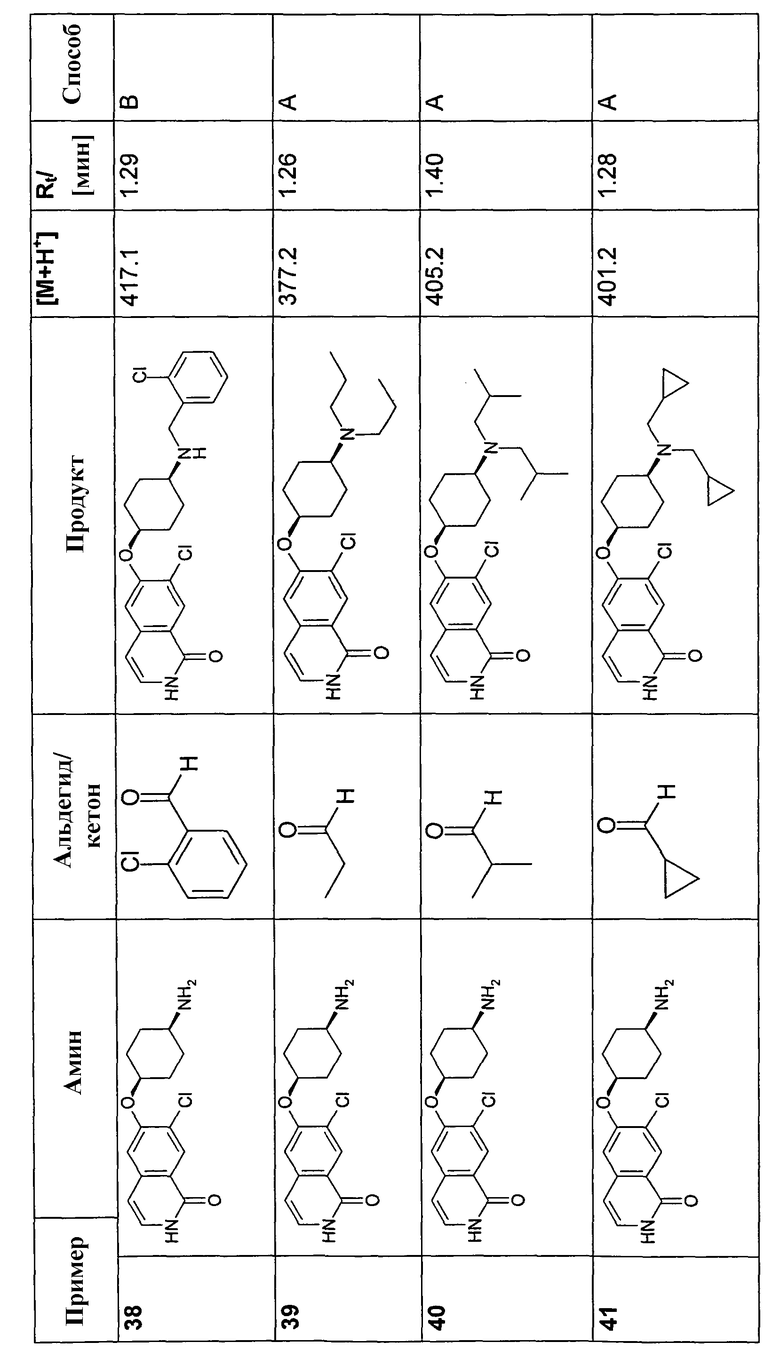
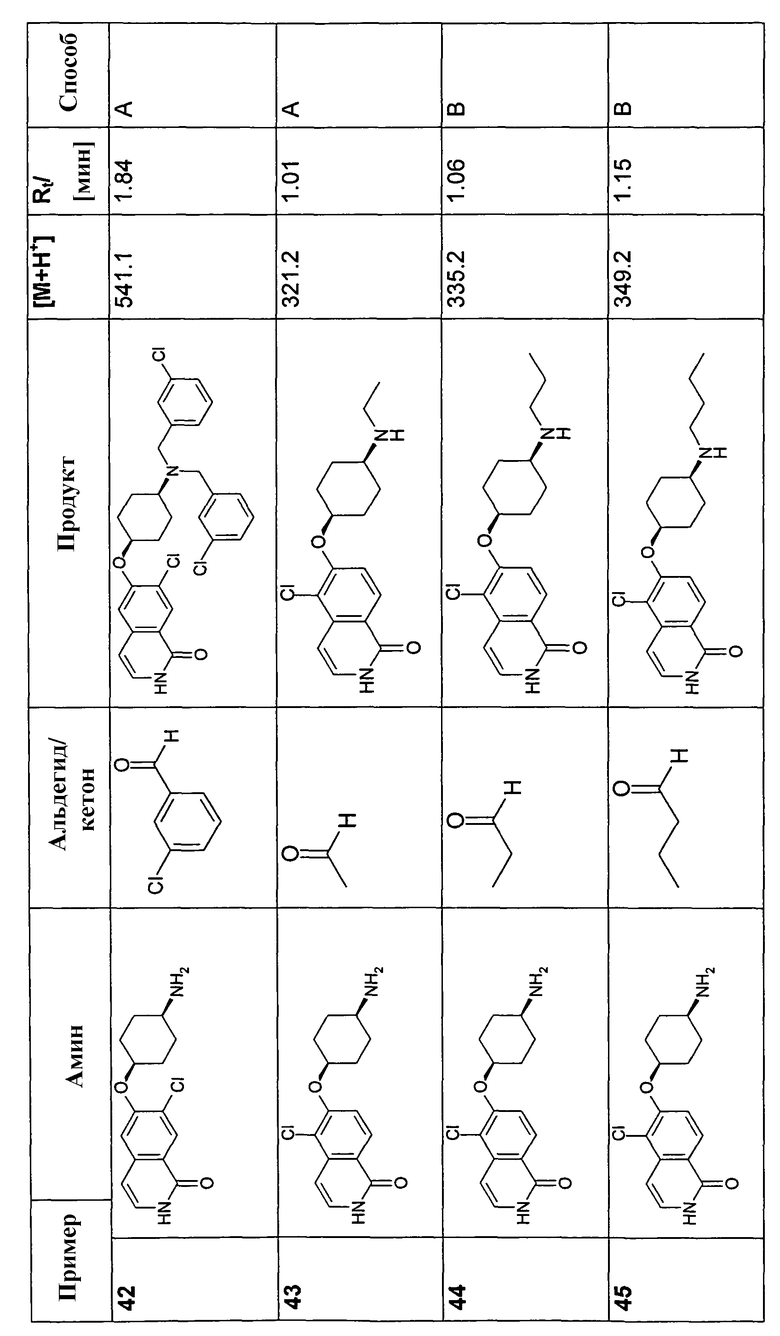
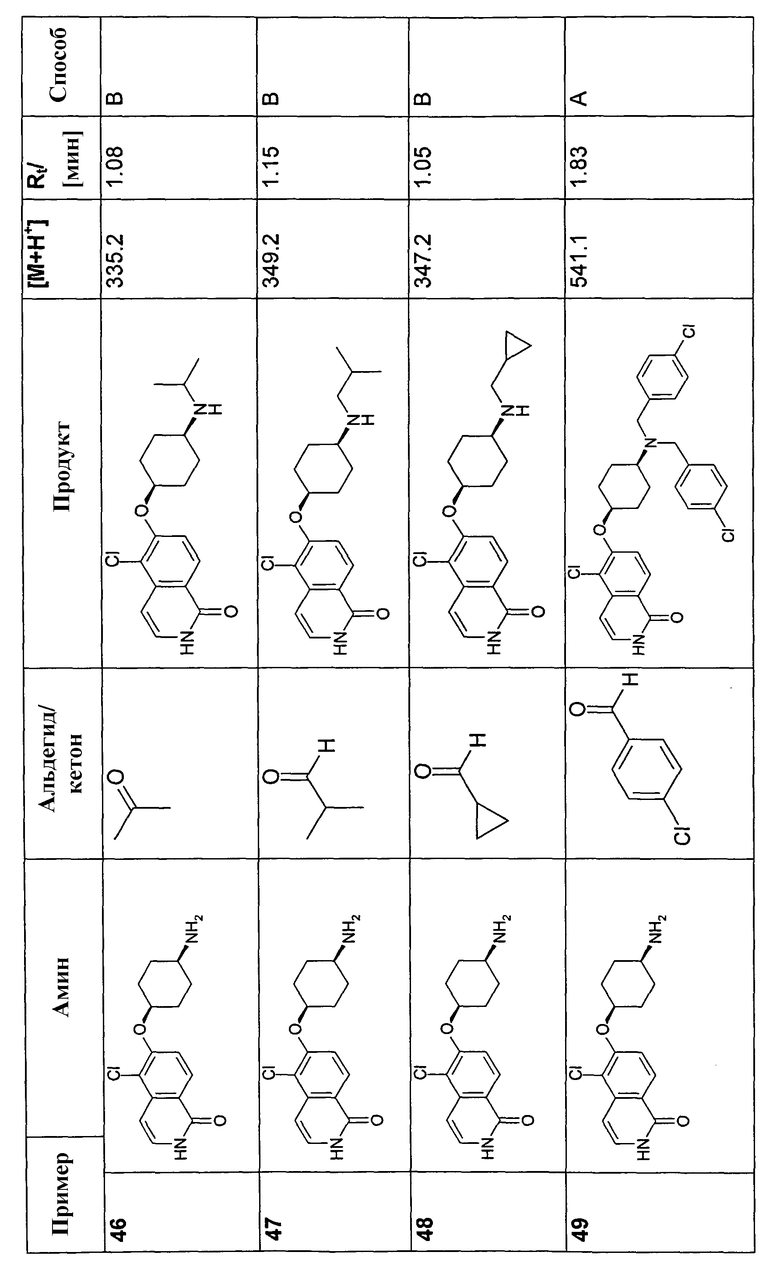
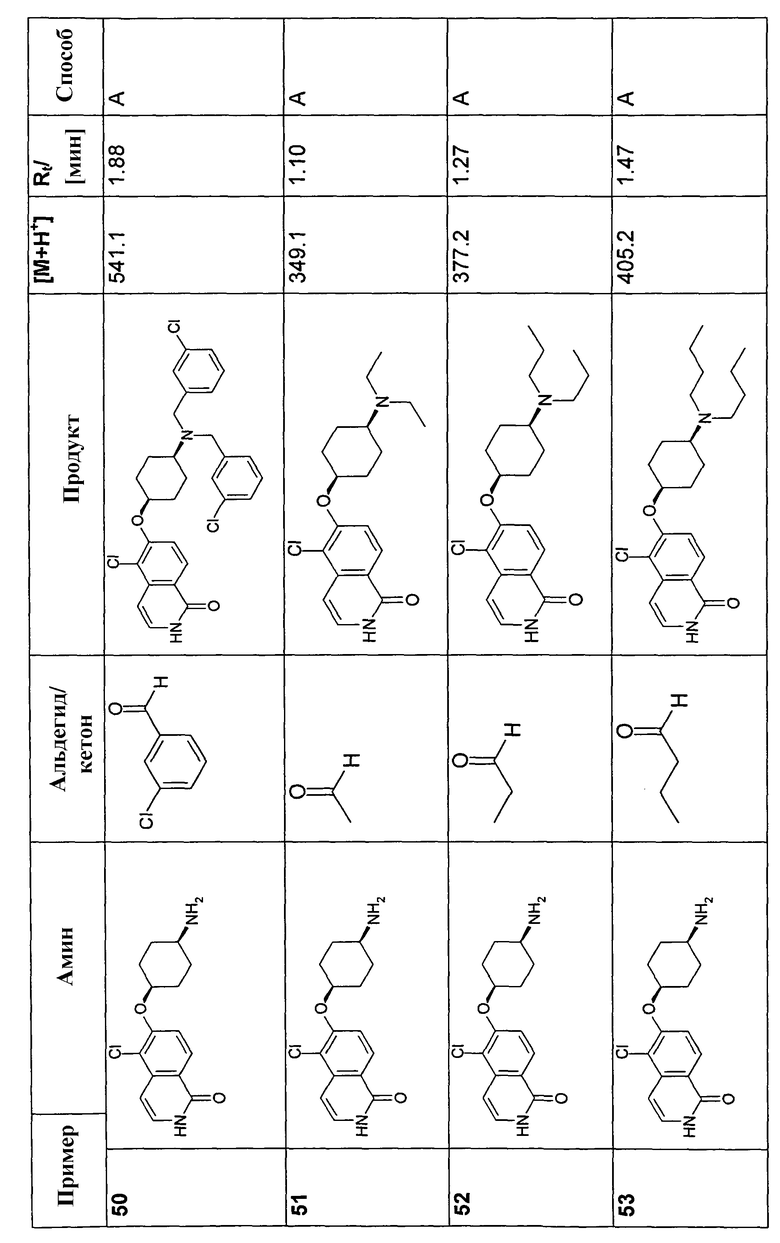
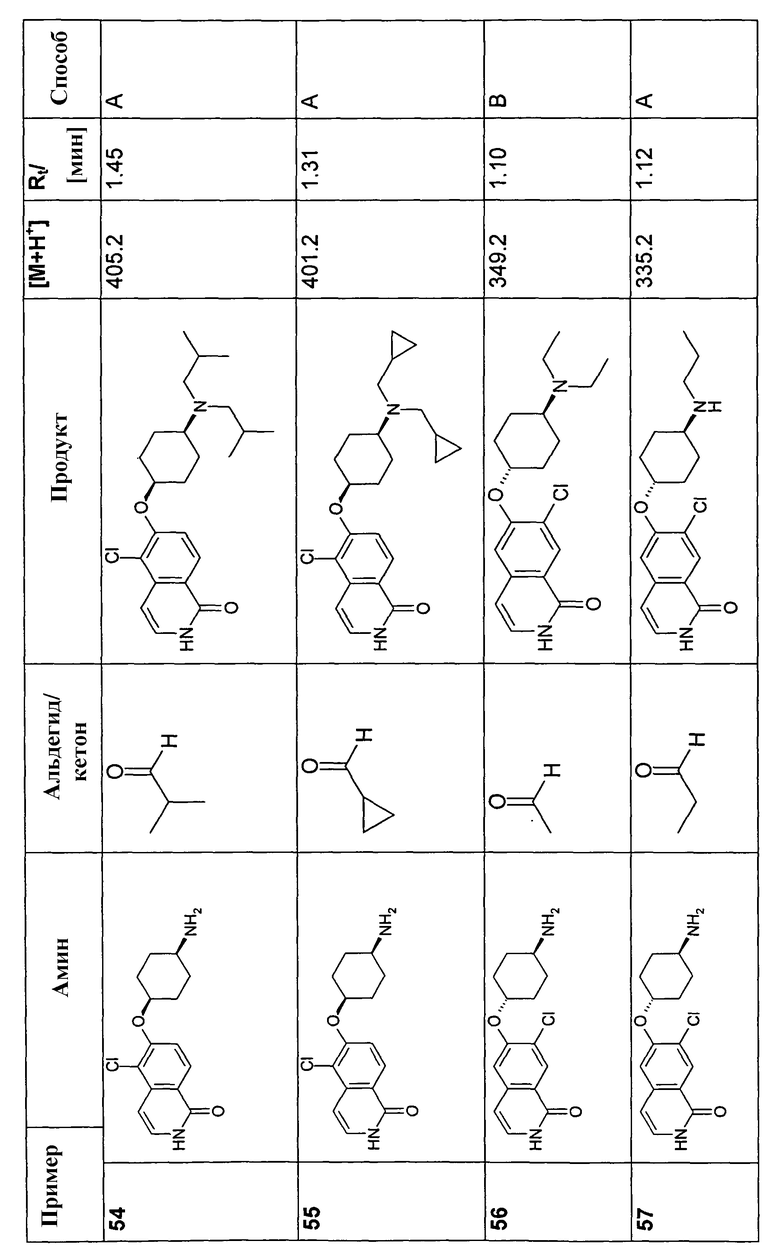
Общая процедура В для реакции восстановительного аминирования:
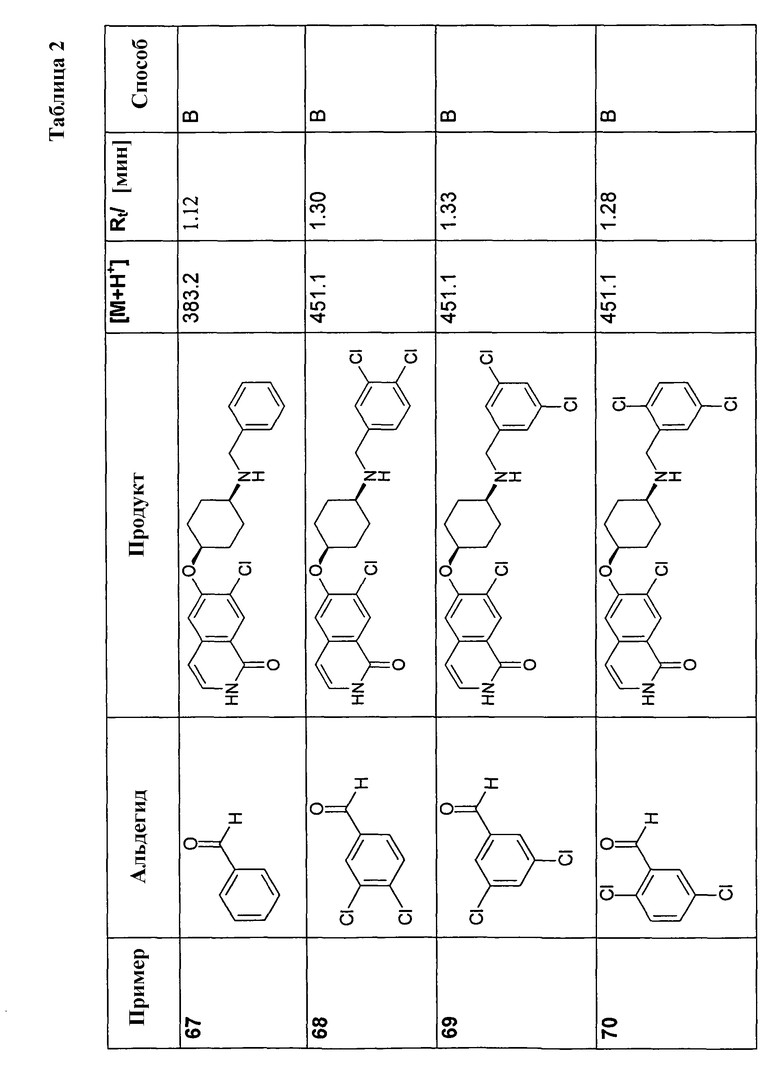
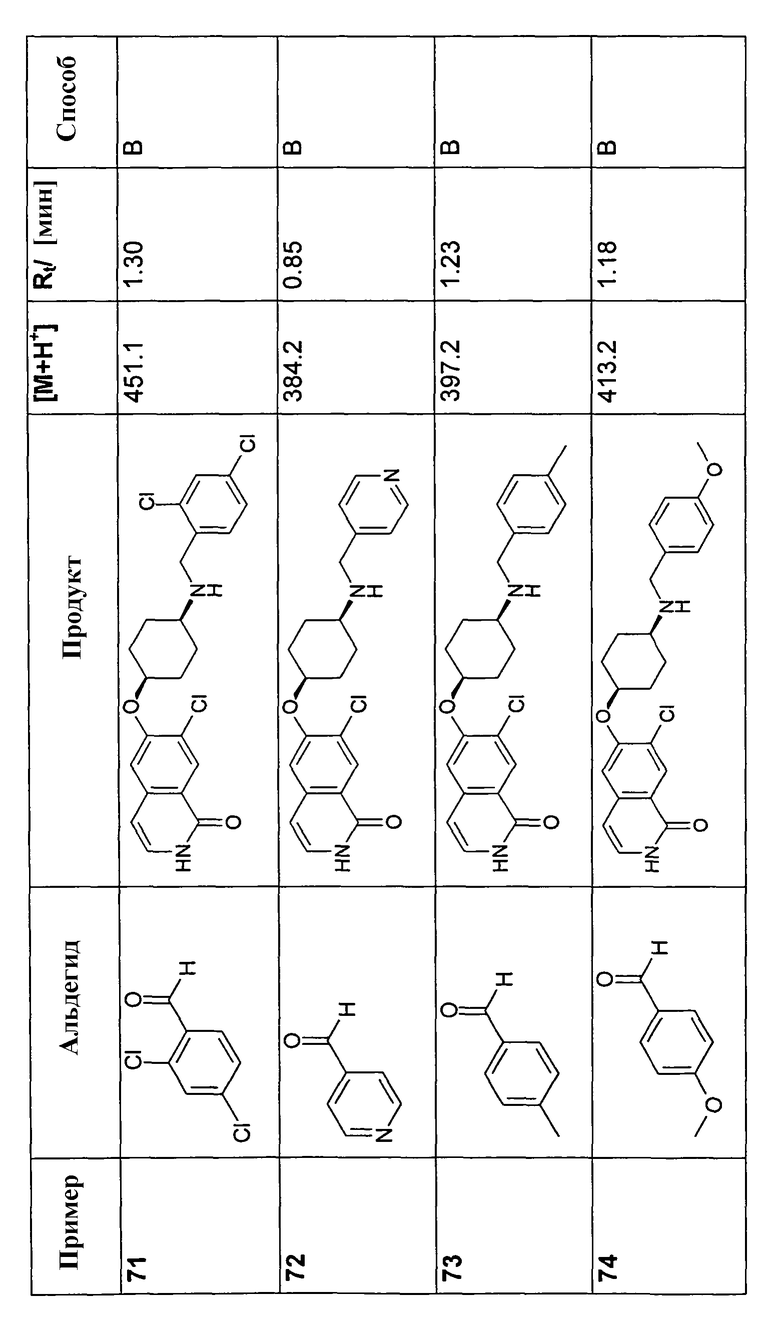
150 мг (0,46 ммоль) гидрохлорида 6-цис-(4-аминоциклогексилокси)-7-хлор-2H-изохинолин-1-она (10) растворяли в 10 мл метанола. После добавления молекулярных сит 4 A 92,3 мг (0,57 ммоль) триэтиламина, 273,8 мг (4,56 ммоль) уксусной кислоты и 0,57 ммоль соответствующего альдегида добавляли по каплям раствор 86,0 мг (1,37 ммоль) цианоборгидрида натрия и смесь перемешивали при комнатной температуре до достижения полной конверсии. В некоторых случаях необходимо было нагреть смесь до 70°C для достижения полной конверсии. Для выделения продуктов раствор фильтровали и растворитель удаляли при пониженном давлении. Остаток растворяли в дихлорметане, промывали 1 н. раствором NaOH и насыщенным раствором хлорида натрия, сушили при помощи сульфата магния и упаривали. Моно- и бис-алкилированные продукты, если таковые получали, очищали препаративной ВЭЖХ или осаждали из раствора HCl в метаноле.
Полученные трифторацетаты перемешивали в растворе 2 н. HCl/метанол, упаривали, растворяли в воде и сушили вымораживанием с получением желаемых продуктов в виде гидрохлоридов.
У Boc-защищенных продуктов удаляли защиту в процессе упаривания ВЭЖХ-фракций, содержащих продукт, которые содержали 0,1% TFA, или в процессе последующего перемешивания в растворе 2 н. HCl/метанол.
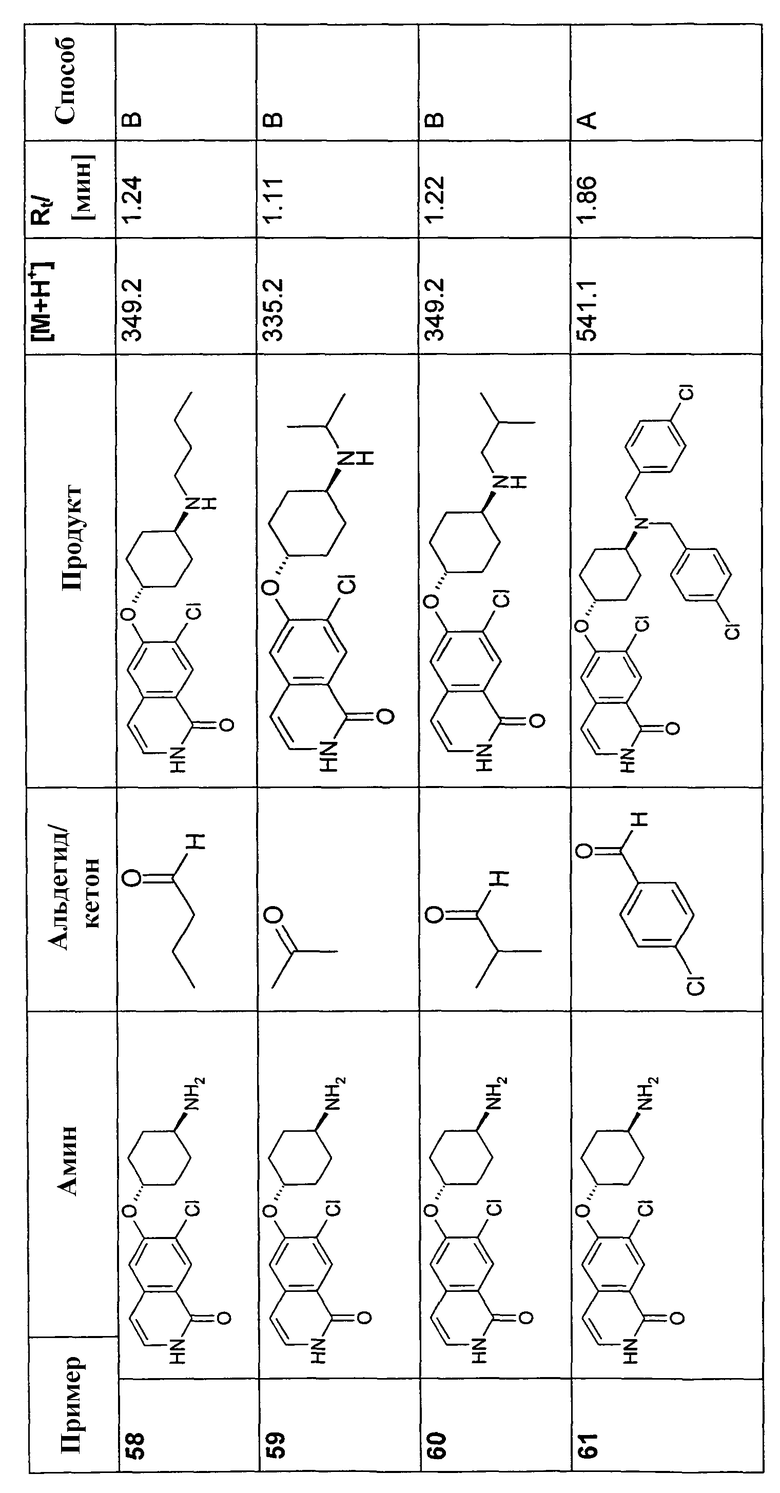
В соответствии с описанной процедурой, получали следующие продукты в виде гидрохлоридов из амина (10) и указанного альдегида (таблица 2)
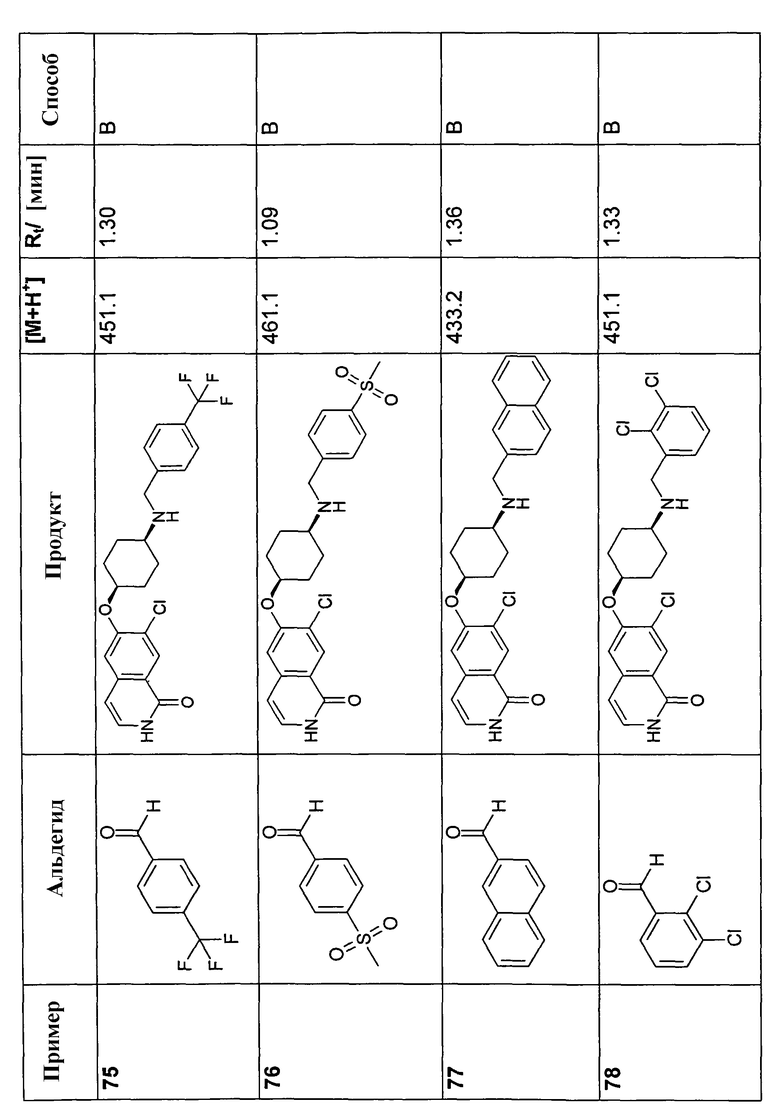
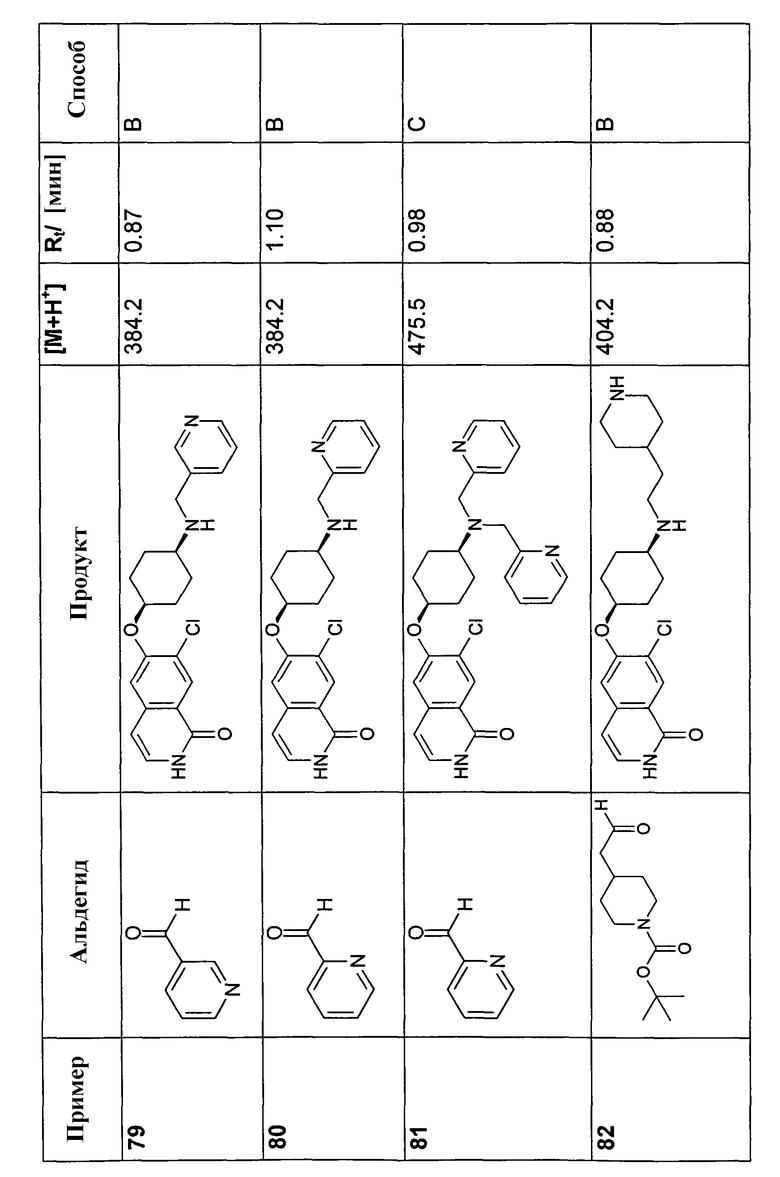
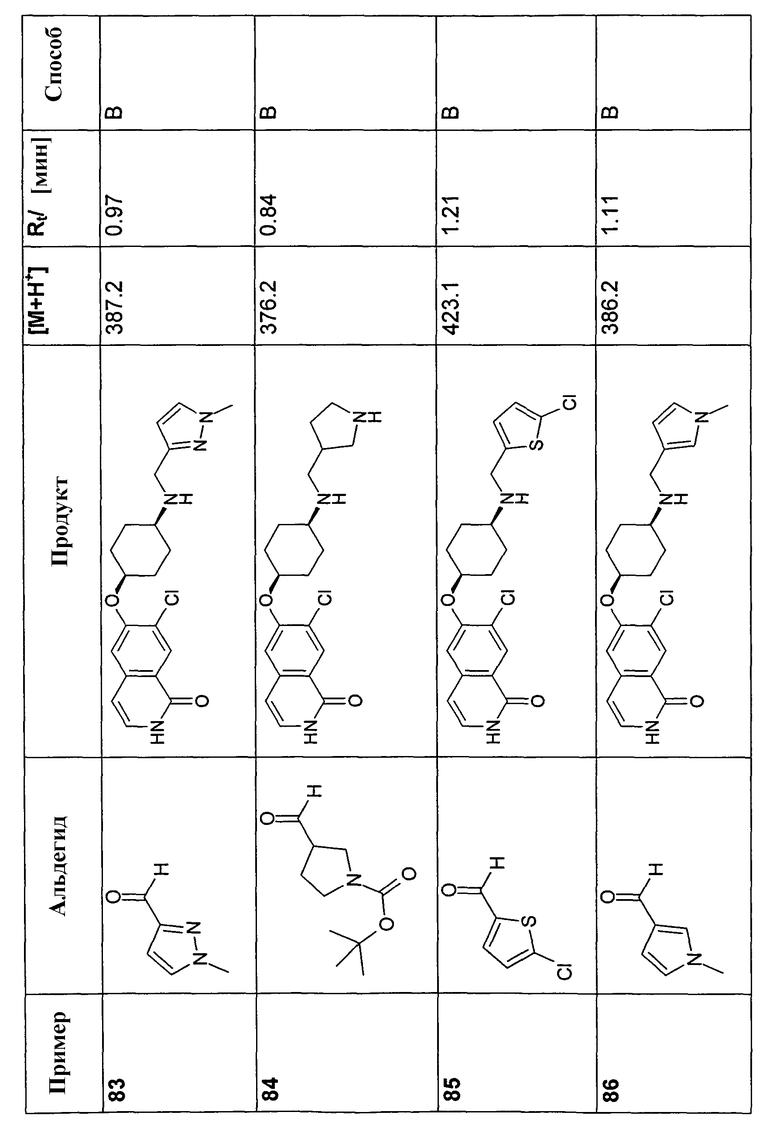
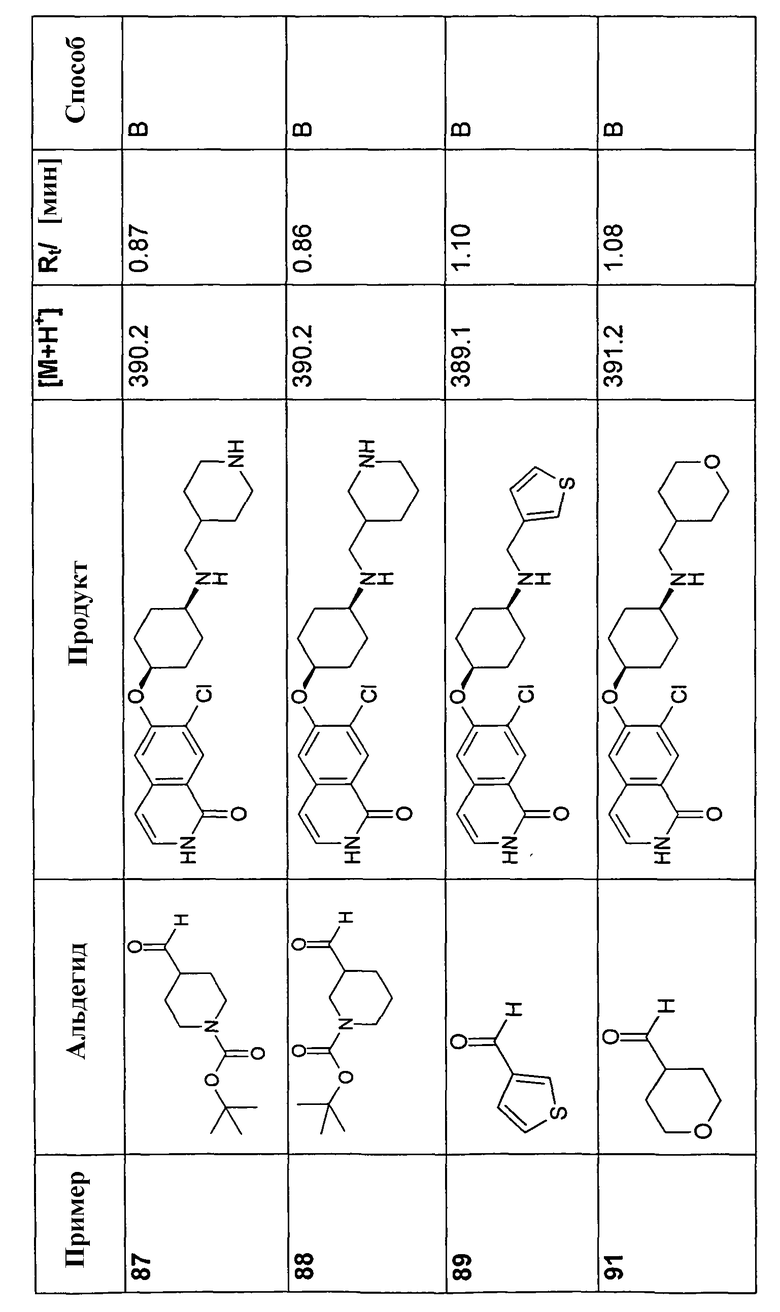
7-Бром-6-фторизохинолин 2-оксид (93)
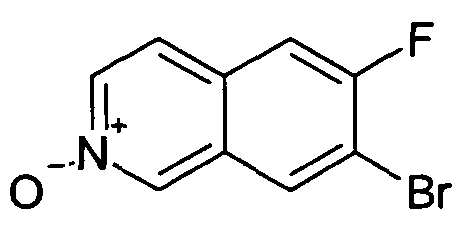
Исходя из соединения (92), получали указанное в заголовке соединение, следуя способу, описанному для 7-хлор-6-фторизохинолин 2-оксида (5). Rt=0,93 мин (Способ C). Определенная масса: 242,2/244,2 (M+H+).
7-Бром-1-хлор-6-фторизохинолин (94)
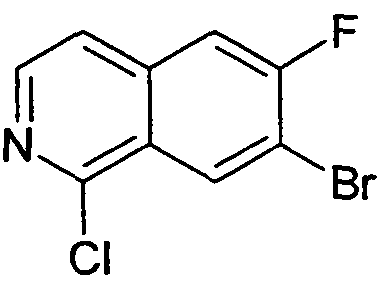
Исходя из 7-бром-6-фторизохинолин 2-оксида (93), желаемый продукт синтезировали в соответствии с протоколом, описанным для 1,7-дихлор-6-фторизохинолина (6). Rt=1,70 мин (Способ C). Определенная масса: 260,0/262,0 (M+H+).
7-Бром-6-фтор-2H-изохинолин-1-он (95)
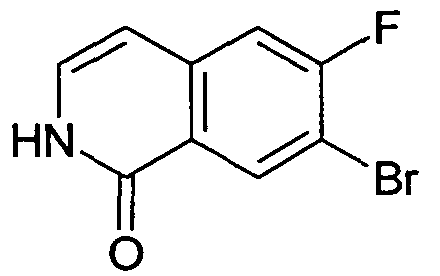
12,9 г (49,5 ммоль) 7-бром-1-хлор-6-фторизохинолина (94) растворяли в 250 мл уксусной кислоты. После добавления 38,7 г (0,5 моль) ацетата аммония раствор перемешивали при 100°C. Через 3 часа растворитель удаляли при пониженном давлении и остаток выливали в воду. Осадок отфильтровывали и сушили с получением 9,91 г (83%) указанного в заголовке соединения. Rt=1,15 мин (Способ C). Определенная масса: 242,2/244,1 (M+H+).
7-Бром-6-фтор-2-(4-метоксибензил)-2H-изохинолин-1-он (96)
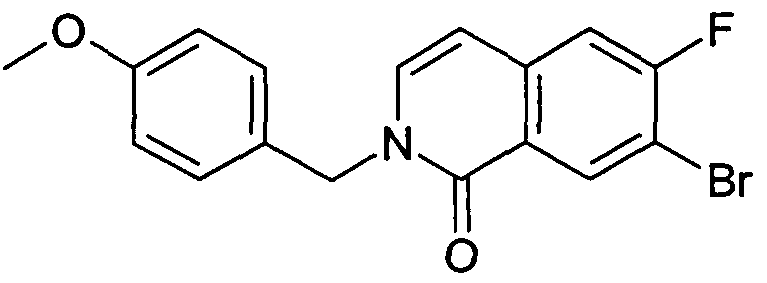
9,66 г (39,9 ммоль) 7-бром-6-фтор-2H-изохинолин-1-она (95) растворяли в 180 мл диметилацетамида и добавляли 1,92 г (48,0 ммоль) гидрида натрия (60%). Через 1 час при комнатной температуре добавляли раствор 7,50 г (48,0 ммоль) 4-метоксибензилхлорида в 25 мл диметилацетамида. Смесь перемешивали при комнатной температуре до достижения полной конверсии. Растворитель удаляли при пониженном давлении, осуществляли поглощение остатка в насыщенный раствор бикарбоната натрия и экстрагировали три раза дихлорметаном. Органические слои сушили при помощи сульфата магния и упаривали с получением 16,8 г неочищенного продукта в виде темного масла, которое перемешивали в метаноле. После отфильтровывания осадка получали 6,56 г указанного в заголовке соединения в виде желтого твердого вещества. Маточный раствор выпаривали и остаток очищали препаративной ВЭЖХ с получением дополнительных 2,62 г желаемого продукта. Rt=1,71 мин (Способ C). Определенная масса: 362,3/364,3 (M+H+).
6-цис-(4-Аминоциклогексилокси)-7-бром-2-(4-метоксибензил)-2H-изохинолин-1-он (97)
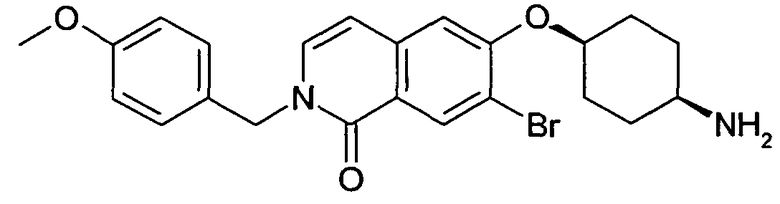
135 мг (0,625 ммоль) трет-бутилового эфира цис-(4-гидроксициклогексил)карбаминовой кислоты растворяли в 2,5 мл диметилацетамида и добавляли 30 мг (0,75 ммоль) гидрида натрия (60%). После перемешивания в течение 15 минут при комнатной температуре добавляли 181 мг (0,5 ммоль) 7-бром-6-фтор-2-(4-метоксибензил)-2H-изохинолин-1-она (96) и перемешивание продолжали. Для достижения полной конверсии через 3 часа добавляли еще 30 мг гидрида натрия (60%). После перемешивания в течение ночи добавляли 2 мл уксусной кислоты с последующим добавлением 2 мл 2 н. раствора HCl и смесь перемешивали при 50°C до завершения удаления защитной Boc-группы. Растворитель удаляли при пониженном давлении, остаток растворяли в насыщенном растворе бикарбоната натрия и экстрагировали три раза дихлорметаном. Органические слои сушили при помощи сульфата магния и упаривали. Конечная очистка препаративной ВЭЖХ давала 83 мг продукта в виде трифторацетата. Rt=1,31 мин (Способ B). Определенная масса: 457,2/459,2 (M+H+).
6-цис-(4-Аминоциклогексилокси)-7-бром-2H-изохинолин-1-он (98)
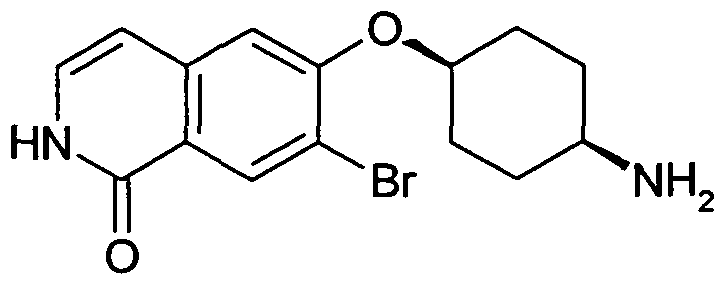
62 мг (0,11 ммоль) 6-(4-аминоциклогексилокси)-7-бром-2-(4-метоксибензил)-2H-изохинолин-1-он трифторацетата (97) растворяли в 2 мл TFA и нагревали в микроволновой печи при 140°C в течение 2 часов. Растворитель удаляли при пониженном давлении. Остаток растворяли в 2 н. растворе HCl и промывали два раза дихлорметаном. Объединенные органические слои экстрагировали при помощи 2 н. раствора HCl и объединенные водные растворы упаривали. Остатки растворяли в воде и сушили вымораживанием. Конечная очистка препаративной ВЭЖХ давала 8 мг желаемого продукта в виде трифторацетата. комнатной Rt=0,86 мин (Способ B). Определенная масса: 337,1/339,1 (M+H+).
6-транс-(4-Аминоциклогексилокси)-7-бром-2-(4-метоксибензил)-2H-изохинолин-1-он (99)
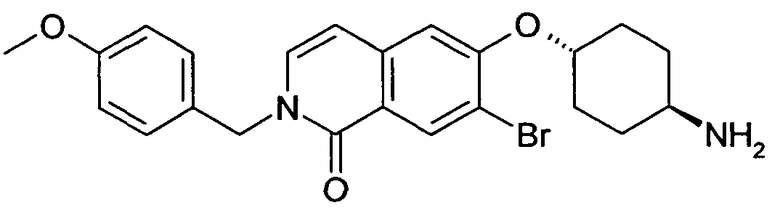
Исходя из трет-бутилового эфира транс-(4-гидроксициклогексил)карбаминовой кислоты и 7-бром-6-фтор-2-(4-метоксибензил)-2H-изохинолин-1-она (96), указанное в заголовке соединение синтезировали, следуя протоколу, описанному для 6-цис-(4-аминоциклогексилокси)-7-бром-2-(4-метоксибензил)-2H-изохинолин-1-она (97). Rt=1,34 мин (Способ B). Определенная масса: 457,2/459,2 (M+H+).
6-транс-(4-Аминоциклогексилокси)-7-бром-2H-изохинолин-1-он (100)
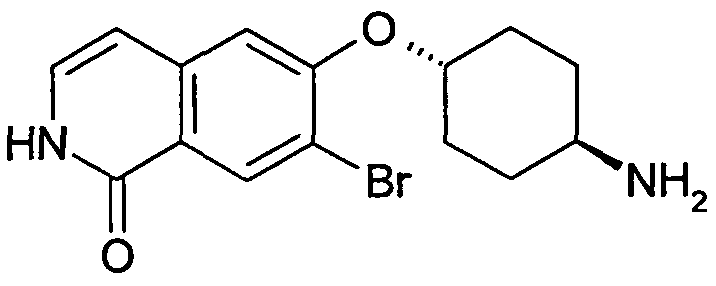
Исходя из 6-транс-(4-аминоциклогексилокси)-7-бром-2-(4-метоксибензил)-2H-изохинолин-1-она (99), желаемый продукт получали способом, описанным для 6-цис-(4-аминоциклогексилокси)-7-бром-2H-изохинолин-1-она (98). Соединение выделяли в виде трифторацетата. Rt=0,88 мин (Способ B). Определенная масса: 337,1/339,1 (M+H+).
7-Хлор-6-фтор-2H-изохинолин-1-он (101)
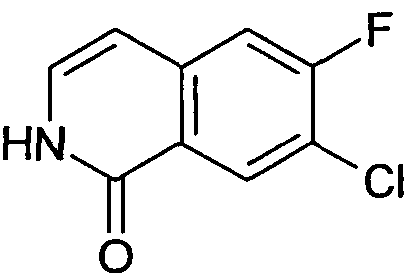
Исходя из 1,7-дихлор-6-фторизохинолина (6), получали указанное в заголовке соединение, следуя протоколу, описанному для 7-бром-6-фтор-2H-изохинолин-1-она (95). Rt=1,11 мин (Способ C). Определенная масса: 198,2 (M+H+).
7-Хлор-6-фтор-2-(4-метоксибензил)-2H-изохинолин-1-он (102)
Исходя из 7-хлор-6-фтор-2H-изохинолин-1-она (101), получали указанное в заголовке соединение, следуя протоколу, описанному для 7-бром-6-фтор-2-(4-метоксибензил)-2H-изохинолин-1-она (96). Rt=1,66 мин (Способ C). Определенная масса: 318,3 (M+H+).
1-Бензилокси-7-хлор-6-фторизохинолин (103)
14,74 г (74,6 ммоль) 7-хлор-6-фтор-2H-изохинолин-1-он (101) растворяли в 150 мл толуола. После добавления 30,86 г (111,9 ммоль) карбоната серебра и 15,31 г (89,5 ммоль) бензилбромида смесь перемешивали при 80°C в течение 3 часов. После охлаждения до комнатной температуры реакционную смесь фильтровали и фильтрат упаривали. Остаток растворяли в дихлорметане и промывали водой, сушили при помощи сульфата магния и упаривали. Конечная очистка препаративной ВЭЖХ давала 11,63 г указанного в заголовке соединения. Rt=2,51 мин (Способ B). Определенная масса: 288,1/290,1 (M+H+).
Общая процедура для реакции 7-хлор-6-фтор-2-(4-метокси-бензил)-2H-изохинолин-1-он арилхлоридов (102) и 1-бензилокси-7-хлор-6-фторизохинолина (103) с реагентами Гриньяра в условиях катализа Fe(acac)3.
2 ммоль соответствующего арилхлорида и 35,3 мг (0,1 ммоль) ацетилацетоната железа(III) растворяли в 24 мл ТГФ и добавляли 2 мл NMP. При 0°C добавляли через шприц в атмосфере аргона 2,4 ммоль реагента Гриньяра и реакционную смесь перемешивали при 0°C в течение 10 минут. Для достижения полной конверсии в некоторых случаях добавляли еще 0,6 ммоль реагента Гриньяра и перемешивание продолжали в течение 10 минут.
В случае N-PMB-защищенных соединений, реакцию гасили, выливая реакционную смесь в 1M HCl. O-Бензил-защищенные аналоги гасили, выливая в насыщенный раствор NH4Cl.
Смесь упаривали и остаток растворяли в дихлорметане и промывали водой. Органический слой сушили при помощи Na2SO4 и растворитель удаляли при пониженном давлении. Конечная очистка препаративной ВЭЖХ давала желаемые 7-алкилированные производные.
В соответствии с описанной процедурой, получали следующие продукты из указанных арилхлорида и реагента Гриньяра (таблица 3).
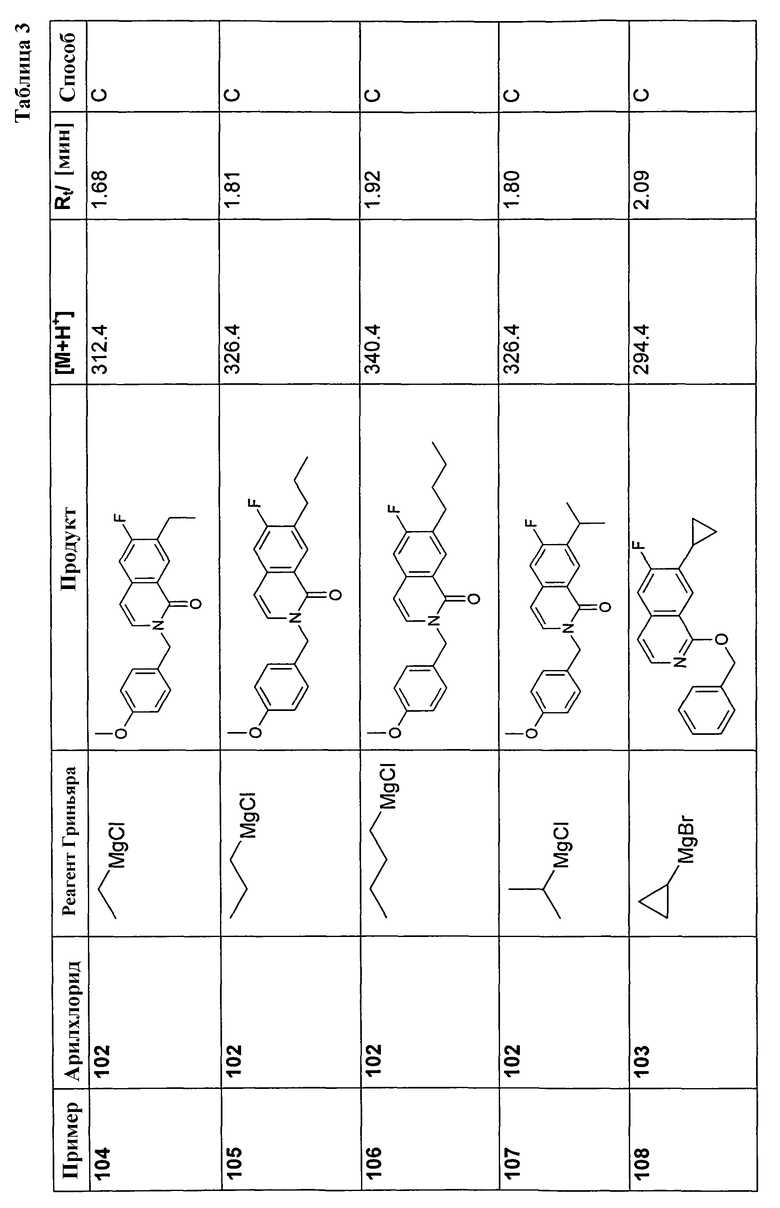
6-цис-(4-Аминоциклогексилокси)-2-(4-метоксибензил)-7-пропил-2H-изохинолин-1-он (109)
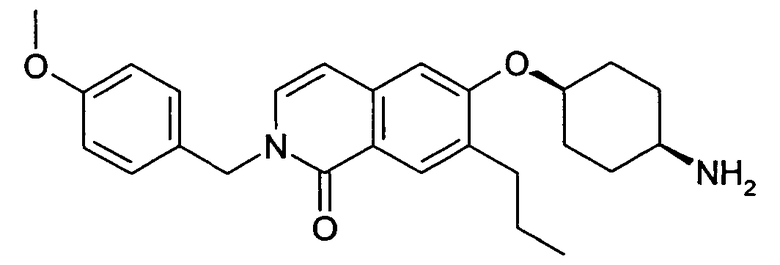
58 мг (0,38 ммоль) гидрохлорида цис 4-аминоциклогексанола растворяли в 10 мл диметилацетамида. В атмосфере аргона добавляли 38 мг (0,96 ммоль) гидрида натрия (60%) и реакционную смесь перемешивали в течение 30 минут при комнатной температуре. После добавления раствора 100 мг (0,31 ммоль) 6-фтор-2-(4-метоксибензил)-7-пропил-2H-изохинолин-1-она (105) раствор перемешивали при 80°C. Для достижения полной конверсии добавляли два раза такие же количества гидрохлорида 4-аминоциклогексанола и гидрида натрия и температуру повышали до 110°C. По достижении полной конверсии растворитель удаляли при пониженном давлении. Остаток растворяли в дихлорметан и промывали водой. Органический слой сушили при помощи сульфата магния и упаривали. После очистки препаративной ВЭЖХ выделяли желаемый продукт в виде трифторацетата. Rt=1,14 мин (Способ C). Определенная масса: 421,6 (M+H+).
Следующие соединения получали в виде трифторацетатов, следуя протоколу, описанному для 6-цис-(4-аминоциклогексилокси)-2-(4-метоксибензил)-7-пропил-2H-изохинолин-1-она (109) (таблица 4):
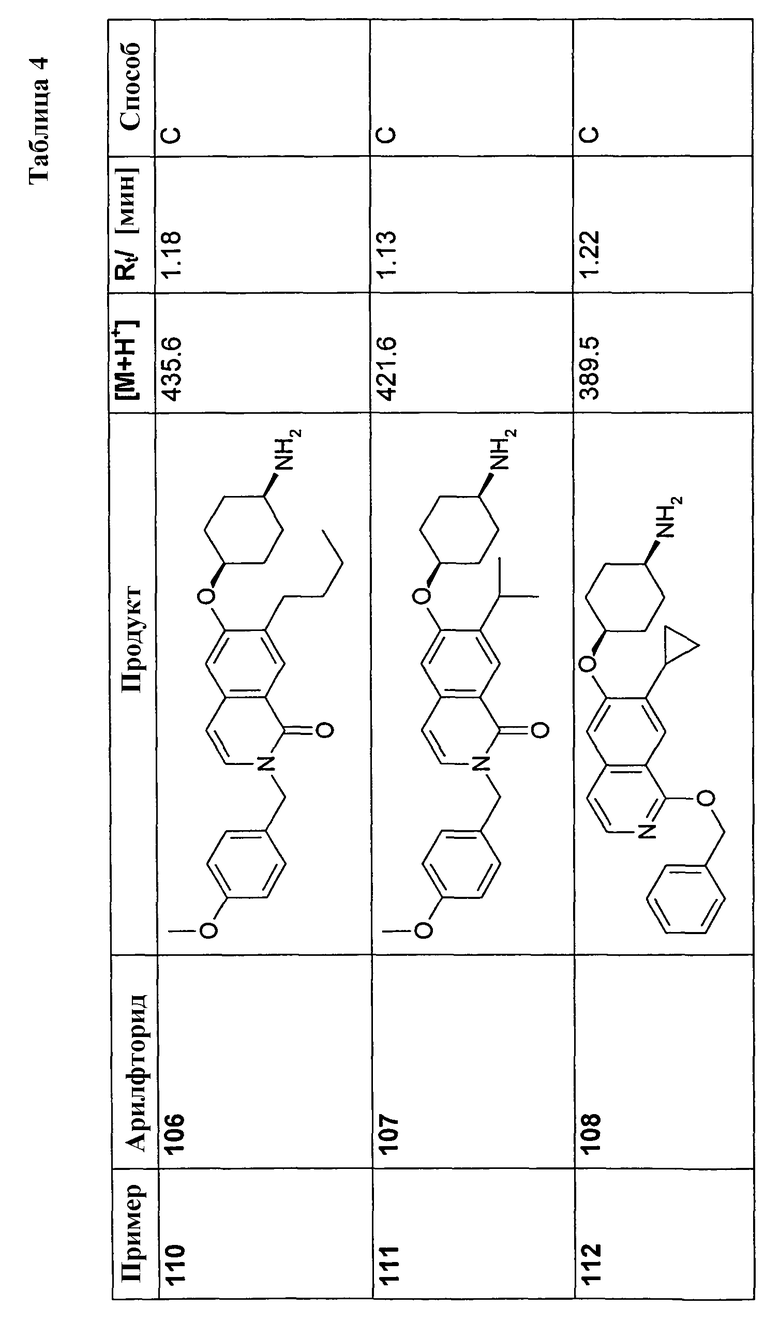
Удаление защиты N-PMB-защищенных изохинолинонов 109, 110 и 111
Защищенные исходные соединения нагревали в TFA в микроволновой печи при 140°C до тех пор, пока не наблюдали достижение полной конверсии. Выпаривание растворителя и очистка препаративной ВЭЖХ давали желаемые продукты с удаленными защитными группами в виде трифторацетатов, которые растворяли в 2 н. растворе HCl и упаривали. После растворения остатка в воде и лиофилизации соединения выделяли в виде HCl-солей.
Удаление защиты у O-бензил-защищенного изохинолинона 112
4-(1-Бензилокси-7-циклопропилизохинолин-6-илокси)циклогексиламин (112) перемешивали в 2 н. растворе HCl при комнатной температуре до достижения полной конверсии. После выпаривания растворителя при пониженном давлении неочищенный продукт очищали препаративной ВЭЖХ, которая давала желаемый продукт в виде трифторацетата. Продукт растворяли в 2 н. растворе HCl и растворитель удаляли при пониженном давлении. После растворения остатка в воде и лиофилизации продукт выделяли в виде HCl-соли.
После удаления защиты из соединений 109-112 выделяли следующие соединения в виде солей HCl (таблица 5):
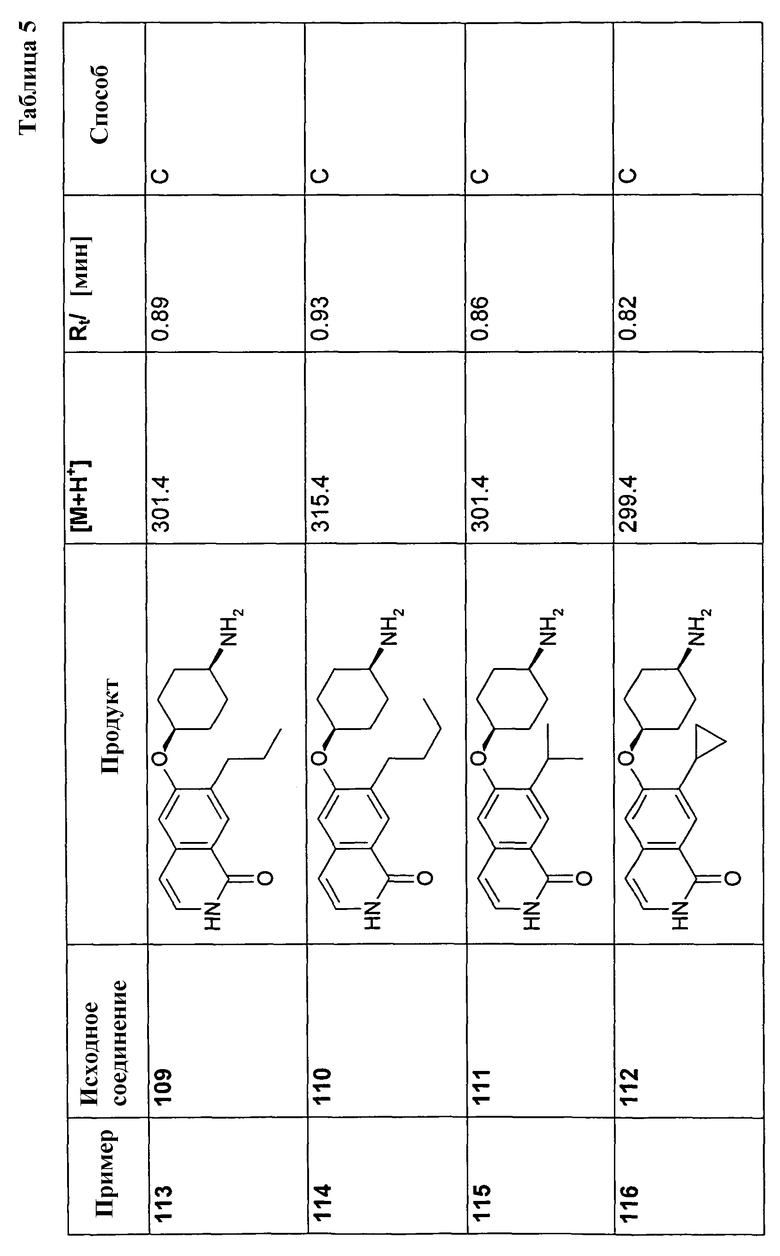
Общая процедура С для реакции восстановительного аминирования:
82 мг (0,25 ммоль) гидрохлорида 6-транс-(4-аминоциклогексилокси)-7-хлор-2H-изохинолин-1-она (14) растворяли в 3 мл триметоксиметана. Добавляли 0,25 ммоль соответствующего альдегида или кетона (растворенного в 0,2 мл ТГФ или в виде твердого вещества) с последующим добавлением 48 мг (0,375 ммоль) триэтиламина. После выдерживания в течение 1 часа при комнатной температуре раствор охлаждали до -10°C и добавляли раствор 265 мг (1,25 ммоль) триацетоксиборгидрида натрия в 1,5 мл ДМФА с последующим добавлением 73,5 мг (1,225 ммоль) уксусной кислоты. После выдерживания в течение 30 мин при 0°C раствор оставляли при комнатной температуре в течение ночи. Для дальнейшей обработки добавляли 0,5 мл воды и растворитель удаляли при пониженном давлении. Остаток очищали препаративной ВЭЖХ. Полученные трифторацетаты растворяли в 1,0 мл раствора 5-6 M HCl в изопропаноле и оставляли при комнатной температуре в течение ночи. После добавления 2,0 мл воды растворы подвергали лиофилизации с получением желаемых продуктов в виде солей HCl.
Соединения, перечисленные в таблице 6 ниже, синтезировали в соответствии с указанным способом и получали в виде солей HCl:
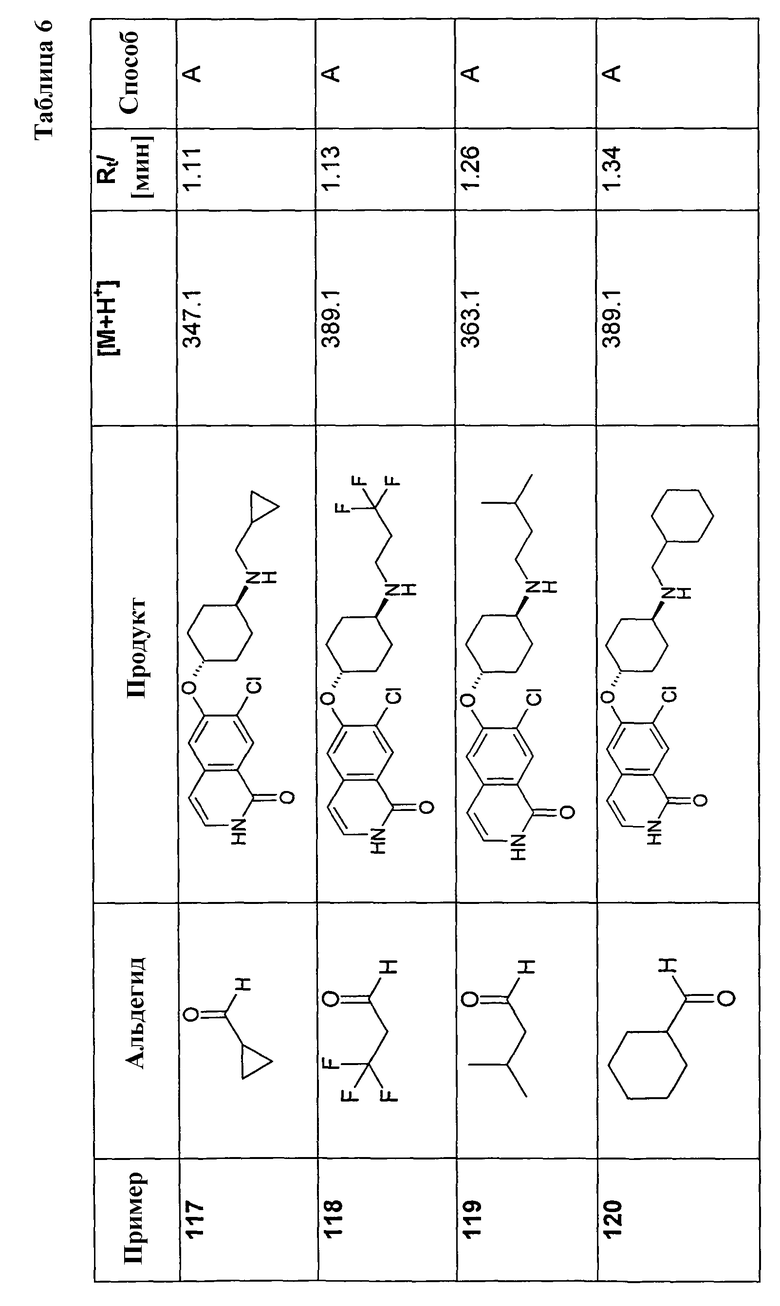
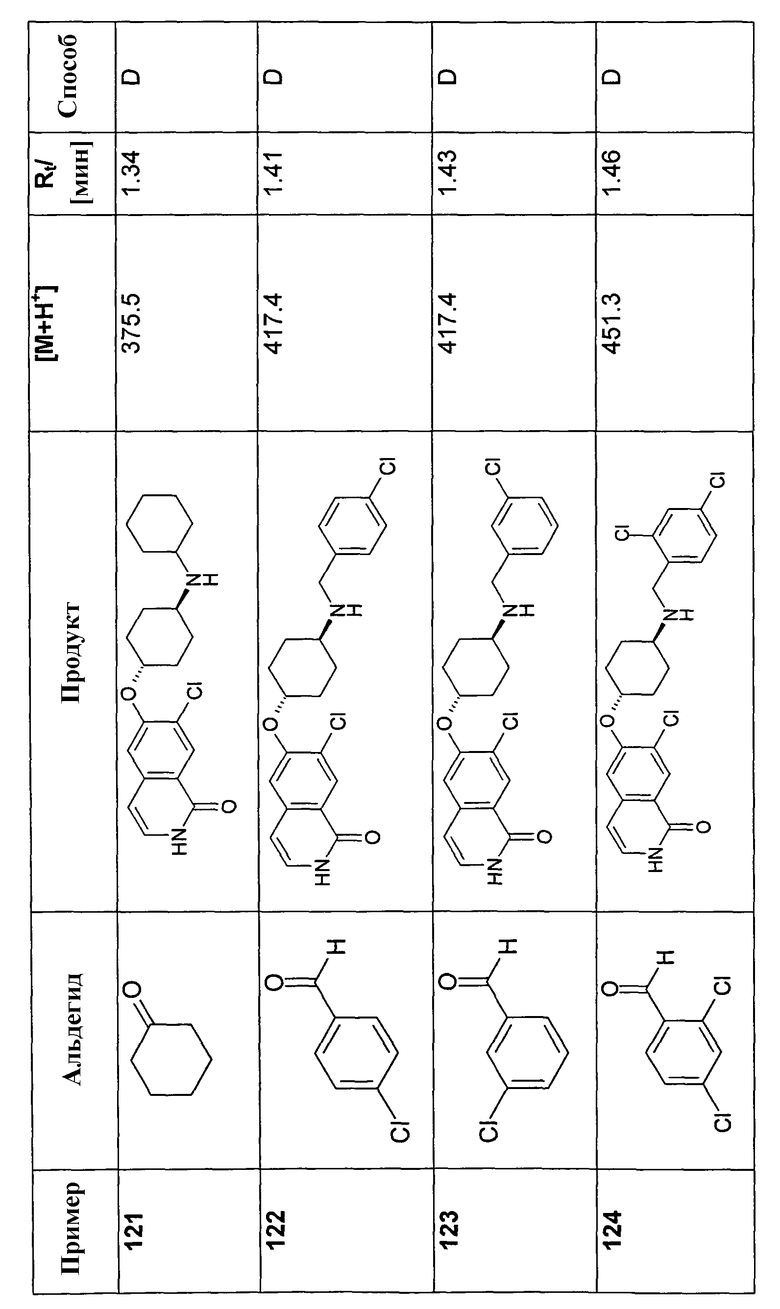
6-[цис-4-(Циклопропилметиламино)циклогексилокси]-2H-изохинолин-1-он (125)
Соединение 125 получали в виде гидрохлорида при помощи описанного выше общего способа, используя циклопропанкарбальдегид и цис-6-(4-аминоциклогексилокси)-2H-изохинолин-1-он (28) в качестве исходных веществ. Rt=1,04 мин (Способ B). Определенная масса: 313,2 (M+H+).
7-Бензилсульфанил-6-фтор-2-(4-метоксибензил)-2H-изохинолин-1-он (126)
500 мг (1,38 ммоль) 7-бром-6-фтор-2-(4-метоксибензил)-2H-изохинолин-1-она (96), 627,3 мг (1,52 ммоль) бензилтиолата трибутилолова, 96,2 мг (1,66 ммоль) свежевысушенного фторида калия и 24,0 мг (0,041 ммоль) XANTPHOS растворяли в 5 мл NMP и перемешивали в течение 15 мин при комнатной температуре. После добавления 19,0 мг (0,021 ммоль) Pd2dba3 реакционную смесь перемешивали при 100°C. Для достижения полной конверсии добавляли еще 0,01 ммоль Pd2dba3 и перемешивание продолжали при 100°C. После выдерживания в течение 5 часов раствор охлаждали до комнатной температуры, разбавляли этилацетатом (10 мл) и обрабатывали 5% раствором KF. Смесь интенсивно перемешивали в течение 15 минут и фильтровали. Фильтрат отделяли и органическую фазу промывали два раза водой и один раз насыщенным раствором хлорида натрия. После сушки при помощи сульфата магния органический слой упаривали и неочищенный продукт очищали препаративной ВЭЖХ. Rt=1,83 мин (Способ C). Определенная масса: 406,5 (M+H+).
6-(4-Аминоцис-циклогексилокси)-7-бензилсульфанил-2-(4-метоксибензил)-2H-изохинолин-1-он (127)
90 мг (0,59 ммоль) гидрохлорида цис-4-аминоциклогексанола растворяли в 10 мл диметилацетамида и 59,3 мг (1,48 ммоль) добавляли гидрид натрия (60%). После перемешивания в течение 30 минут при комнатной температуре добавляли раствор 200 мг (0,49 ммоль) 7-бензилсульфанил-6-фтор-2-(4-метоксибензил)-2H-изохинолин-1-она (126) в 20 мл диметилацетамида и смесь перемешивали при 80°C в течение 1 часа, затем при 130°C в течение 3 часов. Добавляли еще 1,2 эквивалента гидрохлорида цис 4-аминоциклогексанола и 2,5 эквивалентов гидрида натрия и температуру повышали до 160°C. Через 8 часов раствор охлаждали до комнатной температуры и растворитель удаляли при пониженном давлении. Остаток растворяли в дихлорметане, промывали водой и сушили при помощи сульфата магния. После выпаривания растворителя и очистки препаративной ВЭЖХ выделяли указанное в заголовке соединение в виде трифторацетата. Rt=1,18 мин (Способ C). Определенная масса: 501,6 (M+H+).
N-{4-[7-Бензилсульфанил-2-(4-метоксибензил)-1-оксо-1,2-дигидроизохинолин-6-илокси]цис-циклогексил}ацетамид (128)
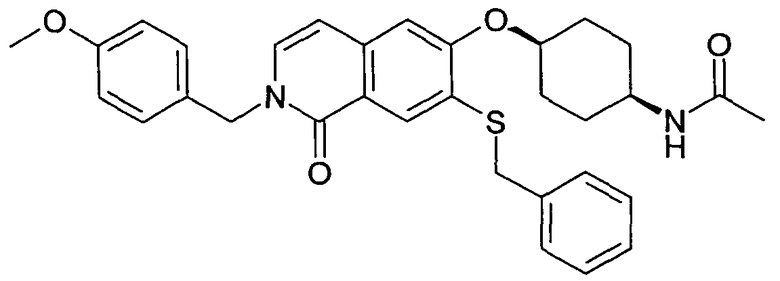
45 мг (0,073 ммоль) 6-(4-амино-цис-циклогексилокси)-7-бензилсульфанил-2-(4-метоксибензил)-2H-изохинолин-1-она (127) растворяли в 5 мл дихлорметана и добавляли 14,8 мг (0,146 ммоль) триэтиламина. При 0°C добавляли 6,9 мг (0,088 ммоль) ацетилхлорида и раствор перемешивали при комнатной температуре. Через 2 часа добавляли дихлорметан и раствор промывали 2 н. раствором HCl и насыщенным раствором бикарбоната натрия. После сушки при помощи сульфата магния и выпаривания растворителя выделяли указанное в заголовке соединение в виде неочищенного продукта, который использовали без дополнительной очистки. Rt=1,53 мин (Способ C). Определенная масса: 543,6 (M+H+).
6-(4-Ацетиламино-цис-циклогексилокси)-4-хлор-2-(4-метоксибензил)-1-оксо-1,2-дигидроизохинолин-7-сульфонилхлорид (129)

37 мг N-{4-[7-бензилсульфанил-2-(4-метоксибензил)-1-оксо-1,2-дигидроизохинолин-6-илокси]циклогексил}ацетамида (128, неочищенный продукт) растворяли в 5 мл дихлорметана. При 0°C добавляли 16,4 мг (0,273 ммоль) уксусной кислоты, 4,9 мг (0,273 ммоль) воды и 273 мкл (0,273 ммоль) сульфурилхлорида (1M в дихлорметане). Через 30 минут добавляли этилацетат и раствор промывали раствором бикарбонатом натрия (2%), водой и насыщенным раствором хлорида натрия. Органический слой сушили при помощи Na2SO4 и упаривали. Полученный, таким образом, неочищенный продукт использовали без дополнительной очистки. Rt=1,55 мин (Способ C). Определенная масса: 553,5 (M+H+).
N-{4-[4-Хлор-2-(4-метоксибензил)-1-оксо-7-сульфамоил-1,2-дигидроизохинолин-6-илокси]цис-циклогексил}ацетамид (130)
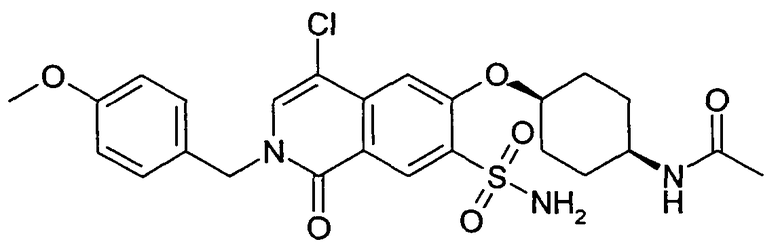
К раствору 29 мг 6-(4-ацетиламино-цис-циклогексилокси)-4-хлор-2-(4-метоксибензил)-1-оксо-1,2-дигидроизохинолин-7-сульфонилхлорида (129, неочищенный продукт) в 2 мл ТГФ добавляли 2 мл 33% водного раствора аммиака. После выдерживания в течение 1 часа при комнатной температуре растворитель удаляли при пониженном давлении и неочищенный продукт использовали без дополнительной очистки. Rt=1,22 мин (Способ C). Определенная масса: 534,5 (M+H+).
Амид 6-(4-амино-цис-циклогексилокси)-4-хлор-2-(4-метоксибензил)-1-оксо-1,2-дигидроизохинолин-7-сульфоновой кислоты (131)
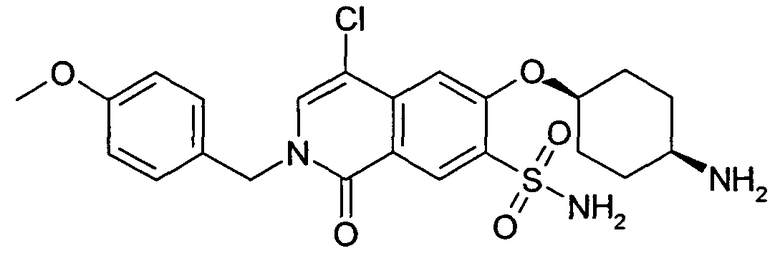
32 мг N-{4-[4-хлор-2-(4-метоксибензил)-1-оксо-7-сульфамоил-1,2-дигидроизохинолин-6-илокси]цис-циклогексил}ацетамида (130, неочищенный продукт) растворяли в 5 мл этанола и 15 мл 2 н. раствора HCl и нагревали в течение 2 часов при 90°C. Растворитель удаляли при пониженном давлении и остаток растворяли в 6 н. растворе HCl и продолжали нагревание при 90°C в течение 20 часов. После охлаждения до комнатной температуры водный раствор упаривали и выделяли указанное в заголовке соединение в виде соли HCl (неочищенный продукт). Rt=1,00 мин (Способ C). Определенная масса: 492,5 (M+H+).
Амид 6-(4-амино-цис-циклогексилокси)-4-хлор-1-оксо-1,2-дигидро-изохинолин-7-сульфоновой кислоты (132)
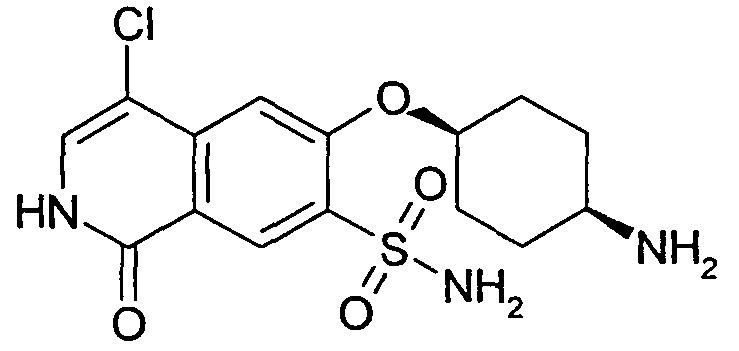
Неочищенное соединение 131 растворяли в 15 мл трифторуксусной кислоты и нагревали в течение 3 часов при 140°C в условиях микроволнового облучения. После выпаривания растворителя неочищенный продукт очищали препаративной ВЭЖХ, которая давала указанное в заголовке соединения в виде трифторацетата. Rt=0,90 мин (Способ B). Определенная масса: 372,3 (M+H+).
1-Бензилокси-7-хлор-6-(1,4-диокса-спиро[4,5]дец-8-илокси)изохинолин (133)
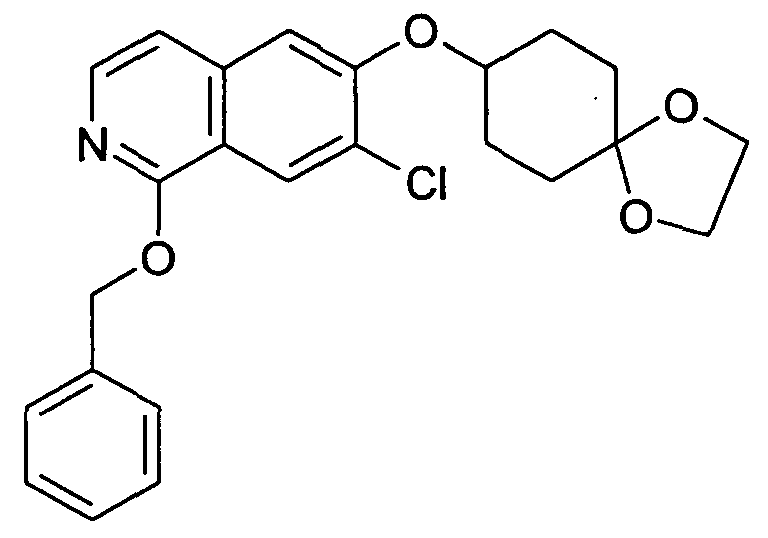
1,26 г (8,34 ммоль) диоксаспиро[4,5]декан-8-ола растворяли в 50 мл диметилацетамида и добавляли 695,2 мг (17,4 ммоль) гидрида натрия (60%). После перемешивания в течение 30 минут при комнатной температуре добавляли раствор 2,0 г (6,95 ммоль) 1-бензилокси-7-хлор-6-фторизохинолина (103) в 50 мл диметилацетамида и перемешивание продолжали при комнатной температуре. Через 1 час растворитель удаляли при пониженном давлении. Остаток растворяли в дихлорметане и промывали водой. Органический слой сушили при помощи сульфата магния и упаривали с получением 3,30 г неочищенного продукта, который использовали без дополнительной очистки. Rt=2,05 мин (Способ C). Определенная масса: 426,5 (M+H+).
7-Хлор-6-(4-оксо-циклогексилокси)-2H-изохинолин-1-он (134)
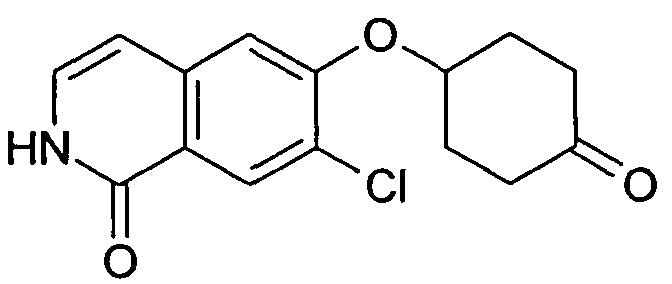
3,30 г 1-бензилокси-7-хлор-6-(1,4-диоксаспиро[4,5]дец-8-илокси)изохинолина (133, неочищенный продукт) перемешивали в 30 мл раствора 6 н. HCl/ацетон (1:2) при комнатной температуре. Через 3 часа реакционную смесь выливали в насыщенный раствор бикарбоната натрия и экстрагировали дихлорметаном. Органический слой сушили при помощи сульфата магния и упаривали. Неочищенный продукт очищали препаративной ВЭЖХ. Rt=1,34 мин (Способ B). Определенная масса: 292,0 (M+H+).
Исходя из 7-хлор-6-(4-оксоциклогексилокси)-2H-изохинолин-1-она (134) следующие соединения в виде гидрохлоридов были синтезированы способом, аналогичным общей процедуре B для реакций восстановительного аминирования (таблица 7):
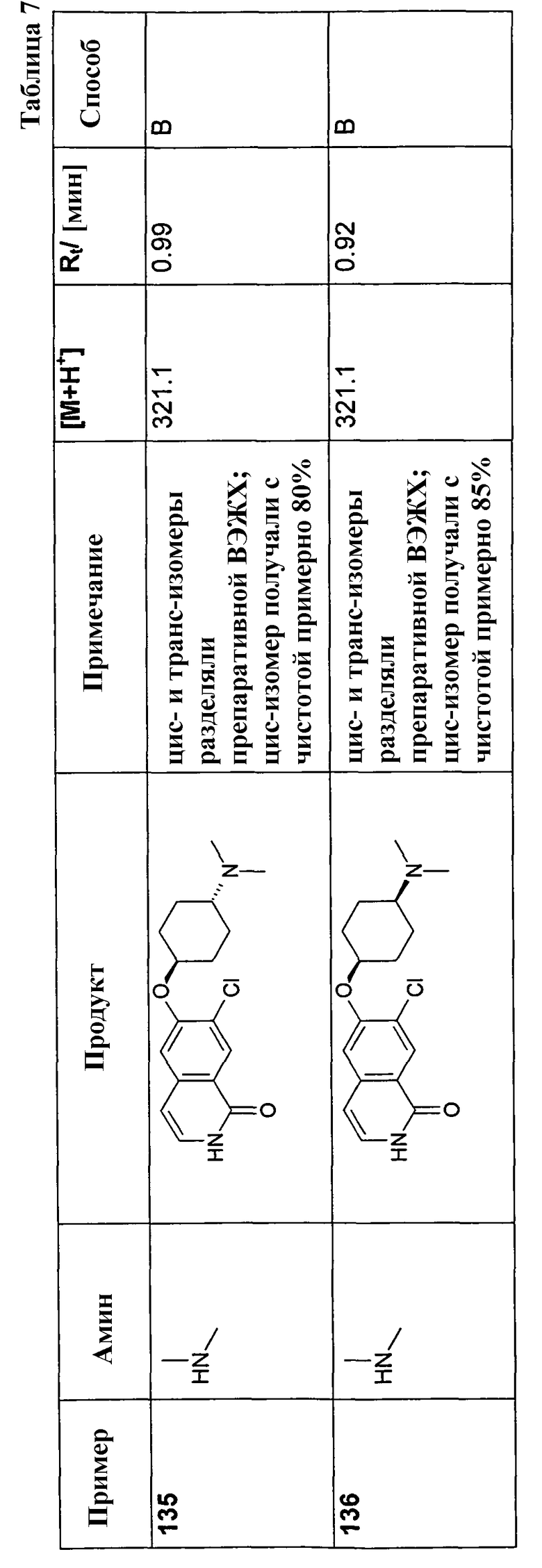
6-(транс-4-Аминоциклогексилокси)-7-метил-2H-изохинолин-1-он (137)
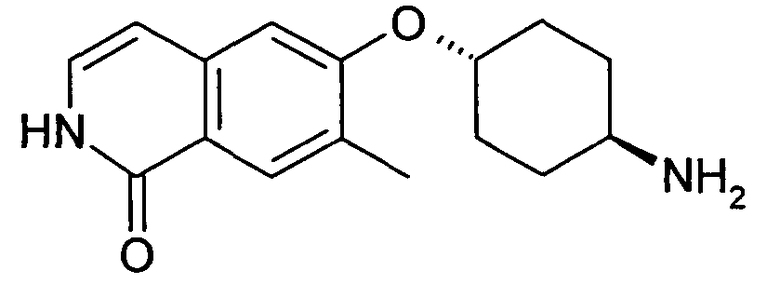
a) 6-Фтор-7-метил-2H-изохинолин-1-он
К раствору 10,0 г (55,5 ммоль) 3-фтор-4-метилкоричной кислоты в 80 мл ацетона последовательно добавляли при 0°C 6,74 г (66,6 ммоль) триэтиламина в 10 мл ацетона с последующим добавлением 7,83 г (72,2 ммоль) этилхлороформиата. После перемешивания в течение 2 часов при температуре 0-5°C добавляли раствор 4,0 г (61,1 ммоль) азида натрия в 9,5 мл воды. После перемешивания еще в течение 1 часа реакционную смесь выливали в 200 мл ледяной воды и экстрагировали два раза хлороформом. Органическую фазу сушили над сульфатом магния, добавляли 40 мл простого дифенилового эфира и хлороформ осторожно удаляли в вакууме. Остаток затем добавляли по каплям в 50 мл простого дифенилового эфира, предварительно нагретого до 245°C. По достижении полной конверсии смесь перемешивали еще в течение 1 часа при 230-250°C. После охлаждения до 150°C реакционную смесь выливали в 270 мл гептана и после дальнейшего охлаждения на ледяной бане осажденный продукт фильтровали с отсосом и получали 4,1 г 6-фтор-7-метил-2H-изохинолин-1-она.
b) 6-Фтор-2-(4-метоксибензил)-7-метил-2H-изохинолин-1-он
К раствору 9,17 г (51,8 ммоль) 6-фтор-7-метил-2H-изохинолин-1-она в 80 мл ДМФА добавляли 20,2 г (62,1 ммоль) карбоната цезия и затем 8,92 г (56,9 ммоль) 4-метоксибензилхлорида. После перемешивания при комнатной температуре в течение 90 минут реакционную смесь выливали в 600 мл воды, перемешивали в течение 1 часа и затем осажденный продукт выделяли отсасыванием. Из маточного раствора выделяли дополнительное количество продуктов при помощи хроматографии с использованием гептана/этилацетата (80:20). Объединенные продукты перекристаллизовывали из этилацетата и получали 8,39 г 6-фтор-2-(4-метоксибензил)-7-метил-2H-изохинолин-1-она.
c) 6-(транс-4-Аминоциклогексилокси)-2-(4-метоксибензил)-7-метил-2H-изохинолин-1-он
К раствору 1,48 г (9,75 ммоль) гидрохлорида транс-4-аминоциклогексанола в 20 мл диметилацетамида добавляли 1,95 г (48,77 ммоль) гидрида натрия (60%) и смесь перемешивали в течение 15 минут. Затем добавляли 2,90 г (9,75 ммоль) 6-фтор-2-(4-метоксибензил)-7-метил-2H-изохинолин-1-она в 30 мл диметилацетамида и реакционную смесь нагревали до 80°C в течение 2 дней. После охлаждения смесь выливали в 300 мл ледяной воды и осажденный неочищенный продукт очищали хроматографией. Сначала остающееся исходное вещество элюировали смесью этилацетат/гептан (2:1) и затем желаемый продукт элюировали чистым метанолом с получением 1,98 г 6-(транс-4-аминоциклогексилокси)-2-(4-метоксибензил)-7-метил-2H-изохинолин-1-она.
d) гидрохлорид 6-(транс-4-аминоциклогексилокси)-7-метил-2H-изохинолин-1-она
2,64 г (6,7 ммоль) 6-(транс-4-аминоциклогексилокси)-2-(4-метоксибензил)-7-метил-2H-изохинолин-1-она и 15,3 г (134,5 ммоль) трифторуксусной кислоты нагревали в течение 2 часов в микроволновой печи при 150°C. Затем избыточное количество трифторуксусной кислоты отгоняли в вакууме и остаток разбавляли 130 мл 1M хлористоводородной кислоты. Водную фазу промывали 3 раза метиленхлоридом и затем ее сушили вымораживанием с получением гидрохлорида, который перекристаллизовывали из изопропанола. Получали 1,1 г 6-(транс-4-аминоциклогексилокси)-7-метил-2H-изохинолин-1-она (137) в виде гидрохлорида. Rt=0,92 мин (Способ B). Определенная масса: 273,22 (M+H+).
6-(цис-4-Аминоциклогексилокси)-7-метил-2H-изохинолин-1-он (138)
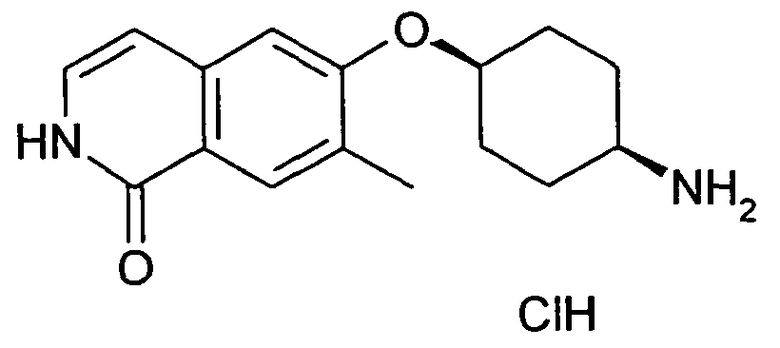
a) гидрохлорид цис-4-аминоциклогексанола
К раствору 30,0 г (0,265 моль) циклогексаноноксима в 300 мл метиленхлорида и 38 мл этанола медленно добавляли при 0°C 34,5 г (0,318 моль) трет-бутилгипохлорита. Полученный темно-синий раствор охлаждали до -20°C и затем добавляли 31,9 г (0,398 моль) 1,3-циклогексадиена и смесь хранили в морозильнике при 5°C в течение 2 дней до исчезновения синего цвета. Реакционную смесь концентрировали до 50% ее объема и затем медленно добавляли 600 мл простого диэтилового эфира. После перемешивания в течение ночи образовавшийся осадок выделяли отсасыванием с получением 29,0 г гидрохлорида 2-окса-3-азабицикло[2,2,2]окт-5-ена. 5,0 г (0,045 моль) этого вещества гидрировали при помощи 3,0 г (0,013 моль) оксида платины при давлении водорода 2 бар. Через 7 часов катализатор отфильтровывали и добавляли раствор 20 мл 4M хлористоводородной кислоты в диоксане. После упаривания остаток перекристаллизовывали из 30 мл изопропанола с получением 3,1 г гидрохлорида цис-4-аминоциклогексанола.
b) гидрохлорид 6-(цис-4-аминоциклогексилокси)-7-метил-2H-изохинолин-1-она
Из 2,55 г (16,8 ммоль) гидрохлорида цис-4-аминоциклогексанола и 5,0 г (16,8 ммоль) 6-фтор-2-(4-метокси-бензил)-7-метил-2H-изохинолин-1-она (137, стадия b) получали 0,98 г гидрохлорида 6-(цис-4-аминоциклогексилокси)-7-метил-2H-изохинолин-1-она, как описано в примере 137, стадии c и d. Rt=0,99 мин (Способ B). Определенная масса: 273,18 (M+H+).
6-(цис-4-Этиламиноциклогексилокси)-7-метил-2H-изохинолин-1-он (139)
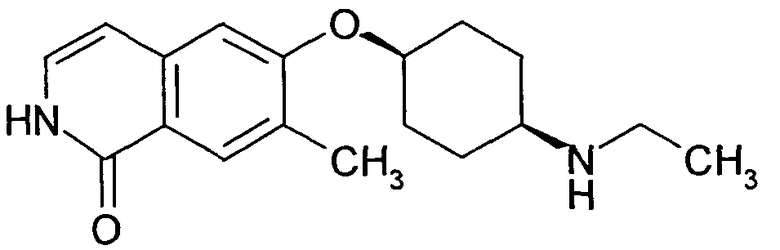
0,2 г (0,65 ммоль) гидрохлорида 6-(цис-4-аминоциклогексилокси)-7-метил-2H-изохинолин-1-она (138), 69 мг (0,68 ммоль) триэтиламина и 35 мг (0,78 ммоль) ацетальдегида перемешивали в 13 мл безводного метанола в течение 4 часов при 5°C. После добавления 37 мг (0,97 моль) боргидрида натрия смесь перемешивали в течение ночи при комнатной температуре. Поскольку наблюдали неполную конверсию исходного амина, снова добавляли такие же количества ацетальдегида и боргидрида натрия последовательно в течение 2 часов. После перемешивания еще в течение 2 часов реакционную смесь подкисляли при помощи концентрированной хлористоводородной кислоты и метанол выпаривали. Водный остаток промывали этилацетатом, а затем насыщенным раствором карбоната калия и экстрагировали метиленхлоридом с получением 145 мг 6-(цис-4-этиламиноциклогексилокси)-7-метил-2H-изохинолин-1-она (139). Rt=0,89 мин (Способ A). Определенная масса: 301,20 (M+H+).
6-(цис-4-Изобутиламиноциклогексилокси)-7-метил-2H-изохинолин-1-он (140)
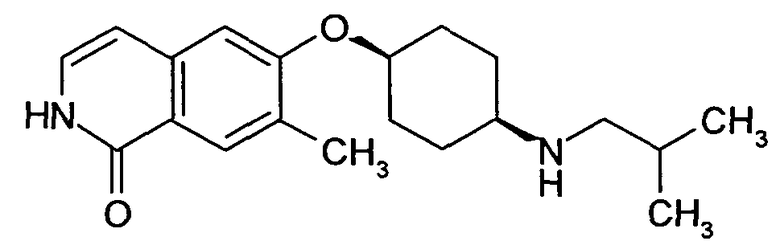
Из 0,2 (0,65 ммоль) гидрохлорида 6-(цис-4-аминоциклогексилокси)-7-метил-2H-изохинолин-1-она (138) и изобутиральдегид получали, аналогично примеру 139, 151 мг 6-(4-изобутиламиноциклогексилокси)-7-метил-2H-изохинолин-1-она. Rt=1,10 мин (Способ A). Определенная масса: 329,20 (M+H+).
Аналогично примерам 139 и 140, получали следующие соединения из соответствующих аминов и альдегида (таблица 8).
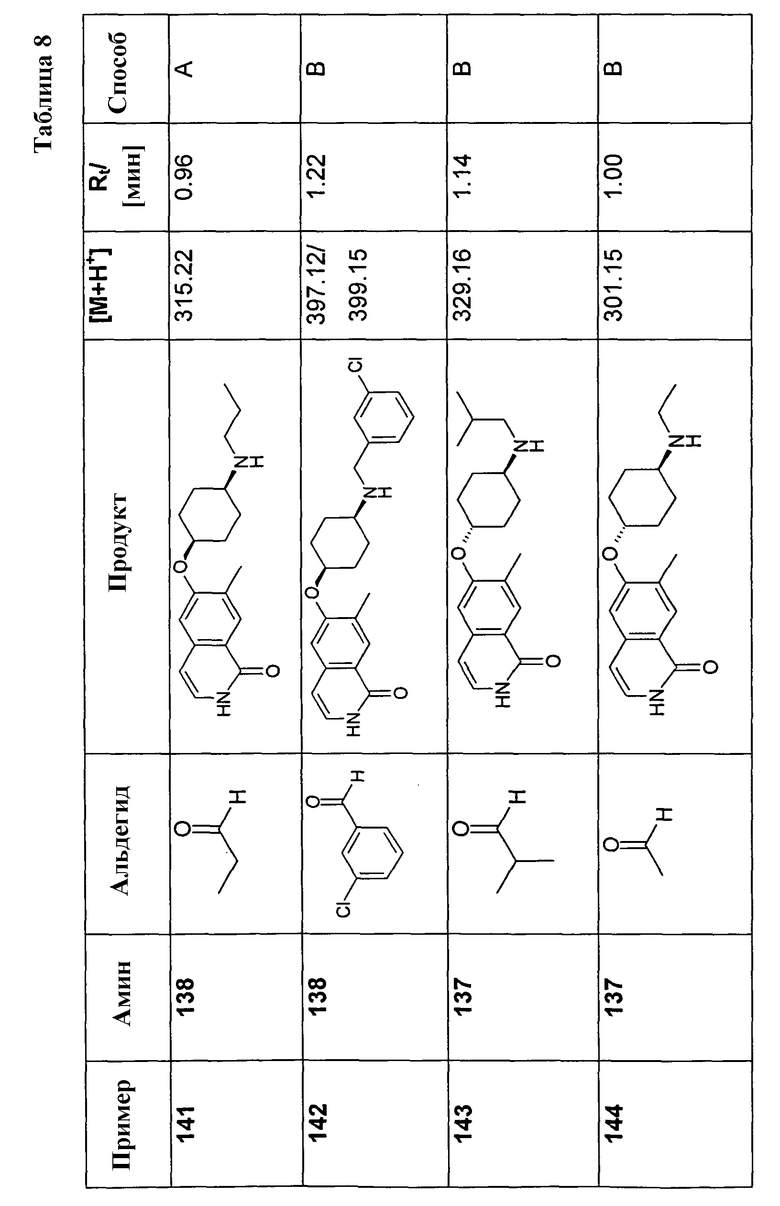
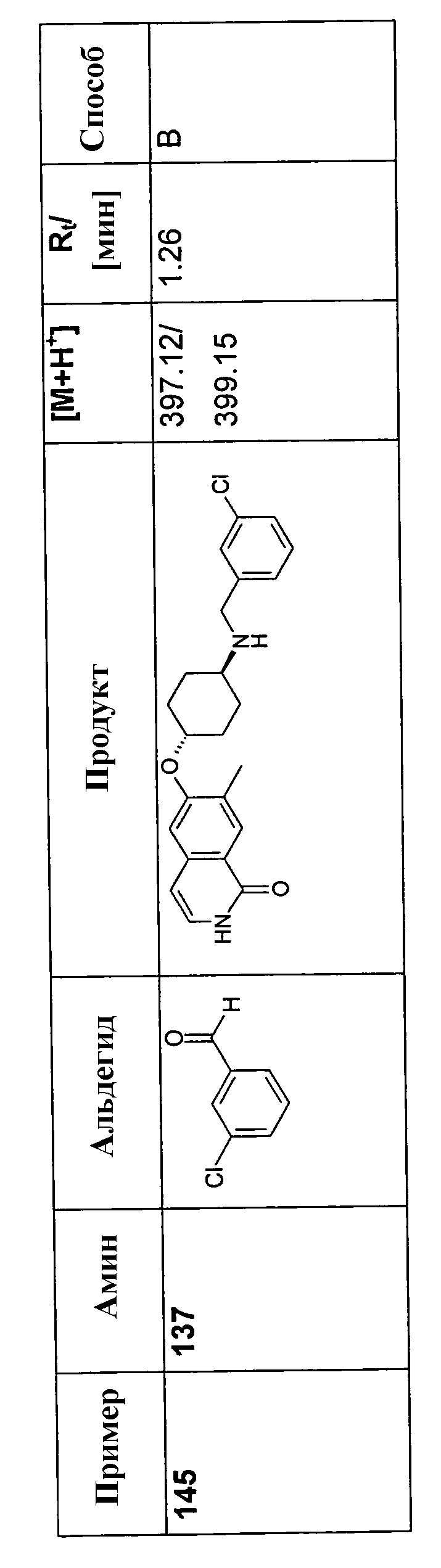
6-(цис-4-Диэтиламиноциклогексилокси)-7-метил-2H-изохинолин-1-он (146)
Реакционную смесь, состоящую из 150 мг (0,49 ммоль) гидрохлорида 6-(цис-4-аминоциклогексилокси)-7-метил-2H-изохинолин-1-она (пример 138), 38 мг (0,63 ммоль) уксусной кислоты, 43 мг (0,97 ммоль) ацетальдегида, молекулярных сит и 515 мг (2,4 ммоль) триацетоксиборгидрида натрия в 5 мл метиленхлорида, перемешивали в течение ночи. Реакционную смесь добавляли к 10 мл раствора 1M гидроксида натрия и экстрагировали два раза смесью метиленхлорида и изопропанола. После сушки и упаривания получали 122 мг 6-(цис-4-диэтиламиноциклогексилокси)-7-метил-2H-изохинолин-1-она (146). Rt=0,99 мин (Способ B). Определенная масса: 329,17 (M+H+).
6-(цис-4-Изопропиламиноциклогексилокси)-7-метил-2H-изохинолин-1-он (147)
Аналогично примеру 146, получали 121 мг 6-(цис-4-изопропиламиноциклогексилокси)-7-метил-2H-изохинолин-1-она (147), исходя из 150 мг (0,49 ммоль) гидрохлорида 6-(цис-4-аминоциклогексилокси)-7-метил-2H-изохинолин-1-она (138), путем взаимодействия с ацетоном. Rt=1,07 мин (Способ B). Определенная масса: 315,13 (M+H+).
2,2,2-Трифтор-N-(транс-4-гидроксициклогексил)ацетамид (148)
25 г гидрохлорида транс-4-аминоциклогексанола суспендировали в 250 мл безводного диоксана и добавляли 30 мл раствора метилата натрия (30% в метаноле, 1 эквивалент). Добавляли 39,3 мл этилтрифторацетата и реакционную смесь оставляли для перемешивания до завершения реакции. Реакционную смесь упаривали, осуществляли ее поглощение в 50 мл 0,1 н. раствора HCl и экстрагировали несколько раз дихлорметаном:изопропанолом 3:1. Объединенный органический слой экстрагировали один раз 0,1 н. раствором HCl и насыщенным солевым раствором, сушили над сульфатом натрия и упаривали досуха с получением 29,0 г соединения 148. Rt=0,69 мин (Способ C). Определенная масса: 212,2 (M+H+).
2,2,2-Трифтор-N-(4-гидроксициклогексил)-N-метилацетамид (149)
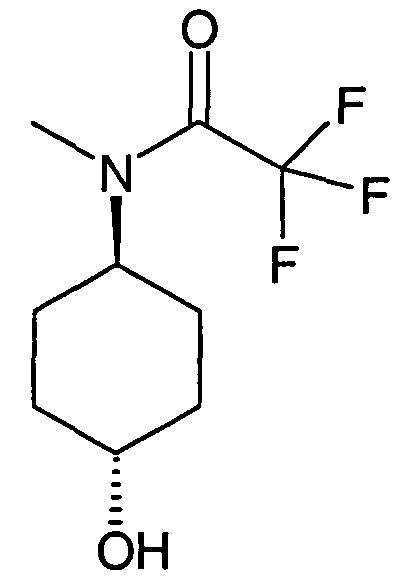
5 г 2,2,2-трифтор-N-(4-гидроксициклогексил)ацетамида (148) растворяли в 25 мл диметилацетамида, добавляли 625 мг 95% гидрида натрия и реакционную смесь охлаждали до 0°C. Добавляли медленно 1,64 мл иодметана и реакционной смеси давали нагреться до комнатной температуры. По завершении реакции реакционную смесь выливали в воду, экстрагировали три раза метил трет-бутиловым эфиром и объединенный органический слой экстрагировали один раз насыщенным солевым раствором, сушили над сульфатом натрия и упаривали досуха. Остаток поглощали в воду и подвергали лиофилизации для удаления оставшегося диметилацетамида с получением 4,0 г продукта. Rt=0,95 мин (Способ C). Определенная масса: 226,2 (M+H+).
транс-4-Метиламиноциклогексанол (150)
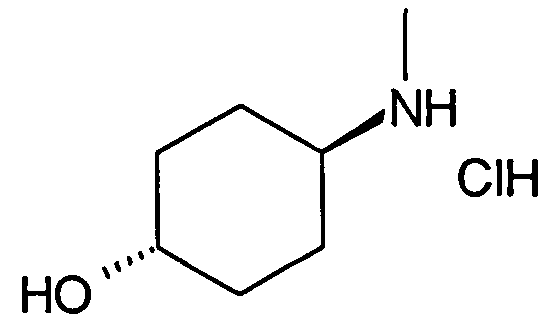
2 г 2,2,2-трифтор-N-(4-гидроксициклогексил)-N-метилацетамида (149) суспендировали в 10 мл 1 н. раствора HCl и нагревали в микроволновой печи при 150° до достижения полной конверсии. Полученный раствор подвергали лиофилизации, и остаток поглощали в воду и снова подвергали лиофилизации два раза с получением 1,45 г 4-метиламиноциклогексанола (150). Rt=0,13 мин (Способ C). Определенная масса: 130,3 (M+H+).
2-(транс-4-Метоксибензил)-6-(4-метиламиноциклогексилокси)-2H-изохинолин-1-он (151)
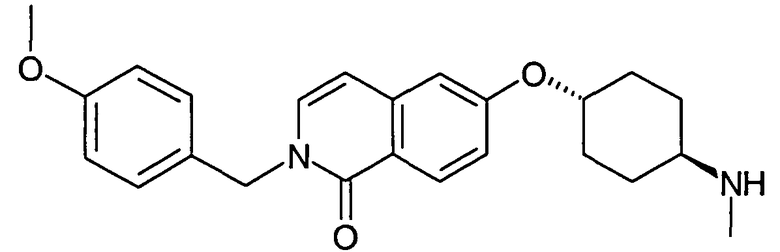
630 мг гидрида натрия (95%) суспендировали в 40 мл диметилацетамида. Добавляли по каплям 1,45 г 4-метиламиноциклогексанола (150), растворенного в 40 мл диметилацетамида, и через 15 минут добавляли 2,48 г 6-фтор-2-(4-метоксибензил)-2H-изохинолин-1-она (177), растворенного в других 40 мл диметилацетамида. Реакционную смесь перемешивали при 80°C до завершения реакции. Смесь выливали в смесь лед-вода, экстрагировали три раза метил-трет-бутиловым эфиром и объединенный органический слой сушили над сульфатом натрия и упаривали. Добавляли воду и неочищенный продукт подвергали лиофилизации для удаления оставшегося диметилацетамида.
Полученный продукт был достаточно чистым для дальнейшего преобразования. Rt=1,24 мин (Способ B), определенная масса: 393,2 (M+H+).
6-(транс-4-Метиламиноциклогексилокси)-2H-изохинолин-1-он (152)
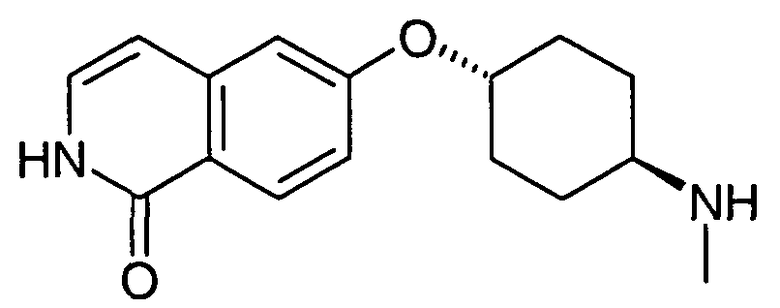
2,46 г 2-(4-метоксибензил)-6-(4-метиламиноциклогексилокси)-2H-изохинолин-1-она (151) растворяли в 15 мл TFA и нагревали в микроволновой печи при 150°C в течение 2 часов. Добавляли метанол и реакционную смесь упаривали. Раствор поглощали в 1н. HCl и экстрагировали три раза дихлорметаном. Объединенные дихлорметановые слои экстрагировали 1н. раствором HCl два раза, и объединенные HCl слои подвергали лиофилизации, остаток поглощали в воду и снова подвергали лиофилизации с получением 1,31 г 6-(4-метиламиноциклогексилокси)-2H-изохинолин-1-она (152) в виде гидрохлорида. Rt=0,81 мин (Способ B). Определенная масса: 273,2 (M+H+).
Следующие два продукта получали в виде гидрохлоридов с использованием такой же последовательности реакций, как описанно для синтеза соединения 152, используя подходящие алкилгалогениды для алкилирования соединения 148.
6-(транс-4-Этиламиноциклогексилокси)-2H-изохинолин-1-он (153)
Rt=0,85 мин (Способ B). Определенная масса: 287,1 (M+H+).
6-(транс-4-Изопропиламиноциклогексилокси)-2H-изохинолин-1-он (154)
Rt=1,16 мин (Способ B). Определенная масса: 315,2 (M+H+).
Общая процедура D для реакции восстановительного аминирования:
250 мг 153 (или другого монозамещенного изохинолононамина) растворяли в 8 мл дихлорметана и 6 мл ДМФА. Добавляли 3 экв. альдегида, 1,3 экв. уксусной кислоты, 300 мг молекулярных сит и 3 экв. триацетоксиборгидрида натрия. Реакционную смесь перемешивали в течение 16 часов при 55°C. Смесь выливали в 5 мл 1н. раствора NaOH и 25 мл дихлорметана и добавляли 10 мл изопропанола. Органический слой отделяли и водный слой экстрагировали три раза смесью изопропанол:дихлорметан 1:3. Объединенный органический слой упаривали досуха, остаток очищали при помощи ВЭЖХ и в конце преобразовывали в соответствующие соли HCl добавлением 2н. раствора HCl с последующей лиофилизацией.
Следующие соединения получали в соответствии с описанной процедурой, и они были получены в форме свободных оснований или гидрохлоридов (таблица 9)
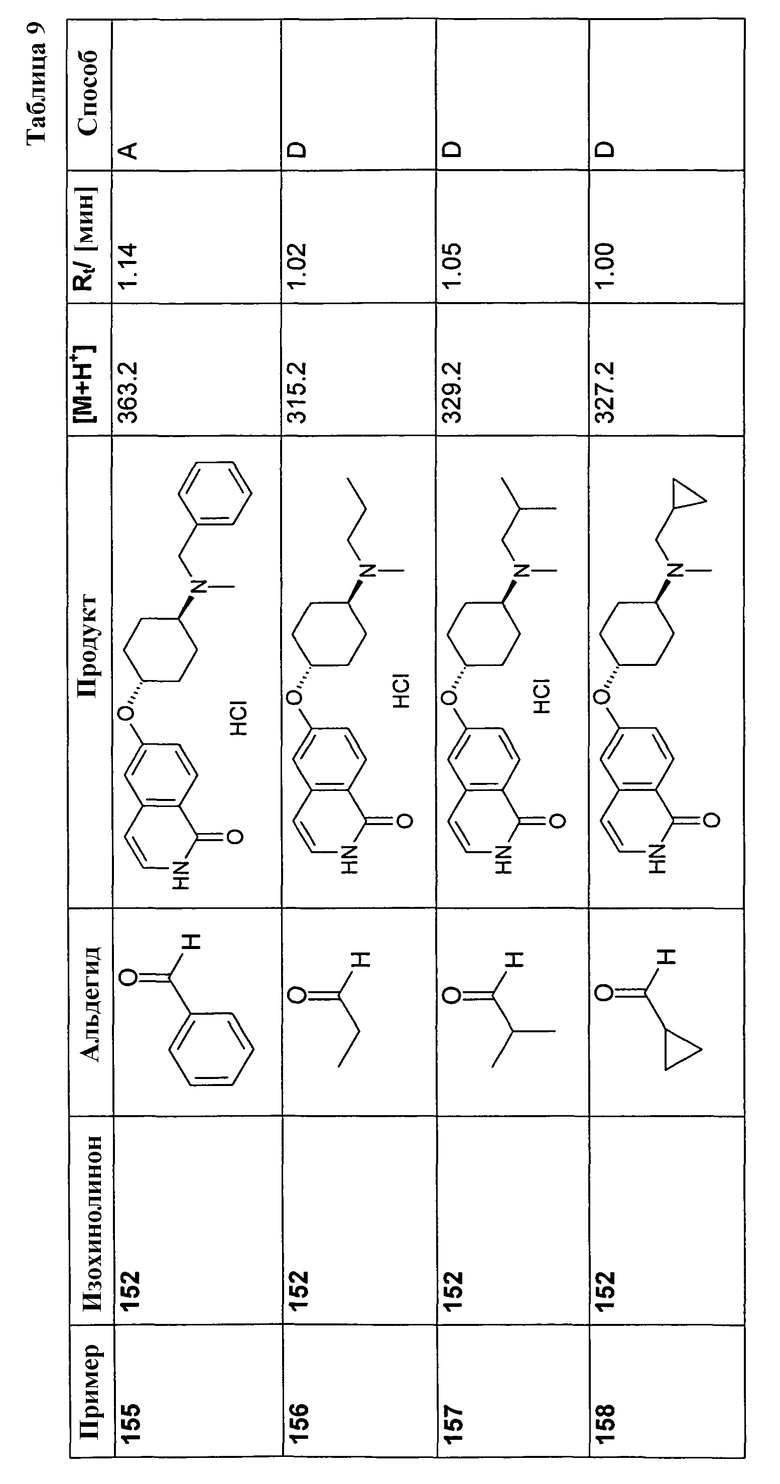
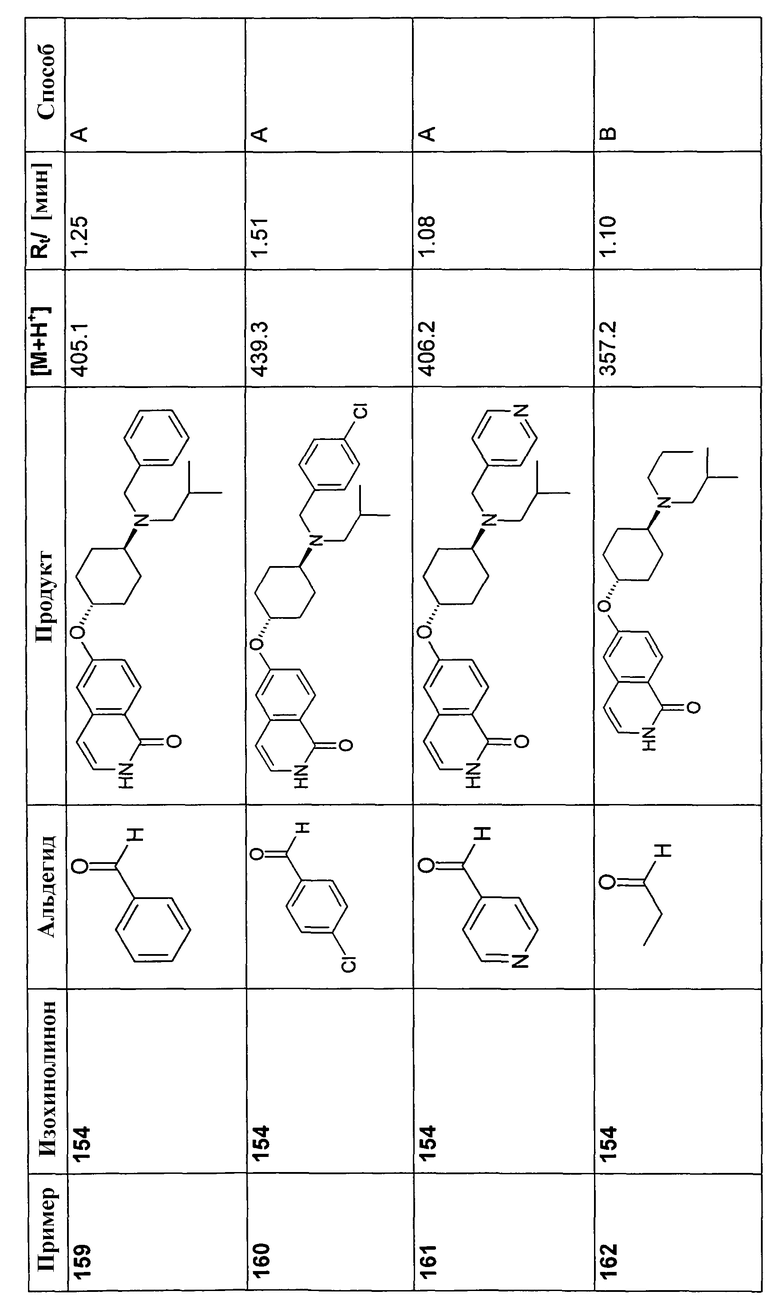
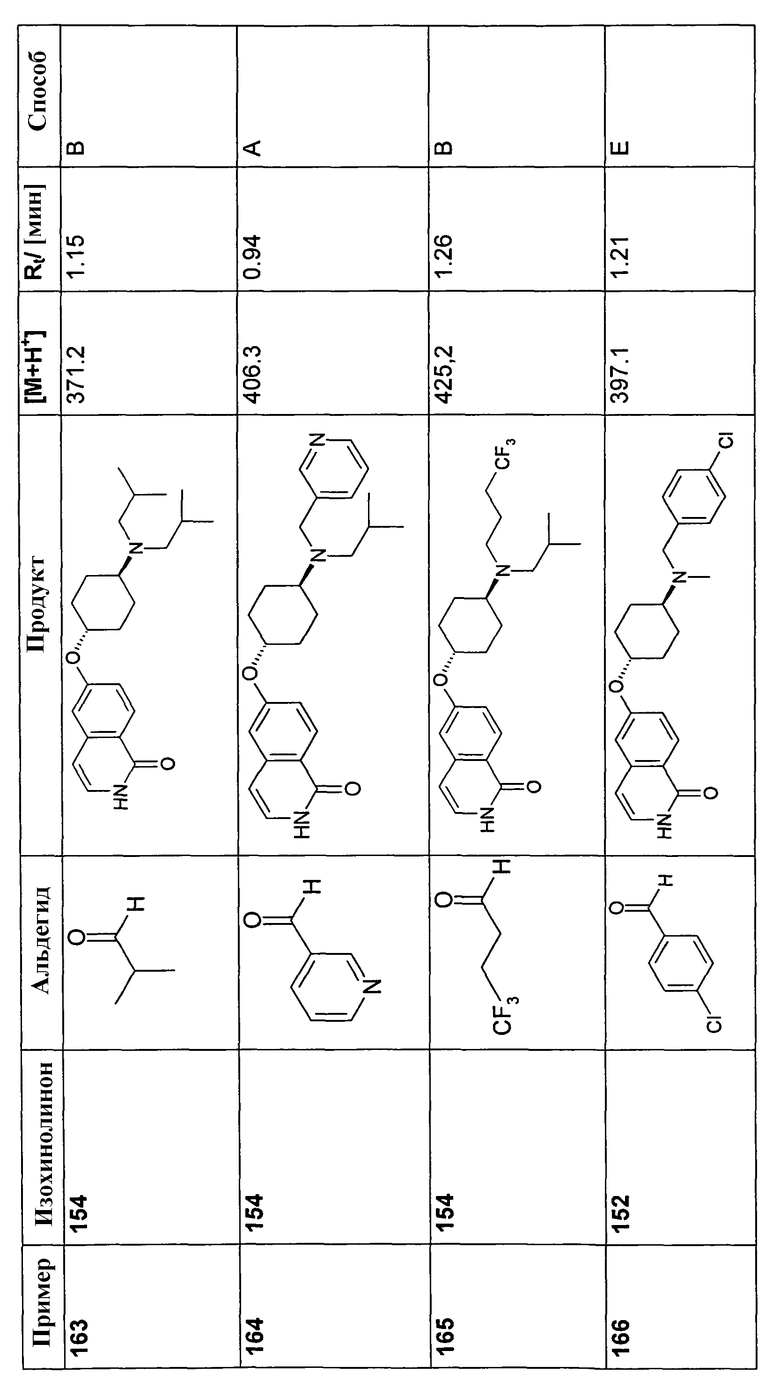
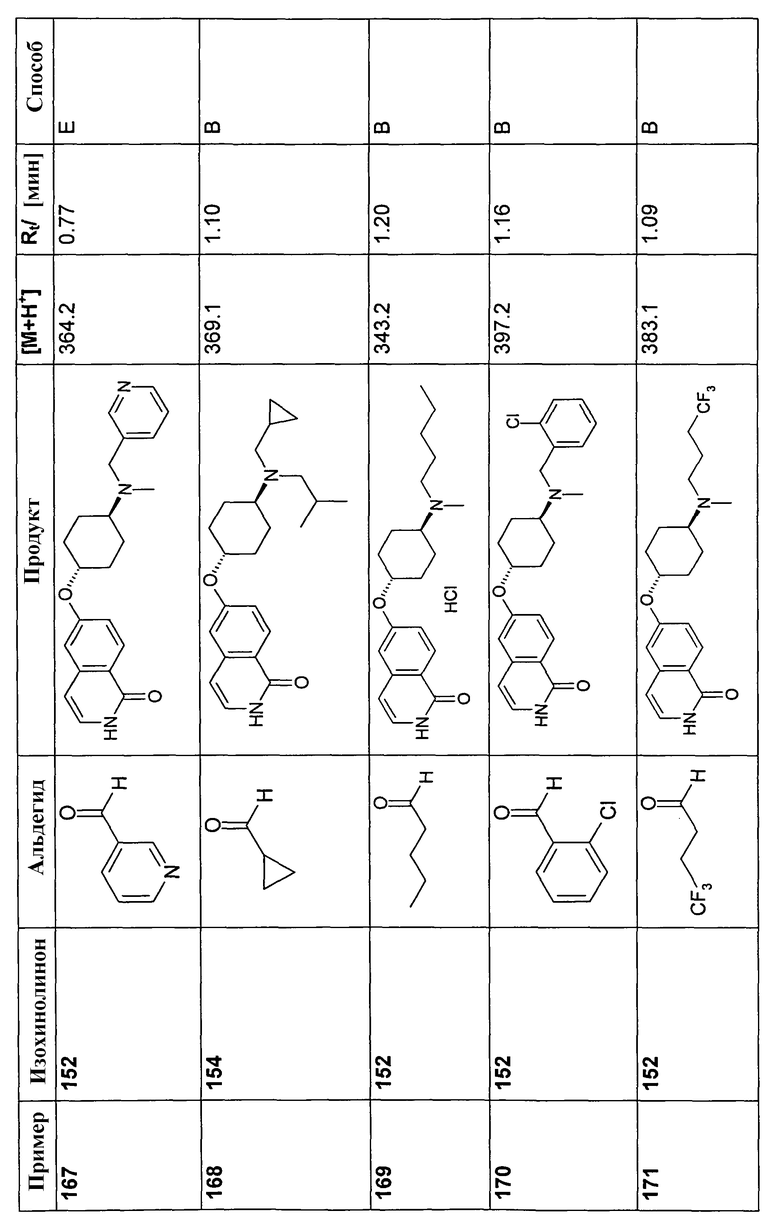
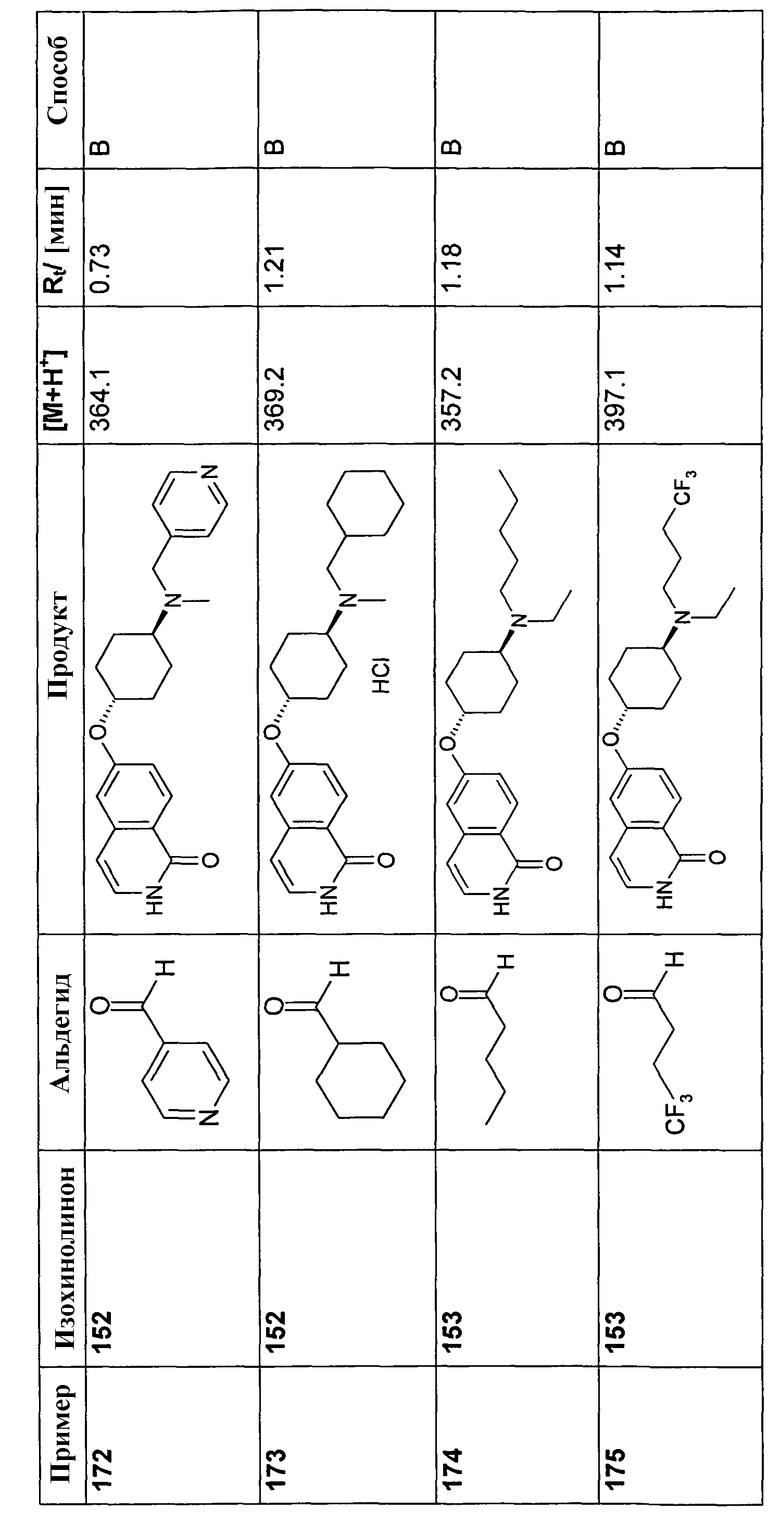
6-Фторизохинолинон (176)
4,8 мл (90,3 ммоль, 1,5 экв.) тионилхлорида добавляли по порциям к раствору 10 г (60,2 ммоль) 3-фторкоричной кислоты в 44 мл хлороформа и 1 мл ДМФА. Реакционную смесь нагревали до температуры кипения с обратным холодильником в течение 2,5 часов. Затем растворители отгоняли с получением 11,4 г неочищенного хлорангидрида кислоты, который использовали без какой-либо дополнительной очистки.
Хлорангидрид кислоты растворяли в 45 мл ацетона. При 0°C добавляли по порциям 8,03 г NaN3 (123,5 ммоль, 2 экв.). Затем добавляли 41 мл воды, поддерживая температуру ниже 5°C. Реакционную смесь перемешивали еще в течение 1,5 часов. Затем добавляли 55 мл хлороформа. Смесь экстрагировали 80 мл воды, а затем 40 мл насыщенного солевого раствора. После сушки над Na2SO4 и фильтрации добавляли 14 мл простого дифенилового эфира и бόльшую часть хлороформа удаляли в вакууме (без нагревания). Следует избегать удаления всего хлороформа.
Раствор, содержащий азид, простой дифениловый эфир и остаток хлороформа, добавляли по каплям при 260°C в течение 15 минут к раствору 10 мл трибутиламина в 97 мл простого дифенилового эфира. В процессе добавления можно наблюдать бурную реакцию. Реакционную смесь перемешивали еще в течение 20 минут при 260°C. После охлаждения до комнатной температуры добавляли 270 мл н-гептана. Осажденный продукт отфильтровывали и промывали простым эфиром с получением 5,65 г указанного в заголовке соединения. MS (DCI) Определенная масса: 164,0 (M+H+).
6-Фтор-2-(4-метоксибензил)-2H-изохинолин-1-он (177)
169 мкл п-метоксибензилхлорида (1,24 ммоль, 1,1 экв.) добавляли к суспензии 200 мг 6-фторизохинолинона (176) (1,13 ммоль) и 368 мг Cs2CO3 (1,36 ммоль, 1,2 экв.) в 3 мл ДМФА. Смесь перемешивали в течение 2 часов и затем выливали на лед. Осадок отфильтровывали, промывали водой и сушили с получением 300 мг указанного в заголовке соединения. ЖХМС Способ B, время удерживания 1,76 мин, определенная масса 284,14 [M+H]+.
4-Этил-6,7-дифтор-2H-изохинолин-1-он (178)
4-Этил-6,7-дифтор-2H-изохинолин-1-он (178) получали таким же способом, как описано для синтеза 176, используя (3,4-дифторфенил)пент-2-еновую кислоту в качестве исходного вещества. Rt=1,46 мин (Способ B). Определенная масса: 210,1 (M+H+). Используемые акриловые кислоты синтезировали из соответствующего альдегида таким же способом, как описано в литературе (см., например: J. Med. Chem. 2005, 48, 71-90).
6-(транс-4-Аминоциклогексилокси)-4-этил-7-фтор-2H-изохинолин-1-он (179)
6-(4-Аминоциклогексилокси)-4-этил-7-фтор-2H-изохинолин-1-он (179) синтезировали в виде гидрохлорида с использованием такой же последовательности реакций, как описано для преобразования 137 (стадии b, c и d), с использованием соединения 178 в качестве исходного вещества. Rt=0,97 мин (Способ B). Определенная масса: 305,2 (M+H+).
Способы ЖХ/МС:
Определение ингибирования Rho-киназы
Для измерения ингибирования Rho-киназы определяли значения ИК50 в соответствии со следующим протоколом:
Буфер: 25 мМ Трис pH 7,5; 0,02% BSA; 5% глицерина; 0,008% Triton X100; 2% ДМСО, 1 мМ DTT; 1 мМ MgCl2; 0,5 мкКи/лунка γ33P АТФ.
Фермент: ROCKII или ROKα) (Upstate, Catalog # 14-451) 0,1 нг/мкл.
Конечная концентрация АТФ в реакционной смеси 40 мкМ.
Биотинилированный субстрат, разбавленный до 0,25 мкМ буфером, описанным выше (без АТФ):
1. 10 мкл буфера Трис (± Ингибитор);
2. Добавить 30 мкл раствора фермента;
3. Начать реакцию с 30 мкл смеси субстрат/АТФ/АТФ33;
4. Инкубировать в течение 20 мин при комнатной температуре;
5. Остановить реакцию при помощи 30 мкл 50 мМ EDTA;
6. Перенести 50 мкл раствора в Streptavidin Flash Plate plus, Perkin Elmer, SMP 103A;
7. Инкубировать в течение 30 мин при комнатной температуре;
8. Промыть 4 раза 300 мкл PBS/0,1% Tween 20;
9. Определяют радиоактивность в лунках.
Следующие продукты/соединения были испытаны в указанном анализе с использованием соответствующей формы (соль или свободное основание), которые были получены, как описано выше в примерах, и были определены следующие показатели активности.
Активность обозначали как отрицательный десятичный логарифм ИК50 (pИК50) следующим образом:
+: pИК50≤3,0
++: 3,0≤pИК50<4,0
+++: 4,0≤pИК50<5,0
++++: 5,0≤pИК50<6,0
+++++: 6,0≤pИК50
| название | год | авторы | номер документа |
|---|---|---|---|
| ЗАМЕЩЕННЫЕ ЦИКЛОАЛКИЛАМИНОМ ПРОИЗВОДНЫЕ ИЗОХИНОЛОНА | 2007 |
|
RU2457203C2 |
| ЗАМЕЩЕННЫЕ ЦИКЛОАЛКИЛАМИНОМ ПРОИЗВОДНЫЕ ИЗОХИНОЛИНА И ИЗОХИНОЛИНОНА | 2007 |
|
RU2468011C2 |
| ПРОИЗВОДНЫЕ ИЗОХИНОЛИНА В КАЧЕСТВЕ ИНГИБИТОРОВ Rho-КИНАЗЫ | 2006 |
|
RU2443688C2 |
| ПИПЕРИДИНИЛ-ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ ИЗОХИНОЛОНА КАК ИНГИБИТОРЫ Rho-КИНАЗЫ | 2006 |
|
RU2414467C2 |
| ЗАМЕЩЕННЫЕ ИЗОХИНОЛИНОВЫЕ И ИЗОХИНОЛИНОНОВЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ Rho-КИНАЗЫ | 2007 |
|
RU2455302C2 |
| 6-ЗАМЕЩЕННЫЕ ИЗОХИНОЛИНЫ И ИЗОХИНОЛИНОНЫ ПОЛЕЗНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ Rho-КИНАЗЫ | 2009 |
|
RU2528229C2 |
| БИ- И ПОЛИЦИКЛИЧЕСКИЕ ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ ИЗОХИНОЛИНА И ИЗОХИНОЛИНОНА, ПОЛЕЗНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ RHO-КИНАЗЫ | 2009 |
|
RU2532481C2 |
| ЗАМЕЩЕННЫЕ ИЗИХИНОЛИНЫ И ИЗОХИНОЛИНОНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ Rho-КИНАЗЫ | 2009 |
|
RU2538588C2 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛОПИРИДИНА В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗЫ 1β-ДРЕНЕРГИЧЕСКОГО РЕЦЕПТОРА | 2006 |
|
RU2415855C2 |
| АНТИВИРУСНЫЕ СОЕДИНЕНИЯ | 2009 |
|
RU2505540C2 |
Настоящее изобретение относится к соединениям формулы (I) 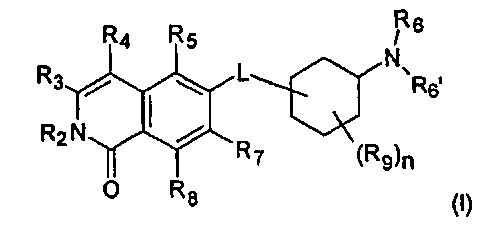 или формулы (I')
или формулы (I') 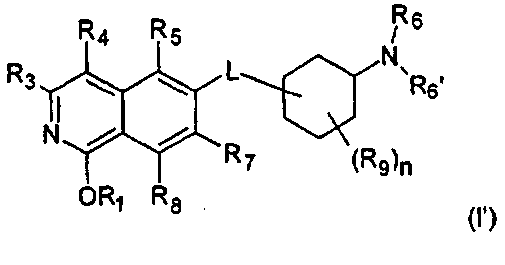 , где значения заместителей раскрыты в формуле изобретения. Данные соединения способны ингибировать Rho-киназу, и, таким образом, могут быть полезны для лечения и/или профилактики заболеваний, которые связаны Rho-киназой и/или опосредованным Rho-киназой фосфорилированием фосфатазы легкой цепи миозина. 29 з.п. ф-лы, 10 табл.
, где значения заместителей раскрыты в формуле изобретения. Данные соединения способны ингибировать Rho-киназу, и, таким образом, могут быть полезны для лечения и/или профилактики заболеваний, которые связаны Rho-киназой и/или опосредованным Rho-киназой фосфорилированием фосфатазы легкой цепи миозина. 29 з.п. ф-лы, 10 табл.
1. Соединение формулы (I)
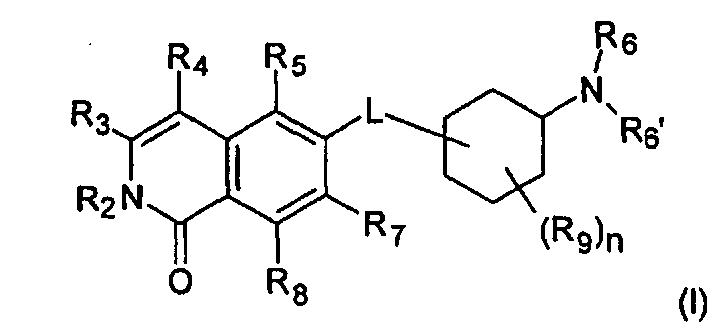
или формулы (I')
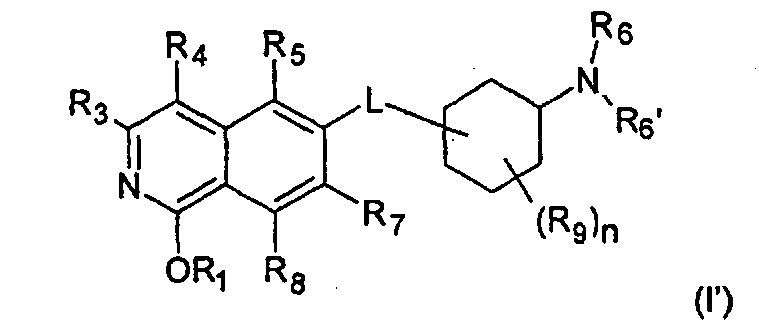
где R1 представляет собой Н, (С1-С6)алкил или [(С1-С6)алкилен]0-1-(С6-С10)арил;
R2 представляет собой Н;
R3 представляет собой Н, галоген или (С1-С6)алкил;
R4 представляет собой Н, галоген или (С1-С6)алкил;
R5 представляет собой Н, галоген или (С1-С6)алкил;
R6 и R6' независимо друг от друга представляют собой Н, R', (С1-С8)алкил, необязательно замещенный одним или более чем одним галогеном, или представляет собой [(C1-C6)алкилен-R';
R7 представляет собой Н, галоген, (С1-С6)алкил, (С3-С8)циклоалкил или SO2-NH2;
R8 представляет собой Н, галоген или (С1-С6)алкил;
R9 представляет собой галоген или (С1-С6)алкил;
n имеет значение 0, 1, 2, 3 или 4; и
L представляет собой О или O-(С1-С6)алкилен;
где R' представляет собой (С3-С8)циклоалкил, (С5-С10)гетероциклил, где (С5-С10)гетероциклил представляет собой 5-10-членную моно- или бициклическую кольцевую систему, содержащую один-три гетероатома, выбранных их азота, кислорода и серы, причем гетероциклил является незамещенным или замещенным (С1-С4)алкилом или галогеном, или (С6-С10)арил, который может быть необязательно дополнительно замещен одним или более чем одним заместителем, выбранным из галогена, (С1-С6)алкила, (С1-С6)алкокси или SO2(C1-C6)алкила;
где в остатках R3, R4, R5, R7 и R8 алкил может быть замещен галогеном один или несколько раз;
или их фармацевтически приемлемые соли и/или стереоизомерные формы.
2. Соединение формулы (I) по п.1, представленное соединением формулы (II)
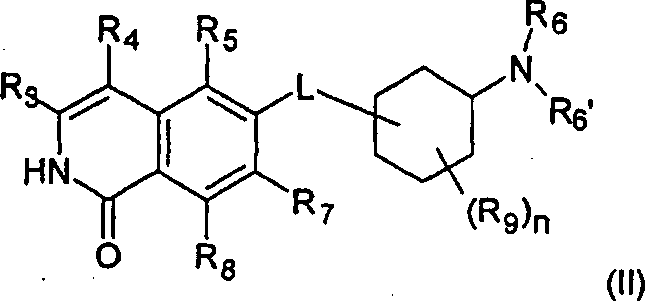 .
.
3. Соединение формулы (I') по п.1, представленное соединением формулы (II')
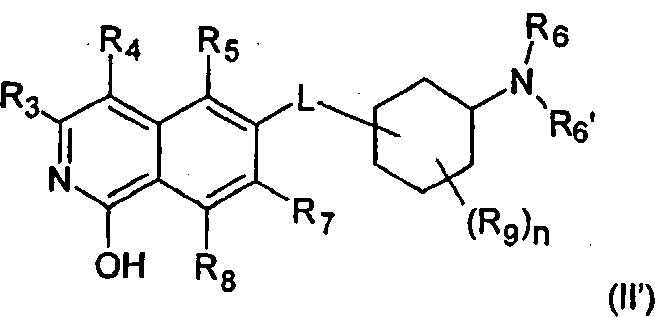 .
.
4. Соединение по любому из пп.1-3, где R6 представляет собой Н, (C1-C6)алкил, (С3-С6)циклоалкил или (С1-С4)алкилен-(С3-С6)циклоалкил, и R6' представляет собой Н, (С1-С6)алкил, (С3-С8)циклоалкил, (С1-С4)алкилен-(С3-С8)циклоалкил, (С5-С10)гетероциклил, (С1-С4)алкилен-(С5-С10)гетероциклил или (С1-С6)алкилен-(С6-С10)арил.
5. Соединение по любому из пп.1-3, где R6 представляет собой Н, (С1-С6)алкил, и R6' представляет собой Н, (С1-С6)алкил, (С3-С8)циклоалкил, (С1-С4)алкилен-(С3-С8)циклоалкил, (С5-С10)гетероциклил, (С1-С4)алкилен-(С5-С10)гетероциклил или (С1-С6)алкилен-(С6-С10)арил.
6. Соединение по любому из пп.1-3, где R6 представляет собой Н, (С1-С6)алкил, и R6' представляет собой Н, (С1-С6)алкил, (С3-С8)циклоалкил, (С1-С4)алкилен-(С3-С8)циклоалкил, (С1-С4)алкилен-(С5-С10)гетероциклил, в котором гетероциклил является незамещенным или замещенным (С1-С4)алкилом или галогеном, или (С1-С6)алкилен-(С6-С10)арил, в котором арил является незамещенным или замещенным галогеном, (С1-С4)алкилом, O-(С1-С4)алкилом или SO2(С1-С4)алкилом.
7. Соединение по любому из пп.1-3, где R6 представляет собой Н, (С1-С6)алкил, и R6' представляет собой Н, (С1-С6)алкил или (С3-С8)циклоалкил.
8. Соединение по любому из пп.1-3, где R6 представляет собой Н, и R6' представляет собой Н, (С1-С6)алкил или (С3-С8)циклоалкил.
9. Соединение по любому из пп.1-3, где R6 и R6' представляют собой Н.
10. Соединение по любому из пп.1-3, где R5 представляет собой Н или галоген.
11. Соединение по любому из пп.1-3, где R5 представляет собой Н.
12. Соединение по любому из пп.1-3, где R4 представляет собой Н или (С1-С6)алкил.
13. Соединение по любому из пп.1-3, где R4 представляет собой Н.
14. Соединение по любому из пп.1-3, где R7 представляет собой Н, галоген, (С1-С4)алкил или (С3-С6)циклоалкил и R8 представляет собой Н.
15. Соединение по любому из пп.1-3, где R7 и R8 представляют собой Н.
16. Соединение по любому из пп.1-3, где R9 представляет собой Cl, F, метил или этил.
17. Соединение по любому из пп.1-3, где n имеет значение 0, 1, 2 или 3.
18. Соединение по любому из пп.1-3, где n имеет значение 0 или 1.
19. Соединение по любому из пп.1-3, где n имеет значение 0.
20. Соединение по любому из пп.1-3, где R3 представляет собой Н.
21. Соединение по любому из пп.1-3, где L присоединен в 4-положении циклогексильного кольца
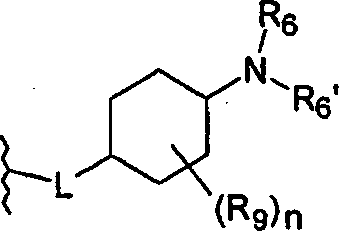
или
L присоединен в 3-положении циклогексильного кольца
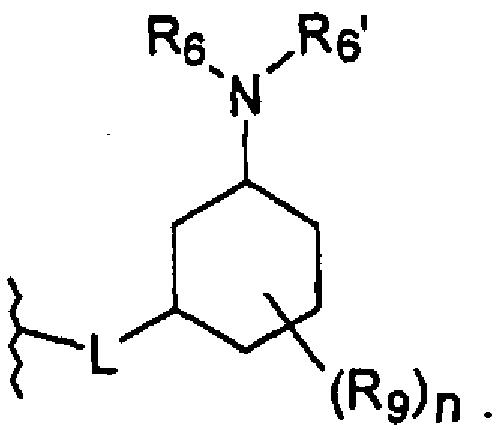
22. Соединение по любому из пп.1-3, где L присоединен в 4-положении циклогексильного кольца.
23. Соединение по любому из пп.1-3, где L представляет собой О-метилен, О-этилен или О.
24. Соединение по любому из пп.1-3, где L представляет собой О-метилен, О-этилен или О, присоединенный в 4-положении циклогексильного кольца.
25. Соединение по любому из пп.1-3, где L представляет собой О.
26. Соединение формул (I) или (I'), и/или их физиологически приемлемые соли, и/или стереоизомерные формы по любому из пп.1-3 для применения в качестве лекарственного средства.
27. Применение, по меньшей мере, одного соединения формулы (I) или (I'), и/или их физиологически приемлемых солей, и/или стереоизомерных форм по любому из пп.1-3 для получения лекарственного средства.
28. Применение соединения формул (I) или (I'), и/или их физиологически приемлемых солей, и/или стереоизомерных форм по любому из пп.1-3 для получения фармацевтических средств для лечения и/или профилактики заболеваний, которые связаны с Rho-киназой и/или опосредованным Rho-киназой фосфорилированием фосфатазы легкой цепи миозина.
29. Применение, по меньшей мере, одного соединения формулы (I) или (I'), и/или их физиологически приемлемых солей, и/или стереоизомерных форм по любому из пп.1-3 для получения лекарственного средства для лечения и/или профилактики гипертензии, легочной гипертензии, глазной гипертензии, ретинопатии, глаукомы, нарушения периферического кровообращения, окклюзивного заболевания периферических артерий (PAOD), коронарной болезни сердца, стенокардии, гипертрофии сердца, сердечной недостаточности, ишемических заболеваний, ишемической недостаточности органа (приводящей в результате к повреждению органа), фиброидного легкого, фиброидной печени, печеночной недостаточности, нефропатии, почечной недостаточности, фиброидной почки, почечного гломерулосклероза, гипертрофии органов, астмы, хронического обструктивного легочного заболевания (COPD), респираторного дистресс-синдрома взрослых, тромботических заболеваний, удара, церебрального вазоспазма, церебральной ишемии, боли, дегенерации нервных клеток, повреждения спинного мозга, болезни Альцгеймера, преждевременных родов, эректильной дисфункции, эндокринных дисфункций, артериосклероза, гипертрофии простаты, диабета и осложнений диабета, метаболического синдрома, рестеноза кровеносных сосудов, атеросклероза, воспаления, аутоиммунных заболеваний, СПИДа, остеопатии, бактериальных инфекций пищеварительного тракта, сепсиса или развития и прогрессирования рака.
30. Лекарственное средство для лечения и/или профилактики гипертензии, легочной гипертензии, глазной гипертензии, ретинопатии, глаукомы, нарушения периферического кровообращения, окклюзивного заболевания периферических артерий (PAOD), коронарной болезни сердца, стенокардии, гипертрофии сердца, сердечной недостаточности, ишемических заболеваний, ишемической недостаточности органа (приводящей в результате к повреждению органа), фиброидного легкого, фиброидной печени, печеночной недостаточности, нефропатии, почечной недостаточности, фиброидной почки, почечного гломерулосклероза, гипертрофии органов, астмы, хронического обструктивного легочного заболевания (COPD), респираторного дистресс-синдрома взрослых, тромботических заболеваний, удара, церебрального вазоспазма, церебральной ишемии, боли, дегенерации нервных клеток, повреждения спинного мозга, болезни Альцгеймера, преждевременных родов, эректильной дисфункции, эндокринных дисфункций, артериосклероза, гипертрофии простаты, диабета и осложнений диабета, метаболического синдрома, рестеноза кровеносных сосудов, атеросклероза, воспаления, аутоиммунных заболеваний, СПИДа, остеопатии, бактериальных инфекций пищеварительного тракта, сепсиса или развития и прогрессирования рака, содержащее эффективное количество, по меньшей мере, одного соединения формул (I) или (I'), и/или их физиологически приемлемых солей, и/или стереоизомерных форм по любому из пп.1-3, физиологически переносимые экципиенты и носители и, если это является подходящим, другие добавки и/или другие активные ингредиенты.
| Устройство для управления механизмом резания листорезальной машины | 1988 |
|
SU1541559A1 |
| Устройство для комплектования пластин в пакет магнитопровода | 1986 |
|
SU1403255A1 |
| RU 2003103606 А, 27.08.2004. | |||
Авторы
Даты
2012-01-27—Публикация
2006-07-20—Подача