Изобретение относится к новому комплексному антигену вируса кори для использования в качестве компонента иммуноферментной диагностической тест-системы и может быть использовано в медицинской вирусологии и микробиологии.
Известен антиген вируса кори, полученный на основе штамма вируса кори Ленинград 16 (Л-16), используемый в качестве компонента диагностической тест-системы (Руководство по вакцинному и сывороточному делу под ред. Академика АМН П.Н.Бургасова. М.: "Медицина", 1978. - с.220-223). Отработка технологии получения антигена вируса кори штамм Л 16 на тканевой культуре из эмбрионов японских перепелок (Васильева Г.А., Бойчук Л.М. - "Специфическая профилактика кори". - Материалы научно-практической конференции ЛНИИЭМ им. Пастера. - Л., 1970. - с.206-210).
Однако данный антиген вируса кори обеспечивает недостаточную чувствительность и специфичность выявления антител с использованием тест-систем на его основе.
Известен антиген вируса кори, полученный на основе штамма вируса кори Эдмонстон (Патент США №4211843, МПК A01N 1/02; А61К 39/12, опубл. 08.07.1980 г.). Штамм Эдмонстон депонирован в Американской Коллекции Клеточных Культур (АТСС - VK-24, 4/92). В ГНЦ ВБ "Вектор" прошел четыре пассажа на культуре клеток Vero. Подлинность штамма установлена методом положительной цепной полимеразной реакции со специфическими праймерами. Штамм относится к генотипу А. Максимальные титры вируса достигают на 5-6 сутки после заражения монослоя клеток Vero и составляют 5×106 ТЦПД50/мл [Агафонов А., и соавт.// Вопр.вирусол., 1997, N.1, с.102-205]. Антигенные свойства штамма: выявляет антитела к вирусу кори в сыворотках больных и вакцинированных людей.
Однако данный антиген вируса кори обеспечивает недостаточную чувствительность и специфичность выявления антител с использованием тест-систем на его основе.
Наиболее близким аналогом (прототипом) является антиген вируса кори, полученный на основе штамма вируса кори NovO/96 и используемый в качестве компонента иммуноферментной тест-системы для диагностики антител к вирусу кори (патент РФ №2230785, МПК C12N 7/00, опубл. 20.06.2004 г.). Вирус нарабатывают на монослое клеток Vero, клетки разрушают замораживанием-оттаиванием, лизат клеток получают центрифугированием и ультрафильтрацией. Антиген для ИФА очищают от чужеродных белков ультрацентрифугированием в градиенте плотности сахарозы, который инактивируют прогреванием при 56°С в течение 30 мин.
Однако данный антиген вируса кори также обеспечивает недостаточную чувствительность и специфичность выявления антител с использованием тест-систем на его основе.
Техническим результатом заявляемого изобретения является повышение чувствительности и специфичности комплексного антигена вируса кори, обеспечивающего выявление антител в сыворотке крови.
Указанный технический результат достигается получением комплексного антигена вируса кори, используемого в качестве компонента иммуноферментной тест-системы для диагностики антител к вирусу кори, полученного из культуральной жидкости, содержащей штаммы вируса кори Ленинград 16 с титром не менее 105.0 ТЦД50/мл, Эдмонстон - не менее 106.0 ТЦД50/мл, NovO/96 -не менее 108.0 ТЦД50/мл путем инактивации ее инфекционной активности детергентом и выделением белка из клеточного лизата хроматографической очисткой в количестве не менее 2 мкг/мл с чистотой не менее 70%.
Культуральная вируссодержащая жидкость получена при раздельном культивировании штаммов вируса кори Ленинград 16, Эдмонстон и NovO/96 на монослое культуры клеток Vero с последующим смешением культуральных вируссодержащих жидкостей в соотношении 1:1:1 по объему.
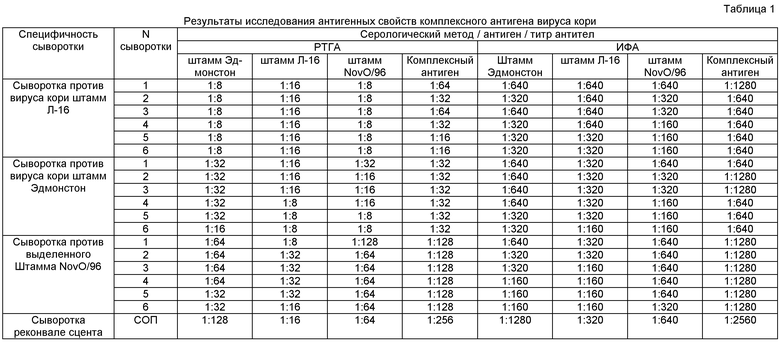
Антигенные свойства комплексного антигена. Выявляет все специфические антитела к вирусу кори в сыворотках больных и вакцинированных людей в более высоких титрах, чем при использовании каждого антигена в отдельности (табл.1).
На основе комплексного антигена создан иммуносорбент - основной компонент набора реагентов одностадийного ИФА для выявления антител к вирусу кори. Набор реагентов «Анти-Корь Ig Трисорбент» состоит из:
- иммуносорбента - комплексного антигена вируса кори, сорбированного в лунках полистироловых разборных планшетов;
- К1+ - положительный контрольный образец №1 - сыворотка крови человека, содержащая антитела к вирусу кори и не содержащая антитела к БИЧ-1, ВИЧ-2, ВГС,
- Treponema pallidum и HBs-антиген, инактивированная прогреванием при температуре 56°С в течение 3 ч - 1 фл., 2 мл;
- К2+ - слабоположительный контрольный образец №2 - сыворотка крови человека, содержащая антитела к вирусу кори в минимальном достоверно определяемом количестве, не содержащая антитела к ВИЧ-1, ВИЧ-2, ВГС, Treponema pallidum и HBs-антиген, инактивированная прогреванием в течение 3 ч при температуре 56°С - 1 фл., 2 мл;
- К- - отрицательный контрольный образец - сыворотка крови человека, не содержащая антитела к вирусу кори, ВИЧ-1, ВИЧ-2, ВГС, Treponema pallidum и HBs-антиген, инактивированная прогреванием при температуре 56°С в течение 3 ч - 1 фл., 3 мл;
- РК - раствор конъюгата - раствор моноклональных антител мыши к Ig человека, конъюгированных с пероксидазой хрена - 1 фл., 11 мл;
- РХ - раствор хромогена, содержащий ТМБ - 1 фл., 13 мл;
- ФСБ-Т(×25) - 25-кратный концентрат фосфатно-солевого буферного раствора с твином - 1 фл., 26 мл;
- стоп-реагент - 1 фл., 6 мл.
Аналитическая чувствительность и аналитическая специфичность набора были определены в ИФА при сравнительной постановке панели сывороток, охарактеризованной в ИФА с применением наборов для количественного определения IgG к вирусу кори производства ЗАО «Вектор-Бест» и ЗАО «Медико-биологический Союз» - «ВектоКорь-IgG» и «Корь-IgG-ДС» соответственно. Сравнительные характеристики наборов реагентов для одностадийного ИФА, в том числе «Анти-Корь Ig Трисорбент», полученный на основе заявляемого комплексного антигена, приведены в таблице 2.
Из таблицы 2 видно, что аналитическая чувствительность и специфичность тест-системы «Анти-Корь Ig Трисорбент», полученной на основе заявляемого комплексного антигена, значительно выше известных аналогов.
Пример 1. Способ получения комплексного антигена вируса кори
Получение вируссодержащей жидкости
Исходные клетки Vero хранят в жидком азоте и выращивают путем серийных пересевов. В качестве ростовой среды используют раствор Игла МЕМ с 8-10% эмбриональной сыворотки КРС. Культуру клеток выращивают в течение 3-4 суток при посевной концентрации клеток 5-10×105 кл/мл среды и пересевают общепринятым способом.
Соответствующим вирусом кори (штаммы Л-16, Эдмонстон, NovO/96) раздельно заражают 1-литровые культуральные сосуды с монослоем культуры клеток Vero (множественность заражения 1:10). После инкубации при 20-25°С в течение 40 минут в культуральные сосуды добавляют 200 мл питательной среды Игла МЭМ, содержащей 4,0±0,1 мл сыворотки крупного рогатого скота, 0.001% - трипсина, 200 ед/мл бензилпеницилина и 200 нг/мл стрептомицина. После инкубации в течение 5-7 суток при (36±1)°С сливают питательную среду. Титр вируса кори, штамм Л-16, в КВЖ составляет не менее 105.0 ТЦД50/мл, штамм Эдмонстон - не менее 106.0 ТЦД50/мл, штамм NovO/96 - не менее 108.0 ТЦД50/мл.
Получение лизата клеток Vero
При культивировании переход вируса из клетки в клетку осуществляется за счет образования симпластов без выхода основного количества последнего в КВЖ, поэтому накопление вируса происходит как в КВЖ, так и внутри клеток. В сосуд с культурой добавляют 5-7 мл 0.01 М Трис НС1, рН=7,6 и детергент тритон Х-100 до конечной концентрации 2-3%. Суспензию инкубируют 1 ч при (36±1)°С и перемешивании, затем обрабатывают ультразвуком 22 Гц 2 раза по 20 сек. Клеточный лизат освобождают от клеточного детрита отстаиванием КВЖ при 4-8°С в течение 8-12 ч или низкоскоростным центрифугированием (ротор JA-14 центрифуги J2-21 («Beckman», США)) при 10000 об/мин в течение 20 мин при температуре 4°С.
Пример 2. Подбор условий хроматографической очистки комплексного антигена
ДЕАЕ-целлюлозу («Whatman», Швеция) подготавливают согласно рекомендациям фирмы-производителя. Колонку с ДЕАЕ-целлюлозой уравновешивают буфером 20 мМ Трис-HCl, рН 7,6. Объединенную суспензию антигенного материала трех штаммов вируса кори наносят на колонку из расчета 1 мл суспензии на 1 мл сорбента. После нанесения колонку промывают тем же буфером. Элюцию сорбированного материала проводят ступеньками концентраций NaCl в том же буферном растворе до снижения оптической плотности при длине волны 280 нм в вытекающем с колонки растворе до «нулевого» значения. Каждую фракцию исследуют на качество антигена по чувствительности и специфичности методом ИФА (см. табл.3).
Пример 3. Хроматографическая очистка комплексного антигена
Колонку с ДЕАЕ-целлюлозой уравновешивают буфером 20 мМ Трис-HCl, рН 7,6. Объединенную суспензию антигенного материала трех штаммов вируса кори наносят на колонку из расчета 1 мл суспензии на 1 мл сорбента. После нанесения колонку промывают тем же буфером, содержащим 0,2 М NaCl. Элюцию целевого комплексного антигена проводят 0,4 М NaCl в том же буфере. Целевую фракцию контролируют на соответствие качества антигена по чувствительности и специфичности методом ИФА.
Выход высокоочищенного комплексного антигена с 3 л КВЖ и лизата клеток составляет 15-20 мг.
Пример 4. Изготовление иммуносорбента
Иммуносорбент готовят добавлением 0,20±0,06 мл комплексного антигена вируса кори после очистки на колонке (см. Пример 3) к 1,00±0,01 л р-ра для сорбции. Состав р-ра для сорбции: 2,00±0,01 г натрия углекислого, 0,50±0,01 г натрия азида, 0,400±0,012 мл 2% фенолфталеина, вода очищенная - до 1 литра. Иммуносорбент перемешивают на магнитной мешалке в течение 1 ч при температуре от 18°С до 24°С.
Нанесение и сорбция иммуносорбента на планшеты: для сорбции используют планшеты Nunc Medisorp - «Nunc А/S», Дания, или аналогичные им. Объем заполнения лунок - 100-105 мкл. Сорбцию проводят при температуре от 17°С до 27°С, время сорбции - 18-20 ч.
Пример 5. Методика применения набора реагентов для одностадийного ИФА "Анти-корь Ig Трисорбент"
Для проведения анализа используется сыворотка или плазма крови человека. Для проведения анализа достаточно 10 мкл образца. Для выявления антител класса G к вирусу кори можно использовать сыворотку (плазму) крови человека как свежеприготовленную, так и хранившуюся не более 7 суток при температуре от 2°С до 8°С при условии отсутствия микробной контаминации либо не более 12 месяцев при температуре минус 20°С. Допускается замораживание сыворотки (плазмы) до температуры минус 20°С не более двух раз.
Для проведения реакции во все лунки планшета вносят по 90 мкл р-ра для разведения образца (состав: 2,00±0,01 г натрия углекислого, 0,50±0,01 г натрия азида, 0,400±0,012 мл 2% фенолфталеина, вода очищенная - до 1 литра). В лунку планшета А1 вносят 10 мкл К1+, в лунки В1 и С1 вносят по 10 мкл К2+. В лунку D1 вносят 10 мкл К-. В остальные лунки планшета вносят по 10 мкл исследуемых сывороток (конечное разведение контрольных и исследуемых образцов - 10 раз). Раствор перемешивают пипетированием и инкубируют в течение 40 мин при температуре 37°С. По окончании инкубации содержимое лунок удаляют и планшет промывают семь раз рабочим раствором ФСБ-Т. В каждую лунку вносят по 100 мкл р-ра хромагена и планшет помещают на 15 мин в защищенное от света место при температуре 37°С. Реакцию останавливают внесением в каждую лунку планшета по 50 мкл стоп-реагента.
Величину ОП растворов в лунках иммуносорбента измеряют на спектрофотометре в двухволновом режиме: основной фильтр - 450 нм, референс-фильтр - в диапазоне от 620 до 700 нм. Результаты теста считают положительными, если ОП исследуемой сыворотки больше ОПК2+ср. (нижняя граница положительных значений соответствует 0,28 МЕ/мл). Результаты теста считают отрицательными, если ОП исследуемой сыворотки меньше ОПК2+ср. - 20% (верхняя граница отрицательных значений соответствует 0,12 МЕ/мл).
Псыв. рассчитывают по формуле:
Псыв.=ОПсыв.×0,25: (ОПК2+ср.)
где ОПсыв. - значение ОП исследуемой сыворотки.
Асыв. (титр антител в МЕ) рассчитывают по формуле:
Асыв.=10(Псыв.-a)÷b
где а и b - константы, специфичные для каждой серии (указаны в Инструкции, которая сопровождает каждый набор).
Пример расчета полученных данных приведен в таблице 4.
Пример 6. Использование набора реагентов «Анти-Корь Ig Трисорбент» на основе заявляемого антигена в клинической практике
1. Во время вспышки инфекционного заболевания в г. Благовещенск в 2010 г. набор реагентов «Анти-Корь Ig Трисорбент» был использован для серологического подтверждения клинического диагноза «корь». У 2-х больных на 2-3 сут после появления клинических признаков заболевания и через 2-4 недели проводили забор крови и получение сывороток для серологического подтверждения диагноза «корь». Нарастание титров специфических антител в парных сыворотках изучали в ИФА с использованием коммерческих наборов «Мелиса Корь-IgM» пр-ва ЗАО «МБС» и параллельно с помощью экспериментальных серий «Анти-Корь Ig Трисорбент», основным компонентом которой является иммуносорбент на основе комплексного антигена вируса кори. Диагноз «корь» подтверждали после проведения ПЦР со специфическими праймерами на С-концевую часть гена, кодирующего NP белок вируса кори, и секвенирования амплификационного фрагмента.
Набор «Мелиса Корь-IgM» выявил специфические IgM к вирусу кори у обоих больных. При постановке ИФА на наборе «Анти-Корь Ig Трисорбент» у этих больных также было отмечено наличие специфических IgM к вирусу кори. При определении нарастания титра специфических антител в парных сыворотках с помощью «Анти-Корь Ig Трисорбент» у обеих больных было заригистрировано как минимум 4-кратное нарастание специфических IgG к вирусу кори.
В образцах больных методом ПЦР был обнаружен генетический материал (РНК) вируса кори. Секвенирование показало принадлежность вируса, вызвавшего вспышку, к генотипу Н.
Таким образом, набор реагентов «Анти-Корь Ig Трисорбент» может быть использован для выявления ранних антител к вирусу кори, а также для определения специфических антител в парных сыворотках, полученных от больных, и таким образом для определения, снятия или подтверждения диагноза при протекании заболевания с клиническими проявлениями, характерными для кори.
2. В период с 2005 по 2010 г.г. в Новосибирской обл. проводились работы по изучению титра специфических антител к вирусу кори в сыворотках крови детей возраста 6 лет перед проведением второй вакцинации против кори. Титры специфических антител изучали в реакции РТГА (по стандартной методике с использованием эритроцитов обезьяны Macaca mulatta) и методом ИФА (с помощью заявляемого набора реагентов «Анти-Корь Ig Трисорбент»).
Результаты сравнения методов ИФА и РТГА для определения противокоревых антител в сыворотке крови детей показали, что с помощью «Анти-Корь Ig Трисорбент» специфические антитела были определены в 235 сыворотках из 237 исследованных сывороток. Аналогичные результат (235 сывороток из 237) были получены с помощью РТГА. Средние арифметические величины специфической активности противокоревых антител, определенных с помощью набора «Анти-Корь Ig Триеорбент», были выше, чем определенные в РТГА (6,2 МЕ/мл и 3,3 МЕ/мл соответственно).
Таким образом, набор реагентов для одностадийного ИФА «Анти-Корь Ig Трисорбент» может быть использован для определения напряженности индивидуального иммунитета к заболеванию «корь».
| название | год | авторы | номер документа |
|---|---|---|---|
| ШТАММ ВИРУСА КОРИ NOVO/96 ДЛЯ ПОЛУЧЕНИЯ АНТИГЕНА - КОМПОНЕНТА ТЕСТ-СИСТЕМЫ И ИММУНОФЕРМЕНТНАЯ ТЕСТ-СИСТЕМА ДЛЯ ДИАГНОСТИКИ АНТИТЕЛ К ВИРУСУ КОРИ | 2002 |
|
RU2230785C2 |
| ШТАММ ВИРУСА ПАРОТИТА ДРАГУН ДЛЯ ПОЛУЧЕНИЯ АНТИГЕНА-КОМПОНЕНТА ТЕСТ-СИСТЕМЫ И ИММУНОФЕРМЕНТНАЯ ТЕСТ-СИСТЕМА ДЛЯ ДИАГНОСТИКИ АНТИТЕЛ К ВИРУСУ ПАРОТИТА | 2007 |
|
RU2348691C1 |
| ШТАММ ВИРУСА КОРИ ДЛЯ ПРИГОТОВЛЕНИЯ ИММУНОБИОЛОГИЧЕСКИХ ПРЕПАРАТОВ | 1992 |
|
RU2035509C1 |
| Штамм вируса Эбола Заир H.sapiens-wt/GIN/2015/Kalidie-Kindia-1022 для получения антигена, используемого в качестве компонента иммуноферментной тест-системы для выявления антител классов G и М к вирусу Эбола | 2016 |
|
RU2631937C1 |
| Штамм hCoV-19/Russia/Omsk-202118-1707/2020 коронавируса SARS-CoV-2, иммуносорбент, содержащий цельновирионный очищенный антиген, полученный на основе указанного штамма и тест-система ИФА для выявления антител классов M, G и A к коронавирусу SARS-CoV-2 с использованием указанного иммуносорбента | 2021 |
|
RU2752862C1 |
| СПОСОБ КУЛЬТИВИРОВАНИЯ ВИРУСА КОРИ | 1994 |
|
RU2053297C1 |
| СПОСОБ ПОЛУЧЕНИЯ СТАНДАРТНОЙ ПОЛОЖИТЕЛЬНОЙ ПАНЕЛИ СЫВОРОТОК КРОВИ ДЛЯ КОНТРОЛЯ КАЧЕСТВА ИММУНОФЕРМЕНТНЫХ ТЕСТ-СИСТЕМ, ПРЕДНАЗНАЧЕННЫХ ДЛЯ ВЫЯВЛЕНИЯ СПЕЦИФИЧЕСКИХ АНТИТЕЛ К ВИРУСНЫМ РЕСПИРАТОРНЫМ ИНФЕКЦИЯМ В БИОЛОГИЧЕСКИХ ЖИДКОСТЯХ ОРГАНИЗМА КРУПНОГО РОГАТОГО СКОТА | 2008 |
|
RU2392331C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЖИВОЙ КОРЕВОЙ ВАКЦИНЫ ДЛЯ ПЕРОРАЛЬНОГО ПРИМЕНЕНИЯ И СПОСОБ ИММУНИЗАЦИИ ПРОТИВ КОРИ | 1997 |
|
RU2133625C1 |
| ШТАММ ВИРУСА ДЛЯ ИЗГОТОВЛЕНИЯ ВАКЦИННЫХ ПРЕПАРАТОВ ПРОТИВ ГЕМОРРАГИЧЕСКОЙ ЛИХОРАДКИ С ПОЧЕЧНЫМ СИНДРОМОМ (ВАРИАНТЫ) | 2018 |
|
RU2683508C1 |
| Система иммуноферментного анализа для определения антител класса А (IgA) против полиовируса в слюне людей для оценки уровня мукозального иммунитета к данному вирусу | 2024 |
|
RU2829655C1 |
Комплексный антиген вируса кори, используемый в качестве компонента иммуноферментной тест-системы для диагностики антител к вирусу кори, получен из культуральной жидкости, содержащей штаммы вируса кори Ленинград 16 с титром не менее 105.0 ТЦД50/мл, Эдмонстон - не менее 106.0 ТЦД50/мл, NovO/96 - не менее 108.0 ТЦД50/мл путем инактивации ее инфекционной активности детергентом и выделением белка из клеточного лизата хроматографической очисткой в количестве не менее 2 мкг/мл с чистотой не менее 70%. Культуральная вируссодержащая жидкость получена при раздельном культивировании штаммов вируса кори Ленинград 16, Эдмонстон и NovO/96 на монослое культуры клеток Vero с последующим смешением культуральных вируссодержащих жидкостей в соотношении 1:1:1 по объему. Использование изобретения позволит повысить чувствительность и специфичность комплексного антигена, обладающего свойством выявлять антитела в сыворотке крови. 1 з.п. ф-лы, 4 табл.
1. Комплексный антиген вируса кори, используемый в качестве компонента иммуноферментной тест-системы для диагностики антител к вирусу кори, полученный из культуральной жидкости, содержащей штаммы вируса кори Ленинград 16 с титром не менее 105.0 ТЦД50/мл, Эдмонстон - не менее 106.0 ТЦД50/мл, NovO/96 - не менее 108.0 ТЦД50/мл путем инактивации ее инфекционной активности детергентом и выделением белка из клеточного лизата хроматографической очисткой в количестве не менее 2 мкг/мл с чистотой не менее 70%.
2. Комплексный антиген по п.1, отличающийся тем, что культуральная вируссодержащая жидкость получена при раздельном культивировании указанных в п.1 штаммов вируса кори на монослое культуры клеток Vero с последующим смешением культуральных вируссодержащих жидкостей в соотношении 1:1:1 по объему.
| ШТАММ ВИРУСА КОРИ NOVO/96 ДЛЯ ПОЛУЧЕНИЯ АНТИГЕНА - КОМПОНЕНТА ТЕСТ-СИСТЕМЫ И ИММУНОФЕРМЕНТНАЯ ТЕСТ-СИСТЕМА ДЛЯ ДИАГНОСТИКИ АНТИТЕЛ К ВИРУСУ КОРИ | 2002 |
|
RU2230785C2 |
| CN 1904069 А, 31.01.2007 | |||
| US 4211843 В, 08.07.1980. | |||
Авторы
Даты
2012-02-10—Публикация
2010-11-10—Подача