Изобретение относится к области лучевой терапии злокачественных опухолей быстрыми нейтронами. Нейтроны генерируют на ускорителях заряженных частиц.
Лучевая терапия является основным методом лечения для 70% больных онкологическими заболеваниями. Причем для 20% из них, страдающих резистентными опухолями, целесообразно использовать плотно-ионизирующие излучения - нейтроны, протоны, пи-мезоны, тяжелые ионы. Эти излучения обладают более высокой эффективностью воздействия на резистентные виды опухолей, плохо поддающиеся лечению гамма-, рентгеновским и электронным излучениями. В настоящее время из плотно-ионизирующих излучений наиболее перспективными и доступными в клинической практике являются нейтроны, как быстрые в области энергий 0,5-30 МэВ, используемых в дистанционной терапии, так и эпитепловых энергий 1 эВ - 30 кэВ - для нейтрон-захватной терапии.
В нейтронной терапии в последние годы 20 века в США, странах ЕС, Японии, Южной Корее, Саудовской Аравии, ЮАР наибольшее распространение получили источники быстрых нейтронов с энергиями 21-29 МэВ интенсивностью (2÷5)·1012 н./(см2·с), получаемые на ускорителях бомбардировкой протонами (или дейтронами) бериллиевой мишени. Глубинное распределение поглощенной дозы в ткани для этих энергий быстрых нейтронов подобно высоковольтному рентгеновскому излучению, половинная доза расположена в диапазоне 8÷15 см при расстоянии источник-пациент (РИП)=1-1,5 м. Использование таких источников позволяет лечить глубоколежащие опухоли. Для энергий нейтронов 6 МэВ глубина половинной дозы расположена в диапазоне 8,5 см для РИП=1,25 м. Как правило, равномерный поток нейтронов по полю облучения удается достичь на расстоянии ~1 м от источника нейтронов.
В МРНЦ РАМН накоплен уникальный опыт физико-дозиметрических, клинических и радиобиологических исследований с различными источниками нейтронного излучения - ядерными реакторами, ускорителями, генератором ИНГ-031 и изотопным источником калифорния-252 [1]. 1 грамм 252Cf испускает мощный поток нейтронов ~2,3×1012 н./с. Средняя энергия нейтронов спектра деления 252Cf составляет 2,15 МэВ при соотношении доз гамма-излучения и нейтронов ~35% и 65%. При этом используются внутритканевые источники двух видов: штырьковые, представляющие собой линейные источники излучения, и гибкие сборки из точечных источников. Разработаны аппараты для дистанционной подачи источников к месту облучения: АНЕТ-1 для внутритканевой и АНЕТ-В для внутриполостной терапии. К настоящему времени эффективность контактной терапии с использованием излучения 252Cf изучена по отношению к широкому кругу опухолей. Апробированы различные варианты методик применения излучения 252Cf в лучевой терапии. Приобретенный к настоящему времени клинический опыт показывает, что применение излучения 252Cf открывает дополнительные возможности в плане местного усиления противоопухолевого воздействия. Анализ биофизических факторов приводит к выводу о высокой опасности нейтронов 252Cf.
Одним из основных недостатков, возникающих при применении источников из 252Cf для контактной лучевой терапии, является обеспечение удовлетворительной защиты медицинского, обслуживающего и технического персонала.
Известно устройство для терапии быстрыми нейтронами на базе циклотрона У-120 в НИИ онкологии Томского научного центра РАМН [2]. Быстрые нейтроны со средней энергией 6,5 МэВ интенсивностью 6,5·109 н./(стерадиан·мкА·с) на выходе коллиматора размерами 15×15 см2 генерируют с помощью ядерной реакции 9Be(d,n)l0B. Пучок нейтронов, сформированный специальным коллиматором длиной 85 см из железа и борированного полиэтилена, введен в медицинский блок. Мониторирование интенсивности нейтронного пучка во время терапевтического сеанса осуществляется ионизационной камерой. Мощность дозы на поверхности фантома составляет 15 сГр/мин для РИП=100 см при максимальном токе дейтронов на мишени. Планирование нейтронной терапии для различных локализаций злокачественных новообразований осуществляется с помощью пары ионизационных камер и фантома.
Недостатком устройства является отсутствие возможности его свободного перемещения в различные медицинские учреждения.
Известно устройство для дистанционной нейтронной терапии (ДТБН) с использованием нейтронов исследовательского ядерного реактора FRM в г. Мюнхене (ФРГ) [3]. В этом методе кресло пациента располагается в пучке нейтронов ядерного реактора в медицинском блоке. В помещении ядерного реактора устанавливается фильтр, который выводит из пучка нейтроны малых энергий и спектр нейтронов пучка становится жестче. Сеанс нейтронной терапии осуществляют при открытом шибере (заслонке) нейтронов, а при закрытом - проводят подготовку пациента к лечению.
К настоящему времени исследовательский ядерный реактор FRM выведен из эксплуатации.
Известно устройство для терапии на основе генератора быстрых нейтронов с энергией 14 МэВ на вакуумных трубках с использованием ядерной реакции 3T(d,n)4He с выходом 5·1012 н./с. Устройство планировалось установить в Германском исследовательском онкологическом центре (г. Гейдельберг) [4]. Это устройство содержит источник нейтронов, испускаемых мишенью, окруженный радиационной защитой. В защите расположен нейтронный канал (коллиматор). Мишень расположена вблизи торца коллиматора. Система формирования радиационного поля в этой установке выполнена из железа, борированного полиэтилена и свинца. Сменные коллиматоры в форме усеченных пирамид из специальной стали формируют поля квадратного или прямоугольного сечения размерами 8×8, 10×10, 12×12, 13×13 и 15,5×10 см2. Мощность дозы (кермы) для РИП=100 см составляет >15 сГр/мин и 20 сГр/мин для РИП=85 см. Половинная доза расположена на глубине 10,8 см. Качество радиационной защиты Н, определяемое как расстояние от края нейтронного канала на поверхности защиты со стороны пациента, на котором керма уменьшается с 80% до 20%, составляет 2,5 см. Для измерения дозы во время терапевтического сеанса используется измерительная система с детектором на основе тканеэквивалентной ионизационной камеры, которая расположена в центре пучка нейтронов внутри нейтронного канала. Такой же детектор используется для исследования дозовых распределений в водном фантоме с клиновидным фильтром при планировании нейтронной терапии злокачественных новообразований сложной геометрической формы.
Недостаток устройства заключается в отсутствии его практического исполнения.
На пучке нейтронов Б-3 реактора БР-10 ГНЦ РФ ФЭИ впервые в мире был доведен до клинического использования способ ДТБН [5]. В реакторном зале на выходе канала Б-3 помещали фильтр нейтронов из борированного полиэтилена толщиной 1 см или из 2 см полиэтилена + 3 см титана, при этом средняя энергия нейтронов составляла 0,85 МэВ и 0,95 МэВ для каждого фильтра соответственно. Пучок быстрых нейтронов выводили в медицинский блок. Кресло пациента располагали в медицинском блоке вблизи коллиматора на расстоянии ~10 м от активной зоны, плотность потока быстрых нейтронов на номинальной мощности реактора 7,6 МВт составляла ~2,3·108 н./(см2·с). Коллиматор с профилем пучка нейтронов прямоугольной формы выполнен из чередующихся слоев свинца и борированного полиэтилена. Размеры профиля пучка нейтронов плавно менялись от 4×4 см2 до 10×10 см2. Мощность кермы на поверхности фантома достигала 18 сГр/мин при ее половинной глубине - 5,5 см. В последнее время эксплуатации реактора БР-10 мощность снижали до 4,3 МВт, а мощность кермы соответственно до ~10 сГр/мин, что не препятствовало успешному проведению ДТБН.
Недостаток - к настоящему времени исследовательский ядерный реактор БР-10 выведен из эксплуатации.
Прототипом предложенного технического решения является устройство Уральского центра нейтронной терапии (УЦНТ). Нейтронная терапия осуществляется на генераторе "НГ-12И" с использованием ядерной реакции 3T(d,n)4He. Интенсивность потока нейтронов с энергией 14 МэВ из мишени ускорителя составляет 1,5·1012 н./с [6]. При этом диаметр мишени составляет 25 мм. Пучок нейтронов выводят в медицинский блок. В зависимости от локализации онкологического заболевания пациент может располагаться в двух положениях: на кресле или на кровати на расстоянии 85 см и 105 см от источника нейтронов, соответствующих каждому положению. Составной коллиматор расположен в защите и выполнен в определенной последовательности: 45 см железа + 15 см борированного полиэтилена + 5 см железа. Мощность кермы на поверхности фантома составляет 5,5 сГр/мин для РИП=105 см. Половинная керма расположена на глубине 9 см. Вклад гамма-излучения в суммарную керму составляет 4-8%.
Главный недостаток прототипа заключается в отсутствии его мобильности.
Технический результат предлагаемого изобретения заключается в улучшении эксплуатационных характеристик устройства для лечения быстрыми нейтронами, включая его мобильность. При этом должны быть обеспечены клинические требования, направленные на уменьшение ожидаемых лучевых повреждений и повышение терапевтической эффективности. Обозначенный технический результат может быть получен за счет создания оптимального формирователя радиационных полей и необходимой радиационной защиты пациента для источника нейтронов с энергией 14 МэВ с выходом 1011 н./c.
В настоящее время во ВНИИА им. Н.Л.Духова разрабатывается портативный генератор НГ-24 - источник нейтронов с энергией 14 МэВ с использованием ядерной реакции 3T(d,n)4He интенсивностью ~1011 н./с для лучевой терапии. При этом следует отметить, что известные стационарные источники нейтронов с энергией 14 МэВ превышают выход нейтронов из мишени генератора НГ-24 в 15÷50 раз [2, 4, 6]. Для удовлетворения клинических требований с источником нейтронов НГ-24 к мощности дозы на объект 8-18 сГр/мин и качеству защиты необходимо РИП уменьшить до 15-25 см.
Однако такие условия, в свою очередь, требуют новое техническое решение для формирования радиационных полей с минимальной толщиной защиты.
Для обеспечения оптимального формирования радиационных полей нами были проведены физико-дозиметрические исследования по поиску материалов защиты и созданию конструкции терапевтической установки. При расчете радиационных полей использован метод Монте-Карло [7], применяемый для проектирования активных зон ядерных реакторов и радиационной защиты. Расчетные исследования показали, что известные защитные материалы (железо, борированный полиэтилен, свинец), а также специальный материал, используемый для радиационной защиты при работе и транспортировке отработанных тепловыделяющих сборок с атомных станций [8], по своим характеристикам не удовлетворяют клиническим требованиям. Поэтому был расширен спектр поиска материалов, включая соли металлов, металлоподобные соединения, органические материалы, растворители и некоторые заполнители пористых материалов. Всего было рассмотрено ~140 соединений.
Наши теоретические исследования показали, что наиболее приемлемой конструкцией, обеспечивающей клинические условия, является установка с генератором нейтронов и нейтронным каналом, встроенным в биологическую защиту. В качестве материалов с высокой эффективностью, замедляющих быстрые нейтроны, могут быть использованы вольфрам, бориды, нитриды, карбиды вольфрама; тантал, бориды, нитриды, карбиды тантала; вещества с высокой ядерной плотностью водорода (BeH2, LiBH4, NH3BH3, H2B(NH3)2BH4 [9], Li[AlH4], AlH3, B3N3H6, LiNH2 и т.д.), BN [10], Li3N, Be3N2, гидрид мишметалла, гидрид циркония, фторид циркония, гидриды тантала (см. таблицу).
Сущность изобретения заключается в том, что в известное по прототипу устройство, включающее генератор нейтронов, окруженный сверху защитой из борированного полиэтилена, расположенный вплотную к биологической защите и на одной оси с встроенным в нее нейтронным каналом, дополнительно введена функциональная защита, прилегающая вплотную к биологической защите. Обе защиты выполнены в виде усеченных конусов, вставленных один в другой, с большим основанием со стороны выходного отверстия нейтронного канала и меньшим - со стороны генератора нейтронов. При этом части биологической и/или функциональной защиты выполнены однородными - из одного материала или составными - из разных материалов в виде чередующихся слоев. Обе защиты или их части выполнены из любой комбинации материалов: W, Та, гидридов металлов - ТаН, ТаН2, ТаН3, TaD, TaD2, TaD3, гидрида мишметалла, ZrH2 и металлоподобных веществ: WB, W2B, WB2, W2B5, WN, WC, W2C, Та2В, ТаВ2, Та3В2, Та3В4, TaN, TaC, а также из веществ, содержащих легкие ядра (водород, дейтерий, бериллий, литий, бор, углерод, азот, кислород, фтор и т.д.) BN, Li3N, LiH, Be3N2, ZrF4. В качестве высокоэффективных материалов, замедляющих нейтроны, использованы водородосодержащие вещества: NH3BH3, Н2В(NH3)2ВН4, LiBH4, BeH2, Li[AlH4], AlH3, B3N3H6, LiNH2, а также раствор бора-10, лития-6 в легкой или тяжелой воде.
Пористые материалы заполнены жидкими органическими веществами, выбранными из веществ с большой проникающей способностью и с максимальным содержанием ядер водорода (дейтерия).
При малой толщине защиты предлагаемого устройства терапевтическая эффективность обеспечивает защиту здоровых участков тела пациента, зависит от размеров входного отверстия нейтронного канала и источника нейтронов, а также суммарной толщины обеих защит. Эффективность определена соотношением F=D/L, где D - расстояние от среза выходного отверстия нейтронного канала на поверхности защиты до точки, в которой керма составляет до 20% от кермы в центре пучка нейтронов, a L - расстояние, прошедшее нейтроном любой энергии без взаимодействия с материалами защиты.
При лечении злокачественных новообразований гортани, молочной железы очаг заболевания располагают вблизи выходного отверстия нейтронного канала. В этом случае в функциональной защите имеется выемка в соответствии с анатомией тела или облучаемого органа пациента.
Для увеличения мощности дозы до 25% в водородосодержащей защите внутри нейтронного канала вставлен вкладыш из неводородосодержащих материалов.
Перечень фигур
Фиг.1. Конструкция многофункционального терапевтического устройства: 1 - генератор нейтронов НГ-24, 2 - биологическая защита из материала А, 3 - биологическая защита из материал Б, 4 - биологическая защита из материала В, 5 - функциональная защита из материала А, 6 - функциональная защита из материала Б, 7 - функциональная защита из материала В, 8 - водный фантом, 9 - кронштейн, 10 - источник нейтронов, 11 - борированный полиэтилен, 12 - нейтронный канал.
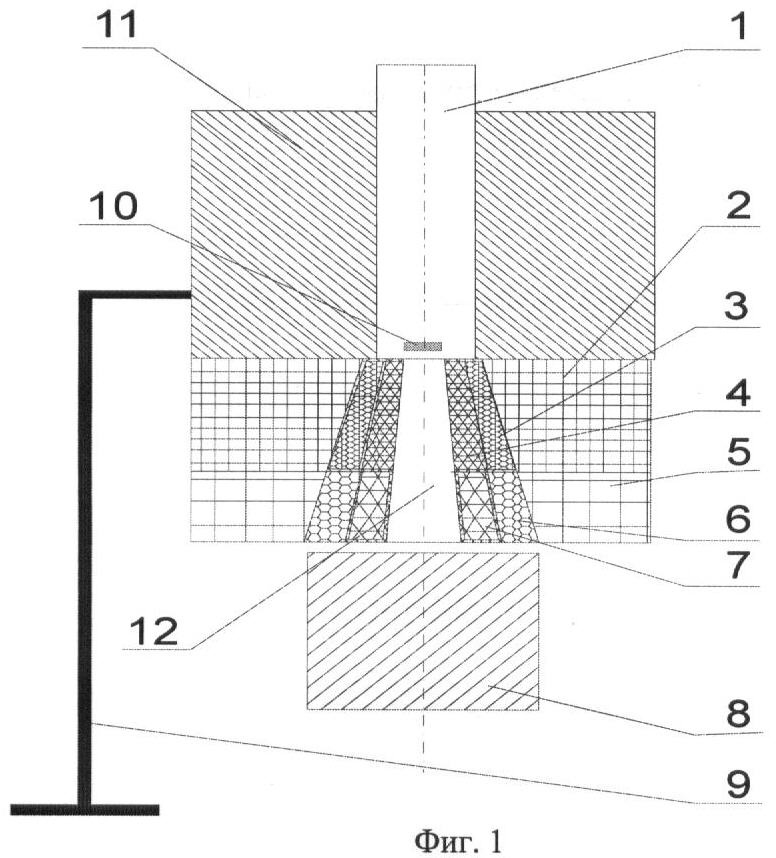
Фиг.2. Распределение кермы на глубине 0,5 см в фантоме по радиусу нейтронного канала и в тени защиты в установке с функциональной защитой: 13 - (65 - УЦНТ), 14 - (25 - ТаН), 15 - (15 - ТаН+ТаН), 16 - (20 - ТаН+ТаН), 17 - (20 - W2B5+ZrH2), 18 - (25 - Устройство), Н - качество радиационной защиты.
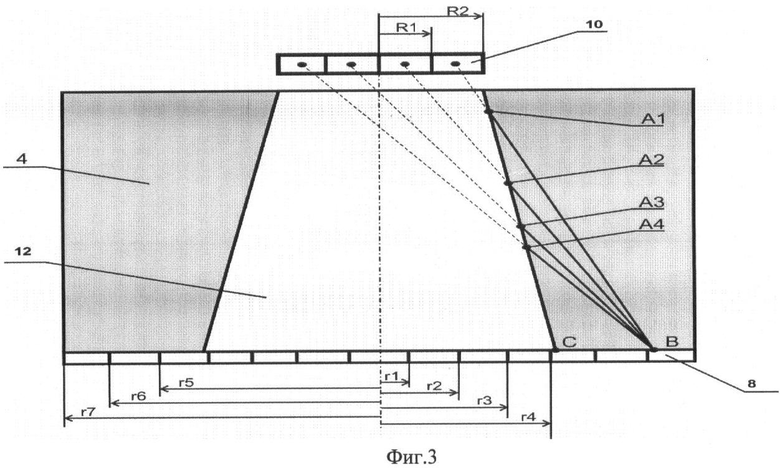
Фиг.3. Схема для расчета терапевтической эффективности устройства: 4 - биологическая защита, 8 - водный фантом, 10 - источник нейтронов, 12 - нейтронный канал.
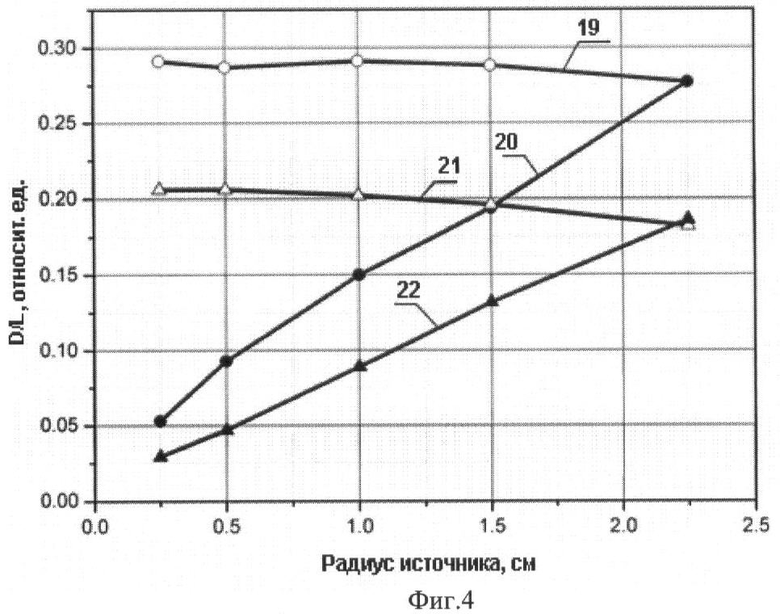
Фиг.4. Зависимость терапевтической эффективности устройства от радиуса источника нейтронов: 19 - Rист.≤Rвх. при толщине защиты 15 см; 20 - Rист.=Rвх. при толщине защиты 15 см; 21 - Rист.≤Rвх. при толщине защиты 20 см; 22 - Rист.=Rвх. при толщине защиты 20 см. Rист. - радиус источника нейтронов, Rвх. - радиус входного отверстия нейтронного канала.
Описание устройства
Генератор нейтронов НГ-24 (1) (Фиг.1) расположен вплотную к биологической защите (3, 4) на одной оси с нейтронным каналом (12), выполненным в форме усеченного конуса. Его большее основание (выходное отверстие нейтронного канала) обращено к пациенту, а меньшее (на входе) диаметром 2,3 см - к НГ-24. При этом диаметр активной части источника нейтронов составлял 2,25 см. Диаметр выходного отверстия канала может быть выбран в зависимости от размеров полей облучения опухолей: от 4 см до 10 см. Биологическая защита (2, 3, 4) выполнена в виде составных частей из различных материалов (А, Б, В). Каждая часть выполнена в форме усеченного конуса, которые вставлены друг в друга. Функциональная защита (5, 6, 7) выполнена в такой же конусной форме из различных или таких же материалов и установлена вплотную к биологической защите на одной оси нейтронного канала (12). Для исследования распределения дозовых полей использован водный фантом (8) размерами 30×30×30 см3.
Рассматриваемое устройство крепят к полу или стене с помощью кронштейна (9). Мишень генератора нейтронов (10) располагают на расстоянии 0,5-1 см от начала нейтронного канала (12). Для защиты пациента от рассеянного излучения генератор сверху окружен борированным полиэтиленом (11) с наружным диаметром 80 см и высотой 120 см.
Обоснование параметров установки
На начальном этапе проектирования терапевтической установки были проведены расчетные исследования качества защиты прототипа УЦНТ с источником нейтронов с энергией 14 МэВ интенсивностью 1,5·1012 н./с [6]. Его биологическая защита выполнена из чередующихся слоев: 45 см железа + 15 см борированного полиэтилена (BCH2) + 5 см железа - общая толщина защиты составляет 65 см. Источник нейтронов выполнен в форме диска диаметром 2,5 см, расположен на расстоянии 1 см от входного отверстия нейтронного канала диаметром 3 см. Выходной диаметр нейтронного канала конической формы составляет 6 см. Водный фантом размерами 30×30×30 см3 располагали на расстоянии 20 см от защиты - РИП=86 см. Результаты расчетных исследований представлены в п.1 таблицы и на Фиг.2 - (13). Мощность кермы на поверхности фантома составляет 9 сГр/мин с источником нейтронов энергией 14 МэВ, интенсивностью 1,5·1012 н./с для РИП=86 см, Н=1,5 см, Кор=1,4%, что удовлетворяет медицинским требованиям и соответствует европейскому протоколу.
В таблице приведены результаты расчетных исследований. В первом столбце указан порядковый номер расчета, во втором - толщина биологической защиты и ее материал, в третьем - материал функциональной защиты, в четвертом - мощность кермы, в пятом столбце - качество защиты - Н. В последнем столбце представлены значения кермы - Кор (на критические органы - глаза, головной мозг и т.д.) на расстоянии 15-20 см от центральной оси пучка относительно величины кермы - К в центре.
В нашей малогабаритной установке (см. Фиг.1) с генератором нейтронов НГ-24 - (1) и выходом нейтронов 1011 н./с проведены расчетные исследования. Толщину биологической защиты изменяли в интервале 15-20-25 см - (2, 3, 4) и толщина функциональной защиты - (5, 6, 7) составляла 10 см. Результаты расчетов приведены в п.п.2-69 таблицы и некоторые композиции защит на Фиг.2.
При проектировании малогабаритной радиационной защиты рассматривали различные материалы и их сочетания. В качестве одной из комбинаций рассматривали тантал и его гидриды: ТаН, ТаН2, ТаН3. Результаты расчетов с биологической защитой толщиной 20 см из Та и ТаН приведены в п.2 и п.3 таблицы. Гидрид тантала, ввиду его пористости, пропитан керосином с объемной долей 10% - ТаНК - п.4 и TAH2K с такой же долей керосина - п.5. Дозиметрические характеристики защиты из тантала и из гидридов тантала с увеличением относительной доли ядер водорода приближаются к защитным характеристикам прототипа с материалом ТаН2К. Такой результат объясняется тем, что количество ядер в металлическом тантале с удельным весом d=16,6 г/см3 nTa=0,055·10 яд./см3, а в соединении с водородом - ТаН (точнее TaH0,78=15,04 г/см3) nTa=0,0498·1024 яд./см3 - в этом соединении ядерная плотность тантала меньше на ~10%, но добавилось существенное количество ядер водорода nH=0,0388·1024 яд./см3. Для ТаН2К nTa=0,044·1024 яд./см3, nH=0,0851·1024 яд./см3.
В результате взаимодействия нейтронов с энергией 14 МэВ с ядрами тантала по ядерным реакциям (n,2n)-σ(n,2n)=2,26·10-24 см2 и неупругого рассеяния - (n,n')-σ(n,n')=2,45·10-24 см2, суммарное сечение замедления нейтронов при неупругом, упругом рассеяниях и (n,2n) реакции σTa=4,85·10-24 см2, на ядрах водорода при энергии нейтронов 14 МэВ сечение упругого рассеяния нейтронов σH=0,68·10-24 см2 [12]. Макроскопическое сечение замедления нейтронов с энергией 14 МэВ танталом ∑Ta=nTa·σTa=0,2668 1/см, гидридом тантала 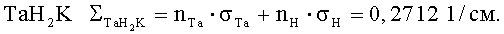 Следовательно, наличие водорода в гидриде тантала существенно не улучшает замедляющие свойства нейтронов с энергией 14 МэВ. Однако в результате их замедления на ядрах тантала в нейтронном спектре наблюдается широкий максимум в области энергий до 1 МэВ. Для этих энергий сечение замедления нейтронов ядром тантала σTa≈(0,7-2,5)·10-24 см2, ∑Ta=(0,0385-0,1375) 1/см, ядром водорода σH≈(11-4,3)·10-24 см2,
Следовательно, наличие водорода в гидриде тантала существенно не улучшает замедляющие свойства нейтронов с энергией 14 МэВ. Однако в результате их замедления на ядрах тантала в нейтронном спектре наблюдается широкий максимум в области энергий до 1 МэВ. Для этих энергий сечение замедления нейтронов ядром тантала σTa≈(0,7-2,5)·10-24 см2, ∑Ta=(0,0385-0,1375) 1/см, ядром водорода σH≈(11-4,3)·10-24 см2, 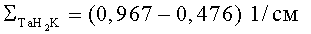 - в этом случае эффективность замедления нейтронов ядрами водорода возрастает, что способствует переводу нейтронов в область энергий с меньшими факторами кермы и тем самым объясняет лучшее качество защиты TaH2K по сравнению с танталом и другими его гидридами, что увеличивает мощность кермы с материалом защиты из тантала на ~25%, чем из гидрида тантала (п.2 и п.5 таблицы). Таким образом, если в водородосодержащей защите внутри нейтронного канала вставить вкладыш п.4 и п.7 таблицы, не меняя размеров канала из W, Ta, BN, боридов, нитридов, карбидов вольфрама, тантала и т.д. определенной толщины, мощность кермы можно увеличить.
- в этом случае эффективность замедления нейтронов ядрами водорода возрастает, что способствует переводу нейтронов в область энергий с меньшими факторами кермы и тем самым объясняет лучшее качество защиты TaH2K по сравнению с танталом и другими его гидридами, что увеличивает мощность кермы с материалом защиты из тантала на ~25%, чем из гидрида тантала (п.2 и п.5 таблицы). Таким образом, если в водородосодержащей защите внутри нейтронного канала вставить вкладыш п.4 и п.7 таблицы, не меняя размеров канала из W, Ta, BN, боридов, нитридов, карбидов вольфрама, тантала и т.д. определенной толщины, мощность кермы можно увеличить.
В рассмотренных выше расчетных исследованиях фантом располагали на расстоянии 1 см от выхода коллиматора, что позволяет лечить злокачественные новообразования кожи. При лечении гортани фантом расположен на расстоянии 10 см от торца коллиматора. В свободное пространство между биологической защитой и головой пациента установлена дополнительная - функциональная защита толщиной 10 см с таким же внешним диаметром, а внутренний ее размер является продолжением нейтронного канала конусной формы - п.п.5, 6, 7 таблицы. В функциональной защите для плеча выполнена выемка в наиболее эффективных материалах, например из TaH2K, TaB2K, BNK, боридов вольфрама, определенных размеров в зависимости от анатомии тела пациента. В расчетах п.п.6, 7, 8, 9 таблицы представлены варианты характеристики обоих видов защит, состоящих из одних гомогенных материалов: ТаН-ТаН, TaD2-TaD2 (дейтерид тантала), TaB2K-TaB2K (борид тантала с 10% долей керосина), TaH2-TaH2. При этом толщина биологической защиты составляет 15 см, что заметно отличает от толщины защиты УЦНТ, хотя дозиметрические характеристики вариантов нашей установки мало отличаются от прототипа. В расчетных исследованиях п.10 таблицы при толщине биологической защиты 20 см и РИП=31 см с функциональной защитой представлена комбинация материалов ТаН-BN, а в расчете п.11 таблицы ТаН2-BN также с РИП=31 см. В п.п.12÷20 таблицы представлены результаты расчетов комбинаций двух видов защит как с чистыми материалами Та-Та, W-W, а также их металлоподобных соединений: W2B, WB2, W2B5, WN, WC, TaB2, TaN, TaC. В расчетах с п.22 по п.27 таблицы в качестве биологической защиты использованы гидриды тантала, а функциональные - выполнены из ZrH2, LiNH2, Li(AlH4), BN. В п.п.28÷36 таблицы рассмотрены различные виды материалов функциональной защиты, включая BNK - с 10% объемной долей керосина, при толщине биологической защиты 20 см. В качестве функциональной защиты использованы также известные материалы из ZrF4 - п.33 и Fe - п.36 таблицы. В расчетах п.п.37÷52 толщина биологической защиты составляет 25 см, в качестве функциональной защиты, кроме названных, добавлены материалы: NH3BH3, Н2В(NH3)2ВН4, BeH2, Be3N2, AlH3, Li3N, В3N3Н6, LiBH4, а также гидрид мишметалла. Гидрид мишметалла состоит из (25-35)% лантана, (40-50)% церия, (4-15)% празеодима, (4-15)% неодима, (1-7)% самарий + гадолиний, а также 5,4% водорода по массе [13]. В расчетах п.п.53, 54 таблицы биологическая защита выполнена в виде чередующихся слоев вольфрама 15 см и 3 см, между ними борированный полиэтилен толщиной 7 см. В качестве функциональной защиты в первом варианте использована вода с литием-6 с объемной долей 7%, во втором - NH3BH3. В расчетах п.п.55÷61 таблицы в качестве биологической защиты использован TaH2, функциональная защита выполнена из NH3BH3, из гидрида или фторида циркония, из железа с РИП 36 см и 46 см. В расчете п.62 таблицы в качестве материалов обоих видов защит используется гидрид циркония. В п.68 таблицы представлены результаты только с биологической защитой толщиной 25 см из ТаН с фантомом, расположенным на расстоянии 20 см от нее, качество защиты Н и Кор не соответствуют прототипу. В приведенных выше расчетах радиус источника составляет 2,25 см, входной радиус коллиматора равен 2,3 см.
Улучшить качество защиты можно другим способом - уменьшением радиуса источника нейтронов и входного отверстия нейтронного канала. При конструировании радиационной защиты введем понятие терапевтической эффективности устройства - F. Она определена выражением F=D/L, где D - расстояние от среза нейтронного канала (точка С) на поверхности защиты до точки В (Фиг.3, D=ВС), в которой керма составляет до 20% от кермы в центре пучка. Величина D характеризуется нейтронно-физическими свойствами материалов защиты. Величина L - расстояние, прошедшее быстрым нейтроном без взаимодействия с материалами защиты (4) до точки В (Фиг.3, ВА1, ВА2, ВА3 и ВА4), усредненное, по всей поверхности источника нейтронов (10, Фиг.3). Величина L определена геометрическими размерами защиты устройства. На Фиг.3 поверхность источника нейтронов схематически разделена на 2 части - круг радиусом R1 и кольцо радиусами R1, R2. При вычислении величины L поверхность источника разделена на большее число частей в форме колец. В качестве детектора нейтронов использован водный фантом (8) толщиной 1 см, который располагали вплотную к защите; детекторы также разделены на круг радиусом r1 и несколько колец радиусами r1…r7.
Исследование терапевтической эффективности установки с источником нейтронов НГ-24 осуществляли с биологической защитой из TaB2 с керосином для двух толщин 15 см и 20 см - Фиг.3. Пространственное распределение доз на поверхности защиты - (4) определяли с помощью водного фантома - (8), расположенного вплотную к защите. Источник нейтронов - (10) толщиной 2 мм располагали на расстоянии 1 см от входного отверстия коллиматора - (12). Радиусы источника нейтронов составляли: 0,25 см, 0,5 см, 1 см, 1,5 см и 2,25 см. Радиус выходного окна нейтронного канала конической формы равен 3 см. При вычислении величины F рассматривали две геометрии: №1 - радиус входного отверстия нейтронного канала равен радиусу источника - (Rист.=Rвх.) и №2 - входной радиус нейтронного канала был максимальным и составлял 2,3 см, изменяли только размеры источника в названных диапазонах - (Rист.≤Rвх.).
На Фиг.4 представлены результаты расчета терапевтической эффективности устройства F. При Rист.=Rвх. - (20 и 22) F возрастает с увеличением радиуса источника. При Rист.≤Rвх. - (19 и 21) она остается примерно постоянной величиной для различной толщины защиты, что является отличительной особенностью представленных данных.
Терапевтическая эффективность установки УЦНТ с конусной формой нейтронного канала с РИП=86 см, D=1,55 см, L=20,2 см составляет F=0,077. В предлагаемой нами установке F=0,065 при толщине защиты 20 см и диаметре источника нейтронов и входного отверстия нейтронного канала 0,75 см - (22) (Фиг.4). Для толщины защиты 15 см F=0,115 при тех же параметрах источника нейтронов и канала - (20) (Фиг.4).
Расчетные исследования по улучшению эффективности радиационной защиты выполнены с биологической защитой толщиной 15 см из TaHK (п.63 таблицы) с фантомом вплотную к ней без функциональной защиты. В этом расчете радиус источника равен 0,3 см, входной радиус нейтронного канала - 0,43 см, величина Н=0,7 см, что лучше, чем у прототипа. В п.64 с толщиной биологической защиты 20 см из TaHK с радиусом источника 0,4 см и входным радиусом нейтронного канала 0,52 см получено качество защиты Н=0,5 см. В отличие от результатов п.4 с тем же материалом защиты, но с радиусом источника, равным 2,25 см, и входным радиусом нейтронного канала 2,3 см, величина Н=1,8 см. В п.п.65-67 с другими материалами защиты толщиной 20 см: W2B5, BNK и W при Rист.=0,4 см и Rвх.=0,52 см качество защиты Н составляет 0,7-0,8 см, причем Кор=2,8-2,9%, что несколько хуже прототипа. Таким образом, качество защиты - Н устройства улучшается с меньшими размерами источника нейтронов и соответствующими им входными размерами нейтронного канала диаметром 0,3÷1,5 см.
Полученные данные свидетельствуют о возможности оптимального выбора материалов из TaH2K, W2B5 и BN с толщинами биологической защиты 15 см, функциональной - 10 см. Качество защиты Н=0,4 см лучше прототипа, что позволит уменьшить лучевую нагрузку на здоровые ткани, расположенные вблизи опухоли, Кор=1,6% - п.69 таблицы.
Мощность кермы для биологической защиты с толщинами 15 см, 20 см и 25 см с фантомом в непосредственной близости от защиты составляет (7-7,2) сГр/мин, (5-5,5) сГр/мин, (3,6-4,1) сГр/мин соответственно. Для биологической защиты толщиной 20 см и функциональной защитой с фантомом вплотную, мощность кермы составляет 5÷5,5 сГр/мин. При расположении фантома на расстоянии 10 см от функциональной защиты мощность кермы составляет 2,7÷2,8 сГр/мин. Для удовлетворения клинических требований по мощности кермы необходимо выход источника нейтронов увеличить до 10 сГр/мин, что возможно при форсированном режиме работы генератора НГ-24 в течение терапевтического сеанса длительностью 10-15 минут.
Глубина половинной кермы в фантоме для различных комбинаций защиты составляет 5-6 см, что соответствует характеристикам ДТБН на пучке Б-3 реактора БР-10.
Принцип действия устройства
Терапевтическую установку собирают в медицинском блоке из защитных материалов, генератора нейтронов НГ-24 и соответствующих электрических кабелей для подключения к блоку управления. Вблизи источника нейтронов устанавливают детектор для измерения нейтронной дозы. В соседнем помещении размещают приборы, контролирующие длительность сеанса терапии. На начальном этапе проводят исследования доз в фантоме - по глубине и по радиусу пучка нейтронов. После расчетно-экспериментального анализа данных дозиметрии приступают к нейтронной терапии.
Показатели достижения технического результата
Предлагаемое устройство позволяет реализовать наш ранее приобретенный клинический опыт в лечении некоторых разновидностей онкологических заболеваний, расположенных на глубине до 5 см, методом ДТБН. Накопленный опыт на стационарном ядерном реакторе БР-10 ГНЦ РФ ФЭИ может быть перенесен на мобильные источники быстрых нейтронов с энергией 14 МэВ, основанные, например, на генераторе НГ-24. При этом соблюдаются медицинские требования по мощности дозы и качеству защиты здоровых участков тела пациента. Кроме того, стоимость материалов коллиматора и защиты вместе с генератором НГ-24 существенно ниже стоимости стационарного источника быстрых нейтронов - ядерного реактора. Такое решение обозначенной проблемы позволит оснастить медицинские клиники и онкологические диспансеры безопасными в эксплуатации терапевтическими мобильными установками доступных размеров и интенсивностей нейтронного излучения.
Литература
1. Втюрин В.Б. Эффекты нейтронного и гамма-излучений источников на основе Cf252. М.: Энергоиздат, 1986.
2. Б.Н.Зырянов, Л.И.Мусабаева, В.Н.Летов, В.А.Лисин. Дистанционная нейтронная терапия. Томск, 1991.
3. Wagner F.N., Koester L., Auberger Th., Reushel W., Mayr M., Kneschaurek P., Breit A., Schraube H. Fast neutrons for the treatment of suoerficial carcinoma. // J. Nucl. Sci. Eng., 1992, Vol.110, pp.32-37.
4. Verbeke JM, Leung KN, Vujic J. Development of a sealed-accelerator-tube neutron generator. Appl Radiat Isot 1998 May-Jun; 49(5-6):723-725.
5. И.А.Гулидов, Ю.С.Мардынский, А.Ф.Цыб, A.C.Сысоев. Нейтроны ядерных реакторов в лечении злокачественных новообразований. Обнинск, 2001.
6. Важенин А.В., Рыковский Г.Н. Уральский центр нейтронной терапии, история создания, методология, результаты работы. М.: Издательство РАМН, 2008.
7. J.F.Breismeister “MCNP-A General Monte Carlo N-Particle Transport Code System. Version 4A”. Los - Alamos National Laboratory, Report LA - 12625-M, 1993.
8. (WO/1994/014167) Radiation-barrier material capable of simultaneous shielding against γ-ray, X-ray and neutron beam.
9. WADC Technical Report 59-207. The University Michigan College.
10. Химия. Справочное руководство. Л., 1975.
11. Химическая энциклопедия в 5 томах. Большая Российская энциклопедия. М., 1995.
12. Групповые константы для расчета реакторов и защиты. М.: Энергоиздат, 1981.
13. Б.А.Колачев, А.А.Ильин. Гидриды металлов. Справочник. М: Металлургия, 1992.
| название | год | авторы | номер документа |
|---|---|---|---|
| БИОЛОГИЧЕСКАЯ ЗАЩИТА К НЕЙТРОННОМУ ГЕНЕРАТОРУ ДЛЯ ПРОВЕДЕНИЯ ДИСТАНЦИОННОЙ ТЕРАПИИ 14 МЭВ НЕЙТРОНАМИ | 2022 |
|
RU2796768C2 |
| СПОСОБ НЕЙТРОН-ЗАХВАТНОЙ ТЕРАПИИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 1998 |
|
RU2141860C1 |
| АППАРАТ ДЛЯ ДИСТАНЦИОННОЙ НЕЙТРОННОЙ ТЕРАПИИ | 2013 |
|
RU2526244C1 |
| ФОТОНЕЙТРОННЫЙ ИСТОЧНИК | 2017 |
|
RU2634330C1 |
| РАДИОГРАФИЧЕСКАЯ УСТАНОВКА | 2007 |
|
RU2362148C1 |
| СПОСОБ ИСПЫТАНИЯ ПРОТИВОРАДИАЦИОННОЙ ЗАЩИТЫ ОБЪЕКТА | 2009 |
|
RU2409875C1 |
| КОЛЛИМАТОР | 2007 |
|
RU2366014C1 |
| Устройство для дистанционной нейтронной терапии | 1990 |
|
SU1762945A1 |
| МЕДИЦИНСКИЙ ИСТОЧНИК НЕЙТРОНОВ, ЯДЕРНЫЙ РЕАКТОР ДЛЯ МЕДИЦИНСКОГО ИСТОЧНИКА НЕЙТРОНОВ, СПОСОБ ПРИМЕНЕНИЯ МЕДИЦИНСКОГО ИСТОЧНИКА НЕЙТРОНОВ | 2015 |
|
RU2589446C1 |
| НЕЙТРОНОПРОДУЦИРУЮЩИЙ МИШЕННЫЙ УЗЕЛ | 2003 |
|
RU2326513C2 |
Изобретение относится к медицинской технике, а именно к устройствам для лучевой терапии злокачественных опухолей быстрыми нейтронами. Устройство включает генератор нейтронов, окруженный сверху защитой от рассеянного излучения из борированного полиэтилена. Генератор расположен вплотную к биологической защите на одной оси с встроенным в нее нейтронным каналом. В устройство также введена функциональная защита. Биологическая и функциональная защиты выполнены в виде установленных вплотную друг к другу усеченных конусов, с большим основанием со стороны выходного отверстия нейтронного канала и меньшим - со стороны генератора нейтронов. Защиты выполнены однородными из одного материала или составными, из частей в виде усеченных конусов, вставленных один в другой, при этом части биологической и/или функциональной защиты выполнены однородными или имеют чередующиеся слои. Биологическая и функциональная защиты или их части выполнены из металлов, или гидридов металлов, или металлоподобных веществ, или пористых материалов, содержащих легкие ядра, или водородосодержащих соединений. При этом радиус входного отверстия нейтронного канала и толщины биологической и функциональной защит выбраны из условия обеспечения терапевтической эффективности устройства, определяемой формулой F=D/L, где D - расстояние от среза выходного отверстия нейтронного канала на поверхности защиты до точки, в которой керма составляет 20% от кермы в центре пучка, a L - расстояние, прошедшее быстрым нейтроном без взаимодействия с материалами защиты до точки, в которой керма составляет 20% от кермы в центре пучка. Использование изобретения позволит улучшить эксплуатационные характеристики устройства за счет создания оптимального формирователя радиационных полей и необходимой радиационной защиты пациента. 8 з.п. ф-лы, 4 ил., 1 табл.
1. Устройство для лучевой терапии быстрыми нейтронами, включающее генератор нейтронов, окруженный сверху защитой от рассеянного излучения из борированного полиэтилена, расположенный вплотную к биологической защите и на одной оси с встроенным в нее нейтронным каналом, отличающееся тем, что дополнительно введена функциональная защита, биологическая и функциональная защиты выполнены в виде установленных вплотную друг к другу усеченных конусов с большим основанием со стороны выходного отверстия нейтронного канала и меньшим - со стороны генератора нейтронов и однородными из одного материала или составными из частей в виде усеченных конусов, вставленных один в другой, при этом части биологической и/или функциональной защиты выполнены однородными или имеют чередующиеся слои, а биологическая и функциональная защиты или их части выполнены из металлов, или гидридов металлов, или металлоподобных веществ, или пористых материалов, содержащих легкие ядра, или водородосодержащих соединений, при этом радиус входного отверстия нейтронного канала и толщины биологической и функциональной защит выбраны из условия обеспечения терапевтической эффективности устройства, определяемой формулой F=D/L, где D - расстояние от среза выходного отверстия нейтронного канала на поверхности защиты до точки, в которой керма составляет 20% от кермы в центре пучка, a L - расстояние, прошедшее быстрым нейтроном без взаимодействия с материалами защиты до точки, в которой керма составляет 20% от кермы в центре пучка.
2. Устройство по п.1, отличающееся тем, что пористые материалы заполнены органическими веществами с максимальным содержанием ядер водорода или дейтерия и веществ с большой проникающей способностью.
3. Устройство по п.1, отличающееся тем, что биологическая и функциональная защиты выполнены из материалов, включающих любую комбинацию из веществ: тантал, гидридов: тантала, мишметалла, циркония, ниобия, бериллия, алюминия, и дейтеридов: тантала, мишметалла, циркония, ниобия, бериллия, алюминия.
4. Устройство по п.1, отличающееся тем, что биологическая и функциональная защиты выполнены из материалов, являющихся любой комбинацией из веществ: бориды тантала, вольфрам, бориды вольфрама.
5. Устройство по п.1, отличающееся тем, что биологическая и функциональная защиты выполнены из материалов, являющихся любой комбинацией из веществ: нитрид тантала, нитрид вольфрама, нитрид бора.
6. Устройство по п.1, отличающееся тем, что биологическая и функциональная защиты выполнены из материалов, являющихся любой комбинацией из веществ: карбид тантала, карбид вольфрама.
7. Устройство по п.1, отличающееся тем, что биологическая и функциональная защиты выполнены из материалов, состоящих из веществ, содержащих легкие ядра, выбранных из NH3BH3, H2B(NH3)BH4, Be3N2, Li3N, B3N3H6, LiBH4, LiNH4, Li(AlH4), ZrH2, BeH2, AlH3, гидрида лития, фторида циркония, водного раствора лития-6.
8. Устройство по п.1, отличающееся тем, что в водородосодержащих биологической и функциональной защитах установлен вкладыш в нейтронном канале из неводородосодержащих материалов.
9. Устройство по п.1, отличающееся тем, что в функциональная защита имеет выемку.
| WAGNER, KNEUSCHAUREC ET ALL | |||
| THE MUNICH FISSION NEUTRON THERAPY FACILITY MEDAPP AT THE RESEARCH REACTOR FRM | |||
| STRAHLENTHER ONCOL, 2008, 184:643-646 | |||
| JP 4143696 A, 18.05.1992 | |||
| СПОСОБ ФОРМИРОВАНИЯ ПОГЛОЩЕННОЙ ДОЗЫ ИЗЛУЧЕНИЯ ПРИ НЕЙТРОННОЙ ТЕРАПИИ | 2000 |
|
RU2191610C2 |
| Роликоопора рольганга | 1982 |
|
SU1050991A1 |
| US 3950651 A, 13.04.1976 | |||
| JP 2004233168 A, 19.08.2004 | |||
| СПОСОБ НЕЙТРОН-ЗАХВАТНОЙ ТЕРАПИИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 1998 |
|
RU2141860C1 |
| JP 8201581 A, 09.08.1996. | |||
Авторы
Даты
2012-02-20—Публикация
2009-11-16—Подача