Изобретение относится к медицине и биологии и может быть использовано для генотипирования Chlamydia trachomatis.
Хламидии являются широко распространенной группой внутриклеточных облигатных паразитов, вызывающих заболевания человека и животных. Среди возбудителей хламидиозов, в настоящее время, особо важное значение для медицины представляет Chlamydia trachomatis, вызывающая различные инфекционные заболевания, связанные с определенным серотипом или аналогичным ему генотипом хламидий. Насчитывается 19 серотипов Chlamydia trachomatis, объединенных в три группы, которые были определены с помощью поликлональных и моноклональных антител к внешнему основному мембранному белку МОМР: группа B (серотипы: B, Ba, D, Da, E, LI, L2, L2a), группа C (серотипы: A, C, H, I, Ja, J, K и L3), и промежуточная группа (серотипы: F, G, Ga) (Molano М., Chris J.L.M., Meijer S.A. [et al.]. Combination of PCR targeting the VD2 of ompl and reverse line blot analysis for typing of urogenital Chlamydia trachomatis serovars in cervical scrape specimens. // Journal of clinical microbiology. - 2004. - Vol.42, №7. - P.2935-2939). Метод серологического типирования с применением специфических антител трудоемок в исполнении в условиях клинической лаборатории и требует больших затрат. В настоящее время проведение типирования Chlamydia trachomatis нацелено на разработку и применение молекулярно-генетических методов с использованием вариабельных участков гена ompA. Поэтому штаммы Chlamydia trachomatis, типированные с применением молекулярно-генетических методов, именуют генотипами (Huang С.-Т., Wong W.-W., Li L.-H., Chiang C.-C, Chen B.-D., and Li S.-Y. Genotyping of Chlamydia trachomatis by Microsphere Suspension Array. // Journal of clinical microbiology. - 2008. - Vol.46, №3. - P.1126-1128). Основываясь на патогенетическом потенциале, серотипы A, B, Ba и C ассоциированы с классической эндемической трахомой; серотипы от D до K вызывают урогенитальную патологию - эпидидимиты, цервициты, сальпингиты, патологию беременности и родов; серотипы от L1 до L3 - возбудители венерической лимфогранулемы (Yuan Y., Zhang Y.X., Watkins N.G. and Caldwell H.D. Nucleotide and deduced amino acid sequences for the four variable domains of the major outer membrane proteins of the 15 Chlamydia trachomatis serovars. // Infection and immunity. -1989. - Vol.57, N 4. - P.1040-1049). Кроме того, на основе литературных данных серотипы G, I и D связаны с возникновением цервикальной клеточной карциномы, а хронические инфекции, вызванные серотипом K у женщин, приводят к бесплодию (Anttila Т., Saikku Р., Koskela P. [et al.]. Serotypes of Chlamydia trachomatis and risk for development of cervical squamous cell carcinoma. // JAMA. - 2001. - Vol.285, №1. - P.47-51).
Для эпидемиологического надзора за возбудителем хламидийной инфекции, выявления патогенетического потенциала, зависящего от типа Chlamydia trachomatis, и, как результат, обеспечения эффективности лечения необходимо вести мониторинг циркуляции типов Chlamydia trachomatis.
В клинической практике встречаемость хламидийной инфекции, вызванной двумя серотипами Chlamydia trachomatis, достигает 50%. Выявляется частое сочетание серотипов D и E, E и F, К и H (Molano М., Chris J.L.M., Meijer S.A. [et al]. Combination of PCR targeting the VD2 of omp1 and reverse line blot analysis for typing of urogenital Chlamydia trachomatis serovars in cervical scrape specimens. // Journal of clinical microbiology. - 2004. - Vol.42, N 7. - P. 2935-2939).
Известен способ выявления LI, LII и LIII генотипов Chlamydia trachomatis, способных вызывать венерическую лимфогранулему, основанный на первоначальном проведении амплификации цитотоксинного гена и дальнейшем секвенировании этого гена, присущего только данным генотипам хламидий (US патент №2007/0269810 A1).
Основным недостатком данного способа является невозможность проводить генотипирование других генотипов Chlamydia trachomatis, часто встречающихся в популяции людей.
Известен способ генотипирования Chlamydia trachomatis с помощью мультилокусного секвенирования-типирования вариабельных участков гена оmpА.
Согласно данному известному способу первоначально проводили ПЦР отдельно каждого из вариабельных участков гена оmpА с помощью праймеров:

Затем секвенирование амплифицированных участков гена ompA и дальнейшую обработку полученных данных секвенирования проводили с помощью программ BioEdit (7,0) и SeqScape (2,5), обеспечивающих анализ последовательностей нуклеотидов в сравнении с известными последовательностями из электронных баз данных (Klint М., Fuxelius Н.-Н., Goldkuhl R.R., Skarin Н., Rutemark С, Andersson S.G.E., Persson К., Herrmann В. High-Resolution Genotyping of Chlamydia trachomatis Strains by Multilocus Sequence Analysis. // Journal of clinical microbiology. - 2007. - Vol.45, N 5. - P.1410-1414).
Также известен способ определения генотипа Chlamydia trachomatis с помощью анализа полиморфизма длины рестрикционных фрагментов - ПДРФ (Restriction Fragment Length Polymorphism - RFLP analysis), основанный на проведении полимеразной цепной реакции (ПЦР) вариабельных участков гена ompA, кодирующего основной мембранный белок хламидий МОМР, и расщеплении этих участков на специфичные каждому генотипу фрагменты ферментами - рестриктазами (Rodriguez P., Vekris A., Barbey-rac В., Dutilh В., Bonnet J., and Bebear С.Typing of Chlamydia trachomatis by restriction endonuclease analysis of the amplified major outer membrane protein gene. // Journal of clinical microbiology. - 1991. - Vol.29, N 6. - P.1132-1136; Gao X., Chen X.S., Yin Y.P., Zhong M.Y., Shi M.Q., Wei W.H., Chen Q., Peeling R.W., Mabey D. Distribution study of Chlamydia trachomatis serovars among high-risk women in China performed using PCR-restriction fragment length polymorphism genotyping. // Journal of clinical microbiology. - 2007. - Vol.45, N 4. -P.1185-1189).
Основным недостатком данных известных способов определения генотипов Chlamydia trachomatis является их неинформативность в случаях, когда хламидийная инфекция обусловлена несколькими генотипами возбудителя, потому что не представляется возможным определить по длине рестрикционных фрагментов конкретные генотипы Chlamydia trachomatis.
Прототипом заявляемого способа генотипирования Chlamydia trachomatis является использование для генотипирования комбинации ПЦР вариабельных участков гена ompA и метода блот-гибридизации с применением типоспецифических олигонуклеотидных зондов, где каждый зонд соответствует конкретному определяемому генотипу (Molano М., Chris J. L.М. Meijer, Morre S.A., Pol R., and Adriaan J.C. van den Brule. Combination of PCR targeting the VD2 of ompl and reverse line blot analysis for typing of urogenital Chlamydia trachomatis serovars in cervical scrape specimens. // Journal of clinical microbiology. - 2004. - Vol.42, N 7. - P.2935-2939).
Основным недостатком известного прототипа является использование двух различных методов исследования, что усложняет проведение генотипирования и увеличивает число используемых реактивов и оборудования за счет использования реактивов и оборудования для блот-гибридизации.
В основу изобретения положена задача обеспечения информативности генотипирования Chlamydia trachomatis при инфекции, вызванной любыми комбинациями генотипов Chlamydia trachomatis, при упрощении проведения генотипирования.
Задача решена тем, что после выделения ДНК из клинического материала проводят ПЦР с использованием группоспецифических праймеров:




Проведенные нами исследования позволили впервые разработать праймеры и их комбинации, обеспечивающие генотипирование всех типов Chlamydia trachomatis - возбудителей хламидиозов и их групп. Кроме того, эти исследования доказали специфичность каждой из заявляемых комбинаций праймеров только для одного генотипа Chlamydia trachomatis или одной группы генотипов, что дает возможность генотипирования Chlamydia trachomatis при инфекции, вызванной любыми двумя и более генотипами Chlamydia trachomatis, при упрощении проведения генотипирования этих типов Chlamydia trachomatis.
Заявляемый способ генотипирования Chlamydia trachomatis является новым и в литературе не описан.
Техническим результатом заявляемого изобретения является обеспечение информативности и упрощение генотипирования Chlamydia trachomatis при инфекции, вызванной любыми комбинациями генотипов Chlamydia trachomatis, при упрощении проведения генотипирования.
Сущность изобретения поясняется на следующих примерах, показывающих при использовании заявляемого способа генотипирования информативность генотипирования Chlamydia trachomatis при инфекции, вызванной комбинациями генотипов Chlamydia trachomatis, при упрощении проведения генотипирования. При этом приведенные в примерах комбинации праймеров и генотипы Chlamydia trachomatis показывают конкретную реализацию заявляемого изобретения, но не ограничивают объем притязаний формулы заявляемого изобретения.
Пример 1. Пациент С., возраст 9 лет. Клинический диагноз - конъюнктивит левого глаза.
После выделения ДНК из соскобного материала с конъюнктивы пациента проводили ПЦР с использованием группоспецифических праймеров:

Затем на основании электрофоретического анализа продуктов амплификации, выявившего положительную ПЦР с праймерами:
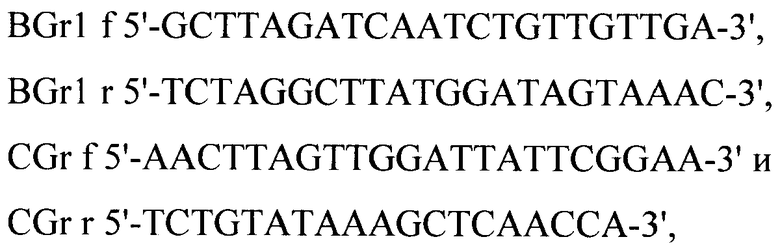
типировали Chlamydia trachomatis групп генотипов B и C в их комбинации.
На основании результатов типирования групп генотипов Chlamydia trachomatis проводили ПЦР с использованием типоспецифических праймеров к генотипам E, D, H, J и R:

Затем на основании электрофоретического анализа продуктов амплификации, выявившего положительную ПЦР с праймерами:

типировали Chlamydia trachomatis генотипов E и J в их комбинации.
Для проверки достоверности и специфичности полученных результатов было проведено секвенирование продуктов амплификации участка гена ompA генотипа E и J. В результате полученных данных секвенирования и сравнения их с нуклеотидной последовательностью генотипа E и J, представленной в электронной базе данных NCBI - GenBank Overview (URL: http://www.ncbi.nlm.nih.gov/genbank/), было установлено, что секвенированная нуклеотидная последовательность принадлежит генотипу E и генотипу J.
На основании проведенного исследования у обследуемого пациента был диагностирован хламидийный конъюнктивит, вызванный комбинацией генотипов Chlamydia trachomatis: генотипом Е и генотипом J.
Таким образом показана при использовании заявляемого способа генотипирования информативность генотипирования Chlamydia trachomatis при инфекции, вызванной комбинацией генотипов Chlamydia trachomatis, при упрощении проведения генотипирования, исключающего использование блот-гибридизации.
Пример 2. Пациентка А., возраст 28 лет. Обратилась с жалобами на отсутствие возникновения беременности. Клинический диагноз - бесплодие.
После выделения ДНК из соскобного материала с конъюнктивы пациента проводили ПЦР с использованием группоспецифических праймеров:

Затем на основании электрофоретического анализа продуктов амплификации, выявившего положительную ПЦР с праймерами:

типировали Chlamydia trachomatis группы генотипов C и промежуточной группы в их комбинации.
На основании результатов типирования групп генотипов Chlamydia trachomatis проводили ПЦР с использованием типоспецифических праймеров к генотипам F, G, H, Ja, J и K:

Затем на основании электрофоретического анализа продуктов амплификации, выявившего положительную ПЦР с праймерами:

типировали Chlamydia trachomatis генотипов G и K в их комбинации.
Для проверки достоверности и специфичности полученных результатов было проведено секвенирование продуктов амплификации участка гена ompA генотипа G и K. В результате полученных данных секвенирования и сравнения их с нуклеотидными последовательностями генотипа G и K, представленными в электронной базе данных NCBI - GenBank Overview, было установлено, что секвенированные нуклеотидные последовательности принадлежат генотипу G и генотипу K.
Проведение генетического типирования Chlamydia trachomatis методом ПДРФ и сравнительного анализа длин рестрикционных фрагментов ДНК с представленными в электронной базе данных NCBI - GenBank Overview, характерных каждому генотипу, позволило определить, что Chlamydia trachomatis по ПДРФ профилям близка к генотипу G. Однако присутствие других фрагментов ДНК свидетельствовало о присутствии другого генотипа, не позволившего точно установить генотип в результате неинформативности ПДРФ метода при хламидийной инфекции, обусловленной несколькими генотипами Chlamydia trachomatis.
На основании проведенного лабораторного исследования у обследуемой пациентки была диагностирована хламидийная инфекция, вызванная комбинацией генотипов Chlamydia trachomatis: генотипом G и генотипом K.
Таким образом показана при использовании заявляемого способа генотипирования информативность генотипирования Chlamydia trachomatis при инфекции, вызванной комбинацией генотипов Chlamydia trachomatis, при упрощении проведения генотипирования, исключающего использование блот-гибридизации.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРОГНОЗИРОВАНИЯ МАНИФЕСТНОЙ ИЛИ СТЕРТОЙ ФОРМЫ ХЛАМИДИЙНОЙ ИНФЕКЦИИ ЧЕЛОВЕКА ИЛИ ОБЕЗЬЯН И НАБОР ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2008 |
|
RU2385945C1 |
| СПОСОБ ДИАГНОСТИКИ ХЛАМИДИЙНОЙ ИНФЕКЦИИ ЧЕЛОВЕКА ИЛИ ОБЕЗЬЯН И НАБОР ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2008 |
|
RU2385946C1 |
| СПОСОБ МОЛЕКУЛЯРНОГО ТИПИРОВАНИЯ CHLAMYDIA TRACHOMATIS | 2008 |
|
RU2378364C1 |
| СПОСОБ МОЛЕКУЛЯРНОЙ ДИАГНОСТИКИ ГЕНЕТИЧЕСКОГО РИСКА РАЗВИТИЯ ОСЛОЖНЕНИЙ УРОГЕНИТАЛЬНОЙ ХЛАМИДИЙНОЙ ИНФЕКЦИИ, ПРИВОДЯЩИХ К НАРУШЕНИЮ РЕПРОДУКТИВНОЙ ФУНКЦИИ, У ЧЕЛОВЕКА | 2012 |
|
RU2535724C2 |
| СПОСОБ МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКОГО ТИПИРОВАНИЯ ШТАММОВ САЛЬМОНЕЛЛ ПО INDEL-МАРКЕРАМ | 2022 |
|
RU2786577C1 |
| Способ генотипирования B.pertussis из клинических образцов на основе вложенной ПЦР | 2023 |
|
RU2822353C1 |
| СПОСОБ ДИФФЕРЕНЦИАЦИИ ШТАММОВ BORDETELLA PERTUSSIS | 2005 |
|
RU2299908C1 |
| Способ и набор для диагностики дифтерии с верификацией токсигенных штаммов возбудителя | 2016 |
|
RU2623149C1 |
| Способ генотипирования крупного рогатого скота по аллелям 1401G/T гена lhcgr (ss52050737) методом ПЦР в режиме реального времени | 2019 |
|
RU2716116C1 |
| СПОСОБ ТАРГЕТНОЙ АМПЛИФИКАЦИИ ГЕНОМОВ ВОЗБУДИТЕЛЕЙ ИНФЕКЦИЙ ОРГАНОВ РЕПРОДУКЦИИ ЧЕЛОВЕКА С ЦЕЛЬЮ ОДНОВРЕМЕННОЙ ИДЕНТИФИКАЦИИ ВОЗБУДИТЕЛЕЙ С НАБОРОМ ПРАЙМЕРОВ | 2015 |
|
RU2625006C1 |
Изобретение относится к области медицины и биологии и касается генотипирования Chlamydia trachomatis. Представленный способ включает выделение ДНК из клинического материала, проведение ПЦР с использованием группоспецифических праймеров к участкам гена ompA Chlamydia trachomatis, затем на основании электрофоретического анализа продуктов амплификации типируют Chlamydia trachomatis по группам генотипов В, С и промежуточной группы, далее проводят ПЦР с использованием ряда типоспецифических праймеров, выбранных на основании результатов типирования группы генотипов Chlamydia trachomatis, и затем на основании электрофоретического анализа продуктов амплификации типируют Chlamydia trachomatis по генотипам А, В, С, D, E, F, G, J, Ja, H и К. Представленное изобретение позволяет обеспечить информативность и упрощение генотипирования Chlamydia trachomatis при инфекции, вызванной любыми комбинациями генотипов Chlamydia trachomatis. 2 пр.
Способ генотипирования Chlamydia trachomatis, включающий выделение ДНК из клинического материала, проведение ПЦР с использованием праймеров к участкам гена ompA Chlamydia trachomatis, типирование Chlamydia trachomatis электрофоретическим анализом продуктов амплификации, отличающийся тем, что после выделения ДНК из клинического материала проводят ПЦР с использованием группоспецифических праймеров:
BGrl f 5′-GCTTAGATCAATCTGTTGTTGA-3′,
BGrl r 5′-TCTAGGCTTATGGATAGTAAAC-3′,
CGr f 5′-AACTTAGTTGGATTATTCGGAA-3′,
CGr r 5′-TCTGTATAAAGCTCAACCA-3′,
FI 5′-CTGTGGTGGAACTGTATACA-3′ и
RI 5′-TGCCACTCATGGTAATCAA-3′,
и затем на основании электрофоретического анализа продуктов амплификации типируют:
Chlamydia trachomatis группы генотипов В при положительной ПЦР с праймерами
BGrl f 5′-GCTTAGATCAATCTGTTGTTGA-3′ и
BGrl r 5′-TCTAGGCTTATGGATAGTAAAC-3′,
Chlamydia trachomatis группы генотипов С при положительной ПЦР с праймерами
CGr f 5′-AACTTAGTTGGATTATTCGGAA-3′ и
CGr r 5′-TCTGTATAAAGCTCAACCA-3′,
Chlamydia trachomatis промежуточной группы при положительной ПЦР с праймерами
FI 5′-CTGTGGTGGAACTGTATACA-3′ и
RI 5′-TGCCACTCATGGTAATCAA-3′,
проводят ПЦР с использованием типоспецифических праймеров, выбранных на основании результатов типирования группы генотипов Chlamydia trachomatis из ряда:
Comp f 5′-AAGGAAGTGTGGTCTCTGCCG-3′,
Comp r 5′-AATTATACAATTATTAGAACC-3′,
Eomp f 5′-ACACAGATACTGCCTTCTCTTG-3′,
Eomp r 5′-CTTGCTTGCCACTCATGGTAAT-3′,
Jomp f 5′-ATCTTTTTCCTAACACTGCT-3′,
Jomp r 5′-TTTAGGTTTAGATTGAGCAT-3′,
Jaomp f 5′-TACTGTCAGCGATGTAGCAG-3′,
Jaomp r 5′-TCCCAGATATTTAATGCCAT-3′,
Fh 5′-ATCTTCTGATTTTAATACAGC-3′,
Rh 5′-ACTTTAGGTTTAGATTGAGCA-3′,
Ff 5′-ACGAAACCTGCTGCAGATA-3′,
Rf 5′-TTGCCACTCATGGTAATCA-3′,
Domp f 5′-ATAATGAAAATCAAAAAACG-3′,
Domp r 5′-TAGATTGAGCATATTGGAAA-3′,
Komp f 5′-TGTTCCTAACACTGCTTTGGA-3′,
Komp r 5′-AGGTTTAGATTGAGCATATTGG-3′,
Gomp f 5′-AGTGTAGTCGCAGCTAAC-3′,
Gomp r 5′-ACTGTAACTGCGTATTTG-3′,
Aomp f 5′-AACACAATCTTCTGGCTTTGAT-3′,
Aomp r 5′-TGATTCAAAGCAGTGTTAGGA-3′,
Bomp f 5′-AGCCGAGACTATCTTTGATGTT-3′ и
Bomp r 5′-TCTGCGCTAGTTTTCACATCG-3′,
и затем на основании электрофоретического анализа продуктов амплификации типируют:
Chlamydia trachomatis генотипа С при положительной ПЦР с праймерами
Comp f 5′-AAGGAAGTGTGGTCTCTGCCG-3′ и
Comp r 6′-ААТТАТАСААТТАТТАGААСС-3′,
Chlamydia trachomatis генотипа Е при положительной ПЦР с праймерами
Eomp f 5′-ACACAGATACTGCCTTCTCTTG-3′ и
Eomp r 5′-CTTGCTTGCCACTCATGGTAAT-3′,
Chlamydia trachomatis генотипа J при положительной ПЦР с праймерами
Jomp f 5′-ATCTTTTTCCTAACACTGCT-3′ и
Jomp r 5′-TTTAGGTTTAGATTGAGCAT-3′,
Chlamydia trachomatis генотипа Ja при положительной ПЦР с праймерами
Jaomp f 5′-TACTGTCAGCGATGTAGCAG-3′ и
Jaomp r 5′-TCCCAGATATTTAATGCCAT-3′,
Chlamydia trachomatis генотипа Н при положительной ПЦР с праймерами
Fh 5′-ATCTTCTGATTTTAATACAGC-3′ и
Rh 5′-ACTTTAGGTTTAGATTGAGCA-3′,
Chlamydia trachomatis генотипа F при положительной ПЦР с праймерами
Ff 5′-ACGAAACCTGCTGCAGATA-3′ и
Rf 5′-TTGCCACTCATGGTAATCA-3′,
Chlamydia trachomatis генотипа D при положительной ПЦР с праймерами
Domp f 5′-ATAATGAAAATCAAAAAACG-3′ и
Domp r 5′-TAGATTGAGCATATTGGAAA-3′,
Chlamydia trachomatis генотипа К при положительной ПЦР с праймерами
Komp f 5′-TGTTCCTAACACTGCTTTGGA-3′ и
Komp r 5′-AGGTTTAGATTGAGCATATTGG-3′,
Chlamydia trachomatis генотипа G при положительной ПЦР с праймерами
Gomp f 5′-AGTGTAGTCGCAGCTAAC-3′ и
Gomp r 5′-ACTGTAACTGCGTATTTG-3′,
Chlamydia trachomatis генотипа А при положительной ПЦР с праймерами
Aomp f 5′-AACACAATCTTCTGGCTTTGAT-3′ и
Aomp r 5′-TGATTCAAAGCAGTGTTAGGA-3′,
Chlamydia trachomatis генотипа В при положительной ПЦР с праймерами
Bomp f 5′-AGCCGAGACTATCTTTGATGTT-3′ и
Bomp r 5′-TCTGCGCTAGTTTTCACATCG-3′.
| MONICA MOLANO et al., Combination of PCR Targeting the VD2 of omp1 and Reverse Line Blot Analysis for Typing of Urogenital Chlamydia trachomatis Serovars in Cervical Scrape Specimens, Journal of Clinical Microbiology, 2004 July, Vol.42, No.7, p.p.2935-2939 | |||
| СПОСОБ МОЛЕКУЛЯРНОГО ТИПИРОВАНИЯ CHLAMYDIA TRACHOMATIS | 2008 |
|
RU2378364C1 |
| СПОСОБ ДИАГНОСТИКИ ХЛАМИДИЙНОЙ ИНФЕКЦИИ ЧЕЛОВЕКА ИЛИ ОБЕЗЬЯН И НАБОР ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2008 |
|
RU2385946C1 |
Авторы
Даты
2012-02-27—Публикация
2010-08-03—Подача