Краткое описание чертежей
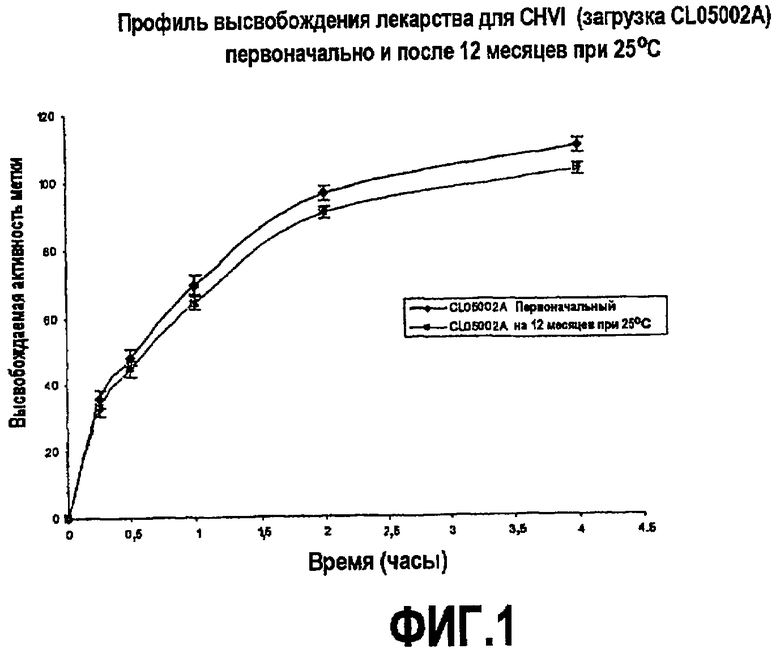
На фиг.1 представлены данные по высвобождению и стабильности в соответствии с вариантом осуществления, продемонстрированным примером.
Подробное описание некоторых вариантов осуществления
Один вариант осуществления предоставляет вкладыш, который содержит неразрушаемую матрицу из гидрогеля и гидрохлорид клиндамицина в контакте с матрицей, где вкладыш является пригодным для интравагинального, буккального или ректального применения у млекопитающих.
Один вариант осуществления предоставляет способ, который предусматривает контактирование влагалища, полости рта или прямой кишки млекопитающих с вкладышем, который содержит неразрушаемую матрицу из гидрогеля и гидрохлорид клиндамицина в контакте с матрицей, где вкладыш является пригодным для интравагинального, буккального или ректального применения у млекопитающих.
Один вариант осуществления предоставляет способ, который включает контактирование гидрохлорида клиндамицина с неразрушаемой матрицей из гидрогеля.
Один вариант осуществления предоставляет упаковку, которая содержит вкладыш, который содержит неразрушаемую матрицу из гидрогеля и гидрохлорид клиндамицина в контакте с матрицей, где вкладыш является пригодным для интравагинального, буккального или ректального применения у млекопитающих, и, по меньшей мере, один упаковочный материал, окружающий вкладыш.
Один вариант осуществления предоставляет извлекаемое устройство, которое содержит вкладыш, который содержит неразрушаемую матрицу из гидрогеля и гидрохлорид клиндамицина в контакте с матрицей, где указанный вкладыш является пригодным для интравагинального, буккального или ректального применения у млекопитающих, и устройство в контакте с вкладышем адаптировано для извлечения вкладыша из влагалища или прямой кишки.
Один вариант осуществления предоставляет вводимое устройство, которое содержит вкладыш, который содержит неразрушаемую матрицу из гидрогеля и гидрохлорид клиндамицина в контакте с матрицей, где указанный вкладыш является пригодным для интравагинального, буккального или ректального применения у млекопитающих, и устройство в контакте с вкладышем адаптировано для ввода вкладыша во влагалище или прямую кишку.
Один вариант осуществления предоставляет способ ингибирования микроорганизма. Способ включает контактирование микроорганизма с эффективным количеством композиции, которая включает гидрохлорид клиндамицина в матрице из гидрогеля, в течение периода времени, эффективного для ингибирования микроорганизма.
Один вариант осуществления предоставляет способ лечения бактериального вагиноза у пациента-человека. Способ включает пероральное, ректальное и/или интравагинальное введение пациенту, нуждающемуся в таком лечении, эффективного количества композиции, которая включает гидрохлорид клиндамицина в матрице из гидрогеля.
Один вариант осуществления относится к терапевтической практике введения в пораженное болезнью влагалище, или перорально, или ректально терапевтически эффективного количества готовой формы гидрохлорида клиндамицина в матрице из гидрогеля. Один вариант осуществления относится к профилактической практике введения гидрохлорида клиндамицина в матрице из гидрогеля для предотвращения бактериального вагиноза у пациентов-женщин, которые имеют риск вагиноза или подвержены ему. С этой целью профилактическое количество вкладыша, который включает матрицу из гидрогеля и гидрохлорид клиндамицина, может пригодным образом вводиться интравагинально, ректально или перорально постоянно или в течение периода времени, пока существует подверженность.
Один вариант осуществления относится к способу лечения или предотвращения одного или более из бактериального вагиноза, воспалительного заболевания тазовой области, эндометрита, послеоперационной инфекции после гинекологического хирургического вмешательства, преждевременных родов, преждевременного рождения, инфекции мочевыводящих путей, рецидивирующей инфекции мочевыводящих путей, инфекции верхних половых путей, послеродового эндометрита, постгистерэктомической инфекции, инфекции после выкидыша, инфекции после аборта, который включает применение или введение гидрохлорида клиндамицина в контакте с полимером гидрогеля.
Один вариант осуществления относится к способу увеличения количества успешных попыток лечения с целью искусственного осеменения/оплодотворения, который включает применение или введение гидрохлорида клиндамицина в контакте с полимером гидрогеля.
Один вариант осуществления предоставляет интравагинальный, буккальный или ректальный вкладыш, который доставляет минимально эффективную дозу гидрохлорида клиндамицина.
Как использовано в данном описании и прилагаемой формуле изобретения, единственные формы включают ссылки на множественные формы, пока контекст ясным образом не диктует иное. Таким образом, например, ссылка на “активное средство” включает единичное активное средство, а также два или более различных активных средств в сочетании.
Термины “благоприятное средство” и “активное средство” используются взаимозаменяемо в данном документе для обозначения химического соединения или композиции, которые имеют благоприятное биологическое воздействие. Благоприятные биологические воздействия включают как терапевтические эффекты, т.е. лечение нарушения или другого нежелательного физиологического состояния, так и профилактические эффекты, т.е. предотвращение нарушения или другого нежелательного физиологического состояния. Термины также охватывают фармацевтически приемлемые, фармакологически активные производные благоприятных средств, конкретно упоминаемых в данном документе, включающие, но без ограничений, соли, сложные эфиры, амиды, пролекарства, активные метаболиты, изомеры, фрагменты, аналоги и т.п. Когда используют термины “благоприятное средство” или “активное средство”, тогда или когда конкретно идентифицируют конкретное средство, то следует понимать, что термин включает средство как таковое, а также фармацевтически приемлемые, фармакологически активные соли, сложные эфиры, амиды, пролекарства, конъюгаты, активные метаболиты, изомеры, фрагменты, аналоги и т.д.
Термин “гидрофильный” используется в данном документе в его общепринятом смысле, означая обладание сильной тенденцией к привлечению, адсорбции и/или абсорбции воды и/или к набуханию в присутствии воды, водных растворов или смесей и/или жидкостей организма.
Термины “излечение” и “лечение”, как используются в данном документе, относятся к уменьшению тяжести и/или частоты наступления симптомов, устранению симптомов и/или вызвавшей их причины, предотвращению возникновения симптомов и/или вызвавшей их причины и улучшению или устранению повреждения. “Лечение” пациента посредством ввода благоприятного средства включает предотвращение конкретного нарушения или нежелательного физиологического события, а также лечение индивида с клиническими симптомами посредством ингибирования или вызывания регрессии нарушения или заболевания.
Под термином “эффективное количество” терапевтического средства подразумевают нетоксичное, но достаточное количество благоприятного средства для обеспечения желательного эффекта. Количество благоприятного средства, которое является “эффективным” может изменяться от субъекта к субъекту, в зависимости от возраста и общего состояния индивида, конкретных благоприятного средства или средств и т.п. Таким образом, не всегда возможно обозначить точное “эффективное количество”. Однако соответствующее “эффективное” количество в любом индивидуальном случае может быть определено рядовым специалистом в данной области с использованием рутинного экспериментирования и рекомендаций, данных в этом документе.
Термин “контролируемое высвобождение” относится к готовой форме, дозированной форме или области, в которой высвобождение благоприятного средства не является немедленным, т.е. с дозированной формой “контролируемого высвобождения” введение не приводит к немедленному высвобождению благоприятного средства в пул усваивания. Термин используется взаимозаменяемо с термином “немоментальное высвобождение”, как определено в Remington: The Science and Practice of Pharmacy, Nineteenth Ed. (Easton, Pa.: Mack Publishing Company, 1995), полное содержание которой включено в данный документ в качестве ссылки. В целом, термин “контролируемое высвобождение”, как используется здесь, включает готовые формы с замедленным высвобождением и отсроченным высвобождением. Один вариант осуществления включает вкладыш с контролируемым высвобождением, который содержит, по меньшей мере, гидрохлорид клиндамицина в контакте с матрицей из гидрогеля и, необязательно, средство с контролируемым высвобождением, например покрытие.
Термин “замедленное высвобождение” (являющееся синонимом термина “длительное высвобождение”) применяется в его общепринятом смысле для обозначения готовой формы, дозированной формы или их области, которая обеспечивает постепенное высвобождение благоприятного средства в течение длительного периода времени и которая предпочтительно, но необязательно, приводит к по существу постоянным уровням в крови и/или локализованным уровням средства в течение расширенного периода времени. Один вариант осуществления включает вкладыш с замедленным высвобождением, который содержит, по меньшей мере, гидрохлорид клиндамицина в контакте с матрицей из гидрогеля. Одно или более средств высвобождения могут представлять собой, например, сорастворенное вещество, средство для набухания или т.п.
Термин “единичная доза” или “единичная дозированная форма”, как используется здесь, относится к физически дискретным единицам такой композиции, пригодной для применения в виде единичных дозировок млекопитающими. Каждая единица содержит предварительно определенное количество гидрохлорида клиндамицина, рассчитанное для оказания желательного терапевтического и/или профилактического эффекта в ассоциации с матрицей из гидрогеля.
Термин “биосовместимый” относится к веществу, которое не является биологически нежелательным, т.е. вещество может быть введено в готовую форму, вводимую пациенту, в общем случае без оказания в результате значительных нежелательных биологических эффектов. В одном варианте осуществления вкладыш и/или матрица из гидрогеля являются биосовместимыми.
Термин “фармацевтически приемлемый”, как в термине “фармацевтически приемлемый” носитель или эксципиент, относится к носителю или эксципиенту, который отвечает требуемым стандартам токсикологического и производственного тестирования или включен в Руководство по Неактивным Ингредиентам, подготовленное Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США. В одном варианте осуществления вкладыш и/или матрица из гидрогеля являются фармацевтически приемлемыми.
“Фармакологически активный” (или просто “активный”), как в термине “фармакологически активные” производное или аналог, относится к производному или аналогу, имеющим такой же тип фармакологической активности, как исходное соединение, и предпочтительно, но необязательно, приблизительно эквивалентную активность по степени.
Термин “полимер”, как используется здесь, относится к молекуле, содержащей ковалентно присоединенные мономерные единицы, и включает разветвленные, дендримерные и звездчатые полимеры, а также линейные полимеры. Термин также включает как гомополимеры, так и сополимеры, например статистические сополимеры, блок-сополимеры и привитые сополимеры, а также несшитые полимеры и в небольшой степени сшитые сополимеры от умеренно до значительно сшитых.
Подразумевают, что термин “влагалище” или “интравагинальный”, как используется здесь, включает в целом область влагалища, включая также вульву и шейку. Также подразумевают, что термин “подверженное воздействию влагалище”, как используется здесь, включает бактериальный вагиноз (БВ) и любое другое указание, описанное здесь.
Подразумевают, что термин “прямая кишка” или “интраректальный”, как используется здесь, включает концевую часть толстого кишечника, пролегающую от приблизительно нисходящей и/или сигмовидной кишки до анального канала.
Подразумевают, что термин “пероральный”, “полость рта” или “буккальный”, как используется здесь, включает рот.
Подразумевают, что термин “полость тела” включает любое из влагалища, прямой кишки или рта по отдельности или совместно.
Подразумевают, что термин “неразрушаемая”, как в “неразрушаемой” матрице из гидрогеля, означает, что матрица из гидрогеля не разрушается во время намеренного или обычного применения, например, во влагалище, во рту или в прямой кишке.
Гидрохлорид клиндамицина (7(S)-хлор-7-деоксилинкомицина гидрохлорид; 7-хлор-7-деоксилинкомицина гидрохлорид; L-трео-альфа-D-галакто-октопиранозид, метил-7-хлор-6,7,8-тридеокси-6-((((2S,4R)-1-метил-4-пропил-2-пирролидинил)карбонил)амино)-1-тио-, моногидрохлорид; (2S-транс)-метил 7-хлор-6,7,8-тридеокси-6-[[(1-метил-4-пропил-2-пирролидинил)карбонил]амино]-1-тио-L-трео-α-D-галакто-октапиранозид гидрохлорид моногидрат является известным соединением. Он представляет собой гидрохлоридную соль клиндамицина. В одном варианте осуществления гидрохлорид клиндамицина представляет собой полусинтетический линкозамдный антибиотик, который может быть получен посредством трехстадийного способа ферментации с последующим хлорированием и реакцией с хлористоводородной кислотой.
В одном варианте осуществления структура гидрохлорида клиндамицина может быть изображена следующим образом:

В одном варианте осуществления структура гидрохлорида клиндамицина может быть изображена следующим образом:
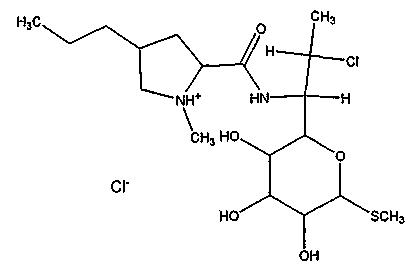
В одном варианте осуществления структура гидрохлорида клиндамицина может быть изображена следующим образом:
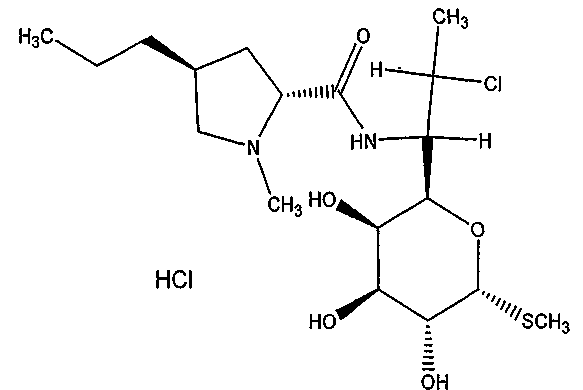
В структуре, приведенной выше, показан один стереоизомер гидрохлорида клиндамицина, но другие стереоизомеры также являются возможными. Все стереоизомеры клиндамицина и гидрохлорида клиндамицина охвачены в данном документе. В одном варианте осуществления активным средством является свободное основание клиндамицина. Клиндамицин применялся в течение нескольких десятилетий в качестве антибиотика с широким спектром, который обладает активностью против грамположительных и грамотрицательных аэробных и анаэробных бактерий, наряду с активностью против Leptospira spp., Mycoplasma spp. и простейших. Антибактериальная активность клиндамицина зависит от чувствительности патогена, измеренной как минимальная ингибирующая концентрация (МИК) и концентрация антибиотика в сыворотке или жидкости организма. МИК для чувствительных грамположительных кокков составляет 0,002-0,8 мг/л и для большинства штаммов Bacteriodes ≤2 мг/л.
Бактериальный вагиноз (“БВ”) является одной из наиболее общих причин вагинальных выделений, и полагают, что он вызывается дисбалансом микробной флоры. Полагают, что один или несколько из микроорганизмов Bacteroides fragilis, Gardnerella vaginalis, Mobilincus spp. являются ответственными за бактериальный вагиноз. Клинический диагноз БВ может быть поставлен, если присутствуют два или более из следующих четырех клинических критериев: (1) гомогенные выделения; (2) рН≥4,7; (3) “рыбный” аминный запах при добавлении 10% КОН к выделению; (4) присутствие эпителиальных ключевых клеток, составляющих более или равных 20% клеток вагинального эпителия.
Вагинальную инфекцию G.vaginalis ассоциируют с возможными осложнениями, такими как воспалительное заболевание тазовой области, эндометрит и преждевременные роды, которые имеют выраженный значительный показатель заболеваемости. Несмотря на то что не существует прямой очевидной связи БВ с этими состояниями, разумно допустить, что сверхрост от 10000 до 100000 анаэробных организмов во влагалище может приводить к определенным генитальным заболеваниям. В последнее десятилетие существовала тенденция к снижению гонореи и трихомониаза, в то время как в течение того же периода времени существовало увеличение случаев так называемого “неспецифического генитального заболевания”. БВ может быть причиной значительно большего общего количества пациентов с вагинитом, чем либо Candida, либо трихомониаз.
Клиндамицин связывается с 50S субъединицей бактериальных рибосом, ингибируя синтез белка. Он проявляет активность против пневмококков и является активным против многих штаммов S.aureus. Клиндамицин является активным против анаэробов, особенно B.fragilis, также Mobiluncus spp., Gardenerella spp. и Atobopium spp. Лекарство также проявляет некоторую активность против атипичных организмов или паразитов, таких как Chlamydia spp., Toxoplasma gondii и некоторых видов и штаммов Plasmodium.
Многочисленные исследования были проведены с пероральными и вагинальными продуктами, которые продемонстрировали эффективность клиндамицина при бактериальном вагинозе. Клиндамицин в настоящее время является одним из двух стандартных лечений этого состояния, другим является метронидазол. Показано, что интравагинальное применение клиндамицина является клинически эффективным при лечении и профилактике БВ.
Когда клиндамицин вводят парентерально, он гидролизуется in vivo до активного клиндамицина. При внутримышечной инъекции пиковая концентрация в плазме достигается только через 2 часа у взрослых и 1 час у детей. Эти значения приблизительно составляют 6 мкг/мл после дозы 300 мг и 9 мкг/мл после дозы 600 мг соответственно (Goodman and Gilman's The Pharmacological Basis of Therapeutics, Ninth Edition (Hardman, J.G. et al, eds.) McGraw-Hill, New York, 1990).
Для доступных в настоящее время вагинальных композиций степень всасывания после вагинального введения зависит от готовой формы. Для готовых форм в виде 2% вагинального крема (например, 2% крема Dalacin®) пиковые уровни в плазме после ежедневного дозирования 100 мг клиндамицина (т.е. 5 грамм 2% крема каждый день) составляли в среднем 20 нг/мл (интервал 3-93 нг/мл). Сообщается, что у женщин с БВ количество клиндамицина, всасывающееся после применения крема Dalacin® (2%), составляет 4% от введенной дозы (Pharmacia Limited SPC для Dalacin® SmPC, Июль 2002). Исследования с вагинальными суппозиториями фосфата клиндамицина (вагинальные суппозитории CLEOCIN™), содержащими 100 мг клиндамицина, показали, что приблизительно 30% (интервал от 6 до 70%) введенной дозы всасывалось в системный кровоток, на основании данных AUC в сравнении с AUC после субтерапевтической внутривенной дозы 100 мг у тех же добровольцев (Pharmacia and Upjohn Company; SPC для вагинальных суппозиториев CLEOCIN™, Январь 2003).
Известны способы получения как клиндамицина, так и гидрохлорида клиндамицина, например, из патентов США №3487068 и 4895934, полное содержание каждого из которых независимо включено в данное описание в качестве ссылки.
Показания, для которых вкладыш является эффективным, включают бактериальный вагиноз, воспалительное заболевание тазовой области, эндометрит, послеоперационная инфекция после гинекологической операции, преждевременные роды, преждевременное рождение, улучшение доли успешных попыток лечения с целью искусственного осеменения/оплодотворения, профилактика перед вагинальной гинекологической операцией, инфекция мочевыводящих путей, рецидивирующая инфекция мочевыводящих путей, инфекция верхних половых путей, послеродовой эндометрит, постгистерэктомическая инфекция, инфекция после выкидыша и инфекция после аборта.
Один вариант осуществления гидрогеля представляет собой трехмерный каркас из цепей гидрофильного полимера, которые сшиты посредством либо химического связывания, физического связывания или их сочетания. В химическом гидрогеле полимерные цепи сшиты непосредственно или опосредованно друг с другом ковалентными связями. В физическом гидрогеле полимерные цепи сшиты непосредственно или опосредованно друг с другом физическими связями, такими как ионные связи, водородные связи, взаимодействия Ван дер Вальса и т.п. Гидрогели сочетания могут быть сшиты посредством сочетания химических и физических связей.
В одном варианте осуществления гидрогель является полностью или по существу полностью сшитым. В одном варианте осуществления, когда гидрогель является полностью сшитым, он представляет собой одну молекулу, независимо от ее размера. В одном варианте осуществления гидрогель является нерастворимым во всех растворителях при повышенных температурах в условиях, где не происходит разрушение полимера.
Вследствие гидрофильной природы полимерных цепей, гидрогели всасывают воду, в результате матрица из гидрогеля набухает. В одном варианте осуществления гидрогель набухает в ответ на контактирование с жидкостью организма, такой как вагинальная жидкость, слюна и/или ректальная жидкость.
Подходящие гидрогели описаны в патентах США №5017382; 4931288; 4894238; и 6488953, полное содержание которых независимо включено в данное описание в качестве ссылки.
В одном варианте осуществления, в ненабухшем состоянии, матрица из гидрогеля является твердой или она является по существу недеформируемой. Здесь подразумевают, что термин твердый используется для различения матрицы из гидрогеля от золя, золь-геля, гелевой эмульсии или коллоида, которые имеют более низкую степень сшивки, более низкую степень желирования, более высокую концентрацию несшитых или растворимых полимеров и/или являются более легко деформируемыми в ненабухшем состоянии.
В одном варианте осуществления матрица из гидрогеля имеет отношение геля к золю (гель является нерастворимой, сшитой, полимерной фракцией, а золь является растворимой несшитой полимерной фракцией), равное 75:25 по массе или более. Этот диапазон включает все значения и поддиапазоны, находящиеся между указанных значений, включая, например, отношения гель:золь, равные 75:25, 80:20, 85:15, 90:10, 91:9, 92:8, 93:7, 94:6, 95:5, 96:4, 97:3, 98:2, 99:1, 99,1:0,9, 99,2:0,8, 99,3:0,7, 99,4:0,6, 99,5:0,5, 99,6:0,4, 99,7:0,3, 99,8:0,2, 99,9:0,1 и 100:0.
Матрица гидрогеля может представлять собой термосет, эластомер, термопластичный эластомер, сшитый полиэтиленоксид, сшитый полиэтиленгликоль, уретан, их сополимеры и их взаимопроникающие полимерные каркасы.
В одном варианте осуществления матрица из гидрогеля включает полиэтиленгликоль, сшитый с уретаном. В одном варианте осуществления матрица из гидрогеля включает полиэтиленгликоль, сшитый с 1,2,6-гексантриолом, и дициклогексилметан 4,4'-диизоцианат в качестве удлинителя цепи и хлорид железа в качестве катализатора.
Матрица из гидрогеля является неразрушаемой, что означает, что она не разрушается во время назначенного или нормального применения, т.е. во влагалище, во рту или в прямой кишке. Как таковой, вкладыш следует различать от свечей, суппозиториев или пессариев, которые разработаны для разрушения при нормальном применении, т.е. они высвобождают их содержимое в основном через деградацию, эрозию, растворение, диссоциацию, гидролиз или другое разрушение материала матрицы.
Размеры сухой матрицы из гидрогеля могут подходящим образом изменяться в интервале от приблизительно 10 до 50 мм по длине, приблизительно от 1 до 20 мм по ширине и приблизительно от 0,5 до 10 мм по толщине. Эти интервалы включают все значения и субинтервалы, находящиеся между этими значениями, включая, например, 0,5, 0,6, 0,7, 0,8, 0,9, 1, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2, 2,1, 2,2, 2,3, 2,4, 2,5, 2,75, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30, 40 и 50, как принято, и любое их сочетание.
Масса незаполненной матрицы из гидрогеля может подходящим образом изменяться в интервале от приблизительно 100 до 1000 мг. Этот интервал включает все значения и субинтервалы, находящиеся между этими значениями, включая, например, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 115, 120, 130, 140, 150, 160, 170, 180, 190, 200, 225, 250, 275, 300, 325, 350, 375, 400, 425, 450, 475, 500, 525, 550, 575, 600, 700, 800, 900, 1000 мг и их сочетание.
Гидрохлорид клиндамицина находится в контакте с матрицей из гидрогеля, что означает, что он поглощается или диспергируется по всему объему или по части матрицы из гидрогеля, суспендирован в части или по всему объему матрицы из гидрогеля, нанесен на одну или более поверхностей матрицы из гидрогеля или их сочетание. В одном варианте осуществления, при нормальном применении, матрица набухает через поглощение жидкости или текучей среды организма, такой как, например, вагинальная текучая среда, слюна, текучая среда организма, ректальная текучая среда и т.п., и гидрохлорид клиндамицина, клиндамицин в виде свободного основания или оба высвобождаются из матрицы.
Количество гидрохлорида клиндамицина, вводимого интравагинально, интраректально или перорально в виде единичной или разовой дозы, может изменяться в широких пределах, в зависимости от многих переменных, таких как возраст и физическое состояние пациента, степень нарушения у пациента, природа нарушения у пациента, продолжительность ввода, частота ввода, необходимость в профилактике, необходимость в терапевтическом введении, степень высвобождения активного средства и т.п.
Количество активного средства в единичной дозе в целом составляет, по меньшей мере, 1 миллиграмм (мг) и не превышает 500 мг. Этот интервал включает все значения и субинтервалы, находящиеся между этими значениями, включая, например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 14, 16, 18, 20, 30, 40, 50, 60, 70, 80, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200, 250, 300, 350, 400, 500 мг и их любое сочетание. Единичная доза может быть измерена в переводе на количество гидрохлорида клиндамицина, содержащегося в матрице из гидрогеля, или количество доставленного основания клиндамицина, отмечая то, что 100 мг клиндамицина = 108,5658 мг гидрохлорида клиндамицина. В одном варианте осуществления один вкладыш содержит гидрохлорид клиндамицина в количестве, эквивалентном 100 мг клиндамицина.
Гидрохлорид клиндамицина может присутствовать в матрице из гидрогеля в количестве, находящемся в интервале от приблизительно 5 до 75% мас./мас. матрицы из гидрогеля. Здесь, “% мас./мас. матрицы из гидрогеля” основано на массе гидрохлорида клиндамицина относительно массы незаполненной матрицы из гидрогеля. Этот интервал включает все значения и субинтервалы, находящиеся между этими значениями, включая, например, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 47, 49, 50, 55, 60, 70 и 75% мас./мас. матрицы из гидрогеля и любое их сочетание.
Вкладыши могут вводиться перорально, интраректально и/или интравагинально однократно или многократно соответственно. При введении более одного раза, вкладыши могут вводиться на регулярной основе или на нерегулярной основе. Вкладыш может вводиться с частотой от одного до четырех раз в течение периода времени в интервале от одного дня до одного года, необязательно с повторением по необходимости и необязательно с одним или более интервалов при отсутствии ввода. Эти интервалы включают все значения и субинтервалы, находящиеся между этими значениями, включая, например, 1, 2, 3 и 4 раза для введения и период времени, равный 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 и 30 дням и 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 и 12 месяцам и любому их сочетанию.
В одном варианте осуществления вкладыши могут вводиться в связи с беременностью или планируемой или непланируемой беременностью. Например, в одном варианте осуществления вкладыши могут вводиться в любое время перед зачатием для доставки и далее. Некоторые примеры времен введения, относящиеся к беременности, включают 1, 2 или 3 месяца перед зачатием, зачатие, 1, 2, 3, 4, 5, 6, 7, 8 и 9 месяцев после зачатия, во время беременности, доставку и послеродовой период.
Общая суточная доза может подходящим образом изменяться от приблизительно 1 мг до приблизительно 1500 мг, причем этот интервал включает все значения и субинтервалы, находящиеся между этими значениями, включая, например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 14, 16, 18, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200, 300, 400, 500, 700, 900, 1000, 1100, 1300 и 1500 мг и любое их сочетание. Дозы, приведенные здесь, являются пригодными либо для терапевтического, либо для профилактического введения. Квалифицированные специалисты в данной области оценят, что приведенные выше дозовые уровни предоставлены иллюстративно и что более высокие и более низкие дозовые уровни могут использоваться без отхода от сущности и объема притязаний настоящего изобретения.
Время пребывания для вкладыша в полости тела, буккальной, вагинальной или ректальной может изменяться в интервале от 1 часа до 2 дней. Этот интервал включает все значения и субинтервалы, находящиеся между этими значениями, включая, например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 36 и 48 часов и любое их сочетание.
Наивысшая средняя концентрация в плазме Cmax клиндамицина при вагинальном введении единичной дозы гидрохлорида клиндамицина, эквивалентной 100 мг клиндамицина в контакте с неразрушаемой матрицей из гидрогеля, измеренная через одно или более значений из 6, 12, 24, 36, 48 или 72 часа после введения, может подходящим образом изменяться в интервале от 1 до 1000 нг/мл. Этот интервал включает все значения и субинтервалы, находящиеся между этими значениями, включая, например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50, 75, 100, 200, 250, 500, 750 и 1000 нг/мл и любое их сочетание.
В одном варианте осуществления матрица может быть расплавленной или литой непосредственно до желательных конечных размера и/или формы. В одном варианте осуществления матрица из гидрогеля может быть полимеризована в объеме, далее порезана или иным образом измельчена до желательного размера и/или формы. Полученная таким образом матрица из гидрогеля может далее храниться при подходящих условиях консервации до дальнейшей переработки.
Матрица из гидрогеля либо в объеме или в виде конечных формы и размера может быть очищена, например, в подходящем растворителе, таком как вода, алкоголь, этанол или их сочетание, для экстракции всех или части из любых оставшихся реагентов или невулканизированного полимера из матрицы. В одном варианте осуществления матрицу из гидрогеля помещают в воду или растворитель и необязательно встряхивают при температуре от 10 до 50°С, по ситуации, в течение времени в интервале от 1 часа до 2 дней, по ситуации, для экстракции и/или очистки. Вода или растворитель могут быть декантированы, и матрица из гидрогеля может быть необязательно высушена. Этот процесс может быть повторен по необходимости перед загрузкой гидрохлорида клиндамицина.
Гидрохлорид клиндамицина и/или любое вещество для совместного введения или другая добавка могут быть одновременно или последовательно загружены на матрицу из гидрогеля. В одном варианте осуществления загружающий раствор может быть получен диспергированием или растворением соединения (соединений), подлежащих загрузке, в подходящем растворителе, например воде, алкоголе, этаноле или их сочетании. Чтобы способствовать загрузке, могут быть добавлены одно или более подходящих веществ для совместного растворения, буферных средств, диспергаторов и т.п. Незаполненную матрицу из гидрогеля помещают в загружающий раствор, при необязательном встряхивании, в течение времени и при температуре, достаточных для влияния на загрузку.
В одном варианте осуществления загружающий раствор представляет собой водный раствор гидрохлорида клиндамицина при концентрации, равной приблизительно от 0,1 до 500 М. Этот интервал включает все значения и субинтервалы, находящиеся между этими значениями, включая, например, 0,1, 0,2, 0,3, 0,4, 0,5, 1, 2, 3, 4, 5, 10, 11, 12, 13, 14, 15, 20, 40, 60, 80, 100, 200, 300, 400, 500 М и любое их сочетание. В одном варианте осуществления загружающий раствор представляет собой сверхнасыщенный раствор гидрохлорида клиндамицина.
В одном варианте осуществления загрузку проводят при температуре загружающего раствора в интервале приблизительно от 5°С до 60°С. Этот интервал включает все значения и субинтервалы, находящиеся между этими значениями, включая, например, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 30, 40, 50 и 60°С и их любое сочетание.
В одном варианте осуществления загрузку проводят в течение времени в интервале приблизительно от 1 до 48 часов для обеспечения поглощения соединения (соединений) для загрузки. Этот интервал включает все значения и субинтервалы, находящиеся между этими значениями, включая, например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 30, 40, 48 часов и любое их сочетание. Загруженную, таким образом, матрицу из гидрогеля можно далее сушить.
Вкладыш может необязательно быть покрыт одним или более покрытиями. Некоторые неограничивающие примеры покрытия включают один или более (со)полимеров, растворимых (со)полимеров, поливинилакрилат, метилцеллюлозу, полигексилэтилметакрилат и их сочетания. Покрытие может необязательно применяться, например, для модификации или достижения конкретного профиля высвобождения или другого свойства вкладыша.
Один вариант осуществления относится к изделию производства, которое может включать упаковочный материал, такой как конверт или саше, и содержащийся в нем вкладыш, который включает, по меньшей мере, гидрохлорид клиндамицина и матрицу из гидрогеля. Упаковочный материал может включать этикетку, которая указывает, что вкладыш может применяться для облегчения симптомов бактериального вагиноза или другого заболевания посредством введения вкладыша.
Может применяться система ввода, пригодная для ввода вкладыша в полость тела. Такие системы введения могут включать один или более приемлемых в медицинском смысле и/или в промышленном отношении способы для внедрения сходных изделий, таких как тампоны, суппозитории и т.п., в полость тела человека, такую как влагалище или прямая кишка. Примеры таких систем введения включают аппликатор, трубку, шприц или т.п., но не ограничены ими. Упаковка может быть изначально герметизирована и открыта во время применения. Если представлена более чем единственная доза, упаковка может быть повторно герметизируема подходящими средствами закрытия.
Вкладыш может применяться в сочетании с системой извлечения. Для удаления вкладыша из полости тела после использования может применяться любая пригодная приемлемая в медицинском смысле и/или в промышленном отношении система извлечения, поскольку она не оказывает влияние на доставку активного средства. Некоторые примеры систем извлечения включают одну или более линий, стрингов, нитей или лент, присоединенных к вкладышу, таких как литая петля, интегральная петля, выходящая из вкладыша, пористая сеть, пористый мешочек, плетеная трубка или любое их сочетание. Один пример подходящей системы извлечения раскрыт в патенте США №5269321, полное содержание которого включено в данное описание в качестве ссылки. Один или более одного вкладыша могут содержаться в системе извлечения. Система извлечения может соединяться с системой ввода по необходимости.
Любое из упаковочного материала, устройства ввода или устройства извлечения могут быть облучены по необходимости.
Для оптимальной загрузки гидрохлорида клиндамицина в матрицу из гидрогеля следует учитывать один или более из следующих факторов: масса загрузочного раствора; концентрация гидрохлорида клиндамицина; размер загрузки; температура загрузки; время загрузки; и/или профиль сушки загруженных систем доставки. Принимая во внимание инструкции, данные здесь, и знания рядового специалиста в данной области, эти факторы могут быть определены только с помощью рутинного экспериментирования.
Кроме гидрохлорида клиндамицина один или более дополнительных активных ингредиентов могут быть необязательно совместно введены с вкладышем. Совместно вводимое вещество может быть выбрано для лечения одной или нескольких бактериальных инфекций, грибковых инфекций, профилактики, например, при окончаниях, расширении и прекращении акушерско-гинекологических обследований и/или преждевременных родах, вагините, вагинальном кандидозе, генитальном кандидозе, трихомониазе, хламидийных инфекциях и/или гонорее.
Совместно вводимое вещество может представлять собой любое профилактическое средство или терапевтическое средство, пригодное для вагинального, буккального или ректального введения. В одном варианте осуществления совместно вводимое вещество достигает локального эффекта в большей степени, чем системного эффекта, что означает, что средство функционирует желательным благоприятным образом без попадания в кровоток. Некоторые локальные эффекты могут включать спермицидную активность, лечение вагинального состояния или нарушения, предотвращение или лечение заболеваний, передающихся половым путем и т.п. В одном варианте осуществления совместно вводимое вещество достигает локального эффекта в дополнение к системному эффекту. В одном варианте осуществления совместно вводимое вещество достигает системного эффекта. Примеры пригодных совместно вводимых веществ включают без ограничений спермицидные средства, противовирусные средства, противовоспалительные средства, местные анестезирующие средства, противоинфекционные средства, антибиотики, противогрибковые средства, противопаразитные средства, кислоты, смазки и их смеси. Некоторые примеры совместно вводимых веществ даны ниже.
Спермицидные средства включают нонилфеноксиполиэтоксиэтанол (продается под торговым наименованием “Ноноксинол-9”), п-диизобутилфеноксиполиэтанол (“Октоксинол-9”), хлорид бензалкония, п-метанилфенилполиоксиэтиленовый эфир (Менфегол), хлоргексидин, полиоксиэтиленоксипропилен стеарат, рицинолевую кислоту, рицинолеат глицерина, хлорид метилбензетония и их смеси.
Противовирусные средства включают нуклеозидфосфонаты и другие аналоги нуклеозидов, аналоги AICAR (5-амино-4-имидазолкарбоксамид рибонуклеотида), ингибиторы гликолитического пути, анионные полимеры и т.п., более конкретно: антигерпесные средства, такие как ацикловир, фамцикловир, фоскарнет, ганцикловир, идоксуридин, соривудин, трифлуридин, валацикловир и видарабин; и другие антивирусные средства, такие как абакавир, адефовир, амантадин, ампренавир, цидофовир, делвиридин, 2-дезоксиглюкозу, декстрансульфат, диданозин, эфавиренц, индинавир, интерферон альфа, ламивудин, нелфинавир, невирапин, рибавирин, римантадин, ритонавир, саквинавир, скваламин, ставудин, типранавир, валганцикловир, зальцитабин, зидовудин, зинтевир и их смеси. Еще другими антивирусными средствами являются глицериды, особенно моноглицериды, которые обладают антивирусной активностью. Одно такое средство представляет собой монолаурин, моноглицерид лауриновой кислоты.
Противовоспалительные средства включают кортикостероиды, например кортикостероид с более низкой активностью, такой как гидрокортизон, гидрокортизон-21-моносложные эфиры (например, гидрокортизон-21-ацетат, гидрокортизон-21-бутират, гидрокортизон-21-пропионат, гидрокортизон-21-валерат и т.д.), гидрокортизон-17,21-дисложные эфиры (например, гидрокортизон-17,21-диацетат, гидрокортизон-17-ацетат-21-бутират, гидрокортизон-17,21-дибутират и т.д.), алклометазон, дексаметазон, флуметазон, преднизолон или метилпреднизолон, или кортикостероид с более высокой активностью, такой как клобетазол пропионат, бетаметазон бензоат, бетаметазон дипропионат, дифлоразон диацетат, флуоцинонид, мометазон фуроат, триамцинолон ацетонид и их смеси.
Местные анестетические средства включают ацетамидоэвгенол, алфадолон ацетат, афлаксолон, амукаин, амоланон, амилокаин, беноксинат, бензокаин, бетоксикаин, бифенамин, бупивакаин, буретамин, бутакаин, бутабен, бутаниликаин, буталитал, бутоксикаин, картикаин, 2-хлорпрокаин, кокаэтилен, кокаин, циклометикаин, дибукаин, диметизоквин, диметокаин, диперадон, диклонин, экгонидин, экгонин, этиламинобензоат, этилхлорид, этидокаин, этоксадрол, β-эукаин, эупроцин, феналкомин, фомокаин, гексобарбитал, гексилкаин, гидроксидион, гидроксипрокаин, гидрокситетракаин, изобутил п-аминобензоат, кетамин, лейцинокаин мезилат, левобупивакаин, левоксадрол, лидокаин, мепивакаин, меприлкаин, метабутоксикаин, метогекситал, метилхлорид, мидазолам, миртекаин, наепаин, октакаин, ортокаин, оксетазаин, парэтоксикаин, фенакаин, фенциклидин, фенол, пиперокаин, пиридокаин, полидоканол, прамоксин, пропанидид, пропанокаин, пропаракаин, пропипокаин, пропофол, пропоксикаин, псевдококаин, пиррокаин, ризокаин, салициловый спирт, тетракаин, тиалбарбитал, тимилал, тиобутабарбитал, тиопентал, толикаин, тримекаин, золамин, фенол и их смеси.
Антибиотические средства включают средства из семейства линкомицина, такие как линкомицин; клиндамицин, соль клиндамицина, фосфат клиндамицина, ацетат клиндамицина, другие макролидные, аминогликозидные и гликопептидные антибиотики, такие как эритромицин, кларитромицин, азитромицин, стрептомицин, гентамицин, тобрамицин, амикацин, неомицин, ванкомицин и тейкопланин; антибиотики из семейства тетрациклина, включая тетрациклин, хлортетрациклин, окситетрациклин, демеклоциклин, ролитетрациклин, метациклин и доксициклин; и антибиотики на основе серы, такие как сульфонамиды сульфацетамид, сульфабензамид, сульфадиазин, сульфадоксин, сульфамеразин, сульфаметазин, сульфаметизол и сульфаметоксазол; стрептограминовые антибиотики, такие как квинупристин и далфопристин; и хинолоновые антибиотики, такие как ципрофлоксацин, налидиксиновая кислота, офлоксацин и их смеси.
Противогрибковые средства включают миконазол, терконазол, изоконазол, итраконазол, фентиконазол, флуконазол, кетоконазол, клотримазол, бутоконазол, эконазол, метронидазол, клиндамицин, 5-фторурацил, амфотерицин В и их смеси.
Другие противоинфекционные средства включают разнообразные антибактериальные средства, такие как хлорамфеникол, спектиномицин, полимиксин В (колистин) и бацитрацин, антимикобактериальные средства, такие как изониазид, рифампин, рифабутин, этамбутол, пиразинамид, этионамид, аминосалициловая кислота и циклосерин, и антигельминтные средства, такие как албендазол, оксфендазол, тиабендазол и их смеси.
Совместно вводимые вещества могут обладать системной и/или местной эффективностью против видов Candida, например против Candida albicans, Candida tropicalis и/или Candida stelloidea, полиеновое противогрибковое средство, эффективное против видов Candida, клотримазол, пиримидиновое противогрибковое средство, эффективное против видов Candida, флуцитозин, циклопирокс оламин, нафтифин, тербинафин, галопрогин. Другие примеры совместно вводимых веществ включают тинидазол, амфотерицин, капсофунгин, гризеофульвин, семапимод, итракаоназол, кетоконазол, андиофунгилины, вориконазол, ацикловир/ацикловир, фамцикловир, тенофовир, зидовудин, азитромицин и их смеси.
Другие необязательные добавки включают антиоксиданты, т.е. средства, которые ингибируют окисление и, таким образом, предотвращают ухудшение качества препаратов посредством окисления. Пригодные антиоксиданты включают, посредством примера и без ограничения, аскорбиновую кислоту, аскорбилпальмитат, бутилированный гидроксианизол, бутилированный гидрокситолуол, гипофосфорную кислоту, монотиоглицерин, аскорбат натрия, формальдегид сульфоксилат натрия, метабисульфит натрия, бисульфит натрия, витамин Е и его производные, пропилгаллат, сульфитные производные и другие, известные рядовому специалисту в данной области. Смеси являются возможными.
Другие необязательные добавки включают пригодные бактериостатики, консерванты, ингибиторы, красители или т.п., такие как метиловый, этиловый, пропиловый и бутиловый сложные эфиры парагидроксибензойной кислоты, пропилгаллат, сорбиновую кислоту и ее натриевую и калиевую соли, пропионовую кислоту и ее кальциевую и натриевую соли, “Диоксин” (6-ацетокси-2,4-диметил-м-диоксан), “Бронопол” (2-бром-2-нитропропан-1,3-диол) и салициланилиды, такие как дисбромсалициланилид, трибромсалициламилиды, “Цинарил” 100 и 200 или “Довицил” 100 и 200 (цис-изомер 1-(3-хлораллил-3,5,7-триаза-1-азанидадамантан хлорид), гексахлорофен, бензоат натрия, лимонную кислоту, этилендиаминтетрауксусную кислоту и ее соли с щелочными металлами и щелочноземельными металлами, бутилгидроксианизол, бутилгидрокситолуол, фенольные соединения, такие как хлор- и бромкрезолы и хлор- и бром-оксиленолы, четвертичные аммониевые соединения, как хлорид бензалкония, ароматические спирты, такие как фенилэтиловый спирт, бензиловый спирт и т.д., хлорбутанол, производные хинолина, такие как йодхлоргидроксихинолин и т.п. Возможны сочетания.
Любое из совместно вводимых веществ может быть введено в виде соли, сложного эфира, амида, пролекарства, конъюгата, активного метаболита, изомера, фрагмента, аналога или т.п., при условии, что соль, сложный эфир, амид, пролекарство, конъюгат, активный метаболит, изомер, фрагмент или аналог является фармацевтически приемлемым или высвобождает фармакологически активное средство в настоящем контексте. Соли, сложные эфиры, амиды, пролекарства, конъюгаты, активные метаболиты, изомеры, фрагменты и аналоги средств могут быть получены с использованием стандартных методик, известных квалифицированным специалистам в области синтетической органической химии, и описаны, например, J. March, Advanced Organic Chemistry: Reactions, Mechanisms and Structure, 5th Edition (New York: Wiley-Interscience, 2001).
Например, соли присоединения кислот получают из лекарства в виде свободного основания, используя общепринятую методологию, включающую реакцию свободного основания с кислотой. Пригодные кислоты для получения солей присоединения кислот включают как органические кислоты, например уксусную кислоту, пропионовую кислоту, гликолевую кислоту, пировиноградную кислоту, щавелевую кислоту, яблочную кислоту, малоновую кислоту, янтарную кислоту, малеиновую кислоту, фумаровую кислоту, винную кислоту, лимонную кислоту, бензойную кислоту, коричную кислоту, миндальную кислоту, метансульфоновую кислоту, этансульфоновую кислоту, п-толуолсульфоновую кислоту, салициловую кислоту и т.п., а также неорганические кислоты, например хлористоводородную кислоту, бромистоводородную кислоту, серную кислоту, азотную кислоту, фосфорную кислоту и т.п. Соль присоединения кислоты может быть реконвертирована в свободное основание обработкой подходящим основанием. Напротив, получение основных солей кислотных фрагментов, которые могут быть представлены как активное средство, может осуществляться сходным образом с использованием фармацевтически приемлемого основания, такого как гидроксид натрия, гидроксид калия, гидроксид аммония, гидроксид кальция, триметиламин или т.п. Получение сложных эфиров включает превращение группы карбоновой кислоты через общепринятую реакцию этерификации, включающую нуклеофильную атаку фрагмента RO- по карбонильному углероду. Этерификация может также осуществляться посредством реакции гидроксильной группы с реагентом этерификации, таким как хлорангидрид кислоты. Сложные эфиры могут быть реконвертированы в свободные кислоты, по желанию, с использованием общепринятых методик гидрогенолиза или гидролиза. Амиды могут быть получены из сложных эфиров, с использованием пригодных аминных реагентов, или они могут быть получены из ангидрида или хлорангидрида кислоты реакцией с аммиаком или низшим алкиламином. Пролекарства и активные метаболиты могут также быть получены с использованием методов, известных квалифицированным специалистам в данной области или описанных в соответствующей литературе. Пролекарства типично получают посредством ковалентного присоединения фрагмента, что приводит к соединению, которое является терапевтически неактивным до модификации метаболической системой индивида.
Другие производные и аналоги совместно вводимых соединений могут быть получены с использованием стандартных методов, известных квалифицированным специалистам в области синтетической органической химии, или могут быть логически выведены со ссылкой на соответствующую литературу. Кроме того, хиральные активные средства могут находиться в изомерно чистой форме или они могут быть введены в виде рацемической смеси изомеров.
Во вкладыше могут быть использованы одно или несколько совместно вводимых соединений и/или добавок.
Количество совместно вводимых соединений в пленке будет типично находиться в интервале от приблизительно 0,01 до приблизительно 15% мас./мас. матрицы из гидрогеля. Этот интервал включает все значения и субинтервалы между этими значениями, включая, например, 0,01, 0,02, 0,03, 0,04, 0,05, 0,06, 0,07, 0,08, 0,09, 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15% мас./мас. матрицы из гидрогеля и любое их сочетание.
В одном варианте осуществления вкладыш включает бутилированный гидроксианизол в количестве в интервале от приблизительно 0,01 до 0,1% мас./мас. матрицы из гидрогеля. Этот интервал включает все значения и субинтервалы между этими значениями, включая, например, 0,01, 0,02, 0,03, 0,04, 0,05, 0,06, 0,07, 0,08, 0,09, 0,1% мас./мас. матрицы из гидрогеля и любое их сочетание.
В то время как настоящее изобретение восприимчиво к варианту осуществления во многих различных формах, некоторые варианты осуществления изобретения описаны здесь в деталях. Следует понимать, однако, что настоящее раскрытие и варианты осуществления, описанные здесь, считаются иллюстративными примерами принципов данного изобретения и не предназначены для ограничения изобретения иным образом, как определено формулой изобретения в настоящем документе.
ПРИМЕРЫ
Следующие примеры предоставлены только для дополнительной иллюстрации и не предназначены для ограничения, если не указано иначе.
Пример 1
Вагинальный вкладыш, содержащий 100 мг гидрохлорида клиндамицина (CHVI) в соответствии с одним вариантом осуществления, получают для лечения бактериального вагиноза (БВ). Применяя микробиологическую модель in vitro, антибактериальную эффективность CHVI сравнивают с тем же показателем для двух промышленно выпускаемых курсов лечения БВ на основе фосфата клиндамицина (CLINDESSE™ и CLEOCIN™). Продукты на основе фосфата клиндамицина выбирают, так как на рынке отсутствуют продукты для вагинального применения, в которых используется гидрохлорид клиндамицина.
Кроме того, антибактериальную активность фосфата клиндамицина, загруженного в матрицу из гидрогеля (CVI), сравнивают с активностью вагинального вкладыша, содержащего 100 мг гидрохлорида клиндамицина (CHVI). При этом сравнении фосфат клиндамицина загружают на матрицу из гидрогеля и вагинальные вкладыши, содержащие 2×50 мг фосфата клиндамицина, применяют вместе в одной системе извлечения.
Материалы
Тестовый микроорганизм: Bacteroides fragilis NCTC 9344
CLINDESSE™ - Единицы по 100 мг фосфата клиндамицина в вагинальном креме - сравнительный пример.
CLEOCIN™ - Единицы по 100 мг фосфата клиндамицина в плавящейся (деградируемой) свече - сравнительный пример.
CHVI - Единицы по 100 мг гидрохлорида клиндамицина, загруженные в матрицу из гидрогеля - пример.
CVI - Единицы по 100 мг фосфата клиндамицина, загруженные в матрицу из гидрогеля - сравнительный пример.
Питательная среда из мозга и сердца (BHI)
Нейтрализующий раствор - 20 г/л казеина плюс 10% Tween 80
Бактериологическая пептонная вода
Синий агар Columbia с 5% лошадиной крови
Анаэробный набор - Oxoid AnaeroGen
Фильтры 0,45 мкм - Pall GN-6
Пипетки Gilson и стерильные наконечники
Стерильные насадки
Инкубатор 37°С +/-1°С
Вагинальные вкладыши с гидрохлоридом клиндамицина (CHVI) составлены из полимера гидрогеля, причем гидрохлорид клиндамицина диспергирован по всему объему матрицы, содержащейся внутри ленты для извлечения. Вкладыш из полимера гидрогеля имеет размеры 30 мм по длине, 10 мм по ширине и приблизительно 1,5 мм по толщине. Он является прямоугольным по форме с закругленными углами. Компоненты и количественная композиция CHVI приведены ниже в таблице 1.
Композиция CHVI
Полимер гидрогеля получают посредством реакции плавленого полиэтиленгликоля (PEG), Desmodur W (дициклогексилметан 4,4'-диизоцианат, DMDI) и гексантриола (HT) со следовыми количествами хлорида железа, который применяется как катализатор. Полимер выливают в формы и после вулканизации при приблизительно 95°С в течение по меньшей мере четырех часов полимер охлаждают до комнатной температуры. Полученные в результате блоки полимера нарезают слоями для получения незаполненных срезов требуемой толщины. Срезы полимера могут храниться при температуре от -20°С до 25°С перед очисткой.
Незаполненные срезы полимера помещают в очищенную воду и взбалтывают при 25°С±2°С в течение приблизительно 6-8 часов и затем воду декантируют. Набухшие срезы снова помещают в очищенную воду и взбалтывают при 25°С±2°С в течение приблизительно 16-20 часов; воду затем декантируют. Набухшие в воде срезы полимера помещают в раствор этанол: вода и взбалтывают при 25°С±2°С в течение приблизительно 6-8 часов. Альтернативно, очистка может происходить в воде только в течение 24 часов. Раствор затем декантируют. Единичные блоки сушат в дражировочном котле в течение приблизительно 24 часов. Очищенные срезы полимера хранят при -20°С перед загрузкой лекарством.
Раствор для загрузки лекарством получают посредством необязательного первоначального диспергирования антиоксиданта, бутилированного гидроксианизола (BHA) в воде. Гидрохлорид клиндамицина растворяют в полученном в результате растворе. Гидрохлорид клиндамицина, используемый в CHVI, производится Zhejiang Hisoar Pharmaceuticals and Chemicals Co., Ltd, No 100 Waisha Branch Road, Jiaojiang Taizhou Zhejiang, China, PC 318000. Срезы и раствор для загрузки лекарством взбалтывают при 25°С±2°С в течение приблизительно 16-24 часов для обеспечения поглощения лекарства. Любой остающийся раствор лекарства затем декантируют и набухшие срезы полимера сушат осушенным воздухом в дражировочном котле в течение приблизительно 24 часов.
Способ
Несмотря на то что модель in vitro будет полностью имитировать состояние in vivo для BV, модель in vitro данного описания была разработана, чтобы воспроизвести насколько возможно условия in vivo. Они представляют собой:
Температура - температура здорового влагалища составляет 37°С +/-1°С. Эта температура, которая использовалась во всем исследовании.
Условия инкубации - анализ проводят в анаэробных условиях для оптимального извлечения B.fragilis.
рН - рН питательной среды, BHI, составляет 7,0-7,2. Данное значение находится в пределах известного интервала рН для женщин, болеющих БВ (National Guideline for the Management of Bacterial Vaginosis, 2002, Hay PE (www.agum.org.uk/ceg 2002), полное содержание которого включено в данное описание посредством ссылки).
Применялись стандартные объемы по 100 мл среды, которые являются пригодными при избыточных объемах, ожидаемых in vivo. Большие объемы были необходимы для обеспечения повторного отбора образцов и для размещения CLINDESSE™. CLINDESSE™ представляет собой воскообразный продукт, который немедленно разрушается при перемешивании. Меньшие объемы среды создавали бы проблемы с отбором образцов во время фильтрации.
Некоторые колонии тестового микроорганизма засевали в 10 мл BHI и инкубировали в анаэробных условиях при 37°С в течение 24 часов. Один мл суспензии культуры, полученной в течение ночи, добавляли к 100 мл BHI и перемешивали на вихревом смесителе. Добавляли одну единицу тестируемого продукта, перемешивали и немедленно один мл удаляли и серийно разбавляли в бактериологической пептонной воде. 0,1 мл соответствующего разведения отбрасывали, добавляли пипеткой на CBA и готовили чашки Петри (временная отметка 0 час).
Дальнейшие образцы отбирали при 20 час, 40 час и 66 час. Для нейтрализации присутствия переходящего остатка антибиотика каждый образец фильтровали и промывали нейтрализующим раствором. При каждой временной отметке аликвоту образца добавляли к 50 мл очищенной воды и пропускали через фильтр 0,45 мкм.
Для CHVI, CVI и CLEOCIN™ каждый образец промывали 1×100 мл нейтрализующего раствора, а для CLINDESSE™ применяли объемы образцов 2×100 мл. После промывки каждый фильтр помещали на СВА.
Параллельно с вышеописанным осуществляли контроль, в котором содержались только тестовый микроорганизм и среда.
Все чашки и тестируемые образцы инкубировали в анаэробных условиях при 37°+/-1°С в течение 48 часов.
Тестирование CHVI и CLINDESSE™
В Таблице 2 ниже приведены суммарные результаты трех независимых анализов, проведенных с CHVI и CLINDESSE™ против Bacteroides fragilis.
Количество кое/мл
Как видно из таблицы 2, единица в 100 мг CHVI при пробе с первоначальным посевным материалом 107 кое/мл (серии 1 и 2) достигает снижения до 105 кое/мл в течение 66 часов. При пробе с более низким содержанием первоначального посевного материала, равным 106 кое/мл (серия 3), через 40 часов колоний не обнаруживали. Для продукта CLINDESSE™ количество счета под воздействием фактора часто имеет место при каждой временной отметке как для пробы 106, так и для 107 кое/мл со снижением до 103 кое/мл в течение 66-часового периода тестирования. Контроль со средой демонстрирует, что микроорганизмы не повреждались в течение периода тестирования.
Тестирование CHVI, CLINDESSE™ и CLEOCIN™
CLEOCIN™ представляет собой доступный на рынке продукт, который применяется in vivo в виде суппозитория 1×100 мг фосфата клиндамицина в день в течение трех дней. Для обеспечения прямого сравнения CHVI и CLINDESSE™ одна единица по 100 мг CLEOCIN™ использовалась для каждой серии теста. Результаты показаны в таблице 3.
Количество кое/мл
Как видно из таблицы 3, для CHVI микробный счет снижался от 105 кое/мл до 101 кое/мл для серии 1 и до 0 кое/мл для серии 2 при 40 часах, а при 66 часах колонии не обнаруживались для обеих серий. В случае CLINDESSE™ счет снижался на 102 в течение 66 часов. Для CLEOCIN™ не наблюдали существенного снижения. Через 66 часов достигалось снижение только на 102 кое/мл.
Тестирование CVI
Единицы полимера гидрогеля были загружены фосфатом клиндамицина (CVI). Две серии были установлены с различным первоначальным количеством посевного материала, равным 105 и 106 кое/мл. Результаты приведены ниже в таблице 4.
Количество кое/мл
Как видно из таблицы 4, CVI с пробой 106 кое/мл (серия 1) достигал снижения счета, равного 102 кое/мл, в течение 66 часов. При тестировании против первоначального посевного материала 105 кое/мл, счет снижался десятикратно для каждой временной отметки в течение 66 часов, приводя в результате к снижению до 103 кое/мл. Степень уничтожения для CVI является сходной с результатами, наблюдаемыми для CLINDESSE™, но подобно CLINDESSE™ была все же ниже, чем для CHVI.
Результаты, показанные в таблицах 1-4, демонстрируют превосходящую эффективность CHVI по отношению к доступным на рынке продуктам, CLINDESSE™ и CLEOCIN™, и фосфату клиндамицина, загруженному на матрицу из гидрогеля (CVI). В отличие от CHVI, ни CLINDESSE™, CLEOCIN™, ни CVI не достигали уничтожения даже после 66 часов. Данный факт позволяет предположить, что CHVI высвобождается более эффективно в модели in vitro и/или что гидрохлорид клиндамицина является более эффективным, чем фосфат клиндамицина.
Хотя уровень антибиотика, высвобождаемого в случае CVI, вероятно также превосходит уровни MIC, профиль высвобождения CVI в забуференной среде, BHI, неизвестен. Понятно, однако, что независимо от механизма, CVI уступает CHVI в модели, что очевидно продемонстрировано наблюдаемыми степенями уничтожения.
Результаты демонстрируют микробиологическое преимущество и превосходящую антимикробную эффективность CHVI по отношению к CVI, CLINDESSE™ и CLEOCIN™. CHVI при пробе с первоначальным посевным материалом ~106 кое/мл B. fragilis достигал уничтожения за 40-66 часов. В сравнении, CLINDESSE™ достигал снижения только 103 кое/мл при 66 часах. CLEOCIN™ при пробе с более низким первоначальным посевным материалом, равным ~105 кое/мл, достигал десятикратного снижения микробного счета в течение периода тестирования, равного 66 часам.
Несмотря на любые трудности с корреляцией данных in vitro и in vivo, если CHVI действует in vivo, так же как в модели in vitro, как ожидается, CHVI будет обеспечивать лучшую и более эффективную альтернативу вагинальным продуктам на основе фосфата клиндамицина, представленным в настоящее время на рынке.
Количественный анализ действия единиц фосфата клиндамицина, загруженных в полимер, (CVI) позволяет проводить прямое сравнение двух лекарств (фосфата клиндамицина и гидрохлорида клиндамицина), загруженных в один и тот же полимер. Результаты показывают, что CVI не был так же эффективен в модели in vitro, как CHVI. В случае CVI, показания счета снижались только на 102-103 кое/мл в течение 66 часов, в то время как CHVI производил уничтожение за 40-66 часов. Результаты для CVI были сходными с результатами, полученными для CLINDESSE™.
Эксперимент по статическому высвобождению лекарства in vitro проводили для CHVI в среде BHI. Он показал, что ~80% лекарства высвобождалось за 18 часов. Поскольку лекарство остается в модели и не является утраченным, уровни должны были быть значительно выше известного MIC, равного 2 мкг/мл для устойчивой к клиндамицину B. fragilis (Lorian V. “Antibiotics in Laboratory Medicine”, 4th Edition Williams & Wilkens, 1996, полное содержание которой включено в данное описание посредством ссылки). В этой связи ожидают, что превосходящие результаты, наблюдаемые in vitro для CHVI, будут распространяться на применения in vivo.
Пример 2
Высвобождение лекарства и стабильность
Одну партию CHVI готовили и тестировали на стабильность.
В таблице 5 представлены данные стабильности для CHVI за 12 месяцев при условиях хранения 25°С и 40°С.
Фиг.1 предоставляет профили высвобождения лекарства для CHVI, хранящегося первоначально при 25°С и после 12 месяцев.
Данные по стабильности для CHVI, 100 мг LS, 3, 6 и 12 месяцев при 25°С и 40°С
Данные по стабильности для CHVI в реальном времени демонстрируют, что для CHVI является стабильным при хранении при 25° и 40°С вплоть до двенадцати месяцев. Профиль высвобождения лекарства не изменяется. Содержание ВНА не изменяется.
Данные по стабильности были также получены для CVI, фосфата клиндамицина на гидрогеле с ВНА (бутилированным гидроксиланизолом) и лимонной кислотой (присутствуют в качестве антиоксиданта и сорастворимого вещества при загрузке соответственно). Было обнаружено, что CVI был нестабильным при 25°С или 40°С в течение одного месяца (данные не представлены).
Соответственно, CHVI является более стабильным, чем CVI.
| название | год | авторы | номер документа |
|---|---|---|---|
| БИОПОЛИМЕРНАЯ МАТРИЦА ДЛЯ ИНТРАВАГИНАЛЬНОГО ВВЕДЕНИЯ, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2023 |
|
RU2840760C2 |
| СРЕДСТВО ДЛЯ ИНТРАВАГИНАЛЬНОЙ ДОСТАВКИ АКТИВНОГО КОМПОНЕНТА, СПОСОБ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ СРЕДСТВА | 2022 |
|
RU2806114C2 |
| ФАРМАЦЕВТИЧЕСКОЕ СРЕДСТВО ДЛЯ ИНТРАВАГИНАЛЬНОГО ВВЕДЕНИЯ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2023 |
|
RU2830742C1 |
| КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ВАГИНИТА И СПОСОБ ЕГО ЛЕЧЕНИЯ | 1991 |
|
RU2032402C1 |
| Косметическая активная противомикробная композиция для личной гигиены | 2023 |
|
RU2823227C1 |
| ФАРМАЦЕВТИЧЕСКИЙ СОСТАВ ДЛЯ ЛЕЧЕНИЯ ИНФЕКЦИОННЫХ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ В ГИНЕКОЛОГИИ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2011 |
|
RU2498806C2 |
| ПРИМЕНЕНИЕ ОЛИГОМЕРОВ МОЛОЧНОЙ КИСЛОТЫ В ЛЕЧЕНИИ ГИНЕКОЛОГИЧЕСКИХ РАССТРОЙСТВ | 2008 |
|
RU2459620C2 |
| ВАГИНАЛЬНЫЙ ГЕЛЬ | 2021 |
|
RU2834988C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ИНФЕКЦИОННЫХ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ В ГИНЕКОЛОГИИ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2010 |
|
RU2479305C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ОЛИГОМЕРНУЮ МОЛОЧНУЮ КИСЛОТУ | 2013 |
|
RU2627470C2 |
Заявленное изобретение относится к химико-фармацевтической промышленности и касается вкладыша для лечения нарушения, выбранного из группы, включающей бактериальный вагиноз, воспалительное заболевание тазовой области, эндометрит, послеоперационную инфекцию после гинекологического хирургического вмешательства, преждевременные роды, преждевременное рождение, инфекцию мочевыводящих путей, рецидивирующую инфекцию мочевыводящих путей, инфекцию верхних половых путей, послеродовой эндометрит, постгистерэктомическую инфекцию, инфекцию после выкидыша, инфекцию после аборта, или для увеличения количества успешных попыток лечения с целью искусственного осеменения/оплодотворения, или для профилактики перед вагинальной гинекологической операцией, который включает неразрушаемую матрицу из гидрогеля и гидрохлорид клиндамицина в контакте с матрицей, где вкладыш является пригодным для интравагинального, буккального или ректального применения у млекопитающих. Также предоставлены способы применения и изготовления вкладыша. Вкладыш обладает высокой эффективностью. 6 н. и 40 з.п. ф-лы, 2 пр., 5 табл., 1 ил.
1. Вкладыш для лечения нарушения, выбранного из группы, включающей бактериальный вагиноз, воспалительное заболевание тазовой области, эндометрит, послеоперационную инфекцию после гинекологического хирургического вмешательства, преждевременные роды, преждевременное рождение, инфекцию мочевыводящих путей, рецидивирующую инфекцию мочевыводящих путей, инфекцию верхних половых путей, послеродовой эндометрит, постгистерэктомическую инфекцию, инфекцию после выкидыша, инфекцию после аборта, или для увеличения количества успешных попыток лечения с целью искусственного осеменения/оплодотворения, или для профилактики перед вагинальной гинекологической операцией, содержащий:
неразрушаемую матрицу из гидрогеля и
гидрохлорид клиндамицина в контакте с матрицей;
где матрица из гидрогеля содержит сшитый полимер полиэтиленгликоля и уретана и
где вкладыш является пригодным для интравагинального, буккального или ректального применения у млекопитающих.
2. Вкладыш по п.1, где вкладыш является пригодным для интравагинального применения.
3. Вкладыш по п.1, где вкладыш является пригодным для буккального применения.
4. Вкладыш по п.1, где вкладыш является пригодным для интраректального применения.
5. Вкладыш по п.1, где гидрохлорид клиндамицина присутствует в количестве от приблизительно 5 до 75% мас./мас. матрицы из гидрогеля.
6. Вкладыш по п.1, где гидрохлорид клиндамицина присутствует в количестве от приблизительно 15 до 30% мас./мас. матрицы из гидрогеля.
7. Вкладыш по п.1, где гидрохлорид клиндамицина присутствует в количестве от приблизительно 20 до 25% мас./мас. матрицы из гидрогеля.
8. Вкладыш по п.1, где вкладыш содержит количество гидрохлорида клиндамицина, эквивалентное 100 мг единичной дозы клиндамицина.
9. Вкладыш по п.1, дополнительно содержащий антиоксидант.
10. Вкладыш по п.1, дополнительно содержащий бутилированный гидроксианизол в количестве от приблизительно 0,01 до 0,1% мас./мас. матрицы из гидрогеля.
11. Вкладыш по п.1, дополнительно содержащий бутилированный гидроксианизол в количестве от приблизительно 0,03 до 0,07% мас./мас. матрицы из гидрогеля.
12. Вкладыш по п.1, дополнительно содержащий устройство, адаптированное для извлечения вкладыша из влагалища или прямой кишки.
13. Вкладыш по п.1, дополнительно содержащий и находящийся в контакте с ним устройство, адаптированное для извлечения вкладыша из влагалища или прямой кишки и выбранное из группы, состоящей из линии, нити, ленты, литой петли, интегральной петли, пористой сети, пористого мешочка, плетеной трубки и их сочетания.
14. Вкладыш по п.1, дополнительно содержащий устройство, адаптированное для введения вкладыша во влагалище или прямую кишку.
15. Вкладыш по п.1, дополнительно содержащий и находящийся в контакте с ним устройство, выбранное из группы, состоящей из аппликатора, шприца, трубки, палочки и их сочетания.
16. Вкладыш по п.1, который является пригодным для интравагинального, буккального или ректального применения у человека.
17. Вкладыш по п.1, который является пригодным для интравагинального, буккального или ректального применения не у человека.
18. Вкладыш по п.1, дополнительно содержащий одно или несколько совместно вводимых веществ.
19. Вкладыш по п.1, где матрица из гидрогеля содержит сшитый полимер, имеющий соотношение гель:золь, равное 75:25 или более.
20. Вкладыш по п.1, где вкладыш проявляет профиль высвобождения лекарственного средства, по существу, такой, как представлен на фиг.1.
21. Способ лечения нарушения, выбранного из группы, включающей бактериальный вагиноз, воспалительное заболевание тазовой области, эндометрит, послеоперационную инфекцию после гинекологического хирургического вмешательства, преждевременные роды, преждевременное рождение, инфекцию мочевыводящих путей, рецидивирующую инфекцию мочевыводящих путей, инфекцию верхних половых путей, послеродовой эндометрит, постгистерэктомическую инфекцию, инфекцию после выкидыша, инфекцию после аборта, или для увеличения количества успешных попыток лечения с целью искусственного осеменения/оплодотворения, или для профилактики перед вагинальной гинекологической операцией, включающий контактирование влагалища, полости рта или прямой кишки млекопитающих с вкладышем по п.1.
22. Способ по п.21, где влагалище, полость рта или прямая кишка принадлежат женщине.
23. Способ по п.21, где указанное контактирование осуществляют для лечения или предотвращения бактериального вагиноза у женщины.
24. Способ по п.21, где указанное контактирование осуществляют для лечения или предотвращения бактериального вагиноза у женщины с известным или подозреваемым бактериальным вагинозом.
25. Способ по п.21, где указанное контактирование осуществляют для лечения или предотвращения бактериального вагиноза у женщины, находящейся в группе риска по бактериальному вагинозу.
26. Способ по п.21, где указанное контактирование является непрерывным в течение периода времени от одного часа до двух дней.
27. Способ по п.21, где указанное контактирование повторяют приблизительно от одного до четырех раз в сутки.
28. Способ по п.21, где указанное контактирование повторяют приблизительно от одного до четырех раз в сутки в течение периода времени от одного дня до одного года.
29. Способ по п.21, где контактирование является достаточным для ингибирования, по меньшей мере, одного микроорганизма во влагалище.
30. Способ по п.29, где микроорганизм представляет собой грибок.
31. Способ по п.29, где микроорганизм представляет собой бактерию.
32. Способ по п.29, где микроорганизм представляет собой дрожжи.
33. Способ по п.29, где микроорганизм представляет собой плесневый грибок.
34. Способ изготовления вкладыша по п.1, включающий контакт гидрохлорида клиндамицина с неразрушаемой матрицей из гидрогеля, где матрица из гидрогеля содержит сшитый полимер полиэтиленгликоля и уретана.
35. Способ по п.34, где указанная неразрушаемая матрица из гидрогеля находится в набухшем состоянии во время указанного контактирования.
36. Способ по п.34, где указанный гидрохлорид клиндамицина присутствует в водном или этанольном растворе во время указанного контактирования.
37. Способ по п.34, где указанный гидрохлорид клиндамицина присутствует в растворе, имеющем концентрацию гидрохлорида клиндамицина от приблизительно 0,1 до 20М.
38. Способ по п.34, дополнительно включающий контактирование недеградируемой матрицы из гидрогеля с, по меньшей мере, одним совместно вводимым веществом.
39. Способ по п.34, дополнительно включающий контактирование недеградируемой матрицы из гидрогеля с бутилированным гидроксиланизолом.
40. Способ по п.34, дополнительно включающий, после указанного контактирования, сушку матрицы из гидрогеля.
41. Упаковка, содержащая:
вкладыш по п.1 и,
по меньшей мере, один упаковочный материал, окружающий вкладыш.
42. Извлекаемое устройство, содержащее:
вкладыш по п.1 и
устройство в контакте с вкладышем и адаптированное для извлечения вкладыша из влагалища или прямой кишки.
43. Извлекаемое устройство по п.42, где устройство выбрано из группы, состоящей из линии, нити, ленты, литой петли, интегральной петли, пористой сети, пористого мешочка, плетеной трубки и их сочетания.
44. Извлекаемое устройство по п.42, дополнительно содержащее устройство, адаптированное для ввода вкладыша во влагалище или в прямую кишку.
45. Вводимое устройство, содержащее:
вкладыш по п.1 и
устройство в контакте с вкладышем и адаптированное для введения вкладыша во влагалище или в прямую кишку.
46. Вводимое устройство по п.45, где устройство выбирают из группы, состоящей из аппликатора, шприца, трубки, палочки и их сочетания.
| US 6303147 B1, 16.10.2001 | |||
| US 5017382 A, 21.05.1991. |
Авторы
Даты
2012-03-10—Публикация
2007-07-12—Подача