Изобретение относится к области биотехнологии, генной инженерии и иммунологии. Оно касается способов создания вакцинных препаратов, представляющих собой химерные белки или ДНК, содержащую последовательности генов этих химерных белков.
Множество патогенных микроорганизмов представляет угрозу здоровью населения. В частности, к таким микроорганизмам относятся вирусы (Influenza virus, HIV, Rabies vims), бактерии (M.tuberculosis, B.anthracis, C.trachomatis, S.enterica, L.pneumophila) и простейшие (Leishmania, Plasmodium). На сегодняшний день, против некоторых возбудителей (HIV, С.trachomatis) вакцины вообще не разработаны, а имеющиеся вакцины против других (M. tuberculosis: B.anthracis) недостаточно эффективны. Как показывают многочисленные исследования (Kaufman SH. 1995 Immun Infekt., Nadia R. 2008 Cellular Microbiology, Annie L. 2004 Cellular Microbiology, Balaram P.2009 Int. J. Med Microbiol.), для вакцинации против всех этих патогенов требуется формирование специфических Т-лимфоцитов к соответствующим антигенам.
Так, в настоящее время легочный туберкулез (ТБ) продолжает оставаться одним из самых распространенных инфекционных заболеваний. По данным ВОЗ ежегодно во всем мире от ТБ погибает около 2 млн человек, и около трети мировой популяции являются носителями инфекции. Заболеваемость и смертность от ТБ в России остаются одной из самых высоких в мире. Вакцина BCG остается единственной разрешенной для использования на людях вакциной против ТБ. Эта вакцина эффективно снижает заболеваемость детей диссеминированным ТБ и туберкулезным менингитом, но она не эффективна против ТБ легких у взрослых. Отсюда вытекает необходимость создания новых вакцин.
Существует несколько направлений разработки новых противотуберкулезных вакцин, альтернативных БЦЖ: субъединичные вакцины, ДНК-вакцины и живые вакцины с улучшенными свойствами. Наиболее полно в экспериментальных моделях на животных охарактеризованы субъединичные вакцины, в том числе препараты, состоящие из нескольких секретируемых белков/пептидов Mycobacterium tuberculosis (Doherty T.M. 2004 J Infect Dis.). Идентифицировано много антигенов M.tuberculosis, потенциально важных в качестве компонентов новых вакцин. К ним относятся, в частности, иммунодоминантные секретируемые антигены, присутствующие в культуральном фильтрате M.tuberculosis. Среди секретируемых антигенов M.tuberculosis лучше всего изучены антигены ESAT-6 (Early Secret Antigen Target-6), CFP-10 (culture-filtrate protein-10) и белки комплекса 85 (Ag85A, B, C).
Белки ESAT-6 и CFP-10 транслируются в составе одной рамки считывания, RD1, присутствующей в разных штаммах вирулентных микобактерий, но утраченной вакцинным штаммом BCG. Как нативные, так и рекомбинантные белки ESAT-6 и CFP-10 индуцируют синтез интерферона-гамма (ИФН-гамма, ИФН-γ) Т-лимфоцитами периферической крови инфицированных M.tuberculosis лиц (Johnson P.D. 1999 Clin. Diagn. Lab. Immunol, Berthet P.X. 1998 Microbiology), поэтому оба белка используются для разработки различных тестов серологической диагностики туберкулеза (Arend S.M. 2000 J. Infect. Dis., van Pinxteren L.A., 2000 Clin. Diagn. Lab. Immunol.).
Близкородственные Ag85A, B, C кодируются тремя отдельными генами, присутствующими во многих штаммах микобактерий, в том числе в вакцинном штамме BCG (Wiker H.G. 1992 Microbiol. Reviews). Антигены 85 также участвуют в формировании Т-клеточного ответа у лиц, инфицированных М.tuberculosis (Launois P, 1994 Infect. Immun.).
Другой серьезной проблемой являются болезни, передающиеся половым путем. Например, Chlamydia trachomatis поражает более 90 миллионов людей в год. Несмотря на многочисленные попытки создания новых вакцин против хламидий, до сих пор не удалось разработать вакцину, которая бы обеспечивала долгую защиту (Hafner L 2008 Mucosal Immunol.). Полагают, что протективный иммунный ответ против хламидий зависит от популяции Th-лимфоцитов CD4+, которые, активируя макрофаги, увеличивают их фагоцитарную и антимикробную активность (Nadia R 2008 Cellular Microbiology).
Вирус гриппа является опасным инфекционным агентом, способным вызывать пандемии мирового масштаба (Деева Э.Г. 2008 ГЭОТАР-Медиа). На сегодняшний день для вакцинации животных и человека против вируса гриппа используют аттенуированные и инактивированные вакцины, которые направлены на формирование специфических антител. Однако узкая специфичность антител делает их не эффективными против других подтипов вирусов с отличающейся антигенной структурой. Представляется перспективным создание вакцин против гриппа, которые стимулируют формирование специфической популяции Т-лимфоцитов, распознающих антигены вируса гриппа. Такие Т-лимфоциты могут активировать В-клетки, продуцирующие антитела против различных подтипов вирусов. Сочетание вакцинации узкоспецифическими «В-клеточными» вакцинами и «Т-вакцинами» с широкой специфичностью может повысить эффективность вакцинации.
Т-лимфоциты двух основных подклассов, CD4+ и CD8+, обеспечивают иммунологическое распознавание и иммунный ответ сами по себе. В частности, активированные Т-клетки, особенно CD8+ и NKLT, способны оказывать прямое цитотоксическое действие на зараженные клетки. Однако еще важнее для защиты от возбудителей способность Т-клеток осуществлять активирующие взаимодействия с В-лимфоцитами (гуморальное звено иммунитета), нейтрофилами и макрофагами (врожденное звено иммунитета). Одним из основных элементов межклеточных взаимодействий в иммунной системе служат секреция Т-клетками ряда цитокинов и экспрессия на мембране связанных лигандов к различным рецепторам. В частности, Т-клеточные цитокины INF-γ и TNFα обладают следующими свойствами:
- INF-γ активирует антибактериальные свойства макрофагов, увеличивая продукцию активных форм кислорода и азота;
- INF-γ, секретируемый Т-клетками, запускает процесс аутофагии и, таким образом, приводит к очищению от внутриклеточных паразитов;
- INF-γ индуцирует апоптоз в зараженных клетках;
- активированные макрофаги увеличивают секрецию TNF-α, который через активацию эндотелия сосудов привлекает в точку заражения клетки иммунной системы.
Для активации Т-клеток требуется представление антигенов антиген-презентирующим клеткам, приводящее к иммунологическому распознаванию, а также второй сигнал, который обеспечивает сложная система вспомогательных рецепторов и регуляторных каскадов. Известно, что TLR-рецепторы, группа рецепторов, распознающих отдельные группы молекул прокариот-паразитов, играет большую роль в активации иммунных клеток. Активируясь, они передают сигналы на такие транскрипционные факторы, как NF-kB, АР-1 и IRF, которые повышают экспрессию костимуляторных молекул (CD40, CD80, CD86), интерферонов и интерлейкинов, тем самым вводя клетку в активированное состояние. Создание искусственных или генно-инженерное использование естественных лигандов к TLR - очень перспективное направление конструирования адъювантов для вакцин. В частности, ведется работа с CpG-олигонуклеотидами, активирующими рецептор TLR9, бактериальным белком флагеллином, способным активировать рецептор TLR5 и др. (McDonald WF 2007 J Infect Dis., Huleatt JW 2007, 2008 Vaccine.).
Для презентации антигенных пептидов Т-клеткам необходим процессинг и доставка внутриклеточных антигенных молекул к поверхности антиген-презентирующих клеток. Эти процессы сопряжены с рядом рецепторов, имеющих, с одной стороны, мотивы для интернализации комплексов рецептор-антиген, а с другой стороны, способных проводить специфический сигнал при активировании. К таким мотивам относится иммунорецепторный тирозиновый активационный мотив (ITAM-мотив). Например, Fc-рецепторы способны связывать комплексы иммуноглобулин-антиген, а с помощью dectin-1 клетки способны фагоцитировать компоненты клеточной стенки грибов.
С другой стороны, доказано, что активирование TLR-рецепторов и рецепторов, содержащих ITAM-мотивы, по отдельности или на разных участках мембраны не приводит к секреции ключевых цитокинов, необходимых для формирования адаптивного иммунного ответа (Ivashkiv LB. 2008, 2009 Nat Rev Immunol, Colonna M 2003 Nat Rev Immunol., Novak N 2010 Int Arch Allergy Immunol.). Например, активация TLR2 или dectin-1 по отдельности не индуцирует увеличение IL-12p40. Однако одновременное стимулирование обоих рецепторов сильно увеличивает продукцию этого цитокина (Gantner BN 2003 J Exp Med.).
Один из подходов по созданию вакцин, приводящих к индукции Т-лимфоцитов, был реализован в создании химерного белка, состоящего из антигена и/или адьюванта на базе Fc-фрагмента антитела (Seok YJ 2010 Appi Biochem Biotechnol., Wang M 2008 Scand J Immunol.). Такие вакцины предлагалось использовать или в форме субъединичной вакцины (очищенный белок) или в форме вектора, несущего ген данного белка. Данное техническое решение, как наиболее близкое к заявляемому, выбрано за прототип (Патент №US 7,067,110 B1).
Недостатки прототипа:
1) В качестве базовой молекулы, к которой в один слитый белок добавляется антиген, адъювант, или и то и другое, используется только Fc-фрагмент антител.
2) При конструировании белка, состоящего из трех частей, в котором Fc-фрагмент располагается или в центре или в N-концевой части, теряется функциональная активность Fc-фрагмента.
3) В качестве адъювантов выступают слитые белки - Fc-адъювант, в которых в качестве адъювантной составляющей выступают такие цитокины, как: INFγ, IL-2, IL-4, IL-12, IL-18, TNF, GMCSF и CD40 лиганд. Активация же врожденного иммунного ответа (который приводит к адаптивному иммунному ответу) зависит от TLR-рецепторов, а цитокины способны только модулировать этот ответ.
4) При конструировании вакцин, состоящих из смеси двух белков - Fc-антиген и Fc-адъювант, снижаются адъювантные свойства белка Fc-адъювант, т.к. по современным иммунологическим представлениям антиген с адъювантом должны быть физически связаны (Gantner BN 2003 J Exp Med.).
Задачей предлагаемого изобретения является получение эффективной и универсальной вакцины против различных патогенов, состоящей из рекомбинантных химерных белков и кодирующих их нуклеиновых кислот, однократное введение которых приводит к формированию специфических Т-лимфоцитов.
Сущностью предлагаемого изобретения является увеличение иммуногенности химерных белков, благодаря введению двух лигандов в состав химерного белка лиганда к TLR-рецепторам и лиганда к рецепторам, сигналирующим через ITAM-мотив. Активирование TLR-рецепторов лигандом, непосредственно связанным с антигеном, приводит к индукции экспрессии костимуляторных молекул и созреванию антиген-презентирующих клеток. Такие рецепторы, как Dectin-1, Fc-рецепторы и KIR, передают сигнал через ITAM-мотивы и способствуют фагоцитозу антигенов, что в конечном итоге приводит к презентации и распознаванию антигенов Т-клетками. Таким образом, активация через TLR-рецепторы и модуляция посредством ITAM-мотив иммунного ответа при вакцинации позволяет сформировать эффективный адаптивный иммунный ответ.
Заявляемый способ имеет следующие преимущества по сравнению с аналогами и прототипом:
1) В противоположность способу-прототипу, заявляемое изобретение не имеет фиксированной базовой последовательности, вакцина состоит из антигена патогенного организма, любого лиганда к TLR-рецептору и лиганда к рецептору, проводящему сигнал через ITAM-мотив.
2) Антиген, лиганд к TLR-рецептору и лиганд рецептора, проводящего сигнал через ITAM-мотив, могут располагаться в любой части химерного белка. Выбор порядка расположения определяется с учетом функциональной активности каждого из компонентов и подбираются варианты без потери активности каждой составляющей.
3) В качестве адъювантной части в нашем изобретении выступает любой лиганд к TLR-рецептору.
4) Для модуляции иммунного ответа в заявляемом изобретении используются лиганды, взаимодействующие с рецептором, передающим сигнал через ITAM-мотив. В качестве таких лигандов выступают домены молекул MICA, Fc-фрагменты антител и домен молекулы ULBP1.
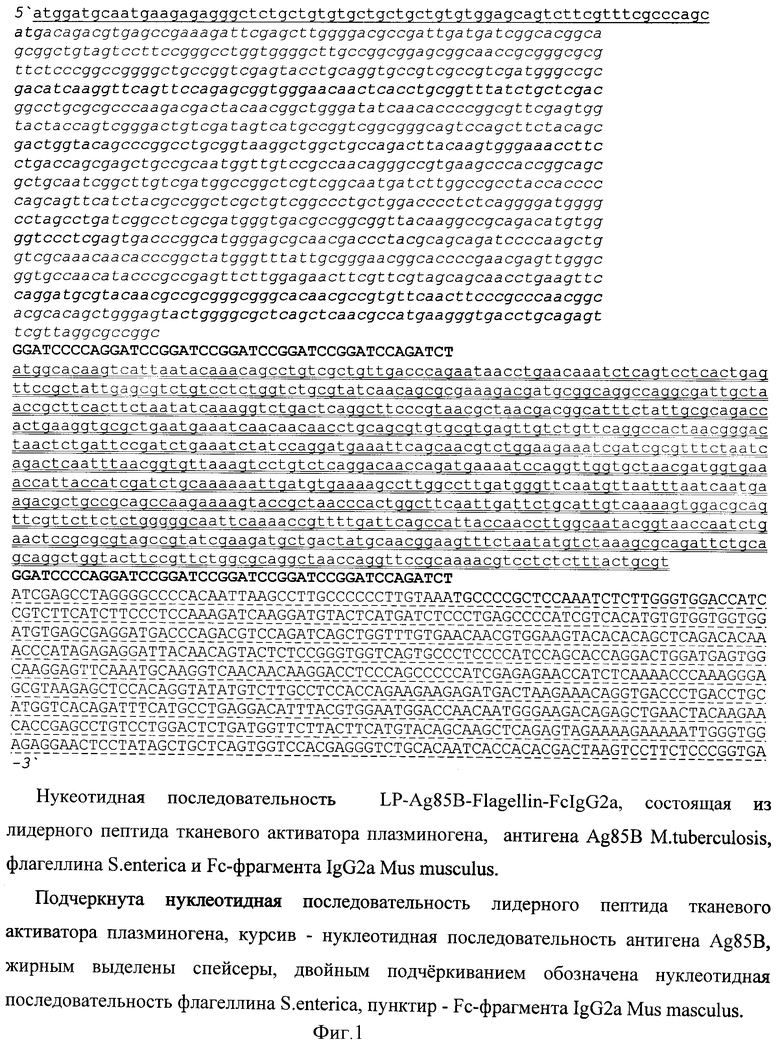
Пример 1. Создание нуклеотидной последовательности, кодирующей химерный белок против патогена на примере M.tuberculosis.
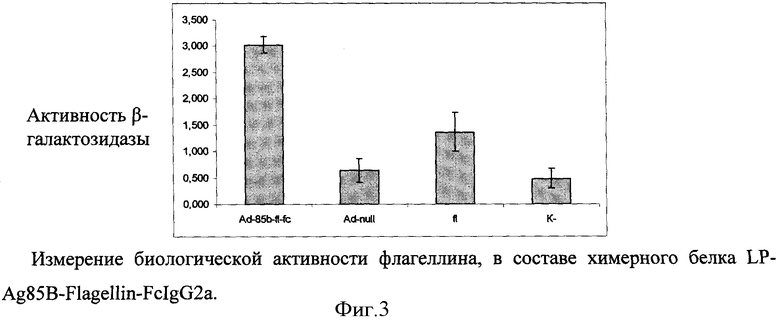
В качестве носителя действующего вещества вакцины выбран рекомбинантный аденовирусный вектор. Путем химического синтеза получают нуклеотидную последовательность LP-Ag85B-Flagellin-FcIgG2a, состоящую из лидерного пептида тканевого активатора плазминогена (tpa), антигена Ag85B M.tuberculosis, флагеллина S.enterica и Fc-фрагмента IgG2a Mus musculus (фигура 1). Методом вестерн-блота проводят оценку экспрессии и секреции данного химерного антигена (фигура 2). Измеряют биологическую активность флагеллина, в составе химерного белка на клеточной линии НЕК293, которая несет ген β-галактозидазы под NF-kB промотером и экспрессирует ген TLR5 (фигура 3). Измерение биологической активности флагеллина в составе химерного белка, экспрессируемого из аденовирусного вектора Ad-Ag85B-Fl-FcIgG2a, оценивают на клеточной линии НЕК293, которая несет ген β-галактозидазы под NF-kB промотором и экспрессирующей ген TLR5. Измерение активности β-галактозидазы производят через 24 часа после добавления исследуемого препарата к клеткам, с них удаляют всю среду и приливают буфер с субстратом для β-галактозидазы (1 мМ MgCl2; 0,25 М трис-HCl, pH 7,4; 0,02% NP4O; 2 г/л о-нитрофенил-β-Д-галактопиранозид). Уровень активности β-галактозидазы определяют спектрофотометрически (414 нм) по конверсии о-нитрофенил-β-Д-галактопиранозида.
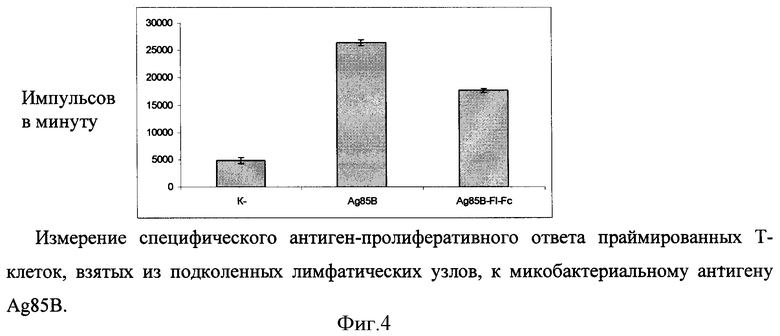
В лимфопролиферативном анализе оценивают способность химерного белка обладать иммуногенными свойствами (фигура 4). Измерение специфического антиген-пролиферативного ответа праймированных Т-клеток производят на клетках подколенных и паховых лимфатических узлов. Клетки лимфатических узлов культивируют в 96-луночных плоскодонных планшетах (Costar), в концентрации 2,5×105 клеток/лунку в 0,2 мл культуральной среды, содержащей 5% ЭТС, инкубируют с 10 мкг/мл антигена 72 часа при 37°C в 5% CO2. На последние 18 часов в лунки вносят 0,5 мкКи метил-[3Н]-тимидина. Содержимое лунок переносят на фильтры, используя полуавтоматический харвестер (Scatron, Норвегия), и оценивают включение радиоактивной метки в ядра делящихся клеток на жидкостном сцинтилляционном счетчике (Wallac, Финляндия). Результаты представляют в импульсах в минуту (имп./мин) или в индексах стимуляции 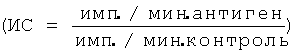 .
.
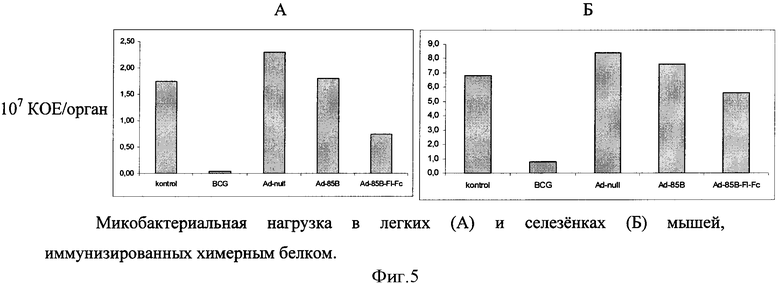
В дальнейшем исследуют способность тройного химерного белка оказывать защитные свойства против микобактериальной инфекции (фигура 5). Группы, состоящие из четырех мышей линии C57BL/6, иммунизируют рекомбинантными аденовирусами дважды с интервалом в две недели. Иммунизацию производят подкожно, в объеме 300 мкл 6·109 БОЕ/мышь. Через пять недель после второй иммунизации производят заражение мышей в/в 2,5·106 КОЕ/мышь M.tuberculosis H37Rv. Результаты оценивают по высеву микобактерий из органов.
Вакцинация данной конструкцией, кодирующей помимо микобактериального антигена, флагеллин и Fc-фрагмент иммуноглобулина, достоверно снижает количество микобактерий в легких (А) и селезенке (Б) по сравнению с контрольными группами. Таким образом, получен рекомбинантный химерный антиген, способный оказывать протективные свойства против инфекции M.tuberculosis.
Пример 2. Создание нуклеотидной последовательности, кодирующей химерный белок против патогена на примере B.anthracis.
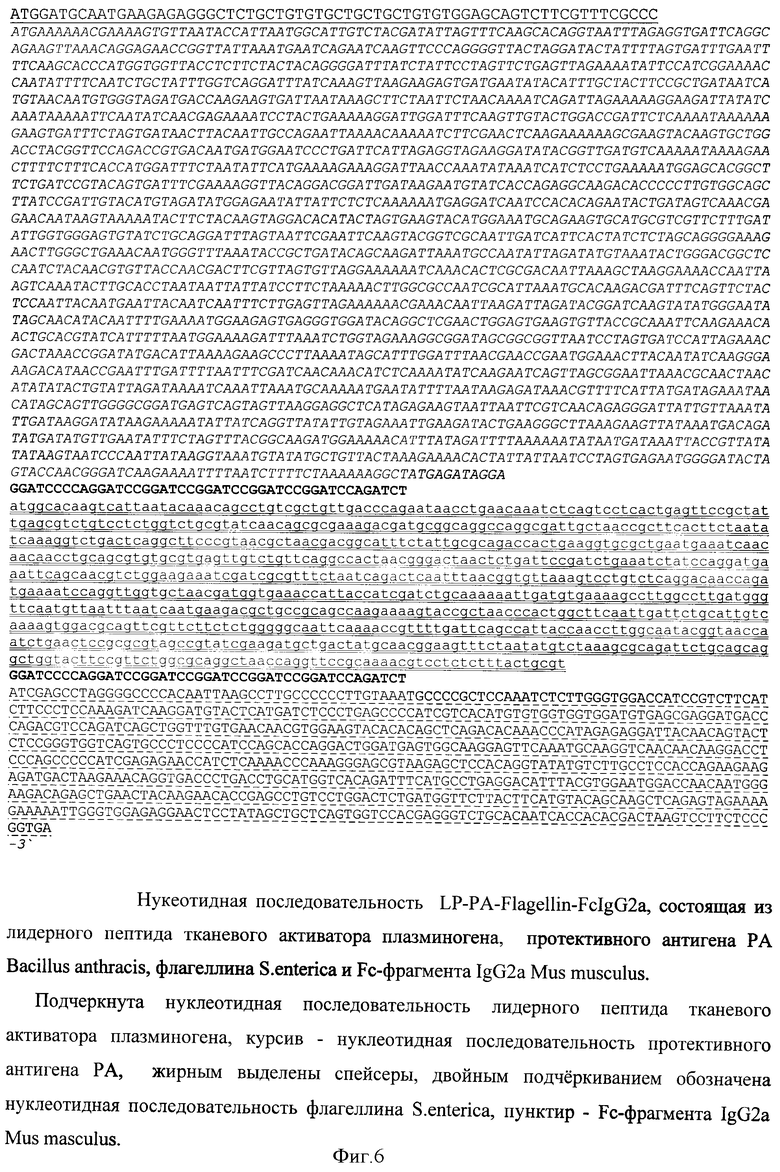
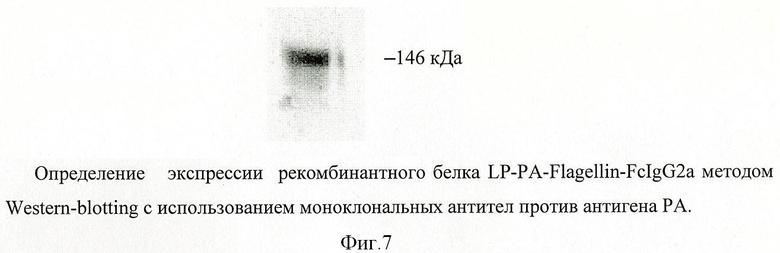
В качестве носителя действующего вещества вакцины выбран рекомбинантный аденовирусный вектор и плазмида pUC19. Путем химического синтеза получают нуклеотидную последовательность LP-PA-Flagellin-FcIgG2a, состоящую из лидерного пептида тканевого активатора плазминогена (tpa), протективного антигена B.anthracis, флагеллина S.enterica и Fc-фрагмента IgG2a Mus musculus (фигура 6). Методом вестерн-блота проводят оценку экспрессии и секреции данного химерного антигена (фигура 7). Измеряют биологическую активность флагеллина, в составе химерного белка на клеточной линии НЕК293, которая несет ген β-галактозидазы под NF-kB промотером и экспрессирует ген TLR5 (фигура 8). Измерение биологической активности флагеллина в составе химерного белка, экспрессируемого из аденовирусного вектора Ad-PA-Fl-FdgG2a, оценивают на клеточной линии НЕК293, которая несет ген β-галактозидазы под NF-kB промотером и экспрессирующей ген TLR5. Измерение активности β-галактозидазы производят через 24 часа после добавления исследуемого препарата к клеткам, с них удаляют всю среду и приливают буфер с субстратом для β-галактозидазы (1 мМ MgCl2; 0,25 М трис-HCl, pH 7,4; 0,02% NP4O; 2 г/л o-нитрофенил-β-Д-галактопиранозид). Уровень активности β-галактозидазы определяют спектрофотометрически (414 нм) по конверсии о-нитрофенил-β-Д-галактопиранозида.
В лимфопролиферативном анализе оценивают способность химерного белка обладать иммуногенными свойствами (фигура 9). Измерение специфического антигенпролиферативного ответа праймированных Т-клеток производят на клетках подколенных и паховых лимфатических узлов. Клетки лимфатических узлов культивируют в 96-луночных плоскодонных планшетах (Costar), в концентрации 2,5×105 клеток/лунку в 0,2 мл культуральной среды, содержащей 5% ЭТС, инкубируют с 10 мкг/мл антигена 72 часа при 37°C в 5% CO2. На последние 18 часов в лунки вносят 0,5 мкКи метил-[3Н]-тимидина. Содержимое лунок переносят на фильтры, используя полуавтоматический харвестер (Scatron, Норвегия), и оценивают включение радиоактивной метки в ядра делящихся клеток на жидкостном сцинтилляционном счетчике (Wallac, Финляндия). Результаты представляют в импульсах в минуту (имп./мин) или в индексах стимуляции 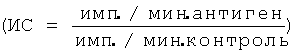 .
.
В дальнейшем исследуют способность тройного химерного белка оказывать защитные свойства против введения летального токсина В.anthracis. Группы, состоящие из десяти мышей линии Balb/c, иммунизируют рекомбинантными аденовирусами Ad-null и Ad-LP-PA-Flagellin-FcIgG2a. Иммунизацию производят внутримышечно, в объеме 50 мкл 109 БОЕ/мышь. Плазмидную ДНК вводят внутримышечно, в объеме 50 мкл 100 мкг/мышь. Через четыре недели после иммунизации вводят 85 млг летального токсина B.anthracis внутривенно в объеме 100 мкл. Результаты оценивают по выживанию мышей (фигура 10).
Вакцинация рекомбинантым аденовирусом, кодирующим ген тройного химерного белка, защищает 80% мышей от гибели. Вакцинация плазмидной ДНК защищает 50% мышей. Таким образом, получен рекомбинантный химерный антиген, способный оказывать протективные свойства против инфекции B.anthracis.
Пример 3. Создание нуклеотидной последовательности, кодирующей химерный белок против патогена на примере C.trachomatis.
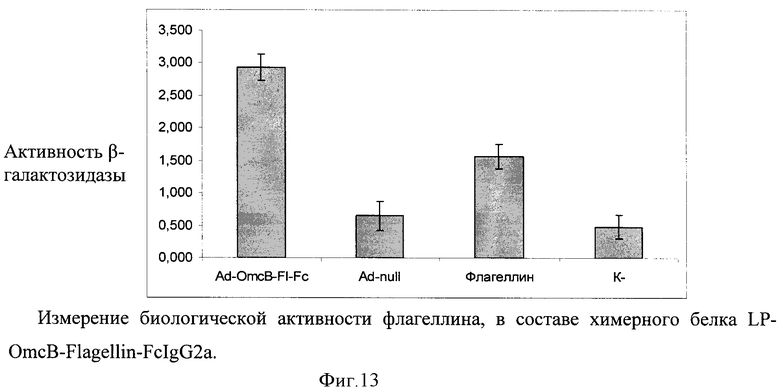
В качестве носителя действующего вещества вакцины выбран рекомбинантный аденовирусный вектор. Путем химического синтеза получают нуклеотидную последовательность LP-OmcB-Flagellin-FcIgG2a, состоящую из лидерного пептида тканевого активатора плазминогена (tpa), антигена ОmсВ C.trachomatis, флагеллина S.enterica и Fc-фрагмента IgG2a Mus musculus (фигура 11). Методом вестерн-блота проводят оценку экспрессии и секреции данного химерного антигена (фигура 12). Измеряют биологическую активность флагеллина, в составе химерного белка на клеточной линии НЕК293, которая несет ген β-галактозидазы под NF-kB промотером и экспрессирует ген TLR5 (фигура 13). Измерение биологической активности флагеллина в составе химерного белка экспрессируемого из аденовирусного вектора Ad-PA-Fl-FcIgG2a оценивают на клеточной линии НЕК293, которая несет ген β-галактозидазы под NF-kB промотером и экспрессирующей ген TLR5. Измерение активности β-галактозидазы производят через 24 часа после добавления исследуемого препарата к клеткам, с них удаляют всю среду и приливают буфер с субстратом для β-галактозидазы (1 мМ MgCl2; 0,25 М трис-HCl, pH 7,4; 0,02% NP4O; 2 г/л о-нитрофенил-β-Д-галактопиранозид). Уровень активности β-галактозидазы определяют спектрофотометрически (414 нм) по конверсии о-нитрофенил-β-Д-галактопиранозида.
В лимфопролиферативном анализе оценивают способность химерного белка обладать иммуногенными свойствами (фигура 14). Измерение специфического антиген-пролиферативного ответа праймированных Т-клеток производят на клетках подколенных и паховых лимфатических узлов. Клетки лимфатических узлов культивируют в 96-луночных плоскодонных планшетах (Costar), в концентрации 2,5×105 клеток/лунку в 0,2 мл культуральной среды, содержащей 5% ЭТС, инкубируют с 10 мкг/мл антигена 72 часа при 37°C в 5% CO2. На последние 18 часов в лунки вносят 0,5 мкКи метил-[3Н]-тимидина. Содержимое лунок переносят на фильтры, используя полуавтоматический харвестер (Scatron, Норвегия), и оценивают включение радиоактивной метки в ядра делящихся клеток на жидкостном сцинтилляционном счетчике (Wallac, Финляндия). Результаты представляют в импульсах в минуту (имп./мин) или в индексах стимуляции 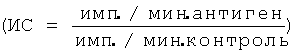 .
.
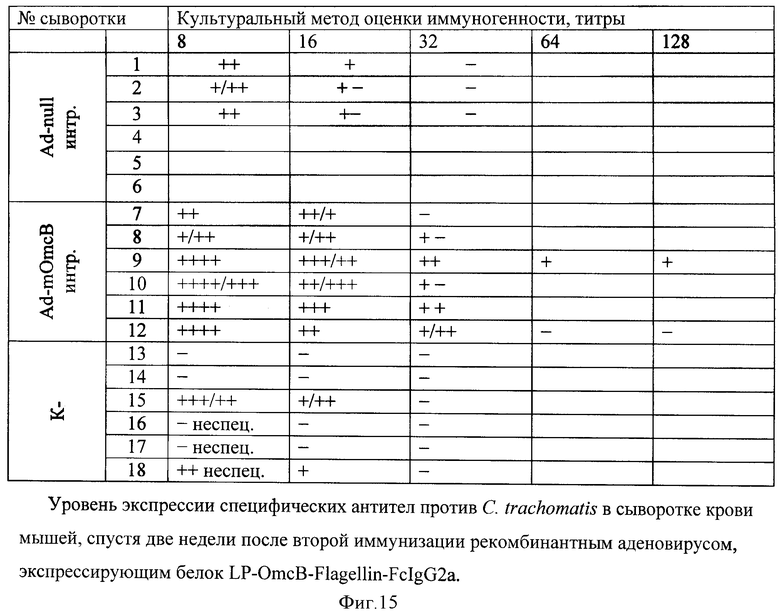
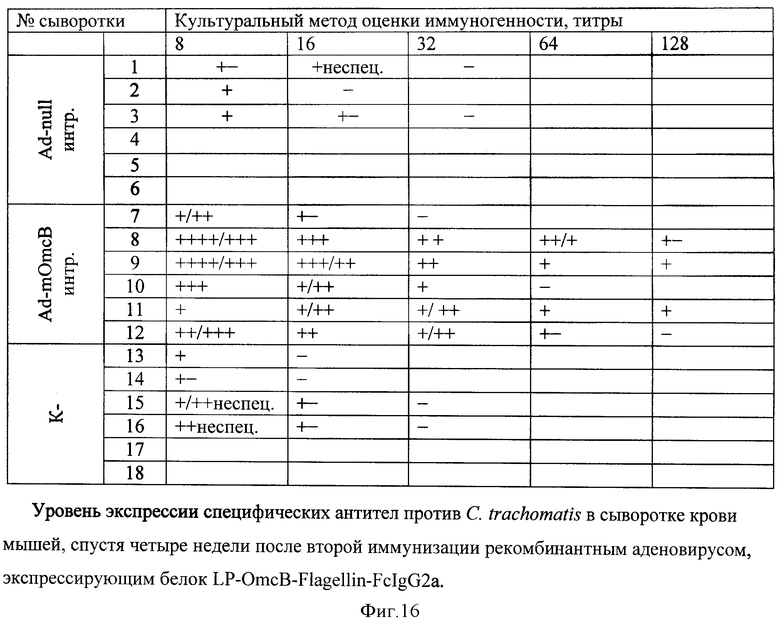
В дальнейшем исследуют способность тройного химерного белка вызывать индукцию и синтез специфических антител против C.trachomatis. Группы, состоящие из шести мышей линии Balb/c, иммунизируют дважды рекомбинантными аденовирусами Ad-null и Ad-OmcB-PA-Flagellm-FcIgG2a. Иммунизацию производят интранозально, в объеме 50 мкл 6,8·109 БОЕ/мышь. Через две недели после иммунизации берут забор крови у экспериментальных животных и в сыворотках крови культуральным методом определяют титры специфических антител к антигену OmcB С.trachomatis. Иммунногенность оценивают по титру антител: диагностический титр от 1:32 и выше (фигура 15-16).
Вакцинация рекомбинантным аденовирусом, кодирующим ген тройного химерного белка, вызывает синтез специфических антител против антигена OmcB C.trachomatis. Таким образом, получен рекомбинантный аденовирус, способный секретировать тройной химерный антиген, на который вырабатываются специфические антитела, взаимодействующие с поверхностным антигеном C.trachomatis.
Пример 4. Создание нуклеотидной последовательности, кодирующей химерный белок против патогена на примере Influenza virus.
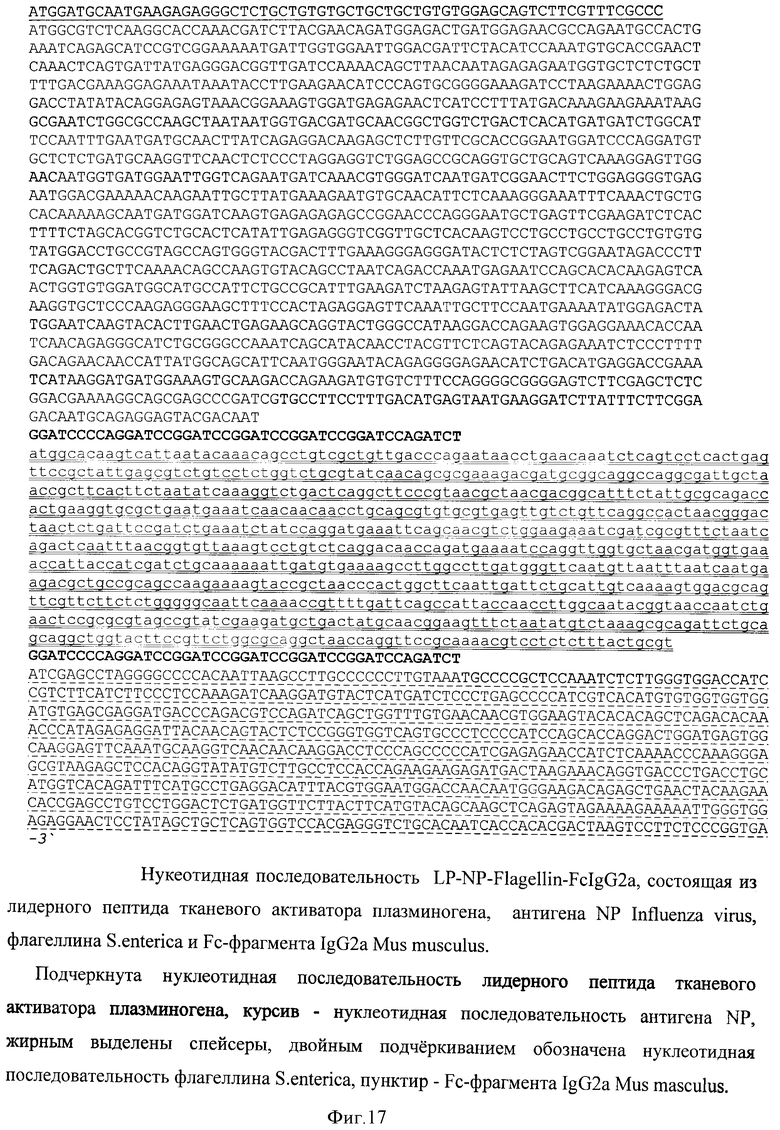
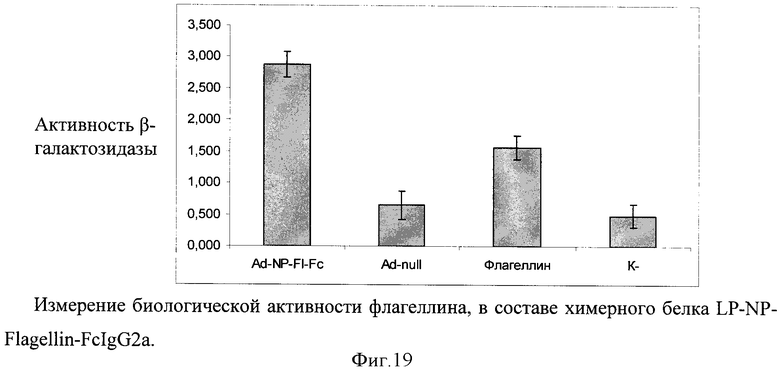
В качестве носителя действующего вещества вакцины выбран рекомбинантный аденовирусный вектор. Путем химического синтеза получают нуклеотидную последовательность LP-NP-Flagellin-FcIgG2a, состоящую из лидерного пептида тканевого активатора плазминогена (tpa), антигена NP Influenza vims, флагеллина S.enterica и Fc-фрагмента IgG2a Mus musculus (фигура 17). Методом вестерн-блота проводят оценку экспрессии и секреции данного химерного антигена (фигура 18). Измеряют биологическую активность флагеллина в составе химерного белка на клеточной линии НЕК293, которая несет ген β-галактозидазы под NF-kB промотером и экспрессирует ген TLR5 (фигура 19). Измерение биологической активности флагеллина в составе химерного белка экспрессируемого из аденовирусного вектора Ad-NP-Fl-FcIgG2a оценивают на клеточной линии НЕК293, которая несет ген β-галактозидазы под NF-kB промотером и экспрессирующей ген TLR5. Измерение активности β-галактозидазы производят через 24 часа после добавления исследуемого препарата к клеткам, с них удаляют всю среду и приливают буфер с субстратом для β-галактозидазы (1 мМ MgCl2; 0,25 М трис-HCl, pH 7,4; 0,02% NP4O; 2 г/л о-нитрофенил-β-Д-галактопиранозид). Уровень активности β-галактозидазы определяют спектрофотометрически (414 нм) по конверсии о-нитрофенил-β-Д-галактопиранозида.
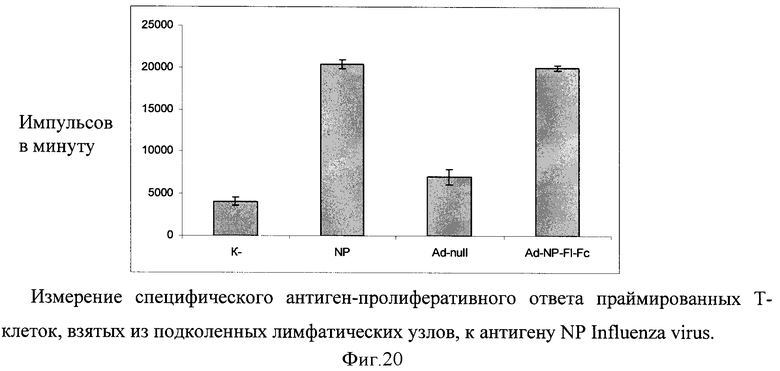
В лимфопролиферативном анализе оценивают способность химерного белка обладать иммуногенными свойствами (фигура 20). Измерение специфического антиген-пролиферативного ответа праймированных Т-клеток производят на клетках подколенных и паховых лимфатических узлов. Клетки лимфатических узлов культивируют в 96-луночных плоскодонных планшетах (Costar), в концентрации 2,5×105 клеток/лунку в 0,2 мл культуральной среды, содержащей 5% ЭТС, инкубируют с 10 мкг/мл антигена 72 часа при 37°C в 5% CO2. На последние 18 часов в лунки вносят 0,5 мкКи метил-[3Н]-тимидина. Содержимое лунок переносят на фильтры, используя полуавтоматический харвестер (Scatron, Норвегия), и оценивают включение радиоактивной метки в ядра делящихся клеток на жидкостном сцинтилляционном счетчике (Wallac, Финляндия). Результаты представляют в импульсах в минуту (имп./мин) или в индексах стимуляции 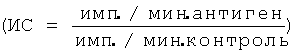 .
.
В дальнейшем исследуют способность тройного химерного белка оказывать защитные свойства против Influenza virus. Группы, состоящие из десяти мышей линии Balb/c, иммунизируют дважды с интервалом в две недели рекомбинантными аденовирусами Ad-null и Ad-LP-NP-Flagellin-FcIgG2a. Иммунизацию производят интранозально, в объеме 50 мкл 109 БОЕ/мышь. Через четыре недели после иммунизации мышей заражают Influenza virus A/USSR/90/1977(H1N1), интранозально в объеме 100 мкл. Результаты оценивают по выживанию мышей (фигура 21).
Вакцинация рекомбинантым аденовирусом, кодирующим ген тройного химерного белка, защищает 60% мышей от гибели. Таким образом, получен рекомбинантный химерный антиген, способный оказывать протективные свойства против инфекции Influenza virus.
Пример 5. Создание нуклеотидной последовательности, кодирующей химерный белок против патогена на примере Influenza virus.
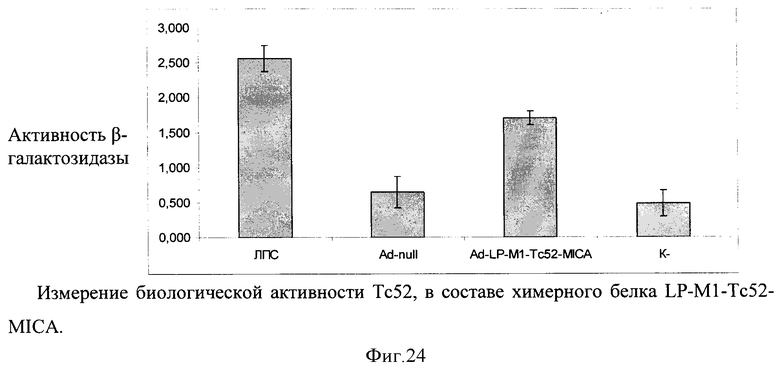
В качестве носителя действующего вещества вакцины выбран рекомбинантный аденовирусный вектор. Путем химического синтеза получают нуклеотидную последовательность LP-M1-Tc52-MICA, состоящую из лидерного пептида тканевого активатора плазминогена (tpa), антигена M1 Influenza virus, Tc52 Trypanosoma cruzi и MICA Homo sapiens (фигура 22). Методом вестерн-блота проводят оценку экспрессии и секреции данного химерного антигена (фигура 23). Измеряют биологическую активность флагеллина, в составе химерного белка на клеточной линии НЕК293, которая несет ген β-галактозидазы под NF-kB промотером и экспрессирует ген TLR2/6 (фигура 24). Измерение биологической активности флагеллина в составе химерного белка экспрессируемого из аденовирусного вектора Ad-M1-Tc52-MICA оценивают на клеточной линии НЕК293, которая несет ген β-галактозидазы под NF-kB промотером и экспрессирующей ген TLR2/6. Измерение активности β-галактозидазы производят через 24 часа после добавления исследуемого препарата к клеткам, с них удаляют всю среду и приливают буфер с субстратом для β-галактозидазы (1 мМ MgCl2; 0,25 М трис-HCl, pH 7,4; 0,02% NP4O; 2 г/л о-нитрофенил-β-Д-галактопиранозид). Уровень активности β-галактозидазы определяют спектрофотометрически (414 нм) по конверсии о-нитрофенил-β-Д-галактопиранозида.
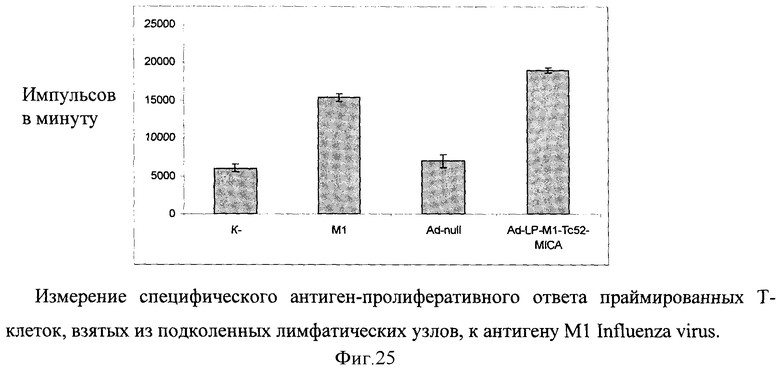
В лимфопролиферативном анализе оценивают способность химерного белка обладать иммуногенными свойствами (фигура 25). Измерение специфического антиген-пролиферативного ответа праймированных Т-клеток производят на клетках подколенных и паховых лимфатических узлов. Клетки лимфатических узлов культивируют в 96-луночных плоскодонных планшетах (Costar), в концентрации 2,5×105 клеток/лунку в 0,2 мл культуральной среды, содержащей 5% ЭТС, инкубируют с 10 мкг/мл антигена 72 часа при 37°C в 5% CO2. На последние 18 часов в лунки вносят 0,5 мкКи метил-[3Н]-тимидина. Содержимое лунок переносят на фильтры, используя полуавтоматический харвестер (Scatron, Норвегия), и оценивают включение радиоактивной метки в ядра делящихся клеток на жидкостном сцинтилляционном счетчике (Wallac, Финляндия). Результаты представляют в импульсах в минуту (имп./мин) или в индексах стимуляции 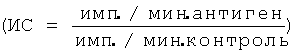 .
.
Таким образом, получен рекомбинантный аденовирус, экспрессирующий химерный антиген М1-Тс52-МIСА, способный обладать иммуногенными свойствами.
Пример 6. Создание нуклеотидной последовательности, кодирующей химерный белок против патогена на примере Influenza virus.
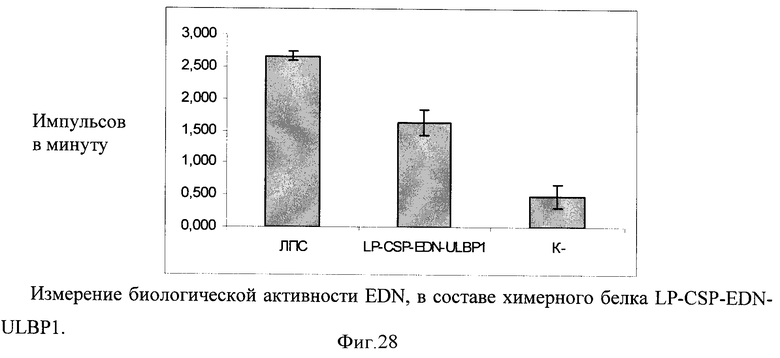
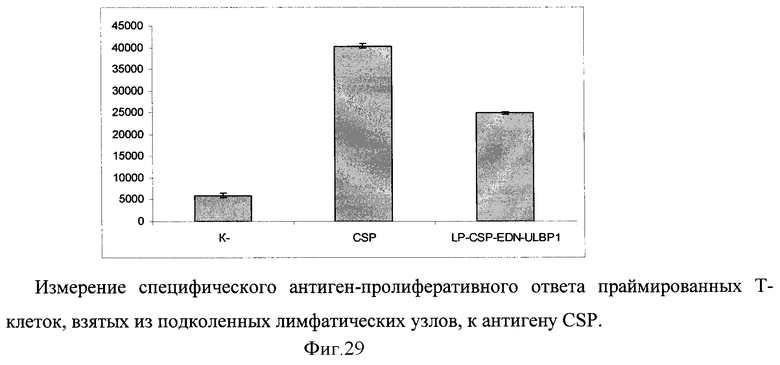
Путем химического синтеза получают нуклеотидную последовательность LP-CSP-EDN-ULBP1, состоящую из лидерного пептида тканевого активатора плазминогена (tpa), антигена CSP Plasmodium malariae, нейротоксина эозинофилов - EDN Homo sapiens и ULBP1 Homo sapiens (фигура 26). Методом вестерн-блота проводят оценку экспрессии и секреции данного химерного антигена (фигура 27). Измеряют биологическую активность флагеллина, в составе химерного белка на клеточной линии НЕК293, которая несет ген β-галактозидазы под NF-kB промотером и экспрессирует ген TLR2/6 (фигура 28). Измерение биологической активности EDN в составе химерного белка оценивают на клеточной линии НЕК293, которая несет ген β-галактозидазы под NF-kB промотером и экспрессирующей ген TLR2/6. Измерение активности β-галактозидазы производят через 24 часа после добавления исследуемого препарата к клеткам, с них удаляют всю среду и приливают буфер с субстратом для β-галактозидазы (1 мМ MgCl2; 0,25 М трис-HCl, pH 7,4; 0,02% NP4O; 2 г/л о-нитрофенил-β-Д-галактопиранозид). Уровень активности β-галактозидазы определяют спектрофотометрически (414 нм) по конверсии о-нитрофенил-β-Д-галактопиранозида.
В лимфопролиферативном анализе оценивают способность химерного белка обладать иммуногенными свойствами (фигура 29). Измерение специфического антиген-пролиферативного ответа праймированных Т-клеток производят на клетках подколенных и паховых лимфатических узлов. Клетки лимфатических узлов культивируют в 96-луночных плоскодонных планшетах (Costar), в концентрации 2,5×105 клеток/лунку в 0,2 мл культуральной среды, содержащей 5% ЭТС, инкубируют с 10 мкг/мл антигена 72 часа при 37°C в 5% CO2. На последние 18 часов в лунки вносят 0,5 мкКи метил-[3Н]-тимидина. Содержимое лунок переносят на фильтры, используя полуавтоматический харвестер (Scatron, Норвегия), и оценивают включение радиоактивной метки в ядра делящихся клеток на жидкостном сцинтилляционном счетчике (Wallac, Финляндия). Результаты представляют в импульсах в минуту (имп./мин) или в индексах стимуляции 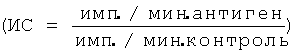 .
.
Таким образом, получен рекомбинантный химерный белок LP-CSP-EDN-ULBP1, несущий в своем составе антиген CSP Plasmodium malariae, обладающий иммуногенными свойствами.
Таким образом, заявляемый способ позволяет получать вакцинные препараты против различных патогенов, обладающие инммуногенными и протективными свойствами.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОТИВОГРИППОЗНАЯ ВАКЦИНА ШИРОКОГО СПЕКТРА ДЕЙСТВИЯ ПРОТИВ ПТИЧЬЕГО ГРИППА А НА ОСНОВЕ ЭКТОДОМЕНА БЕЛКА М2 | 2014 |
|
RU2571944C1 |
| РЕКОМБИНАНТНАЯ ТРЕХВАЛЕНТНАЯ ВАКЦИНА ОТ ГРИППА ЧЕЛОВЕКА | 2012 |
|
RU2485973C1 |
| УЛУЧШЕННЫЙ ВЕКТОР, ЭКСПРЕССИРУЮЩИЙ TOLL-ПОДОБНЫЙ РЕЦЕПТОР И АГОНИСТ, И ПРИМЕНЕНИЕ В ТЕРАПИИ РАКА | 2014 |
|
RU2682762C2 |
| Гибридный белок, ДНК, генетическая конструкция, рекомбинантная клетка, вакцина на основе гибридного белка для профилактики и лечения туберкулеза (варианты) | 2015 |
|
RU2615440C2 |
| КОМПОЗИЦИЯ ДЛЯ УСИЛЕНИЯ ЭКСПРЕССИИ ТРАНСГЕНА В ЭУКАРИОТИЧЕСКИХ КЛЕТКАХ И СПОСОБ УВЕЛИЧЕНИЯ ПРОДУКЦИИ ЦЕЛЕВОГО БЕЛКА, КОДИРУЕМОГО ТРАНСГЕНОМ | 2013 |
|
RU2546249C2 |
| Генотерапевтический препарат FCU1-BsFm/PP для лечения солидных опухолей | 2023 |
|
RU2824977C1 |
| ПРОТИВООПУХОЛЕВЫЕ ЭФФЕКТЫ ВИРУСНОГО ВЕКТОРА, КОДИРУЮЩЕГО ТОЛЛ-ПОДОБНЫЙ РЕЦЕПТОР И АГОНИСТ ТОЛЛ-ПОДОБНОГО РЕЦЕПТОРА | 2017 |
|
RU2741228C2 |
| Противохламидийная вакцина и способ ее получения | 2016 |
|
RU2676768C2 |
| Способ получения химерного рекомбинантного белка fliC:pagN | 2015 |
|
RU2627602C2 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2016 |
|
RU2709015C2 |










Изобретение относится к области биотехнологии, генной инженерии и иммунологии. Способ получения рекомбинантной вакцины предусматривает создание химерных белков или ДНК, экспрессирующих гены этих химерных белков, состоящих из трех или более функциональных частей. Эти части являются действующим веществом вакцины и представлены антигеном патогенного микроорганизма, лигандом для TLR-рецепторов и лигандами для рецепторов, проводящих сигнал через ITAM-мотив. Химерные белки напрямую используют в качестве вакцины для иммунизации человека и животных. Для вакцин, представляющих собой ДНК, кодирующую химерный белок, в качестве носителя используют рекомбинантные аденовирусные частицы и/или плазмидную ДНК. Изобретение предназначено для вакцинации при проведении профилактических мероприятий по борьбе с инфекционными заболеваниями. 29 ил.
Способ получения рекомбинантной вакцины, включающий конструирование нуклеотидной последовательности, кодирующей химерный белок, или аминокислотной последовательности, характеризующей такой химерный белок, где химерный белок состоит из антигена патогенного организма, лиганда к рецепторам, проводящим сигнал через ITAM-мотив - Fc-фрагмента антител, отличающийся тем, что в состав нуклеотидной последовательности, кодирующей химерный белок, включают последовательность, кодирующую лиганд к TLR-рецепторам, или в состав аминокислотной последовательности, характеризующей такой химерный белок, включают аминокислотную последовательность лиганда к TLR-рецепторам, и где в качестве лигандов, проводящих сигнал через ITAM-мотив, используют домены MICA или ULBP1, при этом нуклеотидную последовательность присоединяют к носителю, который представляет собой плазмидную ДНК или рекомбинантную аденовирусную частицу.
| US 7067110 B1, 27.06.2006 | |||
| SEOK Y.J | |||
| et al | |||
| ПРИБОР ДЛЯ СЪЕМКИ СЛОЖНЫХ ПРОФИЛЕЙ, ПРЕИМУЩЕСТВЕННО ГРЕБНЫХ ВОЗДУШНЫХ И ВОДЯНЫХ ВИНТОВ | 1922 |
|
SU733A1 |
| Appl Biochem Biotechnol | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| WANG M | |||
| et al | |||
| The cholera toxin В subunit | |||
Авторы
Даты
2012-03-10—Публикация
2010-06-23—Подача