Настоящее изобретение относится к фармацевтике и медицине, а именно к новым физиологически активным конъюгатам гранулоцитарного колониестимулирующего фактора (Г-КСФ), в частности к новым конъюгатам Г-КСФ с полиэтиленгликолем, пригодным для медицинского применения, например для лечения лейкопений, преимущественно различных видов нейтропений у больных, получающих миелосупрессивную химиотерапию при онкологических заболеваниях, для лечения миелодиспластического синдрома, улучшения переносимости иммуносупрессивных препаратов при пересадке костного мозга, улучшения иммунного статуса у пациентов, страдающих СПИД и другими инфекциями.
Г-КСФ является гемопоэтическим фактором роста, стимулирующим пролиферацию, дифференцировку и созревание гранулоцитов (Metcalf, 1992). Введение экзогенного Г-КСФ вызывает быстрое, специфичное и дозозависимое увеличение нейтрофилов в периферической крови (Welte et al., 1985; Hartung et al., 1995).
Ген Г-КСФ человека был клонирован и экспрессирован в бактериальных и животных клетках, в результате были получены и очищены различные препараты рекомбинантных Г-КСФ (Nagata et al., 1986; Souza et al., 1986; Komatsu et al., 1987).
Известны два препарата рекомбинантных Г-КСФ человека - филграстим и ленограстим, полученные из клеток E.coli и клеток китайского хомячка соответственно. Филграстим состоит из 175 аминокислот, имеет ту же аминокислотную последовательность, что и природный белок, но содержит дополнительный остаток метионина на N-конце молекулы. Ленограстим состоит из 174 аминокислот, его аминокислотная последовательность полностью соответствует таковой природного Г-КСФ человека.
Лекарственные препараты, содержащие рекомбинантный человеческий Г-КСФ (рчГ-Г-КСФ), применяются в клинической практике для лечения различных лейкопений, в частности нейтропений, возникающих после химиотерапии, идиопатической, врожденной и циклической нейтропений, для лечения тяжелых инфекций в комбинации с антибиотиками, а также нейтропений у больных СПИД (Molineux, 2004).
При клиническом применении эффективность действия препаратов, содержащих рчГ-КСФ, ограничена быстрым всасыванием из подкожных тканей, относительно низкой стабильностью, коротким периодом полувыведения, высокой иммуногенностью и токсичностью (Машковский, 2006; de Wit et al., 1996). В результате, использование рчГ-КСФ требует ежедневного введения и проведения неоднократного мониторинга эффективности, в данном случае - клинического анализа крови с подсчетом лейкоцитарной формулы.
Терапевтическая эффективность препаратов Г-КСФ может быть повышена при использовании препаратов пролонгированного действия, в которых нативная молекула белка химически связана с монометокси полиэтиленгликолем (мПЭГ). ПЭГилирование Г-КСФ приводит к улучшению фармакокинетики; увеличению времени полувыведения, уменьшению клиренса, снижению колебаний концентрации в крови; снижению иммуногенности и токсичности, увеличению активности in vivo, увеличению стабильности (Molineux, 2003; Molineux, 2004).
Биологические свойства конъгатов ПЭГ-Г-КСФ в значительной степени зависят от молекулярной массы и типа используемых активированных мПЭГ, функциональные группы которых различаются по способности модифицировать различные аминокислотные остатки белка и по типу образуемых с белком химических связей (Roberts et al., 2002). При получении ПЭГилированных белков наиболее широкое применение нашли активированные мПЭГ, способные связываться со свободными аминогруппами белков (сукцинимидилкарбонатные, сукцинимидилсукцинатные, трезилатные и др).
Из уровня техники известны различные конъюгаты ПЭГ-Г-КСФ.
В патенте US 2007/0014762 описано получение конъюгатов ПЭГ-Г-КСФ с использованием различных активированных мПЭГ с молекулярной массой 5000 Да, в частности мПЭГ-сукцинимидил бутаноата, мПЭГ-сукцинимидил пропионата, мПЭГ-сукцинимидил а-метилбутаноата. Для получения конъюгата использовали рчГ-КСФ, полученный из клеток СНО (ленограстим), содержащий несколько точечных замен аминокислот в различных положениях. Реакцию конъюгирования проводили при рН 7-9. Полученный конъюгат ПЭГ-Г-КСФ состоял из нескольких позиционных изомеров, в которых ПЭГ связывался с эпсилон-аминогруппами лизинов и с альфа-аминогруппой N-концевой аминокислоты. Очистку полученного конъюгата проводили при помощи метода ионообменной хроматографии с использованием сорбента SP-сефароза. Данные об активности и чистоте полученных конъюгатов в патенте отсутствуют.
Недостатками полученного конъюгата являются:
1. Низкая молекулярная масса мПЭГ, присоединенного к Г-КСФ.
2. Образование нескольких позиционных изомеров, в которых ПЭГ был связан с молекулой Г-КСФ через свободные аминогруппы различных лизинов и N-концевой аминокислоты.
В патенте ЕР 0401384 описаны конъюгаты ПЭГ-Г-КСФ, полученные при использовании мПЭГ линейной и разветвленной структуры с молекулярной массой 4500-10000 Да, активированных различными реактивными группами (сукцинимидилкарбонатной, триазинхлоридной, и полиоксиэтилендиаминовой). Полученные конъюгаты ПЭГ-Г-КСФ обладали пролонгированным действием in vivo, причем степень пролонгации зависела от молекулярной массы присоединенного ПЭГ. Время полужизни конъюгата ПЭГ(10000)-Г-КСФ и немодифицированного Г-КСФ составляло 7,05 и 1,79 час соответственно.
Недостатками полученных конъюгатов являются:
1. Сукцинимидилкарбонатные производные мПЭГ могут связываться со всеми стерически доступными свободными аминогруппами белка, в результате чего получаемые конъюгаты ПЭГ-Г-КСФ состоят из нескольких позиционных изомеров.
2. Триазинхлоридные производные мПЭГ помимо свободных аминогрупп способны связываться с функциональными группами других аминокислот - серина, тирозина, треонина и гистидина, что приводит к появлению множества изомеров, часть из которых характеризуется нестабильной связью. Более того, триазиновые производные в настоящее время не используются из-за их высокой токсичности (Veronese & Pasut, 2005).
В патенте ЕР 0335423 описаны конъюгаты Г-КСФ с триазинхлоридным производным мПЭГ ПЭГ с молекулярной массой от 300-30000 Да. Полученные конъюгаты ПЭГ-Г-КСФ обладали пролонгированным действием, их удельная специфическая активность составляла от 11 до 60% от активности немодифицированного Г-ГКСФ.
Недостатками полученных конъюгатов являются:
1. Низкая удельная специфическая активность.
2. Использование триазинхлоридных производных мПЭГ, в результате чего образуется целый ряд позиционных изомеров, часть из которых характеризуется нестабильной связью. Более того, триазиновые производные в настоящее время не используются из-за их высокой токсичности (Veronese & Pasut, 2005).
В качестве прототипа настоящего изобретения был выбран конъюгат ПЭГ-Г-КСФ, описанный в патенте US 5824784, (пример 2). В патенте описана реакция восстановительного алкилирования Г-КСФ с использованием линейного мПЭГ с молекулярной массой от 6000 до 25 Да, активированного пропиональдегидной группой (ALD-mPEG). Реакцию ПЭГилирования проводили при рН 5. В этих условиях присоединение ПЭГ происходило избирательно через альфа-аминогруппу N-концевой аминокислоты. По описанному методу был получен конъюгат Г-КСФ с ПЭГ с молекулярной массой 20 кДа, который в настоящее время применяется в клинике для лечения нейтропений различной этиологии - препарат «Неуластим» (фирма «F.Hoffmann-La Roche», Швейцария). Очистку полученного конъюгата ПЭГ-Г-КСФ проводили при помощи ионообменной хроматографии на колонке с сорбентом «S-Сефароза HP». Биологическая активность полученного очищенного конъюгата ПЭГ-Г-КСФ составляла 68% от нативного Г-КСФ. Содержание немодифицированного Г-КСФ в полученном конъюгате составляло не более 5%. Фармакокинетические параметры полученного конъюгата были лучше, чем у немодифицированного Г-КСФ. В экспериментах на животных было показано, что введение конъгата ПЭГ-Г-КСФ приводило к повышению уровня лейкоцитов в крови, причем конъюгат ПЭГ-Г-КСФ обладал более пролонгированным действием по сравнению с немодифицированным Г-КСФ. При однократном введении конъюгата ПЭГ-Г-КСФ, содержание лейкоцитов в крови животных достигало максимума через 1 день после введения, этот уровень сохранялся в течение суток и затем уровень лейкоцитов снижался до исходного уровня через 4 дня после введения. При введении немодифицированного Г-КСФ максимальный уровень лейкоцитов в крови животных наблюдался через 1 день после введения, затем содержание лейкоцитов быстро снижалось.
Недостатками полученного конъюгата являются:
1. Низкая удельная активность полученного конъюгата, составляющая 68% от активности немодифицированного Г-КСФ.
2. Наличие немодифицированного Г-КСФ в составе конъюгата.
Задача настоящего изобретения состояла в получении нового стабильного высокоочищенного конъюгата ПЭГилированного Г-КСФ с более высокой активностью, с более пролонгированным действием, улучшенной стабильностью, с улучшенными фармакокинетическими параметрами, с оптимальным сочетанием параметров молекулярной массы ПЭГ и специфической активности, с высокой степенью чистоты пригодного для создания лекарственного препарата медицинского назначения, способствующего расширению арсенала лекарственных средств заданной направленности, фармацевтической композиции на основе заявляемого конъюгата.
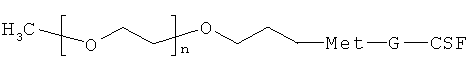
Поставленная задача решается созданием новой молекулы функционально активного конъюгата ПЭГ-Г-КСФ с активностью Г-КСФ, в котором линейная молекула ПЭГ с молекулярной массой от 30000 Да связана с молекулой Г-КСФ стабильной связью строго через альфа-аминогруппу N-концевой аминокислоты (метионина) так, что общая формула конъюгата ПЭГ-Г-КСФ с линейным мПЭГ представляет собой следующее соединение (I):
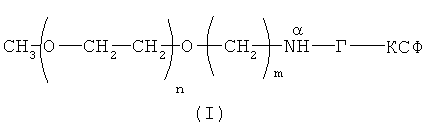
где n - целое значение, равное от 681 до 1000;
m - целое число ≥4;
Г-КСФ - природный или рекомбинантный полипептид, обладающий активностью Г-КСФ.
В полученном конъюгате линейный ПЭГ с молекулярной массой 30000-40000 Да связан с альфа-аминогруппой N-концевой аминокислоты Г-КСФ.
Избирательность модификации Г-КСФ строго по альфа-аминогруппе N-концевой аминокислоты достигается за счет использования альдегид-активированных мПЭГ общей формулы (II) и проведения реакции ПЭГилирования при рН≤5:
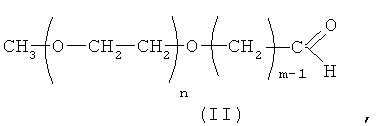
где n - целые значения от 681 до 1000, так что молекулярная масса ПЭГ составляет примерно 30000-40000 Да;
m - целое число ≥4.
Оптимальное соотношение параметров молекулярной массы ПЭГ и специфической гемостимулирующей активности достигается за счет использования активированного мПЭГ (II) со значением m≥4, что приводит к более эффективному взаимодействию заявляемого конъюгата с рецепторами и более высокой биологической активности.
Снижение иммуногенности, токсичности и улучшение фармакокинетических параметров достигается за счет увеличения молекулярной массы присоединенного ПЭГ.
Новым по сравнению с прототипом является:
1. Для получения конъюгата ПЭГ-Г-КСФ использованы альдегидные производные активированных мПЭГ формулы 2.
2. Структурная формула конъюгата ПЭГ-Г-КСФ.
3. Увеличение молекулярной массы конъюгата ПЭГ-ИФН за счет размера присоединенного ПЭГ.
4. Более высокий уровень удельной специфической активности.
5. Улучшенные фармакокинетические параметры.
Заявляемый конъюгат ПЭГ-Г-КСФ является высокоочищенным препаратом с пролонгированным действием, характеризуется высокой специфической биологической активностью (не менее 84-94% от немодифицированного Г-КСФ), чистотой по белку не менее 97%, высокой термостабильностью, повышенной резистентностью к действию протеолитических ферментов, улучшенными фармакокинетическими параметрами.
Также в настоящее изобретение входят фармацевтические композиции, содержащие в качестве активного ингредиента заявляемый конъюгат ПЭГ-Г-КСФ в эффективном количестве, данные композиции могут также включать фармацевтически приемлемые носители, буферные агенты (органические и неорганические кислоты и их соли, например буферы на основе лимонной кислоты, сукцинатный, виннокислый, фумаратный, глюконовый, щавелевокислый, молочнокислый, ацетатный буферы), стабилизаторы (многоатомные спирты сахаров, аминокислоты, органические сахара или спиртовые сахара, инозитол, ПЭГ, аминокислотные полимеры, серосодержащие восстанавливающие агенты, такие как мочевина, глутатион, тиоглицерол и т.д., полипептиды с низкой молекулярной массой, белки, такие как человеческий сыворочный альбумин, иммуноглобулины, гидрофильные полимеры, такие как поливинилпирролидон, моносахариды, такие как манноза, ксилоза, фруктоза, глюкоза, дисахариды, такие как лактоза, мальтоза, сахароза, трисахариды, такие как раффиноза, и полисахариды, такие как декстран), консерванты (фенол, бензиловый спирт, мета-кризол, метилпарабен, пропилпарабен, октадецилдиметилбензил аммонийхлорид, галогениды бензалканов, алкилпарабены), антиоксиданты (метионин, витамин Е, аскорбиновая кислота), изотонирующие агенты (многоатомные спирты сахаров (хлорид натрия, сорбитол, маннитол, арабитол, ксилитол и т.д.), неионные сурфактанты и детергенты (полисорбаты, полиоксамеры, полиолы, твин), сорастворители, наполнители (крахмал), хелатирующие агенты (например, ЭДТА). Данные фармацевтические композиции могут применяться в виде различных форм, например лиофилизата, водной формы (инъекции, аэрозоли, капли и т.п.).
Также в настоящее изобретение входят лекарственные средства на основе заявляемого конъюгата, в частности средства, применяемые для лечения лейкопений, преимущественно различных видов нейтропений.
Заявляемый пегилированный Г-КСФ, а также фармацевтические композиции и лекарственные средства на его основе, может использоваться для лечения нейтропений у больных, получающих миелосупрессивную химиотерапию при онкологических заболеваниях, для лечения миелодиспластического синдрома, улучшения переносимости иммуносупрессивных препаратов при пересадке костного мозга, улучшения иммунного статуса у пациентов, страдающих СПИД и другими инфекциям, в частности для противогрибковой терапии, в особенности для лечения системного или инвазивного кандидоза.
Конъюгат формулы (I) с необязательным фармакологически приемлемым наполнителем, разбавителем и/или фармацевтически приемлемыми вспомогательными веществами вводят внутривенно, подкожно, внутримышечно или каким-либо другим подходящим способом. Путь введения варьируют в зависимости, например, от симптомов и возраста, частота введения и интервал между введениями варьируют в зависимости от заболевания и его тяжести или от цели (терапевтическое или профилактическое использование), эффективное количество активного начала ПЭГ-Г-КСФ выбирается с учетом вышеизложенных факторов.
Для получения заявляемого конъюгата ПЭГ-Г-КСФ был использован высокоочищенный рекомбинантный Г-КСФ человека (филграстим) производства ЗАО «Биокад» и бутиральдегидные производные мПЭГ формулы (II) с молекулярной массой 30000-40000 Да.
Реакцию коньюгирования проводили при рН ниже 5.0 в присутствии восстанавливающего агента при температуре, равной или ниже 20°С. Молярное соотношение ПЭГ/белок составляло 2,5-5/1. Контроль образования конъюгата ПЭГ-Г-КСФ проводили при помощи электрофореза в полиакриламидном геле (ПААГ) в присутствии додецилсульфата натрия (ДДС) в восстанавливающих условиях и обратно-фазной высокоэффективной хроматографии (ОФ ВЭЖХ). Очистку моноПЭГ-Г-КСФ от продуктов реакции, немодифицированного Г-КСФ и от нежелательных форм ПЭГ-Г-КСФ, содержащих две и более молекулы ПЭГ на молекулу белка, проводили при помощи хроматографии на катионообменных сорбентах. Элюцию конъюгата моноПЭГ-ИФН проводили градиентом концентрации хлористого натрия от 0,05 до 0,2 М в буферном растворе с рН ниже 5. Очищенный препарат моноПЭГ-Г-КСФ диализовали против 10-50 мМ буферного раствора с рН 4-5, добавляли соли, или полисахариды, или многоатомные спирты, или поливинилпирролидоны, или моносахариды, или аминосахара, или белки, или аминокислоты и неионные детергенты и хранили в пластиковых или стеклянных флаконах с силиконизированной поверхностью при температуре 4±2°С.
Для характеристики полученного конъюгата моноПЭГ-Г-КСФ исследовали его чистоту, гомогенность, физико-химические, биологические и фармакокинетические параметры в сравнении с немодифицированным Г-КСФ.
Предлагаемое изобретение иллюстрируется чертежами, где представлены:
на фиг.1 - кинетика образования конъгата ПЭГ-Г-КСФ;
на фиг.2 - обратно-фазная ВЭЖХ конъюгата ПЭГ-Г-КСФ на колонке "Symmetry C4 (4.6×4,6×150 mm);
на фиг.3 - гель-фильтрационная ВЭЖХ конъюгата ПЭГ-Г-КСФ на колонке TSK G3000SWx (30 cm × 7.8 mm);
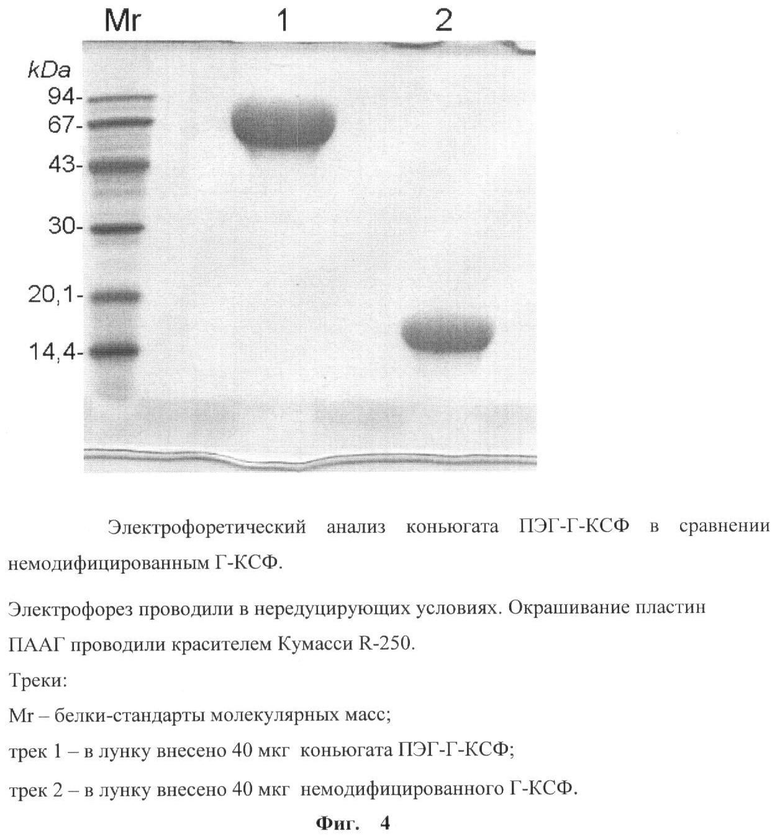
на фиг.4 - электрофоретический анализ конъюгата ПЭГ-Г-КСФ в сравнении с немодифицированным Г-КСФ;
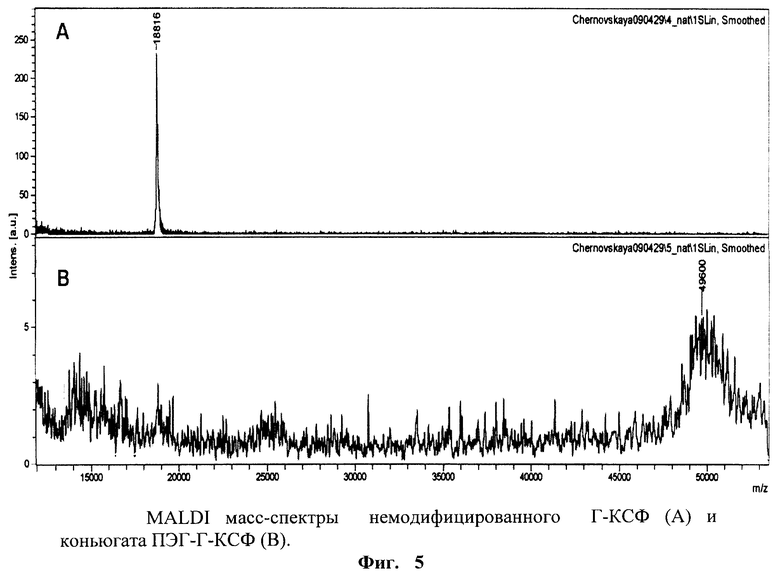
на фиг.5 - MALDI масс-спектры немодифицированного Г-КСФ (А) и конъюгата ПЭГ-Г-КСФ (В);
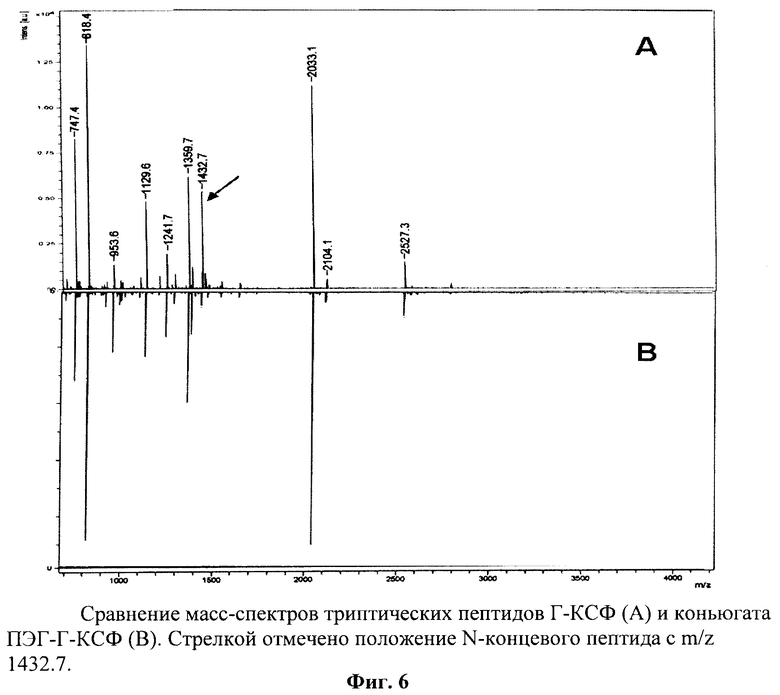
на фиг.6 - сравнение масс-спектров триптических пептидов Г-КСФ (А) и конъюгата ПЭГ-Г-КСФ (В);
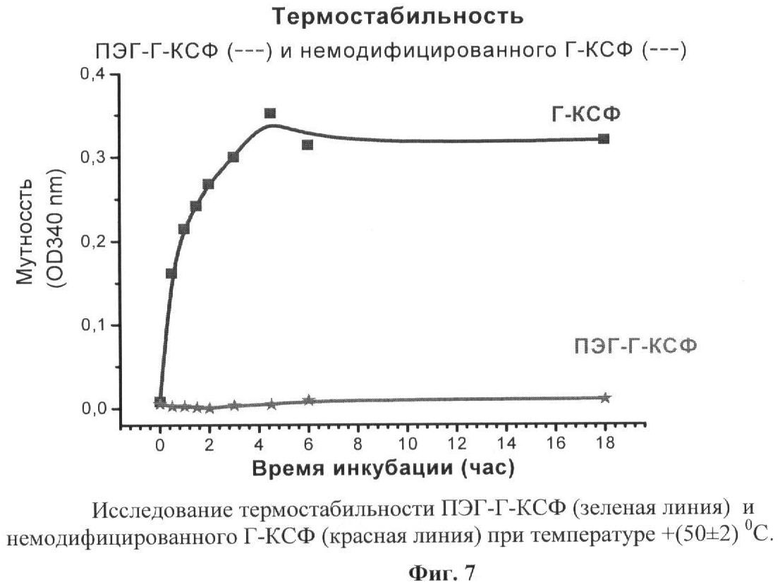
на фиг.7 - исследование термостабильности ПЭГ-Г-КСФ (зеленая линия) и немодифицированного Г-КСФ (красная линия) при температуре +(50±2)°С;
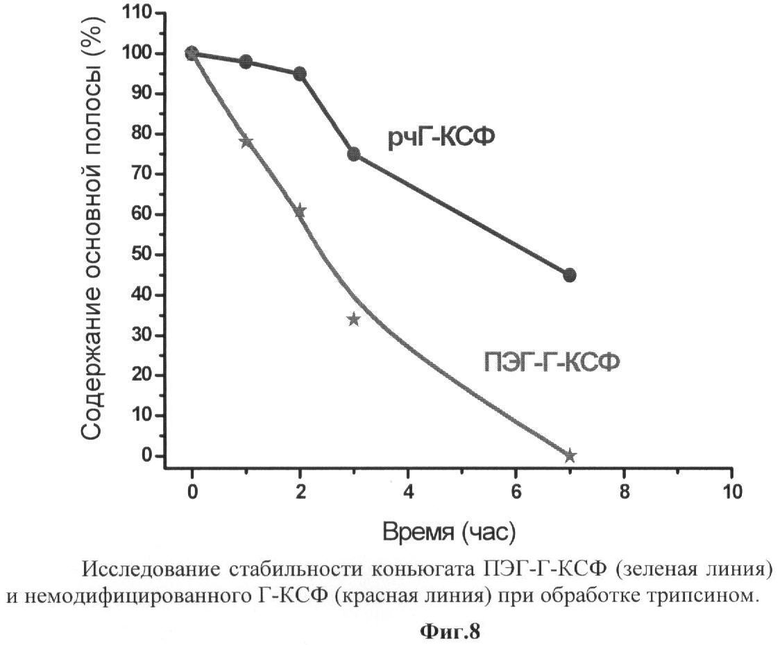
на фиг.8 - исследование стабильности конъюгата ПЭГ-Г-КСФ (зеленая линия) и немодифицированного Г-КСФ (красная линия) при обработке трипсином;
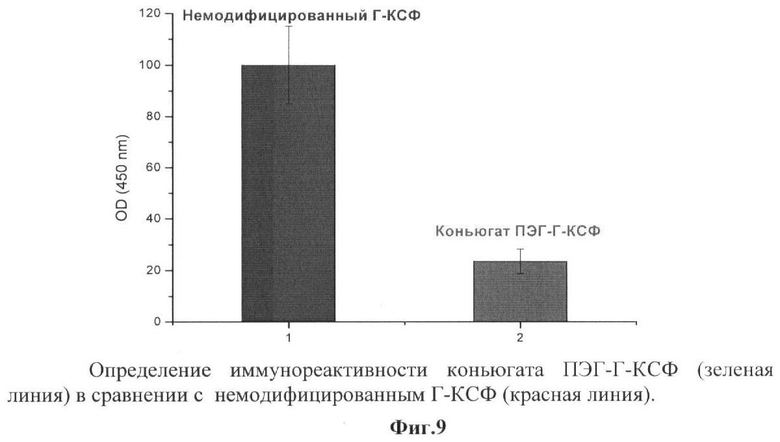
на фиг.9 - определение иммунореактивности конъюгата ПЭГ-Г-КСФ (зеленая линия) в сравнении с немодифицированным Г-КСФ (красная линия);
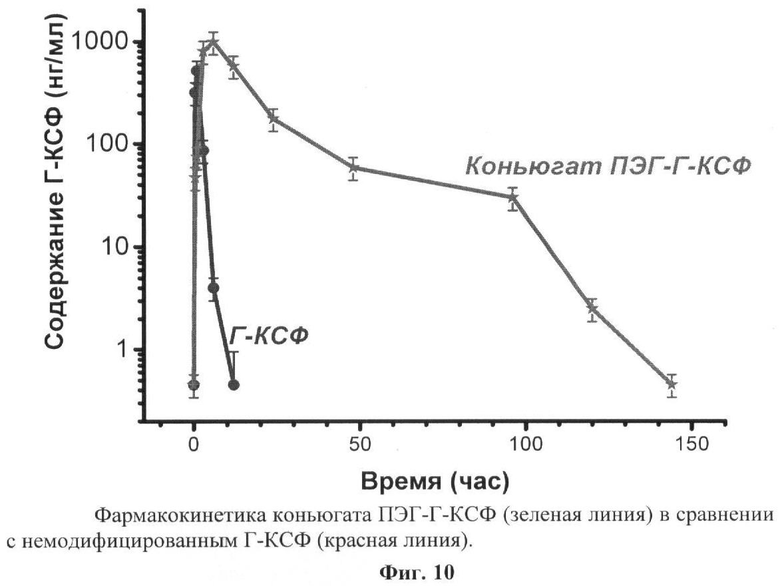
на фиг.10 - фармакокинетика конъюгата ПЭГ-Г-КСФ (зеленая линия) в сравнении с немодифицированным Г-КСФ (красная линия).
Примеры конкретного выполнения способа получения ПЭГ-Г-КСФ и исследования его свойств приведены ниже.
ПРИМЕР 1
Получение очищенного рчГ-КСФ (филграстима)
Выделение и очистку рчГ-КСФ проводили, как описано в патенте RU 2278870.
ПРИМЕР 2
Получение конъюгата ПЭГ-Г-КСФ, в котором молекулярная масса ПЭГ составляет 30 кДа
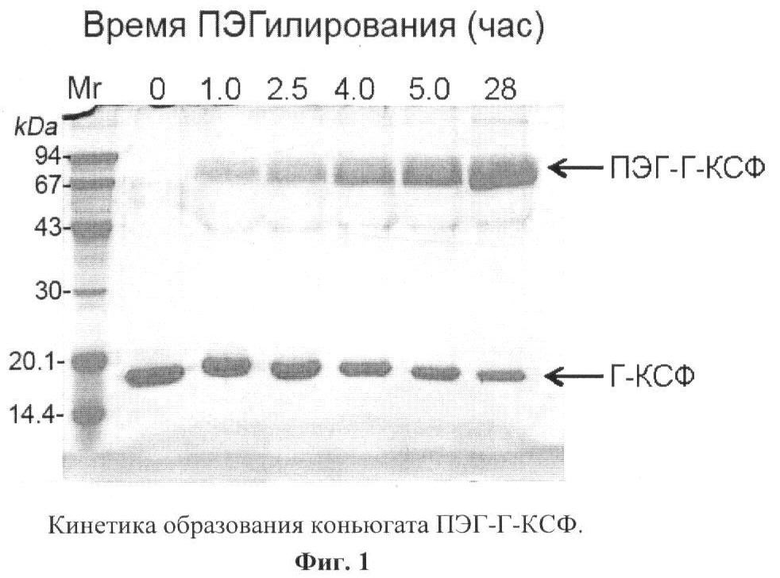
К 2300 мл буферного раствора (50 мМ ацетат натрия, рН 5.0±0.2), содержащего 2500 мг очищенного рчГ-КСФ, полученного по п.1, добавляли 50 мл 1 М раствора цианборогидрида натрия, перемешивали и добавляли 10 г сухого бутиральдегидного производного монометокси ПЭГ (мПЭГ) с молекулярной массой 30000 дальтон. Пробу инкубировали 22 часа при постоянном перемешивании при температуре (20±2)°С. Через различные промежутки времени из реакционной смеси отбирали аликвоты по 50 мкл и анализировали кинетику образования конъюгата ПЭГ-Г-КСФ при помощи метода электрофореза (ЭФ) в полиакриламидном геле (ПААГ) в присутствии додецилсульфата натрия (ДДС) в редуцирующих условиях. Для этого к отобранной пробе добавляли 1/3 объема буфера, содержащего 125 мМ Трис-HCl, рН 6,8, 20% глицерин, 3% ДДС, 15% 2-меркаптоэтанола, 0,005% бромфенолового синего, и нагревали 3 мин на кипящей водяной бане. Пробы в объеме 5 мкл вносили в лунки подготовленных пластин ПААГ и проводили электрофорез в 12,5% ПААГ в присутствии ДДС. По окончании электрофореза гель окрашивали при помощи Кумасси R-250. Кинетика образования конъюгата ПЭГ-Г-КСФ представлена на фиг.1. В момент времени, когда содержание ПЭГ-Г-КСФ составляло более 70%, реакционную смесь разводили в 3 раза 10 мМ натрийацетатным буфером, рН 4,8±0.2.
ПРИМЕР 3
Получение конъюгата ПЭГ-Г-КСФ, в котором молекулярная масса ПЭГ составляет 40 кДа
К 3600 мл буферного раствора (100 мМ ацетат натрия, рН 5.0±0.2), содержащего 2500 мг очищенного рчГ-КСФ, полученного по п.1, добавляли 78 мл 1 М раствора цианборогидрида натрия, перемешивали и добавляли 10 г сухого бутиральдегидного производного монометокси ПЭГ (мПЭГ) с молекулярной массой 40000 дальтон. Пробу инкубировали 29 часов при постоянном перемешивании при температуре (20±2)°С. Через различные промежутки времени из реакционной смеси отбирали аликвоты по 50 мкл и анализировали кинетику образования конъюгата ПЭГ-Г-КСФ при помощи метода электрофореза (ЭФ) в полиакриламидном геле (ПААГ) в присутствии додецилсульфата натрия (ДДС) в редуцирующих условиях. Для этого к отобранной пробе добавляли 1/3 объема буфера, содержащего 125 мМ Трис-HCl, рН 6,8, 20% глицерин, 3% ДДС, 15% 2-меркаптоэтанола, 0,005% бромфенолового синего, и нагревали 3 мин на кипящей водяной бане. Пробы в объеме 5 мкл вносили в лунки подготовленных пластин ПААГ и проводили электрофорез в 12,5% ПААГ в присутствии ДДС. По окончании электрофореза гель окрашивали при помощи Кумасси R-250. В момент времени, когда содержание ПЭГ (40 кДа)-Г-КСФ составляло более 70%, реакционную смесь разводили в 10 раз 10 мМ натрий-ацетатным буфером, рН 4,8±0.2
ПРИМЕР 4
Очистка конъюгата моноПЭГ-Г-КСФ (ПЭГ 30 кДа)
Разбавленный раствор, полученный в примере 2, наносили на колонку с катиоонообменным сорбентом (СМ-сефароза, 300 мл), уравновешенным 10 мМ натрий-ацетатным буфером, рН 4,8 (буфер А), со скоростью 10 мл/мин. Колонку с сорбентом промывали 1500 мл буфера А. Элюцию связавшегося с сорбентом конъюгата ПЭГ-Г-КСФ проводили 6000 мл буфера А, содержащего градиент концентрации NaCl от 0 до 0,2 М, со скоростью - 5 мл/мин, собирая фракции объемом 50 мл. В полученных фракциях измеряли оптическую плотность при 280 и 260 нм, определяли концентрацию белка и проводили анализ при помощи методов обратно-фазной ВЭЖХ и ЭФ в ПААГ, как описано в примере 2. Фракции, содержащие моноПЭГилированный конъюгат ПЭГ-Г-КСФ с чистотой более 95%, объединяли, диализовали против 10 объемов 1,6 мМ натрий-ацетатного буфера, рН 4.0±0.2, проводили стерильную фильтрацию и хранили при температуре 4±2°С.
ПРИМЕР 5
Очистка конъюгата моноПЭГ-Г-КСФ (ПЭГ 40 кДа)
Разбавленный раствор, полученный в примере 3, наносили на колонку с катиоонообменным сорбентом (СМ-сефароза, 300 мл), уравновешенным 10 мМ натрий-ацетатным буфером, рН 4,8 (буфер А), со скоростью 100 мл/мин. Колонку с сорбентом промывали 1500 мл буфера А. Элюцию связавшегося с сорбентом конъюгата ПЭГ(40 кДа)-Г-КСФ проводили 6000 мл буфера А, содержащего градиент концентрации NaCl от 0 до 0,2 М, со скоростью 5 мл/мин, собирая фракции объемом 100 мл. В полученных фракциях измеряли оптическую плотность при 280 и 260 нм, определяли концентрацию белка и проводили анализ при помощи методов обратно-фазной ВЭЖХ и ЭФ в ПААГ, как описано в примере 2. Фракции, содержащие моноПЭГилированный конъюгат ПЭГ(40 кДа)-Г-КСФ с чистотой более 95%, объединяли, диализовали против 10 объемов 1,6 мМ натрий-ацетатного буфера, рН 4.0±0.2, проводили стерильную фильтрацию и хранили при температуре 4±2°С.
ПРИМЕР 6
Определение чистоты конъюгата ПЭГ-Г-КСФ при помощи метода обратно-фазной высокоэффективной жидкостной хроматографии (ОФ ВЭЖХ)
Конъюгат ПЭГ-Г-КСФ, полученный по п.4, разводили 20 мМ натрий-ацетатным буфером, рН 5.0, до концентрации 0,3 мг/мл и 100 мкл полученной пробы вносили на колонку Symmetry C4 (4.6×150 mm). Исследование проводили на хроматографе «Breeze» фирмы "Waters" при 214 нм. Из результатов, представленных на фиг.2, следует, что конъюгат ПЭГ-Г-КСФ представляет собой препарат высокой степени чистоты. Из представленной хроматограммы видно, что с сорбента Symmetry C4 белок элюируется одним симметричным пиком, доля которого составляет 98,85%. Незначительные УФ-поглощающие примеси, элюирующиеся до и после мажорного пика белка, составляют в сумме ≤1,15%. Таким образом, из представленных данных следует, что по данным обратно-фазовой ВЭЖХ чистота заявляемого конъюгата ПЭГ-Г-КСФ составляет ≥98%.
ПРИМЕР 7
Определение чистоты конъюгата ПЭГ-Г-КСФ при помощи метода гель-фильтрационной (эксклюзионной) высокоэффективной жидкостной хроматографии (ГФ ВЭЖХ)
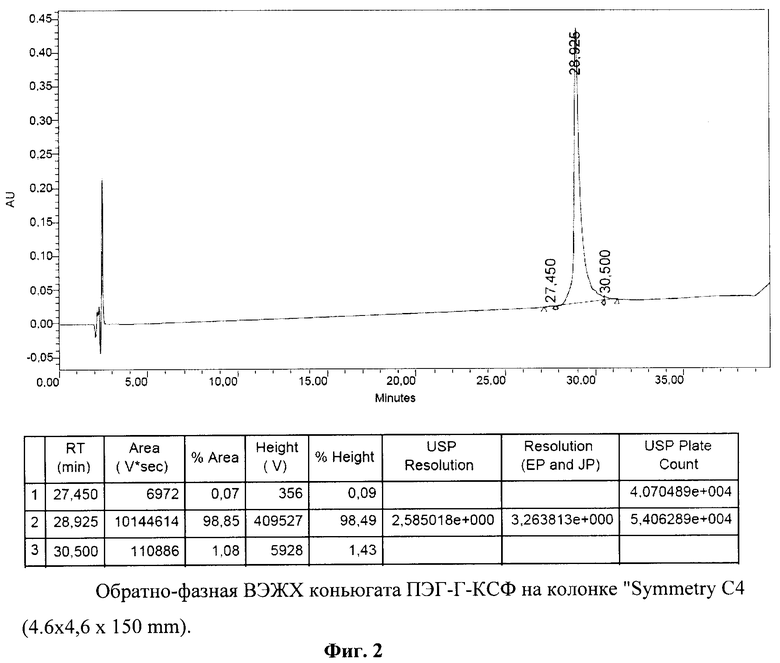
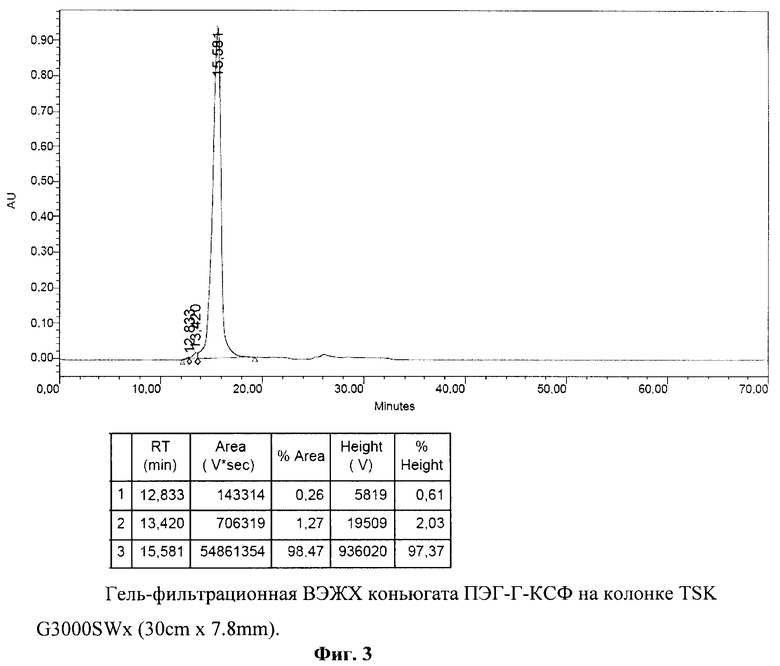
Конъюгат ПЭГ-Г-КСФ, полученный по п.4, разводили 20 мМ натрий-ацетатным буфером, рН 5.0, до концентрации 0,3 мг/мл и 100 мкл полученной пробы вносили на колонку TSK G3000SWX (30 cm × 7.8 mm). Исследование проводили на хроматографе «Breeze» фирмы "Waters" при 220 нм. Результаты исследования представлены на фиг.3. Видно, что исследуемый образец ПЭГ-Г-КСФ выходит с колонки одним четко выраженным симметричным пиком, составляющим 98,47%. Из результатов, представленных на фиг.3, следует, что заявляемый конъюгат ПЭГ-Г-КСФ не содержит свободного немодифицированного Г-КСФ. Содержание высокомолекулярных агрегатов в заявляемом конъюгате не превышает 1,53%. Чистота заявляемого конъюгата ПЭГ-Г-КСФ по данным ГФ ВЭЖХ составляет более 98%.
ПРИМЕР 8
Определение уровня эндотоксинов в конъюгате ПЭГ-Г-КСФ
Содержание бактериальных эндотоксинов (БЭ) в пробе конъюгата ПЭГ-Г-КСФ, полученного по п.4, определяли in vitro с помощью ЛАЛ-теста (модификация гель-тромб тест) в соответствии с требованиями ОФС 42-0002-00. В работе использовали диагностический многокомпонентный набор фирмы «Associates of CAPE COD, Inc. ЛАЛ-реактив PYROTELL® с чувствительностью 0,03 ЕЭ/мл, контрольный стандарт эндотоксина (КСЭ, 0,5 мкг во флаконе), воду для ЛАЛ-теста. Из результатов, представленных в табл.1, видно, что содержание БЭ в пробе конъюгата ПЭГ-Г-КСФ составляет менее 3 единиц эндотоксина (еЭ) на 1 мг белка, что гораздо ниже уровня БЭ, допустимого для медицинских препаратов на основе рекомбинантных белков.
ПРИМЕР 9
Электрофоретический анализ конъюгата ПЭГ-Г-КСФ в сравнении с немодифицированным Г-КСФ
Пробу конъюгата ПЭГ-Г-КСФ, полученную по п.4, анализировали методом электрофореза в ПААГ, как описано в п.2. Электрофорез проводили с нагрузкой на лунку 40 мкг белка в нередуцирующих условиях. Окраску белков в геле проводили красителем Кумасси R-250. Одновременно проводили электрофорез немодифицированного Г-КСФ. Конъюгат ПЭГ-Г-КСФ был представлен одной высокомолекулярной полосой (фиг.4, трек 1). Из электрофореграмм конъюгата ПЭГ-Г-КСФ и немодифицированного Г-КСФ представленных на фиг 4, видно, что конъюгат ПЭГ-Г-КСФ имеет более высокую молекулярную массу, чем Г-КСФ (фиг.4, сравнить треки 1 и 2). Следует отметить, что методом ЭФ точное значение молекулярной массы для ПЭГилированных белков определить нельзя, так как присоединение гидрофильной молекулы ПЭГ к белку значительно увеличивает радиус Стокса образовавшегося комплекса. В результате продвижение комплекса ПЭГ-белок в геле замедляется и значение его молекулярной массы оказывается значительно выше, чем сумма молекулярных масс немодифицированного белка и ПЭГ.
ПРИМЕР 10
Определение молекулярной массы конъюгата ПЭГ-Г-КСФ в сравнении с немодифицированным Г-КСФ методом масс-спектрометрии
1 мкл пробы конъюгата ПЭГ-Г-КСФ, полученного по п.4, и 0,3 мкл раствора 2,5-дигидроксибензойной кислоты (Aldrich, 10 мг × мл-1 в 20% ацетонитриле в воде с 0.5% ТФУ) смешивали и высушивали на воздухе. Аналогичным способом готовили пробу немодифированного Г-КСФ.
Масс-спектры были получены на MALDI-времяпролетном масс-спектрометре Ultraflex II BRUKER (Германия), оснащенном УФ-лазером (Nd). Масс-спектры получены в режиме положительных ионов, в линейном режиме, погрешность измерения средней массы не превышает 10-15 Да.
Результаты по масс-спектрометрическому анализу немодифицированного Г-КСФ и конъюгата ПЭГ-Г-КСФ в диапазоне m/z от 10000-50000 приведены на фиг.5.
Из фиг.5А видно, что масс-спектр Г-КСФ содержит основной пик, соответствующий однозарядному иону [M]+ с молекулярной массой 18816 Да.
В масс-спектре конъюгата ПЭГ-Г-КСФ, приведенном на фиг.5В, представлен размытый основной пик, соответствующий однозарядному иону [М]+ с молекулярной массой 49600 Да. Размытость пика связана с гетерогенностью препаратов монометоксиПЭГ. Для конюгата ПЭГ-Г-КСФ измеренное значение m/z в максимуме пика (49600 Да) совпадает с расчетными данными по сумме молекулярных масс Г-КСФ (19295 Да) и присоединенного ПЭГ (30000 Да).
ПРИМЕР 11
Локализация сайта ПЭГилирования в конъюгате ПЭГ-Г-КСФ
К 5 мкл пробы конъюгата ПЭГ-Г-КСФ, полученного по п.4, добавляли 5 мкл раствора модифицированного трипсина (Promega) в 0.05 М NH4HCO3 с концентрацией 15 мкг × мл-1. Гидролиз проводили в течение 16 ч при 37°С, затем к раствору добавляли 10 мкл 0.5% ТФУ в 10% растворе ацетонитрила в воде и тщательно перемешивали. Аналогичным способом готовили пробу немодифированного ИФН. Полученные растворы использовали для получения MALDI-масс-спектров.
Локализацию сайта связывания ПЭГ с молекулой Г-КСФ определяли путем сравнения масс-спектров триптического гидролизата конъюгата ПЭГ-Г-КСФ и немодифицированного Г-КСФ. В триптическом гидролизате конъюгата ПЭГ-Г-КСФ должен отсутствовать пептид, соответствующий участку белка, по которому произошла модификация. В табл.2 представлены масс-спектры экспериментальных триптических пептидов для немодифицированного Г-КСФ и конъюгата ПЭГ-Г-КСФ. Из табл. 2 видно, что масс-спектры триптических пептидов немодифицированного Г-КСФ практически совпадают с масс-спектрами триптических пептидов конъюгата ПЭГ-Г-КСФ (табл.2), но в триптическом переваре конъюгата ПЭГ-Г-КСФ отсутствует пептид с молекулярной массой 1432.7, присутствующий в триптическом переваре немодифицированного Г-КСФ. Экспериментально полученные масс-спектры триптических пептидов для немодифицированного Г-КСФ и конъюгата ПЭГ-Г-КСФ представлены на фиг.6, из которой видно, что в триптическом переваре конъюгата ПЭГ-Г-КСФ отсутствует пептид с молекулярной массой 1432.7. Согласно анализу теоретических масс триптического гидролизата Г-КСФ пик с m/z 1432.7 соответствует N-концевому пептиду белка (табл.2). Его отсутствие в триптическом переваре конъюгата ПЭГ-Г-КСФ свидетельствует о модификации N-концевого пептида, который, став тяжелее на массу ПЭГ, находится за пределами исследуемой области спектра. Связывание ПЭГ с молекулой Г-КСФ произошло по единственной свободной аминогруппе, присутствующей в этом пептиде, по аминогруппе N-концевого метионина.
ПРИМЕР 12
Определение удельной специфической активности конъюгата ПЭГ-Г-КСФ в сравнении с немодифицированным рчГ-КСФ
Конъюгат ПЭГ-Г-КСФ, полученный по п.4, разводили до концентрации 0,2 нг/мл средой RPMI (АТСС кат.№30-2001). Полученную пробу в объеме 100 мкл вносили в ряд лунок 96-луночного планшета и готовили ряд последовательных двукратных разведений. Затем в каждую лунку вносят по 100 мкл суспензии клеток M-NFS-60 и культивировали в CO2-инкубаторе в течение 50. Затем в каждую лунку вносили 20 мкл красителя Аламар Блю (либо аналогичный, например МТТ) и инкубировали в тех же условиях 14 часов. Рост числа клеток определяли спектрофотометрически по увеличению оптической плотности при длине волны 545 нм и 630 нм. Аналогичным образом исследовали специфическую активность немодифицированного Г-КСФ. В качестве референс-стандарта использовали раствор международного стандартного образца активности Г-КСФ (1-st International Standart 88/502, granulocyte colony stimulating factor, human, rDNA-derived, 10000 IU/amp). Удельную биологическую активность исследуемых препаратов (Во) в МЕ/мг определяли расчетным методом по формуле
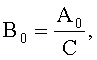
где В0 - удельная биологическая активность ПЭГ-Г-КСФ или Г-КСФ (МЕ/мг);
А0 - определенная биологическая активность ПЭГ-Г-КСФ или Г-КСФ (МЕ/мл);
С - содержание белка в растворе ПЭГ-Г-КСФ или Г-КСФ (мг/мл).
ПРИМЕР 13
Исследование термостабильности конъюгата ПЭГ-Г-КСФ в сравнении с немодифицированным Г-КСФ
Пробу конъюгата ПЭГ-Г-КСФ, полученного по п.4, разводили 5 мМ натрий-ацетатным буфером, рН 4.0, содержащим 140 мМ NaCl, до концентрации белка 0,28 мг/мл, помещали в в водяную баню при температуре (50±2)°С и через различные интервалы времени исследовали появление мутности в растворе белка, измеряя оптическую плотность при 340 нм. Аналогично проводили исследование термостабильности немодифицированного Г-КСФ. Инкубация белков при температуре (50±2)°С приводит к образованию нерастворимых агрегатов, в результате увеличивается мутность белкового раствора, которую можно измерить, определяя оптическую плотность раствора при 340 нм. На фиг.7 представлены результаты исследования, из которых видно, что мутность препарата немодифицированного Г-КСФ растет с увеличением времени инкубации, тогда как препарат ПЭГ-Г-КСФ остается стабильным в течение всего времени наблюдения. Из полученных данных следует, что термостабильность заявляемого конъюгата ПЭГ-Г-КСФ намного выше, чем у немодифицированного Г-КСФ.
ПРИМЕР 14
Исследование протеолитической стабильности конъюгата ПЭГ-Г-КСФ при обработке трипсином в сравнении с немодифицированным Г-КСФ
Пробу конъюгата ПЭГ-Г-КСФ, полученного по п.4, разводили до концентрации белка 0.6 мг/мл и добавляли 150 мкл 1М Трис-HCl, рН 8,5, так чтобы конечный рН пробы составлял 7,4, добавляли 2 мкл 0,5 М CaCl2 до конечной концентрации 1 мМ), перемешивали и добавляли 15 мкл трипсина (Promega, Gold) до конечной концентрации 0,02 мкг/мл. Аналогично готовили пробы, содержащие немодифицированный Г-КСФ. Пробы инкубировали при 37°С. Через определенные промежутки времени отбирали аликвоты в 100 мкл и проводили ЭФ в ПААГ в присутствии ДДС, как описано в п.1. После проведения электрофореза гели окрашивали красителем Кумасси-К-250 и сканировали. Площадь основной полосы определяли при помощи компьютерной программы Ge-lPro Analyser. Площадь основного пика в исходных (необработанных трипсином) пробах принимали за 100%. На фиг.8 представлены данные по чувствительности конъюгата ПЭГ-Г-КСФ и Г-КСФ к обработке трипсином. Видно, что при увеличении времени обработки трипсином количество ПЭГ-Г-КСФ и Г-КСФ снижается, однако заявляемый конъюгат ПЭГ-Г-КСФ более устойчив к действию трипсина в сравнении с немодифицированным Г-КСФ.
ПРИМЕР 15
Исследование иммунореактивности конъюгата ПЭГ-Г-КСФ в сравнении с немодифицированным Г-КСФ
Для определения иммунореактивности исследовали связывание заявляемого конъюгата ПЭГ-Г-КСФ с моноклональными иммуноглобулинами против Г-КСФ человека. Определение проводили иммуноферментным методом с использованием набора реагентов ProCon G-CSF (ООО «Протеиновый контур). Конъюгат ПЭГ-Г-КСФ, полученный по п.4, разводили 10 мМ Трис-HCl буфером, рН 7,2, содержащим 140 мМ NaCl и 1% бычьего сывороточного альбумина, до концентрации 1 мкг/мл, и 100 мкл полученной пробы вносили в лунки планшета для микротитрования, предварительно сенсибилизированные моноклональными антителами против Г-КСФ. После инкубации при температуре 37°С (60 мин) в лунки вносили моноклональные антитела к независимому эпитопу, меченные биотином. Образовавшийся иммунный комплекс детектировали при помощи стрептавидина, меченного пероксидазой хрена. Для развития цветной реакции в лунки планшетов вносили 100 мкл раствора субстрата (200 мкг/мл тетраметилбензидина («Sigma») и 0,1% H2O2 в 0,05 М ТБ, рН 7,2, и инкубировали до развития голубой окраски. Реакцию останавливали внесением в лунки 50 мкл 2 М раствора серной кислоты. Результаты учитывали, измеряя оптическую плотность при длине волны 405 нм на многоканальном спектрофотометре «Multiscan» EX. Аналогичным образом исследовали иммунореактивность немодифицированного Г-КСФ. Взаимодействие немодифицированного Г-КСФ с иммуноглобулинами принимали за 100%. Из результатов сравнительного определения иммунореактивности, представленных на фиг.9, видно, что иммунорективность заявляемого конъюгата ПЭГ-Г-КСФ составляет 25% от иммунореактивности немодифицированного Г-КСФ.
ПРИМЕР 16
Определение стабильности конъюгата ПЭГ-Г-КСФ при хранении
Из пробы, полученной по п.4. отбирали аликвоты в стерильные пробирки с крышками типа "Эппендорф". Концентрация белка в конъюгате ПЭГ-Г-КСФ составляла 1 мг/мл. Пробы помещали в холодильник при температуре (6±2)°С. Через определенные промежутки времени отбирали пробы и анализировали специфическую удельную активность и гомогенность препарата при помощи ГФ ВЭЖХ и ЭФ в ПААГ в присутствии ДДС в редуцирующих условиях, как описано в п.1. Из данных табл.4 видно, что при хранении при температуре (6±2)°С конъюгат ПЭГ-Г-КСФ стабилен в течение по крайней мере 24 месяцев.
ПРИМЕР 17
Исследование фармакокинетики конъюгата ПЭГ-Г-КСФ
Пробу конъюгата ПЭГ-ИФН, полученного по п.4, вводили внутрибрюшинно мышам-самцам линии ICR весом 20 г в дозе 5 мкг/мышь. Параллельно другой группе мышей вводили немодифицированный Г-КСФ. Через определенные промежутки времени у животных отбирали кровь при помощи ретроорбитальной пункции. Сыворотку крови получали стандартным методом. Наличие Г-КСФ в сыворотке определяли методом иммуноферментного анализа (ИФА). Для постановки ИФА использовали «сэндвич» вариант твердофазного ИФА с применением мышиных моноклональных иммуноглобулинов к различным эпитопам Г-КСФ человека. Моноклональные мышиные антитела сорбировали в лунках планшета для микротитрования в концентрации 2, 5 мкг/мл в 20 мМ Трис-HCl буфере (ТБ), рН 9,0. Сорбция антител проходила при температуре 4°С в течение ночи. Неспецифические центры связывания блокировали добавлением 200 мкл ТБ, рН 7.4, содержащего 1% бычьего сывороточного альбумина (БСА) и 0.05% твина-20. Далее в лунки вносили по 100 мкл исследуемой сыворотки, разведенной ТБ, содержащем 1% БСА и 0.05% твина-20, в соотношении 1:2, 1:4 и 1:8. Параллельно в лунки для построения калибровочной кривой вносили известные концентрации стандартного образца ПЭГ-Г-КСФ в интервале от 25 нг/мл до 600 нг/мл в буфере ТБ, содержащем 1% БСА и 0.05% твина-20. Инкубация проходила при температуре 37°С в течение часа. Далее в лунки добавляли последовательно моноклональные антитела к Г-КСФ человека, меченные биотином и стрептавидин, меченный пероксидазой. Для детекции образовавшегося комплекса использовали 100 мм раствор натрий-ацетатного буфера, рН 5,0, содержащего 0,015% перекиси водорода и 0,2 мг/мл тетраметилбензидина. Для остановки реакции использовали раствор 2М H2SO4. Концентрацию Г-КСФ в сыворотке определяли по калибровочной кривой с учетом разведения исследуемой сыворотки.
При анализе фармакокинетики немодифицированного Г-КСФ для построения калибровочной кривой в лунки вносили известные концентрации стандартного образца Г-КСФ в интервале от 6,25 нг/мл до 200 нг/мл в буфере ТБ, содержащем 1% БСА и 0.05% твина-20. Результаты фармакокинетики заявляемого конъюгата ПЭГ-Г-КСФ в сравнении с немодифицированным Г-КСФ представлены на фиг.10. Из результатов следует, что заявляемый конъюгат ПЭГ-Г-КСФ обладает значительным пролонгированным эффектом. При введении нативного Г-КСФ его содержание в крови животных достигало максимума через 1 ч после введения и затем очень быстро снижалось. При введении конъюгата ПЭГ-ИФН максимальное содержание ИФН в крови животных наблюдалось через 6 часов (фиг.10) и затем происходило медленное снижение содержания Г-КСФ в крови в течение 140 час. Исходя из полученных результатов (фиг.10) были рассчитаны основные фармакокинетические параметры для заявляемого конъюгата ПЭГ-Г-КСФ. Результаты показали, что всасывание из места введения, объем распределения, клиренс конъюгата ПЭГ-Г-КСФ значительно замедлены по сравнению с немодифицированным Г-КСФ, что и обеспечило длительную циркуляцию заявляемого конъюгата ПЭГ-Г-КСФ в крови (более 140 часов).
ПРИМЕР 18
Сравнительная характеристика заявляемого конъюгата ПЭГ-Г-КСФ в сравнении с конъюгатом ПЭГ-Г-КСФ, описанном в способе-прототипе
Проведено сравнение структуры, основных физико-химических и фармакокинетических параметров заявляемого конъюгата ПЭГ-Г-ГСФ, полученного по п.4, в сравнении с конъюгатом ПЭГ-Г-КСФ, описанном в способе прототипе (табл.5). Данные, представленные в табл.5, свидетельствуют о значительном улучшении свойств заявляемого конъюгата ПЭГ-ИФН в сравнении с конъюгатом из способа-прототипа.
ПРИМЕР 19
Раствор для подкожного введения 0,6 мг/мл, 1,0 мг/мл, 2,0 мг/мл, 3,0 мг/мл
Раствор для подкожного введения, применяемый в качестве лекарственного средства, содержащий в качестве активного ингредиента ПЭГилированный рекомбинантный гранулоцитарный колониестимулирующий фактор человека (ПЭГ-Г-КСФ) и дополнительные фармацевтически приемлемые компоненты в следующем соотношении:
Активное вещество: ПЭГилированный рекомбинантный гранулоцитарный колониестимулирующий фактор человека (ПЭГ-Г-КСФ) мг - 0,6-3,0
Вспомогательные вещества:
Полисорбат 20, мг - 0,04
Маннитол, мг - 50
Натрия ацетата тригидрат, мг - 0,23
Уксусная кислота ледяная до рН 4,0
Вода для инъекций до 1 мл.
ПРИМЕР 20
Способ упаковки готового лекарственного средства, например, водного раствора, содержащего ПЭГ-Г-КСФ, полученный по п.4
По 1,0 мл в шприцах из нейтрального стекла I гидролитического класса, с впаянными иглами, покрытыми колпачками защитными эластичными или жесткими, укупоренных наконечниками на поршни из бутилкаучука, ламинированного фторполимером.
или
по 1,0 мл во флаконах из нейтрального стекла I гидролитического класса, укупоренных фторрезиновыми или бутилрезиновыми пробками с тефлоновым покрытием, обжатых алюминиевыми колпачками.
ПРИМЕР 21
Набор, содержащий лекарственное средство, например водный раствор, содержащий в качестве активного ингредиента ПЭГ-Г-КСФ, полученный по п.4
Набор, содержащий по 1 шприцу в комплекте с поршнем в контурной ячейковой упаковке из пленки полимерной вместе с инструкцией по применению, которые помещают в пачку из картона.
или
набор, по 1 флакону в контурной ячейковой упаковке из пленки полимерной вместе с инструкцией по применению, которые помещают в пачку из картона.
Источники информации
Машковский М.Д. Лекарственные средства, издание 15, М.: Новая волна, 2006 - 1206 стр.
Патент US 7655766.
Патент ЕР 0401384.
Патент ЕР 0335423.
Патент US 5824784.
Патент RU 2278870.
Hartung T, Docke WD, Gantner F, Krieger G, Sauer A, Stevens P, Volk HD and Wendel A (1995), "Effect of granulocyte colony-stimulating factor treatment on ex vivo blood cytokine response in human volunteers". Blood, V.85, p.2482-2489.
Komatsu Y., Matsumoto Т. et al. (1987), "Cloning of granulocyte colony-stimulating factor cDNA from human macrophages and its expression in Escherichia coli", Japanese journal of cancer research, V.78. P.1179-1181.
Metcalf D. (1992), "Hemopoietic regulators". Trends in biochemical sciences, V.17, p.286-289.
Molineux G. (2003), "Pegfilgrastim: using pegylation technology to improve neutropenia support in cancer patients". Anti-cancer drugs, №14(4), p.259-264.
Molineux G. (2004), "The design and development of pegfilgrastim (PEG-rmetHuG-CSF, Neulasta", Current pharmaceutical design, №10(11), p.1235-1244.
Nagata S. (1986), "Molecular cloning and expression of cDNA for human granulocyte colony-stimulating factor", Nature.V.319, p.415-418.
Roberts M.J., Bentley M.D., Harris J.M. (2002), "Chemistry for peptide and protein PEGylation", Advanced drug delivery reviews, V.54(4), p.459-476.
Souza E.M. et al. (1986), "Recombinant human granulocyte colony-stimulating factor: effects on normal and leukemic myeloid cells". Journal of Science, №232, стр.61-65.
Veronese FM, Pasut G. (2005, Nov 1), "PEGylation, successful approach to drug delivery", Drug discovery today, V.10(21), p.1451-1458.
Welte K, Platzer E et al. (1985), "Purification and biochemical characterization of human pluripotent hematopoietic colony-stimulating factor", Proceedings of the National Academy of Sciences of the USA, V.82(5), p.1526-1530.
de Wit R, Verweij J et al. (1996), "Adverse effect on bone marrow protection of prechemotherapy granulocyte colony-stimulating factor support". Journal of the National Cancer Institute, V.88(19), p.1393-8.
Изобретение относится к области биотехнологии, конкретно к получению ПЭГилированного гранулоцитарного колониестимулирующего фактора (Г-КСФ), и может быть использовано в медицине. Получают конъюгат Г-КСФ с монометоксиполиэтиленгликолем, присоединенным к N-концевому метионину Г-КСФ, общей формулы
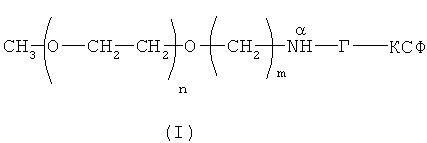
где n - целые значения от 681 до 1000; m представляет собой целое число ≥4; NαH-Г-КСФ представляет собой гранулоцитарный колониестимулирующий фактор. Полученный конъюгат обладает активностью Г-КСФ человека и пролонгированным биологическим действием, что позволяет использовать его в составе фармацевтических композиций и как лекарственное средство для профилактики или лечения нейтропений. 7 н. и 10 з.п. ф-лы, 10 ил., 5 табл., 21 пр.
1. Конъюгат гранулоцитарного колониестимулирующего фактора человека (Г-КСФ) с монометоксиполиэтиленгликолем, присоединенным к N-концевому метионину Г-КСФ, формулы (I)
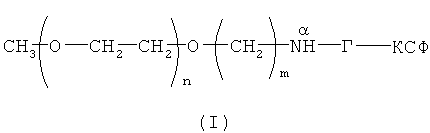
где n - целые значения от 681 до 1 000;
m представляет собой целое число ≥4;
NαH-Г-КСФ представляет собой гранулоцитарный колониестимулирующий фактор;
обладающий активностью гранулоцитарного колониестимулирующего фактора человека.
2. Коньюгат по п.1, в котором средняя молекулярная масса звеньев полиэтилен гликоля составляет от 30 до 40 кДа.
3. Коньюгат по п.2, где молекулярная масса звеньев полиэтиленгликоля предпочтительно составляет 30 кДа.
4. Коньюгат по п.1, в котором m представляет собой целое число от 4 до 6.
5. Коньюгат по п.1, в котором N-концевая группа представлена остатком метионина (Met).
6. Фармацевтическая композиция, обладающая активностью гранулоцитарного колониестимулирующего фактора, содержащая коньюгат общей формулы (I) в эффективном количестве и фармацевтически приемлемые добавки.
7. Фармацевтическая композиция по п.6 для применения в качестве лекарственного средства для лечения нейтропении различного происхождения.
8. Фармацевтическая композиция по п.6, включающая коньюгат общей формулы (I) в эффективном количестве, полисорбат, маннитол, натрия ацетата тригидрат, уксусную кислоту, воду для инъекций до 1 мл.
9. Фармацевтическая композиция по п.8 с pH 3-5.
10. Фармацевтическая композиция по п.8 с pH преимущественно 4.
11. Лекарственное средство, обладающее активностью гранулоцитарного колониестимулирующего фактора, включающее коньюгат общей формулы (I).
12. Лекарственное средство по п.11 для применения для лечения нейтропении различного происхождения.
13. Применение коньюгата формулы (I) для получения лекарственного средства, обладающего активностью гранулоцитарного колониестимулирующего фактора.
14. Способ профилактики или лечения нейтропении, включающий введение эффективного количества коньюгата формулы (I).
15. Контейнер для хранения, герметично запаянный в стерильных условиях, соответствующих хранению перед применением, включающий жидкую фармацевтическую препаративную форму по любому из пп.6-12.
16. Контейнер по п.15, где указанный контейнер представляет собой предварительно заполненный шприц, флакон или автоинжектор.
17. Набор, предназначенный для профилактики или лечения нейтропении различного происхождения, включающий контейнер по п.15 и инструкцию по применению.
| US 5824784, 20.10.1998 | |||
| WO 2004083242 A1, 30.09.2004 | |||
| US 5252714, 12.10.1993 | |||
| СПОСОБ ПОЛУЧЕНИЯ, ВЫДЕЛЕНИЯ, ОЧИСТКИ И СТАБИЛИЗАЦИИ РЕКОМБИНАНТНОГО ГРАНУЛОЦИТАРНОГО КОЛОНИЕСТИМУЛИРУЮЩЕГО ФАКТОРА ЧЕЛОВЕКА, ПРИГОДНОГО ДЛЯ МЕДИЦИНСКОГО ПРИМЕНЕНИЯ, И ИММУНОБИОЛОГИЧЕСКОЕ СРЕДСТВО НА ЕГО ОСНОВЕ | 2004 |
|
RU2278870C2 |
| LEE K.S | |||
| et al | |||
| Capillary electrophoretic separation of poly(ethylene glycol)-modified granulocyte-colony stimulating factor// Arch | |||
| Pharm | |||
| Res., 2010, v.33, n.3, p.491-495. | |||
Авторы
Даты
2012-03-27—Публикация
2010-08-13—Подача