Изобретение относится к биотехнологии, в частности к генной и белковой инженерии, и может быть использовано для получения полипептида с последовательностью рекомбинантного гранулоцитарного колониестимулирующего фактора человека.
Полипептид с последовательностью гранулоцитарного колониестимулирующего фактора человека (Г-КСФ), синонимы: колониестимулирующий фактор-3, плюрипоэтин, относится к белковому семейству колониестимулирующих факторов, включающему также гранулоцитарно-макрофагальный колониестимулирующий фактор и макрофагальный колониестимулирующий фактор. Г-КСФ секретируется активированными моноцитами, макрофагами и нейтрофилами. Г-КСФ человека представляет собой гликопротеин с молекулярной массой около 20-25 кДа. Пептидная часть Г-КСФ представлена двумя вариантами: 174 и 177 аминокислотных остатков, получаемых за счет альтернативного сплайсинга матричной РНК. Оба варианта содержат по 5 цистеиновых аминокислотных остатков и два внутримолекулярных дисульфидных мостика. Г-КСФ - гемопоэтический фактор роста, стимулирует рост клеток костного мозга на последних стадиях дифференциации, значительно увеличивая количество лейкоцитов, главным образом, нейтрофилов, в периферической крови.
[Nagata S., Tsuchiya M., Asano S., Kaziro Y., Yamazaki Т., Yamamoto О., Hirata Y., Kubota N., Oheda M., Nomura H., Ono M. // Molecular cloning and expression of cDNA for human granulocyte colony-stimulating factor. Nature, 1986, v.319, p.415-418. Nagata S., Tsuchiya M., Asano S., Yamamoto О., Hirata Y., Kubota N., Oheda M., Nomura H., Yamazaki Т. // The chromosomal gene structure and two mRNAs for human granulocyte colony-stimulating factor. EMBO I., 1986, v.5(3), p.575-581.]
Г-КСФ осуществляет свое действие через связывание со специфическим рецептором [Fukunaga R., Seto Y., Mizushima S., Nagata S. // Three different mRNAs encoding human granulocyte colony-stimulating factor receptor. Proc. Natl. Acad. Sci. USA, 1990, v.87, p.8702-8706].
Лекарственные формы Г-КСФ (синонимы - Нейпоген (Ф.Хоффманн-Ля Рош Лтд.) и Граноцит (Авентис)) широко используются в медицине для терапии нейтропении у больных, получающих цитостатические средства для лечения немиелоидных злокачественных заболеваний; для купирования побочных эффектов миелосупрессивной химиотерапии; для терапии наследственной, периодической и злокачественной нейтропении; для сокращения продолжительности периода нейтропении и ее клинических последствий у больных, готовящихся к трансплантации костного мозга.
Известен способ получения рекомбинантного Г-КСФ, основанный на получении рекомбинантного Г-КСФ в трансформированных дрожжевых клетках Saccharomyces cerevisiae [Gillis S., Urdal D.L., Clevenger W., Klinke R., Sassenfeld H., Price V., Cosman D. // Production of recombinant human colony stimulating factors in yeast. Behring Inst. Mitt., 1988, p.1-7]. При таком подходе удается получить Г-КСФ человека в правильной конформации с хорошей физиологической активностью. Недостатками этого способа является снижение выхода за счет деградации целевого белка внутриклеточными протеазами.
Известен также способ получения Г-КСФ, включающий экспрессию в клетках Escherichia coli, заключающийся в секреции клетками бактерий рекомбинантного Г-КСФ в виде растворимого белка в периплазматичекое пространство [заявка РСТ WO 01/00549, МКИ C 12 N 15/70, опубл. 2001]. Способ обеспечивает возможность получения правильной конформации белка без рефолдинга. Недостатком является экспрессия Г-КСФ с дополнительным пептидом на N-конце для устранения токсического действия белка, что делает необходимым отрезание специфической протеазой этого пептида.
Известен наиболее близкий к заявленному способ получения Г-КСФ, включающий экспрессию в клетках Escherichia coli, заключающийся в быстром биосинтезе клетками бактерий рекомбинантного Г-КСФ в виде нерастворимых «телец включения» [патент РФ №2113483, МКИ C 12 N 15/27, опубл. 1/21]. В этом способе проводят конструирования рекомбинантной плазмидной ДНК pGGF8, кодирующей конститутивный синтез полипептида со свойствами Г-КСФ человека, и штамма Escherichia coli SG20050/pGGF8, обеспечивающего синтез этого пептида с уровнем экспрессии не ниже 10% суммарного клеточного белка. Недостатком этого способа является длительность процесса (16 часов) конститутивной экспрессии, что снижает технологичность процесса.
Изобретение решает задачу конструирования плазмиды, детерминирующей синтез рекомбинантного белка, и создания высокопродуктивного бактериального штамма-продуцента, позволяющего получать рекомбинантный Г-КСФ с высоким выходом (до 30% от суммарного содержания белка клеток) и по упрощенной технологии (за 6 часов).
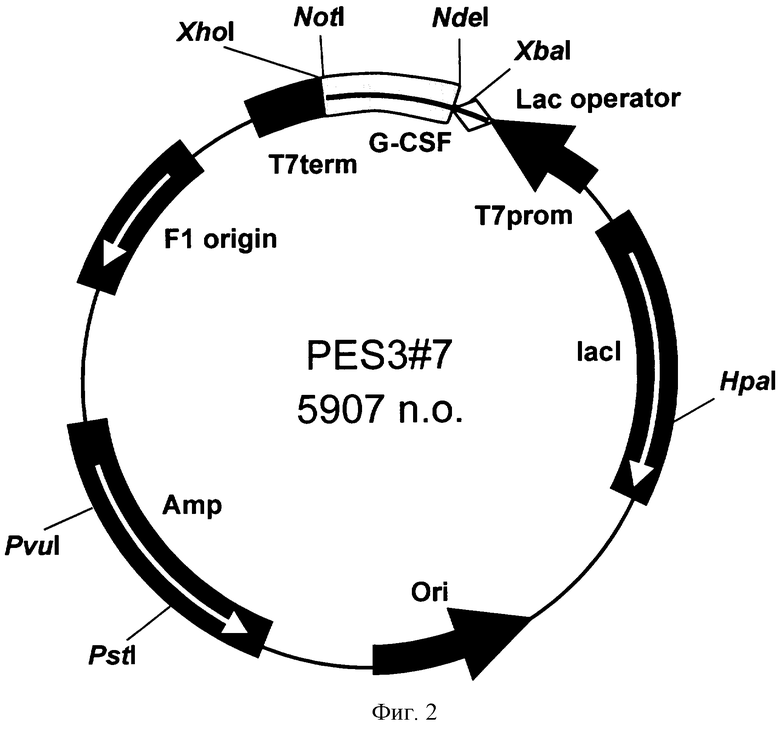
Поставленная задача решается за счет конструирования рекомбинантной плазмидной ДНК pES3-7, имеющей молекулярную массу 3,63 МДа (5907 п.о.) и состоящей из NdeI/NotI-фрагмента ДНК плазмиды рЕТ22b(+), содержащего промотор и терминатор транскрипции Т7-РНК-полимеразы, усилитель трансляции гена 10 фага Т7, ген β-лактамазы, и NdeI/NotI-фрагмента ДНК, содержащего последовательность искусственного гена рекомбинантного Г-КСФ. Плазмида pES3-7 содержит в качестве генетического маркера ген β-лактамазы, детерминирующей устойчивость трансформированных этой плазмидой клеток Е.coli к ампициллину. Плазмида pES3-7 содержит уникальные сайты узнавания эндонуклеаз рестрикции, расположенные на следующем расстоянии вправо от сайта NdeI: XbaI - 38 п.о., HpaI - 1332 п.о., PstI - 4065 п.о., PvuI - 4190 п.о., XhoI - 5363 п.о. Для решения задачи также используется штамм-продуцент Escherichia coli BL21(DE3)/pES3-7, содержащий рекомбинантную плазмидную ДНК pES3-7 - продуцент рекомбинантного Г-КСФ и обеспечивающий синтез рекомбинантного Г-КСФ в количестве 20-30% от суммарного содержания белка клеток.
Преимущества предлагаемого изобретения заключаются, во-первых, в использовании при химико-ферментативном синтезе гена Г-КСФ максимально широкого набора кодонов, являющихся оптимальными для продукции белка в Escherichia coli; расположение которых в синтетическом гене устраняет возможность образования на синтезируемой мРНК протяженных "шпилек", потенциально ингибирующих трансляцию. На фиг.1 приведена аминокислотная последовательность Г-КСФ и соответствующая ей нуклеотидная последовательность гена: верхняя строка - природная кДНК Г-КСФ, нижняя строка - синтезированный искусственный ген. Во-вторых, - применение для биосинтеза рекомбинантного белка оптимальных регуляторных элементов, контролирующих его экспрессию: Т7-Iac промотора для предотвращения базальной экспрессии гена до момента начала индукции и высокого уровня транскрипции соответствующей мРНК при индукции, высокоэффективного терминатора транскрипции Т7, и блока стоп-кодонов, исключающих биосинтез удлиненных вариантов рекомбинантного Г-КСФ. Преимущества предлагаемого штамма E.coli заключается в использовании бактерий с фенотипом Lon OmpT, что исключает возможность протеолитического расщепления синтезируемого de novo рекомбинантного Г-КСФ и загрязнения выделяемого белка наиболее активными протеазами E.coli.
Конструирование нового гена, кодирующего Г-КСФ человека, осуществляют на основе плазмиды рЕТ22b(+). Искусственный ген, кодирующий Г-КСФ, фланкированный сайтами рестриктаз NdeI и NotI, получают химико-ферментативным синтезом набора олигонуклеотидных фрагментов с последующей их сборкой и амплификацией при помощи полимеразной цепной реакции (ПЦР). Перед лигированием для генерации липких концов амплификат и векторную плазмиду обрабатывают рестриктазами NdeI и NotI. Лигазную смесь используют для трансформации компетентных клеток Е.coli DH5α. Отбор положительных клонов проводят при помощи ПЦР с использованием специфических праймеров с последующим рестриктным анализом выделенной плазмидной ДНК рестриктазами NdeI и NotI. Структуру гена, кодирующего рекомбинантный Г-КСФ, определяют секвенированием по методу Сенгера. Она должна полностью соответствовать нуклеотидной последовательности исходного искусственного гена Г-КСФ (фиг.1).
Рекомбинантная плазмидная ДНК pES3-7, кодирующая полипептид Г-КСФ, характеризуется следующими признаками:
- имеет молекулярную массу 3,63 МДа;
- кодирует полипептид Г-КСФ;
- состоит из: NdeI/NotI-фрагмента ДНК плазмиды рЕТ22b(+), содержащей промотор и терминатор транскрипции Т7-РНК-полимеразы, усилитель трансляции гена 10 фага Т7, ген β-лактамазы, и NdeI/NotI - фрагмента ДНК, включающего искусственный ген Г-КСФ;
- имеет уникальную совокупность признаков: промотор и терминатор транскрипции РНК-полимеразы бактериофага Т7, усилитель трансляции гена 10 бактериофага Т7; искусственный ген, кодирующий Г-КСФ; ген β-лактамазы, детерминирующей устойчивость трансформированных плазмидой pES3-7 клеток Е.coli к ампициллину; уникальные сайты узнавания рестрикционных эндонуклеаз, расположенные на следующем расстоянии вправо от сайта NdeI: XbaI - 38 п.о., Hpal - 1332 п.о., PstI - 4065 п.o., PvuI - 4190 п.o., XhoI - 5363 п.о.
Для получения штамма-продуцента рекомбинантного Г-КСФ плазмидную ДНК pES3-7 используют для трансформации компетентных клеток Escherichia coli BL21(DE3) и проводят отбор клонов, сохраняющих уровень биосинтеза рекомбинантного полипептида не ниже 20-30% от суммарного клеточного белка в течение по крайней мере шести последовательных пассирований. Для этого клоны трансформированных плазмидой pES3-7 клеток Е.coli BL21(DE3) выращивают в богатой среде (YT-, LB-бульон и др.) с добавлением ампициллина до 100 мкг/мл и раствора глюкозы до 1% в течение 12-14 часов, инокулируют новую порцию питательной среды в соотношении 1:100, растят культуру до достижения оптической плотности 1 О.Е., индуцируют изопропилтио-β-D-галактозидом, и растят еще 3-6 часов. Получение из клеток продуцента рекомбинантного Г-КСФ включает следующие стадии: отделение бактерий от культуральной среды, их разрушение одним из обычно применяемых способов; отмывку буферными растворами телец включения от водорастворимых компонентов клетки; солюбилизацию и восстановление целевого белка, его рефолдинг и окончательную очистку.
Полученный штамм-продуцент Escherichia coli BL21(DE3)/pES3-7 характеризуется следующими признаками.
Морфологические признаки: клетки палочковидной формы, грамотрицательные, неспороносные.
Культуральные признаки: при росте на агаризованной среде LB колонии круглые, гладкие, мутные, блестящие серые, край ровный. При росте на жидких средах (на минимальной среде с глюкозой или YT-бульоне) образуют интенсивную ровную муть.
Физико-биологические признаки: клетки растут при температуре от 4°С до 40°С при оптимуме рН от 6,8 до 7,5. В качестве источника азота используют как минеральные соли в аммонийной форме, так и органические соединения в виде пептона, триптона, дрожжевого экстракта, аминокислот и т.д. В качестве источника углерода используют аминокислоты, глицерин, углеводы.
Устойчивость к антибиотикам: клетки проявляют устойчивость к ампициллину (до 500 мкг/мл), обусловленную наличием в плазмиде гена β-лактамазы(bla).
Преимущества предлагаемого штамма-продуцента заключается в использовании бактерий с фенотипом Lon OmpT, что исключает возможность протеолитического расщепления синтезируемого de novo рекомбинантного Г-КСФ и загрязнения выделяемого белка наиболее активными протеазами E.coli.
Клетки Е.coli BL21(DE3)/pES3-7 являются суперпродуцентом. При индукции изопропилтио-β-D-галактозидом происходит эффективный биосинтез рекомбинантного Г-КСФ, который накапливается в клетках в количестве более 20% суммарного белка бактерий.
На фиг.1 представлена нуклеотидная последовательность и кодируемая ею аминокислотная последовательность NdeI/NotI-фрагмента плазмиды pES3-7; на фиг.2 - физическая карта плазмиды pES3-7.
Изобретение иллюстрируют примеры.
Пример 1.
Конструирование рекомбинантной плазмидной ДНК pES3-7.
Нуклеотидную последовательность, соответствующую гену Г-КСФ, получают химико-ферментативным синтезом. Для этого теоретически расчитанную последовательность ДНК разбивают на перекрывающиеся фрагменты размером около 50 п.о. Химический синтез олигонуклеотидов, соответствующих этим фрагментам, выполняют твердофазным фосфоамидитным методом при помощи, например, ДНК-синтезатора ASM-102U (БИОССЕТ, Новосибирск) с наращиванием олигонуклеотидной цепи в направлении от 3'-конца к 5'-концу с помощью защищенных фосфамидитов -5'-диметокситритил-N-ацил-2'-дезоксинуклеозид-3'-O-(β-цианэтил-диизопропиламино)-фосфитов, активированных тетразолом. Синтез проводят в масштабе 0,5-0,7 мкмоль, используя в качестве носителя пористое стекло (размер пор 500 Å), к которому через 3'-сукцинатную связь присоединяют первое нуклеозидное звено (нагрузка 20-30 мкмоль/г). Полученные олигонуклеотиды подвергают 5'-концевому фосфорилированию с использованием Т4 полинуклеотидкиназы (Fennentas, Литва). Для этого олигонуклеотиды в количестве 20 пмоль смешивают с ферментом в количестве 10 ед. в буферном растворе, содержащем 50 мМ Tris-HCl (pH 7.6 при 25°С), 10 мМ MgCl2, 5 мМ дитиотреита, 1 мМ спермидина, 0.1 мМ АТФ и 0.1 мМ ЭДТА. Реакцию ведут 30 минут, полинуклеотид киназу инактивируют нагреванием до 65°С в течение 10 мин.
Фосфорилированные олигонуклестиды смешивают в эквимолярном соотношении в 50 мкл буфера, содержащего 20 мМ трис-HCl, pH 7,56, 10 мМ MgCl2, 0,2 мМ rATR, 10 мМ дитиотреита, прогревают до 65°С, медленно охлаждают до 37°С в течение часа и добавляют 10 ед.ак. Т4-ДНК-лигазы. Реакцию лигирования ДНК проводят 4 ч при 37°С. 0.1 мкл полученного раствора используют в качестве матрицы в полимеразной цепной реакции (ПЦР) в присутствии термостабильной ДНК-полимеразы Pfu и специфических праймеров:
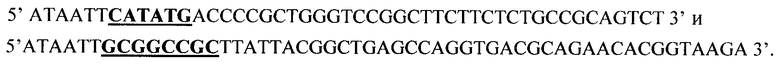
Проводят 25 циклов амплификации (95°С, 20 с; 62°С, 40 с; 72°С, 60 с) для синтеза полноразмерного фрагмента ДНК, содержащего последовательность гена Г-КСФ, фланкированного сайтами узнавания рестриктаз NdeI и NotI. Продукт амплификации гидролизуют рестриктазами NdeI и NotI, очищают электрофорезом в 5% акриламидном геле, полосу ДНК величиной около 550 п.о. выделяют из геля методом электроэлюции и осаждают ДНК из раствора этанолом.
Для приготовления вектора ДНК плазмиды рЕТ-22b(+) (3 мкг, 1 пмоль) обрабатывают в 40 мкл буфера Y (33 мМ трис-ацетат, рН 7,9, 10 мМ Mg-ацетат, 66 мМ К-ацетат 1, 0,5 мМ DTT, 0,1 мг/мл BSA) рестриктазой NdeI (10 ед.акт.), осаждают ДНК этанолом, растворяют в 40 мкл буфура R (10 мМ трис-HCl, рН 8,5, 10 мМ MgCl2, 100 мМ KCl, 0,1 мг/мл BSA) и обрабатывают рестриктазой Notl (10 ед.акт.) в течение 1 ч при 37°С. Полученный фрагмент ДНК величиной 5,4 т.п.о. после электрофоретического разделения в 1% агарозном геле выделяют из геля методом электроэлюции и осаждают ДНК из раствора этанолом.
1 мкг полученного векторного фрагмента лигируют с 2 пмоль NdeI/NotI-фрагмента размером 550 п.о., содержащего синтетический ген рекомбинантного Г-КСФ, в 10 мкл буфера (20 мМ трис-HCl, рН 7,56, 10 мМ MgCl2, 0,2 мМ rATR, 10 мМ дитиотреита) с помощью 10 ед.акт. Т4-ДНК-лигазы в течение 12 ч при 10°С.
1 мкл полученной лигазной смеси используют для электротрансформации компетентных клеток Е.coli BL21(DE3), которую проводят, например, при помощи аппарата для электротрансформации ВТХ 600 (ВТХ, США) при зазоре между пластинами электропорационной кюветы 1 мм и напряжении разряда 1.4 кВ. После трансформации суспензию бактерий смешивают с питательной средой SOC, растят 1 час на +37°С и высевают на чашки Петри с LB-агаром, содержащим 50 мкг/мл ампициллина.
Первичный отбор клонов, содержащих нужную плазмиду, проводят методом "ПЦР с клонов" с использованием специфических праймеров:
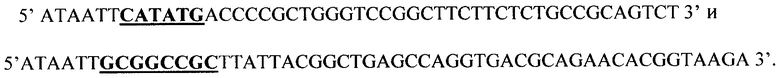
Проводят 25 циклов амплификации (95°С, 20 с; 62°С, 40 с; 72°С, 60 с), с последующим электрофоретическим анализом ПЦР продуктов в 1% агарозном геле на наличие ПЦР-продукта длиной около 550 п.н. Отобранные клоны используют для подроста в жидкой среде и выделения плазмидной ДНК плазмиды, которую анализируют на наличие вставки с помощью эндонуклеаз рестрикции NdeI и NotI с последующим разделением продуктов гидролиза в 5% полиакриламидном геле. Окончательное строение плазмид, содержащих NdeI/NotI-фрагмент около 550 п.о., подтверждают определением нуклеотидной последовательности методом секвенирования по Сенгеру. По данным секвенирования отбирают ту плазмиду, нуклеотидная и соответствующая ей аминокислотная последовательности NdeI/NotI-фрагмента которой полностью идентичны первоначально запланированной (фиг.1). Проводят трансформацию клеток Е.coli BL21(DE3) выбранной плазмидой, как описано выше, петлей переносят 5-10 колоний в 5 мл жидкой среды 2xYT, содержащей 50 мкг/мл ампициллина, в течение 2 ч на качалке со скоростью вращения 190 об/мин до мутности А550 0,7-0,8, отбирают аликвоту культуры для последующего анализа, прибавляют индуктор - изопропилтио-β-D-галактозид до концентрации 0,2 мМ и продолжают рост еще 2 ч. Равные аликвоты суспензии клеток, отобранных до внесения индуктора и после завершения роста, центрифугируют, отделяют супернатант и анализируют осадок клеток электрофорезом в ПААГ. Появление отчетливо видимой полосы белка в районе 20 кДа в образце пробы, отобранной после индукции, свидетельствует о способности штамма синтезировать рекомбинантный Г-КСФ при индукции IPTG и полностью подтверждает корректность сборки плазмиды.
Пример 2.
Получение штамма-продуцента Е.coli BL21(DE3)/pES3-7 с рекомбинантным Г-КСФ и определение его продуктивности.
Штамм-продуцент Е.coli BL21(DE3)/pES3-7 получают трансформацией компетентных клеток Е.coli BL21(DE3) плазмидой pES3-7, как описано в примере 1.
Штамм продуцента Е.coli BL21(DE3)/pES3-7 выращивают при 37°С в 100 мл YT-бульона (рН 7,0) с 50 мкг/мл ампициллина в течение 2 ч на качалке со скоростью вращения 190 об/мин до мутности А550 0,7-0,8, прибавляют изопропилтио-β-D-галактозид до концентрации 0,2 мМ и продолжают процесс еще 4 ч, или продолжают выращивание в отсутствие индуктора в течение 4 ч. Каждый час отбирают пробу по 2 мл, определяют А550 и количество культуры, соответствующее 1 мл с А550 1,0, центрифугируют 5 мин при 6000 об/мин. Осажденные клетки в 100 мкл лизирующего буфера с красителем бромфеноловым синим обрабатывают 20 с ультразвуком, нагревают 3 мин при 100°С и пробы по 1 мкл используют для электрофореза в 15% ПААГ. Гель прокрашивают кумасси R-250 по стандартной методике и сканируют для определения относительного количества белка в полосе целевого белка. По данным сканирования содержание рекомбинантного Г-КСФ составляет 20-30% от всех клеточных белков.
Изобретение относится к генной инженерии и может быть использовано для получения рекомбинантного гранулоцитарного колониестимулирующего фактора человека. Конструируют рекомбинантную плазмидную ДНК pES3-7, которая имеет молекулярную массу 3,63 МДа (5907 п.о.) и состоит из Ndel/Notl-фрагмента ДНК, содержащего последовательность искусственного гена рекомбинантного гранулоцитарного колониестимулирующего фактора, гена β-лактамазы, и Ndel/Notl-фрагмента ДНК плазмиды рЕТ22b(+), содержащего промотор и терминатор транскрипции Т7-РНК-полимеразы, усилитель трансляции гена 10 фага Т7. Плазмида pES3-7 содержит в качестве генетического маркера ген β-лактамазы, детерминирующей устойчивость трансформированных плазмидой pES3-7 клеток E.coli к ампициллину и уникальные сайты узнавания эндонуклеаз рестрикции, расположенные на следующем расстоянии вправо от сайта Ndel: Xbal - 38 п.о., Hpal - 1332 п.о., Pstl - 4065 п.о., Pvul - 4190 п.о., Xhol - 5363 п.о. Полученной плазмидой трансформируют клетки Escherichia coli и получают штамм Е.coli BL21(DE3)/pES3-7 - суперпродуцент рекомбинантного гранулоцитарного колониестимулирующего фактора. Изобретение позволяет получать рекомбинантный гранулоцитарный колониестимулирующий фактор с высоким выходом (в количестве 20-30% от суммарного содержания белка клеток) и по упрощенной технологии. 2 н.п. ф-лы, 2 ил.
NdeI/NotI-фрагмента ДНК плазмиды рЕТ22b(+), содержащего промотор и терминатор транскрипции Т7-РНК-полимеразы и усилитель трансляции гена 10 фага Т7;
NdeI/NotI-фрагмента ДНК, содержащего последовательность искусственного гена рекомбинантного гранулоцитарного колониестимулирующего фактора, приведенную на фиг.1, и содержащая
ген β-лактамазы, детерминирующий устойчивость трансформированных плазмидой pES3-7 клеток Е. coli к ампициллину, в качестве генетического маркера,
уникальные сайты узнавания эндонуклеаз рестрикции, расположенные на следующем расстоянии вправо от сайта NdeI: XbaI - 38 п.о., HpaI - 1332 п.о., PstI - 4065 п.о., PvuI - 4190 п.о., XhoI - 5363 п.о.
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК PGGF 8, КОДИРУЮЩАЯ ПОЛИПЕПТИД СО СВОЙСТВАМИ ГРАНУЛОЦИТАРНОГО КОЛОНИЕСТИМУЛИРУЮЩЕГО ФАКТОРА ЧЕЛОВЕКА И ШТАММ БАКТЕРИЙ ESCHERICHIA COLI - ПРОДУЦЕНТ ПОЛИПЕПТИДА СО СВОЙСТВАМИ ГРАНУЛОЦИТАРНОГО КОЛОНИЕСТИМУЛИРУЮЩЕГО ФАКТОРА ЧЕЛОВЕКА | 1996 |
|
RU2113483C1 |
| JEONG K.J | |||
| et al., Secretory production of human granulocyte colony-stimulating factor in Escherichia coli, Protein Expr | |||
| Purif., 2001, v.23, n.2, p.311-318 | |||
| KR 2001094652, 01.11.2001 | |||
| RU 21434930 C1, 27.12.1999. | |||
Авторы
Даты
2005-09-10—Публикация
2003-07-24—Подача