Изобретение относится к области биохимии и биотехнологии и представляет собой способ выделения и очистки физиологически активного рекомбинантного гранулоцитарного колониестимулирующего фактора человека (рчГ-КСФ), пригодного для научно-исследовательских работ и в качестве медицинского препарата.
Г-КСФ относится к группе клеточных факторов роста и играет важную роль в стимулировании пролиферации, дифференциации и функциональной активности гранулоцитсодержащих лейкоцитов крови [1], рчГ-КСФ снижает продолжительность нейтропении при химиотерапии злокачественных опухолей и трансплантации костного мозга [2, 3], укорачивает период гранулоцитопении, индуцируемой облучением [4]. Все это делает перспективным его применение в медицине.
Е. coli-продуцированный рекомбинантный человеческий гранулоцитарный колониестимулирующий фактор - это 174-аминокислотная последовательность, содержащая дополнительный Met на N-конце. Молекулярная масса белка, определенная электрофорезом в денатурирующих условиях, составляет 18800 Д [5]. Молекула содержит свободный цистеин в положении 17 и две внутримолекулярные дисульфидные связи Cys36-Sys42 и Sys64-Sys74 [5]. Для восстановления биологической активности рчГ-КСФ, экспрессированного в Е.coli в виде нерастворимых тел включения, требуется ренатурация [6].
Известен способ получения Г-КСФ из клеток карциномы мочевого пузыря (линия 5737) [7, 8]. Метод включает концентрирование культуральной жидкости сульфатом аммония, диализ, хроматографию на ДЭАЭ-целлюлозе, гель-фильтрацию на Ультрагеле АсА-54 и обращенно-фазовую высокоэффективную жидкостную хроматографию (ВЭЖХ). Приведенный метод позволил получить препарат с содержанием Г-КСФ более 95% (по результатам гель-электрофореза в полиакриламидном геле). Данные о выходе и содержании примесей отсутствуют.
Недостатки способа: использование соматических клеток влечет за собой повышенную трудоемкость по их сохранению и культивированию, процесс включает три хроматографические очистки, что также повышает трудоемкость процесса и понижает выход продукта. Кроме того, использование обращенно-фазовой высокоэффективной жидкостной хроматографии требует специального оборудования.
Описан способ [7] получения рчГ-КСФ из E.coli, трансформированной плазмидой p536hG-CSF2. Клетки суспендируют в воде, и суспензию несколько раз продавливают в френч-прессе. Осадок отделяют центрифугированием и ресуспендируют в воде до концентрации белка 5-6 мг/мл. Осадок отделяют центрифугированием и материал осадка растворяют в 1% лаурате натрия, содержащем 50 мМ трис, рН 8,5 и 5% этанол. Нерастворимый материал отделяют центрифугированием, а супернатант наносят на колонку (С4) ВЭЖХ. Колонку промывают 100 мМ ацетатом аммония, рН 6,0-7,0 и элюируют рчГ-КСФ градиентом изопропанола в ацетате аммония. Чистота препарата по результатам гель-электрофореза в полиакриламидном геле более 95%. Недостатком способа является использование обращенно-фазовой высокоэффективной жидкостной хроматографии, что требует специального дорогостоящего оборудования. Данных о выходе рчГ-КСФ нет.
Наиболее близким к заявляемому способу является способ получения рекомбинантного Г-КСФ человека из клеток Escherichia coli, содержащих плазмиду pCfBD28 [9] (прототип). Клетки разрушают ультразвуком в трис-НСl буфере. Тела включения отделяют центрифугированием и промывают.
Отмытые тела включения растворяют в 20 мМ трис-НСl буфере, рН 8,0, содержащем 8 М мочевину.
К полученному раствору добавляют дитиотреит до концентрации 0,1 мМ и инкубируют в течение 5 ч при температуре 4oС.
К раствору восстановленного белка для ренатурации добавляют окисленный глутатион до концентрации 0,1 мМ и инкубируют в течение ночи при температуре 4oС.
Раствор ренатурированного белка наносят на колонку ДЭАЭ-Тойоперл, уравновешенную 10 мМ трис-НCl буфером, рН 8,0. рчГ-КСФ элюируют линейным градиентом хлористого натрия.
К элюату, содержащему рчГ-КСФ, добавляют сульфат аммония до концентрации 0,25 М, и раствор наносят на колонку Бутил-Тойоперл, уравновешенную 10 мМ трис-НCl буфером, рН 8,0, содержащим 0,25 М сульфат аммония. рчГ-КСФ элюируют раствором буфера с понижающейся концентрацией сульфата аммония.
Фракции, содержащие рчГ-КСФ, объединяют и обессоливают на колонке с сефадексом G-25 в 10 мМ фосфатном буфере, рН 7,2.
Электрофоретическая чистота получаемого рчГ-КСФ при нагрузке на гель 8 мкг препарата составила более 99%. Выход очищенного рчГ-КСФ составил 33% по отношению к количеству рчГ-КСФ в телах включения.
Недостатками способа-прототипа являются:
- использование для ренатурации специального окислителя - окисленного глутатиона;
- использование для получения очищенного рчГ-КСФ трех стадий хроматографии.
Технической задачей данного изобретения является упрощение способа, снижение потерь целевого продукта и получение препарата рчГ-КСФ с низким содержанием примесей ДНК, липополисахаридов и белков штамма-продуцента, пригодного для использования не только в научно-исследовательских работах, но и в качестве основы для создания нового лекарственного препарата [10].
Сущность предлагаемого способа заключается в следующем: биомассу рекомбинантного штамма E. coli SG 20050/pGGF8 [11], выращенную как описано ранее [12] и собранную центрифугированием, суспендируют в 10 мМ трис-НCl буфере, рН 8,0. Суспензию клеток обрабатывают ультразвуком в течение 5 мин и центрифугируют в течение 20 мин.
Полученный осадок тел включения отмывают известным способом [9].
Отмытый осадок тел включения растворяют в 10 мМ трис-НСl буфере, рН 8,0, содержащем 8 М мочевину.
К раствору добавляют 2-меркаптоэтанол до концентрации 10 мМ и инкубируют в течение ночи при комнатной температуре.
рчГ-КСФ ренатурируют путем разбавления полученного белкового раствора 10 мМ натрий фосфатным буфером, рН 8,0, содержащим 10 мМ ЭДТА и выдерживанием раствора при температуре 4-6oС в течение 20-24 ч.
К смеси ренатурированных белков добавляют уксусную кислоту до рН 4,4-4,5, разбавляют в два раза водой.
Полученный раствор ренатурированного белка наносят на две, соединенные последовательно и уравновешенные 20 мМ натрий ацетатным буфером, рН 4,4-4,5 (буфер "А"), колонки с ДЭАЭ-целлюлозой и SP-сефадексом (С-25). После нанесения всего раствора колонки промывают буфером "А". Колонку с ДЭАЭ-целлюлозой отсоединяют и элюируют рчГ-КСФ с SP-сефадекса линейным градиентом хлористого натрия от 0 до 0,4 М в буфере "А". Фракции, содержащие рчГ-КСФ, объединяют.
Полученный элюат диализуют против 0,05 М натрий ацетатного буфера, рН 4,4-4,5, содержащего 0,1 М хлористый натрий.
Выход электрофоретически гомогенного рчГ-КСФ составляет 24-30 мг из 1 л культуры клеток E. coli SG 20050/pGGF8 (57% от количества рчГ-КСФ в телах включения). Специфическая активность, определенная по образованию колоний нейтрофилов из клеток предшественников костного мозга мыши [13, 15], составляет 107-108 МЕ/мг белка. Содержание примесей липополисахаридов, ДНК и белков штамма-продуцента соответствует требованиям Фармкомитета к качеству генно-инженерных препаратов медицинского назначения [10].
Предлагаемая схема позволяет получать препараты рчГ-КСФ с высоким выходом и необходимой чистотой, что позволяет использовать их в качестве субстанции для создания лекарственного препарата нового поколения.
Новым по сравнению со способом-прототипом является:
- ренатурация рчГ-КСФ разбавлением раствора тел включения нейтральным буфером, содержащим ЭДТА (вместо использования дорогостоящего окисленного глутатиона в способе-прототипе);
- одностадийная хроматографическая очистка рчГ-КСФ на двух последовательно соединенных колонках с ДЭАЭ-целлюлозой и SP-сефадексом в градиенте концентрации соли (вместо трехстадийной в способе-прототипе).
Все это позволяет упростить способ получения рчГ-КСФ и повысить выход конечного продукта с 33% в способе-прототипе до 57%.
Предлагаемый способ осуществлен с использованием штамма-продуцента, полученного трансформацией клеток E.coli SG20050 плазмидой pGGF8 [11]. Биомасса клеток получена, как описано ранее [12].
Клетки разрушают ультразвуком, центрифугируют и осадок тел включения отмывают известным способом. Растворение тел включения происходит в буферном растворе, содержащем 8 М мочевину.
По результатам электрофореза полученного материала в ПААГ в присутствии SDS без обработки 2-меркаптоэтанолом нерастворимый и неактивный белок в телах включения представляет собой олигомеры, где полипептиды соединены дисульфидными связями. Для разрушения дисульфидных связей и получения мономерного белка используют восстановление 2-меркаптоэтанолом.
Полученный раствор белка для ренатурации разбавляют фосфатным буфером до концентрации мочевины 0,8 М и выдерживают раствор при температуре 4-6oC в течение 18-20 ч. В результате понижения концентрации мочевины происходит сворачивание (ренатурация) полипептидных молекул, а за счет растворенного кислорода происходит образование внутримолекулярных дисульфидных связей. Для минимизации образования межмолекулярных связей процесс проводят при температуре 4-6oС.
Для остановки процесса ренатурации и снижения количества олигомеров используют закисление смеси уксусной кислотой до рН 4,4-4,5.
Для очистки белка используют одностадийную хроматографию на двух колонках: первая с ДЭАЭ-целлюлозой, вторая с SP-сефадексом. Использование ДЭАЭ-целлюлозы позволяет сорбировать из раствора липополисахариды, нуклеиновые кислоты и белки штамма-продуцента. При этом рчГ-КСФ на первой колонке не сорбируется. На второй колонке происходит сорбция рчГ-КСФ, при этом если часть липополисахаридов и нуклеиновых кислот не сорбировалась на ДЭАЭ-целлюлозе, то они не сорбируются и на SP-сефадексе и элюируются при промывке колонки. рчГ-КСФ элюируют с SP-сефадекса градиентом концентрации хлористого натрия (0-0,4 М) в 0,02 М натрий ацетатном буфере, рН 4,4-4,5. Использование приведенного способа позволяет снизить потери при хроматографической очистке рчГ-КСФ примерно на 20% по сравнению со способом-прототипом и получать рчГ-КСФ с высоким выходом 24-30 мг/л культуры и незначительным содержанием липополисахаридов, белков штамма-продуцента, ДНК.
Предлагаемое изобретение иллюстрируется фигурами графического изображения, где представлены:
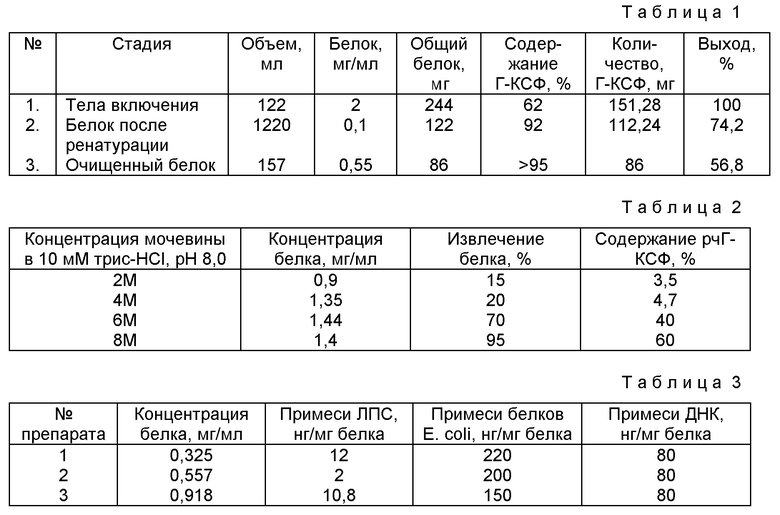
Фиг.1. Электрофоретический анализ белков в 12%-ном полиакриламидном геле в присутствии SDS в ходе получения нерастворимых тел включения:
дорожка 1 - разрушенные клетки штамма-продуцента;
дорожка 2 - супернатант после отделения тел включения;
дорожка 3 - супернатант после промывки 1 М LiCl с мочевиной;
дорожка 4 - супернатант после промывки буферным раствором;
дорожки 5, 6 - отмытые тела включения в мочевине (5 и 10 мкг белка);
дорожка 7 - белки-стандарты.
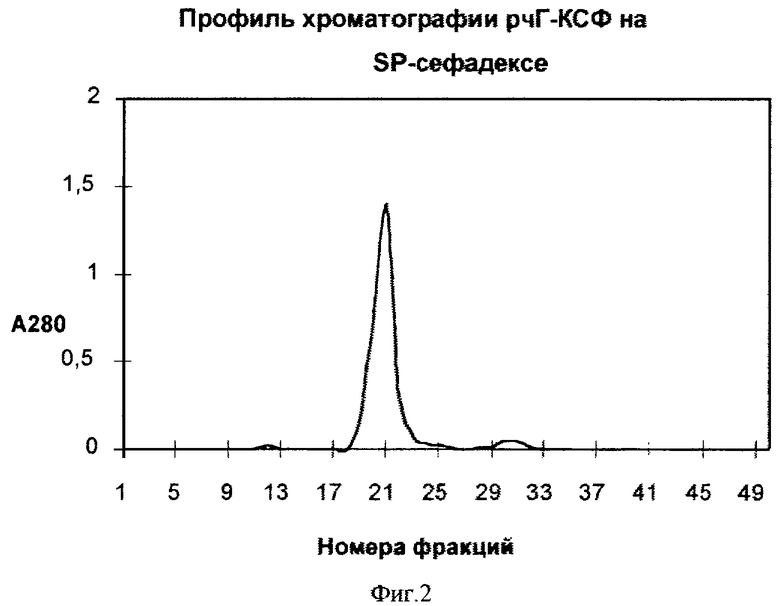
Фиг.2. Профиль элюции рчГ-КСФ с колонки с SP-сефадексом.
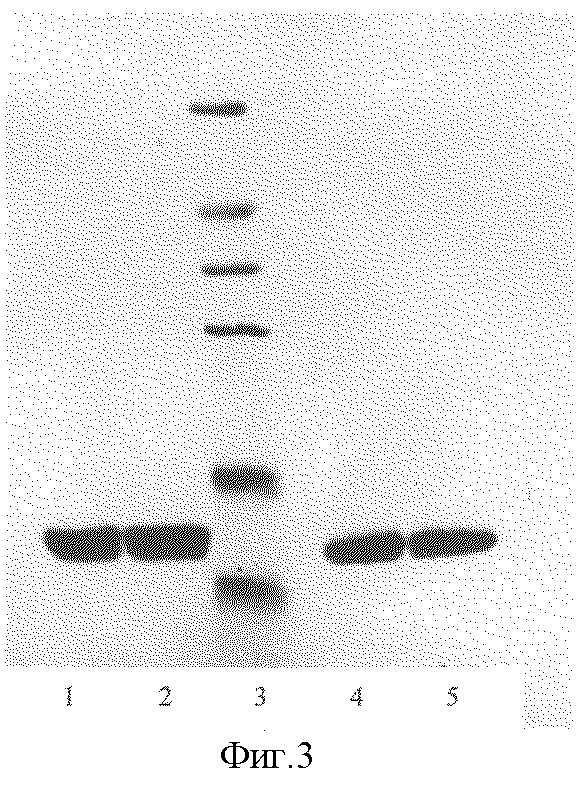
Фиг.3. Электрофоретический анализ очищенного рчГ-КСФ:
дорожки 1, 2 - препараты рчГ-КСФ (по 40 мкг/гель): подготовка проб в присутствии 2-меркаптоэтанола;
дорожка 3 - белки-стандарты;
дорожки 4, 5 - препараты рчГ-КСФ (по 40 мкг/гель): подготовка проб в отсутствие 2-меркаптоэтанола.
Примеры конкретного выполнения способа приведены ниже.
Пример 1. Разрушение клеток и получение тел включения
10 г биомассы штамма-продуцента E.coli SO 20050/pGGF8 суспендируют в 100 мл 10 мМ трис-HCl, рН 8,0. Клетки разрушают ультразвуком и суспензию центрифугируют 20 мин при температуре 4oС. Осадок тел включения отмывают раствором соли в буфере. Промывочный раствор содержит набор солюбилизированных низкомолекулярных белков, но не содержит рчГ-КСФ (фиг.1, дорожки 3, 4). Количество белка в полученном осадке 100-120 мг (табл.2) (фиг.1, дорожки 5, 6).
Пример 2. Растворение тел включения в мочевине и восстановление белка
К полученному в примере 1 осадку добавляют 50 мл 10 мМ трис-HCl, рН 8,0, содержащего 8 М мочевину и интенсивно перемешивают до прозрачности. В растворе определяют концентрацию белка. К раствору добавляют 10 мМ трис-HCl, рН 8,0, содержащего 8 М мочевину до концентрации белка 1-2 мг/мл. Для восстановления белка добавляют 2-меркаптоэтанол до концентрации 10 мМ и смесь оставляют на 18-20 ч при комнатной температуре (18-23oС).
Пример 3. Ренатурация рчГ-КСФ
Раствор восстановленного белка, полученного в предыдущем примере, охлаждают до температуры 4-6oС и добавляют 9 объемов 10 мМ натрий фосфатного буфера, содержащего 10 мМ ЭДТА, охлажденного до указанной температуры. Полученную смесь выдерживают при температуре 4-6oC в течение 20-24 ч. К раствору ренатурированного белка при перемешивании добавляют уксусную кислоту до рН 4,4-4,5.
Пример 4. Очистка ренатурированного рчГ-КСФ
Раствор ренатурированного белка, полученный в примере 3, разбавляют в два раза дистиллированной водой и наносят на две колонки, соединенные последовательно 1-ая 100 мл ДЭАЭ-целлюлозы, 2-ая 300 мл SP-сефадекса, уравновешенные 20 мМ натрий ацетатным буфером, рН 4,4 (буфер "А"). После нанесения колонки промывают буфером "А", колонку с ДЭАЭ-целлюлозой отсоединяют и элюируют сорбированные на SP-сефадексе белки линейным градиентом хлористого натрия от 0 до 0,4 М в буфере "А".
Фракции анализируют электрофорезом в денатурирующих условиях в 12% ПААГ. Фракции, содержащие белок с молекулярной массой 18800, объединяют.
Полученный элюат очищенного рчГ-КСФ диализуют против 50 мМ натрий ацетатного буфера, содержащего 0,1 М хлористый натрий. Конечный объем полученного препарата составил 157 мл, концентрация белка 0,557 мг/мл.
Суммарные данные по очистке рчГ-КСФ из 10 г биомассы приведены в таблице 1.
Электрофоретическая чистота полученного белка рчГ-КСФ при нагрузке на лунку 40 мкг составляет более 95% (Фиг.3).
Пример 5. Определение биологической активности препарата рчГ-КСФ
Суспензию клеток костного мозга добавляют во флаконы, содержащие полную обогащенную среду, из расчета 105 клеток на 1 мл, после чего во флаконы вносят 20 мкл разбавленного раствора рчГ-КСФ. Контрольный образец получают добавлением к суспензии клеток костного мозга в обогащенной среде 20 мкл раствора хлористого натрия с концентрацией 0,15 М. Полученные смеси разносят в лунки 24-луночного планшета в объеме 0,5 мл, используя по две лунки на каждое разведение препарата рчГ-КСФ (от 1 до 50 нг/мл как тестируемого образца, так и стандартного препарата). Планшет с клетками инкубируют при 37oС и 100% влажности в течение 7-8 суток в атмосфере с 5% углекислого газа. По окончании инкубации проводят учет колониестимулирующей активности препаратов, подсчитывая под микроскопом число выросших в лунках колоний. Под колониями подразумевают образовавшиеся в результате культивирования очаги гемопоэза, содержащие более 50 клеток.
За 50 единиц активности принимают количество рчГ-КСФ, которое стимулирует образование 50% от максимального количества колоний [13].
Биологическая активность полученных препаратов рчГ-КСФ составляет 107-108 МЕ/мг белка.
Пример 6. Подбор концентрации раствора мочевины для растворения тел включения рчГ-КСФ
40 мл равномерной суспензии тел включения в трис-НСl буфере рН 8,0 разливают по 10 мл в центрифужные пробирки и осадки отделяют центрифугированием. К полученным осадкам добавляют по 10 мл трис-НСl буфера, рН 8,0, содержащего различные концентрации мочевины. Осадки растворяют перемешиванием в течение 20 мин и центрифугируют. В супернатантах определяют концентрацию белка, общий белок, содержание рчГ-КСФ, общее количество рчГ-КСФ и выход рчГ-КСФ относительно количества целевого белка в телах включения. Полученные результаты сведены в таблицу 2.
Исходя из полученных данных видно, что наибольшее извлечение целевого белка происходит при концентрации мочевины 8 М.
Пример 7. Определение количества примесей в конечном продукте
Примеси липополисахаридов определяли как описано ранее [14].
Примеси белков штамма-продуцента (Е.coli SG20050/pGGF8) определяли иммуноферментным анализом с использованием поликлональных антител к белкам Е. coli SG20050 [16].
Примеси ДНК определяли гибридизацией [10]. Результаты представлены в таблице 3.
Полученные данные указывают на то, что содержание примесей в рчГ-КСФ незначительно и соответствует требованиям, предъявляемым Минздравом к медицинским иммунобиологическим препаратам, полученным методами генетической инженерии [17].
Таким образом, использование предлагаемого способа по сравнению с прототипом позволяет упростить метод очистки целевого продукта (провести ренатурацию без использования специального окисляющего агента; осуществить хроматографическую очистку на двух сорбентах одностадийно (соединив колонки последовательно); увеличить относительный выход целевого продукта на 20% (с 33% в прототипе до 57% в предлагаемом способе) и при этом не снижается чистота продукта.
ЛИТЕРАТУРА
1. Metcalf D. Blood, 1986, v. 67, No. 2, p. 257-267.
2. Morstin G., Souza L.M., Keech J., The Lancet, 1988, No. 26, p. 667-671.
3. Bronchud, M. H. , Scarffe, J.H., Thatcher, N. et al. Br. J. Cancer, 1987, v. 56, No. 6, p. 809-813.
4. Groopman, J.E., Molina, J.-M., Scadden, D.T.N. Engl. J. Med., 1989, v. 321, No. 21, p. 1449-1459.
5. Lu, H. S. , Souza, L.M., Boone, Т.С., Lai, P.-H. Arch. Biochem. Biophys., 1989, v. 268, No. 1, p. 81-92.
6. Lu, H.S., Clogston, C.L., Narhi, L.O. et al. J. Biol. Chem., 1992, v. 267, No. 13, p. 8770-8777.
7. Souza, L.M., Boone, T.C., Gabrilove, J., Lai, P.H. Science, 1987, v. 232, p. 61-65.
8. Welte, K. , Platzer, E., Lu, L. et al. Proc. Natl. Acad. Sci. USA, 1985, v. 82, No. 5, p. 1526-1530.
9. Motoo Yamasaki et al. Biosci. Biotechnol. Biochem., 1998, v.62, N 8, p.1528-1534.
10. Методы контроля медицинских иммунобиологических препаратов, вводимых людям. Методические указания, МУК 4.1/4.2/588-96, М., 1998.
11. Патент РФ 2113483, кл. C 12 N 15/27, опубл. БИ 17, 1998 г.
12. Патент РФ 2158303, кл. С 12 N 1/21, опубл. БИ 30, 2000 г.
13. Nomura H., Imazeki I., Oheda M., Kubota M., Tamura M., Ono M., Ueyama Y., Asano S., EMBO J., 1986, v. 5, No. 5, p. 891-896.
14. Денисова Л.Я., Батурина И.И., Закабунин А.И., Афиногенова Г.H., Пустошилова Н.М. ЖМЭИ, 1999, 5, с.109-112.
15. Гольдберг Е. Д. , Дыгай А.М., Жданов В.В. и др. Бюллетень экспериментальной биологии и медицины, 1999, т. 128, 8, с.194-199.
16. Афиногенова Г.Н., Гладченко Т.Н., Веревкина К.Н., Пустошилова Н.М. Сборник трудов научных сотрудников НИКТИ БАВ, Бердск, 1999 г.
17. Общие требования к медицинским иммунобиологическим препаратам, полученным методами генной инженерии. РД 42-68-9-89, М., 1989.
Изобретение относится к биохимии и биотехнологии и может быть использовано для выделения и очистки физиологически активного рекомбинантного гранулоцитарного колониестимулирующего фактора человека (рчГ-КСФ). рчГ-КСФ получают из трансформированных клеток Escherichia coli. Тела включения, содержащие рекомбинантный фактор, растворяют мочевиной, восстановление проводят 10 мМ 2-меркаптоэтанолом. Ренатурацию осуществляют разбавлением раствора нейтральным буфером, содержащим ЭДТА, до концентрации мочевины 0,8 М. Хроматографическую очистку рч Г-КСФ проводят на двух последовательно соединенных колонках с ДЭАЭ-целлюлозой и SP-сефадексом с последующим элюированием целевого белка с колонки с SP-сефадексом в линейном градиенте хлористого натрия в 0,02 М натрий ацетатном буфере при рН 4,4-4,5. Изобретение позволяет увеличить выход продукта с сохранением его биологической активности и чистоты. 1 з.п. ф-лы, 3 табл., 3 ил.
| MOTOO YAMASAKI et al., Purification and Characterization of Recombinant Human Granulocyte Colonystimulating Factor (rhG-CSF) Derivatives: KW-2228 and other Derivatives, Biosci | |||
| Biotechnol | |||
| Biochem., 1998, v.68, n.8, р.1528-1534 | |||
| РЕКОМБИНАТНАЯ ПЛАЗМИДНАЯ ДНК Р 280 GM, КОДИРУЮЩАЯ ПОЛИПЕПТИД СО СВОЙСТВАМИ ГРАНУЛОЦИТАРНО-МАКРОФАГАЛЬНОГО КОЛОНИЕСТИМУЛИРУЮЩЕГО ФАКТОРА ЧЕЛОВЕКА. ШТАММ ESCHERICHIA COLI SG20050/Р 280 GM - ПРОДУЦЕНТ ПОЛИПЕПТИДА СО СВОЙСТВАМИ ГРАНУЛОЦИТАРНО-МАКРОФАГАЛЬНОГО КОЛОНИЕСТИМУЛИРУЮЩЕГО ФАКТОРА ЧЕЛОВЕКА | 1994 |
|
RU2091488C1 |
| РЕКОМБИНАНТНЫЙ ГРАНУЛОЦИТ-КОЛОНИЕСТИМУЛИРУЮЩИЙ ФАКТОР (G - CSF) БЕЗ ДОПОЛНИТЕЛЬНОГО ОСТАТКА МЕТИОНИНА НА N-КОНЦЕ | 1991 |
|
RU2108386C1 |
| US 5908763, 01.06.1999 | |||
| US 5047504, 10.09.1991. | |||
Авторы
Даты
2003-04-10—Публикация
2001-03-19—Подача