Изобретение относится к производным 1,3,4-тиадиазолинов (I), тиадиазинонов (II) и тиадиазепинов (III), полученным на основе тиогидразидов оксаминовых кислот, которые могут быть использованы для подавления патогенных бактерий, в частности воздействовать на систему секреции 3 типа у патогенов.
По данным ВОЗ почти 60% случаев смертности связаны именно с хроническими заболеваниями. Общей тенденцией является существенное снижение эффективности используемых в клинической практике антибиотиков в отношении хронических инфекций. На данный момент эффективных антибиотиков, оказывающих выраженный терапевтический эффект на хроническую инфекцию, на рынке лекарственных препаратов не существует. Это обусловлено тем, что при хронической инфекции имеет место эволюционно выработанная адаптация патогена, направленная на длительное выживание в макроорганизме, в том числе изменение метаболической активности. Это приводит к снижению чувствительности микроорганизма к антибактериальным препаратам, эффективным на острой стадии инфекционного процесса.
Не менее остро стоит проблема развития антибиотикорезистентности к используемым антибактериальным препаратам. Формирование микроорганизмами устойчивости к антибиотикам сопряжено с рядом негативных последствий как для отдельных пациентов, так и для общества в целом. При устойчивости возбудителя инфекционной болезни к основным антибиотикам резко возрастает вероятность неудачи эмпирического лечения конкретного пациента. В то же время вполне очевидно, что каждое конкретное заболевание, вызываемое резистентным микроорганизмом, является проявлением процесса формирования и распространения устойчивости в микробной популяции. Ситуация осложняется еще и тем, что крупные фармацевтические компании существенно снизили разработку антибиотиков, т.к. рост антибиотикорезистентности ограничивает со временем возможности применения препарата и, соответственно, снижает прибыли от продаж.
Если оценивать экономическую сторону рассматриваемой проблемы, то основным мотивирующим фактором разработки новых антибактериальных препаратов в настоящее время является множественная лекарственная устойчивость. Однако потребность в препаратах для лечения хронических и рецидивирующих инфекций охватывает значительно больший контингент больных, недополучающих необходимое эффективное лечение, что и определяет широкие перспективы в области разработки и внедрения новых лекарственных препаратов.
В связи с вышесказанным совершенно очевидна необходимость выбора иной стратегии поиска лекарственных средств, основанной на выявлении принципиально новых мишеней у бактериальных патогенов.
Детальное изучение и понимание механизмов взаимодействия патогенов с организмом хозяина и выявление наиболее уязвимых звеньев в цепи динамичных событий проявления патогенетического потенциала может явиться основой для эффективного выбора мишеней для действия препаратов нового поколения, направленных на подавление вирулентности, т.н. антивирулентных лекарственных средств. Такие препараты должны иметь ряд преимуществ по сравнению с используемыми ныне антибиотиками. Во-первых, действие на вирулентные свойства патогена, которые важны при взаимодействии в системе патоген-хозяин без подавления жизнеспособности, дает основание прогнозировать отсутствие селективного давления и отбор резистентных штаммов бактерий. Во-вторых, препараты, действующие на специфические мишени патогенных бактерий, не будут токсичными для эукариотических клеток и для нормальной микрофлоры человека, что представляет собой серьезнейшую проблему при использовании антибиотиков. Действительно, микробные клетки, образующие микробиоту здорового человека превосходят по количеству человеческие клетки в десятки раз, колонизируя различные органы и способствуя реализации многих жизненно важных процессов, роль микробиоты в которых только начинает осознаваться. Микробиота представляет собой динамичное состояние, и нарушение ее популяционного состава при действии антибиотиков приводит к утрате симбиотической выгоды и развитию инфекций, обусловленных оппортунистическими патогенами.
Ведущая роль в реализации вирулентных свойств патогенных бактерий принадлежит системе секреции, посредством которой осуществляется транспорт белковых факторов вирулентности в клетку макроорганизма. Процесс осуществляется путем секреции и экспорта эффекторных молекул через мембраны в межклеточное пространство или непосредственно в цитоплазму клетки-хозяина, что приводит к изменению ее нормального физиологического состояния и способствует адгезии, инвазии и внутриклеточному размножению патогена. Кроме того, через систему секреции реализуется спектр адаптационных механизмов, направленных на длительное выживание в организме хозяина, связанное с их способностью инактивировать защитные реакции организма.
В уровне техники известны соединения, воздействующие на вирулентные свойства патогенных бактерий. Эти соединения подавляют секреторные функции некоторых грамотрицательных бактерий, таких как Yersinia pseudotuberculosis, Salmonella enterica, Pseudomonas aeruginosa, патогенных штаммов E.coli, Chlamydia spp и не вызывают развитие устойчивости к препаратам на их основе. К таким соединениям можно отнести гидразоны, полученные на основе гидразидов бензойных и пиридинкарбоновых кислот (FEBS Letters, 581, (2007) 587-595; Infection and Immunity, 2005, p.3104-3114, Vol.73, No.5; PNAS, 26, 2006, vol.103, No.39, 14566-14571).
Однако недостатками этих соединений являются значительная токсичность и недостаточная растворимость в органических растворителях.
Задачей изобретения является создание соединений, не являющихся токсичными для нормальной микрофлоры и клеток хозяина, кроме того, к которым не будет развиваться резистентность, а также обладающих хорошей растворимостью в органических растворителях.
Технический результат, достигаемый заявленной группой изобретений, заключается в получении биологически активных соединений с хорошим выходом, обладающих высокой эффективностью против патогенных бактерий, в том числе при лечении хронических болезней, вызванных патогенными бактериями, и характеризующихся избирательностью, т.е. воздействием только на патогенные бактерии. При этом полученные соединения нетоксичны для клеток человека и животных, они хорошо растворимы в органических растворителях, а также характеризуются специфической активностью в условиях биологических систем воздействия на патогенные бактерии и не вызывают развития резистентности патогенных бактерий.
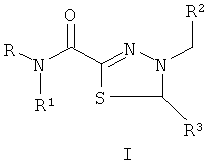
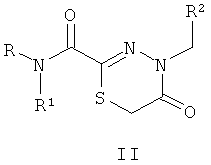
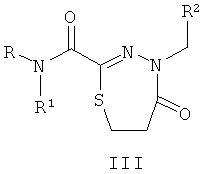
Технический результат обеспечивается за счет того, что биологически активные соединения представляют собой замещенные производные 1,3,4-тиадиазолинов (I), тиадиазинонов (II) и тиадиазепинонов (III), полученные на основе тиогидразидов оксаминовых кислот общей формулы:



где R представляет собой H; R1 представляют собой Н, пиридинил;
фенил, замещенный алкилом С1-С5, Hal, СF3; группу  , где Х представляет собой S, замещенную алкилом С1-С5, COOR4; R2, R3 представляют собой алкил С1-С5, пиридинил, фенил, замещенный Hal, ОН, OR4, а R4 представляет собой незамещенный алкил С1-С4.
, где Х представляет собой S, замещенную алкилом С1-С5, COOR4; R2, R3 представляют собой алкил С1-С5, пиридинил, фенил, замещенный Hal, ОН, OR4, а R4 представляет собой незамещенный алкил С1-С4.
Способ ингибирования секреции III типа у патогенных бактерий заключается в воздействии на бактерии эффективным количеством соединения по п.1.
По заявленному изобретению замещенные тиадиазолины, тиадиазины и тиадиазепины получаются на основе тиогидразидов оксаминовых кислот общей формулы (I) и включают взаимодействие соответствующих хлорацетамидов с предварительно приготовленным раствором элементной серы с морфолином, пропускание полученного раствора монотиооксамидов через слой сорбента, последующее взаимодействие монотиооксамидов с гидразин-гидратом, реакцию полученного соединения с альдегидами или кетонами, восстановление боргидридом натрия в метаноле или тетрагидрофуране и последующее взаимодействие с различными альдегидами или их производными в этаноле или изопропаноле в условиях кислотного катализа (тиадиазолины), галогенуксусной кислотой (тиадиазиноны), β-галогенпропионовой кислотой (тиадиазепиноны) в условиях щелочного катализа. Замещенные тиадиазолины, тиадиазиноны и тиадиазепиноны на основе производных тиогидразидов оксаминовых кислот могут быть синтезированы по следующей схеме:
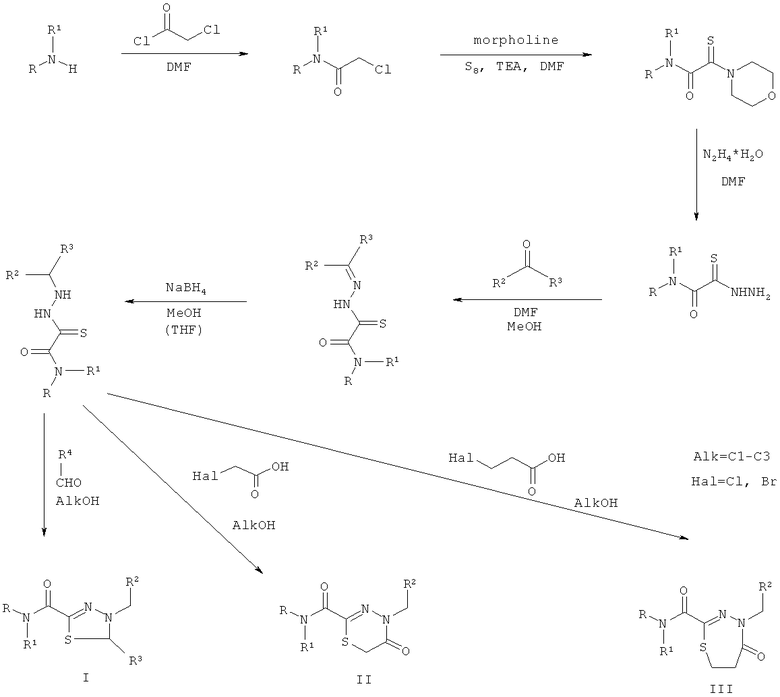
Способ ингибирования секреции III типа у патогенных бактерий заключается в воздействии на бактерии эффективным количеством соединения по п.1.
Данная система секреции III типа выявлена у таксономически далеких микроорганизмов (патогенных бактерий) - возбудителей особо опасных инфекций, таких как Yersinia, Brucella, и возбудителей социально-значимых инфекций, таких как Chlamydia, Salmonella, Shigella, Helicobacter и др. Эта система более консервативна и в гораздо меньшей степени подвержена мутациям как одному из факторов развития антибиотикорезистентности. Следовательно, ингибиторы секреции III типа у патогенов будут оказывать направленное воздействие на механизмы, обуславливающие процесс хронизации инфекции. Кроме того, система III секреции присутствует только у патогенных бактерий, следовательно, ее ингибиторы не токсичны для нормальной микрофлоры человека и клеток хозяина, т.е. характеризуются избирательностью.
Конкретные примеры выполнения группы изобретений.
Получение исходных N'-бензил(пиридил) замещенных тиогидразидов оксаминовых кислот.
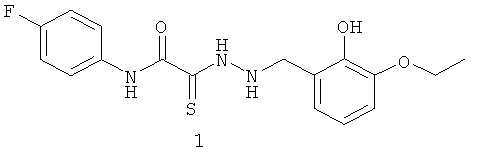
2-[2-(3-этокси-2-гидроксибензил)гидразино]-N-(4-фторфенил)-2-тиоксоацетамид (1)
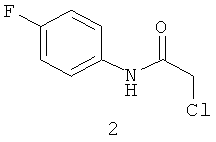
N-хлорацетил-4-фторанилин (2).
Общая методика получения хлорацетамидов.
К раствору (0,1 моль) соответствующего анилина в 100 мл ДМФА добавляем при охлаждении 8,75 мл (0,11 моль) хлорацетилхлорида, следя за тем, чтобы температура не превышала 20°С. После окончания прибавления перемешиваем при комнатной температуре раствор еще 2 часа. Затем выливаем реакционную смесь в 600 мл холодной воды и отфильтровываем осадок. Промываем его на фильтре водой и сушим на воздухе.
Выход (2) 80% Т.пл. 110-112°С. ЯМР 1Н DMSOd6 (δ, м.д., J, Гц): 4,20 (с, 2Н, ArCH2Cl); 7,21 (м, 2Н, Ar); 7,61 (м, 2Н, Ar); 10,21 (с, 1Н, Ar-NH-CO). Найдено (%): С 51.17, Н 3.73, N 7.44. Вычислено (%): С 51.22, Н 3.76, N 7.47. Масс-спектр, m/z: 187
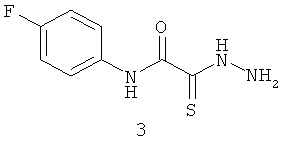
2-[гидразино-(тиоксо)-ацетиламино]-4-фторанилин (3).
Общая методика получения тиогидразидов.
Готовим раствор 0,15 моль элементной серы в 50 мл ДМФА и добавляем 0,06 моль морфолина. Полученную смесь перемешиваем 20-30 минут и добавляем к ней раствор 0,05 моль соответствующего хлорацетамида в минимальном количестве ДМФА, при охлаждении, следя за тем, чтобы температура не превышала 15°С. Полученную смесь перемешиваем 3-6 часов (контроль по ТСХ). После окончания реакции реакционную смесь выливаем в воду, экстрагируем вещество этилацетатом, пропускаем органический слой через колонку с силикагелем, упариваем на роторном испарителе, затем полученный остаток растворяем в небольшом количестве (5-6 мл) ДМФА и добавляем 6 мл (0,12 моль) гидразин-гидрата и перемешиваем при комнатной температуре 2 часа. Затем выливаем в воду и подкисляем разбавленной соляной кислотой до рН 7. Отфильтровываем осадок и сушим его на воздухе.
Выход: (3) 6,4 г, 60%. Т.пл. 154-155°С. ЯМР 1Н DMSOd6 (δ, м.д., J, Гц): 7,22 (м, 2Н, Ar); 7,63 (м, 2Н, Ar); 10,17 (с, 1Н, Ar-NH-CO). Найдено (%): С 45.01, Н 3.85, N 19,80. Вычислено (%): С 45.06, Н 3.78, N 19,71. Масс-спектр, m/z: 213.
2-[2-(3-этокси-2-гидроксибензил)гидразино]-N-(4-фторфенил)-2-тиоксоацетамид (1)

Общая методика получения N-бензилзамещенных тиогидразидов.
К 10 ммоль соответствующего тиогидразида оксаминовой кислоты в 5 мл метанола добавляем 11 ммоль соответствующего альдегида и кипятим при перемешивании в течение 5 минут. Охлаждаем реакционную смесь. При охлаждении льдом (0-5°С) и перемешивании добавили 55 мг (1,5 ммоль) боргидрида натрия, небольшими порциями. Реакционную смесь оставили на 2 часа при охлаждении и перемешивании затем добавили 25 мл воды и нейтрализовали разбавленной соляной кислотой до нейтральной среды. Выпавший осадок отфильтровали и при необходимости перекристаллизовывали из изопропанола.
Выход: (1) 272 мг, 75%. Т.пл. 232-233°С. ЯМР 1Н CDCl3 (δ, м.д., J, Гц): 1.35 (т, 3Н, -О-СН2СН3, J=7,21); 3,96 (q, 2H, -О-CH2CH3, J=7,00 (13,94)); 4,32 (с, 1Н, -NH-CH2-Ar); 6,74-7,62 (м, 7Н, Ar); 9,12 (с, 1Н, ArOH); 10,02 (с, 1Н, Ar-NH-CO). Найдено (%): С 56.43, Н 4.62, N 11.78. Вычислено (%): С 56.19, Н 4.99, N 11.56. Масс-спектр, m/z: 363.
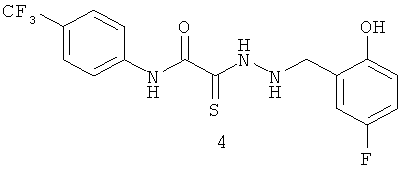
2-[2-(2-гидрокси-5-фторбензил)гидразино]-N-(4-(трифторметил)фенил)-2-тиоксоацетамид (4).
N-хлорацетил-4-(трифторметил)-анилин (5).
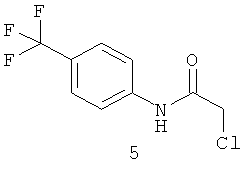
Выход хлорацетамида (5) 19 г 80% Т.пл. 115-116°C. ЯМР 1Н DMSOd6 (δ, м.д., J, Гц): 4,20 (с, 2H, Ar-CH2-Cl); 7,07 (д, 2H, аром); 7,21 (д, 2H, аром);. Найдено (%): С 45.38, Н 2.81, N 5.96. Вычислено (%): С 45.49, Н 2.97, N 5.89. Масс-спектр, m/z: 237.
2-гидразино-2-тиоксо-N-[4-(трифторметил)фенил]ацетамид (6).

Выход тиогидразида (6) 6,4 г, 60%. Т.пл. 154-155°С. ЯМР 1Н DMSOd6 (δ, м.д., J, Гц): 7,08 (д, 2Н, аром); 7,24 (д, 2Н, аром); 10,59 (с, 1Н, NH). Найдено (%): С 41.16, Н 3.13, N 15.83. Вычислено (%): С 41.06, Н 3.06, N 15.96. Масс-спектр, m/z: 263.
2-[2-(2-гидрокси-5-фторбензил)гидразино]-N-(4-(трифторметил)фенил)-2-тиоксоацетамид (4).

Выход гидразида (4) 290 мг, 75%. Т.пл. 212-213°С. ЯМР 1Н CDCl3 (δ, м.д., J, Гц): 4,32 (с, 1Н, -NH-CH2-Ar); 6,70-7,62 (м, 7Н, Ar); 9,30 (с, 1Н, ArOH); 10,12 (с, 1Н, Ar-NH-CO). Найдено (%): С 49.50, Н 3.43, N 10.74. Вычислено (%): С 49.61, Н 3.38, N 10.85. Масс-спектр, m/z: 387.
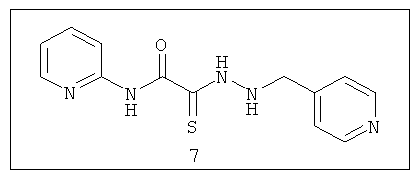
N-пиридин-2-ил-2-[2-(пиридин-4-илметил)гидразино]-2-тиоксоацетамид (7)
N-хлорацетил-2-аминопиридин (8).
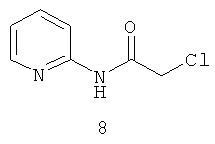
Выход: N-хлорацетил-2-аминопиридина (8) 11,9 г, (70%). Т.пл. 140-141°С. ЯМР 1H CDCl3 (δ, м.д., J, Гц): 4,20 (с, 2Н, CH2Cl); 7,41-7,45 (м, 2Н, Ar); 8,07-8,11 (м, 2Н, аром); 10,31 (с, 1Н, NH). Найдено (%): С 49.20, Н 4.03, N 16.21. Вычислено (%): С 49.28, Н 4.14, N 16.42. Масс-спектр, m/z: 170.
2-Гидразино-N-пиридин-2-ил-2-тиоксо-ацетамид (9).
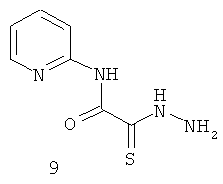
Выход: 2-гидразино-N-пиридин-2-ил-2-тиоксо-ацетамида (9) 1,2 г, (60%). Т.пл. 164-165°С. ЯМР 1Н DMSOd6 (δ, м.д., J, Гц): 7,40-7,43 (м, 2Н, Ar); 8,07-8,10 (м, 2Н, аром); 10,59 (с, 1Н, NH). Найдено (%): С 42.76, Н 4.01, N 28.44. Вычислено (%): С 42.85, Н 4.11, N 28.55. Масс-спектр, m/z: 196.
N-пиридин-2-ил-2-[2-(пиридин-4-илметил)гидразино]-2-тиоксоацетамид (7).
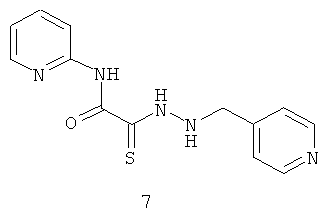
Выход гидразида (7) 200 мг (70%), Т.пл. 231-232°С. ЯМР 1Н DMSOd6 (δ, м.д., J, Гц): ЯМР 1Н DMSOd6 (δ, м.д., J, Гц): 4,05 (с, 1Н, NH-CH2-Ar); 7,40-7,50 (м, 4Н, Ar); 8,07-8,23 (м, 4Н, аром); 10,33 (с, 1Н, Ar-NH-СО). Найдено (%): С 54.18, Н 4.68, N 24.23. Вычислено (%): С 54.34, Н 4.56, N 24.37. Масс-спектр, m/z: 287.
5-этил-2-{[1-(2-гидрокси-бензил)-гидразино]-2-тиоксо-N-[амино}-тиофен-3-этилкарбоксилат]ацетамид (10)
N-хлорацетил-3-карбэтокси-5-этил-тиофен (11).
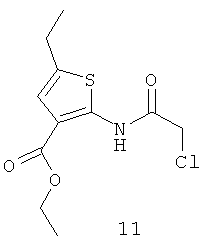
Выход хлорацетамида (11) 23,4 г, 85%. Т.пл. 123-125°С. ЯМР 1Н CDCl3 (δ, м.д., J, Гц): 1,27 (т, 3Н, СН2СН3, J=7,07); 1,30 (т, 3Н, CH2CH3, J=7,21); 2,45 (д, 2Н, CH2CH3, J=7,11); 4,31 (с, 2Н, CH2Cl); 4,43 (д, 2Н, CH2CH3, J=7,17); 7,53 (с, 1Н, Thiofen); 10,65 (с, 1Н, NH). Найдено (%): С 47.85, Н 5.21, N 5.01. Вычислено (%): С 47.91, Н 5.12, N 5.08. Масс-спектр, m/z: 275.
5-этил-2-[гидразино]-2-тиоксо-N-[амино-тиофен-3-этилкарбоксилат]ацетамид (12).
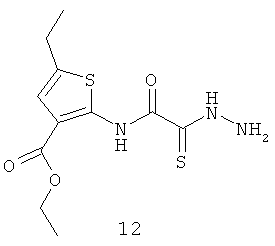
Выход тиогидразида (12) 8,6 г, 57%. Т.пл. 152-154°С. ЯМР 1Н CDCl3 (δ, м.д., J, Гц): 1,27 (т, 3Н, CH2CH3, J=7,07); 1,30 (т, 3Н, CH2CH3, J=7,21); 2,45 (д, 2Н, CH2CH3, J=7,11); 4,31 (с, 2Н, CH2Cl); 4,43 (д, 2Н, CH2CH3, J=7,17); 7,53 (с, 1Н, Thiofen); 10.40 (с, 1Н, NH). Найдено (%): С 43.75, Н 5.14, N 13.90. Вычислено (%): С 43.84, Н 5.02, N 13.94. Масс-спектр, m/z: 301.
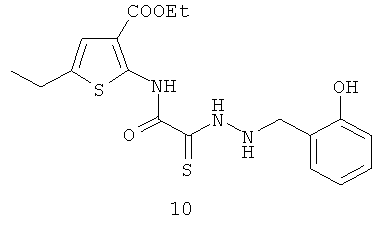
5-этил-2-{[1-(2-гидрокси-бензил)-гидразино]-2-тиоксо-N-[амино}-тиофен-3-этилкарбоксилат]ацетамид (10)
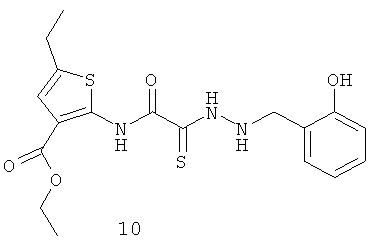
Выход гидразида (10) 364 мг, 90%. Т пл. 159-160°С. ЯМР 1Н CDCl3 (δ, м.д., J, Гц): 1,25 (т, 3Н, CH2CH3, J=7,07); 1,31 (т, 3Н, CH2CH3, J=7,21); 2,44 (д, 2Н, CH2CH3, J=7,11); 4,21 (с, 1Н, -NH-CH2-Ar); 4,43 (д, 2Н, CH2CH3, J=7,17); 6,97-7,11 (м, 4Н, Ar); 7,52 (с, 1Н, Thiofen); 9,10 (с, 1Н, ArOH); 10,22 (с, 1Н, Ar-NH-CO). Найдено (%): С 53.23, Н 4.83, N 10.24. Вычислено (%): С 53.32, Н 4.72, N 10.36.
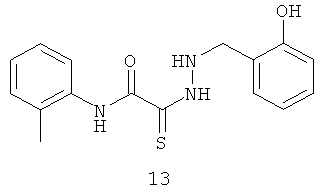
2-[2-(2-гидроксибензил)гидразино]-N-(2-метилфенил)-2-тиоксоацетамид (13)
N-хлорацетил-2-метиланилин (14).
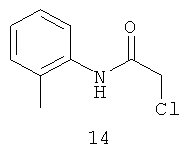
Выход хлорацетамида (14) 15,5 г, 85%. Т.пл. 124-126°С. ЯМР 1Н CDCl3 (δ, м.д., J, Гц): 1,74 (с, 3Н, ArCH3); 4,20 (с, 2Н, CH2Cl); 7,07 (м, 1Н, Ar); 7,21 (м, 1Н, Ar); 7,41 (м, 1Н, Ar); 7,63 (м, 1Н, Ar); 10,57 (с, 1Н, Ar-NH-CH2Cl). Найдено (%): С 58.86, Н 5.47, N 7.64. Вычислено (%): С 58.87, Н 5.49, N 7.63. Масс-спектр, m/z: 183.
2-[гидразино-(тиоксо)-ацетиламино]-2-метиланилин (15).
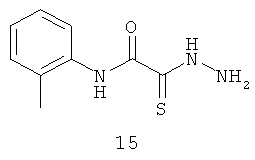
Выход тиогидразида (15) 10,4 г, 60%. Т.пл. 154-157°С. ЯМР 1Н CDCl3 (δ, м.д., J, Гц): 1,74 (с, 3Н, ArCH3); 7,07-7,61 (м, 4Н, Ar); 10,32 (с, 1Н, Ar-NH-CO). Найдено: С 51.41, Н 5.53, N 20,40. Вычислено: С 51.66, Н 5.30, N 20.08. Масс-спектр, m/z: 209.
2-[2-(2-гидроксибензил)гидразино]-N-(2-метилфенил)-2-тиоксоацетамид (13)

Выход тиогидразида (13) 236 мг, 60%. Т.пл. 204-206°С. ЯМР 1Н CDCl3 (δ, м.д., J, Гц): 1,74 (с, 3Н, ArCH3); 4,25 (с, 1Н, -NH-CH2-Ar); 7,89-7,58 (м, 8Н, Ar); 9,18 (с, 1Н, ArOH); 10,32 (с, 1Н, Ar-NH-CO). Найдено: С 60.87, Н 5.51, N 13.23. Вычислено: С 60.93, Н 5.43, N 13.32. Масс-спектр, m/z: 315.
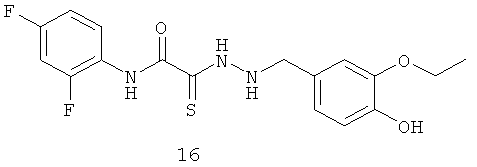
2-[2-(3-этокси-4-гидроксибензил)гидразино]-N-(2,4-дифторфенил)-2-тиоксоацетамид (16)
N-хлорацетил-2,4-дифторанилин (17).
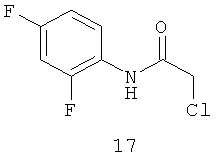
Выход хлорацетамида (17) 87% Т.пл. 101-102°С. ЯМР 1Н CDCl3 (δ, м.д., J, Гц): 4,20 (с, 2Н, ArCH2Cl); 7,10-7,25 (м, 2Н, Ar); 7,53 (м, 1Н, Ar); 10,25 (с, 1Н, Ar-NH-CO). Найдено (%): С 46.62, Н 2.99, N 6.84. Вычислено (%): С 46.74, Н 2.94, N 6.81. Масс-спектр, m/z: 205.
2-[гидразино-(тиоксо)-ацетиламино]-2,4-дифторанилин (18).
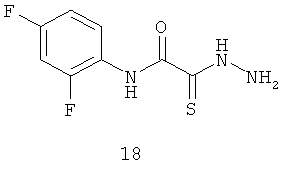
Выход: (18) 8,1 г, 70%. Т.пл. 154-156°С. ЯМР 1Н CDCl3 (δ, м.д., J, Гц): 7,10-7,26 (м, 2Н, Ar); 7,50 (м, 1Н, Ar); 10,30 (с, 1Н, Ar-NH-CO). Найдено (%): С 41.40, Н 3.18, N 18.25. Вычислено (%): С 41.56, Н 3.05, N 18.17. Масс-спектр, m/z: 231.
2-[2-(3-этокси-4-гидроксибензил)гидразино]-N-(2,4-дифторфенил)-2-тиоксоацетамид (16)

Выход гидразида (1) 272 мг, 75%. Т.пл. 238-239°С. ЯМР 1Н CDCl3 (δ, м.д., J, Гц): 1.35 (т, 3Н, -О-CH2CH3, J=7,22); 3,96 (кд, 2Н, -О-CH2CH3, J=7,00 (13,90)); 4,32 (с, 1Н, -NH-CH2-Ar); 6,98-7,62 (м, 6Н, Ar); 9,02 (с, 1Н, ArOH); 10,12 (с, 1Н, Ar-NH-CO). Найдено (%): С 53.45, Н 4.58, N 10.94. Вычислено (%): С 53.54, Н 4.49, N 11.02. Масс-спектр, m/z: 381.
Получение тиадиазолинов (I).
Общая методика получения тиадиазолинов (I).
1 ммоль соответствующего N'-бензил(пиридил) замещенного тиогидразида оксаминовой кислоты добавляем к раствору 1,05 ммоль соответствующего альдегида в 5 мл этанола. Добавляем к реакционной смеси каталитическое количество концентрированной соляной кислоты и оставляем на 2 суток при комнатной температуре. Выпавший осадок отфильтровываем и промываем холодным метанолом.
Пример 1, группа I, (CL022).
4-(3-этокси-2-гидроксибензил)-5-(3-этокси-2-гидроксифенил)-N-(4-фторфенил)-4,5-дигидро-1,3,4-тиадиазол-2-карбоксамид
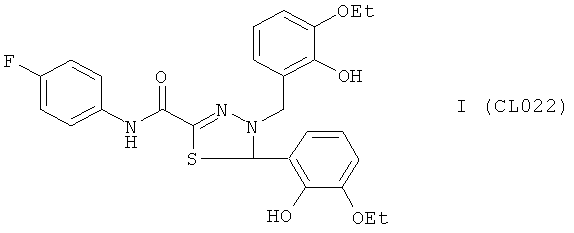
В качестве исходного N'-бензил тиогидразида использовалось соединение (1), в качестве альдегида использовался коммерчески доступный 3-этоксисалициловый альдегид.
Выход: CL022 332 мг, 65%. Т.пл. >300°С с разл. ЯМР 1Н CDCl3 (δ, м.д., J, Гц): 1,30-1,40 (м, 6Н, -O-CH2CH3); 3,90-3,98 (м, 4Н, -O-CH2CH3); 4,41 (д, 1Н, CH2, J=15,3); 4,67 (д, 1Н, СН2, J=15,2); 6,62 (с 1Н, -S-CH-N-); 6,72-7,20 (м, 8Н, Ar); 7,71-7,78 (м, 2Н, Ar); 8,52 (с, 1Н, ArOH); 8,95 (с, 1Н, ArOH); 10.24 (с, 1Н, CO-NH). Найдено (%): С 60.98, Н 5.18, N 8.11. Вычислено (%): С 61.04, Н 5.12, N 8.21. Масс-спектр, m/z: 511.
Пример 2, группа I, (CL024).
4-(2-гидpoкcи-5-фтopфeнил)-5-(2-гидpoкcи-5-фтopбeнзил)-N-(4-(трифторметил)фенил)-4,5-дигидро-1,3,4-тиадиазол-2-карбоксамид.
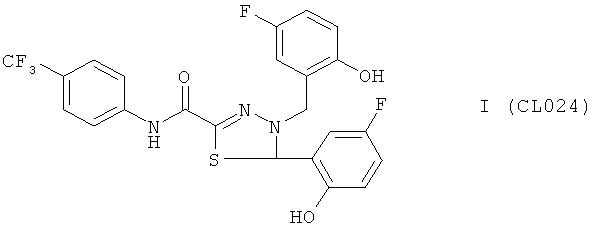
В качестве исходного N'-бензил тиогидразида использовалось соединение (4), в качестве альдегида использовался коммерчески доступный 5-фтор-салициловый альдегид.
Выход (CL024) 321 мг, 70%. Т. пл. >300°С с разл. ЯМР 1Н CDCl3 (δ, м.д., J, Гц); 4,45 (д, 1Н, N-CH2-Ar, J=15,33); 4,71 (д, 1Н, N-CH2-Ar, J=15,22); 6,43 (с 1Н, -S-CH-N-); 6,70-7,62 (м, 10Н, Ar); 9,12 (с, 1Н, АrOН); 9,30 (с, 1Н, АrОН); 10,10 (с, 1Н, Ar-NH-CO). Найдено (%): С 57.41, Н 3.55, N 9.10. Вычислено (%): С 57.51, Н 3.51, N 9.15. Масс-спектр, m/z: 459.
Пример 3, группа I, (CL025).
N-пиридин-2-ил-5-пиридин-4-ил-4-(пиридин-4-илметил)-4,5-дигидро-1,3,4-тиадиазол-2-карбоксамид.
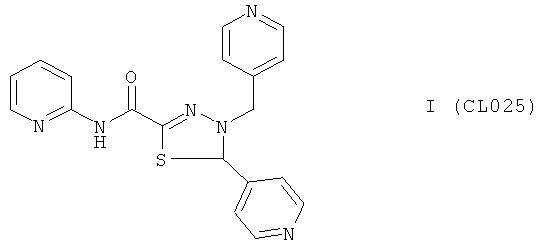
В качестве исходного N'-бензил тиогидразида использовалось соединение (7), в качестве альдегида использовался коммерчески доступный 4-пиридинкарбальдегид.
Выход (CL025) 225 мг (60%), Т. пл. >300°С с разл. ЯМР 1H DMSOd6 (δ, м.д., J, Гц); ЯМР 1H DMSOd6 (δ, м.д., J, Гц): 4,62 1 (д, 1Н, СН2, J=15,12); 4,72 (д, 1Н, CH2, J=15,32); 6,32 (с 1Н, -S-СH-N-); 7,38-7,55 (м, 6Н, Аr); 8,07-8,33 (м, 6Н, аром); 10,39 (с, 1Н, Ar-NH-CO). Найдено (%): С 60.51, Н 4.38, N 22.23. Вычислено (%): С 60.62, Н 4.28, N 22.32. Масс-спектр, m/z: 376.
Пример 4, группа I, (CL021).
этил 2-({[4-(2-гидроксифенил)-5-(2-гидроксибензил)-4,5-дигидро-1,3,4-тиадиазол-2-ил]карбонил}амино)-5-этилтиофен-3-карбоксилат
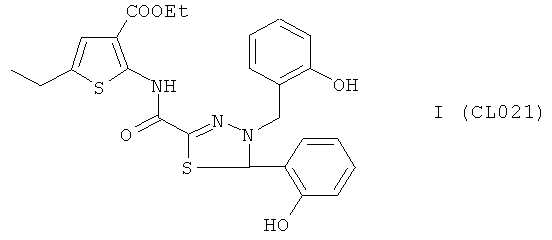
В качестве исходного N'-бензил тиогидразида использовалось соединение (10), в качестве альдегида использовался коммерчески доступный салициловый альдегид.
Выход (CL021) 306 мг, 60%. Т. пл. >300°С с разл. ЯМР 1Н CDCl3 (δ, м.д., J, Гц): 1,25 (т, 3Н, СН2СН3, J=7,07); 1,31 (т, 3Н, CH2CH3, J=7,21); 2,44 (д, 2Н, СH2CН3, J=7,11); 4,38 (д, 1Н, СН2, J=15,3); 4,51 (д, 1Н, CH2, J=15,2); 6,02 (с. 1Н, -S-CH-N-); 6,95-7,15 (м, 8Н, Аr); 7,52 (с, 1Н, Thiofen); 8,95 (с, 1Н, АrОН); 9,10 (с, 1Н, АrОН); 10,25 (с, 1Н, Ar-NH-CO). Найдено (%): С 58.58, Н 5.03, N 8.11. Вычислено (%): С 58.69, Н 4.93, N 8.21.
Пример 5, группа I, (CL020).
4-(2-гидроксифенил)-5-метил-N-(2-метилфенил)-4,5-дигидро-1,3,4-тиадиазол-2-карбоксамид
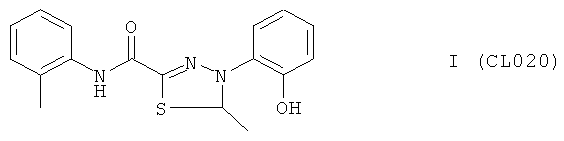
В качестве исходного N'-бензил тиогидразида использовалось соединение (13), в качестве альдегида использовался коммерчески доступный паральдегид.
Выход (CL020) 130 мг, 40%. Т. пл. >250°С с разл. ЯМР 1Н СDСl3 (δ, м.д., J, Гц): 1,53 (д, 3Н, СНСН3, J-14,23); 1,74 (с, 3Н, АrСН3); 4,41 (д, 1Н, СН2, J=15,3); 4,67 (д, 1Н, СН2, J=15,2); 5,11 (кд, 1Н, -S-CH-N-, J=7,12); 7,89-7,58 (м, 8Н, Аr); 9,18 (с, 1Н, ArOH); 10,32 (с, 1Н, Аr-NH-CO). Найдено: С 62.30, Н 5.34, N 12.73. Вычислено: С 62.37, Н 5.23, N 12.83. Масс-спектр, m/z: 327.
Пример 6, группа I, (CL023).
4-(3-этокси-4-гидроксифенил)-5-(3-этокси-4-гидроксибензил)-N-(2,4-дифторфенил)-4,5-дигидро-1,3,4-тиадиазол-2-карбоксамид
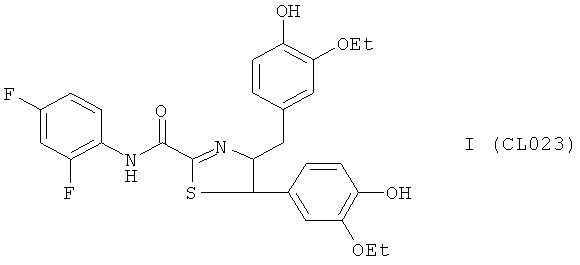
В качестве исходного N'-бензил тиогидразида использовалось соединение (16), в качестве альдегида использовался коммерчески доступный 4-гидрокси-3-этоксибензальдегид.
Выход (CL023) 272 мг, 75%. Т.пл. >300°С с разл. ЯМР 1Н CDCl3 (δ, м.д., J, Гц): 1.35 (т, 3Н, -О-CH2CH3, J=7,22); 3,96 (кд, 2Н, -О-CH2CH3, J=7,00 (13,90)); 4,44 (д, 1Н, СН2, J=15,3); 4,63 (д, 1Н, СН2, J=15,2); 6,53 (с, 1Н, -S-CH-N-); 6,98-7,62 (м, 9Н, Ar); 8,92 (с, 1Н, ArOH); 9,02 (с, 1Н, ArOH); 10,19 (с, 1Н, Ar-NH-CO). Найдено (%): С 61.26, Н 4.98, N 5.21. Вычислено (%): С 61.35, Н 4.96, N 5.30. Масс-спектр, m/z: 528.
Получение тиадиазинонов (II).
Общая методика получения тиадиазинонов (II).
1 ммоль соответствующего N'-бензил(пиридил) замещенного тиогидразида оксаминовой кислоты добавляем к раствору 1,2 ммоль хлоруксусной (или бромуксусной) кислоты в 5 мл изопропанола. Добавляем к реакционной смеси каталитическое количество ацетат аммония и кипятим 2-5 часов (контроль по тонкослойной хроматограмме). После окончания реакции выливаем реакционную смесь в 50 мл воды и экстрагируем вещество этилацетатом, промываем органический слой водой 2*50 мл. Затем отделяем органический слой, сушим его над сульфатом натрия и удаляем растворитель на роторном испарителе. Остаток перекристаллизовываем из минимального количества этанола.
Пример 7, группа II, (CL019)
4-(3-этокси-2-гидроксибензил)-N-(4-фторфенил)-5-оксо-5,6-дигидро-4H-1,3,4-тиадиазин-2-карбоксамид
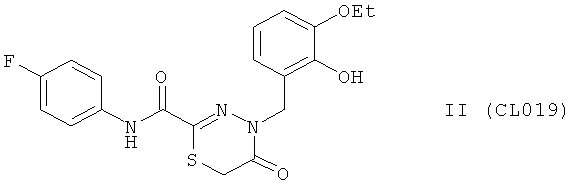
В качестве исходного N'-бензил тиогидразида использовалось соединение (1).
Выход: (CL019) 302 мг, 75%. Т.пл. 274-275°С. ЯМР 1Н CDCl3 (δ, м.д., J, Гц): 1.35 (т, 3Н, -О-CH2CH3, J=7,21); 3,92 (кд, 2Н, -O-CH2CH3, J=7,00 (13,94)); 3,98 (с, 2Н, S-CH2-CO) 5,12 (с, 1Н, -NH-CH2-Ar); 6,74-7,60 (м, 7Н, Ar); 9,10 (с, 1Н, ArOH); 10,02 (с, 1Н, Ar-NH-CO). Найдено (%): С 56.50, Н 4.62, N 10.31. Вычислено (%): С 56.57, Н 4.50, N 10.42. Масс-спектр, m/z: 403.
Пример 8, группа II, (CL029)
4-(5-фтор-2-гидроксибензил)-N-(4-(трифторметил)фенил)-5-оксо-5,6-дигидро-4H-1,3,4-тиадиазин-2-карбоксамид
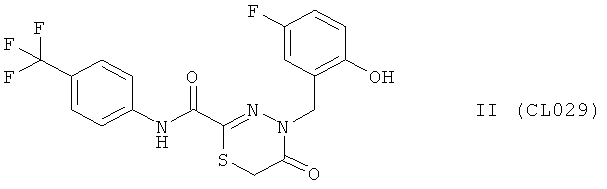
В качестве исходного N'-бензил тиогидразида использовалось соединение (4)
Выход (CL029) 320 мг, 75%. Т.пл. 243-244°С. ЯМР 1Н CDCl3 (δ, м.д., J, Гц): 3,94 (с, 2Н, S-CH2-CO); 5,22 (с, 1Н, -NH-CH2-Ar); 6,70-7,62 (м, 7Н, Ar); 9,30 (с, 1Н, ArOH); 10,29 (с, 1Н, Ar-NH-CO). Найдено (%): С 50.51, Н 3.17, N 9.74. Вычислено (%): С 50.59, Н 3.07, N 9.83. Масс-спектр, m/z: 427.
Пример 9, группа II, (CL030)
5-оксо-N-пиридин-2-ил-4-(пиридин-4-илметил)-5,6-дигидро-4H-1,3,4-тиадиазин-2-карбоксамид
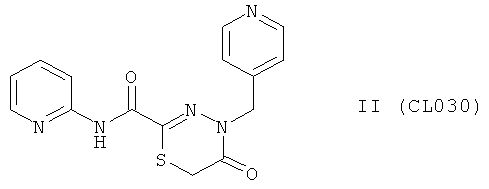
В качестве исходного N'-бензил тиогидразида использовалось соединение (7)
Выход (CL030) 228 мг (70%), Т.пл. 273-274°С. ЯМР 1Н DMSOd6 (δ, м.д., J, Гц): ЯМР 1Н DMSOd6 (δ, м.д., J, Гц): 3,92 (с, 2Н, S-CH2-CO); 5,17 (с, 1Н, -NH-CH2-Ar); 7,42-7,61 (м, 4Н, Ar); 8,07-8,23 (м, 4Н, аром); 10,33 (с, 1Н, Ar-NH-CO). Найдено (%): С 54.93, Н 4.10, N 21.31. Вычислено (%): С 55.04, Н 4.00, N 21.39. Масс-спектр, m/z: 327.
Пример 10, группа II, (CL027)
Этил-5-этил-2-({[4-(2-гидроксибензил)-5-оксо-5,6-дигидро-4H-1,3,4-тиадиазин-2-ил]карбонил}амино)тиофен-3-карбоксилат
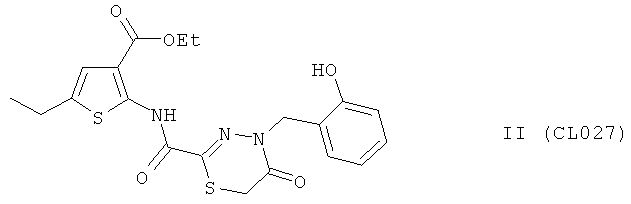
В качестве исходного N'-бензил тиогидразида использовалось соединение (10)
Выход (CL027) 380 мг, 85%. Т пл. >200°С с разл. ЯМР 1Н CDCl3 (δ, м.д., J, Гц): 1,25 (т, 3Н, CH2CH3, J=7,07); 1,31 (т, 3Н, CH2CH3, J=7,21); 2,44 (д, 2Н, CH2CH3, J=7,11); 3,99 (с, 2Н, S-CH2-CO); 4,43 (д, 2Н, CH2CH3, J=7,17); 5,14 (с, 1Н, -NH-CH2-Ar); 6,97-7,11 (м, 4Н, Ar); 7,52 (с, 1Н, Thiofen); 9,10 (с, 1Н, ArOH); 10,22 (с, 1Н, Ar-NH-CO). Найдено (%): С 53.54, Н 4.82, N 9.32. Вычислено (%): С 53.68, Н 4.73, N 9.39.
Пример 11, группа II, (CL026)
4-метил-N-(2-метилфенил)-5-оксо-5,6-дигидро-4H-1,3,4-тиадиазин-2-карбоксамид
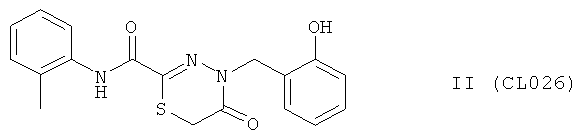
В качестве исходного N'-бензил тиогидразида использовалось соединение (13)
Выход (CL026) 213 мг, 60%. Т.пл. 232-233°С. ЯМР 1Н CDCl3 (δ, м.д., J, Гц): 1,74 (с, 3Н, ArCH3); 3,90 (с, 2Н, S-CH2-СО); 5,08 (с, 1Н, -NH-CH2-Ar); 7,89-7,58 (м, 8Н, Ar); 9,18 (с, 1Н, ArOH); 10,32 (с, 1Н, Ar-NH-CO). Найдено: С 60.74, Н 4.94, N 11.73. Вычислено: С 60.83, Н 4.82, N 11.82. Масс-спектр, m/z: 355.
Пример 12, группа II, (CL028)
4-(3-этокси-4-гидроксибензил)-N-(2,4-дифторфенил)-5-оксо-5,6-дигидро-4H-1,3,4-тиадиазин-2-карбоксамид
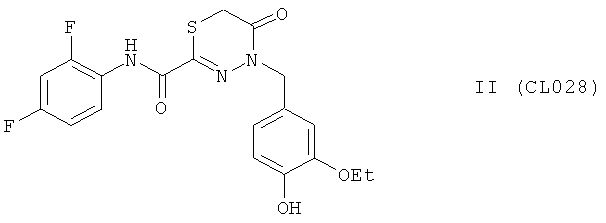
В качестве исходного N'-бензил тиогидразида использовалось соединение (16)
Выход (CL028) 316 мг, 75%. Т.пл. >250°С с разл. ЯМР 1Н CDCl3 (δ, м.д., J, Гц): 1.36 (т, 3Н, -О-CH2CH3, J=7,22); 3,90 (кд, 2Н, -O-CH2CH3, J=7,03 (13,90)); 3,90 (с, 2Н, S-CH2-СО); 5,21 (с, 1Н, -NH-CH2-Ar); 6,98-7,62 (м, 6Н, Ar); 9,04 (с, 1Н, ArOH); 10,10 (с, 1Н, Ar-NH-CO). Найдено (%): С 54.05, Н 4.14, N 9.83. Вычислено (%): С 54.15, Н 4.07, N 9.97. Масс-спектр, m/z: 421.
Получение тиадиазепинов (III).
Общая методика получения тиадиазепинов (III).
1 ммоль соответствующего N'-бензил(пиридил) замещенного тиогидразида оксаминовой кислоты добавляем к раствору 1,2 ммоль β-бромпропионовой кислоты в 5 мл изопропанола. Добавляем к реакционной смеси каталитическое количество ацетат аммония и кипятим 4-7 часов (контроль по тонкослойной хроматограмме). После окончания реакции выливаем реакционную смесь в 50 мл воды и экстрагируем вещество этилацетатом, промываем органический слой водой 2*50 мл. Затем отделяем органический слой, сушим его над сульфатом натрия и удаляем растворитель на роторном испарителе. Остаток перекристаллизовываем из минимального количества этанола.
Пример 13, группа III, (CL023)
4-(3-этокси-2-гидроксибензил)-N-(4-фторфенил)-5-оксо-4,5,6,7-тетрагидро-1,3,4-тиадиазепин-2-карбоксамид
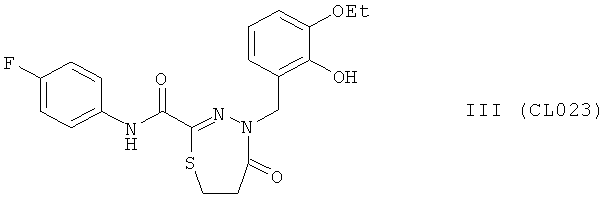
В качестве исходного N'-бензил тиогидразида использовалось соединение (1).
Выход: (CL023) 290 мг, 70%. Т.пл. >240°С с разл. ЯМР 1Н CDCl3 (δ, м.д., J, Гц): 1.36 (т, 3Н, -О-CH2CH3, J=7,21); 1,58 (м, 2Н, -S-CH2-CH2-CO); 2,18 (м, 2Н, -S-CH2-СН2-СО); 3,90 (кд, 2Н, -О-CH2CH3, J=7,00 (13,94)); 5,12 (с, 1Н, -NH-CH2-Ar); 6,73-7,60 (м, 7Н, Ar); 9,10 (с, 1Н, ArOH); 10,00 (с, 1Н, Ar-NH-CO). Найдено (%): С 57.46, Н 4.92, N 10.01. Вычислено (%): С 57.54, Н 4.83, N 10.07. Масс-спектр, m/z: 417.
Пример 14, группа III, (CL035)
4-(5-фтор-2-гидроксибензил)-N-(4-(трифторметил)фенил)-5-оксо-4,5,6,7-тетрагидро-1,3,4-тиадиазепин-2-карбоксамид

В качестве исходного N'-бензил тиогидразида использовалось соединение (4)
Выход (CL035) 352 мг, 80%. Т.пл. >200°С с разл. ЯМР 1Н CDCl3 (δ, м.д., J, Гц): 1,55 (м, 2Н, -S-CH2-CH2-CO); 2,16 (м, 2Н, -S-CH2-CH2-CO); 5,28 (с, 1Н, -NH-CH2-Ar); 6,70-7,62 (м, 7Н, Ar); 9,32 (с, 1Н, ArOH); 10,08 (с, 1Н, Ar-NH-CO). Найдено (%): С 51.59, Н 3.54, N 9.41. Вычислено (%): С 51.70, Н 3.43, N 9.52. Масс-спектр, m/z: 441.
Пример 15, группа III, (CL036)
5-оксо-N-пиридин-2-ил-4-(пиридин-4-илметил)-4,5,6,7-тетрагидро-1,3,4-тиадиазепин-2-карбоксамид
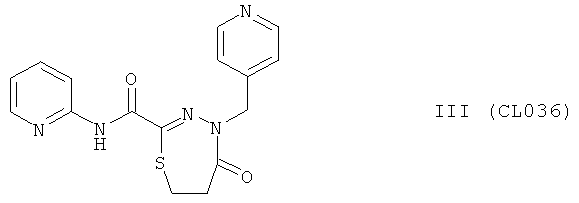
В качестве исходного N'-бензил тиогидразида использовалось соединение (7)
Выход (CL036) 204 мг (60%), Т.пл. 293-294°С. ЯМР 1Н DMSOd6 (δ, м.д., J, Гц): ЯМР 1Н DMSOd6 (δ, м.д., J, Гц): 1,53 (м, 2Н, -S-CH2-CH2-CO); 2,18 (м, 2Н, -S-CH2-СН2-СО); 5,14 (с, 1Н, -NH-CH2-Ar); 7,42-7,54 (м, 4Н, Ar); 8,07-8,23 (м, 4Н, аром); 10,42 (с, 1Н, Ar-NH-CO). Найдено (%): С 56.26, Н 4.52, N 20.43. Вычислено (%): С 56.29, Н 4.43, N 20.51. Масс-спектр, m/z: 341.
Пример 16, группа III, (CL032)
этил 5-этил-2-({[4-(2-гидроксибензил)-5-оксо-4,5,6,7-тетрагидро-1,3,4-тиадиазепин-2-ил]карбонил}амино)тиофен-3-карбоксилат
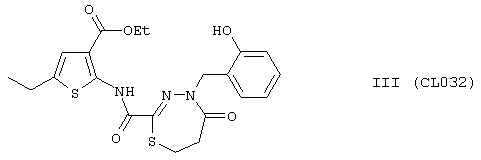
В качестве исходного N'-бензил тиогидразида использовалось соединение (10)
Выход (CL032) 370 мг, 80%. Т пл. >200°С с разл. ЯМР 1Н CDCl3 (δ, м.д., J, Гц): 1,25 (т, 3Н, CH2CH3, J=7,07); 1,31 (т, 3Н, CH2CH3, J=7,21); 1,55 (м, 2Н, -S-СН2-CH2-СО); 2,16 (м, 2Н, -S-CH2-CH2-CO); 2,44 (д, 2Н, CH2CH3, J=7,11); 4,43 (д, 2Н, CH2CH3, J=7,17); 5,19 (с, 1Н, -NH-CH2-Ar); 6,97-7,11 (м, 4Н, Ar); 7,49 (с, 1Н, Thiofen); 9,15 (с, 1Н, ArOH); 10,28 (с, 1Н, Ar-NH-CO). Найдено (%): С 54.52, Н 5.12, N 9.01. Вычислено (%): С 54.65, Н 5.02, N 9.10.
Пример 17, группа III, (CL031)
4-метил-N-(2-метилфенил)-5-оксо-4,5,6,7-тетрагидро-1,3,4-тиадиазепин-2-карбоксамид

В качестве исходного N'-бензил тиогидразида использовалось соединение (13)
Выход (CL031) 221 мг, 60%. Т.пл. >200°С с разл. ЯМР 1Н CDCl3 (δ, м.д., J, Гц): 1,55 (м, 2Н, -S-CH2-CH2-CO); 1,74 (с, 3Н, ArCH3); 2,16 (м, 2Н, -S-CH2-CH2-CO); 5,08 (с, 1Н, -NH-CH2-Ar); 7,89-7,58 (м, 8Н, Ar); 9,18 (с, 1Н, ArOH); 10,32 (с, 1Н, Ar-NH-CO). Найдено: С 61.70, Н 5.24, N 11.29. Вычислено: С 61.77, Н 5.18, N 11.37. Масс-спектр, m/z: 369.
Пример 18, группа III, (CL034)
4-(3-этокси-4-гидроксибензил)-N-(2,4-дифторфенил)-5-оксо-4,5,6,7-тетрагидро-1,3,4-тиадиазепин-2-карбоксамид
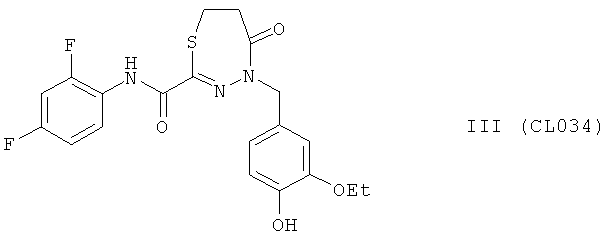
В качестве исходного N'-бензил тиогидразида использовалось соединение (16)
Выход (CL034) 348 мг, 80%. Т.пл. >250°С с разл. ЯМР 1Н CDCl3 (δ, м.д., J, Гц): 1.34 (т, 3Н, -O-CH2CH3, J=7,22); 1,58 (м, 2Н, -S-CH2-CH2-CO); 2,18 (м, 2Н, -S-CH2-CH2-CO); 3,96 (кд, 2Н, -О-CH2CH3, J=7,06 (13,90)); 5,20 (с, 1Н, -NH-CH2-Ar); 6,98-7,62 (м, 6Н, Ar); 9,00 (с, 1Н, ArOH); 10,27 (с, 1Н, Ar-NH-CO). Найдено (%): С 55.04, Н 4.52, N 9.52. Вычислено (%): С 55.17, Н 4.40, N 9.65. Масс-спектр, m/z: 435.
Биологические примеры.
Для определения токсичности и биологической активности замещенных производных тиадиазолинов, тиадиазинонов и тиадиазепинонов, полученных на основе тиогидразидов оксаминовых кислот, были использованы следующие методы:
1. Методы определения цитотоксического эффекта
А) Для определения токсичности в отношении эукариотической клетки использовали метод окрашивания клеток метиленовым синим (стандартная методика), с последующим спектрометрическим учетом результатов. Работу проводили в формате 96-луночных планшетов.
В суточном монослое клеток МсСоу (гибридная линия синовиальных клеток человека и мышиных фибробластов) и HL (эпителиальные клетки легкого человека) заменяли среду культивирования на свежую среду с циклогексимидом (1 мкг/мл) и вносили разные дозы исследуемых химических соединений. Клетки инкубировали в течение 24 и 48 часов в СО2 инкубаторе при 37°С. Спустя 24 и 48 часов из лунок отбирали культуральную среду и отмывали клетки 0,1 мМ раствором фосфатно-солевого буфера (ФСБ). Клетки фиксировали охлажденным метанолом (20 мкл) в течение 15 мин при 4°С. К фиксированным клеткам добавляли 40 мкл 0,5% метиленового синего и инкубировали 20 мин при комнатной температуре. После инкубации метиленовый синий отбирали из лунок и отмывали клетки ФСБ 4 раза. В лунки добавляли 100 мкл 5% додецилсульфата натрия (SDS) в ФСБ и инкубировали в течение 1 часа при комнатной температуре до полного лизиса клеток. Количество живых клеток определяли спектрометрически при длине волны 540 нм на флуориметре MultiscanEX.
Б) Метод, направленный на определение метаболической активности клетки - МТТ-тест (Niks M., Otto M. Towards an optimized MTT assay. // J Immunol. - 1900. - V.130, №1. - p.149-151), основанный на восстановлении бесцветной соли тетразолия (3-[4,5-диметилтиазол-2-ил]-2,5-дифенилтетразолия бромид, MTT) митохондриальными и цитоплазматическими дегидрогеназами живых метаболически активных клеток с образованием голубых кристаллов формазана, количество которого измеряется спектрометрически.
Метод проводили в формате 96-луночного культурального планшета. В суточном монослое клеток МсСоу и HL заменяли среду культивирования на свежую среду без циклогексимида и вносили разные дозы исследуемых химических соединений. Клетки инкубировали в течение 48 часов в СО2 инкубаторе при 37°С. За 4 часа до окончания эксперимента вносили 1:10 от объема культуральной среды 10х раствора MTT (5 мг/мл). Инкубировали 4 часа при 37°С 5% СО2. Отбирали культуральную среду, отмывали однократно ФСБ. Добавляли в каждую лунку по 100 мкл изопропанола (пропанола-2). Инкубировали при комнатной температуре 30 минут. Оценивали оптическую плотность при длине волны 540 нм на флуориметре Multiscan EX. Субстратное поглощение оценивали при 405 нм.
В) Для оценки токсического эффекта исследуемых соединений в условиях in vitro был использован кальцеиновый тест, который основывается на двойной окраске живых, метаболически активных клеток, и мертвых клеток, с поврежденной цитоплазматической мембраной. В качестве первого красителя используется нефлюоресцирующий ацетоксиметилированный эфир кальцеина, который под действием внутриклеточных эстераз живой клетки переходит в флюоресцирующие анионы кальцеина, что обусловливает зеленое свечение живых клеток при флюоресцентной микроскопии. Вторым красителем является этидиум гомодимер, который проникает внутрь клетки только в условиях нарушения целостности ее мембраны и, связываясь с нуклеиновыми кислотами, окрашивает ядро клетки в оранжевый цвет. При просмотре препаратов с помощью люминесцентного микроскопа дифференцируют и определяют количество живых и мертвых клеток в исследуемых условиях.
Метод проводили в формате 24-луночного культурального планшета со стеклами. Анализ осуществлялся согласно протоколу, прилагаемому к коммерческому набору LIVE/DEAD Viability/Cytotoxicity Kit for mammalian cells (Invitrogen, США). Для этого в суточном монослое клеток HL заменяли среду культивирования на свежую среду без циклогексимида и вносили разные дозы исследуемых химических соединений. Клетки инкубировали в течение 48 часов в CO2 инкубаторе при 37°С. Затем отбирали среду, отмывали однократно ФСБ и, не высушивая стекол, вносили смесь реагентов: 20 мкл 2 мМ этидиум гомодимера и 5 мкл 2 мМ Calcein AM, растворенных в 10 мл стерильного ФСБ, в объеме 150 мкл на лунку. Инкубировали в течение 20 мин при 37°С. Затем стекла монтировали на предметное стекло при нанесении на него нескольких 15-20 мкл того же раствора. Учет результатов (определение соотношения живых и мертвых клеток) осуществляли методом флюоресцентной микроскопии.
2. Метод суспензионного заражения эукариотических клеток.
Метод суспензионного заражения эукариотических клеток хламидиями позволяет стандартизовать проведение биологических экспериментов в скрининговом формате на 96-луночных плашках. Для получения суспензии клеток использовали суточный монослой клеток МсСоу и HL, который обрабатывали раствором трипсина и версена (соотношение 1:3 соответственно) для открепления клеток от поверхности флакона. Флакон помещали в термостат на 5 мин. Затем отбирали раствор трипсина и версена и клетки суспендировали в среде культивирования (RPMI 1640 с 10% фетальной сывороткой).
Для получения монослоя из приготовленной клеточной суспензии производили подсчет клеток в камере Горяева из расчета 1,5×105 кл/мл. Заражение клеток штаммом Bu-434 Chlamydia trachomatis серовар L2 производили в соотношении бактерия:клетка 1:1 в необходимом объеме транспортной среды (среда RPMI с 5% фетальной сывороткой, 25 мМ раствора глюкозы, 5 мкг/мл амфотерицина и 4 мкг/мл гентамицина), что обеспечивает 80-90% инфицированных клеток. Готовую суспензию вносили в лунки 96- или 24-луночных планшетов в объеме 100 мкл или 1000 мкл соответственно. Для осаждения клеток и стимуляции взаимодействия с ними хламидий планшеты центрифугировали при 3000 об/мин 1 час при температуре 25°С. После этого планшет помещали в СО2 инкубатор на 48 ч при 37°С.
3. Определение влияния замещенных производных тиадиазолинов, тиадиазинонов и тиадиазепинонов, полученных на основе тиогидразидов оксаминовых кислот, на жизнеспособность хламидий.
Исследуемые химические соединения в разных концентрациях вносили в культуру клеток одновременно с патогеном для оценки их влияния на внутриклеточное размножение хламидий. Эффект оценивали методом прямой иммунофлюоресценции и путем высева материала, полученного из лизата клеток, инфицированных в присутствии ингибитора клеток.
Метод прямой иммунофлюоресценции.
Методы иммунофлюоресценции направлены на выявление объектов, содержащих некоторый антиген, и основаны на обработке препаратов соответствующими антителами, меченными флюорохромом, с последующей микроскопией в ультрафиолетовом луче.
В данной работе использован метод прямой иммунофлюоресценции (стандартная методика), позволяющий проводить полуколичественный учет развития хламидийной инфекции при использовании моноклональных антител к видоспецифическому белковому антигену C.trachomatis.
Работу проводили на клеточных линиях МсСоу и HL, инфицированных методом суспензионного заражения С.trachomatis серовар L2 в формате 96-луночных планшетов или 24-луночных со стеклами. Исследуемые химические соединения добавляли в разных дозах непосредственно при заражении клеток. Через 48 ч из лунок отбирали надосадок и фиксировали клетки. При работе с 96-луночными планшетами фиксацию осуществляли ледяным 72° этанолом с последующим помещением планшета на 30-40 мин на -20°С. При работе с 24-луночными планшетами стекла промывали в 0,1 мМ растворе ФСБ и высушивали. После этого клетки фиксировали ацетоном в течение 15 мин при комнатной температуре. На фиксированные клетки наносили 30-50 мкл моноклональных, меченных ФИТЦ антител к белковому антигену C.trachomatis (ХлаМоноСкрин-2, ООО «НИАРМЕДИК ПЛЮС») и инкубировали в течение 30 мин во влажной камере при 37°С. После инкубации клетки промывались 2 раза раствором ФСБ. Препарат полностью высушивали. В формате 24-луночных планшетов подготовленные таким образом стекла монтировали на предметное стекло при помощи монтирующей жидкости (глицерин в ФСБ). Готовые препараты исследовали в люминесцентном микроскопе.
4. Определение влияния замещенных производных тиадиазолинов, тиадиазинонов и тиадиазепинонов, полученных на основе тиогидразидов оксаминовых кислот, на III транспортную систему хламидий.
Оценку влияния исследуемых соединений на III транспортную систему хламидий проводили на основе детекции транслокации эффекторного белка IncA C.trachomatis на мембрану внутриклеточного хламидийного включения. Белок IncA детектировали с помощью метода непрямой иммунофлюоресценции (стандартная методика) с использованием коммерческих антител к эффекторному белку ТТС IncA C.trachomatis (поликлональная кроличья сыворотка, специфическая к IncA, «Innovagen», Швеция) с последующей детекцией антикроличьими антителами, меченными ФИТЦ.
Для этого суточный монослой заражали для получения 80-90% инфицированных клеток, центрифугировали при 3000 об/мин 30 мин при 25°С. Через 8 ч после заражения (время начала транслокации эффекторного белка в мембрану включения) добавляли разные дозы исследуемых химических соединений. Через 24 ч из лунок отбирали культуральную среду, стекла промывали в 0,1 мМ растворе ФСБ и высушивали. После этого клетки фиксировали ацетоном в течение 15 мин при комнатной температуре. На фиксированные клетки наносили 50 мкл первичных анти IncA антител и инкубировали в течение 30 мин при 37°С. Затем стекла промывали указанным раствором ФСБ и наносили антитела, меченные ФИТЦ. Инкубировали в течение 30 мин во влажной камере при 37°С. После инкубации стекла с клетками промывались 2 раза раствором ФСБ. Препарат полностью высушивали. Подготовленные таким образом стекла монтировали на предметное стекло при помощи монтирующей жидкости. Готовые препараты исследовали в люминесцентном микроскопе. Одновременно проводилась окраска моноклональными антителами к белку МОМР наружной мембраны клеточной стенки, что позволяло оценивать развитие хламидийной инфекции.
Пример 19. Влияние соединений класса тиадиазолинов (I) на жизнеспособность эукариотических клеток и на развитие хламидийной инфекции
Соединения характеризуются высокой степенью растворимости в ДМФ, не образуют осадка в процессе хранения и при переведении в транспортную среду.
Анализ токсичности 6 исследуемых соединений данной группы в условиях in vitro при добавлении в среду культивирования эукариотических клеток в дозах 12.5, 25 и 50 мкМ и последующем инкубировании в течение 24 и 48 часов при 37°С, проведенный методами 1. А-В, выявил различия в действии соединений на жизнеспособность эукариотических клеток. Результаты оценки токсичности тиадиазолинов для эукариотических клеток представлены на диграмме, Таблица 1.
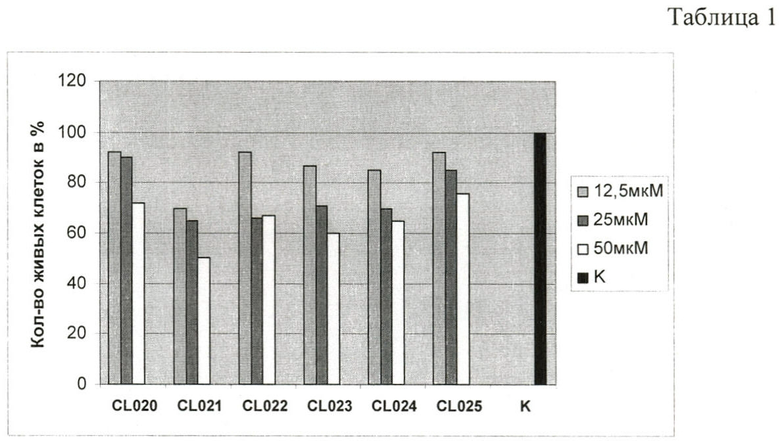
Наименьший токсический эффект был показан для соединений CL020, CL022, CL023, CL024 и CL025. Соединение CL021 характеризовалось выраженной токсичностью, что ограничивает возможность его дальнейшего испытания в качестве ингибитора хламидийной инфекции.
Способность соединений подавлять внутриклеточный жизненный цикл хламидий в условиях in vitro оценивалась при помощи методов 2-4. На диаграмме, Таблица 2, представлены результаты характеристики тиадиазолинов на развитие хламидийной инфекции.
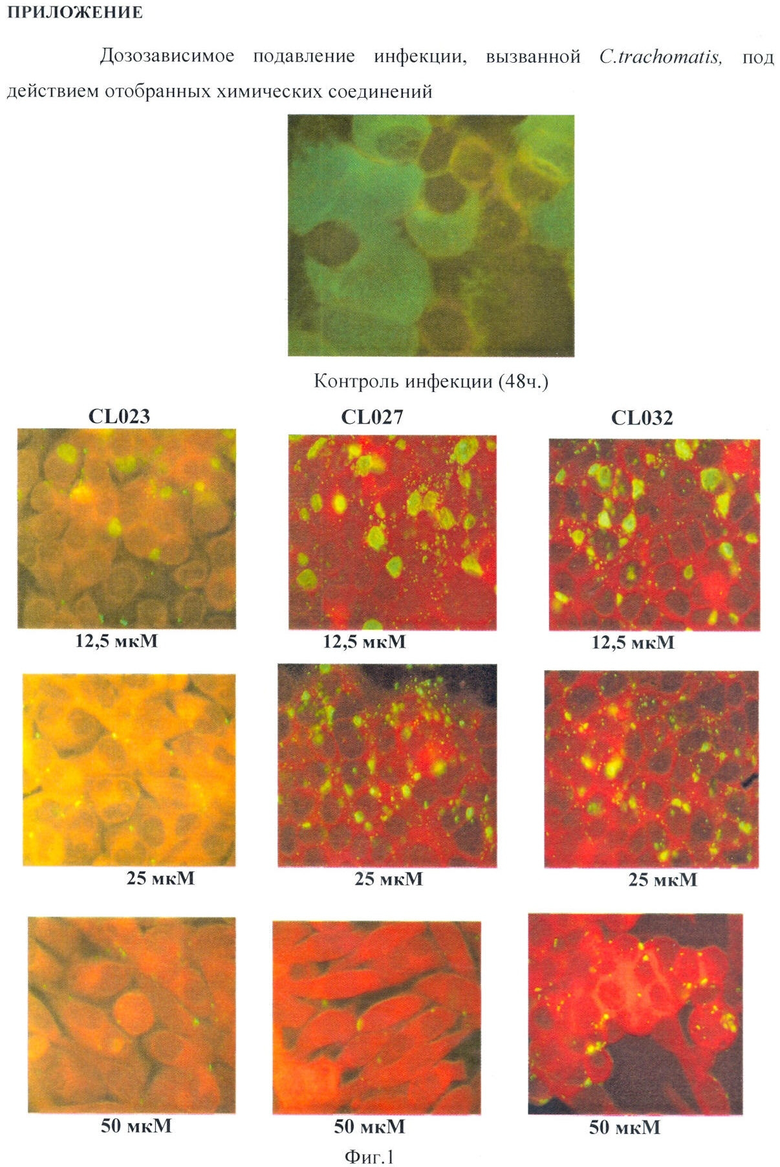
Наилучший эффект оказывало соединение CL023, подавляя жизнеспособность хламидий на 80% при концентрации 12,5 мкМ и полностью - при концентрации 25 мкМ при добавлении в транспортную среду одновременно с инфекционным материалом (штамм С.trachomatis L2) и последующем культивировании в течение 48 часов. Показано, что в данных условиях инфицированные клетки в анализируемом монослое отсутствуют. На Фиг.1 представлено дозозависимое подавление инфекции, вызванной С.trachomatis, под действием отобранных химических соединений. На Фиг.1 показано влияние соединения CL023 на внутриклеточное развитие хламидийной инфекции в условиях in vitro через 48 часов. На диаграмме, Таблица 2, представлены результаты характеристики тиадиазолинов на развитие хламидийной инфекции.
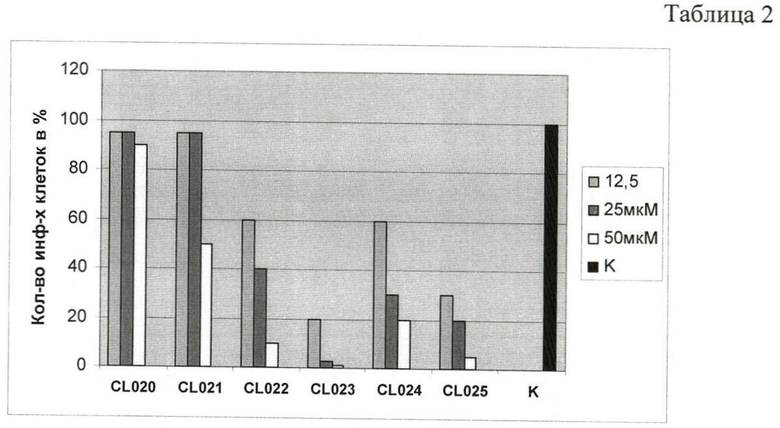
Соединения CL022, CL024 и CL025 эффективно подавляли развитие хламидий в дозе 50 мкМ. Анализ активности данных соединений в дозе 25 мкМ в аналогичных условиях проведения эксперимента выявил выраженное уменьшение размеров включений и сокращение их количества до 40, 30 и 20%.
Соединения CL020 и CL021 проявляли наименьший ингибирующий эффект даже при концентрации 50 мкМ, подавляя развитие инфекции лишь на 90 и 50%.
Пример 20. Влияние соединений класса тиадиазинонов (II) на жизнеспособность эукариотических клеток и на развитие хламидийной инфекции
Соединения характеризуются высокой степенью растворимости в ДМФ, не образуют осадка в процессе хранения и при переведении в транспортную среду.
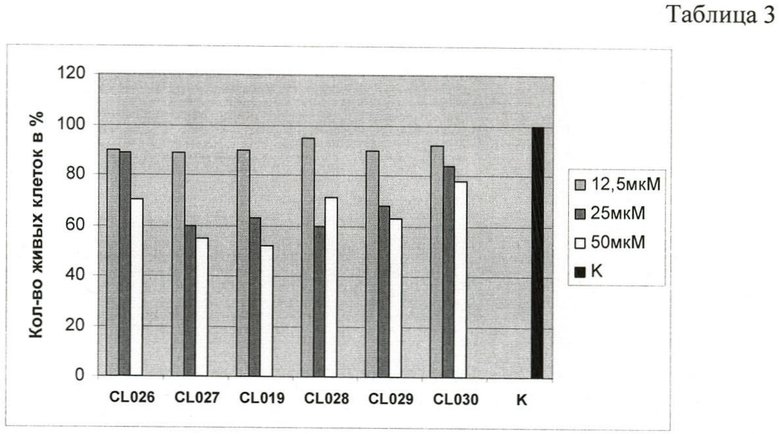
Токсичность соединений для эукариотических клеток оценивалась методами 1. А-В при добавлении соединений в среду культивирования клеток в дозах 12.5, 25 и 50 мкМ и последующем инкубировании в течение 48 часов при 37°С. Анализ токсичности выявил различия в действии соединений на жизнеспособность эукариотических клеток. На диаграмме, Таблица 3, представлены результаты оценки токсичности тиадиазинонов для эукариотических клеток
Наименьший токсический эффект был показан для соединений CL026 и CL030 при концентрации 25 и 50 мкМ.
Соединения CL027, CL019, CL028 и CL029 показали более выраженную токсичность при концентрациях 25 и 50 мкМ.
Способность соединений подавлять внутриклеточный жизненный цикл хламидий в условиях in vitro оценивалась при помощи методов 2-4. На диаграмме, Таблица 4, представлены результаты характеристики тиадиазинонов на развитие хламидийной инфекции.
Наилучший эффект оказывало соединение CL027, подавляя жизнеспособность хламидий на 80% при концентрации 25 мкМ и на 90% при концентрации 50 мкМ при добавлении в транспортную среду одновременно с инфекционным материалом (штамм C.trachomatis L2) и последующем культивировании в течение 48 часов. Показано, что в данных условиях в анализируемом монослое присутствовало значительно меньшее количество инфицированных клеток, а включения имели меньшие размеры (см. Фиг.1).

Соединение CL028, CL029 и CL030 эффективно подавляли развитие хламидий в дозе 50 мкМ. Анализ активности соединений CL029 и CL030 в дозе 25 мкМ в аналогичных условиях проведения эксперимента выявил выраженное уменьшение размеров включений и сокращение их количества до 50 и 30%.
Соединения CL019 и CL026 проявляли наименьший ингибирующий эффект даже при концентрации 50 мкМ, подавляя развитие инфекции лишь на 50 и 80%.
Пример 21. Влияние соединений класса тиадиазепинов (III) на жизнеспособность эукариотических клеток и на развитие хламидийной инфекции.
Соединения характеризуются высокой степенью растворимости в ДМФ, не образуют осадка в процессе хранения и при переведении в транспортную среду.
Анализ токсичности 6 исследуемых соединений данной группы в условиях in vitro при добавлении в среду культивирования эукариотических клеток в дозах 12.5, 25 и 50 мкМ и последующем инкубировании в течение 24 и 48 часов при 37°С, проведенный методами 1. А-В, выявил различия в действии соединений на жизнеспособность эукариотических клеток. На диаграмме, Таблица 5, представлены результаты оценки токсичности тиадиазепинов для эукариотических клеток.
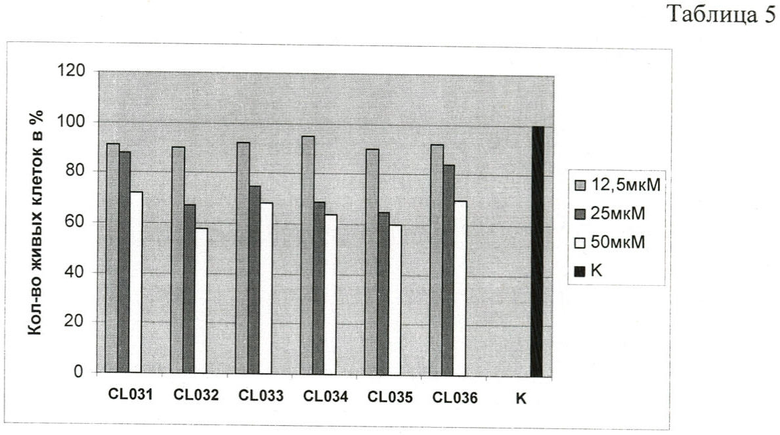
Наименьший токсический эффект был показан для соединений CL031, CL033 и CL036. Соединения CL032, CL034 и CL035 характеризовались большей токсичностью, однако даже при концентрации 50 мкМ токсичность не превышала 40%.
Способность соединений подавлять внутриклеточный жизненный цикл хламидий в условиях in vitro оценивалась при помощи методов 2-4. На диаграмме, Таблица 6, представлены результаты характеристики тиадиазепинов на развитие хламидийной инфекции.
Наилучший эффект оказывало соединение CL032, подавляя жизнеспособность хламидий на 80% при концентрации 25 мкМ и на 94% - при концентрации 50 мкМ при добавлении в транспортную среду одновременно с инфекционным материалом (штамм C.trachomatis L2) и последующем культивировании в течение 48 часов. Показано, что в данных условиях инфицированные клетки в анализируемом монослое практически отсутствуют (см. фиг.1).
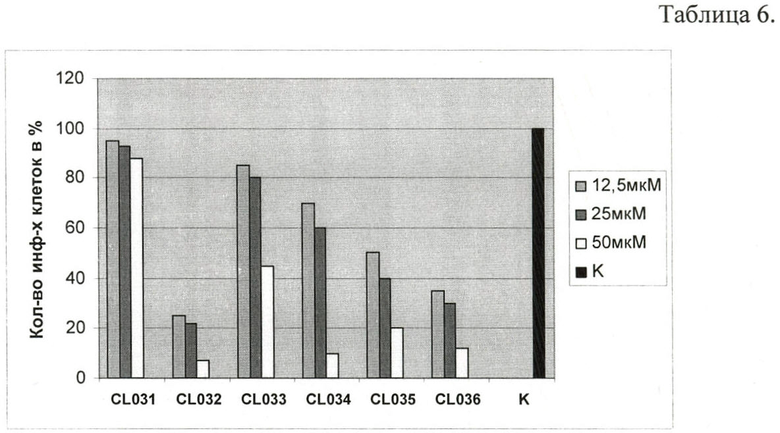
Соединения CL034, CL035 и CL036 эффективно подавляли развитие хламидий в дозе 50 мкМ. Анализ активности данных соединений в дозе 25 мкМ в аналогичных условиях проведения эксперимента выявил выраженное уменьшение размеров включений и сокращение их количества до 60, 40 и 30%.
Соединения CL031 и CL033 проявляли наименьший ингибирующий эффект даже при концентрации 50 мкМ, подавляя развитие инфекции лишь на 10 и 55%.
Характеристика действия замещенных производных тиадиазолинов, тиадиазинонов и тиадиазепинонов, полученных на основе тиогидразидов оксаминовых кислот, на III транспортную систему хламидий.
Исследование на специфическую активность замещенных производных тиадиазолинов, тиадиазинонов и тиадиазепинонов, полученных на основе тиогидразидов оксаминовых кислот, в отношении ингибирования функции третьей транспортной системы (ТТС) проводилось по методу 4.
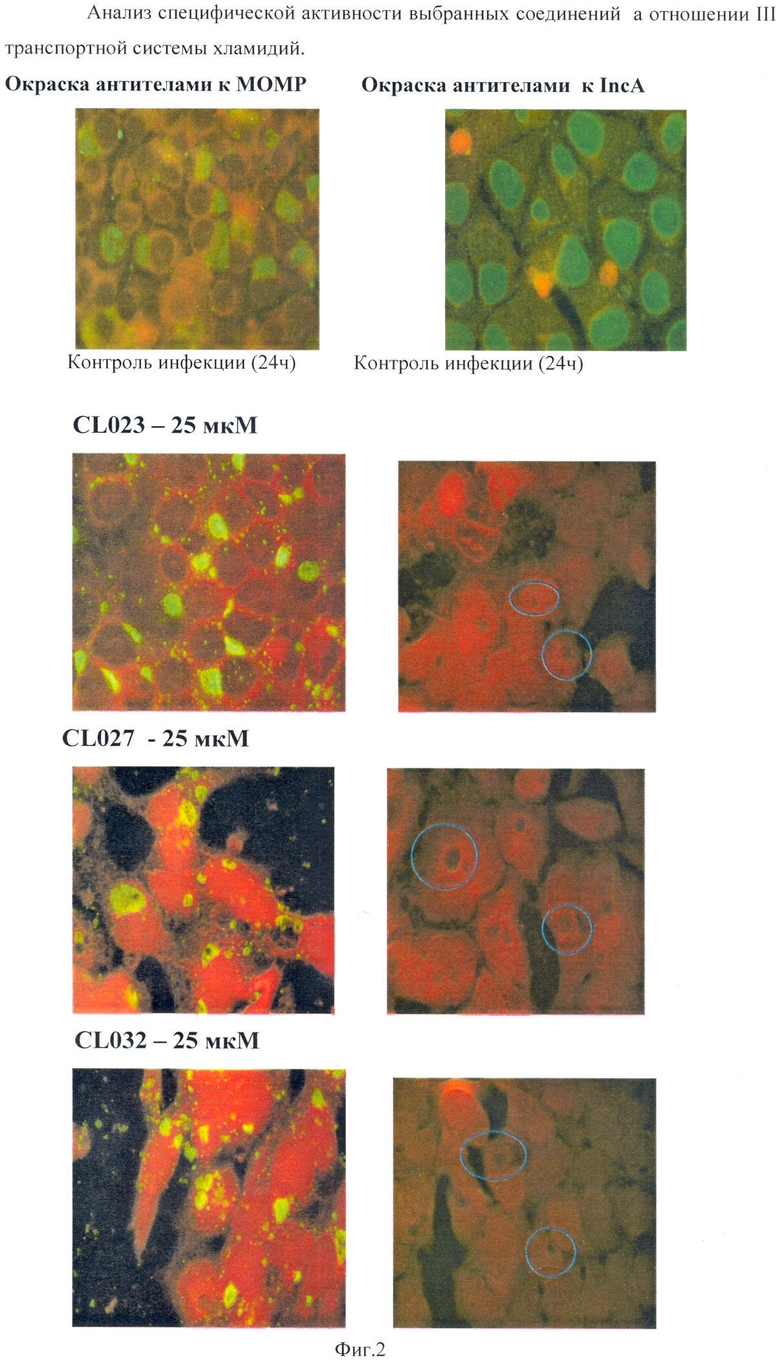
При иммунохимическом выявлении эффекторного белка IncA на поверхности хламидийных включений в контрольных препаратах выявляются включения, соответствующие по своим размерам сроку инфекции. В случае действия препарата на ТТС специфическое окрашивание не должно выявляться.
Характеристика действия соединений CL023, CL027 и CL032 на ТТС показало, что внесение этих соединений через 8 часов после заражения подавляло транслокацию эффекторного белка IncA.
Другой тест на специфичность соединений в отношении ТТС связан с тем, что транслоцируемый с помощью ТТС хламидийный белок IncA участвует в процессе слияния отдельных, развивающихся внутри клетки включений. При окраске инфицированных клеток антителами к белку МОМР в формате эксперимента: заражение - через 8 часов внесение соединения - инкубация до 24 часов с момента заражения, в контрольных клетках наблюдали крупные включения, по одному в каждой клетке, а в случае действия соединения на ТТС - несколько мелких, не слившихся включений в цитоплазме клетки.
Специфический ингибирующий ТТС эффект был показан для соединений CL023, CL027 и CL032. На Фиг.2. представлен анализ специфической активности выбранных соединений в отношении III транспортной системы хламидий. На фиг.2 показано подавление транслокации эффекторного белка IncA C.trachomatis при действии данных соединений.
Проведенные тесты свидетельствуют о том, что ряд биологически активных соединений, представляющих собой соединения общей формулы I, II, III, может проявлять специфическую активность в отношении ТТС C.trachomatis, подавляя процесс транслокации эффекторного белка IncA и препятствуя тем самым процессу гомотипичного слияния первичных включений, т.е. ингибировать систему секреции III типа у патогенных бактерий, не вызывая развития устойчивости к препаратам в результате селекции резистентных мутантов, а также оказывая направленное воздействие на механизмы, обуславливающие процесс хронизации инфекции.
Сказанное выше позволяет сделать вывод, что поставленная техническая задача решена.
| название | год | авторы | номер документа |
|---|---|---|---|
| БИОЛОГИЧЕСКИ АКТИВНЫЕ ВЕЩЕСТВА, ПОДАВЛЯЮЩИЕ ПАТОГЕННЫЕ БАКТЕРИИ | 2008 |
|
RU2402531C2 |
| БИОЛОГИЧЕСКИ АКТИВНЫЕ ВЕЩЕСТВА, ПОДАВЛЯЮЩИЕ ПАТОГЕННЫЕ БАКТЕРИИ, И СПОСОБ ИНГИБИРОВАНИЯ СЕКРЕЦИИ III ТИПА У ПАТОГЕННЫХ БАКТЕРИЙ | 2012 |
|
RU2495036C1 |
| N-ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ ТИОГИДРАЗИДОВ ОКСАМИНОВЫХ КИСЛОТ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИХ ИСПОЛЬЗОВАНИЕ | 2009 |
|
RU2400471C1 |
| Применение 4-(3-этокси-4-гидроксибензил)-5-оксо-5,6-дигидро-4Н-[1,3,4]-тиадиазин-2-(2,4-дифторфенил)-карбоксамида для подавления инфекции, вызванной устойчивыми к антибиотикам штаммами Pseudomonas aeruginosa, и способ подавления этой инфекции | 2016 |
|
RU2624846C1 |
| НЕОБРАТИМЫЕ СВЕТОЧУВСТВИТЕЛЬНЫЕ ОРГАНИЧЕСКИЕ СИСТЕМЫ НА ОСНОВЕ ПРОИЗВОДНЫХ ХРОМОНА ДЛЯ ФОТОНИКИ | 2008 |
|
RU2374237C1 |
| ФОТОУПРАВЛЯЕМЫЕ ФОТОХРОМНЫЕ ЭЛЕКТРОЛЮМИНЕСЦИРУЮЩИЕ И ЭЛЕКТРОПРОВОДЯЩИЕ ПОЛИМЕРЫ ДЛЯ ФОТОНИКИ | 2004 |
|
RU2345998C2 |
| СПОСОБ ПОЛУЧЕНИЯ 5-ЗАМЕЩЁННЫХ 1,2,4-ТРИАЗОЛ-3-КАРБОНОВЫХ КИСЛОТ И ИХ ПРОИЗВОДНЫХ ИЗ УНИВЕРСАЛЬНОГО ПРЕДШЕСТВЕННИКА | 2015 |
|
RU2605414C1 |
| Азопроизводные аминофенолов, обладающие способностью ингибировать образование конечных продуктов гликирования | 2024 |
|
RU2839138C1 |
| ФОТОХРОМНЫЕ ПОЛИМЕРЫ ДЛЯ ТРЕХМЕРНОЙ ОПЕРАТИВНОЙ ОПТИЧЕСКОЙ ПАМЯТИ | 2004 |
|
RU2345997C2 |
| Замещенные спироандростен-17, 6'[1,3,4]тиадиазины, обладающие противовирусной активностью | 2021 |
|
RU2750639C1 |
Изобретение относится к производным 1,3,4-тиадиазолинов (I), тиадиазинонов (II) и тиадиазепинов (III), полученным на основе тиогидразидов оксаминовых кислот, которые могут быть использованы для подавления патогенных бактерий, в частности воздействовать на систему секреции III типа у патогенов, общей формулы:
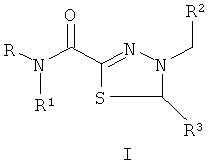
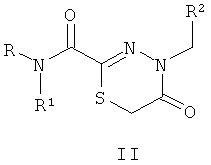
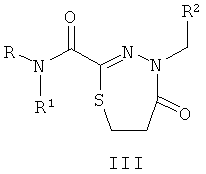
где R представляет собой Н; R1 представляет собой Н, пиридинил; фенил, замещенный алкилом С1-С5, Hal, СF3; группу 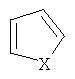 , где Х представляет собой S, замещенную алкилом С1-С5, COOR4; R2, R3 представляют собой алкил С1-С5, пиридинил, фенил, замещенный Hal, ОН, OR4, a R4 представляет собой незамещенный алкил С1-С4. 2 н.п. ф-лы, 2 ил., 6 табл., 21 пр.
, где Х представляет собой S, замещенную алкилом С1-С5, COOR4; R2, R3 представляют собой алкил С1-С5, пиридинил, фенил, замещенный Hal, ОН, OR4, a R4 представляет собой незамещенный алкил С1-С4. 2 н.п. ф-лы, 2 ил., 6 табл., 21 пр.
1. Биологически активные вещества, подавляющие патогенные бактерии, представляющие собой замещенные производные 1,3,4-тиадиазолинов (I), тиадиазинонов (II) и тиадиазепинонов (III), полученные на основе тиогидразидов оксаминовых кислот общей формулы



где R представляет собой H; R1 представляет собой Н, пиридинил; фенил, замещенный алкилом С1-С5, Hal, СF3; группу  , где Х представляет собой S, замещенную алкилом С1-С5, COOR4; R2, R3 представляют собой алкил С1-С5, пиридинил, фенил, замещенный Hal, ОН, OR4, a R4 представляет собой незамещенный алкил С1-С4.
, где Х представляет собой S, замещенную алкилом С1-С5, COOR4; R2, R3 представляют собой алкил С1-С5, пиридинил, фенил, замещенный Hal, ОН, OR4, a R4 представляет собой незамещенный алкил С1-С4.
2. Способ ингибирования секреции III типа у патогенных бактерий, заключающийся в воздействии на бактерии эффективным количеством соединения по п.1.
| FLEISCHHAUER JAN ET AL, Chemical Sciences, vol.64, no.4, 2008, p.p.415-424 | |||
| R.NORDFELTH ET AL, Infection and Immunity, vol.73, no.5, 2005, p.p.3104-3114 | |||
| RU 2008129503 A, 27.01.2010 | |||
| Способ получения производных 1,3,4-тиадиазол-2-карбоновой кислоты | 1979 |
|
SU886745A3 |
Авторы
Даты
2012-04-10—Публикация
2010-04-15—Подача