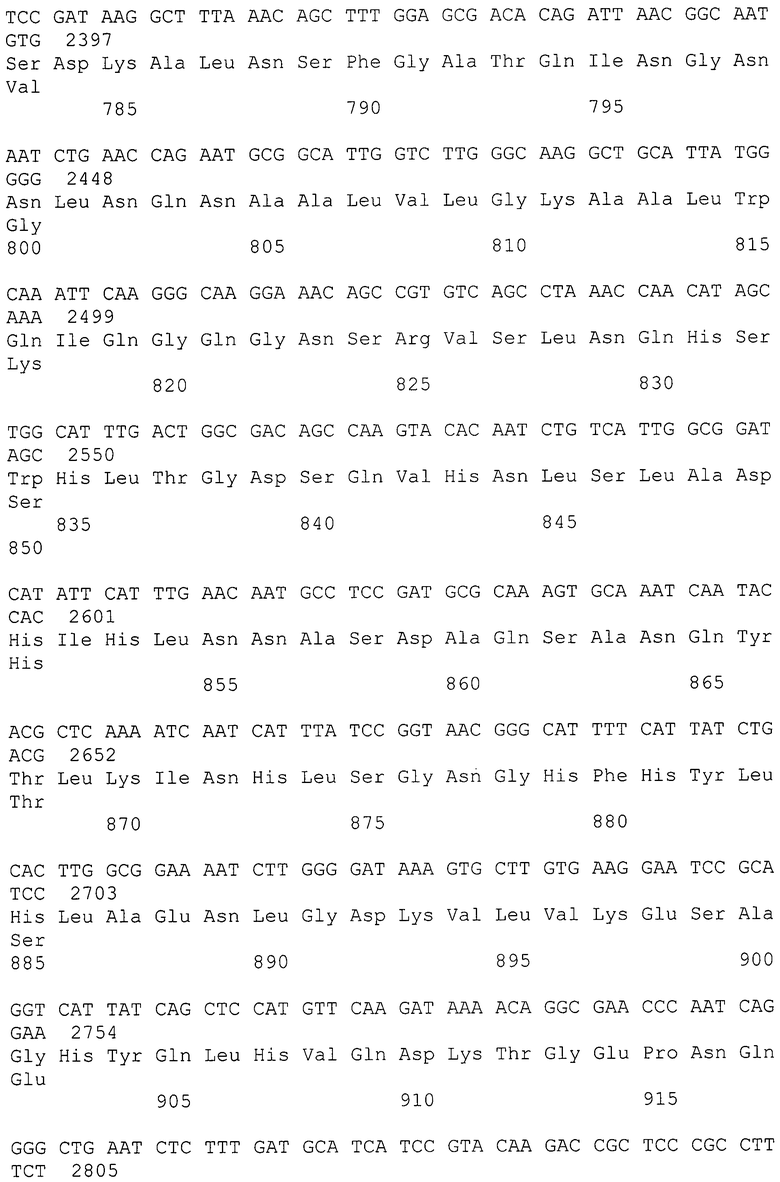
Изобретение относится к области иммунологии, энзимологии, микробиологии и генной инженерии, и касается новой нуклеиновой кислоты, кодирующей функционально активную рекомбинантную IgA1 протеазу Neisseria meningitidis, новой рекомбинантной плазмидной ДНК pBIGAPS1 и нового штамма бактерий Escherichia coli BL21(DE3)/pBIGAPS1, который может быть использован для получения высокоочищенной генно-инженерной IgA1 протеазы и в качестве компонента поливалентной вакцины, предназначенной для защиты человека, прежде всего детей от менингококковой инфекции и других микроорганизмов, патогенность которых обусловлена IgA1 протеазой.
Проблема эффективной вакцинопрофилактики менингококковой инфекции, вызываемой менингококком серогруппы В, до сих пор не решена. В реестре зарегистрированных менингококковых вакцин ВОЗ не зафиксировано ни одного препарата против менинингококка этой серогруппы. Отсутствие эффективной менингококковой группы В вакцины препятствует ликвидации этой инфекции в нашей стране и за ее пределами. Известно, что сериновая IgA протеаза секретируется некоторыми опасными бактериями, прежде всего Neisseria meningitidis, и расщепляет иммуноглобулины класса А на поверхности слизистых оболочек, разрушая первый защитный барьер иммунитета организма-хозяина. Известна менингококковая IgA1 протеаза, которая в опытах на лабораторных животных проявила себя как высокоэффективная менингококковая поливакцина, а следовательно, и вакцина против менингококка серогруппы В (заявка №2009136634/10, решение о выдаче патента) от 16 августа 2010 г.). Было установлено, что выделенная из культуральной жидкости или из продуктов очистки вакцины (менингококковой группы А) IgA1 протеаза высокоэффективна ферментативно и иммунологически, но содержится в указанных источниках в микроколичествах, поэтому могут возникнуть сложности при получении протеазы в препаративных количествах.
В предшествующем уровне техники описано множество попыток создания вакцин, предназначенных для защиты от инфекции менингита группы В. В заявках WO 2005/105141 20051110, WO 95/03413, WO 2005/102384 20051103, WO 03/094960 20031120, WO 2006/024954 20060309, WO 2004/014417 20040219, WO 2005/033148 20050414, WO 2004/032958, WO 03/028661 20030410, WO 2004/014419 A1 WO 02/083711 предлагаются композиции и кандидаты в вакцины на основе липополисахарида, капсулярных олигосахаридов и ряда поверхностных белков менингококка для иммунизации пациента против заболевания, вызываемого Neisseria meningitidis различных серогрупп.
Однако указанные композиции не включают IgA1 протеазу и не обеспечивают достаточную эффективную защиту от менингококковой инфекции и в частности от менингита группы В.
В заявке WO 2004/102199 А2 описан способ идентификации, выбора и выделения вакцинного компонента для пассивной и активной иммунизации против микроорганизма Streptococcus pneumonia, который подвергается уничтожению опсонофагоцитарными клетками. Методом компьютерного моделирования (in silico) идентифицированы антигены, индуцирующие опсонофагоцитоз, которые предлагается использовать в качестве компонентов вакцины, предназначенной для иммунизации. Идентифицировано три пневмококковых белка стрептококлипопротеинароматаза (SlrA), IgA1 протеаза класса металлопротеаз и пневмококковый поверхностный белок адгезии A (PsaA) из Streptococcus pneumonia, получены их рекомбинантные варианты, которые изучены в качестве компонентов вакцины. Установлено, что композиция, содержащая все три рекомбинантных варианта, защищает мышей от указанной инфекции, однако каждый компонент в отдельности не обладает защитными свойствами.
В статье Shishir K. Gupta и др., Vaccine, 2010, т.28, стр.7092-7097 описаны результаты компьютерного моделирования последовательностей белков менингококка серогруппы В и выявлены 6 пептидов-эпитопов Т-хелперных клеток из трех белков: стимулирующий Т-клетки белок А, автотранспортный белок А и IgA1 протеаза. Авторы предполагают, что эти пептиды можно использовать в качестве перспективных агентов против менингококка группы В. Однако экспериментальные данные, подтверждающие данную гипотезу, не приводятся.
Известно (Пат. US 7235242, Achtman, et al., 26.06.2007) получение фрагмента IgA1-протеазы, который используют в качестве пептида-носителя. Описан синтез фрагмента IgA1-протеазы, содержащего от 40 до 200 аминокислотных остатков и включающего 40 аминокислотных остатков последовательности SEQ ID NO: 1, с использованием автоматического синтезатора. Однако при конъюгации с полисахаридом IgA1-протеаза обеспечивает защиту только от менингококка серогруппы С и не эффективна против менингококков серогруппы В.
Известно (Пат. US 7407653, Plaut et al., 05.08.2008) применение бактериальных IgA1-протеаз для лечения заболеваний, связанных с отложениями IgA1 в тканях и органах организма. Растворимые IgA1-протеазы, содержащие различные метки, например, полигистидиновый фрагмент, получают рекомбинантным способом. Фермент выделяют по известной методике с использованием ультрафильтрации, ионообменной и металл-хелатной хроматографии. Полученные препараты можно использовать в качестве фермента для лечения аутоиммунных заболеваний, связанных с накоплением IgA, но не в качестве вакцины.
Известен наиболее близкий к заявленному способ получения предшественника IgA1 протеазы. В статье S.Vitovski and J.R.Sayers, Infection and Immunity, 2007, т.75, №6, стр.2875-2885 описано клонирование полноразмерного гена, кодирующего сигнальный пептид, секретируемую форму протеиназы и автотранспортерный домен и исследование механизма автопроцессинга IgA1 протеазы из ее предшественника. С этой целью был создан ряд мутированных форм белка-предшественника IgA1 протеазы Neisseria meningitidis серогруппы В (NMB), включая мутант с делецией 32-членного пептида в области сайта автопроцессинга, а также мутант, включающий замену остатка Ser в активном центре на остаток Val. Для получения мутантов использовали штаммы NMB, выделенные из цереброспинальной жидкости больных менингококком. Было установлено, что указанные мутанты не обладали автопротеолитической активностью и не наблюдалось образование секретируемой зрелой протеазы. Но в этой работе получали только предшественник IgA1 протеазы, не исследовали ее протективные и иммуногенные свойства, а также не рассматривается возможность создания вакцины на основе IgA1 протеазы.
Кроме того, анализ геномного банка данных показал, что до настоящего времени не известна последовательность гена, кодирующего IgA1 протеазу из Neisseria meningitidis штамм Н44/76.
Изобретение решает задачу получения рекомбинантной IgA1 протеазы, обладающей иммуногенными и протективными свойствами, предназначенной для получения поливакцины для профилактики менингококковых инфекций, в том числе вызываемых бактериями N.meningitidis серогруппы В.
Поставленная задача решается за счет:
Нуклеиновой кислоты, кодирующей IgA1 протеазу Neisseria meningitidis серогруппы В штамм Н44/76 (SEQ ID NO: 1);
рекомбинантной плазмидной ДНК, включающей вышеуказанную нуклеотидную последовательность, и обеспечивающей экспрессию IgA1 протеазы в клетке-хозяине (pBIGAPS1), характеризующейся следующими признаками:
длина цепи составляет 8123 п.о.;
кодирует секретируемую форму IgA1 протеазы с сигнальной последовательностью на N-конце и гистидиновой меткой на С-конце белка;
нуклеотидную последовательность, кодирующую IgA1-протеазу в плазмиде pBIGAPS1, фланкируют уникальные сайты рестрикции эндонуклеазами NdeI и XhoI,
содержит T7lac-промотор транскрипции;
генетическим маркером служит нуклеотидная последовательность (kan), определяющая устойчивость трансформированных плазмидой pBIGAPS1 клеток бактерий к канамицину;
штамма-продуцента Е.coli BL21(DE3)/pBIGAPS1, содержащего рекомбинантную плазмидную ДНК, который продуцирует зрелую форму IgA1 протеазы;
IgA1 протеазы с молекулярной массой 107,6 кДа и рассчитанной изоэлектрической точкой 7,4, с аминокислотной последовательностью (SEQ ID NO: 2), кодируемой вышеуказанной нуклеотидной последовательностью, обладающей иммуногенными и протективными свойствами, предназначенной для получения поливакцины для профилактики менингококковых инфекций, в том числе вызываемых бактериями N. meningitidis серогруппы В;
а также за счет способа получения зрелой формы IgA1 протеазы Neisseria meningitidis серогруппы В, заключающегося в том, что клетку-хозяина трансформируют рекомбинантной плазмидной ДНК кодирующей IgA1 протеазу Neisseria meningitidis серогруппы В с нуклеотидной последовательностью (SEQ ID NO: 1), культивируют штамм-продуцент, выделяют и очищают целевой продукт из телец включения.
Техническим результатом изобретения является получение впервые высокоочищенной полноразмерной IgA1 протеазы N.meningitidis серогруппы В (40% фермента от суммарного клеточного белка, 20 мг из 2 г биомассы клеток, чистота препарата - не менее 90%). Полученный препарат обладает выраженной иммуногенной и протективной активностью в опытах на лабораторных животных. Результаты работы показывают перспективность патентуемого препарата рекомбинантной IgA1 протеазы при разработке поливалентной вакцины для профилактики инфекций и, в первую очередь, для профилактики менингококковых инфекций, вызываемой бактериями N.meningitidis серогруппы В.
Один объект настоящего изобретения включает установление нуклеотидной последовательности iga Neisseria meningitidis серогруппы В штамм Н44/76, кодирующей IgA1 протеазу N.meningitidis серогруппы В. Другой объект настоящего изобретения включает рекомбинантную плазмиду, включающую вышеуказанную нуклеотидную последовательность и обеспечивающую экспрессию IgA1 протеазы в клетке-хозяине.
Был проведен анализ геномного банка данных http://www.ncbi.nlm.nih.gov/Genbank) с целью поиска известных последовательностей генов IgA1 протеазы, продуцируемой штаммами N. meningitidis серогруппы В. Выявлено, что имеющиеся данные охватывают единственный штамм серогруппы В - МС58. На основе последовательности гена, кодирующего IgA1 протеазу МС58, были сконструированы праймеры для клонирования фрагмента гена фермента родственного штамма Н44/76, кодирующего форму IgA1 протеазы, близкую по размеру к секретируемой (~ 900-1000 а.о.). Для клонирования секретируемой формы фермента IgA1 протеазы проводили амплификацию нуклеотидной последовательности по стандартному протоколу ПЦР, используя в качестве матрицы геномную ДНК штамма Neisseria meningitidis Н44/76. Был получен фрагмент ДНК длиной около 2900 п.о. Целевой ПЦР-продукт был клонирован в вектор рЕТ-24а(+) (Novagen, Cat. No 69749-3) при использовании уникальных сайтов рестрикции NdeI и XhoI таким образом, чтобы продуцируемый белок содержал His-метку в C-концевой области для последующей очистки белка с помощью металлохелатной хроматографии. Проведено секвенирование клонированной нуклеотидной последовательности, в результате впервые была установлена нуклеотидная последовательность фрагмента гена, кодирующего секретируемую форму IgA1 протеазы из Neisseria meningitidis Н44/76, на основании которой определена аминокислотная последовательность белка. Полученная плазмидная ДНК была названа pBIGAPS1.
Еще один объект настоящего изобретения включает штамм Е.coli, содержащий рекомбинантную нуклеиновую последовательность (см. выше), который продуцирует зрелую форму IgA1 протеазы. В качестве клетки-хозяина использовали, прежде всего, штамм Е.coli BL21(DE3), на основе которого был получен штамм BL21(DE3)/pBIGAPS1, описанный ниже.
Другой объект включает способ получения зрелой формы IgA1 протеазы Neisseria meningitidis серогруппы В, заключающийся в том, что клетку-хозяина Е.coli BL21(DE3) трансформируют описанной выше рекомбинантной плазмидной ДНК, кодирующей IgA1 протеазу Neisseria meningitidis серогруппы В, с нуклеотидной последовательностью (SEQ ID NO: 1), культивируют клетки-хозяина, как описано ниже, выделяют и очищают целевой продукт из телец включения.
Еще один объект настоящего изобретения включает IgA1 протеазу с молекулярной массой 107,6 кДа и рассчитанной изоэлектрической точкой 7,4 и аминокислотной последовательностью (SEQ ID NO: 2), кодируемую описанной выше нуклеотидной последовательностью и полученную указанным выше способом, предназначенную для получения поливакцины для профилактики инфекций, в том числе вызываемых бактериями N. meningitidis серогруппы В.
IgA1 протеаза в качестве активного компонента может быть использована для получения поливакцины для профилактики инфекций, вызываемых бактериями, такими как Clostridium ramosum, Bacteroides melaninogenicus, Capnocytophaga ochracea, Streptococcus pneumonia, Streptococcus sanguis, Streptococcus oralis, Streptococcus mitis, Haemophilus influenzae, Haemophilus influenzae, Haemophilus aegyptius, Neisseria gonorrhoeae, Neisseria meningitidis, Haemophilus influenzae, Streptococcus viridans, Streptococcus canis, Streptococcus suis, Staphylococcus aureus, Staphylococcus epidermidis, Moraxella catarrhalis, Helicobacter pylori, Campylobacter jejuni, прежде всего N.meningitidis серогруппы В.
Для получения штамма-продуцента IgA1-протеазы трансформируют компетентные клетки Escherichia coli BL21(DE3) (E.coli В F- dcm ompT hsdS (rB - mB -) gal λ (DE3)) (Stratagene Cat. No 200131) плазмидной ДНК pBIGAPS1.
Полученный штамм, названный Е.coli BL21(DE3)/pBIGAPS1, характеризуется следующими свойствами:
Культурально-морфологические признаки:
Клетки мелкие, палочковидной формы, грамотрицательные, 1×3,5 мкм, подвижные. Штамм хорошо растет на обычных питательных средах (LB-бульон, LB-агар). При росте на агаризованной среде LB колонии округлые, гладкие, полупрозрачные, блестящие, желтоватого цвета. Край ровный, диаметр колоний 2-3 мм, консистенция пастообразная. Рост в жидкой среде LB характеризуется ровным помутнением, осадок легко седиментирует.
Физиолого-биохимические признаки:
Клетки растут при 4-42°С, оптимум рН 6,8-7,6. В качестве источника азота используют как минеральные соли аммония, так и органические соединения: аминокислоты, пептон, триптон, дрожжевой экстракт.
Генетические признаки:
Клетки проявляют устойчивость к канамицину (до 100 мкг/мл), обусловленную наличием гена устойчивости к антибиотику в рекомбинантной плазмидной ДНК pBIGAPS1.
Условия хранения:
Штамм бактерий Е.coli BL21(DE3)/pBIGAPS1 хранят на чашках и косяках при 4°С. Пересевы на свежие среды проводят один раз в месяц. Может храниться не менее одного года в среде LB, содержащей 15% глицерина, при -70°С.
Устойчивость к антибиотикам:
Клетки штамма-продуцента проявляют устойчивость к канамицину (до 100 мкг/мл), обусловленную наличием гена устойчивости в рекомбинантной плазмидной ДНК pBIGAPS1.
Изобретение иллюстрируют графические материалы.
Фиг.1. Физическая карта рекомбинантной плазмидной ДНК pBIGAPS1.
Рекомбинантная плазмидная ДНК pBIGAPS1, содержащая 8123 п.о., кодирующая секретируемую форму IgA1-протеиназы, состоящая из:
bigaps1 - область, кодирующая сигнальный пептид, секретируемую форму IgA1-протеазы и гистидиновую метку, и фланкируемая уникальными сайтами рестрикции эндонуклеазами NdeI (3051) и XhoI (158) (нумерация приведена в соответствии с нумерацией в векторе рЕТ-24а), ori - участок инициации репликации рекомбинантной плазмидной ДНК, T7lac promoter - гибридный промотор транскрипции, Stop - терминатор транскрипции рибосомного оперона Е.coli, kan - ген, определяющий устойчивость микроорганизма к канамицину, f1 origin - участок, позволяющий получать одноцепочечную ДНК, lacI - область, кодирующая lac репрессор.
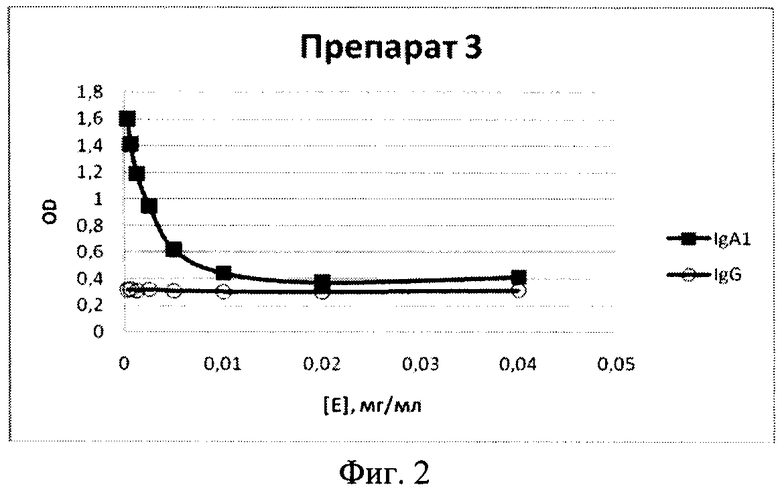
Фиг.2. Ферментативная активность IgA1 протеиназы. На оси ординат указано количество не прогидролизованного субстрата - IgA1 или IgG (контроль - методом ИФА) после инкубации с ферментом.
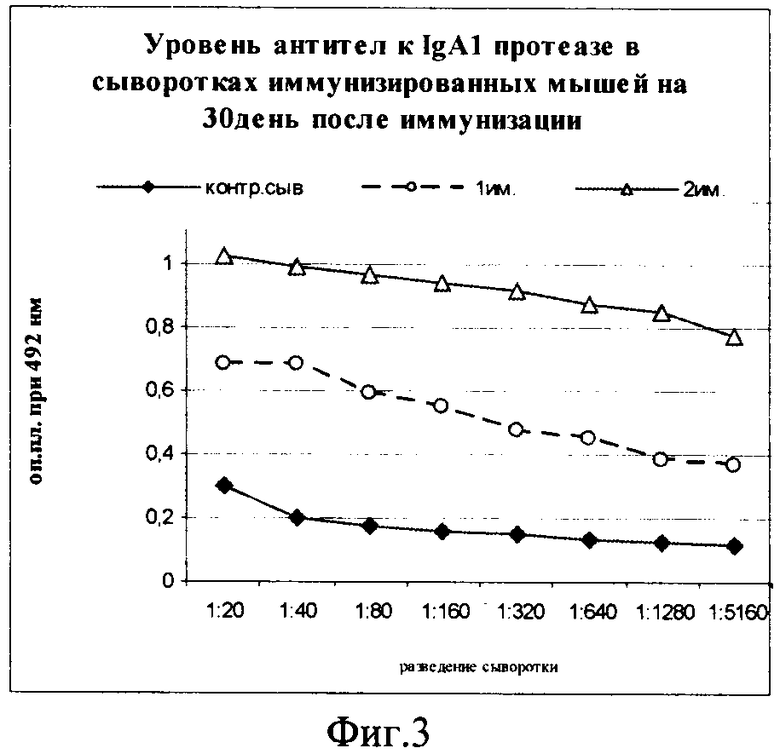
Фиг.3. Уровень специфических антител в крови иммунизированных мышей.
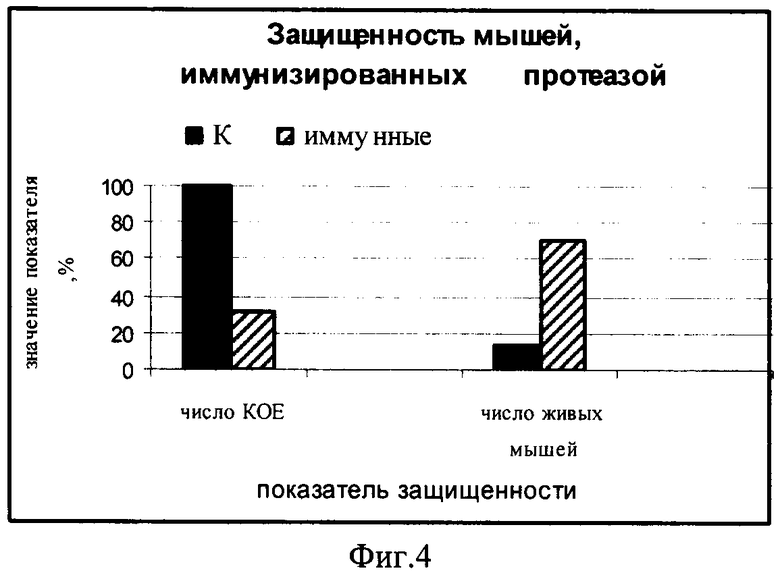
Фиг.4. Защищенность мышей, иммунизированных IgA1-протеазой после заражения менингококком серогруппы В штамм Н44/76.
Впервые установлена нуклеотидная последовательность фрагмента нуклеиновой кислоты (гена) iga Neisseria meningitidis серогруппы В штамм Н44/76, кодирующая секретируемую форму IgA1-специфической протеазы. Впервые создан экспрессионный штамм Е.coli суперпродуцент IgA1-протеазы серогруппы В, выделен белок и осуществлен его рефолдинг, позволяющий получать растворимую форму фермента.
Изобретение иллюстрируют примеры:
Пример 1
Определение и получение нуклеиновой кислоты, кодирующей IgA1 протеазу Neisseria meningitidis серогруппы В штамм Н44/76 (SEQ ID NO: 1)
Проведение анализа данных геномного банка (http://www.ncbi.nlm.nih.gov/Genbank) выявило, что к настоящему времени для Neisseria meningitidis серогруппы В известен единственный геном штамма МС58. На основании предположения о близости строения генов IgA1 протеаз родственных штаммов, по известной последовательности гена iga МС58 сконструированы праймеры для клонирования фрагмента нуклеиновой кислоты (гена) штамма Н44/76, кодирующего форму протеазы, близкую по размеру к секретируемой (примерно 900-1000 аминокислотных остатков, а.о.). Выбранная структура праймеров позволяет амплифицировать продукт полимеразной цепной реакции (ПЦР), пригодный для последующего встраивания в экспрессионные вектора семейства рЕТ (Novagen), используемые для получения белков в штаммах Е.coli, лизогенных по бактериофагу Т7.
Для последующего клонирования в векторе рЕТ-24(а+) в праймеры (f1 - прямой - 5-CGAGACAGCCATATGAAAACCAAACGTTTTAAAATTAAC-3 SEQ ID №3 - обратный - 5-GGGCTCGAGATTGTACAATCGGGTAATACCG-3 SEQ ID №4), потенциально фланкирующие целевой участок гена iga штамма Н44/76, введены последовательности сайтов узнавания рестриктаз NdeI и XhoI (соответственно для f1 и f2), имеющиеся в полилинкере вектора. Строение праймера f2, не содержащего терминирующих кодонов, позволяет получать белок, модифицированный в С-концевой области гексагистидиновой меткой для последующего проведения металлохелатной хроматографии при его выделении.
Амплификацию фрагмента нуклеиновой кислоты проводят по стандартному протоколу за 25 циклов ПЦР, используя в качестве матрицы геномную ДНК штамма Н44/76. Температуру отжига праймеров подбирают экспериментально. Обработку ПЦР-фрагмента и вектора рестриктазами, лигирование и трансформацию компетентных клеток проводят по стандартным процедурам. Далее проводят секвенирование клонированной ДНК с нескольких первичных клонов, в результате впервые установлена нуклеотидная последовательность фрагмента нуклеиновой кислоты, кодирующего секретируемую форму IgA1 протеазы из Neisseria meningitidis H44/76, на основании которой определена аминокислотная последовательность белка (SEQ ID NO: 2). Полученная плазмидная ДНК была названа pBIGAPS1.
Пример 2
А) Получение рекомбинантной плазмидной ДНК pBIGAPS1.
Рекомбинантную плазмидную ДНК получают из клеток ночной культуры стандартным щелочным методом (Maniatis, Т., Fritsch, E.F. and Sambrook, J. (1982) Molecular Cloning: a Laboratory Manual, Cold Sping Harbor Laboratory Press) и используют для введения в компетентные клетки с помощью теплового шока. Для этого к 50 мкл суспензии компетентных клеток добавляют 100 нг - 1 мкг плазмидной ДНК и инкубируют в течение 40 мин на льду. Полученную смесь инкубируют при 42°С в течение 2 мин, затем инкубируют во льду в течение 2 мин, добавляют 1 мл холодного бульона LB и инкубируют в течение 1 ч при 37°С. После этого 100 мкл суспензии бактериальных клеток высевают на чашки Петри с агаром, содержащим 50 мкг/мл канамицина. Чашки инкубируют в течение ночи при 37°С, бактериальные клетки нескольких выросших колоний используют для независимого засева микробиологических пробирок с 5 мл жидкой среды LB, содержащей 50 мкг/мл канамицина, с последующим выращиванием бактериальных клеток на качалке при 37°С в течение ночи. После этого в пробирки добавляют глицерин до конечной концентрации 15%, суспензию клеток разливают в пластиковые пробирки и хранят при -70°С.
Физическая карта рекомбинантной плазмидной ДНК приведена на фигуре 1.
Б) Получение штамма.
Штамм Е.coli BL21(DE3)/pBIGAPS1 получают путем введения плазмидной ДНК pBIGAPS1 в компетентные клетки Е.coli BL21(DE3) с помощью метода теплового шока. Для получения компетентных клеток бактериальные клетки исходного штамма Escherichia coli BL21(DE3) (Е.coli В F- dcm ompT hsdS (rB - mB -) gal λ (DE3)) выращивают в жидкой среде LB в течение ночи при 37°С и используют для засева 100 мл той же среды. Культуру выращивают до ранней логарифмической фазы на качалке при интенсивной аэрации (до оптической плотности при 600 нм = 0.4÷0.5), быстро охлаждают во льду, клетки осаждают центрифугированием в течение 10 мин при 5000 об/мин при +4°С. Осадок дважды промывают в 50 мл 100 мМ CaCl2. Осажденные клетки ресуспендируют в 2 мл 100 мМ CaCl2, с добавлением глицерина до 10%. Разделяют на аликвоты по 50 мкл, быстро замораживают и хранят при -70°С.
Пример 3
Определение продуктивности штамма-продуцента IgA1-протеазы.
В 15 мл жидкой среды LB, содержащей 50 мкг/мл канамицина, вносят 1% инокулят ночной культуры клеток и выращивают при 37°С на качалке при 180 об/мин в течение 2 ч до мутности 0,8. Затем добавляют индуктор изопропилтиогалактопиранозид (ИПТГ) до конечной концентрации 0,5 мМ и продолжают инкубацию в тех же условиях в течение 2,0 ч. Отбирают пробу 1 мл и центрифугируют в течение 6 мин при 12000 об/мин, после чего клетки суспендируют в 100 мкл деионизированной воды, добавляют 33 мкл буферного раствора, содержащего 125 мМ Трис-HCl, рН 6,8, 20% глицерин, 3% додецилсульфат натрия, 3% меркаптоэтанол и 0,01% бромфеноловый синий, нагревают в течение 10 мин до 95°С. Отбирают аликвоту и анализируют электрофорезом в 10% полиакриламидном геле, содержащем 0,1% додецилсульфат натрия. Гель окрашивают Кумасси R250 и сканируют на лазерном сканере. Продуктивность штамма Е.coli BL21(DE3)/pBIGAPS1 составляет 40% фермента от суммарного клеточного белка.
Пример 4
Выделение рекомбинантной IgA1 протеазы
Разрушение клеток и фракционирование лизата
Размороженные после хранения клетки (2 г из 1 л индуцированной культуры) ресуспендируют в семикратном объеме 20 мМ Tris-HCl-буфера, рН 8.5, содержащем 1% Тритон-Х100, либо в детергентсодержащем 20 мМ калий-фосфатном буфере, рН 7.5 Суспензия клеток пятикратно обработана ультразвуком и подвергнута центрифугированию (1 час, 20000 g). Разделенные фракции растворимых белков (бесклеточный экстракт, БЭ) и нерастворимая часть клеточного лизата (дебрис и нерастворимые белки) изолируют. Согласно результатам электрофоретического анализа целевой белок формирует нерастворимые тельца включения (ТВ), независимо от температурных условий индукции культуры и типа буфера, использованного при разрушении клеток. Нерастворимую часть лизата клеток, содержащую ТВ, после ресуспендирования в 1% Тритон-Х100 при повторной обработке ультразвуком и последующего центрифугирования используют для проведения хроматографии на Q-сефарозе в денатурирующих условиях.
Анионообменная хроматография на Q-сефарозе
ТВ, выделенные из 2 г клеток, индуцированные при 25°С, растворяют в 20 мл Tris-HCl-буфера, рН 8.5, содержащего 6 М мочевину и 20 мМ дитиотреитол (ДТТ). Суммарное количество белка, содержащегося в ТВ, составляет около 50 мг при определении по методу Брэдфорд. После центрифугирования и фильтрования раствор наносят со скоростью 1 мл/мин на 10 мл анионообменного сорбента (две предупакованные картридж-колонки HiTrap Q Sepharose HP, GE Healthcare, Швеция), уравновешенного тем же буфером. Фракции, содержащие очищенный белок и полученные в результате градиентной элюции хлоридом натрия (100 мл, 0-1 М NaCl) в стартовом буфере, объединяют (в сумме 20 мл) и используют для переведения IgA1-протеазы в растворимую форму. Выход частично очищенного препарата целевого белка на этой стадии составляет 40 мг из 2 г биомассы клеток.
Рефолдинг IgA1 протеазы
Объединенный элюат (20 мл, 2 мг/мл), полученный после проведения хроматографии на Q-сефарозе, разбавляют в 10 раз 20 мМ Tris-HCl-буфером, рН 8.5, методом быстрого разбавления (выкапывание раствора белка в буфер). После медленного перемешивания раствора (при концентрации белка 0.2 мг/мл) в течение 20 часов и последующего концентрирования методом ультрафильтрации до исходного объема раствор белка трижды диализуют против 1 л 20 мМ Tris-HCl-буфера, рН 8.5. Далее раствор подвергают центрифугированию (30 мин, 5000 g) и фильтрованию через стерильную мембрану с размером пор 0.2 мкм.
Выход белка на конечной стадии составляет 20 мг из 2 г биомассы клеток. Чистота препарата - не менее 90%.
Пример 5
Определение иммуногенной и протективной активности
Иммуногенную и протективную активность полученной IgA1 протеазы оценивают на мышах линии Balb/C. Для оценки этих показателей животных иммунизируют IgA1 протеазой дважды внутривенно в дозе 20 мкг/мышь с интервалом в 45 дней. Для иммунизации мышей используют препарат рекомбинантной IgA1 протеазы, полученный, как описано в примере 3. Полученный препарат обладает специфической ферментативной активностью, т.е. гидролизует IgA1 и не гидролизует IgG (фиг.2).
Показателем иммуногенности полученной IgA1 протеазы служит нарастание специфических антител в крови мышей на 10-й день после иммунизации, определяемых методом ИФА. Через 1 месяц после иммунизации мышей заражают живой вирулентной культурой менингококка серогруппы В штамм Н44/47.
Протективную активность IgA1 протеазы оценивают по уровню бактериемии у иммунизированных животных через 4 часа после заражения менингококком, а также по числу выживших животных, на 5-й день после заражения, по сравнению с этими же показателями у контрольных (неиммунизированных) мышей.
На фиг.3 показана диаграмма иммуногенной активности IgA1 протеазы. По оси ординат - оптическая плотность сывороток при λ=492 нм. Уже после однократной иммунизации уровень специфических антител в сыворотках мышей, иммунизированных IgA1 протеазой, возрастает примерно в 10 раз. Титр антител составляет 1:1280-1:2560. После повторной иммунизации антитела к IgA1 протеазе выявлялись при разведении более 1:5000.
На диаграмме фиг.4 представлены уровень бактериемии (в %) и число выживших мышей, однократно иммунизированных IgA1 протеазой (заштрихованный столбик) по сравнению с контрольными, неиммунизированными животными (черный столбик). Уровень бактериемии в группе иммунизированных мышей снижен на 68% (32 КОЕ) по сравнению с контрольными неиммунизированными мышами (100 КОЕ).
При заражении мышей менингококком в дозе 25·104 микробных клеток в контрольной группе выжило только 2 животных из 14-ти (14%), тогда как в группе иммунизированных IgA1 протеазой выжило 10 мышей из 14 (71%).
Полученные результаты свидетельствуют о высокой иммуногенной и протективной активности препарата рекомбинантной менингококковой IgA1 протеазы серогруппы B в отношении этой инфекции. Кроме того, результаты, полученные ранее (решение о выдаче патента по заявке №2009136634 от 05.10.2009 г. на «Способ получения IgA1 протеазы из культуры Neisseria meningitidis серогруппы А и иммуногенный препарат на ее основе»), дают основание считать, что полученный препарат может быть использован как кандидат на вакцину против менингококковой инфекции основных эпидемических серогрупп А, В и С.
Таким образом, впервые установлена нуклеотидная последовательность фрагмента нуклеиновой кислоты iga Neisseria meningitidis серогруппы В штамм Н44/76, кодирующая секретируемую форму IgA1-специфической протеазы. Впервые на основе полученной плазмидной ДНК pBIGAPS1 создан экспрессионный штамм Е.coli суперпродуцент IgA1 протеазы серогруппы В, выделен белок и осуществлен его рефолдинг, позволяющий получать IgA1 протеазу в количестве на уровне 10-40 мг из 2 г биомассы клеток.
Показана иммуногенная и протективная активность в опытах на лабораторных животных и перспективность патентуемого препарата рекомбинантной IgA1 протеазы при разработке поливалентной вакцины для профилактики инфекций и, в первую очередь, для профилактики менингококковых инфекций, вызываемой бактериями N. meningitidis серогруппы В, а также других патогенов, активность которых обусловлена наличием IgA1 протеазы.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПОЛИНУКЛЕОТИД, КОДИРУЮЩИЙ МУТАНТНУЮ РЕКОМБИНАНТНУЮ IgA1 ПРОТЕАЗУ Neisseria meningitidis СЕРОГРУППЫ В, РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК, СОДЕРЖАЩАЯ УКАЗАННЫЙ ПОЛИНУКЛЕОТИД, КЛЕТКА-ХОЗЯИН, СОДЕРЖАЩАЯ УКАЗАННУЮ ПЛАЗМИДНУЮ ДНК, РЕКОМБИНАНТНАЯ IgA1 ПРОТЕАЗА Neisseria memingitidis СЕРОГРУППЫ В, СПОСОБ ПОЛУЧЕНИЯ ЗРЕЛОЙ ФОРМЫ IgA1 ПРОТЕАЗЫ | 2011 |
|
RU2486243C1 |
| Рекомбинантный белок, обладающий протективным действием в отношении менингококков (варианты), полинуклеотид, кодирующий рекомбинантный белок, рекомбинантная плазмидная ДНК, содержащая указанный полинуклеотид, клетка-хозяин, содержащая указанную рекомбинантную плазмидную ДНК, способ получения рекомбинантного белка | 2017 |
|
RU2701964C2 |
| СПОСОБ ПОЛУЧЕНИЯ IgAl-ПРОТЕАЗЫ ИЗ КУЛЬТУРЫ NEISSERIA MENINGITIDIS СЕРОГРУППЫ А И ИММУНОГЕННЫЙ ПРЕПАРАТ НА ЕЕ ОСНОВЕ | 2009 |
|
RU2407792C1 |
| ПОЛИПЕПТИДЫ ИЗ NEISSERIA MENINGITIDIS | 2007 |
|
RU2450019C2 |
| КОМПОЗИЦИИ NEISSERIA MENINGITIDIS И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2013 |
|
RU2665841C2 |
| ФРАГМЕНТ ДНК, КОДИРУЮЩИЙ БЕЛОК ВНЕШНЕЙ МЕМБРАНЫ NEISSERIA MENINGITIDIS ШТАММА В:4:Р1:15, БЕЛОК ВНЕШНЕЙ МЕМБРАНЫ NEISSERIA MENINGITIDIS, РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pМ-6, ШТАММ БАКТЕРИЙ ESCHERICHIA COLI НВМ 64, СПОСОБ ПОЛУЧЕНИЯ БЕЛКА ВНЕШНЕЙ МЕМБРАНЫ NEISSERIA MENINGITIDIS, ВАКЦИННАЯ КОМПОЗИЦИЯ | 1991 |
|
RU2132383C1 |
| КОМПОЗИЦИИ NEISSERIA MENINGITIDIS И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2739504C2 |
| ВАКЦИННАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ТРАНСФЕРРИН-СВЯЗЫВАЮЩИЙ БЕЛОК И HSF ИЗ ГРАМОТРИЦАТЕЛЬНЫХ БАКТЕРИЙ | 2003 |
|
RU2359696C2 |
| ПЕПТИД NEISSERIA MENINGITIDIS ДЛЯ ТЕРАПЕВТИЧЕСКОГО И ДИАГНОСТИЧЕСКОГО ПРИМЕНЕНИЯ | 2001 |
|
RU2313535C2 |
| АНТИГЕНЫ NEISSERIA MENINGITIDIS | 1999 |
|
RU2343159C2 |












Изобретение относится к области иммунологии, энзимологии, микробиологии и генной инженерии. Описана нуклеиновая кислота, кодирующая IgA1 протеазу Neisseria meningitidis серогруппы В штамм Н44/76. Представлена рекомбинантная плазмидная ДНК, включающая нуклеиновую кислоту. Описан штамм-продуцент E.coli BL21(DE3)/pBIGAPS1, содержащий представленную рекомбинантную плазмидную ДНК. Представлен способ получения зрелой формы IgA1 протеазы Neisseria meningitidis серогруппы В. Описана IgA1 протеаза с молекулярной массой 107,6 кДа и рассчитанной изоэлектрической точкой 7,4. Изобретение позволяет получить высокоочищенную IgA1 протеазу в качестве компонента поливалентной вакцины, предназначенной для защиты человека, прежде всего детей от менингококковой инфекции и других микроорганизмов, патогенность которых обусловлена IgA1 протеазой. 5 н.п. ф-лы, 4 ил., 5 пр.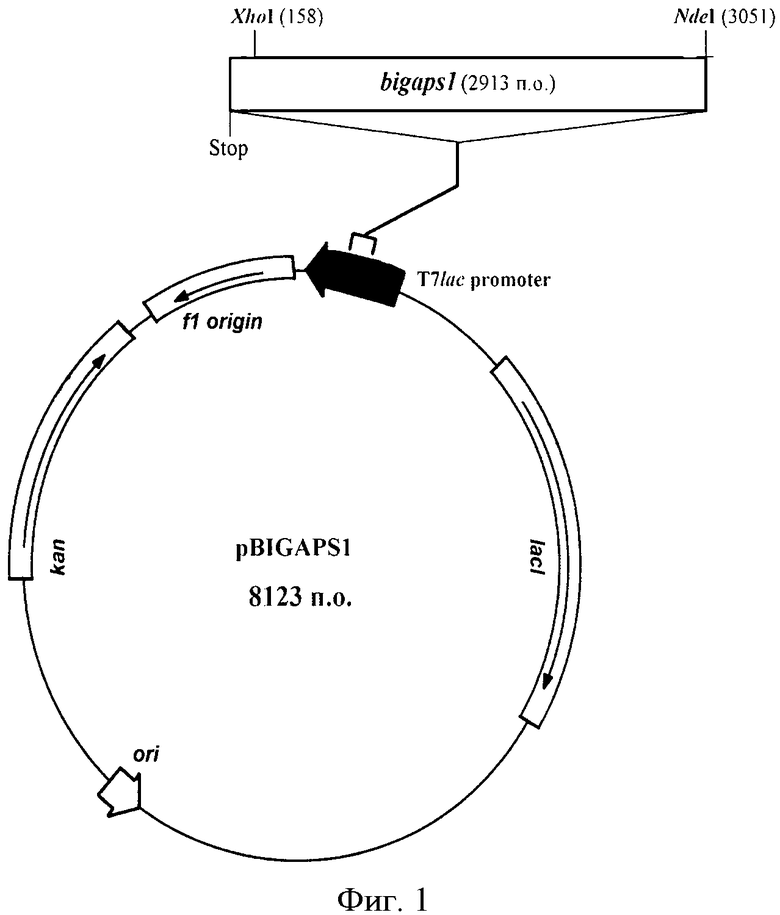
1. Нуклеиновая кислота, кодирующая IgA1 протеазу Neisseria meningitidis серогруппы В штамм Н44/76 (SEQ ID NO: 1).
2. Рекомбинантная плазмидная ДНК, включающая нуклеиновую кислоту по п.1 и обеспечивающая экспрессию IgA1 протеазы в клетке-хозяине (pBIGAPS1), характеризующаяся следующими признаками:
длина цепи составляет 8123 п.о.;
кодирует секретируемую форму IgA1 протеазы с сигнальной последовательностью на N-конце и гистидиновой меткой на С-конце белка;
нуклеотидную последовательность, кодирующую IgA1-протеазу в плазмиде pBIGAPS1, фланкируют уникальные сайты рестрикции эндонуклеазами NdeI и XhoI,
содержит T7lac-промотор транскрипции;
генетическим маркером служит нуклеотидная последовательность (kan),
определяющая устойчивость трансформированных плазмидой pBIGAPS1 клеток бактерий к канамицину.
3. Штамм-продуцент E.coli BL21(DE3)/pBIGAPSl, содержащий рекомбинантную плазмидную ДНК по п.2, который продуцирует зрелую форму IgA1 протеазы.
4. Способ получения зрелой формы IgA1 протеазы Neisseria meningitidis серогруппы В, заключающийся в культивировании штамма-продуцента по п.3, выделении и очистке целевого продукта из телец включения.
5. IgA1 протеаза с молекулярной массой 107,6 кДа и рассчитанной изоэлектрической точкой 7,4, с аминокислотной последовательностью (SEQ ID NO: 2), кодируемая нуклеиновой кислотой по п.1, и полученная способом по п.4, обладающая иммуногенными и протективными свойствами, предназначенная для получения поливакцины для профилактики менингококковых инфекций, в том числе вызываемых бактериями N.meningitidis серогруппы В.
| СПОСОБ ПРИГОТОВЛЕНИЯ БИВАЛЕНТНОЙ ВАКЦИНЫ ДЛЯ ПРОФИЛАКТИКИ МЕНИНГОКОККОВОЙ ИНФЕКЦИИ | 2003 |
|
RU2250113C2 |
| RU 2007127448 A, 27.04.2009. | |||
Авторы
Даты
2012-06-20—Публикация
2011-02-18—Подача