Изобретение относится к области биотехнологии растений, в частности цветоводству, и может быть использовано для оздоровления и микроразмножения растений сирени in vitro.
Известен способ микроразмножения сирени, включающий черенкование выращиваемых in vitro растений на одноузловые сегменты, посадку черенков на питательную среду для мультипликации, содержащую микроэлементы, хелат железа и витамины по прописи Мурасиге и Скуга (MS) [2], 1,5 концентрацию макроэлементов MS, 35 г/л сахарозы, 8 г/л Difco бакто-агара и 1 мг/л 2-изопентениладенина (2ip), получение пробирочных микрорастений, повторное их черенкование и высадку полученных регенерантов на среду укоренения с ауксинами (R.L.M.Pierik; H.H.M.Steegmans; A.A.Elias; O.T.J.Stiekema; A.J.van der Velde. Vegetative propagation of Syringa vulgaris L. in vitro. // Acta Hort., 226 (1988) 195-204.).
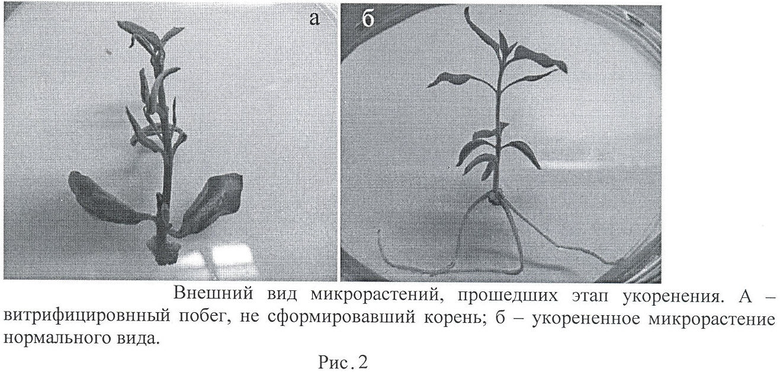
Недостатком данного способа размножения является то, что растения по окончанию этапа размножения получаются утолщенными и укороченными со скрученными листьями вдоль центральной жилки (витрифицированными) (Рисунок 1). Эти микропобеги плохо укореняются (Рисунок 2). Укорененные микрорастения такого качества неспособны адаптироваться к условиям ex vitro.
Технический результат изобретения заключается в повышении выхода нормально сформированных корнесобственных микрорастений, улучшении роста и развитии эксплантов при положительном влиянии оптимальных концентраций минеральных и органических компонентов питательной среды, регуляторов роста растений и антибиотиков.
Сущность изобретения заключается в том, что одноузловые сегменты выращиваемых in vitro растений помещают на среду для мультипликации, содержащую макро-, микроэлементы, хелат железа и витамины по прописи Мурасиге и Скуга (MS) (Murashige Т. & Skoog F., A revised medium for rapid growth and bioassays with tobacco tissue culture. // Physiol. Plant, 15 (1962) 473-497) или или Кворина-Лепорье (1977) (QL) (Quorin M. & Lepoivre P., Elude de milieux adaptes aux cultures in vitro de Prunus. // Acta Hort., 78 (1977) 437-442) или Вуди Плант Медиум (WPM) (Lloyd G. & McCown В., Commercially feasible micropropagation of mountain laurel, Kalmia latifolia, by shoot tip culture. // Comb. Proc. Int. Plant Prop.Soc, 30 (1980) 421-427) или Драйвер и Куниюки (DKW) (Driver J.A., Kuniyuki A.H., In vitro propagation of Paradox walnut rootstock. // Hort. Science, 19 (4), August (1984).), 30-40 г/л сахарозы, 8-9 г/л агар-агара, 0,2-2,0 мг/л 6-бензиламинопурина (БАП) и/или 0,2-2,0 мг/л зеатина (Z) и/или 0,5-1,5 мг/л кинетина (kin) и антибиотики (пенициллин (50-1000 мг/л) и/или ампициллин (50-1000 мг/л) и/или цефотаксим (50-1000 мг/л) и/или тикарциллин (10-500 мг/л) и/или стрептомицин (5-500 мг/л) и/или тетрациклин (10-1000 мг/л) и/или ванкомицин (1-100 мг/л)). Культивирование проводят на светокультуральных стеллажах при освещении белыми люминесцентными лампами общей интенсивностью 2000-4000 люкс при 16-часовом фотопериоде и температуре 21-25°C. Полученные пробирочные микрорастения повторно черенкуют на апикальную часть и серединные одноузловые сегменты. Одноузловые сегменты повторно выращиваются на среде мультипликации, а апикальные высаживают на среду укоренения. Она содержит ½ макроэлементов, полные микроэлементы, хелат железа и витамины по прописи MS, 10-30 г/л сахарозы, 8-9 г/л агар-агара, перечисленные выше антибиотики, 0,1 мг/л ИМК, а также 0,01 мг/л НУК или 0,1 мг/л ИУК.
Добавление сахарозы в питательные среды в концентрациях более 40 г/л снижает интенсивность роста растений и приводит к их витрификации. Добавление в питательные среды регуляторов роста и антибиотиков в предложенных концентрациях наиболее оптимально подходят для роста эксплантов и не оказывают токсического воздействия и эффекта угнетения культуры.
Предлагаемый способ клонального микроразмножения сирени реализуется следующим образом:
1. В нестерильных условиях готовится питательная среда. В нее добавляются необходимые количества макро-, микроэлементов, хелата железа, мио-инозита, объем доводится дистиллированной водой, pH 5,6-5,8. После этого растворяется навеска агара. Среда разливается по колбам, укупоривается фольгой и бумагой, завязывается банковской резинкой. Автоклавирование проводится при 1 ати (=1 изб. атм) в течение 25 минут. В остывшую до 55°C среду в ламинар-боксе добавляются стерильные растворы витаминов, регуляторов роста и антибиотиков. Полученный раствор разливается по стерильным культуральным сосудам.
Все манипуляции с растительным материалом производится в стерильных условиях ламинар-бокса. На всех этапах культивирования число эксплантов в сосудах составляет 15-25 штук.
2. Размножение растительного материала проводят на средах мультипликации, приготовленных по прописи MS или QL или WPM или DKW, дополненных сахарозой (30-40 г/л), агар-агаром (8-9 г/л), БАП и/или зеатином (0,2-2,0 мг/л) или кинетином (0,5-1,5 мг/л) и антибиотиками (пенициллин (50-1000 мг/л) и/или ампициллин (50-1000 мг/л) и/или цефотаксим (50-1000 мг/л) и/или тикарциллин (10-500 мг/л) и/или стрептомицин (5-500 мг/л) и/или тетрациклин (10-1000 мг/л) и/или ванкомицин (1-100 мг/л)). При этом наиболее оптимальными минеральными композициями являются MS и QL. Для цитокининов наиболее удачны концентрации 0,2-1,0 мг/л как для БАП, так и для зеатина, для кинетина - 0,9-1,1 мг/л, а для антибиотиков - пенициллин (50-100 мг/л) и/или ампициллин (50-100 мг/л) и/или цефотаксим (50-200 мг/л) и/или тикарциллин (10-50 мг/л) и/или стрептомицин (5-50 мг/л) и/или тетрациклин (10-100 мг/л) и/или ванкомицин (1-15 мг/л).
3. Полученные микропобеги черенкуются на апикальную часть и серединные одноузловые сегменты. Серединные сегменты повторно переносятся на среды мультипликации. Апикальные части высаживают на среду укоренения. В качестве среды для укоренения используется редуцированная до ½ по макросолям среда MS, дополненная сахарозой (10-30 г/л), агар-агаром (8-9 г/л), антибиотиками (перечень и концентрации указаны в п.2).
Эффективность укоренения оценивается долей укорененных хорошо сформированных микрорастений от числа всех эксплантов, выраженной в процентах.
В таблицах 1-3 представлены результаты исследований по влиянию на укореняемость микропобегов условий предшествующего этапа культивирования, а именно: концентрация цитокининов (БАЛ, зеатин и кинетин), минеральный состав питательной среды (MS, QL, WPM и DKW), наличие антибиотиков в среде. В качестве контрольного варианта использовались среда и концентрация цитокинина (2-изопентениладенин), описанные в прототипе.
нения
тип
0,5 мг/л
0,2 мг/л
0,2 мг/л; БАП
0,5 мг/л
0,5 мг/л;
БАП
0,2 мг/л
1,0 мг/л
2,0 мг/л
1,0 мг/л
2,0 мг/л
0,5 мг/л
1 мг/л
1,5 мг/л
При добавлении индивидуальных антибиотиков в среду культивирования в следующих концентрациях: ванкомицин 1-15 мг/л и/или цефотаксим 50-150 мг/л и/или тикарциллин 10-50 мг/л и/или пенициллин 50-100 мг/л и/или ампициллин 50-100 мг/л и/или стрептомицин 5-50 мг/л и/или тетрациклин 10-100 мг/л - статистически достоверных различий не выявлено (данные не представлены).
Добавление НУК или ИУК в заявленных концентрациях не вызывало статистически достоверных различий процента укоренения (данные не представлены).
Использование перечисленных концентраций фитогормонов позволяют увеличить эффективность укоренения микропобегов сирени в культуре in vitro относительно прототипа до 2 раз.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ клонального микроразмножения флокса метельчатого | 2020 |
|
RU2743966C1 |
| СПОСОБ КЛОНАЛЬНОГО МИКРОРАЗМНОЖЕНИЯ АЛЫЧИ IN VITRO | 2015 |
|
RU2652953C2 |
| СПОСОБ СОХРАНЕНИЯ ЮВЕНИЛЬНОГО СТАТУСА КУЛЬТУРЫ IN VITRO МАЛИНЫ (RUBUS IDAEUS) | 2016 |
|
RU2662670C2 |
| СПОСОБ МИКРОКЛОНАЛЬНОГО РАЗМНОЖЕНИЯ И ПОЛУЧЕНИЯ ПОСАДОЧНОГО МАТЕРИАЛА ВЕЙГЕЛЫ ПРИЯТНОЙ (WEIGELA SUAVIS (КОМ.) L.H.BAILEY) И ВЕЙГЕЛЫ ЦВЕТУЩЕЙ "ВАРИЕГАТА" (WEIGELA FLORIDA "VARIEGATA" BUNGE A. DC.) | 2016 |
|
RU2634431C1 |
| СПОСОБ СОХРАНЕНИЯ КАЧЕСТВЕННЫХ ХАРАКТЕРИСТИК КУЛЬТУРЫ in vitro НЕКОТОРЫХ ДРЕВЕСНЫХ ВИДОВ РАСТЕНИЙ (ЛИМОННИК КИТАЙСКИЙ, РОДОДЕНДРОН, СИРЕНЬ, БЕРЕЗА ПОВИСЛАЯ) | 2015 |
|
RU2590703C1 |
| Способ повышения эффективности культивирования in vitro Березы повислой, Лимонника китайского, Рододендрона и Сирени | 2015 |
|
RU2619177C1 |
| СПОСОБ РАЗМНОЖЕНИЯ IN VITRO ШТАМБОВЫХ СОРТОВ МАЛИНЫ | 2019 |
|
RU2751250C2 |
| Способ микроклонального размножения кирказона маньчжурского (Aristolochia manshuriensis Kom.) | 2023 |
|
RU2807740C1 |
| СПОСОБ ФОРМИРОВАНИЯ КОЛЛЕКЦИИ И ДЛИТЕЛЬНОГО ДЕПОНИРОВАНИЯ ВИНОГРАДА IN VITRO | 2021 |
|
RU2764104C1 |
| Способ получения укорененного подвойного материала ВСЛ-2 invitro | 2019 |
|
RU2732230C1 |

Изобретение относится к области биотехнологии растений. Способ включает культивирование одноузловых сегментов на среде мультипликации, содержащей макро-, микроэлементы, хелат железа, витамины по прописи Murashige & Skoog (MS) или Quorin & Lepoivre, или Woody Plant Medium, или Driver & Kuniyuki, 30-40 г/л сахарозы, 8-9 г/л агар-агара, 0,2-2,0 мг/л 6-бензиламинопурина и/или 0,2-2,0 мг/л зеатина, или 0,5-1,5 мг/л кинетина и антибиотики (пенициллин (50-1000 мг/л) и/или ампициллин (50-1000 мг/л), и/или цефотаксим (50-1000 мг/л), и/или тикарциллин (10-500 мг/л), и/или стрептомицин (5-500 мг/л), и/или тетрациклин (10-1000 мг/л), и/или ванкомицин (1-100 мг/л)). Полученные пробирочные микрорастения повторно черенкуют на апикальную часть и серединные одноузловые сегменты. Одноузловые сегменты повторно выращивают на среде мультипликации, а апикальные высаживают на среду укоренения. Она содержит 1/2 макроэлементов, полные микроэлементы, хелат железа и витамины по прописи MS, 10-30 г/л сахарозы, 8-9 г/л агар-агара, перечисленные выше антибиотики, 0,1 мг/л индолилмасляной кислоты, а также 0,01 мг/л α-нафтилуксусной кислоты или 0,1 мг/л индолилуксусной кислоты. Культивирование проводят на светокультуральных стеллажах при освещении белыми люминесцентными лампами общей интенсивностью 2000-4000 люкс с 16-часовым фотопериодом и температурой 21-25°С. Изобретение позволяет повысить выход нормально сформированных корнесобственных микрорастений, улучшить рост и развитие эксплантов. 1 з.п. ф-лы, 3 ил., 3 табл.
1. Способ клонального микроразмножения сирени in vitro, включающий микрочеренкование пробирочных растений на одноузловые сегменты, высадку их на питательную среду, содержащую макро- и микроэлементы, хелат железа, витамины, сахарозу, агар-агар и цитокинины, получение микропобегов, их черенкование и укоренение на среде, содержащей ауксины, отличающийся тем, что высадку одноузловых сегментов осуществляют на питательную среду Quorin & Lepoivre или Woody Plant Medium, или Driver & Kuniyuki с добавлением 0,2-2,0 мг/л 6-бензиламиноурина, и/или 0,2-2,0 мг/л зеатина, и/или 0,5-1,5 мг/л кинетина, 50-1000 мг/л антибиотика из группы β-лактамных антибиотиков, и/или 5-500 мг/л антибиотика из группы аминогликозидов, и/или 10-1000 мг/л антибиотика из группы тетрациклинов, и/или 1-100 мг/л антибиотика из группы циклических гликопептидов, а укоренение осуществляют на среде, содержащей 1/2 концентрации микросолей по прописи Murashige & Skoog с добавлением 50-1000 мг/л антибиотика из группы β-лактамных антибиотиков, и/или 5-500 мг/л антибиотика из группы аминогликозидов, и/или 10-1000 мг/л антибиотика из группы тетрациклинов, и/или 1-100 мг/л антибиотика из группы циклических гликопептидов, 0,1 мг/л индолилмасляной кислоты, 0,01 мг/л α-нафтилуксусной кислоты или 0,1 мг/л индолилуксусной кислоты.
2. Способ по п.1, отличающийся тем, что в питательную среду в качестве антибиотика группы β-лактамных антибиотиков добавляют пенициллин, или ампициллин, или цефотаксим, или тикарциллин, в качестве антибиотика из группы аминогликозидов - стрептомицин, в качестве антибиотика из группы тетрациклинов - тетрациклин, в качестве антибиотика из группы циклических гликопептидов - ванкомицин.
| CПОСОБ ДОРАЩИВАНИЯ IN VITRO РАСТЕНИЙ ЯГОДНЫХ И ДЕКОРАТИВНЫХ КУСТАРНИКОВ В НЕСТЕРИЛЬНЫХ УСЛОВИЯХ | 2007 |
|
RU2366153C1 |
| СУБСТРАТ ДЛЯ УКОРЕНЕНИЯ ЗЕЛЕНЫХ ЧЕРЕНКОВ ТРУДНОУКОРЕНЯЕМЫХ ЯГОДНЫХ И ДЕКОРАТИВНЫХ КУСТАРНИКОВ | 2007 |
|
RU2368127C2 |
| НОВИКОВА Т.И | |||
| и др | |||
| Сохранение редких и полезных растений в коллекции IN VITRO Центрального сибирского ботанического сада [он-лайн], статья, Вестник ВОГиС, т.12, №4, 2008, [найдено 30.12.2010] | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| Устройство для термохимической обработки соломы | 1981 |
|
SU1020114A1 |
| WO 2007014974 A1, 08.02.2007. | |||
Авторы
Даты
2012-08-10—Публикация
2010-11-13—Подача