Изобретение относится к области медицинской биотехнологии и может быть использовано для создания противоопухолевых вакцин.
Вакцинотерапия является одним из иммунологических подходов в лечении онкологических заболеваний [Барышников А.Ю., Демидов Л.В., Кадагидзе З.Г., Михайлова И.Н., Харкевич Г.Ю., Заботина Т.Н., Борунова А.А, Тимофеев И.В., Лукашина М.И., Чкадуа Г.З., Барышников К.А., Петенко Н.Н. / Современные проблемы биотерапии злокачественных опухолей. // Вестник Московского онкологического общества. - 2008. - Т.1. - С.6-10]. Принцип вакцинотерапии основан на индукции противоопухолевого иммунитета после введения в организм опухолевого антигена (АГ). Вакцины, приготовленные на основе опухолевых клеток, являются цельноклеточными и представляют собой живые аллогенные или аутологичные опухолевые клетки.
Известно, что для повышения иммуногенности опухолевых клеток, используемых для приготовления цельноклеточных противоопухолевых вакцин, применяются способы генной инженерии [Borrello I, Pardoll D. / GM-CSF-based cellular vaccines: a review of the clinical experience. // Cytokine Growth Factor Rev. - 2002. - Vol.13. - P.185-193 ; Li В., Simmons A., Du Т., Lin C., Moskalenko M., Gonzalez-Edick M., VanRoey M., Jooss. K. / Allogeneic GM-CSF-secreting tumor cell immunotherapies generate potent anti-tumor responses comparable to autologous tumor cell immunotherapies. // Clin ImmunoL - 2009. - Nov. - 133(2). - P.184-197]. Установлено, что именно секретируемый рекомбинантный цитокин повышает иммуногенность противоопухолевых вакцин [Dranoff G, Jaffee E, Lazenby A, Golumbek P, Levitsky H, Brose К, Jackson V, Hamada H, Pardoll D, Mulligan RC. / Vaccination with irradiated tumor cells engineered to secrete murine granulocyte-macrophage colony-stimulating factor stimulates potent, specific, and long-lasting anti-tumor immunity. // Proc. Natl. Acad. Sci. USA, 1993 Vol.90, P.3539-3543]. Ключевым фактором, обуславливающим иммуногенность GM-CSF-секретирующих вакцин, является способность этого цитокина индуцировать дифференцировку ранних предшественников в направлении наиболее эффективных профессиональных антигенпрезентирующих клеток (АПК) - дендритных клеток [Hege KM., Jooss К., Pardoll D. / GM-CSF gene-modified cancer cell immunotherapies: of mice and men. / // Int Rev ImmunoL - 2006. - Vol.25. - P.321-52].
Показано, что сингенная вакцинация против опухолей, индуцируемых трансплантацией клеток B16-F10, эффективна, если клетки вакцины секретируют более 35 нг GM-CSF на 106 клеток за 24 часа, а для вакцинопрофилактики других экспериментальных опухолей минимальная эффективная продуктивность клеток вакцины варьировала от 2 до 100 нг GM-CSF [Jaffee E.M, Pardoll D.M. / Considerations for the clinical development of cytokine gene-transduced tumor cell vaccines. // Methods. 1997 Vol. 12, P.143-153; Schmidt W., Schweighoffer T, Herbst E., Maass G., Berger M., Schilcher F., Schaffner G., Bimstiel M.L. / Cancer vaccines: the interleukin 2 dosage effect. // Proceeding of the National Academy of Science USA 1995 Vol.92, P.4711-4714; Toes R.E., Blom R.J., van der Voort E., Offringa R., Melief C.J., Kast W.M. / Protective antitumor immunity induced by immunization with completely allogeneic tumor cells. // Cancer Res. 1996 Vol.56, P.3782-3787].
Недостатком данного способа является относительно низкая иммуногенность противоопухолевой вакцины.
Создание альтернативных способов повышения иммуногенности противоопухолевых вакцин является актуальным.
Низкая иммуногенность противоопухолевых вакцин зачастую связана с низкой иммуногенностью АГ опухолей. Опухолевые АГ, как правило, подвергаются процессингу перед их презентацией в контексте молекул гистосовместимости (классов МНС 1 и МНС 2) на клеточной поверхности [Carretero R., Romero J.M., Ruiz-Cabello P., Maleno I., Rodriguez F., Camacho P.M., Real L.M., Garrido P., Cabrera Т. / Analysis of HLA class I expression in progressing and regressing metastatic melanoma lesions after immunotherapy. // Immunogenetics. - 2008. - Aug. - 60(8). - P.439-447; Degenhardt Y., Huang J., Greshock J., Horiates G., Nathanson K., Yang X., Herlyn M., Weber В./ Distinct МНС gene expression patterns during progression of melanoma. // Genes Chromosomes Cancer, - 2010. - Feb. - 49(2). - P.144-154; Garrido C., Algarra I., Maleno I., Stefanski J., Collado A., Garrido F., Garcia-Lora A.M. / Alterations of HLA class I expression in human melanoma xenografts in immunodeficient mice occur frequently and are associated with higher tumorigenicity. // Cancer Immunol Immunother. - 2010 - Jan. - 59(1). - P.13-26]. Опухолевые клетки утрачивают антигены гистосовместимости МНС 1 и 2 классов, необходимые для презентации АГ. Значительное снижение экспрессии этих молекул или их полное отсутствие в большинстве случаев коррелирует с повышенным метастазированием. Злокачественная трансформация меланоцитов и опухолевая прогрессия часто ассоциируются с потерей антигена МНС 1. Так, при иммуногистохимическом исследовании метастатической меланомы выявлено отсутствие АГ гистосовместимости HLA 1 и HLA 2 классов в 15% и 55% соответственно. При изучении биоптата меланомы показано, что из 11 первичных линий клеток меланомы антигены HLA 1 класса были экспрессированы в 10 случаях, а антигены HLA 2 класса - лишь в 1 клеточной линии [Михайлова И.Н., Лукашина М.И., Барышников А.Ю., Морозова Л.Ф., Бурова О.С., Палкина Т.Н., Козлов A.M., Голубева В.А., Черемушкин Е.А., Дорошенко М.Б., Демидов Л.В., Киселев С.Л., Ларин С.С., Георгиев Г.П. / Клеточные линии меланомы - основа для создания противоопухолевых вакцин. // Вестник Российской АМН. - 2005, - Т.7. - С.37-40; Моисеенко В.М., Данилова А.Б., Данилов А.О., Туркевич Е.А., Балдуева И.А., Мацко Д.Е. / Иммуногистохимическое изучение экспрессии антигенов клетками меланомы кожи, культивируемых для приготовления вакцин. // Вопросы онкологии. - 2008. - 54 (3). - С.303-314].
Наиболее близким к заявляемому способу является способ повышения иммуногенности цельноклеточной противоопухолевой вакцины «Мелавак», представляющей собой клеточную линию меланомы человека Mel Kor, стабильно трансфецированную человеческим геном GM-CSF, имеющей генетическую конструкцию: вектор рВК - CMV (Clon Tech, США) со встроенной к ДНК GM-CSF человека. Метод трансфекции - липофекция при помощи набора Unifectin 56. Перед введением вакцина инактивирована на γ-установке Агат-Р облучением в дозе 100 Гр. Вакцина предназначена для клинического изучения у больных меланомой кожи в качестве средства иммунотерапии [Михайлова Л.М., Ермакова Н.П., Меркулова И.Б., Коняева О.И., Членова Е.Л., Кульбачевская Н.Ю., Абрамова Т.В., Мишин А.И. / Доклиническое токсикологическое изучение противоопухолевой вакцины мелавак. // Российский Биотерапевтический Журнал. T.1, №6, 2007 - С.60; Михайлова Л.М., Ермакова Н.П., Меркулова И.Б., Абрамова Т.В., Мишин А.И., Барышников А.Ю. / Исследование туморогенности противоопухолевой вакцины мелавак. // Российский Биотерапевтический Журнал. T.1, №6, - 2007 - С.60-61].
Недостатком данного способа является низкая иммуногенность вакцины.
Задачей настоящего изобретения является разработка способа повышения иммуногенности цельноклеточной противоопухолевой вакцины за счет повышения иммуногенности опухолевой клеточной линии меланомы, несущей определенный набор антигенов.
Поставленная задача решается тем, что разработан способ повышения иммуногенности цельноклеточных противоопухолевых вакцин путем инкубации клеток опухоли in vitro в присутствии IFN-γ, используя способность IFN-y индуцировать экспрессию МНС на поверхности клеток [Zhou F. Molecular mechanisms of IFN-gamma to up-regulate MHC class I antigen processing and presentation. // hit Rev Immunol. 2009 - 28(3-4) - P.239-260].
Способ повышения иммуногенности цельноклеточных противоопухолевых вакцин осуществляется следующим образом. Известно, что клетки линии B16-F10 в норме слабо экспрессируют только один из вариантов MHC 1 класса Н-2Кb, не экспрессируют молекулу H-2Db и не имеют в геноме фрагмента, кодирующего молекулу H-2Lb [Peter I., Mezzacasa A., LeDonne P., Dummer R., Hemmi S. / Comparative analysis of immunocritical melanoma markers in the mouse melanoma cell lines В 16, K1735 and S91-M3. // Melanoma Res. 2001 Vol.11, P.21-30].
Клетки GM-CSF-секретирующего клона BG получены путем стабильной трансфекции клеток линии B16-F10 генетической конструкцией, кодирующей кольцевую ДНК GM-CSF мыши. Клетки линии B16-F10 не несут молекул MHC на своей поверхности. Для трансфекции клеток мышиной меланомы была использована генетическая конструкция, созданная на базе вектора pBK-CMV (ClonTech, США), содержащая ген устойчивости к антибиотику G418, кодирующая кДНК ГМ-КСФ мыши. Трансфекцию осуществляли при помощи набора для липофекции эукариотических клеток Unifectin-56 (Unifect Group, Россия)
Приготовление цельноклеточной противоопухолевой вакцины, модифицированной с помощью преинкубации с IFN-y, проводили в несколько этапов: сначала клетки GM-CSF-секретирующего клона BG культивировали и инкубировали на планшетах в инкубаторе при стандартных условиях (температура 37°С и 5% СO2) в среде DMEM (ПанЭко, РФ) с добавлением 10% телячьей эмбриональной сыворотки (ТЭС, производство HyClone, США) и 10 мг/мл гентамицина (ПанЭко, РФ). Смену культуральной среды проводили каждые 48 часов. При достижении 50% монослоя при смене культуральной среды вводили рекомбинантный мышиный IFN-γ в концентрации 10 нг/мл культуральной среды (kat №315-05, PetroTech Inc., USA), далее клетки продолжали культивировать и инкубировать в инкубаторе при стандартных условиях в течение 48 часов, исходя из времени, необходимого для реализации эффекта цитокина.
По завершении сроков инкубации проводили обзорную микроскопию полученных планшетов для оценки фенотипических признаков жизнеспособности клеток после воздействия IFN-γ.
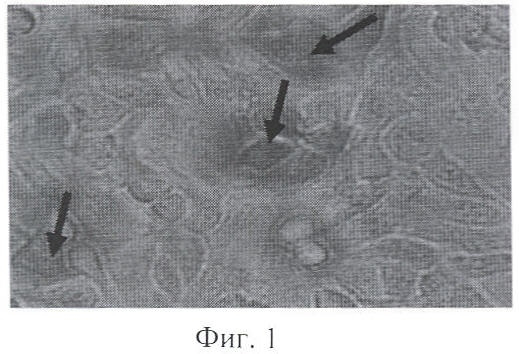
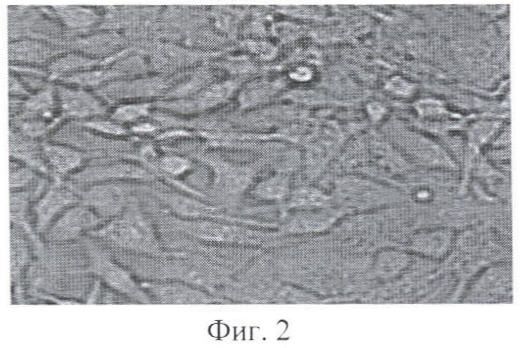
На Фиг.1 представлены результаты обзорной микроскопии клеток GM-CSF-секретирующего клона BG, культивированных в течение 48 ч в присутствии IFN-γ в концентрации 10 нг/мл культуральной среды. На Фиг.2 представлены клетки GM-CSF- секретирующего клона BG, культивированные без присутствия IFN-γ в среде. Отмечено, что присутствие IFN-γ в культуральной среде значительно повышает способность клеток к дифференцировке. При обзорной микроскопии выявлено увеличение числа гиперпигментированных гранулсодержащих клеток, снижение количества делящихся клеток. На жизнеспособность клеток исследуемая концентрация IFN-γ не влияла.
На следующем этапе проводили снятие инкубированных клеток с подложки при помощи раствора Версена, подсчет и оценку жизнеспособности клеток по стандартной методике. Жизнеспособность клеток, культивированных в присутствии IFN-γ, не отличалась от жизнеспособности клеток, культивированных без IFN-γ, количество погибших клеток не превышало 5%. Для приготовления вакцин полученные клетки трижды отмывали культуральной средой с помощью осаждения на центрифуге. Инактивацию клеток проводили путем ионизирующего облучения.
Оценку скорости роста клеток и их подсчет проводили в инвертированном световом микроскопе DMIL (Leica Microsystems, Германия). За монослой принимали слой плотно прилегающих друг к другу клеток, растущих на одной поверхности. Проводили окраску раствором Эозин-синий и подсчет клеток в камере Горяева общепринятым методом. Допустимым считали 5%-ную гибель клеток.
Микрофотосъемку производили с помощью оборудования Nikon (Nikon digital camera DXM1200F, инвертированный световой микроскоп Nikon Eclipse TE2000-U, Япония).
Для приготовления цельноклеточной противоопухолевой вакцины выращенные in vitro клетки GM-CSF-секретирующего клона BG линии B16-F10 тщательно отмывали в культуральной среде и ресуспендировали. Далее клетки помещали в стерильные стеклянные флаконы с добавлением культуральной среды для поддержания жизнедеятельности и облучали на источнике γ-излучения Агат-Р с источником облучения 60Со. Суммарная доза облучения клеток, используемых для вакцинации животных, составила 100 Гр. Инактивация γ-облучением в указанной дозе предотвращала пролиферацию клеток данных клонов, но сохраняла их жизнеспособность и секрецию GM-CSF. После облучения клетки дважды отмывали бессывороточной средой ДМЕМ.
Для длительного хранения клетки консервировали путем замораживания в жидком азоте. Клетки ресуспендировали в среде для замораживания, состоящей из питательной среды ДМЕМ (45%), ТЭС(50%), ДМСО(5%). Замораживание проводили в жидком азоте, снижая температуру на 1°С в минуту до минус 25°С с последующим быстрым замораживанием до минус 70°С. Хранение в жидком азоте осуществляли при температуре минус 196°С. Далее производили быстрое размораживание клеток при температуре 37° С. Клетки разводили в 10 мл бессывороточной среды и осаждали центрифугированием, ресуспендировали в 5 мл той же среды, содержащей 10% ТЭС. Жизнеспособность клеток оценивали по включению трипанового синего. Жизнеспособность клеток после размораживания составила 90%. Иммунологические свойства клеток не изменялись.
Приготовленные размороженные цельноклеточные противоопухолевые вакцины после предварительного двойного отмывания использовали для иммунизации мышей.
Оценку уровня экспрессии антигенов МНС 1 и МНС 2 проводили проточно-цитофлуориметрическим методом на проточном цитофлуориметре FACSCalibur (Becton Dickinson, США), укомплектованном аргоновым лазером (длина волны 488 нм), с использованием программного обеспечения CELLQuest.
Полученные клетки дважды центрифугировали при 1000 об/мин в течение 7 мин в растворе PBS и ресуспендировали, затем клетки делили на 2 части: первую - для последующей окраски антителами, вторую не окрашивали. Для окрашивания к клеткам добавляли по 4 мкл необходимых антител. В работе использованы антитела производства Becton Dickinson and Company (BD Biosciences), USA: FITC Mouse-Anti Mouse 1-Ab mouse, клон AF6-120.1, (Balb|c) IgG2α, к, кат. номер 553551 (для МНС 2) и FITC Mouse-Anti Mouse H-2Db mouse, клон (Ваlb|с) IgG2в, к, кат. номер 553573 (для МНС 1), поставщик: ООО «БиоЛайн». К неокрашенным клеткам добавляли 300 мкл формальдегида. Проводили инкубацию клеток при температуре 7°С в течение 30 мин. Далее все клетки дважды центрифугировали с добавлением 1 мл раствора PBS и проводили проточно-цитофлуориметрический анализ. В каждой пробе анализировали от 2000 до 5000 событий.
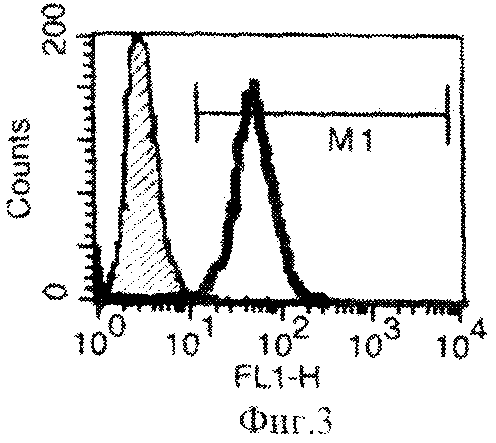
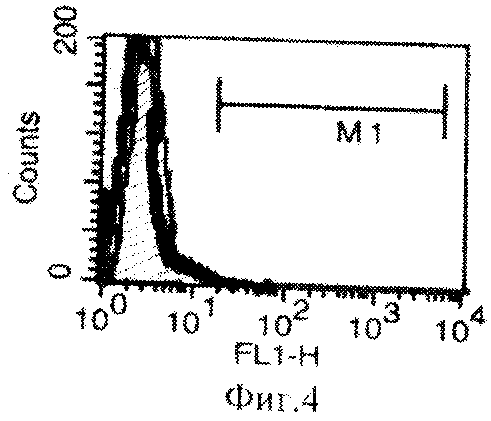
В результате проведенных исследований было показано, что преинкубация клеток в среде с IFN-γ повышает экспрессию МНС 1 и 2 класса. При культивировании клеток линии B16-F10 in vitro в течение 48 ч (в концентрации IFN-γ 10 нг/мл среды) экспрессия антигенов МНС 2 класса увеличивалась до 16 %, а экспрессия антигенов МНС 1 увеличилась до 97%. На Фиг.3 и Фиг.4 представлены гистограммы распределения клеток по интенсивности флуоресценции на клеточной линии B16-F10: заштрихованная кривая - негативный контроль, наложенная сверху жирная кривая - клетки, положительно окрашенные антителами к МНС 2. На Фиг.3 показан уровень экспрессии МНС 2 класса после инкубации клеток в присутствии IFN-γ по сравнению с уровнем экспрессии МНС 2 класса при инкубации клеток без IFN-γ в культуральной среде (Фиг.4).
Исследована активность цитокин-модифицированной in vitro с помощью IFN-γ цельноклеточной секретирующей GM-CSF вакцины.
Эксперименты с трансплантированными опухолями были проведены на 1000 мышах линии С57В1/6 с гаплотипом Н-2b (питомник лабораторных животных РАМН «Столбовая»), у которых отсутствуют локусы Н-2Еа и H-2L главного комплекса гистосовместимости 1 и 2 классов. В экспериментах использовали мышей-самцов 8-12 недельного возраста, массой 20-25 г.
Для индукции опухолей животным линии С57В1/6 трансплантировали по 105 клеток линии B16-F10 (что составляет для данных животных 10 TD100) в 100 мкл суспензии подкожно, в область правой подмышечной впадины. Через 5 дней после трансплантации и далее через каждые 2-3 дня животных обследовали на наличие пальпируемых опухолей в области введения клеток. Объем опухоли измеряли 2 раза в неделю по формуле V=Dmax×D1×(Dmax/2), где Dmax равен максимальному диаметру опухоли, a D1 - диаметру перпендикулярному максимальному. Вакцинацию проводили подкожно в область левой подмышечной впадины по 106 клеток в 100 мкл 0,9% раствора хлорида натрия с помощью инсулиновых шприцов.
Изобретение иллюстрировано следующим примером.
Пример. Исследование проведено на 22 мышах-самцах C57BL/6 10-12 недельного возраста, массой 20-25 г. Животные были разделены на 3 группы: 7 животным первой группы вводили цитокин-модифицированную in vitro с помощью IFN-γ цельноклеточную секретирующую GM-CSF вакцину, 8 животным второй группы вводили цельноклеточную секретирующую GM-CSF вакцину, немодифицированную с помощью IFN-γ, 8 животным - вакцинация не проводилась (контрольная группа). Вакцину вводили подкожно в количестве 1×106 клеток.
Проведена оценка эффекта вакцинотерапии. Вакцину вводили животным за 7 суток до трансплантации опухолевых клеток. Для индукции опухолей животным трансплантировали подкожно 1×106 нетрансфецированных клеток линии B16F10.
Выявлено ингибирующее действие вакцины на развитие опухолей на месте трансплантации опухолевых клеток. Средняя продолжительность жизни животных первой группы, получавших IFN-γ модифицированную in vitro цельноклеточную секретирующую GM-CSF вакцину, составила 53,1±3,0 суток, а увеличение продолжительности жизни на 78% (95% ДИ 69,9-86,1). Средняя продолжительность жизни животных второй группы, получавших цельноклеточную секретирующую GM-CSF вакцину, составила 46,6±4,5 суток и увеличение продолжительности жизни на 57% (95% ДИ (47,3÷66,7)). Средняя продолжительность жизни животных контрольной группы составила 29,7±4,0 суток.
На 52 сутки после трансплантации опухолевых клеток и вакцинации по заявляемому способу роста опухоли не наблюдалось у 72 животных (95% ДИ (63,2÷80,8)). При вакцинации немодифицированной цельноклеточной секретирующей GM-CSF вакциной роста опухоли не выявлено у 50% животных (95% ДИ (40,2÷59,8)). В контрольной группе наблюдалась 100% гибель животных в связи с прогрессией опухолевого роста.
Полученные результаты свидетельствуют о повышении противоопухолевой активности IFN-γ модифицированной in vitro цельноклеточной секретирующей GM-CSF вакцины.
У животных первой группы на месте введения вакцины по заявляемому способу отмечено появление инфильтратов, что свидетельствует об индукции иммунной реакции по типу реакции гиперчувствительности замедленного типа и о повышении иммуногенности вакцины.
С целью контроля воспроизводимости результатов проведена серия опытов по схожим схемам, в которых получены идентичные данные.
Технический результат заявляемого способа состоит в том, что применение INF-γ, стимулирующего экспрессию МНС на поверхности клеток, повышает иммуногенность и специфическую активность противоопухолевых цельноклеточных вакцин. Способ может быть использован для повышения иммуногенности противоопухолевых (цельноклеточных, генноинженерных) вакцин.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЛИНИЯ КЛЕТОК МЕЛАНОМЫ ЧЕЛОВЕКА PG, СЕКРЕТИРУЮЩИХ РЕКОМБИНАНТНЫЙ ГРАНУЛОЦИТАРНО-МАКРОФАГАЛЬНЫЙ КОЛОНИЕСТИМУЛИРУЮЩИЙ ФАКТОР | 2008 |
|
RU2395570C1 |
| ЛИНИЯ КЛЕТОК МЕЛАНОМЫ ЧЕЛОВЕКА ILG, СЕКРЕТИРУЮЩИХ РЕКОМБИНАНТНЫЙ ГРАНУЛОЦИТАРНО-МАКРОФАГАЛЬНЫЙ КОЛОНИЕСТИМУЛИРУЮЩИЙ ФАКТОР | 2008 |
|
RU2395574C1 |
| ЛИНИЯ КЛЕТОК МЕЛАНОМЫ ЧЕЛОВЕКА 26G, СЕКРЕТИРУЮЩИХ РЕКОМБИНАНТНЫЙ ГРАНУЛОЦИТАРНО-МАКРОФАГАЛЬНЫЙ КОЛОНИЕСТИМУЛИРУЮЩИЙ ФАКТОР | 2008 |
|
RU2395571C1 |
| ЛИНИЯ КЛЕТОК МЕЛАНОМЫ ЧЕЛОВЕКА 31G, СЕКРЕТИРУЮЩИХ РЕКОМБИНАНТНЫЙ ГРАНУЛОЦИТАРНО-МАКРОФАГАЛЬНЫЙ КОЛОНИЕСТИМУЛИРУЮЩИЙ ФАКТОР | 2008 |
|
RU2395573C1 |
| ЛИНИЯ КЛЕТОК МЕЛАНОМЫ ЧЕЛОВЕКА IG, СЕКРЕТИРУЮЩИХ РЕКОМБИНАНТНЫЙ ГРАНУЛОЦИТАРНО-МАКРОФАГАЛЬНЫЙ КОЛОНИЕСТИМУЛИРУЮЩИЙ ФАКТОР | 2008 |
|
RU2395572C1 |
| ЛИНИЯ КЛЕТОК МЕЛАНОМЫ ЧЕЛОВЕКА KG, СЕКРЕТИРУЮЩИХ РЕКОМБИНАНТНЫЙ ГРАНУЛОЦИТАРНО-МАКРОФАГАЛЬНЫЙ КОЛОНИЕСТИМУЛИРУЮЩИЙ ФАКТОР | 2008 |
|
RU2362805C1 |
| Покрытые онколитические аденовирусы для противораковых вакцин | 2015 |
|
RU2695375C2 |
| ПРИМЕНЕНИЕ КЛЕТОЧНОЙ ЛИНИИ МЕЛАНОМЫ КОЖИ ЧЕЛОВЕКА 388mel | 2018 |
|
RU2675541C1 |
| Способ стимуляции презентирующей активности дендритных клеток | 2019 |
|
RU2728592C1 |
| ИММУНОСТИМУЛЯТОР, ВЫЗЫВАЮЩИЙ СПЕЦИФИЧНЫЙ К ОПУХОЛИ КЛЕТОЧНЫЙ ИММУННЫЙ ОТВЕТ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1996 |
|
RU2206329C2 |
Изобретение относится к области биотехнологии. Способ повышения иммуногенности цельноклеточных противоопухолевых вакцин, секретирующих GM-CSF, in vitro осуществляется путем инкубации клеток в присутствии IFN-γ в течение 48 часов в концентрации 10 нг/мл культуральной среды. Применение INF-γ, стимулирующего экспрессию МНС на поверхности клеток, повышает иммуногенность и специфическую активность противоопухолевых цельноклеточных вакцин. Способ может быть использован для повышения иммуногенности противоопухолевых цельноклеточных вакцин. 4 ил., 1 пр.
Способ повышения иммуногенности цельноклеточных противоопухолевых вакцин, секретирующих GM-CSF, in vitro путем инкубации в присутствии IFN-γ в течение 48 ч в концентрации 10 нг/мл культуральной среды.
| МИХАЙЛОВА Л.М | |||
| и др | |||
| Доклиническое токсикологическое изучение противоопухолевой вакцины мелавак | |||
| Российский биотерапевтический журнал, т.1, №6, c.60, 2007 | |||
| МИХАЙЛОВА Л.М | |||
| и др | |||
| Исследование туморогенности противоопухолевой вакцины мелавак | |||
| Российский биотерапевтический журнал, т.1, №6, с.60, 61, 2007 | |||
| KR 20070058255 A, 08.06.2007. |
Авторы
Даты
2012-08-10—Публикация
2010-12-10—Подача